Изобретение относится к микробиологии, биотехнологии и медицине, конкретно к созданию методами генной инженерии живых вакцин против вирусных инфекций на основе аттенуированных рекомбинантных штаммов сальмонелл, несущих протективные вирусные антигены, в виде суппозиториев.
В настоящее время в мире происходит стремительное распространение ряда вирусных инфекций, перерастающих в эпидемии; это - СПИД, вызываемый вирусом иммунодефицита человека (ВИЧ), гепатит В, гепатит С и др. Все эти патогены высоко контагиозны, вирулентны и обладают антигенной изменчивостью.
Так как в арсенале медицины на сегодняшний день не имеется достаточно эффективных способов лечения такого рода вирусных инфекционных заболеваний, единственной мерой предотвращения развития инфекций является массовая вакцинация населения.
Главный недостаток существующих вакцин заключается в том, что они способны индуцировать только системный иммунитет. Очевидно, что эффективная противовирусная вакцина должна обеспечивать как системный, так и местный иммунитет слизистой, в области "входных ворот" инфекции.
Среди новых перспективных разработок вирусных вакцин в последнее время предпочтение отдается созданию мукозальных вакцин, т.е. препаратов, вводимых на слизистые оболочки. Такие вакцины имеют ряд преимуществ: введение без шприца, например перорально или интранозально; обеспечивается индукция не только системного, но и местного иммунитета, что крайне важно для заболеваний, передающихся половым путем. Главные проблемы создания мукозальных вакцин на основе инактивированных антигенов связаны с тем, что отдельные вирусные белки плохо проникают в клетки слизистой оболочки или деградируют в желудке или кишечнике.
Одним из наиболее перспективных векторов доставки мукозальных вакцин являются не патогенные для человека аттенуированные штаммы сальмонелл [1, 2].
Интерес к живым клеткам сальмонелл как к носителю иммуногенных эпитопов инфекционных агентов обусловлен тем, что аттенуированные штаммы этой бактерии способны инвазировать слизистую и некоторое время жить в клетках лимфоидной ткани организма млекопитающих. Клетка-вектор, являясь естественным депо и адъювантом для антигена, представляет его в максимально иммуногенной форме, увеличивает время персистенции и способствует накоплению антигена в иммунокомпетентных клетках.
Известен ряд работ, в которых показано, что рекомбинантные аттенуированные сальмонеллы, продуцирующие антигены ВИЧ, индуцируют высокий системный (гуморальный и клеточный) иммунитет и секреторный иммунитет. Примером могут служить рекомбинантные аттенуированные штаммы Salmonella enteritidis Е-23 ВМС120 [3] и Salmonella typhimurium Т-10 ВМС 160 [4], первый из которых обеспечивает синтез белка gp 120 ВИЧ в клетках млекопитающих, а второй - другого белка-иммуногена ВИЧ - gp 160. Известна живая вакцина против ВИЧ на основе аттенуированного штамма Salmonella typhimurium SL-3261 для перорального введения, которая в качестве иммуногенов несет белок обратной транскриптазы и трансактивирующий белок ВИЧ [5]. В описанных работах в качестве антигена используется лишь один или два из фрагментов белков gp 120 или gp 160 или pol, что явно недостаточно для создания эффективной вакцины, поскольку считается, что эффективная вакцина против ВИЧ должна включать эпитопы не только из белка env, но также gag и pol [6].
Известен рекомбинантный аттенуированный штамм бактерий Salmonella enteritidis E-23/pGEX-2T-TBI, способный продуцировать искусственный белок TBI, содержащий девять Т- и В- клеточных эпитопов ВИЧ, в клетках млекопитающих [7]. Известен также рекомбинантный аттенуированный штамм бактерий Salmonella typhimurium SL 7202 pGEX-TBI, способный продуцировать искусственный белок TBI [8].
Известен рекомбинантный аттенуированный штамм бактерий Salmonella enteritidis E-23/pcDNA-TCI [9], способный продуцировать искусственный белок TCI, содержащий множественные (более восьмидесяти) цитотоксические Т-клеточные эпитопы ВИЧ-1, в клетках млекопитающих.
Все описанные штаммы при введении животным индуцируют выраженный специфический гуморальный и клеточный иммунный ответ к ВИЧ и могут быть использованы для конструирования живой ДНК-вакцины против ВИЧ.
Активно идет разработка подходов к созданию живых вакцин и против гепатита В на основе аттенуированных штаммов сальмонелл. В настоящее время проходит клинические испытания вакцина на основе рекомбинантной сальмонеллы, продуцирующей HBcAg-preS2 [10]. Однако, при иммунизации добровольцев данным рекомбинантным штаммом сальмонеллы, ответ на preS2 был отмечен только у одного из 13 испытуемых. Одной из причин такого слабого иммунного ответа является тот факт, что рreS2-область является минорной антигенной детерминантой, тогда как главный нейтрализующий эпитоп содержится в HBsAg.
Известны кандидатные вакцинные штаммы бактерий, сконструированые путем введения плазмид, кодирующих антигены вируса гепатита В HbsAg и HbcAg в виде химерных белков, в реципиентные аттенуированные штаммы Salmonella typhimurium Т-10 и Salmonella typhimurium SL 7207 [11, 12]. При иммунизации мышей полученными конструкциями перорально и перректально (водной суспензией клеток рекомбинантных штаммов в виде клизмы) обнаружены специфические анти- HbsAg и анти-HbcAg IgG в сыворотке крови животных и специфические анти-вирусные IgA в слизистой кишечника, а также показано формирование Т-клеточного ответа на антигены вируса гепатита В.
Известно, что из водных растворов, введенных в прямую кишку в виде клизмы, лекарственные вещества всасываются очень быстро. Однако часть из них выводится обратно вместе с раствором, поэтому общее количество всосавшегося из лекарства вещества невелико. Эффективность всасывания лекарства значительно возрастает при использовании суппозиторной формы. Кроме того, используя суппозиторные формы лекарственных препаратов можно обеспечить быструю и массированную или постепенную доставку лекарственного вещества в кровоток [13].
Преимущество мукозальных вакцин в виде суппозиториев заключается в том, что они могут обеспечивать безболезненность, простоту введения и способствовать белее стабильной и длительной индукции местного иммунитета, поскольку, размножаясь в организме хозяина, вакцинный штамм стимулирует длительную выработку антител с развитием резистентности у входных ворот инфекции. Кроме того, при данном подходе не требуется дорогостоящая стадия очистки антигена.
В связи с вышеизложенным представляется целесообразным разработать подходы к созданию вакцин против вирусных инфекционных агентов на основе живых клеток рекомбинантных аттенуированных сальмонелл в виде суппозиториев.
Имеются сведения о разработках вакцинных препаратов в виде суппозиториев на основе инактивированных микроорганизмов. Такого рода вакцина против урогенитальных инфекций, состоящая из инактивированных бактерий, которые происходят из культур штаммов уропатогенных бактерий видов Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Proteus morganii и Streptococcus faecalis, и полиэтиленгликолевой основы суппозитория, описана в патенте РФ №2224542, выданном американской фирме Протеин Экспресс [14]. При этом суппозиторная форма вакцин способствует равномерному распределению клеток микроорганизмов в лекарственной форме и обеспечивает стабильность активной субстанции в течение длительного времени.
В медицинской практике созданы и используются суппозитории, содержащие живые микроорганизмы. Это суппозитории, содержащие микроорганизмы нормофлоры человека, которые применяются при лечении дисбактериозов, воспалительных процессов дистальных отделов кишечника и полости влагалища [15, 16, 17]. Препараты суппозиториев содержат микробную массу живых бифидобактерий или лактобактерий в количестве 103-108 клеток на одну дозу [17] либо сухую лиофилизованную биомассу микроорганизмов [16] и фармацевтически приемлемые добавки. В России производятся свечи Ацилакт, Бифидин, Лактобактерин (производство ОАО "Биохиммаш"), которые представляют собой микробную массу живых микроорганизмов, высушенную в среде культивирования с добавлением сахарозо-желатино-молочной среды и сформированную в медицинские суппозитории.
Однако в литературе не описаны препараты суппозиториев, содержащие живые клетки рекомбинантных микроорганизмов, несущих протективные вирусные антигены, предназначенные для вакцинопрофилактики вирусных инфекций.
Технической задачей изобретения является разработка эффективного препарата для иммунопрофилактики вирусных инфекций (противовирусных вакцин) на основе живых рекомбинантных штаммов Salmonella в виде суппозитория.
Поставленная задача решается путем разработки технологии получения и состава суппозиториев для ректального введения, содержащих аттенуированную живую культуру клеток рекомбинантных штаммов сальмонелл, несущих гены протективных вирусных антигенов, вмешанных в суппозиторную основу.
Ректальный путь открывает возможность введения в организм лекарственных веществ, разрушающихся в желудке или кишечнике. А для аттенуированных сальмонелл физиологичной является среда с рН 6,8-7,2, таким образом, среда прямой кишки в минимальной степени будет влиять на проявление биологической активности вакцинного штамма.
Для решения поставленной задачи изучена динамика накопления биомасс сальмонелл, несущих протективные антигены ВИЧ и гепатита В, - Salmonella enteritidis E-23/ pGEX-2Т-TBI, Salmonella enteritidis E-23/pcDNA-TCI, Salmonella typhimurium T-10/pKHBc в процессе ферментации. Показано, что активное деление клеток продолжается до ОП=2,0. При этом плазмиды стабильно сохраняются в штаммах. После культивирования титр клеток сальмонелл в культуральной жидкости должен быть не ниже 106.
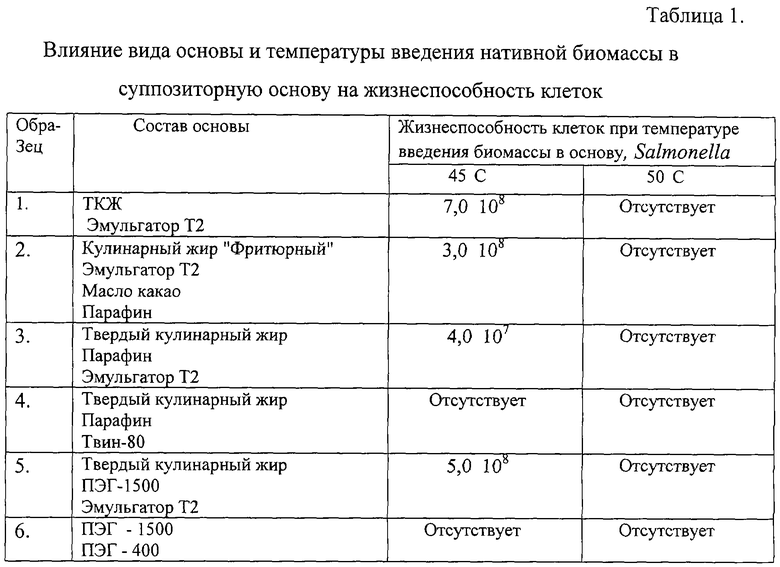
В процессе изготовления ДНК-вакцины в виде суппозиториев, содержащих живые клетки рекомбинантных штаммов сальмонелл, изучено влияние основы и температуры введения нативной биомассы в суппозиторную основу на жизнеспособность клеток. Показано, что вид основы и природа вспомогательных веществ оказывает существенное влияние на жизнеспособность клеток суппозиториев. Из данных, приведенных в Таблице 1, видно, что наилучшую жизнеспособность клеток обеспечивает использование гидрофобных (жировых) основ. В основе гидрофильного типа отсутствуют жизнеспособные клетки. Основы №2 и №6 обладают плохой текучестью. Введение в основу в качестве вспомогательного вещества Твина-80 действует губительно на жизнеспособность клеток сальмонелл в суппозиториях. При изготовлении суппозиториев наблюдается отсутствие жизнеспособных клеток при введении клеток в суппозиторную основу при температуре 50°С. Сохраняется же жизнеспособность при внесении клеток в основу при температуре до 45°С.
В одной дозе препарата (одной суппозитории массой 2 г) содержится 1·106-1·109 живых клеток Salmonella enteritidis E-23/pGEX-2T-TBI или Salmonella enteritidis Е-23/рсВМА-ТС1 или Salmonella typhimurium Т-10/HBc.
Согласно проведенным исследованиям суппозитории готовят на жировой основе, например с использованием кулинарного жира "Фритюрный" или гидролизованного хлопкового масла (ГХМ), или смеси твердого кулинарного жира, масла какао с добавлением твердого нефтяного парафина и эмульгатора Т-2 путем выливания в суппозиторные формы расплавленной массы, содержащей культуры клеток сальмонелл. Оптимальной температурой введения биомассы в суппозиторную основу является температура 39 - 45°С.
Суппозитории для иммунопрофилактики вирусных инфекций содержат компоненты в следующем соотношении на одну свечу массой 2 г, мас.%:
суспензию клеток рекомбинантного аттенуированного штамма Salmonella, несущего гены протективного вирусного антигена, в количестве 106-109 живых клеток - 1%; жировую основу - 94% и эмульгатор Т-2 - 5%. При этом в качестве жировой основы может быть использован твердый кулинарный жир (94%), или гидролизованное хлопковое масло (94%), или смесь кулинарного жира "Фритюрный" (60%), масла какао (24%) и твердого нефтяного парафина (10%).
В процессе изготовления вакцины в виде суппозиториев, содержащих клетки рекомбинантных сальмонелл, возникает проблема хранения в течение длительного времени, стандартизации и стабильности биомассы. Необходимым условием является то, что клетки рекомбинантной сальмонеллы должны быть в состоянии активного деления, т.е. в фазе логарифмического роста. Решением этой проблемы является лиофилизация биомассы.
На жизнеспособность микроорганизмов в процессе лиофилизации оказывает существенное влияние состав защитной среды. В экспериментах использовались следующие защитные среды: сахарозо-желатиновая (СЖ), молочно-глюкозная (МГ), сахарозно-желатиновая с тиомочевиной (СЖТ). Образцы биомассы рекомбинантных штаммов Salmonella, лиофилизованные с различными защитными средами, охарактеризованы по жизнеспособности и стабильности. Данные приведены в Таблице 2.
Приведенные в Таблице 2 данные показывают, что лиофилизованная биомасса рекомбинантных сальмонелл хранится без потери клетками жизнеспособности и стабильности в течение 6 месяцев, однако при процессе лиофилизации предпочтительнее использовать среды СЖ или МГ.
Более того, показано, что суппозитории, изготовленные с использованием лиофилизованной биомассы, могут храниться в течение 6 месяцев при t 4-8 С°, при этом клетки не теряют жизнеспособности и стабильности штамма (см. Таблицу 3).
В ходе доклинических исследований на мышах и морских свинках показано формирование иммунитета против заражения ВИЧ и гепатита В путем образования в организме животных специфических антител и формирования клона клеток памяти. Максимальное увеличение титра антител достигается на 28 сутки и сохраняется в течение недели при однократной иммунизации. При двукратной иммунизации, проведенной на 28 сутки после первой, максимальный титр антител регистрируется на 42-56 сутки. В проведенных доклинических испытаниях, выполненных в соответствии с Правилами проведения государственных испытаний и регистрации новых медицинских иммунобиологических препаратов (СП 3.3.2.561-96), показано отсутствие выраженных отклонений в состоянии жизненно важных органов, гематологических, морфологических показателях, отсутствие аллергизирующей активности, что свидетельствует о безвредности и хорошей переносимости вакцин.
Изобретение иллюстрируется следующими графическими изображениями.
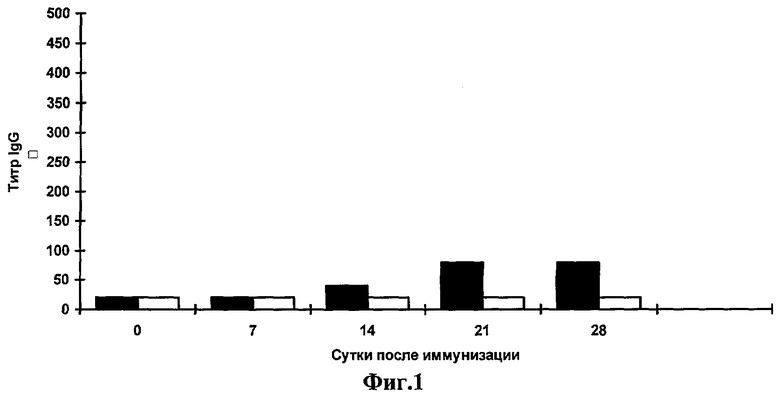
Фиг.1. Анализ системного гуморального ответа к очищенному вирусу ВИЧ-1 сывороток мышей, иммунизированных штаммом Salmonella enteritidis E-23/pcDNA-TCI по данным ИФА.
 S.enteritidis E-23/pcDNA-TCI
S.enteritidis E-23/pcDNA-TCI
 S.enteritidis E-23
S.enteritidis E-23
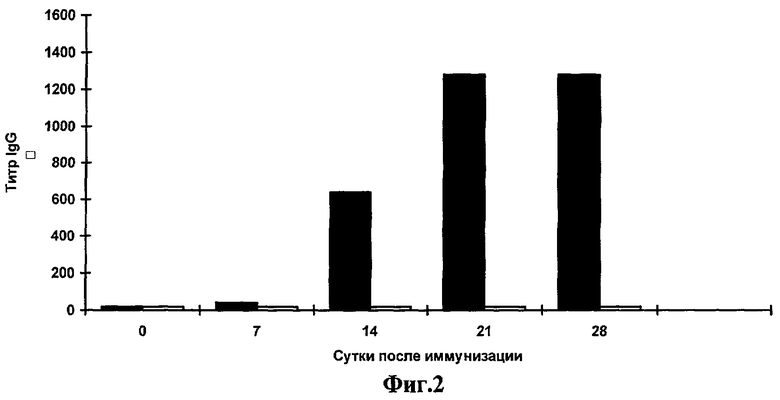
Фиг.2. Анализ системного гуморального ответа к очищенному белку TCI сывороток мышей, иммунизированных штаммом Salmonella enteritidis E-23/pcDNA-TCI по данным ИФА.
 S.enteritidis E-23/ pcDNA-TCI
S.enteritidis E-23/ pcDNA-TCI
 S.enteritidis E-23
S.enteritidis E-23
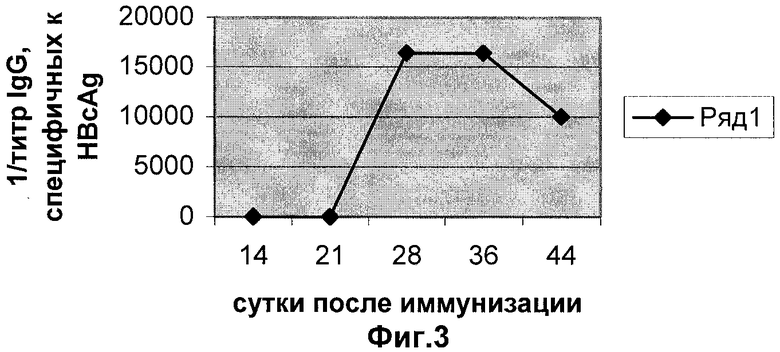
Фиг.3 Иммуноферментный анализ к HBcAg сывороток мышей, иммунизированных суппозиториями, содержащими Salmonella typhimurium T10 рКНВс.
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Культивирование рекомбинантных штаммов сальмонелл. Культивирование рекомбинантных штаммов Salmonella enteritidis E-23/pGEX-2T-TBI или Salmonella enteritidis E-23/pcDNA-TCI или Salmonella typhimurium T-10/pKHBc проводят на среде ЕВ с ампициллином. Перед культивированием проводят трансформацию клеток сальмонелл путем электропорации. Для этого "ночную" культуру Salmonella enteritidis E-23 или Salmonella typhimurium T-10 разводят в соотношении 1: 100 L-бульоном и подращивают в среде LB без ампициллина на качалке при температуре (37±2)°С до оптической плотности Д550=0,2. Клеточную суспензию охлаждают во льду 20 мин и центрифугируют 2 мин при 6000 об/мин. После отмывки водой осадок клеток ресуспендируют в 40 мкл 10%-го раствора глицерина, вносят 1 мкл плазмидной ДНК pGEX-2T-TBI или pcDNA-TCI или рКНВс, инкубируют во льду 2 мин и проводят электрополяцию с использованием прибора "ЭкюБио" ЛТД. Время импульса 4 сек, напряжение 2500 В. После электрополяции в эту же кювету добавляют 300 мкл L-бульона и инкубируют 1 ч при температуре (37±2)°С. Полученные трансформанты высевают на плотную среду L- агар с ампициллином и выращивают в течение суток при температуре (37±2)°С. После проверки на наличие плазмиды проведенные клоны штамма-продуцента культивируют на среде LB с ампициллином на термостатированной качалке при температуре (37±2)°С с частотой вращения 200 об/мин. Выращивание продолжается 3-4 ч до достижения оптической плотности Д550=2,0. После культивирования в культуральной жидкости определяют титр клеток, который не должен быть ниже 106. Центрифугированием при 5000 об/мин в течение 5 мин отделяют биомассу клеток рекомбинантных сальмонелл, которую используют для приготовления суппозиториев.
Пример 2. Приготовление суппозитория Сал-ВИЧ "Б", содержащего живые клетки аттенуированного рекомбинантного штамма Salmonella enteritidis E-23/pGEX-2T-TBI.
Компоненты основы суппозитория в виде навесок (кулинарный жир "Фритюрный" - 300,0±1,0 г, эмульгатор Т2 - 25,0±0,1 г, масло какао - 120,0±0,1 г и парафин - 50,0±0,1 г) количественно переносят в стакан вместимостью 1 л, который помещают на водяную баню, нагретую до 75°С, и выдерживают до полного расплавления смеси. Стакан с расплавленной основой помещают в смеситель-гомогенизатор и перемешивают при 200 об/мин до получения однородной массы. Основу охлаждают при постоянном перемешивании до температуры (39±1)°С. Биомассу клеток Salmonella enteritidis E-23/pGEX-2T-TBI соединяют с 5 мл стерильной очищенной воды и ресуспендируют до получения однородной суспензии, которую вводят в охлажденную суппозиторную основу, тщательно перемешивая до получения однородной массы. Суппозиторную массу выливают в подготовленные формы и охлаждают при температуре минус (15±2)°С в течение 60 мин.
Пример 3. Приготовление суппозитория Сал-ВИЧ "Д", содержащего живые клетки аттенуированного рекомбинантного штамма Salmonella enteritidis E-23/pcDNA-TCI.
Компоненты основы суппозитория в виде навесок (твердый кулинарный жир - 470,0±1,0 г и эмульгатор Т2 - 25,0±0,1 г) количественно переносят в стакан вместимостью 1 л, который помещают на водяную баню, нагретую до 55°С, и выдерживают до полного расплавления смеси. Стакан с расплавленной основой помещают в смеситель-гомогенизатор и перемешивают при 200 об/мин до получения однородной массы. Основу охлаждают при постоянном перемешивании до температуры (39±1)°С. Биомассу клеток Salmonella enteritidis Е-23/pcDNA-TCI соединяют с 5 мл стерильной очищенной воды и ресуспендируют до получения однородной суспензии, которую вводят в охлажденную суппозиторную основу, тщательно перемешивая до получения однородной массы. Суппозиторную массу выливают в подготовленные формы и охлаждают при температуре минус (15±2)°С в течение 60 мин.
Пример 4. Определение жизнеспособных клеток в суппозиториях.
Одну суппозиторию весом 2,0 г, содержащую клетки аттенуированного штамма Salmonella enteritidis Е-23 со встроенной плазмидой pcDNA-TCI или pGEX-2T-TB, размягчают при 37°С в фосфатном буфере до однородного состояния и готовят 10-ти кратные разведения суспензии. Из растворов 6-го, 7-го и 8-го разведении делают высевы по 100 мкл на чашках Петри с L-агаром, содержащим 100 мкг/мл ампициллина, и термостатируют сутки при 37°С. По истечении времени проводят визуально подсчет количества колоний на чашках. Количество жизнеспособных колоний рекомбинантных сальмонелл в суппозитории (X) находят по формуле:
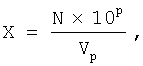
где: X - количество жизнеспособных колоний;
N - количество колоний;
10p - номер разведения;
Vp - объем высеваемого разведения, мкл; (100 мкл).
Количество жизнеспособных колоний в суппозитории после подсчета составляет от 106 до 109.
Пример 5. Определение токсичности препаратов суппозиториев.
Суппозитории весом 100 мг, содержащие от 106 до 109 клеток Salmonella enteritidis Е-23/pGEX-2T-TBI или Salmonella enteritidis Е-23/pcDNA-TCI вводят не менее чем 5 морским свинкам (весом 250-350 г), однократно в прямую кишку на глубину 0,5-1 см и фиксируют в течение 2-3 мин. В течение первых суток и на протяжении 7 суток после введения суппозиториев проводят ежедневное визуальное обследование животных, оценивая их внешний вид, подвижность, измеряют массу тела. В течение всего периода наблюдения ни одно животное не погибло, визуально регистрируемых признаков интоксикации и снижения массы тела животных не наблюдалось. Таким образом, предложенный препарат не токсичен и безвреден.
Пример 6. Определение специфической активности суппозиториев, содержащих Salmonella enteritidis E-23/pcDNA-TCI
Иммунизация. Для иммунизации используют мышей линии BALB/c, весом 12-15 грамм, которые были получены из вивария ГНЦ ВБ "Вектор". Животные содержались на стандартном рационе.
Иммунизацию животных суппозиториями проводят однократно, перректально (один суппозиторий содержит 108 клеток S. enteritidis E-23/pcDNA-TCI). Забор крови производят на 0, 7, 14, 21, 28, 35 сутки после введения сальмонелл.
Иммуноферментный анализ. Специфичность образующихся антител в сыворотках мышей анализируют с помощью ИФА. Для выявления антител против ВИЧ-1 используют очищенный инактивированный вирус ВИЧ-1 и очищенный белок TCI. В каждом эксперименте берут образцы крови от трех животных. После получения сыворотки образцы смешивают, после чего определяют титр специфических антител. Титр определяют как превышение титра сывороток мышей, иммунизированных суппозиториями, содержащими S. enteritidis E-23/pcDNA-TCI над титром сывороток мышей, иммунизированных суппозиториями с исходным штаммом S.enteritidis E-23. На каждую точку делают два повтора. Результаты представлены на фиг.1, 2. Начиная с третьей недели после иммунизации мышей суппозиториями S. enteritidis E-23/pcDNA-TCI обнаруживается продукция IgG к ВИЧ-1, причем продукция антител остается на высоком уровне на протяжении всего срока наблюдения.
Определение количества CTL лимфоцитов на основе реакции ELISPOT
При постановке реакции ELISPOT на первом этапе проводят сорбцию анти-INF-γ MAT с концентрацией 5 мкг/мл на лунку 96-луночного планшета ImmunoSpot M200. После инкубации в течение 12 ч при 4°С каждую лунку дважды промывают раствором PBS и блокируют средой RPMI 1640, содержащей 10% фетальную бычью сыворотку, в течение 2 ч. В качестве клеток-эффекторов используют спленоциты иммунизированных животных в концентрации 106 мл. Для стимуляции продукции INF-γ суспензией клеток используют белок TCI (1 мкг/мл) и два пептида: N15 (DRVIEVVQGAYRAIR), N16 (KQIINMWQEVGKAMYA), для оценки неспецифической продукции используют пептид ЕНЕС (отрицательный контроль). Клетки культивируют в присутствии 5% СО2 при 37°С в течение 24 ч. INF-γ-секретирующие клетки визуализируют, используя 0,5 мкг/мл биотинилированнных анти- INF-γ антитела и 0,25 мкг/мл конъюгата Avidin-HRP. Окрашивание производят добавлением субстратов для пероксидазы (4-хлор-1-нафтол, диаминобензидин фосфат). Реакцию останавливают удалением реагентов, лунки промывают 3 раза дистиллированной водой. Подсчет количества INF-γ-продуцирующих клеток осуществляют с помощью микроскопа. Результаты экспериментов сведены в Таблицу 4.
Результаты оценки цитотоксических Т-лимфоцитов животных, иммунизированных суппозиториями, содержащими S. enteritidis E-23/pcDNA-TCI в ELISPOT
Пример 7. Оценка вируснейтрализующей активности сывороток.
Вируснейтрализующую активность сывороток определяют методом учета ингибирования репродукции вируса ВИЧ-1 по снижению его инфекционного титра. Для этого используют перевиваемые лимфобластоидные клетки человека МТ-4. Клетки культивируют в концентрации 3,0-5,0×105 клеток в 1 мл среды RPMI 1640 с 10% сыворотки эмбрионов коров, 100 мкг/мл гентамицина. В реакции вируснейтрализации используют штамм ВИЧ-1899A (тип Х4, субтип В), полученный из коллекции штаммов вирусов иммунодефицита человека НИИ вирусологии им. Д.И. Ивановского РАМН. Множественность заражения составляет 100 ТЦД50. Сыворотки инактивируют на водяной бане при температуре 56°С в течение 30 мин. В лунки пластиковой 96-луночной панели («Costar», США) вносят по 50 мкл следующих разведении сывороток: 1:10, 1:20, 1:40, 1:80, 1:160, 1:320, 1:640, 1:1280, т.д. и добавляют 50 мкл суспензии вируса. Смесь инкубируют в течении 1 ч при 37°С. После инкубации вносят по 100 мкл взвеси чувствительных клеток МТ-4 в количестве 90-100×103 кл/лунку.
Панель инкубируют при 37°С в атмосфере с 5% СО2 и 98% влажности в течение 5-7 суток до момента учета результатов. В качестве контролей используют: «контроль вируса» - вирус с добавлением среды без сыворотки, «контроль клеток» - клетки в питательной среде, «контроль цитотоксичности сывороток» - клетки + сыворотки. Учет результатов проводят на 5-7 день после начала эксперимента. Ингибирование репродукции вируса оценивают по снижению его инфекционного титра, который определяют по ТЦД50 (50% тканевая цитопатическая доза). Данные по определению нейтрализующих титров антител в сыворотках крови иммунных животных сведены в Таблицу 5.
Нейтрализующая активность сывороток
Данные, представленные в Таблице 5, свидетельствуют о том, что образующиеся после введения суппозиториев S. enteritidis E-231 pcDNA-TCI антитела обладают вируснейтрализующей активностью.
Таким образом, суппозитории, содержащие Salmonella enteritidis E-23/pcDNA-TCI при введении животным индуцирует выраженный специфический гуморальный и клеточный иммунный ответ к ВИЧ-1. Предложенные суппозитории могут быть использованы в качестве живой ДНК- вакцины против ВИЧ-1.
Пример 8. Определение специфической активности суппозиториев, содержащих Salmonella typhimurium T10 рКНВс.
Иммунизация. Для иммунизации используют мышей линии BALB/c, весом 12-15 грамм, полученных из вивария ГНЦ ВБ "Вектор". Животные содержались на стандартном рационе.
Иммунизацию мышей проводят введением суппозиториев перректально, двукратно с интервалом 3 недели. Доза S. typhimurium Т10 рКНВс составляет 107 клеток на суппозиторий. Забор крови производят через 14, 21, 28, 36 и 44 дней после первого введения сальмонелл.
Иммуноферментный анализ. Специфичность образующихся антител в сыворотках мышей анализируют с помощью ИФА. Для выявления антител против HBcAg используют очищенный рекомбинантный HBcAg. В каждом эксперименте берут образцы от трех животных. Эти образцы смешивают, после чего определяют титр специфических антител. Титр определяют как превышение титра сывороток мышей, иммунизированных суппозиториями, содержащими Salmonella typhimurium T10 рКНВс, над титром сывороток мышей, иммунизированных суппозитории с исходным штаммом Salmonella typhimurium T10. На каждую точку делают два повтора. Результаты представлены на фиг.3.
Реакция бласттрансформации. Реакцию бласттрансформации спленоцитов проводят через 81 день после первого введения сальмонелл по ранее описанной методике [18]. В качестве специфического антигена используют HBcAg, в качестве неспецифического антигена - вирус энтерита норки. В лунку планшета вносят по 100 мкл каждого компонента. Концентрация антигенов равна 2 мкг/мл. В качестве митогена используют конканавалин А (производства "Sigma", США) в концентрации 5 мкг/мл. Клетки, стимулированные антигенами, инкубируют в течение 78 ч. За 18 ч до окончания срока инкубации вносят 3H-тимидин (Санкт-Петербург) в дозе 2 мкКи на лунку. Клеточный ответ оценивают по показателю индекса стимуляции, который характеризует отношение пролиферации спленоцитов, индуцированных специфическими антигенами к спонтанной пролиферации спленоцитов (Таблица 6). Формирование клона спленоцитов, сенсибилизированных к HBcAg, регистрируется в группе животных, иммунизированных суппозиториями с S. typhimurium T10/pKHBc. Индекс стимуляции в группе S. typhimurium T10/pKHBc достоверно превосходит таковой как в контрольной группе S. typhimurium Т10, так и при стимуляции спленоцитов гетерологичным антигеном - вирусом энтерита норок. Способность спленоцитов отвечать на стимуляцию HBcAg на 81-й день от начала иммунизации S. typhimurium T10/pKHBc свидетельствует о формировании специфической клеточной памяти.
Приведенные данные свидетельствуют о том, что суппозитории, содержащие Salmonella typhimurium T10/pKHBc, при введении животным индуцируют выраженный специфический гуморальный и клеточный иммунный ответ к HBcAg. Предложенные суппозитории могут быть использованы в качестве живой вакцины против гепатита В.
Пример 9. Приготовление суппозитория из лиофилизированной биомассы аттенуированного рекомбинантного штамма Salmonella typhimurium T-10/pKHBc.
Компоненты основы суппозиториев в виде навесок подготавливают, как описано в Примерах 2 или 3. Стакан с расплавленной основой помещают в смеситель-гомогенизатор и перемешивают при 200 об/мин до получения однородной массы. Основу охлаждают при постоянном перемешивании до температуры (39±1)°С. Флаконы (2-3 флакона) с лиофилизированной биомассой Salmonella typhimurium T-10/pKHBc (титр жизнеспособных клеток должен быть 109-1011 КОЕ/мл) вскрывают в асептических условиях и тщательно растирают таблетки до получения сыпучего порошка без комочков. Таким образом, впервые получены суппозитории для иммунопрофилактики вирусных инфекций, содержащие живые аттенуированые рекомбинантные штаммы сальмонелл, несущие протективные вирусные антигены, индуцирующие при введении животным выраженный специфический гуморальный и клеточный иммунный ответ к соответствующему вирусному антигену, которые могут быть использованы в качестве живых противовирусных вакцинных препаратов.
Пример 10. Определение специфической активности суппозиториев, содержащих Salmonella enteriditis E23/pGEX-2T-TBI.
Рекомбинантный штамм Salmonella enteriditis E23/pGEX-2T-TBI продуцирует полиэпитопный белок gst-TBI, состоящий из В- и Т-клеточных эпитопов ВИЧ-1 [8].
Иммунизация. Для иммунизации используют мышей линии BALB/c, весом 12-15 грамм, полученных из вивария ГНЦ ВБ "Вектор". Животные содержались на стандартном рационе.
Иммунизацию мышей проводят введением суппозиториев перректально. Доза Salmonella enteriditis E23/pGEX-2T-TBI составляет 109 клеток на суппозиторий. В качестве положительного контроля животных иммунизируют белком gst-TBI с ПАФ (полный адъювант Фрейнда) внутримышечно однократно. Забор крови производят через 2, 6 и 12 недель после введения сальмонелл.
Иммуноферментный анализ. Специфичность образующихся антител в сыворотках мышей анализируют с помощью ИФА. Для выявления антител против ВИЧ-1 используют очищенный рекомбинантный белок gst-TBI и лизат ВИЧ-1899А (тип Х4, субтип В), полученный из коллекции штаммов вирусов иммунодефицита человека НИИ вирусологии им. Д.И.Ивановского РАМН. В каждом эксперименте берут образцы от трех животных. Эти образцы смешивают, после чего определяют титр специфических антител. На каждую точку делают два повтора. Результаты представлены в таблице 7.
Развитие ВИЧ-специфического гуморального иммунного ответа у мышей, иммунизированных клетками рекомбинантной сальмонеллы, продуцирующих TBI
Реакция бласттрансформации. Реакцию бласттрансформации спленоцитов проводят через 6 недель после введения сальмонелл по ранее описанной методике [18]. В качестве специфического антигена используют gst-TBI и лизат ВИЧ-1 в качестве неспецифического антигена - вирус энтерита норки. В лунку планшета вносят по 100 мкл каждого компонента. Концентрация антигенов равна 2 мкг/мл. В качестве митогена используют конканавалин А (производства "Sigma", США) в концентрации 5 мкг/мл. Клетки, стимулированные антигенами, инкубируют в течение 78 ч. За 18 ч до окончания срока инкубации вносят 3H-тимидин (Санкт-Петербург) в дозе 2 мкКи на лунку. Клеточный ответ оценивают по показателю индекса стимуляции, который характеризует отношение пролиферации спленоцитов, индуцированных специфическими антигенами, к спонтанной пролиферации спленоцитов (Таблица 8). Формирование клона спленоцитов, сенсибилизированных к gst-TBI, регистрируется в группе животных, иммунизированных суппозиториями с S. enteriditis E23/pGEX-2T-TBI. Индекс стимуляции в группе S. enteriditis E23/pGEX-2T-TBI достоверно превосходит таковой как в контрольной группе S. typhimurium 7207, так и при стимуляции спленоцитов гетерологичным антигеном - вирусом энтерита норок. Способность спленоцитов отвечать на стимуляцию gst-TBI на 6 неделе от начала иммунизации с S. enteriditis E23/pGEX-2T-TBI свидетельствует о формировании специфической клеточной памяти.
Примечание. В каждом эксперименте брали клетки от 3-х животных. Погрешность определения индекса стимуляции не более 0,1.
Приведенные данные свидетельствуют о том, что суппозитории, содержащие с S. enteriditis E23/pGEX-2T-TBI, при введении животным индуцируют выраженный ВИЧ-1 специфический гуморальный и клеточный иммунный ответ.
Пример 11. Приготовление суппозитория Сал-ВИЧ "Д", содержащего живые клетки аттенуированного рекомбинантного штамма Salmonella enteritidis Е-23/pcDNA-TCI.
Компоненты основы суппозитория в виде навесок (гидролизованное хлопковое масло (ГХМ) - 425,0±1,0 г и эмульгатор Т2 - 25,0±0,1 г) количественно переносят в стакан вместимостью 1 л, который помещают на водяную баню, нагретую до 55°С, и выдерживают до полного расплавления смеси. Стакан с расплавленной основой помещают в смеситель-гомогенизатор и перемешивают при 200 об/мин до получения однородной массы. Основу охлаждают при постоянном перемешивании до температуры (39±1)°С. Биомассу клеток Salmonella enteritidis E-23/pcDNA-TCI вводят в охлажденную суппозиторную основу порциями при перемешивании, суспендируют до получения однородной суспензии. Суппозиторную массу выливают в подготовленные формы и охлаждают при температуре минус (15±2)°С в течение 60 мин. Количество жизнеспособных колоний в суппозитории после подсчета составляет от 1,1×106 до 4×108.
Таким образом, впервые получены суппозитории для иммунопрофилактики вирусных инфекций, содержащие живые аттенуированые рекомбинантные штаммы сальмонелл, несущие протективные вирусные антигены, индуцирующие при введении животным выраженный специфический гуморальный и клеточный иммунный ответ к соответствующему вирусному антигену, которые могут быть использованы в качестве живых противовирусных вакцинных препаратов.
ЛИТЕРАТУРА
1. Международная заявка WO №98/48026, кл. С12N 15/74, опубл. 1998 г.
2. Международная заявка WO №0014240, кл. С12N 15/31, опубл. 2000 г.
3. Патент РФ №2192277, кл. А61К 39/12, опубл. БИ №31 за 2002 г.
4. Патент РФ №2192886, кл. А61К 39/19, опубл. БИ №32 за 2002 г.
5. Патент РФ №2223784, кл. А61К 39/385, опубл. БИ №4 за 2004 г.
6. Eroshkin A.M., Karginova E.A., Gileva I.P. et al. Design of four-helical protein as a candidate for HIV vaccine. // Protein Engeneering-1995 - 8 - p.167-173.
7. Некрасова Н.А., Игнатьев Г.М., Агафонов А.П., Ильичев А.А., Карпенко Л.И. Исследование системного и мукозального иммунного ответа при иммунизации мышей кандидатной ВИЧ-1 вакциной. // Сибирский медицинский журнал. - 2004. - Т.19. - С.60-62.
8. Карпенко Л.И., Игнатьев Г.М., Агафонов А.П., Порываева В.А., Лебедев Л.Р., Веремейко Т.А., Некрасова Н.А., Климов Н.А., Козлов А.П., Ильичев А.А. Конструирование и исследование антигенных свойств рекомбинантного штамма сальмонеллы, продуцирующей белок TBI. // Вопросы вирусологии - 2002 - N.2 - С.25-28.
9. Заявка на патент РФ №2003111095/13 от 17.04.2003 г. "Рекомбинантная плазмидная ДНК pcDNA-TCI, обеспечивающая экспрессию искусственного гена TCI в клетках эукариот, и рекомбинантный аттенуированный штамм бактерий Salmonella enteritidis E-23/pcDNA-TCI как кандидат для конструирования живой ДНК-вакцины против ВИЧ".
10. Nardelli-Haeftiger D., Kraehenduhl J.P, et al. Oral and rectal immunization of adult female volunteers with a recombinant attenuated Salmonella typhi vaccine strain. Infect. Immun. - 1996 - v.64 - p.5219-5224.
11. Патент РФ №2216590, кл. С12N 1/21, опубл. БИ №32 за 2003 г.
12. Карпенко Л.И., Игнатьев Г.М., Кожина Е.М. и др. Получение и исследование рекомбинантных штаммов Salmonella typhimurium SL 7207, продуцирующих HbcAg HbcAg-HBs. Вопросы вирусологии - 2000 - №2 - с.43-46.
13. Gregg M.R., Jack D.B., Smith S.R., Kendall M.J. The pharmacokinetics ofoxprenolol following oral and rectal dosing-a comparison of delivery systems and routes of administration. // J Clin Pharm Ther. 1987 Apr; 12 (2): 91-9.
14. Патент РФ №2224542, кл. А61К 39/116, опубл. БИ №6 за 2004 г.
15. Патент РФ №2185842, кл. А61К 35/74, опубл. БИ №21 за 2002 г.
16. Патент РФ №2228738, кл. А61К 9/02, опубл. БИ №15 за 2004 г.
17. Патент РФ №2073520, кл. А61К 35/74, опубл. БИ №5 за 1997 г.
18. Хоробрых В.В., Пронин А.В., Киркин А.Ф., Санин А.В. Методы постановки реакции бласттрансформации в микромодификации // Иммунология. - 1983. - N3. - С.76-79.
Изобретение относится к микробиологии, биотехнологии и медицине, а именно к созданию живых вакцин для ректального введения против вирусных инфекций на основе аттенуированных рекомбинантных штаммов сальмонелл, несущих протективные вирусные антигены. Суппозитории для иммунопрофилактики вирусных инфекций содержат компоненты в следующем соотношении на одну свечу массой 2,0 г, мас.%: суспензия клеток рекомбинантных аттенуированных штаммов Salmonella, трансформированных pGEX-2T-TBI, pcDNA-TCI или рКНВс, несущих гены протективных вирусных антигенов, и вмешанных в суппозиторную основу в количестве 106-109 живых клеток - 1%; жировая основа - 94% и эмульгатор Т-2 - 5%. При этом в качестве жировой основы может быть использован твердый кулинарный жир (94%), или гидролизованное хлопковое масло (94%) или смесь кулинарного жира "Фритюрный" (60%), масла какао (24%) и твердого парафина (10%). Применение суппозиториев позволяет индуцировать специфический гуморальный и клеточный иммунный ответ к соответствующему вирусному антигену. 3 з.п. ф-лы, 8 табл., 3 ил.
| ДОНИН М | |||
| В | |||
| и др | |||
| Возможность использования аттенуировынных рекомбинантных штаммов Salmonella enteriditis, продуцирующих НВс-антиген, как ректальной вакцины в эксперименте | |||
| Вестник Российской академии медицинских наук | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СУППОЗИТОРИИ "ГЕНФЕРОН", ОБЛАДАЮЩИЕ ИММУНОМОДУЛИРУЮЩИМ, ПРОТИВОВИРУСНЫМ, ПРОТИВОБАКТЕРИАЛЬНЫМ, РЕГЕНЕРИРУЮЩИМ, РЕПАРАТИВНЫМ, МЕМБРАНО- И ГЕПАТОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ | 2002 |
|
RU2201212C1 |
| ШТАММ БАКТЕРИЙ SALMONELLA ENTERIDITIS E-23 BMC120 ДЛЯ ИММУНИЗАЦИИ ПРОТИВ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2001 |
|
RU2192277C1 |
| ШТАММ БАКТЕРИЙ SALMONELLA TYPHIMURIUM Т-10 ВМС160 ДЛЯ ИММУНИЗАЦИИ ПРОТИВ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2001 |
|
RU2192886C1 |
| WO | |||
Авторы
Даты
2007-04-10—Публикация
2004-08-25—Подача