Изобретение относится к иммунологии и может быть использовано для создания иммунитета против вируса иммунодефицита человека.
Известен штамм бактерий Salmonella typhimurium SL 7207, см. "Induction of mucosal and systematic responses against human immunodeficiency virus type 1 glycoprotein 120 in mice after oral immunisation with a single dose of a Salmonella-HIV vector", Shaoguuang Wu, D.B.Pascual, G.K.Lewis, D.M. Hone, 1997, AIDS Research and Human Retroviruses vol. 13, N 14, pp. 1187-1193 (копия ссылки прилагается). Штамм вводили мышам per os. В результате у мышей индуцировали выраженный иммунный ответ к вирусному белку gp 120 вируса иммунодефицита человека; клетки сальмонелл секретируют данный вирусный белок в периплазму бактериальных клеток; наблюдается пролиферативный ответ спленоцитов иммунизированных мышей на 14 сутки после иммунизации per os; в основном индуцировались Тh 1 и Тh 2-ответы, а также отмечена индукция IgA-секретирующих клеток в lamina propria и в мезентерических лимфоузлах.
Однако следует отметить, что в данном аналоге существенным недостатком является то, что белок, синтезируемый бактериальной клеткой, не гликозилируется; кроме того, данный штамм не индуцирует антитела к поверхностному белку gp 160 вируса иммунодефицита человека, вследствие этого не возникает полноценный иммунный ответ.
Известен также штамм бактерий Salmonella typhimurium SL 7207 (aro A his G 46), содержащий эукариотические вектора, экспрессирующие два укороченных белка (Act А и листериолизин) патогенной бактерии Listeria monocytogenes, см. "Oral somatic transgene vaccination using attenuated S. typhimurium", A. Darji, C. A.Gusman, B.Girstel, P.Wachholz, K.N.Timmis, J.Wehland, T.Chakraborty, S. Weiss, 1997, Cell vol.91, pp. 765-775 (копия ссылки прилагается). Мышей иммунизировали per os. Наблюдали образование цитотоксических лимфоцитов, Т-хелперных клеток и антител к данным белкам у иммунизированных таким образом животных, а также их невосприимчивость к внутривенному введению Listeria monocytogenes в дозе 10•LD50.
Недостатком этого штамма является отсутствие способности вызывать иммунный ответ в отношении вируса иммунодефицита человека.
Известен штамм бактерий Salmonella typhimurium SL 3621, см. "Potential live vaccines for HIV", M.S.Burnett, N.Wang, M.Hofmann, G.B.Kitto, Vaccine (2001) vol.19, pp. 735-742 (копия ссылки прилагается). Эти бактерии синтезируют белок Pol вируса иммунодефицита человека в виде слитного белка, Pol-OmpA. Мышей иммунизировали per os. После иммунизации мышей клетками данных бактерий наблюдается появление специфического иммуноглобулина А к целевому белку в экстактах фекалий, появление пролиферативного клеточного ответа, а также индукция цитотоксических лимфоцитов селезенки, специфичных к клеткам, представляющим на своей поверхности фрагменты полимеразы.
Данное техническое решение принято в качестве пропотипа настоящего изобретения.
Его недостатком является то обстоятельство, что этот штамм не индуцирует антитела к поверхностному белку gp 160 вируса иммунодефицита человека. Вследствие этого не возникает антител, реагирующих с поверхностью вирусных частиц, что обусловливает недостаточную иммунизацию организма к вирусу иммунодефицита человека.
Задачей настоящего изобретения является получение штамма бактерий, способных вызвать эффективную иммунизацию организма в отношении вируса иммунодефицита человека.
Для решения указанной задачи предлагается штамм бактерий Salmonella typhimurium T-10 ВМС160, обладающий высокой способностью вызывать выраженную и действенную иммунизацию к вирусу иммунодефицита человека.
Штамм Salmonella typhimurium T-10 BMC160 получен из штамма Salmonella typhimurium T-10 (cya, CRP). При помощи генетической трансформации в исходный штамм введена плазмида рВМС-160, обеспечивающая синтез белка gp160 вируса иммунодефицита человека в клетках млекопитающих и человека и несущая также ген устойчивости к ампициллину.
Этот штамм депонирован в Коллекции микроорганизмов ВНИИ сельскохозяйственной микробиологии под номером ВНИИСХМ422-Д от 16.07.2001. Идентификация штамма проведена по "Определителю бактерий Берги"; М., 1997.
Культурально-морфологические признаки:
Морфология: грамотрицательные палочки, средних размеров, расположены хаотично.
Культуральные свойства: растет на мясо-пептонном агаре, глюкозоминимальном агаре Дэвиса, средах Мак-Конки, Левина, Кауфмана, колонии в S-форме мелких размеров через 18 часов роста при 37oС. В мясо-пептонном бульоне, желчном бульоне, жидкой глюкозоминимальной среде А (Дэвиса) - диффузное помутнение через 18 часов роста. В цитратминимальной среде (Дэвиса) - отсутствие роста.
Резистентность к антибиотикам: на всех вышеперечисленных средах растет в присутствии ампициллина (100 микрограммов/мл)
Антигенная структура:
O4,12 Hi1,2
Биохимические свойства:
Не утилизирует цитрат на агаре Симмонса, не продуцирует индол, не расщепляет мочевину, не обладает фенилаланилтрансаминазой, реакция Фогес-Проскауэра - отрицательная; продуцирует сероводород в течение 48 часов, обладает лизин- и орнитилкарбоксилазными активностями и аргининдегидролазной активностью; ферментирует глюкозу, не ферментирует лактозу, сахарозу, мальтозу, сорбит, инозит, дульцит, адонит; в течение 48 часов ферментирует рамнозу, маннит, трегалозу. Желатину не разжижает.
Вирулентность:
Лабораторные мыши белые, беспородные, 12-14 г ЛД50-2,5•106 КОЕ (колониеобразующих единиц) после внутрибрюшинного заражения.
Чувствительность к бактериофагам:
Чувствителен к бактериофагу Р22.
Плазмидный профиль:
Плазмида рВМС-160 с молекулярной массой 5,8 мД. Данная плазмида получена авторами и введена в клетки сальмонеллы известным способом и обеспечивает синтез белка gp l60 вируса иммунодефицита человека в эукариотических клетках.
Пример 1.
Готовили жидкую питательную среду: Пептон 10 г/л. Дрожжевой экстракт 5 г/л, натрий хлористый 10 г/л, к которой после автоклавирования добавляли ампициллин до конечной концентрации 100 микрограммов/миллилитр. 100 миллилитров вышеуказанной среды помещали в колбу объемом 1 литр, после чего засевали материалом из одной колонии, выросшей на агаризованной плотной питательной среде такого же состава. Колбу инкубировали в качалке при температуре +37oС и 250 об/мин в течение 18 часов, после чего определяли количество бактерий в одном миллилитре, оказавшееся равным 2•108. Бактерии концентрировали в 10 раз и полученной суспензией и дважды, с перерывом в 2 недели, иммунизировали лабораторных мышей перректально по 2•108 живых клеток на иммунизацию, еще через 7 дней животных забивали, выделяли спленоциты, которые смешивали с сингенными клетками-мишенями, экспрессирующими поверхностный белок вируса иммунодефицита человека и контрольными клетками, не экспрессирующими данный белок. После совместной инкубации в течение 5 часов распад клеток-мишеней определяли известным способом. Результаты представлены в табл. 1.
Пример 2.
Для иммунизации были использованы мыши линии BALB/C массой 12 г. Животным вводили перорально или перректально суспензию клеток рекомбинантной сальмонеллы, содержащих плазмиду, по 109 живых клеток на каждую мышь на одну иммунизацию. Животных иммунизировали дважды: в день 0 и на 14-е сутки после первой иммунизации. В качестве отрицательного контроля использовали исходный штамм Salmonella typhimurium T-10. Оценку пролиферативного клеточного ответа спленоцитов животных проводили известным методом и выражали в виде индекса пролиферации. Результаты представлены в табл. 2.
Как видно из таблицы, спленоциты животных, иммунизированных Salmonella typhimurium T-10 ВМС-160 ректально, сохраняют способность к пролиферации при добавлении лизата вируса иммунодефицита человека вплоть до 81 дня после первой иммунизации.
Пример 3.
Лабораторных мышей линии BALB/C весом 12-16 г иммунизировали перорально и перректально суспензией клеток Salmonella typhimurium T-10 BMC160 и Salmonella typhimurium T-10, по 108 клеток на мышь, после чего в сроки, указанные в таблице, определяли титры антител к очищенному лизату вируса иммунодефицита человека в сыворотках крови иммунизированных животных. Результаты представлены в табл. 3.
Как видно из таблицы, иммунизация мышей Salmonella typhimurium T-10 BMC160 вызывает образование антител к вирусу иммунодефицита человека.
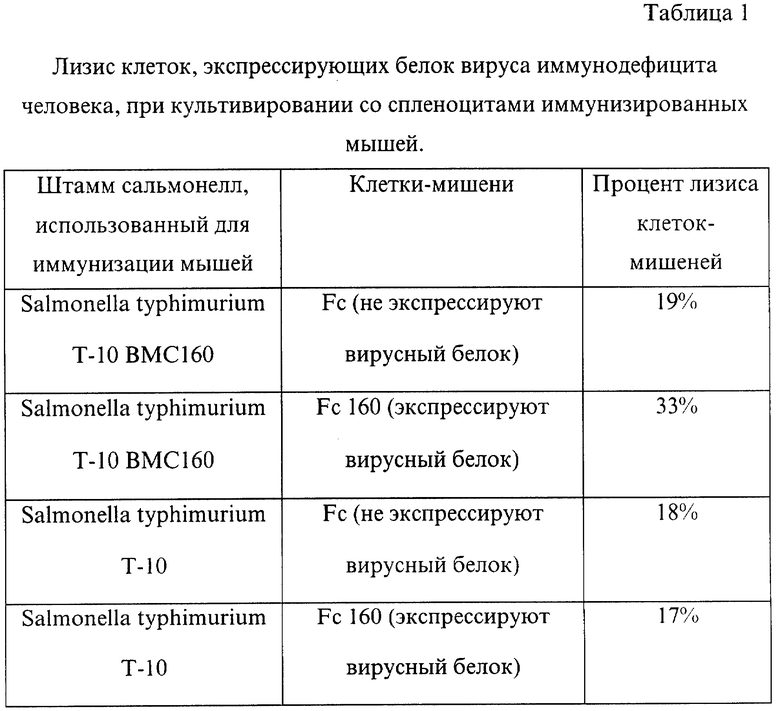
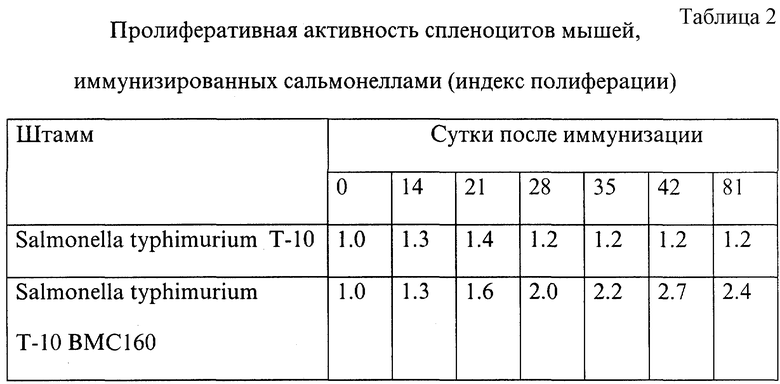
Изобретение относится к иммунологии. Штамм Salmonella typhimurium Т-10 BMC160 получен из штамма Salmonella typhimurium T-10. При помощи генетической трансформации в исходный штамм введена плазмида рВМС160, обеспечивающая синтез белка gp160 вируса иммунодефицита человека. Штамм Salmonella typhimurium Т-10 BMC160 обладает высокой способностью вызывать выраженную и действенную иммунизацию к вирусу иммунодефицита человека. Штамм используется для создания иммунитета против вируса иммунодефицита человека. 3 табл.
Штамм бактерий Salmonella typhimurium, депонированный во ВНИИ сельскохозяйственной микробиологии под "ВНИИСХМ" 422-Д", для иммунизации против вируса иммунодефицита человека.
| US 5733760, 31.03.1998 | |||
| ШТАММ HOMINIS IMMUNODEFICITI VIRUS (HIV-I) ВИЧ-1 /РОССИЯ/ГМ-12-95 (RU 1295) СУБТИПА В ДЛЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 1996 |
|
RU2121502C1 |
| СПОСОБ ПОЛУЧЕНИЯ АТТЕНУИРОВАННОГО ШТАММА БАКТЕРИЙ SALMONELLA И ВАКЦИНА | 1992 |
|
RU2126447C1 |
| WO 9729768, 21.08.1997. | |||
Авторы
Даты
2002-11-20—Публикация
2001-08-24—Подача