Область техники, к которой относится изобретение
Настоящее изобретение относится к области синтетической органической химии и к способу получения ингибитора АХЭ (ацетилхолинэстеразы) периндоприла.
В частности, настоящее изобретение относится к простому и высокоселективному способу получения периндоприла, также пригодному для промышленного производства с использованием имеющихся в продаже сырья и реагентов.
Уровень техники
Периндоприл впервые был получен способом, описанным в ЕР-А-0049658, в котором раскрыт четырехстадийный способ, который приводит к образованию стереоизомеров, которые необходимо разделять с использованием сложных методик. Реагентом для конденсации обоих критически важных промежуточных продуктов являлся дициклогексилкарбодиимид. Патент ЕР-0308339 В1 относится к получению исходного вещества, критически важного для синтеза периндоприла, т.е. (2S,3аS,7аS)-октагидроиндол-2-карбоновой кислоты.
В US 4914214 описан способ получения того же исходного вещества путем гидрирования (S)-2-карбоксииндолина. Соединение, полученное гидрированием, затем конденсируют с N-/1-(S)-этоксикарбонилбутил/-(S)-аланином с использованием дициклогексилкарбодиимида в качестве реагента для конденсации и 1-гидроксибензотриазола в качестве вспомогательного нуклеофильного реагента. Недостатком этого способа является образование дициклогексилмочевины, которую трудно удалить из реакционной смеси.
Альтернативный способ получения периндоприла описан в патенте ЕР-1279665 А2. На первой стадии способа N-/1-(S)-этоксикарбонилбутил/-(S)-аланин активируют фосгеном или полимером фосгена с образованием соответствующего оксазолидина, который затем взаимодействует с (2S,3aS,7aS)-октагидроиндоло-2-карбоновой кислотой. Другим объектом изобретения является конденсация с использованием N,N′-карбонилдиимидазола. Важно, что в этом способе боковая карбоксигруппа является незащищенной. В то же время из химии пептидов известно, что конденсация аминокислот, содержащих незащищенные боковые группы, повышает вероятность побочных реакций.
Задачей настоящего изобретения является получение периндоприла и его фармацевтически приемлемых солей, таких как трет-бутиламиновая соль, новым и простым способом, при котором периндоприл получается с высоким выходом и обладающим высокой чистотой.
Подробное описание изобретения
Первым вариантом выполнения настоящего изобретения является способ получения периндоприла формулы I:
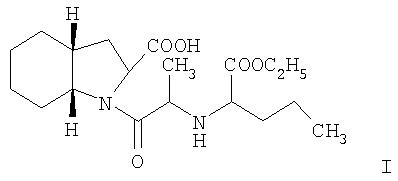 ,
,
отличающийся тем, что карбоксильная группа стереоспецифической аминокислоты N-/1-(S)-этоксикарбонилбутил/-(S)-аланина формулы II:
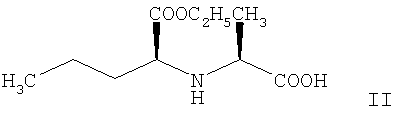
активируется тетраметилурониевой солью формулы III:
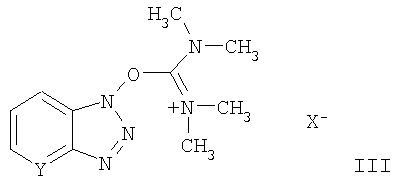
в которой Y обозначает ароматический атом С или N, Х- обозначает анион, такой как тетрафторборатный, гексафторфосфатный или галогеновый, и затем полученная активированная аминокислота формулы II взаимодействует с (2S,3аS,7аS)-октагидроиндоло-2-карбоновой кислотой или ее сложным эфиром формулы IV:
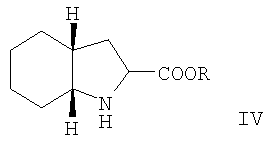
в которой R обозначает водород, бензильную группу, третичную бутильную группу или триметилсилильную группу.
Тетраметилурониевую соль можно выбрать из группы, включающей:
O-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилуронийгексафторфосфат, аббревиатура: HBTU;
O-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилуронийтетрафторборат, аббревиатура: TBTU; и
O-(7-азабензотриазол-1-ил)-N,N,N′,N′-тетраметилуронийгексафторфосфат, аббревиатура: HATU, которые имеются в продаже.
Эти реагенты известны из литературы (G.A.Grant, Synthetic Peptides, Oxford University Press, 1992, 119) как реагенты, подходящие для синтеза пептидов, при использовании которых не протекают побочные реакции изомеризации по хиральным центрам.
Во втором варианте выполнения настоящего изобретения способ получения периндоприла отличается тем, что на стадии активации аминокислоты формулы II прибавляют третичное органическое основание. Два моля третичного органического основания прибавляют к 1 молю эквимолярной смеси тетраметилурониевого реагента и кислотного соединения формулы II.
Реакция активации описана в литературе (Aldrichimica Acta, Vol.29, No.2, 1996, р.9) и включает образование высокореакционноспособного промежуточного продукта формулы V:
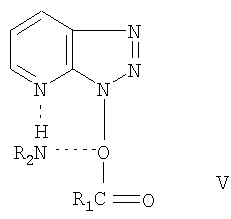
который взаимодействует с амином, например с (2S,3аS,7аS)-октагидроиндоло-2-карбоновой кислотой или ее сложным эфиром, и превращается в дипептид, например периндоприл.
Согласно настоящему изобретению третичным органическим основанием может быть третичный амин, выбранный из группы, включающей триэтиламин, пиридин, лутидин и N,N-диизопропилэтиламин. Предпочтительным третичным амином является N,N-диизопропилэтиламин.
В третьем варианте выполнения настоящего изобретения способ получения периндоприла отличается тем, что на стадии активации аминокислоты II можно использовать основной реакционноспособный растворитель, например, 1-метилимидазол. Растворитель для способа получения периндоприла, предлагаемого в настоящем изобретении, также можно выбрать из группы, включающей N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидон, дихлорметан и их смеси.
Периндоприл можно выделить из конечной реакционной смеси путем экстракции дихлорметаном или этилацетатом. Все побочные продукты и реагенты растворимы в воде и их можно удалить путем простой экстракции водными растворами. В заключение, полученную органическую фазу, содержащую периндоприл, сушат путем выпаривания растворителя в вакууме.
Хотя в способе, предлагаемом в настоящем изобретении, для реакции с активированной аминокислотой используют сложные эфиры (2S,3aS,7aS)-октагидроиндоло-2-карбоновой кислоты, в конце процедуры следует удалить защитную сложноэфирную группу.
Бензильную защитную группу можно удалить гидрированием с использованием методики с применением межфазной системы водород/катализатор (МФВ), включающей палладиевый катализатор на древесном угле, и прибавлением донора протона, например, формиата аммония. В этом случае можно избежать использования газообразного водорода, что исключает возможность воспламенения и взрыва при промышленном производстве. Третичную бутильную защитную группу можно удалить на стадии выделения путем экстракции хлористоводородной кислотой. Триметилсилильную защитную группу можно удалить на стадии экстракции путем взаимодействия с водой.
Периндоприл получают в виде бесцветного вязкого масла, которое затвердевает на холоде. Периндоприл можно превратить в периндоприлэрбумин путем кристаллизации из этилацетата или ацетонитрила после прибавления трет-бутиламина или по известной методике.
Настоящее изобретение иллюстрируется, но ни в какой степени не ограничивается приведенными ниже примерами.
Пример 1
Получение бензилпериндоприла
N-/1-(S)-Этоксикарбонилбутил/-(S)-аланин (7,2 г, 33 ммоль) и TBTU (11,8 г, 36,7 ммоль) суспендировали в смеси растворителей, содержащей 40 мл N,N-диметилформамида и 10 мл дихлорметана. При перемешивании прибавляли N,N-диизопропилэтиламин (12,5 мл, 73 ммоль) и смесь непрерывно перемешивали в течение 10 мин до полного растворения. При непрерывном энергичном перемешивании при комнатной температуре к реакционной смеси прибавляли 30 мл раствора бензилового эфира (3S, 3аS, 7аS)-октагидроиндоло-2-карбоновой кислоты (8,63 г, 33 ммоль) в дихлорметане. Перемешивание в атмосфере азота продолжали в течение еще 4 ч.
За реакцией можно следить с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) при следующих условиях:
колонка: Kromasil 100, CIS, 5 мкм, 150×4,6 мм подвижная фаза:
А - 20% ацетонитрил/80% буферный раствор, содержащий 0,1% триэтиламина/фосфорной кислоты, рН 3,2
В - 60% ацетонитрил/40% буферный раствор, содержащий 0,1% 10 триэтиламина/фосфорной кислоты, рН 3,2.
градиент: от 100% А до 50% А за 20 мин
скорость потока: 1 мл/мин
детектирование: в ультрафиолетовой области при длине водны, равной 215 нм.
времена удерживания: бензилпериндоприл: 5,7 мин; периндоприл: 11,7 мин.
После завершения реакции к конечной реакционной смеси прибавляли 300 мл дихлорметана. Полученную смесь экстрагировали с помощью двух порций 5% рассола по 400 мл, 300 мл 2% хлористоводородной кислоты в воде, 300 мл воды, двух порций насыщенного раствора бикарбоната натрия по 300 мл и в заключение - 300 мл воды. Затем дихлорметановую фазу обрабатывали сульфатом магния, фильтровали и сушили выпариванием растворителя в вакууме при температуре не выше 50°С и получали бензилпериндоприл в виде немного желтоватого масла (13,5 г, 98% от теоретического выхода).
Пример 2
Получение периндоприла
а) Гидрирование с межфазным переносом водорода (МФВ)
Бензилпериндоприл, полученный в примере 1 (13,5 г), растворяли в 300 мл метанола, к раствору прибавляли 1,35 г катализатора (10% палладий на древесном угле) и 1,35 г формиата аммония. Смесь перемешивали при комнатной температуре в течение 30 мин. Затем катализатор отфильтровывали и промывали с помощью 50 мл метанола. Полученный раствор выпаривали в вакууме при 50°С. Сухой остаток растворяли в 100 мл дихлорметана и экстрагировали: с помощью двух порций 5% рассола по 100 мл, двух порций воды по 100 мл. Затем дихлорметановую фазу обрабатывали сульфатом магния, фильтровали и сушили выпариванием дихлорметана при 50°С в вакууме. Остаток представлял собой неочищенное прозрачное и бесцветное масло, затвердевающее на холоде - периндоприл (9,8 г, 90%). Полученное соединение было идентично стандартному соединению - периндоприлу (ВЭЖХ, ИК (инфракрасные) и МС (масс-спектры) спектры).
b) Классическое гидрирование газообразным водородом
Бензилпериндоприл, полученный в примере 1 (13,5 г), растворяли в 300 мл метанола, к раствору прибавляли 1,35 г катализатора (10% палладий на древесном угле). Смесь перемешивали при комнатной температуре при умеренном токе водорода в течение еще 5 ч. Затем катализатор отфильтровывали, промывали с помощью 50 мл метанола и раствор выпаривали при 50°С в вакууме. Остаток представлял собой неочищенное прозрачное и 15 бесцветное маслообразное соединение, затвердевающее на холоде, и было идентично образцу периндоприла (10,2 г, 94% от теоретического выхода).
Пример 3
Получение периндоприла
N-/1-(S)-этоксикарбонилбутил/-(S)-аланина (7,2 г, 33 ммоль) и HATU (13,95 20 г, 36,7 ммоль) суспендировали в 25 сухого N-метилпирролоидона и 25 мл сухого дихлорметана. К смеси при непрерывном перемешивании прибавляли триэтиламин (10,2 мл, 73 ммоль, предварительно высушенный над NaOH и перегнанный в присутствии нингидрина). После 10 мин перемешивания прибавляли раствор триметилсилилового эфира (2S,3аS,7аS)-октагидроиндоло-2-карбоновой кислоты (8,0 г, 33 ммоль) в 30 мл сухого дихлорметана. Раствор перемешивали в течение еще 4 ч при комнатной температуре. Затем реакционную смесь разбавляли с помощью 250 мл дихлорметана и экстрагировали: с помощью двух порций 5% рассола по 400 мл, двух порций 2% хлористоводородной кислоты в воде по 300 мл, 300 мл воды, 300 мл охлажденного льдом насыщенного раствора бикарбоната натрия и в заключение - 300 мл охлажденной льдом воды. Затем полученную дихлорметановую фазу обрабатывали сульфатом магния, фильтровали и сушили выпариванием растворителя в вакууме при 50°С. Получали 9 г (83% от теоретического выхода) прозрачного бесцветного масла, затвердевающего на холоде, идентичного периндоприлу (ВЭЖХ, ИК, МС).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, ОБЛАДАЮЩИХ АПФ ИНГИБИТОРНОЙ АКТИВНОСТЬЮ | 2004 |
|
RU2377236C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРИНДОПРИЛА И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 2010 |
|
RU2433998C1 |
| НОВАЯ КРИСТАЛЛИЧЕСКАЯ ФОРМА ПЕРИНДОПРИЛА | 2005 |
|
RU2387641C2 |
| СОЕДИНЕНИЯ, ИНГИБИРУЮЩИЕ MASP, И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2840441C2 |
| Способ получения 1-алкил-1( -алкоксикарбонилэтил)1,2,3,4,6,7,12,12в-октагидроиндоло (2,3-а) хинолизина или его солей | 1976 |
|
SU619107A3 |
| ПЕРИНДОПРИЛ | 2003 |
|
RU2339645C2 |
| СПОСОБ ПОЛУЧЕНИЯ (S)-ЭНАНТИОМЕРОВ | 1994 |
|
RU2114103C1 |
| ОПТИЧЕСКИ АКТИВНОЕ ПРОИЗВОДНОЕ ДИАЗАБИЦИКЛООКТАНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2591701C2 |
| СТЕРЕОИЗОМЕРНЫЕ ИНДОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ИСПОЛЬЗОВАНИЕ | 1998 |
|
RU2182908C2 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТЫ | 1994 |
|
RU2127261C1 |
Изобретение относится к селективному способу получения ингибитора АХЭ периндоприла с использованием в качестве исходного вещества стереоспецифической аминокислоты N-/1-(S)-этоксикарбонилбутил/-(S)-аланина, которая активируется тетраметилурониевыми солями в присутствии третичного органического основания, с последующей реакцией с (2S,3aS,7aS)-октагидроиндоло-2-карбоновой кислотой или ее сложным эфиром и проводимым после завершения реакции удалением защитной группы гидрированием, межфазным гидрированием или экстракцией. 5 з.п. ф-лы.
1. Способ получения периндоприла формулы I:
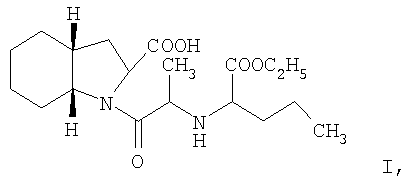
отличающийся тем, что карбоксильная группа стереоспецифической аминокислоты N-/1-(S)-этоксикарбонилбутил/-(S)-аланина формулы II:
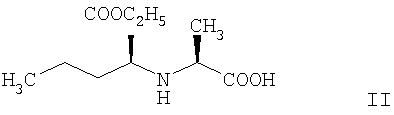
активируется тетраметилурониевой солью формулы III:
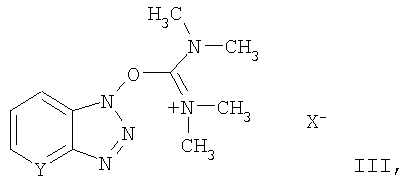
в которой Y обозначает ароматический атом C или N, X' обозначает анион, такой как тетрафторборатный, гексафторфосфатный или галогеновый, и затем полученная активированная аминокислота формулы II взаимодействует с (2S,3аS,7аS)-октагидроиндоло-2-карбоновой кислотой или ее сложным эфиром формулы IV:
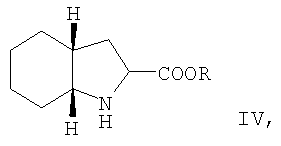
в которой R обозначает водород, бензильную группу, третичную бутильную группу или триметилсилильную группу,
и после завершения реакции защитную группу R удаляют гидрированием, межфазным гидрированием или экстракцией.
2. Способ по п.1, отличающийся тем, что тетраметилурониевую соль выбирают из группы, включающей
O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат,
O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийтетрафторборат, и
O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат.
3. Способ по любому из пп.1 и 2, отличающийся тем, что активацию карбоксильной группы тетраметилурониевыми солями усиливают путем использования третичного органического основания.
4. Способ по п.3, отличающийся тем, что третичное органическое основание выбирают из группы, включающей N,N-диизопропилэтиламин и триэтиламин.
5. Способ по п.1, отличающийся тем, что защитной группой R является бензильная группа.
6. Способ по п.5, отличающийся тем, что бензильную защитную группу удаляют с помощью межфазного гидрирования без использования газообразного водорода.
| Способ получения катализатора на основе нитрата алюминия | 1985 |
|
SU1279665A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| ПЕПТИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СРЕДСТВО, ОБЛАДАЮЩЕЕ БРАДИКИНИН-АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 1993 |
|
RU2109747C1 |
Авторы
Даты
2009-08-10—Публикация
2004-05-07—Подача