Предлагаемое изобретение относится к области металлоорганического синтеза, конкретно, к способу получения 2,3-диалкил(арил)магнеза-циклопент-2-енов общей формулы (I):
 где R=н-Pr, н-Bu, Ph
где R=н-Pr, н-Bu, Ph
Предлагаемые соединения являются перспективными реагентами для селективного получения карбо- и гетероциклов из ацетиленов, а также могут найти применение в качестве компонентов каталитических систем в процессах олигомеризации и полимеризации олефинов и диенов, в тонком промышленном органическом и металлоорганическом синтезе.
Известен способ [1, T.Saito. Preparation of Biscyclopentadienylmagnesium by means of a Titanium Complex Catalyst. // Chem. Commun., 22 (1971) 1422] получения непредельного магнийорганического соединения, а именно бисциклопентадиенида магния общей формулы (2) взаимодействием циклопентадиена с металлическим магнием в присутствии катализатора CpTiCl3 (5 мол.%) при температуре 20°С за 48 часов в ТГФ с выходом 80-85% по схеме:
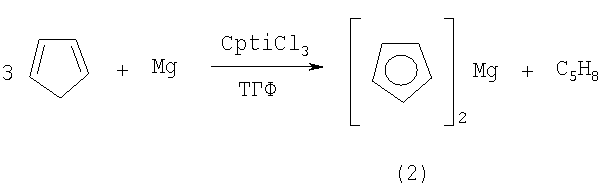
Известный способ не позволяет получать 2,3-диалкил(арил)магнезациклопент-2-ены (1).
Известен способ [2, K.Fujita, Y.Ohnuma, H.Yasuda, H.Tani. Magnesium-butadiene Addition Compounds Isolation, Structural Analysis and Chemical Reactivity. // J. Organomet. Chem., 201 (1976) 113] получения непредельного магнийорганического соединения, а именно магнезациклонона-3,7-диена общей формулы (3) реакцией бутадиена с металлическим магнием в присутствии каталитических количеств метилиодида при температуре 40°С с выходом 60% по схеме:
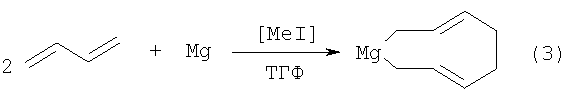
Известным способом не могут быть получены 2,3-диалкил(арил)магнезациклопент-2-ены (1).
Известен способ [3, Патент РФ №2290406, 2006] синтеза 2,3,4,5-тетраалкилмагнезациклопента-2,4-диенов (4) взаимодействием дизамещенных ацетиленов с н-BuMgCl в присутствии цирконацендихлорида (Cp2ZrCl2), взятыми в мольном соотношении R-≡-R: н-BuMgCl: Cp2ZrCl2, равном 10:(20-26):(1,0-1,4). Реакцию проводят в атмосфере аргона при комнатной температуре (20°С) и атмосферном давлении. Время реакции 10-14 часов, выход целевых продуктов 45-60%. Реакция осуществляется в диэтиловом эфире и протекает по схеме:
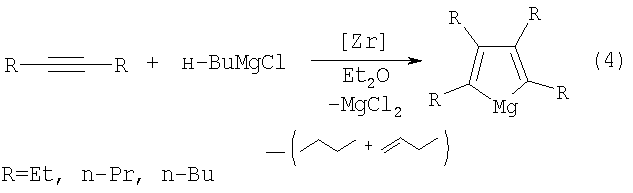
Известным способом не могут быть получены 2,3-диалкил(арил)магнезациклопент-2-ены (1).
Таким образом, в литературе отсутствуют сведения по синтезу 2,3-диалкил(арил)магнезациклопент-2-енов (1).
Предлагается способ получения 2,3-диалкил(арил)магнезациклопент-2-енов (1).
Сущность способа заключается во взаимодействии этилена и дизамещенных ацетиленов общей формулы R-≡-R, где R=н-Pr, н-Bu, Ph с этилмагнийбромидом (EtMgBr) в присутствии катализатора цирконацендихлорида (Cp2ZrCl2), взятыми в мольном соотношении R-≡-R: EtMgBr: Cp2ZrCl2, равном 10:(20-25):(0,2-0,5), предпочтительно 10:22:0,35. Реакцию проводят при комнатной температуре (~20°С) и избыточном давлении этилена в реакторе 0,025 МПа. Время реакции 2-6 часов, выход целевых продуктов 68-89%. В качестве растворителя необходимо использовать смесь диэтилового эфира и тетрагидрофурана в соотношении 1:1. Реакция протекает по схеме:

Целевые продукты (1) с высокими выходами образуются только с участием этилена, дизамещенного ацетилена, EtMgBr и катализатора Cp2ZrCl2. В присутствии других катализаторов на основе комплексов переходных металлов (например, ZrCU, Cp2TiCl2, Cp2HfCl2, Ni(acac)2, Fe(асас)3) целевые продукты (1) не образуются или их выход составляет не более 10%.
Реакции проводили при комнатной температуре (~20°С). При более высокой температуре (например, 40°С) не наблюдается существенного увеличения выхода целевых продуктов (1), а при меньшей температуре (например, 0°С) снижается скорость реакции.
Изменение соотношения исходных реагентов в сторону увеличения содержания EtMgBr по отношению к этилену и исходному ацетилену (R-≡-R) не приводит к существенному повышению выхода целевых продуктов (1). Снижение количества EtMgBr по отношению к этилену и исходному ацетилену снижает выход (1).
Оптимальным давлением этилена в реакторе является 0,025 МПа. При меньшем давлении выход (1) снижается. При высоких давлениях этилена выход (1) не увеличивается.
Отличия предлагаемого способа:
В предлагаемом способе в качестве исходных соединений используется этилен, дизамещенные ацетилены (R-≡-R) и EtMgBr с участием катализатора Cp2ZrCl2. В известном способе непредельное циклическое магнийорганическое соединение (4) получают из дизамещенного ацетилена и н-BuMgCl.
Предлагаемый способ обладает следующими преимуществами:
Способ позволяет получать с высокой селективностью 2,3-диалкил(арил)магнезациклопент-2-енов (1), синтез которых в литературе не описан.
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере сухого аргона помещают 0,35 ммоль катализатора Cp2ZrCl2 и 10 ммоль дец-5-ина. Смесь охлаждают до 0°С, затем добавляют 22 ммоль EtMgBr (1 M раствор в Et2O: ТГФ = 1:1). На реактор устанавливают образцовый манометр с максимальной шкалой 0,4 МПа. Реактор однократно продувают сухим этиленом и создают в нем избыточное давление этилена 0,025 МПа. Реакционную смесь перемешивают при комнатной температуре (20°С) 4 часа. Получают индивидуальный 2,3-дибутилмагнезациклопент-2-ен (1). Выход целевого продукта (1) определен по продукту дейтеролиза. При дейтеролизе (1) образуется 1,4-дидейтеро-1,2-дибутилбут-1Z-ен (5) с выходом 80%.

Спектральные характеристики продукта дейтеролиза (5): Т.кип. 67°С (1 мм рт.ст.), nD 20 1,4308. ИК спектр (ν, см-1): 3085, 2975, 2940, 2870, 2235 (C-D), 2195(C-D), 1710, 1470, 1385, 1260, 1120, 925, 755. Спектр ЯМР 1H (CDCl3, δ, м.д.): 0,79-0,96 м (8Н, С1,10H3, C12H2D), 1,07-1,57 м (8Н, С2,3,8,9), 1,95-2,13 м (6Н, C4,7,11H2). Спектр ЯМР 13С (CDCl3, м.д.): 13.32 (С1), 23.07 (С2), 33.12 (С3), 27.88 (С4), 123.75 (С5, JC-D=22,5 H2), 141.33 (С6), 30.09 (С7), 31.47 (С8), 23.44 (С9), 13.25 (С10), 130.29 (С11), 13.03 (С12, JC-D=19,5 Hz). Масс-спектр, m/z 170 [M+].
Другие примеры, подтверждающие способ, приведены в таблице.
1,2-дифенилацетилен
Все опыты проводили при комнатной температуре (~20°С). Растворитель Et2O: ТГФ = 1:1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-5-АЛКИЛИДЕНМАГНЕЗАЦИКЛОПЕНТ-2-ЕНОВ | 2005 |
|
RU2291870C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3,4-ДИАЛКИЛ-2,5-БИС(ТРИМЕТИЛСИЛИЛ)-МАГНЕЗАЦИКЛОПЕНТА-2,4-ДИЕНОВ | 2005 |
|
RU2290405C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛМАГНЕЗАЦИКЛОГЕПТ-2-ЕНОВ И 4,5-ДИАЛКИЛМАГНЕЗАЦИКЛОГЕПТ-4-ЕНОВ | 2010 |
|
RU2547265C2 |
| СПОСОБ ПОЛУЧЕНИЯ 11,12-ДИАЛКИЛ-10-МАГНЕЗАБИЦИКЛО[7.3.0]ДОДЕКА-8,11-ДИЕНОВ | 2007 |
|
RU2349594C1 |
| СПОСОБ ПОЛУЧЕНИЯ 10,11-ДИАЛКИЛ-9-МАГНЕЗАБИЦИКЛО[6.3.0]УНДЕКА-1(8),10-ДИЕНОВ | 2007 |
|
RU2355695C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3,4,5-ТЕТРААЛКИЛМАГНЕЗАЦИКЛОГЕПТА-2,4-ДИЕНОВ | 2010 |
|
RU2440354C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3,4,5-ТЕТРААЛКИЛМАГНЕЗАЦИКЛОНОНА-2,4-ДИЕНОВ | 2010 |
|
RU2558762C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1-ФЕНИЛ(АЛКИЛ)ЗАМЕЩЕННЫХ ФОСФОЛ-2-ЕНОВ | 2014 |
|
RU2555845C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-5-АЛКИЛИДЕНМАГНЕЗАЦИКЛОПЕНТ-2-ЕНОВ | 2006 |
|
RU2374255C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3,4-ТРИАЛКИЛМАГНЕЗАЦИКЛОПЕНТ-2-ЕНОВ | 2009 |
|
RU2423365C2 |
Изобретение относится к металлоорганическому синтезу, конкретно к способу получения 2,3-диалкил(арил)магнеза-циклопент-2-енов. Способ заключается в совместном взаимодействии дизамещенных ацетиленов с этилмагнийдибромидом в присутствии катализатора цирконоцендихлорида при избыточном давлении этилена 0,025 МПа и комнатной температуре в смеси растворителей диэтиловый эфир: ТГФ (1:1). Выход целевого продукта составляет 68-89%. 1 табл.
Способ получения 2,3-диалкил(арил)магнезациклопент-2-енов (1) общей формулы
 ,
,
характеризующийся тем, что этилен и дизамещенные ацетилены общей формулы R-≡-R (где R=н-Pr, н-Bu, Ph) взаимодействуют с магнийорганическим соединением EtMgBr в присутствии катализатора цирконацендихлорида (Cp2ZrCl2) в мольном соотношении R-≡-R:EtMgBr:Cp2ZrCl2, равном 10:(20-25):(0,2-0,5), при избыточном давлении этилена 0,025 МПа в смеси растворителей диэтиловый эфир: тетрагидрофуран (1:1) в течение 2-6 ч.
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-5-АЛКИЛИДЕНМАГНЕЗАЦИКЛОПЕНТ-2-ЕНОВ | 2005 |
|
RU2291870C1 |
| СПОСОБ СОВМЕСТНОГО ПОЛУЧЕНИЯ 2-АЛКИЛИДЕНМАГНИЙЦИКЛОПЕНТАНОВ И 2-АЛКИЛ-3-МЕТИЛИДЕНМАГНИЙЦИКЛОПЕНТАНОВ | 2003 |
|
RU2245885C1 |
| СПОСОБ ПОЛУЧЕНИЯ (Z)-1,2-ДИАЛКИЛ-1,2-ДИЭТИЛЭТИЛЕНОВ | 2000 |
|
RU2183613C1 |
| J | |||
| Organomet | |||
| Chem., 201 (1976), p.113. | |||
Авторы
Даты
2011-01-20—Публикация
2009-01-26—Подача