на при. (-30) - (+25) С Вое - треТ- -бутилоксикарбонил; Z - бензилокси- карбонил; В - указано выше{ D-Tyr, D-Tyr, Leu, Met, Met(О), Pro, Ser, Tyr(Bzl), Gly, Phe, Trp; F - Ser, Ser(Bzl), Gly или простая связь; E - Pro, Ser, Hyp, Gly, Val Ш1и простая связь; W - указано вьппе. Получение фрагмента ведут по следующей схеме: Вос-Е-ОН. + H-F-W- (К/) fBoc-E-F-W -(ОТЩ )-H-E-F-W +
BOC-D-OH - (К )- BOC-D-E-F-W-
(OTQl )- H-D-E-F-W, где К - конденсация методом смешанных ангидридов в присутствии этилхлорформиата
1
Изобретение относится к способу получения п ептидов общей формулы
H-Tyr-D-Ala-Phe-B-C-W,
где В -.Gly, Sar, Phe}
С - Туг, D-Tyr, Leu, Met, Met(О), Pro, Ser, Tyr-Pro, Tyr(Bzl)- -Pro, Tyr-Ser, Pro-Ser,-. Tyr-Pro-Ser, Tyr(Bzl)-Pro- . -Ser, Tyr-Hyp-Ser, Tyr-Hyp- -Ser(Bz.l), Tyr(Bzl)-Val-Ser, Tyr-Gly-Ser, Phe-Hyp-Ser, Tyr-Pro-Ser, Phe-Pro-Ser, Phe-Hyp-Ser(Bzl), Gly-Pro-Ser Tyr-Pro-Gly, Tyr-Pro-Ser(Bzl) Tyr(Bzl)-Pro-Ser(Bzl); W - OH, OCH,, NHj, NH-R, NH-NH ,
. ,, . . где R - CH,, C, CHjCF,, адамантил,
R, - бензилоксикарбонил, фенил, в виде хлоргидратов и/или трифтораце- татов, которые могут найти применение в экспериментальной биологии и медицине.
Цель изобретения - способ получения новых пептидов, обладающих более высокой анальгетической активностью и низкой токсичностью,
В экспериментальной части исполь- зованы следующие сокращения: Me - метил, Et - этил Z - бензилоксикарбонил; Вос-трет-бутилоксикарбонил}
или изобутилхлорформиата в среде диметилформамида или тетрагидрофу- рана при (-15) - (+25) С или карбо- имидным методом в присутствии дицик- логексилкарбодиимида и N-оксибензо- триазола; ОТЩ - отщепление N-конце- вой трет-бутилоксикарбонильной группы обработкой НС1 в тетрагидрофуране или CF, СООН при О С, причем если имеются боковые защитные группы, то их удаляют гидрогенолизом в присутствии 10%-ного Pd/C в среде метанола или диметилформамида. Испытания ПТ показывают высокую анальгетичес- кую активность, 2 табл.
Bzl - бензип. Ad - адамантил. Met(О) метионин сульфоксид.
Значения R.J определяли на пластинках, покрытых силикагелем 60 F, (Merck), толщина слоя 0,25 мм, длина пластинки 20 см, в следующих системах:
А Бензол - этилацетат - уксусная кислота - вода 10:10:2:1 (верхний слой)
Б Бензол - этилацетат - уксусная кислота - вода 100:100: :40:15 (верхний слой) В н-Бутиловый спирт - уксусная
кислота - вода 4:1:1 Г Хлороформ - метиловый спирт - 32%-ньй гидроксид аммония 65:45:20
Д Хлороформ - метиловый спирт .8:2
Анализы методом ТСХ проводятся не в стандартных условиях, поэтому значения R могут меняться, особенно пр различных температурах. Температуру плавления определяют в открытых капиллярах без поправок. Большинство производных до плавления размягчается и разлагается. Растворители для кристаллизации, высаждения или смешения даны в скобках,
Бумазрный электрофорез под высоким напряжением проводят на приборе фе рог раф Ориджинал-Франкфурт, тип 64
на бумаге № 2317 ф, Гляген энд Шулл при напряжении 1600 В (40 В/см и рН 1,2 (муравьиная кислота - уксусная кислота - вода 123:100:777), Значения электролитической подвижности ( ) приведены относительно этих величин для глутаминовой кислоты.
Пример 1. H-Tyr-D-Ala-Phe- -Gly-Tyr-Prp-Ser-NH -CF, СООН.
Стадия I.
Boc-Pro-Ser-NH,
(I)
К раствору 1,00 г (4,65 ммоль) Boc-Pro-NHj в 10 мл безводного тет- рагидрофурана последовательно приб-ав- ляют при -12°С 0,52 мл (4,65 ммоль) N-мeтш мopфoлинa и 0,45 мл (4,65 ммоль) этилхлорформиата. Реакционную смесь перемешивают 2 мин при и добавляют охлажденный раствор 0,48 г (4,65 ммоль) H-Ser-NHj в 10 мл ДМФА. Реакционную смесь перемешивают при -10° С 3 ч и при 1 ч, осадок отфильтровывают, фильтрат .упаривают в вакууме. Остаток кристаллизуют в системе метанол - эфир.
Получают 1,1 г (I), т.пл. 138 С, -58,9° (С 1, МеОН), R, 0,15 (А)-, 0,33 (В).
Стадия 2.
20
25
Из 1,0 г (1,8 ммоль) (III) по методике, изложенной на стадии 2, получают 1,0 г (IV), т.пл. 54-57°С (разл.), М1 -7,° (С 1; МеОН), RJ 0,59 (С).
Стадия 5.
Boc-Phe-Gly-NH-NH-Z
(V)
H-Pro-Ser-NHj- CF,COOH
1,0 г (3,3 ммоль) соединения (1) растворяют при 0°С в 10 мл трифтор- уксусной кислоты. Через 30 мин раст вор упаривают в вакууме. Продукт извлекают с помощью системы эфир - петролейный эфир.
Получают 1,0 г (II), т.пл. 48 - , Rf 0,10 (С).
Стадия 3.
Бос-Туг(Bzl)-Pro-Ser-NH,
К раствору 1,0 г (3,8 ммоль) Boc-Phe-OH в 10 мл безводного .тетра- гидрофурана последовательно добавляют при -12°С 0,42 мл (3,8 ммоль) N-метилморфолина и 0,3 мл (3,8 ммоль)
30 этилхлорформиата. Реакционную смесь перемешивают 2 мин при -12 С и добавляют охлажденный раствор 0,95 г (3,7 ммоль) H-Gly-NH-NH-Z НС1 и 0,4 мл (3,7 ммоль) N-метилморфолина
35 в 15 мл ДМФА. Реакционную смесь пе(II)ремешивают 3 ч при -10 С и 1 ч при 20 С, отфильтровывают осадок, фильтрат упаривают в вакууме. Остаток растворяют в этилацетате и несколько
- 40 раз последовательно промывают насыщенным раствором NaCl в 1 М лимонной кислоте, 1 М раствором NaHCOj и водой. Органический слой сушат над безводным и упаривают в ва- 45 кууме. Из остатка продукт извлекают с помощью системы метанол-диизопро- пиловый эфир.
(III)Получают 1,4 г (V), т.пл. 143°С,
Мс -Ь5,6 0,63 (А). Стадия 6.
К раствору 1,0 г (3,2 ммоль) (II) в 35 мл ДМФА добавляют при О с 36 мл (3,2 ммоль) N-метилморфолина, 1,2 г (3,2 ммоль) Boc-Tyr(Bzl)-OH, 0,43 г (3,2 ммоль) 1-оксибензотриазола и 0,73 г (3,2 ммоль) дициклогексилкар- бодиимида. Реакционную смесь перемешивают 1 ч при О С и в течение ночи при комнатной температуре. Выпавший осадок отфильтровывают, фильтрат
упаривают в вакууме. Остаток растворяют в этилацетате и раствор последовательно промьтают насыщенным . раствором NaCl в 1 М лимонной кислоте, 1 М раствором NaHCO и водой. Органический слой сушат над безводным и упаривают в вакууме. Остаток кристаллизуют в системе этилацетат-петролейный эфир. Получают 1,4 г (III), т.пл. 1154; о4. -22,9° (С 1, МеОН); R 0,20 (А). Стадия 4.
H-Tyr(Bzl)-Pro-Ser-NHj-CF3COOH (IV)
Из 1,0 г (1,8 ммоль) (III) по методике, изложенной на стадии 2, получают 1,0 г (IV), т.пл. 54-57°С (разл.), М1 -7,° (С 1; МеОН), RJ 0,59 (С).
Стадия 5.
Boc-Phe-Gly-NH-NH-Z
(V)
Получают 1,4 г (V), т.пл. 143°
Мс -Ь5,6 0,63 (А). Стадия 6.
(С 1, МеОН), R
i
-H-Phe-Gly-NH-NH-Z
(VI)
10 г (2,1 ммоль) (V) в течение 30 мин обрабатывают 10 мл 1,3 и. раствора НС1 в ледяной уксусной кислоте. Затем реакционную смесь упаривают в вакууме при 30 С, остаток
растирают с эфиром. Получают 0,89 г (VI), т.пл. 178 С; oi +45 (С 1, МеОН); R 0,78 (С).
Стадия 7. Boc-D-Ala-Phe-Gly-NH-NH-Z
(VII)
Из 1,0 г (5,3 ммоль) Boc-D-Ala-OH и 2,09 г (5,1 ммоль) (VI) аналогично,, стадии 5 получают 2,5 г (VII) ,т.пл. 165 С О +8° (С 1,-МеОН), R 0,51 (А)
Стадия 8.
H-D-Ala-Phe-Gly-NH-NH-Z HCl (VIII)
Из 1,0 г (1,8 ммоль) (VII) аналогично стадии 6 получают 0,84 г
15
(VIII), т.пл. 180°С; W +0,2 (С 1, МеОН), R 0,75 (С).
Стадия 9. .20
Boc-Tyr-D-Ala-Phe-Gly-NH-NH-Z (IX)
Из 1,0 г (3,5 моль) Вос-Туг-ОН и 1,65 г (3,4 ммоль) (VIII) с помощью методики, изложенной на стадии 5, получают 2,24 г (IX), т. пл. I48 c, W +16,2 (С 1, МеОН); R 0,38 (А).
Стадия 10.
25
30
Boc-Tyr-D-Ala-Gly-NH-NH,
(X)
1,0 г (1,4 ммоль) (IX) в 10 мл метанола гидрируют в присутствии 0,27 г 10%-ного Pd/C.Катализатор отфильтровывают, .фильтрат упаривают в вакууме, остаток растирают с этил- ацетатом. Получают 0,64 г (X), с т. пл. 148 С,- М- - +26,6° (С 1, МеОН); Rf 0,34 (В).
Стадия 11.
Boc-Tyr-D-Ala-Phe-Gly-Tyr(В z1)- -Pro-Ser-NHj . (XI)
К раствору 2,0 г (3,5 ммоль) (X) в 20 мл безводного диметилформамида добавляют при -30°С 2,18 мл (8,75 ммоль) 4 н. НС1 в безводном тетГрагидрофуране и 0,45 мл (3,85 ммоль) н-бутилнитрита. Веак- ционную смесь перемеш1шают при 30 мин, добавляют 1 мл (8,75 ммоль) N-метилморфолина, а затем охлажденный до раствор 1j66 г (2,91 ммоль) (IV) и 0,33 мл (2,91 ммоль N-метилморфолина в 40 мл диметилформамида. Реакционную смесь вьщержи
вают три дня при -9°С, отфильтровывают осадок, фильтрат упаривают в вакууме, остаток перекристаллизовы- вают из системы метанол-этилацетат- эфир. Полученный продукт подвергают хроматографической очистке на колонке с силикагелем Мерк 70-230 меш, с использованием в качестве элюента смеси этилацетат-метанол (8:2).
Получают 2,0 г (XI), т.пл. 135 с, Wlf -5,3° (С 1; МеОН), R, 0,24 (В).
Стадия 12.
Boc-Tyr-D-Ala-Phe-Gly-Tyr-ProSer-NH,
(XII)
1,3 г (1,3 ммоль) (XI) в 20 мл метанола гидрируют при 35 С в присутствии 0,30 г 10%-ного Pd/C. Затем катализатор отфильтровывают, фильтрат упаривают в вакууме, остаток растирают с эфиром. Получают 1,1 г (XII), т.пл. 160-163 С Сразл.)(. -7,5 (С 1, МеОН), R, 0,11) (В); 0,80 (С).
Стадия 13. H-Tyr-D-Ala-Phe-Gly-Tyr-Pro30
Ser-NH CFjCOOH
(XIII)
5
21,0 г (1,1 ммоль) (XII) обрабатывают 30 мин при 0°С 10 мл трифтор- уксусной кислоты. Затем реакционный раствор упаривают в вакууме, остаток растирают с эфиром. В итоге получают 0,90 г (XIII), т.пл. 159-1бО°С,
(С 1, МеОН), R
i
0
5
0
5
Wl +5,5 0,51 (С).
Аминокислотный анализ: Ser 0,95 (1); Pro 0,97 (О; Gly 1,00 (l), D-Ala 1,00 (1), Туг 1,91 (2); Phe 1,03 (1).
Найдено, %: С 64,60;-Н 5,86; N 12,10.
, F,
Вычислено, %: С 55,02 Н 5,61; N 12,22.
П р и м е р 2.
H-Tyr-D-Ala-Phe-Gly-Tyr-NHj X CF,СООН
Стадия 1. Boc-Tyr-D-Ala-Phe-Gly-Tyr-NHj, (XIV)
К 2,74 г (4,8 ммоль) (X) в 50 мл безводного диметилформамида последо713
вательно добавляют при -30°С 2,0 мл (12 ммоль) 6 н. НС1 в безводном тет- рагидрофуране и 0,63 мл (5,28 ммоль) н-бутилнитрита. Реакционную смесь перемешивают 30 мин при , добавляют 1,34 мл (.12 ммоль) N-метилморфо- лина при , а затем охлажденный до -40 С раствор 0,865 г (4,0.ммоль) H-Tyr-NHj.HCl и 0,456 мл (4,0 ммоль) N-метилморфолина в 50 мл диметилфор- мамида. Реакционную смесь оставляют на 7 сут при -10 С, упаривают до минимального объема, отфильтровывают осадок и из фильтрата высаживают продукт добавлением хлороформа. Полученный сырой продукт кристаллизуют из смеси метанол-хлороформ.
Получают 2,0 г (XIV), т.пл. 127- 129°Ci +19,9° (С 1, MeOH)i R 0,15 (А)-, 0,56 (В).
Стадия 2.
H-Tyr-D-Ala-Phe-Gly-Tyr-NlI х
CF,СООН
(XV)
1,0 г (1,4 ммоль) (XIV) смешивают с 12 мл трифторуксусной кислоты. Реакционную смесь выдерживают 30 ми при О С, упаривают в вакууме, оста- .,ток растирают с эфиром, образовавшийся осадок отделяют и перекристал- лизовывают из смеси изопропанол-эфир Получают 0,94 г (XV), т.пл. 145 - 146°С, loill +34,5° (g 1, МеОН); R 0,65 (С).
Аминокислотный анализ: Gly 1,02 (1), D-Ala 1,00 (1); Туг 1,96 (2); Phe 1,00 (1).
Найдено, %: С 55,57; Н 5,35; N 11,39; F 7,65.
С,,Н,,Р,ЫбО,
Вычислено, %: С 55,73; Н 5,36; N 11,47} F 7,78.
Пример 3.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser-NH-NH-Z(XVI)
Стадия 1.
Boc-Ser-NHNH-Z
(XVII)
К 1,0 г (4,87 ммоль) Boc-Ser-OH в 20 мл тетрагидрофурана последовательно добавляют 0,55 мл (4,87 ммоль) N-метилморфолина и 0,49 мл (4,87 ммоль) этилхлорформиата при -12 С. Реакционную смесь перемешивают при -12 С 2 мин и добавляют
лажденный раствор 1,0 г (4,87 ммоль) H,N-NH-Z HC1 и 0,55 мл (4,87 ммоль) N-метилморфолина в 20 мл ДМФА. Реакционную смесь перемешивают при -10 С 3 ч и при 1 ч, отфильтровывают осадок, фильтрат упаривают в вакууме. Остаток растворяют в этилацетате и полученный раствор несколько раз промывают последовательно насьщенньм раствором NaCl, 1 М лимонной кислотой, 1 М раствором NaHCO и водой, сушат над безводным и упаривают в вакууме. Остаток очищают на хроматографической
колонке с силикагелем, используя в качестве элюента систему хлороформ- метанол 98:2. Фракции, содержащие однородный по данным тонкослойной хроматографии продукт, объединяют и
упаривают в вакууме. Остаток пере- кристаллизовывают из смеси эфир-пет- ролейньш эфир,
Получают 1,4 г (XVII), т.пл. 42- 46 С; ot -25,8° (С 1; МеОН),
R 0,52 (А).
Стадия 2..
H-Ser-NHNH-Z-HCl
(XVIII)
30 1,0 г (2,83 ммоль). (XVII) растворяют в to мл 4 н. раствора НС1 в безводном тетрагидрофуране, через 30 мин добавляют эфир, выпавший осадок отфильтровывают и перекристаллизовыва35 ют из смеси абсолютный этанол-эфир. Получают 0,7 г (XVIH), т.пл. 110- 115Ч,Мо +20,7° (С 1, МеОН); R 0,49 (С), Е,,2 .16. Стадия 3.
40
Boc-Tyr(Bzl)-Pro-OH (XIX)
1,0 (8,7 ммоль)Н-Рго-ОН растворяют в 4,35 мл 2 н. раствора NaOH.
45 Раствор охлаждают до О С, разбавляют 10 мл ДМФА и упаривают в вакууме при . Остаток суспендируют в 10 мл ДМФА и добавляют 4,3 г (8,7 ммоль) Boc-Tyr(Bzl)-ONp. Реакционную смесь 50 перемешивают 1 ч и упаривают в вакууме. Остаток растворяют в воде и несколько раз промывают этилацетатом Водный слой охлаждают до О С, подкисляют 5 н. соляной кислотой до
55 рН 2,0 и экстрагируют этилацетатом. Органический слой промывают до нейтральной реакции насьш енным раствором NaCl в воде, сушат над безводным NatS04 и упаривают.
Получают 3,7 г (XIX), т пл. 97 л..rtC-rt
lOOV (разл), Гы .-15,7° (С 1, МеОН); R 0,70 (А), Е,,,35. Стадия 4.
Вос-Туг-Рго-ОН
(XX)
1,0 г (2,13 ммоль) (XIX) в 15 мл метанола гидрируют в присутствии 0,27 г 10% Pd/C. Порле окончания гидрирования катализатор отфильтровывают, фильтрат разбавляют этилацета- том и упаривают в вакууме до образования осадка. Получают 0,7 г (XX),. т. пл. 136-138°С; WD -25,0° (С 1; МеОН); R. 0,42 (А); Е д 0,52
Стадия 5.
Boc-Tyr-Pro-Ser-NHNH-Z
(XXI)
Из 1,0 г (2,65 ммоль) (XX) и 0,77 г (2,65 ммоль) по методике, описанной Hd стадии 1, получают 1,46 г (XXI), т.пл. Пб-ПВ С (эфир-петро- лейный эфир) ; oi д -46,5 (С 1, МеОН); R 0,17 (А), 0,37 (В).
Стадия 6.
H-Tyr-Pro-Ser-NHNH-Z-HCl (XXIl)
Из 1,0 г (1,63 ммоль) (XXI) по меН тодике, описанной на стадии 2, получают 0,78 г (XXII), т.пл. 172-174°С (зфир) oi -38,4° (С 1, .МеОН), R 0,46 (С); Е,,, 0,79.
Стадия 7.
Boc-Phe-Gly-NHNH-Z
(XXIII)
Из 1,0 г (3,8 ммоль) Вос-РЬе-ОЫ
и 0,95 г (3,7 ммоль) H-Gly-NHNH-Zк по методике, описанной на стадии 1, получают 1,4 г (XXIII), т.пл. 143 с (метанол-идопропиловый зфир)-, +5,6° (С 1; МеОН); R 0,63 (А). Стадия 8.
H-Phe-Gly-NHNH-Z-НС1
(XXIV)
1,0 г (2,1 ммоль) (XXIII) растворяют в 10 мл 1,3 н. раствора НС1 в ледяной уксусной кислоте, через 30 мин раствор упаривают в вакууме при 30°С. Остаток растирают с эфиром. Получают 0,89 г (XXIV),т.пл. 1784; .Гс +45,0° (С 1, МеОН), Rf0,78 (C)i Е,., 0,88.
1316565
10
Стадия 9.
Boc-D-Ala-Phe-Gly-NHNH-Z (XXV)
Из 1,0 г (5,3 ммоль) Boc-D-Ala-OH и 1,09 г (5,1 ммоль) (XXIV) по методике, описанной на стадии 5, получают 2,5 г (XXV), т.пл. 165° С; oi./r +8,0° (С 1; МеОН); R.
0,51 (А).
Стадия 10.
H-D-Ala-Phe-Gly-NHNH-Z-HCl (XXVI)
Из 1,0 г (XXV) по методике, описанной на стадии 6, получают 0,84 г (XXVI), т.пл. 180°С; .+0,2 (С 1, МеОН), R, 0,75 (С); Е, 0,80.
Стадия 11.
Boc-Tyr-D-Ala-Phe-Gly-NHNH-Z (XXVII)
Из 1,0 г (3,5 ммоль) Вос-Туг-ОН и 1,65 г (3,4 ммоль) (XXVI) по методике, описанной на стадии 5, получают 2,24 г (XXVII), т. пл. 148 С (метанол-эфир); сб +16,2° (С 1-, MeOH)j R 0,38 (А). Стадия 12.
Boc-Tyr-D-Ala-Phe-Gly-NHNH, (XXVIIl)
1,0 г (1,4 ммоль) (XXVII) в 10 мл метанола гидрируют в присутствии 0,27 г 10%-ного Pd/C. После окончания гидрирования реакционную смесь обрабатывают, как описано на стадии 4.Получают 0,64 г (XXVIII) ,т,пл. US C; W +26,6° (С 1; МеОН), R 0,34 (В)-, Е,., 0,57. Стадия 13.
Boc-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser-NHNH-Z(XXIX) К раствору 1,0 г (1,75 ммоль) (XXVIII) в 15 мл безводного ДМФА поседовательно прибавляют 1,1 мл (4,38 ммоль) 4 н. НС1 в безводном етрагидрофуране и 0,2 мл (1,93 ммоль) -бутилнитрита при -30 С. Реакционную смесь перемешивают при -30 С 30 мин, добавляют 0,5 мл (4,38 ммоль) -метилморфолина, а затем охлажден- ый до раствор 0,803 г (1,46 ммоль) (XXII) и- 0,16мл (1,46 ммоль) N-метилморфолина в 15мл езводного ДМФА. Реакционную смесь
оставляют на два дня при , отфильтровывают образовавшийся осадок, фильтрат упаривают в вакууме и остаток смешивают с 10%-ной лимонной кислотой, охлажденной до 0°С. Образовавшийся осадок отфильтровывают, промывают до нейтральной реакции водой, высушивают в вакууме и перекристалли зовывают из смеси этилацетат-эфир. Получают 1,15 г (XXIX), т.пл. 140 - 150°C; oi / -20,3° (С 1; МеОН), RJ 0,17 (В); 0,92 (С). Стадия 14.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser-NHNH - HCl
Из 1,0 г (0,95 ммоль) (XXIX) по методике, описанной на стадии 2, получают 0,89 г; т. пл. 170°С (разл., этилацетат) ; « -l -1,8 ° (С 1, МеОН);М +1,0 °(С 1, АсОН); RJ 0,69 (С).
Аминокислотный анализ: Ser 0,97 (1), Pro 0,98 (1), Gly 1,01 (1); D-Ala 0,99 (1); Туг 1,95 (2); Phe 1,0 (1).
Найдено, %: С 58,21; Н 5,99; N 12,69; С1 3,63.
C48H;8ClN,0,o
Вычислено, %: С 58,32; Н 5,91; N 12,75; С1 3,51. П р и м е р 4.
. H-Tyr-D-Ala-Phe-Gly-Tyr-NHNH-Z I HCl(XXX)
Стадия 1. Boc-Tyr-NHNH-Z
(XXXI)
К раствору 1,0 г (3,55 ммоль) Вос-Туг-ОН в 20 мл безводного ДМФА тетрагидрофурана последовательно прибавляют 0,4 мл (3,55 ммоль) N-ме- тилморфолина и 0,48 мл (3,55 ммоль) изобутилхлорформиата при -12°С. Реакционную смесь перемешивают 2 мин при -12°С, добавляют охлажденный раствор 0,72 г (3,5 ммоль) H N-NH-Z
xHCl и 0,4 мл N-метилморфолина в 20 мл ДМФА. Реакционную смесь перемешивают при -10 С 90 мин, отфильтровывают образовавшийся осадок, фильтрат упаривают в вакууме. Остаток р-астворяют в этилацетате и полученный раствор несколько раз последовательно промывают водным раствором 1 м лимонной кислоты, 1 м раствором. NaHCOj и насыщенным раствором NaCl. Органический слой сушат над безводным и упаривают. Получают 1,3 г (XXXI), т.пл. 68-70 С; W/ -5,85° (С 2; МеОН); Rf
0,76 (А). Стадия 2.
H-Tyr-NHNH-Z -HCl
(XXXII)
1,0 г (2,33 ммоль) (XXXI) растворяют в 10 мл 4 Н. НС1 в безводном тетрагидрофуране, через 30 мин раст- вор упаривают в вакууме и продукт
осаждают из изопропанола эфиром. Получают 0,76 г (XXXII), т.пл. 103- 105 С; ос D +48,8° (С 1 ; МеОН), К 0,70 (С), Е,, 0,9-2. Стадия 3.
. Boc-Tyr-D-Ala-Phe-Gly-TyrNHNH-Z(XXXIII)
к раствору 1,0 г (1,75 ммоль)
(XXVII) в 15 мл безводного ДМФА последовательно добавляют 1,1 мл (4,39 ммоль) 4 Н. НС1 в безводном тетрагидрофуране и 0,2 мл (1,93 ммоль)
н-бутилнитрита при -30 С. Реакционную смесь перемешивают 30 мин при -30 С, добавляют 0,5 мл (4,38 ммоль) N-метилморфолина, а затем охлажденный до -30 С раствор 0,535 г
(1,46 ммоль) (XXXII) и 0,16 мл (1,46 ммоль) N-метилморфолина в 15мл безводного ДМФА. Реакционную смесь выдерживают в течение трех дней при -9°С, отфильтровывают образовавшийся осадок, фильтрат упаривают в вакууме. Остаток смешивают с охлажден-v ной до 0°С 10%-ной лимонной кислотой, выпавший осадок отфильтровывают, промывают до нейтральной реакции водой,
сушат в вакууме и перекристаллизовы- вают из смеси изопропанол-эфир. Получают 0,85 г (XXXIII), т.пл. 137 - +3,8° (С 1, МеОН); R 0,27 (А), 0,52 (В).
Стадия 4.
H-Tyr-D-Ala-Phe-Gly-Tyr- NHNH-Z-HC1(XXX)
Из 1,0 г (1,5 ммоль) (XXXIII.) по методике, описанной на стадии 2, получают 0,83 г (XXX) (разл., этил- ацетат), т.пл. 190-192°С;М п +19,9° (С 1, MeOH)i R 0,81 (С), E,,j 0,52.
13
Аминокислотный анализ: Gly 1,03 (1)j D-Ala 0,98 (1); Туг 1,96 (2), Phe 1,00 (1).
Найдено, %: С 59,61; Н 5,81; N 12,20; С1 4,49.
C,H,C1N,0,
Вычислено, %: С 12,19; С1 4,41 П р и м е р 5.
H-Tyr-D-Ala-Phe- bly-Tyr-ProNH -HCl
(XXXIV)
Стадия 1.
Boc-Tyr(Bzl)-Pro-NH2. (XXXV) Получают путем конденсации Вос- Tyr(Bzl)-OHc H-Pro-NH в присутствии дицикгексикарбодиимида и N-оксибен- зотриазола в среде ДМФА. Стадия 2.
HCl H-Tyr(Bzl)Pro-NH2 (XXXVI)
Из (XXXV) по методике, опиранной в примере 3 (стадия 2), получают (XXXVI), т.пл. 159-1б1 С (эфир), R.J 0,5 (С).
Стадия 3.
Boc-Tyr-D-Ala-Phe-Gly-Tyr(Bzl)-Pro-NH,
(XXXVII)
Из соединений (X) и (XXXVI). по методике, описанной в примере 1 (стдия 11), получают (XXXVII), т.пл. 143°С (эфир); Rf 0,47 (В).
Аминокислотный анализ: Pro 0,98 (1); Gly 1,00 (Oi D-Ala 1,02 (1); Туг 1,96 (2); Phe 1,00 (1).
Найдено, %: С 64,89$ Н 6,66; N 10,87
С Н N О
Вычислено, %: С 64,95; Н 6,56; N 10,82.
Стадия 4.,
Boc-Tyr-D-Ala-Phe-Gly-TyrPro-Nil,
(XXXVIII)
-Из (XXXVII) по методике, описанной в примере 1 (стадия 12), получают (XXXVIII), т.пл. 170-175 С (раэл., диизопропиловый эфир)1 (В),
Аминокислотный анализ: Pro 1,00 ;(1); Gly 0,98 (1); D-Ala 0,97(1); Туг 1,92 (2)i Phe 1,02 (1).
Найдено, %: С 62,71; Н 6,45; N 10,41
1316565
14
G Н N О Вычислено, 10,49.
Стадия 5,
С 62,98, Н 6,54;
H-Tyr-D-Ala-Phe-Gly-Tyr-ProNH. HCl
(XXXIV)
Из соединения (XXXVIII) путем обработки раствором НС1 в этилацетате получают (XXXIV), т. пл. 200°С (этил- ацетат); R 0,58 (C)i Е,,. 0,59.
Аминокислотный анализ: Pro 1,00 (1); Gly 1,00 (I); D-Ala 1,01 (1); Туг 1,98 (2); Phe 1,00 (1).
Найдено, %: С 58,97; Н 6,15, N 13,00; С1 4,77. . .
.C,H,,
Вычислено, %: С 59,08-, F1 6,16; N 13,03; G1 4,78.
П р и м е р 6.
25
Н-Туr-D-Ala-Phe-Gly-Tyr(Bz1)(XXXIX)
Pro-NH.HCl
Из соединения (XXXVII) по методике, описанной в примере 5 (стадия 2), получают (XXXIX), т.пл. 180 С (эфир), R 0,63 (С); Е,,,, 0,53. 30 Аминокислотный анализ: Pro 1,00 (1), Gly 1,01 (1); D-Ala 1,02 (1); Туг 2,00 (2); Phe 1,00 (1).
Найдено, %: С 62,66; Н 6,19; N 11,60-, С1 4,25.
C,,H,,C1N,08
Вычислено, %: С 62,73; Н 6,22; 11,63; С1 4,20. Пример 7.
40
H-Tyr-D-Ala-Phe-Gly-Tyr-Ser- -NHjCFj СООН(XL)
Стадия 1. 45 Boc-Tyr-Ser-Ш
(XLI)
Из Вос-Туг-ОН и H-Sar-NH, по методике, описанной в примере 1 (стадия 1), получают (XLI), т.пл. 88 - 90 С (эфир-петролейный эфир); 0,20 (А).
Стадия 2.
H-Tyr-Ser-KH,,-HCl
(XLII)
55
Из соединения (XLI) по методике, описанной в примере 2 (стадия 2), .получают (ХЫ1), т.пл. 117-120 с (метанол-эфир); Rj 0,27 (С).
Стадия 3.
Boc-Tyr-D-Ala-Phe-Gly-TyrSer-NH,
. (XLIII)
Из соединений (X) и (XLII) по методике, описанной в примере 1 (стадия 11), получают (XLIII) , Т.ПЛ.110С (этилацетат); R 0,15 (В),0,83 (С).
Аминокислотньй анализ: Ser 0,99 (1); Gly 1,00 (1), D-Ala 1,02 (1), Туг 1,98 (2); Phe 0,99 (1).
Найдено, %: С 59,70, Н 6,43, N 12,20.
СдоНмМ О,,
вычислено, %: С 59,64-, Н 6,38,- N 12,17. . Стадия 4.
H-Tyr-D-Ala-Phe-Gly-Tyr-Ser-
NHj CFjCOGH(XL)
. Из соединения (.XLIII) по методик описанной в примере 1 (стадия 12), получают (XL), т.пл. 150-153°С (эфи R, 0,59 (С); Е, 0,57j 4-25,6° (С 1,- ИеОН).
Аминокислотный анализ: Ser 0,97 (1), Gly 1,00 (1); D-Ala 1,01 (1); Туг 2,00 (2); Phe 1,03 (1).
Найдено, .%: С 54,12; Н 5,30-, N 11,83; F 6,90.
С„Н4,Р,Н,0„
Вычислено, %: С 54,21; Н 5,41, N 11,96, F 6,95. . П р и м е р 8.
H-Tyr-D-Ala-Phe-Gly-Tyr-HypSer-NH,,-HCl
(XLIV)
Стадия 1.
Ser-NH
г
Ser(Bzl)-NH
(XLV) (XLV)
Из Boc-Ser(Bzl)-OH и NH методом сметанных ангидридов с использованием этилхлорформиата в тетрагидрофу- ране получают (XIV), т.пл. 97 С (этилацетат-эфир); R 0,82 (В); 9,9 (С 1,- МеОН).
Стадия 2.
H-Set(Bzl),COOH (XLVI)
Из соединения (XLV) по методике, 55 описанной в примере 1 (стадия 2), получают (XLVI), т.пл. 98 с (эфир- диизопропиловый эфир); R 0,44 (С);
.
Стадия 3.
Boc-Hyp-Ser(Bzl)-NH,
(XLVII)
Из Вос-Нур-ОН и соединения (XLVI) методом смешанных ангидридов с использованием изобутилхлорформиата в тетрагидрофуране получают(XLVII), т.пл. (эфир-петролейный эфир); R, 0,13 (А); -34,3° (С 1, МеОН).
Стадия 4.
H-Hyp-Ser(Bzl)-NHj.CFjCOOH (XLVIII)
Из соединения (XLVII) по методике, описанной в примере 1 (стадия 2), получают (XLVIII), т.пл. 181-182 С (метанол-эфир); R 0,32.(С).
Стадия 5.
Бос-Туг(Bzl)-Hyp-Ser(Bzl)-NH (XLIX)
Из Boc-Tyr(Bzl)-OH и (XLVIII) методом активированных эфиров получают (XLIX), т.пл. 130 С (метанол-этил- ацетат-эфир); Rf 0,46 (В), ci-Vc - -5,7 ° (С 1; МеОН).
Стадия 6.
H-Tyr(Bzl)-Hyp-Ser(Bzl)-NH, (L)
Из соединения (XLIX) по методике, описанной в примере 1 (стадия 2), получают (L1), т.пл. 67-69 С (эфир- петролейный эфир); RI 0,52 (С); Е,,г 0,66.
Стадия 7.
Boc-Tyr-D-Ala-Phe-Gly-Tyr- Hyp-Ser-NH (LII)
Из (LI) по методике, описанной в примере 1 (стадия 12), получают (Ш), т.пл. 156-160°С (этилацетат- эфир); Ri 0,75 (С); -1,4 (С 1, МеОН).
Аминокислотный анализ: Hyp 0,98 (1); Ser 0,98 (1)-, Gly 1,05 (1); D-Ala 1,01 (1); Туг 1,97 (2); Phe 1,00 (1).
Найдено, %: С 58,63; Н 6,15; N 1.1,90.
C jHssNeO,,
Вычислено, %: С 58,81-, Н 6,36; N 12,19.
Стадия 8.
НС1.H-Tyr-D-Ala-Phe-Gly-Tyr- -Hyp-Ser-NH (LIII)
17
Из (LII) обработкой раствором НС1 в тетрагидрофуране.получают (LIII), т.пл. 210-220°С (изопропа- нол-эфир); Rf 0,44 (С); 0,66 (D);
1,г
0,51-, +10,1° (С 1;
МеОН).
Аминокислотный анализ: Hyp 0,96 ,(1); Ser 0,96 (1); Gly 1,07 (1); D-Ala 0,97 (1),Tyr 1,97;Phe 1,00 (1)
Найдено, %: С 55,72; Н 5,86; N12,82.
С.оН,, ClNeO,,
- Вычислено, %: С 56,17; Н 6,01 i N 13,10.
Пример 10.
H-Tyr-D-Ala-Phe-Gly-Tyr(Bzl)Hyp-Ser(Bzl)-NHj-HCl - (LIV)
Из (LII) по методике, описанной в примере 8 (стадия 8), получают (LIV) т.пл. 175-180 с (метанол-эфир); RJ. 0,67 (С); Е,, 0,44-,обГд° +10,3 (С 1, МеОН).
Аминокислотный анализ: Hyp 0,97 (1); Ser 0,95 (1); Gly 1,03 (1); D-Ala 0,98 (1); Туг 1,96 (2); Phe 1,00 (1).
Найдено, %: С 62,04; Н 5,89; N 10,61.
,ClNeO,,
Вычислено, %: С 62,63; Н 6,13;
N 10,82.
Пример
11.
CF COGH- H-Tyr-D-Ala-Phe-Gly- Tyr-Val-Ser-NH,,(LV)
Стадия 1. Boc-Tyr-Val-OMe
(LVI)
Из. Вос-Туг-ОН и HCl-H-Val-OMe методом смешанных ангидридов с использованием этилхлорформиата в диметил- формамиде получают (LVI).
Стадия 2.
Boc-Tyr-Val-OH
(LVII)
Из (LVI) путем обработки 1 н, рас твором NaOH получают (LVII). Стадия 3.
Boc-Tyr-Val-Ser-NH,
(LVIII)
Из H-Ser- H и (LVII) по методике, описанной в примере 1 (стадия 1), получают (LVIII), т.пл. 190-195 с (ме- танол-диизопропиловый эфир).
1316565 . 18 Стадия 4.
CFjCOOH H-Tyr-Val-Ser-NHj
(LIX)
Из (LVIII) по методике, описанной в примере 1 .(стадия 2), получают (LIX), т.пл. 114-116 С (изопропанол- этилацетат).
Стадия 5.
0
Boc-Tyr-D-Ala-Phe-Gly-Tyr-Val- Ser-NHj(LX)
Из соединений (X) и (LIX) по методике, описанной в примере 1 (ста- дия 11), получают (LX), т.пл. (диизопропиловый эфир),47 (Е). Аминокислотный анализ: Ser 0,97 (1); Gly 1,05 (1)i D-Ala 1,00; Val 0,95-(1); Tyr 1,94 (2); Phe 1,04 (1). С 59,61; H 6,57;
Найдено, %: N 12,30.
C,sH,,NgO,.,
С 59,72; H 6,68;
5
Вычислено, N 12,38.
Стадия 6.
CFj COOH-H-Tyr-D-Ala-Phe-GlyTyr-Val-Ser-NHj,(LV)
Из соединения (LX) no методике, описанной в примере 1 (стадия 13), получают (ЬУ),т.пл.203-206°С (эфир), Е,.2 0,51.
Аминокислотный анализ: Ser 0,95 (1); Gly 1,00 (1), D-Ala 1,07 (1); Val 0,95 (1); Туг 1,95 (2); Phe 1,00 (1).
Найдено, %: С 54,66; Н 5,71; N 12,15; F 6,05.
C4.H«F,N80,
Вычислено, %: С 54,89; Н 5,81; 12,19, F 6,20. Пример 12.
CF,СООНH-Tyr-D-Ala-Phe-Gly- Tyr-Gly-Ser-NH-t(LXI)
Стадия 1. Boc-Gly-Ser-NHj
(LXII)
Из Boc-Gly-OH и H-Ser-NH по методике, описанной в примере 1 (стадия 1), получают. (LXII),
Стадия 2.
55 HCl-H-Gly-Ser-NH
(LXIII)
Из (LXII) обработкой раствором НС1 в тетрагидрофуране получают (LXI1I).
19
Стадия 3.
Boc-Tyr-Gly-Ser-NHjj
Из Boc-Tyr-OH и (LXIIl) по методике, описанной в примере 1 (стадия 1), получают (LX1V), т.пл. бб-бВ С (этилацетат-эфир); R| 0,57 (С).
Стадия 4..
НС1 H-Tyr-Gly-Ser-NH (LXV)
Из (LXIV) обработкой раствором НС1 в тетрагидрофуране получают (LXV), т.пл. 84-86°С-, ,16 (С).
Стадия 5.
131656520
Из Boc-Phe-OH и соединения (II) по методике, описанной в примере 5 (LXIV) (стадия 1), получают (LXVIII), т.пл.
140-142 с (этилацетат-эфир). 5 Стадия 2.
CF COOH H-Phe-Pro-Ser-NH (LXIX)
Из (LXIX) по методике, описанной в примере 1 (стадия 2), получают (LXIX), т.пл. 93-96°С (этилацетат- эфир) .
Стадия 3.
Boc-Tyr-D-Ala-Phe-Gly-Phe-ProSer-NH.
(LXX)
Во с-Туr-D-Ala-Phe-G1у-ТуrGly-Ser-NH,
(LXVI)
Из соединений (X) и (LXV) по методике, описанной в примере 1 (стадия 11), получают (LXVI), т.пл.245- 250° С (эфир-петролейньй эфир),К, 0,79 (С), 0,15 (В).
Аминокислотный анализ: Ser 0,96 (1)i Gly 2,04 (2)i D-Ala 1,00 (1); Туг 1,96 (2); Phe 1,03 (1).
Найдено, %: С 58,41; Н 6,29, N 13,02.
,, .
Вычислено, %: С 58,48; У 6,31; N 12,99.
Стадия 6.
CF,СООНH-Tyr-D-Ala-Phe-Gly- Tyr-Gly-Ser-NH (LXI
Из соединения (LXVI) по методике описанной в примере 1 (стадия 13), получают (LXI), т.пл. 180-190 С (эфир); R 0,51 (С), 0,73 (D), E,,j 0,52; 4-29,7 (С 1, МеОН).
Аминокислотный анализ: Ser 0,97 (1); Gly 2,04 (2); D-Ala 1,05 (1); Туг 2,00 (2); Phe 1,00 (1).
Найдено, Z: С 53,54; Н 5,57; N 12,74; F 6,39.
С„Н4тРзЫ80,,
Вычислено, %: С 53,45; Н 5,41; N 12,79; F 6,50.
П .р и м е р 13.
H-Tyr-D-Ala-Phe-Gly-Phe-Pro(LXVII
Ser-NHi HCl
Стадия 1. Boc-Phe-Pro-Ser-NH,
(L XVIII)
Ser-NH.
(LXX)
Из соединений (X) и (LXVIII) по етодике, описанной в призере 1 (ста- ия 11), получают (LXX), т.пл.155- (метанол-этилацетат) , R 0., 16
(В), 0,80 (С).
Аминокислотный анализ: Ser 0,98 (1); Pro 1,04 (1); Gly 1,03 (1); D-Ala 1,02 (1); Туг 1,03 (1); Phe . 2,00 (2).
Найдено, %: С 60,41-, И 6,35; N 12,31. .,,
Вычислено, I: С 60,94; Н 6,59, N 12,63.
Стадия 4. .
H-Tyr-D-Ala-Phe-Gly-Phe-Pro- Ser-NH -HCl (LXVII)
Из соединения (LXX) по методике, описанной .в примере 8 (стадия 9), получают (LXVH), т.пл. 190-195° С (метанол-эфир), 0,39 (С); Е, , 0,52; +4,4° (С 1, МеОН).
Аминокислотный анализ: Ser 0,94 (1); Pro 1,04 (1), Gly 1,02 (1); D-Ala 1,03 CD; Туг 1,03 (1); Phe 2,00 (2).
Найдено, %: С 57,98; Н 6,33; N 13,15; Cl 4,18.
C,gH5iClNjOj,
Вычислено, %: С 58,35; Н 6,24; N 13,61; Cl 4,31.
Пример 14.
НС1Н-Туr-D-A1a-Phe-Gly-Phe- Hyp-Ser-NHj,(LXXI )
Стадия 1. Boc-Phe-Hyp-Ser(Bzl)-NH4 (LXXII)
Из Boc-Phe-OH и соединения (XLVIII) по методике, описанной в примере 5 (стадия 1), получают (LXXII), т.пл. 143-146°С (этилацетат- петролейный эфир),
Стадия 2.
H-Phe-Hyp-Ser(Bzl)-NHj х
KCF,COOH
(LXXIII)
Из соединения () по методике, описанной в примере 1 (стадия 2) получают (LXXIII), т.пл. 70-72°С (метанол-эфир) .
Стадия 3.
Boc-Tyr-D-Ala-Phe-Gly-Phe-Hyp- Ser(Bzl)-NH2(LXXIV)
Из соединений (Х) и (LXXII) по методике, описанной в примере 1 (стадия 11), получают (LXXIV), т.пл.140- 145 С (изопропанол-этилацета т), R, 0,25 (В); 0,90 (С).
Аминокислотный анализ: Hyp 0,96 (.1); Ser 0,96 (1); Gly 1,01 (1); b-Ala 0,99 (1); Туг 0,98 (1); Phe 2,00 (2).
Найдено, %: С 62,53; И 6,61; N 11,37.
C5,H64NgO,4
Вычислено, %: С 62,89; Н 6,50; N 11,28.
Стадия 4.
Boc-Tyr-D-Ala-Phe-Gly-Phe- Hyp-Ser-NH (LXXV)
Из соединения (LXXIV) по методике, описанной в примере 1 (стадия 10), получают (LXXV), т.пл. 165 - . (метанол-эфир); R 0,75 (С).
Аминокислотньй анализ: Hyp 0,96 (1)5 Ser 0,98 (1); Gly 1,03 (1)-, D-Ala 1,01 (1); Туг 1,02 (1)-, Phe 2,00(2).
Найдено, %: С 59,63; Н 6,55; N 12,49.
C,,,,
Вычислено, N 1-2,41.
Стадия 5.
%: С 59,86; H 6,47;
H-Tyr-D-Ala-Phe-Gly-Phe-HypSer-NH,-HCl
(LXXI) 55
Из соединения (LXXV) по методике, описанной в примере 3 (стадия 2), получают (LXXI), т.пл. (метаO
5
нол-этилацетат)j Я, 0,47 (С); Е,. 0,51-, ; -И.8° (С 1, МеОН).
Аминокислотный анализ: Hyp 0,97 (1)i Ser 0,98 (1); Gly 1,04 (1); D-Ala 0,98 (1); Туг 1,01 (1); Phe 2,00 (2).
Найдено, %: С 57,00; Н 6,19; N 12,21; Cl 4,29.
C4oH5.ClNeO,,
Вычислено, %: С 57,24-, Н 6,12; N 13,35; Cl 4,22. Пример 15.
H-Tyr-D-Ala-Phe-Gly-Phe-Hyp- Ser(Bzl)-NHj HCl (LXXVI)
Из соединения (LXX) по методике, описанной в примере 2 (стадия 5), получают (LXXVI), т.пл. 160-170 С (изопропанол-этилацетат); R 0,65 (С); Е,,,, 0,50.
Аминокислотный анализ: Hyp 0,98 (1)i Ser 0,96 (1); Gly 1,03 (1); D-Ala 0,97 (1); Tyr 1,02 (1)-, Phe 2,00 (2).
Найдено, %: С 60,47; Н 6,23; N 12,13; Cl 3,95.
С,,Н5,СШбО,о
j Вычислено, %: С 60,74; Н 6,18; .N 12,06; Cl 3,81. . Пример 16.
0
0
Н-Туr-D-Ala-Phe-Gly-Trp-Pro- Ser-NHj.RCl(LXXVII)
Стадия 1.
Boc-Trp-Pro-Ser-NHj(LXXVIII)
Из Boc-Trp-OH и соединения (II) по методике, описанной в примере 5 (стадия 1), получают (LXXVIII), т.пл. 133-136 С (изопропанол-диизо- пропиловый эфир).
Стадия 2.
H-Trp-Pro-Ser-NHj HCl (LXXIX)
Из соединения (LXXVIII) по методике, описанной в примере 3 (стадия
2), получают (LXXIX), т.пл. 174
176 С (метанол-этилацетат). Стадия 3,
Вос-Туr-D-Ala-Phe-Gly-Trp-Pro- Ser-NH (LXXX)
Из соединений (X) и (LXXIX) по методике, описанной в примере 1 (ста23
,), получают (LXXX), т.пл.175- 180 С (метанол-этилацетат); Ri 0,12 (В); 0,81 (С); 0,86 (D).
Аминокислотный анализ: Ser 0,96 (1); Pro 0,97 (1); Gly 1,00 (1); D-Ala 0,99 (1); Туг 0,97 (1); Phe 1,00 (1).
Найдено, %: С 60,57; Н 6,61; N13,53.
C4TH5,N,0,, Вычисленр, 13,61.
Стадия 4.
%: С 60,96; Н 6,42;
H-Tyr-D-Ala-Phe-Gly-Trp-Pro- ,
. (LXXVII)
Ser-NHj - HCl
Из соединения (LXXX) no методике описанной в примере 3 (стадия 2), получают (LXXVII), т.пл. 210-220 С (изопропанол-этилацетат); (С) 0,79 (Д); Е,, 0,50,° +3,.8 (С 1, МеОН).
Аминокислотный анализ: Ser 0,98 (1); Pro 0,97 (1), Gly 1,03 (1); D-Ala 0,97 (1); Туг 1,02 (1); Phe 1,00 (1).
Найдено, %: С 58,21; Н 6,23; N 14,45; С1 4,21.
С4гН„С1Н,0, .
Вычислено, %: С 58,50; Н 6,08j N 14,62; С1 4,11.
Пример 17.
H-Tyr-D-Ala -Phe-Phe-Tyr-Pro- Ser-NHj. HCl(LXXXI)
Стадия 1.
Во с-Туr-D-Ala-Phe-Phe- NH-NH (LXXXII)
Из соединения Boc-Tyr-D-Ala-Phe- Phe-NH-NH-Z no методике, описанной примере 1 (стадия 10), получают (LXXXII), т.пл. 180-183 С .этилаце- тат), R 0,54 (В); Е,. 0,49. Аминокислотный анализ: D-Ala 1,00 (1); Туг 0,99 (1), Phe 1,98 (2)
Найдено, %: С 63,70; Н 6,75,- N 12,66.
C,5H,,N,0, Вычислено, %i 12,71. Стадия 2.
С 63,62; Н 6,71;
Boc-Tyr-D-Ala-Phe-Phe- Tyr(Bzl)-Pro-Ser-NH
(LXXXIII-)
Из соединений (LXXXII) и (IV) по методике, описанной в примере 1 (ста65
2А
дия 11), получают (LXXXIII),т.пл.180- 183° С (метанрл-этилацет ат) ; 0,34 (В). Стадия 3.
Rf
Boc-Tyr-D-Ala-Phe-Phe-TyrPro-Ser-NH,
(LXXXIV)
Из соединения (LXXXIII) по методике, описанной в примере 1 (стадия 12), получают (LXXX1V), т.пл. 140 - 145 С (эфир); К 0,18 (В);0,88(С).
Аминокислотный анализ: Ser 0,95 (1); Pro 1,01 (1), D-Ala 1,00 (1); Туг 1,98 (2), Phe 2,02 (2).
Найдено, %: С 62,78; Н 6,52; N 11,29.
C,H,NjO,,
Вычислено, N 11,28.
Стадия 4.
%: С 62,89,-.Н 6,49;
25
H-Tyr-D-Ala-Phe-Phe-Tyr-Pro(LXXXI)
Ser-NH.HCl
ке
Из соединения (LXXXIV) по методи- , описанной в примере 3 (стадия 2), получают (LXXXI), т.пл. 195-200 С (эфир); Rf 0,66 (С)-, 0,82 (D); E,j 0,50;Гв4 +3,8° (С 1;МеОН).
Аминокислотный анализ: Ser 0,96 (1); Pro 1,01 (О; D-Ala 1,00 (1);- Туг 2,03 (2)-, Phe 2,00 (2).
Найдено, %: С 60,60; Н 6,11; N 11,97; С1 3,78.
C N ClNgO,
Вычислено, %: С 60,73; Н 6,18; N 12,05; С1 3,81.
П р и м е р 18.
H-Tyr-D-Ala-Phe-Phe-Tyr(Bz1)Pro-Ser-NH.HCl (LXXXV)
5
0
5
Из соединения (LXXXIII) по методике, описанной в примере 3 (стадия 2), получают (LXXXV),т.пл.168-180°С (этанол-эфир); R 0,90 (D); Ejj 0,46; +0,9° (С 1; МеОН).
Аминокислотный анализ: Ser 0,98 (1); Pro 1,02 (1); D-Ala 1,03 (1); Туг 1,98 (2); Phe 2,00 (2).
Найдено, %: С 63,49; Н 6,14; N 10,83, С1 3,48.
C5,Hb,ClNeO,o
Вычислено, %: С 63,61; Н 6,22; N 10,99; С1 3,47.
Пример 19.
H-Tyr-D-Ala-Phe- Gly-LeuNHj-HCl
(LXXXVI)
Boc-Tyr-D-Ala-Phe- Gly-Leu NH.
(LXXXVII)
Из соединений (X) и H-L,eu-NH,j-HCl по методике, описанной в примере 1 (стадия 11), получают (LXXXVII).
Стадия 2.
H-Tyr-D-Ala-Phe-Phe-Gly Lau-NXjHCl .
(LXXXVI)
Из соединения (LXXXVII) по методике, описанной в примере 3 (стадия 2) получают (LXXXVI), т.пл. 143-147°С (иэопропанол-эфир); R, 0,73 (С); Е,,, 0,62-, cil +8,1 (С 1,- МеОН).
Аминокислотный анализ: Gly 1,04 (1); D-Ala 0,99 (1); Leu 1,02 (1); Туг 1,01 (1); Phe 1,00 (1).
Найдено, %: С 57,27; Н 6, 91; N 13,70; С1 5,97.
С„Н„СШбОб.
Вычислено, %: С 57,56; Н 6,83; N 13,89; С1 5,86.
Пример 20.
H-Tyr-D-Ala-Phe-Gly-MetNHj -HCl
(LXXXVIII)
Стадия 1.
Boc-Tyr-D-Ala-Phe-Gly-MetNH,
(LXXXIX)
Из соединения (X) и H-Met-NH -HCl no методике, описанной в примере 1 (стадия 11), получают (LXXX1X),
Стадия 2.
H-Tyr-D-Ala-Phe-Gly-Met- NH HCl(LXXXVIII)
Из соединения (LXXXIX) по методике, описанной в примере 3 (стадия 2), получают (LXXXVIII), т.пл. 220225 с (изопропанол-диизопропиловый эфир); R, 0,68 (С); Е,. 0,63; W +13,5° (С 1; Ме оН).
Аминокислотньй анализ: Gly 1,01 (1); D-Ala 1,01 (1); Met 0,97 (1), Туг 1,03 (1); Phe 1,00 (1).
Найдено, %: С 53,45; Н 6,45; N 13,32; С1 5,73.
СгзН„С1МбОв8
Вычислено, %: С 53,97; Н 6,31; N 13,49; С1 5,73.
H-Tyr-D-Ala-Phe-Sar-Tyr- Pro-Ser-NH . HCl(ХС)
Стадия 1. Boc-Tyr-D-Ala-Phe-Sar-NHNHj (XCI)
Из Boc-Tyr-D-Ala-Phe-Sar-NHNH-Z по методике, описанной в примере 1 (стадия 10), получают (XCI),т.пл.110- 115°С (этилацетат); R, 0,32 (В); Е,.г 0,57.
Аминокислотный анализ: Sar 0,97 (1); D-Ala 1,00 (1); Туг 0,98 (1); Phe 1,02 (1).
Найдено, %: С 59,36; Н 6,80; N 14,32.
,,N,0,
Вычислено, %: С 59,59; Н 6,89; N 14,37.
Стадия 2.
Boc-Tyr-D-Ala-Phe-Sar- Туг(Bzl)-Pro-Ser-NH
(XCII)
30
35
Из соединений (IV) и (XCI) по методике, описанной в примере 1 (стадия 11), получают (ХСИ) ,
Стадия 3.
Boc-Tyr-D-Ala-Phe-Sar-Tyr-Pro- Ser-NHj .(хеш)
Из соединения (XCII) по методике описанной в примере 1 (стадия 11), получают (хеш); R, 0,18 (В), 0,71 (С). 40 Стадия 4.
H-Tyr-D-Ala-Phe-Sar-Tyr-Pro- Ser-NHj-HCl . (ХС)
45 Из соединения (ХСШ) по методике, описанной в примере 3 (стадия 2 получают (ХС), т.пл. 195-2.00 С (эфир); Е,, 0,49; +18,0 (С 1 , МеОН) .
50 Аминокислотный анализ: Sar 1,10 41); Ser 0,94 (1); Pro 1,02 (1);
D-Ala 0,97 (1); Туг 1,98 (2);-Phe 1,00 (1).
55 Найдено, %: С 57,65; Н 6,20; N 13,14; С1 4,22.
C4,H5,ClN80,o
Вычислено, %: С 57,71; Н 6,26; N 13,13; С1 4,15.
271316565 28
П р и м е р 22..мере 1 (стадия 1), получают (XClx),
т.пл. 124-12б с (эфир).
H-Tyr-D-Ala-Phe -Gly-Pro-Стадия 2.
Ser-NHj-HCl(XCIV)
5 Boc-Tyr(Bzl)-Pro-Ser-NH-Me (С) Стадия 1.
Из соединения (XCIX) и метиламина
Boc-Gly-Pro-Ser-NHj (XCV) в диметилформамиде получают соединения (С), т.пл. 179-181°С (этилацеИз Boc-Gly-OH и соединения (II) JO тат); R 0,46 (А), по методике, описанной в примере 1 Стадия 3. (стадия 2), получают (XCV).
Стадия 2.H-Tyr(Bzl)-Pro-Ser-NH-Me
HCl(CI)
H-Gly-Pro-Ser-NH-.HCl (XCVI) t5
Из соединения (С) по методике,
Из соединения (XCV) по методике, описанной в примере 3 (стадия 2), описанной в примере 3 (стадия 2), . получают (С1). получают (XCVI) , т.пл. 119-Г21 С. Стадия 4. (метанол) ii;o(,° -68,2 (С 1; 20 МеОН).Boc-Tyr-D-Ala-Phe-GlyСтадия 3.Tyr(Bzl)-Pro-Ser-NH-Me (СИ)
Boc-Tyr-D-Ala-Phe- Gly-ProSer-NHj(XCVII) Из соединений (X) и (CI) по ме тодике, описанной в примере 1 (стаИз соединений (X) и (XCVI) по ме- ), получают (СИ), т.пл.- 179- тодике, описанной в примере 1 (ста- 181°С (изопропанол-эфир),26 (В) . дия 11), получают (XCVII), т.пл. 143- Стадия 5. 146 С (метанол-этилацетат-диизопропиловый эфир)-, Rf 0,58 (С)-,иГ,,° Boc-Tyr-D-Ala-Phe-Gly-Tyr- -10,7° (С 1; МеОН). Pro-Ser-NH-Me(CIII)
Стадия 4.
Из соединения (СИ) по методике,
H Xyr-D-Ala-Phe-Gly-Gly-описанной в примере 1 (стадия 12),
, Pro-Ser-NHj-НС1 (XCIV) 35 получают (CIII), т.пл. 213-216°С
(изопропанол-эфир); R 0,1 (В);
Из соединения (XCVII) по методи- ( -8,1° (С 1, МеОН). ке, описанной в примере 3 (стадия 2), Стадия 6, получают (XCIV)-, т.пл. 180 С (эфир),
R. 0,32 (С)-, Е,, 0,58.40 H-Tyr-D-Ala-Phe-Gly-Tyr-ProАминокислотный анализ: Ser 0,99; Ser-NH-Me HCl (XCVIII) Pro 1,00 (1); Gly 2,00 (2); D-Ala/...N
1,00 (1); Tyr 1,01 (1); Phe 1,00 (1). соединения (CIII) no методиНайдено, %: С 53,89; Н 6,00; описанной в примере 3 (стадия 2),
N 15 09- С1 4 8545 получают (XCVIII), т.пл. (эфир),
с н C1N О (С); Е,. 0,52.
Вычислено %: С 54,05; Н 6.18; Аминокислотный анализ: Ser 0,97 N 15 28- С1 4 Ь У 02 (1);
П р и мер 23.D-Ala 1.00 (1), Туг 1,96 (2); Phe
50 1,03 (1).
H-Tyr-D-Ala-Phe-Gly-Tyr-Найдено, %: С 57,63; Н 6,31;
Pro-Ser-NH-Me.НС1 (XCVIII) 13,04; С1 4,27.
C,,H5,ClN80,o
Р,...„„„ 1Вычислено, %: С 57,70 Н 6,26;
. 55 N 13,13; С1 4,15.
Boc-Tyr(Bzl)-Pro-Ser-OMe (XCIX) П р и м е р 24.
Из соединений (XIX) и H-Ser-OMe i H-Tyr-D-Ala-Phe-Gly-Tyr- HCl по методике, описанной в при- Pro-Ser-NH-Et НС (CIV)
29
Стадия 1.
Boc-Tyr(Bzl)-Pro-Ser-NH-Et (CV) Из соединения (XCIX) и этилами- на по методике, описанной в примере 23 (стадия 2), получают (СУ),-т.пл. 179-181°С (этилацетат); Rj 0,58 (А) -28,4 (С 1; МеОН). Стадия 2.
H-Tyr-CBzD-Pro-Ser-NH- Ef НС1(CVI)
Из соединения (CV) по методТнке, описанной в примере 3 (стадия 2), получают (CVI), т.пл. 169-170 С (мета- ,нол-эфир); R.J 0,50 (С) } fet -19, l (С U МеОН). Стадия 3.
Boc-Tyr-D-Ala-Phe-Gly- Tyr(Bzl)-Pro-Ser-NH-Et (CVII)
33
40
получают (CXII), т.пл. (эфи ,72(C). Стадия 4.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser-OMe HCl(CIX
Из соединения (CXII) по методи описанной в примере 1 (стадия 12) получают (CIX), -т.пл. 240 С (эфир
0,55, М«
Из соединений (X) и (CVI) по ме-Из соединения CXI по-методике,
тодике, описанной в примере 1 (ста--5 призере 3 (стадия 2),
дия 11), получают (CV1I), т.пл. 190- (изопропанол-эфир); Ri 0,36
(В)о
Стадия 4.
Boc-Tyr-D-Ala-Phe-Gly-Tyr- / Pro-Ser-NH-Et(CVIII).
Из соединения (CVII) по методике, описанной в примере 1 (стадия 12), получают (CVIII), т.пл. 200-215 С (изопропанол-эфир); R 0,10 (В); 0,81 (С),
Стадия 5.
H-Tyr-D-Ala-Phe-Gly-Tyr-ProSer-NH-Ef НС1(CIV)
Из. соединения (CVIII) по методике, описанной в примере 3 (стадия 2), получают (CIV), т.пл. 235 С (эфир), Ri 0,62 (С); Е,,г W -3-,54 (С 1, МеОН).
Аминокислотный анализ: Ser 0,96 (1); Pro 1,01 (О; Gly 1,01 (1), D-Ala 0,99 (1); Туг 2,00 (2); Phe 1,00 (1).
Найдено, %; С 58,37; И 6,43; N 12,90; С1 4,21.
C.H ClNjO
Вычислено, %: С 58,15; И 6,39; N 12,91; С1 4,08.
П р-и м е р 25.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser-OMa HCl(CIX)
45
50
55
R 0,66 (С); Е,.г
-4,5 (С 1, МеОН).
Аминокислотный анализ: Ser 0,9 (1); Pro 1,03 (1); Gly 1,01 (1); D-Ala 1,05 (1), Туг 2,00 (2); Phe 1,04 (1).
Найдено, %: С 57,70; В 6,25; N И,51; С1 4,23.
C4,Hj,ClN,0,,
Вычислено, %: С 57,64; Н 6,13; N 11,47-, С1 4,15.
Пример 26.
H-Tyr-D-Ala-Phe-Gly-ProNH iHCl(CXI
Стадия 1.
Boc-Tyr-D-Ala-Phe-GlyFro-Mj(CXIV)
Из соединений (X) и H-Pro-NH п методике, описанной в примере 1 (стадия 11), получают (CXIV) ,foi ,0 (С 1, МеОН).
1316565
30
Стадия 1.
H-Tyr(-Bzl)-Pro-Ser-OMe HCl (СХ)
Из соединения (XCIX) по методике,; описанной в примере 3 (стадия 2), получают (СХ).
Стадия 2,W
Boc-Tyr-D-Ala-Phe-Gly- Tyr()-Pro- Ser-OMe (CXI)
Из соединений (X) и (СХ) по мето- дике, описанной в примере 1 (стадия 11), получают (CXI), т.пл. 175 - 180 С (хлороформ-изопропанол-эфир), RJ - 0,47 (В).
Стадия 3.
20
H-Tyr-D-Ala-Phe-Gly-TyrCBzl)- Pro-Ser-ОМе(CXII)
3
0
получают (CXII), т.пл. (эфир); ,72(C). Стадия 4.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser-OMe HCl(CIX)
Из соединения (CXII) по методике, описанной в примере 1 (стадия 12), получают (CIX), -т.пл. 240 С (эфир);
0,55, М«
5 призере 3 (стадия 2),
5
0
5
R 0,66 (С); Е,.г
-4,5 (С 1, МеОН).
Аминокислотный анализ: Ser 0,98 (1); Pro 1,03 (1); Gly 1,01 (1); D-Ala 1,05 (1), Туг 2,00 (2); Phe 1,04 (1).
Найдено, %: С 57,70; В 6,25; N И,51; С1 4,23.
C4,Hj,ClN,0,,
Вычислено, %: С 57,64; Н 6,13; N 11,47-, С1 4,15.
Пример 26.
H-Tyr-D-Ala-Phe-Gly-ProNH iHCl(CXIII)
Стадия 1.
Boc-Tyr-D-Ala-Phe-GlyFro-Mj(CXIV)
Из соединений (X) и H-Pro-NH по методике, описанной в примере 1 (стадия 11), получают (CXIV) ,foi ,0 (С 1, МеОН).
31
Стадия 2.
H-Tyr-D-Ala-Phe-Gly-ProNHj-HCl
(CXIII)
Из соединения (CXIV) по методике, описанной в примере 3 (стадия 2), получают (CXIII), т.пл. 235°С-(эфир); Ri 0,46 (С), Е,,., 0. +2,5° (С 1, МеОН).
Аминокислотный анализ: Pro 1,01 id), Gly 1,01 (1); D-Ala 1,00 (1); Туг 1,02 (1); Phe 1,00 (1).
Найдено, %: С 57,00; Н 6,39; N 14,35; С1 6,12. qgHj ClNbb,
Вычислено, %: С 57,09; Н 6,33; N 14,26; С1 6,02.
П р и м е р 27.
H-Tyr-D-Ala-Phe-Gly-Ser-.NH V НС1,
Стадия 1.
Boc-Tyr-D-Ala-Phe-Gly- Ser-NHj(CXVI)
Из соединений (X) и H-Ser-NHj по методике, описанной в примере 1 (стадия 11), получают (CXVI), т.пл. 147- 152 С (этилацетат-эфир- диизопропило- вый эфир). Стадия .2.
H-Tyr-D-Ala-Phe-Gly-Ser-NHi х HCl (CXV)
Из соединения (CXVI) по методике, описанной в примере 3 (стадия 2), получают (CXV), т.пл. (изопро- панол-диизопропиловый эфир); R, 0,52 (С); Е,.., 0,65;1лГ1 ° +40,7 (С 1, МеОН).
Аминокислотный анализ: Ser 0,97 (1), Gly 1,01 (1), D-Ala 1,02 (1), Туг 1,00 1), Phe 1,00 (1).
Найдено, %: С 57,71.; Н 6,17; N 14,63; С1 6,25.
С,Н„С1ЫбО,
Вычислено, %: С 53,09; Н 6,09; N 14,51, С1 6,12.
П р .и м е р 28.
H-Tyir-D-Ala-Phe-Gly-D-Tyr- NH HCl(CXVII)
Стадия 1.
Boc-Tyr-D-Ala-Phe-Gly-D- Tyr-NHj(CXVIII)
, ;
131656532
Из соединений (X) и .H-D-Tyr-NH HCl по методике, описанной в примере 1 (стадия 11), получают (CXVIII).
Стадия 2.
H-Tyr-D-Ala-Phe-Gly-D-Tyr- NH j HCl(CXVII)
Из соединения (CXVIII) по методике, описанной в примере 3 (стадия 2), получают (CXVI1) , т.пл. 230°С (эфир);
10
R 0,76 (С); Е,, 0,57;Гы,1
г
«5
+49,4° (С 1, МеОН).
Аминокислотный анализ: Gly 1,00 (1); D-Ala 1,00 (1); Туг 1,92 (2); Phe 1,00 (1).
Найдено, %: С 58,53; Н 6,10; N 12,71-, С1 5,52.
C,iH,,ClNeOT
Вычислено, %: С 58,66; Н 6,00; N 12,82; С1 5,41. Пример 29.
25H-Tyr-D-Ala-Phe-Gly-TyrPro-Gly-NH . НС1(CXIX)
30
Стадия 1. Boc-Tyr(Bzl)-Phe-Gly-NH2 (СХХ)
Из соединений (XIX) и H-Gly-NH « НС1 по методике, описанной в при- мере 3 (стадия 1), получают (СХХ), т.пл. (эфир-петролейный эфир). Стадия 2.
H-Tyr-(Bzl)-Pro-Gly-NHj« HCl (CXXI)
Из соединения (СХХ) по методике, описанной в примере 3 (стадия 2), получают (CXXI), т.пл. 235°С (изо- пропанол-эфир). Стадия 3.
Boc-Tyr-D-Ala-Phe-Gly-Tyr(Bzl)Pro-Gly-NHj(CXXII)
Из соединений (X) и (CXXI) по ме- тодике, описанной в примере 1 (стадия 11), получают (CXX1I) , т.пл.135- 143 С (изопропанол-эфир). Стадия 4.
Boc-Tyr-rD-Ala-Phe-Gly-TyrPro-Gly-NH (CXXIII)
Из соединения (CXXII) по методике, описанной в примере 1 (стадия 12),
получают (CXXIII) , т.пл. 165 С (изо- пропанол-дииэопропиловый эфир). Стадия 5.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-5
Gly-NH -HCl(CXIX)
Из соединения (CXXIII) по методике, описанной в примере 3 (стадия 2), получайт (CXIX), т.пл. 179-185 с (не-Ш танол-диизопропиловый эфир), Rj 0,57 (С); Е,,,, 0,51; t - +14,8°(С 1, МеОН).
Аминокислотный анализ: Pro 1,01 1), Gly 1,94 (2); D-Ala 1,04 (1); 15 Туг 2,00 (2); Phe 1,04 (1).
Найдено, %s С 57,71i Н-6,17, N 13,79; Cl 4,51.
ClNeO.
Вычислено, %: С 57,88; Н 6,10;20
N 13,86; Cl 4,38. Пример 30.
H-Tyr-D-Ala-Phe-Gly-Tyr(Bzl)- Pro-Ser(Bzl)-NH,.-HCl (CXXIV)
Стадия 1. Boc-Tyr(Bzl)-Pro-Ser(Bzl)NH,
(CXXV)
Из соединений (XIX) и (XLVI) по методике, описанной в примере 8 (стадия 3), получают (CXXV) , Т.Ш1..60- 70°С (вода).
Стадия 2.
H-Tyr(Bzl)-Pro-Ser(Bzl)Шг- НС1(CXXVI)
Из соединения (CXXV) по методике, описанной в примере 3 (стадия 2), получают (CXXVI).
Стадия 3.
Boc-Tyr-D-Ala-Phe-Gly- Tyr(Bzl)-Pro-Ser(Bzl)-NHj (CXXVII)
Из соединений(X) и (CXXVI) по методике, описанной в примере t (ста- 50 дия 11), получают (CXXVII),т.пл.169- 171 С (изопропанол-этилацетат-эфир)
Стадия 4.
H-Tyr-D-Ala-Phe-Tyr(Bzl)- 55 Pro-Ser(Bzl) NHj.HCl (CXXIV)
Из соединения (CXXVII) по методике, описанной в примере 3 (стадия 2),
получают (CXXIV), т..пл. (изо- пропанол-эфир) i Rj. 0,81 (С); Е,,, 0,44i ct +9,9 °(С 1, МеОН).
Аминокислотный анализ: Ser 0,97 (1)-, Pro 0,99 U); Gly 1,03 (1); D-Ala 1,02 (1)-, Туг 1,94 (2); Phe 1,00 (1).
Найдено, %: С 63,57; Н 6,19; N 10,82; Cl 3,49.
C HejClNgO o
Вычислено, %: С 63,61; Н 6,22; N 10,98; Cl 3,47.
Пример 31.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser(-Bzl)-NH -HCl(CXXVIII)
Стадия 1. Boc-Tyr-Pro-Ser(Bzl)-NH2 (CXXIX)
Из соединений (XX) и (XLVI) по методике, описанной в примере 8 (ста- i. дия 3), получают (CXXIX).
Стадия 2.
Из соединения (CXXIX) по методике, описанной в примере 3 (стадия 2), получают (СХХХ),47 (С).
Стадия 3.
Вос-Туr-D-Ala-Phe-Gly-Tyг-Рго- Ser(Bzl)-NH2(CXXXI)
Из соединений (X) и (СХХХ) по методике, описанной в примере 1 (стадия 11), получают (CXXXI).
Стадия 4.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-- Ser(Bzl)-NH2-HCl (CXXVIII)
Из соединения (CXXXI) по методике, описанной в примере 3 (стадия 2), получают (CXXVIII), т.пл. 174 с (эфир); R 0,79 (С); Е,.. 0,48; Wo +4,8° (С 1; МеОН).
Аминокислотный анализ: Ser 0,96 (1); Pro 0,98 (1); Gly 1,02 (1); D-Ala 1,00 (1); Туг 2,02 (2); Phe 1,00 (1).
Найдено, %: С 60,65; Н 6,22; N 11,97; Cl 3.90.
C,H,,ClNeO,o
Вычислено, %: С Н 6,18; N 12,05; С1 3,81. Пример 32.
H-Tyr-D-Ala-Phe-Gl y-Tyr-NH Ad -HCl(CXXXI I)
Стадия 1.
Boc-Tyr-NHAd
(CXXXIIl)
Из Boc-Tyr-OH и AdNH с использованием дициклогексилкарбодиимида с добавкой N-оксибензотриазола в качестве конденсирующего агента по методике,.описанной в примере 5 (ста дия 1), получают (CXXXIII), т.пл.128
131 с (петролейный эфир) ; oi +6,7° (С 1, МеОН).
14
Стадия 2. H-Tyr-NHAd-HCl
(CXXXIV)
Из. соединения (CXXXIII) по методике, описанной в примере 3 (стадия 2), получают (CXXXIV).
Стадия 3.
Boc-Tyr-D-Ala-Phe-Gly-Tyr- NHAd(CXXXV)
Из соединений (Х) и (CXXXIV) по методике, описанной в примере 1 (стдия 11), получают (CXXXV).
Стадия 4.
H-Tyr-D-Ala-Phe-Gly-Tyr- NHAd- HCl (CXXXII)
Из соединения (CXXXV) по методике, описанной в примере 3 (стадия 2), получают (CXXXII), т.пл. (эфир); R, 0,90 (С), Е . 0,52, -(-17,2° (С 1, МеОН).
Аминокислотный анализ: Gly 0,98 (1), D-Ala 1,00 (1); Туг 1,96 (2)-, Phe 1,00 (1).
Найдено, %: С 63,79; Н 6,75-, N 10,59; С1 4,60.
С гН„С1Ыб07
Вычислено, %: С 63,90-, Н 6,76; N 10,64; С1 4,49.
П р и м е р 33.
H-Tyr-D-Ala-Phe-Gly-TyrNHCHjCF,-HCl
(CXXXVI)
Стадия 1. Boc-Tyr-NHCH.CF,
(CXXXVII)
Из Вос-Туг-ОН и CF CHjNH. по методике, описанной в примере 8 (стадия 1), получают (CXXXVII).
Стадия 2.
H-Tyr-NHCH,jCF.. HCl
(CXXXVIII)
5 Из соединения (.CXXXVII) по методике, описанной в примере 3 (стадия 2), получают (CXXXVIII). Стадия 3,
10
Boc-Tyr-D-Ala-Phe-Cly-TyrNHCHj CFj
(CXXXIX)
Из соединений (Х) и (CXXXVIII) по методике, описанной в примере 1 (ста- 5 дия 11), получают CXXXIX. Стадия 4.
H-Tyr-D-А1a-Phe-Gly-Tyr- , -HCl(CXXXVI)
Из соединения (CXXXIX) по методике, описанной в примере 3 (стадия 2), получают (CXXXVI), т.пл. 200-230°С (хлороформ-эфир-петролейный эфир),
R, 0,88 (С); Е,, 0,57; oil +32,4° (С 1, МеОН).
Аминокислотный анализ: Gly 1,02 (1); D-Ala 1,00 (1); Туг 1,98 (2); Phe 0,99 (1).
Найдено, %: С 55,70; Н 5,53, N 11 ,36-, F 6,85; С1 4,97.
C,,H,C1F,N607
Вычислено, %: С 55,85; Н 5,51; N 11,49i F 6,97-, С1 4,85.
Пример 34.
H-Tyr-D-Ala-Phe-Gly-D-Tyr- NHNH-Z(CXL)
Стадия 1.
Boc-Tyr-D-Ala-Phe-Gly-D- Tyr-NHNH-Z (CXLI)
Из соединений (X) и H-D-Tyr-NHNH- -Z HCl по методике, описанной в примере 1 (стадия II), получают (CXLI), т.пл. 193-195°С (эфир); WD -16,7° (С 1; ИеОН).
Стадия 2.
H-Tyr-D-Ala-Phe-Gly-D-Tyr- NHNH-Z HCl(CXL)
Из соединения (CXLI) по методике, описанной в примере 3 (стадия 2), получают (CXL), т.пл. 225 с (эфир), Rf 0,85 (С); Ei.z 0,50; +48, (С 1-, НеОН).
37
Аминокислотный анализ: Gly 0,99 (1); D-Ala 1,02 (1); Туг 1,95 (2); Phe 1,00 (1).
Найдено, %: С 59,61; Н 5,78; N 12,21; С1 4,51.
,.
Вычислено, %: С 59,73; Н 5,76; N 12,19; С1 4,41.
Пример 35.
H-Tyr-D-Ala-Phe-Sar-Туг- NHNH-Z-HC1(CXLII)
Стадия 1. Boc-Tyr-D-Ala-Phe-Sar15
H-Tyr-D-Ala-Phe-Gly-Tyr- NHNH-Ph HCl (CXLIV)
NHNH-Z(CXLIII)
Из соединений (XCI) и (XXXII) по
Из соединения (CXLVII) по методике, описанной в примере 3 (стадия 2), получают (CXLIV), т. пл. 220 С (изо- пропанол-диизопропиловый эфир); R,
эп (С); Е,г 0,52;Г«. +8;б методике, описанной в примере 1 ( (г -, л МеОН) - - «
дия 11), получают (CXLIII).Аминокислотный анализ: Gly 1,00
2.(,). (,). у ,д (2);
H-Tyr-D-Ala-Phe-Sar-иой„„„ . г АП О9. и с: OQ .
Tyr-NHNH-Z-HCl (CXLII) 25 Найдено, %: С 60,92,- Н 5,99,
N 13,07; Cl 4,81.
Из соединения (CXLIII) по методике, описанной в примере 3 (стадия 2 получают (CXLII); Rf 0,90 (С), 0,15 (В); Е,,2 0,53; И +30,6° (С 1, МеОН).
Аминокислотный анализ: Sar 1,04 (1), D-Ala 1,00 (1), Туг 1,99 (2); Phe 1,03 (1).
.Найдено, %: С 62,85; Н 6,09; N12,51/
C.4,,0,
Вычислено, %: С 62,98; Н 6,06;
N 12,54. .
Пример 36.
H-Tyr-D-Ala-Phe-Gly-Tyr- NHNH-Ph HCl(CXLIV)
Стадия 1. Boc-Tyr-NHNH-Ph
(CXLV)
Из Boc-Tyr-OH и H,,N-NH-Ph no методике, описанной в примере 8 (стадия 1), получают (CXLV), т.пл. 171- 73°С (изопропанол-диизопропиловый эфир-петролейный эфир).
Стадия 2.
H-Tyr-NHNH-Ph-HCl
(CXLVI)
Из соединения (CXIV) по методике, описанной в примере 3 (стадия, 2),
16565
38
получают (CXLVI), т.пл. 117-120 с (изопропанол-этнпацетат). Стадия 3.
5 Boc-Tyr-D-Ala-Phe-GlyTyr-NHNH-Ph(CXLVII)
Из соединений (X) и (CXLVI) по методике, описанной в примере 1 (ст Ш дия 11), получают (CXLVII). Стадия 4.
H-Tyr-D-Ala-Phe-Gly-Tyr- NHNH-Ph HCl (CXLIV)
Из соединения (CXLVII) по мето ке, описанной в примере 3 (стадия получают (CXLIV), т. пл. 220 С (и пропанол-диизопропиловый эфир); R
Найдено, %: С 60,92,- Н 5,99,
13,07; Cl 4,81.
C,gH,,ClN,07
Вычислено, %: С 61,16; Н 5,94; 13,14, Cl 4,75.
П p и м e p 37.
Ser-NHj.HCl
H-Tyr-D-Ala-Phe-Gly-Pro(CXLVIII)
Стадия 1.
Ser-NH,
Boc-Tyr-D-Ala-Phe-Gly-Pro(CXLIX)
Из соединений (X) и (II) по методике, описанной в примере 1 (стадия ,1), получают (CXLIX), т.пл. 153 - (метанол-диизопропиловый зфир).
Стадия 2.
45
H-Tyr-D-Ala-Phe-Gly-ProSer-NH - HCl
(CXLVIII)
Из соединения (CXLIX) по методи- ке, описанной в примере 3 (стадия 2), получают (CXLVIII); R,j 0,32 (С); E,,j 0,67.
Аминокислотный анализ: Ser 0,96 (1){ Pro 1,01 (1); Gly 1,00 (1); D-Ala 1,02 (1); Туг 1,02 (1); Phe 1,00 (1).
Найдено %: С 54,91; Н 6,35; N 14,44; С1 5,35.
C,,H4iClN,08
391316565
Вычислено, %: С 55,06; Н 6,26; 14,50; С1 5.,24. Пример 38.
, H-Tyr-D-Ala-Phe-Gly-TyrCBzD- Pro-Ser-NH -HCl(CD
опи пол про 5 (1) Туг
Из соединения (XI) по методике, описанной в примере 3 (стадия 2), получают (CL), т.пл. 169 С (метанол этилацетат) , Rf 0,65 (С), Е, 0, -5,4 (С 1-,МеОН)
Аминокислотный анализ: Ser 0,99- (1); Pro 0,99 (1); Gly 1,03 (1); D-Ala 1,00 (1); Туг 1,96 (2); Phe 1,02 (1).
Найдено, %: С 63,05; Н 6,51; N 12,65; С1 4,05.
C,H5,ClNeO,o
Вычислено, %: С 63,22; Н 6,43; N 12,55; С1 3,97.
Пример 39.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser-NHNHj.- 2НС1(CLI)
Из соединения (XVI) путем каталитического гидрирования в метаноле над палладием на угле в присутствии эквимольного количества НС1 получают (CLI), т.пл.198-200°С (изопропанол-этилацетат)V Ri 0,52 (С); Е,, 0,86; М -1,4 (С 1, МеОН).
Аминокислотный анализ: Ser 0.96 (г). Pro 0,97 (О, Gly 1,02 (1), D-Ala 1,03 (О; Туг 2,01 (2); Phe 1,00 (1).
Найдено, %: С. 53,85; Н 6,08, N 14,14, С1 8,09.
С4„Н„С1Ы,0,о
Вычислено, %: С 53,93; Н 5,99; N 14,15; С1 7,96.
Пример 40.
H-Tyr-D-Ala-Phe-Gly-Met(O)- NHj-HCl(GLIl
Стадия 1.
Boc-Tyr-D-Ala-Phe-Gly-Met( Шг(CLIII)
Из соединения (LXXXIX) путем обработки Na J04 в водном метаноле получают (СЫН), т.пл. 159-1бГс (этил- ацетат) .
Стадия 2.
H-Tyr-D-Ala-Phe-Gly-Met(O)NHj. HCl
(CLII)
40
Из соединения (CLII) по методике, описанной в примере 3 (стадия 2), получают (CLII), т.пл. 125°С (диизо- пропиловый эфир)-, R 0,37 (С). Аминокислотный анализ: Gly 1,03 (1); D-Ala 0,98 (1); Met(O) 1,03 (1); Туг 0,99 (1); Phe 1,00 (1).
Найдено, %: С 52,58; Н 6,16; N 13,13, S 4,97; С1 5,58. C28H,,C1N,0,S
Вычислено, %: С 52,62; Н 6,15; N 13,15, S 5,02; С1 5,55. Пример 41 .
H-Tyr -D-Ala-Phe-Gly-Tyr-Pro- Ser-OH HCl(CLIV)
Стадия 1.
H-Tyr-D-Ala-Phe-Gly-Tyr(Bzl)- Pre-Ser-OH(CLV)
Из соединения (CXI) путем обработ- ки 1 Н. раствором NaOH получают (CLV) Стадия 2.
H-Tyr-D-Ala-Phe-Gly -Туг (Bzl)- Pro-Ser-.OH HCl(CLVI)
Из соединения (CLV) по методике, описанной в примере 3 (стадия 2), получают (CLV1).
Стадия 3.
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro- Ser-OH HCl(CLIV)
Из соединения (CLVI) no методике, описанной в примере 1 (стадия 10), получают (CLIV), т.пл. 215°С (изо- пропанол-эфир); R 0,57 (С); 0,50;М +2,4 (С 1; МеОН).
Аминокислотный анализ: Ser 0,96 (1); Pro 1,03 (1); Gly 1,02 (1); D-Ala 0,98 (1); Туг 2,04 (2); Phe 1,00 (1).
Найдено. %: С 57,21-, Н 5,87; N 11,60; С1 4,28. C,oH,oClN,0,,
Вычислено, %: С 57,17; Н 5,99, N 11,66-, С1 4,21.
Периферическая анальгетическая активность описываемых пептидов бы- ла изучена в опытах in vitro на препарате продольная мышца - межмышечное сплетение подвздошной мьш1цы морской свинки (ПММС) и на сосудистом пучке мьш1и (СПМ).
41
Критерием активности пептидов на препаратах гладкой мьшцы при электрическом раздражении служило максимальное ослабление подергиваний, наблюдаемое в течение 5 мин контактирования с исследуемым соединением. Препарат ПММС готовили по известной методике и помещали в ванночку емкостью 15 мл с модифицированным раствором Кребса, содержащим, ммоль; NaCl 118; КС1 4,75; CaCl 2,54, 1,19-, MgS04 0,12-, NaHCO, 25; глюкоза 11, гексаметохлорид 0,D69;
мепираминмалеат 0,125 мкМ; О, 95%
и СО 5%, Температура раствора
36°С
Похожие на подергивания сокращения продольной мышцы фиксировали изометрически с помощью датчика, измеряющего растяжение (DY I, Basile, Milan, и демонстрировали на записывающем микродинамометре (Basile, Milan). Интрамуральные нервы раздражали прямолинейными импульсами длительностью 0,5 мс с интервалами 10 с, используя надмаксимальное напряжение. Обычно подвздошную мышцу подвергали воздействию опсоидных пептидов в течение 3-5 мин до тех пор, пока ослабление подергиваний не становилось максимальным.
Препарат СПМ готовили по известной методике и помещали в ванночку емкостью 8 мл с модифицированным раствором Кребса, содержащим, кмоль: NaCl 118; КС1 4,75-, CaClj 2,54; 0,93, NaHCO, 25; глюкоза 11; аскорбиновая кислота 0,1j натриевая соль.этилендиаминтетрауксусной кислоты 0,027; Qj. 95% и СО,, 5%. ТемпеЦентральная анальгетическая актив ность описываемых соединений была изучана в опытах in vivo на крысах по тестам отдергивание хвоста и горячая пластинка. Крысам линии Wistar мужского пола вводили исследуемые соединения интрацеребровентри кулярно в 10 мкл физиологического раствора по известной методике. В тесте отдергивание хвоста латентный период при воздействии излучаемого тепла измеряли автоматически с точностью до 0,1 с. В каждом эксперименте использовали группы, содержащие 10 животных.
Время реакции на воздействие излучаемого тепла и горячей пластины измеряли за 30 и 15 мин до введения препарата и затем каждые 15 мин в те чение первого часа после введения препарата и далее каждые 30 мин в те чение следующих 3 ч. Рассчитывали эффективную дозу ОД) и 95%-ные доверительные пределы.
Для H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-. 35 -Ser-NHj - GFjGGGH, активность которого принята 100, по тесту горячая пластинка ЭЦ 13,3 пмоль, по тесту отдергивание хвоста 23 пмоль
20
25
30
40 ны в табл. 2.
Формула из.обретения
45
Полученные результаты представле- ратура раствора 36 G. Продольные сокращения записывали так же, как описано для случая с подвздошной мьщ- цей морской свинки.
. Интрамуральные нервы раздражали сериями прямолинейных 41мпульсов длительностью 1 мс. Gepии импульсов подавали с интервалами 15-20 с, и они состояли из 6-7 раздражений с интервалами 100 мс. Импульсы проходили между платиновым точечным источником, находящимся в донной части ванночки, и вертикальным кольцом (высота 5 мм, ширина 10 мм) из платиновой фольги, закрепленным на верхней части ванночки с органическим раствором. 55
Gnoco6 получения пептидов общей формулы
H-Tyr-D-Ala-Phe-B-G-W, где В - Gly, Ser, Phe,
G 50
Туг, D-Tyr, Leu, Met, Met(О), Pro, Ser, Tyr-Pro, Tyr(Bzl)- -Pro, Tyr-Ser, Pro-Ser, Tyr- -Pro-Ser,Tyr(Bzl)-Pro-Ser, Tyr-Hyp-Ser, tyr-Hyp-Ser(Bzl) Tyr(Bzl)-Val-Ser,Tyr-Gly-Ser, Phe-Hyp-Ser, Tj;r-Pro-3er, Phe-Pro-Ser, Phe-Hyp-Ser(Bzl) Gly-Pro-Ser, Tyr-Pro-Gly, Tyr-Pro-Ser(Bzl), Tyr(Bzl)- -Pro-Ser(Bzl),
Полученные результаты представлены в табл. 1, где активность изученных соединений выражена в процентах
10
15
31656542
от активности H-Tyr-D-Ala-Phe-Gly- -Tyr-Pro-Ser-NHj-CF, GOGH, принятой за 100%. Для H-Tyr-D-Ala-Phe-Gly- -Tyr-Pro-Ser-NH -GF,GOOH на препарате nMMG IGyo 3,3 нМ, а на GMn lGyo 29 нМ ( - концентрация препарата, вызывающая ослабление сокращения препаратов гладких мьшц на 50%).
Центральная анальгетическая активность описываемых соединений была изучана в опытах in vivo на крысах по тестам отдергивание хвоста и горячая пластинка. Крысам линии Wistar мужского пола вводили исследуемые соединения интрацеребровентри- кулярно в 10 мкл физиологического раствора по известной методике. В тесте отдергивание хвоста латентный период при воздействии излучаемого тепла измеряли автоматически с точностью до 0,1 с. В каждом эксперименте использовали группы, содержащие 10 животных.
Время реакции на воздействие излучаемого тепла и горячей пластины измеряли за 30 и 15 мин до введения препарата и затем каждые 15 мин в течение первого часа после введения препарата и далее каждые 30 мин в течение следующих 3 ч. Рассчитывали эффективную дозу ОД) и 95%-ные доверительные пределы.
Для H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-. 35 -Ser-NHj - GFjGGGH, активность которого принята 100, по тесту горячая пластинка ЭЦ 13,3 пмоль, по тесту отдергивание хвоста 23 пмоль.20
25
30
40 ны в табл. 2.
Полученные
Формула из.обретения
Полученные результаты представле-
Gnoco6 получения пептидов общей формулы
H-Tyr-D-Ala-Phe-B-G-W, де В - Gly, Ser, Phe,
G
Туг, D-Tyr, Leu, Met, Met(О), Pro, Ser, Tyr-Pro, Tyr(Bzl)- -Pro, Tyr-Ser, Pro-Ser, Tyr- -Pro-Ser,Tyr(Bzl)-Pro-Ser, Tyr-Hyp-Ser, tyr-Hyp-Ser(Bzl), Tyr(Bzl)-Val-Ser,Tyr-Gly-Ser, Phe-Hyp-Ser, Tj;r-Pro-3er, Phe-Pro-Ser, Phe-Hyp-Ser(Bzl), Gly-Pro-Ser, Tyr-Pro-Gly, Tyr-Pro-Ser(Bzl), Tyr(Bzl)- -Pro-Ser(Bzl),
- он, оси
3
43 NH.
NH-R, NH-NH
NH-NH-R,,
R - CH
3 тил;
CjHj.,
CH,jCF,,
адаманR, - бензилоксикарбонил, фенил, в виде хлоргидратов и/или трифтор- ацетатов, отличающийся тем, что соединение формулы:
Вос-В-ОН, где Вое - трет-бутилоксикарбонил,
В имеет указанные значения, конденсируют с соединением формулы
H N-NH-Z,
где Z - бензилоксикарбонил, методом смешанных ангидридов в среде диметнлформамида или тетрагидрофу- рана при (-15) - (+25)°С в присутствии этилхлорформиата и полученное соединение формулы
BOC-B-NH-NH-Z,
где Вое, В и Z имеют указанные
значения,
обрабатывают раствором НС1 в уксусной кислоте или тетрагидрофуране с
10
J5
20
25
где Вое имеет указанное значение, методом смешанных ангидридов в присутствии этилхлорформиата в среде диметилформамида или тетрагидрофу- рана при (-15) - С+25) С и полученное производное защищенного трипеп- тида формулы
Boc-D-Ala Phe-B-NH-NH-Z,
где Вое, В и Z имеют указанные значения,
обрабатывают раствором НС1 в уксусной киелоте или тетрагидрофуране е образованием еоединения формулы:
H-D-Ala-Phe-B-NH-NH-Z,.
где В и Z имеют указанные значения, которое конденсируют е еоединениен формулы
Вое-Туг-ОН,
где Вое имеет указанное значение, методом смешанных ангидридов в приобразованием еоединения общей формулы у. сутетвии этилхлорформиата в среде
диметилформамида или тетрагидрофураH-B-NH-NH-Z,
где В и Z имеют указанные значения которое конденсируют с соединением формулы
Boc-Phe-OH,
где Вое имеет указанное значение, методом смешанных ангидридов в присутствии этилхлорформиата в среде ди метилформамида или тетрагидрофурана при (-15) - (+25) С и от полученного соединения формулы
Boc-Phe-B-NH-NH-Z,
где Вое, В и Z имеют указанные значения,
отщепляют N-концевую защитную группу обработкой раетвором НС1 в укеуеной киелоте или тетрагидрофуране с получением соединения формулы
H-Phe-B-NH-NH-Z,
где В и Z имеют указанные значения, которое конденеируют е еоединением формулы
1316565
44
2
Boc-D-Ala-OH,
где Вое имеет указанное значение, методом смешанных ангидридов в присутствии этилхлорформиата в среде диметилформамида или тетрагидрофу- рана при (-15) - С+25) С и полученное производное защищенного трипеп- тида формулы
Boc-D-Ala Phe-B-NH-NH-Z,
где Вое, В и Z имеют указанные значения,
обрабатывают раствором НС1 в уксусной киелоте или тетрагидрофуране е образованием еоединения формулы:
H-D-Ala-Phe-B-NH-NH-Z,.
где В и Z имеют указанные значения, которое конденсируют е еоединениен формулы
Вое-Туг-ОН,
где Вое имеет указанное значение, методом смешанных ангидридов в прина при (-15) - (+25) С и полученное производное защищенного тетрапепти- да формулы:
Boe-Tyr-D-Ala-Phe-B-NH-NH-Z,
где Вое, В и Z имеют указанные значения,
подвергают каталитичеекому гидрогено- лизу в приеутствии 10%-го d/C в метаноле или диметилформамиде е образованием еоединения общей формулы
Boe-Tyr-D-Ala-Phe-B-NH-NH ,
где Вое и В имеют указанные значения, которое конденсируют азидным методом в присутствии н-бутилнитрита и НС1 в среде диметилформамида или тетрагид- рофурана при (-30) - (+25)°С с соединением общей формулы
H-U-E-F-W,
где D - Туг, D-Tyr, Leu, Met, Met(О), Pro, Ser, Tyr(Bzl), Gly, Phe, Trp;
F - Ser, Ser(Bzl), Gly или простая связь;
45131656546
Е - Pro, Ser, Hyp, Gly, Val или ной группы от полученного соединепростая связь,. W имеет указанные значения, получаемым путем конденсации соединения общей формулы5
где Вое, Е, F и W имеют указанные
B(c-D-OH,значения,
обработкой НС1 в тетрагидрофуране и где Бос и D имеют указанные значения,
ния общей формулы
BOC-E-F-W,
методом смешанных ангидридов в при- О формулы сутствии этилхлорформиата или изо- бутилхлорформиата в среде диметилфор- м амида или тетрагидрофурана прл
от полученного соединения общей
(-15) - (+25)- G или карбодиимидным методом в присутствии дициклогексил карбодиимида и N-оксибензотриазола с соединением общей формулы
H-E-F-W,
- 15
BOC-D-E-F-W,
где Вое, D, Е, F и W имеют указанные значения.
20
отщепляют N-концевую трет-бутилок- сикарбонильную защитную группу обработкой НС1 в тетрагидрофуране и от полученного соединения общей формулы
где Е, F, W имеют указанные значения, которое, в свою очередь, получают, j если Е - Pro, Ser, Hyp, Gly, Val,
путем конденсации соединения общей
формулы
Вос-Е-ОН,
где Бос имеет указанное значение,
Е - Pro, Ser, Hyp, Gly, Val, с соединением общей формулы
H-F-W,
где F и W имеют указанные значения, методом смешанньк ангидридов в присутствии этилхлорформиата или изо- бутилхлорформиата в среде диметил- формамида или тетрагидрофурана при
25
Boc-Tyr-D-Ala-Phe-B-C-W,
где Вое, В, С и W имеют указанные
значения
отщепляют N-концевую трет-бутилокси- карбонильную защитную группу обработкой НС1 в тетрагидрофуране или трифторуксусной кислотой при 0°С и, если имеются боковые защитные груп- 30 ,пы, то их, в случае необходимости, удаляют гидрогенолизом в присутствии 10%-ного Pd/C в метаноле или ди- метилформамиде.
Приоритет по приз- 35 н а к а м:
20.09.79 при W - ОН, ОСН,, NH, NH-R, где R - СН, ., , , адамантил.
(-f5)-(+25) C с последующим удалением 09.05.80 при W - NH-NH, NH-NH-R,, N-концевой трет-бутилоксикарбониль- где R - бензилоксикарбонил, фенил.
Таблица 1
ной группы от полу
ния общей формулы
BOC-E-F-W,
обработкой НС1 в тетрагидрофуран
формулы
от полученного соединения общей
О формулы
15
BOC-D-E-F-W,
где Вое, D, Е, F и W имеют указанные значения.
отщепляют N-концевую трет-бутилок- сикарбонильную защитную группу обработкой НС1 в тетрагидрофуране и от полученного соединения общей формулы
Boc-Tyr-D-Ala-Phe-B-C-W,
где Вое, В, С и W имеют указанные
значения
отщепляют N-концевую трет-бутилокси- карбонильную защитную группу обработкой НС1 в тетрагидрофуране или трифторуксусной кислотой при 0°С и, если имеются боковые защитные груп- пы, то их, в случае необходимости, удаляют гидрогенолизом в присутствии 10%-ного Pd/C в метаноле или ди- етилформамиде.
Приоритет по приз- н а к а м:
20.09.79 при W - ОН, ОСН,, NH, NH-R, где R - СН, ., , , адамантил.
49
1316565
.50 Продолжение табл.1
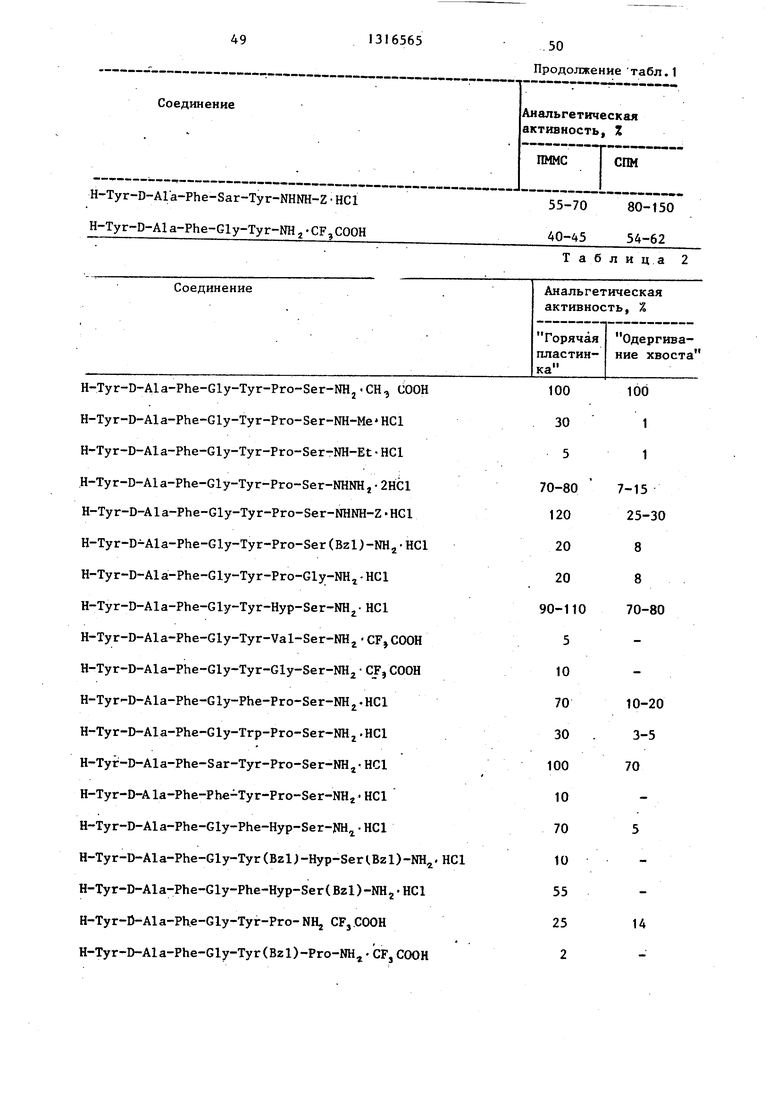
51
H-Tyr-D-Ala Phe-Gly-Tyr-Ser-NH,-CF,CUOH H-Tyr-D-Ala-Phe-Gly-Tyr-NHj.CFjCOOH H-Tyr-D-Ala-Phe-Gly-Tyr-NHNHj 2HCl H-Tyr-D-Ala-Phe-Gly-Tyr-NHNH-Z-HCl H-Ty r-D-Al a-Phe-Gly-D -Ту r-NH HCl- H-Tyr-D-Ala-Phe-Gly-Leu-NHj.HCl H-Tyr-D-Ala-Phe-Sar-Tyr-NHM-Z HCl
Редактор В.Петраш
Составитель В.Волкова Техред В.Кадар,
Заказ 2375/58
Тираж 347Подписное
ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
1316565
52 Продолжение табл. 2
1 12
12 Ь5
14
Корректор С.Шекмар























| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения пептидов или их солей | 1985 |
|
SU1380615A3 |
| Способ получения производных хлоргидрата гептапептида | 1984 |
|
SU1342424A3 |
| Способ получения полипептидов | 1977 |
|
SU904518A3 |
| ПЕПТИД И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1994 |
|
RU2067000C1 |
| ПЕПТИДЫ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1992 |
|
RU2083586C1 |
| НОВОЕ СОЕДИНЕНИЕ С ЭФФЕКТАМИ ТРОМБОЛИЗИСА, АКЦЕПТИРОВАНИЯ СВОБОДНЫХ РАДИКАЛОВ И НАПРАВЛЕННОГО ДЕЙСТВИЯ НА ТРОМБ, А ТАКЖЕ СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2013 |
|
RU2604193C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИПСИХОТИЧЕСКОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2411248C2 |
| ПРОИЗВОДНЫЕ МЕТАСТИНА И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2430107C2 |
| Способ получения пептидов | 1988 |
|
SU1598881A3 |
| Способ получения производных хиназолина или их фармацевтически приемлемых солей с щелочными металлами | 1983 |
|
SU1308197A3 |
Изобретение касается пептидов (ПТ), в частности соединений общей формулы H-Tyr-D-Ala-Phe-BrC-W, где B-Giy, Sar, Phe; C-Tyr, D-TyrJ Leu, Met, Met(O), Pro, Ser, Tyr(Bzl)-Pro, Tyr-Pro, Tyr-Ser, Pro-Ser, Tyr-Pro- Ser, Tyr(Bzl)-Pro-Ser, Tyr-Hyp-Ser, Tyr-Hyp-Ser(Bzl), Tyr(Bzl)-Val-Ser, Tyr-Gly-Ser, Phe-Hyp-Ser, Tyr-Pro- Ser, Phe-Pro-Ser, Phe-Hyp-Ser(Bzl), Gly-Pro-Ser, Tyr-Pro-Gly, Tyr(Bzl)- Pro-Ser(Bzl), Tyr-Pro-Ser(Bzl); W-OH, OCH,, NHj, NHR, , NH-NH, Ш- NHRj, где R, - GH,, C,H, ,, адамантил; R - бензилоксикарбонил или фенил, которые обладают анальге- тической активностью и могут быть использованы в медицине. Цель - создание новых более активных пептидов. Получение ПТ ведут по следующей схеме: Вос-В-ОН + H.jN-NHZ- -(K)- Boc-B- -NH-NHZ - (ОТЩ)-H-B-NH-NHZ + Boc-Phe-OH- (К) -Boc-Phe-B-NH-NHZ- (ОТЩ)- H-Phe-B-NH-NHZ + Boc-D-Ala- ОН- (К) -Boc-D-Ala-Phe-B-NH-NHZ- - XOTDl)-H-Boc-D-Ala-Phe-B-NH-NHZ + Boc-Tyr-OH- Boc-Tyr-D-Ala-Phe-B-NH- -NHZ--(ГД)-- Boc-Tyr-D-Ala-Phe-B-NH-NHj + Н-Д-E-F(KA3), где К конденсация, которую проводят методом смешанных ангидридов в среде ди- метилфорнамида или тетрагидрофурана при (-15) - (+25)°G в присутствии этилхлорформиата; ОТЩ - отщепление защитной группы Z при обработке раствором ЙС1 в CHjCOOH или тетрагидро- фуране; ГД - гидрогенолиз в присутствии 10%-ного Pd/G в среде метанола или диметилформамида; КАЗ - конденсация по азидному методу в присутствии н-бутилнитрита и HG1 в среде . диметилформамида или тетрагидрофураСУ) со о: СП Од СП см



| Gyang Е.А., Kosterlitz H.W | |||
| Agonist and antagonist actions of morphine-like drugs on the guinea- pig isolated ileum | |||
| - Brit | |||
| J.Phar- mac | |||
| Chemother., 1966, v | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Hughes J., Kosterlitz H.W,, Lesli F.W | |||
| Effect of morphine and adtenergie transmission in the mouse vas difere ns | |||
| Assessment of agonist and antagonist potencies of narcotic analgesics | |||
| - Br.J.Pharmac., 1975, V | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| Гидравлическая передача, могущая служить насосом | 1921 |
|
SU371A1 |
| Chermant R., Simon P | |||
| Injection intravertrieulaire cerebrale chez lea rat anasthesie | |||
| - J.Pharmac, Paris, 1975, v | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Подставка для настольных электрических ламп | 1923 |
|
SU489A1 |
| D .mour F.E., Smith D.L | |||
| A method of evaluating analgisie activity in the rat, - J.Pharmac | |||
| exp | |||
| Ther., 1941, V | |||
| Термосно-паровая кухня | 1921 |
|
SU72A1 |
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
| Ашмарин И.П | |||
| и др | |||
| Олигопептиды мозга - аналептики, стимуляторы памяти и сна | |||
| - Молекулярная биология, 1978, № 12, с | |||
| Опорная тележка для канатных транспортеров | 1924 |
|
SU965A1 |
Авторы
Даты
1987-06-07—Публикация
1980-09-19—Подача