Изобретение относится к биохимии, а именно к способам проведения иммуноферментного и ДНК-гибридизационного анализа.
Известен способ иммуноферментного анализа [Патент РФ №2014610, МПК G01N 33/535, опубл. 1994.06.15], где для анализа используют две фазы:
твердую фазу для иммобилизации формируемого биоспецифического комплекса и жидкую, для внесения растворов реагирующих веществ и промежуточных промывок. А для обнаружения наличия аналита и его количества используют конъюгаты биоспецифической молекулы с репортерным ферментом.
Недостатки способа заключаются в том, что он пригоден только для иммуноферментного анализа и при его осуществлении на твердой фазе иммобилизуется только один биоспецифический комплекс и соответственно одна процедура дает ответ о содержании только одного аналита. Измерение проводят колориметрическим методом, обладающим недостаточной чувствительностью и узким линейным диапазоном.
Известен способ одновременного выявления обоих компонентов связывающейся пары [Патент РФ №2373540 С1, МПК G01N 33/532 (2006. 01) опубл. 20.11.2009 (прототип)], где описывается биолюминесцентный молекулярный микроанализ с использованием в качестве меток Са2+ - регулируемых фотопротеинов (обелинов) с измененными спектрами биолюминесценции. Недостаток способа заключается в том, что в нем анализ проводится с использованием в качестве твердой фазы поверхность микропробирок. Для анализа требуется не менее 200 микролитров образца, каждая пробирка обрабатывается отдельно (проведением многократных последовательных процедур сорбции и промывок), измерение сигналов проводят вручную внесением раствора CaCl2 поочередно в каждую пробирку, что существенно увеличивает время анализа.
Техническим результатом изобретения является разработка технологичного, экспрессного, более точного и универсального биолюминесцентного способа молекулярного микроанализа.
Технический результат достигается тем, что в способе одновременного определения двух аналитов биолюминесцентным молекулярным микроанализом, включающем активацию твердой фазы двумя разными иммуноглобулинами или одним иммуноглобулином с двойной специфичностью или двумя разными олигонуклеотидами, отделение непрореагировавшей жидкой фазы, внесение и инкубирование анализируемого образца с последующим разделением жидкой и твердой фаз и обработку твердой фазы одновременно двумя ферментосодержащими конъюгатами с разными характеристиками биолюминесценции и разной биоспецифичностью, состоящими, соответственно, из рекомбинантных Са2+ зависимых фотопротеинов обелинов с разными характеристиками биолюминесценции и молекул разной биоспецифичностью, где в качестве рекомбинантных обелинов используют обелин W92F; H22E и обелин Y138F, новым является то, что разделение сигналов осуществляют за счет разных как спектральных так и кинетических характеристик биолюминесценции рекомбинантных обелинов W92F; H22E и Y138F, с последовательной регистрацией двух сигналов на планшетном биолюминометре с быстро перемещающимися широкополосными светофильтрами, в качестве твердой фазы используют поверхность лунок микропланшет, а анализ проводят в автоматическом режиме.
Перечисленные выше отличительные от прототипа признаки, позволяют сделать вывод о соответствии заявляемого технического решения критерию «новизна».
Признаки, отличающие заявляемое техническое решение от прототипа, не выявлены в других технических решениях и, следовательно, обеспечивают заявляемому решению соответствие критерию «изобретательский уровень»
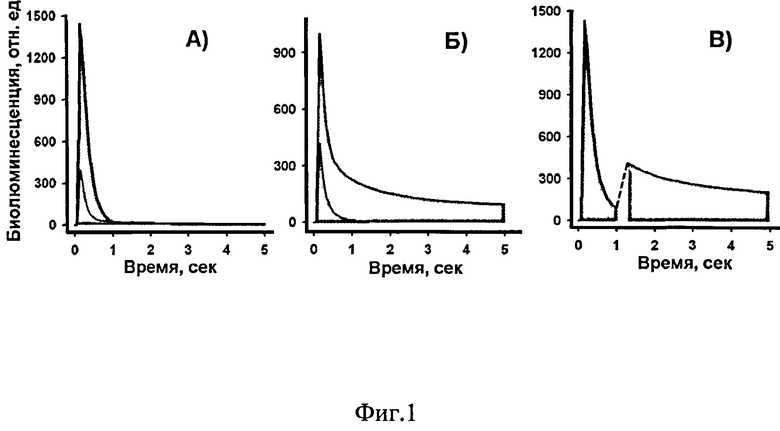
На фиг.1 представлены биолюминесцентные сигналы рекомбинантных обелинов (репортеров) W92F; H22E (фиолетовый, λmax=390 нм [1]) и Y138F (зеленый, λmax=498 нм [1]), записанные на планшетном люминометре с перемещаемыми фотофильтрами сразу после инициации биолюминесценции внесением раствора CaCl2. Фотофильтр I (ФС6) пропускает сигнал быстрого (kd=6,1 с-1 [1]) фиолетового репортера W92F; H22E и па 85-87% задерживает сигнал медленного (kd=0,6 с-1 [1]) зеленого Y138F (фиг.1А). Фотофильтр II (ЖС16) пропускает сигнал зеленого репортера и на 80% задерживает сигнал фиолетового репортера (фиг.1Б). Поскольку сигнал быстрого репортера заканчивается через 1.5 секунды его вклад в сигнал зеленого репортера практически отсутствует. Для разделения сигналов от смеси репортеров их регистрацию проводили последовательно через фотофильтр I ФС6 в течение 1 секунды, а затем после автоматической смены фильтров (в течение 0.3 секунды, показано пунктиром), через фотофильтр II ЖС16 (фиг.1В).
Таким образом, запуск биолюминесцентной реакции репортеров проводится одновременно, сигналы эффективно разделяются на основе разных кинетических и спектральных характеристик их свечения. Измерение сигналов от каждой лунки осуществляется в течение 5 секунд.
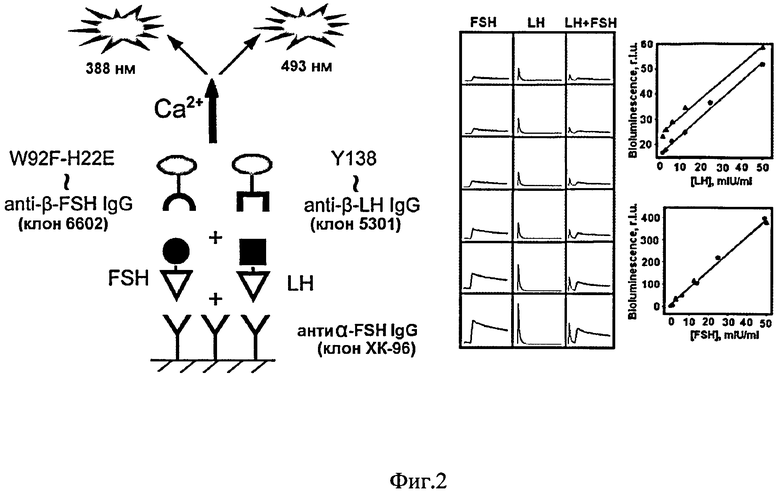
На фиг.2 (слева) показана схема проведения одновременного твердо-фазного иммуноанализа гонадотропных гормонов (лютеинизирующего - LH и фолликулстимулирующего - FSH) в стандартных сыворотках человека; справа приведены результаты анализа в микропланшетном варианте, а также полученные калибровочные кривые при раздельном (▲) или одновременном (●) определении LH и FSH.
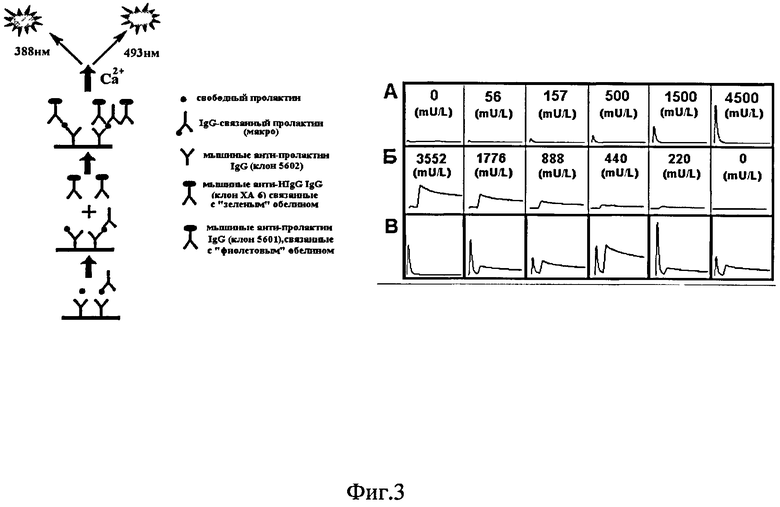
На фиг.3 слева показана схема одновременного определения тотального и иммуноглобулин-связанного пролактина. Поверхность лунок планшета активировали моноклональными мышиными антителами к пролактину человека (клон 5602), которые иммобилизуют на поверхности весь пролактин - свободный и иммупоглобулин-связанный. Затем в лунки вносят смесь меток - коньюгат быстрого фиолетового репортера с моноклопальиыми мышиными антителами к пролактину человека (клон 5601) и коньюгат медленного зеленого репортера с моноклональными мышиными антителами к иммуноглобулину человека (клон XA-6). После промывок, биолюминесценцию связавшихся на поверхности репортеры инициируют ионами кальция. Фиолетовый сигнал быстрого репортера отражает количество тотального пролактина.
На фиг.3, справа показано: А. Зависимость интенсивности быстрого фиолетового репортера от содержания пролактина в стандартных сыворотках. Б. Зависимость интенсивности медленного зеленого репортера от содержания иммуноглобулина человека в стандартных сыворотках (концентрации указаны в пересчете на пролактин при условии эквимолекулярного комплекса). В. Определение тотального пролактина и иммуноглобулин-связанного пролактина в клинических сыворотках (6 образцов).
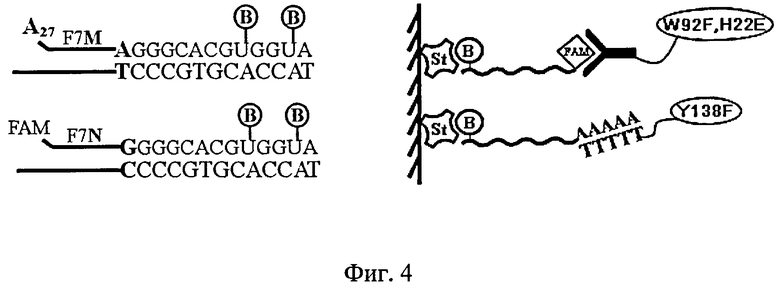
На фиг.4 приведена схема анализа по одновременному определению двух олигонуклеотидов, отличающихся одним нуклеотидным остатком (од-нонуклеотидный полиморфизм гена). Слева показана схема реакции удлинения праймера реакцией ДНК-полимеразы при совпадении концевого олигонуклеотда, сопровождающейся включением меченых биотипом нуклеотидов (РЕХТ-реакции). Праймеры несут в своем составе метки - поли-аденилат (A27) и флуоресцеин (FAM). Справа показана схема анализа полученных продуктов: биотинилированные ампликоны иммобилизовали на поверхности планшет, затем в лунки вносили смесь меток - коныогат быстрого фиолетового репортера с антителом к FAM и коныогат медленного зеленого репортера с политимидилатом. Фиолетовый или зеленый сигнал отражают наличие в гене соответствующих аллелей.
[1] Frank L.A., Borisova V.V., Markova S.V., Malikova N.P., Stepanyuk G.A., Vysotski E.S. Violet and greenish photoprotein obelin mutants for reporter applications in dual-color assay. // Anal. Bioanal. Chem. - 2008 - V.391. - P.2891-2896
При реализации способа в качестве специфических биолюминесцентных меток используют 2 химических коньюгата рекомбинантных форм Ca2+-регулируемого фотопротеина обелина с измененными характеристиками биолюминесценции (репортеры) и соответствующих биоспецифических молекул-антител, олигонуклеотидов и др., которые обеспечивают связывание метки с соответствующими двумя анализируемыми веществами в образце (например, в сыворотке крови, в реакционной смеси после ПЦР).
На твердой фазе (поверхность лунок микропланшета) иммобилизуются специфические комплексы (например, антиген-антитело, ДНК-дуплексы), состав которых зависит от наличия в образце анализируемых веществ. Затем твердая фаза обрабатывается смесью 2-х специфических биолюминесцентных меток, которые в результате иммобилизуются на поверхности за счет специфического взаимодействия с 2-мя анализируемыми веществами. Сигнал обоих репортеров регистрируется с помощью планшетного биолюминометра. Реакция обоих репортеров инициируется добавлением раствора CaCl2. Для разделения сигналов по спектру излучения используют широкополосные фотофильтры, находящиеся на подвижной карусели внутри прибора. Разные кинетические характеристики излучения репортеров позволяют разделить сигналы во времени: сигнал быстрого варианта обелина регистрируют через соответствующий фотофильтр в течение первой секунды после внесения раствора CaCl2, затем производится быстрая смена фотофильтра (в течение 0,3 сек.), и от этой же лунки регистрируют сигнал медленного варианта обелина через другой фотофильтр в течение последующих 4,7 секунд. Таким образом, на измерение каждого образца, помещенного в лунку расходуется 5 секунд и при этом определяется наличие двух анализируемых веществ, а измерение стандартного 96-луночного микропланшета занимает всего 8 минут
Пример 1. Одновременный биолюминесцентный иммуноанализ гормонов ЛГ и ФСГ.
В лунки планшета вносили по 100 мкл растворов моноклональных мышиных иммуноглобулинов к альфа-субъединице ЛГ и ФСГ (клон ХК96) (в PBS, 10 мкг/мл), и инкубировали 12 ч при 4°С. После промывки (трижды, PBS, 0.1% Tween 20, 5 мМ ЭДТА) блокировали не занятые места на поверхности 1% раствором BSA в PBS буфере (1 час при 37°C). После промывки в лунки вносили по 100 мкл смеси соответствующих стандартных сывороток ЛГ и ФСГ, с конечной концентрацией 0, 1.25, 5, 10, 40, 80, мМЕ/мл. Планшет с сыворотками инкубировали в течение часа при 37°C и встряхивании (350 об./мин). После очередной промывки в лунки вносили по 100 мкл равной смеси коныогата фиолетового быстрого репортера с моноклональными мышиными антитеами к бета-субъединице ЛГ (клон 5301) и коныогата зеленого медленного репортера с моноклональными мышиными антитеами к бета-субъединице ФСГ (клон 6602) в 0.02 М Трис HCl pH 7.0, 0.1 М NaCl, 5 мМ ЭДТА. Инкубировали планшет в течение часа при 23°C, при перемешивании 350 об/мин, затем промывали. Биолюминесцентный сигнал связавшихся репортеров измеряли с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия), сразу после впрыска 0.1 мл раствора CaCl2 (0.1 М CaCl2, 0.1 М Трис HCl pH 8.8) в следующем режиме: в течение первой секунды измеряли сигнал через фотофильтр ФС-6 - сигнал фиолетового репортера (H22E; W92F), а затем, в течение следующих 4-х секунд, через фотофильтр (ЖС16) - сигнал зеленого репортера (Y138F).
При раздельном анализе в активированные лунки вносили стандартные растворы только ЛГ или только ФСГ. Последующие процедуры проводили как описано выше.
Пример 2. Одновременный биолюмицссцснтный анализ тотального пролактипа и его иммуноглобулин-связанной формы (макропролак-типа)
В лунки планшета в прямоугольниках с координатами A1-C6, и D1-H12 вносили по 100 мкл растворов моноклональных мышиных иммуноглобулинов (клон 5602) (в PBS, 10 мкг/мл), а в лунки в прямоугольнике A7-C12 вносили по 100 мкл растворов моноклональных мышиных анти-человеческих иммуноглобулинов (клон L-5) (PBS, 10 мкг/мл) и инкубировали 12 ч при 4°C. После промывки (трижды, PBS, 0,1% Tween 20, 5 мМ ЭДТА) блокировали не занятые места на поверхности 1% раствором BSA в PBS буфере (1 час при 37°C). После промывки в лупки, активированные клоном 5602, вносили по 100 мкл стандартных сывороток, содержащих пролактин в концентрациях 0, 56, 165, 500, 1500, 4500 мМЕ/мл и клинических сывороток. В лупки, активированные клоном L-5, вносили растворы IgG человека в PBS с концентрацией 1000, 500, 250, 125, 62.5, 0 нг/мл. Планшет с сыворотками инкубировали в течение часа при 37°C и встряхивании (350 об./мин). После очередной промывки во все лунки вносили по 100 мкл смеси коньюгатов MIgG (5601)-H22E; W92F (0.025 мг/мл) и XA6-Y138F (0.025 мг/мл) в PBS. Инкубировали планшет в течение часа при 23°C, 350 об/мин, затем тщательно промывали. Биолюминесцентный сигнал связавшихся репортеров измеряли с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия), сразу после впрыска 100 мкл раствора CaCl2 (0.1 М CaCl2, 0.1 М Трис HCl pH 8.8) в следующем режиме: в течение первой секунды измеряли сигнал через фотофильтр ФС-6 - сигнал фиолетового репортера (H22E; W92F), а затем в течение следующих 4-х секунд через другой фотофильтр (ЖС16) - сигнал зеленого репортера (Y138F).
Пример 3. Одновременный биолюминесцентный анализ по определению двух олигонуклеотидов, отличающихся одним нуклеотидным остатком (однонуклеотидный полиморфизм гена).
Для генотипирования однонуклеотидного полиморфизма гена, кодирующего коагуляционный фактор VII (G10976A, R353Q) использовали 3 образца ДНК, специально отобранные и предварительно проанализированные другими методами, среди них - гомозиготная норма (NN), гетерозигота (NM) и гомозиготная мутация (ММ).
РЕХТ-реакцию проводили в 20 мкл буфера, содержащего 20 мМ Трис-HCl pH 8.8, 10 мМ (NH4)2SO4, 10 мМ KCl, 0.1% Triton X-100, 2 мМ MgSO4, по 2.5 мкМ dATP, dCTP, dGTP, 1.25 мкМ dTTP, 1.25 мкМ В-dUTP, 0.2 пмоль амплифицированной ДНК-матрицы, 1 пмоль F7N: 5'-FAM-CCACATGCCACCCACTACCG-3' праймера и 1 пмоль F7M: 5'-poly(A)27-CCACATGCCACCCACTACCA-3' праймера, 0.5 ед. акт. Vent (exo-) ДНК-полимеразы. Условия реакции: денатурация при 95°С в течение 5 мин, далее 3 цикла (95°C - 15 с, 55°C - 15 с, 72°C - 15 с), с последующим прогреванием реакционной смеси при 95°C в течение 5 мин.
Гибридизационный анализ продуктов PEXT-реакции. На поверхность лунок планшет (Costar, США) иммобилизовали стрептавидин 5 мкг/мл по 50 мкл в PBS буфере pH 8.5, содержащем 5 мМ ЭДТА. Реакцию проводили 2 ч. при 37°C и промывали лунки (трижды, PBS pH 7.0, 0.1% Tween 20, 5 мМ ЭДТА). Затем в лунки планшета вносили по 3 мкл продуктов РЕХТ-реакции в 47 мкл гибридизационного буфера (0.1 М малеиминовой кислоты, 0.15 М NaCl, 5 мМ ЭДТА, 1% BSA), инкубировали при комнатной температуре 20 мин. После промывки в лунки вносили по 50 мкл смеси меток (W92F; H22E-анти-FITC IgG и Y138F-d(T)30) в буфере, содержащем 20 мМ Трис HCl pH 7.0, 5 мМ ЭДТА, 0.1 М NaCl и инкубировали 30 мин при комнатной температуре. Биолюминесцентный сигнал связавшихся репортеров измеряли с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия), сразу после впрыска 0.1 мл раствора CaCl2 (0.1 М CaCl2, 0.1 М Трис HCl pH 8,8) в следующем режиме: в течение первой секунды измеряли сигнал через фотофильтр ФС-6 - сигнал фиолетового репортера (H22E; W92F), а затем в течение следующих 4-х секунд через другой фотофильтр (ЖС16) - сигнал зеленого репортера (Y138F). Соотношение биолюминесцентных сигналов (BLH22E,W92F/BLY138F) показывает тип генотипа. В случае гомозиготной нормы (NN, нормальный G/G-генотип) отношение сигналов составило 4.66 (2.49 при раздельном выявлении); в случае гетерозиготы (NM, гетерозиготный G/A-генотип) отношение сигналов составило 1.75 (0.75 при раздельном выявлении); в случае гомозиготной мутации (ММ, гомозиготный A/A-генотип) - 0.57 (0.25 при раздельном выявлении.
Таким образом, значения дискриминационных факторов при одновременном и раздельном выявлении продуктов РЕХТ-реакции близки и устанавливают генотип образца с равной достоверностью: отношения дискриминационных факторов для NN:NM и NM:MM составляют 3.1 и 3.0 при раздельном выявлении и 2.7 и 3.1 при одновременном.
В заявляемом способе в качестве ферментов-репортеров используют рекомбинантные формы Ca2+-регулируемого фотопротеина обелина с измененными характеристиками биолюминесценции. Разделение сигналов каждого репортера осуществляют на основе разных спектральных характеристик их свечения - регистрируя световой поток через соответствующие широкополосные светофильтры. В отличие от прототипа, в предлагаемом способе разделение сигналов от каждого репортера осуществляют еще и па основе разных кинетических характеристик их биолюминесценции, регистрируя свечение каждого репортера через соответствующие широкополосные светофильтры последовательно. Это позволяет использовать один канал регистрации и осуществлять анализ в микропланшетном варианте.
Способ предназначен для проведения как иммуноанализа, так и ДНК-гибридизационного анализа.
Способ одновременного определения двух аналитов биолюминесцентным молекулярным микроанализом относится к биохимии, а именно к способам проведения иммуноферментного и ДНК гибридизационного анализа. Способ одновременного определения двух аналитов биолюминесцентным молекулярным микроанализом включает обработку твердой фазы биоспецифическим реагентом, отделение непрореагировавшей жидкой фазы, обработку твердой фазы ферментосодержащим конъюгатом, разделение жидкой и твердой фаз и анализ твердой фазы, в котором в качестве биоспецифического реагента для первой обработки твердой фазы используют два иммуноглобулина или один иммуноглобулин с двойной специфичностью или два олигонуклеотида, а конечную обработку твердой фазы проводят одновременно двумя ферментсодержащими конъюгатами, состоящими, соответственно, из рекомбинантных Cа2+ зависимых фотопротеинов обелинов с разными характеристиками биолюминесценции и молекул разной биоспецифичностью, где в качестве рекомбинантных обелинов используют обелин W92F; H22E и обелин Y138F, с последующим анализом на планшетном биолюминометре с быстро перемещающимися широкополостными светофильтрами с разделением сигналов и по спектру и по времени. 4 ил., 3 пр.
Способ одновременного определения двух аналитов биолюминесцентным молекулярным микроанализом, включающий активацию твердой фазы двумя разными иммуноглобулинами или одним иммуноглобулином с двойной специфичностью или двумя разными олигонуклеотидами, отделение непрореагировавшей жидкой фазы, внесение и инкубирование анализируемого образца с последующим разделением жидкой и твердой фаз и обработку твердой фазы одновременно двумя ферментосодержащими конъюгатами с разными характеристиками биолюминесценции и разной биоспецифичностью, состоящими соответственно из рекомбинантных Са2+ зависимых фотопротеинов обелинов с разными характеристиками биолюминесценции и молекул разной биоспецифичностью, где в качестве рекомбинантных обелинов используют обелин W92F; H22E и обелин Y138F, отличающийся тем, что разделение сигналов осуществляют за счет разных как спектральных, так и кинетических характеристик биолюминесценции рекомбинантных обелинов W92F; H22E и Y138F, с последовательной регистрацией двух сигналов на планшетном биолюминометре с быстро перемещающимися широкополосными светофильтрами, в качестве твердой фазы используют поверхность лунок микропланшет, а анализ проводят в автоматическом режиме.
| СПОСОБ ОДНОВРЕМЕННОГО ОПРЕДЕЛЕНИЯ ДВУХ АНАЛИТОВ БИОЛЮМИНЕСЦЕНТНЫМ МОЛЕКУЛЯРНЫМ МИКРОАНАЛИЗОМ | 2008 |
|
RU2373540C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БАКТЕРИЦИДНОЙ АКТИВНОСТИ СЫВОРОТКИ КРОВИ | 2003 |
|
RU2247987C2 |
| СПОСОБ И СОЕДИНЕНИЯ ДЛЯ МАГНИТОРЕЛАКСОМЕТРИЧЕСКОГО ОБНАРУЖЕНИЯ АНАЛИТОВ И ИХ ПРИМЕНЕНИЕ | 1996 |
|
RU2176393C2 |
| СПОСОБ ЛИПОСОМАЛЬНОГО ИММУНОАНАЛИЗА ДЛЯ ДЕТЕКТИРОВАНИЯ АНАЛИТОВ В ОБРАЗЦЕ | 2001 |
|
RU2203495C2 |
| RU 85658 U1, 10.08.2009 | |||
| СТАНОК ДЛЯ ФРЕЗЕРОВКИ ЧЕРВЯЧНЫХ ШЕСТЕРЕН ПО КОПИРУ | 1935 |
|
SU49733A1 |
| US 5369036 A, 29.11.1994 | |||
| WO 9966324 A2, 23.12.1999 | |||
| ФРАНК Л.Ф | |||
| Биолюминесцентный молекулярный микроанализ на основе Ca-регулируемого фотопротеина обелина: Автореф | |||
| - Красноярск, | |||
Авторы
Даты
2013-10-27—Публикация
2011-12-30—Подача