Настоящее изобретение относится к лекарству для применения в терапии, иммунологии, молекулярной биологии и вирусологии в основном для профилактики и/или лечения заболеваний, связанных с нарушением функции ренин-активируемой ангиотензиновой системы (РАС), преимущественно артериальной гипертензии и сердечнососудистых заболеваний, связанных с повышенным артериальным давлением (АД).
Ренин-ангиотензиновая система, называемая также ренин-ангиотензин-альдостероновой системой (РААС), представляет собой гормональную систему, которая регулирует физиологические процессы в организме. РАС активируется расщеплением пептида ангиотензиногена до декапептида ангиотензина I (Анг I) под действием фермента ренина. Ключевой продукт рениновой системы - октапептидный гормон ангиотензин II (Анг II), который образуется из ангиотензина I под действием ангиотензин-превращающего фермента (АПФ). РАС играет ключевую роль в регуляции объема циркулирующей крови и поддержании АД. Однако чрезмерная активность РАС вызывает артериальную гипертензию и поражение органов-мишеней.
В последние годы удалось выяснить, что РАС играет более значительную роль, чем ей приписывалось по классическим представлениям, в регуляции АД и водно-электролитного баланса. Наряду с регуляцией физиологических и патофизиологических процессов в сердечнососудистой системе и почках, РАС действует и на ряд других тканей, включая головной мозг, железы внутренней секреции, органы чувств, жировые и иммунные клетки. Таким образом, РАС играет важную роль в физиологических и патофизиологических процессах, протекающих также в этих тканях.
Поскольку РАС вовлечена в огромное количество физиологических и аптофизиологических процессов, лекарства направленные на РАС стали важным клиническим инструментом в лечении сердечнососудистых заболеваний и болезней почек, таких как артериальная гипертензия, сердечная недостаточность и диабетическая нефропатия. Кроме того, многочисленные исследования показали, что блокирование РАС влияет не только на сердечнососудистые заболевания, обусловленные высоким АД, но и уменьшают частоту и тяжесть клинических проявлений, связанных с воспалительными процессами и, в частности, атеросклерозом. Фундаментальные исследования и эксперименты, проведенные на животных, убедительно подтвердили роль ангиотензина II как провоспалительного медиатора, который непосредственно участвует в образовании атеросклеротических бляшек и ремоделировании сердца.
К тому же, РАС играет основную роль не только как провоспалительный фактор в патогенезе атеросклероза, но и в механизме развития аутоиммунных заболеваний, таких как рассеянный склероз.
Более того, результаты исследований также показывают, что блокирование РАС снижает риск развития сахарного диабета и связанных с ним осложнений. Имеются также данные, свидетельствующие о роли ангиотензина II в развитии резистентности к инсулину и сахарного диабета. Компоненты РАС находятся в сложном взаимодействии с инсулином и могут привести к развитию и прогрессированию болезней обмена веществ.
РАС, воспалительные и аутоиммунные заболевания (атеросклероз и рассеянный склероз)
Атеросклероз - хроническое воспалительное заболевание, которое поражает клетки сосудистой стенки, иммунной системы и ряда органов. Несмотря на данные о важной роли лейкоцитов, эндотелиальных и гладкомышечных клеток в атеросклеротическом воспалительном процессе, исследования последних лет показали также роль таких факторов, как активность цитокинов и хемокинов, модулирующих воспалительный процесс.Проведенные недавно исследования позволяют также по-новому взглянуть на провоспалительную активность гормонального пептида ангиотензина II. РАС играет важную роль в развитии воспалительного процесса, что связано с индукцией ангиотензином II секреции проатеросклеротических цитокинов и усугублением дисфункции эндотелиальных клеток. Ангиотензин II регулирует не только секрецию цитокинов, хемокинов и факторов роста в артериальной стенке, но участвует также в регуляции экспрессии факторов клеточной адгезии, таких как фактор межклеточной адгезии (VCAM-1), фактор адгезии сосудистых клеток (ICAM-1), Р-селектина. Наряду с этим было показано, что РАС может модулировать активацию системы комплемента как при атеросклерозе, так и при поражении почечной ткани. Этот каскад воспалительных реакций активирует воспалительный процесс в сосудах путем привлечения (рекрутинга) в интиму воспалительных клеток. Рекрутированные клетки могут продуцировать ангиотензин II, что включает ответ по механизму положительной обратной связи, который может поддерживать этот порочный круг индуцированного воспалительного процесса.
Недавно появился ряд работ, показавших, что сходство между хроническими воспалительными заболеваниями типа рассеянного склероза и наиболее распространенным хроническим заболеванием у человека - атеросклерозом распространяется значительно дальше общности корня («склероз») в названии этих болезней. В этих работах на примере рассеянного склероза и его биологической модели на животных - экспериментальном аутоиммунном энцефаломиелите (ЭАЭ) - показано также, что РАС играет важную роль в аутоиммунных процессах. Используя метод протеомики, авторы показали, что при рассеянном склерозе в поврежденных участках мозга активируется РАС. Блокирование продукции ангиотензина II с помощью ингибиторов АПФ или ингибирование сигнального пути ангиотензина II с помощью блокаторов его рецепторов подавляет аутореактивность лимфоцитов-хелперов ТН1 и ТН17 и способствует проявлению активности антиген-специфических CD4 FoxP3 регуляторных Т-лимфоцитов (Treg-клетки). При введении животным ингибиторов АПФ количество CD4 FoxP3 Т-лимфоцитов значительно увеличивается и становится достаточным, чтобы вызвать обратное развитие паралитического ЭАЭ. Это дает основание авторам считать модулирование РАС привлекательной терапевтической стратегией в лечении аутоиммунных заболеваний человека.
РАС и сердечнососудистые заболевания - артериальная гипертензия Сердечнососудистые заболевания - ведущая причина смертности во всем мире. Согласно данным ВОЗ, в структуре смертности на долю сердечнососудистой патологии приходится примерно 30% случаев. Сердечнососудистые заболевания являются результатом поражения сердца и сосудов, и это поражение имеет различные проявления. К ним относятся инфаркт миокарда, инсульт, сердечная недостаточность и терминальную почечную недостаточность. Наиболее существенным фактором риска сердечнососудистой патологии является артериальная гипертензия. Более чем у четверти взрослого населения мира по данным на 2000 г. была выявлена артериальная гипертензия и, если не принять соответствующих мер, этот показатель будет непрерывно расти.
Под артериальной гипертензией обычно понимают повышенное АД, когда систолическое давление превышает 140 мм рт.ст., и/или диастолическое давление превышает 90 мм рт.ст. Согласно Методическим рекомендациям «Объединенного национального комитета по профилактике артериальной гипертензии и выявлению, обследованию и лечению больных с высоким АД», систолическое АД в пределах 120-139 мм рт.ст. и/или диастолическое давление в пределах 80-89 мм рт.ст. должно рассматриваться как предгипертензия, что требует проведения оздоровительных мероприятий для профилактики атеросклероза. Следовательно, снижение повышенного АД - важное направление профилактики сердечнососудистых заболеваний. Прежде всего, следует попытаться снизить АД путем изменения образа жизни и, в частности, отказа от неправильного питания, повышения физической активности и прекращение курения. Однако при эссенциальной гипертензии необходимо особое лечение. Ключевую роль в регуляции АД играет РАС, которая становится привлекательной мишенью для терапевтического воздействия. Таким образом, препараты, специфически действующие на отдельные компоненты РАС, стали важными клиническими инструментами для лечения артериальной гипертензии.
Активация РАС представляет собой каскад реакций, который начинается с расщепления ангиотензина под действием ренина. Ренин - это аспартилпротеаза, которая синтезируется и хранится в основном в гранулах околоклубочковых клеток почек и характеризуется высокой специфичностью по отношению к своему субстрату ангиотензиногену. Ангиотензиноген, главным образом, образуется в клетках печени, которые постоянно секретируют его в кровь. Он расщепляется ренином на N-конце с образованием декапептида ангиотензина I (Анг I; 1-10 пептид), который быстро превращается в биологически активный октапептид ангиотензин II (Анг II; 1-8 пептид). В отличие от Анг II, Анг I не обладает биологической активностью и существует исключительно как предшественник Анг II. Расщепление Анг I происходит в основном под действием АПФ, но не только. Эта связанная с мембранами металлопротеиназа экспрессируется на поверхности эндотелиальных клеток; наиболее высокая концентрация этого фермента отмечается на эндотелии сосудов легких. Помимо АПФ в образовании Анг II участвует также химаза. Ангиотензин II может также образоваться непосредственно из ангиотензиногена под действием ферментов тонина и катепсина. Кроме того, в крови можно обнаружить и другие функционально-активные пептиды, образующиеся из Анг I и Анг II под действием амино-, карбокси- или эндопептидаз. Это Анг (1-9), Анг (1-7), Анг III (пептид 2-8) и Анг IV (пептид 3-8). Карбоксипептидаза, известная как ангиотензин-превращающий фермент II (АПФ II), действует как на Анг I, так и на Анг II. АПФ II, действуя на Анг I, образует Анг 1-9, а на Анг II - Анг 1-7. Под действием АПФ Анг 1-9 может превратиться в Анг 1-7. В отличие от Анг II, который повышает АД и, по-видимому, является основным медиатором, участвующим в ремоделировании сосудов при артериальной гипертензии, Анг 1-7 вызывает расширение сосудов и тем самым может противодействовать потенциальному патогенному действию Анг II. Действие Анг 1-7 реализуется через его рецептор - белок mas, являющийся онкогеном.
Анг II и Анг 1-7 считаются основными эффекторными пептидами РАС, в то время как Анг III и Анг IV обладают несколько меньшей активностью (примерно 40% от активности Анг II). Действие Анг II опосредуется преимущественно двумя рецепторами, трансмембранная часть которых имеет семь доменов: тип 1 (at): подтипы 1a и 1б) и тип 2 (АТ2). Подтипы рецепторы AT1 и АТ2 связывают Анг II одинаково, но отличаются по своей локализации в клетке и по экспрессии в различных тканях. Эффект Анг II большей частью реализуется через рецепторы AT1.
Во всем организме Анг II является сильнодействующим сосудосуживающим агентом. В почках он вызывает спазм клубочковых артериол, тем самым повышая системное АД и уменьшая кровоток. В корковом слое надпочечников он вызывает высвобождение альдостерона, под действием которого в почечных канальцах повышается реабсорбция натрия и воды из мочи. Анг II действует также на центральную нервную систему (ЦНС), повышая солевой аппетит, что вызывает у человека жажду. Кроме того, Анг II стимулирует высвобождение антидиуретического гормона (АДГ).
Классическая роль компонентов РАС состоит в том, чтобы действовать в качестве эндокринных факторов, поддерживающих АД и водно-электролитный баланс. Помимо этих компонентов РАС, циркулирующих в крови, в некоторых тканях существует также местный ангиотензин-генерирующий каскад. Так называемая тканевая РАС может действовать локально по паракринному и/или аутокринному механизму и это действие может проявляться независимо, полностью или частично, от активности циркулирующей РАС.
В настоящее время на рынке имеется несколько групп препаратов для лечения артериальной гипертензии, например диуретики, блокаторы кальциевых каналов, и целый ряд препаратов, специфически воздействующих на компоненты РАС. К последним относятся ингибиторы АПФ, которые связываются с активным центром молекулы АПФ и нарушают способность этого фермента связывать и расщеплять свои субстратами. К характерным побочным эффектам ингибиторов АПФ относятся сухой кашель, «гипотензия первой дозы» и развитие ангионевротического отека. Другой класс препаратов, действующих на РАС, представлен блокаторами рецепторов ангиотензина АТ1. Блокаторы рецепторов ангиотензина специфически влияют на функцию Анг II, блокируя связывание ангиотензина II с рецептором AT1. Недавно на рынок поступил новый препарат, действующий на РАС - Алискерин, ингибирующий активность ренина.
В данной области техники также предполагается применять антагонисты Анг II, которые обладают большим сродством к рецепторам AT1, чем Анг II. В публикации WO 2005/044313 А раскрываются соединения, которые могут применяться для лечения сердечнососудистых заболеваний и болезней, связанных с фиброзом и атеросклерозом. Соединения, раскрываемые в заявке WO 2005/044313 А, включают октапептид с общей формулой X1X2VYIHPX3, в которой X1 может быть любым аминокислотным остатком, Х2 может представлять собой аргинин, или N-алкилированный аргинин, или миметик аргинина, а Х3 может быть аминокислотным остатком, содержащим гидрофобную боковую цепь. Эти соединения имеют более высокое сродство к рецептору AT1, чем Анг II (антагонистическая активность).
В патенте Великобритании 2001653 А раскрывается соединение, которое представляет собой производное ангиотензина II и имеет общую формулу XRVYIHPY, в которой Х представляет собой α-аминоокси алифатическую ацильную группу, a Y может быть лейцином, изолейцином, аланином или треонином. Такое соединение может применяться в лечении почечной гипертензии.
В заявках WO 2002/087504 A, WO 2001/043761 A, WO 2001/098325 А и WO 2000/002905 А предоставляются соединения, которые действуют как аналоги ангиотензина II.
Несмотря на то что на рынке имеются и разные лекарства для лечения артериальной гипертензии, добиться адекватной коррекции последней пока не удается. В целом недостаточно эффективное лечение обусловлено, с одной стороны, тем, что артериальная гипертензия протекает бессимптомно, с другой - необходимостью длительного применения препаратов, которые больные должны принимать, по меньшей мере, один раз в сутки.
В последнее время активная иммунотерапия вызывает повышенный интерес как потенциально новая стратегия лечения артериальной гипертензии и связанных с нею заболеваний.
Возможность применения вакцинации против компонентов РАС для лечения артериальной гипертензии была продемонстрирована на различных животных моделях (Michel-JB et al.. Am Heart J. 1989; 117:756). Один из первых подходов показал, что вакцинация против ренина эффективно снижает АД. Однако этот подход в последующие годы не разрабатывался, так как у животных развивался аутоиммунный нефрит (Michel-JB et al. Circulation. 1990; 81(6): 1899-910). Другие подходы имели целью индуцировать иммунный ответ против компонентов РАС, которые экспрессируются в виде трансмембранных белков на клеточной поверхности, таких, как АПФ и AT1R. Ряд научных коллективов изучал влияние активной иммунизации против AT1R. И хотя в некоторых исследованиях сообщалось о том, что антитела к N-концу AT1R могут уменьшить тяжесть проявлений артериальной гипертензии у крыс со спонтанной гипертензией, в большинстве случаев такой подход не оказывал существенного эффекта на АД. Работ по изучению активной иммунизации против АПФ очень мало. В одной из них сообщается о вакцинации кроликов, но лишь у одного из 50 животных удалось обнаружить антитела против АПФ (Soffer-RL et al., Fed. Proc. 1983; 42(19):2735-9). Исследования по активной иммунизации против ангиотензиногена не проводились, но в ряде работ были сделаны попытки выяснить возможность вакцинации против ангиотензина I и ангиотензина II.
Вакцинация Анг I, конъюгированным с белками-носителями (например, гемоцианином фиссуреллы) вызвала индукцию гуморального иммунного ответа высокой специфичности к антигену. В экспериментах на различных животных моделях антитела к ангиотензину I, индуцированные вакцинацией, по-видимому, обладали функциональной активностью, так как, во-первых, они были способны связываться с ангиотензином I (что было показано способом Вестерн-блоттинга) и, во-вторых, АД достоверно снижалось, что говорит о блокировании влияния ангиотензина на РАС (Downham et al., Br J din Pharmacol. 2003; 56: 505-12). В отличие от экспериментальных данных, клинические исследования на здоровых добровольцах не выявили снижения АД (Downham et al., 2003). Эти данные получили дополнительное подтверждение в исследованиях на больных с артериальной гипертензией, которых лечили аналогом Анг I, содержащем 12 аминокислот, ковалентно связанных с гемоцианином фиссуреллы и адсорбированном на квасцах (он известен как PMD3117) (Brown et al., Clin Sci. 2004; 107:167-73). Важно, что больные хорошо перенесли такое лечение и что оно индуцировало у них стойкий гуморальный антиген-специфический иммунный ответ. Кроме того, лечение влияло на рениновую систему, о чем можно было судить по изменениям уровня ренина и альдостерона. Однако сравнение результатов опытной и контрольной группы, получавшей плацебо, показало, что вакцинация PMD3117 не повлияла на уровень АД (Brown et al., 2004). В отличие от этого, вакцина Со Vaccine HT™, полученная после незначительной доработки этой вакцины к Анг I компанией «Протерикс» и замены квасцов новым адъювантом, оказывала эффект. Введение этой новой вакцины, приготовленной по новой технологии, вызывало 10-кратное повышение титра антител к ангиотензину на доклинической стадии испытания, а у здоровых людей приводило к изменениям систолического и диастолического давления. Тем не менее, снижение АД было незначительным и наблюдалось лишь в состоянии покоя, но не в период активности, что было бы более важно.
При других подходах к получению антител, которые могут блокировать РАС, в качестве антигенов использовались пептиды, являющиеся производными ангиотензина II. В отличие от предыдущего исследования, в котором инъекция конъюгатов ангиотензина II с белком-носителем, не вызывала снижения АД, вакцинация ангиотензином II, связанным с вирусоподобными частицами (VLP - virus-like particles), индуцировала гуморальный иммунный ответ высокой антигенной специфичности, сопровождавшийся статистически достоверным снижением АД (AMbühl et al., J Hypertension. 2007; 25:63-72.). Однако в недавно проведенном клиническом исследовании, в котором больным вводилась вакцина ангиотензина II, связанного с вирусоподобными частицами, такого снижения АД не наблюдалось. Это говорит о том, что индукция гуморального иммунного ответа этой пептидной вакциной могла быть неоптимальной или недостаточной. Таким образом, в данной области техники сохраняется потребность в новых, более эффективных вакцинах к ангиотензиновым пептидам.
Целью настоящего изобретения является предоставление препарата для профилактики и лечения состояний, связанных с повышенным уровнем ангиотензина II, вырабатываемого РАС, на основе вакцины.
Оказалось, что вакцину, включающую пептид, связанный с фармацевтически приемлемым носителем, можно успешно применять для лечения и/или профилактики физического расстройства, связанного с ренин-активируемой ангиотензиновой системой, где указанный пептид имеет аминокислотную последовательность
 ,
,
X1 представляет собой G или D,
X2 представляет собой А, Р, М, G или R,
Х3 представляет собой G, А, Н или V,
Х4 представляет собой S, А, D или Y,
X5 представляет собой А, D, Н, S, N или I,
Х6 представляет собой A, L или F,
где m, n и о независимо друг от друга равны 0 или 1 при условии, что когда о равно 0, m и n равны 0 и, когда n равно 0, m равно 0, и где пептид не является пептидом DRVYIHPF.
Не только пептиды, имеющие аминокислотную последовательность, соответствующую Формуле I, можно применять для лечения и/или профилактики физического расстройства, связанного с ренин-активируемой ангиотензиновой системой, но и пептиды, имеющие аминокислотную последовательность, соответствующую Формулам II и III. Таким образом, другой аспект настоящего изобретения относится к вакцине, включающей пептид, связанный с фармацевтически приемлемым носителем и имеющий аминокислотную последовательность
 ,
,
для лечения и/или профилактики физического расстройства, связанного с ренин-активируемой ангиотензиновой системой, в которой
X1 представляет собой G, А или D,
Х2 представляет собой А, Р, М G или R,
Х3 представляет собой G, А, Н или V,
Х4 представляет собой S, А, D или Y,
Х5 представляет собой A, D, H, S, N или I,
Х6 представляет собой Y или И,
Х7 представляет собой А, V, L, I или F,
где m, n и независимо друг от друга равны 0 или 1 при условии, что когда о равно 0, m и n равны 0 и, когда n равно 0, m равно 0, и где пептид не является пептидом DRVYIHPF.
Согласно наиболее предпочтительному воплощению настоящего изобретения вакцина содержит пептид, имеющий аминокислотную последовательность

который можно применять для лечения и/или профилактики физического расстройства, связанного с ренин-активируемой ангиотензиновой системой, предпочтительно артериальной гипертензии и связанных с ней нарушений, в которой
X1 представляет собой G, А или D,
Х2 представляет собой А, Р, M, G или R,
Х3 представляет собой G, A, H или V,
Х4 представляет собой S, А, D или Y,
Х5 представляет собой А, D, H, S, N или I,
Х6 представляет собой Y или H,
Х7 представляет собой А, V, L, I или F, и где пептид не является пептидом DRVYIHPF.
Вакцина настоящего изобретения при введении млекопитающим способна индуцировать у них образование антител к ангиотензину I или ангиотензину II при связывании ее с белком-носителем (или с пептидом, содержащим антигенную детерминанту Т-клеток). Пептиды, обозначенными формулами I-III, могут индуцировать образование антител, которые имеют более высокую специфичность к Анг II, чем к Анг I. Вакцины, содержащие пептид, имеющий аминокислотную последовательность, отраженную в формулах I-III, и аминокислоты Н и L на С-конце пептида X1X2X3X4X5X6PX7HL (обе аминокислоты происходят из Анг I), например, индуцируют образование антител, которые распознают Анг I и более специфичны по отношению к нему, чем к Анг II. Это дает возможность специфически «нацелить» вакцину только на один вид пептидов ангиотензина или на их комбинацию. Поскольку у животных, о которых говорилось выше, эти антитела связываются с пептидами, производными ангиотензина, уровень пептидов ангиотензина может значительно меняться, что дает возможность применять эти иммуногенные пептиды в иммунотерапевтическом подходе к лечению состояний, связанных с повышенными уровнями ангиотензина II, продуцируемого РАС или другими протеазами (например, химазой). Не ограничивая себя рамками той или иной теории молекулярного механизма действия, отметим, что пептидные варианты настоящего изобретения будут действовать как иммуногены, индуцирующие образование антител, которые связываются с более чем одним видом ангиотензинового пептида и таким образом нейтрализуют одновременно все существующие виды ангиотензиновых пептидов, участвующие в развитии артериальной гипертензии. При альтернативном подходе индуцированные антитела могут специфически связываться с С-концом ангиотензина II. При таких условиях индуцированные антитела дополнительно блокируют связывание ангиотензина II с его рецептором AT1R.
Аминокислотные остатки, приведенные в формулах I-III, можно заменять на соответствующие аминокислотные остатки, указанные выше. Аминокислотная последовательность, получающаяся путем указанных замен, включает в себя один, два, три, четыре, пять, шесть или семь аминокислотных остатков, которые не идентичны исходной аминокислотной последовательности ангиотензина II (DRVYIHPF). Предпочтительнее всего, чтобы формулы I-III отличались от аминокислотной последовательности ангиотензина II, по меньшей мере, на один аминокислотный остаток более предпочтительно, по меньшей мере, на два и максимум на семь аминокислотных остатков, более предпочтительно, максимум на шесть аминокислотных остатков, более предпочтительно, максимум на пять, более предпочтительно, максимум на четыре и даже более предпочтительно, максимум на три аминокислотных остатка.
Пептиды, имеющие приведенные выше формулы, могут также включать пять, шесть, семь или восемь аминокислотных остатков (начиная от X1 или Х2 или Х3 до последнего аминокислотного остатка).
Пептид в соответствии с настоящим изобретением может состоять из 5, 6, 7 или 8 (до 20) аминокислотных остатков, предпочтительно из 5, 6, 7 или 8 (до 15), в частности из 5, 6, 7, 8 или 9 аминокислотных остатков. Пептиды в настоящем изобретении могут быть также частью полипептида или белка, количество аминокислотных остатков в котором достигает 300, предпочтительно 200, а еще более предпочтительно 150 и даже более предпочтительно 100 аминокислотных остатков.
Пептиды настоящего изобретения не идентичны естественному ангиотензину II, имеющему формулу DRVYIHPF. Вакцина настоящего изобретения вызовет иммунный ответ у хозяина, который реагирует на ангиотензиновые пептиды.
Пептиды настоящего изобретения можно получить способами химического синтеза, которые хорошо известны в данной области техники, либо в виде изолированного пептида, либо пептида, входящего в состав другого пептида или полипептида. При альтернативном способе пептид синтезируется микроорганизмами, а затем выделяется и при необходимости подвергается дополнительной очистке. Вариант пептида может продуцироваться микроорганизмами, такими как бактерии, дрожжевые и плесневые грибы, клетками эукариот, такими как клетка млекопитающего или насекомого, или с помощью рекомбинантного вектора таких вирусов, как аденовирусы, поксвирусы, герпесвирусы, вирусы леса Семлики, бакуловирусы, а также бактериофагов и вирусов Синдбис и Сендай. К бактериям, которые подходят для использования в качестве продуцента соединения/пептида, относятся Е. coli, В. subtilis или любая другая бактерия, способная экспрессировать пептиды. Пригодные дрожжевые грибы для экспрессии указанного соединения/пептида включают Saccharomyces cerevisiae, Schizosaccharomyces pombe, Candida spp., Pichia pastoris и любые другие дрожжевые грибы, которые способны экспрессировать пептиды. Соответствующие способы хорошо известны в данной области техники. Способы выделения и очистки пептидов, получаемых рекомбинантным путем, также хорошо известны в данной области техники и включают, например, гель-фильтрацию, аффинную и ионообменную хроматографию и др.
Чтобы облегчить выделение пептида, может быть получен слитый полипептид, в которой данный пептид трансляционно слит (ковалентно связан) с гетерологическим полипептидом, обеспечивающим возможность выделения путем аффинной хроматографии. Типичными гетерологическими полипептидами являются His-Tag (например. His 6, то есть 6 остатков гистидина), GST-Tag (глутатион-3-трансфераза) и др. Слитый полипептид не только облегчают процесс очистки пептида, но может также предотвращать разрушение указанного пептида при очистке. Если гетерологический полипептид надо удалить после очистки, то в слитом полипептиде создают сайт расщепления, расположенный между гетерологическим пептидом и выделяемым пептидом. Сайт расщепления состоит из аминокислотной последовательности, которая расщепляется ферментом, активный центр которого специфичен к данной аминокислотной последовательности (например, протеазами).
Используемые здесь формулировки «пептид, связанный с фармацевтически приемлемым носителем» и «пептид, связанный с носителем» означают, что пептид слит или конъюгирован с носителем. Если пептид настоящего изобретения слит или конъюгирован (например, через карбоксильную или аминогруппу, или сульфгидрильную, гидроксильную, имидазолильную, гуанидильную или индолильную группу) с белковым носителем, можно ввести линкер между пептидом и белковым носителем.
Согласно особенно предпочтительному воплощению настоящего изобретения Формула I может содержать следующие заместители:
X1 представляет собой G или D,
Х2 представляет собой G, R, А, Р или М,
Х3 представляет собой А, V или G,
Х4 представляет собой Y, А или S,
Х5 представляет собой N, I, D, S или А и/или
Х6 представляет собой F.
Согласно предпочтительному воплощению настоящего изобретения пептид с Формулой I выбирается из группы, состоящей из GRVYIHPF, DPVYIHPF, DMVYIHPF, DGVYIHPF, DAVYIHPF, DRGYIHPF, DRAYIHPF, DRHYIHPF, DRVAIHPF, DRVSIHPF, DRVDIHPF, DRVYAHPF, DRVYNHPF, DRVYDHPF, DRVYHHPF, DRVYSHPF, DRVYIHPA, DRVYIHPL, DAAYIHPF, DRAAIHPF, DRVAAHPF, DRAYAHPF, DRAAAHPF, DAAAIHPF, DAGYIHPF, DAHYIHPF, DPGYIHPF, DPAYIHPF, DMGYIHPF, DMAYIHPF, DMHYIHPF, DGGYIHPF, DGAYIHPF, DGHYIHPF, DPVAIHPF, DMVAIHPF, DMVSIHPF, DRGAIHPF, DRHAIHPF, DRGYAHPF, DRGYDHPF, DRGYHHPF, DRGYSHPF, DRGYNHPF, DRAYDHPF, DRAYHHPF, DRAYSHPF, DRAYNHPF, DRHYAHPF, DRHYSHPF, DRHYNHPF, DRHYDHPF, DRHYHHPF, DRGADHPF, DRVAHHPF, DRHADHPF, GRGAIHPF, DPGAIHPF, DPGSIHPF, DMGAIHPF, DMGSIHPF, GPGYIHPF, GPGSIHPF, GMGSIHPF, DRGSIHPF, DPHAIHPF. DMHAIHPF, GPHAIHPF, GMHSIHPF, PVYIHPF, MVYIHPF, GVYIHPF, AVYIHPF, RGYIHPF, RAYIHPF, RHYIHPF, RVAIHPF, RVSIHPF, RVDIHPF, RVYAHPF, RVYNHPF, RVYDHPF, RVYHHPF, RVYSHPF, RVYIHPA, RVYIHPL, AAYIHPF, RAAIHPF, RVAAHPF, RAYAHPF, RAAAHPF, AAAIHPF, AGYIHPF, AHYIHPF, PGYIHPF, PAYIHPF, MGYIHPF, MAYIHPF, MHYIHPF, GGYIHPF, GAYIHPF, GHYIHPF, PVAIHPF, PVSIHPF, MVAIHPF, MVSIHPF, RGAIHPF, RHAIHPF, RGYAHPF, RGYDHPF, RGYHHPF, RGYSHPF, RGYNHPF, RAYDHPF, RAYHHPF, RAYSHPF, RAYNHPF, RHYAHPF, RHYSHPF, RHYNHPF, RHYDHPF, RHYHHPF, RGADHPF, RGAHHPF, RHADHPF, RHSIHPF, PGAIHPF, RHAIHPF, PGSIHPF, MGAIHPF, MGSIHPF, RGSIHPF, PHAIHPF, MHAIHPF, PHSIHPF, MHSIHPF, GYIHPF, AYIHPF, HYIHPF, VYAHPF, VYNHPF, VYDHPF, VYHHPF, VYSHPF, VYIHPA, VYIHPL, AAIHPF, AYAHPF, HYIHPF, GAIHPF, HAIHPF, GYAHPF, GYDHPF, GYHHPF, GYSHPF, GYNHPF, AYDHPF, AYHHPF, AYSHPF, AYNHPF, HYAHPF, HYSHPF, HYNHPF, HYDHPF, HYHHPF, GAIHPF, HSIHPF, GSIHPF, HAIHPF, AIHPF, SIHPF, DIHPF, YAHPF, YNHPF, YDHPF, YHHPF и YSHPF.
Особенно предпочтительными пептидами являются DPVYIHPF, DMVYIHPF, DGVYIHPF, DAVYIHPF, DRGYIHPF, DRAYIHPF, DRHYIHPF, DRVAIHPF, DRVYAHPF, DRVYNHPF, DRVYDHPF, DRVYSHPF, DRVYIHPL, DAAYIHPF, DRAAIHPF, DRVAAHPF, DRAYAHPF, DAGYIHPF, DAHYIHPF, DPGYIHPF, DPAYIHPF, DMGYIHPF, DMAYIHPF, DMHYIHPF, DGGYIHPF, DGAYIHPF, DGHYIHPF, DMVSIHPF, DRGAIHPF, DRGYAHPF, DRGYDHPF, DRGYSHPF, DRGYNHPF, DRAYDHPF, DRAYSHPF, DRHYAHPF, DRHYSHPF, DRHYNHPF, DRHYDHPF, GPGYIHPF, GPGSIHPF, DRGSIHPF, PVYIHPF, GVYIHPF, AVYIHPF, RGYIHPF, RAYIHPF, RHYIHPF, RVAIHPF, RVSIHPF, RVDIHPF, RVYAHPF, RVYNHPF, RVYDHPF, RVYSHPF, RVYIHPL, AAYIHPF, RAAIHPF, RVAAHPF, RAYAHPF, AGYIHPF, AHYIHPF, PGYIHPF, PAYIHPF, GGYIHPF, GAYIHPF, GHYIHPF, PVSIHPF, MVSIHPF, RGAIHPF, RGYAHPF, RGYDHPF, RGYSHPF, RGYNHPF, RAYDHPF, RAYSHPF, RAYNHPF, RHYAHPF,RHYSHPF, RHYNHPF, RHYDHPF, RHSIHPF, PGAIHPF, RHAIHPF, PGSIHPF,MGAIHPF, MGSIHPF, MGYIHPF, RGSIHPF, PHAIHPF, MHAIHPF, PHSIHPF, MHSIHPF, GYIHPF, AYIHPF, VYAHPF, VYNHPF, VYDHPF, VYSHPF, AAIHPF, AYAHPF, HYIHPF, GAIHPF, GYAHPF, GYDHPF, GYSHPF, GYNHPF, AYDHPF, AYSHPF, AYNHPF, GAIHPF, GSIHPF.
Еще более предпочтительными пептидами являются DPVYIHPF, DMVYIHPF, DGVYIHPF, DAVYIHPF, DRGYIHPF, DRAYIHPF, DRHYIHPF, DRVYIHPL, DAAYIHPF, DRAAIHPF, DRVAAHPF, DRAYAHPF, DAGYIHPF, DAHYIHPF, DPGYIHPF, DPAYIHPF, DMGYIHPF, DMAYIHPF, DMHYIHPF, DGGYIHPF, DGAYIHPF, DGHYIHPF, DMVSIHPF, DRGAIHPF, DRGYAHPF, DRGYDHPF, DGAYIHPF, DGHYIHPF, DMVSIHPF, DRGAIHPF, DRGYAHPF, DRGYDHPF, DRGYSHPF, DRGYNHPF, DRAYDHPF, DRAYSHPF, DRAYNHPF, GPGYIHPF, PVYIHPF, GVYIHPF, RGYIHPF, RAYIHPF, RVSIHPF, RVYIHPL, AAYIHPF, RAAIHPF, RAYAHPF, AGYIHPF, PGYIHPF, PAYIHPF, GAYIHPF, PVSIHPF, MVSIHPF, RGAIHPF, RGYAHPF, RGYSHPF, GYIHPF, где самыми предпочтительными являются пептиды DPVYIHPF, DMVYIHPF, DAAYIHPF, DRAAIHPF, DRAYAHPF, DAGYIHPF, DPGYIHPF, DGAYIHPF, DMVSIHPF, DRGAIHPF, DRGYDHPF, DRGYSHPF, PVYIHPF, GVYIHPF, AAYIHPF, RAAIHPF, RAYAHPF, PGYIHPF, PVSIHPF, MVSIHPF, RGAIHPF.
Согласно предпочтительному воплощению настоящего изобретения
X1 в формулах II и III представляет собой G, А или D,
X2 в формулах II и III представляет собой G, А, Р, М или R,
Х2 в формулах II и III представляет собой G, А, Н или V,
Х4 в формулах II и III представляет собой S, А, D или Y,
Х5 в формулах II и III представляет собой А, D, Н, S, N или I,
Х6 в формулах II и III представляет собой Y или Н,
Х7 в формулах II и III представляет собой А, V, L, I или F.
Упомянутые выше аминокислотные остатки являются наиболее предпочтительными заместителями.
Пептиды настоящего изобретения могут быть укороченными на своих N-концах, так что в этих пептидах отсутствуют первый, второй и/или третий аминокислотные остатки.
Пептиды предпочтительно выбираются из группы, состоящей из: GRVYIHPF, DPVYIHPF, DMVYIHPF, DAVYIHPF, DRGYIHPF, DRAYIHPF, DRHYIHPF, DRVAIHPF, DRVSIHPF, DRVDIHPF, DRVYAHPF, DRVYNHPF, DRVYDHPF, DRVYHHPF, DRVYSHPF, DRVYIYPF, DRVYIHPA, DRVYIHPV, DRVYIHPL, DRVYIHPI, DAAYIHPF, DRAAIHPF, DRVAAHPF. DRAYAHPF, DRAAAHPF, ARAAIHPF, ARVAAHPF, DAAAIHPF, DAAAAHPF, DAVAAHPF, DAGYIHPF, DAHYIHPF, DPGYIHPF, DPAYIHPF, DMGYIHPF, DMAYIHPF, DMHYIHPF, DGGYIHPF, DGAYIHPF, DGHYIHPF, DPVAIHPF, DPVSIHPF, DMVAIHPF, DMVSIHPF, DRGAIHPF, DRHAIHPF, DRGYAHPF, DRGYDHPF, DRGYHHPF, DRGYSHPF, DRGYNHPF, DRAYDHPF, DRAYHHPF, DRAYSHPF, DRAYNHPF, DRHYAHPF, DRHYSHPF, DRHYNHPF, DRHYDHPF, DRHYHHPF, DRHYIYPF, DRGADHPF, DRGAHHPF, DRVAHHPF, DRHADHPF, GRGAIHPF, GRHSIHPF, GRHADYPF, DPGAIHPF, GRHAIIIPF, DPGSIHPF, DMGAIHPF, DMGSIHPF, GPGYIHPF, GMGYIHPF, GPGSIHPF, GMGSIHPF, DRGSIHPF, DPHAIHPF, DMHAIHPF, GPHAIHPF, GPHAIHPF, GMHAIHPF, GPHSIHPF и GMHSIHPF.
Укороченные варианты пептидов, в которых отсутствует первый N-концевой аминокислотный остаток, предпочтительно выбираются из группы, состоящей из: PVYIHPF, MVYIHPF, GVYIHPF, AVYIHPF, RGYIHPF, RAYIHPF, RVAIHPF, RVSIHPF, RVDIHPF, RVYAHPF, RVYNHPF, RVYDHPF, RVYHHPF, RVYSHPF, RVYIYPF, RVYIHPA, RVYIHPV, RVYIHPL, RVYIHPI, AAYIHPF, RAAIHPF, RVAAHPF, RAYAHPF, RAAAHPF, RAAIHPF, RVAAHPF, AAAIHPF, AAAAHPF, AVAAHPF, AGYIHPF, AHYIHPF, PGYIHPF, PAYIHPF, MGYIHPF, MAYIHPF, MHYIHPF, GGYIHPF, GAYIHPF, GHYIHPF, PVAIHPF, PVSIHPF, MVAIHPF, MVSIHPF, RGAIHPF, RHAIHPF, RGYAHPF, RGYDHPF, RGYHHPF, RGYSHPF, RGYNHPF, RAYDHPF, RAYSHPF, RAYNHPF, RHYAHPF, RHYSHPF, RHYNHPF, RHYDHPF, RHYHHPF, RHYIYPF, RGADHPF, RGAHHPF, RVAHHPF, RHADHPF, RHSIHPF, RHADYPF, PGAIHPF, RHAIHPF, PGSIHPF, MGAIHPF, MGSIHPF, RGSIHPF, PHAIHPF, MHAIHPF, PHSIHPF и MHSIHPF.
Укороченные варианты пептидов, у которых отсутствуют первые два N-концевых аминокислотных остатка, предпочтительно выбираются из группы, состоящей из: GYIHPF, AYIHPF, HYIHPF, VAIHPF, VSIHPF, VDIHPF, VYAHPF, VYNHPF, VYDHPF, VYHHPF, VYSHPF, VYIHPA, VYIHPV, VYIHPL, VYIHPI, AAIHPF, VAAHPF, AYAHPF, AAAHPF, HYIHPF, GAIHPF, HAIHPF, GYAHPF, GYDHPF, GYHHPF, GYSHPF, GYNHPF, AYDHPF, AYSHPF, AYNHPF, HYAHPF, HYSHPF, HYNHPF, HYDHPF, HYHHPF, HYIYPF, GADHPF, GAHHPF, VAHHPF, HADHPF, GAIHPF, HSIHPF, HADYPF, GSIHPF и HAIHPF.
Укороченные варианты пептидов, у которых отсутствуют первые три N-концевых аминокислотных остатка, предпочтительно выбираются из группы, состоящей из: AIHPF, SIHPF, DIHPF, YAHPF, YNHPF, YDHPF, YHHPF, YSHPF, YIYPF, YIHPA, YIHPV, YIHPL, YIHPI, AAHPF, ADHPF, AHHPF и ADYPF.
Согласно предпочтительному воплощению настоящего изобретения, по меньшей мере, один цистеиновый остаток присоединен к N-концу аминокислотной последовательности в соответствии с формулами I, II и/или III и всех упомянутых выше специфических пептидов.
Пептид в настоящего изобретения может дополнительно включать, по меньшей мере, один цистеиновый остаток на N-конце. Этот цистеиновый остаток может служить реактивной группой для связывания пептида с другой молекулой или носителем. Например, эта группа может использоваться для связывания данного пептида с белком-носителем. Альтернативно этому, цистеиновый остаток можно присоединить к С-концу пептида настоящего изобретения.
Пептиды настоящего изобретения являются связанными с носителем, предпочтительно с белковым носителем.
Для увеличения продукции специфических антител к ангиотензиновому пептиду у млекопитающего соединение настоящего изобретения является связанным с носителем.
Согласно предпочтительному воплощению настоящего изобретения носитель выбирается из группы, в которую входят гемоцианин фиссуреллы, столбнячный анатоксин и дифтерийный токсин или любой другой белок или пептид, содержащий антигенные детерминанты (эпитопы) Т-клеток.
Согласно предпочтительному воплощению настоящего изобретения пептид конъюгируют с фармацевтически приемлемым носителем, предпочтительно гемоцианином фиссуреллы (KLH - Keyhole Limpet Haemocyanin), столбнячным анатоксином, альбумин-связывающим белком, бычьим сывороточным альбумином, дендримером (MAP; Biol Chem. 358: 581), пептидными линкерами (или фланкирующими участками), а также с адъювантными веществами, описанными Singh et al. в Nat. Biotech. 17 (1999), 1075-1081 (особенно веществами, приведенными в Табл. 1 этого документа) и O'Hagan et al. в Nature Reviews, Drug Discovery 2 (9) (2003), 727-735 (особенно описанными ими эндогенными иммунопотенцирующими соединениями и системами доставки) или их смесями. Реакцию конъюгации (например, с помощью гетеробифункциональных соединений, таких как GMBS и, конечно же, других веществ, описанных в «Bioconjugate Techniques» Greg. Т.Hermanson) для связывания пептида с носителем можно выбрать из реакций, известных специалистам в данной области техники. Кроме того, в состав вакцины можно включить адъювант, предпочтительно малорастворимую композицию алюминия, в частности гидроксид алюминия. И конечно, можно использовать такие адъюванты, как MF59 фосфат алюминия, фосфат кальция, цитокины [например, IL-2, IL-12, GM-CSF (гранулоцитарно-макрофаговый колониестимулирующий фактор)], сапонины (например, QS21), производные мурамилдипептида (MDP), CpG олигонуклеотиды, липополисахариды, монофосфориллипид А, полифосфазены, эмульсии [например, с адъювантом Фройнда или синтетическим маслом «Синтекс» (SAF)], липосомы, виросомы, иммуностимулирующие комплексы (iscoms), протеолипосомы с улиткообразной структурой (cochleates), полилактидкогликолидные микрочастицы (PLG microparticles), полоксамерные частицы, вирусоподобные частицы, термолабильный энтеротоксин, холерный токсин, мутантные токсины (например, LTK63 и LTR72), микрочастицы и/или полимеризованные липосомы.
Согласно предпочтительному воплощению настоящего изобретения пептид готовят вместе с адъювантом, предпочтительно адсорбированном на квасцах.
В близком воплощении настоящее изобретение является пригодным для профилактики или лечения заболеваний, расстройств или состояний, связанных с РАС, в том числе (но не только) артериальной гипертензии, инсульта, инфаркта миокарда, почечной недостаточности, застойной сердечной недостаточности, поражений сосудов и кровоизлияния в сетчатку. В дополнение к этому, иммунизация упомянутыми пептидами, включенными в данное воплощение настоящего изобретения, может применяться для лечения или профилактики образования атеросклеротических бляшек, развития тромбоза артерий и осложнений, связанных с воспалительным поражением сосудов. Помимо этого, лечение аутоиммунных заболеваний, таких как рассеянный склероз, может проводиться с применением пептидов, включенных в данное воплощение настоящего изобретения.
Вакцину настоящего изобретения можно вводить подкожно, внутримышечно, внутрикожно, внутривенно (см. «Handbook of Pharmaceutical Manufacturing Formulations» Sarfaraz Niazi, CRC Press Inc. 2004). В зависимости от пути введения вакцины она может включать соответствующие носители, адъюванты и/или наполнители.
Вакцина в соответствии с настоящим изобретением содержит соединение в количестве от 0,1 нг до 10 мг, предпочтительно от 10 нг до 1 мг, в частности от 100 нг до 100 мкг или, альтернативно этому, от 100 фмоль до 10 мкмоль, предпочтительно от 10 пмоль до 1 мкмоль, в частности от 100 пмоль до 100 нмоль. Соединение или пептид настоящего изобретения вводится млекопитающему в количестве предпочтительно от 100 нг до 1 мг, более предпочтительно от 1 мкг до 500 мкг и даже более предпочтительно от 10 мкг до 100 мкг, в частности от 20 до 40 или 30 мкг на 1 дозу. Обычно вакцина может также содержать вспомогательные вещества, например буферы, стабилизаторы и т.д.
Другой аспект настоящего изобретения касается применения пептида настоящего изобретения для производства лекарства для лечения и/или профилактики физических расстройств, связанных с ренин-активируемой ангиотензиновой системой, предпочтительно артериальной гипертензии и заболеваний, обусловленных артериальной гипертензией.
Аббревиатуры аминокислотных остатков, раскрываемых в настоящем изобретении, приводятся в соответствии с рекомендациями IUPAC (Международный союз по теоретической и прикладной химии):
Настоящее изобретение дополнительно иллюстрируется на следующих Фигурах и Примерах, но этим не ограничивается.
На фиг.1 показана иммуногенность пептидных вариантов, в которых произведена замена аминокислотного остатка в положении 1 пептида Анг II CDRVYIHPF.
На фиг.2 показана иммуногенность пептидных вариантов, в которых произведена замена аминокислотного остатка в положении 2 пептида Анг II CDRVYIHPF
На фиг.3 показана иммуногенность пептидных вариантов, в которых произведена замена аминокислотного остатка в положении 3 пептида Анг II CDRVYIHPF
На фиг.4 показана иммуногенность пептидных вариантов, в которых произведена замена аминокислотного остатка в положении 4 пептида Анг II CDRVYIHPF
На фиг.5 показана иммуногенность пептидных вариантов, в которых произведена замена аминокислотного остатка в положении 5 пептида Анг II CDRVYIHPF
На фиг.6 показана иммуногенность пептидных вариантов, в которых произведена замена аминокислотного остатка в положении 6 пептида Анг II CDRVYIHPF
На фиг.7 показана иммуногенность пептидных вариантов, в которых произведена замена аминокислотного остатка в положении 7 пептида Анг II CDRVYIHPF
На фиг.8 показана иммуногенность пептидных вариантов, в которых произведена замена аминокислотного остатка в положении 8 пептида Анг II CDRVYIHPF
На фиг.9 показана иммуногенность пептидных вариантов, в которых произведена замена двух или более аминокислотных остатков пептида Анг II CDRVYIHPF аланином
На фиг.10 показана иммуногенность пептидных вариантов, в которых произведена замена трех аминокислотных остатков в различных положениях пептида Анг II CDRVYIHPF желательными аминокислотными остатками.
На фиг.11 показана иммуногенность пептидных вариантов, в которых произведена замена от двух до четырех аминокислотных остатков в различных положениях пептида Анг II CDRVYIHPF желательными для данных положений аминокислотными остатками.
На фиг.12 показана иммуногенность укороченных вариотопов ангиотензина, в которых отсутствует первый аминокислотный остаток на N-конце.
На фиг.13 показана иммуногенность укороченных вариотопов ангиотензина, в которых отсутствуют первые два или три аминокислотных остатка на N-конце.
На каждой из Фигур по оси х приведены сыворотки животных, иммунизированных упомянутыми пептидами. По оси у отложены относительные титры антител в сыворотке. Титры антител у животных, иммунизированных Анг II, приняты за 100%. Титры определяли по разведению сыворотки, обеспечивающему полумаксимальное связывание (то есть ODmax/2). Белые столбцы показывают титры антител к пептидам, которые были использованы для вакцинации, а черные столбцы отражают титры антител к пептиду Анг II.
Примеры:
Пример 1: Позиционное сканирование пептида Анг II
Ангиотензин II (Анг II) - ключевой компонент РАС, регулирующей АД, был выбран в качестве мишени для воздействия антителами, образование которых индуцируется введением вакцины. Поэтому были идентифицированы и отобраны пептиды, которые могут индуцировать иммунный ответ, направленный против Анг II.
Под «позиционным сканированием» понимают технологию систематических замен в каждом положении в определенной области белка или пептида одних аминокислотных остатков другими. Эта технология до настоящего времени использовалась лишь в исследованиях белоко-белкового взаимодействия и пептид-белкового взаимодействия и/или для изучения функции доменов в молекулах пептидов и белков.
Технология позиционного сканирования в настоящее время превратилась в область иммунологии и применяется для идентификации вариотопов октапептида Анг II (DRVYIHPF). Цель данного примера в том, чтобы идентифицировать аминокислотные остатки для каждого положения, которые поддерживают или, по меньшей мере, не влияют на индукцию поликлонального/олигоклонального иммунного ответа, направленного против пептида Анг II.
В связи с этим на первом этапе экспериментов аминокислотный остаток в каждом положении аминокислотной последовательности Анг II систематически заменяли аминокислотным остатком со схожими или отличными свойствами (см. табл.1 для положения 2). На следующем этапе все эти пептиды были химическим путем присоединены через дополнительный N-концевой остаток цистеина к гемоцианину фиссуреллы, используемому в качестве белкового носителя, и вводили вместе с квасцами в качестве адъюванта мышам линии BALB/c. Для оценки иммуногенных свойств упомянутых пептидов сыворотку вакцинированных мышей брали на исследование. Определение титра антител к введенному пептиду (то есть варианту, или вариотопу, пептида Анг II), а также оценку связывающей способности иммунной сыворотки в отношении пептида Анг II осуществляли с помощью твердофазного иммуноферментного анализа (ELISA).
На фигурах (фиг.1-8 для положения 1-8) показаны результаты всех проведенных экспериментов. На оси х показаны сыворотки всех животных, иммунизированных указанными пептидами. На оси у показаны относительные титры индуцированных антител в сыворотке. Титры антител, образовавшихся у животных, которым вводили Анг II, приняты за 100%. Титры определяли по разведению сыворотки, при котором достигается полумаксимальное связывание [то есть ODmax/2 (OD - оптическая плотность)]. Белые столбцы указывают титры антител к пептидам, которыми животные были вакцинированы, а черные столбцы указывают титры антител к Анг II.
Хотя все исследованные пептиды, представляющие собой варианты Анг II с замененным аминокислотным остатком в положении 1, индуцировали антитела, которые связывались с введенным пептидом (фиг.1), указывая на то, что замена аминокислоты не лишало пептид иммуногенности, при иммунизации некоторыми вариантами пептидов титр антител в сыворотке был низким (это обычно были пептиды, у которых выполнена замена ароматическим аминокислотным остатком). В отличие от этих пептидов, вариант пептида, в котором аминокислотный остаток в 1-м положении Анг II был заменен аминокислотой G, вызывал иммунный ответ с титром антител, вдвое большим, чем титр антител при иммунизации Анг II. Реактивность по отношению к Анг II примерно на 50% больше при использовании указанного вариотопа. Сыворотка животных, иммунизированных вариантами пептидов, в которых в 1-м положении были введены аминокислотные остатки А, Т, Е, N, R или Н, по своей иммунной активности существенно не отличалась от сыворотки животных, иммунизированных Анг II. Ароматические или алифатические аминокислотные остатки в положении 1, такие как L, F, Y, оказались менее иммуногенными, и способность связываться с Анг II сыворотки животных, которым вводились эти варианты пептидов, была выражена слабее.
Таким образом, в положении 1 могут находиться следующие аминокислотные остатки:
- исходный аминокислотный остаток D
- аминокислотные остатки G, А
- полярные аминокислотные остатки, такие как Е, N, R, Н.
Как показано на фиг.2, использование для иммунизации пептида, в котором аминокислотный остаток в 2-м положении заменен на Р или М, повышает титр антител и реактивность в отношении Анг II. Пептиды, в которых осуществлена замена R на А или R на K, вызывают образование антител в таких же титрах, как и введение самого Анг II. Эти результаты говорят о том, что замена R в положении 2 на Р или М вызывает более сильный гуморальный иммунный ответ. А аминокислотные остатки А и K, например, обеспечивают такую же иммуногенность, как и R.
В положении 2 могут находиться следующие аминокислотные остатки:
- исходный аминокислотный остаток R
- неполярные и нейтральные аминокислотные остатки Р, М, G и А
- полярные аминокислотные остатки, такие как Е, Н, K
В положении 3 могут находиться следующие аминокислотные остатки:
- исходный аминокислотный остаток V
- аминокислотные остатки G и Н (наиболее желательно)
- неполярные и нейтральные аминокислотные остатки, такие как А
- алифатические аминокислотные остатки, такие как L
- полярные аминокислотные остатки, такие как Е, Н, K.
В положении 4 исходный аминокислотный остаток можно заменить на любой, независимо от их свойств.
Ароматические аминокислотные остатки Y и W и аминокислотный остаток Р нельзя использовать для замены исходного аминокислотного остатка в положении 5. Все другие аминокислотные остатки можно использовать для замены.
На фиг.6 показаны результаты замены исходного аминокислотного остатка Н в положении 6. При замене ароматического аминокислотного остатка Н другим, также ароматическим аминокислотным остатком, например why, иммунная сыворотка лучше связывается с Анг II, чем сыворотка, полученная вакцинацией самим Анг II. При замене аминокислотного остатка в пептиде в положении 6 неароматическим аминокислотным остатком реактивность сыворотки по отношению к Анг II значительно снижается (до 60%). Эти результаты показывают, что в положении 6 может находиться ароматическая аминокислота (но не F).
В положении 6 могут находиться следующие аминокислотные остатки:
- исходный аминокислотный остаток Н
- аминокислотные остатки, которые содержат ароматическую боковую цепь, например Y, W.
В положении 7 могут находиться следующие аминокислотные остатки:
- исходный аминокислотный остаток Р
- или аминокислотные остатки, которые содержат ароматическую боковую цепь, например F, W, Н.
В положении 8 могут находиться следующие аминокислотные остатки:
- исходный аминокислотный остаток F
- аминокислотные остатки A, L, I, V, Р, М.
Пример 2. Комбинированная замена двух или более аминокислотных остатков в аминокислотной последовательности Анг II с использованием аланина.
Чтобы проверить результаты первых экспериментов in vivo, в которых было применено позиционное сканирование, и выяснить, оказывает ли комбинированная замена аминокислотных остатков в различных положениях аддитивный эффект (если выполняются нейтральные или желательные замены) или этот эффект субтрактивный (ослабляющий) (если выполняется неоптимальная замена аминокислотных остатков) в аминокислотной последовательности Анг II заменяли два или более аминокислотных остатка. Для этого на следующем этапе экспериментов была использована аминокислота аланин (табл.2). Замена на аланин расценивается как желательная для положения 4 (фиг.4), нейтральная для положений 1, 2, 3, 5 и 8 (фиг.1-3, 5, 8 и 9). Для положений 6 и 7 замена исходных аминокислотных остатков на аланин считается менее желательной (фиг.6, 7 и 9). Поэтому можно ожидать, что варианты пептидов, содержащие аланин в положении 4 (желательная замена) в сочетании с заменой в положении 1-3, 5 и 8 (нейтральная замена) будут индуцировать образование антител с титрами, которые выше, или по крайней мере такие же как титры антител, образование которых индуцировано Анг II. Варианты пептидов, содержащие аланин в положении 1-3, 5 и 8, будут индуцировать иммунный ответ, при котором антитела связываются с Анг II не менее эффективно, чем при иммунном ответе, индуцированном самим Анг II. Можно ожидать, что варианты пептидов, в которых аминокислотные остатки в положении 6 и 7 заменены на аланин (неоптимальная замена в указанном положении), вызовут ослабленный иммунный ответ в отношении Анг II.
Все пептиды, перечисленные в табл.2, были присоединены с помощью химических реакций через N-конец к гемоцианину фиссуреллы, адсорбированному на квасцах, и введены подкожно мышам линии BALB/c. Сыворотку животных исследовали с помощью твердофазного иммуноферментного анализа и титры антител, образовавшихся в ответ на введение пептидных вариантов, сравнивали с титрами, полученными в ответ на индукцию Анг II.
Все пептидные варианты, в которых произведена замена исходных аминокислотных остатков на аланин, при введении экспериментальным животным были способны индуцировать образование антител. Это свидетельствовало о том, что замена аминокислотного остатка в них не лишала пептидные варианты иммуногенных свойств (фиг.9). Но титры антител в сыворотке, образование которых индуцировано С-DAVYIAAF, ниже по сравнению с титрами антител, образуемых при иммунизации другими антигенами. Это свидетельствует о том, что сочетанная замена аминокислотных остатков аланином менее активно влияет на иммуногенность пептидов (фиг.9).
Анализ реактивности пептидных вариантов, индуцирующих образование антител (табл.2) к Анг II, показал, что при введении следующих пептидов реактивность сыворотки по отношению к Анг II снижается: C-DRVYAAPF, C-DRVYIHAA, C-DRAAAHAF, С-DAVYIAPF, C-DAVYIAAF, C-DAVYIAAA (фиг.9). Эти результаты показали, что пептидные варианты Анг II, в которых осуществлена замена, по меньшей мере, одного аминокислотного остатка (в положении 6 или 7) на аланин (замена на аланин для этих положений нежелательная) индуцирует менее выраженную иммуногенность сыворотки по отношению к Анг II. Эти данные совпадают с результатами экспериментов по позиционному сканированию.
Замена аминокислотных остатков в аминокислотной последовательности Анг II в положении 1-5 на аланин (для этих положений замена на аланин является нейтральной или желательной) не влияет на реактивность сыворотки по отношению к Анг II. Замена аминокислотных остатков в упомянутых положениях на аланин индуцирует образование антител, титр которых выше, чем титр антител, образующихся в ответ на введение самого Анг II. Этот эффект особенно выражен при замене Y в положении 4 на аланин (фиг.9).
Исследование различных эпитопов Анг II, модифицированных заменой на аланин, которое было проведено на крысах Вистар, показало аналогичные результаты. Это говорит о том, что отмеченные выше изменения не ограничиваются только мышами, но и распространяются на другие виды животных.
Пример 3. Влияние сочетанной желательной замены аминокислотных остатков в различных положениях на выбор вариотопов ангиотензина.
В следующих экспериментах изучено влияние комбинированных замен желательных и/или нейтральных аминокислотных остатков в каждом из положений. Как видно из фиг.10 и фиг.11, аминокислотные замены в различных положениях на желательные аминокислотные остатки, подобранные в экспериментах с позиционным сканированием, приводят к образованию вариотопов, способных вызвать иммунный ответ на Анг II, который по силе сравним или превышает ответ, индуцируемый самим Анг II.
Пример 4. Укороченные варианты вариотопов без одного аминокислотного остатка.
В следующих экспериментах были изучены укороченные варианты вариотопов ангиотензина. Как видно из фиг.12 и 13, укорочение вариотопов ангиотензина (выбранных, как было описано выше) на N-конце не лишает их способности индуцировать гуморальный иммунный ответ на ангиотензин II, сопоставимый или превосходящий ответ, индуцируемый введением самого ангиотензина II.
SEQUENCE LISTING
<110> Affiris AG
<120> Vaccine
<130> R 56221
<150> AT A 1162/2009
<151> 2009-07-23
<160> 244
<170> PatentIn version 3.5
<210> 1
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa = (Xaa)m, wherein Xaa is G or D and m is 0 or 1
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Xaa = (Xaa)n, wherein Xaa is A, P, M, G or R and n is 0 or 1
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Xaa = (Xaa)o, wherein Xaa is G, A, H or V and o is 0 or 1
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa is S, A, D or Y
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa is A, D, H, S, N or I
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Xaa is A, L or F
<400> 1
Xaa Xaa Xaa Xaa Xaa His Pro Xaa
1 5
<210> 2
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa = (Xaa)m, wherein m is 0 or 1 and Xaa is G, A or D
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Xaa = (Xaa)n, wherein n is 0 or 1 and Xaa is A, P, M, G or R
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Xaa = (Xaa)o, wherein o is 0 or 1 and Xaa is G, A, H or V
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa is S, A, D or Y
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa is A, D, H, S, N or I
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Xaa is Y or H
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Xaa is A, V, L, I or F
<400> 2
Xaa Xaa Xaa Xaa Xaa Xaa Pro Xaa
1 5
<210> 3
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa is G, A or D
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Xaa is A, P, M, G or R
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Xaa is G, A, H or V
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa is S, A, D or Y
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa is A, D, H, S, N or I
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Xaa is Y or H
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Xaa is A, V, L, I or F
<400> 3
Xaa Xaa Xaa Xaa Xaa Xaa Pro Xaa
1 5
<210> 4
<211> 8
<212> PRT
<213> Homo sapiens
<400> 4
Asp Arg Val Tyr Ile His Pro Phe
1 5
<210> 5
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> Xaa is an amino acid residue selected from the group consisting
of D, G, A, T, S, Q, E, K, R and H
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Xaa is an amino acid residue selected from the group consisting
of R, P, M, G, A, S, T, N, Q, D, E, K and H
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Xaa is an amino acid residue selected from the group consisting
of V, G, H, A, L, I, N, Q, D, E, K and R
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Xaa is any amino acid residue
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Xaa is an amino acid residue other than P, F, W
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Xaa is an aromatic amino acid residue
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Xaa is an amino acid residue selected from the group
consisting of F, L, I, P, M, V, A, H, a non acidic amino
acid residue and a non basic amino acid residue
<400> 5
Xaa Xaa Xaa Xaa Xaa Xaa Pro Xaa His Leu
1 5 10
<210> 6
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 6
Gly Arg Val Tyr Ile His Pro Phe
1 5
<210> 7
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 7
Asp Pro Val Tyr Ile His Pro Phe
1 5
<210> 8
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 8
Asp Met Val Tyr Ile His Pro Phe
1 5
<210> 9
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 9
Asp Gly Val Tyr Ile His Pro Phe
1 5
<210> 10
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 10
Asp Ala Val Tyr Ile His Pro Phe
1 5
<210> 11
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 11
Asp Arg Gly Tyr Ile His Pro Phe
1 5
<210> 12
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 12
Asp Arg Ala Tyr Ile His Pro Phe
1 5
<210> 13
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 13
Asp Arg His Tyr Ile His Pro Phe
1 5
<210> 14
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 14
Asp Arg Val Ala Ile His Pro Phe
1 5
<210> 15
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 15
Asp Arg Val Ser Ile His Pro Phe
1 5
<210> 16
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 16
Asp Arg Val Asp Ile His Pro Phe
1 5
<210> 17
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 17
Asp Arg Val Tyr Ala His Pro Phe
1 5
<210> 18
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 18
Asp Arg Val Tyr Asn His Pro Phe
1 5
<210> 19
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 19
Asp Arg Val Tyr Asp His Pro Phe
1 5
<210> 20
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 20
Asp Arg Val Tyr His His Pro Phe
1 5
<210> 21
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 21
Asp Arg Val Tyr Ser His Pro Phe
1 5
<210> 22
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 22
Asp Arg Val Tyr Ile Tyr Pro Phe
1 5
<210> 23
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 23
Asp Arg Val Tyr Ile His Pro Ala
1 5
<210> 24
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 24
Asp Arg Val Tyr Ile His Pro Val
1 5
<210> 25
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 25
Asp Arg Val Tyr Ile His Pro Leu
1 5
<210> 26
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 26
Asp Arg Val Tyr Ile His Pro Ile
1 5
<210> 27
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 27
Asp Ala Ala Tyr Ile His Pro Phe
1 5
<210> 28
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 28
Asp Arg Ala Ala Ile His Pro Phe
1 5
<210> 29
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 29
Asp Arg Val Ala Ala His Pro Phe
1 5
<210> 30
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 30
Asp Arg Ala Tyr Ala His Pro Phe
1 5
<210> 31
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 31
Asp Arg Ala Ala Ala His Pro Phe
1 5
<210> 32
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 32
Ala Arg Ala Ala Ile His Pro Phe
1 5
<210> 33
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 33
Ala Arg Val Ala Ala His Pro Phe
1 5
<210> 34
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 34
Asp Ala Ala Ala Ile His Pro Phe
1 5
<210> 35
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 35
Asp Ala Ala Ala Ala His Pro Phe
1 5
<210> 36
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 36
Asp Ala Val Ala Ala His Pro Phe
1 5
<210> 37
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 37
Asp Ala Gly Tyr Ile His Pro Phe
1 5
<210> 38
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 38
Asp Ala His Tyr Ile His Pro Phe
1 5
<210> 39
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 39
Asp Pro Gly Tyr Ile His Pro Phe
1 5
<210> 40
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 40
Asp Pro Ala Tyr Ile His Pro Phe
1 5
<210> 41
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 41
Asp Met Gly Tyr Ile His Pro Phe
1 5
<210> 42
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 42
Asp Met Ala Tyr Ile His Pro Phe
1 5
<210> 43
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 43
Asp Met His Tyr Ile His Pro Phe
1 5
<210> 44
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 44
Asp Gly Gly Tyr Ile His Pro Phe
1 5
<210> 45
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 45
Asp Gly Ala Tyr Ile His Pro Phe
1 5
<210> 46
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 46
Asp Gly His Tyr Ile His Pro Phe
1 5
<210> 47
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 47
Asp Pro Val Ala Ile His Pro Phe
1 5
<210> 48
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 48
Asp Pro Val Ser Ile His Pro Phe
1 5
<210> 49
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 49
Asp Met Val Ala Ile His Pro Phe
1 5
<210> 50
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 50
Asp Met Val Ser Ile His Pro Phe
1 5
<210> 51
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 51
Asp Arg Gly Ala Ile His Pro Phe
1 5
<210> 52
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 52
Asp Arg His Ala Ile His Pro Phe
1 5
<210> 53
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 53
Asp Arg Gly Tyr Ala His Pro Phe
1 5
<210> 54
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 54
Asp Arg Gly Tyr Asp His Pro Phe
1 5
<210> 55
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 55
Asp Arg Gly Tyr His His Pro Phe
1 5
<210> 56
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 56
Asp Arg Gly Tyr Ser His Pro Phe
1 5
<210> 57
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 57
Asp Arg Gly Tyr Asn His Pro Phe
1 5
<210> 58
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 58
Asp Arg Ala Tyr Asp His Pro Phe
1 5
<210> 59
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 59
Asp Arg Ala Tyr His His Pro Phe
1 5
<210> 60
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 60
Asp Arg Ala Tyr Ser His Pro Phe
1 5
<210> 61
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 61
Asp Arg Ala Tyr Asn His Pro Phe
1 5
<210> 62
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 62
Asp Arg His Tyr Ala His Pro Phe
1 5
<210> 63
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 63
Asp Arg His Tyr Ser His Pro Phe
1 5
<210> 64
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 64
Asp Arg His Tyr Asn His Pro Phe
1 5
<210> 65
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 65
Asp Arg His Tyr Asp His Pro Phe
1 5
<210> 66
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 66
Asp Arg His Tyr His His Pro Phe
1 5
<210> 67
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 67
Asp Arg His Tyr Ile Tyr Pro Phe
1 5
<210> 68
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 68
Asp Arg Gly Ala Asp His Pro Phe
1 5
<210> 69
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 69
Asp Arg Gly Ala His His Pro Phe
1 5
<210> 70
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 70
Asp Arg Val Ala His His Pro Phe
1 5
<210> 71
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 71
Asp Arg His Ala Asp His Pro Phe
1 5
<210> 72
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 72
Gly Arg Gly Ala Ile His Pro Phe
1 5
<210> 73
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 73
Gly Arg His Ser Ile His Pro Phe
1 5
<210> 74
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 74
Gly Arg His Ala Asp Tyr Pro Phe
1 5
<210> 75
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 75
Asp Pro Gly Ala Ile His Pro Phe
1 5
<210> 76
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 76
Gly Arg His Ala Ile His Pro Phe
1 5
<210> 77
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 77
Asp Pro Gly Ser Ile His Pro Phe
1 5
<210> 78
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 78
Asp Met Gly Ala Ile His Pro Phe
1 5
<210> 79
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 79
Asp Met Gly Ser Ile His Pro Phe
1 5
<210> 80
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 80
Gly Pro Gly Tyr Ile His Pro Phe
1 5
<210> 81
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 81
Gly Met Gly Tyr Ile His Pro Phe
1 5
<210> 82
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 82
Gly Pro Gly Ser Ile His Pro Phe
1 5
<210> 83
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 83
Gly Met Gly Ser Ile His Pro Phe
1 5
<210> 84
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 84
Asp Arg Gly Ser Ile His Pro Phe
1 5
<210> 85
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 85
Asp Pro His Ala Ile His Pro Phe
1 5
<210> 86
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 86
Asp Met His Ala Ile His Pro Phe
1 5
<210> 87
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 87
Gly Pro His Ala Ile His Pro Phe
1 5
<210> 88
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 88
Gly Met His Ala Ile His Pro Phe
1 5
<210> 89
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 89
Gly Pro His Ser Ile His Pro Phe
1 5
<210> 90
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 90
Gly Met His Ser Ile His Pro Phe
1 5
<210> 91
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 91
Pro Val Tyr Ile His Pro Phe
1 5
<210> 92
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 92
Met Val Tyr Ile His Pro Phe
1 5
<210> 93
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 93
Gly Val Tyr Ile His Pro Phe
1 5
<210> 94
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 94
Ala Val Tyr Ile His Pro Phe
1 5
<210> 95
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 95
Arg Gly Tyr Ile His Pro Phe
1 5
<210> 96
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 96
Arg Ala Tyr Ile His Pro Phe
1 5
<210> 97
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 97
Arg His Tyr Ile His Pro Phe
1 5
<210> 98
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 98
Arg Val Ala Ile His Pro Phe
1 5
<210> 99
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 99
Arg Val Ser Ile His Pro Phe
1 5
<210> 100
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 100
Arg Val Asp Ile His Pro Phe
1 5
<210> 101
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 101
Arg Val Tyr Ala His Pro Phe
1 5
<210> 102
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 102
Arg Val Tyr Asn His Pro Phe
1 5
<210> 103
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 103
Arg Val Tyr Asp His Pro Phe
1 5
<210> 104
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 104
Arg Val Tyr His His Pro Phe
1 5
<210> 105
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 105
Arg Val Tyr Ser His Pro Phe
1 5
<210> 106
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 106
Arg Val Tyr Ile Tyr Pro Phe
1 5
<210> 107
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 107
Arg Val Tyr Ile His Pro Ala
1 5
<210> 108
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 108
Arg Val Tyr Ile His Pro Val
1 5
<210> 109
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 109
Arg Val Tyr Ile His Pro Leu
1 5
<210> 110
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 110
Arg Val Tyr Ile His Pro Ile
1 5
<210> 111
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 111
Ala Ala Tyr Ile His Pro Phe
1 5
<210> 112
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 112
Arg Ala Ala Ile His Pro Phe
1 5
<210> 113
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 113
Arg Val Ala Ala His Pro Phe
1 5
<210> 114
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 114
Arg Ala Tyr Ala His Pro Phe
1 5
<210> 115
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 115
Arg Ala Ala Ala His Pro Phe
1 5
<210> 116
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 116
Arg Ala Ala Ile His Pro Phe
1 5
<210> 117
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 117
Arg Val Ala Ala His Pro Phe
1 5
<210> 118
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 118
Ala Ala Ala Ile His Pro Phe
1 5
<210> 119
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 119
Ala Ala Ala Ala His Pro Phe
1 5
<210> 120
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 120
Ala Val Ala Ala His Pro Phe
1 5
<210> 121
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 121
Ala Gly Tyr Ile His Pro Phe
1 5
<210> 122
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 122
Ala His Tyr Ile His Pro Phe
1 5
<210> 123
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 123
Pro Gly Tyr Ile His Pro Phe
1 5
<210> 124
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 124
Pro Ala Tyr Ile His Pro Phe
1 5
<210> 125
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 125
Met Gly Tyr Ile His Pro Phe
1 5
<210> 126
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 126
Met Ala Tyr Ile His Pro Phe
1 5
<210> 127
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 127
Met His Tyr Ile His Pro Phe
1 5
<210> 128
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 128
Gly Gly Tyr Ile His Pro Phe
1 5
<210> 129
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 129
Gly Ala Tyr Ile His Pro Phe
1 5
<210> 130
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 130
Gly His Tyr Ile His Pro Phe
1 5
<210> 131
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 131
Pro Val Ala Ile His Pro Phe
1 5
<210> 132
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 132
Pro Val Ser Ile His Pro Phe
1 5
<210> 133
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 133
Met Val Ala Ile His Pro Phe
1 5
<210> 134
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 134
Met Val Ser Ile His Pro Phe
1 5
<210> 135
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 135
Arg Gly Ala Ile His Pro Phe
1 5
<210> 136
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 136
Arg His Ala Ile His Pro Phe
1 5
<210> 137
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 137
Arg Gly Tyr Ala His Pro Phe
1 5
<210> 138
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 138
Arg Gly Tyr Asp His Pro Phe
1 5
<210> 139
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 139
Arg Gly Tyr His His Pro Phe
1 5
<210> 140
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 140
Arg Gly Tyr Ser His Pro Phe
1 5
<210> 141
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 141
Arg Gly Tyr Asn His Pro Phe
1 5
<210> 142
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 142
Arg Ala Tyr Asp His Pro Phe
1 5
<210> 143
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 143
Arg Ala Tyr His His Pro Phe
1 5
<210> 144
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 144
Arg Ala Tyr Ser His Pro Phe
1 5
<210> 145
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 145
Arg Ala Tyr Asn His Pro Phe
1 5
<210> 146
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 146
Arg His Tyr Ala His Pro Phe
1 5
<210> 147
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 147
Arg His Tyr Ser His Pro Phe
1 5
<210> 148
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 148
Arg His Tyr Asn His Pro Phe
1 5
<210> 149
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 149
Arg His Tyr Asp His Pro Phe
1 5
<210> 150
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 150
Arg His Tyr His His Pro Phe
1 5
<210> 151
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 151
Arg His Tyr Ile Tyr Pro Phe
1 5
<210> 152
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 152
Arg Gly Ala Asp His Pro Phe
1 5
<210> 153
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 153
Arg Gly Ala His His Pro Phe
1 5
<210> 154
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 154
Arg Val Ala His His Pro Phe
1 5
<210> 155
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 155
Arg His Ala Asp His Pro Phe
1 5
<210> 156
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 156
Arg Gly Ala Ile His Pro Phe
1 5
<210> 157
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 157
Arg His Ser Ile His Pro Phe
1 5
<210> 158
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 158
Arg His Ala Asp Tyr Pro Phe
1 5
<210> 159
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 159
Pro Gly Ala Ile His Pro Phe
1 5
<210> 160
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 160
Arg His Ala Ile His Pro Phe
1 5
<210> 161
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 161
Pro Gly Ser Ile His Pro Phe
1 5
<210> 162
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 162
Met Gly Ala Ile His Pro Phe
1 5
<210> 163
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 163
Met Gly Ser Ile His Pro Phe
1 5
<210> 164
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 164
Pro Gly Tyr Ile His Pro Phe
1 5
<210> 165
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 165
Met Gly Tyr Ile His Pro Phe
1 5
<210> 166
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 166
Arg Gly Ser Ile His Pro Phe
1 5
<210> 167
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 167
Pro His Ala Ile His Pro Phe
1 5
<210> 168
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 168
Met His Ala Ile His Pro Phe
1 5
<210> 169
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 169
Pro His Ser Ile His Pro Phe
1 5
<210> 170
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 170
Met His Ser Ile His Pro Phe
1 5
<210> 171
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 171
Gly Tyr Ile His Pro Phe
1 5
<210> 172
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 172
Ala Tyr Ile His Pro Phe
1 5
<210> 173
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 173
His Tyr Ile His Pro Phe
1 5
<210> 174
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 174
Val Ala Ile His Pro Phe
1 5
<210> 175
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 175
Val Asp Ile His Pro Phe
1 5
<210> 176
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 176
Val Tyr Ala His Pro Phe
1 5
<210> 177
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 177
Val Tyr Asn His Pro Phe
1 5
<210> 178
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 178
Val Tyr Asp His Pro Phe
1 5
<210> 179
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 179
Val Tyr His His Pro Phe
1 5
<210> 180
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 180
Val Tyr Ser His Pro Phe
1 5
<210> 181
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 181
Val Tyr Ile Tyr Pro Phe
1 5
<210> 182
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 182
Val Tyr Ile His Pro Ala
1 5
<210> 183
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 183
Val Tyr Ile His Pro Val
1 5
<210> 184
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 184
Val Tyr Ile His Pro Leu
1 5
<210> 185
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 185
Val Tyr Ile His Pro Ile
1 5
<210> 186
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 186
Ala Ala Ile His Pro Phe
1 5
<210> 187
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 187
Val Ala Ala His Pro Phe
1 5
<210> 188
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 188
Ala Tyr Ala His Pro Phe
1 5
<210> 189
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 189
Ala Ala Ala His Pro Phe
1 5
<210> 190
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 190
His Tyr Ile His Pro Phe
1 5
<210> 191
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 191
Val Ser Ile His Pro Phe
1 5
<210> 192
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 192
Gly Ala Ile His Pro Phe
1 5
<210> 193
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 193
His Ala Ile His Pro Phe
1 5
<210> 194
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 194
Gly Tyr Ala His Pro Phe
1 5
<210> 195
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 195
Gly Tyr Asp His Pro Phe
1 5
<210> 196
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 196
Gly Tyr His His Pro Phe
1 5
<210> 197
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 197
Gly Tyr Ser His Pro Phe
1 5
<210> 198
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 198
Gly Tyr Asn His Pro Phe
1 5
<210> 199
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 199
Ala Tyr Asp His Pro Phe
1 5
<210> 200
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 200
Ala Tyr His His Pro Phe
1 5
<210> 201
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 201
Ala Tyr Ser His Pro Phe
1 5
<210> 202
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 202
Ala Tyr Asn His Pro Phe
1 5
<210> 203
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 203
His Tyr Ala His Pro Phe
1 5
<210> 204
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 204
His Tyr Ser His Pro Phe
1 5
<210> 205
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 205
His Tyr Asn His Pro Phe
1 5
<210> 206
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 206
His Tyr Asp His Pro Phe
1 5
<210> 207
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 207
His Tyr His His Pro Phe
1 5
<210> 208
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 208
His Tyr Ile Tyr Pro Phe
1 5
<210> 209
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 209
Gly Ala Asp His Pro Phe
1 5
<210> 210
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 210
Gly Ala His His Pro Phe
1 5
<210> 211
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 211
Val Ala His His Pro Phe
1 5
<210> 212
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 212
His Ala Asp His Pro Phe
1 5
<210> 213
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 213
Gly Ala Ile His Pro Phe
1 5
<210> 214
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 214
His Ser Ile His Pro Phe
1 5
<210> 215
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 215
His Ala Asp Tyr Pro Phe
1 5
<210> 216
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 216
Gly Ser Ile His Pro Phe
1 5
<210> 217
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 217
His Ala Ile His Pro Phe
1 5
<210> 218
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 218
Ala Ile His Pro Phe
1 5
<210> 219
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 219
Ser Ile His Pro Phe
1 5
<210> 220
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 220
Asp Ile His Pro Phe
1 5
<210> 221
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 221
Tyr Ala His Pro Phe
1 5
<210> 222
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 222
Tyr Asn His Pro Phe
1 5
<210> 223
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 223
Tyr Asp His Pro Phe
1 5
<210> 224
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 224
Tyr His His Pro Phe
1 5
<210> 225
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 225
Tyr Ser His Pro Phe
1 5
<210> 226
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 226
Tyr Ile Tyr Pro Phe
1 5
<210> 227
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 227
Tyr Ile His Pro Ala
1 5
<210> 228
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 228
Tyr Ile His Pro Val
1 5
<210> 229
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 229
Tyr Ile His Pro Leu
1 5
<210> 230
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 230
Tyr Ile His Pro Ile
1 5
<210> 231
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 231
Ala Ala His Pro Phe
1 5
<210> 232
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 232
Ala Asp His Pro Phe
1 5
<210> 233
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 233
Ala His His Pro Phe
1 5
<210> 234
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 234
Ala Asp Tyr Pro Phe
1 5
<210> 235
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 235
Cys Asp Arg Val Tyr Ile His Pro Phe
1 5
<210> 236
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 236
Cys Asp Ala Val Tyr Ile His Pro Phe
1 5
<210> 237
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 237
Cys Asp Glu Val Tyr Ile His Pro Phe
1 5
<210> 238
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 238
Cys Asp Phe Val Tyr Ile His Pro Phe
1 5
<210> 239
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 239
Cys Asp His Val Tyr Ile His Pro Phe
1 5
<210> 240
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 240
Cys Asp Lys Val Tyr Ile His Pro Phe
1 5
<210> 241
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 241
Cys Asp Met Val Tyr Ile His Pro Phe
1 5
<210> 242
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 242
Cys Asp Val Val Tyr Ile His Pro Phe
1 5
<210> 243
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 243
Cys Asp Tyr Val Tyr Ile His Pro Phe
1 5
<210> 244
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 244
Cys Asp Pro Val Tyr Ile His Pro Phe
1 5
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, НАРУШЕНИЙ ИЛИ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С МУТАНТНЫМ р53 | 2017 |
|
RU2762089C2 |
| АНТИТЕЛА К C10ORF54 И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2819627C1 |
| IL-17A-связывающие полипептиды | 2016 |
|
RU2749712C2 |
| АФФИМЕРЫ, СВЯЗЫВАЮЩИЕСЯ С НЕОНАТАЛЬНЫМ FC РЕЦЕПТОРОМ | 2020 |
|
RU2817008C1 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) С АНТИГЕНСВЯЗЫВАЮЩИМИ ДОМЕНАМИ К КОНСТАНТНОЙ ОБЛАСТИ β Т-КЛЕТОЧНОГО РЕЦЕПТОРА | 2015 |
|
RU2830064C2 |
| Фармацевтическая композиция, содержащая инсулин и глюкагон | 2019 |
|
RU2823246C2 |
| АНТИ-PVRIG АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732042C2 |
| АНТИ-PVRIG АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2827926C2 |
| РЕКРУТИРУЮЩИЕ Т-КЛЕТКИ ПОЛИПЕПТИДЫ, СПОСОБНЫЕ СВЯЗЫВАТЬ CD123 И TCR АЛЬФА/БЕТА | 2017 |
|
RU2775063C2 |
| Новые эндолизины гарднереллы и их применение | 2020 |
|
RU2820886C2 |




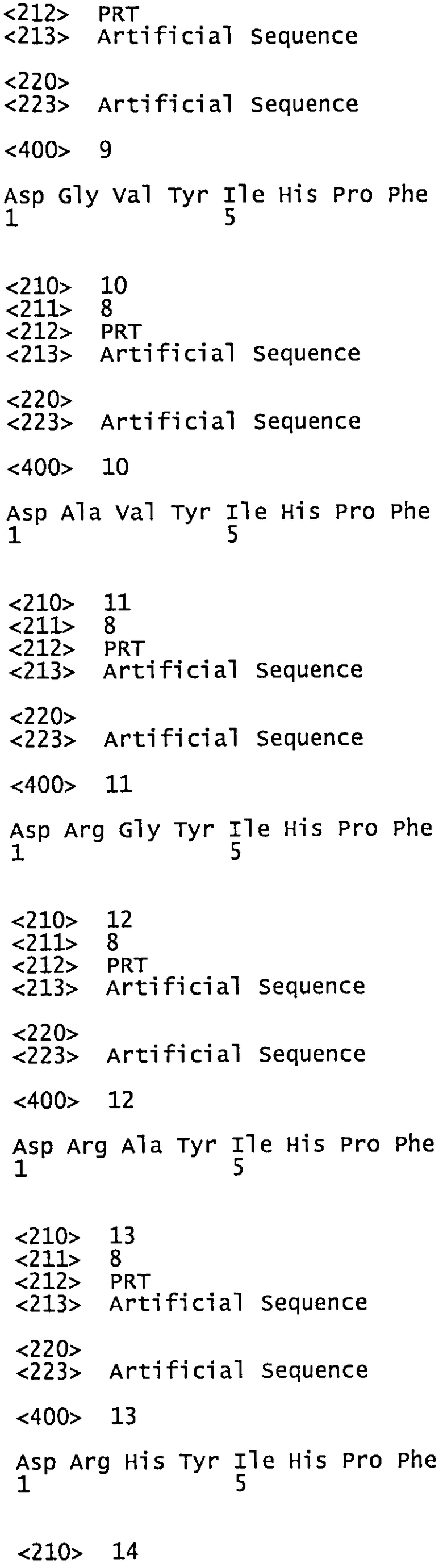





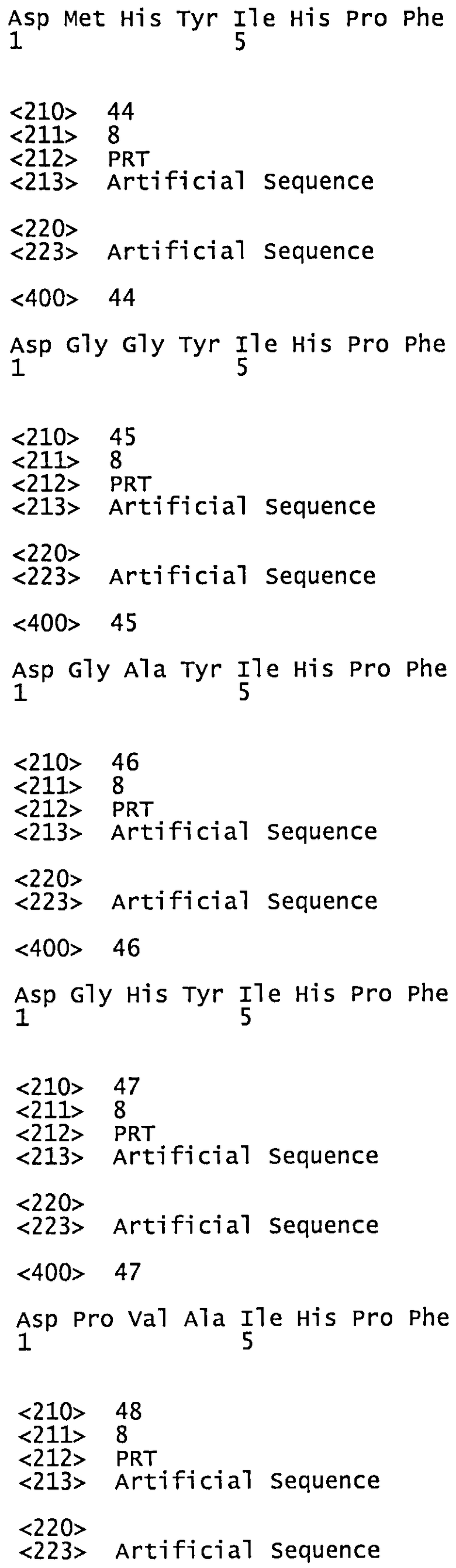








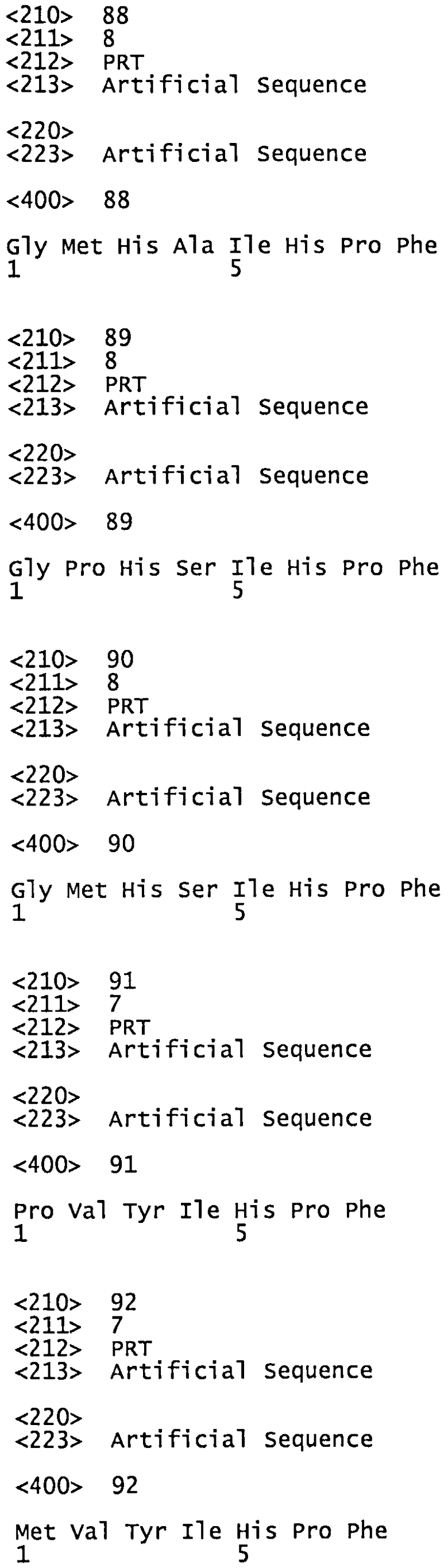




























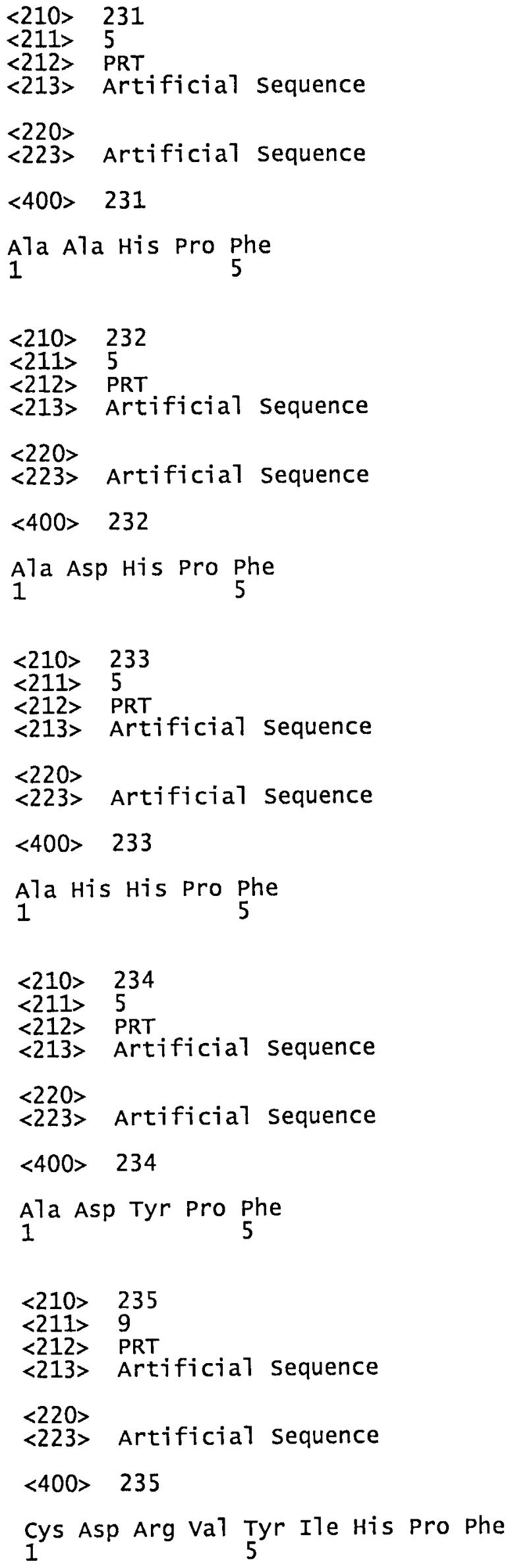



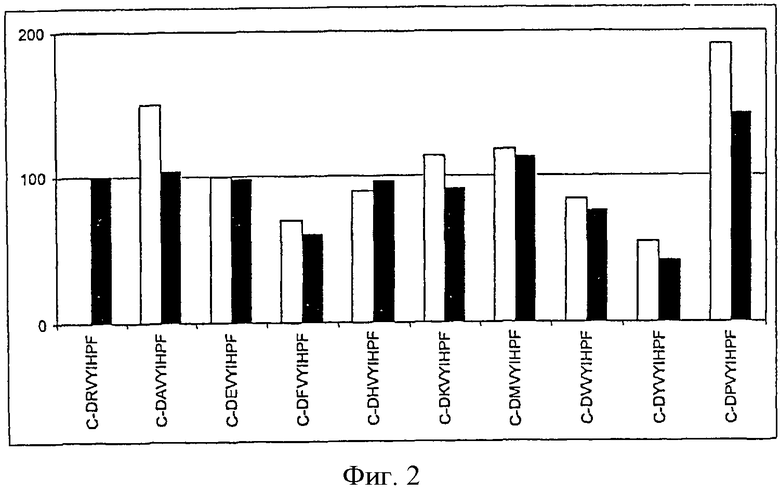
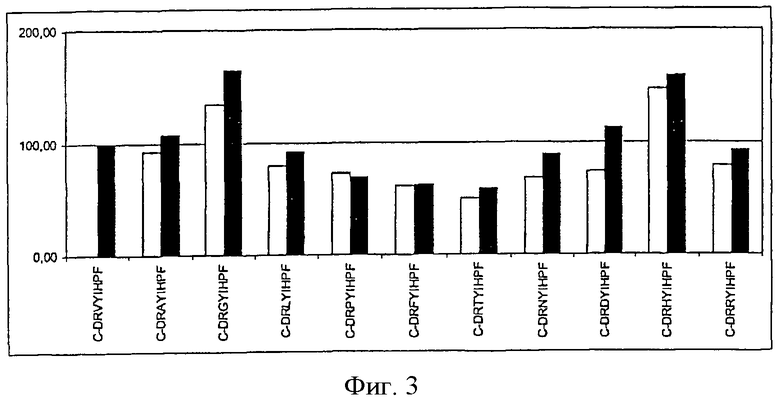
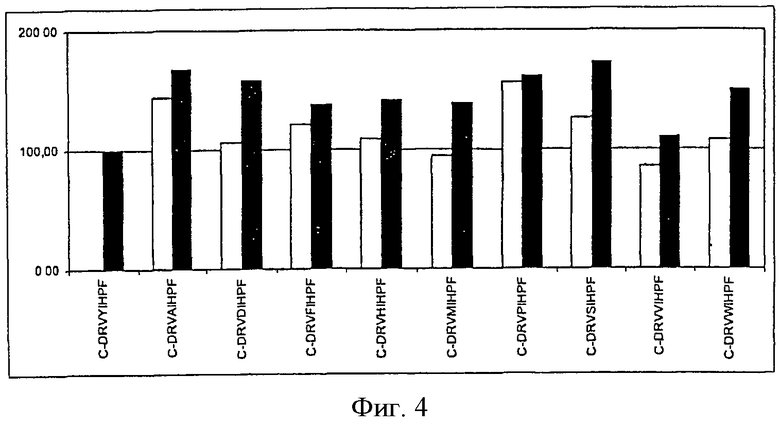
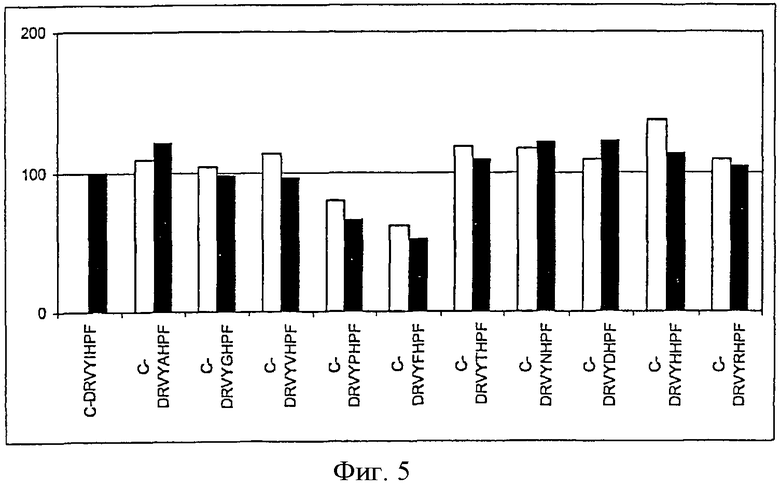
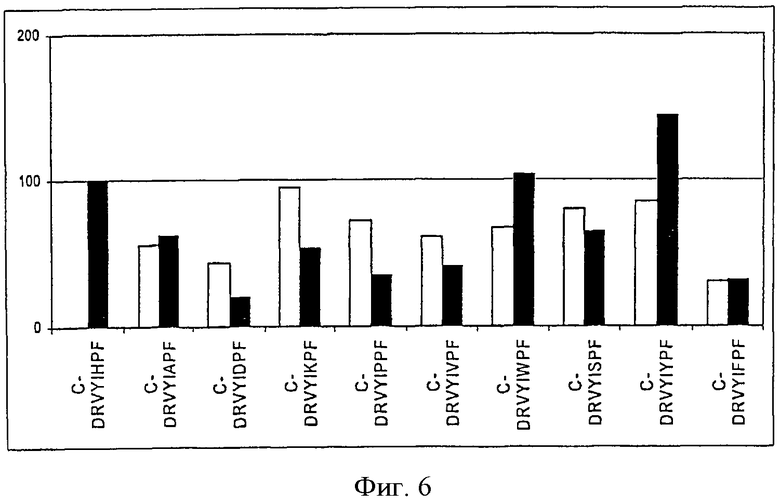
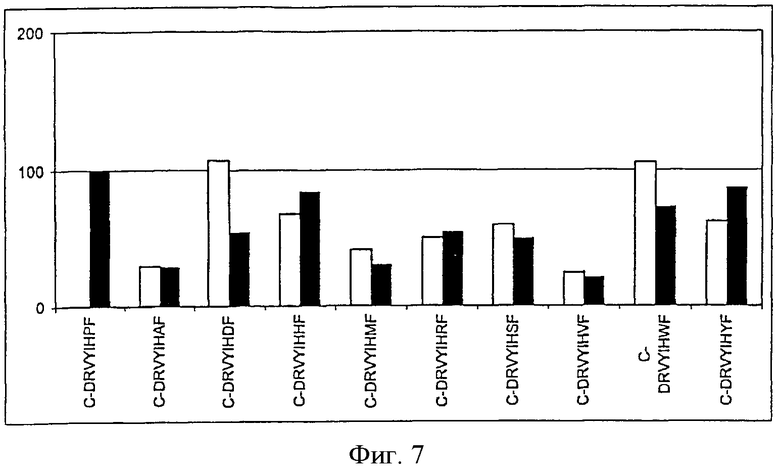
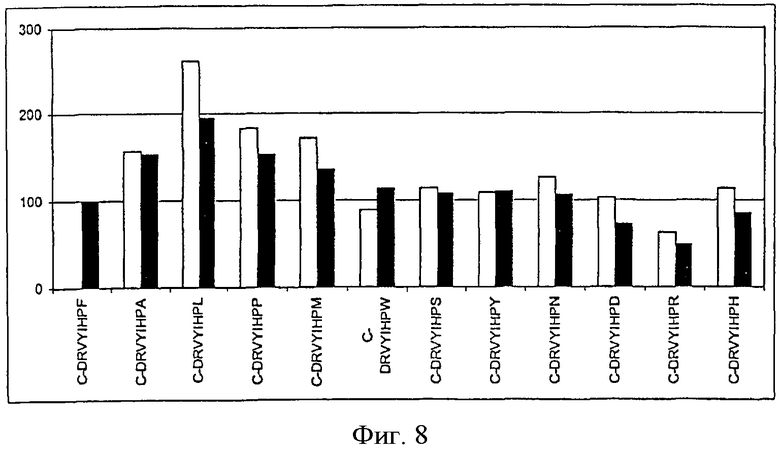
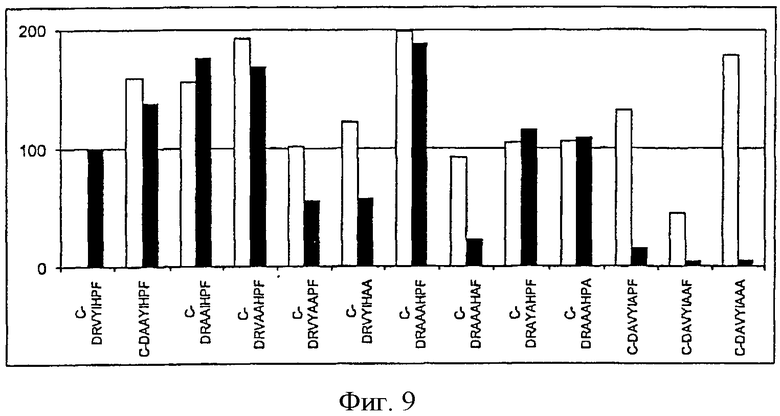
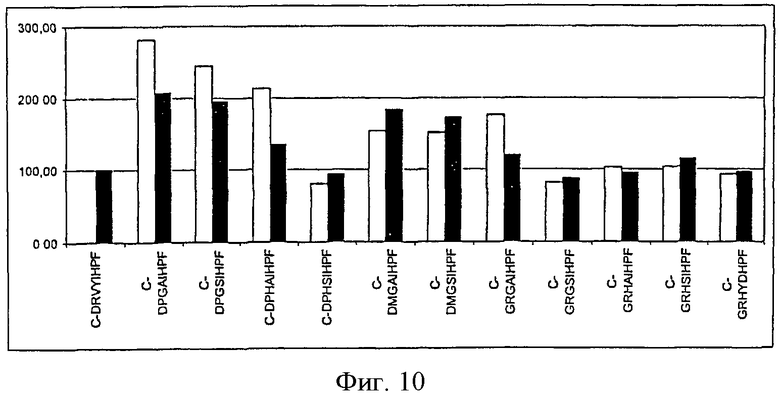
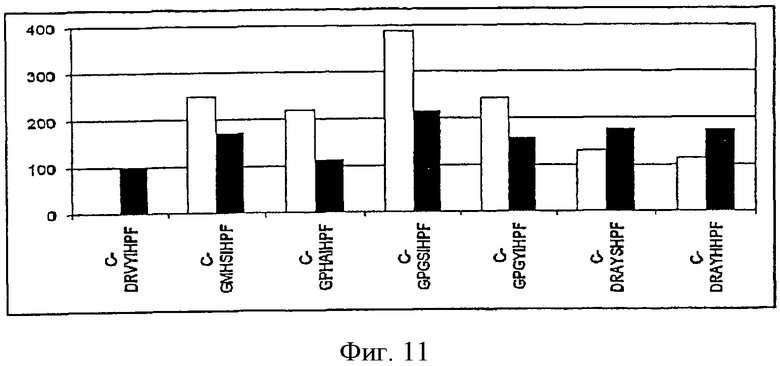
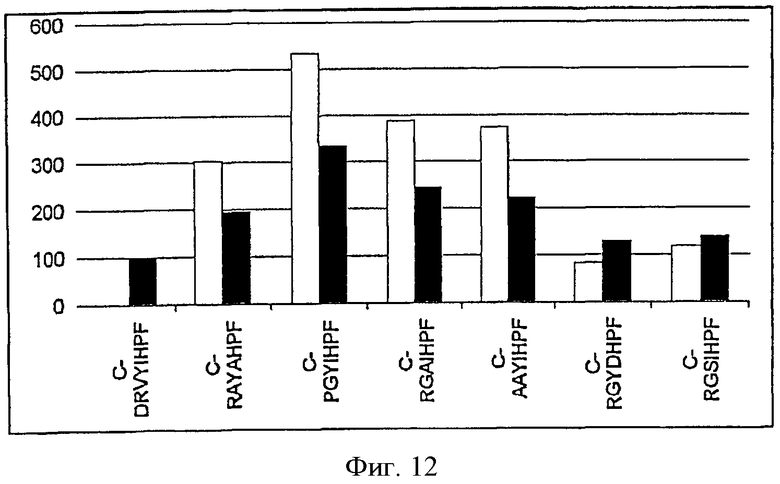
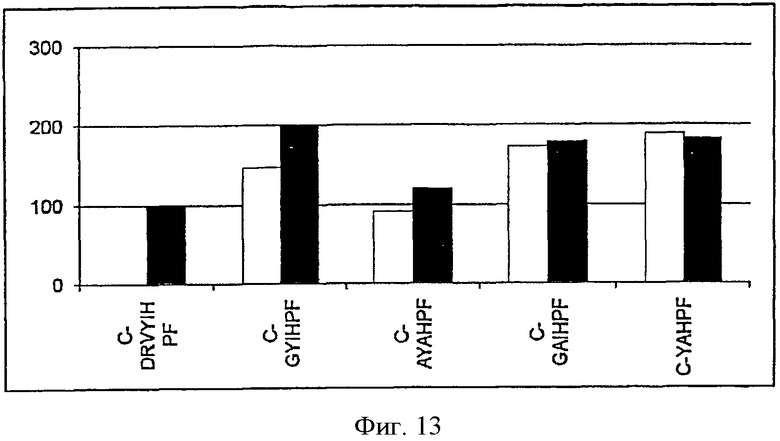
Представлена вакцина, включающая пептид, присоединенный к фармацевтически приемлемому носителю, не являющийся ангеотензином II и имеющий аминокислотную последовательность формулы (X1)m(X2)n(X3)oX4X5HPX6, где X1 представляет собой G или D, Х2 представляет собой А, Р, М, G или R; Х3 представляет собой G, А, Н или V; Х4 представляет собой S, А, D или Y; Х5 представляет собой А, D, Н, S, N или I; Х6 представляет собой A, L или F, где m, n и о независимо друг от друга равны 0 или 1 при условии, что, когда о равно 0, то и m и n равны 0, и когда n равно 0, то и m равно 0, и где пептид не является пептидом DRVYIHPF. Охарактеризовано также применение такого пептида для производства вакцины. Представленные изобретения могут быть использованы для лечения и/или профилактики физических расстройств, связанных с ренин-активируемой ангиотензиновой системой. 2 н. и 6 з.п. ф-лы, 13 ил., 2 табл., 4 пр.
1. Вакцина, включающая пептид, связанный с фармацевтически приемлемым носителем, с аминокислотной последовательностью, описываемой формулой

для лечения и/или профилактики физического расстройства, связанного с ренин-активируемой ангиотензиновой системой, где
X1 представляет собой G или D,
X2 представляет собой A, P, M, G или R,
X3 представляет собой G, A, H или V,
X4 представляет собой S, A, D или Y,
X5 представляет собой A, D, H, S, N или I,
X6 представляет собой A, L или F,
где m, n и o независимо друг от друга равны 0 или 1 при условии, что когда o равно 0, m и n равны 0, и когда n равно 0, m равно 0,
где формула I отличается от аминокислотной последовательности ангиотензина II (DRVYIHPF), по меньшей мере, на один аминокислотный остаток более предпочтительно, по меньшей мере, на два и максимум на семь аминокислотных остатков, более предпочтительно, максимум на шесть аминокислотных остатков, более предпочтительно, максимум на пять, более предпочтительно, максимум на четыре и даже более предпочтительно, максимум на три аминокислотных остатка, где пептид выбирается из группы, включающей: DRAYAHPF, RAYAHPF, DPGYIHPF, PGYIHPF, DPVYIHPF, DAVYIHPF, DAAYIHPF, AAYIHPF, DRHYIHPF, DAHYIHPF, GRVYIHPF, DMVYIHPF, DRAYIHPF, DRGYIHPF, DRVAIHPF, DRVDIHPF, DRVSIHPF, DRVYAHPF, DRVYNHPF, DRVYDHPF, DRVYHHPF, DRVYIHPA, DRVYIHPL, DRAAIHPF, DRVAAHPF, DRAAAHPF, DPGAIHPF, DPGSIHPF, DPHAIHPF, DMGAIHPF, DMGSIHPF, GRGAIHPF, GRHSIHPF, DRVYIHPF, GMHSIHPF, GPHAIHPF, GPGSIHPF, GPGYIHPF, DRAYSHPF, DRAYHHPF, RGAIHPF, RGYDHPF, RGSIHPF, DRVYIH, GYIHPF, AYAHPF, GAIHPF, YAHPF.
2. Вакцина по п.1, отличающаяся тем, что пептид выбирается из группы, включающей GRVYIHPF, DAAYIHPF, DRAAIHPF, DRAYAHPF, DPGYIHPF, RAYAHPF, PGYIHPF.
3. Вакцина по п.1, отличающаяся тем, что, по меньшей мере, один цистеиновый остаток присоединен к N-концу аминокислотной последовательности, соответствующей Формуле I.
4. Вакцина по п.1, отличающаяся тем, что носитель представляет собой белковый носитель.
5. Вакцина по п.4, отличающаяся тем, что белковый носитель выбирается из группы, включающей гемоцианин фиссуреллы, столбнячный анатоксин и дифтерийный токсин.
6. Вакцина по п.1, отличающаяся тем, что соединение смешивается с адъювантом, предпочтительно адсорбируется на квасцах.
7. Вакцина по любому одному из пп.1-6, отличающаяся тем, что физическое расстройство, связанное с ренин-активируемой ангиотензиновой системой, выбирается из группы, включающей артериальную гипертензию, инсульт, инфаркт миокарда, почечную недостаточность, застойную сердечную недостаточность, атеросклероз, поражение сосудов, кровоизлияние в сетчатку и аутоиммунные заболевания, особенно рассеянный склероз.
8. Применение пептида по любому одному из пп.1-6, для производства вакцины для лечения и/или профилактики физических расстройств, связанных с ренин-активируемой ангиотензиновой системой, предпочтительно артериальной гипертензии и связанных с артериальной гипертензией заболеваний.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| PATRIK MAURER et al., Immunization against angiotensins for the treatment of hypertension, Clinical Immunology 2009 3 April, Vol.134, No.1, p.p.89-95 | |||
| КОНЪЮГАТ АНГИОТЕНЗИНОВОЙ ПЕПТИДНОЙ СОСТАВЛЯЮЩЕЙ С НОСИТЕЛЕМ, КОМПОЗИЦИЯ ВАКЦИНЫ, СПОСОБ ИММУНИЗАЦИИ ЖИВОТНОГО И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ФИЗИЧЕСКОГО НАРУШЕНИЯ, АССОЦИИРОВАННОГО С АКТИВИРУЕМОЙ РЕНИНОМ АНГИОТЕНЗИНОВОЙ СИСТЕМОЙ | 2002 |
|
RU2350622C2 |
| ВАКЦИНА ПРОТИВ ГИПЕРТОНИИ | 2004 |
|
RU2259847C1 |
Авторы
Даты
2014-12-10—Публикация
2010-07-23—Подача