Изобретение относится к материалам на основе оксидных ванадиевых соединений и может быть использовано в качестве ионоселективного материала для определения ионов аммония в растворах.
В настоящее время для количественного определения ионов 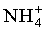
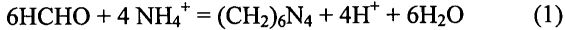
При этом выделяется минеральная кислота в количестве, эквивалентном находящимся в пробе аммонийным солям. Далее титрованием раствором гидроксида натрия NaOH определяют количество освободившейся при этом кислоты и эквивалентное ей количество азота. Определение 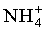
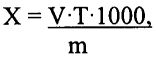
где V - количество раствора гидроксида натрия NaOH, пошедшее на титрование, мл;
T - предварительно установленный по стандартному образцу титр раствора гидроксида натрия;
m - навеска исследуемого вещества, г.
Недостатком известного способа является необходимость соблюдения нейтральности раствора, т.к. содержание ионов аммония определяют титриметрически по количеству кислоты, выделяющейся согласно реакции (1). Вследствие чего затруднено определение ионов аммония в образцах, слабо и/или практически нерастворимых в воде, но растворимых в кислой или щелочной среде. Кроме того, перед каждым определением ионов аммония необходимо проверять титр раствора гидроксида натрия по фенолфталеину.
На сегодняшний день наиболее распространенным способом определения ионов аммония является способ фотометрического определения с использованием реактива Несслера, основанный на образовании оранжевого раствора при взаимодействии солей аммония с реактивом Несслера (Коростелев П.П. Фотометрический и комплексометрический анализ в металлургии. М.: Металлургия. 1984. 179 с.). По оптической плотности раствора, измеренной фотоколориметрическим методом, пропорциональной интенсивности окраски анализируемого раствора судят о количественном содержании ионов аммония.
Недостатком известного способа определения является использование высокотоксичного реактива Несслера, представляющего собой щелочной водный раствор дигидрата тетраиодомеркурата(II) калия состава K2Hgl4(H2O)2. Реактив Несслера содержит ртуть, поэтому он ядовит. Кроме того, следует соблюдать определенные условия его хранения (темная склянка с притертой пробкой, холодное место). Известный способ не позволяет определять ионы аммония с большой точностью при повышенном содержании в исследуемом растворе ионов Mg, Ca, Fe и ряда других, так как образующийся с аммонием цветной коллоидный комплекс становится неустойчивым. Мешающие ионы вызывают его коагуляцию, вследствие чего происходит помутнение раствора, изменяется его оптическая плотность. Определению ионов аммония с реактивом Несслера мешает присутствие в исследуемом растворе аминов, хлораминов, ацетона, альдегидов, сульфидов, реагирующих с реактивом Несслера.
Наиболее близким по назначению к заявленному является способ определения ионов аммония с использованием ионоселективного электрода (патент US 2010/0290951, МПК C07 K/54, C07D 273/00, 2010), изготовленного с использованием ионофора 11-меркапто-N-(9,15,18-триизопропил-6,12-диметил-2,5,8,11,14,17-гексаоксо-1,7,13-триокса-4,10,16-триазациклооктадекан-3-ил)бутил) ундеканамида в поливинилхлоридной матрице (ионофор - органическое вещество, осуществляющее перенос катионов 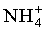
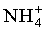
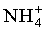
Недостатком известного способа является узкий рабочий интервал определения концентраций ионов аммония 10-2-10-1 M. Кроме того известный ионоселективный материал умеренно селективен по отношению к ионам Na+ (K=5.9·10-2) и К+(K=6.8·10-3). Данные по селективности к другим катионам не известны. Принцип работы известного ионофора как ионоселективного материала основан на процессе комплексообразования с ионом аммония. Для обеспечения достаточной скорости процесса комплексообразования в качестве электролита используется тетрабутиламмоний бромид или тетраэтиламмоний хлорид, что влияет на точность определения указанного иона, так как аммонийная группировка входит в состав указанных электролитов. Кроме того, электрод с известным ионоселективным материалом преимущественно может быть использован только в нейтральной области кислотности (pH 6).
Известна гидратированная оксидная ванадиевая бронза аммония состава (NH4)0.5V2O5·0.9H2O (P.N. Trikalitis, V. Petkov, M. G. Kanatzidis, Chem. Mater. 2003. V. 15. P. 3337-3342). Для получения известной ванадиевой бронзы 6.67 мМ ксерогеля V2O5·nH2O (1 г), растворенного в 50 мл ацетонитрила, смешивают в атмосфере азота в течение 4 часов со стехиометрическим количеством иодида аммония NH4I. Затем осадок промывают ацетонитрилом и сушат в вакууме. В результате образуется темно-синий продукт состава (NH4)0,5V2O5·0,9H2O, кристаллизующийся в моноклинной сингонии с параметрами элементарной ячейки a=11.845 Å, b, b=3.677(1) Å, c=9.058 Å, β=88.635°. Частицы (NH4)0,5V2O5·0,9H2O имеют морфологию нанолент шириной 10 нм и длиной несколько микрон. В настоящее время не известно какое-либо использование гидратированной оксидной ванадиевой бронзы аммония.
Синтез известного соединения происходит в результате топотактической (топотактическая реакция - это твердофазная реакция, в которой упаковка атомов в кристалле реагента остается в значительной степени неизменной в ходе течения реакции) гетерогенной окислительно-восстановительной реакции, в которой восстановление ионов V5+ до V4+ происходит за счет окисления ионов I- до I0. Недостатком известного способа получения является использование очень слабого восстановителя иодида аммония NH4I, что приводит к значительному увеличению времени реакции и требует дополнительного перемешивания, перетирания реакционной массы в процессе синтеза для получения продукта со 100% выходом.
Таким образом, перед авторами стояла задача получить ионоселективный материал для определения ионов аммония в растворе, позволяющий просто и надежно определять концентрацию  в растворе. Причем предлагаемый материал должен быть селективен в отношении других одно- и двухвалентных ионов в присутствии ионов аммония.
в растворе. Причем предлагаемый материал должен быть селективен в отношении других одно- и двухвалентных ионов в присутствии ионов аммония.
Поставленная задача решена путем применения гидратированной оксидной ванадиевой бронзы аммония состава 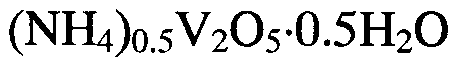 в качестве ионоселективного материала для селективного определения концентрации ионов аммония в интервале концентраций
в качестве ионоселективного материала для селективного определения концентрации ионов аммония в интервале концентраций 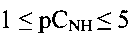 и кислотности среды
и кислотности среды 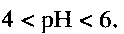
Поставленная задача также решена в способе получения гидратированной оксидной ванадиевой бронзы аммония состава 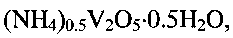 включающем растворение метаванадата аммония
включающем растворение метаванадата аммония 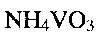 в воде, добавление при постоянном перемешивании по каплям водного раствора лимонной кислоты
в воде, добавление при постоянном перемешивании по каплям водного раствора лимонной кислоты 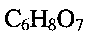 до установления кислотности раствора
до установления кислотности раствора 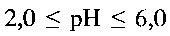 с последующей обработкой смеси при температуре 140 - 180°С в течение 24-48 часов в автоклаве, фильтрацию, промывание и сушку.
с последующей обработкой смеси при температуре 140 - 180°С в течение 24-48 часов в автоклаве, фильтрацию, промывание и сушку.
В настоящее время в патентной и научно-технической литературе не известно применение в качестве ионоселективного материала для определения ионов аммония в растворе гидратированной оксидной ванадиевой бронзы аммония состава 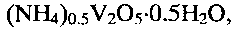 а также не известен способ получения этой бронзы путем гидротермальной обработки в предлагаемых условиях.
а также не известен способ получения этой бронзы путем гидротермальной обработки в предлагаемых условиях.
Исследования, проведенные авторами, позволили сделать вывод, что гидратированная оксидная ванадиевая бронза аммония состава 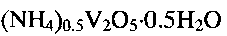 обладает свойством катионной функции, которое позволяет использовать ее в качестве ионоселективного материала для определения ионов аммония в растворе. Предпосылками возникновения катионной функции являются наличие в соединении ионов ванадия в двух степенях окисления
обладает свойством катионной функции, которое позволяет использовать ее в качестве ионоселективного материала для определения ионов аммония в растворе. Предпосылками возникновения катионной функции являются наличие в соединении ионов ванадия в двух степенях окисления 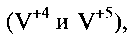 а также слоистая структура, обеспечивающая легкость процесса интеркаляции/деинтеркаляции катиона аммония по отношению к ванадий-кислородной матрице.
а также слоистая структура, обеспечивающая легкость процесса интеркаляции/деинтеркаляции катиона аммония по отношению к ванадий-кислородной матрице.
Существенными являются условия соблюдения параметров процесса получения, заявляемые в предлагаемом техническом решении. Только использование лимонной кислоты, являющейся мягким восстановителем, для создания требуемой кислотности (рН) раствора позволяет получить гидратированную бронзу требуемого состава со 100% выходом, без возможных примесей в виде соединений 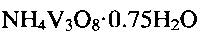 , или
, или 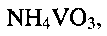 или
или 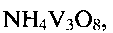 или
или 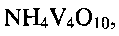 или
или 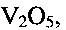 или
или 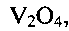 или
или 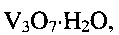 или
или 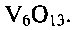 Экспериментальным путем было установлено, что существенным фактором, определяющим состав, структуру и морфологию конечного продукта, является величина кислотности исходного раствора
Экспериментальным путем было установлено, что существенным фактором, определяющим состав, структуру и морфологию конечного продукта, является величина кислотности исходного раствора 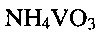 (значение рН), создаваемая лимонной кислотой. В процессе получения в присутствии лимонной кислоты пятивалентный ванадий частично восстанавливается до четырехвалентного состояния, образуя продукт с низкоразмерной морфологией. Необходимо соблюдать точное значение рН среды
(значение рН), создаваемая лимонной кислотой. В процессе получения в присутствии лимонной кислоты пятивалентный ванадий частично восстанавливается до четырехвалентного состояния, образуя продукт с низкоразмерной морфологией. Необходимо соблюдать точное значение рН среды 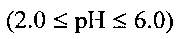 для получения бронзы требуемого состава. Проведение процесса в указанном интервале кислотности позволяет получать однофазный продукт, исключить процессы гидролиза исходного метаванадата аммония
для получения бронзы требуемого состава. Проведение процесса в указанном интервале кислотности позволяет получать однофазный продукт, исключить процессы гидролиза исходного метаванадата аммония 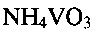 и образование в качестве примесей различных ванадатов.
и образование в качестве примесей различных ванадатов.
Кроме того, при значении кислотности раствора, равном 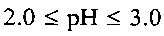 , образуется продукт с морфологией частиц, подобной шарам. При значении кислотности раствора в интервале
, образуется продукт с морфологией частиц, подобной шарам. При значении кислотности раствора в интервале 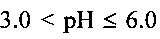 образуется продукт с морфологией частиц, подобной цветку. Экспериментально были определены температура и время гидротермальной обработки реакционной смеси, только при соблюдении которых может быть получена гидратированная ванадиевая бронза аммония состава
образуется продукт с морфологией частиц, подобной цветку. Экспериментально были определены температура и время гидротермальной обработки реакционной смеси, только при соблюдении которых может быть получена гидратированная ванадиевая бронза аммония состава 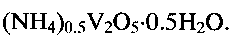 Так, при снижении температуры гидротермальной обработки менее 140°С или при повышении ее выше 180°С и при выходе за заявленные значения временного интервала, в конечном продукте появляются в качестве примеси непрореагировавший метаванадат аммония
Так, при снижении температуры гидротермальной обработки менее 140°С или при повышении ее выше 180°С и при выходе за заявленные значения временного интервала, в конечном продукте появляются в качестве примеси непрореагировавший метаванадат аммония 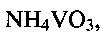 оксид ванадия(V) V2O5 или оксид ванадия(IV) V2O4. Совокупность предлагаемых условий проведения процесса позволяет получать гидротермальной обработкой реакционной смеси низкоразмерную гидратированную оксидную ванадиевую бронзу аммония состава
оксид ванадия(V) V2O5 или оксид ванадия(IV) V2O4. Совокупность предлагаемых условий проведения процесса позволяет получать гидротермальной обработкой реакционной смеси низкоразмерную гидратированную оксидную ванадиевую бронзу аммония состава 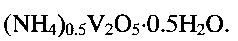
Гидратированная оксидная ванадиевая бронза аммония состава 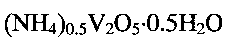 может быть получена следующим образом. Берут метаванадат аммония
может быть получена следующим образом. Берут метаванадат аммония 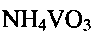 и растворяют его в воде, добавляют при постоянном перемешивании по каплям водный раствор лимонной кислоты
и растворяют его в воде, добавляют при постоянном перемешивании по каплям водный раствор лимонной кислоты 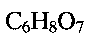 до установления кислотности раствора
до установления кислотности раствора 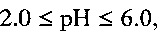 затем помещают в автоклав и обрабатывают при температуре 140-180°С в течение 24-48 часов. Полученный продукт фильтруют, промывают и сушат.
затем помещают в автоклав и обрабатывают при температуре 140-180°С в течение 24-48 часов. Полученный продукт фильтруют, промывают и сушат.
Контроль фазовой однородности и морфологии полученного продукта проводят соответственно методами рентгенофазового анализа (РФА) и сканирующей электронной микроскопии (СЭМ). При проведении процесса за счет регулирования рН реакционной среды появляется возможность получения продукта разной морфологии и, следовательно, разного гранулометрического состава.
Для исследования ионоселективной функции полученного материала готовят смесь, содержащую поливинилхлорид, дибутилфталат и полученный порошок гидратированной ванадиевой бронзы аммония при следующем соотношении компонентов: поливинилхлорид:дибутилфталат:гидратированная ванадиевая бронза аммония 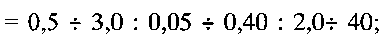 соответственно. При этом поливинилхлорид добавляют в виде 5%-ного раствора в тетрагидрофуране. Полученную смесь наносят на графитовый стержень, а затем сушат при комнатной температуре до полного испарения тетрагидрофурана.
соответственно. При этом поливинилхлорид добавляют в виде 5%-ного раствора в тетрагидрофуране. Полученную смесь наносят на графитовый стержень, а затем сушат при комнатной температуре до полного испарения тетрагидрофурана.
Исследование ионоселективной функции материала проводили путем измерения ЭДС гальванического элемента типа
электрод | исследуемый раствор || КСl нас., AgCl | Ag
с использованием иономера И-130.2М.
Для определения коэффициентов потенциометрической селективности использовали метод непрерывных растворов (Окунев М.С., Хитрова Н.В., Корниенко О.И. Оценка селективности ионоселективных электродов // Журн. аналит. химии. 1982. Т. 37. № 1. С. 5-13). Полученные значение коэффициентов селективности аммонийселективного материала представлены в таблице.
Таблица
Коэффициенты селективности (KNH/М) аммонийного материала

Способы получения и применения гидратированной оксидной ванадиевой бронзы аммония иллюстрируются следующими примерами.
Пример 1. Берут 0.2 г порошка метаванадата аммония NH4VO3 и растворяют его в 12 мл дистиллированной воды. К полученному раствору при перемешивании по каплям добавляют водный раствор лимонной кислоты до установления рН раствора 2.0. Полученную смесь помещают в автоклав, нагревают до 140°С и при этой температуре выдерживают 48 часов. После этого автоклав охлаждают до комнатной температуры, полученный продукт фильтруют, промывают водой и сушат на воздухе при комнатной температуре. По данным рентгенофазового и электронно-микроскопического анализов полученный продукт однофазный, имеет состав 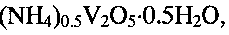 кристаллизуется в моноклинной сингонии с параметрами кристаллической решетки
кристаллизуется в моноклинной сингонии с параметрами кристаллической решетки 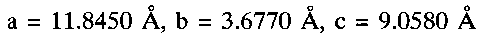 и
и 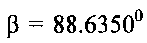
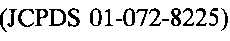 и состоит из слабо агломерированных наночастиц шарообразной формы диаметром 150-250 нм. 2 мг полученного порошка смешивают с 0,5 мл 5%-ного поливинилхлорида в тетрагидрофуране и 0,05 мл дибулилфталата, что соответствует соотношению поливинилхлорид:дибутилфталат:гидратированная ванадиевая бронза аммония
и состоит из слабо агломерированных наночастиц шарообразной формы диаметром 150-250 нм. 2 мг полученного порошка смешивают с 0,5 мл 5%-ного поливинилхлорида в тетрагидрофуране и 0,05 мл дибулилфталата, что соответствует соотношению поливинилхлорид:дибутилфталат:гидратированная ванадиевая бронза аммония 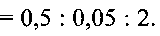 Полученную смесь наносят на графитовый стержень и сушат при комнатной температуре до полного испарения тетрагидрофурана.
Полученную смесь наносят на графитовый стержень и сушат при комнатной температуре до полного испарения тетрагидрофурана.
На фиг. 1 представлена рентгенограмма 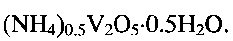 На фиг. 2 приведено изображение наночастиц
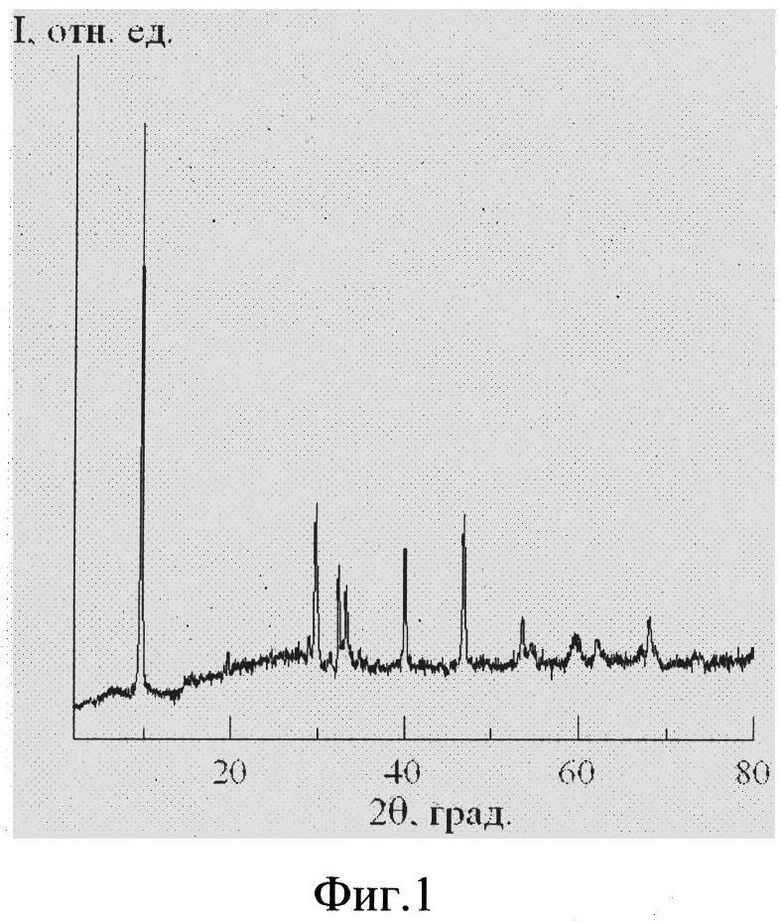
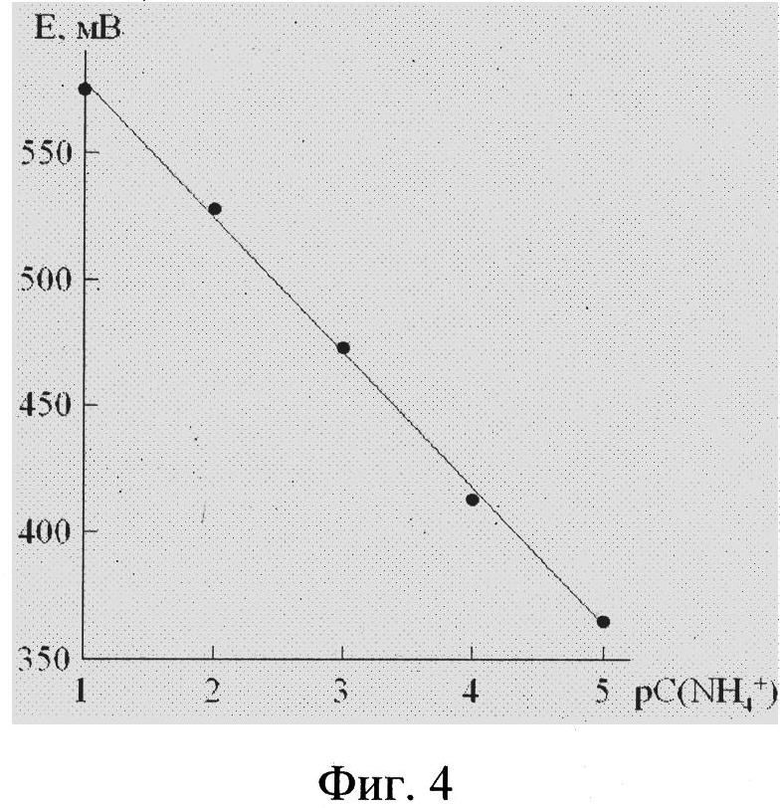
На фиг. 2 приведено изображение наночастиц 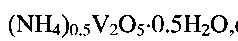 синтезированных при рН = 2.0, полученное на сканирующем электронном микроскопе. На фиг. 3 представлен ИК-спектр соединения. Полосы поглощения при 3215 см-1 и 1395 см-1, при 3413 см-1 и 1631 см-1 подтверждают наличие в полученном соединении аммонийных группировок и адсорбционной воды, соответственно. На фиг. 4 представлена зависимость потенциала электрода от концентрации катионов аммония в растворе при рН 4. При рН 4 в интервале концентраций
синтезированных при рН = 2.0, полученное на сканирующем электронном микроскопе. На фиг. 3 представлен ИК-спектр соединения. Полосы поглощения при 3215 см-1 и 1395 см-1, при 3413 см-1 и 1631 см-1 подтверждают наличие в полученном соединении аммонийных группировок и адсорбционной воды, соответственно. На фиг. 4 представлена зависимость потенциала электрода от концентрации катионов аммония в растворе при рН 4. При рН 4 в интервале концентраций 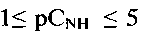 угловой коэффициент электродной функции близок к теоретическому значению и равен
угловой коэффициент электродной функции близок к теоретическому значению и равен 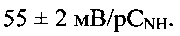
Пример 2. Берут 0.2 г порошка метаванадата аммония 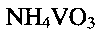 и растворяют его в 12 мл дистиллированной воды. К полученному раствору при перемешивании по каплям добавляют водный раствор лимонной кислоты до установления рН раствора 3.0. Полученную смесь помещают в автоклав, нагревают до 150°С и при этой температуре выдерживают 48 часов. После этого автоклав охлаждают до комнатной температуры, полученный продукт фильтруют, промывают водой и сушат на воздухе при комнатной температуре. 2 мг полученного порошка смешивают с 0,5 мл 5%-ного поливинилхлорида в тетрагидрофуране и 0,05 мл дибулилфталата, что соответствует соотношению поливинилхлорид:дибутилфталат:гидратированная ванадиевая бронза аммония
и растворяют его в 12 мл дистиллированной воды. К полученному раствору при перемешивании по каплям добавляют водный раствор лимонной кислоты до установления рН раствора 3.0. Полученную смесь помещают в автоклав, нагревают до 150°С и при этой температуре выдерживают 48 часов. После этого автоклав охлаждают до комнатной температуры, полученный продукт фильтруют, промывают водой и сушат на воздухе при комнатной температуре. 2 мг полученного порошка смешивают с 0,5 мл 5%-ного поливинилхлорида в тетрагидрофуране и 0,05 мл дибулилфталата, что соответствует соотношению поливинилхлорид:дибутилфталат:гидратированная ванадиевая бронза аммония 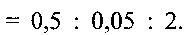 Полученную смесь наносят на графитовый стержень и сушат при комнатной температуре до полного испарения тетрагидрофурана.
Полученную смесь наносят на графитовый стержень и сушат при комнатной температуре до полного испарения тетрагидрофурана.
По данным рентгенофазового и электронно-микроскопического анализов полученный продукт однофазный, имеет состав 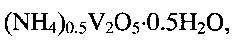 кристаллизуется в моноклинной сингонии с параметрами кристаллической решетки
кристаллизуется в моноклинной сингонии с параметрами кристаллической решетки 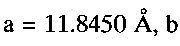
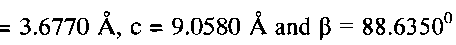 и состоит из слабо агломерированных наночастиц шарообразной формы диаметром 150-250 нм. При рН 5 в интервале концентраций
и состоит из слабо агломерированных наночастиц шарообразной формы диаметром 150-250 нм. При рН 5 в интервале концентраций 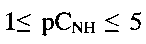 угловой коэффициент электродной функции близок к теоретическому значению и равен 54±2 мВ/pCNH.
угловой коэффициент электродной функции близок к теоретическому значению и равен 54±2 мВ/pCNH.
Пример 3. Берут 0.2 г порошка метаванадата аммония NH4VO3 и растворяют его в 12 мл дистиллированной воды. К полученному раствору при перемешивании по каплям добавляют водный раствор лимонной кислоты до установления рН раствора 4.0. Полученную смесь помещают в автоклав, нагревают до 180°С и при этой температуре выдерживают 24 часа. После этого автоклав охлаждают до комнатной температуры, полученный продукт фильтруют, промывают водой и сушат на воздухе при комнатной температуре. 40 мг полученного порошка смешивают с 3,0 мл 5%-ного поливинилхлорида в тетрагидрофуране и 0,4 мл дибулилфталата, что соответствует соотношению поливинилхлорид:дибутилфталат:гидратированная ванадиевая бронза аммония 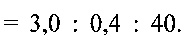 Полученную смесь наносят на графитовый стержень и сушат при комнатной температуре до полного испарения тетрагидрофурана.
Полученную смесь наносят на графитовый стержень и сушат при комнатной температуре до полного испарения тетрагидрофурана.
По данным рентгенофазового и электронно-микроскопического анализов полученный продукт однофазный, имеет состав 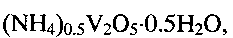 кристаллизуется в моноклинной сингонии с параметрами кристаллической решетки
кристаллизуется в моноклинной сингонии с параметрами кристаллической решетки 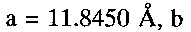
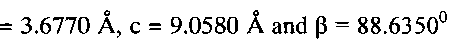 и состоит из частиц с морфологией, подобной цветку, образованной пересекающимися пластинками толщиной 100-350 нм и шириной 0.8 - 1 мкм (фиг. 5). При рН 6 в интервале концентраций
и состоит из частиц с морфологией, подобной цветку, образованной пересекающимися пластинками толщиной 100-350 нм и шириной 0.8 - 1 мкм (фиг. 5). При рН 6 в интервале концентраций 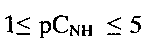 угловой коэффициент электродной функции близок к теоретическому значению и равен
угловой коэффициент электродной функции близок к теоретическому значению и равен 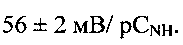
Пример 4. Берут 0.2 г порошка метаванадата аммония 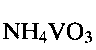 и растворяют его в 12 мл дистиллированной воды. К полученному раствору при перемешивании по каплям добавляют водный раствор лимонной кислоты до установления рН раствора 6.0. Полученную смесь помещают в автоклав, нагревают до 180°С и при этой температуре выдерживают 32 часа. После этого автоклав охлаждают до комнатной температуры, полученный продукт фильтруют, промывают водой и сушат на воздухе при комнатной температуре. 2 мг полученного порошка смешивают с 0,5 мл 5%-ного поливинилхлорида в тетрагидрофуране и 0,05 мл дибулилфталата, что соответствует соотношению поливинилхлорид:дибутилфталат:гидратированная ванадиевая бронза аммония
и растворяют его в 12 мл дистиллированной воды. К полученному раствору при перемешивании по каплям добавляют водный раствор лимонной кислоты до установления рН раствора 6.0. Полученную смесь помещают в автоклав, нагревают до 180°С и при этой температуре выдерживают 32 часа. После этого автоклав охлаждают до комнатной температуры, полученный продукт фильтруют, промывают водой и сушат на воздухе при комнатной температуре. 2 мг полученного порошка смешивают с 0,5 мл 5%-ного поливинилхлорида в тетрагидрофуране и 0,05 мл дибулилфталата, что соответствует соотношению поливинилхлорид:дибутилфталат:гидратированная ванадиевая бронза аммония 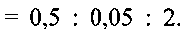 Полученную смесь наносят на графитовый стержень и сушат при комнатной температуре до полного испарения тетрагидрофурана.
Полученную смесь наносят на графитовый стержень и сушат при комнатной температуре до полного испарения тетрагидрофурана.
По данным рентгенофазового и электронно-микроскопического анализов полученный продукт однофазный, имеет состав 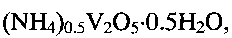 кристаллизуется в моноклинной сингонии с параметрами кристаллической решетки
кристаллизуется в моноклинной сингонии с параметрами кристаллической решетки 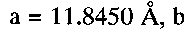
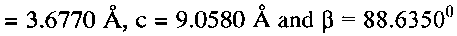 и состоит из частиц с морфологией, подобной цветку, образованной пересекающимися пластинками толщиной 100-350 нм и шириной 0.8-1 мкм. При рН 5 в интервале концентраций
и состоит из частиц с морфологией, подобной цветку, образованной пересекающимися пластинками толщиной 100-350 нм и шириной 0.8-1 мкм. При рН 5 в интервале концентраций  угловой коэффициент электродной функции близок к теоретическому значению и равен 54 ± 2 мВ/рСNH·
угловой коэффициент электродной функции близок к теоретическому значению и равен 54 ± 2 мВ/рСNH·
Таким образом, авторами предложено применение в качестве ионоселективного материала для определения ионов аммония в растворе гидратированной ванадиевой бронзы аммония состава  Предлагается также простой и надежный способ получения ванадиевой бронзы указанного состава.
Предлагается также простой и надежный способ получения ванадиевой бронзы указанного состава.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НАНОИГЛ ОКСИДНОЙ ВАНАДИЕВОЙ БРОНЗЫ НАТРИЯ | 2013 |
|
RU2549421C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ ДИОКСИДА ВАНАДИЯ | 2015 |
|
RU2602896C1 |
| Способ получения наноструктурированных полых микросфер оксида ванадия (варианты) | 2020 |
|
RU2739773C1 |
| СЛОЖНЫЙ ОКСИД МОЛИБДЕНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2010 |
|
RU2446106C2 |
| Способ получения композита ортованадат лития/углерод | 2018 |
|
RU2683094C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ АММИАКА ИЗ СОЕДИНЕНИЯ ВАНАДИЯ ДЛЯ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ АММИАКА И РЕЦИРКУЛЯЦИИ СТОЧНЫХ ВОД | 2019 |
|
RU2710613C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО ЭЛЕКТРОДНОГО МАТЕРИАЛА НА ОСНОВЕ КОБАЛЬТ ВАНАДИЕВОГО ОКСИДА И ОКСИДНЫХ СОЕДИНЕНИЙ МОЛИБДЕНА | 2014 |
|
RU2570070C1 |
| СПОСОБ ФОРМИРОВАНИЯ МИКРОСТРУКТУРЫ ИЗ ДИОКСИДА ВАНАДИЯ, СОДЕРЖАЩЕЙ ПЕРЕХОД МЕТАЛЛ-ПОЛУПРОВОДНИК | 2024 |
|
RU2830793C1 |
| Ионоселективный материал для определения ионов калия | 2020 |
|
RU2732249C1 |
| АНОДНЫЙ МАТЕРИАЛ ДЛЯ ЛИТИЙ- И НАТРИЙ-ИОННЫХ АККУМУЛЯТОРОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2020 |
|
RU2730001C1 |


Изобретение может быть использовано в аналитической химии. Гидратированную оксидную ванадиевую бронзу аммония состава (NH4)0,5V2O5·0,5H2O используют в качестве ионоселективного материала для селективного определения концентрации ионов аммония в растворах. Для получения гидратированной оксидной ванадиевой бронзы аммония указанного состава метаванадат аммония NH4VO3 растворяют в воде и добавляют при постоянном перемешивании по каплям водный раствор лимонной кислоты до установления кислотности раствора 2,0≤pH≤6,0. Затем смесь обрабатывают при температуре 140-180°C в течение 24-48 часов в автоклаве. Полученный продукт фильтруют, промывают и сушат. Изобретение позволяет получить ионоселективный материал для простого и надежного определения концентрации NH4 + в растворах. 2 н.п. ф-лы, 5 ил., 1 табл., 4 пр.
1. Применение гидратированной оксидной ванадиевой бронзы аммония состава (NH4)0,5V2O5·0,5H2O в качестве ионоселективного материала для селективного определения концентрации ионов аммония.
2. Способ получения гидратированной оксидной ванадиевой бронзы аммония состава (NH4)0,5V2O5·0,5H2O по п.1, включающий растворение метаванадата аммония NH4VO3 в воде, добавление при постоянном перемешивании по каплям водного раствора лимонной кислоты C6H8O7 до установления кислотности раствора 2,0≤pH≤6,0 с последующей обработкой смеси при температуре 140-180°C в течение 24-48 часов в автоклаве, фильтрацию, промывание и сушку.
| ИОНОСЕЛЕКТИВНЫЙ ЭЛЕКТРОД ДЛЯ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ КИСЛОРОДСОДЕРЖАЩИХ ИОНОВ ВОЛЬФРАМА, МОЛИБДЕНА И ВАНАДИЯ И СПОСОБ ИЗГОТОВЛЕНИЯ ИОНОСЕЛЕКТИВНОГО ЭЛЕКТРОДА | 2007 |
|
RU2350940C1 |
| ИСПОЛЬЗОВАНИЕ БРОНЗЫ НА ОСНОВЕ ОКИСИ ВАНАДИЯ, ЖЕЛЕЗА И/ИЛИ АЛЮМИНИЯ В КАЧЕСТВЕ МАТЕРИАЛА КАТОДА В ЭЛЕКТРОХИМИЧЕСКИХ ГЕНЕРАТОРАХ | 1992 |
|
RU2091915C1 |
| WO 2002013291 A2, 14.02.2002; | |||
| US 2010290951 A1, 18.11.2010 | |||
| TRIKALITIS P.N | |||
| et al., Structure of Redox Intercalated (NH)VO∴υ215;mHO Xerogel Using the Pair Distribution Function Technique, Chem | |||
| Mater, 2003, v | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| АВТОМАТ ДЛЯ ПРОДАЖИ ПЕРРОНЫХ БИЛЕТОВ | 1926 |
|
SU3337A1 |
Авторы
Даты
2015-02-20—Публикация
2013-06-25—Подача