Область техники, к которой относится изобретение
Настоящее изобретение относится к производному витамина D3 или его медицински приемлемому сольвату, которые применимы в качестве лекарственного средства, к терапевтическому средству с использованием их, к фармацевтической композиции, включающей их, и к промежуточному соединению для их получения. Конкретнее, настоящее изобретение относится к производному 23-ин-витамина D3 или его медицински приемлемому сольвату, к фармацевтической композиции, включающей их, к включающему их в качестве активного ингредиента терапевтическому средству против остеопороза, злокачественной опухоли, псориаза, гиперпаратиреоза, воспалительного заболевания дыхательных путей, ревматоидного артрита, сахарного диабета, гипертензии, алопеции, акне или дерматита, и к промежуточному соединению для их получения.
Уровень техники
Активированные производные витамина D3 регулируют ремоделирование костной ткани, состоящее из образования костной ткани и резорбции костной ткани, и показывают эффект повышения плотности костной ткани. Таким образом, они используются как ценные терапевтические средства в случае остеопороза. Однако такие активные производные витамина D3, например, 1α,25-дигидроксивитамин D3, не всегда показывают удовлетворительное повышение плотности минерального костного вещества. Когда дозу повышают для того, чтобы повысить плотность минерального костного вещества, происходит повышение уровня кальция в сыворотке, а не дополнительное повышение плотности минерального костного вещества, что вызывает повышение сывороточного показателя кальция в на 1 мг/л или более - величину, рассматриваемую как один из критериев, клинически нежелательных. Так, иногда имеют место случаи, когда достаточного эффекта повышения плотности минерального костного вещества не получают (международная публикация №WO 01/62723). Поэтому весьма желательно производное витамина D3, которое проявляет сильное действие повышения плотности минерального костного вещества без возрастания показателя кальция в сыворотке. До сих пор синтезировано множество производных витамина D3 в попытке получить такое производное, но пока еще не найдено какое-либо производное, которое имеет удовлетворительный профиль.
Раскрытие изобретения
Целью настоящего изобретения является новое производное витамина D3 или его медицински приемлемый сольват, проявляющие желательное фармакологическое действие, отделенное от эффекта возрастания содержания кальция в крови.
Кроме того, целью настоящего изобретения является терапевтическое средство против остеопороза, злокачественной опухоли, псориаза, гиперпаратиреоза, воспалительного заболевания дыхательных путей, ревматоидного артрита, сахарного диабета, гипертензии, алопеции, акне или дерматита, включающее в качестве активного ингредиента производное витамина D3 или его медицински приемлемый сольват.
Кроме того, целью настоящего изобретения является фармацевтическая композиция, включающая производное витамина D3 или его медицински приемлемый сольват.
И также целью настоящего изобретения является промежуточное соединение производного витамина D3, подходящее для получения производного витамина D3 или его медицински приемлемого сольвата.
Авторы настоящего изобретения провели кропотливое исследование для того, чтобы решить вышеуказанные проблемы, и в результате осуществили описанное далее изобретение.
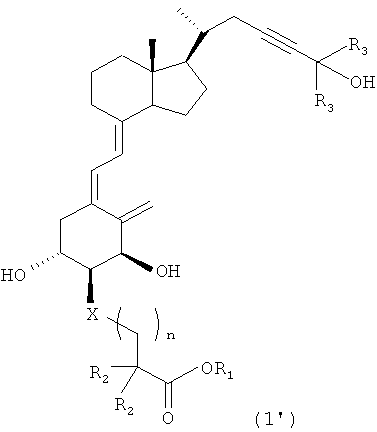
Иными словами, настоящее изобретение относится к производному витамина D3, представленному приведенной далее формулой (1), или его медицински приемлемому сольвату.
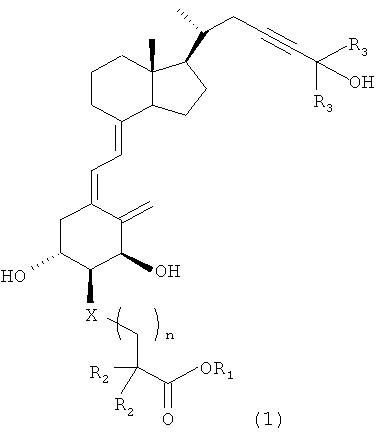
где
R1 представляет собой атом водорода, алкильную группу с 1-6 атомами углерода, алкилкарбонилоксиалкильную группу, причем каждый алкил имеет 1-6 атомов углерода, или арилкарбонилоксиалкильную группу, причем арил имеет 6-10 атомов углерода и алкил имеет 1-6 атомов углерода; R2 представляет собой атом водорода или алкильную группу с 1-6 атомами углерода или вместе с другим R2 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; R3 представляет собой алкильную группу с 1-6 атомами углерода или вместе с другим R3 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; Х представляет собой атом кислорода или метиленовую группу; и n равен целому числу 1 или 2.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей производное витамина D3, представленное приведенной выше формулой (1), или его медицински приемлемый сольват и фармацевтически приемлемый носитель.
Кроме того, настоящее изобретение относится к терапевтическому средству против одного или нескольких заболеваний, выбранных из группы, включающей остеопороз, злокачественную опухоль, псориаз, гиперпаратиреоз, воспалительное заболевание дыхательных путей, ревматоидный артрит, сахарный диабет, гипертензию, алопецию, акне или дерматит, включающему в качестве активного ингредиента производное витамина D3, представленное приведенной выше формулой (1), или его медицински приемлемый сольват.
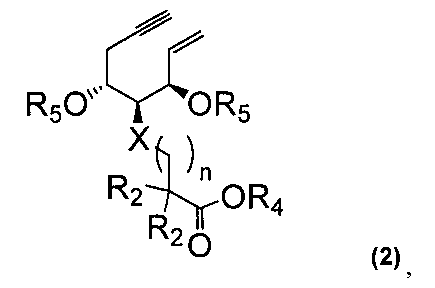
И, кроме того, настоящее изобретение относится к промежуточному соединению для производного витамина D3, представленному формулой (2)
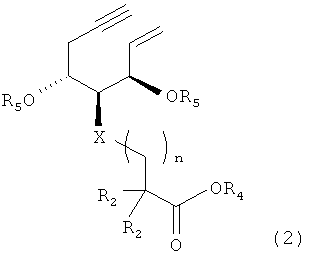 ,
,
где
R2, X и n являются такими же, как в приведенной выше формуле (1); R4 представляет собой R1 в приведенной выше формуле (1), метоксим стильную группу, метоксиэтоксиметильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу или бензилоксиметильную группу; и R5 представляет собой защитную группу для гидроксильной группы.
Согласно настоящему изобретению, предлагается новое производное витамина D3 или его медицински приемлемый сольват, которые эффективны для лечения различных заболеваний, представленных остеопорозом, злокачественной опухолью, псориазом, гиперпаратиреозом, воспалительным заболеванием дыхательных путей, ревматоидным артритом, сахарным диабетом, гипертензией, алопецией, акне, дерматитом и т.п. Кроме того, получаемое промежуточное соединение, представленное приведенной выше формулой (2), применимо для получения производного витамина D3 и т.п. по настоящему изобретению.
Осуществление изобретения
Термины, используемые в настоящем изобретении, определяются так, как описано далее.
«Алкильная группа» обозначает линейную, разветвленную или циклическую алифатическую углеводородную группу. Алкильная группа с 1-6 атомами углерода конкретно включает, например, метильную группу, этильную группу, изобутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, гексильную группу, циклопропильную группу, циклопропилметильную группу и циклогексильную группу.
«Алкилкарбонилоксиалкильная группа» конкретно включает трет-бутилкарбонилоксиметильную группу.
«Арилкарбонилоксиалкильная группа» конкретно включает фенилкарбонилоксиметильную группу.
В приведенной выше формуле (1) R1 представляет собой атом водорода, алкильную группу с 1-6 атомами углерода, алкилкарбонилоксиалкильную группу, причем каждый алкил имеет 1-6 атомов углерода, или арилкарбонилоксиалкильную группу, причем арил имеет 6-10 атомов углерода и алкил имеет 1-6 атомов углерода. Из них предпочтительными являются атом водорода, метильная группа, этильная группа, пропильная группа, изопропильная группа или трет-бутильная группа; и особенно предпочтительны атом водорода или изопропильная группа. Как алкилкарбонилоксиалкильная группа предпочтительной является трет-бутилкарбонилоксиметильная группа. Кроме того, предпочтительной в качестве арилкарбонилоксиалкильной группы является фенилкарбонилоксиалкильная группа.
В приведенной выше формуле (1) R2 представляет собой атом водорода или алкильную группу с 1-6 атомами углерода или вместе с другим R2 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода. Из них R2 предпочтительно представляет собой атом водорода или метильную группу; или, когда R2 вместе с другим R; и атомом углерода, с которым они связаны, образует циклоалкильную группу, предпочтительной является циклопропильная группа.
В приведенной выше формуле (1) R3 представляет собой алкильную группу с 1-6 атомами углерода или вместе с другим R3 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу. В качестве алкильной группы с 1-6 атомами углерода предпочтительными являются метальная группа и этильная группа. Кроме того, когда R3 вместе с другим R3 и атомом углерода, с которым они связаны, образует циклоалкильную группу, предпочтительной является циклопентильная группа.
Кроме того, в приведенной выше формуле (1) Х представляет собой атом кислорода или метиленовую группу.
Кроме того, в приведенной выше формуле (1) n равен целому числу 1 или 2, где особенно предпочтительно, n равен 1.
В качестве предпочтительного конкретного примера производного витамина D3 по настоящему изобретению, представленного формулой (1), можно упомянуть соединения, указанные в следующей далее таблице.
При необходимости производное витамина Ds по настоящему изобретению можно превратить в медицински приемлемый сольват. Такой растворитель включает воду, метанол, этанол, 1-пропанол, 2-пропанол, бутанол, трет-бутанол, ацетонитрил, ацетон, метилэтилкетон, хлороформ, этилацетат, диэтиловый эфир, трет-бутилметиловый эфир, бензол, толуол, ДМФА, ДМСО и подобные растворители. В особенности как предпочтительные растворители можно упомянуть воду, метанол, этанол, 1-пропанол, 2-пропанол, ацетонитрил, ацетон, метилэтилкетон и этилацетат.
Кроме того, R5 в приведенной выше формуле (2) представляет собой защитную группу для гидроксильной группы. Защитная группа для гидроксильной группы включает метоксиметильную группу, ацильную группу с 1-3 атомами углерода (указанное число атомов углерода включает углерод карбонила), триметилсилильную группу, триэтилсилильную группу, трет-бутилдиметилсилильную группу, трет-бутилдифенилсилильную группу- и подобные группы. Из них как предпочтительные примеры можно назвать триэтилсилильную группу и трет-бутилдиметилсилильную группу.
Кроме того, R4 в приведенной выше формуле (2) представляет собой R1 в приведенной выше формуле (1) или представляет собой метоксиметильную группу, метоксиэтоксиметильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу или бензилоксиметильную группу. Из них предпочтительными являются метильная группа, этильная группа, пропильная группа, изопропильная группа; или трет-бутильная группа, трет-бутилкарбонилоксиметильная группа, фенилкарбонилоксиалкильная группа или бензилоксиметильная группа.
Кроме того, в приведенной выше формуле (2) n равен целому числу 1 или 2, при этом особенно предпочтительный n равен 1.
Синтез производного витамина D3, представленного приведенной выше формулой (1), можно выполнить любым способом, но можно осуществить, например, так, как описано на следующей далее схеме 1. Иными словами, после того, как соединение (2) и соединение (3) подвергают реакции сочетания, группу, защищающую гидроксильную группу, удаляют, и при необходимости сложноэфирную группу гидролизуют, и получают целевой материал (1).
Схема 1
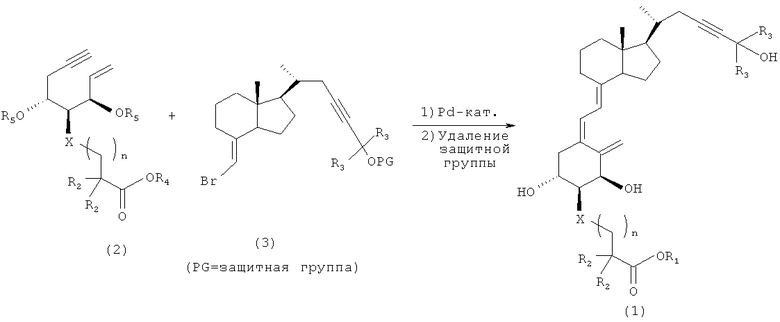
В формулах на приведенной выше схеме реакции R1-R5 в соединении (1) и соединении (2) являются такими же, как в приведенных выше формулах (1) и (2). Кроме того, в формулах на приведенной выше схеме реакции R3 в соединении (3) являются такими же, как в приведенной выше формуле (1). Кроме того, OPG в соединении (3) представляет собой защищенную гидроксильную группу. Конкретно защитная группа включает триметилсилильную группу, триэтилсилильную группу и метоксиметильную группу.
Когда на приведенной выше схеме 1 R2 представляет собой атом водорода, соединение (2) можно синтезировать из ен-инового соединения (4) согласно следующей далее схеме 2, причем ен-иновое соединение (4) описано, например, в литературе (Takayama et al., «Vitamin D Analog in Cancer Prevention and Therapy», Recent Results in Cancer Research, Vol.164, Springer, pp.289-317, 2003; и т.п.). Иными словами, путем селективного удаления защитной группы (трет-бутилдиметилсилильной группы - группы TBS) из первичной гидроксильной группы (4) получают соединение (5). Затем гидроксильную группу (5) окисляют до карбоксильной группы, которую впоследствии этерифицируют, и получают нужное соединение (2) (R2=TBS).
Схема 2
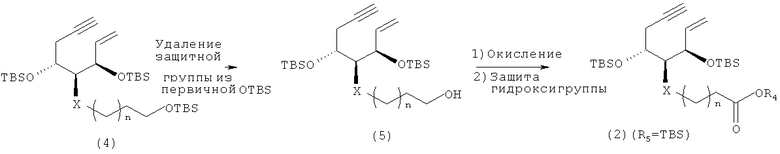
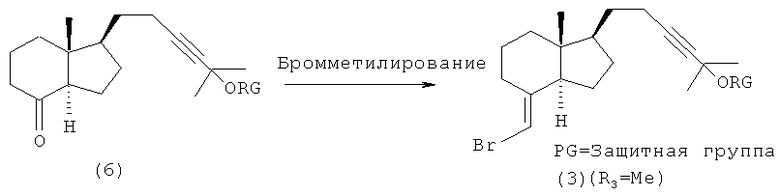
Между тем, когда на приведенной выше схеме 1 R3 представляет собой метальную группу, соединение (3) можно синтезировать так, как описано на следующей далее схеме 3.
Иными словами, соединение (3) можно получить бромметилированием соединения (6), причем последнее соединение описано в литературе (например, в патенте США №4804502).
Схема 3
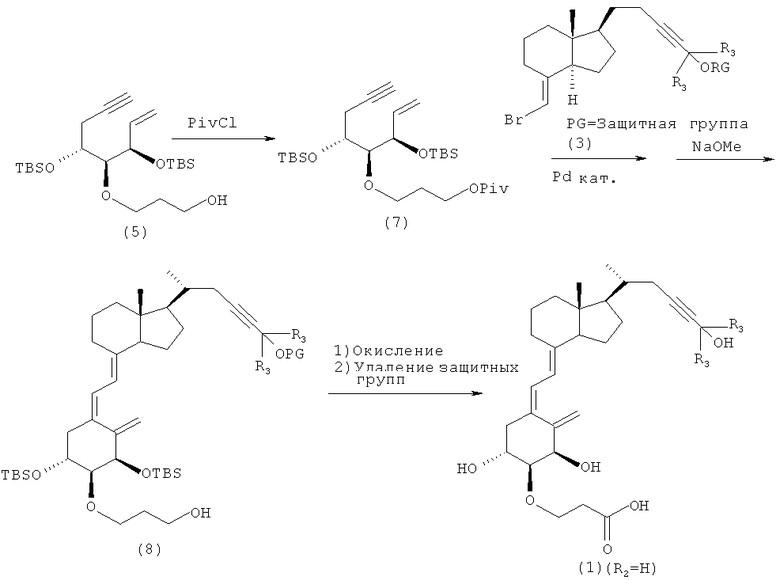
Кроме того, из производных витамина D3, представленных приведенной выше формулой (1), соединение, в котором R2 представляет собой атом водорода, кроме как по описанной выше схеме 1, также можно синтезировать согласно способу, показанному на приведенной далее схеме 4. Иными словами, в соединение (5) на схеме 2 вводят защитную пивалоильную группу, и получают соединение (7), которое подвергают сочетанию с соединением (3) на схеме 1, и удаляют группу, защищающую гидроксильную группу на конце заместителя, присоединенного в положении 2 цикла А, и получают соединение (8).
Гидроксильную группу полученного соединения окисляют до карбоновой кислоты, и наконец, все группы, защищающие гидроксильные группы, удаляют и получают соединение (1) (R2=Н).
Схема 4
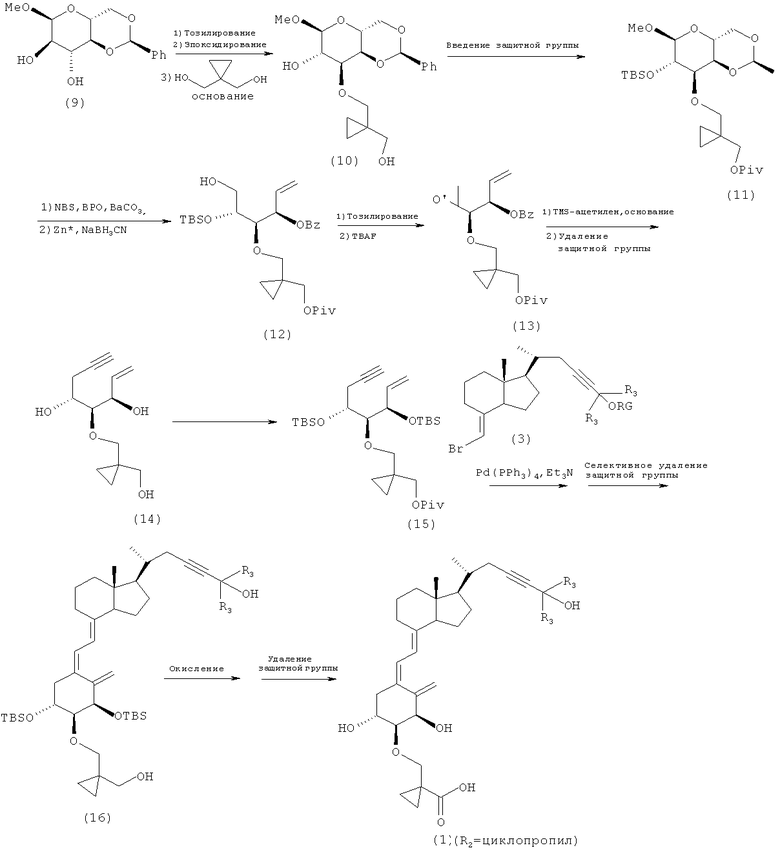
Кроме того, когда на приведенной выше схеме 1 R2 является замещенным, например, когда R2 в соединении (2) образует циклоалкильную группу вместе с другим R2 и атомом углерода, с которым они связаны, соединение (10) получают эпоксидированием коммерческого 4,6-O-бензилиден-α-O-метилглюкопиранозида (9), который используют в качестве исходного материала, и затем осуществляют раскрытие цикла эпоксида в щелочной среде таким же способом, как ен-инового соединения (4), описанного в литературе (Takayama et al., «Vitamin D Analog in Cancer Prevention and Therapy», Recent Results in Cancer Research, Vol. 164, Springer, pp.289-317, 2003; и т.п.). После получения соединения (11) путем защиты гидроксильных групп соединения (10), осуществляют раскрытие бензилиденового цикла и далее восстановление 1-положения глюкозы, и получают соединение (12). Затем получают эпоксид из диольной части, и получают соединение (13), после чего следует взаимодействие эпоксида с ацетиленом с образованием соединения (14), имеющего введенную тройную связь. Защищая подходящим образом гидроксильные группы, можно получить соединение (15). Путем сочетания соединения (15) и цикла CD промежуточного соединения (3), описанного на схеме 1, и селективного удаления защитной группы получают соединение (16). Далее, путем окисления первичной гидроксильной группы до карбоксильной и последующего удаления защитных групп из гидроксильных групп можно получить нужное соединение (1).
Схема 5
 Терапевтическое средство против остеопороза и т.п., включающее в качестве активного ингредиента производное витамина D3 или его медицински приемлемый сольват по настоящему изобретению, получают с использованием носителя, наполнителя и других добавок, обычно используемых в композициях лекарственных средств. Носитель и наполнитель для лекарственного препарата могут быть твердыми или жидкими и включают, например, лактозу, стеарат магния, крахмал, тальк, желатин, агар, аравийскую камедь, оливковое масло, сезамовое масло, масло какао, этиленгликоль и т.п.; и другие обычно используемые материалы. Тип введения может быть или пероральным введением посредством таблеток, пилюль, капсул, гранул, порошка, жидкостей и т.п.; или парентеральным введением посредством инъекций, таких как внутривенная инъекция, внутримышечная инъекция и т.п., суппозиториев, трансдермальных лекарственных средств и т.п.
Терапевтическое средство против остеопороза и т.п., включающее в качестве активного ингредиента производное витамина D3 или его медицински приемлемый сольват по настоящему изобретению, получают с использованием носителя, наполнителя и других добавок, обычно используемых в композициях лекарственных средств. Носитель и наполнитель для лекарственного препарата могут быть твердыми или жидкими и включают, например, лактозу, стеарат магния, крахмал, тальк, желатин, агар, аравийскую камедь, оливковое масло, сезамовое масло, масло какао, этиленгликоль и т.п.; и другие обычно используемые материалы. Тип введения может быть или пероральным введением посредством таблеток, пилюль, капсул, гранул, порошка, жидкостей и т.п.; или парентеральным введением посредством инъекций, таких как внутривенная инъекция, внутримышечная инъекция и т.п., суппозиториев, трансдермальных лекарственных средств и т.п.
В терапевтическом средстве по настоящему изобретению терапевтически эффективное количество активного ингредиента изменяется в зависимости от способа введения, возраста и пола пациента и степени заболевания. Однако оно, как правило, составляет примерно 0,01-10 мкг/сутки, и число введений, как правило, составляет 1-3 раз/сутки или 1-3 раз/неделя. Таким образом, предпочтительно получают композицию, удовлетворяющую таким условиям.
Примеры
Далее настоящее изобретение будет описываться подробнее с обращением к примерам. Однако следует иметь в виду, что не предполагается ограничение ими настоящего изобретения. Кроме того, в настоящем изобретении используются следующие аббревиатуры:
TBS = трет-бутилдиметилсилильная группа;
TES = триэтилсилильная группа;
TESCl = хлортриэтилсилан;
TMS = триметилсилильная группа;
TMSCl = хлортриметилсилан;
Piv = пивалоильная группа;
PivCl = пивалоилхлорид;
TBAF = фторид тетрабутиламмония;
CSA = (+/-)-камфор-10-сульфоновая кислота;
PDC = дихромат пиридиния;
TBSOTf = трет-бутилдиметилсилилтрифторметансульфонат;
DIBAL = гидрид дибутилалюминия;
ДМФА = N,N-диметилформамид;
ТГФ = тетрагидрофуран;
TsCl = п-толуолсульфонилхлорид; и
Ts = п-толуолсульфонил.
Пример 1
Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-карбоксиэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение С-1)
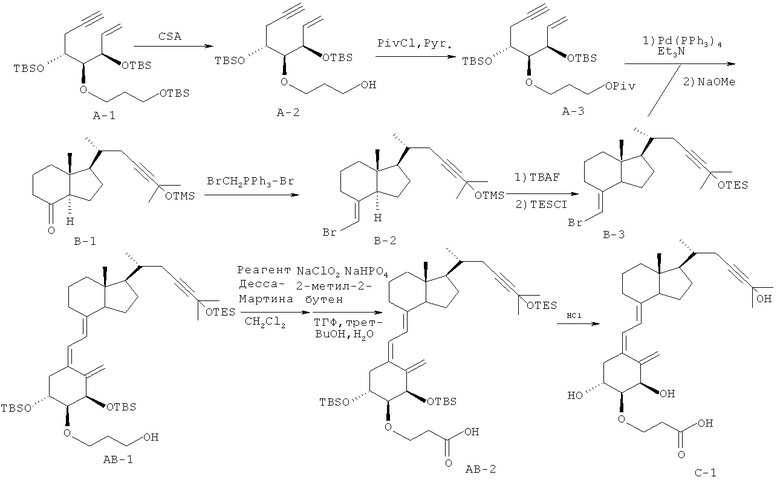 (1) Соединение А-1 (2,29 г, 4,11 ммоль), известное из литературы (например, из Kittaka et al., J. Org. Chem., 69, 7463-7471 (2004)), растворяют в этаноле (20 мл), к раствору при охлаждении льдом добавляют (+/-)-камфор-10-сульфоновую кислоту (954 мг, 4,11 ммоль), и смесь перемешивают при 0°C в течение 1 часа. Реакцию обрывают путем добавления насыщенного водного раствора гидрокарбоната натрия, и смесь разбавляют этилацетатом. Смесь промывают водой и насыщенным водным раствором хлорида натрия, и органический слой сушат над сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 9/1), и получают соединение А-2 (1,64 г, выход 90%).
(1) Соединение А-1 (2,29 г, 4,11 ммоль), известное из литературы (например, из Kittaka et al., J. Org. Chem., 69, 7463-7471 (2004)), растворяют в этаноле (20 мл), к раствору при охлаждении льдом добавляют (+/-)-камфор-10-сульфоновую кислоту (954 мг, 4,11 ммоль), и смесь перемешивают при 0°C в течение 1 часа. Реакцию обрывают путем добавления насыщенного водного раствора гидрокарбоната натрия, и смесь разбавляют этилацетатом. Смесь промывают водой и насыщенным водным раствором хлорида натрия, и органический слой сушат над сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 9/1), и получают соединение А-2 (1,64 г, выход 90%).
1Н-ЯМР (CDCl3) δ: 5,96-5,88 (1Н, м), 5,27-5,21 (2Н, м), 4,29 (1Н, дд, J=6,8, 3,9 Гц), 3,88-3,72 (5Н, м), 3,45 (1Н, дд, J=5,4, 4,1 Гц), 3,00 (1Н, т, J=6,0 Гц), 2,50-2,46 (1Н, м), 2,38-2,33 (1Н, м), 2,01 (1Н, т, J=2,6 Гц), 1,85-1,68 (2Н, м), 0,91 (9Н, с), 0,91 (9Н, с), 0,10 (9Н, с),0,07(3Н, с).
(2) Соединение А-2 (1,0 г, 2,26 ммоль), полученное в (1), растворяют в пиридине (10 мл), и после добавления пивалоилхлорида (0,69 мл, 5,65 ммоль) при 0°C, реакционную смесь перемешивают при комнатной температуре. К смеси добавляют безводный метанол (3 мл), и смесь перемешивают при комнатной температуре еще в течение 30 минут.
Добавляют толуол, и смесь концентрируют при пониженном давлении. К полученному остатку добавляют этилацетат, смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 9/1), и получают соединение А-3 (1,072 г, выход 90%).
1Н-ЯМР (CDCl) δ: 5,95 (1Н, ддд, J=17,0, 11,0, 6,0 Гц), 5,21 (1Н, ддд, J=17, 2,0,1,0 Гц), 5,14 (1Н, ддд, J=11,0, 2,0, 1,0 Гц), 4,32-4,28 (1Н, м), 4,18-4,10 (2Н, м), 3,86 (1Н, к, J=5,6 Гц), 3,81-3,74 (1Н, м), 3,68-3,60 (1Н, м), 3,39 (1Н, дд, J=5,4, 3,4 Гц), 2,49 (1Н, дк, J=17,0, 2,7 Гц), 2,35 (1Н, дк, J=16,9, 2,8 Гц), 1,96 (1Н, т, J=2,7 Гц), 1,87 (2Н, дт, J=14,0, 7,0 Гц), 1,19 (9Н, с), 0,90 (9Н, с), 0,89 (9Н, с), 0,10 (3Н, с), 0,08 (3Н, с), 0,07 (5Н, с), 0,03 (3Н, с).
(3) Бромид (брометил)трифенилфосфония (1,25 г, 2,87 ммоль) растворяют в тетрагидрофуране (7 мл), и раствор охлаждают до 0°C в атмосфере азота. К раствору добавляют бис(триметилсилил)амид натрия (1,0 М раствор в тетрагидрофуране, 2,90 мл, 2,87 ммоль), и смесь перемешивают при охлаждении льдом в течение 30 минут. Реакционную смесь охлаждают до -78°C, и к ней добавляют раствор соединения В-1 (200 мг, 0,574 ммоль), растворенное в тетрагидрофуране (1,5 мл), причем указанное соединение известно из литературы (например, из Uskokovic et al., патент США №4804502). После перемешивания при -78°C в течение 1 часа смесь еще в течение 1 часа перемешивают при 0°C. К реакционной смеси добавляют силикагель (2,5 г), и после энергичного перемешивания при комнатной температуре в течение 10 минут смесь фильтруют через целит. Полученный фильтрат концентрируют при пониженном давлении, остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 9/1), и получают соединение В-2 (161 мг, выход 67%).
1Н-ЯМР (CDCl3) δ: 5,65 (1Н, с), 2,90-2,86 (1Н, м), 2,28-1,24 (20Н, м), 1,08 (3Н, д, J=6,3 Гц), 0,58 (3Н, с), 0,18 (9Н, с).
(4) Соединение В-2 (1,2 г, 2,82 ммоль), полученное в (3), растворяют в тетрагидрофуране (10 мл), к раствору добавляют фторид тетрабутиламмония (1 М раствор в тетрагидрофуране, 4,23 мл, 4,23 ммоль), и смесь перемешивают при 50°c в течение 30 минут. Добавляют этилацетат, смесь промывают водой, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, и полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 19/1). Очищенный материал растворяют в безводном пиридине (10 мл), и раствор охлаждают до 0°C в атмосфере азота. К раствору добавляют хлортриэтилсилан (0,944 мл, 5,70 ммоль), и смесь нагревают до комнатной температуры и перемешивают в течение 2,5 часов. Реакционную смесь охлаждают до 0°C, и после добавления насыщенного водного раствора хлорида аммония и воды выполняют экстракцию толуолом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 99/1), и получают соединение В-3 (783 мг, выход 88%).
1Н-ЯМР (CDCl3) δ: 5,65 (1Н, с), 2,92-2,85 (1Н, м), 2,23 (1Н, дд, J=16,5, 3,4 Гц), 2,07-1,24 (19Н, м), 1,08 (3Н, д, J=6,6 Гц), 0,96 (9Н, т, J=7,9 Гц), 0,66 (6Н, к, J=7,9 Гц), 0,57 (3Н, с).
(5) Соединение В-3 (783 мг, 1,67 ммоль), полученное в (4), и соединение А-3 (733 мг, 1,39 ммоль), полученное в (2). растворяют в смеси безводный толуол/триэтиламин (1/1, 11,1 мл), к полученной смеси добавляют тетракис(трифенилфосфин)палладий (289 мг, 0,25 ммоль), и смесь перемешивают в атмосфере азота при 105°C в течение 2 часов. После охлаждения до комнатной температуры к смеси добавляют диамин-силикагель (производство Fuji Silysia Chemical Ltd., 6 г) и н-гексан (20 мл), и смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь фильтруют с использованием этилацетата, полученный фильтрат концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 100/0 → 95/5). Полученный очищенный материал безводном тетрагидрофуране (5,5 мл) и безводном метаноле (4,6 мл), к раствору добавляют раствор метоксида натрия в метаноле (0,91 мл, 5,46 ммоль), и смесь кипятят с обратным холодильником в течение 1 часа. Добавляют насыщенный водный раствор хлорида аммония, и смесь концентрируют при пониженном давлении. К полученному остатку добавляют этилацетат, смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 100/0 → 50/50), и получают соединение АВ-1 (609 мг, выход 67%).
1Н-ЯМР (CDCl3) δ: 6,18 (1Н, д, J=11,2 Гц), 6,02 (1Н, д, J=11,2 Гц), 5,30 (1Н, ушс), 5,00 (1Н, ушс), 4,46 (1Н, ушс), 4,05 (1Н, м), 3,88-3,69 (4Н, м), 3,36 (1Н, ушс), 2,94 (1Н, ушс), 2,83-2,77 (1Н, м), 2,62-2,56 (1Н, м), 2,24 (1Н, дд, J=16,5, 3,4 Гц), 2,10 (1Н, дд, J=13,9, 4,4 Гц), 2,06-1,21 (21Н, м), 1,07 (3Н, д, J=6,6 Гц), 0,96 (9Н, т, J=7,9 Гц), 0,93 (9Н, с), 0,87 (9Н, с), 0,67 (6Н, к, J=7,9 Гц), 0,55 (3Н, с), 0,10 (3Н, с), 0,10 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с).
(6) Соединение АВ-1 (427 мг, 0,514 ммоль), полученное в (5), растворяют в безводном дихлорметане (5,2 мл), и раствор охлаждают до 0°C. Затем добавляют реагент Десса-Мартина (523 мг, 1,23 ммоль), и после перемешивания при охлаждении льдом в течение 2 часов смесь нагревают до комнатной температуры и перемешивают в течение 1 часа. К смеси добавляют насыщенный водный раствор тиосульфата натрия и насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют дихлорметаном. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток растворяют в трет-бутаноле (21 мл), к раствору добавляют тетрагидрофуран (37 мл) и 2-метил-2-бутен (6,47 мл), и смесь охлаждают на льду. Добавляют водный раствор (7,3 мл) гипохлорита натрия (чистота 80%, 580 мг, 5,14 ммоль) и дигидрат дигидрофосфата натрия (400 мг, 2,57 ммоль), и смесь перемешивают при охлаждении льдом в течение 45 минут. К смеси добавляют насыщенный водный раствор тиосульфата натрия и насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 100/0 → 80/20), и получают соединение АВ-2 (341 мг, выход 78%).
1Н-ЯМР (CDCl3) δ: 6,22 (1Н, д, J=11,2 Гц), 6,00 (1Н, д, J=11,2 Гц), 5,27 (1Н, ушс), 4,99 (1Н, ушс), 4,45 (1Н, ушс), 4,07 (1Н, м), 3,91 (2Н, т, J=6,1 Гц), 3,36 (1Н, ушс), 2,84-2,77 (1Н, м), 2,64 (2Н, д, J=6,1, 1,5 Гц), 2,60-2,53 (1Н, м), 2,24 (1Н, дд, J=16,5, 3,4 Гц), 2,13 (1Н, дд, J=13,9, 5,4 Гц), 2,07-1,21 (19Н, м), 1,07 (3Н, д, J=6,3 Гц), 0,96 (9Н, т, J=7,9 Гц), 0,90 (9Н, с), 0,87 (9Н, с), 0,67 (6Н, к, J=7,9 Гц), 0,55 (3Н, с), 0,09 (3Н, с), 0,09 (6Н, с), 0,07 (3Н, с).
(7) Соединение АВ-2 (140 мг, 0,165 ммоль), полученное в (6), растворяют в ацетоне (1,65 мл), и раствор охлаждают до 0°C. Затем добавляют разбавленный раствор (1,65 мл) хлороводородной кислоты (6 N, 0,332 мл) в ацетоне, и смесь перемешивают при комнатной температуре в течение 4 часов. К смеси добавляют н-гексан (3,3 мл), и смесь предварительно очищают хроматографией на силикагеле (н-гексан/ацетон = 1/1) и тонкослойной хроматографией на силикагеле (н-гексан/ацетон = 4/5) и дополнительно очищают ВЭЖХ с обращенной фазой (А = 0,1% муравьиной кислоты/1% метанола/4% ацетонитрила/вода; В = 0,1% муравьиной кислоты/5% воды/19% метанола/ацетонитрил; 0-2 мин: В=20%, 2-20 мин: В=20% → 98%, 20-25 мин: В=98%, 25-30 мин: В=20%), и получают соединение С-1 (34,9 мг, выход 42%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,2 Гц), 6,00 (1Н, д, J=11,2 Гц), 5,39 (1Н, д, J=1,9 Гц), 5,09 (1Н, д, J=1,9 Гц), 4,50 (1Н, д, J=2,9 Гц), 4,36-3,58 (6Н, м), 3,35 (1Н, дд, J=8,1, 3,2 Гц), 2,86-2,79 (1Н, м), 2,72-2,57 (3Н, м), 2,29-2,19 (2Н, м), 2,04-1,20 (19Н, м), 1,06 (3Н, д, J=6,6 Гц),0,54(3Н, с).
Пример 2
Получение (5Z,7E)-(1R,2S,3R,20R)-2-(2-метоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение С-2)
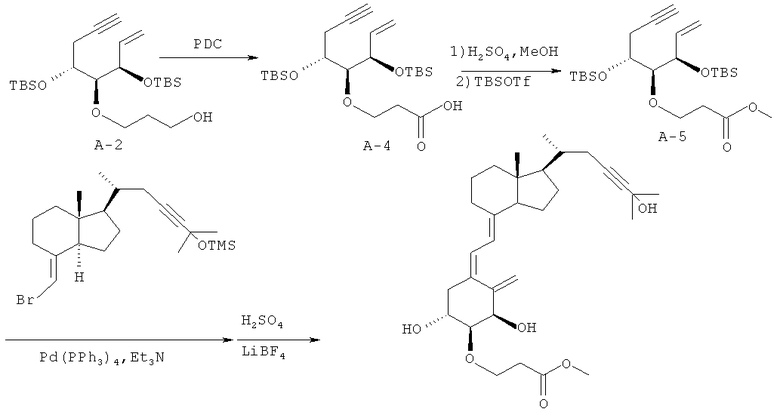
(1) Соединение А-2 (1,45 г, 3,27 ммоль), полученное в примере 1 (1), растворяют в безводном диметилформамиде (15 мл), к раствору добавляют дихромат пиридиния (6,17 г, 16,4 ммоль), и смесь перемешивают в течение 12 часов. Добавляют воду, смесь экстрагируют этилацетатом, и полученный органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (20% этилацетата/н-гексан), и получают соединение А-4 (0,82 г, выход 55%).
1Н-ЯМР (CDCl3) δ: 5,90 (1Н, ддд, J=17,0, 6,0, 11,0 Гц), 5,30-5,20 (2Н, м), 4,33 (1Н, ддт, J=7,0, 3,0, 1,0 Гц). 3,96 (2Н, тд, J=6,0, 1,2 Гц), 3,85-3,75 (1Н, м), 3,55 (1Н, дд, J=6,3, 3,7 Гц), 2,63 (2Н, тд, J=5,9, 1,9 Гц), 2,50-2,32 (2Н, м), 2,02 (1Н, т, J=2,7 Гц), 0,91 (9Н, с), 0,90 (9Н, с), 0,11 (3Н, с), 0,10 (3Н, с), 0,09 (3Н, с), 0,08 (3Н, с).
(2) Соединение А-4 (0,82 г, 1,79 ммоль), полученное в (1), растворяют в безводном метаноле (8 мл), к раствору добавляют концентрированную серную кислоту (74 мкл, 1,5 ммоль), и смесь перемешивают в течение 2,5 часов. После охлаждения до комнатной температуры к смеси добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Полученный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток растворяют в безводном дихлорметане, к раствору при охлаждении льдом добавляют 2,6-лутидин (1,01 мл, 9 ммоль) и трет-бутилдиметилсилилтрифторметансульфонат (1,65 мл, 7,2 ммоль), и затем смесь перемешивают при комнатной температуре в течение 1 часа. Добавляют безводный метанол (1,5 мл), и смесь перемешивают при комнатной температуре еще в течение 10 минут. К смеси добавляют смесь н-гексан/этилацетат (9/1), смесь промывают водой, и полученный органический слой сушат над безводным сульфатом натрия. Органический слой концентрируют при пониженном давлении, остаток очищают колоночной хроматографией на силикагеле (3% этилацетата/н-гексан), и получают соединение А-5 (683,4 мг, выход 81%).
1Н-ЯМР (CDCl3) δ: 5,94 (1Н, ддд, J=10,0, 17,2, 6,5 Гц), 5,21 (1Н, дт, J=17,3, 1,3 Гц), 5,14 (1Н, дт, J=10,0, 1,3 Гц), 4,30 (1Н, дд, J=6,8, 3,4 Гц), 4,00-3,97 (1Н, м), 3,88-3,82 (2Н, м), 3,68 (3Н, с), 3,40 (1Н, дд, J=5,5, 3,5 Гц), 2,57 (2Н, т, J=6,6 Гц), 2,48 (1Н, дк, J=16,8, 2,7 Гц), 2,35 (1Н, дк, J=17,0, 2,8 Гц), 1,96 (1Н, т, J=2,6 Гц), 0,90 (9Н, с), 0,89 (9Н, с), 0,09 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с), 0,03 (3Н, с).
(3) Соединение А-5 (47.0 мг, 0,1 ммоль), полученное в (2), и соединение В-2 (46,2 мг, 0,11 ммоль), полученное в примере 1 (3), растворяют в смеси толуол/триэтиламин (1/1, 2 мл), добавляют тетракис(трифенилфосфин)палладий (12,5 мг, 0,0108 ммоль), и смесь перемешивают в атмосфере азота при 110°C в течение 3 часов. Смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток предварительно очищают тонкослойной хроматографией на силикагеле (н-гексан/этилацетат = 19/1). Полученный предварительно очищенный материал растворяют в смеси безводный дихлорметан/ацетонитрил (1/1, 1 мл), к смеси при 0°C в атмосфере азота добавляют тетрафторборат лития (78 мг, 0,8 ммоль) и серную кислоту (1 М раствор в ацетонитриле, 0,08 мл, 0,08 ммоль), и смесь перемешивают в течение 30 минут. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Полученный органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток предварительно очищают тонкослойной хроматографией на силикагеле (н-гексан/этилацетат = 1/2) и дополнительно очищают ВЭЖХ с обращенной фазой (А = 95% воды/ацетонитрил; В = 0,5% воды/40% метанола/ацетонитрил; В = 75%),и получают соединение С-2 (6,8 мг, 13%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,2 Гц), 6,03 (1Н, д, J=11,2 Гц), 5,40 (1Н, д, J=1,2 Гц), 5,09 (1Н, д, J=2,2 Гц), 4,45 (1Н, т, J=3,3 Гц), 4,06-3,79 (3Н, м), 3,73 (3Н, с), 3,36 (1Н, дд, J=7,7, 3,3 Гц), 2,85-2,60 (7Н, м), 2,24 (2Н, дт, J=18,8, 5,9 Гц), 2,02-1,96 (3Н, м), 1,89-1,82 (2Н, м), 1,72-1,54 (6Н, м), 1,51 (6Н, s), 1,47-1,24 (4H, м), 1,06 (3Н, д, J=6,3 Гц), 0,54 (3Н, с).
МС m/z 537,2 (М+23)+523.3 (М+18)+.
Пример 3 Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-пропоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение С-4)
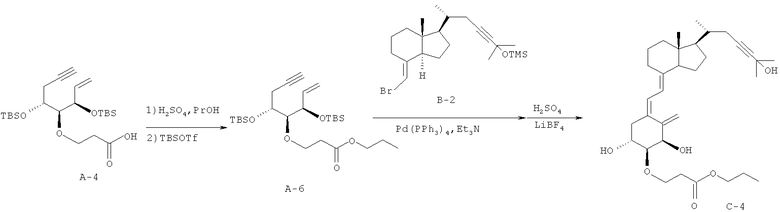
(1) С использованием в качестве исходного материала соединения А-4 (240 мг, 0,525 ммоль), полученного в примере 2 (1), и заменяя метанол пропанолом, осуществляют синтез так же, как в примере 2 (2), и получают соединение А-6 (18,5 мг, выход 27%).
(2) С использованием в качестве исходных материалов соединения А-6 (40,5 мг, 0,081 ммоль), полученного в (1), и соединения В-2 (47 мг, 0,11 ммоль), полученного в примере 1 (3), осуществляют синтез так же, как в примере 2 (3), и получают соединение С-4 (6,8 мг, выход 15%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,2 Гц), 6,03 (1Н, д, J=11,2 Гц), 5,39 (1Н, д, J=1,2 Гц), 5,09 (1Н, д, J=2,2 Гц), 4,45 (1Н, т, J=3,5 Гц), 4,08 (2Н, т, J=6,7 Гц), 4,06-3,95 (2Н, м), 3,85-3,77 (1Н, м), 3,36 (1Н, дд, J=7,8, 3,2 Гц), 2,85-2,82 (1Н, м), 2,79 (1Н, д, J=4,1 Гц), 2,70-2,62 (4Н, м), 2,26-2,22 (2Н, м), 2,03-1,98 (3Н, м), 1,90-1,80 (3Н, м), 1,70-1,64 (7Н, м), 1,58-1,53 (4Н, м), 1,51 (6Н, с),1,48-1,45 (2Н, м), 1,40-1,20 (4Н, м), 1,06 (3Н, д, J=6,6 Гц), 0,94 (4Н, т, J=7,4 Hz), 0,54 (3Н, с).
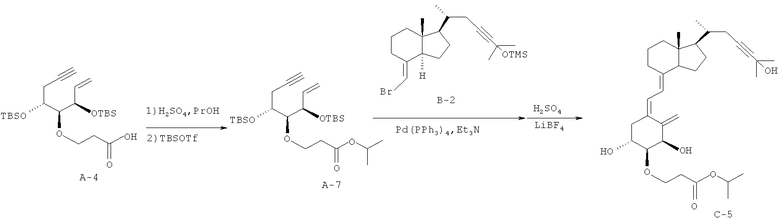
(1) С использованием в качестве исходного материала соединения А-4 (240 мг, 0,525 ммоль), полученного в примере 2 (1), и заменяя метанол изопропанолом, осуществляют синтез так же, как в примере 2 (2), и получают соединение А-7 (157,4 мг, выход 60%).
(2) С использованием в качестве исходных материалов соединения А-7 (35 мг, 0,07 ммоль), полученного в (1), и соединения В-2 (44 мг, 0,11 ммоль), полученного в примере 1 (3), осуществляют синтез так же, как в примере 2 (3), и получают соединение С-5 (6,8 мг, выход 17%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,0 Гц), 6,03 (1Н, д, J=11,5 Гц), 5,39 (1Н, д, J=1,5 Гц), 5,09-5,02 (2Н, м), 4,45 (1Н, т, J=3,5 Гц), 4,05-3,78 (3Н, м), 3,35 (1Н, дд, J=7,7, 3,3 Гц), 2,85-2,58 (6Н, м), 2,28-1,53 (18Н, м), 1,51 (6Н, с), 1,46-1,30 (5Н, м), 1,26 (3Н, д, J=1,7 Гц), 1,24 (3Н, д, J=1,5 Гц), 1,06 (3Н, д, J=6,3 Гц), 0,54 (3Н, с).
Пример 5
Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-карбоксипропил)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение D-1)
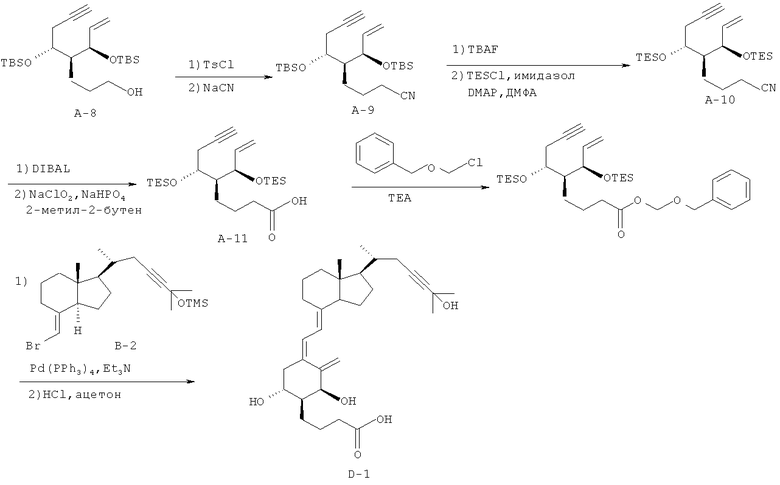
(1) Соединение А-8 (0,72 г, 1,69 ммоль), полученное таким же способом, как в примере 1 (1) из (3R,4R,5S)-3,5-бис[(трет-бутилдиметилсилил)окси]-4-[3-{(трет-бутилдиметилсилил)окси}пропил]окт-1-ен-7-ина - соединения, известного из литературы (например, из Saito, et al., Tetrahedron, 60, 7951-7961 (2004)), растворяют в дихлорметане (6,8 мл). К раствору при 0°C добавляют триэтиламин (0,47 мл, 3,37 ммоль), гидрохлорид триметиламина (16 мг, 0,169 ммоль) и п-толуолсульфонилхлорид (0,48 г, 2,53 ммоль), и смесь перемешивают при комнатной температуре в течение 1 часа. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, смесь экстрагируют этилацетатом, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, и полученный остаток растворяют в диметилформамиде (3 мл). К раствору добавляют цианид натрия (199 мг, 4,06 ммоль) и иодид натрия (380 мг, 2,53 ммоль), и смесь перемешивают при 50°C в течение 2 часов. Добавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния, концентрируют при пониженном давлении, и получают сырое соединение А-9. Его растворяют в тетрагидрофуране (5 мл), к раствору добавляют фторид тетрабутиламмония (1 М раствор в тетрагидрофуране, 5,07 мл, 5,07 ммоль), и смесь перемешивают при 60°C в течение 1 часа. Добавляют этилацетат, смесь промывают водой, и органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток растворяют в диметилформамиде (5 мл), к раствору при 0°C добавляют имидазол (460 мг, 6,76 ммоль), диметиламинопиридин (21 мг, 0,169 ммоль) и хлортриэтилсилан (0,851 мл, 5,07 ммоль), и смесь перемешивают при 50°C в течение 40 минут. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, смесь экстрагируют этилацетатом, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (1% этилацетата/н-гексан → 2% этилацетата/н-гексан → 5% этилацетата/н-гексан → 10% этилацетата/н-гексан), и получают соединение А-10 (531,3 мг, выход 72%).
1Н-ЯМР (CDCl3) δ: 5,82 (1Н, ддд, J=17,0, 10,0, 7,0 Гц), 5,17 (1Н, дд, J=17,2, 1,1 Гц), 5,11 (1Н, ддд, J=10,0, 2,0, 1,0 Гц), 4,00-3,95 (1Н, м), 2,42-2,37 (2Н, м), 2,32 (2Н, т, J=7,8 Гц), 1,97 (1Н, т, J=2,6 Гц), 1,85-1,65 (3Н, м), 1,43-1,29 (2Н, м), 1,26 (2Н, т, J=7,2 Гц), 0,89 (19Н, с), 0,09 (3Н, с), 0,06 (3Н, с), 0,06 (3Н, с), 0,03 (3Н, с).
(2) Соединение А-10 (449,4 мг, 1,03 ммоль), полученное в (1), растворяют в дихлорметане (5 мл), к раствору при охлаждении при -78°C добавляют гидрид диизобутилалюминия (1 М раствор в толуоле, 2,08 мл, 2,08 ммоль), и смесь перемешивают при -78°C в течение 50 минут. Добавляют безводный метанол (0,3 мл), и смесь перемешивают при комнатной температуре в течение 20 минут. Далее добавляют насыщенный водный раствор натрикалийтартрата, и смесь перемешивают в течение 10 минут. Добавляют этилацетат, смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток растворяют в тетрагидрофуране (6,9 мл), к раствору добавляют трет-бутанол (6,9 мл) и 2-метил-2-бутен (4,5 г), и смесь охлаждают на льду. К смеси добавляют водный раствор (6,9 мл) гипохлорита натрия (931 мг, 10,3 ммоль) и дигидрофосфат натрия (803 мг, 5,15 ммоль), и смесь перемешивают в течение 1 часа. Затем следует добавление насыщенного водного раствора тиосульфата натрия и затем добавление насыщенного водного раствора гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 100/1 → 50/1 → 20/1 → 10/1 → 5/1 → 2/1), и получают соединение А-11 (220 мг, выход 47%).
1H-NMR (CDCl3) δ: 5,82 (1Н, ддд, J=17,0, 10,0, 7,0 Гц), 5,17 (1Н, дд, J=17,2, 1,1 Гц), 5,11 (1Н, ддд, J=10,0, 2,0, 1,0 Гц), 4,00-3,95 (1Н, м), 2,42-2,37 (2Н, м), 2,32 (2Н, т, J=7,8 Гц), 1,97 (1Н, т, J=2,6 Гц), 1,85-1,65 (3Н, м), 1,43-1,29 (2Н, м), 1,26 (2Н, т, J=7,2 Гц), 0,89 (19Н, с), 0,09 (3Н, с), 0,06 (3Н, с), 0,06 (3Н, с), 0,03 (3Н, с).
(3) Соединение А-11 (126,6 мг, 0,278 ммоль), полученное в (2), растворяют в диметилформамиде (1,2 мл), к раствору при охлаждении при 0°C добавляют триэтиламин (0,126 мл, 0,9 ммоль), и смесь перемешивают в течение 40 минут. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 95/5), и получают соединение А-12 (126,5 мг, выход 79%).
1H-NMR (CDCl3) δ: 5,82 (1Н, ддд, J=17,0, 10,0, 7,0 Гц), 5,17 (1Н, дд, J=17,2, 1,1 Гц), 5,11 (1Н, ддд, J=10,0, 2,0, 1,0 Гц), 4,00-3,95 (1Н, м), 2,42-2,37 (2Н, м), 2,32 (2Н, т, J=7,8 Гц), 1,97 (1Н, т, J=2,6 Гц), 1,85-1,65 (3Н, м), 1,43-1,29 (2Н, м), 1,26 (2Н, т, J=7,2 Гц), 0,89 (19Н, с), 0,09 (3Н, с), 0,06 (3Н, с), 0,06 (3Н, с), 0,03 (3Н, с).
(4) Соединение А-12 (46 мг, 0,08 ммоль), полученное выше в (3), и соединение В-2 (47 мг, 0,1 ммоль), полученное в примере 1 (3), растворяют в смеси толуол/триэтиламин (1/1, 0,2 мл), к раствору добавляют тетракис(трифенилфосфин)палладий (12 мг, 0,01 ммоль), и смесь перемешивают в атмосфере азота при 110°С в течение 3 часов. Смесь охлаждают до комнатной температуры и затем концентрируют при пониженном давлении. Остаток предварительно очищают тонкослойной колоночной хроматографией на силикагеле (н-гексан/этилацетат = 19/1). Полученный предварительно очищенный материал растворяют в ацетоне, добавляют к раствору соляную кислоту (6 N, 0,1 мл, 0,6 ммоль), и смесь перемешивают при 0°C в течение 50 минут. Добавляют еще соляную кислоту (6 N, 0,2 мл, 1,2 ммоль), и смесь перемешивают при комнатной температуре в течение 40 минут. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния, концентрируют при пониженном давлении, и полученный остаток предварительно очищают на установке Bond Elut SI (производство Varian, Inc.; н-гексан/этилацетат = 1/2 → этилацетат → этилацетат/уксусная кислота = 99/1). Предварительно очищенный материал дополнительно очищают ВЭЖХ с обращенной фазой (А=95% воды/ацетонитрил; В=0,5% уксусной кислоты/5% воды /ацетонитрил; В=65%), и получают соединение D-1 (14,6 мг, 36%).
1Н-ЯМР (CDCl3) δ: 6,40 (1Н, д, J=11,5 Гц), 6,00 (1Н, д, J=11,2 Гц), 5,27 (1Н, д, J=1,5 Гц), 4,99 (1Н, д, J=2,0 Гц), 4,39 (1Н, т, J=4,0 Гц), 3,92-3,84 (1Н, м), 2,86-2,79 (1Н, м), 2,65 (1Н, дд, J=13,3, 4,3 Гц), 2,30-2,20 (4Н, м), 2,05-1,96 (3Н, м), 1,88 (2Н, т, J=10,0 Гц), 1,81-1,64 (8Н, м), 1,56 (6Н, дт, J=15,3, 4,5 Гц), 1,51 (6Н, с), 1,49-1,46 (3Н, м), 1,45 (9Н, с), 1,40-1,24 (5Н, м), 1,06 (3Н, д, J=6,6 Гц), 0,54 (3Н, с), 0,54 (3Н, с).
Пример 6
Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-(1,1-диметил)этоксикарбонилпропил)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение D-6)
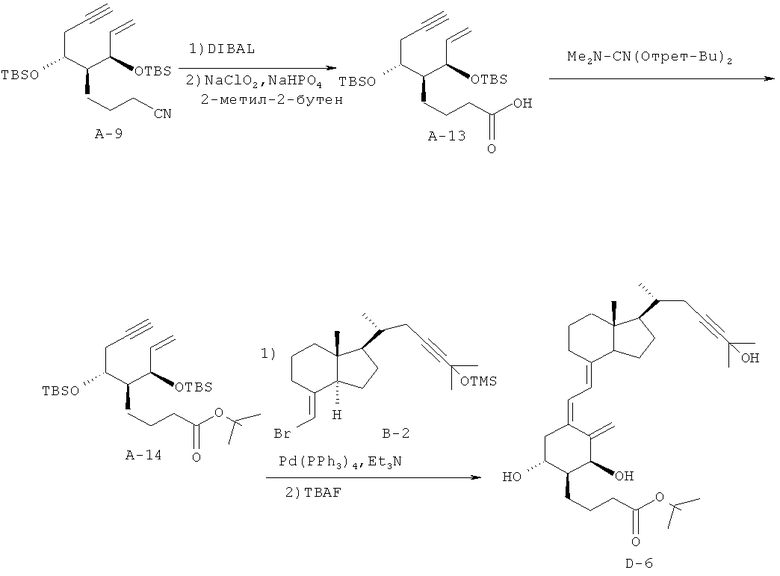
(1) Соединение А-9 (565 мг, 1,29 ммоль), полученное в примере 5 (1), растворяют в дихлорметане, к раствору при охлаждении при -78°C добавляют гидрид диизобутилалюминия (1 М раствор в толуоле, 2 мл, 2 ммоль), и смесь перемешивают при -78°C в течение 2 часов. Добавляют безводный метанол (1 мл), и смесь перемешивают при комнатной температуре в течение 20 минут. Далее добавляют насыщенный водный раствор натрикалийтартрата, и смесь перемешивают в течение 10 минут. Добавляют этилацетат, смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток растворяют в тетрагидрофуране (18,3 мл), к раствору добавляют трет-бутанол (18,3 мл) и 2-метил-2-бутен (6 мл), и смесь охлаждают на льду. К смеси добавляют водный раствор (5 мл) гипохлорита натрия (1,47 г, 13 ммоль) и дигидрофосфат натрия (1,01 г, 6,5 ммоль), и смесь перемешивают в течение 1 часа. К смеси добавляют насыщенный водный раствор тиосульфата натрия и затем насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (н-гексан/этилацетат = 9/1 → 7/1 → 5/1), и получают соединение А-13 (233,7 мг, выход 38%).
1Н-ЯМР (CDCl3) δ: 5,82 (1Н, ддд, J=17,0, 10,0, 7,0 Гц), 5,17 (1Н, дд, J=17,2, 1,1 Гц), 5,11 (1Н, ддд, J=10,0, 2,0, 1,0 Гц), 4,00-3,95 (1Н, м), 2,42-2,37 (2Н, м), 2,32 (2Н, т, J=7,8 Гц), 1,97 (1Н, т, J=2,6 Гц), 1,85-1,65 (3Н, м), 1,43-1,29 (2Н, м), 1,26 (2Н, т, J=7,2 Гц), 0,89 (19Н, с), 0,09 (3Н, с), 0,06 (3Н, с), 0,06 (3Н, с), 0,03 (3Н, с).
(2) К соединению А-13 (228,4 мг, 0,5 ммоль), полученному в (1), добавляют толуол (5 мл) и ди-трет-бутилацеталь N,N-диметилформамида (1,1 мл, 4 ммоль), и смесь перемешивают при 80°C в течение 1 часа. К смеси добавляют этилацетат, смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают хроматографией на силикагеле (3% этилацетата/н-гексан), и получают соединение А-14 (118,5 мг, выход 46%).
1Н-ЯМР (CDCl3) δ: 5,83 (1Н, ддд, J=17,0, 10,0, 7,0 Гц), 5,15 (1Н, дк, J=17,2, 1,0 Гц), 5,10 (1Н, дк, J=10,0, 1,0 Гц), 4,12 (1Н, дд, J=8,0, 5,0 Гц), 4,00 (1Н, тд, J=6,2, 3,8 Гц), 2,39 (2Н, дд, J=6,1,2,7 Гц), 2,17 (2Н, т, J=8,0 Гц), 1,79-1,63 (3Н, м), 1,44 (9Н, с), 1,40-1,20 (4Н, м), 0,89 (18Н, с), 0.09 (3Н, с), 0,06 (3Н, с), 0,05 (3Н, с), 0,03 (3Н, с).
(3) Соединение А-14 (59,6 мг, 0,12 ммоль), полученное в (2), и соединение В-2 (60 мг, 0,14 ммоль), полученное в примере 1 (3), растворяют в смеси толуол/триэтиламин (1/1, 2 мл), к раствору добавляют тетракис(трифенилфосфин)палладий (17 мг, 0,0147 ммоль), и смесь перемешивают в атмосфере азота при 110°C в течение 3,5 часов. Смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток предварительно очищают тонкослойной хроматографией на силикагеле (н-гексан/этилацетат = 19/1). Полученный предварительно очищенный материал растворяют в тетрагидрофуране, добавляют к раствору фторид тетрабутиламмония (1 М раствор в тетрагидрофуране, 0,84 мл, 0,84 ммоль), и смесь перемешивают при 60°C в течение 2 часов. Добавляют этилацетат, смесь промывают водой, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, и полученный остаток предварительно очищают тонкослойной хроматографией на силикагеле (н-гексан/этилацетат = 1/1) и дополнительно очищают ВЭЖХ с обращенной фазой (А = 95% воды/ацетонитрил; В = 0,5% воды/40% метанола/ацетонитрил; В = 85%), и получают соединение D-6 (5,0 мг, выход 7%).
1Н-ЯМР (CDCl3) δ: 6,40 (1Н, д, J=11,5 Гц), 6,00 (1Н, д, J=11,2 Гц), 5,27 (1Н, д, J=1,5 Гц), 4,99 (1Н, д, J=2,0 Гц), 4,39 (1Н, т, J=4,0 Гц), 3,92-3,84 (1Н, м), 2,86-2,79 (1Н, м), 2,65 (1Н, дд, J=13,3, 4,3 Гц), 2,30-2,20 (4Н, м), 2,05-1,96 (3Н, м), 1,88 (2Н, т, J=10,0 Гц), 1,81-1,64 (8Н, м), 1,56 (6Н, дт, J=15,3, 4,5 Гц), 1,51 (6Н, с), 1,49-1,46 (3Н, м), 1,45 (9Н, с), 1,40-1,24 (5Н, м), 1,06 (3Н, д, J=6,6 Гц), 0,54 (3Н, с), 0,54 (3Н, с).
Пример 7
Получение (5Z,7E)-(1R,2S,3R,20R)-2-((трет-бутилкарбонилокси)метоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение С-7)
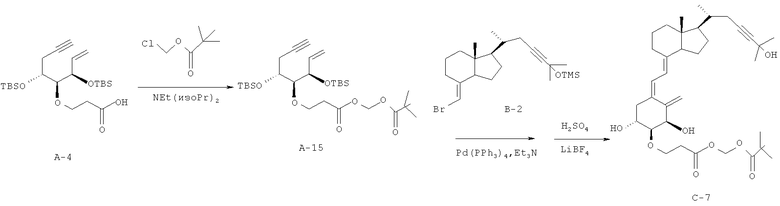
(1) Соединение А-4 (164,3 мг, 0,360 ммоль), полученное в примере 2 (1), растворяют в безводном N,N-диметилформамиде (1,2 мл), и раствор охлаждают до 0°C. К раствору добавляют триэтиламин (0,15 мл, 1,08 ммоль) и пивалоилоксиметилхлорид (0,104 мл, 0,719 ммоль), и смесь перемешивают при комнатной температуре в течение 1 часа. Через 1 час добавляют иодид натрия (150 мг, 1,008 ммоль) и карбонат калия (140 мг, 1,008 ммоль), и смесь перемешивают при нагревании при 50°C еще в течение 30 минут.
Реакционную смесь охлаждают до комнатной температуры, и после разбавления водой полученную смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 5/1), и получают соединение А-15 (158,0 мг, выход 77%).
1Н-ЯМР (CDCl3) δ: 5,98-5,90 (1Н, м), 5,76 (2Н, с), 5,21 (1Н, дт, J=17,32, 1,46 Гц), 5,14 (1Н, дт, J=10,37, 1,10 Гц), 4,30 (1Н, дд, J=8,00, 3,00 Гц), 4,02-3,82 (3Н, м), 3,42 (1Н, дд, J=5,61, 3,41 Гц), 2,62 (2Н, т, J=6,71 Гц), 2,47 (1Н, ддд, J=16,83, 2,68, 5,50 Гц), 2,34 (1Н, ддд, J=16,83, 2,76, 5,50 Гц), 1,96 (1Н, т, J=2,68 Гц), 1,21 (9Н, с), 0,90 (9Н, с), 0,89 (9Н, с), 0,09 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с), 0,03 (3Н, с).
(2) С использованием в качестве исходных материалов соединения А-15 (40 мг, 0,07 ммоль), полученного в (1), и соединения В-2 (36 мг, 0,085 ммоль), полученного в примере 1 (3), выполняют синтез так же, как в примере 2 (3), и получают соединение С-7 (7,8 мг, выход 18%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11.47 Гц), 6,02 (1Н, д, J=11,22 Гц), 5,81-5,76 (2Н, м), 5,39 (1Н, д, J=1,46 Гц), 5,09 (1Н, д, J=2,20 Гц), 4,44 (1Н, с), 4,04-3,95 (2Н, м), 3,85-3,80 (1Н, м), 3,36 (1Н, дд, J=7,56, 3,17 Гц), 2,85-2,57 (6Н, м), 2,28-1,81 (8Н, м), 1,59-1,24 (16Н, м), 1,23 (9Н, с), 1,06 (3Н, д, J=6,59 Гц), 0,54 (3Н, с).
Пример 8
Получение (5Z,7E)-(1R,2S,3R,20R)-2-((фенилкарбонилокси)метоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение C-8)
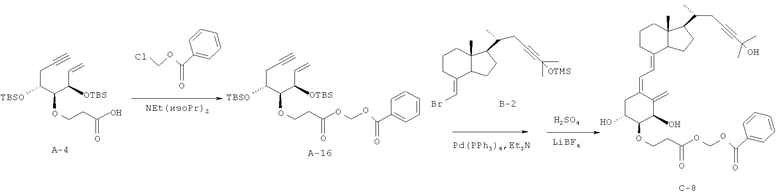 С использованием в качестве исходного материала соединения А-4 (175 мг, 0,383 ммоль), полученного в примере 2 (1), и заменяя пивалоилоксиметилхлорид на бензоилоксиметилхлорид, выполняют синтез так же, как в примере 7 (1), и получают соединение А-16. Затем с использованием в качестве исходных материалов соединения А-16 (41,3 мг, 0,07 ммоль) и соединения В-2 (34 мг, 0,08 ммоль), полученного в примере 1 (3), выполняют синтез так же, как в примере 7 (2), и получают соединение С-8 (4,9 мг, выход 11%).
С использованием в качестве исходного материала соединения А-4 (175 мг, 0,383 ммоль), полученного в примере 2 (1), и заменяя пивалоилоксиметилхлорид на бензоилоксиметилхлорид, выполняют синтез так же, как в примере 7 (1), и получают соединение А-16. Затем с использованием в качестве исходных материалов соединения А-16 (41,3 мг, 0,07 ммоль) и соединения В-2 (34 мг, 0,08 ммоль), полученного в примере 1 (3), выполняют синтез так же, как в примере 7 (2), и получают соединение С-8 (4,9 мг, выход 11%).
1Н-ЯМР (CDCl3) δ: 8,09-8,07 (2Н, м), 7,62-7,44 (3Н, м), 6,41 (1Н, д, J=10,98 Гц), 6,05-6,01 (3Н, м), 5,38 (1Н, д, J=1,46 Гц), 5,07 (1Н, д, J=1,95 Гц), 4,44 (1Н, д, J=2,93 Гц), 4,05-3,97 (2Н, м), 3,87-3,82 (1Н, м), 3,36 (1Н, дд, J=7,56, 3,17 Гц), 2,85-2,64 (4Н, м), 2,32-2,18 (2Н, м), 2,05-1,53 (9Н, м), 1,49-1,24 (4Н, м), 1,06 (3Н, д, J=6,34 Гц), 0,55 (3Н, с).
Пример 9
Получение (5Z,7Е)-(1R,2S,3R,20R)-2-((2-карбокси-2,2-этано)этокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение Е-1)
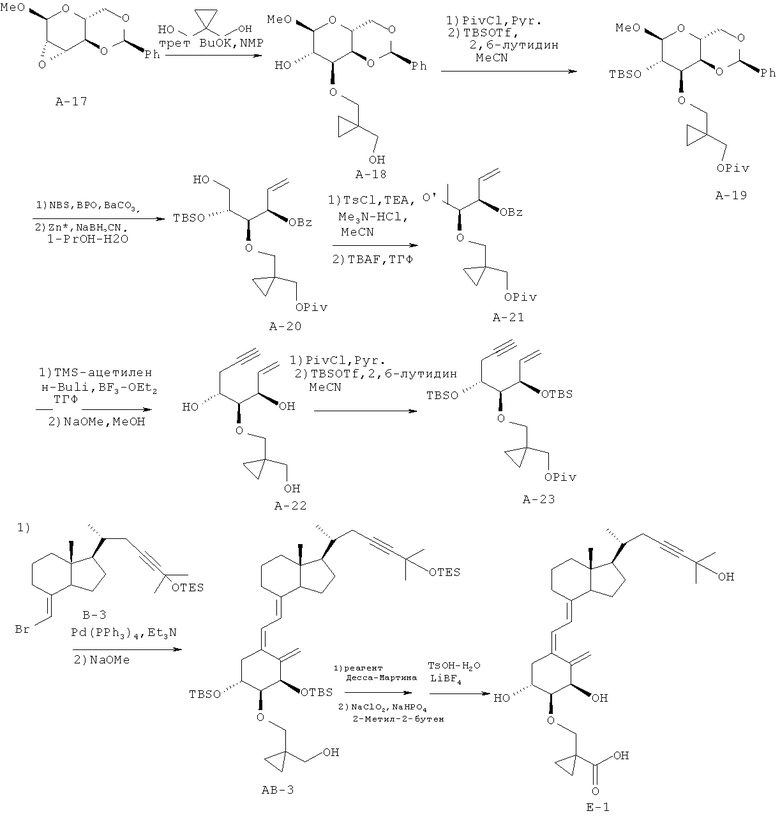
(1) Соединение А-17 (6,03 г, 22,8 ммоль), описанное в литературе (например, в Kittaka et al., J. Org. Chem., 69, 7463-7471 (2004)), растворяют в N-метилпирролидоне (60 мл), к раствору добавляют трет-бутоксид калия (11,88 г, 114 ммоль), и смесь перемешивают при нагревании при 130°C в течение 4 часов. Реакционную смесь охлаждают до комнатной температуры, добавляют к ней воду (240 мл) и затем DIAION HP-20SS (производство Mitsubishi Chemical Corporation, 30 г (сухая масса)), и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь фильтруют, твердый материал промывают насыщенным водным раствором хлорида аммония (100 мл) и водой (200 мл), и экстрагируют ацетоном (500 мл). Экстракт концентрируют при пониженном давлении и разбавляют этилацетатом. Смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 1/4), и получают соединение А-18 (1,78 г, выход 21%).
1Н ЯМР(CDCl3) δ: 7,51-7,36 (5Н, м), 5,54 (1Н, с), 4,61 (1Н, с), 4,40-4,29 (2Н, м), 4,08 (1Н, т, J=4,27 Гц), 4,01 (1Н, дд, J=9,27, 2,68 Гц), 3,93 (1Н, ушс), 3,83-3,75 (3Н, м), 3,60-3,50 (3Н, м), 3,41 (3Н, с), 0,59-0,41 (3Н, м).
(2) Соединение А-18 (2,97 г, 8,10 ммоль), полученное в (1), растворяют в безводном пиридине (30 мл), и раствор охлаждают до 0°C. К раствору добавляют пивалоилхлорид (1,15 мл, 9,32 ммоль), и смесь перемешивают при той же температуре в течение 1 часа. К смеси добавляют безводный метанол (3 мл), и смесь перемешивают при комнатной температуре в течение 5 минут и концентрируют при пониженном давлении. Остаток растворяют в толуоле, раствор промывают насыщенным водным раствором хлорида натрия, и затем органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении и сушат. Полученный сырой материал растворяют в безводном дихлорметане (20 мл), раствор охлаждают до 0°C, и после добавления 2,6-лутидина (1,3 мл, 11,6 ммоль) и трет-бутилдиметилсилилтрифторметансульфоната (2,14 мл, 9,32 ммоль) смесь перемешивают при комнатной температуре в течение 1 часа. Добавляют безводный метанол (5 мл), и смесь концентрируют при пониженном давлении. Остаток растворяют в толуоле, раствор промывают водой, и органический слой сушат над безводным сульфатом натрия. Раствор концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (5% этилацетата/н-гексан → 10% этилацетата/н-гексан), и получают соединение А-19 (3,19 г, выход 69%).
1Н ЯМР(CDCl3) δ: 7,49-7,34 (5Н, м), 5,56 (1Н, с), 4,45 (1Н, с), 4,29-4,25 (2Н, м), 4,18 (1Н, д, J=11,22 Гц), 3,98-3,92 (3Н, м), 3,75 (1Н, т, J=12,08 Гц), 3,65 (1Н, т, J=2,68 Гц), 3,56 (2Н, дд, J=29,76, 9,51 Гц), 3,35 (3Н, с), 1,19 (9Н, с), 0,91 (9Н, с), 0,61-0,51 (4Н, м), 0,10(3Н, с),0,10(3Н, с).
(3) Соединение А-19 (3,17 г, 5,61 ммоль), полученное в (2), растворяют в циклогексане (63 мл), к раствору добавляют карбонат бария (775 мг, 3,92 ммоль), пероксид бензоила (136 мг, 0,56 ммоль) и N-бромсукцинимид (1,21 г, 6,73 ммоль), и смесь кипятят с обратным холодильником в течение 1 часа. После охлаждения смесь фильтруют через целит, и органический слой промывают в указанном порядке насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия. Затем органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении, и получают сырой материал (4,0 г). Полученный сырой материал растворяют в смешанном растворителе из 1-пропанола (36 мл) и воды (4 мл), к раствору добавляют активированный цинк (7,38 г, 112,2 ммоль) и цианоборогидрид натрия (1,42 г, 22,4 ммоль), и смесь кипятят с обратным холодильником в течение 1 часа. После охлаждения смесь фильтруют через целит, твердое вещество промывают 1-пропанолом, и затем жидкость концентрируют при пониженном давлении. Полученный остаток разбавляют этилацетатом, промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат = 90/10 → 80/20), и получают соединение А-20 (1,50 г, выход 50%).
1Н ЯМР(CDCl3) δ: 8,05-8,02 (2Н, м), 7,59-7,43 (3Н, м), 6,11 (1Н, ддд, J=11,00, 17,32, 6,00 Гц), 5,78-5,75 (1Н, м), 5,41 (1Н, дт, J=17,32, 1,34 Гц), 5,30 (1Н, дт, J=10,49, 1,22 Гц), 4,17 (1Н, д, J=11,47 Гц), 3,96-3,93 (2Н, м), 3,81 (1Н, дд, J=11,47, 5,12 Гц), 3,73-3,68 (2Н, м), 3,64 (1Н, д, J=9,76 Гц), 3,50 (1Н, д, J=9,76 Гц), 1,18 (9Н, с), 0,90 (9Н, с), 0,55 (4Н, т, J=1,95 Гц), 0,09 (3Н, с), 0,07 (3Н, с).
(4) Соединение А-20 (2,41 г, 4,5 ммоль), полученное в (3), растворяют в ацетонитриле (25 мл), к раствору добавляют триэтиламин (1,26 мл, 9 ммоль), гидрохлорид триметиламина (86 мг, 0,9 ммоль) и п-толуолсульфонилхлорид (1,30 г, 6,8 ммоль) в указанном порядке, и смесь перемешивают при комнатной температуре в течение 1 часа. Добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь концентрируют при пониженном давлении. Остаток разбавляют этилацетатом, и смесь промывают насыщенным водным раствором хлорида натрия. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Сырой материал (3,31 г) растворяют в тетрагидрофуране (18 мл), к раствору добавляют фторид тетрабутиламмония (1 М раствор в тетрагидрофуране, 13,5 мл, 13,5 ммоль), и смесь кипятят с обратным холодильником в течение 1,5 часов. После охлаждения смесь концентрируют при пониженном давлении, и остаток разбавляют толуолом. Смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении.
Полученный остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат = 90/10), и получают соединение А-21 (851 мг, выход 47%).
1Н ЯМР(CDCl3) δ: 8,06-8,02 (2Н, м), 7,61-7,44 (3Н, м), 6,10-6,01 (1Н, м), 5,67-5,64 (1Н, м), 5,42 (1Н, дт.J=17,24, 1,34 Гц), 5,32 (1Н, дт, J=10,57, 1,22 Гц), 4,04 (2Н, дд, J=27,32, 11,22 Гц), 3,65 (1Н, д, J=10,24 Гц), 3,53 (1Н, д, J=10,24 Гц), 3,17 (1Н, дд, J=7,32, 5,37 Гц), 3,10-3,06 (1Н, м), 2,75 (1Н, т, J=4,39 Гц), 2,60 (1Н, дд, J=4,88, 2,93 Гц), 1,19 (9Н, с),0,55(4Н, с).
(5) Раствор триметилсилилацетилена (1,62 мл, 11,5 ммоль) в тетрагидрофуране (3 мл) помещают в атмосферу азота и охлаждают смесью сухой лед-ацетон. К раствору добавляют раствор н-бутиллития в гексане (2,64 М, 3,97 мл, 10,5 ммоль), и смесь перемешивают в течение 45 минут. К полученной смеси добавляют раствор соединения А-21 (846 мг, 2,1 ммоль), полученного в (4), в тетрагидрофуране (6 мл) и комплекс трифторборан-диэтиловый эфир (0,343 мл, 2,73 ммоль), и смесь перемешивают в течение 2 часов при охлаждении смесью сухой лед-ацетон и затем перемешивают в течение 1 часа при 0°C. К смеси добавляют насыщенный водным раствором хлорид аммония, смесь приводят к комнатной температуре и разбавляют этилацетатом. Раствор последовательно промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток растворяют в безводном метаноле (10 мл), добавляют к раствору метоксид натрия (870 мг, 6,3 ммоль), и смесь перемешивают при нагревании при 50°C в течение 1 часа. После охлаждения смесь концентрируют при пониженном давлении. Остаток разбавляют этилацетатом, затем смесь промывают насыщенным водным раствором хлорида натрия, и органический слой сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат = 60/40 → 50/50 → 35/65), и получают соединение А-22 (311,5 мг, выход 62%).
1Н ЯМР(CDCl3) δ: 5,57 (1Н, ддд, J=17,00, 11,00, 6,00 Гц), 4,88 (1Н, дт, J=17,00, 1,70 Гц), 4,73 (1Н, дт, J=11,00, 1,70 Гц), 3,85-3,81 (1Н, м), 3,51 (1Н, ддд, J=8,42, 5,73, 2,07 Гц), 3,16 (1Н, д, J=9,50 Гц), 3,05 (1Н, д, J=9,50 Гц), 2,85 (2Н, дд, J=4,63, 2,20 Гц), 2,12-1,92 (2Н, м), 1,85 (1Н, т, J=2,68 Гц).
(6) Соединение А-22 (534,4 мг, 2,26 ммоль), полученное в (5), растворяют в безводном пиридине (7,5 мл), и после добавления при 0°C пивалоилхлорида (0,276 мл, 2,26 ммоль) смесь перемешивают при той же температуре в течение 45 минут. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия. Смесь разбавляют толуолом и промывают рассолом. Органический слой сушат над безводным сульфатом магния и упаривают, и получают остаток. Остаток разбавляют сухим дихлорметаном (10 мл), и к раствору при 0°C добавляют 2,6-лутидин (1,1 мл, 9,22 ммоль) и трет-бутилдиметилсилилтрифторметансульфонат (1,7 мл, 7,55 ммоль). Реакционную смесь перемешивают при той же температуре в течение 1,5 часов. Реакционную смесь разбавляют этилацетатом, и органический слой промывают рассолом, сушат над безводным сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (гексан/этилацетат = 99/1 → 85/15), и получают соединение А-23 (1,08 г, выход 91%).
1Н-ЯМР (CDCl3) δ: 6,00-5,91 (1Н, м), 5,21 (1Н, д, J=17,32 Гц), 5,13 (1Н, д, J=11,00 Гц), 4,32 (1Н, дд, J=7,07, 3,90 Гц), 4,03 (2Н, дд, J=19,03, 11,22 Гц), 3,94 (1Н, дд, J=10,73, 5,85 Гц), 3,64 (1Н, д, J=9,76 Гц), 3,45 (1Н, д, J=9,76 Гц), 3,39 (1Н, т, J=4,27 Гц), 2,51 (1Н, ддд, J=16,83, 6,00, 3,00 Гц), 2,36 (1Н, ддд, J=16,71, 6,10, 2,56 Гц), 1,95 (1Н, т, J=2,56 Гц), 1,19 (9Н, с), 0,90 (9Н, с), 0,88 (9Н, с), 0,55-0,48 (3Н, м), 0,11 (3Н, с), 0,09 (3Н, с), 0,06 (3Н, с), 0,03 (3Н, с).
(7) С использованием в качестве исходных материалов соединения А-23 (70 мг, 0,15 ммоль), полученного в (6), и соединения В-3 (69 мг, 0,16 ммоль), полученного в примере 1 (4), выполняют синтез так же, как в примере 1 (5), и получают соединение АВ-3 (48,1 мг, 37,4%).
1Н-ЯМР (CDCl3) δ: 6,18 (1Н, д, J=10,98 Гц), 6,02 (1Н, д, J=11,47 Гц), 5,32 (1Н, с), 5,01 (1Н, с), 4,47 (1Н, с), 4,03 (1Н, к, J=4,15 Гц), 3,91 (1Н, д, J=9,03 Гц), 3,58 (1Н, дд, J=11,10, 4,03 Гц), 3,46-3,39 (2Н, м), 3,32 (1Н, д, J=9,51 Гц), 3,21 (1Н, ушс), 2,80 (1Н, т, J=7,81 Гц), 2,61 (1Н, д, J=13,42 Гц), 2,24 (1Н, дд, J=16,34, 3,42 Гц), 2,10 (1Н, дд, J=13,66, 4,15 Гц), 2,05-1,84 (4Н, м), 1,66-1,49 (12Н, м), 1,43-1,30 (4Н, м), 1,07 (4Н, д, J=6,59 Гц), 0,98-0,83 (36Н, м), 0,82-0,81 (2Н, м), 0,70-0,64 (9Н, м), 0,57-0,54 (6Н, м), 0,51-0,36 (6Н, м), 0,11 (3Н, с), 0,10 (3Н, с), 0,08 (3Н, с), 0,07 (3Н, с).
(8) С использованием в качестве исходного материала соединения АВ-3 (48,1 мг, 0,056 ммоль), полученного в (7), осуществляют такую же обработку, как в примере 1 (6). Продукт реакции (28,5 мг, 0,0327 ммоль) растворяют в смешанном растворителе безводный дихлорметан/ацетонитрил (1/1, 1 мл), и раствор охлаждают до 0°C. Затем добавляют моногидрат п-толуолсульфоновой кислоты (31 мг, 0,163 ммоль) и тетрафторборат лития (30 мг, 0,327 ммоль), и смесь перемешивают при той же температуре в течение 30 минут. К реакционной смеси добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении.
Полученный остаток предварительно очищают тонкослойной хроматографией на силикагеле (этилацетат/ацетон = 9/1+0,5% уксусной кислоты) и дополнительно очищают ВЭЖХ с обращенной фазой (А = 95% воды/ацетонитрил; В = 0,5% воды/40% метанола/ацетонитрил; В = 85%), и получают соединение Е-1 (4,9 мг, выход 16,6%).
1Н-ЯМР (CDCl3) δ: 6,41 (1Н, д, J=11,22 Гц), 6,01 (1Н, д, J=10,98 Гц), 5,37 (1Н, с), 5,08 (1Н, д, J=1.46 Гц), 4,48 (1Н, д, J=2,68 Гц), 4,06-3,82 (2Н, м), 3,55-3,25 (2Н, м), 2,88-2,60 (2Н, м), 2,28-1,54 (13Н, м), 1,42-1,20 (10Н, м), 1,10-1,08 (1Н, м), 1,06 (3Н, д, J=6,59 Гц), 0,91 (3Н, д, J=4,88 Гц), 0,54 (3Н, с).
Пример 10
Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-карбоксиэтокси)-26,27-диметил-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение F-1)
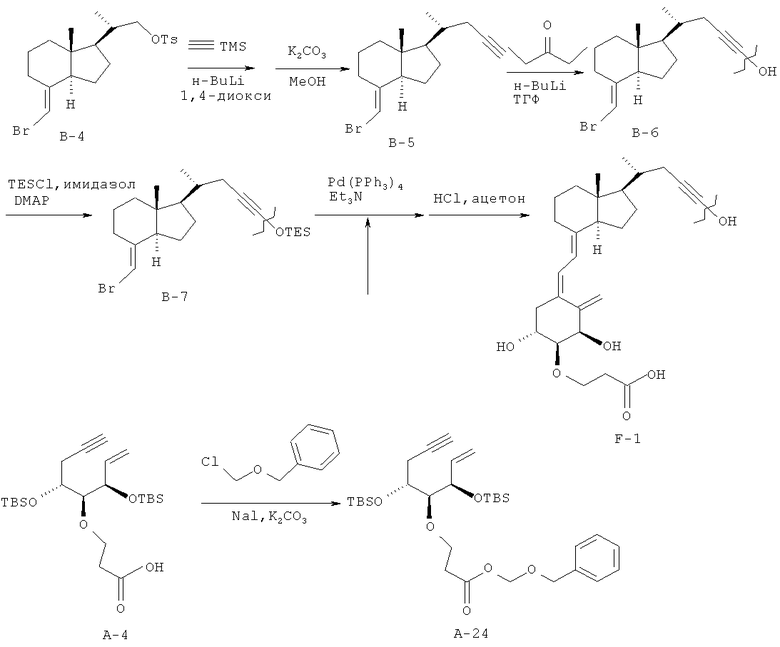
(1) Триметилсилилацетилен (1,84 мл, 13,0 ммоль) растворяют в 1,4-диоксане (15 мл), и к раствору в атмосфере аргона и при охлаждении на ледяной бане добавляют по каплям в течение 10 минут 1,59 М раствор н-бутиллития в гексане (8,18 мл, 13,0 ммоль). К полученной смеси добавляют соединение В-4 (1,91 г, 4,33 ммоль), растворенное в 1,4-диоксане (10 мл), причем соединение В-4 синтезируют согласно способу Tanaka et al. (международная публикация №WO 98/58909), и смесь кипятят с обратным холодильником при 110°C в течение 24 часов. После охлаждения до комнатной температуры к смеси добавляют насыщенный водный раствор хлорида аммония и затем перемешивают. Затем смесь экстрагируют н-гексаном, и полученный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток растворяют в смеси тетрагидрофуран-метанол (1:1, 20 мл), к раствору добавляют карбонат калия (718 мг, 5,20 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют воду, и затем смесь экстрагируют н-гексаном. Полученный органический слой промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан), и получают соединение В-5 (1,14 г, выход 89%).
1Н-ЯМР (CDCl3) δ: 5,65 (1Н, с), 2,90-2,86 (1Н, м), 2,25 (1Н, дт, J=16,6, 3,0 Гц), 2,10-1,88 (5Н, м), 1,72-1,25 (9Н, м), 1,11 (3Н, д, J=6,6 Гц), 0,58 (3Н, с).
(2) Соединение В-5 (301 мг, 1,02 ммоль), полученное в (1), растворяют в тетрагидрофуране (10 мл), к раствору в атмосфере аргона и при охлаждении до -78°C добавляют по каплям 1,59 М раствор н-бутиллития в н-гексане (0,673 мл, 1,02 ммоль), и смесь перемешивают в течение 30 минут. К смеси добавляют 3-пентанон (0,216 мл, 2,04 ммоль), и смесь перемешивают в течение 1 часа, поддерживая температуру -78°C. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония, и смесь нагревают до комнатной температуры. Реакционную смесь экстрагируют этилацетатом, и полученный органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Органический слой концентрируют при пониженном давлении, полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 9/1), и получают соединение В-6 (205 мг, выход 53%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=11,2 Гц), 6,02 (1Н, д, J=11,2 Гц), 5,39 (1Н, с), 5,10 (1Н, с), 4,44 (1Н, т, J=3,9 Гц), 4,11-4,07 (1Н, м), 3,84-3,81 (1Н, м), 3,75-3,68 (2Н, м), 3,39 (1Н, дд, J=7,4, 3,3 Гц), 2,84-2,81 (1Н, м), 2,68 (1Н, дд, J=13,7, 4,4 Гц), 2,52 (2Н, т, J=6,8 Гц), 2,29-2,20 (3Н, м), 2,15-1,83 (6Н, м), 1,70-1,22 (14Н, м), 1,08-1,01 (9Н, м), 0,55 (3Н, с) м.д.
(3) Соединение В-6 (396 мг, 1,04 ммоль), полученное в (2), растворяют в безводном N,N-диметилформамиде (4 мл), к раствору добавляют хлортриэтилсилан (0,283 мл, 1,68 ммоль), имидазол (152 мг, 2,23 ммоль) и 4-диметиламинопиридин (27 мг, 0,22 ммоль), и смесь перемешивают при нагревании при 50°C в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры, добавляют к ней безводный метанол (1 мл), и смесь перемешивают в течение 30 минут. Смесь разбавляют толуолом и промывают насыщенным водным раствором хлорида натрия. Затем органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 90/10), и получают соединение В-7 (454,8 мг, выход 88%).
1Н-ЯМР (CDCl3) δ: 5,65 (1H, с), 2,91-2,85 (1Н, м), 2,24 (1Н, дд, J=16,46, 3,54 Гц), 2,10 (1Н, дд, J=16,58, 6,83 Гц), 2,02-1,88 (4Н, м), 1,71-1,58 (9Н, м), 1,54-1,24 (7Н, м), 1,08 (3Н, д, J=8,00 Гц), 0,98-0,91 (22Н, м), 0,73-0,64 (9Н, м), 0,58 (3Н, с), 0,52 (2Н, к, J=7,97 Гц).
(4) Соединение А-4 (457 мг, 1 ммоль), полученное в примере 2 (1), растворяют в безводном N,N-диметилформамиде (5 мл), к раствору добавляют триэтиламин (0,421 мл, 3 ммоль) и хлорметилбензиловый эфир (0,276 мл, 2 ммоль), и смесь перемешивают при 0°C в течение 1 часа 45 минут. К смеси добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (н-гексан/этилацетат = 95/5), и получают соединение А-24 (485 мг, выход 84%).
(5) С использованием в качестве исходных материалов соединения В-7 (44 мг, 0,09 ммоль), полученного в (3), и соединения А-24 (43 мг, 0,075 ммоль), полученного в (4), выполняют реакцию сочетания и реакцию удаления защитной группы так же, как в примере 5 (4). Полученный сырой продукт реакции предварительно очищают тонкослойной хроматографией на силикагеле (этилацетат/ацетон = 4/1 + уксусная кислота (1,5%, об./об.) и дополнительно очищают ВЭЖХ с обращенной фазой (А = 95% воды/ацетонитрил; В = 0,5% воды/40% метанола/ацетонитрил; В = 75%), и получают соединение F-1 (4,7 мг, выход 12%).
1Н-ЯМР (CDCl3) δ: 6,42 (1Н, д, J=10,98 Гц), 6,00 (1Н, д, J=10,98 Гц), 5,37 (1Н, д, J=1,46 Гц), 5,08 (1Н, д, J=1,95 Гц), 4,47 (1Н, д, J=2,93 Гц), 4,08-3,94 (2Н, м), 3,82-3,74 (1Н, м), 3,33 (1Н, дд, J=8,17, 3,05 Гц), 2,83 (1Н, д, J=12,20 Гц), 2,69-2,60 (3Н, м), 2,30-2,20 (2Н, м), 1.98 (2Н, д, J=11,71 Гц), 1,91-1,80 (1Н, м), 1,72-1,24 (16Н, м), 1,07 (3Н, д, J=6,34 Гц), 1,03 (8Н, т, J=7,44 Гц), 0,54 (3Н, с).
Пример 11
Получение (5Z,7Е)-(1R,2S,3R,20R)-2-(2-карбоксиэтокси)-26,27-нор-25-циклопентил-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триола (соединение F-2)
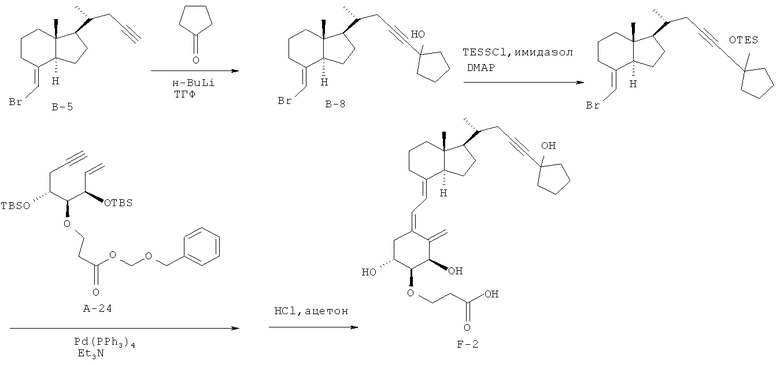
(1) С использованием в качестве исходного материала соединения В-5 (442 мг, 1,5 ммоль), полученного в пример 10 (1), выполняют синтез так же, как примере 10 (2), и получают смесь (427,2 мг) соединения В-8 и циклопентанона. С использованием в качестве исходного материала полученного сырого материала и использованием безводного N,N-диметилформамида (4,5 мл), хлортриэтилсилана (0,283 мл, 1,68 ммоль), имидазола (152 мг, 2,23 ммоль) и 4-диметиламинопиридина (27 мг, 0,22 ммоль) выполняют синтез так же, как в примере 10 (3), и получают соединение В-9 (506 мг, выход 68%).
1Н-ЯМР (CDCl3) δ: 5,65 (1Н, с), 2,92-2,85 (1Н, м), 2,24 (1Н, дд, J=16,46, 3,29 Гц), 2,08 (1Н, дд, J=16,10, 6,83 Гц), 2,02-1,57 (19Н, м), 1,54-1,26 (7Н, м), 1,07 (4Н, д, J=7,56 Гц), 0,98-0,91 (15Н, м), 0,73-0,63 (8Н, м), 0,57 (3Н, с), 0,52 (3Н, к, J=7,97 Гц).
(2) С использованием в качестве исходных материалов соединения В-9 (44 мг, 0,09 ммоль), полученного в (1), и соединения А-24 (43 мг, 0,075 ммоль), полученного в примере 10 (4), выполняют синтез так же, как в примере 10 (5), и получают соединение F-2 (2,0 мг, выход 5%).
1Н-ЯМР (CDCl3) δ: 6,41 (1Н, д, J=10,98 Гц), 6,00 (1Н, д, J=10,98 Гц), 5,36 (1Н, с), 5,07 (1Н, с), 4,46 (1Н, с), 4,10-3,93 (2Н, м), 3,78 (1Н, ушс), 3,30 (1Н, д, J=6,59 Гц), 3,07-2,62 (9Н, м), 2,30-2,19 (2Н, м), 2,05-1,24 (25Н, м), 1,06 (3Н, д, J=6,59 Гц), 0,54 (3Н, с).
Пример 12
Оценка аффинности к VDR
VDR оценивают с использованием коммерческого инструмента и набора для оценки, например, «PolarScreen Vitamin D Receptor Competitor Assay, Red, Cat. No. PV4569», продавемого Invitrogen Corporation, согласно следующей процедуре.
Растворы соединений добавляют в каждые две лунки 384-луночного планшета с лунками с темным дном аликвотами по 10 мкл. В каждую лунку аликвотами по 10 мкл добавляют комплекс VDR/Fluoromone VDR, включенный в набор, и оставляют взаимодействовать при комнатной температуре на 2 часа. Через 2 часа измеряют поляризацию флуоресценции, и оценивают аффинность к VDR. Кроме того, оценивают аффинность в относительных величинах (1/Х) в сравнении с аффиностью к 1,25-(ОН)2-витамину D3, принятую за 1.
Подтверждается, что соединения, полученные согласно настоящему изобретению, имеют сильную аффинность к VDR. Обнаруживают, что очень сильную аффинность к VDR имеют, в частности, соединение С-1 и соединение D-1.
Пример 13
Транскрипционная активность VDR в остеобласте человека (клетки HOS)
(1) Конструируют репортерный вектор, встраивая последовательность промоторного участка гена остокальцина человека выше гена люциферазы с использованием вектора pGL3 (Promega Corporation), при этом промоторный участок гена остокальцина человека клонируют с использованием кДНК, полученной из клеток HOS (закупают из АТСС), способом, известным из литературы (Ozono et al., The Journal of Biological Chemistry, 265, 21881-21888 (1990)). Экспрессирующий вектор конструируют, встраивая последовательность ДНК, которая кодирует VDR человека и RXR человека, в вектор pcDNA3 (Invitrogen Corporation). Клетки HOS инкубируют в среде DMEM, содержащей 10% FBS, в условиях: 37°C и 5% CO2, и субкультивируют каждые 2 или 3 дня.
(2) Клетки, которые субкультивированы, извлекают центрифугированием и суспендируют в среде DMEM без сыворотки и фенолового красного при плотности 4×105 клеток/мл. Такую суспензию высевают в 96-луночный планщет в количестве 0,1 мл/лунку. К такой системе добавляют различные векторы, описанные в (1), в количестве 0,05 мл на лунку с использованием липофектамина 2000 (Invitrogen Corporation). После инкубации при 37°C в течение 3 часов в каждую лунку добавляют 2 мкл каждого из этанольных растворов испытываемых соединений различной концентрации или этанол в качестве контроля. После инкубации при 37°C в течение 24 часов среду удаляют, клетки промывают один раз PBS(-), и затем измеряют люциферазную активность с использованием люминометра (Berthold Technologies GmbH & Со. KG) и использованием набора для анализа люциферазы Dual-Glo (Promega Corporation).
В результате обнаруживают, что все соединения по настоящему изобретению имеют транскрипционную активность с величинами ЕС50 20 нМ или меньше. Кроме того, обнаружено, что соединения С-1, С-2, D-1, E-1, F-1 и F-2 обладают транскрипционной активностью с величинами ЕС50 0,2 нМ или меньше. Обнаружено, что в частности соединения D-1, E-1, F-1 и F-2 обладают транскрипционной активностью с величинами EC50 0,02 нМ или меньше.
Пример 14
Эффект повышения плотности минерального вещества на крысиной модели (овариэктомия) остеопороза (сравнительное испытание)
Двенадцатинедельных самок крыс рода SD (Charles River Japan, Inc.) подвергают билатеральной овариэктомии, и после 4-недельного покоя им вводят соединения по настоящему изобретению и 2α-(3-гидроксипропил)окси-1α,25-дигидроксивитамин D3, описанный в международной публикации WO 01/62723, каждое 5 раз в неделю в течение 4 недель. Через 24 часа после последнего введения спускают кровь под эфирным наркозом, и крыс усыпляют. Под наркозом измеряют плотность костного минерального вещества четвертого и пятого поясничных позвонков с использованием двухлучевого рентгеновского анализатора костного минерального вещества (QDR-2000; Hologic, Inc.). Для сравнения в группе с псевдооперацией (псевдо) (выполняют абдоминальную операцию, но яичники не удаляют; испытываемые соединения не вводят) и группе с овариэктомией (OVX) (подвергают овариэктомии, но испытываемые соединения не вводят) также проводят измерения плотности костного минерального вещества четвертого и пятого поясничных позвонков во время рассечения. Кроме того, в каждой группе также выполняют измерение концентрации кальция в сыворотке.
В группе OVX подтверждается падение плотности костного минерального вещества по сравнению с группой с псевдооперацией (псевдо). Также подтверждается, что плотность костного минерального вещества восстанавливается при введении производных витамина D3. Однако группа, которой вводили 2α-(3-гидроксипропил)окси-1α,25-дигидроксивитамин D3, описанный в международной публикации WO 01/62723, показывает повышение уровня кальция в сыворотке с возрастанием плотности костного минерального вещества, и обнаружено, что при дозе (25 нг/кг), необходимой для того, чтобы плотность костного минерального вещества стала равной или превысила плотность в группе псевдо, возрастание существенно - на 1 мг/дл или более. С другой стороны, обнаружено, что соединения по настоящему изобретению повышают плотность костного минерального вещества до величины, эквивалентной или большей, чем величина в группе псевдо, хотя находят повышение уровня кальция в сыворотке при сравнении с группой OVX в интервале не более 1 мг/дл.
Из результатов, описанных выше, находят, что производные витамина D3 или их медицински приемлемые сольваты по настоящему изобретению оказывают действие на костную ткань более превосходное, чем предшествующие описанные производные витамина D3.
Производные витамина D3 или их медицински приемлемые сольваты по настоящему изобретению могут применяться в качестве лекарственных средств.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ПОЛУСИНТЕЗА ТАКСАНОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2159237C2 |
| ПРОИЗВОДНЫЕ АЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2161612C2 |
| НОВОЕ ПРОИЗВОДНОЕ ОКСАЗОЛИДИНОНА И ВКЛЮЧАЮЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2012 |
|
RU2617408C2 |
| НОВЫЕ АНАЛОГИ ВИТАМИНА D | 2001 |
|
RU2261244C2 |
| ПРОИЗВОДНЫЕ 22-ТИАВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, СОЕДИНЕНИЯ | 1995 |
|
RU2142941C1 |
| ПРОИЗВОДНЫЕ КАРБАМОИЛМОЧЕВИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2134684C1 |
| ГЕКСАЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 1992 |
|
RU2071476C1 |
| НОВЫЕ НУКЛЕОЗИДНЫЕ И ОЛИГОНУКЛЕОТИДНЫЕ АНАЛОГИ | 2000 |
|
RU2233844C2 |
| ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ АМИНОВ, ОБЛАДАЮЩИХ ПОДАВЛЯЮЩИМ ОАС ДЕЙСТВИЕМ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИНГИБИТОР НОАС | 1997 |
|
RU2193554C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ СУЛЬФОНАМИДНЫЕ ГРУППЫ, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ И АНТИАНГИОГЕННЫЙ АГЕНТ НА ИХ ОСНОВЕ | 2000 |
|
RU2239631C2 |
Изобретение относится к новому производному витамина D3, применимому в качестве терапевтического средства против остеопороза, которое представлено формулой (1), где R1 представляет собой атом водорода, алкильную группу с 1-6 атомами углерода, алкилкарбонилоксиалкильную группу, причем каждый алкил имеет 1-6 атомов углерода, или арилкарбонилоксиалкильную группу, причем арил имеет 6-10 атомов углерода и алкил имеет 1-6 атомов углерода; R2 представляет собой атом водорода или алкильную группу с 1-6 атомами углерода или вместе с другим R2 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; R3 представляет собой алкильную группу с 1-6 атомами углерода или вместе с другим R3 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; X представляет собой атом кислорода или метиленовую группу; и n равен целому числу 1 или 2. Изобретение также относится к фармацевтической композиции, обладающей аффинностью к рецептору витамина D (VDR), содержащей соединение формулы (1); а также относится к промежуточному соединению, представленному формулой (2), в которой R2, X и n являются такими же, как указано выше, R4 представляет собой R1 в формуле (1), метоксиметильную группу, метоксиэтоксиметильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу или бензилоксиметильную группу; и R5 представляет собой защитную группу для гидроксильной группы, выбранную из группы, включающей метоксиметильную группу, ацильную группу с 1-3 атомами углерода (указанное число атомов углерода включает углерод карбонила), триметилсилильную группу, триэтилсилильную группу, трет-бутилдиметилсилильную группу и трет-бутилдифенилсилильную группу. 5 н. и 7 з.п. ф-лы, 4 табл., 14 пр.
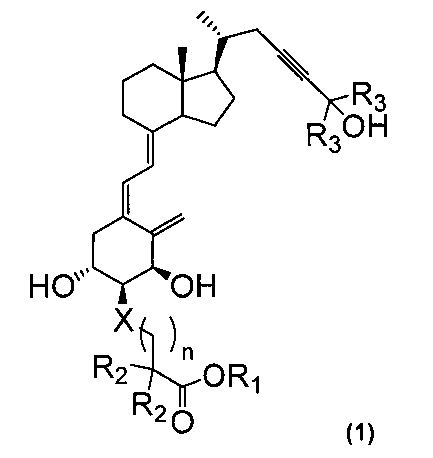
1. Производное витамина D3, представленное следующей формулой (1):

где
R1 представляет собой атом водорода, алкильную группу с 1-6 атомами углерода, алкилкарбонилоксиалкильную группу, причем каждый алкил имеет 1-6 атомов углерода, или арилкарбонилоксиалкильную группу, причем арил имеет 6-10 атомов углерода и алкил имеет 1-6 атомов углерода; R2 представляет собой атом водорода или алкильную группу с 1-6 атомами углерода или вместе с другим R2 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; R3 представляет собой алкильную группу с 1-6 атомами углерода или вместе с другим R3 и атомом углерода, с которым они связаны, может образовывать циклическую алкильную группу с 3-6 атомами углерода; X представляет собой атом кислорода или метиленовую группу; и n равен целому числу 1 или 2.
2. Производное витамина D3 по п. 1, где X представляет собой атом кислорода.
3. Производное витамина D3 по п. 1, где X представляет собой метиленовую группу.
4. Производное витамина D3 по любому из пп. 1-3, где n равен 1.
5. Производное витамина D3 по любому из пп. 1-4, где R2 представляет собой атом водорода.
6. Производное витамина D3 по любому из пп. 1-5, где R1 представляет собой атом водорода, метильную группу, этильную группу, пропильную группу, изопропильную группу, трет-бутильную группу, трет-бутилкарбонилоксиметильную группу или фенилкарбонилоксиметильную группу.
7. Производное витамина D3 по любому из пп. 1-6, где R2 представляет собой атом водорода и n равен 1.
8. Производное витамина D3 по п. 1, где R1 представляет собой атом водорода, метильную группу, этильную группу, пропильную группу, изопропильную группу, трет-бутильную группу, трет-бутилкарбонилоксиметильную группу или фенилкарбонилоксиметильную группу; R2 представляет собой атом водорода или вместе с другим R2 и атомом углерода, с которым они связаны, образует циклопропильную группу; R3 представляет собой метильную группу или этильную группу или вместе с другим R3 и атомом углерода, с которым они связаны, образует циклопропильную группу; X представляет собой атом кислорода или метиленовую группу; и n равен 1.
9. Производное витамина D3, выбранное из группы, включающей
(5Z,7E)-(1R,2S,3R,20R)-2-(2-карбоксиэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-(2-метоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-(2-пропоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(lR,2S,3R,20R)-2-(2-(1-метил)этоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-((трет-бутилкарбонилокси)метоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-((фенилкарбонилокси)метоксикарбонилэтокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-(2-карбоксипропил)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-(2-(1,1-диметил)этоксикарбонилпропил)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-((2-карбокси-2,2-этано)этокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-((2-метоксикарбонил-2,2-диметил)этокси)-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол;
(5Z,7E)-(1R,2S,3R,20R)-2-(2-карбоксиэтокси)-26,27-диметил-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол и
(5Z,7E)-(1R,2S,3R,20R)-2-(2-карбоксиэтокси)-26,27-нор-25-циклопентил-23-ин-9,10-секо-5,7,10(19)-холестатриен-1,3,25-триол.
10. Фармацевтическая композиция, обладающая аффинностью к рецептору витамина D (VDR), содержащая терапевтически эффективное количество производного витамина D3 по любому из пп. 1-9 и фармацевтически приемлемый носитель.
11. Терапевтическое средство против остеопороза, содержащее в качестве активного ингредиента терапевтически эффективное количество производного витамина D3 по любому из пп. 1-9.
12. Соединение, представленное следующей формулой (2)

где
R2, X и n являются такими же, как в формуле (1);
R4 представляет собой R1 в формуле (1), метоксиметильную группу, метоксиэтоксиметильную группу, тетрагидрофуранильную группу, тетрагидропиранильную группу или бензилоксиметильную группу; и
R5 представляет собой защитную группу для гидроксильной группы, выбранную из группы, включающей метоксиметильную группу, ацильную группу с 1-3 атомами углерода (указанное число атомов углерода включает углерод карбонила), триметилсилильную группу, триэтилсилильную группу, трет-бутилдиметилсилильную группу и трет-бутилдифенилсилильную группу.
| US 6410523 B1, 25.06.2002 | |||
| Устройство для измерения формы сигналов | 1982 |
|
SU1061070A1 |
| Устройство для расширения скважин | 1985 |
|
SU1260502A1 |
| US 4804502 A1, 14.02.1989 | |||
| АНАЛОГИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2165413C2 |
| US 6281249 B1, 28.08.2001 | |||
| WO 1992003414 A, 05.03.1992 | |||
Авторы
Даты
2015-08-10—Публикация
2011-10-24—Подача