Область техники
Настоящее изобретение относится к сульфонамидсодержащему гетероциклическому соединению, которое пригодно в качестве лекарственного соединения, и к его антиангиогенному действию. Кроме того, оно относится к противоопухолевому агенту, агенту, подавляющему метастазирование злокачественных опухолей, терапевтическому агенту для лечения диабетической ретинопатии, терапевтическому агенту для лечения ревматического артрита и терапевтическому агенту для лечения гематомы на основе антиангиогенного действия.
Уровень техники
Была установлена тесная связь между пролиферацией злокачественной опухоли и ангиогенезом. Так, когда в области злокачественной опухоли не происходит ангиогенеза, злокачественная опухоль остается в дремлющем состоянии. Однако было установлено, что, когда ангиогенез происходит, кислород и питательные вещества из крови доставляются в опухоль, что способствует пролиферации и метастазированию злокачественной опухоли, приводя к ухудшению клинического состояния. Соответственно, ожидается, что, подавляя ангиогенез, можно подавить пролиферацию и метастазирование злокачественной опухоли. Поскольку новообразованные сосуды построены из эндотелиальных клеток и интерстициальных клеток хозяина, мишенью антиангиогенного агента являются не клетки злокачественной опухоли, а указанные нормальные клетки хозяина. В силу того факта, что клетки злокачественной опухоли не являются непосредственной мишенью, можно также ожидать эффективности в отношении злокачественной опухоли, которая не реагирует на известные противоопухолевые агенты, и, кроме того, полагают, что вероятность возникновения толерантной злокачественной опухоли, что является большой проблемой при лечении злокачественных опухолей, мала. Кроме того, ангиогенез представляет собой явление, специфичное для опухолей, и у позвоночных индивидуумов он ограничивается образованием эндометрия и т.п., сопровождающимся менструальным циклом. Соответственно, полагают, что его неблагоприятное действие будет небольшим по сравнению с известными противоопухолевыми лекарственными средствами. Недавно в доклинических исследованиях было экспериментально доказано, что антиангиогенные агенты способны подавлять и в дальнейшем уменьшать пролиферацию злокачественной опухоли у экспериментальных животных с трансплантированными злокачественными опухолями, что толерантная злокачественная опухоль не развивается, и в клинических испытаниях была показана корреляция между ангиогенезом и метастазированием многих твердых злокачественных опухолей, таких как рак молочной железы, рак предстательной железы, рак легкого и рак толстого кишечника.
В тканях злокачественной опухоли постоянно наблюдается апоптоз и пролиферация опухолевых клеток, и известно, что в зависимости от равновесия между ними наблюдается прогрессирующая злокачественная опухоль или дремлющая опухоль. Антиангиогенный агент не убивает непосредственным образом клетки злокачественной опухоли, а отсекает от них источники питания таким образом, что указанное равновесие склоняется в сторону апоптоза, индуцируя дремлющую опухоль или ее уменьшение, поэтому он представляет собой лекарственное средство, которое, как можно ожидать, будет показывать отличный эффект (увеличение продолжительности жизни, ингибирование рецидивов и подавление метастазирования) при долгосрочном лечении.
На доклинической стадии существуют антиангиогенные агенты с различными механизмами действия, но, поскольку их противоопухолевое действие на доклинической стадии является недостаточным, их пригодность на клинической стадии все еще является сомнительной, и, следовательно, существует настоятельная потребность в антиангиогенных агентах с надежным действием.
Известно также, что ангиогенез участвует в развитии ретинопатии или ретинита. Когда кровеносный сосуд прорастает в сетчатку, зрение ухудшается, а при прогрессировании процесса наступает слепота. Требуются эффективные лекарственные средства для лечения указанного состояния.
В US 662798 описаны гидрокси- и ацилоксифенилсульфониламинозамещенные хинолин и хиноксалин, но они относятся к противовирусным агентам и отличаются от настоящего изобретения. В J.Sci.Ind.Res., sect В, 21 (1962), описан 3-п-толуолсульфониламино-8-гидроксихинолин. Однако там нет описания, относящегося к антиангиогенному действию. В JP-A 1-254682 описаны производные 1,8-нафтилидина и пиридо[2,3-d]пиримидина, содержащие замещенный сульфонамид, но они относятся к гербицидам и отличаются от настоящего изобретения. В JP-A 62-426 и 7-267936 описаны производные сульфонамидхиноксалина, обладающие противоопухолевой активностью. Однако там нет описания, относящегося к антиангиогенному действию.
Соответственно, целью настоящего изобретения является создание нового сульфонамидсодержащего гетероциклического соединения, которое обладает отличным антиангиогенным действием и имеет структуру, отличную от структуры обычного антиангиогенного агента. Другой целью настоящего изобретения является создание промежуточного продукта указанного соединения и фармацевтической композиции, содержащей указанное соединение в качестве активного ингредиента.
Описание изобретения
Были предприняты интенсивные исследования антиангиогенного агента. В результате было установлено, что новое сульфонамидсодержащее гетероциклическое соединение обладает отличным антиангиогенным действием и оказывает отличное действие как фармацевтическое лекарственное средство. Таким образом было осуществлено настоящее изобретение.
Конкретно, настоящее изобретение относится к сульфонамидсодержащему гетероциклическому соединению, представленному формулой (I), его фармацевтически приемлемой соли и их гидрату.
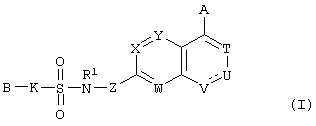
где А представляет атом водорода, атом галогена, гидроксильную группу, С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена, цианогруппу, -(CO)kNR2R3 (где R2 и R3 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу, которая может быть замещена атомом галогена, и k означает 0 или 1), С2-С4 алкенильную группу или алкинильную группу, которая может иметь заместитель, или фенильную группу или феноксигруппу, которая может иметь заместитель, выбранный из следующей группы А;
В представляет арильную группу или моноциклическую гетероарильную группу, которая может иметь заместитель, выбранный из следующей группы А, или
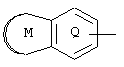
(где кольцо Q представляет ароматическое кольцо, которое может иметь один или два атома азота; кольцо М представляет собой ненасыщенное С5-С12 моноциклическое или полициклическое кольцо, имеющее общую двойную связь с кольцом Q, и кольцо может иметь 1-4 гетероатома, выбранных из атома азота, атома кислорода и атома серы; кольцо Q и кольцо М могут иметь общий атом азота и кольцо Q и кольцо М могут иметь заместитель, выбранный из следующей группы А);
К представляет простую связь или -(CR4R5)m- (где R4 и R5 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу, a m означает целое число 1 или 2);
Т, W, Х и Y одинаковые или различные и каждый означает =C(D)- (где D представляет атом водорода, атом галогена, гидроксильную группу, С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена, цианогруппу, -(CO)nNR6R7 (где R6 и R7 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу, которая может быть замещена атомом галогена, и n означает 0 или 1), или С2-С4 алкенильную группу или алкинильную группу, которая может иметь заместитель), или атом азота;
U и V одинаковые или различные и каждый означает =C(D)- (где D имеет значения, указанные выше), атом азота, -CH2-, атом кислорода или -СО-;
Z представляет простую связь или -CO-NH-;
R1 представляет атом водорода или С1-С4 алкильную группу и
----- означает простую или двойную связь.
Группа А:
атом галогена, гидроксильная группа, С1-С4 алкильная группа или алкоксигруппа, которая может быть замещена атомом галогена, цианогруппа, -R8R9N(NH)p- (где R8 и R9 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу, которая может быть замещена атомом галогена, и р означает 0 или 1, и R8 и R9 могут быть объединены с атомом азота, с которым они связаны, с образованием 5- или 6-членного кольца, которое может включать атом азота, атом кислорода или атом серы и может иметь заместитель), аминосульфонильная группа, которая может быть замещена одной или двумя С1-С4 алкильными группами, необязательно замещенная С1-С8 ацильная группа, С1-С4 алкил-S(O)s-C1-C4 алкиленовая группа (где s означает целое число 0, 1 или 2), фенилсульфониламиногруппа, которая может иметь С1-С4 алкил или заместитель, - (CO)qNR10R11 (где R10 и R11 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу, которая может быть замещена аминогруппой, которая может быть замещена атомом галогена или С1-С4 алкильной группой, и q означает 0 или 1), или арильная или гетероарильная группа, которая может иметь заместитель, при условии, что исключается случай, когда U представляет атом кислорода, V означает -СО- или -СН2-; когда V представляет атом кислорода, U означает -СО- или -СН2-, и следующие случаи 1) где только один из Т, U, V, W, Х и Y представляет атом азота и А и D оба представляют атомы водорода, 2) где Т, U, V, W, Х и Y все представляют атомы азота, 3) где Y и W представляют атомы азота; Т, U, V и Х представляют =C(D1)- (где D1 означает атом водорода, метильную группу, атом галогена, трифторметильную группу или метоксигруппу) и Z представляет простую связь, и А представляет атом водорода, метильную группу, атом галогена, трифторметильную группу или метоксигруппу, 4) где W представляет атом азота; Т, U, V, Х и Y представляют =C(D2)- (где D2 означает атом водорода); К и Z представляют простые связи; А представляет гидроксильную группу и В представляет п-толуолсульфониламиногруппу, 5) где V и W представляют атомы азота и 6) где Т, V и W представляют атомы азота.
Настоящее изобретение относится к галогензамещенному хинолиновому соединению, представленному следующей формулой:
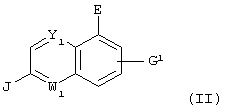
(где Y1 и W1 различные и каждый означает атом азота или =C(D3)- (где D3 представляет атом водорода, атом галогена, гидроксильную группу, С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена, цианогруппу или -(CO)nNR6R7 (где R6 и R7 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу, которая может быть замещена атомом галогена, и n означает 0 или 1)); Е представляет атом галогена, цианогруппу или С1-С4 алкильную группу, которая может быть замещена атомом галогена; J представляет аминогруппу, которая может иметь защитную группу или карбоксильную группу, которая может иметь защитную группу; G1 представляет атом водорода, атом азота, гидроксильную группу, С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена, цианогруппу или -(CO)tNR14R15 (где R14 и R15 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу, которая может быть замещена атомом галогена, и t означает 0 или 1); или необязательно замещенную С2-С4 алкенильную группу или алкинильную группу при условии, что исключается случай, где Y1 представляет атом азота; Е представляет гидроксильную группу; J представляет аминогруппу и G1 представляет атом водорода), который представляет собой промежуточный продукт соединения, представленного приведенной выше формулой (I), или к его соли.
Кроме того, настоящее изобретение относится к способу получения соединения, представленного формулой
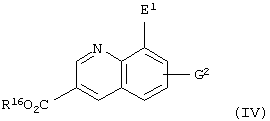
(где Е1 представляет атом галогена; R16 представляет карбоксилзащитную группу; G2 представляет атом водорода, атом галогена, гидроксильную группу или С1-С4 алкильную группу, или алкоксигруппу, которая может быть замещена атомом галогена), который включает стадию восстановления соединения, представленного формулой
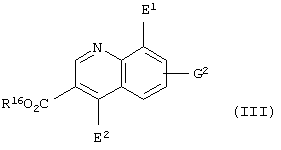
(где Е1 представляет атом галогена; Е2 представляет атом хлора или атом брома; R16 представляет карбоксилзащитную группу; G2 представляет атом водорода, атом галогена, гидроксильную группу или С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена), оловом, цинком или железом.
Соединение, представленное приведенной выше формулой (IV), представляет собой соединение приведенной выше формулы (II), в которой Y представляет атом азота; W1 представляет =СН-; Е представляет атом галогена; J представляет карбоксильную группу, имеющую защитную группу, и G1 представляет атом водорода, атом галогена, гидроксильную группу или С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена.
Настоящее изобретение относится к антиангиогенному агенту, противоопухолевому агенту, агенту, подавляющему метастазирование злокачественной опухоли, терапевтическому агенту для лечения диабетической ретинопатии, терапевтическому агенту для лечения ревматического артрита или терапевтическому агенту для лечения гематомы, включающему в качестве активного ингредиента сульфонамидсодержащее гетероциклическое соединение, представленное приведенной выше формулой (I), его фармацевтически приемлемую соль или их гидрат.
Настоящее изобретение относится к способу профилактики или лечения заболевания, при котором антиангиогенное действие является эффективным для профилактики или лечения злокачественной опухоли, метастазирования злокачественной опухоли, диабетической ретинопатии, ревматического артрита или гематомы, путем введения пациенту фармакологически эффективного количества сульфонамидсодержащего гетероциклического соединения, представленного приведенной выше формулой (I), его фармацевтически приемлемой соли или их гидрата.
Настоящее изобретение относится к применению сульфонамидсодержащего гетероциклического соединения, представленного приведенной выше формулой (I), его фармацевтически приемлемой соли или их гидрата для производства антиангиогенного агента, противоопухолевого агента, агента, подавляющего метастазирование злокачественной опухоли, терапевтического агента для лечения диабетической ретинопатии, терапевтического агента для лечения ревматического артрита или терапевтического агента для лечения гематомы.
В настоящем изобретении "ароматическое кольцо, которое может иметь один или два атома азота," в кольце Q представляет собой ароматический углеводород или 6-членный ароматический гетероцикл, включающий один или два атома азота. Примерами указанных ароматических колец в кольце Q являются бензол, пиридин, пиримидин, пиразин, пиридазин и т.п. "Ненасыщенное С5-С12 моноциклическое или полициклическое кольцо, которое может иметь от одного до четырех гетероатомов, выбранных из атома азота, атома кислорода и атома серы," как кольцо М, означает ненасыщенное моноциклическое или полициклическое кольцо, которое имеет общую двойную связь с кольцом Q и включает ароматические углеводородные кольца, такие как бензол и нафталин; ненасыщенные углеводородные кольца, такие как циклопентен, циклогексен, циклогептен, циклооктен, циклопентадиены, циклогептадиены и циклооктадиены, и ненасыщенные гетероциклические кольца, такие как тетрагидропиридин, пиррол, фуран, тиофен, оксазол, изоксазол, тиазол, изотиазол, пиразол, имидазол, триазол, пиридин, пиримидин, пиразин, пиридазин, триазин, индол, изоиндол, хинолин, изохинолин, индазолидин, нафтилидин, бензофуран, бензопиран, бензотиофен, бензимидазол, бензоксазол, бензотиазол, пирролопиридин, пиридопиримидин и имидазопиридин. Фраза "кольцо Q и кольцо М могут иметь один общий атом азота" означает случай, когда атом азота находится в положении конденсации между двумя кольцами, и указанные кольца включают, например, индазолидин, имидазо[1,2-а]пиридин, имидазо[1,5-а] пиридин и пираэоло[1,5-а]пиримидин.
В настоящем изобретении С1-С4 алкильная группа в R1, R4 и R5 и С1-С4 алкильная группа в С1-С4 алкильной группе, которая может быть замещена атомом галогена, в A, D, R1, R2, R3, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, G1, G2 и группе А включают линейные или разветвленные алкильные группы, содержащие 1-4 атома углерода, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа и трет-бутильная группа. Фраза "которая может быть замещена атомом галогена," означает, что каждая из указанных алкильных групп может быть замещена атомом (атомами) галогена, выбранным из атома фтора, атома хлора, атома брома и атома иода. Указанные галогензамещенные алкильные группы включают, например, монофторметильную группу, монохлорметильную группу, дифторметильную группу, трифторметильную группу, 1- или 2-монофторэтильную группу, 1- или 2-монохлорэтильную группу, 1- или 2-монобромэтильную группу, 1,2-дифторэтильную группу, 1,2-дихлорэтильную группу, 1,1,2,2,2-пентафторэтильную группу и 3,3,3-трифторпропильную группу. Их них предпочтительными являются монофторметильная группа, дифторметильная группа, трифторметильная группа, 1- или 2-монофторэтильная группа, 1,2-дифторэтильная группа и 1,1,2,2,2-пентафторэтильная группа.
В настоящем изобретении С1-С4 алкоксигруппа в С1-С4 алкоксигруппе, которая может быть замещена атомом галогена в A, D и группе А, включает линейные или разветвленные алкоксигруппы, содержащие 1-4 атома углерода, такие как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутилоксигруппа, изобутилоксигруппа, втор-бутилоксигруппа и трет-бутилоксигруппа. Фраза "которая может быть замещена атомом галогена," означает, что каждая из указанных алкоксигрупп может быть замещена атомом (атомами) галогена, выбранным из атома фтора, атома хлора, атома брома и атома иода. Указанные галогензамещенные алкоксигруппы включают, например, монофторметоксигруппу, дифторметоксигруплу, трифторметоксигруппу, 1- или 2-монофторэтоксигруппу, 1- или 2-монохлорэтоксигруппу, 1- или 2-монобромэтоксигруппу, 1,2-дифторэтоксигруппу, 1,1,2,2,2-пентафторэтоксигруппу и 3,3,3-трифторпропоксигруппу. Их них предпочтительными являются монофторметоксигруппа, дифторметоксигруппа, трифторметоксигруппа, 1- или 2-монофторэтоксигруппа, 1,2-дифторэтоксигруппа и 1,1,2,2,2-пентафторэтоксигруппа.
В настоящем изобретении С2-С4 алкенильная группа или алкинильная группа в А и D включает алкенильные группы или алкинильные группы, содержащие 2-4 атома углерода, такие как винильная группа, аллильная группа, 2- или 3-бутенильная группа, 1,3-бутандиенильная группа, этинильная группа, 2-пропинильная группа, 2-метилэтинильная группа и 2- или 3-бутинильная группа.
Арильная группа в В и группе А в настоящем изобретении означает и включает ароматические углеводородные группы, такие как фенильная группа и нафтильная группа. Гетероарильная группа означает и включает моноциклические и полициклические кольца, каждое из которых содержит один или более атомов азота, атомов кислорода и атомов серы. Указанные гетероарильные группы включают, например, пирролил, имидазолильную группу, пиразолильную группу, триазолильную группу, фурильную группу, тиенильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильнуго группу, тиадиазолильную группу, пиридильную группу, пиримидильную группу, пиразильную группу, индолильную группу, индолизинильную группу, бензимидазолильную группу, бензотиазолильную группу, бензоксазолильную группу, хинолинильную группу, изохинолинильную группу, хиназолинильную группу и фталазинильную группу.
Фраза "R8 и R9 могут быть объединены с атомом азота, к которому они присоединены, с образованием 5- или 6-членного кольца, которое может включать атом азота, атом кислорода или атом серы" в R8 и R9 в настоящем изобретении означает, что R8 и R9 вместе с атомом азота, к которому они присоединены, образуют кольцо, такое как пирролидинильная группа, пиперидинильная группа, морфолиногруппа, тиоморфолиногруппа и пиперазинильная группа.
В настоящем изобретении С1-С4 алкильная группа в аминосульфонильной группе, которая может быть замещена одной или двумя С1-С4 алкильными группами, С1-С4 алкил-S(О)s-C1-C4 алкиленовая группа, С1-С4 алкил- или фенилсульфониламиногруппа, причем указанная фенильная группа может иметь заместитель, и С1-С4 алкильная группа, которая может быть замещена С1-С4 алкильной группой, в группе А означают и включают те же алкильные группы, которые указаны выше. Алкиленовая группа включает, например, метиленовую группу, этиленовую группу, пропиленовую группу и бутиленовую группу, а также метилметиленовую группу, 1- или 2-метилэтиленовую группу, 1-, 2- или 3-метилпропиленовую группу и диметилметиленовую группу.
С1-С8 алканоильная группа означает, например, формильную группу, ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, валерильную группу, бензоильную группу и т.п.
Защитная группа в "аминогруппе, которая может иметь защитную группу," в J настоящего изобретения конкретно не ограничивается, поскольку в органическом синтезе она обычно используется в качестве аминозащитной группы. Указанные защитные группы включают, но не ограничиваются ими, бензилоксикарбонильную группу, трет-бутоксикарбонильную группу, формильную группу, ацетильную группу, хлорацетильную группу, 2,2,2-трихлорэтильную группу, бензилиденовую группу, бензгидрильную группу и тритильную группу. Защитная группа в карбоксильной группе, которая может иметь защитную группу, и карбоксизащитная группа в R16 конкретно не ограничиваются и могут представлять собой любые защитные группы, поскольку в органическом синтезе они обычно используется в качестве карбоксизащитных групп. Указанные защитные группы включают, но не ограничиваются ими, метильную группу, этильную группу, пропильную группу, изопропильную группу, трет-бутильную группу, метоксиметильную группу, 2,2,2-трихлорэтильную группу, пивалоилоксиметильную группу и бензильную группу.
В настоящем изобретении заместитель во фразе "которая может иметь заместитель" означает и включает указанные выше атомы галогенов, С1-С4 алкильные группы или алкоксигруппы, которые могут быть замещены атомом галогена, гидроксильную группу, гидрокси-С1-С4 алкильные группы, аминогруппы, которые могут быть замещены одной или двумя С1-С4 алкильными группами, С2-С4 алкенильные группы или алкинильные группы, цианогруппу, С1-С8 ацильные группы, аминосульфонильные группы, которые могут быть замещены одной или двумя С1-С4 алкильными группами, карбоксильную группу, С1-С4 алкоксикарбонильные группы и карбамоильные группы, которые могут быть замещены одной или двумя С1-С4 алкильными группами.
Сульфонамидсодержащие гетероциклические соединения, представленные приведенной выше формулой (I), могут образовывать соли с кислотами или основаниями. Настоящее изобретение также включает соли соединения (I). Указанные соли с кислотами включают, например, соли неорганических кислот, такие как гидрохлорат, гидробромат и сульфат, и соли с органическими кислотами, такими как уксусная кислота, молочная кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, лимонная кислота, бензойная кислота, метансульфоновая кислота и п-толуолсульфоновая кислота. Примерами солей с основанием являются неорганическая соль, такая как натриевая соль, калиевая соль и кальциевая соль, и соль с органическим основанием, таким как триэтиламин, аргинин или лизин.
Само собой разумеется, что настоящее изобретение включает также все оптические изомеры, если они существуют, а также гидрат указанных соединений. Кроме того, также включены соединения, которые оказывают антиангиогенное действие, возникающее в результате метаболизма соединения по настоящему изобретению, такого как окисление, восстановление и гидролиз in vivo. Настоящее изобретение также включает соединения, из которых в результате метаболизма, такого как окисление, восстановление и гидролиз in vivo, получается соединение по настоящему изобретению.
Соединения (I) по настоящему изобретению можно получить разными способами. Показательными способами являются следующие.
1) Когда Z представляет простую связь
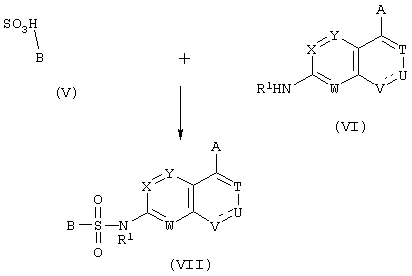
где в формулах А, В, Т, U, V, W, Х и Т имеют те же значения, которые определены выше.
Конкретно, указанные соединения можно получить взаимодействием сульфоновой кислоты, представленной формулой (V), или ее реакционноспособного производного с соединением, представленным формулой (VI).
Указанные реакционноспособные производные сульфоновой кислоты (V) включают, например, обычно используемые реакционноспособные производные, такие как сульфонилгалогениды, сульфонилангидриды и N-сульфонилимидазолид. Из них обычно предпочтительны сульфонилгалогениды. Растворители для использования в реакции конкретно не ограничиваются, но предпочтительными являются растворители, которые растворяют вещества и являются инертными по отношению к этим веществам. Указанные растворители включают пиридин, тетрагидрофуран, диоксан, бензол, диэтиловый эфир, дихлорметан, диметилформамид и смеси указанных растворителей. Когда в ходе реакции выделяется кислота, как в случае использования в реакции сульфонилгалогенида, реакцию предпочтительно осуществляют в присутствии подходящего связывающего кислоту агента. Таким образом, в данном случае предпочтительно использовать пиридин и другие основные растворители. Когда используют нейтральный растворитель, к реакционной системе можно добавлять карбонат щелочного металла, органический третичный амин или другое основное вещество. Растворители, которые можно использовать в данном случае, не ограничиваются перечисленными выше. Реакция обычно протекает при комнатной температуре, но реакционную систему при необходимости можно охлаждать или нагревать. Время реакции можно необязательно выбирать в зависимости от типов используемых соединений и температуры реакции, и оно обычно составляет от 10 минут до 20 часов.
Когда аминогруппа или гидроксильная группа полученного продукта защищена, можно получить сульфонамидное производное (VII), имеющее свободную гидроксильную группу или аминогруппу, подвергая продукт действию кислоты, действию основания, каталитическому восстановлению и другим обычным процедурам снятия защиты, в соответствии с необходимостью.
2) Когда Z представляет -СО-NH-
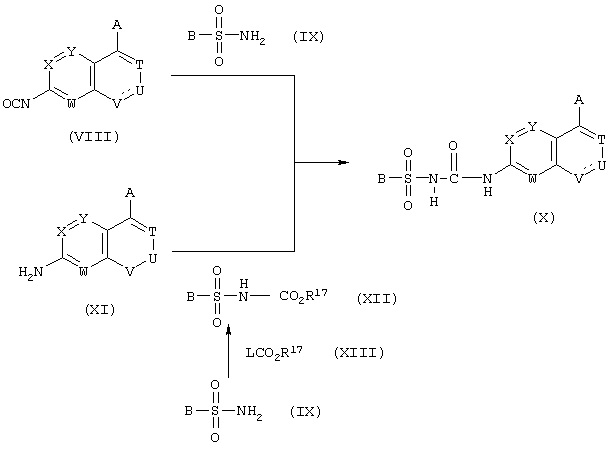
где в формулах L представляет атом хлора или атом брома;
R17 представляет С1-С4 алкильную группу или бензильную группу;
А, В, Т, U, V, W, Х и Т имеют те же значения, которые определены выше.
Целевое соединение можно получить взаимодействием изоцианатного соединения, представленного формулой (VIII), и сульфонамидного соединения, представленного формулой (IX).
Реакцию обычно осуществляют в воде или в смешивающемся с водой инертном растворителе, таком как тетрагидрофуран и ацетон, в присутствии основания, такого как гидроксид натрия, гидроксид калия, гидроксид лития, метоксид натрия и гидрид натрия. Реакцию осуществляют при температуре от 0 до 100°С, предпочтительно приблизительно от 20 до 30°С.
Альтернативно целевое соединение получают способом, при котором сульфонамид, представленный формулой (IX), взаимодействует и галогенформиатом, представленным формулой (XIII), с получением карбамата, представленного формулой (XII), и полученному карбамату дают возможность взаимодействовать с амином, представленным формулой (XI).
Реакцию между сульфонамидом, представленным формулой (IX), и галогенформиатом, представленным формулой (XIII), осуществляют в инертном растворителе, таком как ацетон, тетрагидрофуран и метилэтилкетон, в присутствии связывающего кислоту агента, такого как карбонат калия, карбонат натрия, гидроксид калия и гидроксид натрия. Температуру реакции можно варьировать приблизительно от 30°С до температуры кипения флегмы. Впоследствии осуществляют реакцию между карбаматом, представленным формулой (XII), и амином, представленным формулой (XI), при нагревании в инертном растворителе с высокой температурой кипения, таком как диоксан, толуол и диглим, при температурах, варьирующихся приблизительно от 50°С до температуры кипения флегмы.
Аминосоединения, представленные формулой (VI) или (XI), представляют собой исходные вещества для сульфонамид- или сульфонилмочевинасодержащих гетероциклических соединений по настоящему изобретению и могут быть получены с помощью комбинаций обычных методик.
Например, хинолиновые и изохинолиновые производные можно получить в соответствии со следующими способами получения.
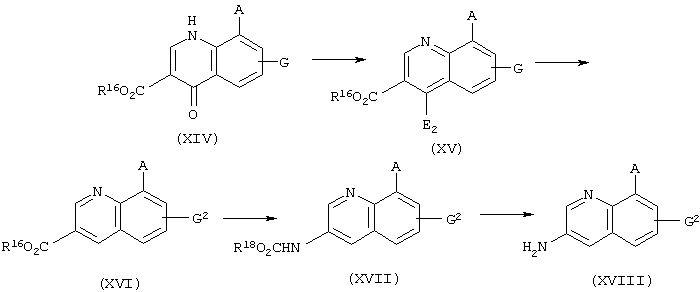
где в формулах A, E2, G2 и R16 имеют те же значения, которые определены выше, а R18 представляет С1-С4 алкильную группу или бензильную группу.
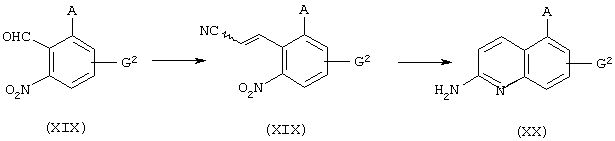
где в формулах А и G2 имеют те же значения, которые определены выше.
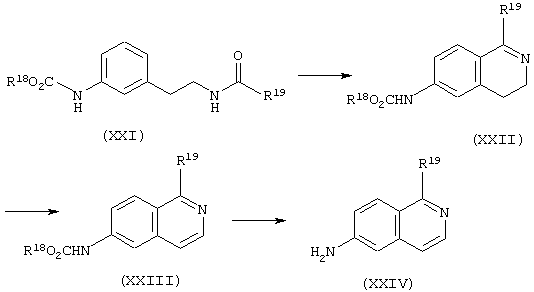
где в формулах R18 имеет то же значение, которое определено выше, а R19 представляет С1-С4 алкильную группу.
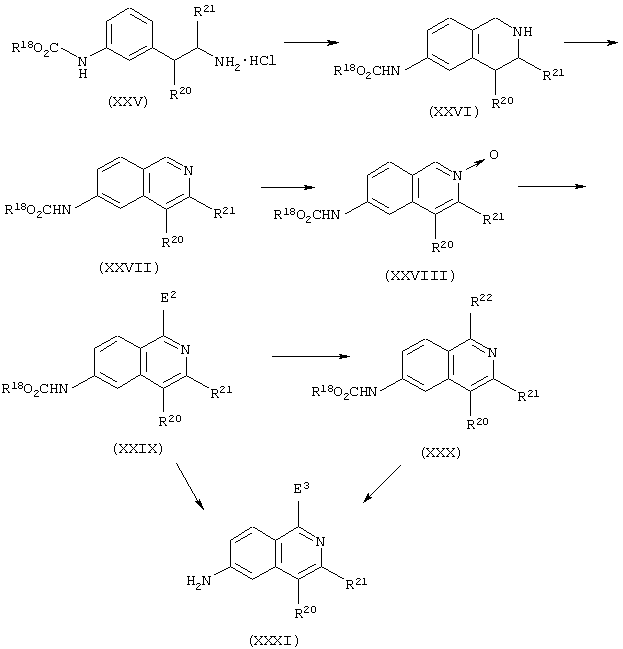
где в формулах R18 и Е2 имеют те же значения, которые определены выше; R20 и R21 каждый представляет атом водорода или С1-С4 алкильную группу; R22 представляет С1-С4 алкоксигруппу, необязательно замещенную феноксигруппой или фенильной группой, цианогруппу или аминогруппу, которая может быть замещена одной или двумя С1-С4 алкильными группами, и Е3 представляет атом водорода, атом галогена, С1-С4 алкоксигруппу, необязательно замещенную феноксигруппой или фенильной группой, цианогруппу или аминогруппу, которая может быть замещена одной или двумя С1-С4 алкильными группами.
Когда соединения по настоящему изобретению используют в качестве фармацевтических лекарственных средств, их вводят пациенту перорально или парентерально. Дозу варьируют в зависимости от тяжести симптомов, возраста, пола, массы тела и чувствительности пациента, способа введения лекарственного средства, продолжительности введения, интервала между введениями, характеристик, дозирования и типа полученного фармацевтического препарата, типа активного ингредиента и т.п., ее конкретно не ограничивают. Доза обычно составляет от 10 до 6000 мг, предпочтительно приблизительно от 50 до 4000 мг и более предпочтительно от 100 до 3000 мг в день для взрослого человека. Лекарственное средство вводят пациенту от одного до трех раз в день.
Для изготовления твердых препаратов для перорального введения наполнители и, если необходимо, другие добавки, такие как связывающие агенты, разрыхлители, смазывающие агенты, красители и корригенты, добавляют к основному компоненту и из полученной смеси формируют таблетки, таблетки, покрытые оболочкой, гранулы, мелкие гранулы, порошки, капсулы и т.п., в соответствии с обычной методикой.
Указанные наполнители включают лактозу, кукурузный крахмал, сахарозу, глюкозу, сорбит, кристаллическую целлюлозу и диоксид кремния. Связывающие агенты включают, например, поливиниловый спирт, этилцеллюлозу, метилцеллюлозу, аравийскую камедь, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Смазывающие агенты включают стеарат магния, тальк и диоксид кремния. Красители включают красители, разрешенные для применения в фармацевтических лекарственных средствах. Корригенты включают порошок какао, ментол, ароматический порошок, масло мяты перечной, борнеол и порошкообразную кору коричного дерева. Указанные таблетки и гранулы по необходимости можно покрывать сахаром, желатином или другими покрывающими веществами.
Для изготовления препаратов для инъекций применяют добавки, такие как агенты, корригирующие рН (буферы). К основному компоненту добавляют суспендирующие агенты, солюбилизирующие агенты, стабилизаторы, агенты, придающие изотоничность, и консерванты и из полученной смеси изготавливают препараты для внутривенных инъекций, подкожных инъекций или внутримышечных инъекций, в соответствии с обычной методикой. Если необходимо, препараты для инъекций изготавливают в лиофилизованной форме.
Указанные суспендирующие агенты включают метилцеллюлозу, полисорбат 80, гидроксиэтилцеллюлозу, аравийскую камедь, порошкообразный трагакант, натрийкарбоксиметилцеллюлозу и монолаурат полиоксиэтиленсорбитана.
Солюбилизирующие агенты включают полиоксиэтилен, гидрогенизированное касторовое масло, полисорбат 80, никотинамид, монолаурат полиоксиэтиленсорбитана, макрогол и этиловые эфиры жирных кислот касторового масла.
Стабилизаторы включают сульфит натрия и метасульфит натрия, а консерванты включают, например, метил-пара-гидроксибензоат, этил-пара-гидроксибензоат, сорбиновую кислоту, фенол, крезол и хлоркрезол.
Действие соединений по настоящему изобретению будет проиллюстрировано ниже в фармакологическом экспериментальном примере.
Фармакологический экспериментальный пример.
Антиангиогенное действие
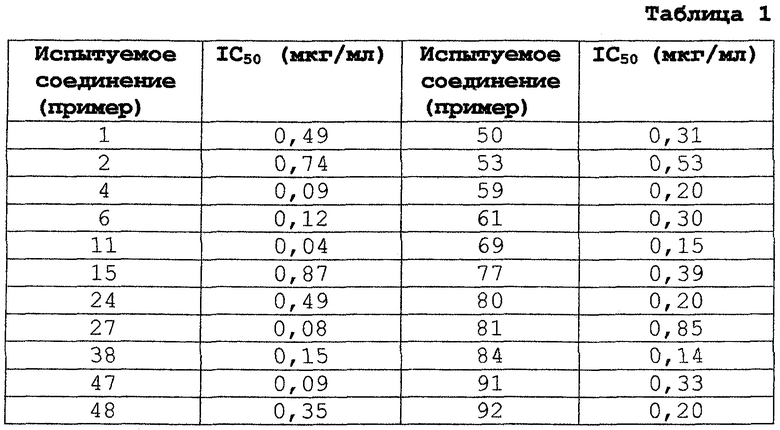
Степень ингибирования ангиогенеза, наблюдаемого при инкубации кусочков аорты крысы в коллагене, определяли как антиангиогенное действие. То есть аорту, взятую у самца крысы линии Sprague-Dawley (возраст 10-12 недель), промывали раствором Хэнкса так, чтобы окружающая ее жировая ткань была тщательно удалена. Аорту нарезали кусочками площадью 2 мм2 и оставляли стоять в 24-ячеечной чашке эндотелиальными клетками вверх. Затем 500 мкл нейтрализованного коллагена типа I (Cell Matrix Type I-A; производство компании Nitta Gelatin) наливали в каждую ячейку и для отверждения геля оставляли стоять приблизительно на 20 минут при комнатной температуре на рабочем столе для асептического изготовления лекарственных средств. После подтверждения затвердевания геля добавляли 500 мкл среды MCDB 131 (производство компании Chlorella Kogyo), a затем инкубировали в термостате СО2 (5% CO2) при 37°С. На следующий день культуральную среду заменяли на 500 мкл среды MCDB 131, содержавшей испытуемое соединение, и инкубацию продолжали. Через три дня среду снова заменяли на 500 мкл среды MCDB 131, содержавшей испытуемое соединение, и на стадии 7-го дня после начала добавления испытуемого соединения подсчитывали под микроскопом количество капилляров, образовавшихся вокруг аорты. Раствор, содержавший испытуемое соединение, изготавливали по системе трехкратного разведения, при которой 10 мкг/мл составляли самую большую концентрацию.
Степень ингибирования рассчитывали по следующей формуле и определяли 50% ингибирующую концентрацию (IC50) для каждого испытуемого соединения (см. таблицу 1).
Степень ингибирования (%) = (С-Т),Сx100,
С - количества капилляров, когда соединение не добавляли,
Т - количества капилляров, когда соединение добавляли.
Ниже приведены "примеры получения", иллюстрирующие получение исходных веществ для соединений по настоящему изобретению, а также "примеры" типичных представителей соединений по настоящему изобретению. Однако представленные примеры не предназначены для ограничения объема настоящего изобретения.
Пример получения 1: 2-амино-5-бромхинолин
После достаточного, в течение 1 минуты, перемешивания 2-бром-6-нитробензальдегида (30,4 г), оксида магния (75 г) и диметилсульфоксида (11,3 мл) добавляли диэтил(цианометил)фосфонат (25,8 мл) и смесь перемешивали в течение еще 2 часов. По окончании перемешивания смесь оставляли стоять в течение ночи. Затем добавляли этилацетат, смесь перемешивали и затем фильтровали. Фильтрат концентрировали и остаток очищали колоночной хроматографией на силикагеле (этилацетат) с получением 32 г 3-(2-бром-6-нитрофенил)-2-пропеннитрила (Е-изомер : Z-изомер=3:1).
1H-ЯMP (CDCl3) δ (м.д.): 5,63 (д, J=16,5 Гц, Е-изомер 1Н), 5,81 (д, J=10,8 Гц, Z-изомер 1Н), 7,42-7,52 (м, Е-изомер 1Н, Z-изомер 2Н), 7,56 (д, J=16,5 Гц, Е-изомер 1Н), 7,90-8,16 (м, Е-изомер 2Н, Z-изомер 2Н).
Затем этанол (250 мл), олово (60 г) и дистиллированную воду (150 мл) добавляли к 32 г 3-(2-бром-6-нитрофенил)-2-пропеннитрила (Е-изомер : Z-изомер=3:1), полученную смесь нагревали при 90°С при перемешивании, затем по каплям добавляли концентрированную хлористоводородную кислоту (256 мл) и перемешивали при 90°С в течение 3 часов. После охлаждения до комнатной температуры декантировали жидкий слой и охлаждали до 0°С. Полученное твердое вещество отфильтровывали, разбавляли водным раствором аммиака и экстрагировали этилацетатом. Экстракт концентрировали и остаток очищали колоночной хроматографией на силикагеле (этилацетат) с получением 5,0 г указанного в заголовке соединения.
1H-ЯMP (CDCl3) δ (м.д.): 4,88 (2Н, шир.), 6,79 (1Н, д, J=9,3 Гц), 7,39 (1H, т, J=8,9 Гц), 7,51 (1Н, д, J=8,9 Гц), 7,61 (1Н, д, J=8,9 Гц), 8,27 (1Н, д, J=9,3 Гц).
Пример получения 2: 2-амино-5-хлорхинолин
Указанное в заголовке соединение получали из 2-хлор-6-нитробензальдегида по аналогичной методике примера получения 1.
1H-ЯMP (CDCl3) δ (м.д.): 5,25 (2Н, шир.), 6,80 (1Н, д, J=9,7 Гц), 7,32 (1H, дд, J=7,5 Гц, 1,5 Гц), 7,46 (1Н, т, J=7,5 Гц), 7,57 (1H, м), 8,30 (1H, д, J=9,7 Гц).
Пример получения 3: 3-карбэтокси-4-гидрокси-8-бромхинолин
Смесь 50 г (0,291 моль) 2-броманилина и 63 г (0,291 моль) диэтилэтоксиметиленмалоната нагревали при 100°С при пониженном давлении в течение 3 часов, затем нагревали при 200°С в течение еще 12 часов. По окончании реакции твердое вещество в полученной реакционной смеси промывали этилацетатом, кристаллы отфильтровывали и сушили с получением 50 г указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,26 (3Н, т, J=7,2 Гц), 4,21 (2Н, кв, J=7,2 Гц), 7,34 (1H, т, J=7,6 Гц), 8,03 (1H, дд, J=1,6 Гц, 7,6 Гц), 8,15 (1H, дд, J=1,6 Гц, 7,6 Гц), 8,43 (1H, с), 11,56 (1H, с).
Пример получения 4: 3-карбэтокси-8-бромхинолин
Смесь 2,5 г (8,4 ммоль) 3-карбэтокси-4-гидрокси-8-бромхинолина и 10 мл оксихлорида фосфора нагревали при кипении с обратным холодильником в течение 1 часа. По окончании реакции оксихлорид фосфора удаляли, остаток очищали с помощью NH-силикагеля с получением 2,6 г хлорированного производного. Затем 500 мг (1,6 ммоль) хлорированного производного растворяли в 20 мл диоксана и добавляли 1 г порошкообразного цинка и 3 мл уксусной кислоты, затем нагревали при 65°С в течение 30 минут. К реакционной смеси добавляли этилацетат и затем фильтровали через целит. Фильтрат промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали. К остатку добавляли 1 мл уксусной кислоты и смесь оставляли стоять в течение 12 часов. Затем уксусную кислоту удаляли, остаток подвергали колоночной хроматографии на силикагеле и элюировали элюентом (этилацетат : н-гексан=1:7) с получением 180 мг указанного в заголовке соединения.
1H-ЯMP (CDCl3) δ (м.д.): 1,47 (3Н, т, J=7,2 Гц), 4,50 (1Н, кв, J=7,2 Гц), 7,50 (1Н, д, J=7,6 Гц), 7,93 (1H, дд, J=1,2 Гц, 7,6 Гц), 8,18 (1H, дд, J=1,2 Гц, 7,6 Гц), 8,85 (1H, д, J=2 Гц), 9,57 (1H, д, J=2 Гц).
Пример получения 5: 3-амино-8-бромхинолин
К смеси этанола (10 мл) и 1 н. водного раствора NaOH (10 мл) добавляли 500 мг (1,8 ммоль) 3-карбэтокси-8-бромхинолина, затем перемешивали при комнатной температуре в течение 3 часов. Этанол удаляли и остаток нейтрализовали 1 н. НСl. Полученное твердое вещество отфильтровывали, промывали водой и сушили с получением 450 мг карбоновой кислоты. Затем 450 мг (1,8 ммоль) карбоновой кислоты добавляли к 25 мл трет-бутанола, затем добавляли еще 0,58 мл (2,7 ммоль) DPPA и 0,37 мл (2,7 ммоль) триэтиламина и нагревали при кипении с обратным холодильником в течение 12 часов. Реакционную смесь концентрировали, остаток подвергали колоночной хроматографии на силикагеле и элюировали элюентом (этилацетат : н-гексан=1:4) с получением 352 мг амидного производного. Затем 350 мг (1,1 ммоль) амидного производного добавляли к смеси 4 мл метанола и 2 мл концентрированной НСl, затем перемешивали при комнатной температуре 1 час. Реакционную смесь подщелачивали добавлением водного раствора аммиака и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали с получением 240 мг указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 5,88 (2Н, с), 7,13 (1Н, д, J=2,8 Гц), 7,24 (1Н, дд, J=7,6 Гц, 8,4 Гц), 7,59-7,65 (2Н, м), 8,49 (1Н, д, J=2,8 Гц).
Пример получения 6: 3-амино-8-иодхинолин
Указанное в заголовке соединение получали из 2-иоданилина по аналогичной методике примеров получения 3-5.
1H-ЯMP (ДМСО-d3) δ (м.д.): 5,85 (2Н, с), 7,07 (1Н, д, J=2,8 Гц), 7,10 (1Н, дд, J=1,2 Гц, 7,6 Гц), 7,62 (1Н, дд, J=1,2 Гц, 7,6 Гц), 7,90 (1Н, дд, J=1,2 Гц, 7,6 Гц), 8,45 (1Н, д, J=2,8 Гц).
Пример получения 7: 3-амино-8-цианохинолин
Указанное в заголовке соединение получали из 2-цианоанилина по аналогичной методике примеров получения 3-5.
1H-ЯMP (ДМСО-d6) δ (м.д.): 6,03 (2Н, шир.с), 7,22 (1Н, д, J=2,8 Гц), 7,48 (1Н, дд, J=7,2 Гц, 8,4 Гц), 7,84 (1Н, дд, J=1,2 Гц, 8,4 Гц), 7,94 (1Н, дд, J=1,2 Гц, 8,4 Гц), 8,57 (1Н, д, J=2,8 Гц).
Пример получения 8: 3-амино-8-(метилсульфонил)хинолин
Указанное в заголовке соединение получали по аналогичной методике примеров получения 3-5.
1H-ЯMP (ДМСО-d6) δ (м.д.): 6,00 (2Н, с), 7,26 (1Н, д, J=2,4 Гц), 7,53 (1Н, т, J=7,2 Гц), 7,91 (1Н, дд, J=1,6 Гц, 7,2 Гц), 7,96 (1Н, дд, J=1,2 Гц, 8,4 Гц), 8,58 (1Н, д, J=2,8 Гц).
Пример получения 9: 3-амино-8-хлорхинолин
Указанное в заголовке соединение получали по аналогичной методике примеров получения 3-5.
1H-ЯMP (ДМСО-d6) δ (м.д.): 5,90 (2Н, с), 7,17 (1Н, д, J=2,8 Гц), 7,33 (1Н, т, J=7,6 Гц), 7,46 (1Н, д, J=7,6 Гц), 7,58 (1Н, д, J=7,6 Гц), 8,52 (1Н, д, J=2,8 Гц).
Пример получения 10: 3-амино-8-трифторметилхинолин
Указанное в заголовке соединение получали по аналогичной методике примеров получения 3-5.
1H-ЯMP (ДМСО-d6) δ (м.д.): 5,94 (2Н, с), 7,23 (1Н, д, J=2,8 Гц), 7,48 (1H, т, J=7,6 Гц), 7,69 (1Н, д, J=7,6 Гц), 7,91 (1H, д, J=7,6 Гц), 8,55 (1H, д, J=2,8 Гц).
Пример получения 11: этил-8-хлор-4-винилхинолин-3-карбоксилат
К раствору 2,0 г (7,4 ммоль) этил-4,8-дихлорхинолин-3-карбоксилата, полученного по аналогичной методике примера получения 4, в толуоле (20 мл) добавляли трибутилвинилолово (2,8 мл) и тетракис(трифенилфосфин)палладий (171 мг), затем перемешивали в течение 2 часов при кипячении с обратным холодильником. Реакционную смесь фильтровали через целит и концентрировали. Затем остаток очищали колоночной хроматографией на силикагеле с получением 1,92 г указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,36 (3Н, т, J=7,6 Гц), 4,37 (2Н, д, J=7,6 Гц), 5,52 (1Н, д, J=18,0 Гц), 5,58 (1Н, д, J=16,4 Гц), 7,40 (1Н, дд, J=16,4 Гц, 18,0 Гц), 7,70 (1Н, т, J=8,0 Гц), 8,11 (1Н, д, J=8,0 Гц), 8,25 (1Н, д, J=8,0 Гц), 9,24 (1Н, с).
Пример получения 12: 3-амино-8-хлор-4-винилхинолин
Указанное в заголовке соединение получали из 4-винил-8-хлорхинолин-3-карбоксилата по аналогичной методике примера получения 5.
1H-ЯMP (ДМСО-d6) δ (м.д.): 5,69 (1H, дд, J=1,6 Гц, 18,0 Гц), 5,81 (2Н, с), 5,84 (1H, дд, J=1,6 Гц, 11,6 Гц), 6,91 (1H, дд, J=11,6 Гц, 18,0 Гц), 7,38 (1H, т, J=8,0 Гц), 7,52 (1H, дд, J=1,2 Гц, 8,0 Гц), 7,85 (1H, дд, J=1,2 Гц, 8,0 Гц), 8,60 (1H, с).
Пример получения 13: этил-7-амино-2-хлорхинолин-4-карбоксилат
К 25 мг (231 ммоль) м-фенилендиамина добавляли 43 г (231 ммоль) диэтилоксалоацетата, затем перемешивали при 160°С в течение 1 часа. После охлаждения кристаллы промывали метанолом. К раствору кристаллов (3,0 г, 13 ммоль) в хлороформе (30 мл) добавляли оксихлорид фосфора (3,6 мл), затем нагревали при кипении с обратным холодильником в течение 1 часа. После охлаждения реакционную смесь выливали в ледяную воду, подщелачивали 1 н. водным раствором гидроксида натрия и полученные кристаллы отфильтровывали. Кристаллы промывали тетрагидрофураном и фильтрат выпаривали с получением 4,85 г указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,31-1,42 (3Н, м), 4,34-4,46 (2Н, м), 6,92 (1Н, д, J=2,4 Гц), 7,12 (1Н, дд, J=2,4 Гц, 9,2 Гц), 7,40 (1Н, с), 8,21 (1Н, д, J=9,2 Гц).
Пример получения 14: 2-бензилтио-4-метоксипиридазин
В диметилсульфоксиде (30 мл) суспендировали 843 мг (21 ммоль, 55% в масле) гидроксида натрия, добавляли 2,0 мл (16,7 моль) бензилмеркаптана при охлаждении льдом, затем перемешивали в течение 10 минут. К реакционной смеси добавляли 2,5 г (17,6 ммоль) 4-метокси-2-хлорпиридазина, затем перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли водный насыщенный хлорид аммония, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали. Затем остаток очищали колоночной хроматографией на силикагеле с получением 1,63 г указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,98 (3Н, с), 4,48 (2Н, с), 7,12 (1Н, д, J=8,8 Гц), 7,22-7,26 (1Н, м), 7,29-7,37 (2Н, м), 7,41-7,44 (2Н, м), 7,57 (1Н, д, J=8,8 Гц).
Пример получения 15: 2-бензилтио-4-карбоксамидпиридин
К 25 мг (159 ммоль) 2-хлоризоникотиновой кислоты добавляли тионилхлорид (120 мл), затем перемешивали в течение 3 часов при кипячении с обратным холодильником. После охлаждения реакционную смесь выпаривали с получением остатка. Раствор остатка в тетрагидрофуране (200 мл) выливали в смешанный раствор насыщенного водного раствора аммиака (200 мл) и раствора тетрагидрофурана (200 мл) при охлаждении льдом. После перемешивания в течение 15 минут при охлаждении льдом смесь выпаривали, полученные кристаллы отфильтровывали и промывали водой с получением 22,6 г кристаллов белого цвета. К раствору 5,13 г (32 ммоль) полученных кристаллов белого цвета в диметилформамиде (70 мл) добавляли 4,2 мл (36 ммоль) бензилтиомеркаптана и 10 г (77 ммоль) карбоната калия, затем перемешивали в течение 3 часов при кипячении с обратным холодильником. К реакционной смеси добавляли воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и выпаривали. Затем остаток очищали хроматографией на силикагеле. Полученные кристаллы промывали гексаном с получением 6,3 г указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 4,46 (2Н, с), 7,22-7,33 (3Н, м), 7,41 (2Н, д, J=7,2 Гц), 7,49 (1Н, дд, J=1,6, Гц, 5,2 Гц), 7,67 (1Н, с), 7,73 (1Н, с), 8,21 (1Н, с), 8,58 (1Н, д, J=5,2 Гц).
Пример получения 16: 7-амино-2-хлор-4-метилхинолин
К 27 г (251 ммоль) м-фенилендиамина добавляли 32 г (251 ммоль) этилацетоацетата, затем перемешивали при 200°С в течение 1 часа. После охлаждения кристаллы промывали гексаном. К 9,5 г (54 ммоль) кристаллов добавляли 15 мл оксихлорида фосфора и затем нагревали при кипении с обратным холодильником в течение 2 часов. После охлаждения реакционную смесь выливали в ледяную воду и подщелачивали насыщенным водным раствором аммиака. Полученные кристаллы отфильтровывали и промывали водой. Кристаллы промывали метанолом и фильтрат выпаривали с получением 4,85 г указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,18 (3Н, с), 5,95 (2Н, с), 6,82 (1Н, д, J=2,4 Гц), 6,98 (1Н, с), 7,01 (1Н, дд, J=2,4 Гц, 8,8 Гц), 7,76 (1Н, д, J=8,8 Гц).
Пример получения 17: 3,4-дигидроизохинолин
К раствору 26,67 г (0,2 моль) 1,2,3,4-тетрагидроизохинолина в метиленхлориде (300 мл) добавляли N-бромсукцинимид (39,2 г) при охлаждении льдом в течение 20 минут. После перемешивания в течение 40 минут к реакционной смеси добавляли 30% водный раствор гидроксида натрия (130 мл). Органический слой промывали водой, экстрагировали 10% хлористоводородной кислотой (200 мл) и водный слой промывали метиленхлоридом. Водный слой подщелачивали водным раствором аммиака, экстрагировали метиленхлоридом. Экстракт сушили над сульфатом магния и затем выпаривали. Полученный остаток дистиллировали (около 16 мм рт.ст., 120°С) с получением 21,5 г указанного в заголовке соединения в виде масла.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,66 (2Н, т, J=8 Гц), 3,62 (2Н, тд, J=2 Гц, 8 Гц), 7,19-7,21 (1Н, м), 7,29-7,33 (1Н, м), 7,35-7,40 (1Н, м), 8,31 (1H, т, J=2 Гц).
Пример получения 18: 7-нитроизохинолин
К концентрированной серной кислоте (70 мл) добавляли 15 г нитрата калия, затем добавляли раствор 18 г (0,14 моль) 3,4-дигидроизохинолина в концентрированной серной кислоте (70 мл) при -15°С в течение 20 минут. После перемешивания при комнатной температуре в течение 1 часа смесь нагревали при 60°С в течение 40 минут. Реакционную смесь выливали в ледяную воду, а затем придавали ей основность водным раствором аммиака и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали. К остатку добавляли декалин (100 мл), нитробензол (100 мл) и палладиевую чернь (2 г), затем нагревали при 200°С в потоке азота в течение ночи. Реакционную смесь промывали этилацетатом и экстрагировали 2 н. хлористоводородной кислотой. Водный слой промывали этилацетатом, затем добавляли водный раствор гидроксида натрия. Полученные осадки отфильтровывали и промывали водой с получением 14,4 г указанного в заголовке соединения.
1H-ЯMP(CDCl3) δ (м.д.): 7,79 (1Н, д, J=5,6 Гц), 8,00 (1H, д, J=9,2 Гц), 8,48 (1H, дд, J=2,4 Гц, 9,2 Гц), 8,75 (1H, д, J=5,6 Гц), 8,96 (1H, д, J=2 Гц), 9,48 (1H, с).
Пример получения 19: 4-бром-7-нитроизохинолин
К 1,6 г (9,19 ммоль) 7-нитрохинолина добавляли 1,2 мл водной бромистоводородной кислоты и 3 мл брома, затем нагревали при 180°С в течение 5,5 часов. Реакционную смесь экстрагировали этилацетатом, экстракт промывали последовательно водным раствором гидроксида натрия, водным раствором тиосульфата натрия и насыщенным раствором соли, сушили над сульфатом магния и концентрировали. Затем полученный остаток очищали колоночной хроматографией на силикагеле (элюирование гексан : этилацетат=1:4) с получением 500 мг указанного в заголовке соединения.
1H-ЯMP(CDCl3) δ (м.д.): 8,36 (1H, д, J=9,2 Гц), 8,58 (1H, д, J=2,4 Гц, 9,2 Гц), 8,93 (1Н, с), 8,96 (1H, д, J=3,2 Гц), 9,38 (1H, с).
Пример получения 20: 7-амино-4-бромизохинолин
В 1 мл этанола, 2 мл тетрагидрофурана и 1 мл воды растворяли 66 мг (0,26 ммоль) 7-нитро-4-бромизохинолина и добавляли 70 мг порошкообразного железа и 140 мг хлорида аммония, затем нагревали при 50°С в течение 3 часов. К реакционной смеси добавляли 1 н. водный раствор хлорида натрия и затем экстрагировали хлороформом. Органический слой сушили над сульфатом магния и концентрировали. Затем полученный остаток кристаллизовали из изопропилового эфира с получением 33 мг указанного в заголовке соединения.
1H-ЯMP (ДСМО-d6) δ (м.д.): 5,98 (2Н, с), 6,97 (1H, д, J=2,4 Гц), 7,31 (1H, дд, J=2,4 Гц, 8,8 Гц), 8,28 (1H, с), 8,89 (1H, с).
Пример получения 21: 6-(4-толуолсульфониламин)изохинолин
В пиридине (30 мл) растворяли 6-аминоизохинолин (3,348 г, Synthesis, 733 (1975)) и добавляли 4-толуолсульфонилхлорид (5,13 г), затем перемешивали при комнатной температуре в течение ночи. Добавляли воду и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток перекристаллизовывали из этанола с получением указанного в заголовке соединения (5,958 г, 85%) в виде кристаллов бледно-желтого цвета.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,28 (3Н, с), 7,32 (2Н, д, J=8,2 Гц), 7,40 (1Н, дд, J=1,6 Гц, 9,2 Гц), 7,55 (1Н, шир.с), 7,67 (1Н, д, J=5,6 Гц), 7,74 (2Н, д, J=8,2 Гц), 7,97 (1Н, д, J=9,2 Гц), 8,36 (1Н, д, J=5,6 Гц), 9,10 (1Н, с).
Пример получения 22: 1-хлор-6-(4-толуолсульфониламин)изохинолин
В хлороформе (100 мл) растворяли 3,0 г 6-(4-толуолсульфониламин)изохинолин (пример получения 21) и добавляли м-хлорпербензойную кислоту (2,57 г) при охлаждении льдом, затем перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали, полученные кристаллы промывали диэтиловым эфиром, отфильтровывали и сушили с получением кристаллов бледно-желтого цвета. Полученные кристаллы суспендировали в хлороформе (83 мл), добавляли оксихлорид фосфора (19 мл) и затем нагревали при кипении с обратным холодильником в течение 5 часов. После охлаждения растворитель выпаривали и остаток подщелачивали водным бикарбонатом натрия на водяной бане, затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток очищали на колонке с силикагелем с получением неочищенных кристаллов указанного в заголовке соединения (1,630 г, 49,40%). Неочищенные кристаллы перекристаллизовывали из этанола с получением указанного в заголовке соединения в виде бесцветных кристаллов.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,29 (3Н, с), 7,34 (2Н, д, J=8,0 Гц), 7,52 (1H, дд, J=2,0 Гц, 9,0 Гц), 7,65 (1Н, д, J=2,0 Гц), 7,76 (1H, д, J=5,6 Гц), 7,77 (2Н, д, J=8,0 Гц), 8,14 (1H, д, J=9,0 Гц), 8,16 (1H, д, J=5,6 Гц).
Пример получения 23: 6-амино-1-хлоризохинолин
В серной кислоте (30 мл) растворяли 3,323 г 1-хлор-6-(4-толуолсульфониламин)изохинолина (пример получения 22), затем перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали на лед, подщелачивали добавлением водного раствора гидроксида натрия и затем карбоната калия и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (1,37 г, 76,81%) в виде кристаллов желтовато-коричневого цвета.
1H-ЯMP (ДМСО-d6) δ (м.д.): 6,23 (2Н, шир.с), 6,76 (1H, с), 7,09 (1H, д, J=9,6 Гц), 7,37 (1H, д, J=6,4 Гц), 7,89 (1H, д, J=9,6 Гц), 7,90 (1H, д, J=6,4 Гц).
Пример получения 24: 2-хлор-1,6-нафтилидин
В оксихлориде фосфора (19 мл) растворяли 1,0 г 1, 6-нафтиридин-2-она (J. Org. Chem., 4744 (1990)), затем нагревали при кипении с обратным холодильником при 120°С в течение 2 часов. После охлаждения растворитель выпаривали, остаток подщелачивали водой и карбонатом калия и затем смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (0,658 г, 58,45%) в виде кристаллов оранжевого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 7,55 (1H, д, J=8,8 Гц), 7,86 (1H, д, J=6,0 Гц), 8,28 (1H, дд, J=8,8 Гц), 8,80 (1Н, д, J=6,0 Гц), 9,29 (1H, с).
Пример получения 25: 2-амино-1,6-нафтилидин
В герметично закрытой пробирке 2-хлор-1,6-нафтилидин (0,628 г, пример получения 24) и водный раствор аммиака (40 мл) нагревали при 130°С в течение 11 часов. После охлаждения реакционную смесь экстрагировали этилацетатом, экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (0,497 г, 89,73%) в виде кристаллов бледно-желтого цвета.
1H-ЯMP (ДМСО-d6) δ (м.д.): 6,81 (1H, д, J=8,8 Гц), 7,24 (1H, д, J=5,8 Гц), 7,97 (1H, д, J=8,8 Гц), 8,34 (1H, д, J=5,8 Гц), 8,80 (1H, с).
Пример получения 26: N-(3-нитроэтоксифенил)фталимид
В тетрагидрофуране (225 мл) растворяли 15 г 3-нитроэтоксифенилового спирта, затем добавляли трифенилфосфин (26 г) и фталимид (13,9 г). Затем полученную смесь охлаждали льдом и затем по каплям добавляли диэтилазодикарбоксилат (15,5 мл). После перемешивания при комнатной температуре в течение 1 часа полученные кристаллы отфильтровывали, промывали диэтиловым эфиром и сушили с получением N-(3-нитроэтоксифенил)фталимида в виде бесцветных кристаллов.
1H-ЯMP (CDCl3) δ (м.д.): 3,12 (2Н, т, J=7,4 Гц), 3,98 (2Н, т, J=7,4 Гц), 7,47 (1H, дд, J=8,0 Гц, 8,0 Гц), 7,60 (1H, д, J=8,0 Гц), 7,72 (2Н, м), 7,83 (2Н, м), 8,09 (1H, д, J=8,0 Гц), 8,12 (1H, с).
Пример получения 27: 3-нитроэтоксифениламин
В этаноле (150 мл) суспендировали N-(3-нитроэтоксифенил)фталимид, полученный в примере получения 26. К смеси добавляли гидразин (5,7 мл), затем нагревали при кипении с обратным холодильником в течение 1 часа. Хотя реакционная смесь была уже полностью растворена, снова выпадали в осадок кристаллы. Кристаллы отфильтровывали и промывали охлажденным этанолом. Затем растворитель выпаривали с получением указанного в заголовке соединения (5,559 г, 99%) в виде масла желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 2,87 (2Н, т, J=6,8 Гц), 3,04 (2Н, т, J=6,8 Гц), 7,48 (1H, дд, J=7,6 Гц, 8,4 Гц), 7,55 (1H, ддд, J=1,2 Гц, 1,6 Гц, 7,6 Гц), 8,08 (2Н, м).
Пример получения 28: N-ацетил-N-(3-нитроэтоксифенил)амин
В пиридине (33 мл) растворяли 5,559 г 3-нитроэтоксифениламина (пример получения 27), затем по каплям добавляли ацетилхлорид (2,5 мл) при охлаждении льдом. После перемешивания при комнатной температуре в течение 0,5 часа смесь снова охлаждали льдом. Добавляли воду и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (6,323 г, 91%) в виде масла желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,97 (3Н, с), 2,95 (2Н, т, J=7,0 Гц), 3,55 (2Н, дт, J=6,0 Гц, 7,0 Гц), 5,60 (1Н, шир.с), 7,49 (1H, дд, J=7,2 Гц, 8,0 Гц), 7,55 (1Н, д, J=7,2 Гц), 8,07 (1H, с), 8,12 (1H, д, J=8,0 Гц).
Пример получения 29: N-ацетил-N-(3-аминоэтоксифенил)амин
В этаноле (40 мл) суспендировали 2,1 г N-ацетил-N-(3-нитроэтоксифенил)амина (пример получения 28), затем добавляли порошкообразное железо (2,25 г), ацетат аммония (4,3 г) и воду (20 мл) и затем нагревали при кипении с обратным холодильником в течение 1,5 часов. Твердый материал отфильтровывали, промывали этанолом и часть фильтрата выпаривали. Остаток экстрагировали этилацетатом, промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (1,723 г, 96%) в виде масла желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,94 (3Н, с), 2,72 (2Н, т, J=6,8 Гц), 3,50 (2Н, дт, J=6,0 Гц, 6,8 Гц), 6,53 (1H, с), 6,57 (1H, д, J=8,0 Гц), 6,59 (1H, д, J=7,2 Гц), 7,10 (1H, дд, J=7,2 Гц, 8,0 Гц).
Пример получения 30: N-ацетил-N-(3-этоксикарбониламиноэтоксифенил)амин
В пиридине (5 мл) растворяли 1,7 г N-ацетил-N-(3-аминоэтоксифенил)амина (пример получения 29), затем по каплям добавляли этилхлорформиат (1,4 мл) при охлаждении льдом. После перемешивания при комнатной температуре в течение 1 часа смесь снова охлаждали льдом. Добавляли воду, затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (2,358 г, 97%) в виде масла желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,29 (3Н, т, J=7,2 Гц), 1,93 (3Н, с), 2,76 (2Н, т, J=7,0 Гц), 3,47 (2Н, дт, J=6,0 Гц, 7,0 Гц), 4,20 (2Н, кв, J=7,2 Гц), 5,57 (1H, шир.с), 6,86 (1H, д, J=7,2 Гц), 7,21 (1H, дд, J=7,2 Гц, 8,0 Гц), 7,28 (1H, д, J=8,0 Гц), 7,29 (1H, с).
Пример получения 31: 6-этоксикарбониламино-1-метил-3,4-дигидроизохинолин
С использованием 1,0 г N-ацетил-N-(3-этоксикарбониламиноэтоксифенил)амина (пример получения 30) осуществляли реакцию циклизации согласно методике, описанной в Heterocycles 31(2), 341 (1990). По окончании указанной реакции реакционную смесь выливали на лед, смесь подщелачивали карбонатом калия и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения в виде масла коричневого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,19 (3Н, т, J=7,2 Гц), 2,23 (3Н, с), 2,60 (1H, т, J=7,4 Гц), 3,55 (2Н, т, J=7,4 Гц), 4,13 (2Н, кв, J=7,2 Гц), 7,31 (1H, д, J=6,8 Гц), 7,32 (1H, с), 7,34 (1H, д, J=6,8 Гц).
Пример получения 32: 6-этоксикарбониламино-1-метилизохинолин
К 6-этоксикарбониламино-1-метил-3,4-дигидроизохинолину добавляли п-цимен (100 мл) и палладий на угле (0,9 г), затем нагревали при перемешивании при 195°С в атмосфере азота в течение 1 часа. После отфильтровывания катализатора реакционную смесь промывали этанолом и часть фильтрата выпаривали. Остаток экстрагировали 1 н. хлористоводородной кислотой, затем подщелачивали карбонатом калия и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (0,629 г, 69%, 2 стадии) в виде кристаллов бледно-желтого цвета.
1H-ЯMP(CDCl3) δ (м.д.): 1,30 (3Н, т, J=7,2 Гц), 2,89 (3Н, с), 4,26 (1Н, кв, J=7,2 Гц), 7,40 (1Н, д, J=5,8 Гц), 7,56 (1Н, дд, J=1,6 Гц, 8,8 Гц), 7,99 (1H, д, J=8,8 Гц), 8,05 (1Н, д, J=1,6 Гц), 8,30 (1H, д, J=5,6 Гц), 8,37 (1H, с).
Пример получения 33: 6-амино-1-метилизохинолин
В этаноле (20 мл) суспендировали 0,629 г 6-этоксикарбониламино-1-метилизохинолина (пример получения 32) и 8 н. водный раствор гидроксида натрия (6,8 мл), затем нагревали при кипении с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуры добавляли насыщенный водный раствор хлорида аммония и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (0,311 г, 72%) в виде кристаллов бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 2,81 (3Н, с), 4,24 (2Н, шир.с), 6,60 (1H, д, J=2,0 Гц), 6,91 (1H, ддд, J=1,6 Гц, 2,0 Гц, 8,8 Гц), 7,18 (1H, д, J=5,6 Гц), 7,84 (1Н, д, J=8,8 Гц), 8,16 (1H, дд, J=1,6 Гц, 5,6 Гц).
Пример получения 34: N-трет-бутоксикарбонил-3-нитроэтоксифениламин
В тетрагидрофуране (130 мл) растворяли 4,559 г 3-нитроэтоксифениламина (пример получения 27) и добавляли триэтиламин (8,4 мл) и ди-трет-бутилбикарбонат (6,6 г), затем перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, к остатку добавляли насыщенный раствор соли и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (8,789 г, включая примеси) в виде масла желтого цвета. Указанный продукт использовали в последующей реакции без дополнительной очистки.
1H-ЯMP (CDCl3) δ (м.д.): 1,53 (9Н, с), 2,92 (2Н, т, J=7,6 Гц), 3,42 (2Н, дт, J=6,4 Гц, 6,8 Гц), 4,58 (1H, шир.с), 7,48 (1H, дд, J=7,2 Гц, 8,0 Гц), 7,54 (1H, д, J=8,0 Гц), 8,07 (1H, с), 8,10 (1H, д, J=7,2 Гц).
Пример получения 35: 3-(2-трет-бутоксикарбониламиноэтил)анилин
С использованием N-трет-бутоксикарбонил-3-нитроэтоксифениламина (8,789 г, включая примеси, пример получения 34) указанное в заголовке соединение (5,521 г, 76%) получали в виде масла желтого цвета по аналогичной методике примера получения 17.
1H-ЯMP (CDCl3) δ (м.д.): 1,44 (9Н, с), 2,70 (3Н, т, J=7,4 Гц), 3,36 (2Н, шир.кв), 4,54 (1H, шир.с), 6,54 (1H, с), 6,57 (1Н, д, J=8,0 Гц), 6,60 (1H, д, J=7,2 Гц), 8,10 (1Н, дд, J=7,2 Гц, 8,0 Гц).
Пример получения 36: 3-(2-трет-бутоксикарбониламиноэтил)этоксикарбониламинобензол
С использованием 3-(2-трет-бутоксикарбониламиноэтил)анилина (5,521 г, пример получения 35) указанное в заголовке соединение (0,320 г) получали в виде масла желтого цвета по аналогичной методике примера получения 29. Указанный продукт использовали в последующей реакции без дополнительной очистки.
1H-ЯMP (CDCl3) δ (м.д.): 1,31 (3Н, т, J=7,2 Гц), 1,43 (9Н, с), 2,77 (2Н, т, J=7,4 Гц), 3,67 (2Н, шир.кв), 4,22 (2Н, кв, J=7,4 Гц), 4,55 (1Н, шир.с), 6,52 (1Н, шир.с), 6,89 (1Н, м), 7,24 (1Н, м).
Пример получения 37: гидрохлорид 3-этоксикарбониламиноэтоксифениламина
В этаноле (15 мл) растворяли 14,96 г 3-(2-трет-бутоксикарбониламиноэтил)этоксикарбониламинобензола (пример получения 36). При охлаждении льдом добавляли хлористоводородную кислоту (15 мл), затем перемешивали при комнатной температуре в течение 20 минут. Еще раз добавляли хлористоводородную кислоту (12 мл) и этанол (15 мл) и затем перемешивали при комнатной температуре в течение 20 минут. Затем еще раз добавляли хлористоводородную кислоту (20 мл) и этанол (30 мл) и затем перемешивали при комнатной температуре в течение 30 минут. Растворитель выпаривали (азеотропная дистилляция с толуолом) с получением указанного в заголовке соединения (11,99 г) в виде кристаллов бледно-желтого цвета.
1H-ЯMP (ДМСО6) δ (м.д.): 1,22 (3Н, т, J=7,2 Гц), 2,82 (2Н, м), 2,95 (2Н, м), 4,10 (2Н, кв, J=7,2 Гц), 6,86 (1Н, д, J=7,6 Гц), 7,20 (1Н, дд, J=7,6 Гц, 8,4 Гц), 7,31 (1Н, д, J=8,4 Гц), 7,36 (1Н, с), 8,05 (2Н, с), 9,61 (1Н, с).
Пример получения 38: 6-аминоэтил-1,2, 3, 4-тетрагидроизохинолин
Указанное в заголовке соединение (4,226 г, включая примеси) получали в виде масла желтого цвета в соответствии с методикой, описанной в Chem. Pharm. Bull., 42(8), 1676 (1994), за исключением того, что использовали гидрохлорид 3-этоксикарбониламиноэтоксифениламина (4,7 г), полученный в примере получения 37.
1H-ЯMP (CDCl3) δ (м.д.): 1,29 (3Н, т, J=7,2 Гц), 2,68 (1Н, шир.с), 2,83 (3Н, м), 3,73 (2Н, м), 4,20 (1Н, кв, J=7,2 Гц), 6,77 (1Н, с), 6,94 (1Н, д, J=8,4 Гц), 7,07 (1Н, д, J=8,4 Гц), 7,18 (1Н, шир.с).
Пример получения 39: 6-этоксикарбониламиноизохинолин
К 10 г 6-аминоэтил-1,2,3,4-тетрагидроизохинолина (пример получения 38) добавляли п-цимен (100 мл) и палладий на угле (0,9 г), затем нагревали при перемешивании до 195°С в атмосфере азота в течение 1 часа. После отфильтровывания катализатора и промывания этанолом фильтрат выпаривали. Полученные кристаллы промывали диэтиловым эфиром и сушили. Растворитель выпаривали с получением указанного в заголовке соединения (6,51 г, 66%) в виде кристаллов бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,36 (3Н, т, J=7,2 Гц), 3,74 (1Н, м), 4,29 (2Н, кв, J=7,2 Гц), 6,70 (1Н, д, J=2,0 Гц), 7,46 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,58 (1Н, д, J=6,0 Гц), 7,90 (1H, д, J=8,8 Гц), 8,04 (1H, шир.с), 8,46 (1H, д, J=6,0 Гц), 9,13 (1H, с).
Пример получения 40: N-оксид 6-этоксикарбониламиноизохинолина
Указанное в заголовке соединение (293 г) получали в виде кристаллов бледно-желтого цвета по аналогичной методике примера получения 22, за исключением того, что использовали 6-этоксикарбониламиноизохинолин (250 мг, пример получения 39).
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,25 (3Н, т, J=7,2 Гц), 4,26 (2Н, кв, J=7,2 Гц), 7,61 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,79 (1H, д, J=8,8 Гц), 7,81 (1H, д, J=7,2 Гц), 8,04 (1H, дд, J=2,0 Гц, 7,2 Гц), 8,79 (1H, с), 8,46 (1H, д, J=6,0 Гц), 9,13 (1H, с).
Пример получения 41: 1-хлор-6-этоксикарбониламиноизохинолин
Указанное в заголовке соединение (173 мг, 60%, 2 стадии) получали в виде кристаллов бледно-желтого цвета по аналогичной методике примера получения 22, за исключением того, что использовали N-оксид 6-этоксикарбониламиноизохинолина (250 мг).
1H-ЯMP (CDCl3) δ (м.д.): 1,34 (3Н, т, J=7,2 Гц), 4,29 (2Н, кв, J=7,2 Гц), 7,36 (1H, шир.с), 7,50 (1H, д, J=5,6 Гц), 7,52 (1H, дд J=2,4 Гц, 9,2 Гц), 8,11 (1H, м), 8,19 (1H, д, J=5,6 Гц), 8,22 (1H, д, J=9,2 Гц).
Пример получения 42: 1-метокси-6-метоксикарбониламиноизохинолин
В диметилсульфоксиде (45 мл) растворяли 2,27 г 1-хлор-6-этоксикарбониламиноизохинолина (пример получения 41). К смеси добавляли 28% раствор метоксида натрия (8,7 мл), затем нагревали при перемешивании до 110°С в течение 1,5 часов. После остывания до комнатной температуры добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (1,75 г, 84%) в виде масла коричневого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 3,74 (3Н, с), 4,03 (3Н, с), 7,05 (1Н, д, J=5,8 Гц), 7,41 (1Н, дд J=2,0 Гц, 9,2 Гц), 7,86 (1Н, д, J=5,8 Гц), 7,90 (1Н, шир.с), 8,06 (1Н, д, J=9,2 Гц), 8,08 (1Н, с).
Пример получения 43: 6-амино-1-метоксиизохинолин
Указанное в заголовке соединение (1,04 г, 99%) получали в виде кристаллов светло-коричневого цвета по аналогичной методике примера получения 41, за исключением того, что использовали 1-метокси-6-метоксикарбониламиноизохинолин (1,75 г, пример получения 42) и метанол в качестве растворителя.
1H-ЯMP (CDCl3) δ (м.д.): 4,07 (3Н, с), 4,07 (2Н, шир.с), 6,78 (1Н, д, J=2,2 Гц), 6,88 (1Н, дд, J=2,2 Гц, 8,8 Гц), 6,95 (1Н, д, J=6,0 Гц), 7,84 (1Н, д, J=6,0 Гц), 8,03 (1Н, д, J=8,8 Гц).
Пример получения 44: N-пропинил(3-нитроэтоксифенил)амин
Указанное в заголовке соединение (3,070 г, 77%, включая примеси) получали в виде масла желтого цвета по аналогичной методике примера получения 28, за исключением того, что использовали 3-нитроэтоксифениламин (3,0 г, пример получения 27) и пропионилхлорид (2,5 мл).
1H-ЯMP (CDCl3) δ (м.д.): 1,14 (3Н, т, J=7,6 Гц), 2,19 (2Н, кв, J=7,6 Гц), 2,96 (2Н, т, J=6,8 Гц), 3,56 (2Н, дт, J=6,4 Гц, 6,8 Гц), 7,49 (1Н, дд J=7,6 Гц, 8,0 Гц), 7,55 (1Н, д, J=7,6 Гц), 8,07 (1Н, с), 8,10 (1Н, д, J=8,0 Гц).
Пример получения 45: N-пропинил(3-аминоэтоксифенил)амин
Осуществляли реакцию, аналогично описанной в примере получения 29, с использованием N-пропинил(3-нитроэтоксифенил)амина (3,070 г, пример получения 44). Полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (0,857 г, 32%) в виде масла бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,12 (3Н, т, J=7,6 Гц), 2,19 (2Н, кв, J=7,6 Гц), 2,71 (2Н, т, J=6,8 Гц), 3,49 (2Н, дт, J=6,0 Гц, 6,8 Гц), 5,56 (1Н, шир.с), 6,52 (1Н, с), 6,56 (1Н, д, J=7,6 Гц), 7,09 (1Н, дд, J=7,6 Гц, 7,6 Гц).
Пример получения 46: N-пропинил(3-этоксикарбониламиноэтоксифенил)амин
Осуществляли реакцию, аналогично описанной в примере получения 30, с использованием N-пропинил(3-аминоэтоксифенил)амина (0,857 г, пример получения 44). Полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (0,747 г, 61%) в виде масла светло-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,12 (3Н, т, J=7,6 Гц), 1,30 (3Н, т, J=7,0 Гц), 2,16 (2Н, кв, J=7,6 Гц), 2,78 (2Н, т, J=6,8 Гц), 3,50 (2Н, дт, J=6,0 Гц, 6,8 Гц), 4,21 (2Н, кв, J=7,0 Гц), 6,67 (1H, шир.с), 6,87 (1H, д, J=6,8 Гц), 7,00 (1Н, шир.с), 7,22 (1H, дд, J=6,8 Гц, 8,4 Гц), 7,26 (1Н, д, J=8,4 Гц), 7,28 (1H, с).
Пример получения 47: 6-этоксикарбониламино-1-этилизохинолин
Повторяли методики примеров получения 31 и 32, за исключением того, что использовали N-пропинил-(3-этоксикарбониламиноэтоксифенил)амин (0,747 г, пример получения 46) с получением 6-этоксикарбониламино-1-этил-3,4-дигидроксиизохинолина в виде кристаллов коричневого цвета и затем - указанного в заголовке соединения (0,516 г, 75%, в 2 стадии) в виде масла желтого цвета.
Данные для промежуточного продукта и указанного в заголовке соединения были следующими.
6-Этоксикарбониламино-1-этил-3,4-дигидроксиизохинолин
1H-ЯMP (CDCl3) δ (м.д.): 1,21 (3Н, т, J=7,6 Гц), 1,30 (3Н, т, J=7,0 Гц), 2,66 (2Н, т, J=7,4 Гц), 2,74 (2Н, кв, J=7,6 Гц), 3,64 (2Н, т, J=7,4 Гц), 4,23 (2Н, кв, J=7,0 Гц), 7,32 (1H, д, J=8,4 Гц), 7,37 (1H, с), 7,43 (1H, д, J=8,4 Гц), 7,79 (1H, с).
6-Этоксикарбониламино-1-этилизохинолин
1H-ЯMP (CDCl3) δ (м.д.): 1,32 (3Н, т, J=7,0 Гц), 1,41 (3Н, т, J=7,6 Гц), 3,27 (2Н, кв, J=7,6 Гц), 4,27 (1H, кв, J=7,0 Гц), 7,40 (1H, д, J=6,0 Гц), 7,52 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,89 (1H, с), 8,02 (1H, д, J=2,0 Гц), 8,25 (1H, д, J=8,8 Гц), 8,34 (1H, д, J=6,0 Гц).
Пример получения 48: 6-амино-1-этилизохинолин
Указанное в заголовке соединение (0,320 г, 88%) получали в виде кристаллов бледно-желтого цвета по аналогичной методике примера получения 33, за исключением того, что использовали 6-этоксикарбониламино-1-этилизохинолин (0,516 г, пример получения 47).
1H-ЯMP (CDCl3) δ (м.д.): 1,31 (3Н, т, J=7,2 Гц), 3,21 (2Н, кв, J=7,2 Гц), 4,20 (2Н, шир.с), 6,82 (1Н, д, J=2,4 Гц), 6,95 (1H, дд, J=2,4 Гц, 8,8 Гц), 7,21 (1Н, д, J=6,0 Гц), 7,94 (1H, д, J=8,8 Гц), 8,24 (1H, д, J=6,0 Гц).
Пример получения 49: 1-метокси-4-(3-нитрофенил)пропан-1-ен
Хлорид метоксиметилфосфония (31,1 г) суспендировали в тетрагидрофуране (200 мл), затем при охлаждении льдом добавляли трет-бутоксид калия (10,2 г). В тот момент, когда реакционная смесь приобретала красный цвет, по частям с помощью пипетки добавляли раствор 3-нитроацетофенона (10 г) в тетрагидрофуране (100 мл). После перемешивания при комнатной температуре в течение 2,5 часов при охлаждении льдом добавляли насыщенный водный раствор хлорида аммония. Смесь экстрагировали этилацетатом, экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (8,010 г) в виде масла желтого цвета.
Пример получения 50: 2-(3-нитрофенил)пропаналь
К 1-метокси-4-(3-нитрофенил)пропан-1-ену (8,010 г) добавляли 2 н. хлористоводородную кислоту (150 мл), затем нагревали при перемешивании при 80°С в течение 4 часов. Затем добавляли хлористоводородную кислоту (5 мл) и нагревали при кипении с обратным холодильником в течение 2,5 часов. После охлаждения реакционную смесь нейтрализовали водным раствором гидроксида натрия и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (7,531 г) в виде масла желтого цвета.
Пример получения 51: 2-(3-нитрофенил)пропан-1-ол
В этаноле (100 мл) растворяли 7,531 г 2-(3-нитрофенил)пропаналя. При охлаждении льдом добавляли борогидрид натрия (1,9 г), затем перемешивали при комнатной температуре в течение 1 часа. К смеси добавляли насыщенный раствор соли и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (6,275 г, 57,19%, в 3 стадии) в виде масла коричневого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,34 (3Н, д, J=6,8 Гц), 1,51 (1Н, шир.с), 3,09 (1Н, ткв, J=6,8 Гц, 6,8 Гц), 3,78 (2Н, д, J=6,8 Гц), 7,50 (1Н, дд, J=7,6 Гц, 8,4 Гц), 7,60 (1Н, ддд, J=1,2 Гц, 1,6 Гц, 7,6 Гц), 8,10 (1Н, ддд, J=1,2 Гц, 2,4 Гц, 8,4 Гц), 8,13 (1Н, дд, J=1,6 Гц, 2,4 Гц).
Пример получения 52: 2-(3-нитрофенил)пропиламин
Указанное в заголовке соединение получали в виде масла желтого цвета в соответствии с методиками, описанными в примерах получения 26 и 27, за исключением того, что использовали 2-(3-нитрофенил)пропан-1-ол (1,908 г, пример получения 51).
Пример получения 53: 1-трет-бутоксикарбониламино-2-(3-нитрофенил)пропан
Осуществляли реакцию аналогично описанной в примере получения 35 с использованием 2-(3-нитрофенил)пропиламина, полученного в примере получения 52. Полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (2,626 г) в виде масла желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,31 (3Н, д, J=6,8 Гц), 1,40 (9Н, с), 3,10 (1Н, м), 3,26 (1Н, м), 3,88 (1Н, м), 7,49 (1Н, дд, J=7,6 Гц, 8,4 Гц), 7,56 (1Н, д, J=7,6 Гц), 8,08 (1Н, с), 8,10 (1Н, д, J=8,4 Гц).
Пример получения 54: 2-(3-аминофенил)-1-трет-бутоксикарбониламинопропан
Указанное в заголовке соединение (0,320 г, 88%) получали в виде масла желтого цвета по аналогичной методике примера получения 29, за исключением того, что использовали полученный выше 1-трет-бутоксикарбониламино-2-(3-нитрофенил)пропан (2,626 г).
Пример получения 55: 1-трет-бутоксикарбониламино-2-(3-этоксикарбониламинофенил)пропан
Осуществляли реакцию аналогично описанной в примере получения 30 с использованием полученного выше 2-(3-аминофенил)-1-трет-бутоксикарбониламинопропана. Образовавшийся остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (2,960 г, 77,56%, в 3 стадии) в виде масла коричневого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,25 (3Н, д, J=7,6 Гц), 1,31 (3Н, т, J=7,2 Гц), 1,41 (9Н, с), 2,90 (1Н, м), 3,18 (1H, ддд, J=4,2 Гц, 7,6 Гц, 9,2 Гц), 3,39 (1H, м), 4,42 (2Н, кв, J=7,6 Гц), 4,45 (1H, шир.с), 6,87 (1H, шир.с), 6,94 (1H, м), 7,22 (3Н, м).
Пример получения 56: 6-этоксикарбониламино-4-метил-1,2,3,4-тетрагидроизохинолин
Указанное в заголовке соединение (2,967 г, неочищенное) получали в виде твердого вещества желтого цвета в соответствии с методиками, описанными в примерах получения 38 и 39, за исключением того, что использовали 1-трет-бутоксикарбониламино-2-(3-этоксикарбониламинофенил)пропан (2,960 г, пример получения 55).
Пример получения 57: 6-этоксикарбониламино-4-метилизохинолин
Указанное в заголовке соединение (2,061 г, неочищенное) получали в виде кристаллов бледно-желтого цвета в соответствии с реакцией, описанной в примере получения 40, за исключением того, что использовали полученный выше 6-этоксикарбониламино-4-метил-1,2,3,4-тетрагидроизохинолин (2,967 г, неочищенный).
1H-ЯMP (CDCl3) δ (м.д.): 1,36 (3Н, т, J=7,2 Гц), 2,59 (3Н, с), 4,30 (2Н, кв, J=7,2 Гц), 7,12 (1H, д, J=2,0 Гц), 7,49 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,91 (1H, д, J=8,8 Гц), 8,12 (1H, с), 8,32 (1H, с), 9,00 (1H, с).
Пример получения 58: 6-амино-4-метилизохинолин
Полученный выше 6-этоксикарбониламино-4-метилизохинолин (2,061 г, неочищенный) подвергали реакции в соответствии с методикой, описанной в примере получения 30. Полученные кристаллы промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (0,403 г, 27,75% в 4 стадии) в виде кристаллов бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 2,48 (3Н, с), 4,18 (2Н, шир.с), 6,95 (1Н, д, J=2,0 Гц), 7,00 (1Н, дд, J=2,0 Гц, 8,8 Гц), 7,76 (1Н, д, J=8,8 Гц), 8,19 (1Н, с), 8,86 (1Н, с).
Пример получения 59: 2-(3-нитрофенил)бутан-1-ол
Указанное в заголовке соединение (5,456 г, 50,08%, в 3 стадии) получали в виде масла желтого цвета в соответствии с методиками, описанными в примерах получения 52-55, за исключением того, что использовали 3-нитропропиофенон (10 г).
1H-ЯMP (CDCl3) δ (м.д.): 0,86 (3Н, т, J=7,4 Гц), 1,63 (1Н, м), 1,85 (1Н, м), 3,24 (1Н, м), 3,83 (2Н, м), 7,50 (1Н, дд, J=7,2 Гц, 8,0 Гц), 7,57 (1Н, д, J=8,0 Гц), 8,10 (1Н, с), 8,13 (1Н, д, J=7,2 Гц).
Пример получения 60: 2-(3-нитрофенил)бутиламин
Указанное в заголовке соединение (5,247 г) получали в виде масла желтого цвета в соответствии с методиками, описанными в примерах получения 26 и 27, за исключением того, что использовали 2-(3-нитрофенил)бутан-1-ол (5,456 г, пример получения 59).
Пример получения 61: 1-трет-бутоксикарбониламино-2-(3-нитрофенил)бутан
Затем полученный выше 2-(3-нитрофенил)бутиламин (5,247 г) подвергали реакции в соответствии с методикой, описанной в примере получения 27. Полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (7,679 г) в виде масла бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 0,83 (3Н, т, J=7,4 Гц), 1,39 (9Н, с), 1,63 (1Н, м), 1,79 (1H, м), 2,84 (1Н, м), 3,21 (1H, м), 3,52 (1H, м), 4,42 (1H, шир.с), 7,49 (1H, д, J=7,6 Гц), 7,52 (1H, дд, J=6,8 Гц, 7,6 Гц), 8,04 (1H, с), 8,10 (1H, д, J=6,8 Гц).
Пример получения 62: 2-(3-аминофенил)-1-трет-бутоксикарбониламинобутан
Указанное в заголовке соединение (6,311 г, 85,40%, в 4 стадии) получали в виде масла желтого цвета в соответствии с методикой, описанной в примере получения 29, за исключением того, что использовали 1-трет-бутоксикарбониламино-2-(3-нитрофенил)бутан (7,679 г).
Пример получения 63: 1-трет-бутоксикарбониламино-2-(3-этоксикарбониламинофенил)бутан
Полученное выше соединение затем подвергали реакции в соответствии с методикой, описанной в примере получения 30 с получением указанного в заголовке соединения (8,230 г, неочищенное) в виде твердого вещества оранжевого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 0,81 (3Н, т, J=7,4 Гц), 1,31 (3Н, т, J=7,2 Гц), 1,40 (9Н, с), 1,55 (1H, м), 1,68 (1H, м), 2,63 (1H, м), 3,14 (1H, ддд, J=4,8 Гц, 8,8 Гц, 13,6 Гц), 3,52 (1H, м), 4,22 (2Н, кв, J=7,2 Гц), 4,38 (1H, шир.с), 6,63 (1H, шир.с), 6,87 (1H, м), 7,23 (3Н, м).
Пример получения 64: 6-этоксикарбониламино-4-этил-1,2,3,4-тетрагидроизохинолин
Указанное в заголовке соединение получали в виде масла коричневого цвета в соответствии с методиками, описанными в примерах получения 38 и 39, за исключением того, что использовали 1-трет-бутоксикарбониламино-2-(3-этоксикарбониламинофенил)бутан (8,230 г, неочищенный, пример получения 63).
Пример получения 65: 6-этоксикарбониламино-4-этилизохинолин
Полученный выше 6-этоксикарбониламино-4-этил-1,2,3,4-тетрагидроизохинолин (3,0 г) подвергали реакции в соответствии с методикой, описанной в примере получения 40. Полученные неочищенные кристаллы промывали смесью этанола и диэтилового эфира и сушили с получением указанного в заголовке соединения в виде кристаллов оранжевого цвета.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,27 (3Н, т, J=7,2 Гц), 1,28 (3Н, т, J=7,2 Гц), 2,91 (2Н, кв, J=7,2 Гц), 4,18 (2Н, кв, J=7,2 Гц), 7,64 (1Н, д, J=8,8 Гц), 8,00 (1Н, д, J=8,8 Гц), 8,25 (1Н, с), 8,27 (1Н, с), 8,98 (1Н, с), 10,12 (1Н, с).
Пример получения 66: 6-амино-4-этилизохинолин
Полученный выше 6-этоксикарбониламино-4-этилизохинолин подвергали реакции в соответствии с методикой, описанной в примере получения 30. Полученный остаток очищали на колонке с NH-силикагелем, полученные неочищенные кристаллы промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (0,637 г) в виде кристаллов оранжевого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,35 (3Н, т, J=7,6 Гц), 2,92 (2Н, кв, J=7,6 Гц), 4,17 (2Н, шир.с), 6,99 (1Н, д, J=8,4 Гц), 7,00 (1Н, с), 7,77 (1Н, д, J=8,4 Гц), 8,21 (1Н, с), 8,86 (1Н, с).
Пример получения 67: диэтилметил(3-нитробензил)малонат
В этаноле (45 мл) растворяли натрий (0,7 г) и добавляли диэтилметилмалонат (5,26 мл) и 3-нитробензилхлорид (5 г), затем нагревали при кипении с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали льдом, добавляли насыщенный водный раствор хлорида аммония и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (9,724 г) в виде масла бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,27 (6Н, т, J=7,2 Гц), 1,37 (3Н, с), 3,32 (2Н, с), 4,21 (4Н, кв, J=7,2 Гц), 7,44 (1Н, д, J=7,6 Гц), 7,48 (1Н, дд, J=7,6 Гц, 7,6 Гц), 8,03 (1Н, с), 8,11 (1Н, д, J=7,6 Гц).
Пример получения 68: этил-1-метил-2-(3-нитрофенил)пропионат
В диметилсульфоксиде (30 мл) растворяли полученный выше диэтилметил(3-нитробензил)малонат (9,724 г), добавляли воду (0,54 мл) и хлорид лития (2,54 г) и затем нагревали при кипении с обратным холодильником при 190°С в течение 3,5 часов. После остывания до комнатной температуры добавляли воду, затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением указанного в заголовке соединения (5,071 г, 73,35%, в 2 стадии) в виде масла коричневого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,20 (3Н, т, J=7,2 Гц), 1,21 (3Н, д, J=7,2 Гц), 2,79 (2Н, м), 3,10 (1Н, м), 4,10 (2Н, кв, J=7,2 Гц), 7,45 (1Н, дд, J=7,6 Гц, 8,0 Гц), 7,52 (1Н, д, J=7,6 Гц), 8,06 (1Н, с), 8,08 (1Н, д, J=8,0 Гц).
Пример получения 69: 1-метил-2-(3-нитрофенил)пропионовая кислота
В этаноле (50 мл) растворяли 5,071 г этил-1-метил-2-(3-нитрофенил)пропионата (пример получения 68), добавляли 5 н. водный раствор гидроксида натрия (43 мл) и затем нагревали при кипении с обратным холодильником в течение 2,5 часов. После остывания до комнатной температуры добавляли диэтиловый эфир и воду для отделения водного слоя. Органический слой экстрагировали насыщенным раствором соли. Водные слои объединяли, подкисляли разбавленной хлористоводородной кислотой и затем экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (2,918 г, 65,27%) в виде масла красного цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,24 (3Н, д, J=6,0 Гц), 2,83 (2Н, с), 3,16 (1Н, м), 7,47 (1Н, дд, J=7,2 Гц, 8,0 Гц), 7,54 (1Н, д, J=7,2 Гц), 8,08 (1Н, с), 8,10 (1Н, д, J=8,0 Гц). Пример получения 70: N-Вос-1-метил-2-(3-нитрофенил)этиламин
В трет-бутаноле (36 мл) растворяли 2,918 г 1-метил-2-(3-нитрофенил)пропионовой кислоты (пример получения 69), добавляли триэтиламин (4,09 мл) и дифенилфосфорилазид и затем нагревали при кипении с обратным холодильником в течение 2,5 часов. После охлаждения растворитель выпаривали. К остатку добавляли насыщенный раствор бикарбоната натрия и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (2,117 г, 54,14%) в виде кристаллов желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 1,13 (3Н, д, J=6,8 Гц), 2,82 (1Н, м), 2,92 (1Н, м), 3,94 (1Н, шир.с), 7,47 (1Н, дд, J=7,2 Гц, 8,0 Гц), 7,54 (1Н, д, J=7,2 Гц), 8,05 (1Н, с), 8,09 (1Н, д, J=8,0 Гц).
Пример получения 71: N-Boc-2-(3-аминофенил)-1-метилэтиламин
N-Вос-1-метил-2-(3-нитрофенил)этиламин (2,117 г, пример получения 70) подвергали реакции в соответствии с методикой, описанной в примере получения 29. После экстрагирования полученный остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (0,976 г, 51,63%) в виде масла желтого цвета.
Пример получения 72: N-Вос-1-метил-2-(3-этоксикарбониламинофенил)этиламин
Указанное в заголовке соединение (1,173 г, неочищенное) получали в виде масла желтого цвета в соответствии с методикой, описанной в примере получения 30, за исключением того, что использовали N-Boc-2-(3-аминофенил)-1-метилэтиламин (0,976 г). Полученный продукт использовали в последующей реакции без дополнительной очистки.
1H-ЯMP (CDCl3) δ (м.д.): 1,09 (3Н, д, J=6,4 Гц), 1,31 (3Н, т, J=7,2 Гц), 1,43 (9Н, с), 2,62 (1Н, дд, J=6,8 Гц, 13,2 Гц), 2,82 (1Н, м), 3,88 (1Н, м), 4,22 (2Н, кв, J=7,2 Гц), 4,38 (1Н, м), 6,56 (1Н, м), 6,89 (1Н, д, J=6,8 Гц), 7,18 (1Н, с), 7,22 (1Н, дд, J=6,8 Гц, 8,0 Гц), 7,23 (1Н, д, J=8,0 Гц).
Пример получения 73: гидрохлорид 2-(3-этоксикарбониламинофенил)-1-метилэтиламина
В этаноле (5 мл) растворяли 1,173 г N-Вос-1-метил-2-(3-этоксикарбониламинофенил)этиламина (неочищенный), добавляли хлористоводородную кислоту (5 мл) и затем перемешивали при комнатной температуре в течение 1,5 часов. Затем еще раз добавляли хлористоводородную кислоту (2,5 мл) и перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали с получением указанного в заголовке соединения (1,148 г, неочищенное) в виде масла желтого цвета. Полученное соединение использовали в последующей реакции без дополнительной очистки.
1H-ЯMP (CDCl3) δ (м.д.): 1,03 (3Н, д, J=6,8 Гц), 1,22 (3Н, т, J=7,2 Гц), 2,55 (1Н, м), 2,95 (1Н, м), 3,32 (1Н, м), 4,10 (2Н, кв, J=7,2 Гц), 6,84 (1Н, д, J=7,2 Гц), 7,21 (1H, дд, J=7,2 Гц, 7,2 Гц), 7,29 (1H, д, J=7,2 Гц), 7,35 (1H, с), 8,00 (1H, шир.с), 9,60 (1H, с).
Пример получения 74: 6-этоксикарбониламино-3-метил-1,2,3,4-тетрагидроизохинолин
Указанное в заголовке соединение (0,441 г) получали реакцией с помощью методики, описанной в Chem.Pharm.Bull., 42(8), 1676 (1994), с использованием гидрохлорида 2-(3-этоксикарбониламинофенил)-1-метилэтиламина (1,148 г, пример получения 73) и с очисткой продукта на колонке с NH-силикагелем.
1H-ЯMP (CDCl3) δ (м.д.): 1,24 (3Н, д, J=6,4 Гц), 1,30 (3Н, т, J=7,2 Гц), 2,48 (1H, дд, J=10,0 Гц, 16,4 Гц), 2,75 (1H, дд, J=3,6 Гц, 16,4 Гц), 3,01 (1H, м), 4,03 (2Н, шир.кв), 4,21 (2Н, кв, J=7,2 Гц), 6,66 (1H, с), 6,95 (1H, д, J=8,4 Гц), 7,09 (1H, д, J=8,4 Гц), 7,14 (1H, с).
Пример получения 75: 6-этоксикарбониламино-3-метилизохинолин
Указанное в заголовке соединение (0,356 г) получали в соответствии с методикой, описанной в примере получения 39, за исключением того, что использовали полученный выше 6-этоксикарбониламино-3-метил-1,2,3,4-тетрагидроизохинолин (0,441 г).
1H-ЯMP (CDCl3) δ (м.д.): 1,34 (3Н, т, J=7,2 Гц), 2,67 (3Н, с), 4,28 (2Н, кв, J=7,2 Гц), 7,08 (1H, шир.с), 7,39 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,40 (1H, с), 7,85 (1H, д, J=8,8 Гц), 7,94 (1H, с), 9,05 (1H, с).
Пример получения 76: 6-амино-3-метилизохинолин
Полученный выше 6-этоксикарбониламино-3-метилизохинолин (0,356 г) подвергали реакции в соответствии с методикой, описанной в примере получения 33, с получением неочищенных кристаллов (0,182 г). Кристаллы промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (93 мг) в виде кристаллов бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 2,63 (3Н, с), 4,14 (2Н, шир.с), 6,77 (1H, д, J=2,0 Гц), 6,93 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,18 (1H, с), 7,72 (1H, д, J=8,8 Гц).
Пример 1: N-(8-бромхинолин-3-ил)-3-пиридинсульфонамид
В пиридине (5 мл) растворяли 3-амино-8-бромхинолин (пример получения 5) и добавляли 3-пиридинсульфонилхлорид (254 мл), затем перемешивали при комнатной температуре в течение 30 минут. По окончании реакции реакционную смесь выливали в насыщенный раствор соли и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и затем концентрировали. Полученные неочищенные кристаллы промывали этилацетатом и IPA с получением указанного в заголовке соединения (270 мг).
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,47 (1H, т, J=8,0 Гц), 7,52-7,60 (1Н, м), 7,99-8,03 (2Н, м), 8,10 (1Н, д, J=2,4 Гц), 8,18-8,22 (1Н, м), 8,71 (1H, д, J=2,4 Гц), 8,78 (1Н, дд, J=1,6 Гц, 4,8 Гц), 8,98 (1H, д, J=2,4 Гц), 11,23 (1H, шир.с).
Пример 2: N-(5-бромхинолин-2-ил)-5-метил-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 2-амино-5-бромхинолина (пример получения 1) и 5-метил-3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,37 (3Н, с), 7,58-7,72 (4Н, м), 8,11 (1H, шир.с), 8,37 (1H, д, J=9,6 Гц), 8,59 (1H, д, J=1,2 Гц), 8,86 (1H, шир.с).
Пример 3: 6-амино-N-(8-бромхинолин-3-ил)-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 5) и 6-амино-3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 6,40 (1H, т, J=8,8 Гц), 6,93 (2Н, шир.с), 7,44 (1H, т, J=8,0 Гц), 7,65 (1H, дд, J=2,4 Гц, 8,8 Гц), 7,96-7,99 (2Н, м), 8,01 (1H, д, J=2,4 Гц), 8,31 (1H, д, J=2,4 Гц), 8,70 (1H, д, J=2,4 Гц), 10,73 (1H, шир.с).
Пример 4: N-(8-бромхинолин-3-ил)-4-цианобензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 5) и 4-цианобензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,46 (1Н, т, J=8,0 Гц), 7,96-8,07 (7Н, м), 8,70 (1Н, д, J=2,4 Гц), 11,27 (1Н, шир.с).
Пример 5: 6-хлор-N-(8-бромхинолин-3-ил)-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 5) и 6-хлор-3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,47 (1H, т, J=8,0 Гц), 7,71 (1Н, д, J=8,4 Гц), 7,99-8,03 (2Н, м), 8,10 (1H, д, J=2,4 Гц), 8,20 (1H, дд, J=8,4 Гц), 8,71 (1H, д, J=2,4 Гц), 8,83 (1H, д, J=2,4 Гц), 10,73 (1H, шир.с).
Пример 6: N-(8-бромхинолин-3-ил)-4-(N-этилсульфамоил)бензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 5) и 4-(N-этилсульфамоил)бензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 0,82 (3Н, т, J=7,2 Гц), 2,69-2,76 (2Н, м), 7,45 (1H, т, J=8,4 Гц), 7,75 (1H, т, J=5,6 Гц), 7,90-8,04 (7Н, м), 8,70 (1H, д, J=2,8 Гц), 11,18 (1H, шир.с).
Пример 7: N-(8-бромхинолин-3-ил)-5-циано-2-пиридинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 5) и 5-циано-3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,46 (1H, т, J=8,0 Гц), 7,95 (1Н, д, J=8,0 Гц), 8,01 (1H, д, J=8,0 Гц), 8,11 (1H, д, J=2,4 Гц), 8,21 (1H, д, J=8,4 Гц), 8,57 (1H, дд, J=2,0 Гц, 8,4 Гц), 8,79 (1H, д, J=2,4 Гц), 9,14 (1H, д, J=2,0 Гц), 11,49 (1H, шир. с).
Пример 8: N-(8-цианохинолин-3-ил)-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-цианохинолина (пример получения 7) и 3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,59 (1H, дд, J=4,8 Гц, 8,0 Гц), 7,70 (1H, т, J=8,0 Гц), 8,21-8,25 (3Н, м), 8,33 (1H, д, J=8,0 Гц), 8,77-8,79 (2Н, м), 9,01 (1H, д, J=2,8 Гц), 11,34 (1H, шир.с).
Пример 9: N-(8-цианохинолин-3-ил)-4-цианобензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-цианохинолина (пример получения 7) и 4-цианобензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,71 (1H, т, J=8,0 Гц), 7,96-8,07 (4Н, м), 8,18 (1H, д, J=2,8 Гц), 8,24 (1H, д, J=8,0 Гц), 8,31 (1H, д, J=8,0 Гц), 8,78 (1H, д, J=2,8 Гц), 11,37 (1H, шир. с).
Пример 10: N-(5-бромхинолин-2-ил)-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 2-амино-5-бромхинолина (пример получения 1) и 3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,57-7,61 (3Н, м), 7,70-7,72 (2Н, м), 8,28 (1H, шир.), 8,38 (1H, д, J=9,6 Гц), 8,75 (1Н, дд, J=1,2 Гц, 4,8 Гц), 9,07 (1H, шир.).
Пример 11: N-(8-бромхинолин-3-ил)-5-индансульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 5) и 5-индансульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,92-2,01 (2Н, м), 2,81-2,86 (4Н, м), 7,34 (1H, д, J=8,0 Гц), 7,44 (1H, т, J=8,0 Гц), 7,60 (1H, дд, J=1,6 Гц, 8,0 Гц), 7,70 (1H, д, J=1,6 Гц), 7,95 (1H, д, J=8,0 Гц), 7,97 (1H, д, J=8,0 Гц), 8,03 (1H, д, J=2,4 Гц), 8,71 (1H, д, J=2,4 Гц), 10,93 (1H, шир.с).
Пример 12: N-(8-иодхинолин-3-ил)-N*-ацетил-5-индолинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-иодхинолина (пример получения 6) и N-ацетил-6-индолинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,11 (3Н, с), 3,11 (2Н, т, J=8,4 Гц), 4,06 (2Н, т, J=8,4 Гц), 7,28 (1H, т, J=8,0 Гц), 7,65-7,68 (2Н, м), 7,93-7,96 (2Н, м), 8,05 (1H, д, J=9,2 Гц), 8,22 (1H, дд, J=1,2 Гц, 7,6 Гц), 8,64 (1H, д, J=2,4 Гц), 10,87 (1H, шир.с).
Пример 13: N-(8-бромхинолин-3-ил)-3-хинолинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 5) и 3-хинолинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,38 (1H, т, J=8,0 Гц), 7,70-7,74 (1H, м), 7,90-8,00 (3Н, м), 8,07 (1Н, д, J=8,0 Гц), 8,13 (1H, д, J=2,4 Гц), 8,19 (1Н, дд, J=0,8 Гц, 8,4 Гц), 8,75 (1H, д, J=2,4 Гц), 9,00-9,01 (1H, м), 9,19 (1H, д, J=2,4 Гц), 11,31 (1H, шир.с).
Пример 14: N-(8-бромхинолин-3-ил)-N*-ацетил-1,2,3,4-тетрагидрохинолин-6-сульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 5) и N-ацетил-1,2,3,4-тетрагидрохинолин-6-сульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 1,86-2,01 (2Н, м), 2,77 (2Н, т, J=6,4 Гц), 3,65-3,76 (1H, м).
Пример 15: N-(8-иодхинолин-3-ил)-4-изохинолинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-иодхинолина (пример получения 6) и 4-изохинолинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,26 (1H, т, J=8,0 Гц), 7,82-7,86 (1H, м), 7,93-7,95 (2Н, м), 7,98 (1H, д, J=2,4 Гц), 8,02-8,06 (1H, м), 8,19 (1H, дд, J=1,2 Гц, 7,6 Гц), 8,27 (1H, д, J=8,4 Гц), 8,59 (1H, д, J=2,4 Гц), 8,67 (1H, д, J=8,4 Гц), 9,12 (1H, с), 9,52 (1H, с), 11,57 (1H, шир.с).
Пример 16: 4-циано-N-(8-иодхинолин-3-ил)бензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-иодхинолина (пример получения 6) и 4-цианобензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,31 (1H, т, J=8,0 Гц), 7,96-8,04 (6Н, м), 8,26 (1H, дд, J=1,2 Гц, 7,2 Гц), 8,65 (1Н, д, J=2,8 Гц), 11,24 (1H, шир.с).
Пример 17: N-(8-иодхинолин-3-ил)-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-иодхинолина (пример получения 6) и 3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,31 (1H, т, J=8,0 Гц), 7,57-7,60 (1H, м), 7,99 (1H, д, J=1,2 Гц, 8,4 Гц), 8,04 (1H, д, J=2,8 Гц), 8,18-8,21 (1H, м), 8,26 (1H, дд, J=1,2 Гц, 7,2 Гц), 8,66 (1H, д, J=2,8 Гц), 8,77 (1H, дд, J=1,6 Гц, 4,8 Гц), 8,98 (1H, д, J=2,8 Гц), 11,20 (1H, шир.с).
Пример 18: N-(5-бромхинолин-2-ил)-4-цианобензолсульфонамид
Указанное в заголовке соединение получали из 2-амино-5-бромхинолина (пример получения 1) и 4-цианобензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,57-7,73 (4Н, м), 8,00-8,08 (4Н, м), 8,38 (1H, д, J=8,8 Гц).
Пример 19: N-(8-бромхинолин-3-ил)-6-этил-3-пиридинсульфонамид
Пиридин (0,5 мл) и раствор 6-этил-3-пиридинсульфонилхлорида (30 мл) в метиленхлориде (0,5 мл) добавляли к 3-амино-8-бромхинолину (18 мг, пример получения 5) при 0°С. После перемешивания при комнатной температуре в течение 30 минут добавляли воду и смесь экстрагировали этилацетатом. Экстракт очищали препаративной ТСХ (гексан : этилацетат=1:1) с получением указанного в заголовке соединения (20 мг).
1H-ЯMP (CDCl3) δ (м.д.): 1,25 (3Н, т, J=7,5 Гц), 2,70 (2Н, кв, J=7,5 Гц), 7,34-7,98 (5Н, м), 8,19 (1Н, д, J=3,3 Гц), 8,54 (1H, с), 8,83 (1Н, д, J=3,3 Гц).
Пример 20: 4-хлор-N-(5-хлорхинолин-2-ил)бензолсульфонамид
Пиридин (1 мл) и 4-хлорбензолсульфонилхлорид (255 мг) добавляли к 2-амино-5-хлорхинолину (119 мг, пример получения 2) при комнатной температуре. После перемешивания при комнатной температуре в течение 3 дней добавляли воду и смесь экстрагировали этилацетатом. Этилацетатный слой сушили над сульфатом магния и концентрировали. Затем полученное твердое вещество промывали метанолом с получением указанного в заголовке соединения (20 мг).
1H-ЯMP (CDCl3) δ (м.д.): 6,96 (1H, д, J=9,7 Гц), 7,34 (1H, д, J=8,4 Гц), 7,42-7,48 (3Н, м), 7,54 (1H, т, J=8,4 Гц), 7,94 (2Н, д, J=6,3 Гц), 8,29 (1H, д, J=9,7 Гц).
Пример 21: N-(8-хлорхинолин-3-ил)-6-этил-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-хлорхинолина (пример получения 9) и 6-этил-3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 1,28 (3Н, т, J=8,3 Гц), 2,86 (2Н, кв, J=8,3 Гц), 7,24 (1H, д, J=8,0 Гц), 7,49 (1H, т, J=8,0 Гц), 7,73 (1H, д, J=8,0 Гц), 7,78 (1H, д, J=8,0 Гц), 7,95 (2Н, дд, J=8,0 Гц, 2,1 Гц), 8,18 (1H, д, J=2,5 Гц), 8,67 (1H, д, J=2,5 Гц), 8,93 (1H, д, J=2,1 Гц).
Пример 22: N-(5-хлорхинолин-2-ил)-6-этил-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 2-амино-5-хлорхинолина (пример получения 2) и 6-этил-3-пиридинсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 1,32 (3Н, т, J=8,3 Гц), 2,89 (2Н, кв, J=8,3 Гц), 6,97 (1H, д, J=9,4 Гц), 7,29 (1Н, т, J=8,0 Гц), 7,35 (1H, д, J=8,0 Гц), 7,44 (1H, д, J=8,0 Гц), 7,56 (1H, т, J=8,0 Гц), 8,18 (1H, дд, J=8,0 Гц, 2,6 Гц), 8,30 (1H, д, J=9,4 Гц), 9,10 (1H, д, J=2,6 Гц).
Пример 23: N-(8-хлорхинолин-3-ил)бензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-хлорхинолина (пример получения 9) и бензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 7,30-7,48 (6Н, м), 7,84 (2Н, д, J=7,4 Гц), 8,11 (1H, д, J=3,1 Гц), 8,66 (1H, д, J=3,1 Гц).
Пример 24: 4-циано-N-(5-хлорхинолин-2-ил)бензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-бромхинолина (пример получения 2) и 4-цианобензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 6,96 (1H, д, J=9,5 Гц), 7,35 (1H, д, J=8,7 Гц), 7,45 (1H, д, J=8,7 Гц), 7,57 (1H, т, J=8,7 Гц), 7,78 (2Н, д, J=8,9 Гц), 8,10 (2Н, д, J=8,9 Гц), 8,33 (1H, д, J=9,5 Гц).
Пример 25: N-(5-хлорхинолин-2-ил)-4-метилбензолсульфонамид
Указанное в заголовке соединение получали из 2-амино-5-хлорхинолина (пример получения 2) и 4-толуолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 2,41 (3Н, с), 6,98 (1H, д, J=9,3 Гц), 7,28 (2Н, д, J=8,2 Гц), 7,35 (1H, д, J=7,9 Гц), 7,41 (1H, д, J=7,9 Гц), 7,53 (1Н, т, J=7,9 Гц), 7,88 (2Н, д, J=8,2 Гц), 8,26 (1Н, д, J=9,3 Гц).
Пример 26: N-(5-хлорхинолин-2-ил)-4-сульфамоилбензолсульфонамид
Указанное в заголовке соединение получали из 2-амино-5-хлорхинолина (пример получения 2) и 4-сульфамоилбензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 7,42-7,49 (3Н, м), 7,58 (1Н, т, J=8,0 Гц), 8,00-8,12 (4Н, м), 8,39 (1Н, д, J=9,3 Гц).
Пример 27: N-(5-бромхинолин-2-ил)-4-(N-этилсульфамоил)бензолсульфонамид
Указанное в заголовке соединение получали из 2-амино-5-хлорхинолина (пример получения 2) и 4-(N-этилсульфамоил) бензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 1,14 (3Н, т, J=7,5 Гц), 3,01-3,09 (2Н, м), 7,08 (1Н, д, J=9,5 Гц), 7,42 (1Н, дд, J=7,6 Гц, 1,3 Гц), 7,49 (1Н, т, J=7,6 Гц), 7,65 (1Н, дд, J=7,6 Гц, 1,3 Гц), 7,96 (2Н, д, J=8,7 Гц), 8,10 (2Н, д, J=8,7 Гц), 8,31 (1Н, д, J=9,5 Гц).
Пример 28: 3-циано-N-(8-хлорхинолин-3-ил)бензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-хлорхинолина (пример получения 9) и 3-цианобензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 7,52 (1H, т, J=7,9 Гц), 7,59 (1Н, т, J=7,9 Гц), 7,72-7,86 (3Н, м), 8,00 (1H, д, J=7,9 Гц), 8,13 (1Н, д, J=3,2 Гц), 8,16 (1H, с), 8,64 (1H, д, J=3,2 Гц).
Пример 29: N-(8-хлорхинолин-3-ил)-3-метилбензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-хлорхинолина (пример получения 9) и 3-толуолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 2,35 (3Н, с), 7,16-7,79 (7Н, м), 8,09 (1H, д, J=2,7 Гц), 8,65 (1H, д, J=2,7 Гц).
Пример 30: N-(8-хлорхинолин-3-ил)-3-сульфамоилбензолсульфонамид
Указанное в заголовке соединение получали из 3-амино-8-хлорхинолина (пример получения 9) и 3-сульфамоилбензолсульфонилхлорида в соответствии с методикой, описанной в примере 1.
1H-ЯMP (CDCl3) δ (м.д.): 7,46 (1H, т, J=7,6 Гц), 7,53 (1H, т, J=7,6 Гц), 7,58-7,78 (2Н, м), 8,00 (1H, д, J=7,6 Гц), 8,04 (1H, д, J=7,6 Гц), 8,14 (1H, д, J=2,8 Гц), 8,47 (1H, с), 8,59 (1H, д, J=2,8 Гц).
Пример 31: N-(8-метилхинолин-3-ил)-3-пиридинсульфонамид
Белые кристаллы (562 мг) получали аналогично методике примера 1 за исключением того, что использовали 1,02 г (5,2 ммоль) 7-амино-2-хлор-4-метилхинолина (пример получения 16) и 0,9 г (5,2 ммоль) 3-пиридинсульфонилхлорида. К 102 мг (0,29 ммоль) белых кристаллов добавляли метанол (4 мл), тетрагидрофуран (4 мл) и 10% палладий на угле (5 мг) и затем перемешивали в атмосфере водорода в течение 6 часов. Реакционную смесь фильтровали через целит и затем выпаривали.
Остаток промывали этилацетатом с получением 65 мг указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,82 (3Н, с), 7,64-7,66 (2Н, м), 7,73 (1Н, д, J=5,2 Гц), 8,03 (1Н, с), 8,30-8,35 (2Н, м), 8,82 (1Н, дд, J=1,2 Гц, 4,8 Гц), 9,00 (1Н, д, J=5,2 Гц), 9,11 (1Н, д, J=2,0 Гц).
Пример 32: N-(8-метилхинолин-3-ил)-4-цианобензолсульфонамид
Белые кристаллы (358 мг) получали аналогично методике примера 1, за исключением того, что использовали 305 мг (1,58 ммоль) 7-амино-2-хлор-4-метилхинолина (пример получения 16) и 0,48 г (2,4 ммоль) 4-цианобензолсульфонилхлорида. К белым кристаллам (140 мг, 0,38 ммоль) добавляли уксусную кислоту (6 мл), воду (2 мл) и цинк (122 мг), затем перемешивали при 60°С в течение 15 минут. Реакционную смесь фильтровали через целит, затем добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали. Затем остаток очищали хроматографией на силикагеле с получением 82 мг указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,60 (3Н, с), 7,26 (1Н, дд, J=1,2 Гц, 4,4 Гц), 7,41 (1Н, дд, J=2,4 Гц, 8,8 Гц), 7,64 (1Н, д, J=2,4 Гц), 7,97-8,06 (1Н, м), 7,98 (1Н, д, J=8,4 Гц), 8,04 (1Н, д, J=8,4 Гц), 8,66 (1Н, д, J=4,4 Гц), 11,06 (1Н, шир.с).
Пример 33: N-(6-хлор-8-цианохинолин-3-ил)-3-пиридинсульфонамид
Белые кристаллы (764 мг) получали аналогично методике примера 1, за исключением того, что использовали 3,0 г (13 ммоль) этил-7-амино-2-хлорхинолин-4-карбоксилата (пример получения 13) и 2,3 г (13 ммоль) 3-пиридинсульфонилхлорида. К раствору 108 мг (0,28 ммоль) полученных кристаллов в этаноле (6 мл) добавляли 1 н. гидроксид натрия (0,5 мл) и затем перемешивали в течение ночи. К реакционной смеси добавляли 1 н. хлористоводородную кислоту и затем дважды экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали с получением остатка. К раствору остатка в тетрагидрофуране (10 мл) при охлаждении льдом добавляли оксалилхлорид (0,04 мл) и одну каплю диметилформамида, затем перемешивали при комнатной температуре в течение 30 минут. Через 30 минут добавляли насыщенный водный раствор аммиака (5 мл), затем перемешивали еще 10 минут. К реакционной смеси добавляли насыщенный раствор соли и затем экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и концентрировали с получением остатка. К раствору остатка в тетрагидрофуране (6 мл) при охлаждении льдом добавляли пиридин (0,06 мл) и ангидрид трифторуксусной кислоты (0,05 мл), затем перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли насыщенный раствор соли и затем экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и концентрировали. Остаток очищали хроматографией на силикагеле с получением 37 мг указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,62-7,66 (1Н, м), 7,68-7,72 (2Н, м), 8,08 (1Н, д, J=8,8 Гц), 8,23 (1H, с), 8,26-8,29 (1Н, м), 8,81 (1H, дд, J=1,6 Гц, 4,8 Гц), 9,04 (1H, д, J=2,4 Гц).
Пример 34: N-(8-хлорхинолин-3-ил)-4-цианобензолсульфонамид
Указанное в заголовке соединение (58 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 38 мг (0,21 ммоль) 3-амино-8-хлорхинолина (пример получения 9) и 43 мг (0,21 ммоль) 4-цианобензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,55 (1H, т, J=7,6 Гц), 7,84 (1H, д, J=7,6 Гц), 7,95 (1H, т, J=7,6 Гц), 7,99 (2Н, д, J=8,8 Гц), 8,04 (2Н, д, J=8,8 Гц), 8,09 (1H, д, J=2,8 Гц), 8,73 (1H, д, J=2,8 Гц), 11,39 (1H, с).
Пример 35: N-(8-хлорхинолин-3-ил)-4-(N-этилсульфамоил)бензолсульфонамид
Указанное в заголовке соединение (36 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 36 мг (0,19 ммоль) 3-амино-8-хлорхинолина (пример получения 9) и 52 мг (0,19 ммоль) 4-(N-этилсульфамоил)бензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 0,84 (3Н, т, J=7,2 Гц), 2,78-2,71 (2Н, м), 7,54 (1H, т, J=7,6 Гц), 7,77 (1H, т, J=6,0 Гц), 7,83 (1H, т, J=7,6 Гц), 7,92-7,95 (1H, м), 7,93 (2Н, д, J=8,8 Гц), 8,03 (2Н, д, J=8,8 Гц), 8,07 (1H, д, J=2,4 Гц), 8,73 (1H, д, J=2,4 Гц), 11,20 (1H, с).
Пример 36: N-(8-хлорхинолин-3-ил)-3-пиридинсульфонамид
Указанное в заголовке соединение (29 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 33 мг (0,19 ммоль) 3-амино-8-хлорхинолина (пример получения 9) и 33 мг (0,19 ммоль) 3-пиридинсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,54 (1Н, т, J=7,6 Гц), 7,60 (1Н, дд, J=4,8 Гц, 7,6 Гц), 7,81 (1Н, д, J=7,6 Гц), 7,94 (1Н, д, J=7,6 Гц), 8,09 (1Н, д, J=2,8 Гц), 8,19-8,26 (1Н, м), 8,72 (1Н, д, J=2,8 Гц), 8,77 (1Н, дд, J=1,6 Гц, 4,8 Гц), 9,00 (1Н, д, J=2,8 Гц), 11,46 (1Н, с).
Пример 37: N-(8-хлорхинолин-3-ил)-5-этилсульфамоил-2-пиридинсульфонамид
Указанное в заголовке соединение (10 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 30 мг (0,17 ммоль) 3-амино-8-хлорхинолина (пример получения 9) и 95 мг (0,34 ммоль) 5-этилсульфамоил-2-хлорсульфонилпиридина.
1H-ЯMP (ДМСО-d6) δ (м.д.): 0,88 (3Н, т, J=7,6 Гц), 2,79-2,86 (2Н, м), 7,55 (1Н, т, J=7,6 Гц), 7,85 (1Н, т, J=7,6 Гц), 7,94 (1Н, д, J=7,6 Гц), 8,00 (1Н, т, J=6,4 Гц), 8,16 (1Н, д, J=2,8 Гц), 8,27 (1Н, д, J=8,0 Гц), 8,41 (1Н, дд, J=2,4 Гц, 8,0 Гц), 8,84 (1Н, д, J=2,8 Гц), 9,04 (1Н, д, J=2,4 Гц), 11,47 (1Н, с).
Пример 38: N-(8-трифторметилхинолин-3-ил)-4-цианобензолсульфонамид
Указанное в заголовке соединение (59 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 35 мг (0,17 ммоль) 3-амино-8-трифторметилхинолина (пример получения 10) и 37 мг (0,18 ммоль) 4-цианобензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,71 (1H, т, J=7,6 Гц), 8,03-8,09 (5Н, м), 8,19 (1H, д, J=2,4 Гц), 8,30 (1Н, д, J=7,6 Гц), 8,78 (1H, д, J=2,4 Гц), 11,72 (1H, с).
Пример 39: N-(8-трифторметилхинолин-3-ил)-4-(N-этилсульфамоил)бензолсульфонамид
Указанное в заголовке соединение (60 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 35 мг (0,17 ммоль) 3-амино-8-трифторметилхинолина (пример получения 10) и 56 мг (0,20 ммоль) 4-(N-этилсульфамоил)бензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 0,83 (3Н, т, J=7,2 Гц), 2,71-2,78 (2Н, м), 7,69 (1H, т, J=8,0 Гц), 7,76 (1H, т, J=5,6 Гц), 7,93 (1H, д, J=8,8 Гц), 8,04-8,07 (3Н, м), 8,13 (1H, д, J=2,8 Гц), 8,25 (1H, д, J=8,0 Гц), 8,75 (1H, д, J=2,8 Гц), 11,28 (1H, с).
Пример 40: N-(8-трифторметилхинолин-3-ил)-3-пиридинсульфонамид
Указанное в заголовке соединение (71 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 45 мг (0,21 ммоль) 3-амино-8-трифторметилхинолина (пример получения 10) и 45 мг (0,25 ммоль) 3-пиридинсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,59-7,63 (1H, м), 7,70 (1H, т, J=7,6 Гц), 8,06 (1H, д, J=7,6 Гц), 8,20 (1H, д, J=2,8 Гц), 8,23-8,24 (1H, м), 8,30 (1H, д, J=7,6 Гц), 8,76 (1H, д, J=2,8 Гц), 8,79 (1H, дд, J=1,6 Гц, 4,8 Гц), 9,03 (1H, д, J=2,0 Гц), 11,64 (1H, с).
Пример 41: N-(8-хлорхинолин-3-ил)-1,2,3,4-тетрагидро-6-нафталинсульфонамид
Указанное в заголовке соединение (46 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 33 мг (0,19 ммоль) 3-амино-8-хлорхинолина (пример получения 9) и 73 мг (0,22 ммоль) 6-хлорсульфонил-1,2,3,4-тетрагидронафталина.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,68 (4Н, шир.), 2,71 (4Н, шир.), 7,20 (1Н, т, J=8,4 Гц), 7,52 (1Н, т, J=7,6 Гц), 7,53 (1Н, дд, J=2,0 Гц, 8,4 Гц), 7,58 (1Н, д, J=2,0 Гц), 7,80 (1Н, д, J=7,6 Гц), 7,93 (1Н, д, J=7,6 Гц), 8,06 (1Н, д, J=2,4 Гц), 8,73 (1Н, д, J=2,4 Гц), 10,94 (1Н, с).
Пример 42: N-(8-хлорхинолин-3-ил)-2,3-дигидро-5-бензофурансульфонамид
Указанное в заголовке соединение (57 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 30 мг (0,17 ммоль) 3-амино-8-хлорхинолина (пример получения 9) и 44 мг (0,20 ммоль) 5-хлорсульфонил-2,3-дигидробензофурана.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,19 (2Н, т, J=8,8 Гц), 4,58 (2Н, т, J=8,8 Гц), 6,86 (1Н, д, J=8,8 Гц), 7,23 (1Н, т, J=7,6 Гц), 7,62 (1Н, дд, J=1,6 Гц, 8,8 Гц), 7,72 (1Н, д, J=1,6 Гц), 7,80 (1Н, д, J=7,6 Гц), 7,92 (1Н, д, J=7,6 Гц), 8,03 (1Н, д, J=2,4 Гц), 8,73 (1Н, д, J=2,4 Гц), 10,85 (1Н, с).
Пример 43: N-(8-хлор-4-винилхинолин-3-ил)-4-цианобензолсульфонамид
Указанное в заголовке соединение (15 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 30 мг (0,15 ммоль) 3-амино-4-винил-8-хлорхинолина (пример получения 12) и 36 мг (0,18 ммоль) 4-цианобензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 5,29 (1Н, д, J=17,6 Гц), 5,59 (1Н, д, J=11,6 Гц), 6,75 (1Н, дд, J=11,6 Гц, 17,6 Гц), 7,59 (1Н, т, J=8,0 Гц), 7,80 (1Н, дд, J=8,8 Гц), 7,96 (1Н, д, J=8,0 Гц), 8,00-8,04 (3Н, м), 8,74 (1Н, с), 10,58 (1Н, с).
Пример 44: N-(8-трифторметилхинолин-3-ил)-5-(N-ацетилиндолин)сульфонамид
Указанное в заголовке соединение (186 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 109 мг (0,51 ммоль) 3-амино-8-трифторметилхинолина (пример получения 10) и 200 мг (0,77 ммоль) 5-хлорсульфонил-N-ацетилиндолина.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,13 (3Н, с), 3,14 (2Н, т, J=8,0 Гц), 4,09 (2Н, т, J=8,8 Гц), 7,67 (1Н, т, J=8,4 Гц), 7,69-7,73 (2Н, м), 8,01 (1Н, д, J=7,2 Гц), 8,07-8,09 (2Н, м), 8,24 (1Н, д, J=8,4 Гц), 8,73 (1Н, д, J=2,8 Гц), 10,98 (1Н, с).
Пример 45: N-(8-бромхинолин-3-ил)-2-метилтио-5-пиридинсульфонамид
Белые кристаллы (197 мг, 0,556 ммоль) получали аналогично методике примера 1, за исключением того, что использовали 100 мг (0,56 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 142 мг (0,67 ммоль) 2-хлор-5-пиридинсульфонилхлорида. К кристаллам (60 мг, 0,17 ммоль) добавляли диметилформамид (1 мл), пиридин (1 мл) и тиометоксид натрия (111 мг, 1,6 ммоль), затем перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный раствор соли, затем экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и концентрировали. Полученный остаток очищали хроматографией на силикагеле с получением 62 мг указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,33 (3Н, с), 7,47 (1Н, д, J=8,8 Гц), 7,55 (1Н, т, J=8,0 Гц), 7,84 (1Н, д, J=6,8 Гц), 7,97 (1Н, д, J=8,8 Гц), 7,98 (1Н, д, J=8,8 Гц), 8,13 (1Н, д, J=2,0 Гц), 8,74 (1Н, д, J=2,4 Гц), 8,82 (1Н, д, J=2,0 Гц), 11,16 (1Н, с).
Пример 46: N-(8-бромхинолин-3-ил)-4-(2-метилсульфонилэтил)бензолсульфонамид
Указанное в заголовке соединение (55 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 30 мг (0,13 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 57 мг (0,20 ммоль) 4-(2-метилсульфонилэтил)бензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,92 (3Н, с), 3,00-3,05 (2Н, м), 3,37-3,44 (2Н, м), 7,46 (1Н, т, J=7,6 Гц), 7,48 (2Н, д, J=8,0 Гц), 7,80 (2Н, д, J=8,0 Гц), 7,96 (1Н, д, J=7,6 Гц), 7,99 (1Н, д, J=7,6 Гц), 8,04 (1Н, д, J=2,4 Гц), 8,71 (1Н, д, J=2,4 Гц), 11,02 (1Н, с).
Пример 47: N-(8-бромхинолин-3-ил)-4-окса-7-бензотиохромансульфонамид
Указанное в заголовке соединение (99 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 51 мг (0,23 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 86 мг (0,34 ммоль) 7-хлорсульфонил-4-оксабензотиохромана.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,18 (2Н, т, J=8,4 Гц), 4,39 (2Н, т, J=8,4 Гц), 6,92 (1Н, д, J=8,8 Гц), 7,42 (1Н, дд, J=2,4 Гц, 8,8 Гц), 7,46 (1Н, т, J=7,6 Гц), 7,59 (1Н, д, J=2,4 Гц), 7,99 (1Н, д, J=7,6 Гц), 8,02 (1Н, д, J=7,6 Гц), 8,05 (1Н, шир.), 8,71 (1Н, д, J=2,4 Гц), 10,92 (1Н, с).
Пример 48: N-(8-бромхинолин-3-ил)-4-(2-ацетамидэтил)бензолсульфонамид
Указанное в заголовке соединение (56 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 30 мг (0,13 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 201 мг (0,77 ммоль) N-(4-хлорсульфонилэтоксифенилэтил)ацетамида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,71 (2Н, т, J=7,2 Гц), 3,25-3,20 (2Н, м), 7,37 (2Н, д, J=8,4 Гц), 7,46 (1Н, т, J=8,0 Гц), 7,78 (2Н, д, J=8,4 Гц), 7,86 (1Н, шир.), 7,97 (1Н, д, J=8,0 Гц), 8,00 (1Н, д, J=8,0 Гц), 8,04 (1Н, д, J=2,8 Гц), 8,72 (1Н, д, J=2,8 Гц), 10,99 (1Н, с).
Пример 49: N-(8-бромхинолин-3-ил)-1,2,3,4-тетрагидро-N-ацетил-7-изохинолинсульфонамид
Белые кристаллы (180 мг) получали аналогично методике примера 1, за исключением того, что использовали 145 мг (0,65 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 277 мг (0,85 ммоль) 1,2,3,4-тетрагидро-2-(трифторацетил)изохинолин-7-сульфонилхлорида. К кристаллам добавляли этанол (20 мл) и 1 н. водный раствор гидроксида натрия (0,5 мл), затем перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли 1 н. хлористоводородную кислоту (0,4 мл), затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали. К полученному остатку добавляли пиридин (0,5 мл) и уксусный ангидрид (0,014 мл), затем перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный раствор соли и смесь экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и концентрировали. Остаток очищали хроматографией на силикагеле с получением 113 мг указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,19-1,28 (2Н, м), 2,05 (3Н, с), 2,97 (1Н, т, J=6,4 Гц), 3,03 (1Н, т, J=6,4 Гц), 3,75 (1Н, т, J=6,4 Гц), 4,73 (1Н, с), 7,37 (1Н, т, J=8,8 Гц), 7,53-7,58 (1Н, м), 7,75-7,87 (2Н, м), 7,91 (1Н, д, J=8,0 Гц), 8,19-8,27 (2Н, м), 8,76-8,78 (1Н, м).
Пример 50: N-(8-бромхинолин-3-ил)-1,1-диоксид-6-бензотиохромансульфонамид
Белые кристаллы получали аналогично методике примера 1, за исключением того, что использовали 71 мг (0,32 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 119 мг (0,48 ммоль) 6-хлорсульфонилбензотиохромана. К кристаллам добавляли хлороформ (10 мл) и мета-хлорпербензойную кислоту (145 мг) при охлаждении льдом, затем перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор тиосульфата натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над сульфатом магния и концентрировали. Остаток очищали хроматографией на силикагеле с получением 113 мг указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,26-2,29 (2Н, м), 3,05 (2Н, т, J=6,0 Гц), 3,53-3,56 (2Н, м), 7,48 (1Н, т, J=7,6 Гц), 7,86-7,90 (2Н, м), 7,96-8,04 (3Н, м), 8,10 (1Н, д, J=2,4 Гц), 8,75 (1Н, д, J=2,4 Гц), 11,24 (1Н, с).
Пример 51: N-(8-бромхинолин-3-ил)-4-(3-метилсульфонилпропил)бензолсульфонамид
Указанное в заголовке соединение (62 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 33 мг (0,14 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 66 мг (0,22 ммоль) 4-(3-метилсульфонилпропил)бензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,90-1,98 (2Н, м), 2,72 (2Н, т, J=8,0 Гц), 2,93 (3Н, с), 3,06 (2Н, т, J=8,0 Гц), 7,42 (2Н, д, J=8,0 Гц), 7,46 (1Н, д, J=7,6 Гц), 7,97 (2Н, д, J=7,6 Гц), 8,00 (1Н, д, J=7,6 Гц), 8,05 (1Н, д, J=2,4 Гц), 8,72 (1Н, д, J=2,4 Гц), 11,01 (1Н, с).
Пример 52: N-(8-бромхинолин-3-ил)-4-фторбензолсульфонамид
Указанное в заголовке соединение (50 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 33 мг (0,14 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 39 мг (0,20 ммоль) 4-фторбензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,40 (1Н, т, J=8,8 Гц), 7,47 (1Н, т, J=7,6 Гц), 7,89-7,93 (2Н, м), 9,78 (1Н, д, J=0,9 Гц, 7,6 Гц), 8,01 (1H, дд, J=0,9 Гц, 7,6 Гц), 8,06 (1Н, д, J=2,4 Гц), 8,71 (1H, д, J=2,4 Гц), 11,06 (1Н, с).
Пример 53: N-(8-бромхинолин-3-ил)-4-метокси-2-пиридазинсульфонамид
При охлаждении льдом газообразный хлор барботировали через раствор 2-бензилтио-5-метоксипиридазина (0,86 г, 3,7 ммоль, пример получения 14) в концентрированной хлористоводородной кислоте (8 мл), затем перемешивали в течение 1 часа. Затем к реакционной смеси добавляли ледяную воду и затем экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали с получением остатка 700 мг (2,1 ммоль). Указанное в заголовке соединение (93 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 180 мг (0,54 ммоль) полученного выше остатка и 60 мг (0,27 ммоль) 3-амино-8-бромхинолина (пример получения 5).
1H-ЯMP (ДМСО-d6) δ (м.д.): 4,07 (3Н, с), 7,44 (1H, д, J=9,2 Гц), 7,47 (1H, т, J=7,6 Гц), 7,96 (1H, т, J=7,6 Гц), 8,02 (1H, т, J=7,6 Гц), 8,13 (1H, д, J=2,4 Гц), 8,17 (1H, д, J=9,2 Гц), 8,82 (1H, д, J=2,4 Гц), 11,54 (1H, с).
Пример 54: N-(8-бромхинолин-3-ил)бензолсульфонамид
Указанное в заголовке соединение (49 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 30 мг (0,13 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 35 мг (0,20 ммоль) бензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,45 (1H, д, J=7,6 Гц), 7,53-7,63 (3Н, м), 7,84-7,86 (2Н, м), 7,96 (1Н, дд, J=1,2 Гц, 7,6 Гц), 7,99 (1H, дд, J=1,2 Гц, 7,6 Гц), 8,04 (1Н, д, J=2,8 Гц), 8,71 (1H, д, J=2,8 Гц), 11,02 (1H, с).
Пример 55: N-(8-бромхинолин-3-ил)-4-карбоксамид-2-пиридинсульфонамид
При охлаждении льдом газообразный хлор барботировали через раствор 2-бензилтио-4-карбоксамидопиридина (1,1 г, 4,3 ммоль, пример получения 15) в концентрированной хлористоводородной кислоте (16 мл), затем перемешивали в течение 1 часа. Затем к реакционной смеси добавляли ледяную воду и затем экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали. Указанное в заголовке соединение (37 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 140 мг (0,40 ммоль) полученного выше остатка и 45 мг (0,20 ммоль) 3-амино-8-бромхинолина.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,46 (1H, д, J=8,0 Гц), 7,94-7,96 (2Н, м), 8,00-8,02 (2Н, м), 8,12 (1H, д, J=2,4 Гц), 8,44 (1H, шир.), 8,49 (1H, шир.), 8,83-8,85 (2Н, м), 11,35 (1H, с).
Пример 56: N-(8-бромхинолин-3-ил)-3-метоксибензолсульфонамид
Указанное в заголовке соединение (70 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 40 мг (0,18 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 56 мг (0,27 ммоль) 3-метоксибензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,76 (3Н, с), 7,17 (1H, дд, J=2,8 Гц, 8,0 Гц), 7,34-7,40 (2Н, м), 7,45 (1H, т, J=7,6 Гц), 7,47 (1H, т, J=7,6 Гц), 7,99 (2Н, т, J=7,6 Гц), 8,07 (1H, д, J=2,4 Гц), 8,72 (2Н, м), 11,35 (1H, д, J=2,4 Гц).
Пример 57: N-(8-бромхинолин-3-ил)-3-гидроксибензолсульфонамид
Указанное в заголовке соединение (73 мг) получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 45 мг (0,20 ммоль) 3-амино-8-бромхинолина (пример получения 5) и 117 мг (0,61 ммоль) 3-гидроксибензолсульфонилхлорида.
1H-ЯMP (ДМСО-d6) δ (м.д.): 6,97 (1H, д, J=8,0 Гц), 7,18 (1H, шир.), 7,25 (1H, д, J=8,0 Гц), 7,34 (1H, т, J=8,0 Гц), 7,47 (1H, т, J=8,0 Гц), 7,97 (1H, д, J=8,0 Гц), 8,01 (1H, д, J=8,0 Гц), 8,04 (1H, д, J=2,4 Гц), 8,73 (1H, д, J=2,4 Гц), 10,15 (1H, с), 10,96 (1H, с).
Пример 58: N-(4-бромхинолин-7-ил)-4-хлорбензолсульфонамид
В 1,5 мл пиридина растворяли 20 мг (0,09 ммоль) 7-амино-4-бромизохинолина (пример получения 20), добавляли 23 мг 4-хлорбензолсульфонилхлорида, затем перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и затем экстрагировали этилацетатом. Экстракт сушили над сульфатом магния и концентрировали. Затем полученный остаток очищали тонкослойной хроматографией на силикагеле с получением 13 мг указанного в заголовке соединения. Температура плавления: вещество постепенно разлагалось, начиная с температуры 229°С.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,59-7,61 (2Н, м), 7,66 (1H, дд, J=2 Гц, 9,2 Гц), 7,82-7,84 (3Н, м), 7,99 (1H, д, J=9,2 Гц), 8,60 (1H, с).
Пример 59: N-(4-бромизохинолин-7-ил)-6-хлор-3-пиридинсульфонамид
Указанное в заголовке соединение получали из 7-амино-4-бромизохинолина (пример получения 20) и 6-хлор-3-пиридинсульфонилхлорида аналогично методике примера 57.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,66 (1H, дд, J=2,4 Гц, 9,2 Гц), 7,70 (1H, д, J=8,4 Гц), 7,89 (1H, д, J=2,4 Гц), 8,02 (1H, д, J=9,2 Гц), 8,20 (1H, дд, J=2,4 Гц, 8,4 Гц), 8,64 (1H, с), 8,84 (1H, д, J=2,4 Гц), 9,26 (1H, с).
Пример 60: 2-(4-хлорбензолсульфониламин)-1,6-нафтилидин
В дихлорметане (6,0 мл) растворяли 200 мг 2-амино-1,6-нафтиридина (пример получения 25) и добавляли триэтиламин (0,20 мл) и 4-хлорбензолсульфонилхлорид (0,31 г), затем перемешивали при 40°С в течение 1,5 часов. Добавляли насыщенный водный раствор бикарбоната натрия и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (84 мг, 21,44%) в виде кристаллов бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 7,10 (1H, д, J=9,2 Гц), 7,37 (1H, д, J=5,4 Гц), 7,46 (2Н, д, J=8,8 Гц), 7,93 (2Н, д, J=8,8 Гц), 8,94 (1H, д, J=9,2 Гц), 8,66 (1H, д, J=5,4 Гц), 8,92 (1H, шир. с).
Пример 61: 1-хлор-6-(4-цианобензолсульфониламин)изохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-хлоризохинолин (пример получения 23) и 4-цианобензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,52 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,68 (1Н, д, J=2,0 Гц), 7,79 (1Н, д, J=5,6 Гц), 8,03 (4Н, м), 8,18 (1Н, д, J=5,6 Гц), 8,21 (1Н, д, J=8,8 Гц), 11,36 (1Н, с).
Пример 62: 1-хлор-6-(4-хлорбензолсульфониламин)изохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-хлоризохинолин (пример получения 23) и 4-хлорбензолсульфонилхлорид.
1H-ЯMP (CDCl3) δ (м.д.): 7,33 (1Н, шир.с), 7,39 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,44 (2Н, д, J=8,8 Гц), 7,50 (1H, д, J=5,6 Гц), 7,58 (1H, д, J=2,0 Гц), 7,81 (2Н, д, J=8,8 Гц), 8,24 (1H, д, J=5,6 Гц), 8,25 (1H, д, J=8,8 Гц).
FAB-MC: 353.
Пример 63: 1-хлор-6-(4-(пирролидин-1-илсульфонил)бензолсульфониламин)изохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-хлоризохинолин (пример получения 23) и 4-(пирролидин-1-илсульфонил)бензолсульфонилхлорид.
1H-ЯMP (CDCl3) δ (м.д.): 1,71 (4Н, м), 3,20 (4Н, т, J=7,0 Гц), 7,46 (1H, д, J=5,4 Гц), 7,49 (1H, дд, J=2,0 Гц, 9,2 Гц), 7,61 (1H, д, J=2,0 Гц), 7,87 (2Н, д, J=8,8 Гц), 8,02 (2Н, д, J=8,8 Гц), 8,19 (1H, д, J=9,2 Гц), 8,20 (1Н, д, J=5,4 Гц), 9,72 (1H, с).
Пример 64: 1-хлор-6-(4-(N-этилсульфамоил)бензолсульфониламин)изохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-хлоризохинолин (пример получения 23) и 4-(N-этилсульфамоил)бензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 0,81 (3Н, т, J=7,2 Гц), 2,73 (2Н, м), 7,53 (1H, д, J=9,2 Гц), 7,67 (1H, с), 7,75 (1H, д, J=6,0 Гц), 7,78 (1H, д, J=6,0 Гц), 7,92 (2Н, д, J=8,0 Гц).
Пример 65: 1-метокси-6-(пиридин-3-илсульфониламин)изохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 3-пиридинсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 4,09 (3Н, с), 7,09 (1H, д, J=6,0 Гц), 7,25 (1H, дд, J=2,0 Гц, 8,8 Гц), 7,37 (1H, дд, J=8,0 Гц, 8,8 Гц), 7,48 (1H, д, J=2,0 Гц), 7,96 (1H, д, J=6,0 Гц), 8,07 (1H, ддд, J=1,6 Гц, 2,0 Гц, 8,0 Гц), 8,14 (1H, д, J=8,8 Гц), 8,74 (1H, дд, J=1,6 Гц, 8,8 Гц), 9,08 (1H, д, J=2,0 Гц).
ESI-MC: 316,0.
Пример 66: 6-(4-цианобензолсульфониламин)-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 4-цианобензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,97 (3Н, с), 7,25 (1H, д, J=5,6 Гц), 7,32 (1Н, д, J=8,8 Гц), 7,51 (1H, с), 7,90 (1Н, д, J=5,6 Гц), 7,97 (2Н, д, J=7,6 Гц), 8,01 (2Н, д, J=7,6 Гц), 8,03 (1H, д, J=8,8 Гц).
Пример 67: 6-(4-карбамоилбензолсульфониламин)-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в Synthesis, 949 (1989), за исключением того, что использовали 6-(4-цианобензолсульфониламин)-1-метоксиизохинолин (пример 65).
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,96 (3Н, с), 7,24 (1H, д, J=6,4 Гц), 7,33 (1H, д, J=9,2 Гц), 7,51 (1H, с), 7,55 (1H, шир.с), 7,88 (1H, д, J=6,4 Гц), 7,89 (2Н, д, J=8,0 Гц), 7,93 (2Н, д, J=8,0 Гц), 8,01 (1H, д, J=9,2 Гц), 8,06 (1H, шир.с), 10,95 (1H, с).
FAB-MC: 358.
Пример 68: 6-(4-(N-этилсульфамоил)бензолсульфониламин)-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 4-(N-этилсульфамоил)бензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 0,81 (3Н, т, J=6,8 Гц), 2,71 (2Н, м), 3,96 (3Н, с), 7,23 (1H, д, J=6,4 Гц), 7,32 (1H, д, J=8,8 Гц), 7,48 (1H, с), 7,73 (1H, шир.с), 7,89 (2Н, д, J=8,0 Гц), 7,90 (1H, д, J=6,4 Гц), 8,01 (3Н, м), 11,03 (1H, шир.с).
ESI MC: 422,0.
Пример 69: 6-(2-аминопиридин-5-илсульфониламин)-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 6-амино-3-пиридинсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,96 (3Н, с), 6,39 (1Н, д, J=8,8 Гц), 6,89 (2Н, с), 7,25 (1Н, д, J=4,2 Гц), 7,32 (1Н, д, J=9,2 Гц), 7,47 (1Н, с), 7,64 (1Н, д, J=9,2 Гц), 7,89 (1Н, д, J=4,2 Гц), 8,01 (1Н, д, J=8,8 Гц), 8,31 (1Н, с), 10,95 (1Н, с).
ESI MC: 331,0.
Пример 70: 1-метокси-6-(4-метилбензолсуль фониламин)изохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 4 - толуолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,28 (3Н, с), 3,96 (3Н, с), 7,22 (1Н, д, J=6,0 Гц), 7,32 (3Н, м), 7,48 (1Н, с), 7,71 (2Н, д, J=8,4 Гц), 7,88 (1Н, д, J=6,0 Гц), 8,00 (1Н, д, J=9,2 Гц), 10,79 (1Н, с).
ESI MC: 329,0.
Пример 71: 6-(4-ацетиламинобензолсульфониламин)-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 4-ацетамидобензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,01 (3Н, с), 3,96 (3Н, с), 7,23 (1Н, д, J=6,0 Гц), 7,32 (1Н, д, J=9,2 Гц), 7,47 (1Н, с), 7,67 (1Н, д, J=8,8 Гц), 7,76 (2Н, д, J=8,8 Гц), 7,88 (1Н, д, J=6,0 Гц), 8,00 (1Н, д, J=9,2 Гц), 10,26 (1Н, с), 10,75 (1Н, с).
ESI МС: 372,1.
Пример 72: 6-(4-метансульфониламинобензолсульфониламин)-1-метоксиизохинолин
Нитрогруппу в синтезируемое соединение вводили аналогично методике примера 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43), и 4-нитробензолсульфонилхлорид восстанавливали по аналогичной методике примера получения 170. Полученное соединение растворяли в пиридине, при охлаждении льдом добавляли метансульфонилхлорид и затем оставляли при перемешивании в течение 4 часов. Добавляли насыщенный раствор соли и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток очищали на колонке с силикагелем и полученные кристаллы перекристаллизовывали из этанола с получением указанного в заголовке соединения.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,06 (3Н, с), 3,97 (3Н, с), 7,24 (3Н, м), 7,33 (1Н, д, J=9,0 Гц), 7,49 (1Н, с), 7,79 (2Н, д, J=8,8 Гц), 7,89 (1Н, д, J=6,0 Гц), 8,01 (1Н, д, J=9,0 Гц), 10,39 (1Н, с), 10,80 (1Н, с).
ESI MC: 372,1.
Пример 73: 6-(2-хлорпиридин-5-илсульфониламин)-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 6-хлор-3-пиридинсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,31 (3Н, с), 3,99 (1Н, с), 7,30 (1Н, д, J=6,0 Гц), 7,34 (1Н, д, J=8,8 Гц), 7,56 (1Н, с), 7,71 (1Н, д, J=8,8 Гц), 7,92 (1Н, д, J=6,0 Гц), 8,06 (1Н, д, J=8,8 Гц), 8,19 (1Н, д, J=8,8 Гц), 11,13 (1Н, с).
ESI MC: 350,1.
Пример 74: 1-метокси-6-(3-метилбензолсульфониламин)изохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 3-толуолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,31 (3Н, с), 3,96 (3Н, с), 7,22 (1Н, д, J=6,0 Гц), 7,32 (1Н, дд, J=2,0 Гц, 8,8 Гц), 7,39 (2Н, м), 7,47 (1Н, д, J=2,0 Гц), 7,62 (1Н, м), 7,67 (1Н, с), 7,87 (1Н, д, J=6,0 Гц), 8,00 (1Н, д, J=8,8 Гц), 10,84 (1Н, с).
Пример 75: 6-бензилсульфониламин-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и бензилсульфонилхлорид.
1H-ЯMP (СDCl3) δ (м.д.): 4,13 (3Н, с), 4,42 (2Н, с), 6,69 (1Н, шир.с), 7,13 (2Н, м), 7,22 (2Н, м), 7,30-7,37 (3Н, м), 7,50 (1Н, д, J=2,4 Гц), 7,99 (1Н, д, J=6,0 Гц), 8,20 (1Н, д, J=8,8 Гц).
Пример 76: 6-(3-цианобензолсульфониламин)-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 3-цианобензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 3,98 (3Н, с), 7,28 (1Н, д, J=6,0 Гц), 7,34 (1Н, дд, J=2,0 Гц, 8,8 Гц), 7,53 (1Н, д, J=2,0 Гц), 7,75 (1Н, дд, J=8,0 Гц, 8,0 Гц), 7,91 (1Н, д, J=6,0 Гц), 8,04 (1Н, д, J=8,8 Гц), 8,09 (2Н, м), 9,29 (1Н, м), 11,05 (1Н, с).
Пример 77: 1-метокси-6-(4-тиазол-2-илбензолсульфониламин) изохинолин
Соединение (40 мг), полученное в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 4-иодбензолсульфонилхлорид, а также 2-три-н-бутилстаннилтиазол (136 мг), тетракис(трифенилфосфин)палладий(0) (11 мг) нагревали при кипении с обратным холодильником в толуоле в атмосфере азота в течение 1 часа. Растворитель выпаривали, остаток очищали на колонке с силикагелем. Полученные кристаллы перекристаллизовывали из метанола с получением указанного в заголовке соединения (20 мг).
1H-ЯMP (CDCl3) δ (м.д.): 4,08 (3Н, с), 6,94 (1Н, шир.с), 7,09 (1Н, д, J=6,0 Гц), 7,23 (1Н, дд, J=2,0 Гц, 8,8 Гц), 7,41 (1Н, д, J=3,6 Гц), 7,45 (1H, д, J=2,0 Гц), 7,89 (2Н, д, J=8,4 Гц), 7,90 (1H, д, J=8,6 Гц), 7,95 (1Н, д, J=6,0 Гц), 7,82 (2Н, д, J=8,4 Гц), 8,13 (1Н, д, J=8,8 Гц).
Пример 78: 6-(4-хлорбензолсульфониламин)-1-метоксиизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метоксиизохинолин (пример получения 43) и 4-хлорбензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 4,00 (3Н, с), 7,27 (1Н, д, J=5,6 Гц), 7,45 (1Н, дд, J=2,0 Гц, 8,8 Гц), 7,53 (1Н, д, J=2,0 Гц), 7,63 (2Н, д, J=8,8 Гц), 7,85 (1Н, д, J=8,8 Гц), 7,92 (1Н, д, J=5,6 Гц), 8,06 (1Н, д, J=8,8 Гц), 10,97 (1Н, с).
Пример 79: 6-(4-хлорбензолсульфониламин)-1-метилизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-метилизохинолин (пример получения 33) и 4-хлорбензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,76 (3Н, с), 7,56 (1Н, д, J=6,0 Гц), 7,52 (2Н, м), 7,60 (2Н, д, J=8,8 Гц), 7,82 (2Н, д, J=8,8 Гц), 8,08 (1Н, д, J=9,2 Гц), 8,20 (1Н, д, J=6,0 Гц).
ESI-MC: 333,0.
Пример 80: 6-(4-хлорбензолсульфониламин)-1-этилизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-1-этилизохинолин (пример получения 48) и 4-хлорбензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,39 (3Н, т, J=7,6 Гц), 3,25 (2Н, кв, J=7,6 Гц), 7,35 (1H, дд, J=2,4 Гц, 9,2 Гц), 7,38 (1Н, д, J=5,6 Гц), 7,41 (2Н, д, J=8,8 Гц), 7,53 (1Н, д, J=2,4 Гц), 7,81 (2Н, д, J=8,8 Гц), 8,05 (1Н, д, J=9,2 Гц), 8,37 (1H, д, J=5,6 Гц).
ESI-MC: 347,0.
Пример 81: 6-(4-хлорбензолсульфониламин)-4-этилизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-4-этилизохинолин (пример получения 66) и 4-хлорбензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,18 (3Н, т, J=7,2 Гц), 2,85 (1H, кв, J=7,2 Гц), 7,38 (1H, д, J=8,8 Гц), 7,60 (1H, с), 7,62 (2Н, д, J=8,0 Гц), 7,82 (2Н, д, J=8,0 Гц), 8,00 (1H, д, J=8,8 Гц), 8,26 (1H, с), 8,99 (1H, с).
Пример 82: 6-(4-хлорбензолсульфониламин)-4-метилизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-4-метилизохинолин (пример получения 58) и 4-хлорбензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,43 (3Н, с), 7,41 (1H, д, J=8,8 Гц), 7,56 (1H, с), 7,62 (2Н, д, J=8,8 Гц), 7,85 (2Н, д, J=8,8 Гц), 7,99 (1H, д, J=8,8 Гц), 8,26 (1H, с), 8,98 (1H, с), 11,09 (1H, шир.с).
Пример 83: 6-(4-хлорбензолсульфониламин)-3-метилизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-амино-3-метилизохинолин (пример получения 76) и 4-хлорбензолсульфонилхлорид.
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,53 (3Н, с), 7,30 (1H, д, J=8,8 Гц), 7,45 (1H, с), 7,50 (1Н, с), 7,62 (2Н, д, J=8,4 Гц), 7,84 (2Н, д, J=8,4 Гц), 7,93 (1H, д, J=8,8 Гц), 9,03 (1H, с).
Пример 84: 6-(4-хлорбензолсульфониламин)-1-цианоизохинолин
Указанное в заголовке соединение получали в соответствии с методикой, описанной в примере 1, за исключением того, что использовали 6-аминоизохинолин (0,5 г Synthesis, 733 (1975)) и 4-хлорбензолсульфонилхлорид (0,88 г), растворенные в хлороформе (150 мл). При охлаждении льдом добавляли м-хлорпербензойную кислоту (0,9 г), затем перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали, полученные кристаллы промывали диэтиловым эфиром, отфильтровывали и сушили с получением N-оксида 6-(4-хлорбензолсульфониламин)изохинолина (1,072 г). В ацетонитриле (1,5 мл) растворяли 50 мг полученного соединения. К смеси добавляли триметилцианид (0,08 мл) и триэтиламин (0,04 мл), затем нагревали при кипении с обратным холодильником в течение 3,5 часов. После выпаривания растворителя остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (23 мг, 64%) в виде кристаллов желтого цвета.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,66 (2Н, д, J=8,8 Гц), 7,67 (1H, дд, J=2,0 Гц, 9,2 Гц), 7,80 (1H, д, J=2,0 Гц), 7,93 (2Н, д, J=8,8 Гц), 8,17 (1H, д, J=9,2 Гц), 8,18 (1H, д, J=5,6 Гц), 8,59 (1H, д, J=5,6 Гц).
ESI-MC: 344,1.
Пример 85: 1-карбамоил-6-(4-хлорбензолсульфониламин)изохинолин
Кристаллы, полученные в соответствии с методикой, описанной в Synthesis, 949 (1989), за исключением того, что использовали 6-(4-хлорбензолсульфониламин)-1-цианоизохинолин (30 мг, пример 83), промывали диэтиловым эфиром с получением указанного в заголовке соединения (26 мг, 82%) в виде бесцветных кристаллов.
1H-ЯMP (CDCl3) δ (м.д.): 6,25 (1Н, шир.с), 7,35 (2Н, д, J=8,8 Гц), 7,43 (1Н, дд, J=2,0 Гц, 9,2 Гц), 7,62 (1Н, д, J=2,0 Гц), 7,66 (1Н, д, J=6,8 Гц), 7,81 (2Н, д, J=8,8 Гц), 8,04 (1Н, шир.с), 8,37 (1Н, шир.с), 9,32 (1Н, д, J=9,2 Гц), 9,76 (1Н, шир.с).
Пример 86: 6-(4-хлорбензолсульфониламин)-1-метиламиноизохинолин
Смесь 1-хлор-6-(4-хлорбензолсульфониламин)изохинолина (50 мг, пример 61) и 40% раствора метиламина в метаноле (5,0 мл) нагревали в герметизированной пробирке при 130°С в течение 18 часов. После охлаждения добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (28 мг, 52%) в виде твердого вещества бледно-желтого цвета.
1H-ЯMP (CDCl3) δ (м.д.): 3,14 (3Н, с), 5,22 (1Н, шир.с), 6,89 (1Н, д, J=6,0 Гц), 7,19 (Н, дд, J=2,4 Гц, 9,2 Гц), 7,31 (1Н, д, J=2,4 Гц), 7,40 (2Н, д, J=8,8 Гц), 7,64 (1Н, д, J=9,2 Гц), 7,73 (2Н, д, J=8,8 Гц), 7,98 (1Н, д, J=6,0 Гц).
Пример 87: 1-амино-6-(4-хлорбензолсульфониламин)изохинолин
Кристаллы, полученные в соответствии с методикой, описанной в YAKUGAKU ZASSHI (Journal of the Pharmaceutical Society of Japan), 84, 35 (1964), за исключением того, что использовали N-оксид 6-(4-хлорбензолсульфониламин)изохинолина (50 мг, промежуточное соединение в примере 83), промывали диэтиловым эфиром и сушили с получением указанного в заголовке соединения (2 мг) в виде кристаллов светло-коричневого цвета.
1H-ЯMP (ДМСО-d6) δ (м.д.): 7,76 (1Н, д, J=6,0 Гц), 6,93 (2Н, шир.с), 7,15 (1Н, дд, J=2,0 Гц, 8,8 Гц), 7,27 (1Н, д, J=2,0 Гц), 7,59 (2Н, д, J=8,8 Гц), 7,63 (1Н, д, J=6,0 Гц), 7,80 (2Н, д, J=8,8 Гц), 9,05 (1Н, д, J=6,0 Гц).
ESI-MC: 334,1.
Пример 88: 6-(4-хлорбензолсульфониламин)-1-диметиламиноизохинолин
В диметилсульфоксиде (1 мл) растворяли 60 мг 1-хлор-6-(4-хлорбензолсульфониламин)изохинолина (пример 61). К смеси добавляли 50% раствор диметиламина в метаноле (0,04 мл), затем нагревали при 80°С при перемешивании в течение 10 часов. После охлаждения добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток очищали препаративной ТСХ и отверждали из изопропилового эфира с получением указанного в заголовке соединения (17 мг).
1H-ЯMP (ДМСО-d6) δ (м.д.): 2,96 (6Н, с), 7,12 (1Н, д, J=6,0 Гц), 7,27 (1Н, дд, J=2,0 Гц, 9,2 Гц), 7,45 (1Н, д, J=2,0 Гц), 7,64 (2Н, д, J=8,8 Гц), 7,85 (2Н, д, J=8,8 Гц), 7,93 (1Н, д, J=6,0 Гц), 8,01 (1H, д, J=9,2 Гц), 10,91 (1H, шир.с).
Пример 89: 6-(4-хлорбензолсульфониламин)-1-гидроксиизохинолин
В уксусном ангидриде (0,75 мл) растворяли 50 мг N-оксида 6-(4-хлорбензолсульфониламин)изохинолина (промежуточное соединение в примере (83), затем нагревали при 80°С при перемешивании в течение 16 часов, а затем - в течение 2 часов. После охлаждения добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток растворяли в этаноле (2,0 мл) и воде (0,5 мл), затем нагревали при кипении с обратным холодильником в течение 0,5 часа. После выпаривания растворителя остаток очищали на колонке с силикагелем с получением указанного в заголовке соединения (20 мг) в виде твердого вещества бледно-красного цвета.
1H-ЯMP (CDCl3) δ (м.д.): 6,58 (1H, д, J=7,2 Гц), 7,22 (1H, д, J=7,2 Гц), 7,31 (1H, дд, J=2,0 Гц, 8,4 Гц), 7,54 (1H, д, J=2,0 Гц), 7,56 (2Н, д, J=8,8 Гц), 8,01 (2Н, д, J=8,8 Гц), 8,53 (1H, д, J=8,4 Гц), 10,36 (1H, шир.с).
ESI-MC: 335,1.
Пример 90: 6-(4-хлорбензолсульфониламин)-1-этоксиизохинолин
В диметилсульфоксиде (1 мл) растворяли 57 мг 1-хлор-6-(4-хлорбензолсульфониламин)изохинолина (пример 61). К смеси добавляли этанол (0,1 мл) и 60% гидрид натрия (14 мг), затем нагревали при 80°С при перемешивании в течение 9 часов. После охлаждения добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Затем остаток очищали препаративной ТСХ и отверждали из изопропилового эфира с получением указанного в заголовке соединения (21 мг).
1H-ЯMP (ДМСО-d6) δ (м.д.): 1,38 (3Н, т, J=7,2 Гц), 4,46 (2Н, кв, J=7,2 Гц), 7,24 (1Н, д, J=6,0 Гц), 7,35 (1H, дд, J=2,0 Гц, 9,2 Гц), 7,50 (1H, д, J=2,0 Гц), 7,63 (2Н, д, J=8,8 Гц), 7,90 (1H, д, J=6,0 Гц), 8,04 (1H, д, J=9,2 Гц), 10,94 (1H, шир.с).
Пример 91: N-(5-винилхинолин-2-ил)-3-пиридинсульфонамид
Раствор 2-амино-5-бромхинолина (510 мг, пример получения 1), винилтрибутилолово (0,94 мл), толуол (4 мл), тетракис(трифенилфосфин)палладий(0) (20 мг) и 2,6-ди-трет-бутил-п-крезол (около 0,1 мг) перемешивали при 120°С в течение 4 часов. После охлаждения до комнатной температуры добавляли воду и смесь экстрагировали этилацетатом. Этилацетатный слой сушили над сульфатом магния и концентрировали. Затем полученное твердое вещество промывали гексаном с получением 282 мг твердого вещества, содержавшего виниловое производное. Твердое вещество растворяли в 2 мл пиридина и добавляли 412 мг 3-пиридинсульфонилхлорида, затем перемешивали при комнатной температуре в течение ночи. Добавляли воду и смесь экстрагировали этилацетатом. Этилацетатный слой сушили над сульфатом магния и концентрировали. Затем полученное твердое вещество промывали метанолом с получением указанного в заголовке соединения (235 мг).
1H-ЯMP (CDCl3) δ (м.д.): 5,59 (1H, дд, J=10,8 Гц, 1,5 Гц), 5,82 (1Н, дд, J=16,9 Гц, 1,5 Гц), 6,95 (1Н, д, J=10,3 Гц), 7,20 (1H, дд, J=10,8 Гц, 16,9 Гц), 7,36 (1Н, д, J=8,5 Гц), 7,43 (1H, м), 7,50 (1H, д, J=8,5 Гц), 7,62 (1H, т, J=8,5 Гц), 8,24 (1H, д, J=10,3 Гц), 8,29 (1H, м), 8,74 (1H, м), 9,22 (1H, м).
Пример 92: N-(4-трифторметилкумарин-7-ил)-4-хлорбензолсульфонамид
К раствору 7-амино-4-трифторметилкумарина (200 мг, 0,87 ммоль) и 4-диметиламинопиридина (1 мг) в пиридине (3 мл) добавляли 4-хлорбензолсульфонилхлорид (203 мг, 0,96 ммоль), затем перемешивали при 70°С в течение 50 минут. К реакционной смеси добавляли 2 н. хлористоводородную кислоту и затем экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и выпаривали. Полученный остаток кристаллизовали из смеси этилацетат-диизопропиловый эфир с получением 253 мг указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета.
1H-ЯMP (ДМСО-d6) δ (м.д.): 6,87 (1H, с), 7,12 (1H, д, J=2,4), 7,17 (1H, дд, J=2,6 Гц, 8,4 Гц), 7,60 (1H, д, J=8,4 Гц), 7,67 (2Н, д, J=6,8 Гц), 7,87 (2Н, д, J=6,8 Гц), 11,29 (1H, с).
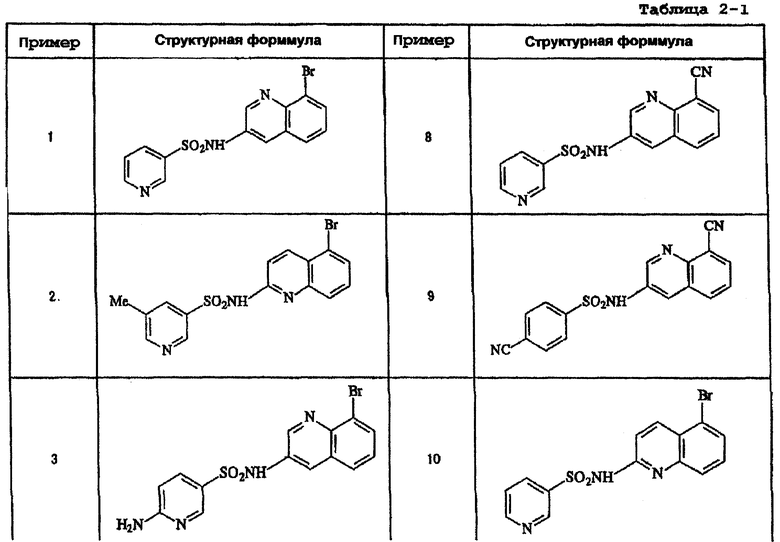
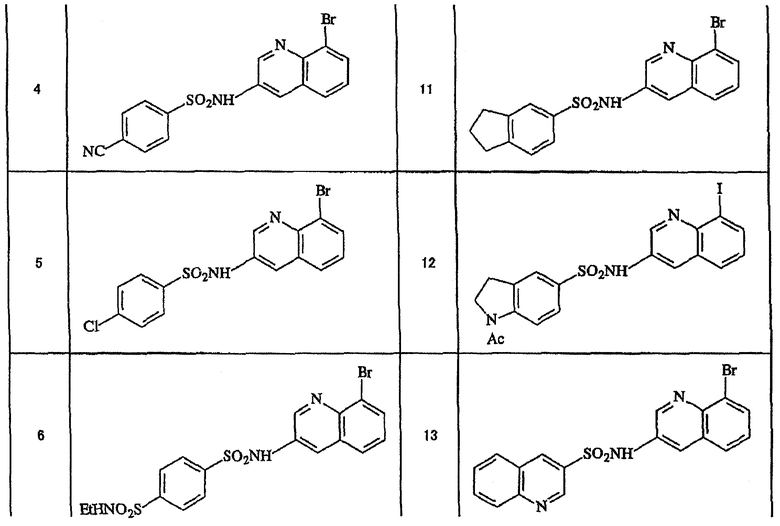
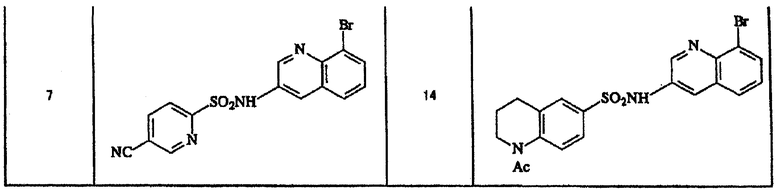
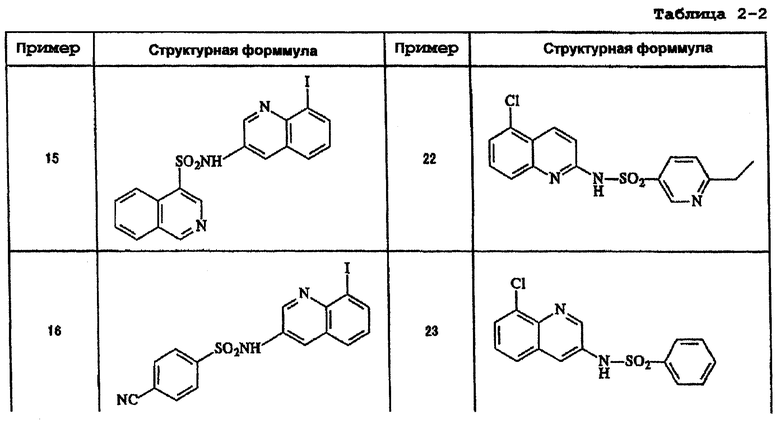
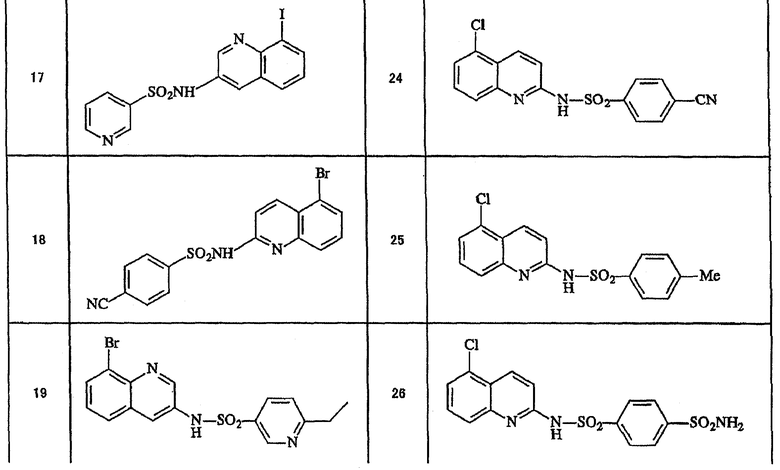
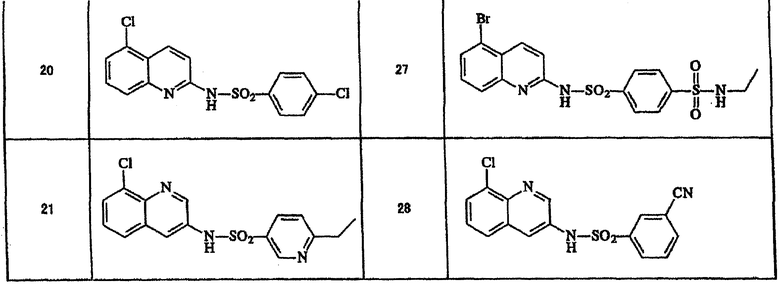
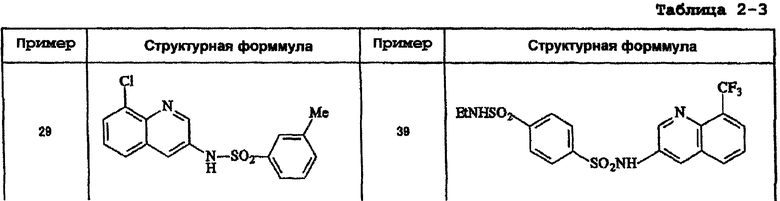
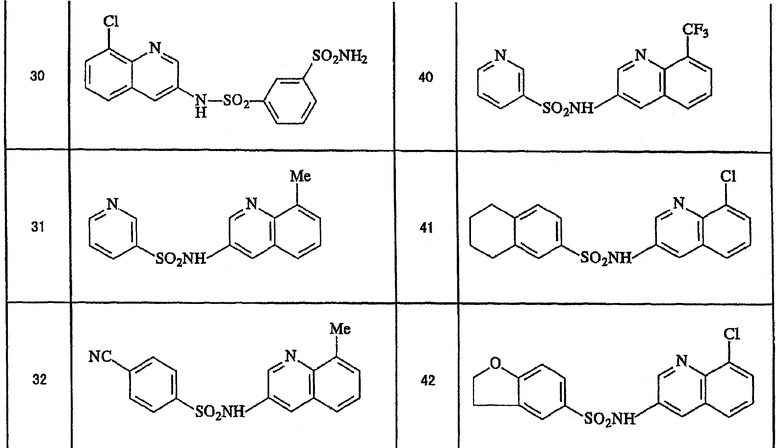
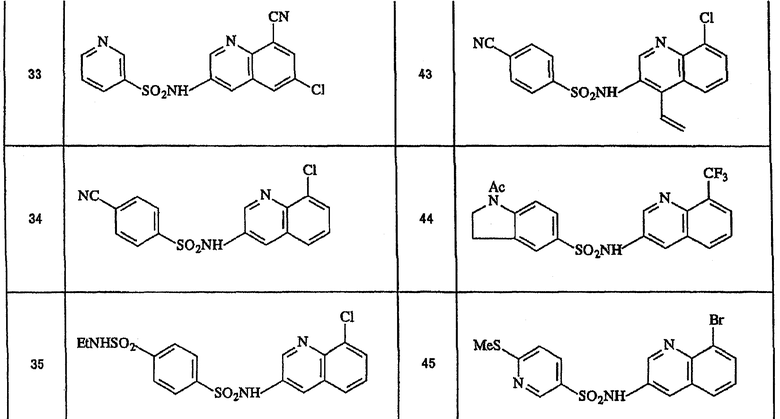
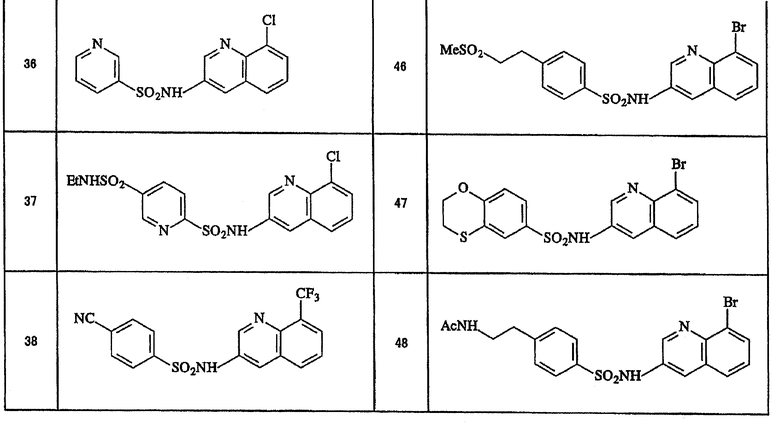
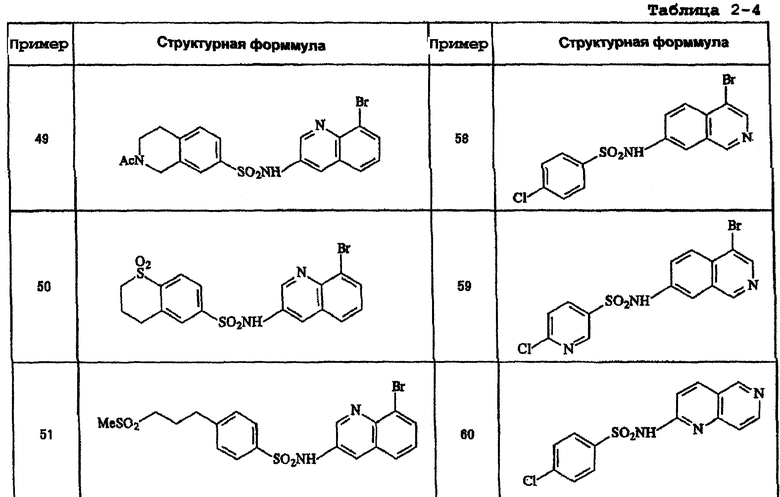
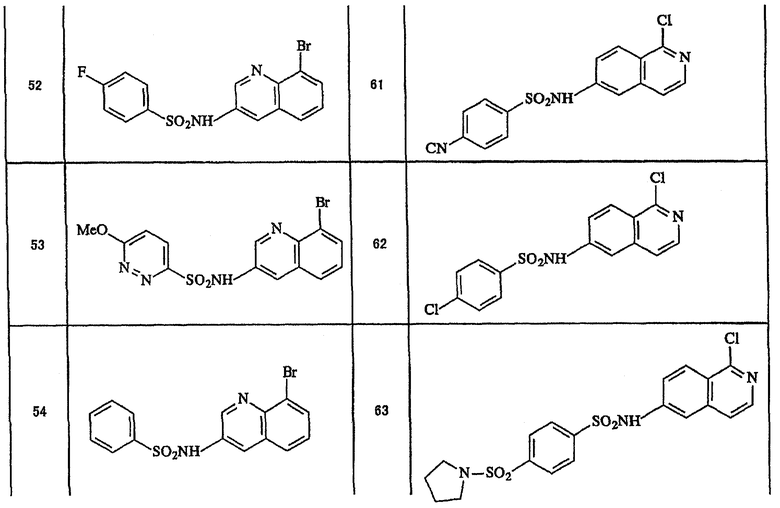
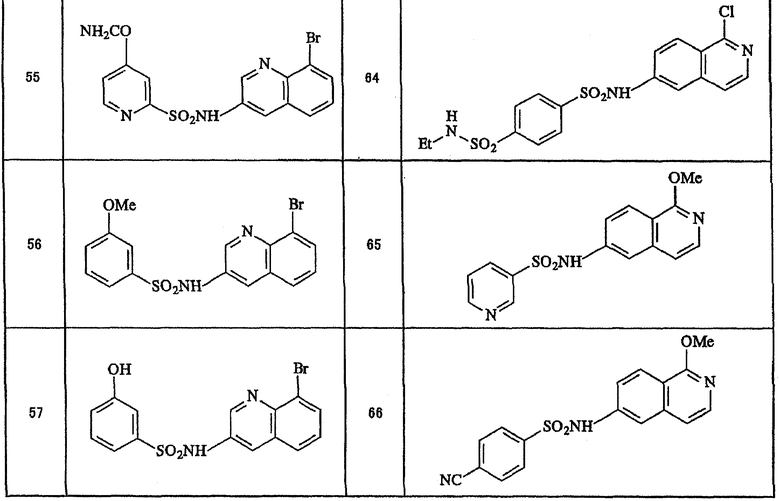
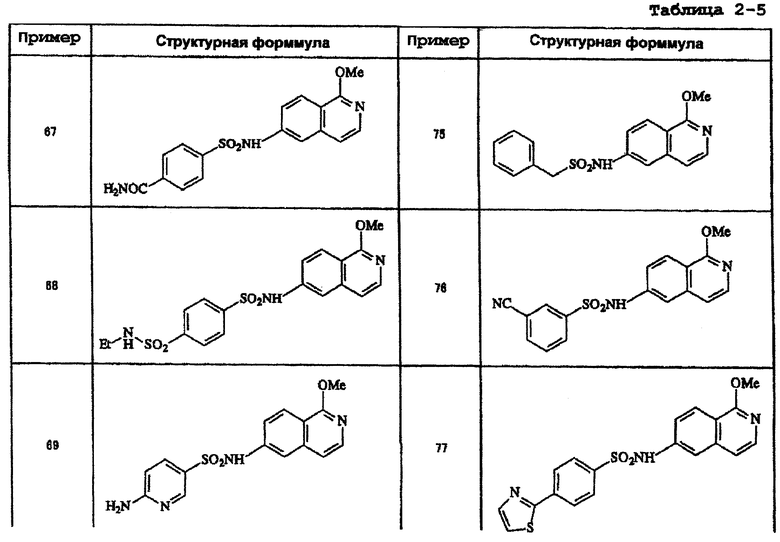
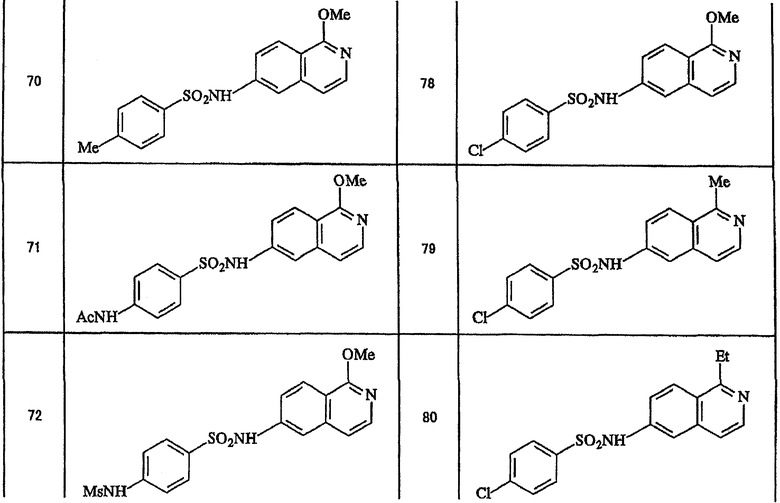
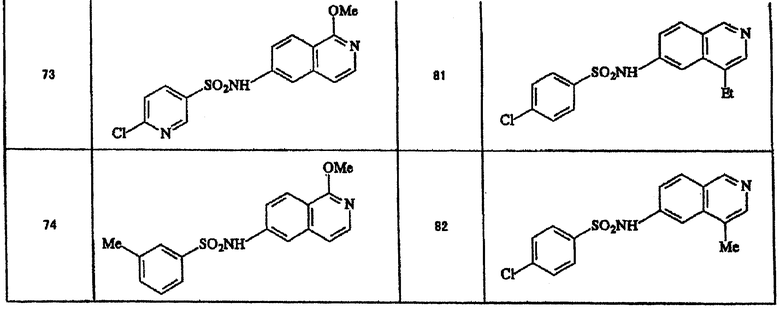
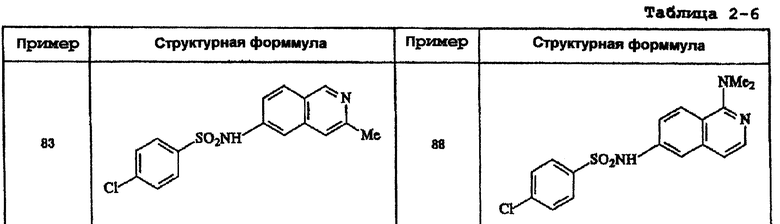
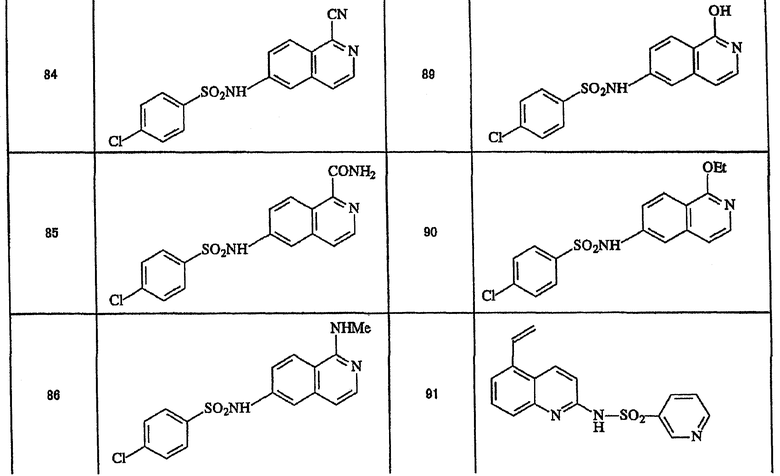
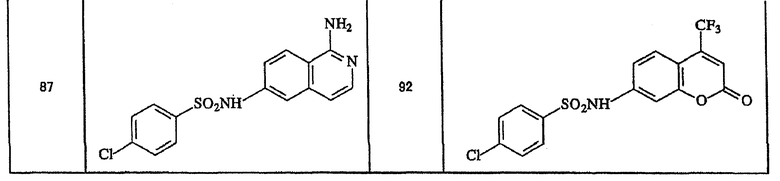
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОР ЭКСПРЕССИИ ИНТЕГРИНА | 2001 |
|
RU2240826C2 |
| СУЛЬФОНАМИДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ИНДОЛА | 2000 |
|
RU2208607C2 |
| СОЕДИНЕНИЯ N, N-ЗАМЕЩЕННОГО ЦИКЛИЧЕСКОГО АМИНА | 1999 |
|
RU2232156C2 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| ПИПЕРИДИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ НАТРИЕВЫХ КАНАЛОВ И КАЛИЕВЫХ КАНАЛОВ | 2001 |
|
RU2259365C2 |
| ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ АМИНОВ, ОБЛАДАЮЩИХ ПОДАВЛЯЮЩИМ ОАС ДЕЙСТВИЕМ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИНГИБИТОР НОАС | 1997 |
|
RU2193554C2 |
| 5-ЧЛЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕКАРСТВЕННЫХ ЦЕЛЕЙ | 2008 |
|
RU2515968C2 |
| ЦИКЛОПРОПАНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2571414C2 |
| ПРОИЗВОДНЫЕ ДИАМИНОВ | 2002 |
|
RU2319699C2 |
| ПРОИЗВОДНЫЕ 2-АМИНОПИРИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2250898C2 |
Изобретение относится к сульфонамидсодержащему гетероциклическому соединению, представленному формулой (I), к его фармацевтически приемлемой соли и их гидратам
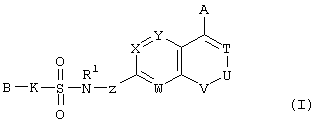
где значения A, B, K, T, W, X, Y, U, V, Z, R1 указаны в п.1 формулы изобретения. Изобретение также относится к промежуточным соединениям формулы (II)
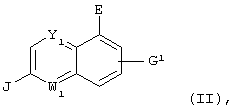
к способу получения соединения, представленного формулой IV, к противоопухолевому агенту, к агенту, подавляющему метастазирование злокачественной опухоли на основе соединений формулы (I).
Технический результат – получение новых соединений в целях профилактики и лечения диабетической ретинопатии, ревматического артрита, гематомы, подавления метастазирования злокачественной опухоли. 8 н. и 8 з.п. ф-лы, 2 табл.
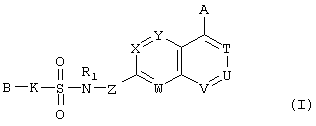
где А представляет атом водорода, атом галогена, гидроксильную группу, С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена, цианогруппу, (СО) kNR2R3 (где R2 и R3 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу и k = 0 или 1) или С2-С4 алкенильную группу;
В представляет арильную группу или пиридильную или пиридазинильную группу, которая может иметь заместитель, выбранный из следующей группы А, или
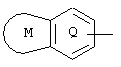
где кольцо Q представляет ароматическое кольцо, которое может иметь один или два атома азота;
кольцо М представляет собой ненасыщенное С5-С12 моноциклическое кольцо, имеющее общую двойную связь с кольцом Q, и кольцо может содержать 1-2 гетероатома, выбранных из атома азота, атома кислорода и атома серы; кольцо М может иметь заместитель, выбранный из следующей группы А;
К представляет простую связь или -(СR4R5)m- (где R4 и R5 каждый означает атом водорода, a m = 1 или 2);
Т, W, Х и Y одинаковые или различные и каждый означает =C(D)- (где D представляет атом водорода, атом галогена, С1-С4 алкильную группу или С2-С4 алкенильную группу) или атом азота;
U и V одинаковые или различные и каждый означает =C(D)- (где D имеет значения, определенные выше), атом азота, атом кислорода или -СО-;
Z представляет простую связь;
R1 представляет атом водорода;
 означает простую или двойную связь;
означает простую или двойную связь;
группа А атом галогена, гидроксильная группа, С1-С4 алкильная группа или алкоксигруппа, цианогруппа, -R8R9N(NH)p- (где R8 и R9 одинаковые или различные и каждый означает атом водорода или С1-С4 алкильную группу; р = 0 и R8 и R9 могут быть объединены с атомом азота, с которым они связаны, с образованием 5-членного кольца), аминосульфонильная группа, которая может быть замещена одной или двумя С1-С4 алкильными группами, С1-С8 ацильная группа, С1-С4 алкил-S(О)s-C1-C4 алкиленовая группа (где s = 2), -(СО)qNR10R11 (где R10 и R11 каждый означает атом водорода и q = 0 или 1) или 1,3-тиазолильная группа,
при условии, что исключаются случаи, когда U представляет атом кислорода, V означает –СО- или –CH2-; когда V представляет атом кислорода, U означает –СО- или –CH2-; и следующие случаи: 1) где только один из Т, U, V, W, Х и Y представляет атом азота и А и D оба представляют атомы водорода; 2) где Т, U, V, W, X и Y все представляют атомы азота; 3) где Y и W представляют атомы азота; Т, U, V и Х представляют =C(D1)- (где D1 означает атом водорода, метильную группу, атом галогена, трифторметильную группу или метоксигруппу); 4) где W представляет атом азота; Т, U, V, Х и Y представляют =C(D2)- (где D2 означает атом водорода); К и Z представляют простые связи; А представляет гидроксильную группу и B представляет п-толуолсульфониламино группу; 5) где V и W представляют атомы азота; 6) где Т, V и W представляют атомы азота; 7) Х и Y представляют С(СН3), Z представляет простую связь, R1 представляет атом водорода, К представляет простую связь, В представляет 4-метилфенил, W представляет атом азота, V, U и Т представляют -СН= и А представляет атом водорода; 8) Х представляет -С(ОСН3)=, Y представляет атом азота, Z представляет простую связь, R1 представляет атом водорода, К представляет простую связь, В представляет 4-метилфенил, W представляет -C(CONH2)=, V, U и Т представляют -СН= и А представляет атом водорода.
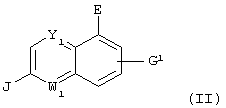
где Y1 и W1 различные и каждый означает атом азота или =C(D3)- (где D3 представляет атом водорода или гидроксильную группу);
Е представляет атом галогена, цианогруппу или С1-С4 алкильную группу, которая может быть замещена атомом галогена;
J представляет аминогруппу, которая может иметь защитную группу;
G1 представляет атом водорода,
или его соль, при условии, что исключается случай, где Y1 представляет атом азота; Е представляет гидроксильную группу; J представляет аминогруппу и G1 представляет атом водорода.
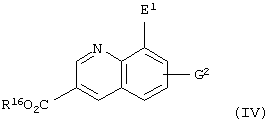
где Е1 представляет атом галогена;
R16 представляет карбоксилзащитную группу;
G2 представляет атом водорода, атом галогена, гидроксильную группу или С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена,
который включает стадию восстановления соединения, представленного формулой
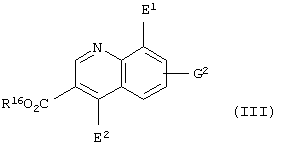
где Е1 представляет атом галогена;
Е2 представляет атом хлора или атом брома;
R16 представляет карбоксилзащитную группу;
G2 представляет атом водорода, атом галогена, гидроксильную группу или С1-С4 алкильную группу или алкоксигруппу, которая может быть замещена атомом галогена,
оловом, цинком или железом.
| Устройство для фиксации рычага тумблера | 1977 |
|
SU672662A1 |
| Способ получения покрытий на основе хрома | 1974 |
|
SU496332A1 |
| BAILEY A.S., J | |||
| Chem | |||
| Soc | |||
| (С) | |||
| Устройство станционной централизации и блокировочной сигнализации | 1915 |
|
SU1971A1 |
| ПНЕВМАТИЧЕСКИЙ ВОДОПОДЪЕМНЫЙ АППАРАТ | 1926 |
|
SU3769A1 |
| RIED W., Liebigs Ann | |||
| Chem | |||
| Запальная свеча для двигателей | 1924 |
|
SU1967A1 |
| ФРИКЦИОННОЕ ПРИСПОСОБЛЕНИЕ ДЛЯ СЦЕПЛЕНИЯ КОРПУСА СЪЕМНОГО КОЛЕСА СО СТУПИЦЕЙ РАБОЧЕЙ ОСИ | 1925 |
|
SU707A1 |
| Металлические подъемные леса | 1921 |
|
SU242A1 |
| ERICKSON H.E | |||
| Journal of Medicinal Chemistry | |||
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Топка генеративного типа для мелкого топлива | 1923 |
|
SU816A1 |
| ПРОИЗВОДНЫЕ СУЛЬФОНАМИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2128648C1 |
| US 4343804 А, 10.08.1982. | |||
Авторы
Даты
2004-11-10—Публикация
2000-12-27—Подача