Изобретение относится к новому способу получения гликопептидов глицирризиновой кислоты (ГК) (I) общей формулы (II), представляющих интерес для медицины в качестве противовирусных агентов и иммуномодуляторов [Hoever G., Baltina L., Michaelis M., Kondratenko R., Baltina L., Tolstikov G., Doerr H.W., Cinatl J., Jr. Antiviral activity of Glycyrrhizic acid derivatives against SAES-Coronavirus. // J. Med. Chem., 2006, 48, 1256-1259; Lin J.-Ch., Cherng J.-M., Hung M.-Sh., Baltina L.A., Baltina L., Kondratenko R. Inhibitory effects of some derivatives of Glycyrrhizic acid against Epstein-Barr virus infection: Structure-activity reationships. // Antiviral Res., 2008, 79, 6-11; Baltina L.A., Zarubaev V.V., Baltina L.A., Orshanskaya I.A., Fairushina A.I., Kiselev O.I., Yunusov M.S. Glycyrrhizic acid derivatives as influenza A/H1N1 virus inhibitors. // Bioorg. Med. Chem. Lett., 2015, 25, 1742-1746; Baltina L.A. (jr.), Kondratenko R.M., Baltina L.A., Baschenko N.Z., Plyasunova O.A. Synthesis and biological activity of new Glycyrrhizic acid conjugates with amino acids and dipeptides. // Russian J. Bioorg. Chem., 2009, 35, 510-517; Л.А. Балтина, С.А. Рыжова, Е.В. Васильева, Г.А. Толстиков, Г.М. Сахаутдинова, Ф.С. Зарудий. Трансформации глицирризиновой кислоты. VIII. Синтез иммуномодулирующих гликопептидов с использованием трет-бутиловых эфиров аминокислот. // Биоорган, химия, 1994, 20 (12), 1365-1374).
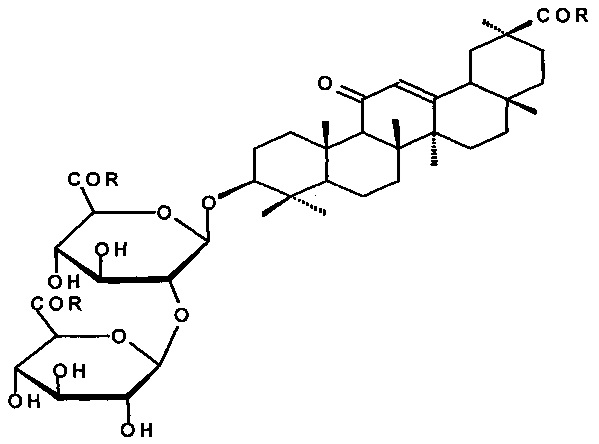

Известен способ получения гликопептидов ГК по схеме 1 (прототип 1) [RU 2057139 С1, 27/03/1996; Балтина Л.А., Рыжова С.А., Васильева Е.В., Капина А.П., Толстиков Г.А. Трансформации глицирризиновой кислоты. IV. Новый способ получения карбоксизащищенных гликопептидов. Ж. общей хим., 1993, т. 63, вып. 9, 2140-2147).
Схема 1
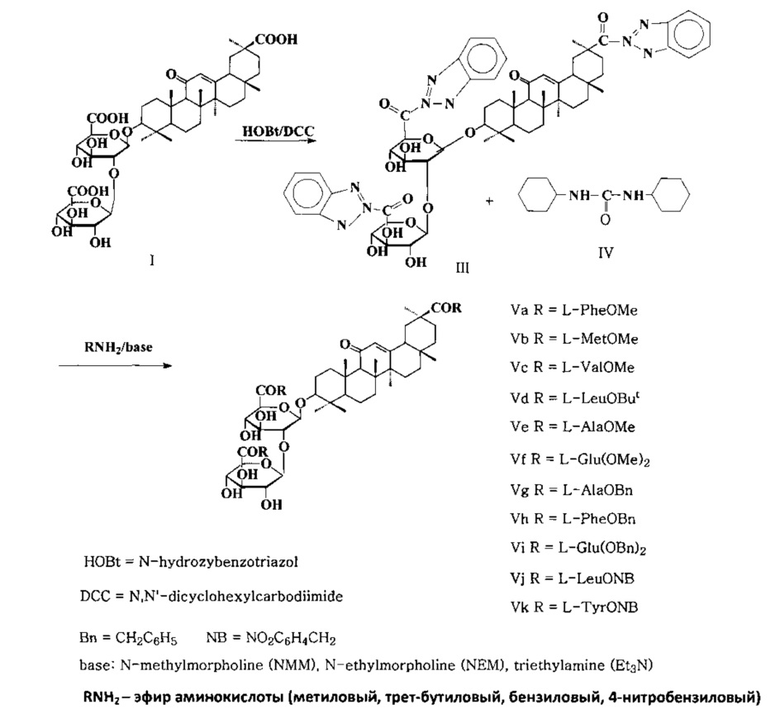
Способ заключается в обработке ГК (I) N-гидроксибензотриазолом (HOBt) и N,N'-дициклогексилкарбодиимидом (DCC) в среде растворителя (тетрагидрофурана, диоксана) при соотношении реагентов ГК/HOBt/DCC, равном 1/3.5-4.0/3.5-4.0 ммоль, при 0-+5°C 1 ч, при комнатной температуре 6-8 ч с получением активированного трис-оксибензотриазольного эфира (III), который после отделения осадка образующейся N,N'-дициклогексилмочевины (IV) подвергают взаимодействию с эфирами аминокислот (метиловыми, трет-бутиловыми, бензиловыми, 4-нитробензиловыми) (3.5-4.0 ммоль) в виде их гидрохлоридов, тозилатов или бензолсульфонатов (аминокомпонент) в присутствии третичного амина - N-метилморфолина (NMM), триэтиламина (Et3N) или трибутиламина (Bu3N) (4.2-7.2 ммоль)). Выход карбоксизащищенных гликопептидов ГК (V), содержащих по три остатка эфиров аминокислот, составляет 82-94%.
Основным недостатком данного способа получения гликопептидов ГК является его многостадийность, что усложняет и удлиняет процесс получения целевых гликопептидов - конъюгатов ГК с аминокислотами со свободными COOH-группами.
Способ состоит из следующих стадий:
1) синтез эфиров аминокислот (метиловых, трет-бутиловых, бензиловых, 4-нитробензиловых) для защиты COOH-групп аминокомпонентов;
2) получение активированного эфира (III) в растворе тетрагидрофурана или диоксана;
3) взаимодействие эфира (III) с гидрохлоридами, тозилатами или бензолсульфонатами эфиров аминокислот (метиловыми, трет-бутиловыми, бензиловыми или 4-нитробензиловыми) в присутствии избытка третичного основания - N-метилморфолина (NMM), триэтиламина (Et3N), трибутиламина (BU3N);
4) удаление защитных эфирных групп аминокислотных остатков для получения свободных гликопептидов - трет-бутиловых с помощью CF3COOH, бензиловых (нитробензиловых) - с помощью гидрогенолиза в 75% CH3COOH в присутствии Pd/C.
Метиловые сложноэфирные защитные группы гликопептидов ГК не удаляются, так как их деблокирование требует щелочного гидролиза, что приводит к деструкции гликозидной структуры и образованию сложных смесей продуктов разложения. После удаления защитных групп (бензильных, 4-нитробензильных) гидрогенолизом целевые деблокированные гликопептиды ГК выделяют с помощью колоночной хроматографии (КХ) на силикагеле (СГ) с выходами 65-75% в способе-прототипе 1 (Балтина Л.А., Рыжова С.А., Васильева Е.В., Калина А.П., Толстиков Г.А. Трансформации глицирризиновой кислоты. IV. Новый способ получения карбоксизащищенных гликопептидов. Ж. общей хим., 1993, т. 63, вып. 9, 2140-2147).
Известен способ получения гликопептидов ГК по схеме 2 (прототип 2) [SU 1625882 А1, 07.02.1991; Балтина Л.А., Рыжова С.А., Васильева Е.В., Толстиков Г.А., Сахаутдинова Г.М., Зарудий Ф.С. Трансформации глицирризиновой кислоты. VIII. Синтез иммуномодулирующих гликопептидов с использованием трет-бутиловых эфиров аминокислот. // Биоорган, химия, 1994, 20 (12), 1365-1374).
Способ заключается в обработке ГК N-гидроксисукцинимидом (HOSu) и DCC в среде тетрагидрофурана или диоксана при 3-ступенчатом выдерживании реакционной массы: при 0-+5°C 3 ч, при комнатной температуре - 6 ч, при 4-8°C 12 ч при соотношении ГК/HOSu/DCC=1/4-5/3.0-3.2 ммоль, с получением активированного трис-оксисукцинимидного эфира VI (схема 2), который после отделения осадка дициклогексилмочевины (IV) вводят в реакцию конденсации с эфирами аминокислот (метиловыми, трет-бутиловыми) в виде гидрохлоридов (3.0-3.5 ммоль) в присутствии триэтиламина (4.8-5.4 ммоль). Выход карбоксизащищенных гликопептидов ГК (Vc, VIIa-с) составляет 75-80%.
Схема 2
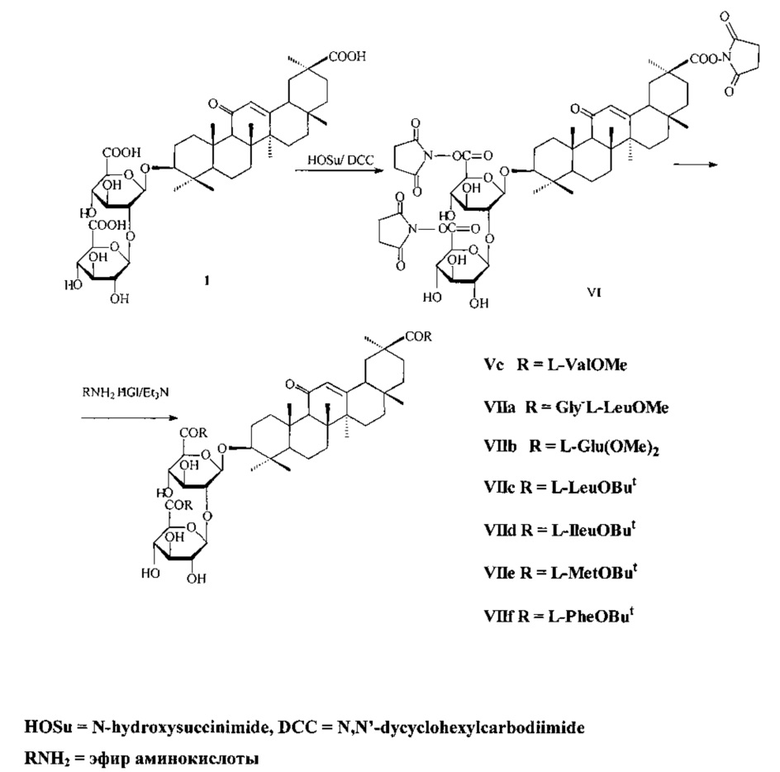
Недостатком данного способа получения гликопептидов ГК является его многостадийность, как и в способе-прототипе 1, и необходимость проведения операции деблокирования карбоксизащищенных гликопептидов - удаление сложноэфирных трет-бутильных групп CF3COOH для получения гликопептидов со свободными COOH группами, которые выделяют в индивидуальном состоянии с помощью КХ на СГ с выходами 39-47% (Балтина Л.А., Рыжова С.А., Васильева Е.В., Толстиков Г.А., Сахаутдинова Г.М., Зарудий Ф.С. Трансформации глицирризиновой кислоты. VIII. Синтез иммуномодулирующих гликопептидов с использованием трет-бутиловых эфиров аминокислот. // Биоорган, химия, 1994, 20 (12), 1365-1374).
Задача, на решение которой направлено заявленное техническое решение, заключается в разработке нового способа получения гликопептидов ГК со свободными COOH группами аминокислотных остатков с использованием ГК I без предварительной защиты гидроксильных групп углеводной части молекулы и аминокислот с временной защитой их карбокси-групп в виде натриевых солей, что исключает процессы деблокирования и позволяет получать целевые продукты по укороченной схеме по принципу «минимальной защиты» аминокомпонента (схема 3).
Схема 3
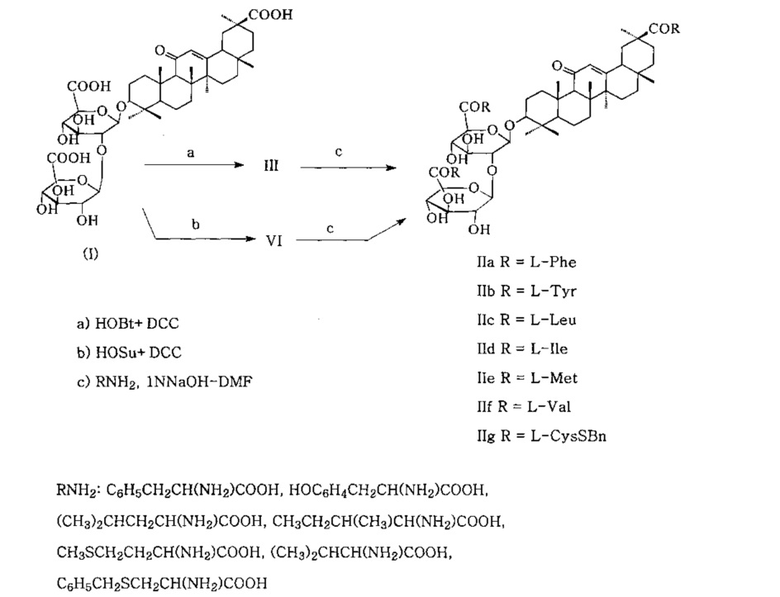
В заявленном техническом решении поставленная цель достигается тем, что ГК I обрабатывается HOBt и DCC в соотношении ГК/HOBt/DCC=1/3.0-3.5/3.0-3.5 ммоль или HOSu и DCC в соотношении ГК/HOSu/DCC=1/4.0-5.0/3.0-3.5 ммоль при 0-+5°C 1 ч в растворителе (тетрагидрофуран, диоксан), смесь выдерживается при перемешивании 5-6 ч при комнатной температуре (20-22°C), осадок N,N'-дициклогексилмочевины IV отделяется. Полученный раствор активированного трис-оксибензотриазольного эфира III (схема 1) или активированного трис-оксисукцинимидного эфира VI (схема 2) добавляется постепенно к раствору аминокислоты (4.0-5.0 ммоль) в смеси 1N водного раствора NaOH и N,N'-диметилформамида при соотношении 1:1 (v/v) при 0-+5°C, затем реакционная смесь выдерживается с периодическим перемешиванием при 20-22°C 24 ч. В качестве аминокислот используют L-фенилаланин (L-Phe), L-тирозин (L-Tyr), L-лейцин (L-Leu), L-изолейцин (1-Ile), L-метионин (L-Met), L-валин (L-Val), S-бензил-L-цистеин (L-CysSBn). Целевые продукты - свободные гликопептиды формулы IIa-g выделяют путем разбавления реакционной смеси холодной водой и подкисления 5% соляной кислотой до pH ~2-3. Полученный осадок отфильтровывают, промывают водой и сушат. При активации карбоксильных групп ГК HOBt-DCC выход свободных гликопептидов IIa-g составляет 82-100%, при активации ГК с помощью HOSu-DCC - 80-95%.
Существенные отличия и преимущества предлагаемого способа получения гликопептидов ГК заключаются в следующем.
В качестве аминокомпонентов используются свободные аминокислоты, а не их эфиры (метиловые, трет-бутиловые, бензиловые, 4-нитробензиловые) в виде гидрохлоридов, тозилатов или сульфонатов, что позволяет избежать стадии деблокирования образующихся при синтезе карбоксизащищенных гликопептидов ГК.
Для временной защиты карбокси-групп аминокислот в виде натриевых солей используется 1 N водный раствор NaOH.
Синтез является 2-стадийным, а не 4-стадийным, как в способах-прототипах 1 и 2.
Токсичные третичные амины (NMM, NEM, Et3N) с неприятным запахом в синтезе не используются.
Сущность изобретения иллюстрируется следующими примерами.
Методика получения гликопептидов ГК (IIa-g)
А) К раствору 1 ммоль глицирризиновой кислоты в 20 мл тетрагидрофурана или диоксана при 0-+5°C прибавляли 3.0-3.5 ммоль N-гидроксибензотриазола, 3.0-3.5 ммоль N,N'-дициклогексилкарбодиимида и перемешивали смесь при 0-+5°C 1 ч, при комнатной температуре (20-22°C) 5-6 ч. Отфильтровывали осадок дициклогексилмочевины, фильтрат (раствор А) использовали далее в реакции с аминокислотами.
Б) К раствору 1 ммоль глицирризиновой кислоты в 20 мл тетрагидрофурана или диоксана при 0-+5°C прибавляли 4.0-5.0 ммоль N-гидроксисукцинимида, 3.0-3.5 ммоль N,N'-дициклогексилкарбодиимида и перемешивали смесь при 0-+5°C 1 ч, при 20-22°C 5-6 ч. Отфильтровывали осадок дициклогексилмочевины, фильтрат (раствор Б) использовали далее в реакции с аминокислотами.
В) Готовили раствор аминокислоты (4.0-5.0 ммоль) в смеси 10 мл 1N водного раствора NaOH и 10 мл диметилформамида при 0-+5°C (раствор В). К полученному раствору B прибавляли постепенно раствор A или раствор Б при перемешивании и охлаждении (0-+5°C), выдерживали реакционную смесь 24 ч при 20-22°C с периодическим перемешиванием. Разбавляли смесь холодной водой, подкисляли 5% соляной кислотой до рН 2-3, осадок отфильтровывали, промывали водой и сушили. Выходы целевых продуктов составили 80-100%. Для получения аналитически чистых образцов для ЯМР часть продуктов хроматографировали на колонке с СГ, элюируя смесью хлороформа-метанола-воды, 300:10:1, 200:10:1, 100:10:1, 50:10:1 (v/v).
3-О-{2-О-[-N-(β-глюкопиранозилуроноил)-L-фенилаланин]-N-(β-D-глюкопиранозилуроноил)-L-фенилаланин}-(3β,20β)-11-оксо-30-(N-карбонил-L-фенилаланин)-30-норолеан-12-ен (IIа).
А) Получен по методике из 0.82 г (1 ммоль) ГК, 0.48 г (3.5 ммоль) N-гидроксибензотриазола, 0.72 г (3.5 ммоль) N,N'-дициклогексилмочевины, 0.82 г (5.0 ммоль) L-фенилаланина. Выход 1.26 г (100%). Для получения аналитически чистого образца часть продукта хроматографировали на колонке с СГ, как описано выше. ИК-спектр, ν, см-1: 3600-3200 (ОН, NH), 1724 (COOH), 1655 (С=O), 1540 (CONH), 1500 (Ph). Спектр ЯМР 13С (Py-d5), δ, м.д.: 40.3 (C1), 27.6 (С2), 90.6 (С3), 40.6 (С4), 56.5 (С5), 18.5 (С6), 33.9 (С7), 46.7 (С8), 63.1 (С9), 38.0 (С10), 202.7 (С11), 129.6 (С12), 171.3 (С13), 44.3 (С14), 27.4 (С15, С16), 32.8 (С17), 48.2 (С18), 42.6 (С19), 44.5 (С20), 32.1 (С21), 38.4 (С22), 28.4 (С23), 17.0 (С24), 17.3 (С25), 19.4 (С26), 23.8 (С27), 29.0 (С28), 29.3 (С29), 175.1 (С30), 104.7 (С1'), 81.3 (С2'), 75.9 (С3'), 73.6 (С4'), 77.3 (С5'), 171.3 (С6'), 104.8 (С1''), 75.2 (С2''), 76.0 (С3''), 73.5 (С4''), 77.9(С5''), 171.6 (C6''); Phe: 174.1, 172.6, 172.5, 138.9-127.8,54.9, 54.6, 54.4, 37.9, 37.8, 37.2. Найдено, %: N 3.3. C69H89O19N3. Вычислено, %: N 3.3. М.в. 1264.6.
Б) Получен по методике из 0.82 г (1 ммоль) ГК, 0.46 г (4.0 ммоль) N-гидроксисукцинимида, 0.62 г (3 ммоль) N,N'-дициклогексилкарбодиимида, 0.82 г (5.0 ммоль) L-фенилаланина. Выход 1.07 г (85%).
3-О-{2-O-[N-O[N-(β-D-глюкопиранозилуроноил)-L-тирозин]-N-(β-D-глюкопиранозилуроноил)-L-тирозин}-(3β,20β)-11-оксо-30-(N-карбонил-L-тирозин)-30-норолеан-12-ен (IIb).
А) Получен по методике из 0.82 г (1 ммоль) ГК, 0.48 г (3.5 ммоль) N-гидроксибензотриазола, 0.72 г (3.5 ммоль) N,N'-дициклогексилкарбодиимида, 0.90 г (5.0 моль) L-тирозина. Выход 1.31 г (100%). Для получения аналитически чистого образца часть продукта хроматографировали как описано выше. ИК-спектр, ν, см-1: 3600-3200 (ОН, NH); 1720 (COOH); 1630 (С=O); 1570 (CONH); 1515 (Ph). Спектр ЯМР 13С (CD3OD, δ, м.д.): 40.3 (С1); 27.6 (С2); 90.8 (С3); 40.6 (С4); 56.4 (С5); 18.4 (С6); 33.9 (С7); 46.7 (С8); 63.1 (С9); 37.9 (С10); 202.8 (С11); 129.8 (С12); 171.3 (С13); 44.5 (С14); 27.4 (С15); 28.5 (С16); 33.0 (С17); 48.2 (С18); 42.5 (С19); 44.7 (С20); 38.1 (С22), 29.0 (С23); 17.0 (С24); 17.3 (С25); 19.3 (С26); 23.8 (С27); 29.2 (С28); 29.3 (С29); 175.2 (С30); 104.6 (С1'); 81.4 (С2'); 76.0 (С3', С3''); 73.5 (С4'); 77.2 (С5'); 171.4 (С6', С6''); 104.9 (С1''); 75.9 (С2''); 73.6 (С4''); 77.9 (С5''); Tyr: 173.2; 173.1; 172.2; 157.7, 157.4, 157.2, 131.6-131.2, 117.0, 116.5, 116.4, 55.3, 54.8. Найдено, %: N 3.1. C69H89N3O22. Вычислено, %: N 3.2. М.в. 1312.4.
Б) Получен по методике из 0.82 г (1 ммоль) ГК, 0.57 г (5.0 ммоль) N-гидроксисукцинимида, 0.72 г (3.5 ммоль) N,N'-дициклогексилкарбодиимида, 0.90 г (5.0 ммоль) L-тирозина. Выход 1.24 г (95%).
3-О-{2-O-[N-(β-D-глюкопиранозилуроноил)-L-лейцин]-N-(β-D-глюкoпиpaнoзилypoнoил)-L-лeйцин}-(3β,20β)-11-oкco-30-(N-кapбoнил-L-лeйцин)-30-норолеан-12-ен (IIс).
А) Получен по методике из 0.82 г (1 ммоль) ГК, 0.48 г (3.5 ммоль) N-гидроксибензотриазола, 0.72 г (3.5 ммоль) N,N'-дициклогексилкарбодиимида, 0.65 г (5.0 моль) L-лейцина. Выход 1.10 г (95%). ИК-спектр, ν, см-1: 3600-3200 (ОН, NH), 1720 (COOH), 1660 (С=O), 1540 (CONH). Спектр ЯМР 13С (CD3OD, δ, м.д.): 40.7 (С1), 28.4 (С2), 90.7 (С3), 40.9 (С4), 56.5 (С5), 18.7 (С6), 34.1 (С7), 46.0 (С8), 63.4 (С9), 38.4 (С10), 202.8 (С11), 129.2 (С12), 171.5 (С13), 44.9 (С14), 27.6 (С15), 27.9 (С16), 33.2 (С17), 47.0 (С18), 42.7 (С19), 45.2 (С20), 32.3 (С21), 39.3 (С22), 28.7 (С23), 17.4 (С24), 17.6 (С25), 19.6 (С26), 24.2 (С27), 29.0 (С28), 29.5 (С29), 175.9 (С30), 105.2 (C'), 82.0 (С2'), 76.2 (С3'), 73.9 (С4'), 77.4 (С5'), 171.8 (С6'), 105.3 (С1''), 75.5 (С2''), 75.9 (С3''), 73.3 (С4''), 77.6 (С5''), 173.0 (С6''); Leu: 173.3, 173.2, 173.1, 52.3, 52.2, 52.1, 40.9, 40.8, 40.6, 23.7, 23.4, 22.5, 22.3, 21.0. Найдено, %: N 3.4 C72H96N3O20. Вычислено, %: N 3.6. М.в. 1162.4.
Б) Получен по методике (пример 2) из 0.82 г (1 ммоль) ГК, 0.57 г (5 ммоль) N-гидроксисукцинимида, 0.72 г (3.5 ммоль) N,N'-дициклогексилкарбодиимида, 0.65 г (5.0 ммоль) L-лейцина. Выход 1.05 г (90%).
3-О-{2-O-[N-(β-D-глюкопиранозилуроноил)-L-изолейцин]-N-(β-D-глюкoпиpaнoзилypoнoил)-L-изoлeйцин}-(3β,20β)-11-oкco-30-(N-кapбoнил-L-изолейцин)-30-норолеан-12-ен (IId).
А) Получен по методике из 0.82 г (1 ммоль) ГК, 0.5 г (3.5 ммоль) N-гидроксибензотриазола, 0.6 г (3 ммоль) N,N'-дициклогексилкарбодиимида, 0.65 г (5.0 моль) L-изолейцина. Выход 1.0 г (86%). ИК-спектр, см-1: 3600-3200 (ОН, NH); 1720 (COOH); 1660 (С11=O); 1530 (CONH). Спектр ЯМР 13С (CD3OD), δ, м.д.: 40.3 (С1), 27.6 (С2), 90.3 (С3), 40.7 (С4), 56.4 (С5), 18.5 (С6), 33.8 (С7), 46.8 (С8), 63.2 (С9), 38.1 (С10), 202.7 (С11), 129.3 (С12), 171.3 (С13), 44.6 (С14), 27.4 (С15, С16), 33.0 (С17), 48.2 (С18), 42.5 (С19), 44.9 (С20), 32.0 (С21), 38.7 (С22), 28.4 (С23), 17.0 (С24), 17.3 (С25), 19.4 (С26), 23.9 (С27), 28.8 (С28), 29.2 (С 29), 175.0 (С30), 104.9 (С1'), 81.7 (С2'), 76.3 (С3'), 73.4 (С4'), 77.3 (С5'), 171.4 (С6'), 105.0 (C1''), 75.2 (С2''), 76.0 (С3''), 73.6 (С4''), 77.7 (С5''), 171.6 (С6''); Ile: 174.5, 174.4, 172.9, 57.9, 57.8, 57.7, 39.0, 38.9, 38.7, 26.5, 26.2, 26.1, 16.1, 16.0, 12.1, 12.0, 11.8. Найдено, %: N 3.3. C60H95N3O19. Вычислено, %: N 3.6. М.в. 1162.4.
Б) Получен по методике из 0.82 г (1 ммоль) ГК, 0.46 г (4.0 ммоль) N-гидроксисукцинимида, 0.62 г (3.0 ммоль) N,N'-дициклогексилкарбодиимида, 0.52 г (4.0 ммоль) L-изолейцина. Выход 0.95 г (82%).
3-O-{2-O-[N-(β-D-глюкопиранозилуроноил)-L-метионин]-N-(β-D-глюкoпиpaнoзилypoнoил)-L-мeтиoнин}-(3β,20β)-11-oкco-30-(N-кapбoнил-L-метионин)-30-норолеан-12-ен (IIе).
А) Получен по методике из 0.82 г (1 ммоль) ГК, 0.42 г (3.0 ммоль) N-гидроксибензотриазола, 0.62 г (3.0 ммоль) N,N'-дициклогексилкарбодиимида, 0.60 г (4.0 моль) L-метионина. Выход 0.98 г (82%). ИК-спектр, см-1: 3600-3200 (ОН, NH); 1720 (COOH); 1655 (С11=O); 1550 (CONH). Спектр ЯМР 13С (CD3OD), δ, м.д.: 40.2 (С1), 27.6 (С2), 90.6 (С3), 40.6 (С4), 56.3 (С5), 18.3 (С6), 33.7 (С7), 46.7 (С8), 63.0 (С9), 37.9 (С10), 202.5 (С11), 129.1 (С12), 171.4 (С13), 44.4 (С14), 27.4 (С15), 28.4 (С16), 32.8 (С17), 48.1 (С18), 42.4 (С19), 44.7 (С20), 32.5 (С21), 38.6 (С22), 28.8 (С23), 17.0 (С24), 17.3 (С25), 19.3 (С26), 23.8 (С27), 29.1 (С28), 29.3 (С29), 177.4 (С30), 104.7 (С1'), 80.8 (С2'), 75.8 (С3'), 73.4 (С4'), 77.0 (С5'), 172.5 (С6'), 104.8 (С1''), 75.9 (С2''), 76.1 (С3''), 73.3 (С4''), 77.5 (С5''), 172.6 (С6''); Met: 175.0, 173.1, 173.0, 52.9, 52.7, 52.6, 31.9, 31.7, 31.4, 31.3, 31.0, 30.6, 17.0, 16.9, 15.4. Найдено, %: N 3.4; S 7.8. C57H86O19N3S3. Вычислено, %: N 3.5; S 8.0. М.в. 1201.4.
Б) Получен по методике (пример 2) из 0.82 г (1 ммоль) ГК, 0.46 г (4.0 ммоль) N-гидроксисукцинимида, 0.62 г (3.0 ммоль) N,N'-дициклогексилкарбодиимида, 0.6 г (4.0 ммоль) L-метионина. Выход 0.96 г (80%).
3-О-{2-O-[N-(β-D-глюкопиранозилуроноил)-L-валин]-N-(β-D-глюкoпиpaнoзилypoнoил)-L-вaлин}-(3β,20β)-11-oкco-30-(N-кapбoнил-L-вaлин)-30-норолеан-12-ен (IIf).
А) Получен по методике из 0.82 г (1 ммоль) ГК, 0.48 г (3.5 ммоль) N-гидроксибензотриазола, 0.72 г (3.5 ммоль) N,N'-дициклогексилкарбодиимида, 0.58 г (5.0 моль) L-валина. Выход 1.0 г (89%). ИК-спектр, см-1: 3600-3200 (ОН, NH); 1710 (COOH); 1660 (С11=O); 1540 (CONH). Спектр ЯМР 13С (CD3OD), δ, м.д.: 40.4 (С1), 27.9 (С2), 90.3 (С3), 40.7 (С4), 56.5 (С5), 18.2 (С6), 33.9 (С7), 46.8 (С8), 63.2 (С9), 38.2 (С10), 202.7 (С11), 129.2 (С12), 171.6 (С13), 44.6 (С14), 27.5 (С15), 28.7 (С16), 33.0 (С17), 48.2 (С18), 42.8 (С19), 44.7 (С20), 32.1 (С21), 38.8 (С22), 28.8 (С23), 17.0 (С24), 17.3 (С25), 19.4 (С26), 23.8 (С27), 29.1 (С28), 29.4 (С29), 177.6 (С30), 104.8 (С1'), 81.7 (С2'), 76.4 (С3'), 73.8 (С4'), 77.4 (С5'), 171.7 (С6'), 105.0 (С1''), 75.2 (С2''), 76.1 (С3''), 73.8 (С4''), 77.8 (С5''), 172.4 (С6''); Val: 174.9, 174.2, 172.8, 59.0, 58.9, 58.4, 32.2, 32.1, 31.8, 19.8, 19.6, 19.5, 18.7, 18.5, 18.0. Найдено, %: N 3.5. C57H89N3O19. Вычислено, %: N 3.8. М.в. 1120.3.
Б) Получен по методике из 0.82 г (1 ммоль) ГК, 0.46 г (4.0 ммоль) N-гидроксисукцинимида, 0.62 г (3.0 моль) N,N'-дициклогексилкарбодиимида, 0.58 г (5.0 ммоль) L-валина. Выход 0.90 г (80%).
3-О-{2-O-[N-(β-D-глюкопиранозилуроноил)-L-цистеин-8-бензил]-N-(β-D-глюкопиранозилуроноил)-L-цистеин-8-бензилн}-(3β,20β)-11-оксо-30-(N-карбонил-L-цистеин-S-бензил)-30-норолеан-12-ен (IIg).
А) Получен по методике из 0.82 г (1 ммоль) ГК, 0.48 г (3.5 ммоль) N-гидроксибензотриазола, 0.72 г (3.5 ммоль) N,N'-дициклогексилкарбодиимида, 0.6 г (5.0 моль) S-бензил-L-цистеина. Выход 1.15 г (82%), ИК-спектр, см-11: 3600-3200 (ОН, NH); 1710 (COOH); 1670 (С11=O); 1550 (CONH), 1510 (С6Н5). Спектр ЯМР 13С (ацетон-d6), δ, м.д.: 38.4 (С1), 27.6 (С2), 88.1 (С3), 38.8 (С4), 54.3 (С5), 16.6 (С6), 32.2 (С7), 45.7 (С8), 61.0 (С9), 36.0 (С10), 199.0 (С11), 127.7 (С12), 170.7 (С13), 44.5 (С14), 27.3 (С15), 28.3 (С16), 32.2 (С17), 47.8 (С18), 42.8 (С19), 44.6 (С20), 31.9 (С21), 38.4 (С22), 28.8 (С23), 15.5 (С24), 15.7 (С25), 17.7 (С26), 22.4 (С27), 29.0 (С28), 29.4 (С29), 177.2 (С30), 102.9 (С1'), 80.1 (С2'), 74.1 (С3'), 72.6 (С4'), 75.3 (С5'), 169.6 (С6'), 103.2 (С1''), 74.8 (С2''), 73.7 (С3''), 71.7 (С4''), 75.3 (С5''), 170.0 (С6''); L-Cys (SBn): 173.0, 172.4, 172.1, 130.0 127.3, 51.3, 50.8, 50.5, 35.5, 35.3. Найдено, %: N 2.8, S 6.7. С57Н89N3О19. Вычислено, %: N 3.0, S 6.8. М.в. 1402.7.
Б) Получен по методике (пример 2) из 0.82 г (1 ммоль) ГК, 0.46 г (4.0 ммоль) N-гидроксисукцинимида, 0.62 г (3.0 ммоль) N,N'-дициклогексилкарбодиимида, 0.6 г (5.0 ммоль) S-бензил-L-цистеина. Выход 1.12 г (80%), после переосаждения из метанола-эфиром - 60%.
Работа выполнена при финансовой поддержке РНФ (грант 14-03-01307).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КАРБОКСИЗАЩИЩЕННЫХ ГЛИКОПЕПТИДОВ ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ | 2014 |
|
RU2572785C1 |
| Применение конъюгатов глицирризиновой кислоты с аминокислотами в качестве ингибиторов флавивирусов Денге 2 и Зика | 2020 |
|
RU2818911C2 |
| ГЛИКОПЕПТИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С L-ПРОЛИНОМ, СТИМУЛИРУЮЩИЙ ГУМОРАЛЬНЫЙ ИММУННЫЙ ОТВЕТ | 2005 |
|
RU2303601C2 |
| ДИГЛИКОПЕПТИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С МЕТИЛОВЫМ ЭФИРОМ L-ВАЛИНА, СТИМУЛИРУЮЩИЙ ПЕРВИЧНЫЙ ИММУННЫЙ ОТВЕТ | 2003 |
|
RU2238944C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРИТЕРПЕНОВЫХ ГЛИКОПЕПТИДОВ | 1994 |
|
RU2083587C1 |
| ГЛИКОПЕПТИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С ГЛИЦИЛ-L-ФЕНИЛАЛАНИНОМ, ПРОЯВЛЯЮЩИЙ АНТИ-ВИЧ-1 АКТИВНОСТЬ | 2006 |
|
RU2315058C1 |
| ГЛИКОПЕПТИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С S-БЕНЗИЛ-L-ЦИСТЕИНОМ, ПРОЯВЛЯЮЩИЙ АНТИ-ВИЧ АКТИВНОСТЬ | 2001 |
|
RU2198177C2 |
| СРЕДСТВО, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ АМИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С 5-АМИНОУРАЦИЛОМ, ПРОЯВЛЯЮЩЕЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ В ОТНОШЕНИИ ВИРУСА ГРИППА A/H1N1 | 2014 |
|
RU2568849C9 |
| ГЛИКОПЕПТИД β-ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С ДИБУТИЛОВЫМ ЭФИРОМ L-ГЛУТАМИНОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И ПРОТИВОЯЗВЕННУЮ АКТИВНОСТЬ | 1991 |
|
RU2024548C1 |
| Способ получения гликопептидов глицирризиновой кислоты | 1988 |
|
SU1625882A1 |
Изобретение относится к способу получения гликопептидов тритерпенового гликозида - глицирризиновой кислоты общей формулы (lIa-g)
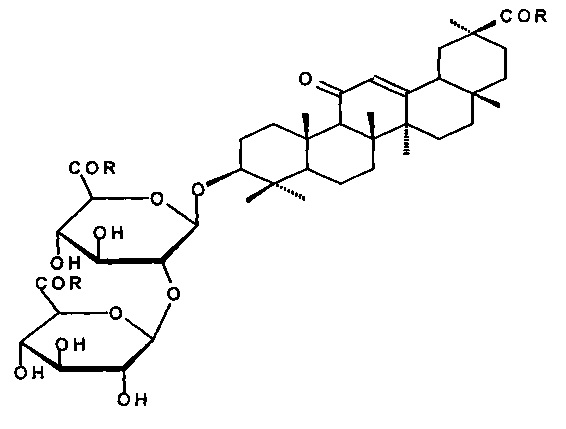
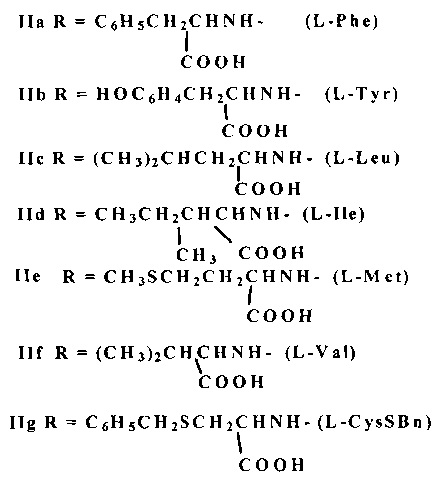
В предложенном способе продукт получают из глицирризиновой кислоты (ГК) без предварительной защиты гидроксильных групп углеводной части молекулы, превращая ее в активированный трис-оксибензотриазольный эфир с помощью N-гидрооксибензотриазола (HOBu) и N,N'-дициклогексилкарбодиимида (DCC) или трис-оксисукцинимидный эфир с помощью N-гидроксисукцинимида (HOSu) и DCC в среде тетрагидрофурана или диоксана при 0-+5°C 1 ч, 20-22°C - 24 ч, затем образующийся активированный эфир вводят в реакцию с аминокислотой (АК) (L-фенилаланин, L-тирозин, L-лейцин, L-изолейцин, L-метионин, L-валин, S-бензил-L-цистеин) в растворе 1N водного раствора гидроокиси натрия и N,N'-диметилформамида при мольном соотношении реагентов ГК/HOBt/DCC/AK, равном 1/3.0-3.5/3.0-3.5/4-5, или ГК/HOSu/DCC/AK=1/4-5/3.0-3.5/4-5. Предложен новый эффективный способ, позволяющий получить ценные вещества с высокими выходами. 3 з.п. ф-лы, 7 пр.
1. Способ получения гликопептидов глицирризиновой кислоты общей формулы (IIa-g)
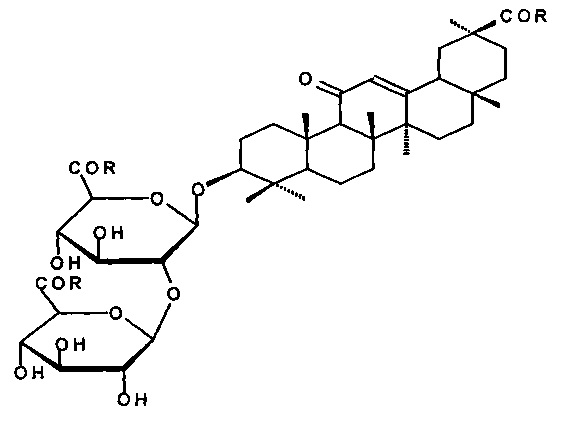
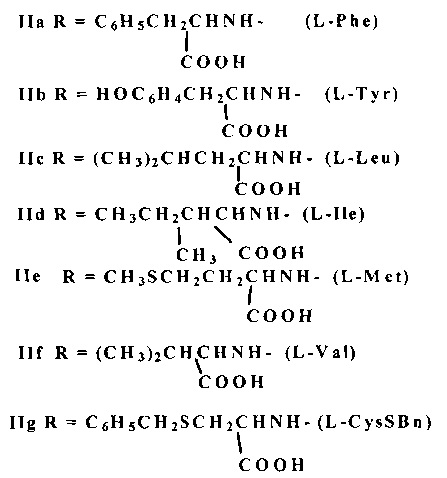
путем обработки глицирризиновой кислоты (ГК) N-гидроксибензотриазолом (HOBt) и N,N-дициклогексилкарбодиимидом (DCC) или N-гидроксисукцинимидом (HOSu) и N,N'-дициклогексилкарбодиимидом (DCC) в среде тетрагидрофурана или диоксана при температуре 0-+5°С в течение 1 ч, затем при комнатной температуре с последующим отделением осадка N,N'-дициклогексилмочевины и получением раствора активированного трис-оксибензотриазольного или активированного трис-оксисукцинимидного эфира, отличающийся тем, что соотношение ГК/HOBt/DCC составляет 1/3.0-3.5/3.0-3.5 ммоль, соотношение ГК/HOSu/DCC составляет 1/4.0-5.0/3.0-3.5 ммоль, реакционную смесь выдерживают при комнатной температуре (20-22°С) при перемешивании в течение 5-6 ч, раствор активированного трис-оксибензотриазольного эфира или активированного трис-оксисукцинимидного эфира добавляется постепенно к раствору аминокислоты в смеси 1 N водного раствора гидроокиси натрия и N,N'-диметилформамида при 0-+5°С, реакционную смесь выдерживают с периодическим перемешиванием при температуре 20-22°С в течение 24 ч, затем разбавляют холодной водой, подкисляют 5% соляной кислотой до рН ~2-3, полученный осадок отфильтровывают, промывают водой и сушат.
2. Способ по п. 1, отличающийся тем, что в качестве аминокислот используют L-фенилаланин, L-тирозин, L-лейцин, L-изолейцин, L-метионин, L-валин, S-бензил-L-цистеин.
3. Способ по пп. 1, 2, отличающийся тем, что концентрация аминокислот составляет 4.0-5.0 ммоль.
4. Способ по п. 1, отличающийся тем, что смесь 1N водного раствора гидроокиси натрия и N,N'-диметилформамида берут в соотношении 1:1 (v/v).
| СПОСОБ ПОЛУЧЕНИЯ КАРБОКСИЗАЩИЩЕННЫХ ГЛИКОПЕПТИДОВ ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ | 1992 |
|
RU2057139C1 |
| Способ получения гликопептидов глицирризиновой кислоты | 1988 |
|
SU1625882A1 |
| Рыжова С.А | |||
| и др | |||
| Журнал общей химии, 1966, 66, 1, 160-162 | |||
| Балтина Л.А | |||
| и др | |||
| Биоорганическая химия, 1994, 20, 12, 1365-1973. | |||
Авторы
Даты
2017-04-11—Публикация
2015-11-03—Подача