Изобретение относится к биотехнологии растений и может быть использовано в работах по клеточной и генной инженерии ячменя для повышения морфогенетического потенциала каллусной ткани.
Каллусная культура - неорганизованная пролиферирующая ткань, состоящая из дедифференцированных клеток. При повышении концентрации цитокининов в питательной среде часть каллуса способна переходить к морфогенезу (регенерации), т.е. образованию и дифференцировке органов и тканей, которая происходит за счет процессов деления и дифференциации клеток [Лутова Л.А. Биотехнология высших растений / Л.А. Лутова // Изд-во СПб-университета, 2010. - 238 с.]. У ячменя морфогенетический потенциал каллусной ткани реализуется лишь в течение короткого времени (двух-четырех недель), что лимитирует манипуляции in vitro для данной культуры и снижает выход растений-регенерантов, в особенности в работах по генетической трансформации, где увеличивается количество пассажей каллуса и имеют место факторы, дополнительно снижающие регенерационную способность. Это обусловливает необходимость поиска подходов к повышению морфогенетического потенциала в культуре ткани ячменя.
Известен способ получения растений-регенерантов при культивировании каллусной ткани на плотной питательной среде с минеральной основой по Мурасиге и Скугу (МС). Индукция морфогенеза осуществляется путем введения в среду фитогормонов - ауксинов и цитокининов в определенном соотношении, которое обусловлено видом культивируемого злака [Внучкова В.А. Методические указания по индукции каллуса и растений-регенерантов зерновых злаков при культивировании незрелых зерновок / М., 1987. - 22 с.]. Недостатком данного способа является высокая обусловленность выхода растений-регенерантов генотипическими особенностями донорного растения. Для повышения морфогенетической активности каллуса необходимо подбирать оптимальное соотношение фитогормонов практически для каждого генотипа (сорта), что делает процесс чрезмерно трудоемким и мало предсказуемым.
Известен способ стимуляции регенерации в каллусной культуре ячменя путем повышения в МС-среде концентрации ионов меди [Dahleen L.S. Improved plant regeneration from barley cultures callus by increased copper levels // Plant Cell, Tissue and Organ Culture. 1995. V. 43. P. 267-269]. Данный подход способствовал существенному повышению регенерации сорта Hector на среде с концентрацией ионов меди 50 mM и сорта Excel - на среде с концентрацией ионов Cu2+ 5,0 mM. Недостатком способа также является необходимость подбора концентрации ионов Cu2+ для каждого генотипа ячменя, т.к. авторы указывают оптимальную концентрацию меди для конкретного сорта.
Известным способом повышения регенерации растений in vitro является регуляция уровня эндогенного этилена за счет внесения в питательную среду 1-аминоциклопропан 1-карбоксильной кислоты - активатора продукции этилена либо блокирования продукции этилена нитратом серебра [Jha А.K., Dahleen S.L., Suttle J.C. Ethylene influences green plant regeneration from barley callus / Plant Cell Rep, 2007. V. 26. P. 285-290]. Недостатком такого подхода является то, что уровень эндогенного гормона обусловлен генотипом, поэтому одни сорта требуют внесения ингибитора, а другие - активатора продукции этилена. Инструментальное определение уровня этилена для каждого сортообразца затруднительно, поэтому данный способ неудобно применять на практике.
Известен способ стимуляции морфогенеза в культуре каллусной ткани и получения растений-регенерантов путем введения ацетона (10-20 г/л) в состав среды МС для инициации каллуса и формирования регенерантов. Введение ацетона способствует процессу закладки меристематических зон в каллусе пшеницы и увеличению числа растений-регенерантов [Внучкова В.А. Способ получения растений-регенерантов in vitro / Патент РФ №2027757, публикация заявки 27.01.1995, дата приоритета 04.08.1992]. Недостатками данного способа являются легкая воспламеняемость, летучесть и наркотическое действие ацетона, вследствие чего работа с ним должна проводиться в вытяжных шкафах, что осложняет обычный протокол работы с культурой ткани.
Прототипом изобретения является способ стимуляции морфогенеза в культуре ткани ячменя, при котором среду для пролиферации каллуса или среду для индукции морфогенеза готовят полужидкой (4 г/л агара) с добавлением 5 об. % перфтордекалина (ПФД) и культивируют каллус при постоянном встряхивании (180 об/мин) до появления листовых инициалий [Широких И.Г., Бакулина А.В., Баталова Г.А. Индукция морфогенеза в каллусной ткани ячменя // Доклады РАСХН. 2014. №3. С. 6-10]. Погружение каллусной ткани в питательную среду, содержащую ПФД с газотранспортной функцией, способствовало увеличению доли морфогенного каллуса в каллусной культуре ячменя, а также, по данным гистологической оценки каллуса, стимулировало в ней закладку элементов проводящей системы и эпидермы листовой ткани. Однако активизация морфогенетических процессов в присутствии ПФД не привела к существенному увеличению выхода растений-регенерантов ячменя. Причиной тому, по-видимому, явились возникающие в процессе высокой интенсивности встряхивания механические повреждения каллусной ткани.
Задачей изобретения является разработка способа увеличения частоты регенерации в каллусной культуре ячменя на основе ПФД путем снижения механического воздействия на культивируемый каллус.
Поставленная задача решается тем, что культивирование каллуса проводят в полужидкой МС-среде с добавлением ПФД при постоянном встряхивании с интенсивностью перемешивания 125 об/мин.
Сущность изобретения
Перфтордекалин (ПФД, химическая формула - C10F18), ТУ 95-1233 -бесцветная негорючая жидкость без запаха, относящаяся к перфторорганическим соединениям (ПФОС). ПФОС характеризуются высокой химической и биологической устойчивостью, отсутствием токсичности для живых организмов, большой способностью растворять газы (растворяют до 50 об. % кислорода и до 200 об. % углекислого газа) и модифицировать мембраны клеток, облегчая транспорт веществ через них [Иваницкий Г.Р. Биофизика на пороге нового тысячелетия: перфторуглеродные среды и газотранспортные кровезаменители. / Биофизика. 2001. №1. С. 5-33]. Благодаря уникальным свойствам ПФОС были использованы в качестве газотранспортных элементов при глубинном культивировании микроорганизмов [Пименов Е.В., Бакулин М.К., Плетнева А.Ю., Грудцина А.С. Способ культивирования клеток микроорганизмов // Патент РФ №2005139679. Публикация заявки 27.06.2007, дата приоритета 19.12.2005]. Добавление ПФОС и, в частности, перфтордекалина способствовало ускорению роста, увеличению биомассы, интенсификации процессов биосинтеза у различных групп прокариот и некоторых эукариот (простейшие и микромицеты) [Бакулин М.К., Дармова С.В., Бакулин В.М. Теория и практика использования перфторуглеродов «голубой крови» при глубинном культивировании биодеструкторов / Теоретическая и прикладная экология. 2010. №4. С. 4-8].
В изобретении погружение каллусов в полужидкую среду с добавлением ПФД стимулируют процессы морфогенеза в каллусной ткани за счет газотранспортной функции ПФД, увеличения площади соприкосновения со средой и возрастания диффузии в клетки компонентов питательной среды и уменьшения механического повреждения каллуса посредством снижения интенсивности встряхивания. В сравнении с прототипом способ позволяет стимулировать морфогенез в каллусе ячменя не только на уровне его гистологического строения (стимуляция закладки в каллусе меристематических зон), но и обеспечивает достоверное увеличение частоты регенерации.
Условиями достижения технического эффекта является использование ПФД в концентрации не более 5% от объема питательной среды. При внесении ПФД в полужидкую (4 г/л агара) среду культивирование следует проводить при постоянном встряхивании (125 об/мин) в течение 2-3 недель до появления листовых инициалий.
Технический эффект изобретения заключается в увеличении выхода растений-регенерантов за счет интенсификации закладки в каллусной ткани ячменя меристематических зон.
Описание изобретения
С целью увеличения выхода растений-регенерантов каллусную ткань ячменя, индуцированную на среде МС в присутствии 2 мг/л дихлорфеноксиуксусной кислоты (2,4-Д), культивируют в МС-среде со сниженной концентрацией агара (4 г/л) и модифицированной добавлением ПФД с фитогормональным составом, зависящим от возраста каллуса. Для каллуса в возрасте 2-3 недель в среду МС вносят 1 мг/л 2,4-Д (среда для пролиферации каллуса), для каллуса в возрасте 6-7 недель - 1 мг/л кинетина, 0,5 мг/л нафтил- или индолилуксусной кислоты, 0,1 мг/л гибберелловой кислоты (среда для индукции морфогенеза). Нестерильную среду разливают в культивационные сосуды (пробирки или колбы) и в каждый вносят ПФД из расчета 5% от объема МС-среды. Стерилизуют среду 25 мин автоклавированием при давлении насыщенного пара 0,11 МПа. Стерильную питательную среду используют для культивирования каллуса. Каллусную ткань погружают в МС-среду, при этом ПФД оседает на дне культивационных сосудов, поэтому перед помещением на шейкер их встряхивают, чтобы пузырьки ПФД равномерно распределились в толще среды. Каллусные культуры выращивают в течение 2-3 недель до появления листовых инициалей при непрерывном встряхивании (125 об/мин), температуре 20±2 / 16±2°С (день / ночь), освещенности 4000 лк, продолжительности фотопериода 16 ч. Для регенерации растений каллусную ткань переносят на плотную МС-среду (7 г/л агара).
Возможность осуществления изобретения показана следующими примерами.
Пример 1, демонстрирующий повышение количества меристематических зон в каллусе ячменя при добавлении ПФД.
Каллусную ткань ячменя со сниженной регенерационной способностью (использовали каллусные линии после 30 дней культивирования на среде с антибиотиками, возраст каллуса 7 недель) помещали в пробирки с полужидкой МС-средой, содержащей 1 мг/л кинетина, 0,5 мг/л индолилуксусной кислоты (ИУК), 0,1 мг/л гибберелловой кислоты (ГК) и ПФД в количестве 5 об. %. Через 3 недели культивирования каллус микроскопировали, определяя частоту встречаемости различных гистологических структур и некрозов в каллусе ячменя в контроле и при добавлении ПФД (табл. 1). Статистическую обработку данных микроскопии проводили стандартными методами [Урбах В.Ю. Биометрические методы / М.: Наука, 1964. 415 с.] с использованием пакета программ Microsoft Excel 2007.
Таблица 1. Частоты встречаемости (%) гистологических структур и некрозов в каллусе разных генотипов ячменя в зависимости от добавления ПФД в питательную среду
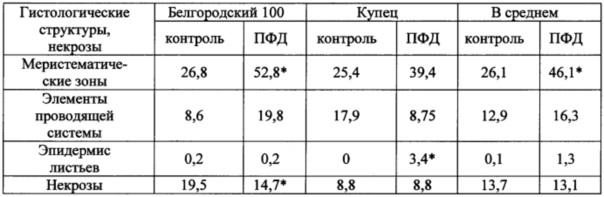
*Достоверные отличия от контроля при α=0,05
Основным положительным эффектом добавления ПФД в питательную среду для регенерации каллуса ячменя явилось увеличение закладки меристематических зон. Частота встречаемости меристематических клеток у генотипа Белгородский 100 увеличилась в сравнении с контролем на 26,0%, у генотипа Купец - на 14,0%. У сорта Купец добавление ПФД приводило также к достоверному увеличению частоты встречаемости эпидермиса листьев. Наряду с увеличением морфогенетической активности, ПФД способствовал уменьшению некротизации каллуса у сорта Белгородский 100. Таким образом, гистологическая оценка каллусной ткани ячменя после воздействия ПФД (5 об. %) подтвердила наличие в ней изменений, способствующих повышению морфогенетического потенциала каллуса.
Пример 2, демонстрирующий увеличение частоты регенерации в каллусной ткани ячменя в результате добавления в среду ПФД на стадии пролиферации.
Каллусную ткань двух генотипов ячменя в возрасте 2-3 недель пассировали в полужидкую МС-среду, содержащую 1 мг/л 2,4-Д и ПФД в количестве 5 об. %, и культивировали на шейкере (125 об/мин) в течение 3 недель. Для индукции морфогенеза каллус переносили на плотную МС-среду с 1 мг/л кинетина, 0,5 мг/л ИУК, 0,1 мг/л ГК. По окончании культивирования определяли частоту регенерации в каллусной культуре (табл. 2).
Таблица 2. Увеличение частоты регенерации (%) у двух генотипов ячменя при добавлении ПФД (5 об. %) в среду для пролиферации каллуса

У обоих исследованных сортов в среде с добавлением ПФД, при выращивании каллуса на шейкере (125 об/мин), на этапе морфогенеза происходило увеличение частоты регенерации в сравнении с каллусом, выращенным в контрольных условиях.
Пример 3, демонстрирующий стимуляцию регенерационной способности каллусной культуры ячменя в результате добавления ПФД на стадии морфогенеза.
Каллусную ткань ячменя, полученную по стандартной схеме культивирования, на стадии морфогенеза переносили в полужидкую МС-среду с 1 мг/л кинетина, 0,5 мг/л ИУК, 0,1 мг/л ГК и ПФД в количестве 2 и 5 об. %. После двух недель глубинного культивирования каллус пересаживали на плотную МС-среду того же гормонального состава, по окончании культивирования учитывали выход растений-регенерантов (табл. 3).
Таблица 3. Влияние ПФД на выход растений-регенерантов и частоту регенерации каллуса ячменя
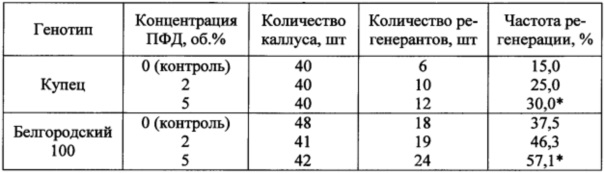
*Достоверные отличия от контроля при α=0,05
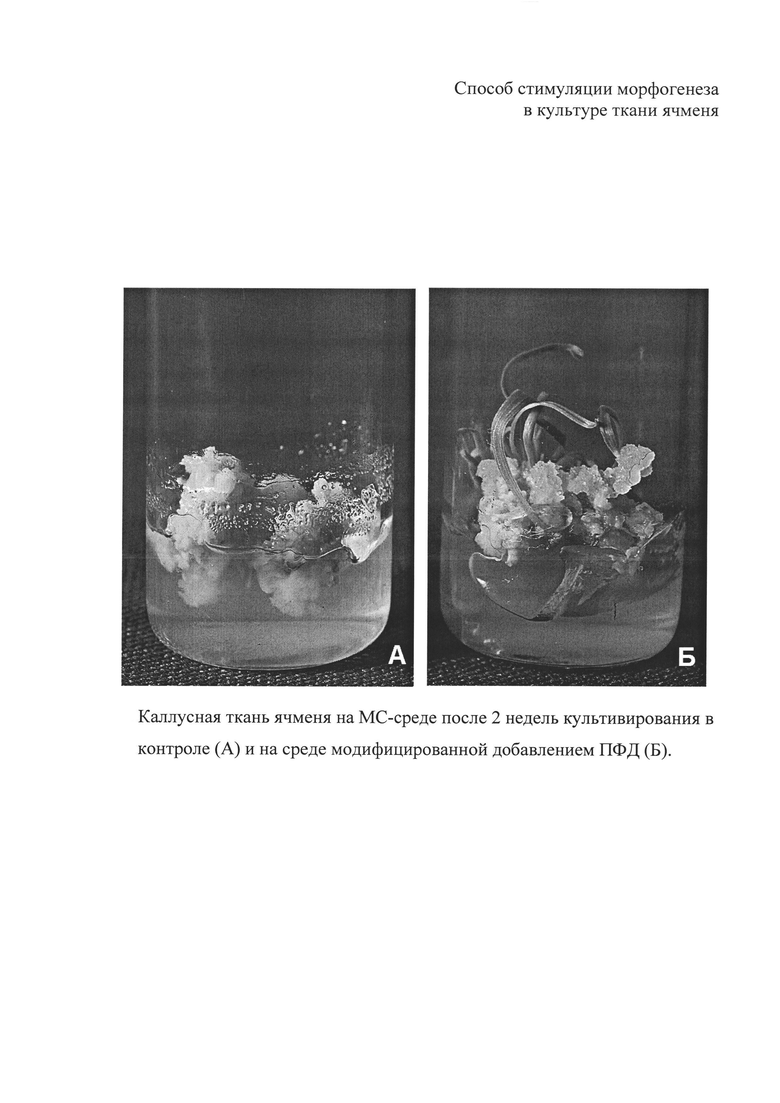
Способ поясняется чертежом (А, Б).
Добавление в полужидкую среду для морфогенеза ПФД и культивирование каллуса на шейкере (125 об/мин) способствовало повышению частоты регенерации у исследованных генотипов ячменя. Достоверные отличия от контроля обеспечила концентрация ПФД 5 об. %. На чертеже (Б) показан общий вид формирующегося в каллусной ткани растения-регенеранта.
Таким образом, приведенные примеры показывают, что предлагаемый способ стимуляции морфогенеза в каллусной культуре ячменя с использованием ПФД 5 об. % при постоянном встряхивании (125 об/мин) усиливает закладку меристематических зон, повышает морфогенетический потенциал у культур со сниженной регенерационной способностью, увеличивает выход растений-регенерантов в каллусной ткани ячменя.
.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РЕГЕНЕРАЦИИ РАСТЕНИЙ КЛЕВЕРА ЛУГОВОГО ПРИ ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ | 2005 |
|
RU2305931C2 |
| Способ регуляции морфогенетической активности каллусной ткани лекарственных растений in vitro | 2022 |
|
RU2798292C1 |
| Способ размножения гречихи IN VIтRо | 1988 |
|
SU1704715A1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ - РЕГЕНЕРАНТОВ IN VITRO | 1992 |
|
RU2027757C1 |
| СПОСОБ РЕГЕНЕРАЦИИ РАСТЕНИЙ СОРГО В КУЛЬТУРЕ IN VITRO | 1999 |
|
RU2175189C2 |
| Способ получения растений-регенерантов НоRDеUм VULGaRe, устойчивых к токсическому действию AI @ в кислой среде | 1988 |
|
SU1546483A1 |
| Способ получения регенерантов подсолнечника в культуре соматических клеток | 1990 |
|
SU1720596A1 |
| Способ получения растений картофеля в культуре тканей | 1983 |
|
SU1276308A1 |
| Способ регенерации растений из пыльников вишне-черешневых гибридов | 1989 |
|
SU1708211A1 |
| СПОСОБ ПОЛУЧЕНИЯ IN VITRO СЕЛЕКЦИОННОЙ ПОПУЛЯЦИИ РЕГЕНЕРАНТОВ ПРИ САМОКЛОНАЛЬНОМ СОРТОУЛУЧШЕНИИ КАРТОФЕЛЯ | 1992 |
|
RU2080779C1 |
Изобретение относится к биотехнологии. Изобретение представляет собой способ стимуляции морфогенеза в культуре ткани ячменя, включающий получение каллуса на плотной среде Мурасиге-Скуга, содержащей 2 мг/л дихлорфеноксиуксусной кислоты; его пассирование для пролиферации на среду с 1 мг/л дихлорфеноксиуксусной кислоты, а через три недели - для индукции морфогенеза - пассирование на среду с 1 мг/л кинетина, 0,5 мг/л индолилуксусной кислоты, 0,1 мг/л гибберелловой кислоты, при этом одну из сред (для пролиферации каллуса или индукции морфогенеза) готовят не плотной, а полужидкой (4 г/л агара) с добавлением 5 об. % перфтордекалина; культивирование каллуса в полужидкой среде при постоянном встряхивании (125 об/мин) в течение 2-3 недель до появления листовых инициалий и последующую регенерацию растений на плотной среде. Изобретение позволяет увеличить выход растений-регенерантов ячменя за счет стимуляции закладки меристематических зон в каллусной ткани и повышения морфогенетического потенциала в каллусных линиях со сниженной регенерационной способностью. 1 ил., 3 табл., 3 пр.
Способ стимуляции морфогенеза в культуре ткани ячменя, включающий получение каллуса на плотной среде Мурасиге-Скуга, содержащей 2 мг/л дихлорфеноксиуксусной кислоты; его пассирование для пролиферации на среду с 1 мг/л дихлорфеноксиуксусной кислоты, а через три недели - для индукции морфогенеза - пассирование на среду с 1 мг/л кинетина, 0,5 мг/л индолилуксусной кислоты, 0,1 мг/л гибберелловой кислоты, при этом одну из сред (для пролиферации каллуса или индукции морфогенеза) готовят не плотной, а полужидкой (4 г/л агара) с добавлением 5 об. % перфтордекалина; культивирование каллуса в полужидкой среде при постоянном встряхивании (125 об/мин) в течение 2-3 недель до появления листовых инициалий и последующую регенерацию растений на плотной среде.
| ШИРОКИХ И.Г | |||
| и др | |||
| Индкция морфогенеза в каллусной ткани ячменя | |||
| Доклады Российской Академии сельскохозяйственных наук, номер 3, Май-июнь 2014, с.6-10 | |||
| Щуплецова О.Н | |||
| Совершенствование и применение метода культуры ткани для получения форм ярового ячменя, устойчивых к кислым почвам, автореферат диссертации, Москва, 2003, с | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ДИТЧЕНКО Т.И | |||
| Культура клеток, тканей и органов растений, курс лекций | |||
| Минск, БГУ, 2007, с.33, найдено в Интернет, 14.09.2016, адрес сайта www.bio.bsu.by | |||
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ - РЕГЕНЕРАНТОВ IN VITRO | 1992 |
|
RU2027757C1 |
Авторы
Даты
2017-08-14—Публикация
2015-08-28—Подача