Изобретение относится к органической химии, в частности к синтезу новых ароматических аминопиразолов, обладающих антибактериальными свойствами, которые могут быть использованы в фармакологии для создания новых лекарственных препаратов.
Известно, что пиразолы - это соединения, представляющее большой практический интерес, так как их производные являются основой распространенных фармацевтических препаратов (анальгин, антипирин), применяемые как жаропонижающие средства и анальгетики / Данилов, Е.А. Введение в химию и технологию химико-фармацевтических препаратов [Текст] / Е.А. Данилов, М.К. Исляйкин / Иваново: под ред. Г.П. Шапошникова, 2002. - 284 с./.
В то же время известно, что использование лекарственных веществ со спиртовой или карбоксильной группой в виде их сложных или простых эфиров изменяет полярность молекулы и улучшает проявление фармакологической активности / Солдатенков, А.Т. Основы органической химии лекарственных веществ [Текст] / А.Т. Солдатенков. - М.: Мир, 2003. - 191 с./.
Известно получение аминосоединений восстановлением нитрозосоединений подходящими восстановителями / Вейганд, К. Методы эксперимента в органической химии [Текст] в 2 т Т. 2 / К. Вейганд. - М., - Издат. ин. лит, 1952. - С. 241 /; и получение аминопиразолов восстановлением нитрозопиразолов / Любяшкин, А.В. Синтез нафтилзамещенных аминопиразолов [Текст] / А.В. Любяшкин, М.С. Товбис. - Изв. ВУЗов. Химия и химическая технология, 2010. - Т. 4. - С. 3-5 /.
К недостаткам известных аминопиразолов относится их плохая растворимость и затруднение выведения из организма продуктов их метаболизма, поэтому они токсичны для печени и почек, а также вызывают проявление агранулоцитоза / Зарецкий, М.М. Агранулоцитоз: от диагностики к выбору лечебной тактики [Текст] / М.М. Зарецкий, Н.М. Черникова. - Therapia. - №1. - Т. 54. - 2011. - С. 27-29 /.
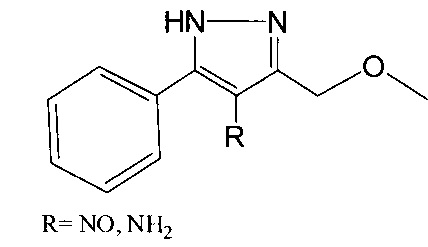
Аминопиразолы, одновременно содержащие метоксиметильный и фенильный заместители, до настоящего времени не были известны. Аналогов получения таких соединений нет.
Изобретение решает задачу получения новых аминопиразолов, содержащих в пиразольном кольце метоксиметильный и фенильный заместители.
Технический результат заключается в получении новых аминопиразолов, содержащих в пиразольном кольце метоксиметильный и фенильный заместители, которые обладают антибактериальными свойствами.
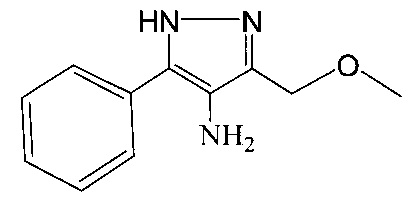
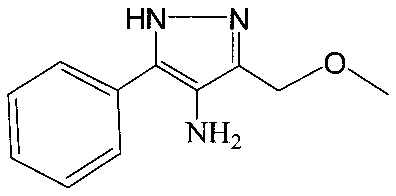
Указанный технический результат достигается тем, что получен 4-амино-3-метоксиметил-5-фенил-1Н-пиразол, имеющий формулу
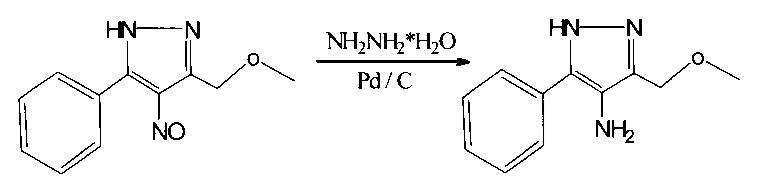
Изонитрозодикетон с фенильным и метоксизаместителями вводят в реакцию циклоконденсации с гидразином, с получением нитрозопиразола с метоксиметильным и фенильным заместителями. Нитрозопиразол с метоксиметильным и фенильным заместителями подвергают восстановлению гидразингидратом в спиртовом растворе на палладиевом катализаторе, с получением метоксиметилзамещенного аминопиразола с фенильным заместителем.
Авторами впервые получен 1Н-3-метоксиметил-4-аминопиразол с фенильным заместителем в 5-м положении, который выделен и идентифицирован.
Полученный аминопиразол показал высокую антибактериальную активность по отношению к Е. coli (Escherichia coli, штамм АТСС 25822 чувствительный к антибиотикам).
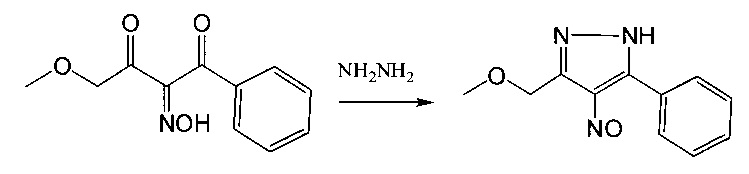
Ранее синтезированный 1-фенил-4-метоксибутан-1,2,3-трион-2-оксим, полученный по Кляйзену / Любяшкин, А.В. Синтез 1-(2-нафтил)-4-этоксибутандиона-1,3 и этоксиметинитрозопиразола на его основе [Текст] / А.В. Любяшкин [и др.] // Фундаментальные исследования. - 2014. - №11. часть 7. - С. 1552-1554 / был введен в реакцию циклоароматизации с гидразингидратом в водно-щелочной среде. Выделенный нитрозопиразол с фенильным и метоксиметильным заместителями восстанавливали гидразингидратом на палладиевом катализаторе.
4-Амино-3-метоксиметил-5-фенил-1Н-пиразол получают в результате циклоароматизации изонитрозодикетона и восстановления нового, ранее не описанного промежуточного продукта нитрозопиразола - 4-нитрозо-3-метоксиметил-5-фенил-1Н-пиразол. Полученные новые, ранее не известные промежуточный 4-нитрозопиразол и целевой продукт - 4-аминопиразол одновременно содержат метоксиметильную группу и фенильный заместитель.
4-Нитрозо-3-метоксиметил-5-фенил-1Н-пиразол
Синее кристаллическое вещество с Тпл.=128-130°С, растворимое в органических растворителях, не растворимое в воде. В ЯМР 1Н спектре (ДМСО-d6) наблюдаются сигналы протонов бензольного кольца с хим. сдвигом 7.6-8.24 м.д., сигналы протонов группы СН3 метильного заместителя с хим. сдвигом 3.34 м.д., сигнал протонов метиленовой группы в области 4.38 м.д., сигнал протона пиразольного кольца в области 14.26 м.д. В УФ спектре (EtOH) полученного нитрозопиразола присутствует полоса поглощения с λ=685 нм, ε=55, принадлежащая n-π* переходу нитрозогруппы.
4-Амино-3-метоксиметил-5-фенил-1Н-пиразол
Белое кристаллическое вещество с Тпл.=89-90°С, растворимое в органических растворителях, слабо растворимое в воде. В ЯМР 1Н спектре (ДМСО-d6) наблюдаются сигналы протонов бензольного кольца с хим. сдвигом 7.24-7.8 м.д., сигналы протонов группы СН3 метильного заместителя с хим. сдвигом 3.26 м.д., сигнал протонов метиленовой группы в области 3.93 м.д., сигнал протонов аминогруппы NH2 с хим. сдвигом 4.39, сигнал протона пиразольного кольца в области 12.4 м.д.
Получение 4-нитрозопиразола с метоксиметильным и фенильным заместителями осуществляют следующим способом.
В 7% растворе NaOH в воде растворяют изонитродикетон с фенильным и метоксильным заместителями. По каплям добавляют гидразингидрат в 10% избытке по молям. Контролируют наличие исходного изонитрозодикетона с помощью тонкослойной хроматографии на пластинах Sorbfil марки ПТСХ-АФ-В (Россия). Когда исходное соединение полностью прореагировало, смесь подкисляют 5% раствором серной кислоты до до рН=4. Конечный продукт выпадает в виде синих кристаллов. Выход 64%.
Получение 4-аминопиразола с метоксиметильным и фенильным заместителями осуществляют следующим способом.
В этиловом спирте растворяют 4-нитрозопиразол с метоксиметильным и фенильным заместителями. Затем добавляют катализатор - палладий на угле, перемешивают в течение 30 минут. По истечении этого времени приливают по каплям гидразингидрат (5-кратный мольный избыток относительно нитрозопиразола). Начало реакции можно заметить, если начал выделяться газ. После того как весь гидразингидрат добавили, еще 30 минут перемешивают и контролируют наличие исходного нитрозопиразола с помощью тонкослойной хроматографии на пластинах Sorbfil марки ПТСХ-АФ-В (Россия). Когда исходное соединение полностью прореагировало, отфильтровывают катализатор на фильтре Шотта, а фильтрат упаривают в выпарной чашке. Конечный продукт выпадает в виде белых кристаллов. Выход 87%.
Пример 1
Способ получения 4-Нитрозо-3-метоксиметил-5-фенил-1Н-пиразол.
К раствору 3.2 г (14 ммоль) 4-метокси-1-фенил-бутан-1,2,3-трион-2-оксима в 180 мл 7% раствора КОН в воде, при перемешивании добавляли 1.456 г (29 ммоль) гидразингидрата. После перемешивания в течение 50 минут при 20°С раствор подкисляли 5% H2SO4 до рН=4. Выпадал осадок синего цвета. Выход 1.94 г (64%).
Пример 2
Способ получения) 4-Амино-3-метоксиметил-5-фенил-1Н-пиразол.
В 30 мл этилового спирта растворяли 1.06 г (5 ммоль) 3-метоксиметил-4-нитрозо-5-фенил-1Н-пиразола. Добавляли 0.03 г палладия на угле 0.05% и при интенсивном перемешивании по каплям 0.825 мл (20 ммоль) гидразингидрата. Через 30 минут и отфильтровывали катализатор, фильтрат упаривали. Выход 0.88 г (87%). Белые кристаллы, т.пл. 89-90°С (EtOH).
Строение впервые полученных промежуточного 4-нитрозопиразола и конечного 4-аминопиразола было доказано методом ЯМР спектроскопии.
Для выявления антибактериальной активности проведены исследования указанных веществ в лаборатории микробиологии им. доц. Б.М. Зельмановича («Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого»). Определение антибактериальной активности проводили методом серийных разведений на тест-культуре: Е. coli (Escherichia coli, штамм АТСС 25822, чувствительный к антибиотикам). Двукратное разведение соединений в объеме 1 мл готовили на дистиллированной воде. В каждую пробирку с растворенным 4-аминопиразолом вносили по 0.1 мл взвеси испытуемых тест-культур, приготовленных из 18-часовых агаровых культур по стандарту мутности 0,5 макфарланда. Пробирки инкубировали при 37 градусах Цельсия. Высев производили через 24 часа на сектора штрихом в чашки с мясопептонным агаром. Учет результатов производили по наличию и характеру роста культур на питательной среде. Концентрация изучаемого 4-аминопиразола составляла 5*10-2 моль/л. В результате проведенных испытаний было установлено, что впервые синтезированный 1Н-3-метоксиметил-4-амино-5-фенилпиразол обладает бактерицидным действием, полностью подавляя рост бактериальных культур. 4-Нитрозо-3-метоксиметил-5-фенил-1 Н-пиразол такой активностью не обладает.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЛКОКСИМЕТИЛЗАМЕЩЕННЫЕ 1Н-4-АМИНОПИРАЗОЛЫ | 2014 |
|
RU2579515C1 |
| 3-МЕТИЛ-4-НИТРОЗОПИРАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2010 |
|
RU2440343C1 |
| ГЕКСАЗАМЕЩЕННЫЕ ПАРА-АМИНОФЕНОЛЫ С АРИЛАМИДНЫМИ ГРУППАМИ В 2,6-ПОЛОЖЕНИЯХ ПО ОТНОШЕНИЮ К ГИДРОКСИЛУ | 2013 |
|
RU2537398C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ФЕНИЛ-3-(ТРИФТОРМЕТИЛ)-1Н-ПИРАЗОЛ-4-АМИНА | 2017 |
|
RU2642924C1 |
| ВУЛКАНИЗУЕМАЯ РЕЗИНОВАЯ СМЕСЬ | 2013 |
|
RU2548066C1 |
| ПРИМЕНЕНИЕ ГЕКСАЗАМЕЩЕННЫХ ПАРА-АМИНОФЕНОЛОВ С АРИЛАМИДНЫМИ ГРУППАМИ В 2,6-ПОЛОЖЕНИЯХ ПО ОТНОШЕНИЮ К ГИДРОКСИЛУ В КАЧЕСТВЕ АНТИАРИТМИЧЕСКИХ И АНТИГИПЕРТЕНЗИВНЫХ СРЕДСТВ | 2015 |
|
RU2593592C1 |
| 2-Арил-6-(метилтио)-4-хлор-2H-пиразоло[3,4-d]пиримидины и способ их получения | 2019 |
|
RU2708892C1 |
| Производные 1Н-пиразоло[3,4-d]пиримидина и способ их получения | 2017 |
|
RU2638928C1 |
| 1-Бензоилзамещенные-6-(метилтио)-4-хлор-1Н-пиразоло[3,4-d]пиримидины и способ их получения | 2019 |
|
RU2709018C1 |
| КОМПОЗИЦИЯ ДЛЯ ОКРАСКИ КЕРАТИНОВЫХ ВОЛОКОН, СОДЕРЖАЩАЯ ПО КРАЙНЕЙ МЕРЕ ОДИН ДИАМИНОПИРАЗОЛ, СПОСОБ ОКРАШИВАНИЯ, НОВЫЕ ДИАМИНОПИРАЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2168326C2 |
Изобретение относится к области органической химии, а именно к получению нового ранее не описанного 4-амино-3-метоксиметил-5-фенил-1Н-пиразола. 4-Амино-3-метоксиметил-5-фенил-1Н-пиразол, имеющий приведенную ниже формулу, получают в результате циклоароматизации изонитрозодикетона и восстановления нового, ранее не описанного промежуточного продукта - 4-нитрозо-3-метоксиметил-5-фенил-1Н-пиразола. Полученное целевое соединение показывает высокую антибактериальную активность по отношению к Е. coli (Escherichia coli, штамм АТСС 25822, чувствительный к антибиотикам), что позволяет применять его в фармакологии для создания антибактериальных препаратов. 2 пр.
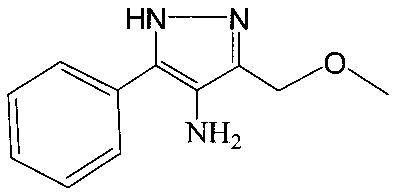
4-Амино-3-метоксиметил-5-фенил-1Н-пиразол формулы
| US 3374227 A, 19.03.1968 | |||
| A.В | |||
| ЛЮБЯШКИН И ДР | |||
| "Синтез этоксиметилнитрозопиразолов", Журнал Органической Химии, 2015, т.51, вып.4, стр | |||
| ШПАЛОРЕЗНЫЙ СТАНОК | 1922 |
|
SU607A1 |
| KH | |||
| S | |||
| SHIKHALIEV ET AL | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| САМОСМАЗЫВАЮЩАЯСЯ БУКСА С ПНЕВМАТИЧЕСКИМ ОХЛАЖДЕНИЕМ | 1923 |
|
SU1034A1 |
Авторы
Даты
2018-01-24—Публикация
2015-12-22—Подача