Изобретение относится к исследованию или анализу материалов, а именно к получению образцов для исследования, в частности микрочастиц и микроследов с объекта-носителя растительного и животного происхождения, и может использоваться в палинологии, биологии, экологии, медицина для спорово-пыльцевого анализа, криминалистической, товароведческой и экологической экспертиз.
Из патента US 7250138 известен способ для обнаружения присутствия субмикронных частиц в образце, взятом из окружающей среды. Способ включает в себя отбор пробы из окружающей среды, очистку и концентрирование субмикронных частиц в образце на основании размера частиц. Очищенные и концентрированные частицы детектируют с помощью устройства, которое включает в себя узел электрораспыления, имеющий капилляр, анализатор дифференциальной подвижности, который принимает выходной сигнал из капилляра, и устройство конденсации частиц для подсчета числа частиц, которые проходят через анализатор дифференциальной подвижности.
Однако данный способ предназначен для улавливания частиц размером менее 1 мкм из воздуха, что много меньше размера органических пылевых частиц, в том числе и пыльцевых зерен, диапазон размеров которых равен 10-100 мкм. В способе применено устройство - узел электрораспыления. Пыльца высших растений характеризуется наличием электрического заряда, но в одном цветке содержится разное количество пыльцевых зерен, заряженных как положительно, так и отрицательно. Величина заряда пыльцы крайне мала и находится в пределах 10-16-10-17 Кл. Данный способ также не применим для сбора микрочастиц из глубоких пор, трещин поверхности макрообъекта.
Известен также способ измельчения, экстракции и обнаружения аналитов в твердых биологических образцах из международной заявки WO 2005063962. Данное изобретение относится к способам, реагентам, наборам, приборам и автоматизированным системам для измельчения, извлечения и обнаружения аналитов наркотиков, пестицидов, гербицидов и стероидов в твердых биологических образцах, происходящих, например, от человека, домашних животных, растений, амфибий, насекомых и рептилий.
Однако данный способ отличается высокими экономическими затратами на электричество, воду и утилизацию токсичных отходов, где, например, в качестве растворителя использована соляная кислота. При экстракции и обнаружении аналитов используют автоматизированные хроматографические системы, дорогостоящие иностранные наборы КИТ (KitLab) и аналитические стандарты высокой чистоты. Кроме того, применение измельчения на этапе подготовки препаратов приводит к полному разрушению микрообъектов, в том числе пыльцевых зерен и спор без возможности их регистрации и идентификации по морфометрическим признакам.
Известно также техническое решение из патента RU 2273853 «Способ бактериоскопической экспрессной идентификации микрофлоры содержимого толстой и прямой кишки». Данное изобретение относится к области медицины - колопроктологии, гастроэнтерологии, клинической микробиологии. Способ включает отбор пробы, которую разводят дистиллированной водой, усредненные суспензии субстрата отстаивают, добавляют 95,5° этиловый спирт, центрифугируют в два этапа, из осадка делают монослойный мазок, который высушивают при комнатной температуре, фиксируют 95,5° этиловым спиртом, затем окрашивают мазок по Граму и определяют морфологию микроорганизмов. Изобретение обеспечивает быструю идентификацию большого числа видов микробных популяций при одновременном определении соотношений грамположительных и грамотрицательных форм.
Однако средний размер бактерий составляет 0,5-5 мкм, что много меньше размера пыльцевых зерен. Поэтому данный метод не применим для макрообъектов растительного и животного происхождения, т.к. не позволяет отделить крупный «мусор» - пыльцевые зерна и споры - от бактериальных клеток в полном объеме. Кроме того, в норме пыльцевых зерен и спор в экскрементах не должно быть, т.к. это свидетельствует о нарушении перистальтики и слишком быстрой эвакуации пищевых масс из кишечника.
Наиболее близким по технической сущности к предлагаемому способу является способ изъятия микрочастиц и микроследов с объектов-носителей вакуумным методом (например, пылесос, специальные насадки-фильтры); изъятие микрочастиц с помощью ультразвука в инертных средах; изъятие микрочастиц с помощью ультразвуковой кавитации в среде фреона-113. Способы применяются в медицине, криминалистике, товароведении, палиноморфологических и других исследованиях (Гладкова А.Н., Гричук В.П., Заклинская Е.Д. и др. Пыльцевой анализ, 1950; ГОСТ 31769-2012 Мед. Метод определения частоты встречаемости пыльцевых зерен; Каревская И.А. Спорово-пыльцевой анализ при палеогеографических и геоморфологических исследованиях, 1999; Додонкин Ю.В., Жебелева И.А., Криштафович В.И. Таможенная экспертиза товаров, 2004; ГОСТ 28887-90. Пыльца цветочная (обножка). Технические условия; ГОСТ Р 51074-2003. Продукты пищевые; и др.).
Способ отбора пробы микрочастиц, т.е. пыльцевых зерен и спор из жидких субстанций, например меда (ГОСТ 28887-90, ГОСТ 31769-2012), основан на добавлении к пробе дистиллированной воды и центрифугировании в два этапа. Осадок окрашивают 0,1%-ным спиртовым раствором фуксина. Затем препарат фиксируют в глицерин-желатине и по морфологии пыльцевых зерен проводят определение. Данный способ оперативен и обеспечивает идентификацию большого числа видов пыльцевых зерен и спор из жидких сред, но не применим для снятия микрообъектов с поверхности и неровностей объекта-носителя. Вакуумный метод и ультразвуковая кавитация как способы изъятия микрообъектов, наряду с широким применением и проверкой временем, также имеют ряд существенных ограничений. Во-первых, проблематично по медицинским аспектам (имеются ограничения) - шумовое загрязнение и дополнительное запыление, соблюдение жестких требований по санитарным нормативам, в том числе по фреону. Во-вторых, экономические затраты на ресурсы (электричество) и время проведения рутинных работ, а также утилизацию токсичных отходов, оказывающих значительное влияние на экологию рабочего места. В-третьих, данный способ не обеспечивает достаточный набор (или диапазон) микрочастиц, т.к. многие из них разрушаются или теряются при извлечении, измельчении и прочих процедурах. В-четвертых, при реализации данного способа трудно, а иногда невозможно изъять микрочастицы с объекта-носителя растительного и животного происхождения для последующей регистрации/идентификации.
Техническая проблема, на решение которой направлено заявляемое изобретение, заключается в недостаточном качестве проб, содержащих макро- и микрообъекты, т.е. чистоте проб, в которых много примесей иных микрочастиц, кроме пыльцевых зерен и спор, разрушение микрообъектов до неидентифицируемых остатков в процессе изъятия, разделения и подготовки (щелочной гидролиз) к регистрации.
Техническим результатом заявляемого изобретения является улучшение качества проб на подготовительных этапах и получение максимально полного набора микрочастиц и микроследов за счет выбора растворителей и режимов смыва, что позволяет ускорить рутинные работы при изъятии микрочастиц и микроследов растительного и животного происхождения с объекта-носителя, повысить эффективность результатов идентификационного анализа в целом.
Указанный технический результат достигается за счет того, что в способе снятия микрочастиц и микроследов с объекта растительного и животного происхождения с поверхности объекта-носителя осуществляют смыв материала физико-механическим способом при температуре 20-25°С в растворе одноосновной карбоновой кислоты с добавлением поверхностно-активного вещества с последующей седиментацией, после чего проводят щелочной гидролиз осадка с использованием смеси нашатырного спирта и щелочи с последующим отмыванием, осушением и окрашиванием микрочастиц и микроследов.
В способе могут проводить дополнительный смыв материала с глубоких слоев поверхности объекта-носителя при ультразвуковом воздействии при температуре 35-45°С в растворе одноосновной карбоновой кислоты с добавлением поверхностно-активного вещества с дальнейшей седиментацией, после чего проводят щелочной гидролиз осадка с использованием смеси нашатырного спирта и щелочи с последующим отмыванием, осушением и окрашиванием микрочастиц и микроследов.
Достижение указанного технического результата обеспечивается благодаря использованию неразрушающего принципа снятия с объекта-носителя микрочастиц и микроследов растительного и животного происхождения. В способе осуществляют смыв материала при комнатной температуре (20-25°С) в растворе одноосновной карбоновой кислоты с добавлением поверхностно-активного вещества и последующей седиментацией. После чего проводят мягкий щелочной гидролиз (смесь нашатырного спирта и щелочи) при кипячении с последующим отмыванием, осушением и окрашиванием микрочастиц и микроследов. Предлагаемый способ является доступным, эргономичным и экологически безопасным.
Реализация изобретения проиллюстрирована с помощью блок-схем на фиг. 1-2, на которых показаны:
Фиг. 1 - алгоритм реализации способа основным смывом;
Фиг. 2 - алгоритм реализации способа с дополнительным смывом.
Способ реализуют следующим образом.
Первый этап (смыв А или основной) предусматривает снятие микрочастиц и микроследов с поверхности объекта-носителя физико-механическим способом на орбитальной качалке (шейкере) при температуре 20-25°С раствором одноосновной карбоновой (уксусной) кислотой с добавлением поверхностно-активного вещества, например Полисорбата 20 (жидкое мыло, TWEEN_20). Седиментацию водных растворов проводят с добавлением хлорида натрия при температуре 20-25°С на лабораторной центрифуге.
Второй этап (смыв Б или дополнительный) предусматривает снятие микрочастиц и микроследов с поверхности объекта-носителя физико-механическим способом в ультразвуковой ванне при температуре 35-45°С раствором одноосновной карбоновой (уксусной) кислотой с добавлением Полисорбата 20 (жидкое мыло, TWEEN_20). Далее проводят седиментацию водных растворов на лабораторной центрифуге при комнатной температуре.
Щелочной гидролиз получаемых осадков, содержащих неразрушенные микрообъекты, проводят в инертной посуде на кипящей водяной бане с добавлением в равных объемах нашатырного спирта (NH4OH) и щелочи (NaOH) и с последующим отмыванием и осушением осадка путем центрифугирования.
Далее полученные осадки с микрообъектами окрашивают спиртовым раствором фуксина и фиксируют препарат в глицеринсодержащую среду для процедуры микроскопирования с использованием световой микроскопии.
В зависимости от типа поверхности макрообъекта возможен дополнительный (самостоятельный) смыв микрообъектов с глубоких слоев поверхности объекта-носителя. Принято условное деление: тип 1 - неровная, шероховатая, опушенная, жесткая, грубая, шершавая, восковое/парафиновое покрытие; тип 2 - ровная, гладкая, шелковистая (таблица 1).
В таблице 1 использованы следующие сокращения: Ш - шейкер, УЗВ - ультразвуковая ванна, БВ - водяная баня, ЦФ1 - центрифуга, ЦФ2 - микроцентрифуга-вортекс, ОН - объект-носитель.
Понимается, что осадок - это компонент раствора, содержащий микрочастицы и микроследы с объекта-носителя биологического происхождения.
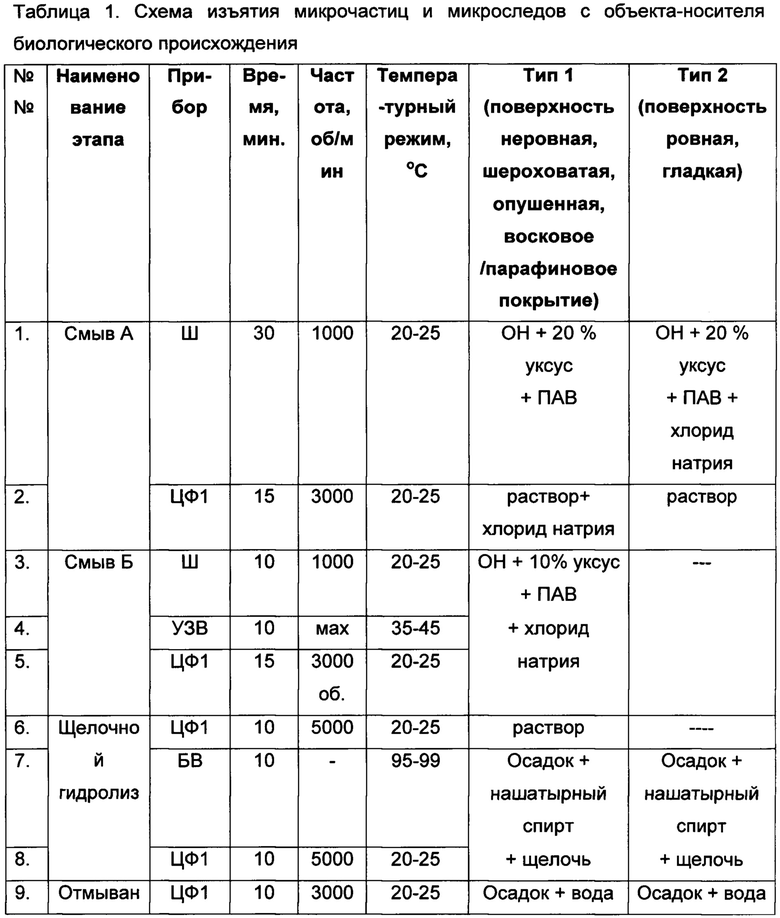
Примечание:
Для снятия микрочастиц объект-носитель помещается в контейнер с плотной крышкой из инертного материала. Вся посуда используется также из инертного материала.
На этапе «Смыв А» на один объем объекта-носителя равный 1 см3 добавляют 1 см3 20%-ного раствора одноосновной карбоновой (уксусной) кислотой, т.е. на объект-носитель со средним объемом 50 см3, например корнеплод, ягода и др., добавляют 50 мл раствора.
На этапе «Смыв Б» на один объем объекта-носителя равный 1 см3 добавляют 2 см3 10%-ного раствора одноосновной карбоновой (уксусной) кислотой.
Примеры использования данного способа
Пример 1. Картонная коробка из аптеки - ольха шишки (плоды), 50 г.
Подготовка к испытанию
Смыв А. Из упаковки брали навеску плодов ольхи массой 50 г и помещали в контейнер с плотной крышкой. Затем добавляли 0,5 мл Полисорбата 20 (TWEEN_20, жидкое мыло), заливали 50 мл 20%-ным раствором одноосновной карбоновой (уксусной) кислотой и помещали на орбитальную качалку (шейкер) при температуре 20-25°С на 30 мин с частотой 1000 об/мин. На один объем объекта-носителя добавляли один объем раствора одноосновной карбоновой (уксусной) кислоты, т.е. на 50 г добавляли 50 мл раствора. Раствор отстаивали 10 мин и надосадочную жидкость сливали в центрифужные пробирки (далее - пробирки) без плодов ольхи. К раствору в пробирки добавляли 5 г хлорида натрия и центрифугировали, т.е. осуществляли седиментацию, в течение 15 мин при частоте вращения ротора 3000 об/мин на лабораторной центрифуге. После центрифугирования пробирки осторожно извлекали и сливали надосадочную жидкость.
К осадку в пробирке добавляли 10 мл смеси: в равных объемах 10%-ного нашатырного спирта (NH4OH) и 10%-ной щелочи (NaOH) и в течение 10 мин на водяной бане при 95-99°С проводили щелочной гидролиз получаемых осадков, содержащих неразрушенные микрообъекты. Далее пробирки центрифугировали, т.е. осуществляли седиментацию, в течение 10 мин при частоте вращения ротора 5000 об/мин на лабораторной центрифуге, сливали надосадочную жидкость (щелочь) и отмывали водой, добавляя в пробирку по 10 мл дистиллированной воды, перемешивая стеклянной палочкой, и проводили центрифугирование в течение 10 мин при частоте вращения ротора 5000 об/мин. Повторяли процедуру отмывки осадка водой. Затем сливали надосадочную жидкость (супернатант) и к осадку добавляли 1 мл дистиллированной воды, перемешивали на микроцентрифуге-вортекс 10 с и переносили в пробирку эппендорф объемом 2 мл. Суспензию центрифугировали на микроцентрифуге-вортекс в течение 10 мин при ускорении 1000 g. Из-под надосадочной жидкости брали аккуратно автоматизированным дозатором 0,03 мл осадочной суспензии, переносили в пробирку эппендорф объемом 0,5 мл, добавляли 2-3 капли 0,1%-ного спиртового раствора фуксина, т.е. 10 мг основного фуксина на 60 мл 96% спирта, для окрашивания и встряхивали на вортексе.
Обезжиренное предметное стекло помещали на нагревательный столик и наносили круг из воска. В центр помещали одну каплю суспензии с микрообъектами и накрывали покровным стеклом. Готовый препарат микроскопировали с использованием профессионального биологического светового микроскопа.
Смыв Б. После получения смыва А к навескам №№1-3 в контейнеры с шишками ольхи доливали 100 мл 10%-ного раствора одноосновной карбоновой (уксусной) кислоты и добавляли 0,5 мл Полисорбата 20 (TWEEN_20, жидкое мыло). На один объем объекта-носителя добавляли два объема раствора одноосновной карбоновой (уксусной) кислоты, т.е. на 50 г добавляли 100 мл раствора. Контейнеры плотно закрывали и помещали на ультразвуковую ванну на 10 мин с максимальной мощностью, затем отстаивали 10 мин и надосадочную жидкость сливали в центрифужные пробирки (далее - пробирки) без плодов ольхи. К раствору в пробирки добавляли 5 г хлорида натрия и центрифугировали, осуществляя седиментацию, в течение 15 мин при частоте вращения ротора 3000 об/мин на лабораторной центрифуге. После центрифугирования пробирки осторожно извлекали и сливали надосадочную жидкость.
К осадку в пробирке добавляли 10 мл смеси - в равных объемах 10%-ого нашатырного спирта (NH4OH) и 10%-ной щелочи (NaOH) и в течение 10 мин на водяной бане при 95-99°С проводили щелочной гидролиз получаемых осадков, содержащих неразрушенные микрообъекты. Далее пробирки центрифугировали, осуществляя седиментация, в течение 10 мин при частоте вращения ротора 5000 об/мин на лабораторной центрифуге. Сливали надосадочную жидкость (щелочь) и отмывали водой, добавляя в пробирку по 10 мл дистиллированной воды, перемешивая стеклянной палочкой, и проводили центрифугирование в течение 10 мин при частоте вращения ротора 5000 об/мин. Повторяли процедуру отмывки осадка водой. Затем сливали надосадочную жидкость (супернатант) и к осадку добавляли 1 мл дистиллированной воды, перемешивали на микроцентрифуге-вортекс 10 с и переносили в пробирку эппендорф объемом 2 мл. Суспензию центрифугировали на микроцентрифуге-вортекс в течение 10 мин при ускорении 1000 g. Из-под надосадочной жидкости брали автоматизированным дозатором 0,03 мл осадочной суспензии, переносили в пробирку эппендорф объемом 0,5 мл, добавляли 2-3 капли 0,1%-ного спиртового раствора фуксина: 10 мг основного фуксина на 60 мл 96% спирта для окрашивания и встряхивали на микроцентрифуге-вортекс.
Обезжиренное предметное стекло помещали на нагревательный столик и наносили круг из воска. В центр помещали одну каплю суспензии с микрообъектами и накрывали покровным стеклом. Готовый препарат микроскопировали с использованием профессионального биологического светового микроскопа.
Проведение испытания
Регистрацию и анализ микрообъектов - общее число пыльцевых зерен и число пыльцевых зерен отдельных родов/видов, микромицетов - проводили с использованием световой микроскопии при увеличении 40-1000 крат. Палиноиндикацию пыльцевых зерен и спор высших растений (возможна индикация микромицетов, фитолитов и др.) проводили по качественным признакам в соответствии с описаниями в атласах, научной литературе, специализированных интерактивных базах данных с описанием и иллюстрациями микрообъектов. Учитывали три повторности (навеска №№1-3) по два стекла с каждой навески и не менее 150 пыльцевых зерен (общее число).
Обработка результатов испытаний
Число пыльцевых зерен определяемого рода/вида растения X, %, рассчитывали по формуле: Х=a/b*100%, где а - число учтенных пыльцевых зерен определяемого рода/вида в препарате, шт.; b - общее число учтенных пыльцевых зерен в препарате, шт.; 100 - коэффициент пересчета на массовую долю (%) пыльцевых зерен определяемого рода/вида. За окончательный результат испытания принимали среднеарифметическое значение результатов параллельных определений (навеска №№1-3).
В итоге между тремя результатами испытаний (навеска №№1-3) одной и той же пробы (ольха шишки (плоды), 50 г, картонная коробка из аптеки), полученными по одной методике, в одной и той же лаборатории, одним и тем же лаборантом, с использованием одного и того же средства измерения и оборудования, получили предельно допустимое относительное расхождение менее 20% среднеарифметического значения (таблица 2).


Пример 2. Слива сезонная, обыкновенная (вес образца 1 кг).
Подготовка к испытанию
Смыв А. Брали три навески в каждой по три плода сливы и помещали в контейнер с плотной крышкой. Вес сливы зависит от сорта и размера урожая, но в среднем вес равен 30 г, т.е. каждая навеска 90-100 г. В каждую навеску добавляли 0,5 мл Полисорбата 20 (TWEEN_20, жидкое мыло) и 100 мл 20%-ного раствора одноосновной карбоновой (уксусной) кислоты. Для лучшего снятия микрообъектов механическим трением и отделения от объекта-носителя добавляли 5 г хлорида натрия. На один объем объекта-носителя добавляли один объем раствора одноосновной карбоновой (уксусной) кислоты, т.е. на 100 г добавляли 100 мл раствора. Контейнер с плотно закрытой крышкой помещали на орбитальную качалку (шейкер) при температуре 20-25°С на 30 мин с частотой 1000 об/мин. Раствор отстаивали 10 мин и надосадочную жидкость сливали в центрифужные пробирки (далее - пробирки) без плодов сливы.
Пробирки с солевым раствором центрифугировали, т.е. осуществляли седиментацию, в течение 25 мин при частоте вращения ротора 3000 об/мин на лабораторной центрифуге. После центрифугирования пробирки осторожно извлекали и сливали надосадочную жидкость.
К осадку в пробирке добавляли 10 мл смеси - в равных объемах 10%-ного нашатырного спирта (NH4OH) и 10%-ной щелочи (NaOH) - и в течение 10 мин на водяной бане при 95-99°С проводили щелочной гидролиз получаемых осадков, содержащих неразрушенные микрообъекты. Далее пробирки центрифугировали, осуществляя седиментацию, в течение 10 мин при частоте вращения ротора 5000 об/мин на лабораторной центрифуге, сливали надосадочную жидкость (щелочь) и отмывали водой, добавляя в пробирку по 10 мл дистиллированной воды, перемешивая стеклянной палочкой, и проводили центрифугирование в течение 10 мин при частоте вращения ротора 5000 об/мин. Повторяли процедуру отмывки осадка водой. Затем сливали надосадочную жидкость (супернатант) и к осадку добавляли 1 мл дистиллированной воды, перемешивали на микроцентрифуге-вортекс 10 с и переносили в пробирку эппендорф объемом 2 мл. Суспензию центрифугировали на микроцентрифуге-вортекс в течение 10 мин при ускорении 1000 g. Из-под надосадочной жидкости брали аккуратно автоматизированным дозатором 0,03 мл осадочной суспензии, переносили в пробирку эппендорф объемом 0,5 мл, добавляли 2-3 капли 0,1%-ного спиртового раствора фуксина, т.е. 10 мг основного фуксина на 60 мл 96% спирта для окрашивания, и встряхивали на микроцентрифуге-вортекс.
Обезжиренное предметное стекло помещали на нагревательный столик и наносили круг из воска. В центр помещали одну каплю суспензии с микрообъектами, накрывали покровным стеклом. Готовый препарат микроскопировали с использованием профессионального биологического светового микроскопа.
Проведение испытания
Регистрацию и анализ микрообъектов - общее число пыльцевых зерен и число пыльцевых зерен отдельных родов/видов - проводили с использованием световой микроскопии при увеличении 40-1000 крат. Палиноиндикацию пыльцевых зерен и спор высших растений (возможна индикация микромицетов, фитолитов и др.) проводили по качественным признакам в соответствии с описаниями в атласах, научной литературе, специализированных интерактивных базах данных с описанием и иллюстрациями микрообъектов. Учитывают три повторности (навеска №№1-3), по два стекла с каждой навески, не менее 150 пыльцевых зерен (общее число).
Обработка результатов испытаний
Число пыльцевых зерен, определяемого рода/вида растения X, %, рассчитывали по формуле: Х=a/b*100%, где а - число учтенных пыльцевых зерен определяемого рода/вида в препарате, шт.; b - общее число учтенных пыльцевых зерен в препарате, шт.; 100 - коэффициент пересчета на массовую долю (%) пыльцевых зерен определяемого рода/вида. За окончательный результат испытания принимали среднеарифметическое значение результатов параллельных определений (навеска №№1-3).
В итоге между тремя результатами испытаний (навеска №№1-3) одной и той же пробы (слива сезонная, обыкновенная), полученными по одной методике, в одной и той же лаборатории, одним и тем же лаборантом, с использованием одного и того же средства измерения и оборудования, получили предельно допустимое относительное расхождение менее 15% среднеарифметического значения (таблица 3).
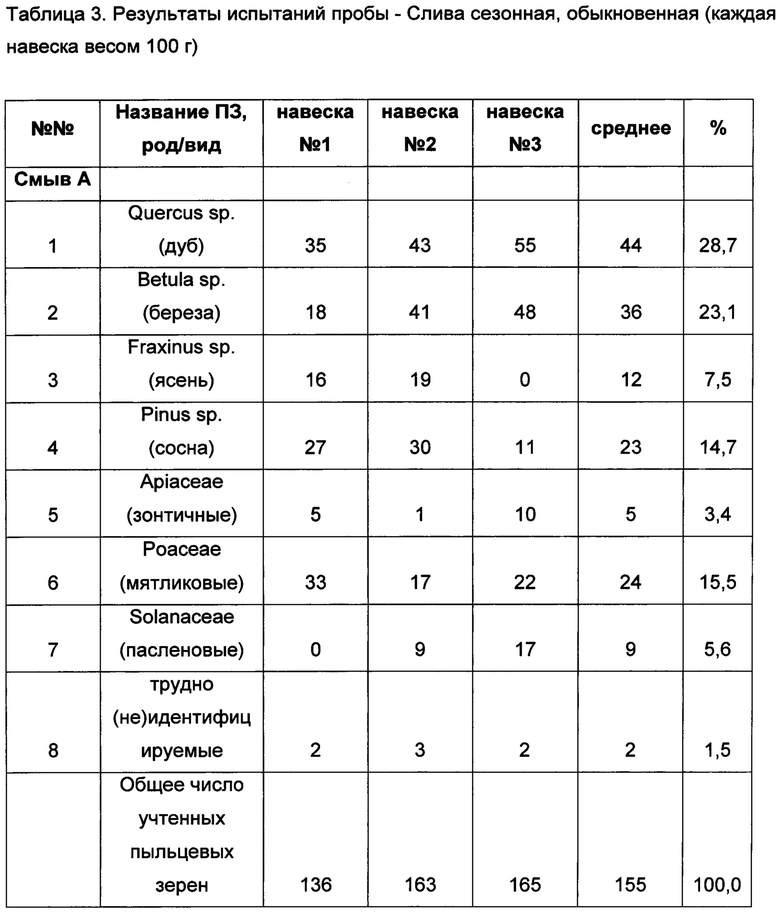

Специалисту в данной области техники очевидно, что заявляемые диапазоны значений температур и времени не являются альтернативами, а представляют собой конкретный режим, который может изменяться в указанных пределах в зависимости от исходного объекта, используемого оборудования и других внешних факторов.
Приведенные примеры являются частными случаями и не исчерпывают всех возможных реализаций заявляемого изобретения.
Предлагаемое изобретение является доступным, эргономичным и экологически безопасным способом изъятия микрочастиц для получения «чистых» качественных проб с набором микрочастиц. Способ позволяет получить максимально полный набор микрочастиц и микроследов растительного и животного происхождения, в том числе пыльцевых зерен и спор высших растений, палиноморфов, мицелия, бактерий, простейших, фитолитов, обломков растительного и животного происхождения для характеристики свойств объекта-носителя. Способ также позволяет получить дифференцированный набор микрочастиц и микроследов растительного и животного происхождения с учетом времени роста объекта-носителя, т.к. дополнительным или горячим смывом снимают глубоко зафиксированные микрочастицы, осевшие в месте произрастания объекта-носителя; основным или холодным смывом - более поздние микроследы, связанные с упаковкой и перемещением объекта-носителя. Использование заявляемого способа ускоряет рутинные работы - время проведения работ в среднем 2,5 ч на 1 пробу, а также увеличивает эффективность результатов идентификационного анализа - количество трудно или неидентифицируемых микрообъектов колеблется в пределах 1-8%.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения углеводного состава пищевых продуктов растительного происхождения | 1983 |
|
SU1176246A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БОТАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ МЁДА | 2019 |
|
RU2717539C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК | 2011 |
|
RU2485178C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК COCCIDIOIDES IMMITIS ДЛЯ ПРОВЕДЕНИЯ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2005 |
|
RU2295569C1 |
| Способ выделения РНК и ДНК из сухих биологических образцов, хранившихся на бумажном носителе, и набор для его осуществления | 2016 |
|
RU2628695C1 |
| Способ определения функционально-активных лейкоцитов | 1988 |
|
SU1686355A1 |
| Способ обнаружения яиц гельминтов в пробах почвы и донных отложениях | 1984 |
|
SU1314268A1 |
| СПОСОБ ГРУППОВОЙ ЭКСПРЕСС-ДИАГНОСТИКИ ГЕЛЬМИНТОЗОВ КРУПНОГО РОГАТОГО СКОТА | 2004 |
|
RU2302207C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ АМИНОКИСЛОТ, И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОАЛЛЕРГИЧЕСКИХ, АНТИАНАФИЛАКТИЧЕСКИХ И ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ | 2008 |
|
RU2406727C2 |
| СПОСОБ ОСВЕТЛЕНИЯ ГЛИНИСТОЙ СУСПЕНЗИИ | 2024 |
|
RU2838653C1 |


Изобретение относится к исследованию или анализу материалов, а именно к получению образцов для исследования, в частности микрочастиц и микроследов с объекта-носителя растительного и животного происхождения, и может использоваться в палинологии, биологии, экологии, медицина для спорово-пыльцевого анализа, криминалистической, товароведческой и экологической экспертиз. С поверхности объекта-носителя осуществляют смыв материала физико-механическим способом при температуре 20-25°С в растворе одноосновной карбоновой кислоты с добавлением поверхностно-активного вещества с последующей седиментацией. Затем проводят щелочной гидролиз осадка с использованием смеси нашатырного спирта и щелочи с последующим отмыванием, осушением и окрашиванием микрочастиц и микроследов. Обеспечивается улучшение качества проб на подготовительных этапах и получение максимально полного набора микрочастиц и микроследов за счет выбора растворителей и режимов смыва, что позволяет ускорить рутинные работы при изъятии микрочастиц и микроследов растительного и животного происхождения с объекта-носителя, повысить эффективность результатов идентификационного анализа в целом. 1 з.п. ф-лы, 2 ил., 3 табл., 2 пр.
1. Способ сбора образцов микрочастиц и микроследов с объектов растительного и животного происхождения, характеризующийся тем, что с поверхности объекта-носителя осуществляют смыв материала физико-механическим способом при температуре 20-25°С в растворе одноосновной карбоновой кислоты с добавлением поверхностно-активного вещества с последующей седиментацией, после чего проводят щелочной гидролиз осадка с использованием смеси нашатырного спирта и щелочи с последующим отмыванием, осушением и окрашиванием микрочастиц и микроследов.
2. Способ по п. 1, характеризующийся тем, что проводят дополнительный смыв материала с глубоких слоев поверхности объекта-носителя при ультразвуковом воздействии при температуре 35-45°С в растворе одноосновной карбоновой кислоты с добавлением поверхностно-активного вещества.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Утверждено гл | |||
| гос | |||
| сан | |||
| врачом РФ Г.Г | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| RU 2370540 С2, 20.10.2009 | |||
| СПОСОБ ПРЕДПОСЕВНОЙ ОБРАБОТКИ ПРОБ, СНЯТЫХ С ОБЪЕКТОВ ВНЕШНЕЙ СРЕДЫ, НА ВЫДЕЛЕНИЕ МИКОБАКТЕРИЙ | 2009 |
|
RU2402781C1 |
| СПОСОБ ОТБОРА И ОБРАБОТКИ ПРОБ ДЛЯ ОПРЕДЕЛЕНИЯ ЗАГРЯЗНЕННОСТИ ПОВЕРХНОСТЕЙ МЕТАЛЛИЧЕСКОЙ РТУТЬЮ И ЕЕ СОЕДИНЕНИЯМИ | 2002 |
|
RU2229109C2 |
| Способ подготовки эпителиальных клеток желудочно-кишечного тракта к исследованию | 1989 |
|
SU1735737A1 |
Авторы
Даты
2018-04-18—Публикация
2016-12-30—Подача