Данное изобретение относится к соединениям, которые можно использовать для терапевтического применения при лечении расстройств, связанных со стрессом, обусловленным неправильным фолдингом (сворачиванием) белков, в частности с накоплением неправильно свернутых белков. В частности, в данном изобретении предлагаются соединения, способные оказывать защитное действие в отношении цитотоксического стресса эндоплазматического ретикулума.
Уровень техники
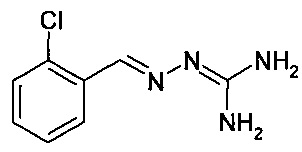
Соединение 2-(2,6-дихлорбензилиден)гидразинкарбоксимидамид, называемое также гуанабензом, является агонистом α2-адренергических рецепторов, применяемым в качестве средства против гипертензии.
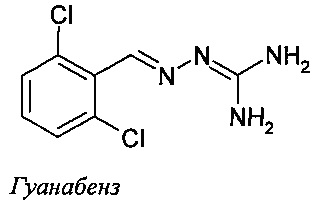
Сообщалось также о различных производных гуанабенза. Например в патенте US №3,982,020 (Sandoz, Inc.) описываются замещенные бензилиденгидразины и их применение в качестве агентов, противодействующих гипергликемии, ожирению и воспалению. В публикации заявки на патент US №2004/0068017 (Bausch & Lomb Inc.) описываются замещенные бензилиденгидразины, способные повышать активность желатиназы А в клетках глаза. Эти соединения нашли применение в лечении первичной открытоугольной глаукомы. В публикации WO 2008/061647 (Acure Pharma АВ) описывается использование N-(2-хлор-3,4-диметоксибензилиденамино)гуанидина в качестве ингибитора рецепторов фактора роста эндотелия сосудов (VEGFR) и связанные с ним применения при лечении или предотвращении нежелательного образования кровеносных сосудов в ходе опухолевого роста и/или при воспалительных состояниях. В публикации WO 2005/031000 (Acadia Pharmaceuticals, Inc.) описываются замещенные бензилиденгидразины и их применение при лечении острой боли и хронической нейропатической боли. Наконец, в Европейском патенте №ЕР 1908464 (CNRS) описываются гуанабенз и хлоргуанабенз и их применение при лечении заболеваний, связанных с удлинением полиглутаминовьгх участков в белках, в частности болезни Хантингтона.
Недавно сообщалось, что гуанабенз обладает терапевтическим потенциалом в ряде других областей. Так, отмечено, что гуанабенз имеет антиприонную активность (D. Tribouillard-Tanvier et al., 2008, PLoS One 3, e1981). Сообщалось, что его активность в смысле защиты от неправильного сворачивания полипептидной цепи белка на удивление оказалась гораздо шире и включает ослабление накопления мутантного хантингтина в экспериментах с клетками (WO 2008/041133) и защиту от летальных эффектов экспрессии склонного к неправильному сворачиванию инсулина при мутации Akita в эндоплазматическом ретикулуме бета-клеток поджелудочной железы линий Min6 и INS-1 (P. Tsaytler, Н.P. Harding, D. Ron and A. Bertolotti, Science, 332, 1 April 2011, 91-94).
Также показано, что гуанабенз дозозависимым образом способствует выживанию клеток HeLa, подвергнутых потенциально цитотоксическому стрессу эндоплазматического ретикулума, вызванного ингибитором N-гликозилирования туникамицином (P. Tsaytler, Н.P. Harding, D. Ron and A. Bertolotti, Science, 332, 1 April 2011, 91-94). Количественное определение жизнеспособности клеток показало, что гуанабенз приводил к удваиванию числа выживающих клеток при стрессе эндоплазматического ретикулума при средней эффективной концентрации ~0,4 мкМ. Ни агонист α2-адренергических рецепторов клонидин, ни антагонист α2-адренергических рецепторов эфароксан не защищали клетки от цитотоксического стресса эндоплазматического ретикулума, причем эфароксан не влиял на защитный эффект гуанабенза (P. Tsaytler, Н.P. Harding, D. Ron and A. Bertolotti, Science, 332, 1 April 201 1, 91-94). Эти наблюдения говорят о том, что механизм спасения клеток от летального стресса эндоплазматического ретикулума под действием гуанабенза не зависит от α2-адренергических рецепторов. Гуанабенз защищает клетки от потенциально летального накопления неправильно свернутых белков путем связывания с регуляторной субъединицей фосфатазы 1, PPP1R15A (GADD34), в результате чего избирательно прекращается обусловленное указанным стрессом дефосфорилирование α-субъединицы фактора инициации трансляции 2 (eIF2α). Под действием гуанабенза в подвергнутых стрессу клетках устанавливается такой уровень трансляции, с которым могут справиться имеющиеся шапероны, и тем самым восстанавливается белковый гомеостаз. Сообщалось, что гуанабенз не связывается с конститутивной субъединицей фосфатазы PPP1R15B (CReP) и таким образом не подавляет трансляцию в клетках, не испытывающих стресс (Р. Tsaytler, Н.P. Harding, D. Ron and A. Bertolotti, Science, 332, 1 April 2011, 91-94).
Невозможность поддерживать стабильность молекул белков (протеостаз) в эндоплазматическом ретикулуме путем клеточного ответа на неправильно свернутые белки (Unfolded Protein Response, UPR) считается фактором развития многих патологических состояний. Так, описанные в настоящем документе соединения, которые ингибируют фосфатазу eIF2 в ходе тонкой регуляции синтеза белков, могут принести пользу в лечении большого числа заболеваний, обусловленных стрессом, связанным с неправильным сворачиванием белков, в частности с накоплением неправильно свернутых белков.
В данном изобретении предлагаются новые соединения на основе структуры гуанабенза, которые могут иметь терапевтическое применение при лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и в частности с накоплением неправильно свернутых белков.
Сущность изобретения
В первом своем аспекте данное изобретение относится к соединениям, описываемым формулой (I), или к их фармацевтически приемлемым солям.
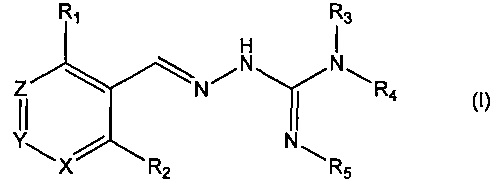
где R1 представляет собой алкил, Cl, F или Br;
R2 представляет собой Н или F;
R3 выбирают из Н и алкила;
R4 выбирают из Н и C(O)R6;
R5 представляет собой Н;
или R4 и R5 соединены, образуя гетероциклическую группировку, которая необязательно является замещенной одной иди более группами R10;
R6 выбирают из R7, OR7 и NR8R9;
R7, R8 и R9 независимо друг от друга выбирают каждый из алкила, циклоалкила, аралкила, циклоалкенила, гетероциклила и арила, каждый из которых необязательно является замещенным одной или более группами R10;
каждая группа R10 независимо от других выбирается из галогена и групп ОН, CN, СОО-алкила, аралкила, SO2-алкила, SO2-арила, СООН, СО-алкила, СО-арила, NH2, NH-алкила, N(алкил)2, CF3, алкила и алкокси-группы;
X и Z независимо друг от друга каждый представляет собой CR11, a Y выбирают из CR11 и N;
R11 представляет собой Н или F;
для применения при лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков.
Ранее проведенные исследования показали, что для того, чтобы обсуждаемые соединения проявляли полезную фармакологическую активность, арильная группа должна быть по меньшей мере двухзамещенной (см., например, D. Tribouillard-Tanvier et al, PLoS One 3, e1981 (2008) и EP 1908464 A, CNRS). Однако в противоположность ранее проведенным исследованиям заявитель обнаружил, что однозамещенные арильные производные тоже обладают желаемой активностью.
Кроме того, соединения, описываемые формулой (I), приведенной выше, предпочтительно не проявляют активности в отношении адренергических α2А-рецепторов по сравнению с ранее известными соединениями, например гуанабензом (фиг. 4). Это отсутствие активности в отношении α2 адренергических рецепторов приводит к тому, что соединения по настоящему изобретению полезны при лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, например болезни Шарко-Мари-Тута (СМТ), заболеваний сетчатки (предпочтительно пигментного ретинита, RP), болезни Альцгеймера (AD), болезни Паркинсона (PD), бокового амиотрофического склероза (ALS), болезни Хантингтона (HD), таупатий, прионных заболеваний, диабета (предпочтительно диабета типа 2) и рака. Отсутствие активности в отношении адренергических α2 рецепторов означает, что соединения, описываемые формулой (I), можно вводить пациентам в дозировке, подходящей для лечения упомянутых выше заболеваний, без какого-либо существенного влияния на кровяное давление.
Во втором своем аспекте данное изобретение относится к соединениям, описываемым формулой (II), или к их фармацевтически приемлемым солям,
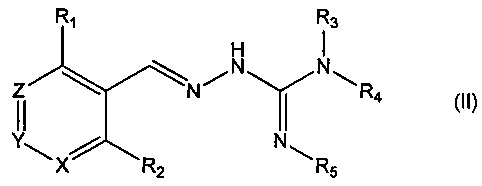
где R1 представляет собой алкил, Cl, F или Br;
R2 представляет собой Н или F;
R3 выбирают из Н и алкила;
R4 выбирают из Н и С(O)R6;
R5 представляет собой Н;
или R4 и R5 соединены, образуя гетероциклическую группировку, которая необязательно является замещенной одной иди более группами R10;
R6 выбирают из R7, OR7 и NR8R9;
R7, R8 и R9 независимо друг от друга выбирают каждый из алкила, циклоалкила, аралкила, циклоалкенила, гетероциклической группы, арила и гетероарила, каждый из которых необязательно является замещенным одной или более группами R10;
каждая группа R10 независимо от других выбирается из галогена и групп ОН, CN, СОО-алкила, аралкила, SO2-алкила, SO2-арила, СООН, СО-алкила, СО-арила, NH2, NH-алкила, N(алкил)2, CF3, алкила и алкокси-группы;
X и Z независимо друг от друга каждый представляет собой CR11, a Y представляет собой N;
R11 представляет собой Н или F.
В третьем своем аспекте данное изобретение относится к соединениям, описываемым формулой (III), или к их фармацевтически приемлемым солям,
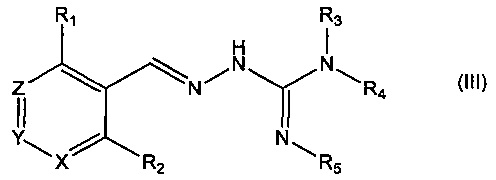
где R1 представляет собой алкил, Cl, F или Br;
R2 представляет собой Н или F;
R3 выбирают из Н и алкила;
R4 представляет собой C(O)R6;
R5 представляет собой Н;
или R4 и R5 соединены, образуя гетероциклическую группировку, которая необязательно является замещенной одной иди более группами R10;
R6 выбирают из R7, OR7 и NR8R9;
R7, R8 и R9 независимо друг от друга выбирают каждый из алкила, циклоалкила, аралкила, циклоалкенила, гетероциклической группы, арила и гетероарила, каждый из которых необязательно является замещенным одной или более группами R10;
каждая группа R10 независимо от других выбирается из галогена и групп ОН, CN, СОО-алкила, аралкила, SO2-алкила, SO2-арила, СООН, СО-алкила, СО-арила, NH2, NH-алкила, N(алкил)2, CF3, алкила и алкокси-группы;
X и Z независимо друг от друга каждый представляет собой CR11, a Y выбирают из CR11 и N; и
R11 представляет собой H или F.
В четвертом своем аспекте данное изобретение относится к соединениям, описываемым формулой (IV), или к их фармацевтически приемлемым солям,

где R1 представляет собой алкил или Br;
R2 представляет собой Н;
R3 выбирают из Н и алкила;
R4 выбирают из Н и C(O)R6;
R5 представляет собой Н;
или R4 и R5 соединены, образуя гетероциклическую группировку, которая необязательно является замещенной одной иди более группами R10;
R6 выбирают из R7, OR7 и NR8R9;
R7, R8 и R9 независимо друг от друга выбирают каждый из алкила, циклоалкила, аралкила, циклоалкенила, гетероциклила и арила, каждый из которых необязательно является замещенным одной или более группами R10;
каждая группа R10 независимо от других выбирается из галогена и групп ОН, CN, СОО-алкила, аралкила, SO2-алкила, SO2-арила, СООН, СО-алкила, СО-арила, NH2, NH-алкила, N(алкил)2, CF3, алкила и алкокси-группы;
X и Z независимо друг от друга каждый представляет собой СН, a Y представляет собой CR11;
R11 представляет собой Н или F.
В другом своем аспекте данное изобретение относится к фармацевтическим композициям, содержащим соединения, описываемые формулой (II), (III) или (IV), как описано выше, смешанные с подходящими фармацевтически приемлемыми разбавителями, носителями или эксципиентами.
Осуществление изобретения
Термин «алкил» в настоящем документе включает насыщенные алкильные группы с неразветвленной или с разветвленной цепью, которые могут быть замещенными (моно- или полизамещенными) либо незамещенными. Предпочтительно алкильные группы в контексте данного изобретения содержат 1-20 атомов углерода (C1-20-алкилы), более предпочтительно 1-15 атомов углерода (С1-15-алкилы), еще более предпочтительно 1-12 атомов углерода (С1-12-алкилы), еще более предпочтительно 1-6 атомов углерода (С1-6-алкилы), более предпочтительно 1-3 атомов углерода (С1-3-алкилы). Особенно предпочтительные по данному изобретению алкильные группы включают, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и гексил. Подходящие заместители включают, например, одну или более групп R10. Предпочтительно алкильная группа по данному изобретению является незамещенной.
Термин «циклоалкил» в настоящем документе относится к циклическим алкильным группам, которые могут быть замещенными (моно- или полизамещенными) либо незамещенными. Предпочтительно циклоалкильные группы в контексте данного изобретения содержат 3-12 атомов углерода (С3-12-циклоалкилы). Подходящие заместители включают, например, одну или более групп R10.
Термин «алкенил» в настоящем документе относится к группам, содержащим одну или более двойных связей между атомами углерода, причем эти группы могут быть разветвленными или неразветвленными, замещенными (моно- или полизамещенными) либо незамещенными. Предпочтительно алкенильные группы в контексте данного изобретения содержат 2-20 атомов углерода (С2-20-алкенилы), более предпочтительно 2-15 атомов углерода (С2-15-алкенилы), еще более предпочтительно 2-12 атомов углерода (С2-12-алкенилы) или предпочтительно 2-6 атомов углерода (С2-6-алкенилы), более предпочтительно 2-3 атома углерода (С2-3-алкенилы). Подходящие заместители включают, например, одну или более групп R10, определенных выше. Термин «циклический алкенил» трактуется соответственно.
Термин «арил» в настоящем документе относится к ароматическим группам, содержащим 6-12 атомов углерода (С6-12-арилы), которые могут быть замещенными (моно- или полизамещенными) либо незамещенными. Типичные примеры арилов по данному изобретению включают фенил и нафтил и др. Подходящие заместители включают, например, одну или более групп R10.
Термин «гетероцикл» в настоящем документе (где он называется также гетероциклилом и гетероциклической группой) относится к замещенным (моно- или полизамещенным) либо незамещенным, насыщенным, ненасыщенным либо частично ненасыщенным циклическим группам, содержащим один или более гетероатомов, выбираемых из N, О и S, причем эти гетероциклические группы необязательно содержат также одну или более групп СО. Подходящие заместители включают, например, одну или более групп R10. Термин «гетероцикл» охватывает гетероарильные группы и гетероциклоалкильные группы, описанные ниже.
Термин «гетероарил» в настоящем документе относится к ароматическим группам, содержащим 2-12 атомов углерода (С2-12-группы), которые могут быть замещенными (моно- или полизамещенными) либо незамещенными и содержат один или более гетероатомов. Предпочтительно гетероарильные группы по данному изобретению содержат 4-12 атомов углерода (ароматические С4-12-группы) и один или более гетероатомов, выбираемых из N, О и S. Подходящие гетероарильные группы включают пиррол, пиразол, пиримидин, пиразин, пиридин, хинолин, тиофен, 1,2,3-триазол, 1,2,4-триазол, тиазол, оксазол, изотиазол, изооксазол, имидазол, фуран и т.п. Опять-таки подходящие заместители включают, например, одну или более групп R10.
Термин «гетероциклоалкил» в настоящем документе относится к замещенным (моно- или полизамещенным) либо незамещенным циклическим алифатическим группам, содержащим один или более гетероатомов. Предпочтительные гетероциклоалкильные группы включают пиперидинил, пирролидинил, пиперазинил, тиоморфолинил и морфолинил. Более предпочтительно гетероциклоалкильные группы выбирают из N-пиперидинила, N-пирролидинила, N-пиперазинила, N-тиоморфолинила и N-морфолинила. Подходящие заместители включают, например, одну или более групп R10.
Термин «аралкил» в настоящем документе включает (но не ограничивается перечисленным здесь) группы, обладающие как арильными, так и алкильными функциональными элементами. Так, к примеру, этот термин включает группы, в которых один из атомов водорода алкильной группы замещен арильной группой, например фенильной группой, в которой необязательно имеются один или более заместителей, например галоген, алкил, алкоксильная группа, гидроксильная группа и т.п. Типичные аралкильные группы по данному изобретению включают бензил, фенэтил и т.п.
В одном из предпочтительных воплощений данного изобретения R1 представляет собой Cl, Br, Me или F, более предпочтительно О.
В одном из предпочтительных воплощений данного изобретения R2 представляет собой Н.
В одном из предпочтительных воплощений данного изобретения Y представляет собой CR11.
В другом предпочтительном воплощении данного изобретения Y представляет собой N.
В одном из предпочтительных воплощений данного изобретения R3 и R4 оба представляют собой Н.
В одном из предпочтительных воплощений данного изобретения R3 представляет собой Н и R4 представляет собой C(O)R6.
В одном из предпочтительных воплощений данного изобретения R6 представляет собой алкильную или алкоксильную группу, более предпочтительно метил (Me) или ОМе.
В одном из предпочтительных воплощений данного изобретения R4 и R5 соединены, образуя гетероциклическую группу, необязательно замещенную одной или более группами R10.
В одном из предпочтительных воплощений данного изобретения указанное соединение является соединением, описываемым формулой (Ia), или какой-либо его фармацевтически приемлемой солью,
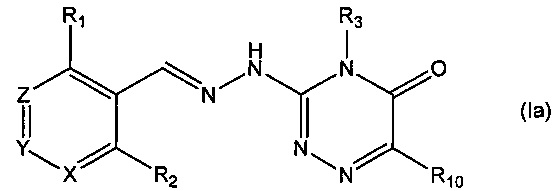
где R1, R2, R3 и R10 определены выше.
В одном особенно предпочтительном воплощении данного изобретения соединение, описываемое формулой (I), выбирают из следующих:
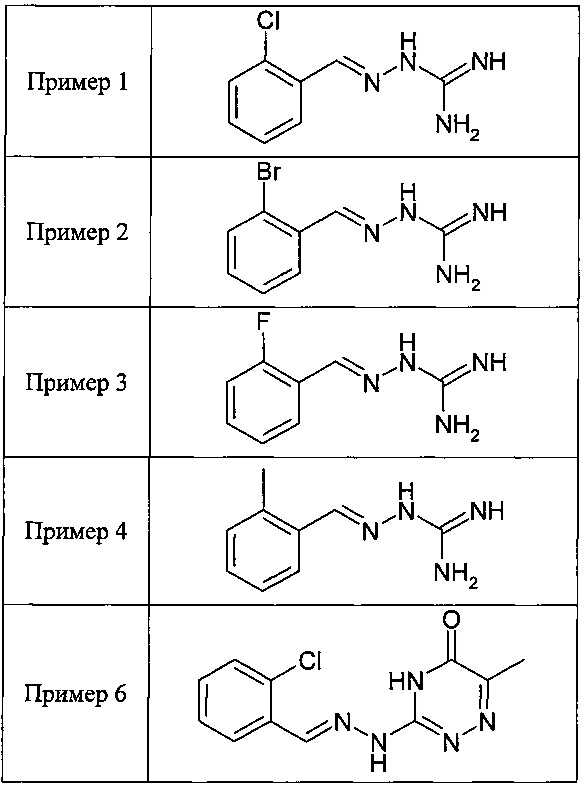
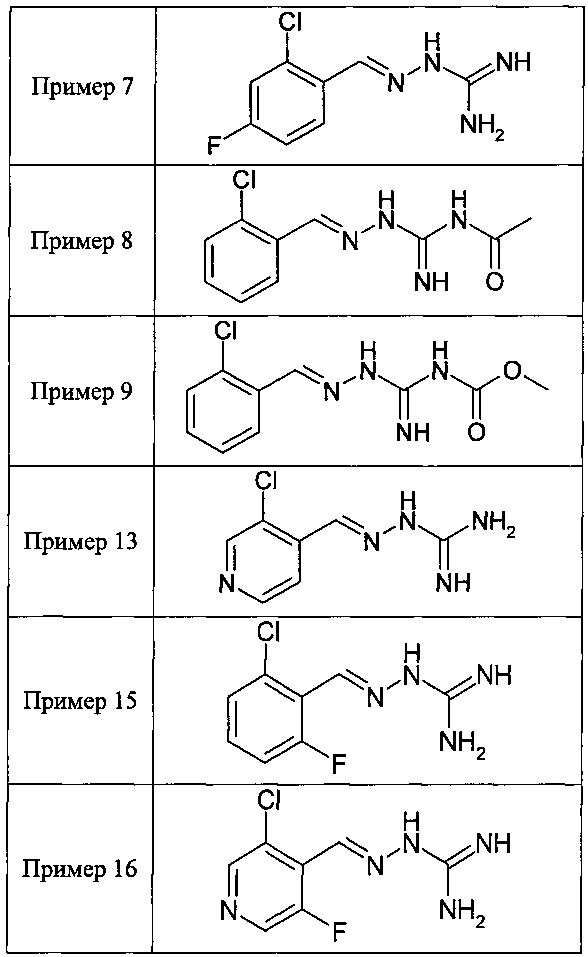
и их фармацевтически приемлемых солей.
В одном очень предпочтительном воплощении данного изобретения соединение, описываемое формулой (I), выбирают из соединений, представленных в этой таблице как Примеры 1, 3, 6 и 15.
Еще более предпочтительно, чтобы соединение, описываемое формулой (I), выбирали из Примеров 1 и 15, более предпочтительны Примера 1, то есть являлось 1-[(Е)-[(2-хлорфенил)метилиден]амино]-гуанилином.
Соединения
В одном из своих аспектов данное изобретение относится к соединениям, описываемым формулами (II), (III) или (IV), или к их фармацевтически приемлемым солям, определенным выше. Предпочтительные аспекты данного изобретения применимы mutatis mutandis (с необходимыми изменениями). Особенно предпочтительные соединения по этому аспекту данного изобретения включают описанные здесь соединения, обозначенные как Примеры 7, 8, 9,13 и 16.
Терапевтические применения
Заявитель показал, что соединения, описываемые формулой (I), можно применять терапевтически при лечении расстройств, связанных с накоплением неправильно свернутых белков. В частности, было показано, что соединения, описываемые формулой (I), защищают от цитотоксического стресса эндоплазматического ретикулума и возрастных расстройств.
Другой аспект данного изобретения относится к применению соединений, описываемых формулой (I) и определенных выше, при получении медикаментов для лечения расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков.
Словосочетание «получение медикамента» в настоящем документе включает применение одного или более из описанных выше соединений непосредственно в качестве медикамента, а также их использование для скрининга других активных агентов или на любой стадии изготовления такого медикамента.
Еще один аспект данного изобретения относится к способу лечения расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, у нуждающихся в этом индивидов, причем указанный способ включает введение указанному индивиду терапевтически эффективного количества соединения, описываемого формулой (I) и определенного выше.
Термин «способ» в настоящем документе относится к видам, средствам, методам и методикам действия, предназначенным для осуществления поставленной задачи, включая (но не ограничиваясь перечисленным здесь) такие виды, средства, методы и методики действия, которые либо известны практикующим специалистам в областях химии, фармакологии, биологии, биохимии и медицины, либо с легкостью разрабатываются из известных в этих областях видов, средств, методов и методик действия.
Термин «лечение» в настоящем документе включает нейтрализацию, существенное подавление, замедление или обращение прогрессирования заболевания или расстройства, существенное ослабление клинических симптомов заболевания или расстройства или существенное предотвращение возникновения клинических симптомов заболевания или расстройства.
Термин «терапевтически эффективное количество» в настоящем документе относится к такому количеству вводимого индивиду соединения, которое обеспечивает ослабление в некоторой степени одного или симптомов заболевания или расстройства, подлежащих лечению.
Клеточный ответ на неправильно свернутые белки (Unfolded Protein Response, UPR) является компонентом защитной системы клетки, которая приспосабливает сворачивание белков в эндоплазматическом ретикулуме к изменяющимся условиям. UPR активируется при накоплении несвернутых или неправильно свернутых белков в просвете эндоплазматического ретикулума. При этом UPR решает две задачи: (i) восстановление нормального функционирования клетки путем приостановления трансляции (синтеза белков) и (ii) активация сигнальных механизмов, ведущих к увеличению образования молекул-шаперонов, участвующих в сворачивании белков. Если эти цели не достигаются в пределах некоторого промежутка времени или приостановка трансляции продолжается, UPR нацеливается на апоптоз.
Вышележащими (upstream) компонентами клеточного ответа на неправильно свернутые белки являются находящиеся в эндоплазматическом ретикулуме трансмембранные белки IRE1, ATF6 и PERK, которые реагируют (т.е.активируются) при дефектах фолдинга для того, чтобы согласованным образом воздействовать на транскрипцию и трансляцию и восстановить протеостаз. Активированные IRE1 и ATF6 вызывают усиление транскрипции генов, продукты которых участвуют в сворачивании белков в эндоплазматическом ретикулуме, например генов, кодирующих шапероны BiP и GRP94. Активированный белок PERK вызывает ослабление синтеза белков в целом, фосфорилируя субъединицу фактора инициации трансляции 2 (eIF2α) по остатку серина в положении 51 и в то же время способствуя трансляции фактора транскрипции ATF4. Последний регулирует экспрессию другого фактора транскрипции - CHOP, который в свою очередь способствует экспрессии PPP1R15A/GADD34. Белок PPP1R15A, являющийся эффектором петли отрицательной обратной связи, прекращающей действие сигнального механизма UPR, приводит в действие каталитическую субъединицу фосфатазы 1 (РР1с), в результате чего eIF2α дефосфорилируется, так что синтез белков восстанавливается. Сбой механизма UPR вносит вклад во многие патологические состояния, которые могли бы быть купированы путем адекватной стимуляции этой адаптивной клеточной реакции. Избирательные ингибиторы индуцируемой стрессом эндоплазматического ретикулума фосфатазы PPP1R15A-PP1, дефосфорилирующей eIF2α, задерживают это дефосфорилирование и, следовательно, синтез белков именно и только в клетках, испытывающих указанный стресс, не влияя на синтез белка в клетках, не испытывающих такой стресс. Это продлевает полезные эффекты UPR. Временное ослабление синтеза белков полезно для клеток, испытывающих стресс, потому что при сокращении потока новосинтезированньгх белковых молекул увеличивается доступность шаперонов, что защищает от стресса, обусловленного неправильным сворачиванием белков (P. Tsaytler, Н.P. Harding, D. Ron and A. Bertolotti, Science, 332,1 April 2011, 91-94). Неизбирательные ингибиторы фосфатазы 2, дефосфорилирующей eIF2α, могут иметь нежелательные эффекты, поскольку непрерывное подавление трансляции губительно для клетки. В самом деле, у мышей ликвидация генетическими методами и PPP1R15A, и PPP1R15B приводит к гибели на ранних стадиях эмбрионального развития, что свидетельствует о губительности для организма в целом ингибирования обеих фосфатаз, дефосфорилирующих eIF2α, - PPP1R15A-PP1 и PPP1R15B-PP1. Напротив, ликвидация генетическими методами только PPP1R15A не имела вредных последствий в экспериментах на мышах (Harding et al., 2009, Proc. Natl. Acad. Sci. USA, 106, 1832-1837). Кроме того, можно ожидать, что специфичные ингибиторы PPP1R15A никак не влияют на клетки, не испытывающие стресс, связанный с неправильным сворачиванием белков, так как PPP1R15A не экспрессируется в отсутствие такого стресса. Таким образом, можно рассчитывать, что избирательные ингибиторы PPP1R15A безопасны. Неизбирательные ингибиторы обеих фосфатаз, дефосфорилирующих eIF2α, также могут оказаться полезными для лечения заболеваний, связанных с неправильным сворачиванием белков, если их использовать в дозах, вызывающих лишь частичное ингибирование указанных фосфатаз.
Защита клеток от стресса эндоплазматического ретикулума может быть определена количественно соответствующими аналитическими методами; например, ее можно определять, используя клетки HeLa, в которых стресс эндоплазматического ретикулума вызывают путем прибавления среды, содержащей туникамицин, представляющий собой смесь гомологичных нуклеозидных антибиотиков, ингибирующих ферменты трансферазы семейства UDP-HexNAc: полипренол-Р HexNAc-1-P и используемых для индукции ответа на несвернутые белки. Спустя некоторое время определяют жизнеспособность клеток в присутствии и в отсутствии соединений-ингибиторов, измеряя восстановление WST-8 в формазан с помощью стандартного аналитического набора для определения жизнеспособности клеток (например, Cell Viability Counting Kit-8 производства Dojindo). Защиту клеток от стресса эндоплазматического ретикулума выражают как увеличение (в процентах) числа жизнеспособных клеток (по сравнению с контролем) после стресса эндоплазматического ретикулума. Более подробно пригодные для такого определения аналитические методы представлены в разделе «Примеры».
В одном из предпочтительных воплощений данного изобретения соединение, описываемое формулой (I), способно продлевать защитный эффект клеточного ответа на белки ненативной конформации (UPR) по сравнению с контролем (т.е. при отсутствии ингибирующего соединения) по меньшей мере на 20%, более предпочтительно по меньшей мере на 30%, еще более предпочтительно по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, еще более предпочтительно по меньшей мере на 90%.
Заявителем было показано, что соединения, описываемые формулой (I), являются ингибиторами действия PPP1R15A-PP1, вызывающими защитный эффект. Предпочтительно указанные соединения обладают защитным эффектом, характеризующимся ЕС50 менее чем около 5 мкМ, более предпочтительно менее чем около 2 мкМ, еще более предпочтительно менее чем около 1 мкМ. Указанное соединение предпочтительно не имеет α2-адренергической активности. Таким образом, в одном из предпочтительных воплощений данного изобретения соединение, описываемое формулой (I), не проявляет никакой активности в функциональном тесте на α2-адренергическую активность.
Заявителем также было показано, что некоторые соединения, описываемые формулой (I), избирательно ингибируют PPP1R15A-PP1, тем самым продлевая защитный эффект клеточного ответа на неправильно свернутые белки (UPR) и спасая клетки от стресса, обусловленного неправильным сворачиванием белков. Таким образом, описанные в данном изобретении ингибиторы PPP1R15A-PP1 могут иметь терапевтические применения при лечении различных заболеваний, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков.
В одном из воплощений данного изобретения соединения, описываемые формулой (I), способны ингибировать ферменты PPP1R15A и PPP1R15B.
В одном из предпочтительных воплощений данного изобретения соединения, описываемые формулой (I), способны избирательно ингибировать PPP1R15A по сравнению с PPP1R15B.
В одном из предпочтительных воплощений данного изобретения соединения, описываемые формулой (I), предназначены для применения при лечении нейродегенеративных заболеваний, а именно тех, в механизме развития которых участвует накопление неправильно свернутых белков (Brown et al., 2012, Frontiers in Physiology, 3, Article 263).
В одном из особенно предпочтительных воплощений данного изобретения соединения, описываемые формулой (I), предназначены для применения при лечении заболеваний, выбираемых из болезни Шарко-Мари-Тута, тяжелого синдрома Дежерина-Сотта (Voermans et al., 2012, J. Peripher New Syst., 17(2), 223-5), заболеваний сетчатки (например, но не ограничиваясь перечисленным здесь, пигментного ретинита, цилиопатий сетчатки, макулярной дегенерации сетчатки, диабетической ретинопатии), болезни Альцгеймера, болезни Паркинсона, бокового амиотриофического склероза, болезни Хантингтона, таупатий, прионных заболеваний, диабета типа 2 и/или типа 1, рака, например, но не ограничиваясь только ею, множественной миеломы.
В одном из своих воплощений данное изобретение относится к соединениям, описываемым формулой (I) и определенным выше, предназначенным для применения при лечении расстройств, связанных с механизмом фосфорилирования eIF2α, в развитии которых участвует накопление неправильно свернутых белков. Предпочтительно такое расстройство связано с ферментом PPP1R15A. Примеры таких расстройств включают заболевания, обусловленные неправильным сворачиванием белков, например (не ограничиваясь перечисленным здесь) болезнь Шарко-Мари-Тута, тяжелый синдром Дежерина-Сотта и пигментный ретинит.
В другом своем воплощении данное изобретение относится к соединениям, описываемым формулой (I) и определенным выше, предназначенным для применения при лечении расстройств, обусловленных или сопровождающихся, или связанных с фосфорилированием eIF2α и/или активностью фермента PPP1R15A.
В другом своем воплощении данное изобретение относится к соединениям, описываемым формулой (I) и определенным выше, предназначенным для применения при лечении расстройств клеточного ответа на неправильно свернутые белки (UPR), например (не ограничиваясь только этим) при старении (Naidoo et al., 2008, J Neurosci, 28, 6539-48).
Выражение «заболевание или расстройство, связанное с PPP1R15A» в настоящем документе относится к заболеваниям или расстройствам, характеризующимся аномальной активностью фермента PPP1R15A, в механизме развития которых участвует накопление неправильно свернутых белков. Термин «аномальная активность» относится к ситуациям, когда (i) PPP1R15A экспрессируется в клетках, в которых в норме нет экспрессии этого белка; (ii) имеет место усиленная экспрессия PPP1R15A или (iii) усилена активность PPP1R15A.
В другом своем воплощении данное изобретение относится к способу лечения млекопитающих, страдающих от патологического состояния, облегчаемого ингибированием PPP1R15A, в механизме развития которого участвует накопление неправильно свернутых белков, причем этот способ включает введение в организм указанного млекопитающего терапевтически эффективного количества соединения, описываемого формулой (I) и определенного выше.
В другом своем воплощении данное изобретение относится к ингибиторам PPP1R15A, описываемым формулой (I), или их фармацевтически приемлемым солям для применения при лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, и/или расстройств механизма клеточного ответа на неправильно свернутые белки (UPR), причем указанные соединения-ингибиторы не обладают активностью агонистов α2-адренергических рецепторов или обладают такой активностью в меньшей степени, чем гуанабенз.
В другом своем воплощении данное изобретение относится к ингибиторам PPP1R15A, описываемым формулой (I), или их фармацевтически приемлемым солям для применения при лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, и/или расстройств механизма клеточного ответа на неправильно свернутые белки (UPR), причем указанные соединения не ингибируют трансляцию в клетках, не испытающих стресс эндоплазматического ретикулума, в которых экспрессируется фермент PPP1R15B.
В другом своем воплощении данное изобретение относится к способу лечения расстройств, характеризующихся ответной активностью на стресс эндоплазматического ретикулума с накоплением неправильно свернутых белков, причем этот способ включает введение пациенту терапевтически эффективного количества по меньшей мере одного соединения, описываемого формулой (I), которое модулирует ответ на указанный стресс.
В другом своем воплощении данное изобретение относится к ингибиторам PPP1R15A, описываемым формулой (I), или их фармацевтически приемлемым солям для применения при лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, и/или расстройств механизма клеточного ответа на неправильно свернутые белки (UPR), причем указанные соединения действуют избирательно на холофосфатазу PPP1R15A-PP1 и не действуют на холофосфатазу PPP1R15B-PP1 или же эта активность понижена, а отношение (активность в отношении холофосфатазы PPP1R15A-РР1/активность в отношении PPP1R15B-PP1) для указанных соединений по меньшей мере равно такому отношению для гуанабенза или превышает его.
В другом своем воплощении данное изобретение относится к ингибиторам PPP1R15A, описываемым формулой (I), или их фармацевтически приемлемым солям для применения при лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, и/или расстройств механизма клеточного ответа на неправильно свернутые белки (UPR), причем
- указанные соединения обладают активностью в отношении холофосфотазы PPP1R15A-PP1 и не обладают активностью или обладают сниженной активностью в отношении холофосфотазы PPP1R15B-PP1; и
- отношение (активность в отношении холофосфотазы PPP1R15A-РР1/активность в отношении PPP1R15B-PP1) для указанных соединений по меньшей мере равно таковому отношению для гуанабенза или превышает его; и
- указанные соединения не обладают активностью агонистов α2-адренергических рецепторов или обладают такой активностью в меньшей степени, чем гуанабенз.
В настоящем документе заболевания или расстройства, отличающиеся наличием активного ответа на стресс эндоплазматического ретикулума, и/или заболевания или расстройства, связанные со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, и/или расстройства клеточного ответа на неправильно свернутые белки (UPR) выбирают из болезни Шарко-Мари-Тута, тяжелого синдрома Дежерина-Сотта (Voermans et al., 2012, J. Peripher. New Syst, 17(2), 223-5), заболеваний сетчатки (например, но не ограничиваясь перечисленным здесь, пигментного ретинита, цилиопатий сетчатки, макулярной дегенерации сетчатки, диабетической ретинопатии), болезни Альцгеймера, болезни Паркинсона, бокового амиотриофического склероза, болезни Хантингтона, диабета (например, диабета типа 2, но не только его) и рака, такого как, множественная миелома, не ограниченного этим примером.
Болезнь Шарко-Мари-Тута
В одном из предпочтительных воплощений данного изобретения соединения, описываемые формулой (I), предназначаются для применения при лечении Шарко-Мари-Тута.
Известно более 100 мутаций гена, кодирующего белок Р0 миелина (трансмембранный белок, однократно пересекающий мембрану; это основной белок, производимый миелинизирующими шванновскими клетками), которые приводят к нейропатии Шарко-Мари-Тута (D'Antonio et al., 2009, J. Neurosci. Res., 87, 3241-9). Эти мутации, наследующиеся по доминантному типу, приводят к возникновению токсичности и потому болезнетворны (D'Antonio et al., 2009, J. Neurosci. Res., 87, 3241-9). У человека при делеции остатка серина в положении 63 полипептидной цепи белка Р0 (P0S63del) развивается нейропатия Шарко-Мари-Тута типа 1В; сходная нейропатия с демиелинизацией наблюдается у трансгенных мышей. Мутантный белок накапливается в эндоплазматическом ретикулуме и вызывает клеточный ответ на неправильно свернутые белки (UPR) (D'Antonio et al, 2009, J. Neurosci. Res., 87, 3241-9). В экспериментах на мышах с синдромом, аналогичным болезни Шарко-Мари-Тута, генетическая ликвидация проапоптозного гена CHOP, белок-продукт которого участвует в клеточном ответе на неправильно свернутые белки, приводила к восстановлению моторной функции (Pennuto et al, 2008, Neuron, 57, 393-405). Из того факта, что ингибирование PPP1R15A приводит к почти полному исчезновению экспрессии CHOP в клетках, испытьшающих стресс эндоплазматического ретикулума, следует, что генетическое или фармакологическое подавление активности PPP1R15A должно уменьшать степень моторной дисфункции при синдроме типа Шарко-Мари-Тута у мышей. Недавно Д'Антонио с сотрудниками (D'Antonio et al., 2013, Resetting translational homeostatis restores myelination in CMT disease type 1B mice, J. Exp. Med. Vol. pp. 1-18) показали, что у мышей с P0S63del обработка салубриналом (низкомолекулярным ингибитором фосфатазы PPP1R15A, вызывающим увеличение уровня фосфорилирования eIF2α; см. Воусе et al., 2005, Science Vol. 307, pp. 935-939), приводила к почти полному восстановлению двигательной способности, определяемой при помощи установки с вращающимся валиком (тест «RotaRod»), что сопровождалось исчезновением морфологических и электрофизиологических аномалий. Не только у мышей с P0S63del имеет место накопление мутантных белков, связанных с синдромом типа болезни Шарко-Мари-Тута; идентифицировано по меньшей мере пять мутантных форм белка Р0, задерживающихся в эндоплазматическом ретикулуме и вызывающих клеточный ответ на неправильно свернутые белки (Pennuto et al., 2008, Neuron, Vol. 57, pp. 393-405; Saporta et al., 2012, Brain, Vol. 135, pp. 2032-2047). Кроме того, показано, что неправильное сворачивание белков и накопление неправильно свернутых белков в эндоплазматическом ретикулуме участвует в патогенезе также других нейропатий Шарко-Мари-Тута в связи с мутациями в генах белков периферического миелина РМР22 и Сх32 (Colby et al., 2000, Neurobiol. Disease, Vol. 7, pp. 561-573; Kleopa et al., 2002, J. Neurosci. Res., Vol. 68, pp. 522-534; Yum et al., 2002, Neurobiol. Dis. Vol. 11, pp. 43-52). Однако салубринал токсичен и его нельзя использовать для лечения людей (D'Antonio et al., 2013, Resetting, J. Exp.Med., Vol. pp. 1-18). В противоположность этому ингибиторы PPP1R15A, описываемые формулой (I) должны быть безопасны и могут использоваться для лечения нейропатий Шарко-Мари-Тута типов 1А и 1В.
Заболевания сетчатки
В последнее время опубликован ряд работ, содержащих данные, свидетельствующие об участии клеточного ответа на неправильно свернутые белки (UPR) в развитии дегенерации сетчатки: наследственной дегенерации сетчатки, например цилиопатий сетчатки и пигментного ретинита; макулярной дегенерации сетчатки; ретинопатии недоношенных; дегенерации сетчатки, индуцированной светом; отслоения сетчатки, диабетической ретинопатии и глаукомы (см. обзор в работе Gorbatyuk et Gorbatyuk, 2013. Retinal degeneration: Focus on the unfolded protein response, Molecular Vision Vol. 19 pp 1985-1998).
В одном из предпочтительных воплощений данного изобретения соединения, описываемые формулой (I), предназначены для применения при лечении заболеваний сетчатки, более предпочтительно - наследственной дегенерации сетчатки, например цилиопатий сетчатки и пигментного ретинита; макулярной дегенерации сетчатки; ретинопатии недоношенных; дегенерации сетчатки, индуцированной светом; отслоения сетчатки, диабетической ретинопатии и глаукомы.
Цилиопатий сетчатки - группа редких генетических расстройств, характеризующихся дефектом первичных ресничек фоторецепторных клеток, что приводит к пигментному ретиниту. Сообщалось, что этот дефект обусловливает стресс эндоплазматического ретикулума из-за накопления белка во внутренних сегментах фоторецепторов, что в свою очередь вызывает клеточный ответ на неправильно свернутые белки (UPR); см. WO 2013/124484. При цилиопатиях очень часто имеет место дегенерация сетчатки: она наблюдается либо при собственно пигментном ретините, как при врожденном амаврозе Лебера или пигментном ретините, сцепленном с Х-хромосомой, либо при состояниях типа синдрома Барде-Бидля (BBS) или синдроме Альстрема (ALMS). В данном изобретении цилиопатий сетчатки выбирают из группы, состоящей из синдрома Барде-Бидля, синдрома Сениора-Локена, синдрома Жубера, синдрома Салдино-Мейнцера, синдрома Сенсенбреннера, синдрома Жена, синдрома Меккеля-Грубера, синдрома Альстрема, синдрома MORM (умственная отсталость, ожирение, дистрофия сетчатки, микропенис), врожденного амавроза Лебера, вызываемого мутацией одного из генов ресничек, и пигментного ретинита, сцепленного с Х-хромосомой, вызываемого мутацией в гене RPGR.
Пигментный ретинит - наследственное дегенеративное заболевание глаз, приводящее к тяжелым нарушениям зрения и часто - к слепоте. Этот дефект является наиболее распространенной причиной генетически обусловленной слепоты. У больных с пигментным ретинитом наблюдаются один или более из следующих симптомов: ночная слепота; туннельное зрение (отсутствует периферийное зрение); периферийное зрение (отсутствует центральное зрение); сеточное зрение; антипатия к яркому свету; медленное приспособление от темного к светлому и наоборот; нечеткость зрения; плохое различение цветов; крайняя усталость.
Последние данные подтверждают роль стресса эндоплазматического ретикулума в апоптозе и гибели клеток в сетчатке (Jing et al., 2012, Exp. Diabetes. Res, 2012, 589589). Пигментный ретинит - наиболее распространенная форма наследственной дегенерации сетчатки; его обусловливают более 100 мутаций в гене родопсина (Dryja et al., 1991, Proc. Natl. Acad. Sci. USA, 88, 9370-4). Белок фоторецепторных клеток сетчатки родопсин представляет собой трансмембранный рецептор, связанный с G-белком; он осуществляет превращение света в фоторецепторах-палочках и состоит из белковой части длиной 348 аминокислотных остатков (опсина), пересекающей мембрану фоторецепторной клетки, и ковалентно связанного с ней 11-цис-ретиналя (Palczewski, 2006, Annu. Rev. Biochem., 75, 743-67). Мутации гена родопсина, обусловливающие пигментный ретинит, являются в основном миссенс-мутациями, распределенными по полипептидной цепи (Dryja et al., 1991, Proc. Natl. Acad. Sci. USA, 88, 9370-4), что похоже на мутации гена SOD1, вызывающие боковой амиотрофический склероз (Valentine et al., 2005, Annu. Rev. Biochem., 74, 563-93). Мутантные формы родопсина изучались в различных системах, и результаты, полученные в экспериментах по гетерологичной экспрессии с культурами клеток млекопитающих, трансгенными мышами и дрозофилами согласуются между собой (Griciuc et al., 2011, Trends Mol. Med., 17, 442-51). Мутантная форма родопсина, наиболее часто фигурирующая при пигментном ретините, имеет ненативную конформацию, не связывается с 11-цис-ретиналем и не попадает на клеточную поверхность, а задерживается в эндоплазматическом ретикулуме (Griciuc et al., 2011, Trends Mol. Med.., 17, 442-51). Неправильное сворачивание белковой части мутантных форм родопсина обусловливает стресс эндоплазматического ретикулума и гибель клеток-палочек сетчатки (Griciuc et al., 2011, Trends Mol. Med., 17, 442-51). Это служит веским указанием на то, что ингибиторы PPP1R15A по данному изобретению окажутся полезными для лечения пигментного ретинита.
Возрастная макулярная дегенерация (AMD) в США является основной причиной практической слепоты у лиц старше 65 лет. Сообщалось, что в настоящее время на это заболевание приходится 54% случаев слепоты среди белого населения США. По прогнозам, из-за роста заболеваемости макулярной дегенерацией сетчатки количество слепых людей в США к 2020 году увеличится на 70%. Было показано (Shen et al., 2011. Effect of Guanabenz on Rat AMD Models and Rabbit Choroidal Blood - Vol. 5 pp 27-31), что гуанабенз существенно защищает пигментный эпителий сетчатки от дегенерации, индуцируемой иодатом натрия (NaIO3), подавляет развитие хориоидальной неоваскуляризации у крыс с макулярной дегенерацией сетчатки, вызванной воздействием лазерного излучения, и значительно усиливает хориоидальный кровопоток in vivo.
Однако гуанабенз является агонистом α2-адренергических рецепторов, и в силу его гипотензивной активности этот препарат нельзя использовать для лечения макулярной или иной дегенерации сетчатки.
Соединения по данному изобретению, которые, как и гуанабенз, ингибируют PPP1R15A, но предпочтительно не обладают активностью в отношении α2-адренергических рецепторов, должны ослаблять макулярную или иную дегенерацию сетчатки.
Болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Хантингтона, таупатиии и прионные болезни
В одном из предпочтительных воплощений данного изобретения соединения, описываемые формулой (I), предназначены для применения при лечении заболеваний, выбираемых из болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза, болезни Хантингтона, таупатиий и прионных болезней.
Поскольку накопление белков с ненативной конформацией является отличительной чертой различных заболеваний и поскольку показано, что соединения, описываемые формулой (I), сокращают накопление четырех неродственных неправильно свернутых и болезнетворных белков (фиг. 4-6), соединения, описываемые формулой (I), должны быть полезны также и для лечения других нейродегенеративных заболеваний, обусловленных накоплением неправильно свернутых белков.
Кроме того, поскольку индукция клеточного ответа на неправильно свернутые белки (UPR) является отличительной чертой этих заболеваний, обусловленных накоплением неправильно свернутых белков, соединения, описываемые формулой (I), должны быть полезны для лечения этих заболеваний (Scheper and Hoozemans, 2009; Kim et al., 2008).
Гуанабенз ослабляет симптомы у мышей, зараженных прионами (D. Tribouillard-Tanvier et al., 2008, PLos One, 3,e, 1981). Однако из-за гипотензивной активности гуанабенза этот препарат не годится для лечения болезней, связанных с неправильным сворачиванием белков, у человека. Напротив, описанные в настоящей работе ингибиторы фермента PPP1R15A, не обладающие активностью в отношении α2-адренергических рецепторов, могут быть полезны для лечения прионных заболеваний.
Болезнь Паркинсона
Салубринал подавляет дефосфорилирование eIF2α при участии фосфатазы PPP1R15A (Воусе et al., 2005, Science, Vol.307, pp 935-939). Недавно на двух животных моделях α-синуклеинопатии было показано, что салубринал значительно ослабляет проявления заболевания (см. Colla et al., J. of Neuroscience, 2012, Vol. 32, №10, pp. 3306-3320).
Не связывая себя какой-либо теорией, отметим, что, как можно ожидать, соединения по данному изобретению, являющиеся ингибиторами PPP1R15A, должны ослаблять проявления α-синуклеинопатий, например болезни Паркинсона.
Боковой амиотрофический склероз
Показано, что салубринал увеличивает продолжительность жизни у трансгенных мышей линии G93A-SOD1, служащих моделью заболеваний с поражение двигательных нейронов (см. Saxena et al., Nature Neuroscience, 2009, Vol. 12 pp 627-636). He связывая себя какой-либо теорией, отметим, что, как можно ожидать, соединения по данному изобретению, являющиеся ингибиторами фермента PPP1R15A, должны ослаблять проявления бокового амиотрофического склероза с мутацией G93A (замена глицина в 93-м положении на аланин) в гене супероксиддисмутазы (SOD1). Известно более 140 мутаций (в основном миссенс-мутаций) в гене SOD1, приводящих к агрегации дефектного белка при семейной форме бокового амиотрофического склероза. Поскольку при разных мутациях SOD1 наблюдаются одинаковые дефекты (Munch et al., 2010), считается, что и механизм патогенеза бокового амиотрофического склероза при различных мутациях SOD1 один и тот же. Кроме того, при спорадической и при семейной форме этого заболевания клинические проявления существенно не различаются, и в настоящее время признано, что как в спорадической, так и в семейной форме бокового амиотрофического склероза центральную роль играет неправильное сворачивание белков. Следовательно, соединения по данному изобретению, описываемые формулой (I), можно использовать для лечения как семейной, так и спорадической формы бокового амиотрофического склероза.
Заявителем было обнаружено, что спектр защитной активности гуанабенза в отношении клеток, испытывающих стресс, обусловленный неправильным сворачиванием белков, на удивление широкий: этот препарат, помимо всего прочего, уменьшает накопление в клетках мутантного хантингтина (WO 2008/041133). Данный факт является весьма неожиданным, потому что мутантный хантингтин находится в цитозоле или в ядре. Однако в уровне техники имелись указания на то, что метаболизм хангтинтина связан с ответом на стресс эндоплазматического ретикулума (Nishitoh et al, 2002, Genes Dev., 16, 1345-55; Rousseau et al, 2004, Proc. Natl. Acad. Sci. U.S.A, 101, 9648-53; Duennwald and Lindquist, 2008, Genes Dev., 22, 3308-19). Полученные заявителем данные о том, что гуанабенз защищает клетки от цитотоксического стресса эндоплазматического ретикулума и уменьшает накопление мутантного хантингтина, поддерживают то предположение, что в стрессе эндоплазматического ретикулума есть такие аспекты, которые влияют на накопление мутантного хантингтина. Также расстройство клеточного ответа на стресс энедоплазматического ретикулума участвует в различных патологических состояниях, включая диабет типа 2 и нейродегенеративные расстройства (Scheper and Hoozemans, 2009, Curr. Med. Chem., 16, 615-26). Таким образом, не связывая себя какой-либо теорией, отметим, что, как полагают, гуанабенз и родственные ему соединения обладают защитным эффектом при вторичных нарушениях клеточного ответа на неправильно свернутые белки (UPR), а именно при расстройствах, обусловленных накоплением неправильно свернутых белков, находящихся вне эндоплазматического ретикулума, которые вызывают клеточный ответ на неправильно свернутые белки.
Диабет
В одном из предпочтительных воплощений данного изобретения соединения, описываемые формулой (I), предназначены для применения при лечении диабета, предпочтительно диабета типа 2.
Секретирующие инсулин β-клетки поджелудочной железы испытывают огромную нагрузку в связи с биосинтезом и секрецией инсулина, которые подлежат строгой регуляции. Соответственно, этим клеткам крайне необходимо, чтобы поддерживался гомеостаз эндоплазматического ретикулума (Back and Kaufman, 2012, Annu. Rev. Biochem., 81, 767-93). Диабет типа 2 проявляется повышенным уровнем глюкозы в крови из-за резистентности к инсулину в жировой, мышечной и печеночной тканях и/или нарушенной секреции инсулина β-клетками поджелудочной железы. В ответ на это масса β-клеток поджелудочной железы увеличивается и их функция усиливается. В конце концов, нагрузка на эти клетки оказывается такой большой, что они выходят из строя и гибнут. Все больше данных свидетельствует о том, что гибель β-клеток поджелудочной железы происходит в результате стресса эндоплазматического ретикулума (Back and Kaufman, 2012, Annu. Rev. Biochem., 81, 767-93). Важно, что, как показано в экспериментах с различными моделями диабета, делеция гена Chop улучшает функционирование β-клеток поджелудочной железы (Song et al., 2008, J. Clin. Invest., 118, 3378-89). He ограничивая себя какой-либо теорией, отметим, что, как полагают, ингибиторы фосфатазы PPP1R15A-PP1 должны улучшать функционирование β-клеток поджелудочной железы при диабете типа 2, поскольку ингибирование этого фермента снижает уровень проапоптозного белка CHOP в процессе стресса эндоплазматического ретикулума (Tsaytler et al., 2011, Science, 332, 91-4).
Рак
В одном из предпочтительных воплощений данного изобретения соединения, описываемые формулой (I), предназначены для применения при лечении рака.
У раковых клеток высокие метаболические потребности, и их пролиферация определяется успешностью синтеза белков. В регуляции белкового гомеостаза, дифференцировки, пролиферации и злокачественного перерождения клеток ключевую роль играет инициация трансляции. Усиление инициации трансляции способствует возникновению рака, а снижение уровня инициации трансляции, наоборот, может ослабить опухолевый рост (Donze et al, 1995, EMBO J., 14, 3828-34; Pervin et al, 2008, Cancer Res., 68, 4862-74; Chen et al, 2011, Nat. Chem. Biol., 7, 610-6). He ограничивая себя какой-либо теорией, отметим, что, как полагают, ингибирование фосфатазы PPP1R15A может избирательно снижать уровень трансляции в опухолевых клетках и таким образом ослаблять опухолевый рост.
Старение
Известно, что при старении расстраиваются ответные реакции организма на стресс и, в частности, с возрастом нарушается клеточный ответ на неправильно свернутые белки (Naidoo et al, 2008, J. Neurosci., 28, 6539-48). Следовательно, продление благотворного эффекта клеточного ответа на неправильно свернутые белки путем ингибирования фермента, дефосфорилирующего eIF2α, может ослабить связанные с возрастом расстройства.
Фармацевтические композиции
Для применения по данному изобретению описанные в настоящем документе соединения или их физиологически приемлемые соли, эфиры или иные физиологически функциональные производные могут быть представлены в виде фармацевтических композиций, содержащих эти соединения или их физиологически приемлемые соли, сложные эфиры или иные физиологически функциональные производные вместе с одним или более фармацевтически приемлемым носителем и необязательно другими ингредиентами, обладающими терапевтическим и/или профилактическим эффектом. Носитель (носители) должен быть приемлемым в смысле совместимости с другими ингредиентами композиции и не причинять вреда индивиду, которому вводится указанная композиция. Композиции по данному изобретению могут быть предназначены для медицинского или ветеринарного применения.
Примеры описанных в настоящем документе пригодных эксципиентов для различных форм фармацевтических композиций можно найти в работе "Handbook of Pharmaceutical Excipients, второе издание, (1994), под редакцией A. Wade и P.J. Weller.
Приемлемые для терапевтического применения носители или разбавители хорошо известны в области фармацевтики и описаны, например, в работе Remington's Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro edit. 1985).
Примеры пригодных носителей включают лактозу, крахмал, глюкозу, метилцеллюлозу, стеарат магния, маннит, сорбит и т.п. Примеры пригодных разбавителей включают этиловый спирт, глицерин и воду.
Выбор фармацевтического носителя, разбавителя или иного эксципиента определяется предполагаемым путем введения препарата в организм пациента и обычной фармацевтической практикой. Фармацевтические композиции по данному изобретению могут содержать, помимо указанного носителя, разбавителя и иных эксципиентов, один или более каких-либо подходящих связующих агентов, агентов, улучшающих скольжение, суспендирующих агентов, покрывающих агентов, солюбилизирующих агентов, забуферивающих веществ, ароматизаторов, поверхностно-активных веществ, загустителей, консервантов (включая антиоксиданты) и т.п., а также веществ, включаемых в композиции для придания им изотоничности с кровью пациента.
Примеры пригодных связующих агентов включают крахмал, желатин, природные сахара (например, глюкозу, безводную лактозу, сыпучую (не комкующуюся) лактозу, β-лактозу, кукурузные подсластители, природные и синтетические камеди (например, аравийскую камедь, трагакантовую камедь или альгинат натрия), карбоксиметилцеллюлозу и полиэтиленгликоль.
Примеры пригодных агентов, улучшающих скольжение, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п.
В композицию по данному изобретению могут входить консерванты, стабилизирующие агенты, красители и даже ароматизирующие агенты. Примеры консервантов включают бензоат натрия, сорбиновую кислоту и эфиры парагидроксибензойной кислоты. Можно также использовать антиоксиданты и суспендирующие агенты.
Фармацевтические композиции по данному изобретению включают составы, пригодные для перорального, местного (включая, накожное, буккальное, глазное и подъязычное применение), ректального или парентерального (включая подкожное, внутрикожное, внутримышечное и внутривенное введение), назального, внутриглазного и ингаляционного введения, например путем вдыхания. Если есть необходимость, композиция по данному изобретению может быть представлена раздельными единицами дозирования и может быть получена любым из известных в области фармацевтики способов. Все эти способы включают этап объединения активного компонента с жидкими носителями или тонкодисперсными твердыми носителями, или с тем и другим вместе и затем, при необходимости, формование продукта желаемым образом.
Фармацевтические композиции по данному изобретению, пригодные для перорального введения и включающие твердый носитель, представлены предпочтительно в единичной (дозированной) лекарственной форме, например в форме пилюль, капсул или таблеток, содержащих определенное количество активного соединения. Препарат в форме таблеток можно изготавливать путем прессования или формования, необязательно с одним или более вспомогательных ингредиентов. Прессованные таблетки могут быть изготовлены с помощью машины для прессования из активного компонента в сыпучей (не комкующейся) форме, например в виде порошка или гранул, необязательно смешанных со связующим агентом, агентом, улучшающим скольжение, инертным разбавителем, поверхностно-активным веществом или диспергирующим агентом. Формованные таблетки изготавливают с помощью формовочного оборудования из активного компонента с инертным жидким разбавителем. Таблетки необязательно могут быть с покрытием или, если они без покрытия, то необязательно с насечкой (делимые таблетки). Препарат в форме капсул получают, наполняя капсульные оболочки активным соединением - в отдельности либо в смеси с одним или более вспомогательных ингредиентов, - и затем закрывая их обычным образом. Саше аналогичны капсулам с той разницей, что активное соединение вместе с любыми вспомогательными ингредиентами запечатывается в пакетик из рисовой бумаги. Активное соединение может быть представлено диспергируемыми гранулами, которые перед приемом можно, например, суспендировать в воде или рассыпать по пище. Гранулы могут быть упакованы, например, в саше. Композиции, пригодные для перорального введения, в том случае, когда носитель жидкий, могут быть в виде раствора или суспензии в воде или иной жидкости, или в виде эмульсии типа «масло в воде».
Композиции по данному изобретению для перорального введения включают лекарственные формы с контролируемым высвобождением, например таблетки, в которых активный ингредиент находится в соответствующем матриксе, обеспечивающем его постепенное высвобождение, или же активный ингредиент покрыт пленкой, обеспечивающей его постепенное высвобождение. Такие композиции особенно подходят для профилактического применения.
Фармацевтические композиции, пригодные для ректального введения, в тех случаях когда носитель твердый, представлены предпочтительно однодозовыми суппозиториями. Носители, подходящие для такой лекарственной формы, включают масло какао и другие вещества, обычно используемые для этой цели в данной области техники. Суппозитории обычно изготавливают путем смешивания активного ингредиента с размягченным или расплавленным носителем (одним или более) с последующим отливанием в форму и охлаждением.
Фармацевтические композиции, пригодные для парентерального введения, включают стерильные растворы или суспензии активного соединения в водных или масляных носителях.
Фармацевтические композиции по данному изобретению пригодны для введения в глаза, в частности для интраокулярного или периокулярного введения, а также местного нанесения, причем более предпочтительны местное нанесение или периокулярное введение.
Инъецируемые препараты могут быть предназначены для болюсного введения или же для непрерывной инфузии. Такие препараты обычно представлены однодозовыми или многодозовыми емкостями (последние после взятия порции препарата герметично закрываются до следующего его использования). Или же активное соединение представлено в виде порошка, который перед введением смешивают с подходящим носителем, например со стерильной апирогенной водой.
Активное соединение по данному изобретению может быть также в составе депо-препарата длительного действия, который вводят путем внутримышечной инъекции или путем имплантации, например подкожно или внутримышечно. Депо-препараты могут содержать, например, пригодные полимерные или гидрофобные материалы, например ионообменные смолы. Такие препараты длительного действия особенно подходят для профилактического применения.
Композиции, пригодные для ингаляционного введения через полость рта, должны быть представлены в такой форме, чтобы частицы, содержащие активное соединение, желательно диаметром 0,5-7 мкм, поступали в бронхиальное дерево пациента. Одна из возможных форм таких препаратов - тонкодисперсный порошок, который может находиться в проницаемых капсулах, например из желатина, для использования в ингаляционном аппарате или же входит в состав самораспространяющейся композиции, содержащей активное соединение, подходящий жидкий или газовый пропеллент и, необязательно, другие ингредиенты, например поверхностно-активные вещества и/или твердый разбавитель. Пригодные для этой цели жидкие пропелленты включают пропан и хлорфторуглероды, пригодные газовые пропелленты включают диоксид углерода. Самораспространяющиеся композиции могут также использоваться в тех случаях, когда активное соединение находится в виде капель раствора или суспензии.
Такие самораспространяющиеся композиции аналогичны известным в данной области техники препаратам и могут быть получены путем установленных методик. Удобно, когда такая композиция помещена в контейнер, снабженный управляемым вручную или автоматически действующим клапаном, обеспечивающим желаемое распыление/разбрызгивание; предпочтительно этот клапан за одно срабатывание отмеряет определенный объем препарата, например 25-100 мкл.
Другая возможность - включение активного соединения в состав раствора или суспензии для использования в атомайзере или небулайзере, в которых под действием ускоренного потока воздуха или ультразвуковой обработки образуется мелкокапельная взвесь для вдыхания.
Композиции, пригодные для назального введения, включают препараты, как правило, сходные с описанными выше для ингаляционного введения. В таких препаратах во взвешенном состоянии диаметр частиц составляет 10-200 мкм, чтобы они задерживались в носовой полости; это достигается использованием порошков с нужным размером частиц или подбором подходящего клапана. Другие пригодные для указанной цели композиции включают крупнодисперсные порошки с диаметром частиц 20-500 мкм для введения путем быстрого вдыхания через носовых ходы из контейнера, поднесенного вплотную к носу, и капли в нос в виде водного или масляного раствора или суспензии, содержащие 0,2-5% (масса/объем) активного соединения.
Фармацевтически приемлемые носители хорошо известны специалистам в данной области техники; они включают (не ограничиваясь перечисленным здесь) фосфатный буферный раствор концентрацией 0,1 М, предпочтительно 0,05 М или солевой раствор концентрацией 0,8%. Также эти фармацевтически приемлемые носители могут представлять собой водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое) и пригодные для инъекций органические сложные эфиры (например, этилолеат). Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевые и забуференные среды. Пригодные для парентерального введения носители включают раствор хлорида натрия, раствор Рингера с декстрозой, декстрозу и хлорид натрия, раствор Рингера с лактатом, или нелетучие масла. В таких композициях могут присутствовать консерванты и другие добавки, например антимикробные агенты, антиоксиданты, хелатирующие агенты, инертные газы и т.п.
Композиции, пригодные для местного применения могут быть представлены гелями, кремами или мазями. Такие препараты можно использовать для нанесения, например на рану или язву, либо непосредственно распределяя препарат по поверхности повреждения или же прикладывая к ней подходящую подложку (например, бинт, марлевую салфетку, лоскут ткани или подобные материалы) с нанесенным на нее препаратом.
Предлагаются также жидкие или порошковые композиции, которые можно распределять или разбрызгивать непосредственно по подлежащему обработке участку, например по поверхности раны или язвы. Или же такие препараты распределяют по поверхности подходящей подложки/носителя, например бинта, марлевой салфетки, лоскута ткани или подобного материала, который прикладывают к пораженному месту.
По другому аспекту данного изобретения предлагается способ получения фармацевтических композиций для медицинского или ветеринарного применения, описанных выше, который включает объединение активного соединения (соединений) с носителем, например путем смешивания.
Вообще говоря, композиции по данному изобретению получают путем обеспечения равномерного тщательного объединения активного агента с жидкими или тонкодисперсными твердыми носителями, или с теми и другими вместе с последующим необязательно формованием продукта. Данное изобретение охватывает способы получения фармацевтических композиций, включающие объединение (интеграцию, смешение) соединений, описываемых общей формулой (I), с фармацевтически приемлемыми для медицинского или ветеринарного применения носителями или средствами доставки.
Соли/сложные эфиры
Соединения по данному изобретению могут быть представлены солями или сложными эфирами, в частности такими, которые фармацевтически приемлемы для медицинского или ветеринарного применения.
Фармацевтически приемлемые соли соединений по данному изобретению включают пригодные в указанном отношении соли присоединения кислоты или основания. Обзор подходящих фармацевтически приемлемых солей можно найти в работе Berge et al, J. Pharm. Sci., 66, 1-19 (1977). Соли образуют, например, сильные неорганические кислоты: водные растворы галогеноводородов (хлористого водорода, бромистого водорода и йодистого водорода), серная кислота (сульфаты, бисульфаты, гемисульфаты), фосфорная кислота, пероксосерная кислота (персульфаты), тиоциановая кислота (тиоцианаты) и сульфоновые кислоты (сульфонаты); сильные органические карбоновые кислоты, например алканкарбоновые кислоты, содержащие 1-4 атомов углерода, которые могут быть незамещенными или замещенными (заместителями могут быть, например, галогены), например уксусная кислота; насыщенные или ненасыщенные дикарбоновые кислоты, например щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, фталевая кислота или тетрафталевая кислота; гидроксикарбоновые кислоты, например аскорбиновая кислота, гликолевая кислота, молочная кислота, яблочная кислота, виннокаменная кислота или лимонная кислота; аминокислоты, например аспарагиновая кислота или глутаминовая кислота; бензойная кислота; или органические сульфоновые кислоты, например (С1-С4)-алкил- или арилсульфоновые кислоты, которые могут быть незамещенными или замещенными (заместителями могут быть, например, галогены), например метансульфоновая кислота или пара-толуолсульфоновая кислота. Соли, фармацевтически не приемлемые для медицинских или ветеринарных применений, могут использоваться как промежуточные соединения.
Предпочтительные по данному изобретению соли включают, например, ацетаты, трифторацетаты, лактаты, глюконаты, цитраты, тартраты, малеаты, малаты, пантотенаты, адипаты, альгинаты, аспартаты, бензоаты, бутираты, диглюконаты, циклопентанаты, глюкогептанаты, глицерофосфаты, оксалаты, гептаноаты, гексаноаты, фумараты, никотинаты, пальмоаты, пектинаты, 3-фенилпропионаты, пикраты, пивалаты, пропионаты, тартраты, лактобионаты, пиволаты, камфораты, ундеканоаты и сукцинаты, соли сульфоновых кислот, например метансульфонаты, этансульфонаты, 2-гидроксиэтансульфонаты, камфорсульфонаты, 2-нафталинсульфонаты, бензолсульфонаты, пара-хлорбензолсульфонаты и пара-толуолсульфонаты; и соли неорганических кислот, например соляной кислоты, бромистоводородной кислоты, иодистоводородной кислоты, серной кислоты (сульфаты, бисульфаты, гемисульфаты), тиоциановой кислоты, пероксисерной кислоты, фосфорной кислоты и сульфоновых кислот.
Сложные эфиры образуются из органических кислот или спиртов/гидроксидов - в зависимости от этерифицируемой функциональной группы. При этом органические кислоты включают карбоновые кислоты, например алканкарбоновые кислоты, содержащие 1-12 атомов углерода, которые могут быть незамещенными или замещенными (заместителями могут быть, например, галогены), например уксусную кислоту; насыщенные или ненасыщенные дикарбоновые кислоты, например щавелевую кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, фталевую кислоту или тетрафталевую кислоту; гидроксикарбоновые кислоты, например аскорбиновую кислоту, гликолевую кислоту, молочную кислоту, яблочную кислоту, виннокаменную кислоту или лимонную кислоту; аминокислоты, например аспарагиновую кислоту или глутаминовую кислоту; бензойную кислоту; или органические сульфоновые кислоты, например (С1-С4)-алкил- или арилсульфоновые кислоты, которые могут быть незамещенными или замещенными (заместителями могут быть, например, галогены), например метансульфоновую кислоту или пара-толуолсульфоновую кислоту. Пригодные по данному изобретению гидроксиды включают неорганические гидроксиды, например гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид алюминия. Пригодные спирты включают алкановые спирты, содержащие 1-12 атомов углерода, которые могут быть незамещенными или замещенными (заместителями могут быть, например, галогены).
Энантиомеры/таутомеры
Во всех обсуждавшихся ранее аспектах данного изобретения оно включает, в тех случаях, когда это уместно, все энантиомеры, диастереоизомеры и таутомеры соединений по данному изобретению. Специалисту в данной области техники понятно, какие соединения обладают оптической активностью (наличие одного или более хиральных атомов углерода) или таутомерией. Соответствующие энантиомеры и/или таутомеры могут быть выделены/получены известными в данной области техники методами. Энантиомеры характеризуются абсолютной конфигурацией хиральных центров (R/S) и описываются правилами последовательности Кана-Ингольда-Прелога. Такие системы хорошо известны в данной области техники (см., например, «Advanced Organic Chemistry», третье издание, March, J., John Wiley and Sons, New York, 1985).
Таким образом, соединения, описываемые формулой (I), включают таутомерные формы, описываемые формулой
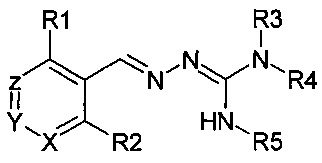
Иллюстративным примером может служить таутомерная форма соединения, называемого в настоящем документе «Пример 1»:
Соединения по данному изобретению, содержащие хиральный центр, можно использовать в виде рацемической смеси или смеси, обогащенной определенными энантиомерами; или же рацемическую смесь разделяют известными в данной области техники методами и используют отдельные энантиомеры.
Стереоизомеры и геометрические изомеры
Некоторые из соединений по данному изобретению существуют как стереоизомеры и/или геометрические изомеры - например, они обладают одним или более асимметричными и/или геометрическими центрами и поэтому существуют в двух или более формах (стереоизомеры и/или геометрические изомеры). Данное изобретение охватывает применение всех отдельных стерео- и геометрических изомеров предлагаемых агентов-ингибиторов и их смесей. Термины, используемые в формуле изобретения, включают эти формы при условии, что указанные формы сохраняют соответствующую функциональную активность (впрочем, необязательно, чтобы в той же степени).
Данное изобретение также включает все пригодные в его контексте изотопные варианты указанных агентов или их фармацевтически приемлемых солей. Изотопный вариант агента по данному изобретению или его фармацевтически приемлемой соли - это форма соединения, в котором по меньшей мере один атом заменен атомом с тем же атомным номером, но с атомной массой, отличной от той, которая имеется в природной форме. К примерам изотопов, включаемых в агент по данному изобретению и его фармацевтически приемлемые соли, относятся изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, например 2Н, 3Н, 13С, 14С, 15N, 17О, 18О, 31Р, 32Р, 35S, 18F и 36Cl, соответственно. Некоторые изотопные варианты агентов по данному изобретению и их фармацевтически приемлемых солей, например, содержащие радиоактивные изотопы, например 3Н или 14С, можно использовать в исследованиях распределения лекарственных препаратов и/или субстратов в тканях. Особенно предпочтительны изотопные формы, содержащие тритий (3Н) или углерод-14 (14С), поскольку их сравнительно легко получать и выявлять. Также использование такого изотопа, как дейтерий (2Н), может дать некоторые терапевтические преимущества в силу его большей метаболической стабильности, например большему времени полураспада in vivo или меньшей необходимой дозировки, что может быть предпочтительным в некоторых обстоятельствах. Например, данное изобретение включает соединения, описываемые формулой (I), в которых какой-либо из атомов водорода заменен атомом дейтерия. Изотопные варианты агентов по данному изобретению и их фармацевтически приемлемых солей могут быть получены обычно применяемыми для этого методами с использованием соответствующих изотопных вариантов пригодных реагентов.
Пролекарства
Данное изобретение также включает предлагаемые соединения в форме пролекарств, то есть соединений, содержащих ковалентно связанный исходный активный агент, описываемый формулой (I), из которых он высвобождается in vivo. Такие пролекарства - это обычно соединения по данному изобретению, в которых одна или более соответствующих групп модифицирована таким образом, что эта модификация обратима после введения препарата пациенту (человеку или животному). Обратное превращение обычно осуществляется при участии фермента, от природы имеющегося у пациента, хотя возможно вместе с пролекарством вводить второй агент для осуществления обратной реакции in vivo. Примеры таких модификаций включают образование сложного эфира (например, какого-либо из числа описанных выше), при этом обратная реакция может осуществляться эстеразой; и т.п. Другие подобные системы должны быть известны специалистам в данной области техники.
Сольваты
Данное изобретение также включает сольватированные формы описываемых соединений. Термины, используемые в формуле изобретения, охватывают эти формы.
Полиморфные формы
Данное изобретение относится также к предлагаемым соединениям в различных их кристаллических формах, полиморфных формах и гидратированных/негидратированных формах. В фармацевтической промышленности известно, как выделить химическое соединение в какой-либо из таких форм путем некоторой модификации метода очистки и/или выделения из растворителей, используемых при синтетическом получении таких соединений.
Введение препаратов
Фармацевтические композиции по данному изобретению могут быть приспособлены для ректального, назального, интрабронхиального, местного (включая буккальное, подъязычное и глазное введение, в частности интраокулярное, окулярное и периокулярное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное, интраартериальное и интрадермальное введение), внутрибрюшинного или интратекального введения. Предпочтительно композиции по данному изобретению являются препаратами для перорального введения. Композиции по данному изобретению могут быть представлены единичной лекарственной формой, то есть в виде отдельных порций, содержащих разовую дозу или ее часть, или несколько таких доз. Например, композиции по данному изобретению могут быть в форме таблеток и капсул с замедленным высвобождением; такие препараты можно получить методами, известными в данной области техники.
Композиции по данному изобретению для перорального введения могут быть представлены в дискретном виде, например в форме желатиновых или крахмальных капсул, капель, пилюль или таблеток, каждая из которых содержит определенное количество активного агента; в виде порошка или гранул; в виде раствора, эмульсии или суспензии активного агента в воде или иной жидкости; или в виде жидкой эмульсии типа «масло в воде» или «вода в масле»; или в виде крупных пилюль (болюсов). Предпочтительно в одной дозе таких композиций содержится от 1 до 250 мг и более, предпочтительно 10-100 мг, активного ингредиента.
Применительно к композициям по данному изобретению для перорального введения (например, таблеток и капсул) термин «приемлемый носитель» включает такие обычные эксципиенты, как связующие агенты (например, паточный сироп, аравийскую камедь, желатин, сорбит, трагакантовую камедь, поливинилпирролидон/повидон, метилцеллюлозу, этилцеллюлозу, карбоксиметилцеллюлозу-натрий, гидроксипропилцеллюлозу, сахарозу и крахмал); наполнители и носители (например, кукурузный крахмал, желатин, лактозу, сахарозу, микрокристаллическую целлюлозу, каолин, маннит, двузамещенный фосфат кальция CaHPO4, хлорид натрия и альгиновую кислоту); агенты, улучшающие скольжение (например, стеарат магния, стеарат натрия и стеараты других металлов, глицерилстеарат, кремниевое масло, тальк, воска, масла и коллоидный диоксид кремния). Можно также использовать ароматизирующие агенты, например перечную мяту, масло грушанки («винтергриновое»), вишневую отдушку и т.п. Может оказаться желательным добавление красителя, чтобы лекарственная форма имела отличительный признак. Таблетки могут иметь покрытие, которое делают известными в данной области техники методами.
Таблетки можно изготавливать путем прессования или формования с использованием необязательно одного или более вспомогательных ингредиентов. Прессованные таблетки могут быть изготовлены с помощью машины для прессования из активного компонента в сыпучей (не комкующейся) форме, например в виде порошка или гранул, необязательно смешанных со связующим агентом, агентом, улучшающим скольжение, инертным разбавителем, консервантом, поверхностно-активным веществом или диспергирующим агентом. Формованные таблетки изготавливают с помощью формовочного оборудования из смеси соединения по данному изобретению в виде порошка с инертным жидким разбавителем. Таблетки необязательно могут быть с покрытием или с насечкой (делимые таблетки); таблетки могут иметь такой состав, который обеспечивает замедленное или контролируемое высвобождение активного агента.
Другие препараты, пригодные для перорального введения, включают леденцы, содержащие активный агент в ароматизированной основе, обычно в сахарозе и аравийской или трагакантовой камеди; пастилки, содержащие активный агент в инертной основе, например в желатине или глицерине, или в сахарозе и аравийской камеди; полоскания для полости рта, содержащие активный агент в подходящем жидком носителе.
Другие формы для введения соединений по данному изобретению включают растворы или эмульсии, которые вводят путем инъекции внутривенно, интраартериально, интратекально, подкожно, внутрикожно, внутрибрюшинно, интраокулярно, местно, периокулярно или внутримышечно, и которые получают из стерильных или стерилизуемых растворов. Инъецируемые лекарственные формы обычно содержат в одной дозе 10-1000 мг, предпочтительно 10-250 мг активного ингредиента.
Фармацевтические композиции по данному изобретению могут быть также в форме суппозиториев, пессариев, суспензий, эмульсий, лосьонов, мазей, кремов, гелей, аэрозолей или спреев, растворов или распыляемых порошков.
Для трансдермального введения альтернативой инъекциям служат накожные притирания, наклейки и пластыри. Например, активный ингредиент может входить в состав крема из водной эмульсии полиэтиленгликолей или жидкого парафина. Активный ингредиент может быть также включен в концентрации от 1 до 10% (масса/масса) в состав мази с основой из белого воска или мягкого белого парафина, необязательно вместе со стабилизирующими агентами и консервантами.
Дозировка
Для специалиста в данной области техники не составит труда определить нужную дозу одной из растворимых композиций по данному изобретению для введения пациенту без излишнего экспериментирования. Обычно реальную дозировку, наиболее подходящую для данного пациента, определяет врач с учетом различных факторов, включая активность используемого соединения, его метаболическую стабильность и продолжительность действия, а также индивидуальные особенности пациента - возраст, массу тела, общее состояние здоровья, пол, рацион, способ и режим введения препарата, скорость его выведения из организма, другие принимаемые пациентом лекарства, степень тяжести патологического состояния и получаемое пациентом лечение. Дозировки, приведенные в настоящем документе, являются примерными для среднего случая. Разумеется, в каких-то случаях могут быть оправданы более высокие или же более низкие дозировки, и таковые входят в объем данного изобретения.
По данному изобретению эффективное количество соединения, описываемого формулой (I), может быть введено индивиду целенаправленно против конкретного состояния или заболевания. Конечно, это количество в дальнейшем изменяют соответственно пути введения препарата. Например, для интенсивной или краткосрочной терапии для достижения эффективного количества соединения, описываемого формулой (I), предпочтительно парентеральное введение. При этом введение соединения по данному изобретению наиболее эффективно путем внутривенной инфузии в 5%-ном водном растворе декстрозы или в физиологическом растворе, или в составе сходного раствора вместе с подходящими эксципиентами; впрочем, хороший эффект дает также внутримышечная болюсная инъекция. Обычно при парентеральном введении доза берется от около 0,01 до около 100 мг/кг массы тела (предпочтительно от 0,1 до 20 мг/кг), чтобы обеспечить эффективный уровень концентрации препарата в плазме крови. Соединения по данному изобретению можно вводить пациенту 1-4 раза в сутки ежедневно в таких количествах, чтобы суммарная суточная доза составляла от около 0,4 до около 400 мг/кг массы тела. Рядовой специалист в данной области техники без труда сумеет в точности определить терапевтически эффективное количество соединения по данному изобретению и оптимальный путь и способ его введения, сравнивая уровень данного агента в крови пациента с концентрацией, требующейся для достижения терапевтического эффекта.
Соединения по данному изобретению можно вводить пациенту перорально таким образом, чтобы концентрация препарата была достаточной для достижения желаемого эффекта при одном или более из описанных в настоящем документе терапевтических показаний. Обычно при пероральном введении фармацевтической композиции, содержащей соединение по данному изобретению, доза берется от около 0,1 мг/кг массы тела до 50 мг/кг в зависимости от состояния пациента. Предпочтительно доза фармацевтической композиции, содержащей соединение по данному изобретению, при пероральном введении составляет от около 0,1 до около 20 мг/кг массы тела.
При введении соединений по данному изобретению так, как это предлагается в настоящем документе, никаких неприемлемых токсических эффектов не ожидается. Соединения по данному изобретению, обладающие хорошей биологической доступностью, могут быть испытаны одним из биологических аналитических методов, чтобы определить концентрацию такого соединения, требующуюся для оказания того или иного фармакологического действия.
Комбинации препаратов
В одном из особенно предпочтительных воплощений данного изобретения одно или более предлагаемых соединений вводят пациенту в сочетании с одним или более других активных агентов, например уже существующих лекарственных препаратов, имеющихся в продаже. В таких случаях соединения по данному изобретению вводят последовательно, одновременно или в определенном порядке с одним или более других активных агентов.
Как правило, лекарства действуют более эффективно при использовании их в оптимальном сочетании. В частности, комбинированная терапия желательна, чтобы избежать наложения токсичности, механизмов действия или механизма (механизмов) резистентности. Кроме того, для большинства лекарственных препаратов желательно также вводить их пациенту в максимально переносимой им дозе с минимальными интервалами между приемами. Основные преимущества комбинирования лекарственных препаратов заключаются в том, что при этом в силу биохимических взаимодействий может достигаться суммарный или синергический эффект, а также возможно снижение возникновения резистентности к терапии.
Составить предположительно полезные комбинации лекарственных препаратов можно, изучая ингибирующую активность испытываемых соединений в присутствии агентов, о которых известно или предполагается, что они эффективны для лечения данного расстройства. Этот подход можно также использовать для определения порядка введения комбинируемых препаратов, то есть вводить ли их до или после соединений по данному изобретению или одновременно с ними. Подобная схема подходит для всех активных агентов, о которых идет речь в настоящем документе.
Способ анализа
В другом своем аспекте данное изобретение относится к применению описанных выше соединений в способе анализа с целью идентификации других возможных ингибиторов PPP1R15A-PP1.
Предпочтительно указанный способ анализа является методом конкурентного связывания. Более предпочтительно, указанный способ анализа методом конкурентного связывания включает контактирование соединения по данному изобретению с ферментом PPP1R15A-PP1 и с соединением - кандидатом на роль ингибитора этого фермента и выявление любых изменений взаимодействия соединения по данному изобретению и PPP1R15A-PP1.
Предпочтительно соединение - кандидат на роль ингибитора PPP1R15A-PP1 получают путем модификации соединений по данному изобретению по принципу зависимости между структурой соединения и его активностью (стандартный подход SAR).
В настоящем документе термин «стандартный подход SAR» относится к известным в данной области техники обычно применяемым методам варьирования исходного химического соединения путем получения его производных.
Таким образом, с одной стороны, идентифицированные соединения могут служить моделью (например, матрицей) для разработки других соединений. В таком анализе испытываемые соединения могут находиться в свободном виде в растворе, быть иммобилизованными на твердой подложке, появляться на клеточной поверхности или находиться внутри клетки. При этом можно количественно определять исчезновение активности или образование комплексов между данным соединением и испытываемым агентом.
Анализ по данному изобретению может состоять в скрининге, когда испытывается ряд агентов. В одном из аспектов данного изобретения проводимый анализ является скринингом высокой пропускной способности.
Данное изобретение также охватывает применение скрининга путем анализа методом конкурентного связывания препаратов, при котором нейтрализующие антитела, способные связываться с данным соединением, специфично конкурируют с испытываемым соединением за связывание с данным соединением.
Другой метод, обеспечивающий скрининг высокой пропускной способности (HTS) агентов, обладающих подходящим сродством связывания с определенными веществами, основан на способе, подробно описанном в публикации WO 84/03564.
Можно рассчитывать, что способы анализа по данному изобретению подойдут как для широкомасштабного, так и для ограниченного скрининга испытываемых соединений, а также для количественного анализа.
Предпочтительно анализ методом конкурентного связывания включает контактирование соединения по данному изобретению с ферментом PPP1R15A-PP1 в присутствии известного субстрата PPP1R15A-PP1 и выявление любых изменений во взаимодействии указанного фермента и указанного известного субстрата.
В другом аспекте данного изобретения предлагается способ выявления связывания лиганда с PPP1R15A-PP1, причем указанный способ включает этапы:
i) контактирования лиганда с PPP1R15A-РР1 в присутствии известного субстрата;
(ii) выявления любых изменений во взаимодействии PPP1R15A-PP1 и указанного известного субстрата,
причем указанный лиганд является соединением по данному изобретению.
В одном из своих аспектов данное изобретение относится к способу, включающему этапы:
(a) осуществления анализа описанным выше способом;
(b) идентификации одного или более лигандов, способных связываться с доменом, связывающим лиганд; и
(c) получения некоторого количества указанных одного или более лигандов.
В другом аспекте данного изобретения предлагается способ, включающий этапы:
(a) осуществления анализа описанным выше способом;
(b) идентификации одного или более лигандов, способных связываться с доменом, связывающим лиганд; и
(c) получения фармацевтической композиции, содержащей указанные один или более лигандов.
В другом аспекте данного изобретения предлагается способ, включающий этапы:
(a) осуществления анализа описанным выше способом;
(b) идентификации одного или более лигандов, способных связываться с доменом, связывающим лиганд;
(c) модификации указанных одного или более лигандов, способных связываться с доменом, связывающим и лиганд;
d) осуществления анализа описанным выше способом;
e) необязательно получения фармацевтической композиции, содержащей указанные один или более лигандов.
Данное изобретение относится также к лигандам, идентифицированным описанным выше способом.
В еще одном своем аспекте данное изобретение относится к фармацевтическим композициям, содержащим лиганд, идентифицированный описанным выше способом.
В другом своем аспекте данное изобретение относится к применению лигандов, идентифицированных способом, описанным выше, при получении фармацевтических композиций для применения при лечении обсуждавшихся выше расстройств, связанных с накоплением неправильно свернутых белков.
Указанные выше способы можно применять для поиска лигандов, которые пригодны в качестве ингибиторов PPP1R15A-PP1.
Соединения, описываемые общей формулой (I), можно использовать и как инструмент лабораторных исследований, и как терапевтические агенты. В исследовательских целях некоторые соединения по данному изобретению можно использовать для валидизации мишени, то есть для того, чтобы определять, выполняет ли известная или ранее не известная структура-мишень ключевую или по меньшей мере существенную биохимическую функцию в процессе возникновения или прогрессирования патологического состояния.
Ниже данное изобретение описывается подробно на примерах с прилагаемыми иллюстрациями, а именно:
Фигура 1 изображает зависимую от дозы защиту клеток HeLa соединением по данному изобретению, описываемым формулой (I) и названным "Пример 1», от стресса эндоплазматического ретикулума, вызванного 6-часовым воздействием туникамицина. (См. тест 1).
Фигура 2 демонстрирует, что соединение по данному изобретению, описываемое формулой (I) и обозначенное «Пример 1», задерживает восстановление трансляции в клетках, подвергнутых стрессу эндоплазматического ретикулума. А именно, через 2 часа после добавления туникамицина трансляция ослаблена. В клетках, которые обрабатывали только туникамицином, наблюдается восстановление трансляции. Соединение по данному изобретению «Пример 1» продлевает период ослабленности трансляции в клетках, обработанных туникамицином. (См. тест 3.)
Фигура 3 демонстрирует, что соединение по данному изобретению, описываемое формулой (I) и называемое в настоящем документе «Пример 1», в отличие от гуанабенза не обладает активностью в отношении α2А-адренергических рецепторов, что показано путем функционального анализа для α2А-адренергических рецепторов. (См. тест 5.)
Фигура 4 демонстрирует, что соединение по данному изобретению, описываемое формулой (I) и называемое в настоящем документе «Пример 1», предотвращает задержку в эндоплазматическом ретикулуме мутантного белка P0S63del, ассоциированного с болезнью Шарко-Мари-Тута типа 1В. По оси ординат - число клеток; UT - без обработки.
Фигура 5 демонстрирует, что соединение по данному изобретению, описываемое формулой (I) и называемое в настоящем документе «Пример 1», уменьшает накопление двух не зависимых друг от друга неправильно свернутых белков, обусловливающих заболевание: мутантный N-концевой фрагмент хантингтина (Htt48Q), ассоциированный с болезнью Хантингтона, и мутантный фермент SOD1 (A4V), ассоциированный с боковым амиотрофическим склерозом. По оси ординат - относительное (по сравнению с не обработанными клетками) накопление белка в процентах; UT - без обработки.
Фигура 6 демонстрирует, что соединение по данному изобретению, описываемое формулой (I) и называемое в настоящем документе «Пример 1», уменьшает накопление мутантного родопсина Р23Н, ассоциированного с пигментным ретинитом. По оси ординат - число клеток; UT- без обработки.
Далее данное изобретение описывается на приведенных ниже примерах, которые не имеют ограничительного характера.
Примеры
Материалы и методы
Пример 1: приобретено в Chemdiv (ref. 1683-6588)
Пример 2: приобретено в Chembridge (ref. 5173161)
Пример 4: приобретено в Enamine (ref. Z49562642)
Пример 6: приобретено в Chemdiv (ref. 1683-6502)
Получение соединений по данному изобретению
Реагенты и коммерческие вещества приобретали в Acros Organics, Sigma-Aldrich. Соединения по данному изобретению могут быть получены следующим общим способом:
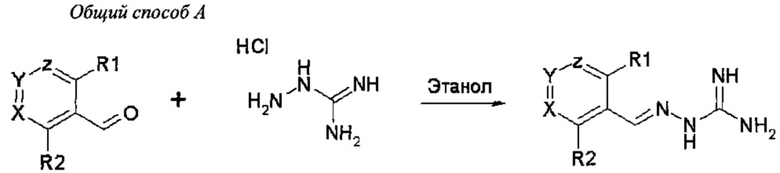
К раствору бензальдегида (1 экв.) в этиловом спирте (300 мл) прибавляют по очереди аминогуанидина гидрохлорид (1 экв.) и ацетат натрия (1 экв.) при температуре 25°С. Полученную реакционную смесь нагревают при температуре 80°С в течение ~6 часов. Завершение реакции отслеживали путем тонкослойной хроматографии (TLC), используя в качестве подвижной фазы смесь дихлорметан/метанол (8/2). После завершения реакции реакционной смеси дают остыть до температуры 25°С и выливают ее в насьпценный раствор (700 мл) бикарбоната натрия (NaHCO3). Образовавшийся осадок отфильтровывают в вакууме и промывают водой (100 мл). Полученное твердое вещество растирают с диэтиловым эфиром (2×25 мл) и высушивают в вакууме. В результате получают желаемое замещенное производное аминогуанидина.
Этим общим способом А были получены следующие соединения.
«Пример 1». 1-[(Е)-[(2-хлорфенил)метилиден]амино]-гуанидин
Получали общим способом А из 2-хлорбензальдегида.
1Н-ЯМР (DMSO-d6): δ (ppm) 5,61 (s, 2Н); 6,06 (s, 2Н); 7,22-7,32 (m, 2Н); 7,40 (dd, 1Н); 8,15 (dd, 1H); 8,28 (s, 1H); MS (ESI+): m/z=197,4 [M+H]+
«Пример 3». 1-[(Е)-[(2-фторфенил)метилиден]амино]-гуанидин
Получали общим способом А из 2-фторбензальдегида.
«Пример 7». 1-[(Е)-[(2-хлор-4-фторфенил)метилиден]амино]гуанидин
Получали общим способом А из 2-хлор-4-фторбензальдегида. Выход 67%.
1Н-ЯМР (DMSO-d6): δ (ppm) 5,80 (brs, 2Н); 5,84 (brs, 2Н); 7,19-7,34 (m, 4Н); 8,16 (s, 1Н); MS (ESI+): m/z=215,1 [M+H]+
«Пример 13». 1-[(Е)-[(3-хлорпиридин-4-ил)метилиден]амино]гуанидин
Получали общим способом А из 3-хлоризоникотинальдегида. Выход 50%.
1Н-ЯМР (DMSO-d6): δ (ppm) 6,01 (brs, 2Н); 6,33 (brs, 2Н); 8,10 (d, 1H); 8,14 (s, 1H); 8,37 (dd, 1H); 8,52 (s, 1H); MS (ESI+): m/z=198,4 [M+H]+
«Пример 15». 1-[(Е)-[(2-хлор-6-фторфенил)метилиден]амино]гуанидин
Получали общим способом А из 2-хлорникотинальдегида. Выход 56%.
1Н-ЯМР (DMSO-d6): δ (ppm) 5,84 (brs, 2Н); 5.88 (brs, 2Н); 7,18-7,35 (m, 3Н); 8,16 (s, 1Н); MS (ESI+): m/z=215,4 [M+H]+.
Промежуточное соединение 1: 3-хлор-5-фторизоникотинальдегид.
К перемешиваемому раствору N,N-диизопропиламина (0,864 г, 0,006690 моль) в тетрагидрофуране (THF) (6 мл) прибавляли (по каплям за 15 минут) раствор н-бутиллития (n-buLi) (1,6М) в гексане (7,6 мл, 0,012164 моль) при температуре -78°С. Полученную реакционную смесь перемешивали при температуре -78°С в течение 15 минут и затем, перемешивая еще в течение 1 часа, давали согреться до температуры 0°С. Реакционную смесь снова остужали до температуры -78°С и прибавляли (по каплям за 10 минут) раствор 3-хлор-5-фторпиридина (0,8 г, 0,006082 моль) в тетрагидрофуране (6 мл). Реакционную смесь перемешивали при температуре -78°С в течение 1 часа, после чего прибавляли по каплям метилформиат (0,73 г, 0,012164 моль) при температуре -78°С. Реакционную смесь перемешивали при температуре -78°С в течение еще 1 часа. За ходом реакции следили путем тонкослойной хроматографии (TLC), используя в качестве подвижной фазы смесь гексан: этилацетат (5:5). После завершения реакции реакционную смесь выливали в насыщенный раствор хлористого аммония (NH4Cl) (50 мл) и экстрагировали этилацетатом (4×25 мл). Объединенный органический экстракт промывали деминерализованной водой (50 мл) и солевым раствором (25 мл), высушивали над сульфатом натрия и концентрировали в вакууме. Органический слой перегоняли, получая в результате искомый альдегид (0,6 г, выход 61,85%) в не очищенном виде. Это не очищенное вещество использовали на следующем этапе без какой-либо дальнейшей обработки.
«Пример 16». 1-[(E)-[(3-хлор-5-фторпиридин-4-ил)метилиден]амино]гуанидин
Получали общим способом А из 3-хлор-5-фторизоникотинальдегида. Выход 14%.
1Н-ЯМР (DMSO-d6): δ (ppm) 5,95-6,30 (m, 4Н); 8,10 (s, 1Н); 8,46-8,52 (m, 2H); MS (ESI+): m/z=216,0 [M+H]+.
«Пример 8». N-{N-[(E)-[(2-хлорфенил)метилиден]амино]карбамимидоил}апетамид
К раствору 1-[(Е)-[(2-хлорфенил)метилиден]амино]-гуанидина (0,50 г, 0,002543 моль) в диметилсульфоксиде (DMSO) (10 мл) прибавляли уксусный ангидрид (0,26 г, 0,002543 моль) при температуре 25°С. Полученную реакционную смесь перемешивали при температуре 25°С в течение последующих 15 часов. Завершение реакции отслеживали путем тонкослойной хроматографии (TLC), используя в качестве подвижной фазы смесь дихлорметан/метиловый спирт (9,5/0,5). После завершения реакции реакционную смесь выливали в воду (100 мл) и экстрагировали этилацетатом (2×150 мл). Объединенный органический экстракт промывали солевым раствором (100 мл), высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный неочищенный материал далее очищали путем флэш-хроматографии, используя в качестве подвижной фазы смесь дихлорметан/метиловый спирт; при этом искомый продукт элюировался при концентрации метилового спирта в дихлорметане приблизительно 1,0%. Фракции очищенного продукта перегоняли, в результате получали 0,080 г N-{N-[(E)-[(2-хлорфенил)метилиден]амино]карбамимидоил}ацетамида (выход 13%).
1Н-ЯМР (DMSO-d6): δ (ppm) 2,97 (s, 3Н); 7,25-7,41 (m, 3Н); 7,42-7,53 (m, 1H); 7,79 (brs, 1H); 8,22-8,29 (m, 1H); 8,48 (s, 1H); 10,58 (brs, 1H); MS (ESI+): m/z=239,2 [M+H]+.
«Пример 9». Метил-N-{N-[(E)-[(2-хлорфенил)метилиден]амино]карбамимидоил}карбамат
К суспензии 1-[(Е)-[(2-хлорфенил)метилиден]амино]-гуанидина (0,15 г, 0,000762 моль) в дихлорметане (5 мл) прибавляли триэтиламин (0,32 мл, 0,002288 моль) при температуре 25°С. Полученную реакционную смесь охлаждали на ледяной бане с солью до температуры 0°С. Затем в реакционную смесь добавляли метилхлорформиат (0,09 мл, 0,001144 моль) при температуре 0°С. Полученную реакционную смесь перемешивали при комнатной температуре в течение 15 часов. Завершение реакции отслеживали путем тонкослойной хроматографии (TLC), используя в качестве подвижной фазы смесь дихлорметан/метиловый спирт (9/1). После завершения реакции реакционную смесь выливали в насыщенный раствор бикарбоната натрия (NaHCO3) (20 мл) и экстрагировали дихлорметаном (3×25 мл). Объединенный органический экстракт промывали деминерализованной водой (20 мл), солевым раствором (20 мл), высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный неочищенный материал далее очищали путем колоночной флэш-хроматографии, используя в качестве подвижной фазы смесь дихлорметан/метиловый спирт; при этом искомый продукт элюировался при концентрации метилового спирта в дихлорметане приблизительно 1,0%. Фракции очищенного продукта перегоняли, в результате получали 0,065 г N-{N-[(E)-[(2-хлорфенил)метилиден]амино]карбамимидоил}карбамата (выход 37%).
1Н-ЯМР (DMSO-d6): δ (ppm) 3,60 (s, 3Н); 7,34-7,43 (m, 2Н); 7,45-7,52 (m, 1H); 7,67 (brs, 1H); 7,92 (brs, 1H); 8,22-8,30 (m, 1H); 8,44 (s, 1H); 11,02 (brs, 1H); MS (ESI+): m/z=255,4 [M+H]+.
Выбранные соединения по данному изобретению представлены в таблице 1 ниже.
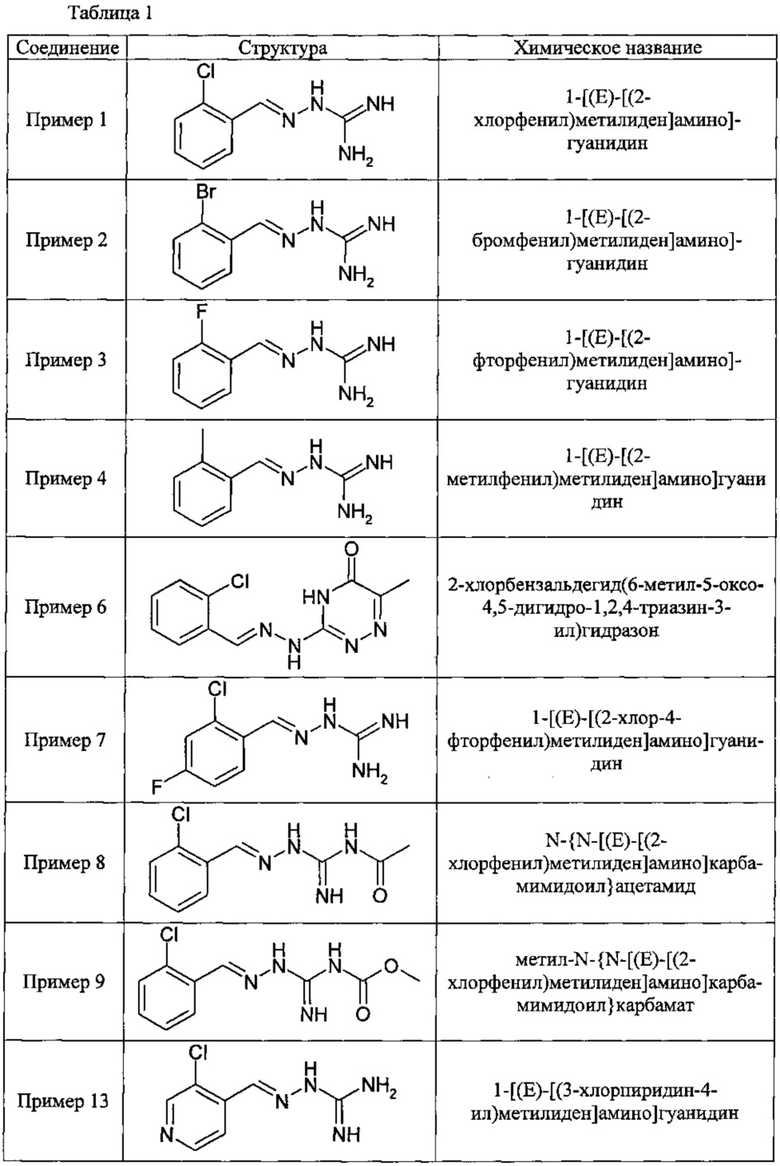
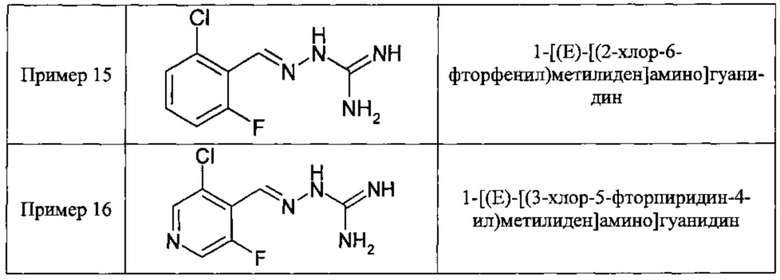
В некоторых из описанных ниже экспериментов можно использовать соли указанных соединений; например ацетат, образуемый соединением, названным в таблице «Пример 1», и уксусной кислотой.
Защита клеток от стресса эндоплазматического ретикулума (тест 1) Клетки HeLa культивировали в среде Игла, модифицированной по способу Дульбекко (DMEM), содержащей пенициллин, стрептомицин, 5% сыворотки плода коровы (фетальной телячьей сыворотки, FBS), при температуре 37°С в атмосфере с 5% СО2. За 24 часа до обработки клетки размещали в 24-луночных планшетах с плотностью 15000 клеток/мл. Стресс эндоплазматического ретикулума вызывали добавлением свежей среды, содержащей 2,5 мкг/мл туникамицина (Sigma-Aldrich) вместе с ингибиторами фосфатазы, дефосфорилирующей eIF2α (0,2-5 мкм). Спустя 6 часов среду заменяли на свежую, содержащую ингибиторы фосфатазы (0,2-5 мкм). Ингибиторы были растворены в диметилсульфоксиде (DMSO) (50 мМ) и DMSO использовали для имитации обработки (контроль). Через 48 часов после обработки туникамицином определяли жизнеспособность клеток по реакции восстановления WST-8 [2-(2-метокси-4-нитрофенил)-3-(4-нитрофенил)-5-(2,4-дисульфофенил)-2Н-тетразолия] с образованием формазана, используя набор Cell viability Counting Kit-8 (Dojindo) согласно рекомендациям производителя. Защиту клеток от стресса эндоплазматического ретикулума выражали как возрастание доли (в процентах) жизнеспособных клеток (относительно контроля) после того, как они испытывали этот стресс. Результаты для соединения по данному изобретению, называемому в настоящем документе «Пример 1», представлены на фиг. 1.
Определение уровня трансляции в клетках, не испытывающих стресс (тест 2)
За 24 часа до каждого опыта клетки HeLa (80000 клеток/мл) размещали в 12-луночных планшетах и обрабатывали либо не обрабатывали испытываемыми соединениями (50 мкМ) в течение 0,5; 1; 2,5; 5 и 7,5 часов. В конце каждого из указанных промежутков времени в культуральную среду добавляли 30,6 мкКи/мл 35S-метионина (EasyTag, PerkinElmer) на 10 минут при температуре 37°С. После мечения клетки промывали ледяным физиологическим раствором, забуференным фосфатом (PBS) и подвергали лизису в 75 мкл буферного раствора Лэммли. Лизаты подвергали ультразвуковой обработке, кипятили в течение 5 минут при температуре 95°С и проводили электрофорез в полиакриламидном геле (NuPAGE) с градиентом 4-12%. Гели окрашивали красителем кумасси (Coomassie Brilliant Blue R-250); для количественного определения использовали формирование изображения на люминесцентном фосфорном покрытии.
Определение уровня трансляции в клетках, испытывающих стресс (тест 3)
Обработку клеток проводили так же, как описано для определения трансляции в клетках, не подвергавшихся стрессу эндоплазматического ретикулума, за тем исключением, что вместе с испытываемыми соединениями прибавляли туникамицин (2,5 мкг/мл). Результаты для соединения по данному изобретению, обозначенного «Пример 1», показаны на фиг. 3.
Иммунопреципитация (тест 4)
Накануне дня обработки клетки HeLa (80000 клеток/мл) высевали, трансфицировали экспрессионными плазмидами GFP-PPP1R15A либо FLAG-PPP1R15B, используя для этого липофектамин (Lipofectamine 2000, Invitrogen), согласно инструкциям производителя. Через двое суток после трансфекции клетки обрабатывали в течение 6 часов испытываемым соединением (50 мкм), после чего промывали PBS и проводили лизис клеток в буферном растворе для ингибирования протеаз (IP: Tris 50 мМ, NaCl 150 мМ, Triton Х-100 0,2%, глицерин 10%, смесь ингибиторов протеаз без EDTA; рН 7,4). Лизаты осветляли путем центрифугирования при 15000 g в течение 15 минут при температуре 4°С и проводили пробоподготовку, используя магнитные шарики, покрытые белком G, в течение 1 часа при температуре 4°С. Проводили иммунопреципитацию белков с 1,5 мкл антител к зеленому флуоресцентному белку (GFP) (JL-8, Clontech, 632380), связанных с белок G-сефарозными гранулами (GE Healthcare, 17-0618-01). Промывали три раза холодным буферным раствором IP и кипятили с 50 мкл буферного раствора Лэммли (25 мМ Tris-HCl рН 6,8; 1% додецилсульфат натрия; 25 мМ дитиотреитиол; 7,5% глицерин; 0,05% бромфеноловый синий). Осажденные иммунокомплексы белков (17 мкл) разделяли путем электрофореза в полиакриламидном геле (NuPAGE, Invitrogen) с градиентом 4-12%, переносили на нитроцеллюлозную мембрану повышенной прочности Optitran BA-S 83 и проводили визуализацию, используя антитела к GFP и РР1 (sc-7482, Santa Cruz Biotechnology, Inc.).
Функциональный анализ для α2А-адренергических рецепторов с использованием экворина (тест 5)
Клетки СНО-K1, в которых совместно экспрессировались митохондриальный апоэкворин, маркер Gα16 и рекомбинантный человеческий α2А-адренергический рецептор, культивировали в культуральной среде без антибиотиков до середины экспоненциальной фазы роста, затем снимали с поверхности посуды с помощью буферного раствора PBS-EDTA, центрифугировали и ресуспендировали в концентрации 1×106 клеток/мл в следующей смеси: среда Игла, модифицированная по Дульбекко, среда Хэма F12 (DMEM/HAM's F12), содержащая 4-(2-оксиэтил)1-пиперазинэтансульфоновую кислоту (HEPES) и не содержащая феноловый красный, + 0,1% бычьего сывороточного альбумина (BSA), без протеаз. Клетки инкубировали с целентеразином в течение по меньшей мере 4 часов при комнатной температуре. В день испытания весь опыт проводили с референсным агонистом (UK14304), чтобы оценить процедуру и определить ЕС50. После этого в лунках 96-луночного планшета смешивали по 50 мкл суспензии клеток с 50 мкл испытываемого агониста. Возникающее свечение регистрировали с помощью люминометра (Hamamatsu Functional Drug Screening System 6000). Для стандартизации регистрируемого светоиспускания (определение «100%-ного сигнала») по планшету и по разным опытам, в некоторые лунки планшета помещали дигитонин (100 мкМ) или AT в насыщающей концентрации (20 мкМ).
Данные по зависимости доза-ответ, полученные для испытываемых соединений, анализировали с помощью программы XLfit (IDBS), используя нелинейную регрессию применительно к сигмоидальной кривой «доза-ответ».
Результаты для соединения по данному изобретению, обозначенному «Пример 1», представлены на фиг. 4. В противоположность гуанабензу соединение «Пример 1» не считается сильным агонистом α2-адренергических рецепторов, что дает преимущество. Благодаря отсутствию α2-адренергической активности это соединение имеет терапевтическую ценность при лечении расстройств, указанных в формуле данного изобретения. Отсутствие α2-адренергической активности позволяет вводить это соединение пациентам в дозировке, подходящей для лечения расстройств, указанных в формуле изобретения, без какого-либо влияния на кровяное давление, что избавляет от необходимости параллельно вводить известные антагонисты α2-адренергических рецепторов (альфа-блокаторы).
Определение избирательности
Об избирательности судили по результатам тестов 1, 2, 3 и 5. Избирательный ингибитор фосфатазы PPP1R15A должен защищать клетки от стресса эндоплазматического ретикулума (тест 1), не подавлять трансляцию в клетках, не подвергавшихся такому стрессу (тест 2), продлевать ослабление трансляции после воздействия туникамицина (тест 3) и специфично вызывать диссоциацию холофосфотазы PPP1R15A-PP1, но не PPP1R15B-PP1. Результаты
Результаты тестов 1-4 для некоторых соединений по данному изобретению представлены ниже в таблице 1.
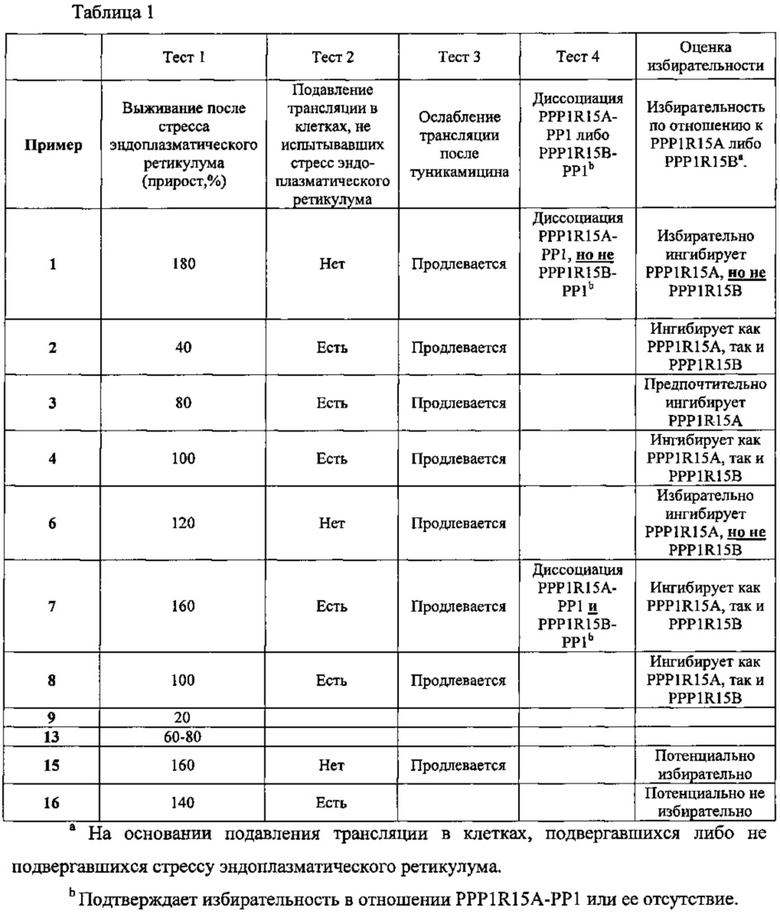
Эксперименты с использованием клеток
Материалы и методы
Культуры клеток и реагенты. Клетки линии 293Т культивировали в среде Игла, модифицированной по Дульбекко и содержащей 10% сыворотки плода коровы (фетальной телячьей сыворотки, FBS). Их трансфекцию проводили в 6- или 12-луночных планшетах, применяя метод с использованием фосфата кальция, что давало обычно 70%-ную эффективность трансфекции. Как правило, перед трансфекцией в планшетах размещали клетки в концентрации 45000 клеток/мл, как описано в работе Rousseau et al., 2009. ДНК-конструкт для миелина P0S63del-DSred описан в работе Pennuto et al., 2008; ДНК-конструкт для хантингтина описан в работе Rousseau et al., 2009. ДНК-конструкт для супероксиддисмутазы (SOD1A4V) описан в работе Munch et al., 2011, ДНК-конструкт Р23Н описан в работе Mendes and Cheetham, 2008.
Флуоресцентная микроскопия. Трансфицированные клетки фиксировали 4%-ным параформальдегидом и метили указанными антителами. Микрофотографии делали с увеличением ×100 при помощи конфокального микроскопа Leica TCS SP2AOBS или флуоресцентного микроскопа Leica DMRB.
Иммуноблоттинг. Обычно 70% сливающихся клеток в лунке 12-луночного планшета претерпевали лизис в 140 мкл кипящего буферного раствора Лэммли (25 мМ Tris-HCl рН 6,8; 1% додецилсульфата натрия; 25 мМ дитиотреитол; 7,5% глицерин; 0,05% бромфеноловый синий) для иммуноблоттинга. Белковый экстракты в количестве 18 мкл наносили на гели (NuPAGE 2-12%) и переносили на нитроцеллюлозную мембрану повышенной прочности Optitran BA-S 83 (Whatman and Schuell). Равную загрузку гелей белковыми экстрактами, с которыми проводили иммуноблоттинг, контролировали с помощью виментина и окрашивания понсо красным (эти данные не представлены). Мембраны блокировали 5%-ньгм обезжиренным сухим молоком в физиологическом растворе, забуференном фосфатом, и обрабатывали Htt2b4-антителами или НА-антителами для выявления супероксиддисмутазы (SOD1) с гемагтлютининовой (НА) меткой. Соответствующие вторичные антитела, связанные с пероксидазой, выявляли с помощью набора SuperSignal West Pico Chemiluminescent kit (Pierce). Изображения получали с помощью системы визуализации Chemi-Smart 5000 (Vilber-Lourmat), обеспечивающей количественное определение хемилюминесценции. Нужные сигналы обрабатывали при помощи программы ImageJ.
Исследование эффекта соединений по данному изобретению при болезни Шарко-Мари-Тута (тест 6)
У человека при делеции остатка серина в положении 63 полипептидной цепи белка P0 (P0S63del) развивается нейропатия Шарко-Мари-Тута типа 1В; сходная нейропатия с демиелинизацией наблюдается у трансгенных мышей. Мутантный белок сворачивается неправильно и накапливается в эндоплазматическом ретикулуме, вызывает клеточный ответ на неправильно свернутые белки (UPR), и не включается в миелин (D'Antonio et al., 2009, J. Neurosci. Res., 87, 3241-9). Клетки линии 293T трансфицировали меченым P0S63del (P0S63del-DSred) и через 48 часов после трансфекции в присутствии или же в отсутствие соединений по данному изобретению, описываемых формулой (I), исследовали методом конфокальной микроскопии. Клетки с задержанным в эндоплазматическом ретикулуме P0S63del-DSred подсчитывали, применяя методику, описанную в работе Pennuto et al., 2008. На фиг. 4 видно, что без соединений по данному изобретению в клетках происходит накопление P0S63del в эндоплазматическом ретикулуме, а соединение по данному изобретению, обозначенное «Пример 1», предотвращает это накопление. Поскольку накопление неправильно свернутого белка Р0 вызывает нейропатию Шарко-Мари-Тута типа 1В, а соединение по данному изобретению, обозначенное «Пример 1», уменьшает накопление патогенного белка, соединения по данному изобретению, описываемые формулой (I), должны приносить пользу при болезни Шарко-Мари-Тута типа 1В, а также при других формах этого заболевания, при которых патогенный белок обладает ненативной конформацией и накапливается в эндоплазматическом ретикулуме.
Исследование эффекта соединений по данному изобретению при болезни Хантингтона и боковом амиотрофическом склерозе (тест 7)
Определяли накопление мутантного N-концевого фрагмента хантингтина (Htt48Q), ассоциированного с болезнью Хантингтона, и мутантной супероксиддимсутазы (SOD1-A4V), ассоциированной с боковым амиотрофическим склерозом.
Применяли способ, ранее описанный в публикации WO/2008/041133. Клетки линии 293Т трансфицировали плазмидами, кодирующими Htt48 или SOD1A4V, и через 4 часа после трансфекции обрабатывали их соединением по данному изобретению, обозначенному «Пример 1», в диметилсульфоксиде (DMSO) либо одним только DMSO. Через 48 часов после трансфекции клетки подвергали лизису додецилсульфатом натрия (SDS) и лизаты исследовали методом иммуноблоттинга, используя NuPAGE, антитела против хантингтина (2В4) или гемагтлютинина (SOD1). На фиг. 5 представлены результаты количественной обработки регистрируемых в результате иммуноблоттинга сигналов, нормализованных по данным для не обработанных клеток. Видно, что соединение по данному изобретению, называемое в настоящем документе «Пример 1», уменьшает накопление обоих указанных белков. Поскольку соединение «Пример 1» уменьшает накопление патогенных белков, вызывающих болезнь Хантингтона и боковой амиотрофический склероз, соединения по данному изобретению, описываемые формулой (I), должны приносить пользу при лечении этих и других нейродегенеративных заболеваний, обусловленных накоплением неправильно свернутых белков.
Исследование эффекта соединений по данному изобретению при агрегации родопсина Р23Н (тест 8)
Определяли агрегацию родопсина, ассоциированную с пигментным ретинитом, как описано в работе Mendes and Cheetham, 2008. Клетки линии 293Т трансфицировали плазмидами, кодирующими мутантный родопсин Р23Н, и через 4 часа после трансфекции обрабатывали их соединением по данному изобретению, обозначенному «Пример 1» в диметилсульфоксиде (DMSO) либо одним только DMSO. Клетки исследовали под микроскопом. На фиг. 6 представлены данные для клеток с агрегатами родопсина и без них. Соединение по данному изобретению, обозначенное в настоящем документе «Пример 1», уменьшает количество агрегатов. Поскольку накопление неправильно свернутого родопсина вызывает пигментный ретинит, а соединение «Пример 1» уменьшает накопление этого патогенного белка, соединения, описываемые формулой (I), должны быть полезны при лечении пигментного ретинита.
Установлено, что соединения по данному изобретению, обозначенные в настоящем документе «Пример 1» и «Пример 6», являются избирательными ингибиторами PPP1R15A. Установлено, что соединения по данному изобретению, обозначенные в настоящем документе «Пример 2», а также 4, 7 и 8, ингибируют как PPP1R15A, так и PPP1R15B.
Специалистам в данной области техники должны быть очевидны различные модификации и варианты данного изобретения, не выходящие за рамки его объема и сущности. Хотя в настоящем документе данное изобретение описано в связи с определенными предпочтительными его воплощениями, следует учесть, что данное изобретение, как оно представлено в настоящей заявке, не ограничивается этими конкретными воплощениями. Подразумевается, что данным изобретением охватываются различные модификации описанных в настоящем документе способов его осуществления, очевидные для специалистов в релевантных областях техники.
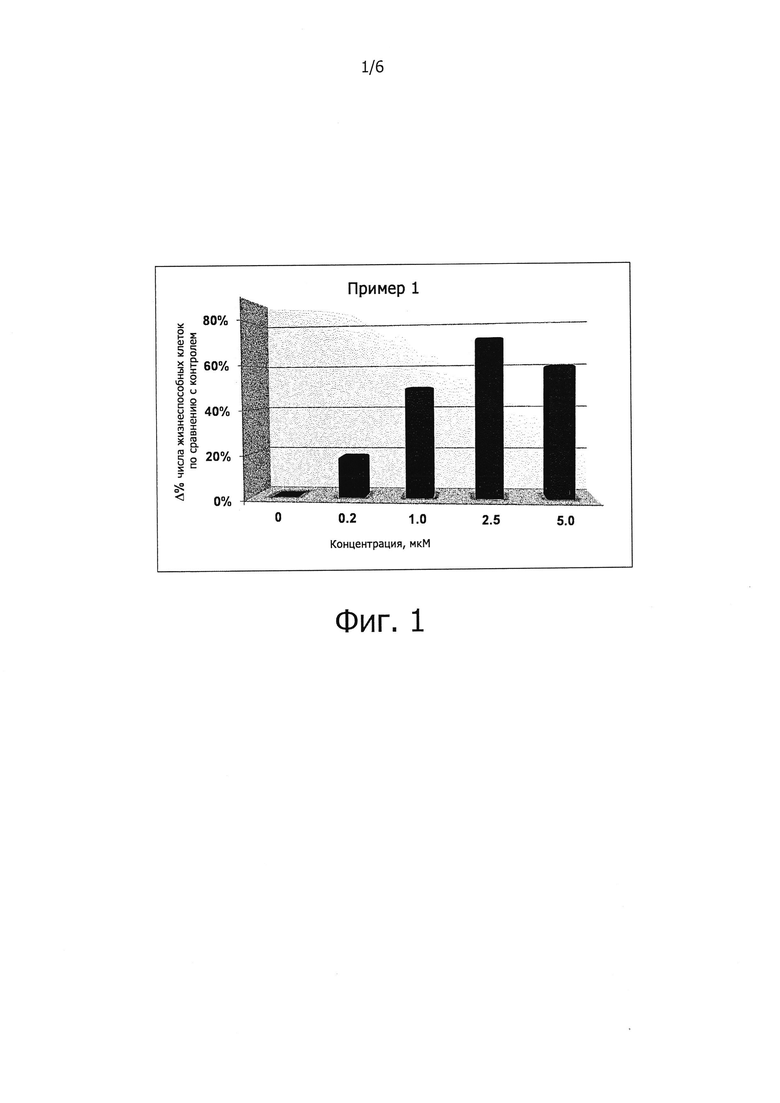
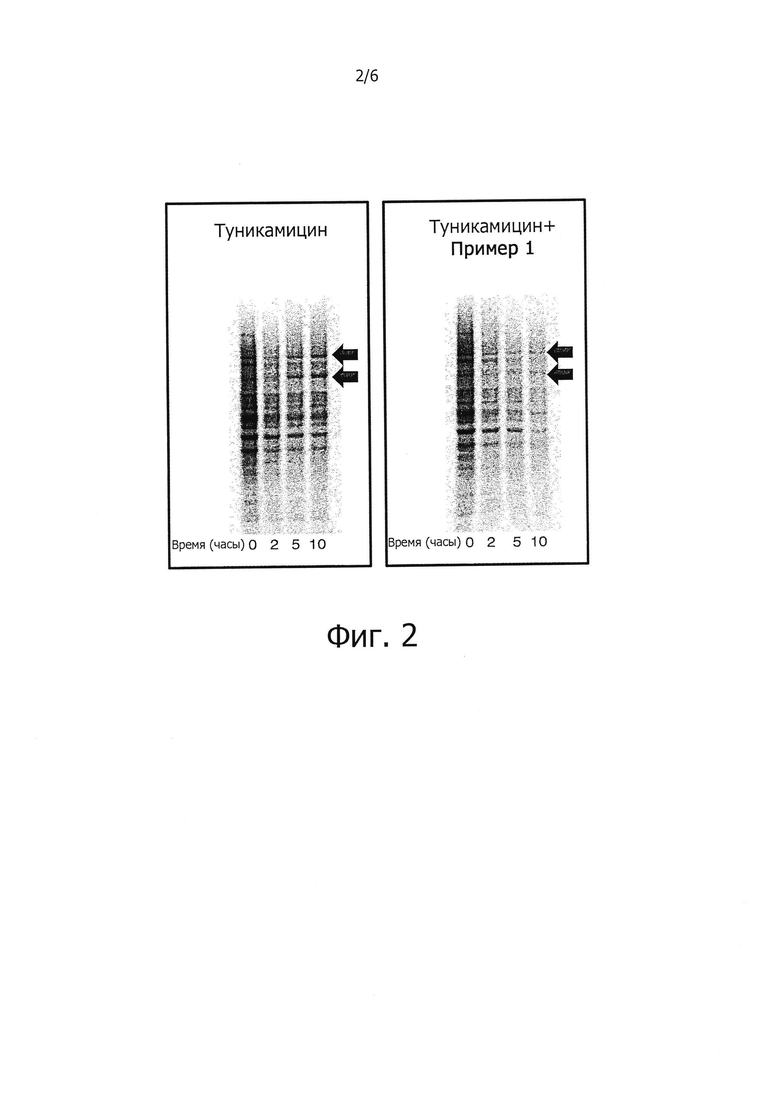
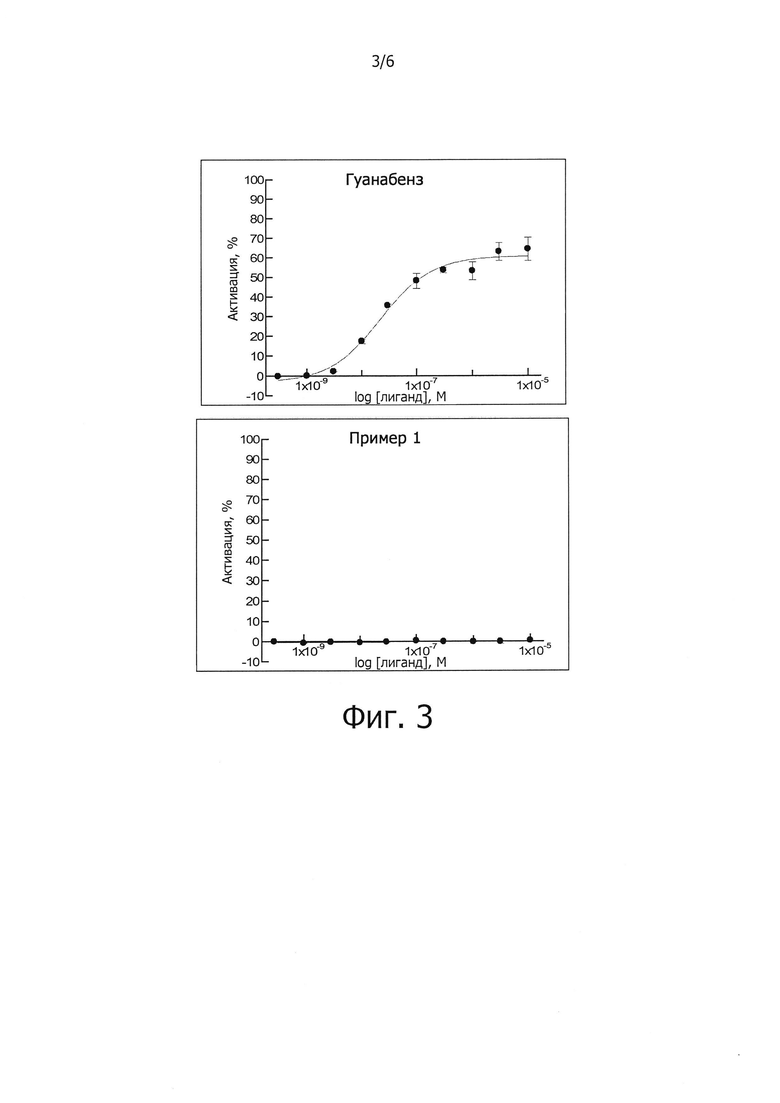
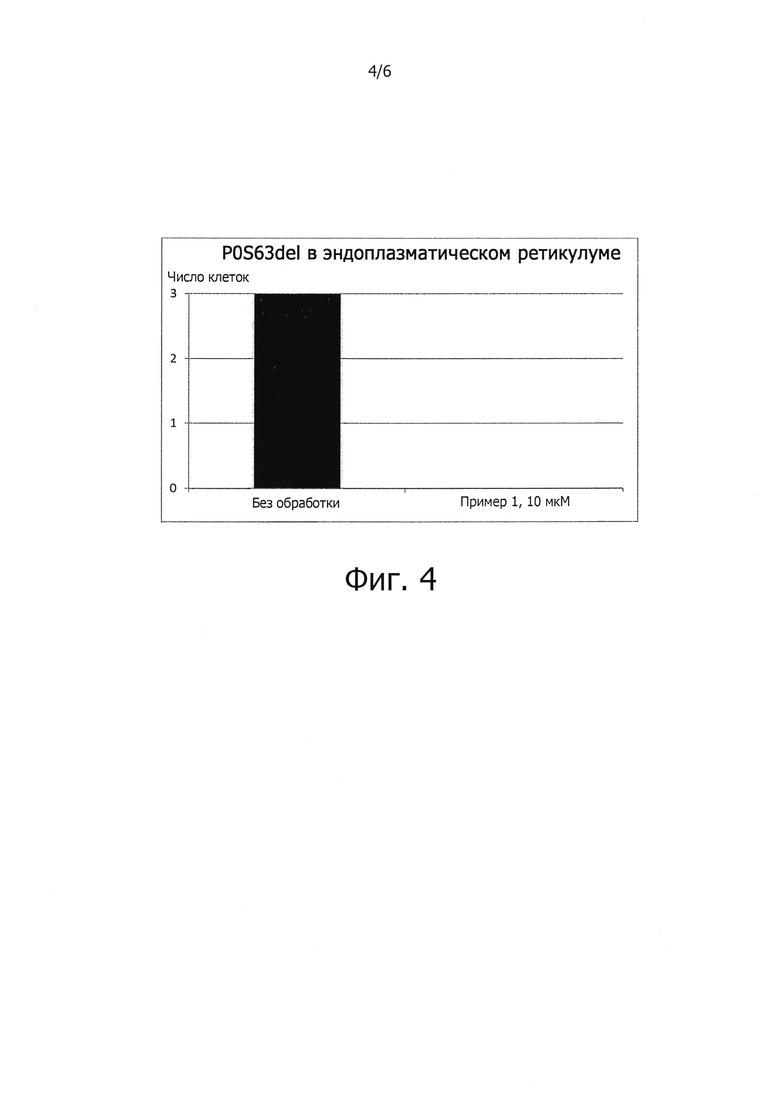
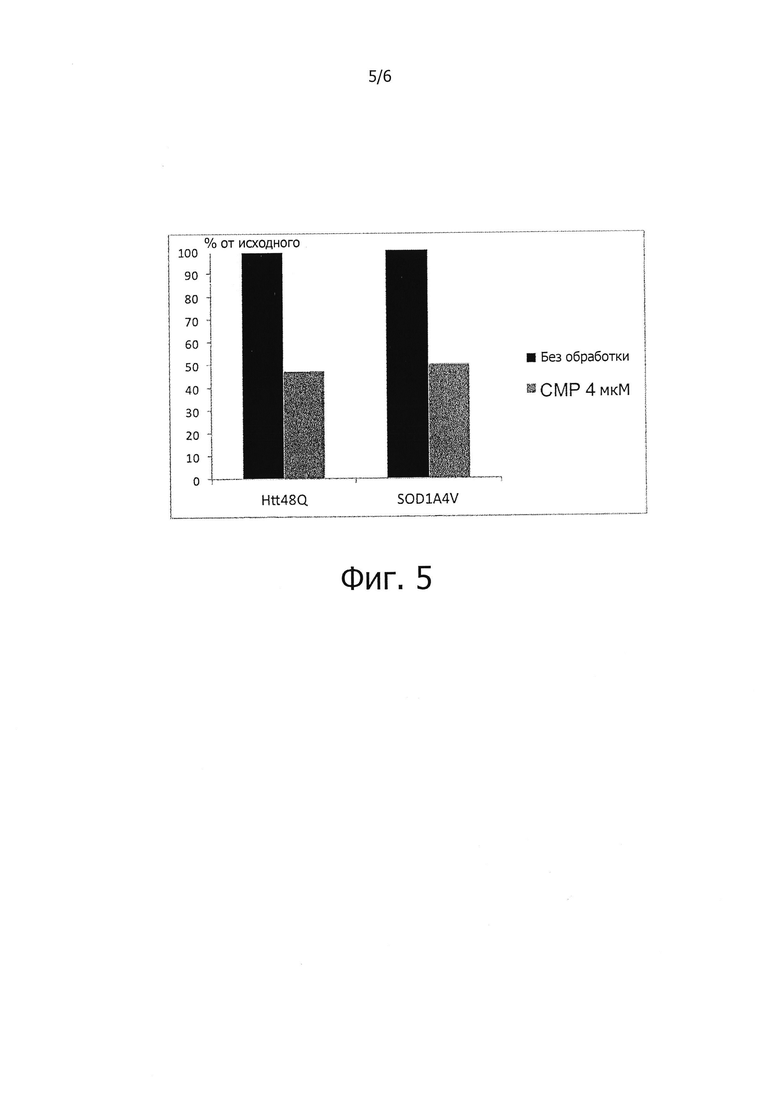
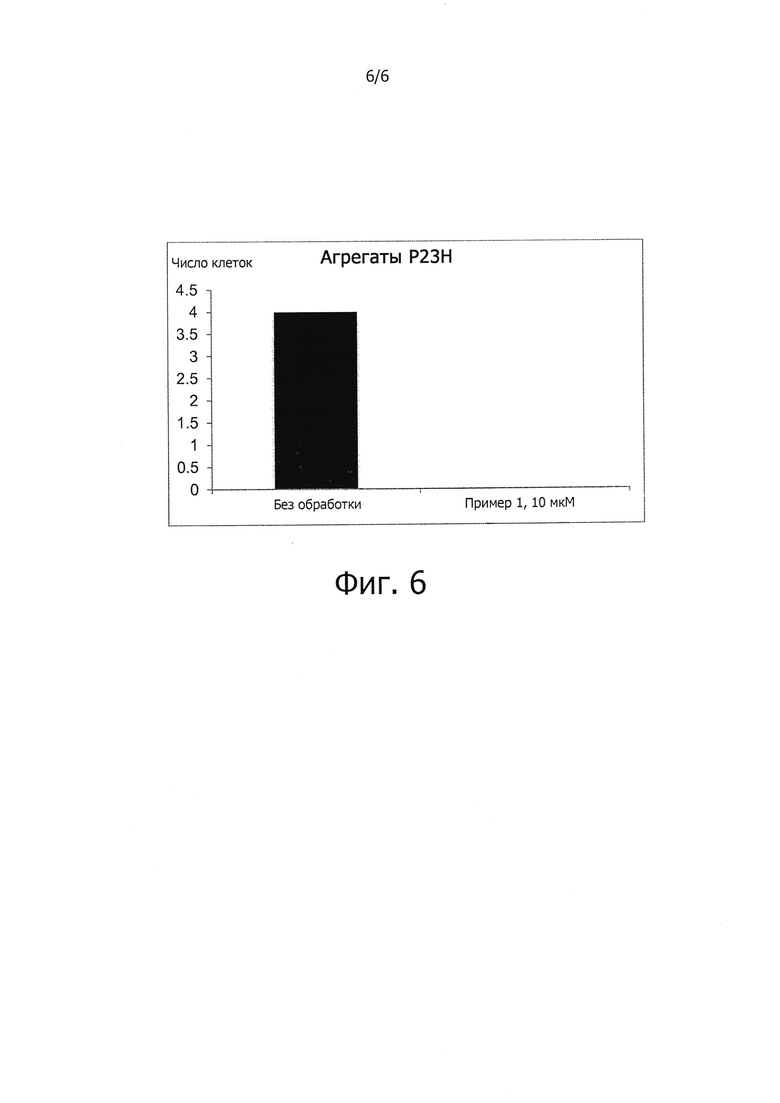
Изобретение относится к применению соединений, описываемых формулой (I), или их фармацевтически приемлемых солей или таутомерных форм для лечения расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, в частности с накоплением неправильно свернутых белков. Расстройства выбраны из нейропатии Шарко-Мари-Тута; тяжелого синдрома Дежерина-Сотта; заболеваний сетчатки, предпочтительно пигментного ретинита, цилиопатии сетчатки, макулярной дегенерации или диабетической ретинопатии или бокового амиотрофического склероза (ALS). В формуле (I) R1 представляет собой алкил, Cl, F или Br; R2 представляет собой H или F; R3 выбирают из H и алкила; R4 выбирают из H, COалкила и COOалкила; R5 представляет собой H; или R4 и R5 соединены, образуя оксодигидротриазиновую группу, которая необязательно является замещенной одной или более алкильными группами R10; X и Z независимо друг от друга представляют собой CR11, Y выбирают из CR11 и N; R11 представляет собой H или F, причем алкил означает C1-20-алкил. Изобретение относится также к различным вариантам соединений формулы (I) и фармацевтической композиции для использования в лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, в частности с накоплением неправильно свернутых белков. 6 н. и 8 з.п. ф-лы, 6 ил., 2 табл., 16 пр.
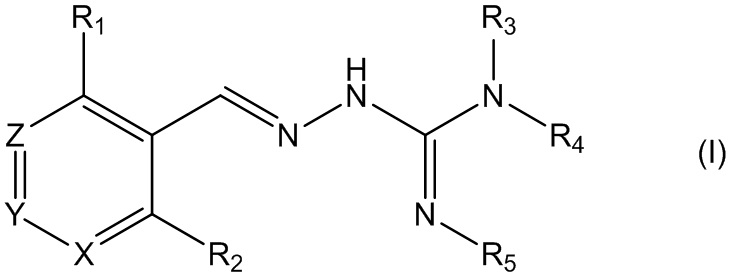
1. Применение соединения, описываемого формулой (I), или его фармацевтически приемлемой соли или его таутомерной формы
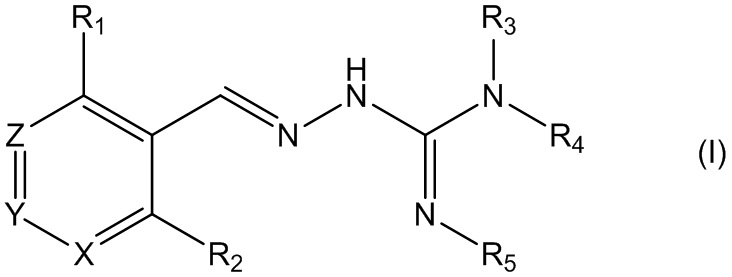 ,
,
где R1 представляет собой алкил, Cl, F или Br;
R2 представляет собой H или F;
R3 выбирают из H и алкила;
R4 выбирают из H, COалкила и COOалкила;
R5 представляет собой H;
или R4 и R5 соединены, образуя оксодигидротриазиновую группу, которая необязательно является замещенной одной или более алкильными группами R10;
X и Z независимо друг от друга представляют собой CR11, Y выбирают из CR11 и N;
R11 представляет собой H или F;
в лечении расстройств, связанных со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, выбранных из нейропатии Шарко-Мари-Тута; тяжелого синдрома Дежерина-Сотта; заболеваний сетчатки, предпочтительно пигментного ретинита, цилиопатии сетчатки, макулярной дегенерации или диабетической ретинопатии; бокового амиотрофического склероза (ALS),
где алкил означает C1-20-алкил.
2. Применение соединения по п.1, в котором
R1 представляет собой Cl, Br, Me или F, более предпочтительно Cl;
R2 представляет собой H;
Y представляет собой CR11;
Y представляет собой N;
R3 и R4 представляют собой H;
R3 представляет собой H и R4 представляет собой COалкил и COOалкил; или
R4 и R5 соединены, образуя оксодигидротриазиновую группу, которая необязательно является замещенной одной или более алкильными группами R10.
3. Применение соединения по п.1 или 2, в котором указанное соединение описывается формулой (Ia) или является его фармацевтически приемлемой солью или его таутомерной формой
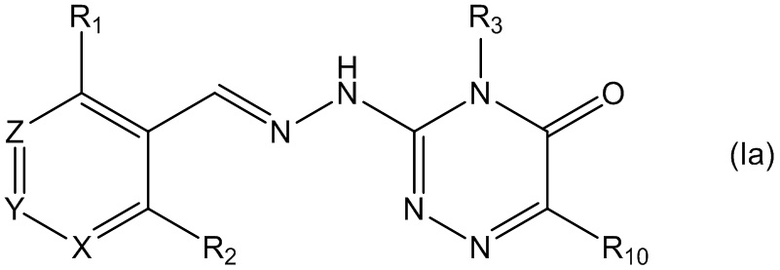 ,
,
где R1, R2, R3 и R10 соответствуют определениям в п.1.
4. Применение соединения по п.1 или 2, которое выбрано из следующих соединений:
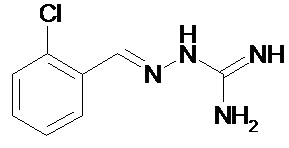


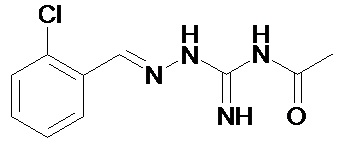

или их таутомерных форм или их фармацевтически приемлемых солей.
5. Применение соединения по п.4, которое выбрано из «Примера 1» или его фармацевтически приемлемых солей.
6. Применение соединения по п.4, являющегося «Примером 15» или его фармацевтически приемлемой солью.
7. Применение соединения по п.4, являющегося «Примером 16» или его фармацевтически приемлемой солью.
8. Применение соединения по п.1 или 2, в котором расстройство представляет собой нейропатию Шарко-Мари-Тута.
9. Соединение, описываемое формулой (II), или его фармацевтически приемлемая соль или его таутомерная форма
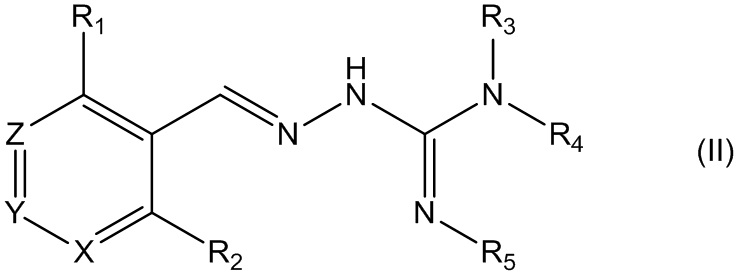 ,
,
где R1 представляет собой алкил, Cl, F или Br;
R2 представляет собой H или F;
R3 выбирают из H и алкила;
R4 выбирают из Н, COалкила и COOалкила;
R5 представляет собой H;
или R4 и R5 соединены, образуя оксодигидротриазиновую группу, которая необязательно является замещенной одной или более алкильными группами R10;
X и Z независимо друг от друга каждый представляет собой CR11, а Y представляет собой N; и
R11 представляет собой H или F,
где алкил означает C1-20-алкил.
10. Соединение, описываемое формулой (III), или его фармацевтически приемлемая соль или его таутомерная форма
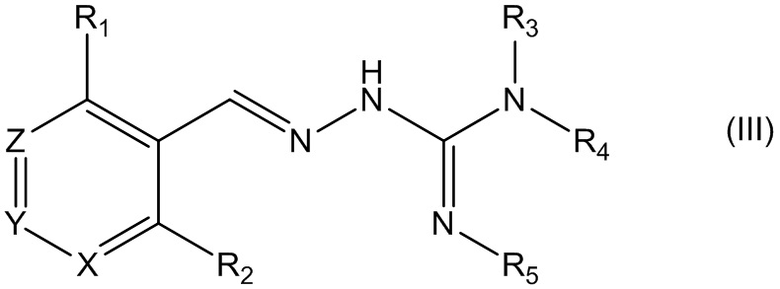 ,
,
где R1 представляет собой алкил, Cl, F или Br;
R2 представляет собой H или F;
R3 выбирают из H и алкила;
R4 представляет собой COалкил или COOалкил;
R5 представляет собой H;
или R4 и R5 соединены, образуя оксодигидротриазиновую группу, которая необязательно является замещенной одной или более алкильными группами R10;
X и Z независимо друг от друга каждый представляет собой CR11, а Y выбирают из CR11 и N; и
R11 представляет собой H или F,
где алкил означает C1-20-алкил;
при условии, что в формуле (III) следующие условия не могут выполняться одновременно:
R1=Cl, R2=H, X=Y=Z=CH, R3=H и R4 и R5 соединены с образованием цикла
 .
.
11. Соединение по п.10, описываемое формулой (IIIа), или его фармацевтически приемлемая соль
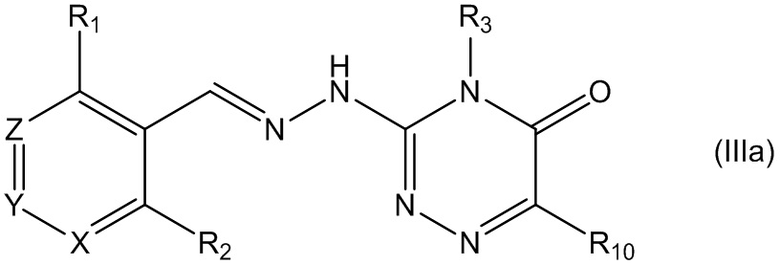 ,
,
где R1, R2, R3 и R10 соответствуют определениям в п.10, при условии, что в этом соединении следующие условия не могут выполняться одновременно: R1=Cl, R2=H, X=Y=Z=CH, R3=H и R10=CH3.
12. Соединение, описываемое формулой (IV), или его фармацевтически приемлемая соль или его таутомерная форма
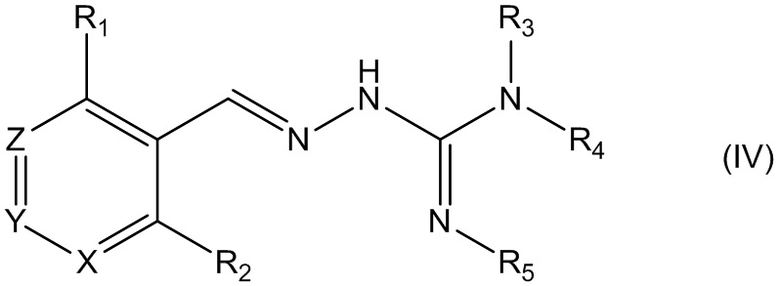 ,
,
где R1 представляет собой алкил или Br;
R2 представляет собой H;
R3 выбирают из H и алкила;
R4 выбирают из Н, COалкила и COOалкила;
R5 представляет собой H;
или R4 и R5 соединены, образуя оксодигидротриазиновую группу, которая необязательно является замещенной одной или более алкильными группами R10;
X и Z независимо друг от друга каждый представляет собой CН, а Y представляет собой CR11;
R11 представляет собой H или F,
где алкил означает C1-20-алкил;
при условии, что в формуле (IV) следующие условия не могут выполняться одновременно:
R1=Br или метил, R2=H, X=Y=Z=CH, R3=R4=R5=H.
13. Соединение, выбираемое из следующих и их фармацевтически приемлемых солей или их таутомерных форм:





14. Фармацевтическая композиция для использования в лечении расстройства, связанного со стрессом, обусловленным неправильным сворачиванием белков, и, в частности, с накоплением неправильно свернутых белков, содержащая эффективное количество соединения по любому из пп.9-13 или его таутомерной формы, смешанное с фармацевтически приемлемым разбавителем, носителем или эксципиентом.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 3541218 А, 17.11.1970 | |||
| Устройство для ротационной вытяжки | 1981 |
|
SU958018A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| NAN JIANG ET AL., Synthesis and biological evaluation of novel 2-(2-arylmethylene)hydrazinyl-4-aminoquinazoline derivatives as potent antitumor agents, EUR | |||
| J | |||
| MED | |||
| CHEM., 2012, vol | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| Ножной переключатель для перемены направления вращения электродвигателя | 1921 |
|
SU534A1 |
| D | |||
| TRIBOUILLARD-TANVIER ET AL., Antihypertensive drug guanabenz is active in vivo against both yeast and mammalian prions, PLOS ONE, 2008, vol | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| АМИНОГУАНИДИНКАРБОКСИЛАТЫ | 1995 |
|
RU2162462C2 |
Авторы
Даты
2018-05-25—Публикация
2014-01-10—Подача