Изобретение относится к медицине, а именно к репродуктологии, андрологии и вспомогательным репродуктивным технологиям.
На сегодняшний день каждая шестая супружеская пара сталкивается с трудностями наступления и вынашивания беременности. По данным Всемирной Организации Здравоохранения доля мужского бесплодия составляет 50-60% (World Health Organization. WHO laboratory manual for the Examination and processing of human semen (5th edn). WHO Press: Geneva, 2010; 271). Мужское бесплодие может быть обусловлено широким спектром причин, включающих как соматические заболевания пациентов, так и генетически обусловленные нарушения сперматогенеза, приводящие к снижению качества эякулята. Значительную долю составляют нарушения репродуктивной функции без видимой причины (идиопатическое бесплодие). Последнее может быть вызвано в том числе функциональными нарушениями генома сперматозоидов из-за его аномального эпигенетического статуса.
В соответствии с рекомендациями Всемирной Организации Здравоохранения (WHO Press: Geneva, 2010; 271 (World Health Organization. WHO laboratory manual for the Examination and processing of human semen (5th edn)), оценка качества эякулята проводится по таким параметрам, как объем эякулята, концентрация, подвижность и морфология сперматозоидов. Недавно внедренным в медицинскую практику, но уже широко используемым способом оценки качества эякулята является оценка целостности генома сперматозоидов методом TUNEL (terminal deoxynucleotidyl transferase-mediated dUTP nick-end labelling), выявляющим одно- и двунитевые разрывы в ДНК (фрагментацию ДНК).
Используемые способы позволяют оценить морфологические характеристики сперматозоидов и целостность их ДНК, но не дают представления об их эпигенетическом статусе. Эпигенетический статус клетки можно оценить по наличию и характеру распределения специфических эпигенетических маркеров, наиболее значимыми из которых являются метилированный цитозин (5-метилцитозин) и его кислородсодержащая форма -5-гидроксиметилцитозин. Эпигенетическому модифицированию подвергается цитозин, входящий в состав ДНК, но при этом не происходит изменения последовательности нуклеотидов. Превращение цитозина в 5-гидроксиметилцитозин происходит как запрограммированно, так и спонтанно под влиянием экзогенных факторов, в том числе оксидативного стресса. Как запрограммированные, так и спонтанные эпигенетические изменения приводят к изменению работы генома. Таким образом, эпигенетический статус сперматозоида важен для реализации основной его функции, которая заключается в передаче генетической и эпигенетической информации и инициации программы развития нового организма.
Связь качества эякулята с уровнем метилирования ДНК (содержанием 5-метилцитозина) доказана. Однако специфичность гидроксиметилирования ДНК сперматозоидов (содержания 5-гидроксиметилцитозина) остается малоизученной в связи с тем, что эпигенетическая роль 5-гидроксиметилцитозина была установлена только в 2009-2011 годах (Tahiliani M, Koh KP, Shen Y, Pastor WA, Bandukwala H, Brudno Y, Agarwal S, Iyer LM, Liu DR, Aravind L, Rao A. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science. 2009; 324: 930-935. Branco MR, Ficz G, Reik W. Uncovering the role of 5-hydroxymethylcytosine in the epigenome. Nat Rev Genet. 2011; 13: 7-13). В дальнейшем Дженкинс с соавторами изучил уровень гидроксиметилирования в ДНК, выделенной из образцов эякулята (тотальной ДНК), и установил, что с возрастом содержание 5-гидроксиметилцитозина в эякуляте увеличивается (Jenkins TG, Aston KI, Cairns BR, Carrell DT. Paternal aging and associated intraindividual alterations of global sperm 5-methylcytosine and 5-hydroxymethylcytosine levels. Fertil Steril. 2013; 100: 945-951). Ванг с соавторами выявил различия по специфичности содержания 5-гидроксиметилцитозина в 9029 генах между нормальными сперматозоидами, морфологически аномальными сперматозоидами и сперматозоидами при глобозооспермии (Wang XX, Sun BF, Jiao J, Chong ZC, Chen YS, Wang XL, Zhao Y, Zhou YM, Li D. Genome-wide 5-hydroxymethylcytosine modification pattern is a novel epigenetic feature of globozoospermia. Oncotarget. 2015; 6: 6535-6543. doi: 10.18632/oncotarget.3163). В другом исследовании было показано повышение общего уровня гидроксиметилирования ДНК на 19.37% в эякуляте мужчин, подверженных в силу профессиональной вредности действию бисфенола-А, вызывающего также снижение концентрации и подвижности сперматозоидов (Zheng H, Zhou X, Li DK, Yang F, Pan H, Li T, Miao M, Li R, Yuan W. Genome-wide alteration in DNA hydroxymethylation in the sperm from bisphenol A-exposed men. PLoS One. 2017;12(6):e0178535. doi: 10.1371/journal.pone.0178535. eCollection 2017). Эти данные указывают на возможную связь аномальных изменений характера гидроксиметилирования ДНК сперматозоидов с ухудшением характеристик эякулята. Однако авторами этих исследований не было заявлено об их диагностическом характере.
Ограничениями указанных способов является то, что устанавливается средний уровень гидроксиметилирования ДНК, т.к. анализ проводят на ДНК, выделенной из большого числа сперматозоидов (тотальной ДНК). Такой способ оценки не чувствителен в ситуации, когда в одних сперматозоидах происходит увеличение гидроксиметилирования, а в других - уменьшение, при этом общий уровень гидроксиметилирования ДНК не меняется. Между тем, анализ индивидуальных сперматозоидов крайне важен в рамках вспомогательных репродуктивных технологий, где идет искусственно направленный селекционный отбор гамет.
Задачей заявляемого решения является разработка способа оценки качества эякулята по содержанию в нем индивидуальных сперматозоидов с высоким уровнем гидроксиметилирования ДНК.
Техническим результатом предлагаемого способа является более точная дифференциальная диагностика мужского бесплодия.
Технический результат достигается тем, что способ диагностики формы мужского бесплодия включает исследование эякулята на содержание в нем сперматозоидов с повышенным уровнем гидроксиметилирования ДНК.
Решение поставленной задачи обеспечивается тем, что в способе оценки качества эякулята по содержанию сперматозоидов с гидроксиметилированной ДНК на преаналитическом этапе проводят фиксацию сперматозоидов на предметных стеклах и детектируют в них гидроксиметилированную ДНК с помощью иммунофлуоресценции, затем оценивают при микроскопическом анализе флуоресценцию в не менее чем 5000 индивидуальных сперматозоидов, при этом нормой считают долю сперматозоидов с гидроксиметилированной ДНК, не превышающую 0.5% от общего числа проанализированных сперматозоидов.
Отличие способа заключается в том, что проводят иммунофлуоресцентный анализ гидроксиметилированной ДНК в индивидуальных сперматозоидах, зафиксированных на предметном стекле, а не в тотальной ДНК, выделенной из эякулята.
Этот способ является более точным и информативным по сравнению с другими способами оценки гидроксиметилированной ДНК в эякуляте, т.к. позволяет оценить гидроксиметилирование ДНК в индивидуальных сперматозоидах с учетом их морфологических особенностей и определить их долю в эякуляте. Для оценки доли сперматозоидов с гидроксиметилированной ДНК в эякуляте одного пациента необходимо и достаточно провести анализ 5000 клеток, что дает возможность с 95% вероятностью выявить определить 25 и более сперматозоидов с гидроксиметилированной ДНК.
Анализ специальной и патентной литературы показал, что предлагаемый способ является оригинальным и не имеет аналогичных решений по оценке качества эякулята. Следовательно, предлагаемое техническое решение соответствует критерию изобретения «новизна».
Авторами заявляемого способа впервые проведено исследование эякулята на содержание в нем сперматозоидов с повышенным уровнем гидроксиметилирования ДНК. Ранее никем не было предложено использовать долю гидроксиметилированных сперматозоидов в эякуляте для оценки его качества, на основании которого можно диагностировать бесплодие.
Данный способ предназначен для использования в медицине, а именно в репродуктологии, андрологии и вспомогательных репродуктивных технологиях. Осуществление его возможностей подтверждено описанными в изобретении приемами и средствами.
Следовательно, предлагаемый «Способ оценки качества эякулята по содержанию сперматозоидов с гидроксиметилированной ДНК» соответствует критериям «изобретательский уровень» и «промышленная применимость».
Предлагаемый способ заключается в том, что у пациентов на препаратах из эякулята определяют под микроскопом долю сперматозоидов с гидроксиметилированной ДНК, выявленной методом иммунофлуоресценции.
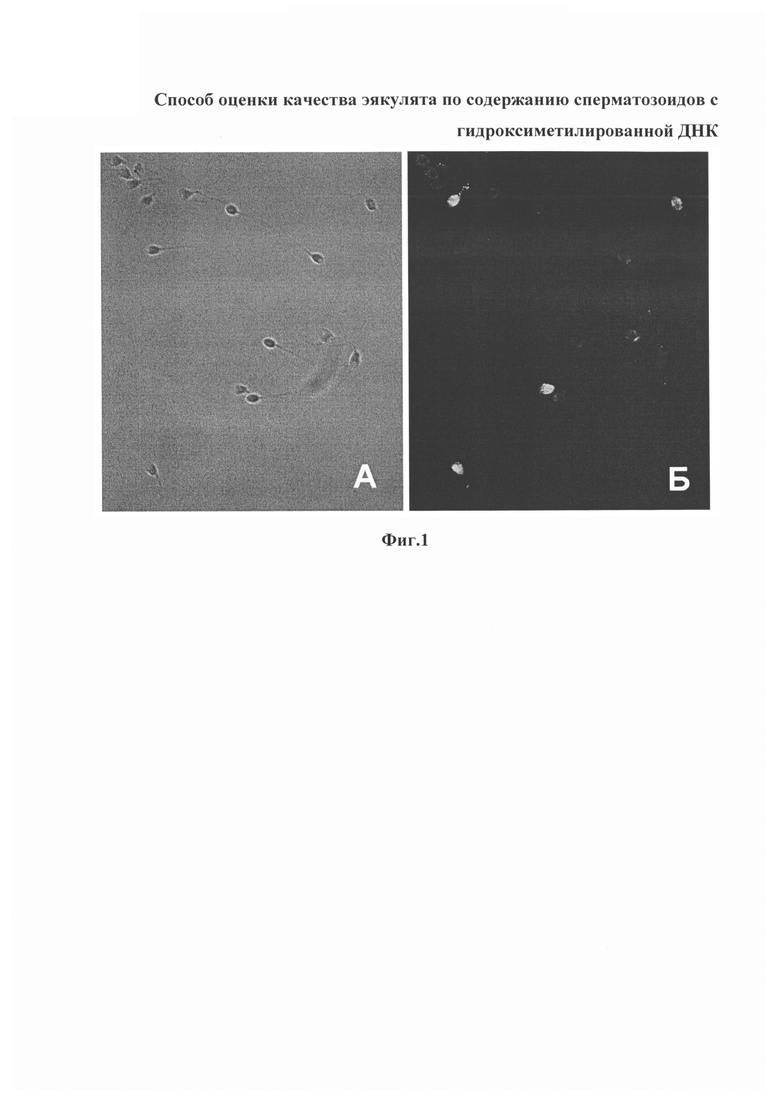
Изобретение поясняется фиг. 1, на которой представлены сперматозоиды из эякулята пациента со сниженным репродуктивным потенциалом, сфотографированные в режиме фазового контраста (А) и в режиме флуоресценции после иммунофлуоресцентной детекции 5-гидроксиметилцитозина (Б). Гидроксиметилированные сперматозоиды характеризуются ярким флуоресцентным сигналом (Б).
Способ осуществляют следующим образом. Образцы эякулята, полученные путем мастурбации, помещают в центрифужные пробирки (по 1 мл в пробирку) и осаждают центрифугированием в течение 5 мин при 1700 об/мин. Далее готовят препараты сперматозоидов, зафиксированных на предметном стекле, а именно: удаляют супернатант и осуществляют пипетирование осадка до образования однородного раствора. Затем в пробирку с эякулятом по капле добавляют 5 мл гипотонического раствора (0.9% цитрат натрия) и снова пипетируют. Проводят гипотоническую обработку материала при комнатной температуре в течение 40 минут. После этого проводят центрифугирование в течение 10 минут при 1700 об/мин, удаляют супернатант и пипетируют осадок. К осадку добавляют по капле 5 мл фиксатора (этанол + ледяная уксусная кислота в соотношении 3:1), периодически встряхивая пробирку, после чего пипетируют до образования однородного раствора. Фиксируют при температуре +4°С не менее 2 часов. Зафиксированный эякулят пипетируют и делают препараты, нанося на чистые обезжиренные предметные стекла путем раскапывания 30-50 мкл суспензии с высоты 30-50 см. Стекла высушивают на воздухе при комнатной температуре в течение суток. Препараты проводят через серию спиртов 70, 80, 95% по 3 минуты в каждом и высушивают. Проводят денатурацию препаратов в 2М HCl в течение 25-30 минут при комнатной температуре. Отмывают препараты в трех сменах охлажденного в морозильной камере (-20°С) фосфатного буфера 1xPBS (pH 7.2-7.4) по 3 минуты в каждой, а затем в трех сменах фосфатного буфера 1xPBS (pH 7.2-7.4) при комнатной температуре по 3 минуты в каждой. На влажные препараты под покровные стекла 24×60 мм наносят по 100 мкл блокирующего раствора (1% BSA, 0.1% Tween 20 в 1xPBS) и инкубируют в течение 30-40 минут во влажной камере при температуре +37°С. Далее на влажные препараты под покровные стекла 24×60 мм наносят по 100 мкл раствора антител к 5-гидроксиметилцитозину (rabbit anti-5hmC, ActiveMotif, USA), разведенных в блокирующем растворе в соотношении 1:500, и инкубируют во влажной камере не менее 90 минут при комнатной температуре. Препараты отмывают в трех сменах 1xPBS (рН 7.2-7.4), содержащего 0.5% Tween 20, по 3 мин в каждой, на водяной бане при температуре +37°С. На влажные препараты под покровные стекла 24×60 мм наносят по 100 мкл раствора вторых антител, коньюгированных с флуорохромом Alexa 488 (goat anti-rabbit. Life technologies, USA), разведенных в блокирующем растворе в соотношении 1:200, и инкубируют во влажной камере не менее 90 минут при 37°С. Препараты отмывают в трех сменах 1xPBS (рН 7.2-7.4), содержащего 0,5% Tween 20, по 3 мин в каждой, на водяной бане при температуре +37°С, а затем в двух сменах фосфатного буфера (1xPBS, 7.2-7.4) при комнатной температуре в течение 3 минут в каждой. Препараты ополаскивают дистиллированной водой, проводят через серию спиртов 70, 80, 95% по 3 минуты в каждом и высушивают на воздухе при комнатной температуре. Препараты заключают под покровные стекла 24×60 мм в фотозащитный раствор Vectashield, содержащий краситель DAPI (VetorLabs, США), и анализируют с помощью люминесцентного микроскопа, оборудованного светофильтрами для флуорохромов Alexa 488 и DAPI. О гидроксиметилировании ДНК в сперматозоидах судят по наличию флуоресцентного сигнала Alexa 488 (флуоресценция с зеленой части спектра) в головке. В норме подавляющее большинство сперматозоидов окрашивается антителами к 5-гидроксиметилцитозину одинаково слабо и не содержат яркого флуоресцентного сигнала; яркая флуоресценция, свидетельствующая о повышенном уровне гидроксиметилирования ДНК, характерна для единичных сперматозоидов (фиг. 1). Производят анализ 5000 сперматозоидов, подсчитывая среди них сперматозоиды с повышенным уровнем гидроксиметилирования ДНК. В результате анализа устанавливают в эякуляте долю сперматозоидов с повышенным уровнем гидроксиметилирования ДНК (= гидроксиметилированных сперматозоидов). В норме она не должна превышать 0.5%.
Пример 1. Проведен сравнительный анализ содержания сперматозоидов с повышенным уровнем гидроксиметилирования ДНК у пациентов из бесплодных пар (n=37) и доноров спермы (n=13). Доля таких сперматозоидов варьировала в широких пределах у пациентов (от 0.12 до 21.24%) и была стабильно низка у доноров спермы: 0.02-0.46%. С помощью U-критерия Манна-Уитни установлено, что в эякуляте пациентов из бесплодных пар содержание гидроксиметилированных сперматозоидов статистически значимо выше, чем в эякуляте доноров спермы (Р<0.0001). Следовательно, увеличение в эякуляте доли сперматозоидов с повышенным уровнем гидроксиметилирования ДНК ассоциировано с нарушением фертильности.
Пример 2. Проведен корреляционный анализ (путем расчета коэффициента ранговой корреляции Спирмена) между содержанием в эякуляте гидроксиметилированных сперматозоидов и другими качественными и количественными параметрами спермограммы: концентрацией, подвижностью и морфологией, в том числе содержанием в эякуляте сперматозоидов с нормальной головкой, аномальной головкой, аномальным хвостом, аномальной шейкой. Выявлена сильная отрицательная корреляция между содержанием в эякуляте гидроксиметилированных сперматозоидов и сперматозоидов с нормальной общей морфологией (r = -0.567, Р < 0.0001), а также сперматозоидов с нормальной морфологией головки (r = -0.609, Р < 0.0001). Слабая положительная корреляция выявлена с содержанием непрогрессивно-подвижных сперматозоидов (r = 0.346, Р = 0.014) и общей подвижностью (r = 0.317, Р = 0.025). Не выявлено статистически значимых корреляций между содержанием в эякуляте гидроксиметилированных сперматозоидов и концентрацией (r = 0.077, Р = 0.595), прогрессивной подвижностью (r = -0.192, Р = 0.183), содержанием сперматозоидов с аномалиями хвоста (r = -0.192, Р = 0.183) и шейки (r = -0.157, Р = 0.276). Следовательно, чем выше в эякуляте доля гидроксиметилированных сперматозоидов, тем меньше в нем содержание морфологически нормальных сперматозоидов и сперматозоидов с нормальной морфологией головки.
Пример 3. Проведен корреляционный анализ (путем расчета коэффициента ранговой корреляции Спирмена) между содержанием в эякуляте гидроксиметилированных сперматозоидов и сперматозоидов с фрагментированной ДНК, выявленных методом TUNEL. Высокая доля сперматозоидов с фрагментированной ДНК свидетельствует о снижении качества эякулята. Выявлена сильная положительная корреляция между содержанием в эякуляте гидроксиметилированных сперматозоидов и сперматозоидов с фрагментированной ДНК (r = 0.46, Р = 0.001). Следовательно, чем выше в эякуляте доля гидроксиметилированных сперматозоидов, тем больше в нем содержание сперматозоидов с фрагментированной ДНК.
Таким образом, впервые показано, что оценка качества эякулята может быть основана на определении доли сперматозоидов с гидроксиметилированной ДНК, повышение которой является негативным прогностическим критерием фертильности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ АНОМАЛИЙ УПАКОВКИ ХРОМАТИНА СПЕРМАТОЗОИДОВ ПРИ МУЖСКОМ БЕСПЛОДИИ | 2010 |
|
RU2437100C1 |
| СПОСОБ ДИАГНОСТИКИ ФЕРТИЛЬНОСТИ ЭЯКУЛЯТА ПРИ ИДИОПАТИЧЕСКОМ БЕСПЛОДИИ | 2022 |
|
RU2789239C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНОМАЛИИ УПАКОВКИ ХРОМАТИНА СПЕРМАТОЗОИДОВ ЧЕЛОВЕКА ПРИ МУЖСКОЙ ИНФЕРТИЛЬНОСТИ С ИСПОЛЬЗОВАНИЕМ БИОМЕДИЦИНСКОЙ ТЕСТ-СИСТЕМЫ | 2015 |
|
RU2595838C1 |
| СПОСОБ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ МУЖСКОЙ РЕПРОДУКТИВНОЙ ФУНКЦИИ НА БАЗЕ ОЦЕНКИ ДИСПЕРСИИ ДНК-ФРАГМЕНТОВ СПЕРМАТОЗОИДОВ | 2022 |
|
RU2795567C1 |
| СПОСОБ ДИАГНОСТИКИ НАРУШЕНИЯ РЕПРОДУКТИВНОЙ ФУНКЦИИ У МУЖЧИН | 2009 |
|
RU2419097C1 |
| Способ для определения целостности хроматина/ДНК в сперматозоидах | 2020 |
|
RU2730947C1 |
| СПОСОБ ДИАГНОСТИКИ АНОМАЛИЙ УПАКОВКИ ХРОМАТИНА СПЕРМАТОЗОИДОВ ПРИ МУЖСКОМ БЕСПЛОДИИ И ДИАГНОСТИКУМ ОПРЕДЕЛЕНИЯ МУЖСКОГО БЕСПЛОДИЯ | 2014 |
|
RU2582914C2 |
| СПОСОБ ПОДГОТОВКИ ПРОБЫ СПЕРМАТОЗОИДОВ ДЛЯ ЭЛЕКТРОННОЙ МИКРОСКОПИИ | 2008 |
|
RU2371718C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КАЧЕСТВА ЭЯКУЛЯТА У МУЖЧИН ПО АКТИВНОСТИ КРЕАТИНФОСФОКИНАЗЫ В СПЕРМАЛЬНОЙ ПЛАЗМЕ | 2020 |
|
RU2732968C1 |
| Способ исследования мужской репродуктивной функции | 2023 |
|
RU2819094C1 |
Изобретение относится к медицине, а именно к репродуктологии, андрологии и вспомогательным репродуктивным технологиям, и может быть использовано для оценки качества эякулята по содержанию в нем индивидуальных сперматозоидов с высоким уровнем гидроксиметилирования ДНК. Для этого проводят фиксацию сперматозоидов на предметных стеклах и детектируют содержание гидроксиметилированной ДНК методом иммунофлуоресценции, при этом оценивают не менее 5000 индивидуальных сперматозоидов. Нормой считают долю сперматозоидов с гидроксиметилированной ДНК, не превышающую 0.5% от общего проанализированного количества сперматозоидов. Изобретение обеспечивает точную дифференциальную диагностику мужского бесплодия. 1 ил., 3 пр.
Способ оценки качества эякулята по содержанию сперматозоидов с гидроксиметилированной ДНК, отличающийся тем, что на преаналитическом этапе проводят фиксацию сперматозоидов на предметных стеклах и детектируют в них гидроксиметилированную ДНК с помощью иммунофлуоресценции, затем оценивают при микроскопическом анализе флуоресценцию в не менее чем 5000 индивидуальных сперматозоидов, при этом нормой считают долю сперматозоидов с гидроксиметилированной ДНК, не превышающую 0.5% от общего числа проанализированных сперматозоидов.
| RU2012153836 A, 27.06.2014 | |||
| СПОСОБ ДИАГНОСТИКИ БЕСПЛОДИЯ У МУЖЧИН | 2008 |
|
RU2371720C1 |
| СПОСОБ ЦИТОЛОГИЧЕСКОЙ ДИАГНОСТИКИ НАРУШЕНИЯ СПЕРМАТОГЕНЕЗА | 2007 |
|
RU2328736C1 |
| СПОСОБ ОЦЕНКИ ФЕРТИЛЬНОСТИ МУЖЧИНЫ | 2007 |
|
RU2360247C2 |
| Волновая зубчатая передача | 1985 |
|
SU1310553A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Руководство ВОЗ по исследованию и обработке эякулята человека, М., Капитал Принт, 2012, стр | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
Авторы
Даты
2018-11-27—Публикация
2017-11-30—Подача