Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США серийный номер 61 /867202, поданной 19 августа 2013 года, полное содержание которой включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Согласно настоящему изобретению предложена технология, связанная с манипуляциями и детектированием нуклеиновых кислот, включая, но не ограничиваясь композициями, способами и наборами, связанными с нуклеотидами, содержащими химически активную связывающую группу.
УРОВЕНЬ ТЕХНИКИ
Методики детектирования нуклеиновых кислот остаются инструментом, который имеет критическое значение в области молекулярной диагностики. Способность специфически и эффективно осуществлять манипуляции с биомолекулами лежит в основе многих успешных технологий детектирования. Например, связывание группы, имеющей химическую, биологическую или физическую природу, (например, присоединение «метки») с представляющей интерес биомолекулой представляет собой одну из ключевых технологий, связанных с последующими манипуляциями, детектированием и/или идентификацией указанной биомолекулы.
Традиционные технологии связывания зачастую основаны на способах, в которых задействованы ферменты. Например, в некоторых способах присоединения желаемой метки к целевой ДНК используют фермент лигазу для соединения целевой ДНК с указанной меткой (например, другим фрагментом ДНК, содержащим метку, другим фрагментом ДНК, который сам служит в качестве метки и т.д.). В другом способе фермент полимераза встраивает субстрат полимеразы, модифицированный меткой (например, дезоксинуклеотидтрифосфат (дНТФ) или модифицированный дНТФ), в нуклеиновую кислоту. Преимущество данных способов, в которых задействованы ферменты, заключается в том, что связи, соединяющие биомолекулу с группой, представляют собой «природные» связи, которые позволяют осуществлять дальнейшие манипуляции с конъюгированным продуктом. Однако некоторые имеющие важное значение недостатки включают низкий выход продукта, неэффективные реакции и низкую специфичность вследствие присутствия нескольких реакционноспособных групп в целевой биомолекуле, которые может распознавать фермент. Более того, традиционные способы являются высокозатратными как по времени, так и по финансовым средствам.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соответственно, согласно настоящему изобретению предложена технология, относящаяся к связыванию групп с биомолекулами с использованием химической конъюгации. Данные реакции связывания являются более специфичными и эффективными по сравнению с традиционными технологиями, поскольку разработаны таким образом, что указанные реакции включают механизм конъюгации между конкретными химическими группами.
Тогда как биологические катализаторы (например, ферменты) не распознают и/или не процессируют большинство стандартных химических ковалентных связей, что таким образом ограничивает последующие манипуляции с конъюгированным продуктом, технология, описанная в настоящем документе, обеспечивает химическую связь, которая позволяет осуществлять последующие манипуляции с конъюгированным продуктом с помощью стандартных молекулярно-биологических и биохимических методик.
Например, тогда как в настоящее время доступно множество аналогов нуклеотидов, которые могут приводить к окончанию (терминировать) полимеразной реакции (например, дидезоксинуклеотиды и различные 3'-модифицированные аналоги нуклеотидов), данные молекулы препятствуют или сильно ограничивают дальнейшие манипуляции с нуклеиновыми кислотами, терминированными данными аналогами. Например, указанные аналоги нуклеотидов полностью или по существу ингибируют последующие ферментативные реакции, такие как полимеразная цепная реакция. Кроме того, в некоторых решениях использовали аналоги нуклеотидов, называемые «обратимыми терминаторами», в которых 3'-гидроксильные группы кэпированы химической группой, которая может быть удалена в результате конкретной химической реакции с регенерацией таким образом свободного 3'-гидроксила. Однако применение данных аналогов нуклеотидов требует дополнительного этапа снятия защиты (удаления кэпирующей группы) для удаления защитной (кэпирующей) группы из нуклеиновой кислоты, а также дополнительного этапа очистки для удаления высвобожденного защитной (кэпирующей) группы из реакционной смеси.
В отличие от традиционных технологий согласно настоящему изобретению предложена технология, относящаяся к разработке, синтезу и применению аналогов нуклеотидов (например, рибонуклеотидов, дезоксирибонуклеотидов), которые содержат химически активные группы. Например, в некоторых вариантах реализации предложен аналог нуклеотида, содержащий алкиновую группу, например, нуклеотид, содержащий 3'-алкиновую группу, такой как предложен в вариантах технологии, связанных с 3'-О-пропаргилдезоксинуклеотидами. Указанные химические группы и связи не влияют или не ограничивают в значительной степени применение последующих молекулярно-биологических методик для осуществления манипуляций с соединениями (например, нуклеиновыми кислотами, конъюгатами и другими биомолекулами), содержащими аналоги нуклеотидов. Таким образом, соединения (например, нуклеиновые кислоты, конъюгаты и другие биомолекулы), содержащие описанные аналоги нуклеотидов, находят множество применений.
В некоторых вариантах реализации аналоги нуклеотидов находят применение в качестве функциональных нуклеотидных терминаторов, т.е. указанные аналоги нуклеотидов завершают синтез нуклеиновой кислоты полимеразой, и дополнительно содержат функциональную реакционноспособную группу для последующей химической и/или биохимической обработки, реакции и/или манипуляции. В частности, в некоторых вариантах реализации предложен аналог нуклеотида, в котором 3'-гидроксильная группа кэпирована химической группой, содержащей, например, алкин (например, тройную связь углерод-углерод, например, С≡С). Когда 3'-алкиновый аналог нуклеотида встраивают в нуклеиновую кислоту под действием полимеразы (например, ДНК- и/или РНК-полимеразы) во время синтеза, дальнейшая элонгация нуклеиновой кислоты прекращается («терминируется», «завершается»), поскольку указанная нуклеиновая кислота не содержит свободный 3'-гидроксил для обеспечения субстрата, подходящего для последующего присоединения нуклеотида.
Тогда как аналоги нуклеотидов не являются природным субстратом для стандартных молекулярно-биологических ферментов, алкиновая химическая группа является хорошо известным партнером для химической конъюгации, реакционноспособным в отношении конкретных функциональных групп. Например, алкин реагирует с азидной группой (например, N3, например, N=N=N) в реакции азид-алкинового циклоприсоединения, катализируемой медью (I) («CuAAC»), с образованием двух новых ковалентных связей между атомами азота азида и атомами углерода алкила. Указанные ковалентные связи образуют химическую связь (например, содержащую пятичленное триазольное кольцо) между первым компонентом и вторым компонентом, которые содержали азидную и алкиновую группы до связывания. Реакция циклоприсоединения данного типа является одной из фундаментальных реакций «клик-химии», поскольку она обеспечивает желаемый химический выход, является физиологически стабильной и демонстрирует значительную термодинамическую движущую силу, которая способствует «пружинной» реакции, позволяющей получить один продукт (например, 1,4-региоизомер 1,2,3-триазола). См., например, Huisgen (1961) "Centenary Lecture-1,3-Dipolar Cycloadditions", Proceedings of the Chemical Society of London 357; Kolb, Finn, Sharpless (2001) "Click Chemistry: Diverse Chemical Function from a Few Good Reactions", Angewandte Chemie International Edition 40(11): 2004-2021. Например:
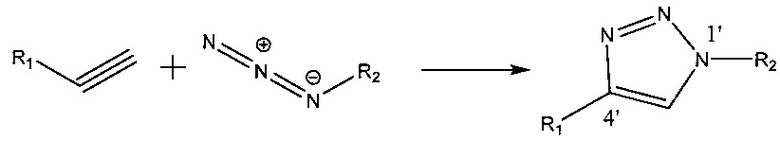 ,
,
где R1 и R2 по отдельности представляют собой любую химическую структуру или химическую группу.
Реакция может быть проведена в различных растворителях, включая водные смеси, композиции, содержащие воду и/или водные смеси, и различных органических растворителях, включая композиции, содержащие спирты, диметилсульфоксид (ДМСО), диметилформамид (ДМФА), трет-бутиловый спирт (ТВА или tBuOH; также известный как 2-метил-2-пропанол (2М2Р)) и ацетон. В некоторых вариантах реализации реакцию проводят в среде, содержащей катализатор на основе меди, такой как Cu/Cu(OAc)2, третичный амин, такой как трис-(бензилтриазолилметил)амин (ТВТА), и/или тетрагидрофуран и ацетонитрил (ТГФ/MeCN).
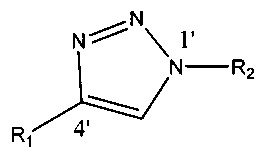
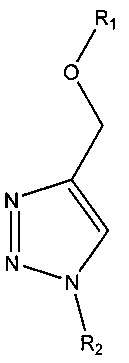
В некоторых вариантах реализации связь, представляющая собой триазольное кольцо, имеет структуру в соответствии с:
 , например,
, например, 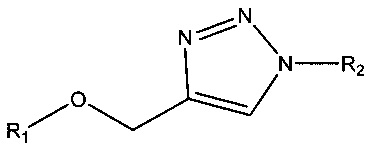 , например,
, например, 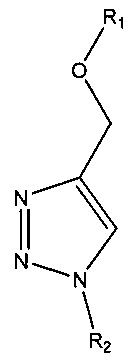 , например,
, например,  ,
,
где R1 и R2 по отдельности представляют собой любую химическую структуру или химическую группу (и могут представлять собой одинаковые или разные химические структуры или химические группы в разных структурах), и В, B1 и В2 по отдельности означают основание нуклеотида (например, аденин, гуанин, тимин, цитозин или природное, или синтетическое нуклеотидное основание, например, модифицированный пурин, такой как гипоксантин, ксантин, 7-метилгуанин; модифицированный пиримидин, такой как 5,6-дигидроурацил, 5-метилцитозин, 5-гидроксиметилцитозин; и т.д.).
Связь, представляющая собой триазольное кольцо, образованная путем алкин-азидного циклоприсоединения, обладает схожими характеристиками (например, физическими, биологическими, биохимическими, химическими характеристиками и т.д.) с природной фосфодиэфирной связью, присутствующей в нуклеиновых кислотах, и, следовательно, является имитатором остова нуклеиновой кислоты. Следовательно, стандартные ферменты, которые узнают природные нуклеиновые кислоты в качестве субстратов, также узнают в качестве субстратов продукты, образованные путем алкин-азидного циклоприсоединения в соответствии с технологией, описанной в настоящем документе. См., например, El-Sagheer et al. (2011) "Biocompatible artificial DNA linker that is read through by DNA polymerases and is functional in Escherichia coli", Proc Natl Acad Sci U S A 108(28): 11338-43.
В некоторых вариантах реализации применение аналогов нуклеотидов, содержащих алкин (например, 3'-О-пропаргильный аналог нуклеотида), позволяет получать нуклеиновые кислоты (например, фрагменты полинуклеотидов ДНК или РНК), содержащие концевую 3'-алкиновую группу. Например, в некоторых вариантах реализации аналоги нуклеотидов, содержащие алкин (например, 3'-О-пропаргильный аналог нуклеотида), встраивают в растущую цепь нуклеиновой кислоты в полимеразной реакции удлинения; после встраивания указанные аналоги нуклеотидов останавливают полимеразную реакцию. Данные терминированные нуклеиновые кислоты представляют собой подходящий химический реагент для реакции клик-химии (например, алкин-азидного циклоприсоединения), например, для химического лигирования с азид-модифицированной молекулой, такой как 5'-азид-модифицированная нуклеиновая кислота, маркирующая группа, содержащий азид, твердый носитель, содержащий азид, белок, содержащий азид, и т.д., включая, но не ограничиваясь ими, фрагменты, соединения и компоненты, рассмотренные в настоящем документе. В некоторых вариантах реализации, например, 3'-О-пропаргильную группу на 3'-конце продукта, представляющего собой нуклеиновую кислоту, используют в реакции введения метки с азид-модифицированной меткой с использованием химического лигирования, например, в соответствии с реакцией клик-химии. Ковалентная связь, образуемая с использованием этой химии, имитирует ковалентную связь природной фосфодиэфирной связи нуклеиновой кислоты, что таким образом позволяет применять химически лигированные нуклеиновые кислоты в последующих ферментативных реакциях, таких как полимеразная цепная реакция, при этом триазольная химическая связь вызывает минимальное, ограниченное или недетектируемое (например, отсутствие) ингибирование ферментативной реакции.
В некоторых вариантах реализации аналог нуклеотида, содержащий алкин, подвергают реакции с реагентом, содержащим фосфиновую группу, в лигировании по Штаудингеру. В лигировании по Штаудингеру электрофильную ловушку (например, сложный метиловый эфир) помещают на арильную группу триарилфосфина (как правило, в орто-положении по отношению к атому фосфора) и подвергают реакции с азидом с получением аза-илидного промежуточного соединения, которое затем перегруппировывается (например, в водных средах) с образованием соединения с амидной группой и фосфиноксидной функциональной группой. Лигирование по Штаудингеру позволяет лигировать (присоединять и ковалентно связывать) две исходные молекулы друг с другом.
Соответственно, согласно настоящему изобретению предложена технология, связанная с композицией, содержащей аналог нуклеотида, имеющий структуру в соответствии с:
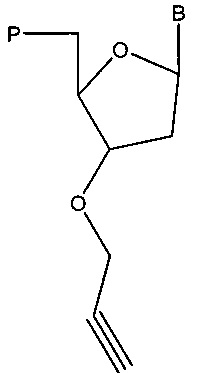 ,
,
где В представляет собой основание, и Р содержит фосфатную группу. В некоторых вариантах реализации Р содержит тетрафосфат; трифосфат; дифосфат; монофосфат; 5'-гидроксил; альфа-тиофосфат (например, фосфоротиоат или фосфородитиоат), бета-тиофосфат (например, фосфоротиоат или фосфородитиоат) и/или гамма-тиофосфат (например, фосфоротиоат или фосфородитиоат); или альфа-метилфосфонат, бета-метилфосфонат и/или гамма-метилфосфонат.
В некоторых вариантах реализации Р содержит азид (например, N3, например, N=N=N), что таким образом обеспечивает в некоторых вариантах реализации направленный бифункциональный агент полимеризации, описанный в настоящем документе.
В некоторых вариантах реализации В представляет собой основание цитозин, гуанин, аденин, тимин или урацил. То есть в некоторых вариантах реализации В представляет собой пурин или пиримидин, или модифицированный пурин, или модифицированный пиримидин. Технология не ограничивается основаниями В, которые находят применение в аналогах нуклеотидов. Например, В может представлять собой любое синтетическое, искусственное или природное основание; таким образом, в некоторых вариантах реализации В представляет собой синтетическое основание; в некоторых вариантах реализации В представляет собой искусственное основание; в некоторых вариантах реализации В представляет собой природное основание. В некоторых вариантах реализации композиции содержат аналог нуклеотида и нуклеиновую кислоту (например, полинуклеотид). В некоторых вариантах реализации композиции дополнительно содержат полимеразу и/или нуклеотид (например, стандартный нуклеотид). В композициях, содержащих нуклеотид и аналог нуклеотида, в некоторых вариантах реализации числовое соотношение аналога нуклеотида и нуклеотида составляет 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:15, 1:20, 1:25, 1:30, 1:50, 1:75, 1:100, 1:200, 1:300, 1:400, 1:500, 1:600, 1:700, 1:800, 1:900, 1:1000, 1:5000 или 1:10000.
В некоторых вариантах реализации нуклеиновая кислота содержит аналог нуклеотида, предложенный согласно настоящему изобретению. В некоторых вариантах реализации нуклеиновая кислота содержит аналог нуклеотида на 3'-конце (например, аналог нуклеотида расположен на 3'-конце нуклеиновой кислоты). В некоторых вариантах реализации технология относится к синтезу нуклеиновой кислоты, содержащей аналог нуклеотида, под действием биологического фермента. То есть, указанный биологический фермент узнает аналог нуклеотида в качестве субстрата и встраивает аналог нуклеотида в нуклеиновую кислоту. Например, в некоторых вариантах реализации нуклеиновую кислоту получают под действием полимеразы.
В некоторых вариантах реализации композиции дополнительно содержат азид, например, компонент, соединение, молекулу, поверхность, биомолекулу и т.д., содержащую азид.
В некоторых вариантах реализации композиции содержат несколько нуклеиновых кислот; соответственно, в некоторых вариантах реализации композиции содержат вторую нуклеиновую кислоту (например, в дополнение к нуклеиновой кислоте, содержащей аналог нуклеотида). Технология включает функционализированные нуклеиновые кислоты для проведения реакции с нуклеиновой кислотой, содержащей аналог нуклеотида. Таким образом, в некоторых вариантах реализации вторая нуклеиновая кислота содержит азидную группу, например, в некоторых вариантах реализации вторая нуклеиновая кислота содержит азидную группу на 5'-конце второй нуклеиновой кислоты.
Технология не ограничивается соединением (например, содержащим азидную группу), реагирующим с нуклеиновой кислотой, содержащей аналог нуклеотида. Например, в некоторых вариантах реализации композиции дополнительно содержат маркер, содержащий азид, метку, содержащую азид, твердый носитель, содержащий азид, нуклеотид, содержащий азид, биотин, содержащий азид, или белок, содержащий азид. В некоторых вариантах реализации алкиновую группу и азидную группу подвергают реакции с использованием реакции «клик-химии», катализируемой катализатором на основе меди. Таким образом, в некоторых вариантах реализации композиции дополнительно содержат реагент, представляющий собой катализатор на основе меди. В некоторых вариантах реализации в результате реакции азида и алкина получают триазольную группу. В некоторых вариантах реализации нуклеиновую кислоту, содержащую алкин (например, нуклеиновую кислоту, содержащую аналог нуклеотида, содержащий алкин), подвергают реакции с нуклеиновой кислотой, содержащей азид, с получением более длинной нуклеиновой кислоты. Таким образом, в некоторых вариантах реализации композиции в соответствии с технологией дополнительно содержат нуклеиновую кислоту, содержащую триазол (например, который образует связь между двумя нуклеиновыми кислотами). В некоторых вариантах реализации реакция алкина и азида протекает с региоселективностью, например, в некоторых вариантах реализации нуклеиновая кислота содержит 1',4'-замещенный триазол. В некоторых вариантах реализации нуклеиновую кислоту, содержащую аналог нуклеотида, подвергают реакции с адаптерным олигонуклеотидом, адаптерным олигонуклеотидом, содержащим идентификатор («штрих-код»), или идентификационным («штрих-кодовым») олигонуклеотидом, содержащим азид. Таким образом, в некоторых вариантах реализации предложены реакционные смеси, содержащие адаптерный олигонуклеотид, адаптерный олигонуклеотид, содержащий идентификатор, или идентификационный олигонуклеотид.
В некоторых вариантах реализации нуклеиновая кислота (например, полученная в результате объединения двух нуклеиновых кислот путем реакции «клик-химии» между алкином и азидом) содержит структуру в соответствии с:
 или
или 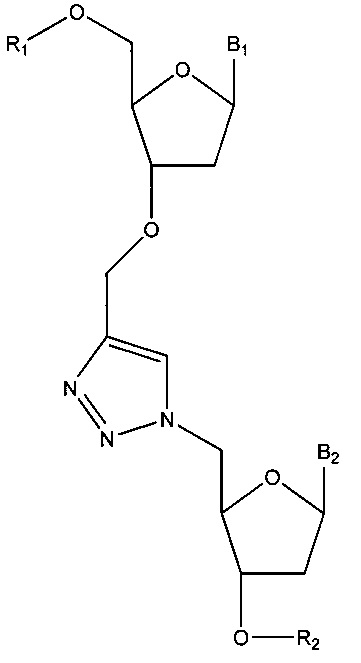 ,
,
где R1 и R2 по отдельности представляют собой любую химическую структуру или химическую группу (и могут представлять собой одинаковые или разные химические структуры или химические фрагменты в разных структурах), и B1 и В2 по отдельности означают основание нуклеотида (например, аденин, гуанин, тимин, цитозин или природное, или синтетическое нуклеотидное основание, например, модифицированный пурин, такой как гипоксантин, ксантин, 7-метилгуанин; модифицированный пиримидин, такой как 5,6-дигидроурацил, 5-метилцитозин, 5-гидроксиметилцитозин; и т.д.).
Другой аспект технологии относится к вариантам способов синтеза модифицированной нуклеиновой кислоты, при этом указанный способ включает получение аналога нуклеотида, содержащего алкиновую группу, и связывание нуклеиновой кислоты с указанным аналогом нуклеотида с получением модифицированной нуклеиновой кислоты, содержащей аналог нуклеотида. В некоторых вариантах реализации аналог нуклеотида имеет структуру в соответствии с:
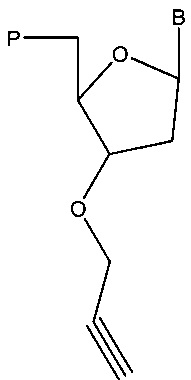 ,
,
где В представляет собой основание (например, цитозин, гуанин, аденин, тимин или урацил), и Р содержит трифосфатную группу. Варианты указанного способа включают также получение, например, матрицы, праймера, нуклеотида (например, стандартного нуклеотида) и/или полимеразы. Аналоги нуклеотидов узнаются в качестве субстрата биологическими ферментами, такими как полимеразы; таким образом, в некоторых вариантах реализации полимераза катализирует связывание нуклеиновой кислоты с аналогом нуклеотида с получением модифицированной нуклеиновой кислоты, содержащей аналог нуклеотида. Указанная модифицированная нуклеиновая кислота обеспечивает субстрат для реакции с азидсодержащим соединением, например, с получением конъюгированного продукта путем реакции «клик-химии». Таким образом, в некоторых вариантах реализации способы дополнительно включают проведение реакции модифицированной нуклеиновой кислоты с азидной группой. Указанные способы не ограничиваются соединением, содержащим азидную группу; например, в некоторых вариантах реализации способы включают проведение реакции модифицированной нуклеиновой кислоты со второй нуклеиновой кислотой, содержащей азидную группу, например, проведение реакции модифицированной нуклеиновой кислоты со второй нуклеиновой кислотой, содержащей азидную группу на 5'-конце второй нуклеиновой кислоты, маркером, содержащим азид, меткой, содержащей азид, твердым носителем, содержащим азид, нуклеотидом, содержащим азид, и/или белком, содержащим азид.
Указанные способы находят применение в связывании адаптерного олигонуклеотида (например, для применения в секвенировании следующего поколения) с нуклеиновой кислотой, содержащей аналог нуклеотида. Соответственно, в некоторых вариантах реализации способы дополнительно включают проведение реакции модифицированной нуклеиновой кислоты с адаптерным олигонуклеотидом, содержащим азидную группу, адаптерным олигонуклеотидом, содержащим идентификатор и содержащим азидную группу, и/или идентификационным олигонуклеотидом, содержащим азидную группу, например, с получением конъюгата нуклеиновая кислота-олигонуклеотид. В некоторых вариантах реализации реакции аналога нуклеотида (например, нуклеиновой кислоты, содержащей аналог нуклеотида) и азида катализируют реагентом, представляющим собой катализатор на основе меди. Соответственно, связанные способы в некоторых вариантах реализации включают проведение реакции модифицированной нуклеиновой кислоты с азидной группой и реагентом, представляющим собой катализатор на основе меди. Поскольку триазольное кольцо, образованное путем реакции «клик-химии», по существу и/или в детектируемой степени не ингибирует активность биологического фермента, конъюгат нуклеиновая кислота-олигонуклеотид обеспечивает нуклеиновую кислоту, подходящую для дальнейших манипуляций, например, в некоторых вариантах реализации модифицированная нуклеиновая кислота представляет собой субстрат для биологического фермента, модифицированная нуклеиновая кислота представляет собой субстрат для полимеразы, и/или модифицированная нуклеиновая кислота представляет собой субстрат для секвенирующей реакции.
Аналоги нуклеотидов, предложенные согласно настоящему изобретению, представляют собой функциональные терминаторы, например, они служат для завершения синтеза нуклеиновой кислоты (например, подобно дидезоксинуклеотиду, используемому в секвенировании по Сэнгеру) в то время как также содержат реакционноспособную группу для дальнейшей химической обработки. Соответственно, как описано в настоящем документе, в некоторых вариантах реализации способы дополнительно включают завершение полимеризации с помощью аналога нуклеотида.
В некоторых вариантах реализации родственные способы обеспечивают способ секвенирования нуклеиновой кислоты, при этом указанный способ включает гибридизацию праймера с матрицей нуклеиновой кислоты с образованием комплекса гибридизованный праймер/матрица нуклеиновой кислоты; получение множества аналогов нуклеотидов, при этом каждый аналог нуклеотида содержит алкиновую группу; проведение реакции указанного комплекса гибридизованный праймер/матрица нуклеиновой кислоты и аналога нуклеотида с полимеразой с присоединением аналога нуклеотида к праймеру путем полимеразной реакции с получением удлиненного продукта, содержащего встроенный аналог нуклеотида; и проведение реакции указанного удлиненного продукта с азидсодержащим соединением с получением структуры, содержащей триазольное кольцо. В конкретных вариантах реализации аналоги нуклеотидов представляют собой 3'-О-пропаргил-дНТФ-аналоги нуклеотидов, и Н выбран из группы, состоящей из А, С, G, Т и U. Поскольку триазольное кольцо, образуемое путем реакции «клик-химии», по существу и/или в детектируемой степени не ингибирует активность биологического фермента, конъюгат нуклеиновая кислота-олигонуклеотид обеспечивает нуклеиновую кислоту, подходящую для дальнейших манипуляций. Таким образом, в некоторых вариантах реализации структуру, содержащую триазольное кольцо, применяют в последующих ферментативных реакциях, например, полимеразной цепной реакции и/или секвенирующей реакции. В некоторых вариантах реализации полимеризацию в присутствии аналогов нуклеотидов осуществляют в присутствии также стандартных (например, нетерминаторных) нуклеотидов. Родственные способы включают получение стандартных нуклеотидов.
Согласно настоящему изобретению также предложены варианты наборов. Например, в некоторых вариантах реализации предложены наборы для синтеза модифицированной нуклеиновой кислоты, при этом указанный набор содержит аналог нуклеотида, содержащий алкинильную группу; и реагент, представляющий собой катализатор на основе меди. В некоторых вариантах реализации наборы дополнительно содержат другие компоненты, которые находят применение в обработке и/или манипуляциях с нуклеиновыми кислотами. Таким образом, в некоторых вариантах реализации наборы дополнительно содержат полимеразу, адаптерный олигонуклеотид, содержащий азидную группу, и/или нуклеотид (например, стандартный нуклеотид).
Например, некоторые варианты технологии относятся к наборам для получения библиотеки для секвенирования следующего поколения (NGS) и/или для получения информации о последовательности от целевой нуклеиновой кислоты. Например, в некоторых вариантах реализации предложен набор, содержащий аналог нуклеотида, например, для получения лесенки (лэддера) нуклеотидных фрагментов в соответствии со способами, предложенными согласно настоящему изобретению. В некоторых вариантах реализации аналог нуклеотида представляет собой 3'-О-блокированный аналог нуклеотида, например, 3'-О-алкинильный аналог нуклеотида, например, 3'-О-пропаргильный аналог нуклеотида. В некоторых вариантах реализации в наборе предложены стандартные А-, С-, G-, U- и/или Т-нуклеотиды, а также один или более (например, 1, 2, 3 или 4) аналогов А-, С-, G-, U- и/или Т-нуклеотидов.
В некоторых вариантах реализации наборы содержат полимеразу (например, природную полимеразу, модифицированную полимеразу и/или разработанную полимеразу и т.д.), например, для амплификации (например, путем термического циклирования, изотермической амплификации) или для секвенирования и т.д. В некоторых вариантах реализации наборы содержат лигазу, например, для присоединения адаптеров к нуклеиновой кислоте, такой как ампликон или лесенка фрагментов, или для циркуляризации адаптера-ампликона. Некоторые варианты наборов содержат реагент, представляющий собой катализатор на основе меди, например, для реакции клик-химии, например, для проведения реакции азидной и алкинильной группы с образованием триазольной связи. В некоторых вариантах наборов предложены буферы, соли, реакционные сосуды, инструкции и/или компьютерное программное обеспечение.
В некоторых вариантах реализации наборы содержат праймеры и/или адаптеры. В некоторых вариантах реализации адаптеры содержат химическую модификацию, подходящую для присоединения адаптера к аналогу нуклеотида, например, посредством клик-химии. Например, в некоторых вариантах реализации набор содержит аналог нуклеотида, содержащий алкиновую группу, и адаптерный олигонуклеотид, содержащий азидную (N3) группу. В некоторых вариантах реализации применяют способ «клик-химии», такой как азид-алкиновое циклоприсоединение, для связывания адаптера с группой через образование триазола.
Конкретные варианты набора обеспечивают набор для получения библиотеки для секвенирования, при этом указанный набор содержит адаптерный олигонуклеотид, содержащий первую реакционноспособную группу (например, азид), 3'-О-блокированный аналог нуклеотида (например, 3'-О-алкинильный аналог нуклеотида или 3'-О-пропаргильный аналог нуклеотида, например, содержащий алкиновую группу, например, содержащую вторую реакционноспособную группу, которая образует химическую связь с первой реакционноспособной группой, например, с использованием клик-химии), полимеразу (например, полимеразу для изотермической амплификации или термического циклирования), второй адаптерный олигонуклеотид, одну или более композиций, содержащих нуклеотид или смесь нуклеотидов, и лигазу или реагент, представляющий собой катализатор на основе меди для клик-химии.
В некоторых вариантах набора наборы содержат один или более Заблокированных аналогов нуклеотидов (например, один или более 3'-О-алкинильных аналогов нуклеотидов, таких как один или более 3'-О-пропаргильных аналогов нуклеотидов) и один или более адаптерных олигонуклеотидов, содержащих азидную группу (например, 5'-азидо-олигонуклеотид, например, 5'-азидо-метил-олигонуклеотид). В некоторых вариантах набора дополнительно предложен 5'-азидо-метил-олигонуклеотид, содержащий идентификатор. В некоторых вариантах набора дополнительно предложено множество 5'-азидо-метил-олигонуклеотидов, содержащих множество идентификаторов (например, каждый 5'-азидо-метил-олигонуклеотид содержит идентификатор, который отличается от одного или более других идентификаторов одного или более других 5'-азидо-метил-олигонуклеотидов, содержащих другой идентификатор). Дополнительные варианты набора содержат каталитический реагент для клик-химии (например, каталитический реагент, представляющий собой медь (I)).
Некоторые варианты набора содержат один или более стандартных дНТФ в дополнение к одному или более 3'-О-блокированным аналогам нуклеотидов (например, одному или более 3'-О-алкинильным аналогам нуклеотидов, таким как один или более 3'-О-пропаргильных аналогов нуклеотидов). Например, в варианте набора предложены дезоксиаденозинтрифосфат (дАТФ), дезоксицитидинтрифосфат (дЦТФ), дезоксигуанозинтрифосфат (дГТФ) и дезокситимидинтрифосфат (дТТФ) либо в отдельных сосудах, либо в виде смеси с одним или более 3'-О-пропаргил-дАТФ, 3'-О-пропаргил-дЦТФ, 3'-О-пропаргил-дГТФ и/или 3'-О-пропаргил-дАТФ.
Некоторые варианты набора дополнительно содержат полимеразу, полученную, происходящую, выделенную, клонированную и т.д. из видов Thermococcus (например, организм таксономической линии Archaea; Euryarchaeota; Thermococci; Thermococcales; Thermococcaceae; Thermococcus). В некоторых вариантах реализации полимеразу получают, извлекают, выделяют, клонируют и т.д. из вида Thermococcus 9°N-7. В некоторых вариантах реализации полимераза содержит замены аминокислот, которые обеспечивают улучшенное встраивание модифицированных субстратов, таких как модифицированные дидезоксинуклеотиды, рибонуклеотиды и ациклонуклеотиды. В некоторых вариантах реализации полимераза содержит замены аминокислот, которые обеспечивают улучшенное встраивание аналогов нуклеотидов, содержащих модифицированные 3'-функциональные группы, таких как 3'-О-пропаргил-дНТФ, описанные в настоящем документе. В некоторых вариантах реализации аминокислотная последовательность полимеразы содержит одну или более замен аминокислот относительно аминокислотной последовательности полимеразы дикого типа Thermococcus sp. 9°N-7, например, замену аспарагиновой кислоты на аланин в положении аминокислоты 141 (D141A), замену глутаминовой кислоты на аланин в положении аминокислоты 143 (Е143А), замену тирозина на валин в положении аминокислоты 409 (Y409V) и/или замену аланина на лейцин в положении аминокислоты 485 (A485L). В некоторых вариантах реализации полимеразу получают в гетерологичном организме-хозяине, таком как Escherichia coli, который содержит клонированный ген полимеразы Thermococcus sp. 9°N-7, например, содержащий одну или более мутаций (например, D141A, Е143А, Y409V и/или A485L). В некоторых вариантах реализации полимераза представляет собой полимеразу Thermococcus sp. 9°N-7, продаваемую под торговым названием THERMINATOR (например, THERMINATOR II) компанией New England BioLabs (Ипсуич, Массачусетс).
Соответственно, некоторые варианты набора содержат один или более 3'-О-пропаргильных аналогов нуклеотидов (например, один или более из: 3'-О-пропаргил-дАТФ, 3'-О-пропаргил-дЦТФ, 3'-О-пропаргил-дГТФ и/или 3'-О-пропаргил-дАТФ), смесь стандартных дНТФ (например, дАТФ, дЦТФ, дГТФ и дТТФ), один или более 5'-азидо-метил-олигонуклеотидных адаптеров, полимеразу, полученную, происходящую, выделенную, клонированную и т.д. из видов Thermococcus, и катализатор клик-химии для образования триазола из азидной группы и алкильной группы. В некоторых вариантах реализации один или более 3'-О-пропаргильных аналогов нуклеотидов (например, один или более из: 3'-О-пропаргил-дАТФ, 3'-О-пропаргил-дЦТФ, 3'-О-пропаргил-дГТФ и/или 3'-О-пропаргил-дАТФ) и смесь стандартных дНТФ (например, дАТФ, дЦТФ, дГТФ и дТТФ) предложены вместе, например, набор содержит раствор, содержащий один или более 3'-О-пропаргильных аналогов нуклеотидов (например, один или более из: 3'-О-пропаргил-дАТФ, 3'-О-пропаргил-дЦТФ, 3'-О-пропаргил-дГТФ и/или 3'-О-пропаргил-дАТФ) и смесь стандартных дНТФ (например, дАТФ, дЦТФ, дГТФ и дТТФ). В некоторых вариантах реализации указанный раствор содержит один или более 3'-О-пропаргильных аналогов нуклеотидов (например, один или более из: 3'-О-пропаргил-дАТФ, 3'-О-пропаргил-дЦТФ, 3'-О-пропаргил-дГТФ и/или 3'-О-пропаргил-дАТФ) и смесь стандартных дНТФ (например, дАТФ, дЦТФ, дГТФ и дТТФ) в соотношении от 1:500 до 500:1 (например, 1:500, 1:450, 1:400, 1:350, 1:300, 1:250, 1:200, 1:150, 1:100, 1:90, 1:80, 1:70, 1:60, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 20:1, 30:1, 40:1, 50:1, 60:1, 70:1, 80:1, 90:1, 100:1, 150:1, 200:1, 250:1, 300:1, 350:1, 400:1, 450:1 или 500:1).
Некоторые варианты наборов дополнительно содержат программное обеспечение для обработки данных последовательности, например, для извлечения данных нуклеотидной последовательности из данных, выданных секвенатором; для идентификации идентификаторов и целевых подпоследовательностей на основе данных, выданных секвенатором; для выравнивания и/или сборки подпоследовательностей на основе данных, выданных секвенатором, для получения консенсусной последовательности; и/или для выравнивания подпоследовательностей и/или консенсусной последовательности с эталонной последовательностью.
В некоторых вариантах реализации предложены композиции, содержащие аналог нуклеотида, имеющий структуру в соответствии с:
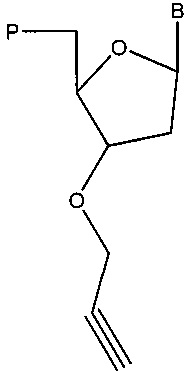 ,
,
где В представляет собой основание (например, пурин или пиримидин, такой как цитозин, гуанин, аденин, тимин или урацил; например, модифицированный пурин или модифицированный пиримидин), и Р содержит фосфатную группу (например, тетрафосфат; трифосфат; дифосфат; монофосфат; 5'-гидроксил; альфа-тиофосфат (например, фосфоротиоат или фосфородитиоат), бета-тиофосфат (например, фосфоротиоат или фосфородитиоат) и/или гамма-тиофосфат (например, фосфоротиоат или фосфородитиоат); или альфа-метилфосфонат, бета-метилфосфонат и/или гамма-метилфосфонат); нуклеиновую кислоту; полимеразу; и нуклеотид (например, содержащий основание В, например, в числовом соотношении аналога нуклеотида и нуклеотида, составляющем 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:15, 1:20, 1:25, 1:30, 1:50, 1:75, 1:100, 1:200, 1:300, 1:400, 1:500, 1:600, 1:700, 1:800, 1:900, 1:1000, 1:5000 или 1:10000).
Также предложены варианты композиций, содержащие нуклеиновую кислоту (например, полученную под действием полимеразы), при этом указанная нуклеиновая кислота содержит аналог нуклеотида (например, на 3'-конце), имеющий структуру в соответствии с:
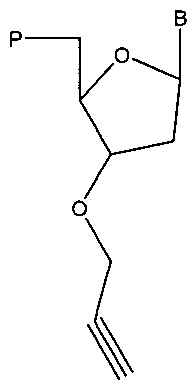 ,
,
где В представляет собой основание (например, пурин или пиримидин, такой как цитозин, гуанин, аденин, тимин или урацил; например, модифицированный пурин или модифицированный пиримидин), и Р содержит фосфатную группу (например, тетрафосфат; трифосфат; дифосфат; монофосфат; 5'-гидроксил; альфа-тиофосфат (например, фосфоротиоат или фосфородитиоат), бета-тиофосфат (например, фосфоротиоат или фосфородитиоат) и/или гамма-тиофосфат (например, фосфоротиоат или фосфородитиоат); или альфа-метилфосфонат, бета-метилфосфонат и/или гамма-метилфосфонат); вторую нуклеиновую кислоту (например, содержащую азид, например, на 5'-конце); маркер, содержащий азид, метку, содержащую азид, твердый носитель, содержащий азид, нуклеотид, содержащий азид, биотин, содержащий азид, или белок, содержащий азид; реагент, представляющий собой медный (например, на основе меди) катализатор; нуклеиновую кислоту, содержащую триазол (например, 1',4'-замещенный триазол); и/или такую структуру, как:
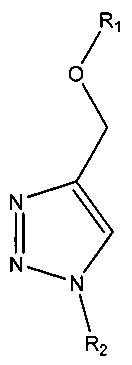 или
или 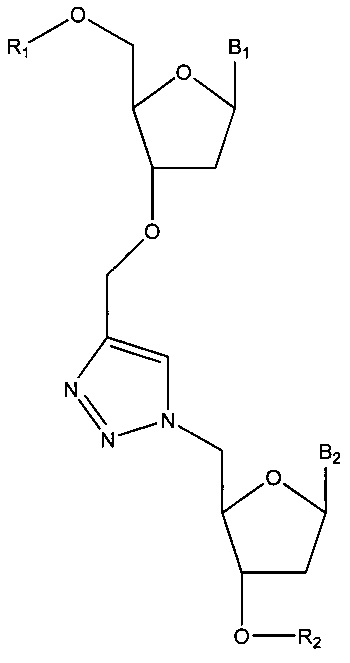 ,
,
где R1 и R2 по отдельности представляют собой любую химическую структуру или химическую группу (и могут представлять собой одинаковые или разные химические структуры или химические группы в разных структурах), и B1 и В2 по отдельности означают основание нуклеотида (например, аденин, гуанин, тимин, цитозин или природное, или синтетическое нуклеотидное основание, например, модифицированный пурин, такой как гипоксантин, ксантин, 7-метилгуанин; модифицированный пиримидин, такой как 5,6-дигидроурацил, 5-метилцитозин, 5-гидроксиметилцитозин; и т.д.); адаптерный олигонуклеотид, адаптерный олигонуклеотид, содержащий идентификатор, или идентификационный олигонуклеотид.
В соответствии с другим аспектом технологии предложен способ синтеза модифицированной нуклеиновой кислоты, при этом указанный способ включает получение аналога нуклеотида, содержащего алкиновую группу, например, нуклеотида, имеющего структуру в соответствии с:
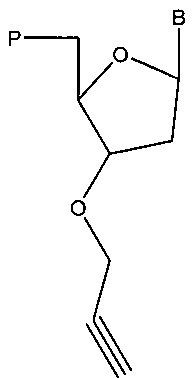 ,
,
где В представляет собой основание (например, цитозин, гуанин, аденин, тимин или урацил), и Р содержит тиофосфатную группу; связывание нуклеиновой кислоты с указанным аналогом нуклеотида с получением модифицированной нуклеиновой кислоты, содержащей аналог нуклеотида; получение матрицы; получение праймера; получение нуклеотида; получение полимеразы (например, для катализа связывания нуклеиновой кислоты с аналогом нуклеотида); завершение полимеризации с помощью аналога нуклеотида; проведение реакции модифицированной нуклеиновой кислоты с азидной группой (например, со второй нуклеиновой кислотой, содержащей азидную группу на 5'-конце, маркером, содержащим азид, меткой, содержащей азид, твердым носителем, содержащим азид, нуклеотидом, содержащим азид, белком, содержащим азид, адаптерным олигонуклеотидом, содержащим азидную группу, адаптерным олигонуклеотидом, содержащим идентификатор и содержащим азидную группу, или идентификационным олигонуклеотидом, содержащим азидную группу), например, с получением конъюгата нуклеиновая кислота-олигонуклеотид (например, представляющего собой субстрат для биологического фермента, такого как полимераза, и/или для получения субстрата для секвенирующей реакции); и/или проведение реакции модифицированной нуклеиновой кислоты с азидной группой и реагентом, представляющим собой катализатор на основе меди.
В некоторых вариантах реализации предложен способ секвенирования нуклеиновой кислоты, при этом указанный способ включает гибридизацию праймера с матрицей нуклеиновой кислоты с образованием комплекса гибридизованный праймер/матрица нуклеиновой кислоты; получение множества аналогов нуклеотидов (например, 3'-О-пропаргил-дНТФ-аналогов нуклеотидов, где Н выбран из группы, состоящей из А, С, G, Т и U), при этом каждый аналог нуклеотида содержит алкиновую группу; получение стандартных нуклеотидов; проведение реакции комплекса гибридизованный праймер/матрица нуклеиновой кислоты и аналога нуклеотида с полимеразой с присоединением аналога нуклеотида к праймеру путем полимеразной реакции с получением удлиненного продукта, содержащего встроенный аналог нуклеотида; и проведение реакции указанного удлиненного продукта с азидсодержащим соединением с получением структуры, содержащей триазольное кольцо (например, которую применяют в последующих ферментативных реакциях, таких как полимеразная цепная реакция).
В некоторых вариантах реализации предложен набор для синтеза модифицированной нуклеиновой кислоты, при этом указанный набор содержит аналог нуклеотида, содержащий алкинильную группу; реагент, представляющий собой катализатор на основе меди; полимеразу; адаптерный олигонуклеотид, содержащий азидную группу; и стандартный нуклеотид.
Конкретные варианты реализации относятся к получению лесенки фрагментов нуклеиновой кислоты с использованием полимеразной реакции, включающей стандартные дНТФ и 3'-О-пропаргил-дНТФ в молярном соотношении от 1:500 до 500:1 (стандартные дНТФ и 3'-О-пропаргил-дНТФ). Терминированные фрагменты нуклеиновой кислоты, получаемые способами, описанными в настоящем документе, содержат пропаргильную группу на 3'-концах. Другие варианты реализации относятся к присоединению адаптера к 3'-концам фрагментов нуклеиновой кислоты с использованием химической конъюгации. Например, в некоторых вариантах реализации 5'-азидо-модифицированный олигонуклеотид (например, 5'-азидо-метил-модифицированный олигонуклеотид) конъюгируют с 3'-пропаргил-терминированными фрагментами нуклеиновой кислоты посредством клик-химии (например, в реакции, катализируемой медью (например, реагентом, представляющим собой медь (I)). В некоторых вариантах реализации целевую область сначала амплифицируют (например, путем ПЦР) с получением целевого ампликона для секвенирования. В некоторых вариантах реализации амплификация целевой области включает амплификацию целевой области на протяжении от 5 до 15 циклов (например, амплификацию с «ограниченными циклами» или «малым количеством циклов»).
Другие варианты реализации предусматривают содержание целевым ампликоном метки (например, содержание идентификационной последовательности), например, целевой ампликон представляет собой поддающийся идентификации ампликон. В некоторых вариантах реализации праймер, используемый для амплификации целевой области, содержит метку (например, содержащую идентификационную последовательность), которую затем включают в целевой ампликон (например, в реакции «копирование и мечение») с получением поддающегося идентификации ампликона. В некоторых вариантах реализации адаптер, содержащий метку (например, содержащую идентификационную последовательность), лигируют с целевым ампликоном после амплификации (например, в реакции с лигазой) с получением поддающегося идентификации комплекса адаптер-ампликон. В некоторых вариантах реализации праймер, используемый для получения поддающегося идентификации ампликона в реакции копирования и мечения, содержит 3'-область, содержащую специфичную в отношении цели праймирующую последовательность, и 5'-область, содержащую две различные универсальные последовательности (например, универсальную последовательность А и универсальную последовательность В), фланкирующие вырожденную последовательность. В некоторых вариантах реализации адаптер, лигируемый с ампликоном с получением поддающегося идентификации комплекса адаптер-ампликон, представляет собой двухцепочечный адаптер, например, содержащий одну цепь, содержащую вырожденную последовательность (например, содержащую от 8 до 12 оснований), фланкированную как на 5'-конце, так и на 3'-конце двумя различными универсальными последовательностями (например, универсальной последовательностью А и универсальной последовательностью В), и вторую цепь, содержащую универсальную последовательность С (например, на 5'-конце) и последовательность (например, на 3'-конце), комплементарную универсальной последовательности В и содержащую дополнительный Т в 3'-концевом положении.
Варианты технологии обеспечивают получение лесенки фрагментов нуклеиновой кислоты из комплекса адаптер-ампликон, например, для получения библиотеки для секвенирования для NGS. В частности, технология обеспечивает получение 3'-О-пропаргил-дН-терминированной лесенки нуклеиновой кислоты для секвенирования нуклеиновых кислот (например, NGS), например, путем использования полимеразной реакции, включающей стандартные дНТФ и 3'-О-пропаргил-дНТФ в молярном соотношении от 1:500 до 500:1 (стандартные дНТФ и 3'-О-пропаргил-дНТФ). Затем, в некоторых вариантах реализации технология обеспечивает присоединение адаптера к 3'-концам фрагментов нуклеиновой кислоты с использованием химической конъюгации. Например, в некоторых вариантах реализации 5'-азидо-модифицированный олигонуклеотид (например, 5'-азидо-метил-модифицированный олигонуклеотид) конъюгируют с 3'-пропаргил-терминированными фрагментами нуклеиновой кислоты посредством клик-химии (например, в реакции, катализируемой медью (например, реагентом, представляющим собой медь (I)).
В некоторых вариантах технологии предложена композиция для применения в качестве библиотеки для секвенирования следующего поколения для получения последовательности целевой нуклеиновой кислоты, при этом указанная композиция содержит n нуклеиновых кислот (например, библиотеку фрагментов нуклеиновой кислоты), при этом каждая из указанных n нуклеиновых кислот содержит 3'-О-блокированный аналог нуклеотида (например, 3'-О-алкинильный аналог нуклеотида, такой как 3'-О-пропаргильный аналог нуклеотида). В некоторых вариантах реализации каждая нуклеиновая кислота из n нуклеиновых кислот содержит нуклеотидную подпоследовательность целевой нуклеотидной последовательности. В частности, в вариантах реализации предложена композиция, содержащая n нуклеиновых кислот, при этом каждая из указанных n нуклеиновых кислот терминирована 3'-О-блокированным аналогом нуклеотида (например, 3'-О-алкинильным аналогом нуклеотида, таким как 3'-О-пропаргильный аналог нуклеотида). В других вариантах реализации предложена композиция, содержащая n нуклеиновых кислот (например, библиотеку фрагментов нуклеиновой кислоты), при этом каждая из указанных n нуклеиновых кислот содержит 3'-О-блокированный аналог нуклеотида (например, 3'-О-алкинильный аналог нуклеотида, такой как 3'-О-пропаргильный аналог нуклеотида), и каждая из указанных n нуклеиновых кислот конъюгирована (например, связана) с олигонуклеотидным адаптером триазольной связью (например, связью, образованной в результате химической конъюгации пропаргильной группы и азидогруппы, например, путем реакции клик-химии). Например, в некоторых вариантах реализации предложена композиция, содержащая n нуклеиновых кислот (например, библиотеку фрагментов нуклеиновой кислоты), при этом каждая из указанных n нуклеиновых кислот содержит 3'-О-пропаргильный аналог нуклеотида (например, 3'-О-пропаргил-дА, 3'-О-пропаргил-дС, 3'-О-пропаргил-дG и/или 3'-О-пропаргил-дТ), конъюгированный (например, связанный) с олигонуклеотидным адаптером триазольной связью (например, связью, образованной в результате химической конъюгации пропаргильной группы и азидогруппы, например, путем реакции клик-химии).
В некоторых вариантах реализации композицию для применения в качестве библиотеки для секвенирования следующего поколения для получения последовательности целевой нуклеиновой кислоты получают способом, включающим синтез n нуклеиновых кислот (например, библиотеки фрагментов нуклеиновой кислоты) с использованием смеси дНТФ и одного или более 3'-О-блокированных аналогов нуклеотидов (например, одного или более 3'-О-алкинильных аналогов нуклеотидов, таких как один или более 3'-О-пропаргильных аналогов нуклеотидов), например, в молярном соотношении от 1:500 до 500:1 (например, 1:500, 1:450, 1:400, 1:350, 1:300, 1:250, 1:200, 1:150, 1:100, 1:90, 1:80, 1:70, 1:60, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 20:1, 30:1, 40:1, 50:1, 60:1, 70:1, 80:1, 90:1, 100:1, 150:1, 200:1, 250:1, 300:1, 350:1, 400:1, 450:1 или 500:1). В некоторых вариантах реализации композицию получают с использованием полимеразы, полученной, происходящей, выделенной, клонированной и т.д. из видов Thermococcus (например, организм таксономической линии Archaea; Euryarchaeota; Thermococci; Thermococcales; Thermococcaceae; Thermococcus). В некоторых вариантах реализации полимеразу получают, извлекают, выделяют, клонируют и т.д. из видов Thermococcus 9°N-7. В некоторых вариантах реализации полимераза содержит замены аминокислот, которые обеспечивают улучшенное встраивание модифицированных субстратов, таких как модифицированные дидезоксинуклеотиды, рибонуклеотиды и ациклонуклеотиды. В некоторых вариантах реализации полимераза содержит замены аминокислот, которые обеспечивают улучшенное встраивание аналогов нуклеотидов, содержащих модифицированные 3'-функциональные группы, таких как 3'-О-пропаргил-дНТФ, описанные в настоящем документе. В некоторых вариантах реализации аминокислотная последовательность полимеразы содержит одну или более замен аминокислот относительно аминокислотной последовательности полимеразы дикого типа Thermococcus sp. 9°N-7, например, замену аспарагиновой кислоты на аланин в положении аминокислоты 141 (D141A), замену глутаминовой кислоты на аланин в положении аминокислоты 143 (Е143А), замену тирозина на валин в положении аминокислоты 409 (Y409V) и/или замену аланина на лейцин в положении аминокислоты 485 (A485L). В некоторых вариантах реализации полимеразу получают в гетерологичном организме-хозяине, таком как Escherichia coli, который содержит клонированный ген полимеразы Thermococcus sp. 9°N-7, например, содержащий одну или более мутаций (например, D141A, Е143А, Y409V и/или A485L). В некоторых вариантах реализации полимераза представляет собой полимеразу Thermococcus sp. 9°N-7, продаваемую под торговым названием THERMINATOR (например, THERMINATOR II) компанией New England BioLabs (Ипсуич, Массачусетс).
Соответственно, технология относится к реакционным смесям, содержащим целевую нуклеиновую кислоту, смесь дНТФ и один или более 3'-О-блокированных аналогов нуклеотидов (например, один или более 3'-О-алкинильных аналогов нуклеотидов, таких как один или более 3'-О-пропаргильных аналогов нуклеотидов), например, в молярном соотношении от 1:500 до 500:1 (например, 1:500, 1:450, 1:400, 1:350, 1:300, 1:250, 1:200, 1:150, 1:100, 1:90, 1:80, 1:70, 1:60, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 20:1, 30:1, 40:1, 50:1, 60:1, 70:1, 80:1, 90:1, 100:1, 150:1, 200:1, 250:1, 300:1, 350:1, 400:1, 450:1 или 500:1), и полимеразу для синтеза нуклеиновой кислоты с использованием дНТФ и одного или более 3'-О-блокированных аналогов нуклеотидов (например, полимеразу, полученную, происходящую, выделенную, клонированную и т.д. из видов Thermococcus). В некоторых вариантах реализации целевая нуклеиновая кислота представляет собой ампликон. В некоторых вариантах реализации целевая нуклеиновая кислота содержит идентификатор. В некоторых вариантах реализации целевая нуклеиновая кислота представляет собой ампликон, содержащий идентификатор. В некоторых вариантах реализации целевая нуклеиновая кислота представляет собой ампликон, лигированный с адаптером, содержащим идентификатор. В некоторых вариантах реализации предложены реакционные смеси, содержащие множество целевых нуклеиновых кислот, при этом каждая целевая нуклеиновая кислота содержит идентификатор, ассоциированный с поддающейся идентификации характеристикой указанной целевой нуклеиновой кислоты.
В некоторых вариантах реализации предложена композиция реакционной смеси, содержащая матрицу (например, кольцевую матрицу, например, содержащую универсальную нуклеотидную последовательность и/или идентификационную нуклеотидную последовательность), содержащую подпоследовательность целевой нуклеиновой кислоты, полимеразу, один или более фрагментов из библиотеки лесенки фрагментов и 3'-О-блокированный аналог нуклеотида.
В некоторых вариантах реализации предложена композиция реакционной смеси, содержащая библиотеку нуклеиновых кислот, при этом указанная библиотека нуклеиновых кислот содержит перекрывающиеся короткие нуклеотидные последовательности, покрывающие целевую нуклеиновую кислоту (например, перекрывающиеся короткие нуклеотидные последовательности покрывают область целевой нуклеиновой кислоты, содержащую 100 оснований, 200 оснований, 300 оснований, 400 оснований, 500 оснований, 600 оснований, 700 оснований, 800 оснований, 900 оснований, 1000 оснований или более 1000 оснований, например, 2000 оснований, 2500 оснований, 3000 оснований, 3500 оснований, 4000 оснований, 4500 оснований, 5000 оснований или более 5000 оснований) и смещенные относительно друг друга на 1-20, 1-10 или 1-5 оснований (например, 1 основание), и при этом каждая нуклеиновая кислота библиотеки содержит менее 100 оснований, менее 90 оснований, менее 80 оснований, менее 70 оснований, менее 60 оснований, менее 50 оснований, менее 45 оснований, менее 40 оснований, менее 35 оснований или менее 30 оснований.
Дополнительные варианты реализации приведены ниже и в качестве вариаций описанной технологии, как очевидно специалисту в данной области техники.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Эти и другие признаки, аспекты и преимущества технологии согласно настоящему изобретению станут более понятными с учетом следующих чертежей:
Фиг. 1 представляет собой схему, демонстрирующую полимеразную реакцию достройки с использованием 3'-О-пропаргил-дГТФ. Достройка под действием полимеразы прекращается после встраивания 3'-О-пропаргил-дГТФ с получением продукта 1. 5'-азид-модифицированный фрагмент ДНК химически лигируют с продуктом 1 с использованием клик-химии с получением продукта 2. Ковалентная связь, образуемая путем формирования триазольного кольца, имитирует ковалентную связь природной фосфодиэфирной связи остова ДНК. Затем продукт 2 применяют в ферментативных реакциях (например, ПЦР).
Фиг. 2 представляет собой схему, демонстрирующую полимеразную реакцию достройки с использованием комбинации дНТФ и 3'-О-пропаргил-дНТФ. Лесенки фрагментов ДНК (n+1 фрагменты) получают в случае каждого из 3'-концов фрагментов, содержащих алкиновую группу. Данные лесенки фрагментов ДНК лигируют с 5'-азид-модифицированной молекулой ДНК, содержащей «универсальную» последовательность и/или идентификационную последовательность, и/или сайт связывания праймера, посредством клик-химии. Затем лигированные фрагменты ДНК обрабатывают и используют в качестве исходных в способах секвенирования следующего поколения (NGS). Данные фрагменты ДНК с характеристикой n+1 формируют данные секвенирования ДНК путем сборки коротких прочтений, что тем самым значительно уменьшает время проведения NGS.
На фиг. 3 представлены аналитические данные для 3'-O-пропаргил-2'-дезоксицитидин-5'-трифосфата (3'-О-пропаргил-дЦТФ), синтезированного, как описано в настоящем документе. На фиг. 3А представлены данные 1Н ЯМР для 3'-О-пропаргил-дЦТФ. На фиг. 3В представлена в увеличенном масштабе часть данных 1Н ЯМР для 3'-О-пропаргил-дЦТФ, представленных на фиг. 3А. На фиг. 3С представлена в увеличенном масштабе часть данных 1Н ЯМР для 3'-О-пропаргил-дЦТФ, представленных на фиг. 3А. На фиг. 3В представлены данные 31Р ЯМР для 3'-О-пропаргил-дЦТФ. На фиг. 3Е представлена в увеличенном масштабе часть данных 31Р ЯМР для 3'-О-пропаргил-дЦТФ, представленных на фиг. 3D. На фиг. 3F представлены данные анионообменной ВЭЖХ для 3'-О-пропаргил-дЦТФ. На фиг. 3G представлены данные масс-спектра высокого разрешения для 3'-О-пропаргил-дЦТФ.
На фиг. 4 представлены аналитические данные для 3'-O-пропаргил-2'-дезокситимидин-5'-трифосфата (3'-О-пропаргил-дТТФ), синтезированного, как описано в настоящем документе. На фиг. 4А представлены данные 1Н ЯМР для 3'-О-пропаргил-дТТФ. На фиг. 4В представлена в увеличенном масштабе часть данных 1Н ЯМР для 3'-О-пропаргил-дТТФ, представленных на фиг. 4А. На фиг. 4С представлена в увеличенном масштабе часть данных 1Н ЯМР для 3'-О-пропаргил-дТТФ, представленных на фиг. 4А. На фиг. 4D представлены данные 31Р ЯМР для 3'-О-пропаргил-дТТФ. На фиг. 4Е представлена в увеличенном масштабе часть данных 31Р ЯМР для 3'-О-пропаргил-дТТФ, представленных на фиг. 4D. На фиг. 4F представлены данные анионообменной ВЭЖХ для 3'-О-пропаргил-дТТФ. На фиг. 4G представлены данные масс-спектра высокого разрешения для 3'-О-пропаргил-дТТФ.
На фиг. 5 представлены аналитические данные для 3'-O-пропаргил-2'-дезоксиаденозин-5'-трифосфата (3'-О-пропаргил-дАТФ), синтезированного, как описано в настоящем документе. На фиг. 5А представлены данные 1Н ЯМР для 3'-О-пропаргил-дАТФ. На фиг. 5В представлена в увеличенном масштабе часть данных 1Н ЯМР для 3'-О-пропаргил-дАТФ, представленных на фиг. 5А. На фиг. 5С представлена в увеличенном масштабе часть данных 1Н ЯМР для 3'-О-пропаргил-дАТФ, представленных на фиг. 5А. На фиг. 5D представлены данные 31Р ЯМР для 3'-О-пропаргил-дАТФ. На фиг. 5Е представлена в увеличенном масштабе часть данных 31Р ЯМР для 3'-О-пропаргил-дАТФ, представленных на фиг. 5D. На фиг. 5F представлены данные анионообменной ВЭЖХ для 3'-О-пропаргил-дАТФ. На фиг. 5G представлены данные масс-спектра высокого разрешения для 3'-О-пропаргил-дАТФ.
На фиг. 6 представлены аналитические данные для 3'-O-пропаргил-2'-дезоксигуанозин-5'-трифосфата (3'-О-пропаргил-дГТФ), синтезированного, как описано в настоящем документе. На фиг. 6А представлены данные 1Н ЯМР для 3'-О-пропаргил-дГТФ. На фиг. 6В представлена в увеличенном масштабе часть данных 1Н ЯМР для 3'-О-пропаргил-дГТФ, представленных на фиг. 6А. На фиг. 6С представлена в увеличенном масштабе часть данных 1Н ЯМР для 3'-О-пропаргил-дГТФ, представленных на фиг. 6А. На фиг. 6D представлены данные 31Р ЯМР для 3'-О-пропаргил-дГТФ. На фиг. 6Е представлена в увеличенном масштабе часть данных 31Р ЯМР для 3'-О-пропаргил-дГТФ, представленных на фиг. 6D. На фиг. 6F представлены данные анионообменной ВЭЖХ для 3'-О-пропаргил-дГТФ. На фиг. 6G представлены данные масс-спектра высокого разрешения для 3'-О-пропаргил-дГТФ.
Следует понимать, что данные фигуры не обязательно изображены в масштабе, также как и объекты на фигурах не обязательно изображены в масштабе по отношению друг к другу. Фигуры представляют собой изображения, предназначенные для внесения ясности и понимания различных вариантов устройств, систем и способов, описанных в настоящем документе. Где возможно, одинаковые ссылочные номера используются на всех чертежах для обозначения одинаковых или подобных частей. Кроме того, следует понимать, что указанные чертежи никоим образом не ограничивают объем идей настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложена технология, связанная с манипуляциями и детектированием нуклеиновых кислот, включая, но не ограничиваясь ими, композиции, способы, системы и наборы, связанные с нуклеотидами, содержащими химически активную связывающую группу. В конкретных вариантах реализации указанная технология обеспечивает аналоги нуклеотидов, содержащие основание (например, аденин, гуанин, цитозин, тимин или урацил), сахар (например, рибозу или дезоксирибозу) и алкиновую химическую группу, например, присоединенную к 3'-кислороду сахара (например, 3'-кислороду дезоксирибозы или 3'-кислороду рибозы). Указанные аналоги нуклеотидов (например, 3'-алкинильный аналог нуклеотида, например, 3'-О-пропаргильный аналог нуклеотида, такой как 3'-О-пропаргил-дНТФ или 3'-О-пропаргил-НТФ) находят применение в вариантах технологии для введения конкретного химической группы (например, алкина) на конце (например, 3'-конце) нуклеиновой кислоты (например, ДНК или РНК) путем полимеразной реакции достройки и, следовательно, для получения модификации нуклеиновой кислоты, которая не существует в природных биологических системах. Химическое лигирование между продуктами достройки под действием полимеразы и подходящими партнерами для конъюгации (например, азид-модифицированными соединениями) осуществляют с высокой эффективностью и специфичностью с использованием клик-химии. Варианты функциональных нуклеотидных терминаторов, предложенных согласно настоящему изобретению, применяют для получения нуклеиновых кислот, подходящих для различных видов применения в молекулярной биологии, биохимии и биотехнологии.
Указанная технология обеспечивает ряд преимуществ перед существующими технологиями. Например, технология позволяет получить данные о последовательности, которые лучше (например, более высокое качество, более длинные прочтения, меньшее количество ошибок и т.д.) или сравнимы с существующими технологиями, за более короткое время проведения по сравнению с существующими технологиями. Более того, технология позволяет получить прочтения последовательности, которые могут быть объединены для получения более длинного прочтения высокого качества.
В настоящем описании заголовки разделов приведены только для целей организации и никоим образом не ограничивают описанный объект изобретения. В данном подробном описании различных вариантов реализации для целей пояснения приведены многочисленные конкретные детали для обеспечения полного понимания описанных вариантов реализации. Однако для специалиста в данной области техники очевидно, что эти различные варианты могут быть реализованы с помощью данных конкретных деталей или без них. В других случаях структуры и устройства представлены в виде блок-схемы. Кроме того, для специалиста в данной области техники очевидно, что конкретные последовательности, в которых представлены и выполнены способы, являются иллюстративными, и предусматривается, что указанные последовательности можно варьировать и они по-прежнему будут находиться в пределах сущности и объема различных вариантов реализации, описанных в настоящем документе.
Полное содержание всех литературных и подобных материалов, приведенных в настоящей заявке, включая, но не ограничиваясь ими, патенты, заявки на патент, статьи, книги, монографии и web-страницы Internet, явным образом включено в настоящее описание посредством ссылки для любой цели. Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют те же значения, которые обычно понятны специалисту в области техники, к которой относятся различные варианты реализации, описанные в настоящем документе. В случае, когда определения терминов во включенных источниках, по-видимому, отличаются от определений, приведенных в соответствии с идеями настоящего изобретения, определения, приведенные в соответствии с идеями настоящего изобретения, будут иметь преимущественную силу.
Определения
Для облегчения понимания технологии согласно настоящему изобретению ниже определен ряд терминов и фраз. Дополнительные определения приведены на всем протяжении подробного описания.
На всем протяжении настоящего описания и формулы изобретения следующие термины имеют значения, явным образом ассоциируемые с ними в настоящем описании, если в контексте явным образом не указано иное. В настоящем описании термин «в одном из вариантов реализации» не обязательно относится к этому же варианту реализации, хотя может. Кроме того, в настоящем описании термин «в другом варианте реализации» не обязательно относится к другому варианту реализации, хотя может. Таким образом, как описано ниже, различные варианты реализации настоящего изобретения можно легко комбинировать в пределах объема или сущности настоящего изобретения.
Кроме того, в настоящем описании термин «или» является включающим оператором «или» и эквивалентен термину «и/или», если в контексте явным образом не указано иное. Термин «основанный на (на основе)» не является исключающим и допускает обусловленность дополнительными не описанными факторами, если из контекста явным образом не следует иное. Кроме того, на всем протяжении настоящего описания формы единственного числа включают множества объектов. Значение «в» включает «в» и «на».
В настоящем описании «нуклеотид» содержит «основание» (в качестве альтернативы, «нуклеотидное основание» или «азотистое основание»), «сахар» (в частности, пятиуглеродный сахар, например, рибозу или 2-дезоксирибозу) и «фосфатную группу (фрагмент)» одной или более фосфатных остатков (например, монофосфата, дифосфата, трифосфата, тетрафосфата и т.д., состоящих из одного, двух, трех, четырех или более связанных фосфатов соответственно). Без фосфатной группы нуклеотидное основание и сахар составляют «нуклеозид». Таким образом, нуклеотид может также называться нуклеозидмонофосфатом или нуклеозиддифосфатом, или нуклеозидтрифосфатом в зависимости от количества присоединенных фосфатных групп. Фосфатная группа, как правило, присоединена к 5-углероду сахара, хотя некоторые нуклеотиды содержат фосфатные группы, присоединенные к 2-углероду или 3-углероду сахара. Нуклеотиды содержат либо пуриновое (например, в нуклеотидах - аденин и гуанин), либо пиримидиновое основание (например, в нуклеотидах - цитозин, тимин и урацил). Некоторые нуклеотиды содержат неприродные основания. Рибонуклеотиды представляют собой нуклеотиды, в которых сахар представляет собой рибозу. Дезоксирибонуклеотиды представляют собой нуклеотиды, в которых сахар представляет собой дезоксирибозу.
В настоящем описании термин «нуклеиновая кислота» означает любую молекулу нуклеиновой кислоты, включая, без ограничения, ДНК, РНК и их гибриды. Основания нуклеиновых кислот, которые образуют молекулы нуклеиновых кислот, могут представлять собой основания А, С, G, Т и U, а также их производные. Производные данных оснований хорошо известны в данной области техники. Следует понимать, что данный термин включает в качестве эквивалентов аналоги либо ДНК, либо РНК, полученные на основе аналогов нуклеотидов. В настоящем описании данный термин также включает кДНК, которая представляет собой комплементарную ДНК, полученную на матрице РНК, например, под действием обратной транскриптазы. Хорошо известно, что ДНК (дезоксирибонуклеиновая кислота) представляет собой цепь нуклеотидов, состоящую из 4 типов нуклеотидов - А (аденин), Т (тимин), С (цитозин) и G (гуанин) - и что РНК (рибонуклеиновая кислота) представляет собой цепь нуклеотидов, состоящую из 4 типов нуклеотидов - A, U (урацил), G и С. Также известно, что все данные 5 типов нуклеотидов специфично связываются друг с другом в комбинациях, называемых спариванием оснований по принципу комплементарности. То есть аденин (А) образует пару с тимином (Т) (однако в случае РНК аденин (А) образует пару с урацилом (U)), и цитозин (С) образует пару с гуанином (G), так что каждая из данных пар оснований образует двойную цепь. В настоящем описании термин «данные секвенирования нуклеиновой кислоты», «информация, полученная в результате секвенирования нуклеиновой кислоты», «последовательность нуклеиновой кислоты», «геномная последовательность», «генетическая последовательность», «последовательность фрагмента» или «прочтение, полученное в результате секвенирования нуклеиновой кислоты» означает любую информацию или данные, показывающие порядок нуклеотидных оснований (например, аденин, гуанин, цитозин и тимин/урацил) в молекуле (например, весь геном, весь транскриптом, экзом, олигонуклеотид, полинуклеотид, фрагмент и т.д.) ДНК или РНК. Следует понимать, что идеи настоящего изобретения предусматривают информацию о последовательности, полученную с использованием всех доступных разновидностей методик, платформ или технологий, включая, но не ограничиваясь ими: капиллярный электрофорез, микроматрицы, системы на основе лигирования, системы на основе полимеразы, системы на основе гибридизации, системы прямой или непрямой идентификации нуклеотидов, пиросеквенирование, системы детектирования на основе ионов или рН, электронные системы на основе сигнатур, системы на основе пор (например, нанопор), системы на основе визуализации и т.д.
Ссылка на основание, нуклеотид или на другую молекулу может быть в единственном или множественном числе. То есть термин «основание» может относиться к одной молекуле данного основания или к множеству молекул основания, например, в растворе.
Термин «полинуклеотид», «нуклеиновая кислота» или «олигонуклеотид» относится к линейному полимеру нуклеозидов (включая дезоксирибонуклеозиды, рибонуклеозиды или их аналоги), соединенных межнуклеозидными связями. Как правило, полинуклеотид содержит по меньшей мере три нуклеозида. Как правило, размер олигонуклеотидов находится в диапазоне от нескольких мономерных звеньев, например, от 3 до 4, до нескольких сотен мономерных звеньев. Всякий раз, когда полинуклеотид, такой как олигонуклеотид, представлен последовательностью букв, такой как «ATGCCTG», понятно, что нуклеотиды расположены в порядке 5'-3' слева направо, и что «А» означает дезоксиаденозин, «С» означает дезоксицитидин, «G» означает дезоксигуанозин, и «Т» означает тимидин, если не указано иное. Буквы А, С, G и Т могут быть использованы для обозначения самих оснований, нуклеозидов или нуклеотидов, содержащих указанные основания, что является обычным в данной области техники.
В настоящем описании термин «дНТФ» означает дезоксинуклеотидтрифосфат, в котором нуклеотид содержит нуклеотидное основание, такое как А, Т, С, G или U.
В настоящем описании термин «мономер» означает любое соединение, которое может быть включено в растущую молекулярную цепь под действием конкретной полимеразы. Такие мономеры включают, без ограничения, встречающиеся в природе нуклеотиды (например, АТФ, ГТФ, ТТФ, УТФ, ЦТФ, дАТФ, дГТФ, дТТФ, дУТФ, дЦТФ, синтетические аналоги), предшественники каждого нуклеотида, не встречающиеся в природе нуклеотиды и их предшественники или любую другую молекулу, которая может быть включена в растущую полимерную цепь под действием конкретной полимеразы.
В настоящем описании термин «комплементарный», в целом, относится к специфическому образованию дуплекса нуклеотидами с образованием канонических пар оснований Уотсона-Крика, как понятно специалисту в данной области техники. Однако термин «комплементарный» также включает спаривание оснований аналогов нуклеотидов, которые способны к универсальному спариванию оснований с А-, Т-, G- или С-нуклеотидами и «запертыми» нуклеиновыми кислотами, которые повышают термическую стабильность дуплексов. Для специалиста в данной области техники очевидно, что жесткость гибридизации является фактором, определяющим степень соответствия или несоответствия в дуплексе, образуемом путем гибридизации.
В настоящем описании термин «группа (фрагмент)» относится к одной из двух или более частей, на которые что-либо может быть разделено, таких как, например, различные части нити, молекулы или зонда.
В настоящем описании «линкер» представляет собой молекулу или группу, который соединяет две молекулы или две группы, и/или обеспечивает расстояние между указанными двумя молекулами или группами, благодаря чему они способны функционировать предполагаемым образом. Например, линкер может содержать углеводородную цепь диамина, ковалентно связанную через реакционноспособную группу на одном конце с молекулой аналога олигонуклеотида и через реакционноспособную группу на другом конце с твердым носителем, таким как, например, поверхность гранулы. Сочетание линкеров с нуклеотидами и представляющими интерес субстратными конструкциями можно осуществлять путем применения реагентов для реакции сочетания, которые известны в данной области техники (см., например, Efimov et al., Nucleic Acids Res. 27: 4416-4426, 1999). Способы дериватизации и сочетания органических молекул хорошо известны в области органической и биоорганической химии. Линкер может также быть расщепляемым (например, фоторасщепляемым) или обратимым.
«Полимераза» представляет собой фермент, как правило, для соединения 3'-ОН, 5'-трифосфат-нуклеотидов, олигомеров и их аналогов. Полимеразы включают, но не ограничиваются ими, ДНК-зависимые ДНК-полимеразы, ДНК-зависимые РНК-полимеразы, РНК-зависимые ДНК-полимеразы, РНК-зависимые РНК-полимеразы, ДНК-полимеразу Т7, ДНК-полимеразу Т3, ДНК-полимеразу Т4, РНК-полимеразу Т7, РНК-полимеразу Т3, РНК-полимеразу SP6, ДНК-полимеразу 1, фрагмент Кленова, ДНК-полимеразу Thermophilus aquaticus, ДНК-полимеразу Tth, ДНК-полимеразу Vent (New England Biolabs), ДНК-полимеразу Deep Vent (New England Biolabs), большой фрагмент ДНК-полимеразы Bst, Штоффель-фрагмент, ДНК-полимеразу 9°N, ДНК-полимеразу Pfu, ДНК-полимеразу Tfl, полимеразу Phi29 RepliPHI, ДНК-полимеразу Tli, эукариотическую ДНК-полимеразу бета, теломеразу, полимеразу Therminator (New England Biolabs) (например, Therminator I, Therminator II и другие варианты), ДНК-полимеразу KOD HiFi. (Novagen), ДНК-полимеразу KOD1, репликазу Q-бета, терминальную трансферазу, обратную транскриптазу AMV, обратную транскриптазу M-MLV, обратную транскриптазу Phi6, обратную транскриптазу ВИЧ-1, новые полимеразы, обнаруживаемые путем биоразработки, и полимеразы, приведенные в публикации заявки на патент США №2007/0048748 и в патентах США №№6329178; 6602695; и 6395524. Данные полимеразы включают дикий тип, мутантные изоформы и полученные методами генетической инженерии варианты, такие как ехо- полимеразы и другие мутанты, например, которые допускают модифицированные (например, меченые) нуклеотиды и включают их в цепь нуклеиновой кислоты.
Термин «праймер» относится к олигонуклеотиду, либо встречающемуся в природе как в случае очищенного рестрикта, либо полученному путем синтеза, который способен выступать в качестве точки инициации синтеза при помещении в условия, в которых индуцируется синтез продукта достройки праймера, комплементарного цепи нуклеиновой кислоты (например, в присутствии нуклеотидов и индуцирующего агента, такого как полимераза, и при подходящей температуре и рН). Предпочтительно, праймер является одноцепочечным для максимальной эффективности амплификации, но, в качестве альтернативы, может быть двухцепочечным. В случае если он является двухцепочечным, праймер сначала обрабатывают для разделения цепей перед применением для получения продуктов достройки. Предпочтительно, праймер представляет собой олигодезоксирибонуклеотид. Праймер должен быть достаточно длинным для праймирования синтеза продуктов достройки в присутствии индуцирующего агента. Точные длины праймеров зависят от многих факторов, включая температуру, источник праймера и применение способа.
В настоящем описании «адаптер» представляет собой олигонуклеотид, который связан или предназначен для связывания с нуклеиновой кислотой для введения указанной нуклеиновой кислоты в процесс секвенирования. Адаптер может быть одноцепочечным или двухцепочечным (например, двухцепочечная ДНК или одноцепочечная ДНК). В настоящем описании термин «адаптер» относится к адаптерной нуклеиновой кислоте в состоянии, когда она не связана с другой нуклеиновой кислотой, и в состоянии, когда она связана с нуклеиновой кислотой.
По меньшей мере часть адаптера содержит известную последовательность. Например, некоторые варианты адаптеров содержат праймер-связывающую последовательность для амплификации нуклеиновой кислоты и/или для связывания секвенирующего праймера. Некоторые адаптеры содержат последовательность для гибридизации комплементарного зонда захвата. Некоторые адаптеры содержат химическую или другую группу (например, биотиновую группу) для захвата и/или иммобилизации на твердом носителе (например, содержащем авидиновую группу). Некоторые варианты адаптеров содержат маркер, индекс, идентификатор, метку или другую последовательность, благодаря которой адаптер и нуклеиновая кислота, с которой он связан, поддаются идентификации.
Некоторые адаптеры содержат универсальную последовательность. Универсальная последовательность представляет собой последовательность, которая является общей для нескольких адаптеров, которые в остальном могут содержать разные последовательности за пределами указанной универсальной последовательности. Например, универсальная последовательность обеспечивает общий сайт связывания праймера для набора нуклеиновых кислот из разных целевых нуклеиновых кислот, например, которые могут содержать разные идентификаторы.
Некоторые варианты адаптеров содержат определенную, но неизвестную последовательность. Например, некоторые варианты адаптеров содержат вырожденную последовательность из определенного числа оснований (например, вырожденную последовательность из 1-20 оснований). Такая последовательность является определенной, даже если каждая отдельная последовательность не известна - такая последовательность может, тем не менее, служить в качестве индекса, идентификатора, метки и т.д. для маркировки фрагментов нуклеиновой кислоты, например, из одной и той же целевой нуклеиновой кислоты.
Некоторые адаптеры содержат тупой конец, и некоторые адаптеры содержат конец с выступающим одним или более основаниями.
В конкретных вариантах реализации, представленных в настоящем описании, адаптер содержит азидо-группу, например, адаптер содержит азидо (например, азидо-метил)-группу на 5'-конце. Таким образом, некоторые варианты реализации относятся к адаптерам, которые представляют собой или которые содержат 5'-азидо-модифицированный олигонуклеотид или 5'-азидо-метил-модифицированный олигонуклеотид.
В некоторых вариантах реализации используют уникальный индекс (в некоторых вариантах реализации «маркер») для ассоциации фрагмента с матричной нуклеиновой кислотой, из которой он был получен. В некоторых вариантах реализации уникальный индекс представляет собой уникальную последовательностью синтетических нуклеотидов или уникальную последовательностью природных нуклеотидов, которая позволяет легко идентифицировать целевую нуклеиновую кислоту в составном наборе олигонуклеотидов (например, фрагментов), содержащих различные последовательности. В некоторых вариантах реализации уникальные индексные идентификаторы присоединяют к фрагментам нуклеиновой кислоты до присоединения адаптерных последовательностей. В некоторых вариантах реализации уникальные индексные идентификаторы содержатся в пределах адаптерных последовательностей, так что уникальная последовательность содержится в прочтениях, получаемых в результате секвенирования. Это обеспечивает возможность детектирования гомологичных фрагментов на основе уникальных индексов, присоединенных к каждому фрагменту, что таким образом также обеспечивает точное воссоздание консенсусной последовательности. Гомологичные фрагменты могут возникать, например, случайным образом из-за геномных повторов, двух фрагментов, происходящих из гомологичных хромосом, или фрагментов, возникающих в результате перекрывания положений на одной и той же хромосоме. Гомологичные фрагменты могут также возникать из близкородственных последовательностей (например, члены семейств близкородственных генов, паралоги, ортологи, онологи (ohnologs), ксенологи и/или псевдогены). Такие фрагменты могут быть отброшены для обеспечения точного вычисления сборки длинного фрагмента. Маркеры могут быть присоединены, как описано выше для адаптерных последовательностей. Индексы (например, маркеры) могут быть включены в адаптерные последовательности.
В некоторых вариантах реализации уникальный индекс (например, индексный идентификатор, метка, маркер и т.д.) представляет собой «идентификатор». В настоящем описании термин «идентификатор» относится к известной последовательности нуклеиновой кислоты, которая позволяет идентифицировать определенный признак нуклеиновой кислоты, с которой связан указанный идентификатор. В некоторых вариантах реализации указанный идентифицируемый признак нуклеиновой кислоты представляет собой образец или источник, из которого получена нуклеиновая кислота. В некоторых вариантах реализации длина идентификаторов составляет по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более нуклеотидов. В некоторых вариантах реализации длина идентификаторов меньше 10, 9, 8, 7, 6, 5 или 4 нуклеотидов. В некоторых вариантах реализации идентификаторы, связанные с одними нуклеиновыми кислотами, имеют другую длину по сравнению с идентификаторами, связанными с другими нуклеиновыми кислотами. В целом, идентификаторы имеют достаточную длину и содержат последовательности, отличающиеся в достаточной степени для обеспечения идентификации образцов на основе идентификаторов, с которыми они связаны. В некоторых вариантах реализации идентификатор и источник образца, с которым он связан, можно с точностью идентифицировать после мутации, встраивания или делеции одного или более нуклеотидов в идентификационной последовательности, такой как мутация, встраивание или делеция 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более нуклеотидов. В некоторых вариантах реализации каждый идентификатор среди множества идентификаторов отличается от всех остальных идентификаторов среди указанного множества в двух или более положениях нуклеотидов, например, в 2, 3, 4, 5, 6, 7, 8, 9, 10 или более положениях. В некоторых вариантах реализации один или более адаптеров содержат по меньшей мере одну из множества идентификационных последовательностей. В некоторых вариантах реализации способы согласно технологии дополнительно включают идентификацию образца или источника, из которого получена целевая нуклеиновая кислота, на основе идентификационной последовательности, с которой соединена указанная целевая нуклеиновая кислота. В некоторых вариантах реализации способы согласно технологии дополнительно включают идентификацию целевой нуклеиновой кислоты на основе идентификационной последовательности, с которой соединена указанная целевая нуклеиновая кислота. Некоторые варианты способа дополнительно включают идентификацию источника или образца целевой нуклеотидной последовательности путем определения идентификационной нуклеотидной последовательности. Некоторые варианты способа дополнительно включают применение для подсчета молекул (например, цифровой подсчет и/или сортировка по идентификатору) для определения уровней экспрессии или состояния числа копий желаемых целей. В целом, идентификатор может содержать последовательность нуклеиновой кислоты, которая при соединении с целевой нуклеиновой кислотой служит для идентификации образца, из которого был получен целевой полинуклеотид.
В некоторых вариантах реализации олигонуклеотид, такой как праймер, адаптер и т.д., содержит «универсальную» последовательность. Универсальная последовательность представляет собой известную последовательность, например, для применения в качестве сайта связывания праймера или зонда с использованием праймера или зонда с известной последовательностью (например, комплементарной универсальной последовательности). В то время как специфичная в отношении матрицы последовательность праймера, идентификационная последовательность праймера и/или идентификационная последовательность адаптера могут отличаться в вариантах технологии, например, от фрагмента к фрагменту, от образца к образцу, от источника к источнику или от представляющей интерес области к представляющей интерес области, варианты технологии предусматривают, что универсальная последовательность является одинаковой от фрагмента к фрагменту, от образца к образцу, от источника к источнику или от представляющей интерес области к представляющей интерес области, в результате чего со всеми фрагментами, содержащими универсальную последовательность, можно работать и/или подвергать их обработке одинаковым или схожим образом, например, амплифицировать, идентифицировать, подвергать секвенированию, выделять и т.д. с использованием схожих способов или методик (например, с использованием одинакового праймера или зонда).
В конкретных вариантах реализации используют праймер, содержащий универсальную последовательность (например, универсальную последовательность А), идентификационную последовательность и специфичную в отношении матрицы последовательность. В конкретных вариантах реализации используют первый адаптер, содержащий универсальную последовательность (например, универсальную последовательность В), и в конкретных вариантах реализации используют второй адаптер, содержащий универсальную последовательность (например, универсальную последовательность С). Универсальная последовательность А, универсальная последовательность В и универсальная последовательность С могут представлять собой любую последовательность. Данную систему обозначений используют для указания на то, что универсальная последовательность А первой нуклеиновой кислоты (например, фрагмента), содержащей универсальную последовательность А, является такой же, что и универсальная последовательность А второй нуклеиновой кислоты (например, фрагмента), содержащей универсальную последовательность А, универсальная последовательность В первой нуклеиновой кислоты (например, фрагмента), содержащей универсальную последовательность В, является такой же, что и универсальная последовательность В второй нуклеиновой кислоты (например, фрагмента), содержащей универсальную последовательность В, и универсальная последовательность С первой нуклеиновой кислоты (например, фрагмента), содержащей универсальную последовательность С, является такой же, что и универсальная последовательность С второй нуклеиновой кислоты (например, фрагмента), содержащей универсальную последовательность С. Хотя универсальные последовательности А, В и С, как правило, отличаются в вариантах технологии, они могут и не отличаться. Таким образом, в некоторых вариантах реализации универсальные последовательности А и В являются одинаковыми; в некоторых вариантах реализации универсальные последовательности В и С являются одинаковыми; в некоторых вариантах реализации универсальные последовательности А и С являются одинаковыми; и в некоторых вариантах реализации универсальные последовательности А, В и С являются одинаковыми. В некоторых вариантах реализации универсальные последовательности А, В и С отличаются.
Например, если две представляющие интерес области подлежат секвенированию (например, из одинаковых или разных источников, или, например, из двух разных областей одной и той же нуклеиновой кислоты, хромосомы, гена и т.д.), могут быть использованы два праймера: один праймер, содержащий первую специфичную в отношении матрицы последовательность для праймирования от первой представляющей интерес области и первый идентификатор для связывания первого амплифицированного продукта с первой представляющей интерес областью, и второй праймер, содержащий вторую специфичную в отношении матрицы последовательность для праймирования от второй представляющей интерес области и второй идентификатор для связывания второго амплифицированного продукта со второй представляющей интерес областью. Однако в некоторых вариантах реализации эти два праймера будут содержать одинаковую универсальную последовательность (например, универсальную последовательность А) для объединения в пул и дальнейшей совместной обработки. Могут быть использованы две или более универсальных последовательностей и, как правило, количество универсальных последовательностей будет меньше количества специфичных в отношении цели последовательностей и/или идентификационных последовательностей для объединения образцов в пул и обработки пулов в виде одного образца (партии).
Соответственно, в некоторых вариантах реализации определение первой нуклеотидной подпоследовательности и второй нуклеотидной подпоследовательности включает праймирование от универсальной последовательности. В некоторых вариантах реализации определение первой нуклеотидной подпоследовательности и второй нуклеотидной подпоследовательности включает завершение полимеризации с помощью 3'-О-блокированного аналога нуклеотида. Например, в некоторых вариантах реализации определение первой нуклеотидной подпоследовательности и второй нуклеотидной подпоследовательности включает завершение полимеризации с помощью 3'-О-алкинильного аналога нуклеотида, например, в некоторых вариантах реализации определение первой нуклеотидной подпоследовательности и второй нуклеотидной подпоследовательности включает завершение полимеризации с помощью 3'-О-пропаргильного аналога нуклеотида. В некоторых вариантах реализации определение первой нуклеотидной подпоследовательности и второй нуклеотидной подпоследовательности включает завершение полимеризации с помощью аналога нуклеотида, содержащего обратимый терминатор.
Полученные короткие прочтения последовательностей делят на группы в соответствии с их идентификатором (т.е. проводят демультиплексирование) и прочтения, полученные из одинаковых образцов, источников, представляющих интерес областей и т.д., группируют вместе, например, сохраняют в отдельных файлах или хранят в организованной структуре данных, которая позволяет идентифицировать сгруппированные прочтения. Затем сгруппированные короткие последовательности собирают в консенсусную последовательность. Сборку последовательности, в целом, можно подразделить на две широкие категории: сборку de novo и сборку с картированием на эталонный геном. При сборке de novo прочтения последовательностей собирают вместе, в результате чего они образуют новую и ранее неизвестную последовательность. При картировании на эталонный геном прочтения последовательностей собирают относительно существующей опорной последовательности (например, эталонной последовательности и т.д.) с выстраиванием последовательности, схожей, но не обязательно идентичной указанной опорной последовательности.
Таким образом, в некоторых вариантах реализации целевые нуклеиновые кислоты, соответствующие каждой представляющей интерес области, воссоздают с использованием сборки de-novo. Для начала процесса воссоздания короткие прочтения сшивают биоинформационно путем обнаружения перекрываний и удлинения их с получением консенсусной последовательности. В некоторых вариантах реализации указанный способ дополнительно включает картирование консенсусной последовательности на эталонную последовательность. Преимуществом способов согласно указанной технологии являются показатели качества секвенирования, которые показывают достоверность распознавания оснований для воссоздания полноразмерных фрагментов. В дополнение к сборке de-novo фрагменты могут быть использованы для достижения фазирования (приписывание гомологичным копиям хромосом) геномных вариантов путем определения, что консенсусные последовательности происходят из любой одной из хромосом.
В настоящем описании термин «система» означает набор компонентов, реальных или абстрактных, составляющих целое, при этом каждый компонент взаимодействует или связан по меньшей мере с одним из остальных компонентов в пределах данного целого.
Различные платформы для секвенирования нуклеиновых кислот, системы сборки нуклеиновых кислот и/или картирования (например, компьютерное программное обеспечение и/или аппаратное обеспечение) описаны, например, в публикации заявки на патент США №2011/0270533, содержание которой включено в настоящее описание посредством ссылки.
В настоящем описании термин «алкил» и приставка «алк-» включают как линейные, так и разветвленные насыщенные или ненасыщенные группы, и циклические группы, например, циклоалкильные и циклоалкенильные группы. Если не указано иное, ациклические алкильные группы составляют от 1 до 6 атомов углерода. Циклические группы могут быть моноциклическими или полициклическими, и предпочтительно содержат от 3 до 8 атомов углерода кольца. Типичные циклические группы включают циклопропильные, циклопентильные, циклогексильные и адамантильные группы. Алкильные группы могут содержать один или более заместителей, или не содержать заместителей. Типичные заместители включают алкокси-, арилокси-, сульфгидрильные, алкилтио-, арилтио-, галогеногруппы, алкилсилильные, гидроксильные, фторалкильные, перфторалкильные, амино-, аминоалкильные, дизамещенные амино-, четвертичные аминогруппы, гидроксиалкильные, карбоксиалкильные и карбоксильные группы. В случае употребления приставки «алк» число атомов углерода, содержащихся в алкильной цепи, представлено диапазоном, который непосредственно предшествует данному термину, при этом число атомов углерода, содержащихся в остальной части группы, которая включает данный префикс, определено в иных местах настоящего документа. Например, термин «C1-С4 алкарил» иллюстрирует арильную группу, состоящую из 6-18 атомов углерода (например, см. ниже), присоединенную к алкильной группе, состоящей из 1-4 атомов углерода.
В настоящем описании термин «алкокси» относится к химическому заместителю формулы -OR, где R представляет собой алкильную группу. Термин «арилокси» означает химический заместитель формулы -OR', где R' представляет собой арильную группу.
В настоящем описании термин «алкин» относится к углеводороду, содержащему тройную связь углерод-углерод. Одним из примеров алкинсодержащей функциональной группы является пропаргильная группа. Пропаргил представляет собой алкильную функциональную группу 2-пропинил со структурой НС≡С-CH2-, полученную из алкина пропина.
В настоящем описании термин «азид» или «азидо» относится к любому соединению, содержащему группу N3-. Азид может представлять собой органический азид или азид металла. Одна из реакций с участием азидов является типом реакций клик-химии, известных как реакция 1,3-диполярного циклоприсоединения, катализируемая медью (I). Данная реакция позволяет конъюгировать алкины и азиды с образованием пятичленного триазольного кольца, который обеспечивает ковалентную связь.
В настоящем описании термин «остов» относится к структурному компоненту молекулы нуклеиновой кислоты, который представляет собой ряд ковалентно связанных атомов, которые вместе создают непрерывную цепь в указанной молекуле. В «природных» нуклеиновых кислотах остов содержит фосфодиэфирные связи, связывающие переменные сахара (например, рибозу или дезоксирибозу) и фосфатные группы (относящиеся к фосфорной кислоте).
В настоящем описании «целевой сайт» представляет собой участок у субъекта, в который необходима доставка биологически активного агента и проявление им активности. Целевой сайт может представлять собой клетку, тип клетки, ткань, орган, область или другое указание анатомии и/или физиологии субъекта.
Термины «белок» и «полипептид» относятся к соединениям, содержащим аминокислоты, соединенные через пептидные связи, и являются взаимозаменяемыми. В настоящем описании используются следующие традиционные одно- и трехбуквенные обозначения аминокислот - аланин: Ala, А; аргинин: Arg, R; аспарагин: Asn, N; аспартат: Asp, D; цистеин: Cys, С; глутамат: Glu, Е; глутамин: Gln, Q; глицин: Gly, G; гистидин: His, Н; изолейцин: Ile, I; лейцин: Leu, L; лизин: Lys, K; метионин: Met, М; фенилаланин: Phe, F; пролин: Pro, Р; серии: Ser, S; треонин: Thr, Т; триптофан: Trp, W; тирозин: Tyr, Y; валин: Val, В. В настоящем описании обозначения Хаа и X относятся к любой аминокислоте.
В некоторых вариантах реализации соединения согласно технологии содержат представляющий собой антитело компонент или группу, например, антитело или его фрагменты, или производные. В настоящем описании «антитело», также известное как «иммуноглобулин» (например, IgG, IgM, IgA, IgD, IgE), содержит две тяжелые цепи, связанные друг с другом дисульфидными связями, и две легкие цепи, каждая из которых связана с тяжелой цепью дисульфидной связью. Специфичность антитела заключается в структурной комплементарности между антигенсвязывающим центром антитела (или паратопом) и антигенной детерминантой (или эпитопом). Антигенсвязывающие сайты состоят из остатков в основном из гипервариабельных или определяющих комплементарность областей (CDR). Иногда остатки из негипервариабельных или каркасных областей влияют на общую структуру домена и, следовательно, сайт связывания. В некоторых вариантах реализации нацеливающая группа представляет собой фрагмент антитела, например, любую белок- или полипептидсодержащую молекулу, которая содержит по меньшей мере часть молекулы иммуноглобулина, такую, чтобы обеспечить специфическое взаимодействие между указанной молекулой и антигеном. Указанная часть молекулы иммуноглобулина может содержать, но не ограничивается ими, по меньшей мере одну определяющую комплементарность область (CDR) тяжелой или легкой цепи, или ее лигандсвязывающую часть, вариабельную область тяжелой цепи или легкой цепи, константную область тяжелой цепи или легкой цепи, каркасную область или их любую часть. Такие фрагменты могут быть получены путем ферментативного расщепления, с помощью синтетических или рекомбинантных методик, известных в данной области техники и/или описанных в настоящем документе. Антитела также могут быть получены в различных укороченных формах с использованием генов антител, в которых один или более стоп-кодонов были введены выше (upstream) природного стоп-сайта. Различные части антител могут быть химически соединены друг с другом с помощью традиционных методов или могут быть получены в виде непрерывного белка с использованием методов генной инженерии.
Фрагменты антител включают, но не ограничиваются ими, фрагменты Fab (например, в результате расщепления папаином), F(ab')2 (например, в результате расщепления пепсином), Fab' (например, в результате расщепления пепсином и частичного восстановления) и Fv или scFv (например, с помощью методик молекулярной биологии).
Фрагмент Fab может быть получен путем обработки антитела протеазой папаином. Fab также может быть получен путем встраивания ДНК, кодирующей Fab антитела, в вектор для прокариотической системы экспрессии или для эукариотической системы экспрессии, и введения указанного вектора в прокариот или эукариот для экспрессии Fab. F(ab')2 может быть получен путем обработки антитела протеазой пепсином. F(ab')2 также может быть получен путем связывания Fab' через тиоэфирную связь или дисульфидную связь. Fab может быть получен путем обработки F(ab')2 восстановителем, например, дитиотреитолом. Fab' также может быть получен путем встраивания ДНК, кодирующей Fab'-фрагмент антитела, в вектор экспрессии для прокариота или вектор экспрессии для эукариота, и введения указанного вектора в прокариот или эукариот для экспрессии. Fv-фрагмент может быть получен путем ограниченного расщепления пепсином, например, при 4°С и рН 4,0 (способ, называемый «расщеплением холодным пепсином»). Fv-фрагмент состоит из вариабельного домена тяжелой цепи (VH) и вариабельного домена легкой цепи (VL), удерживаемых вместе сильным нековалентным взаимодействием. scFv-фрагмент может быть получен путем получения кДНК, кодирующей домены VH и VL, как описано ранее, конструирования ДНК, кодирующей scFv, встраивания указанной ДНК в вектор экспрессии для прокариота или в вектор экспрессии для эукариота, а затем путем введения указанного вектора экспрессии в прокариот или эукариот для экспрессии ScFv.
В целом, можно индуцировать антитела, как правило, к любому антигену с использованием множества традиционных методик, хорошо известных в настоящее время в данной области техники. Любое нацеливающее антитело к антигену, обнаруживаемее в достаточной концентрации на участке в организме млекопитающего, которое представляет интерес для диагностики или лечения, можно применять для получения соединений, предложенных согласно настоящему изобретению.
В настоящем описании термин «конъюгированный» относится к случаю, когда одна молекула или агент физически или химически связан или соединен с другой молекулой или агентом. Примеры конъюгации включают ковалентную связь и электростатическое комплексообразование. В настоящем описании термины «объединенный в комплекс», «объединенный в комплекс с» и «конъюгированный» являются взаимозаменяемыми.
В настоящем описании термин «лечение» определяется как применение или введение терапевтического агента, описанного в настоящем документе, или идентифицированного способом, описанным в настоящем документе, пациенту, или применение или введение указанного терапевтического агента в выделенную ткань или линию клеток пациента, демонстрирующего заболевание, симптом заболевания или предрасположенность к заболеванию, с целью излечивания, вылечивания, облегчения, ослабления, изменения, исцеления, уменьшения интенсивности, смягчения или влияния на указанное заболевание, симптомы заболевания или предрасположенность к заболеванию.
В результате выбора заместителей и паттернов заместителей некоторые соединения согласно настоящей технологии могут содержать центры асимметрии и могут встречаться в виде смесей стереоизомеров или в виде отдельных диастереомеров, или энантиомеров. Все изомерные формы данных соединений, будь то выделенные или в смесях, входят в объем технологии согласно настоящему изобретению. Фармацевтически приемлемые соли включают как соли металлов (неорганические), так и органические соли, перечень которых приведен в Remington's Pharmaceutical Sciences, 17th Edition, pg. 1418 (1985). Специалисту в данной области техники хорошо известно, что подходящую форму соли выбирают на основе физических и химических свойств. Как понятно специалисту в данной области техники, фармацевтически приемлемые соли включают, но не ограничиваются ими, соли неорганических кислот, такие как гидрохлорид, сульфат, фосфат, дифосфат, гидробромид и нитрат; или соли органической кислоты, такие как манат, малеат, фумарат, тартрат, сукцинат, цитрат, ацетат, лактат, метансульфонат, п-толуолсульфонат или пальмоат, салицилат и стеарат. Подобным образом, фармацевтически приемлемые катионы включают, но не ограничиваются ими, натрий, калий, кальций, алюминий, литий и аммоний (особенно соли аммония с вторичными аминами). В объем данной технологии также включены кристаллические формы, гидраты и сольваты.
Композиции в соответствии с технологией могут быть введены в форме фармацевтически приемлемых солей. Термин «фармацевтически приемлемая соль» относится к соли, которая обладает эффективностью исходного соединения и не является биологически или иным образом нежелательной (например, не является ни токсичной, ни иным образом вредной для ее реципиента). Подходящие соли включают соли присоединения кислоты, которые могут быть образованы, например, путем смешивания раствора соединения согласно настоящей технологии с раствором фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, серная кислота, уксусная кислота, трифторуксусная кислота или бензойная кислота. Некоторые соединения, применяемые в технологии согласно настоящему изобретению, могут содержать кислотную группу (например, СООН или фенольную группу), и в этом случае их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов (например, соли натрия или калия), соли щелочноземельных металлов (например, соли кальция или магния) и соли, образованные подходящими органическими лигандами, такие как соли четвертичного аммония. Кроме того, в случае присутствия кислотной (СООН) или спиртовой группы могут быть использованы фармацевтически приемлемые сложные эфиры для модификации характеристик растворимости или гидролиза соединения.
Термин «введение» и его варианты (например, «осуществление введения» соединения) по отношению к соединению означает предоставление соединения или пролекарства соединения индивидууму, нуждающемуся в лечении или профилактике. Когда соединение согласно технологии или его пролекарство предоставляют в комбинации с одним или более другими активными агентами, понятно, что термин «введение» и его варианты включают предоставление указанного соединения или пролекарства и других агентов в одно и то же время или в разное время. Когда агенты комбинации вводят в одно и то же время, они могут быть введены совместно в одной композиции или они могут быть введены по отдельности. В настоящем описании термин «композиция» включает продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, получаемый напрямую или опосредованно в результате комбинирования определенных ингредиентов в определенных количествах.
Термин «фармацевтически приемлемый» означает, что ингредиенты фармацевтической композиции должны быть совместимы друг с другом и не должны наносить вред их реципиенту.
В настоящем описании термин «субъект» относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, который является объектом лечения, наблюдения или эксперимента.
В настоящем описании термин «эффективное количество» означает такое количество активного соединения или фармацевтического агента, которое вызывает биологический или медицинский ответ в клетке, ткани, органе, системе, у животного или человека, которого добивается исследователь, ветеринар, врач или другой клиницист. В некоторых вариантах реализации эффективное количество представляет собой «терапевтически эффективное количество» для облегчения симптомов вылечиваемого заболевания или состояния. В некоторых вариантах реализации эффективное количество представляет собой «профилактически эффективное количество» для профилактики симптомов предотвращаемого заболевания или состояния. В настоящем описании указанный термин также включает количество активного соединения, достаточное для ингибирования минералокортикоидного рецептора и, таким образом, вызова желаемого ответа (например, «эффективное для ингибирования количество»). В случае, когда активное соединение вводят в виде соли, ссылки на количество активного ингредиента приведены для свободной формы (несолевой формы) соединения. В некоторых вариантах реализации данное количество составляет от 1 мг до 1000 мг в сутки, например, от 1 мг до 500 мг в сутки (от 1 мг до 200 мг в сутки).
В способе согласно настоящей технологии соединения, возможно в форме соли, могут быть введены любым способом, который обеспечивает контакт активного агента с местом действия указанного агента. Они могут быть введены любыми традиционными способами, доступными для применения в сочетании с фармацевтическими препаратами либо в виде отдельных терапевтических агентов, либо в комбинации терапевтических агентов. Они могут быть введены отдельно, но, как правило, их вводят совместно с фармацевтическим носителем, выбранным исходя из выбранного пути введения и стандартной фармацевтической практики. Соединения согласно технологии могут быть введены, например, перорально, парентерально (включая техники подкожных инъекций, внутривенных, внутримышечных, интрастернальных инъекций или инфузий), посредством спрея для ингаляций или ректально, в форме однократной дозы фармацевтической композиции, содержащий эффективное количество соединения и традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и среды. Жидкие препараты, подходящие для перорального введения (например, суспензии, сиропы, эликсиры и т.п.), могут быть получены в соответствии с методиками, известными в данной области техники, и в них может быть использована любая из стандартных сред, таких как вода, гликоли, масла, спирты и т.п. Твердые препараты, подходящие для перорального введения (например, порошки, пилюли, капсулы и таблетки), могут быть получены в соответствии с методиками, известными в данной области техники, и в них могут быть использованы такие твердые вспомогательные вещества, как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, разрыхлители и т.п. Композиции для парентерального введения могут быть получены в соответствии с методиками, известными в данной области техники, и в них, как правило, используют стерильную воду в качестве носителя и, возможно, другие ингредиенты, такие как вспомогательное вещество, улучшающее растворимость. Растворы для инъекций могут быть получены в соответствии со способами, известными в данной области техники, при этом носитель содержит физиологический раствор, раствор глюкозы или раствор, содержащий смесь физиологического раствора и глюкозы. Подробное описание способов, подходящих для применения для получения фармацевтических композиций для применения в технологии согласно настоящему изобретению, и ингредиентов, подходящих для применения в указанных композициях, приведено в Remington's Pharmaceutical Sciences, 18th edition, edited by A.R. Gennaro, Mack Publishing Co., 1990. Соединения согласно настоящей технологии могут быть получены различными способами, изображенными на схемах реакций синтеза, представленных в настоящем документе. Исходные вещества и реагенты, используемые для получения данных соединений, как правило, либо доступны от коммерческих поставщиков, таких как Aldrich Chemical Co., либо их получают способами, известными специалисту в данной области техники, в соответствии с методиками, изложенными в таких источниках, как Fieser and Fieser's Reagents for Organic Synthesis, Wiley & Sons: New York, Volumes 1-21; R.C. LaRock, Comprehensive Organic Transformations, 2nd edition Wiley-VCH, New York 1999; Comprehensive Organic Synthesis, B. Trost and I. Fleming (Eds.) vol. 1-9 Pergamon, Oxford, 1991; Comprehensive Heterocyclic Chemistry, A.R. Katritzky and C.W. Rees (Eds) Pergamon, Oxford 1984, vol. 1-9; Comprehensive Heterocyclic Chemistry II, A.R. Katritzky and C.W. Rees (Eds) Pergamon, Oxford 1996, vol. 1-11; и Organic Reactions, Wiley & Sons: New York, 1991, Volumes 1-40. Указанные схемы реакций синтеза и примеры, приведенные в настоящем документе, лишь иллюстрируют некоторые способы, которыми могут быть синтезированы соединения согласно настоящей технологии, и специалисту в данной области техники предложено произвести различные модификации данных схем реакций синтеза на основания описания, содержащегося в данной заявке.
Исходные вещества и промежуточные соединения на схемах реакций синтеза могут быть при необходимости выделены и очищены с использованием традиционных методик, включая, но не ограничиваясь ими, фильтрацию, дистилляцию, кристаллизацию, хроматографию и т.п. Такие вещества могут быть охарактеризованы с использованием традиционных параметров, включая физические константы и спектральные данные.
Описание
Технология, описанная в настоящем документе, относится к аналогам нуклеотидов и связанным с ними способам, композициям (например, реакционным смесям), наборам и системам для манипуляций, детектирования, выделения и секвенирования нуклеиновых кислот. В частности, некоторые варианты указанных аналогов нуклеотидов содержат алкиновую группу, который обеспечивает функции как терминации, так и связывания. Указанная технология обладает такими преимуществами перед традиционными способами, как более низкая стоимость и пониженная сложность.
1. Аналоги нуклеотидов
Согласно настоящему изобретению предложены аналоги нуклеотидов. В некоторых вариантах реализации указанные аналоги нуклеотидов содержат один или более алкиновых терминаторных групп. Например, в некоторых вариантах технологии предложен 3'-О-блокированный аналог нуклеотида, который представляет собой 3'-О-алкинильный аналог нуклеотида. В некоторых вариантах реализации 3'-О-блокированный аналог нуклеотида представляет собой 3'-О-пропаргильный аналог нуклеотида, имеющий структуру, представленную ниже:
 ,
,
где В представляет собой основание нуклеотида, например, аденин, гуанин, цитозин, тимин или урацил, например, В представляет собой одну из следующих структур:
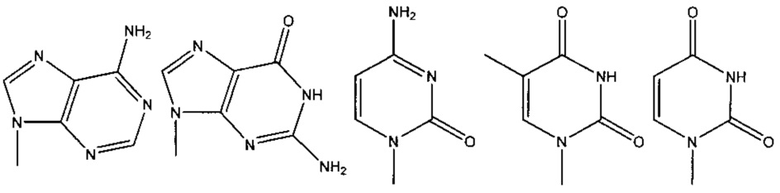
или природное или синтетическое нуклеотидное основание, например, модифицированный пурин, такой как гипоксантин, ксантин, 7-метилгуанин; модифицированный пиримидин, такой как 5,6-дигидроурацил, 5-метилцитозин, 5-гидроксиметилцитозин; и т.д., и где Р содержит фосфатную группу (например, монофосфат, дифосфат, трифосфат, тетрафосфат); 5'-гидроксил; альфа-тиофосфат (например, фосфоротиоат или фосфородитиоат), бета-тиофосфат (например, фосфоротиоат или фосфородитиоат) и/или гамма-тиофосфат (например, фосфоротиоат или фосфородитиоат); или альфа-метилфосфонат, бета-метилфосфонат и/или гамма-метилфосфонат, определенные в настоящем описании.
Аналоги нуклеотидов не ограничивается конкретной фосфатной группой. В некоторых вариантах реализации фосфатная группа представляет собой монофосфатную группу или полифосфатную группу, такую как дифосфатная группа, трифосфатная группа или тетрафосфатная группа. В некоторых вариантах реализации фосфатная группа представляет собой пирофосфат. В некоторых вариантах реализации Р представляет собой группу, содержащую 5'-гидроксил; альфа-тиофосфат (например, фосфоротиоат или фосфородитиоат), бета-тиофосфат (например, фосфоротиоат или фосфородитиоат) и/или гамма-тиофосфат (например, фосфоротиоат или фосфородитиоат); или альфа-метилфосфонат, бета-метилфосфонат и/или гамма-метилфосфонат.
Более того, основание аналогов нуклеотидов не ограничивается конкретным основанием. В некоторых вариантах реализации основание представляет собой аденин, цитозин, гуанин, тимин, урацил и их аналоги, такие как, например, ациклические основания. Аналоги нуклеотидов не ограничивается конкретной группой сахара. В некоторых вариантах реализации указанная сахарная группа представляет собой рибозу, дезоксирибозу, дидезоксирибозу и их аналоги, производные и/или модификации (например, тиофуранозу, тиорибозу, тиодезоксирибозу и т.д.). В некоторых вариантах реализации сахарная группа представляет собой арабинозу или другой родственный углевод.
В некоторых вариантах реализации аналог нуклеотида представляет собой 3'-О-пропаргил-дНТФ, где Н выбран из группы, состоящей из А, С, G, Т и U. В некоторых вариантах реализации аналоги нуклеотидов содержат детектируемые маркеры или метки, такие как оптически детектируемые группы (например, флуоресцентный краситель), электрохимически детектируемые группы (например, редокс-активную группу), квантовая точка, хромоген, биологический контрастный агент для визуализации, метка-носитель для доставки лекарственного средства и т.д.
Синтез соединений, предложенных согласно настоящему изобретению, осуществляют, как описано, например, в Bentley et al. (2008) "Accurate whole genome sequencing using reversible terminator chemistry" Nature 456(7218): 53-9 и Ju et al. (2006) "Four Color DNA Sequencing by synthesis using cleavable fluorescent nucleotide reversible terminators," PNAS 103(52): 19635-40, содержание которых включено в настоящее описание посредством ссылки, с модификациями, необходимыми для получения различных аналогов нуклеотидов, описанных в настоящем документе. Кроме того, в некоторых вариантах реализации используют различные молекулярные исследования, такие как ЯМР, масс-спектрометрия и хроматография/анализ аффинности, для подтверждения успешного синтеза соответствующих соединений.
В некоторых вариантах реализации способы синтеза соединений, включенных и предусмотренных технологией, описанной в настоящем документе, включают одну или более следующих схем синтеза или их модификаций:
Синтез 3'-О-пропаргил-дЦТФ
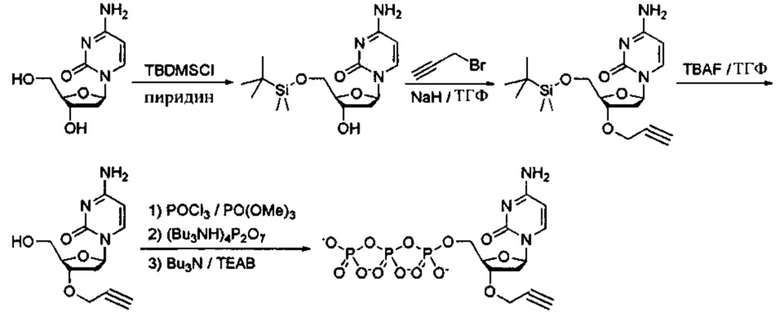
Синтез 3'-О-пропаргил-дТТФ
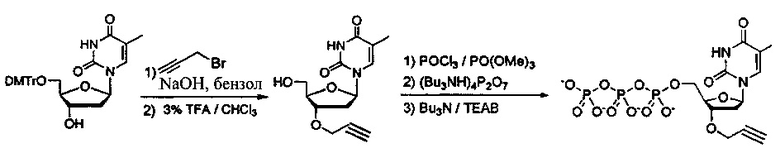
Синтез 3'-О-пропаргил-дАТФ
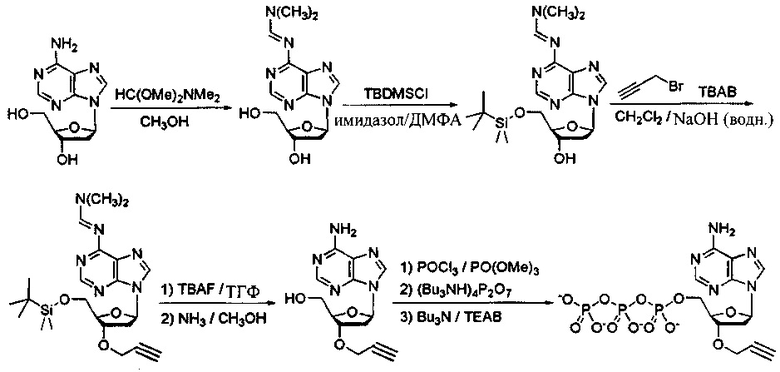
Синтез 3'-О-пропаргил-дГТФ
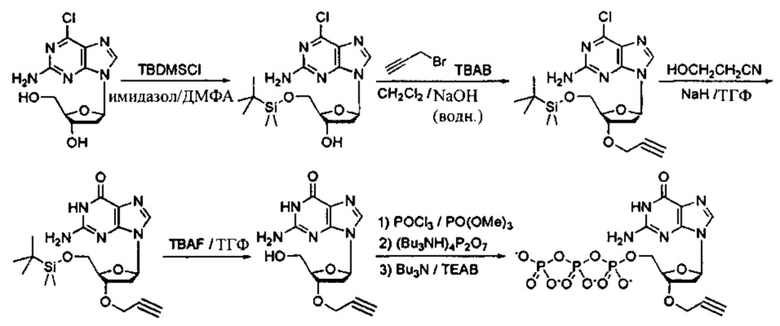
В некоторых вариантах реализации аналоги нуклеотидов применяют для включения алкиновых групп в полимеры, представляющие собой нуклеиновые кислоты, например, под действием полимеразы. В некоторых вариантах реализации полимеразу модифицируют для усиления включения аналогов нуклеотидов, описанных в настоящем документе. Типичные модифицированные полимеразы описаны в патентах США №№4889818; 5374553; 5420029; 5455170; 5466591; 5618711; 5624833; 5674738; 5789224; 5795762; 5939292; и публикациях патента США №№2002/0012970 и 2004/0005599. Не ограничивающий пример модифицированной полимеразы включает ДНК-полимеразу G46E E678G CS5, ДНК-полимеразу G46E E678G CS5, ДНК-полимеразу E615G Taq, полимеразу ΔZO5R и ДНК-полимеразу G46E L329A E678G CS5, описанную в публикации патента США №2005/0037398. В некоторых вариантах реализации полимераза представляет собой полимеразу Thermococcus sp. 9°N-7, продаваемую под торговым названием THERMINATOR (например, THERMINATOR II) компанией New England BioLabs (Ипсуич, Массачусетс). Получение модифицированных полимераз можно осуществлять с использованием множества традиционных методик в области молекулярной биологии и рекомбинантных ДНК, описанных в настоящем документе и известных в данной области техники. В некоторых вариантах реализации используют мутанты полимеразы, такие как те, которые описаны в патенте США №5939292, которые встраивают НТФ, а также дНТФ.
В некоторых вариантах реализации аналоги нуклеотидов содержат метки в дополнение к алкиновым группам (см. выше). В некоторых вариантах реализации аналоги нуклеотидов, содержащие 3'-алкиновые группы, применяют для завершения полимеразной реакции. Затем к полимеру, представляющему собой нуклеиновую кислоту, могут быть присоединены химические метки, содержащие азидо-группу, посредством клик-химии. В некоторых вариантах реализации в результате реакции терминаторного алкинового соединения с соединением, содержащим азидо-группу, получают триазольное соединение. В некоторых вариантах реализации указанное триазольное соединение функционирует в качестве остова нуклеиновой кислоты, и дальнейшие ферментативные реакции, такие как ПЦР, проводят по триазольному соединению.
2. Олигонуклеотиды
В некоторых вариантах реализации аналоги нуклеотидов находят применение для синтеза нуклеиновых кислот с триазольной модификацией остова (например, аналогов олигонуклеотидов). Например, аналоги нуклеотидов находят применение в способах водного, твердофазного синтеза олигонуклеотидов. Таким образом, такие способы устраняют необходимость, в частности, в использовании органических растворителей, этапах снятия защиты и этапах кэпирования некоторых традиционных синтезов; кроме того, водные способы минимизируют или исключают нежелательное окисление фосфора в синтезируемых соединениях, например, во время циклического синтеза. Предполагается, что преимущество водофазного синтеза заключается в том, что он является более быстрым, чем традиционные методики синтеза в органической фазе.
В некоторых вариантах реализации предложен олигонуклеотид с триазольной модификацией остова, содержащий аналоги нуклеотидов, предложенные согласно настоящему изобретению. То есть, аналоги нуклеотидов, описанные в настоящем документе, находят применение в синтезе модифицированных олигонуклеотидов, содержащих один или более аналогов нуклеотидов и содержащих триазольные группы в молекулярном остове. В некоторых вариантах реализации олигонуклеотиды содержат стандартные нуклеотиды и аналоги нуклеотидов в различных пропорциях. В некоторых вариантах реализации олигонуклеотиды содержат только аналоги нуклеотидов и не содержат стандартные нуклеотиды.
Соответственно, в некоторых вариантах реализации предложен аналог нуклеотида, описанный в иных местах настоящего документа, например, имеющий структуру в соответствии с:
 или
или  ,
,
где В представляет собой основание нуклеотида (например, аденин, гуанин, тимин, цитозин или природное, или синтетическое нуклеотидное основание, например, модифицированный пурин, такой как гипоксантин, ксантин, 7-метилгуанин; модифицированный пиримидин, такой как 5,6-дигидроурацил, 5-метилцитозин, 5-гидроксиметилцитозин; и т.д.).
Такие аналоги нуклеотидов и их варианты, и модифицированные производные (например, содержащие аналог основания или альтернативный сахар, описанный в настоящем документе) представляют собой направленный бифункциональный аналог нуклеотида (например, направленный бифункциональный агент полимеризации), например, для синтеза олигонуклеотида (например, аналога олигонуклеотида, например, олигонуклеотида, содержащего аналог нуклеотида, описанный в настоящем документе). В некоторых вариантах реализации данный направленный бифункциональный аналог нуклеотида обеспечивает синтез олигонуклеотида в 5'-3'-направлении, и в некоторых вариантах реализации направленный бифункциональный аналог нуклеотида обеспечивает синтез олигонуклеотида в 3'-5'-направлении. В некоторых вариантах реализации синтез олигонуклеотида включает использование пропаргильной группы и линкера, присоединенного к твердому носителю (например, линкера (например, карбоксилатного линкера), расщепляемого в кислых (например, слабокислых) условиях). В некоторых вариантах реализации синтез олигонуклеотида включает использование пропаргильной группы и азидного линкера, присоединенного к твердому носителю. В некоторых вариантах реализации 3'-тио-модифицированный пропаргильную группу связывают с твердым носителем и расщепляют с помощью реагента, содержащего нитрат серебра или хлорид ртути. В некоторых вариантах реализации твердый носитель включает стекло с контролируемым размером пор, диоксид кремния, сефадекс, агарозу, акриламид, латекс или полистирол и т.д., представленный в некоторых вариантах реализации в виде микросфер.
Предложены следующие типичные схемы синтеза для получения олигонуклеотидов:
а. 3'-5'-синтез олигонуклеотидов с использованием 3'-алкинил/5'-азидо-аналога нуклеотида
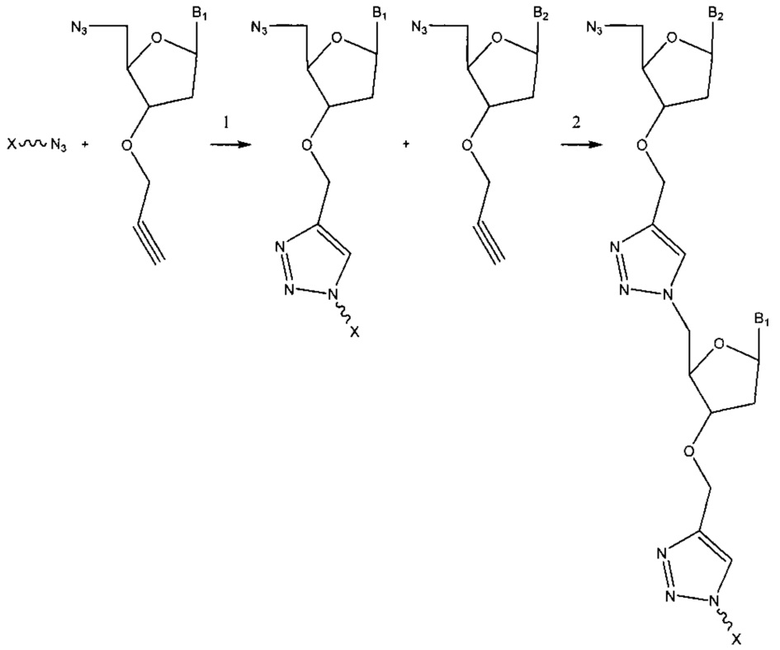
На типичной схеме синтеза а X представляет собой твердый носитель, волнистая линия (~) представляет собой расщепляемый линкер, B1 представляет собой первое нуклеотидное основание, и В2 представляет собой второе нуклеотидное основание, которое может быть таким же или отличным от В1. На первом этапе (1) осуществляют связывание первого аналога нуклеотида с твердым носителем (например, с использованием реакции клик-химии, например, с использованием катализатора на основе меди). Затем один или более (например, несколько) кругов второго этапа (2) (например, с использованием реакции клик-химии, например, с использованием катализатора на основе меди) позволяют синтезировать аналог олигонуклеотида, при этом на каждом этапе происходит присоединение еще одного аналога нуклеотида к растущей полимерной цепи.
b. 5'-3'-синтез олигонуклеотидов с использованием 3'-алкинил/5'-азидо-аналога нуклеотида
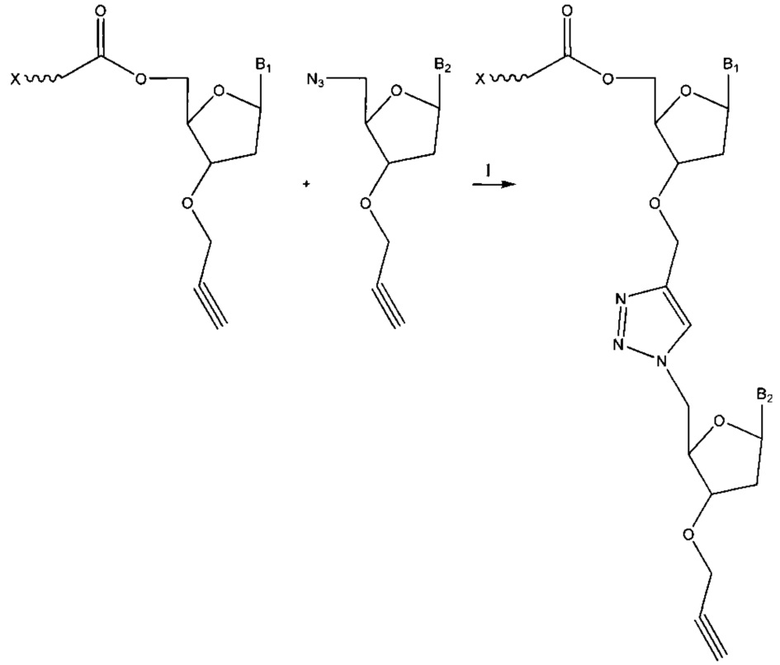
На типичной схеме синтеза b X представляет собой твердый носитель, волнистая линия (~) представляет собой расщепляемый линкер (например, карбоксилатный линкер), B1 представляет собой первое нуклеотидное основание, и В2 представляет собой второе нуклеотидное основание, которое может быть таким же или отличным от В1. После проведения реакции первого аналога нуклеотида с твердым носителем, содержащим линкер и реакционноспособный карбоксилатную группу (например, с образованием сложноэфирной связи), один или более (например, несколько) кругов присоединения нуклеотида и реакции (1) (например, с использованием реакции клик-химии, например, с использованием катализатора на основе меди) позволяют синтезировать аналог олигонуклеотида, при этом на каждом этапе происходит присоединение еще одного аналога нуклеотида к растущей полимерной цепи.
с. 5'-3'-синтез олигонуклеотидов с использованием 3'-азидо/5'-алкинильного аналога нуклеотида
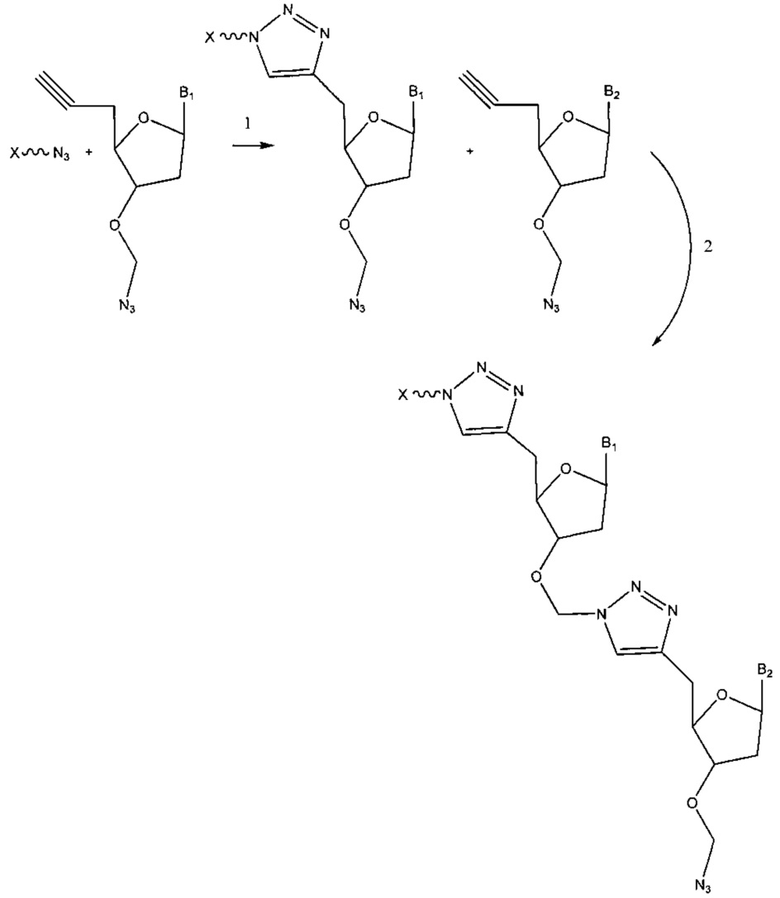
На типичной схеме синтеза с X представляет собой твердый носитель, волнистая линия (~) представляет собой расщепляемый линкер, B1 представляет собой первое нуклеотидное основание, и В2 представляет собой второе нуклеотидное основание, которое может быть таким же или отличным от В1. На первом этапе (1) осуществляют связывание первого аналога нуклеотида с твердым носителем (например, с использованием реакции клик-химии, например, с использованием катализатора на основе меди). Затем один или более (например, несколько) кругов второго этапа (2) (например, с использованием реакции клик-химии, например, с использованием катализатора на основе меди) позволяют синтезировать аналог олигонуклеотида, при этом на каждом этапе происходит присоединение еще одного аналога нуклеотида к растущей полимерной цепи.
d. 3'-5'-синтез олигонуклеотидов с использованием 3'-азидо/5'-алкинильного аналога нуклеотида
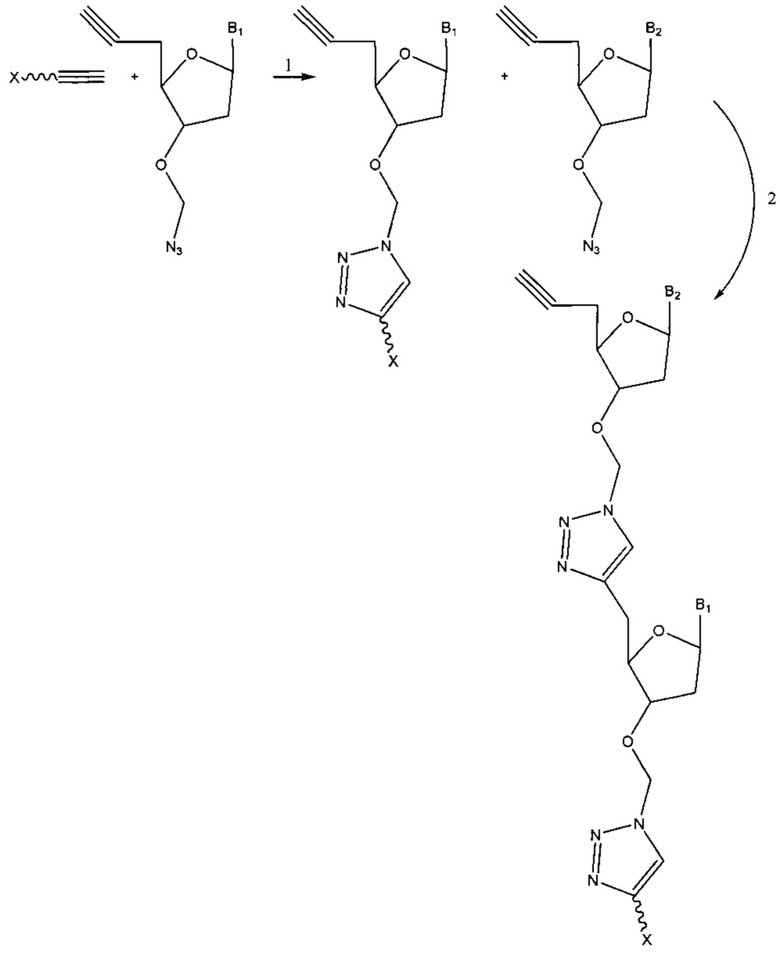
На типичной схеме синтеза d X представляет собой твердый носитель, волнистая линия (~) представляет собой расщепляемый линкер, B1 представляет собой первое нуклеотидное основание, и В2 представляет собой второе нуклеотидное основание, которое может быть таким же или отличным от В1. На первом этапе (1) осуществляют связывание первого аналога нуклеотида с твердым носителем (например, с использованием реакции клик-химии, например, с использованием катализатора на основе меди). Затем один или более (например, несколько) кругов второго этапа (2) (например, с использованием реакции клик-химии, например, с использованием катализатора на основе меди) позволяют синтезировать аналог олигонуклеотида, при этом на каждом этапе происходит присоединение еще одного аналога нуклеотида к растущей полимерной цепи.
В некоторых вариантах реализации проводят реакцию аналога олигонуклеотида и/или нуклеотида с линкером с присоединением аналога олигонуклеотида и/или нуклеотида к твердому носителю, например, грануле, плоской поверхности (матрице), столбцу и т.д. В настоящем описании термин «твердый носитель» относится к материалу или группе материалов, имеющих жесткую или полужесткую поверхность или поверхности. Во многих вариантах реализации по меньшей мере одна поверхность твердого носителя является по существу плоской, хотя в некоторых вариантах реализации может быть желательным разделение областей твердого носителя, например, с помощью ячеек, выступающих областей, стержней, вытравленных канавок и т.п. В соответствии с другими вариантами реализации твердый носитель принимает форму гранул, смол, гелей, микросфер или других геометрических конфигураций. Типичные субстраты см., например, в патенте США №5744305 и публикациях патента США №№20090149340 и 20080038559. В некоторых вариантах реализации линкер представляет собой расщепляемый линкер (например, расщепляемый светом, теплом, в результате химической или биохимической реакции).
На типичных схемах синтеза а, b, с и d варианты способов синтеза олигонуклеотида включают один или более дополнительных этапов присоединения аналога нуклеотида, проведения реакции аналога нуклеотида, «смывания» и/или иного удаления невстроенного аналога нуклеотида (например, после этапа синтеза), расщепления линкера, выделения синтезированного олигонуклеотида, очищения синтезированного олигонуклеотида и/или присоединения метки или маркера к синтезированному олигонуклеотиду.
3. Мечение и маркировка
Методики детектирования нуклеиновых кислот играют критическую роль в области молекулярной диагностики. Способность осуществлять манипуляции с биомолекулами являлась определенной и эффективной центральной движущей силой многих успешных технологий детектирования нуклеиновых кислот. Среди множества методик молекулярной биологии способность маркировать или «метить» представляющую интерес биомолекулу являлась ключевой технологией для последующего детектирования и идентификации указанной биомолекулы.
Соответственно, в некоторых вариантах технологии предложены композиции, способы, системы и наборы, относящиеся к мечению биомолекул, таких как нуклеиновые кислоты и/или нуклеотиды. В некоторых вариантах реализации алкинсодержащие нуклеотиды, такие как 3'-О-пропаргил-модифицированные нуклеотиды (например, 3'-О-пропаргил-дНТФ), встраивают в нуклеиновую кислоту в полимеразной реакции достройки. В некоторых вариантах реализации аналог нуклеотида останавливает полимеразную реакцию. В некоторых вариантах реализации алкинсодержащий нуклеотид (например, без дополнительной обработки и/или очистки) используют в реакции мечения с азид-модифицированной меткой или маркирующим реагентом с использованием химического лигирования (например, реакции клик-химии). Ковалентная связь, образуемая с использованием этой химии, имитирует природные фосфодиэфирные связи нуклеиновой кислоты, что таким образом позволяет получить конъюгированный продукт, подходящий для применения в последующих ферментативных реакциях, таких как полимеразная цепная реакция.
Маркеры и метки представляют собой соединения, структуры или элементы, которые поддаются по меньшей мере одному из способов детектирования и/или выделения, который позволяет распознать различные маркеры и/или метки. Например, маркеры и/или метки содержат полупроводниковые нанокристаллы, соединения металлов, пептиды, антитела, малые молекулы, изотопы, частицы или структуры, имеющие различные формы, цвета, идентификаторы или дифракционные картины, связанные с ними или включенные в них, числовые строки, случайные фрагменты белков или нуклеиновых кислот, или различные изотопы.
В настоящем описании термины «маркер» или «метка» являются взаимозаменяемыми и относятся к любой химической группе, присоединенной к нуклеотиду или нуклеиновой кислоте, при этом указанное присоединение может быть ковалентным или нековалентным. Предпочтительно, маркер поддается детектированию и делает указанный нуклеотид или нуклеиновую кислоту детектируемой для специалиста, практикующего указанную технологию. Типичные детектируемые маркеры, которые находят применение совместно с технологией, предложенной согласно настоящему изобретению, включают, например, флуоресцентный маркер, хемилюминесцентный маркер, гаситель, радиоактивный маркер, биотин и золото, или их комбинации. Детектируемые маркеры включают люминесцентные молекулы, флуорохромы, гасители флуоресценции, окрашенные молекулы (например, хромогены, используемые для гибридизации in situ (ISH, FISH) и получения изображений методом яркого поля), радиоизотопы или сцинтилляторы. Детектируемые маркеры также включают любую подходящую линкерную молекулу (такую как биотин, авидин, дигоксигенин, стрептавидин, пероксидаза хрена (HRP), белок А, белок G, антитела или их фрагменты, Grb2, полигистидин, Ni2+, FLAG-метки, myc-метки), тяжелые металлы, ферменты (примеры включают щелочную фосфатазу, пероксидазу и люциферазу), доноры/акцепторы электронов, сложные эфиры акридиния, красители и калориметрические субстраты. Также предполагается, что изменение массы можно считать детектируемым маркером, который, например, находит применение в детектировании методом поверхностного плазмонного резонанса.
Технология также находит применение в таких областях, как связывание ДНК-содержащих алкинов с контрастным агентом для визуализации (например, меглюминами, ферумоксилом (ferumoxsil), ферумоксидами, гадодиамидом, гадоверсетамидом, соединениями галлия, соединениями индия, соединениями таллия, соединениями рубидия, соединениями технеция, йопамидолом и т.д.), например, для биомедицинской визуализации (например, магнитно-резонансной томографии (МРТ), сканирования методом компьютерной томографии (КТ), рентгена и т.д.), связывание ДНК с олиго и/или антисмысловыми метками-носителями для доставки лекарственного средства (например, стероидами, липидами, холестерином, витаминами, гормонами, углеводами и/или рецептор-специфичными лигандами (например, фолатом, никотинамидом, ацетилхолином, ГАМК, глутаматом, серотонином и т.д.), и связывание с хромогенами для применения для гибридизации in situ. Специалист в данной области техники сможет легко определить подходящие детектируемые маркеры, не упомянутые выше, которые могут быть использованы в процессе согласно настоящему изобретению.
Таким образом, указанная технология не ограничивается маркером или меткой, которую связывают с нуклеиновой кислотой, например, путем использования азидного маркирующего реагента в реакции клик-химии. Таким образом, в некоторых вариантах реализации маркер содержит флуоресцентно-детектируемую группу на основе красителя, при этом указанный краситель представляет собой ксантен, флуоресцеин, родамин, BODIPY, цианин, кумарин, пирен, фталоцианин, фикобилипротеин, ALEXA FLUOR® 350, ALEXA FLUOR® 405, ALEXA FLUOR® 430, ALEXA FLUOR® 488, ALEXA FLUOR® 514, ALEXA FLUOR® 532, ALEXA FLUOR® 546, ALEXA FLUOR® 555, ALEXA FLUOR® 568, ALEXA FLUOR® 568, ALEXA FLUOR® 594, ALEXA FLUOR® 610, ALEXA FLUOR® 633, ALEXA FLUOR® 647, ALEXA FLUOR® 660, ALEXA FLUOR® 680, ALEXA FLUOR® 700, ALEXA FLUOR® 750, флуоресцентный полупроводниковый кристалл или сквареновый краситель. В некоторых вариантах реализации метка или маркер содержит радиоактивный изотоп, спиновую метку, квантовую точку или биолюминесцентную группу. В некоторых вариантах реализации маркер представляет собой флуоресцентно-детектируемую группу, описанную, например, в Haugland (September 2005) MOLECULAR PROBES HANDBOOK OF FLUORESCENT PROBES AND RESEARCH CHEMICALS (10th ed.), полное содержание которого включено в настоящее описание посредством ссылки.
В некоторых вариантах реализации маркер (например, флуоресцентно-детектируемый маркер) представляет собой маркер, доступный у АТТО-ТЕС GmbH (Am Eichenhang 50, 57076 Зиген, Германия), например, описанный в публикациях заявки на патент США №№20110223677, 20110190486, 20110172420, 20060179585 и 20030003486; и в патенте США №7935822, содержание всех из которых включено в настоящее описание посредством ссылки.
В некоторых вариантах реализации нуклеиновую кислоту и/или нуклеотид, содержащий модифицированный нуклеотид, например, содержащий алкиновую группу, метят группой, позволяющей детектировать и/или выделить нуклеиновую кислоту и/или нуклеотид благодаря специфическому взаимодействию со второй группой. Например, в некоторых вариантах реализации нуклеиновую кислоту и/или нуклеотид связывают (например, путем реакции клик-химии) с меткой, содержащей азидную и биотиновую группу, эпитопом, антигеном, аптамером, аффинной меткой, гистидиновой меткой, идентификационным олигонуклеотидом, полиА-хвостом, олигонуклеотидом захвата, белком, сахаром, хелатором, массовой меткой (например, 2-нитрометилбензильная группа, 2-нитрометил-3-фторбензильная группа, 2-нитро-α-метил-3,4-дифторбензильная группа, 2-нитро-α-метил-3,4-диметоксибензильная группа, 2-нитро-α-метилбензильная группа, 2-нитро-α-метил-3-фторбензильная группа, 2-нитрометил-3,4-дифторбензильная группа, 2-нитро-α-метил-3,4-диметоксибензил), меткой-зарядом.
В некоторых вариантах реализации проводят реакцию нуклеиновой кислоты и/или нуклеотида, содержащего алкин, с линкером, содержащим азид, с присоединением нуклеиновой кислоты и/или нуклеотида к твердому носителю, например, грануле, плоской поверхности (матрице), столбцу и т.д. В некоторых вариантах реализации линкер представляет собой расщепляемый линкер (например, расщепляемый светом, теплом, в результате химической или биохимической реакции).
4. Реакции
В некоторых вариантах реализации технология находит применение в связывании олигонуклеотида с нуклеиновой кислотой (например, ДНК, РНК). Например, в некоторых вариантах реализации нуклеиновую кислоту, содержащую аналог нуклеотида (например, нуклеиновую кислоту, содержащую алкиновую группу, например, 3'-О-пропаргильный нуклеотид, например, 3'-О-пропаргил-дНТФ), связывают с олигонуклеотидом, содержащим группу (например, азидную группу), которая является химически активной в отношении химической группы аналога нуклеотида, например, путем реакции клик-химии. В некоторых вариантах реализации олигонуклеотид является одноцепочечным, и в некоторых вариантах реализации олигонуклеотид является двухцепочечным. В некоторых вариантах реализации нуклеиновая кислота представляет собой ДНК, и в некоторых вариантах реализации нуклеиновая кислота представляет собой РНК; в некоторых вариантах реализации олигонуклеотид представляет собой ДНК, и в некоторых вариантах реализации олигонуклеотид представляет собой РНК.
В некоторых вариантах реализации способы согласно технологии включают присоединение адаптера к нуклеиновой кислоте. В некоторых вариантах реализации адаптер содержит функциональную группу для химического лигирования с аналогом нуклеотида. Например, в некоторых вариантах реализации адаптер содержит азидную группу (например, на 5'-конце), которая способна реагировать с алкинильной группой (например, пропаргильной группой, например, на 3'-конце нуклеиновой кислоты, содержащей аналог нуклеотида), например, путем реакции клик-химии (например, с использованием реагента, представляющего собой медный (например, на основе меди) катализатор).
В некоторых вариантах реализации алкин представляет собой бутаргильную (butargyl) группу или ее структурное производное. В некоторых вариантах реализации алкин содержит атом серы, например, с образованием тиоалкинильной, тиопропаргильной (например, 3'-S-пропаргильной) группы или их структурного производного.
В некоторых вариантах реализации адаптеры содержат универсальную последовательность и/или индексную, например, идентификационную нуклеотидную последовательность. Кроме того, адаптеры могут содержать один или более из множества элементов последовательности, включая, но не ограничиваясь ими, одну или более гибридизующихся последовательностей праймера для амплификации или их комплементарных последовательностей, одну или более гибридизующихся последовательностей секвенирующего праймера или их комплементарных последовательностей, одну или более идентификационных последовательностей, одну или более общих последовательностей среди нескольких различных адаптеров или подгрупп различных адаптеров (например, универсальную последовательность), один или более сайтов узнавания рестрикционными ферментами, один или более липких концов, комплементарных одному или более липким концам целевого полинуклеотида, один или более сайтов связывания зонда (например, для присоединения к платформе секвенирования, такой как проточная ячейка для массового параллельного секвенирования, например, разработанная Illumina, Inc.), одну или более случайных или почти случайных последовательностей (например, один или более нуклеотидов, выбранных случайным образом из набора из двух или более различных нуклеотидов в одном или более положениях, при этом каждый из различных нуклеотидов, выбранных в одном или более положениях, представлен в пуле адаптеров, содержащих случайную последовательность) и их комбинации. Два или более элементов последовательности могут не примыкать друг к другу (например, разделены одним или более нуклеотидами), примыкать друг к другу, частично перекрываться или полностью перекрываться. Например, гибридизующаяся последовательность праймера для амплификации может также служить в качестве гибридизующейся последовательности секвенирующего праймера. Элементы последовательности могут быть расположены на или вблизи 3'-конца, или на или вблизи 5'-конца, или во внутренней области адаптерного олигонуклеотида. В случае, когда адаптерный олигонуклеотид способен образовывать вторичную структуру, такую как «шпилька», элементы последовательности могут быть расположены частично или полностью за пределами вторичной структуры, частично или полностью в пределах вторичной структуры или между последовательностями, участвующими в образовании вторичной структуры. Например, в случае, когда адаптерный олигонуклеотид содержит шпилечную структуру, элементы последовательности могут быть расположены частично или полностью в пределах или за пределами гибридизуемых последовательностей («стебель»), в том числе в последовательности между гибридизуемыми последовательностями («петля»). В некоторых вариантах реализации адаптерные олигонуклеотиды среди множества адаптерных олигонуклеотидов, содержащие различные идентификационные последовательности, содержат элемент последовательности, общий для всех адаптерных олигонуклеотидов среди данного множества. Различие в элементах последовательности может быть любым, так что по меньшей мере часть различных адаптеров полностью не выравнивается, например, вследствие изменений длины последовательности, делеции или встраивания одного или более нуклеотидов, или изменения нуклеотидного состава в одном или более положениях нуклеотидов (например, замена основания или модификация основания). В некоторых вариантах реализации адаптерный олигонуклеотид содержит липкий 5'-конец, липкий 3'-конец или тот и другой, комплементарный одному или более целевым полинуклеотидам. Длина комплементарных липких концов может составлять один или более нуклеотидов, включая, но не ограничиваясь ими, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более нуклеотидов. Комплементарные липкие концы могут содержать фиксированную последовательность. Комплементарные липкие концы могут содержать такую случайную последовательность из одного или более нуклеотидов, что один или более нуклеотидов выбраны случайным образом из набора из двух или более различных нуклеотидов в одном или более положениях, при этом каждый из различных нуклеотидов, выбранных в одном или более положениях, представлен в пуле адаптеров с комплементарными липкими концами, содержащими указанную случайную последовательность. В некоторых вариантах реализации липкий конец адаптера комплементарен липкому концу целевого полинуклеотида, полученному путем расщепления рестрикционной эндонуклеазой. В некоторых вариантах реализации липкий конец адаптера состоит из аденина или тимина.
В некоторых вариантах реализации адаптерные последовательности содержат идентификационный элемент, представляющий собой сайт молекулярного связывания, для облегчения идентификации и выделения целевой нуклеиновой кислоты для последующего применения. Молекулярное связывание как механизм аффинности обеспечивает взаимодействие между двумя молекулами, которое приводит к образованию стабильного ассоциированного комплекса. Молекулы, которые могут участвовать в реакциях молекулярного связывания, включают белки, нуклеиновые кислоты, углеводы, липиды и малые органические молекулы, такие как лиганды, пептиды или лекарственные средства.
В случае, когда сайт молекулярного связывания нуклеиновой кислоты используют в качестве части адаптера, его можно использовать для селективной гибридизации для выделения целевой последовательности. Селективная гибридизация может ограничивать значительную гибридизацию целевыми нуклеиновыми кислотами, содержащими адаптер с сайтом молекулярного связывания, и обеспечивать захват нуклеиновых кислот, которые в достаточной степени комплементарны сайту молекулярного связывания. Таким образом, посредством «селективной гибридизации» можно детектировать присутствие целевого полинуклеотида в неочищенном образце, содержащем пул из множества нуклеиновых кислот. Пример системы выделения с использованием селективной нуклеотид-нуклеотидной гибридизации включает систему с несколькими нуклеотидами захвата, которые представляют собой последовательности, комплементарные идентификационным элементам, представляющим собой молекулярное связывание, и возможно иммобилизованы на твердом носителе. В других вариантах реализации полинуклеотиды захвата комплементарны самим целевым последовательностям или идентификатору, или уникальной метке, содержащейся в адаптере. Полинуклеотиды захвата могут быть иммобилизованы на различных твердых носителях, например, внутри лунки планшета, монодисперсных сферах, микроматрицах или любой другой подходящей поверхности-носителе, известной в данной области техники. Гибридизованные комплементарные адаптерные полинуклеотиды, присоединенные к твердому носителю, могут быть выделены путем «смывания» нежелательных не связывающихся нуклеиновых кислот, в результате которого остаются желаемые целевые полинуклеотиды. Если комплементарные молекулы адаптера фиксированы на парамагнитных сферах или с помощью подобной технологии выделения с использованием гранул, то затем сферы могут быть смешаны в пробирке с целевым полинуклеотидом, содержащим адаптеры. В случае, когда адаптерные последовательности были гибридизованы с комплементарными последовательностями, фиксированными на сферах, нежелательные молекулы могут быть «смыты», тогда как сферы удерживаются в пробирке с помощью магнитного или подобного агента. Затем желаемые целевые молекулы могут быть высвобождены путем повышения температуры, изменения рН или путем использования любого другого подходящего способа элюирования, известного в данной области техники.
Как описано в иных местах настоящего документа, «идентификатор» или «идентификационный олигонуклеотид» представляет собой известную последовательность нуклеиновой кислоты, которая позволяет идентифицировать определенный признак нуклеиновой кислоты, с которой связан указанный идентификатор. Например, в некоторых вариантах реализации указанный идентифицируемый признак нуклеиновой кислоты представляет собой образец или источник, из которого получена нуклеиновая кислота. Идентификационная последовательность, как правило, включает некоторые признаки, которые делают указанную последовательность полезной, например, в секвенирующих реакциях. Например, идентификационные последовательности разрабатывают таким образом, чтобы они содержали минимальные или совсем не содержали гомополимерных областей, например, 2 или более одинаковых оснований подряд, например, АА или ССС, в пределах идентификационной последовательности. В некоторых вариантах реализации идентификационные последовательности также разрабатывают таким образом, чтобы они находились по меньшей мере на одном корректируемом расстоянии от порядка присоединения оснований при осуществлении манипуляций или молекулярно-биологического процесса, такого как секвенирование основание за основанием, для того чтобы первое и последнее основания не соответствовали ожидаемым основаниям последовательности.
В некоторых вариантах реализации идентификационные последовательности разрабатывают таким образом, чтобы каждая последовательность коррелировала с конкретной нуклеиновой кислотой. Способы создания наборов идентификационных последовательностей представлены, например, в патенте США №6235475, полное содержание которого включено в настоящее описание посредством ссылки. В некоторых вариантах реализации идентификационные последовательности находятся в диапазоне от примерно 5 нуклеотидов до примерно 15 нуклеотидов. В конкретном варианте реализации идентификационные последовательности находятся в диапазоне от примерно 4 нуклеотидов до примерно 7 нуклеотидов. В некоторых вариантах реализации длины и последовательности идентификационных последовательностей направлены на достижение желаемого уровня точности в определении идентичности нуклеиновой кислоты. Например, в некоторых вариантах реализации идентификационные последовательности разрабатывают таким образом, чтобы после допустимого числа точечных мутаций можно было установить идентичность связанной нуклеиновой кислоты с желаемой точностью. В некоторых вариантах реализации транспозаза Tn-5 (коммерчески доступная у Epicentre Biotechnologies; Мэдисон, Висконсин) разрезает нуклеиновую кислоту на фрагменты и встраивает короткие части ДНК в «разрезы». Указанные короткие части ДНК используют для встраивания идентификационных последовательностей.
Способы создания наборов идентификационных последовательностей и другие способы присоединения адаптеров (например, содержащих идентификационные последовательности) представлены в патентах США №№6138077; 6352828; 5636400; 6172214; 6235475; 7393665; 7544473; 5846719; 5695934; 5604097; 6150516; RE39793; 7537897; 6172218; и 5863722, полное содержание каждого из которых включено в настоящее описание посредством ссылки.
При соответствующих изменениях схем реакций предполагается, что применение 5'-алкинил/3'-азидо- и 5'-азидо/3'-алкинильных аналогов нуклеотидов является взаимозаменяемым в реакциях с соответствующими реакционноспособными субстратами для связывания с 5'- и/или 3'-концами аналогов нуклеотидов, например, посредством клик-химии.
В некоторых вариантах реализации технология находит применение в реакции достройки праймера (см., например, фиг. 1) и/или лигировании адаптера (см., например, фиг. 1). В конкретных вариантах реализации праймер, гибридизованный с матрицей (например, целевой нуклеиновой кислотой), достраивают под действием полимеразы, которая присоединяет аналог нуклеотида к указанному праймеру. Тогда как на фиг. 1 показано типичное присоединение G-содержащего аналога нуклеотида напротив основания С в матрице, технология достройки праймера не ограничивается основаниями, которые присоединяют. Затем, в некоторых вариантах реализации азид-модифицированную ДНК (например, адаптер, например, адаптер, содержащий сайт связывания праймера и/или идентификатор) лигируют с продуктом достройки праймера (например, посредством клик-химии). Продукт лигирования содержит связь, которая имитирует традиционный остов нуклеиновой кислоты, например, триазол, и которая биологически совместима с последующими ферментативными и/или химическими реакциями, например, ПЦР (например, см. фиг. 1).
5. Секвенирование
В некоторых вариантах реализации аналоги нуклеотидов находят применение в секвенировании нуклеиновых кислот, например, «секвенировании следующего поколения» (NGS). Например, секвенирование ДНК путем синтеза (SBS) включает определение последовательности ДНК путем детектирования определенных сигналов (например, пирофосфатных групп), которые вырабатываются, когда нуклеотид встраивается путем полимеразной реакции. Другие способы SBS включают альтернативные средства детектирования присоединения нуклеотидов под действием полимеразы, такие как детектирование излучения света, изменения флуоресценции, изменения рН или какого-либо другого физического или химического изменения. Например, секвенирование с обратимыми терминаторами Illumina основано на обратимых терминаторных основаниях, содержащих краситель. Когда одно такое основание присоединяют к растущему полимеру, представляющему собой нуклеиновую кислоту, реакция останавливается, и краситель на терминальной нуклеиновой кислоте может быть детектирован. Затем молекула, содержащая терминатор, может быть обработана расщепляющим ферментом, который «отменяет» терминацию и позволяет присоединять дополнительные нуклеотиды. Данный поэтапный процесс усовершенствован по сравнению с более ранней технологией, но дополнительный этап расщепления и последующая очистка образца оставляют пространство для дальнейшего усовершенствования.
В некоторых вариантах реализации настоящего изобретения предложены функциональные терминаторные нуклеотиды, содержащие 3'-алкины, которые встраиваются в растущий полимер, представляющий собой нуклеиновую кислоту, и завершают реакцию достройки. 3'-алкин можно непосредственно применять в реакции с азид-модифицированной меткой посредством клик-химии. Связь, образуемая посредством клик-химии, имитирует природную фосфодиэфирную связь нуклеиновой кислоты и позволяет применять конъюгированный продукт в последующих ферментативных реакциях, таких как ПЦР. Таким образом, некоторые варианты реализации настоящего изобретения позволяют избежать этапа расщепления терминатора в секвенирующей реакции с обратимым терминатором и тем самым уменьшают время проведения реакции (см., например, вариант реализации, представленный на фиг. 2).
В некоторых вариантах реализации аналог нуклеотида, например, 3'-алкинильный аналог нуклеотида (например, 3'-О-пропаргильный аналог нуклеотида, такой как 3'-О-пропаргил-дНТФ) применяют в полимеразной реакции, и получают продукты достройки нуклеиновой кислоты, в которых 3'-конец содержит алкиновую группу. Затем алкин-модифицированные продукты нуклеиновых кислот можно применять в качестве специфичного субстрата в реакциях химического лигирования с соединениями, содержащими азидо-группы, посредством клик-химии (например, реакция 1,3-диполярного циклоприсоединения, катализируемая медью (I)). Данный тип клик-химии позволяет конъюгировать алкины и азиды с образованием ковалентной связи (например, пятичленного триазольного кольца) между алкинсодержащим соединением и азидсодержащим соединением. Например, 5'-азид-модифицированный фрагмент ДНК может быть химически лигирован с 3'-алкин-модифицированным фрагментом ДНК с использованием клик-химии. Затем данный конъюгированный продукт ДНК можно использовать в качестве исходного в последующих ферментативных реакциях, таких как ПЦР или секвенирование, поскольку ковалентная связь, образуемая пятичленным триазольным кольцом, имитирует природную фосфодиэфирную связь остова ДНК и в значительной и/или детектируемой степени не ингибирует последующую ферментативную активность.
Предусмотренные реакции с участием аналогов нуклеотидов обеспечивают многочисленные возможные явления детектирования. В некоторых вариантах реализации аналог нуклеотида встраивает специфический флуорофор в удлиняющуюся цепь нуклеиновой кислоты. В некоторых вариантах реализации присоединение аналога нуклеотида формирует детектируемый сигнал, такой как пирофосфат. В некоторых вариантах реализации встраивание аналога нуклеотида может быть детектировано по излучению света, изменению флуоресценции, изменению рН, изменению конформации или какому-либо другому химическому изменению. В некоторых вариантах реализации реакция клик-химии между встроенным аналогом нуклеотида и соединением, содержащим азидо-группу, может быть детектирована способами, схожими со встраиванием аналога нуклеотида.
Благодаря клик-химии алкинсодержащие аналоги нуклеотидов легко реагируют с соединениями, содержащими азидо-группы. С использованием данной клик-химии различные метки могут быть ковалентно встроены в удлиняющуюся цепь нуклеиновой кислоты, которая содержит один из аналогов нуклеотидов. Примеры таких меток включают, но не ограничиваются ими, флуоресцентные красители, ДНК, РНК, олигонуклеотиды, нуклеозиды, белки, аминокислоты, полипептиды, полисахариды, нуклеиновые кислоты, синтетические полимеры и вирусы.
В некоторых вариантах реализации технология относится к способам секвенирования нуклеиновой кислоты. В некоторых вариантах реализации секвенирование осуществляют с помощью следующей последовательности действий с типичным применением аналога нуклеотида, содержащего 3'-О-пропаргильную группу. Сначала аналог нуклеотида ориентируют в активном центре полимеразы (например, с помощью полимеразы) для спаривания основания с комплементарным основанием матричной цепи и для примыкания к свободному 3'-гидроксилу растущей синтезируемой цепи. Затем указанный аналог нуклеотида присоединяют к 3'-концу растущей нити под действием полимеразы, например, путем катализируемой ферментом атаки 3'-гидроксила в альфа-фосфате аналога нуклеотида. Дальнейшая достройка цепи под действием полимеразы блокируется 3'-О-пропаргильной терминирующей группой во встроенном аналоге нуклеотида. Затем в некоторых вариантах реализации цепь подвергают ПЦР-реакции и используют в различных способах секвенирования.
В некоторых вариантах реализации 3'-О-пропаргильную терминирующую группу обрабатывают азид-меченой молекулой ДНК. Это позволяет удалить терминаторный алкин. После удаления терминатора растущая нить становится свободной для дальнейшей полимеризации: встраивают следующее основание с продолжением еще одного цикла, например, ориентируют аналог нуклеотида в активном центре полимеразы, присоединяют указанный аналог нуклеотида к 3'-концу растущей цепи под действием полимеразы и исследуют аналог нуклеотида с идентификацией присоединенного основания.
Некоторые варианты реализации относятся к параллельному (например, массовому параллельному) секвенированию.
В некоторых вариантах реализации технология, описанная в настоящем документе, относится к способу секвенирования нуклеиновой кислоты, включающему: гибридизацию праймера с нуклеиновой кислотой с образованием комплекса гибридизованный праймер/нуклеиновая кислота, получение множества аналогов нуклеотидов, при этом каждый аналог нуклеотида содержит нуклеотид и алкиновую группу, присоединенную к указанному нуклеотиду, проведение реакции указанного комплекса гибридизованный праймер/нуклеиновая кислота и аналога нуклеотида с полимеразой с присоединением аналога нуклеотида к праймеру путем полимеразной реакции с получением удлиненного продукта, содержащего встроенный аналог нуклеотида, исследование удлиненного продукта с идентификацией встроенного аналога нуклеотида, проведение реакции удлиненного продукта с азидсодержащим соединением с получением структуры, содержащей триазольное кольцо. В некоторых вариантах реализации аналоги нуклеотидов включают 3'-О-пропаргил-дНТФ, где Н выбран из группы, состоящей из А, С, G, Т и U. В некоторых вариантах реализации конъюгат нуклеиновой кислоты, содержащий триазольное кольцо, применяют в последующих ферментативных реакциях, таких как полимеразная цепная реакция. В некоторых вариантах реализации способ включает получение стандартных нуклеотидов во время того же этапа, на котором получают аналоги нуклеотидов.
В некоторых вариантах реализации технология, описанная в настоящем документе, обеспечивает способ секвенирования нуклеиновой кислоты, включающий: гибридизацию праймера с нуклеиновой кислотой с образованием комплекса гибридизованный праймер/нуклеиновая кислота, получение множества нуклеотидов (некоторые из которых представляют собой аналоги нуклеотидов, содержащие нуклеотид и алкиновую группу, присоединенную к указанному нуклеотиду), проведение реакции указанного комплекса гибридизованный праймер/нуклеиновая кислота и аналога нуклеотида с полимеразой с присоединением аналога нуклеотида к праймеру путем полимеразной реакции с получением удлиненного продукта, содержащего встроенный аналог нуклеотида, и исследование структуры, содержащей триазольное кольцо, с идентификацией того, какой аналоговый нуклеотид был встроен. В некоторых вариантах реализации способы дополнительно включают проведение реакции удлиненного продукта с азидсодержащим соединением с получением структуры, содержащей триазольное кольцо. В некоторых вариантах реализации аналоги нуклеотидов включают 3'-О-пропаргил-дНТФ, где Н выбран из группы, состоящей из А, С, G, Т и U. В некоторых вариантах реализации структуру, содержащую триазольное кольцо, применяют в последующих ферментативных реакциях, таких как полимеразная цепная реакция. В некоторых вариантах реализации способ включает получение стандартных нуклеотидов во время того же этапа, на котором получают аналоги нуклеотидов.
В некоторых конкретных вариантах реализации, включающих использование полимеразы для включения аналогов нуклеотидов в нуклеиновую кислоту (например, ПЦР, достройка праймера, секвенирование ДНК (например, NGS), достройка цепи на одно основание и т.д.), полимераза представляет собой полимеразу, полученную, происходящую, выделенную, клонированную и т.д. из видов Thermococcus (например, организм таксономической линии Archaea; Euryarchaeota; Thermococci; Thermococcales; Thermococcaceae; Thermococcus). В некоторых вариантах реализации полимеразу получают, извлекают, выделяют, клонируют и т.д. из видов Thermococcus 9°N-7 (см., например, Southworth, et al. (1996) "Cloning of thermostable DNA polymerases from hyperthermophilic marine Archaea with emphasis on Thermococcus sp. 9°N-7 and mutations affecting 3'-5' exonuclease activity" Proc. Natl. Acad. Sci. USA 93: 5281, полное содержание которого включено в настоящее описание посредством ссылки). Нуклеотидная последовательность, кодирующая полимеразу дикого типа Thermococcus sp. 9°N-7, представлена под номером доступа GenBank U47108 (например, ген полимеразы начинается с нуклеотида 40 номера доступа U47108), и аминокислотная последовательность полимеразы дикого типа Thermococcus sp. 9°N-7 представлена под номером доступа GenBank ААА88769.
В некоторых вариантах реализации полимераза содержит замены аминокислот, которые обеспечивают улучшенное встраивание модифицированных субстратов, таких как модифицированные дидезоксинуклеотиды, рибонуклеотиды и ациклонуклеотиды. В некоторых вариантах реализации полимераза содержит замены аминокислот, которые обеспечивают улучшенное встраивание аналогов нуклеотидов, содержащих модифицированные 3'-функциональные группы, таких как 3'-О-пропаргил-дНТФ, описанные в настоящем документе. В некоторых вариантах реализации аминокислотная последовательность полимеразы содержит одну или более замен аминокислот относительно аминокислотной последовательности полимеразы дикого типа Thermococcus sp. 9°N-7, например, замену аспарагиновой кислоты на аланин в положении аминокислоты 141 (D141A), замену глутаминовой кислоты на аланин в положении аминокислоты 143 (Е143А), замену тирозина на валин в положении аминокислоты 409 (Y409V) и/или замену аланина на лейцин в положении аминокислоты 485 (A485L).
В некоторых вариантах реализации полимеразу получают в гетерологичном организме-хозяине, таком как Escherichia coli, который содержит клонированный ген полимеразы Thermococcus sp. 9°N-7, например, содержащий одну или более мутаций (например, D141A, Е143А, Y409V и/или A485L). В некоторых вариантах реализации полимераза представляет собой полимеразу Thermococcus sp. 9°N-7, продаваемую под торговым названием THERMINATOR (например, THERMINATOR II) компанией New England BioLabs (Ипсуич, Массачусетс).
В некоторых вариантах реализации способы получения мутантов полимеразы и скрининга их активности (например, встраивание модифицированных нуклеотидов) описаны, например, в Gardner and Jack (1999) "Determinants of nucleotide sugar recognition in an archaeon DNA polymerase" Nucleic Acids Research 27(12): 2545, полное содержание которого включено в настоящее описание посредством ссылки. В частности, способы получения и идентификации мутантов полимеразы, которые обеспечивают встраивание модифицированных нуклеотидов, предложены, например, Gardner and Jack (2002) "Acyclic and dideoxy terminator preferences denote divergent sugar recognition by archaeon and Taq DNA polymerases" Nucleic Acids Research 30(2): 605, полное содержание которого включено в настоящее описание посредством ссылки. Дополнительные анализы для характеристики встраивания модифицированных нуклеотидов под действием различных полимераз описаны, например, в Ruparel et al. (2005). Proc. Natl. Acad. Sci. USA. 26: 5932; Barnes (1978). J. Mol. Biol. 119: 83; Sanger et al. (1977). Proc. Natl. Acad. Sci. USA. 74: 5463; Haff and Simirnov (1997) Genome Methods 7: 378; и в патенте США №5558991, полное содержание каждого из которых включено в настоящее описание посредством ссылки.
6. Применение
Аналоги нуклеотидов, предложенные согласно настоящему изобретению, находят применение в широком спектре областей применения. Не ограничивающие примеры применения описанных аналогов нуклеотидов включают применение в качестве противовирусных и/или противораковых агентов. В некоторых вариантах реализации аналоги нуклеотидов, предложенные согласно настоящему изобретению, находят применение в диагностической медицинской визуализации, например, в качестве контрастных агентов для применения, например, в МРТ, сканировании методом компьютерной томографии (КТ), рентгенографии, ангиографии (например, венографии, цифровой субтракционной ангиографии (DSA), артериографии), внутривенной урографии, внутривенной пиелографии, миелографии, интервенционной медицине (например, ангиопластике (например, чрескожной транслюминальной ангиопластике), при абляции и/или окклюзии артерий (например, для лечения рака и/или сосудистых нарушений), и установке стентов), артрографии, сиалографии, ретроградной холедохо-панкреатографии, микционной цистографии и т.д. Дополнительное иллюстративное и не ограничивающее применение таких контрастных агентов включает визуализацию in vivo для диагностики у людей, поиск лекарственных средств и разработку лекарственных средств в модельных системах (модели у мышей и т.д.).
В некоторых вариантах реализации олигонуклеотид, содержащий один или более аналогов нуклеотидов, описанных в настоящем документе, находит применение в наноконъюгате (например, содержащем наночастицы, такие как наночастицы диоксида титана, олигонуклеотид (например, содержащий аналог нуклеотида) и/или контрастный агент (например, представляющий собой тяжелый металл контрастный агент, такой как гадолиний)) для применения для визуализации и/или терапии (например, нейтронозахватной терапии рака). См., например, Paunesku et al. Nanomedicine 4(3): 201-7, 2008.
В некоторых вариантах реализации технология находит применение в качестве метки для доставки лекарственного средства, например, для целевой доставки в клетку олигонуклеотида и антисмысловых лекарственных средств (например, малой интерферирующей РНК (siPHK), микроРНК и т.д.). В некоторых вариантах реализации технология находит применение для доставки лекарственных средств, связанных с нуклеиновой кислотой, содержащей аналог нуклеотида, при этом указанная нуклеиновая кислота служит в качестве нацеливающей группы. В некоторых вариантах реализации технология включает применение нацеливающей на клетку группы для направления и/или доставки олигонуклеотида в конкретную клетку, ткань, орган и т.д. Указанная нацеливающая на клетку группа наделяет соединения (например, олигонуклеотид (например, аналог олигонуклеотида) в соответствии с технологией, описанной в настоящем документе, связанный с фрагментом, нацеливающим на клетку/доставляющим лекарственное средство, например, описанным ниже) такими характеристиками, что указанные соединения и/или олигонуклеотиды предпочтительно узнаются, связываются, вводятся, процессируются, активируются и т.д. одним или более целевыми типами клеток по сравнению с одним или более другими нецелевыми типами клеток. Например, эндотелиальные клетки обладают высокой аффинностью к пептидному нацеливающему фрагменту Arg-Gly-Asp (RGD), клетки рака и почек преимущественно взаимодействуют с соединениями, содержащими группу, представляющую собой фолиевую кислоту, иммунные клетки обладают аффинностью к маннозе, и кардиомиоциты обладают аффинностью к пептиду CWLSEAGPVVTVRALRGTGSW (см., например, Biomaterials 31: 8081-8087,2010). Другие нацеливающие/доставляющие группы известны в данной области техники. Соответственно, соединения, содержащие нацеливающую группу, предпочтительно взаимодействуют и поглощаются целевым типом клеток.
В некоторых вариантах реализации соединения содержат пептид RGD. Пептиды RGD содержат от 4 до 30 (например, от 5 до 20 или от 5 до 15) аминокислот и направляют на клетки опухоли (например, эндотелиальным клеткам опухоли). Такие пептиды и агенты, получаемые из них, известны в данной области техники и описаны Beer et al. в Methods Mol. Biol. 680: 183-200 (2011) и в Theranostics 1: 48-57 (2011); Morrison et al. в Theranostics 1: 149-153 (2011); Zhou et al. в Theranostics 1: 58-82 (2011); и Auzzas et al. в Curr. Med. Chem. 17: 1255-1299 (2010).
В некоторых вариантах реализации нацеливающая группа представляет собой фолиевую кислоту, например, для направления на клетки, экспрессирующие рецептор фолата. Рецептор фолата сверхэкспрессируется на клеточных поверхностях раковых клеток человека, например, в раковых опухолях головного мозга, почки, легкого, яичника и молочной железы по сравнению с более низкими уровнями в нормальных клетках (см., например, Sudimack J, et al. 2000 "Targeted drug delivery via the folate receptor" Adv Drug Deliv Rev 41: 147-162).
В некоторых вариантах реализации нацеливающая группа содержит трансферрин, который направляет соединения, например, на макрофаги, эритроидные предшественники в костном мозге и раковые клетки. Когда белок трансферрин встречается с рецептором трансферрина на поверхности клетки, указанный рецептор трансферрина связывается с трансферрином и переносит трансферрин в клетку. Лекарственные средства и другие соединения, и/или группы, связанные с трансферрином, также переносятся в клетку и, в некоторых случаях, вводятся в клетки. В некоторых вариантах реализации группа, представляющая собой трансферрин, направляет соединения согласно технологии на целевую клетку. См., например, Qian et al. (2002) "Targeted drug delivery via the transferrin receptor-mediated endocytosis pathway", Pharmacol. Rev. 54: 561-87; Daniels et al. (2006) "The transferrin receptor part I: Biology and targeting with cytotoxic antibodies for the treatment of cancer", Clin. Immunol. 121: 144-58.
В некоторых вариантах реализации нацеливающая группа содержит пептид VHSPNKK. Данный пептид направляет соединения на клетки, экспрессирующие молекулу адгезии сосудистого эндотелия 1 (VCAM-1), например, на активированные эндотелиальные клетки. Направление на активированные эндотелиальные клетки находит применение, например, в доставке терапевтических агентов в клетки для лечения воспаления и рака. Некоторые клетки меланомы используют VCAM-1 для присоединения к эндотелию, и VCAM-1 участвует в привлечении моноцитов к атеросклеротическим участкам. Соответственно, пептид VHSPNKK находит применение в направлении соединений согласно настоящей технологии на клетки рака (например, меланомы) и атеросклеротические участки.
См., например, Lochmann, et al. (2004) "Drug delivery of oligonucleotides by peptides" Eur. J. Pharmaceutics and Biopharmaceutics 58: 237-251, содержание которого включено в настоящее описание посредством ссылки, в котором рассмотрены нацеливающие группы и клетки, на которые направлены данные группы.
В некоторых вариантах реализации нацеливающая на клетку группа содержит антитело или его производное, или фрагмент. Антитела к клеточноспецифичным молекулам, таким как, например, белки (например, белки клеточной поверхности, мембранные белки, протеогликаны, гликопротеины, пептиды и т.п.); полинуклеотиды (нуклеиновые кислоты, нуклеотиды); липиды (например, фосфолипиды, гликолипиды и т.п.) или их фрагменты, содержащие эпитоп или антиген, специфично распознаваемый антителом, направляют соединения в соответствии с технологией на клетки, экспрессирующие клеточноспецифичные молекулы.
Например, многие антитела и фрагменты антител специфично связывают маркеры, вырабатываемые или связанные с опухолями или инфекционными поражениями, включая вирусные, бактериальные, грибковые и паразитарные инфекции, и антигены и продукты, связанные с такими микроорганизмами (см., например, патенты США №№3927193; 4331647; 4348376; 4361544; 4468457; 4444744; 4460459; 4460561; 4818709; и 4624846, содержание которых включено в настоящее описание посредством ссылки). Кроме того, антитела, которые направляют на инфаркт миокарда, описаны, например, в патенте США №4036945. Антитела, которые направляют на здоровые ткани или органы, описаны, например, в патенте США №4735210. В данной области техники известны антитела к фибрину, а также антитела, которые связываются с атеросклеротической бляшкой и аутореактивными клонами лимфоцитов.
В случае рака (например, рака молочной железы) и его метастазов специфический маркер или маркеры могут быть выбраны из маркеров клеточной поверхности, таких как, например, члены семейства муцинов MUC-типа, рецептор эпителиального фактора роста (EGFR), карциноэмбриональный антиген (СЕА), антиген карциномы человека, антиген фактора роста сосудистого эндотелия (VEGF), ген антигена меланомы (MAGE), антиген семейства, антиген Т/Tn, рецептор гормона, рецепторы факторов роста, антиген, представляющий собой кластер дифференцировки (CD), ген-супрессор опухоли, регулятор клеточного цикла, онкоген, онкогенный рецептор, маркер пролиферации, молекула адгезии, протеиназа, вовлеченная в распад внеклеточного матрикса, фактор, связанный со злокачественной трансформацией, фактор, связанный с апоптозом, антиген карциномы человека, гликопротеиновые антигены, DF3, 4F2, антигены мембран жировых глобул молока (MGFM), антиген СА 15-3 опухоли молочной железы, кальпонин, катепсин, антиген CD 31, ядерный антиген клеточной пролиферации 10 (PC 10) и pS2. В случае других форм рака и их метастазов специфический маркер или маркеры могут быть выбраны из маркеров клеточной поверхности, таких как, например, семейство рецепторов фактора роста сосудистого эндотелия (VEGFR), член семейства карциноэмбриональных антигенов (СЕА), тип антиидиотипических моноклональных антител (mAB), тип имитатора ганглиозида, член антигенов, представляющих собой кластер дифференцировки, член семейства рецепторов эпидермального фактора роста (EGFR), тип молекулы клеточной адгезии, член семейства муцинов MUC-типа, тип ракового антигена (СА), тип матриксной металлопротеиназы, тип гликопротеинового антигена, тип ассоциированного с меланомой антигена (МАА), протеолитический фермент, кальмодулин, член семейства рецепторов фактора некроза опухоли (TNF), тип маркера ангиогенеза, антиген меланомы, узнаваемый Т-клетками (MART), член семейства генов, кодирующих антиген меланомы (MAGE), мембранный простат-специфический антиген (PMSA), антиген мелкоклеточной карциномы легкого (SCLCA), антиген Т/Tn, рецептор гормона, антиген гена-супрессора опухоли, антиген регулятора клеточного цикла, онкогенный антиген, антиген онкогенного рецептора, маркер пролиферации, протеиназа, вовлеченная в распад внеклеточного матрикса, фактор, связанный со злокачественной трансформацией, фактор, связанный с апоптозом, и тип антигена карциномы человека.
Антитело может обладать аффинностью к цели, связанной с заболеванием иммунной системы, такой как, например, белок, цитокин, хемокин, инфекционный организм и т.п. В другом варианте реализации антитело может быть направлено на предварительно определенную цель, связанную с состоянием, связанным с патогеном. Конкретная цель и антитело могут быть специфичны по отношению к, но не ограничиваются им, типу состояния, связанного с патогеном. Патоген определяется как любой вызывающий заболевание агент, такой как, например, бактерия, вирус, микроорганизм, грибок, прион и паразит. Антитело может обладать аффинностью к патогену или веществу, связанному с патогеном. Антитело может обладать аффинностью к клеточному маркеру или маркерам, связанным с состоянием, связанным с патогеном. Указанный маркер или маркеры могут быть выбраны таким образом, чтобы они представляли жизнеспособную цель на инфицированных клетках. В случае состояния, связанного с патогеном, антитело может быть выбрано для направления на сам патоген. В случае бактериального состояния предварительно определенной целью может являться сама бактерия, например, Escherichia coli или Bacillus anthracis. В случае вирусного состояния предварительно определенной целью может являться сам вирус, например, цитомегаловирус (CMV), вирус Эпштейна-Барр (EBV), вирус гепатита, такой как вирус гепатита В, вирус иммунодефицита человека, такой как ВИЧ, ВИЧ-1 или ВИЧ-2, или вирус герпеса, такой как вирус герпеса 6. В случае паразитарного состояния предварительно определенной целью может являться сам паразит, например, Trypanosoma cruzi, кинетопластида, Schistosoma mansoni, Schistosoma japonicum или Schistosoma brucei. В случае грибкового состояния предварительно определенной целью может являться сам грибок, например, Aspergillus, Candida, Cryptococcus neoformans или Rhizomucor.
В другом варианте реализации антитело может быть направлено на предварительно определенную цель, связанную с нежелательной целью. Указанная конкретная цель и антитело могут быть специфичны по отношению к, но не ограничиваются им, типу нежелательной цели. Нежелательная цель представляет собой цель, которая может быть связана с заболеванием или нежелательным состоянием, но также присутствует в нормальном состоянии. Например, цель может присутствовать в повышенных концентрациях или иным образом изменяться при заболевании или нежелательном состоянии. Антитело может обладать аффинностью к нежелательной цели или к биологическим молекулярным путям, связанным с нежелательной целью. Антитело может обладать аффинностью к клеточному маркеру или маркерам, связанным с нежелательной целью. В случае нежелательной цели выбор предварительно определенной цели может иметь важное значение для терапии с применением соединений в соответствии с настоящей технологией (например, лекарственных средств и/или терапевтических групп). Антитело может быть выбрано для направления на биологический объект, связанный с заболеванием или нежелательным состоянием. В случае артериосклероза предварительно определенной целью может являться, например, аполипопротеин В липопротеина низкой плотности (ЛНП). В случае ожирения предварительно определенный маркер или маркеры могут быть выбраны из маркеров клеточной поверхности, таких как, например, один из: рецептора желудочного ингибиторного полипептида и антигена CD36. Другой нежелательной предварительно определенной целью может являться свернувшаяся кровь. В другом варианте реализации антитело может быть направлено на предварительно определенную цель, связанную с реакцией на орган, трансплантированный пациенту. Конкретная цель и антитело могут быть специфичны по отношению к, но не ограничиваются им, типу органа-трансплантата. Антитело может обладать аффинностью к биологической молекуле, связанной с реакцией на орган-трансплантат. Антитело может обладать аффинностью к клеточному маркеру или маркерам, связанным с реакцией на орган-трансплантат. Указанный маркер или маркеры могут быть выбраны таким образом, чтобы они представляли жизнеспособную цель на Т-клетках или В-клетках иммунной системы. В другом варианте реализации антитело может быть направлено на предварительно определенную цель, связанную с токсином у пациента. Токсин определяется как любой яд, вырабатываемый организмом, включая, но не ограничиваясь ими, бактериальные токсины, растительные токсины, токсин насекомых, токсины животного происхождения и искусственные токсины. Конкретная цель и антитело могут быть специфичны по отношению к, но не ограничиваются им, типу токсина. Антитело может обладать аффинностью к токсину или биологической молекуле, связанной с реакцией на токсин. Антитело может обладать аффинностью к клеточному маркеру или маркерам, связанным с реакцией на токсин. В другом варианте реализации антитело может быть направлено на предварительно определенную цель, связанную с заболеванием, связанным с гормонами. Конкретная цель и антитело могут быть специфичны по отношению к, но не ограничиваются им, конкретному гормональному заболеванию. Антитело может обладать аффинностью к гормону или биологической молекуле, связанной с путем гормона. Антитело может обладать аффинностью к клеточному маркеру или маркерам, связанным с гормональным заболеванием. В другом варианте реализации антитело может быть направлено на предварительно определенную цель, связанную с тканью, пораженной нераковым заболеванием. Конкретная цель и антитело могут быть специфичны по отношению к, но не ограничиваются ей, конкретной ткани, пораженной нераковым заболеванием, такой как связанные с нераковым заболеванием отложения и предшествующие отложения. Антитело может обладать аффинностью к биологической молекуле, связанной с тканью, пораженной нераковым заболеванием. Антитело может обладать аффинностью к клеточному маркеру или маркерам, связанным с тканью, пораженной нераковым заболеванием. В другом варианте реализации антитело может быть направлено на белковоподобный патоген. Конкретная цель и антитело могут быть специфичны по отношению к, но не ограничиваются им, конкретному белковоподобному патогену. Антитело может обладать аффинностью к белковоподобному патогену или биологической молекуле, связанной с указанным белковоподобным патогеном. Антитело может обладать аффинностью к клеточному маркеру или маркерам, связанным с белковоподобным патогеном. В случае прионных заболеваний, также известных как трансмиссивные губкообразные энцефалопатии, предварительно определенной целью может являться, например, прионный белок 3F4.
Перечень целей, клеточноспецифичных маркеров (например, антигены для направления на них молекулы антитела), антител и показаний, связанных с данными целями, клеточноспецифичными маркерами и антигенами/антителами, см., например, в публикации заявки на патент США №20050090732 (в частности, таблице I), содержание которой включено в настоящее описание посредством ссылки.
В некоторых вариантах реализации технология находит применение в визуализации, например, для гибридизации in situ (ISH). В некоторых вариантах реализации аналоги нуклеотидов, предложенные согласно настоящему изобретению, находят применение в нуклеиновых кислотах, которые представляют собой гибридизационные зонды для ISH и флуоресцентной гибридизации in situ (FISH). В некоторых вариантах реализации аналоги нуклеотидов находят применение непосредственно в ISH и/или в областях иммуногистохимии без использования вторичных детектирующих реагентов.
7. Фармацевтические составы
В некоторых вариантах реализации аналоги нуклеотидов, олигонуклеотиды, содержащие аналог нуклеотида, и т.д. представлены в фармацевтическом составе для введения субъекту. В целом, предполагается, что соединения (например, аналоги нуклеотидов, олигонуклеотиды, содержащие аналог нуклеотида, конъюгаты аналогов нуклеотидов и/или олигонуклеотидов, содержащих аналог нуклеотида, и т.д.), связанные с технологией, представлены в форме для введения млекопитающему и, в особенности, человеку с состоянием, которое отвечает на введение таких соединений. Следовательно, когда предусмотренные соединения вводят в фармакологической композиции, предполагается, что указанные предусмотренные соединения получены в смеси с фармацевтически приемлемым носителем. Например, предусмотренные соединения могут быть введены перорально в виде фармакологически приемлемых солей или внутривенно в физиологическом растворе (например, забуференном до рН от примерно 7,2 до 7,5). Для этой цели могут быть использованы стандартные буферы, такие как фосфаты, бикарбонаты или цитраты. Конечно, специалист в данной области техники может модифицировать составы в рамках идей настоящего описания с получением многочисленных составов для конкретного пути введения. В частности, предусмотренные соединения можно модифицировать для придания им большей растворимости в воде или другом носителе и это, например, может быть легко осуществлено с помощью незначительных модификаций (образование солей, этерификация и т.д.), которые находятся в рамках компетенции специалиста в данной области техники. Модификация пути введения и режима дозирования конкретного соединения для управления фармакокинетикой соединений согласно настоящему изобретению для достижения максимального полезного эффекта у пациента также находится в рамках компетенции специалиста в данной области техники.
В некоторых фармацевтических лекарственных формах могут быть получены пролекарственные формы предусмотренных соединений для различных целей, включая снижение токсичности, повышение специфичности к органу или целевой клетке и т.д. Среди различных пролекарственных форм ацилированные (ацетилированные или другие) производные, сложные пиридиновые эфиры и различные солевые формы соединений согласно настоящему изобретению являются предпочтительными. Специалисту в данной области техники известно как модифицировать соединения согласно настоящему изобретению для получения пролекарственных форм для облегчения доставки активных соединений в целевой участок в организме-хозяине или у пациента. Специалист в данной области техники также сможет воспользоваться преимуществом благоприятных фармакокинетических параметров пролекарственных форм при необходимости для доставки соединений согласно настоящему изобретению в целевой участок в организме-хозяине или у пациента для максимального усиления предполагаемого действия соединения. Подобным образом, следует понимать, что предусмотренные соединения могут также метаболизироваться в биологически активную форму и, следовательно, предусмотрены, в частности, все метаболиты соединений, описанных в настоящем документе. Кроме того, предусмотренные соединения (и их комбинации) могут быть введены в комбинации с другими агентами.
Что касается введения субъекту, предполагается, что соединения вводят в фармацевтически эффективном количестве. Специалисту в данной области техники известно, что фармацевтически эффективное количество варьируется в зависимости от применяемого терапевтического агента, возраста, состояния и пола субъекта, и от степени заболевания у субъекта. В целом, доза не должна быть такой высокой, чтобы вызывать нежелательные побочные эффекты, такие как синдромы повышенной вязкости крови, отек легких, застойная сердечная недостаточность и т.п. Доза может быть также скорректирована лечащим врачом или ветеринаром для достижения желаемой терапевтической цели.
В настоящем описании фактическое количество, включенное в термин «фармацевтически эффективное количество», будет зависеть от пути введения, типа вылечиваемого субъекта и физических характеристик конкретного рассматриваемого субъекта. Эти факторы и их взаимосвязь для определения данного количества хорошо известны практикующему специалисту в области медицины, ветеринарии и других родственных областях. Данное количество и способ введения могут быть подобраны для максимального повышения эффективности, но будут зависеть от таких факторов, как масса тела, диета, сопутствующая лекарственная терапия, и других факторов, известных специалисту в данной области техники.
Фармацевтические композиции предпочтительно содержат одно или более соединений согласно настоящей технологии, связанных с одним или более фармацевтически приемлемыми носителями, разбавителями или вспомогательными веществами. Фармацевтически приемлемые носители известны в данной области техники, например, такие как описаны, например, в Remingtons Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro edit. 1985), содержание которого явным образом включено в настоящее описание посредством ссылки для всех целей.
Соответственно, в некоторых вариантах реализации иммунотерапевтический агент представлен в виде таблетки, капсулы, таблетки с замедленным высвобождением, капсулы с замедленным высвобождением; гранулы с замедленным высвобождением; таблетки с медленным высвобождением, капсулы с медленным высвобождением; гранулы с медленным высвобождением; таблетки с быстрым высвобождением, капсулы с быстрым высвобождением; гранулы с быстрым высвобождением; сублингвальной таблетки; гелевой капсулы; микрокапсулы; состава для трансдермальной доставки; трансдермального геля; трансдермального пластыря; стерильного раствора; стерильного раствора, приготовленного для применения для внутримышечной или подкожной инъекции, для применения для инъекции напрямую в целевой участок или для внутривенного введения; раствора, приготовленного для ректального введения; раствора, приготовленного для введения через желудочный зонд для кормления или дуоденальный зонд для кормления; суппозитория для ректального введения; жидкости для перорального потребления, полученной в форме раствора или эликсира; крема для топического применения; геля; лосьона; настойки; сиропа; эмульсии; или суспензии.
В некоторых вариантах реализации состав с замедленным высвобождением представляет собой механизм пролонгированного высвобождения, пролонгированного действия, длительного высвобождения, контролируемого высвобождения, модифицированного высвобождения или непрерывного высвобождения, например, композицию изготавливают для растворения быстро, медленно или с любой подходящей скоростью высвобождения соединения со временем.
В некоторых вариантах реализации композиции изготовлены таким образом, что активный ингредиент заключен в матрицу нерастворимого вещества (например, различные акриловые смолы, хитин), вследствие чего растворяющееся соединение «выбирается» через отверстия в матрице, например, путем диффузии. В некоторых вариантах реализации состав заключен в таблетку на основе полимера с проделанным лазером отверстием на одной стороне и пористой мембраной на другой стороне. Кислоты желудка проталкиваются через пористую мембрану и тем самым выталкивают лекарственное средство через проделанное лазером отверстие. Со временем вся доза лекарственного средства высвобождается в систему, в то время как полимерная емкость остается интактной и позже выводится путем обычного пищеварения. В некоторых составах с пролонгированным высвобождением соединение растворяется в матрице, и матрица физически набухает с образованием геля, что позволяет соединению «выйти» через внешнюю поверхность геля. В некоторых вариантах реализации составы представлены в форме микрокапсул, например, которую используют в некоторых вариантах реализации для получения сложного профиля растворения. Например, путем покрытия соединением инертного ядра и нанесения на него нерастворимых веществ с образованием микросферы некоторые варианты реализации позволяют получить более согласованные и воспроизводимые скорости растворения в удобном формате, который объединяют в конкретных вариантах реализации с другими фармацевтическими ингредиентами с контролируемым (например, немедленным) высвобождением, например, с получением составной гелевой капсулы.
В некоторых вариантах реализации фармацевтические препараты и/или составы согласно технологии представлены в виде частиц. В настоящем описании термин «частицы» в фармацевтическом контексте означает нано- или микрочастицы (или в некоторых случаях более крупные), которые могут состоять полностью или частично из соединений, описанных в настоящем документе. Частицы могут содержать препараты и/или составы в ядре, на которое нанесено покрытие, включая, но не ограничиваясь им, энтеросолюбильное покрытие. Препараты и/или составы также могут быть распределены по всей частице. Препараты и/или составы также могут быть адсорбированы частицами. Частицы могут демонстрировать кинетику высвобождения любого порядка, включая высвобождение нулевого порядка, высвобождение первого порядка, высвобождение второго порядка, отсроченное высвобождение, замедленное высвобождение, немедленное высвобождение и их любую комбинацию, и т.д. В дополнение к препаратам и/или составам частицы могут содержать любое из тех веществ, которые обычно используют в фармации и медицине, включая, но не ограничиваясь ими, разлагаемые, неразлагаемые, биоразлагаемые или небиоразлагаемые вещества или их комбинации. Частицы могут представлять собой микрокапсулы, содержащие состав в растворе или в полутвердом состоянии. Частицы могут быть практически любой формы.
Как небиоразлагаемые, так и биоразлагаемые полимерные вещества могут быть использованы для получения частиц для доставки препаратов и/или составов. Такие полимеры могут представлять собой природные или синтетические полимеры. Полимер выбирают исходя из периода времени, на протяжении которого необходимо высвобождение. Биоадгезивные полимеры, представляющие особый интерес, включают биоразлагаемые гидрогели, описанные Н.S. Sawhney, С.P. Pathak and J.A. Hubell в Macromolecules, (1993) 26: 581-587, содержание которого включено в настоящее описание посредством ссылки. Они включают полигиалуроновые кислоты, казеин, желатин, глютин, полиангидриды, полиакриловую кислоту, альгинат, хитозан, поли(метилметакрилаты), поли(этилметакрилаты), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат).
Технология также обеспечивает способы получения стабильных фармацевтических препаратов, содержащих водные растворы соединений или их солей для ингибирования образования продуктов распада. Получают раствор, содержащий соединение или его соли и по меньшей мере один ингибирующий агент. Указанный раствор обрабатывают в соответствии с по меньшей мере одной методикой стерилизации до и/или после окончательного помещения раствора в герметичную емкость с получением стабильного фармацевтического препарата. Составы согласно настоящему изобретению могут быть получены различными способами, известными в данной области техники, при условии, что состав является по существу гомогенным, например, фармацевтический препарат распределен в составе по существу равномерно. Такое равномерное распределение облегчает контроль над высвобождением лекарственного средства из состава.
В некоторых вариантах реализации соединение включают в состав совместно с буферным агентом. Указанный буферный агент может представлять собой любой фармацевтически приемлемый буферный агент. Буферные системы включают цитратные буферы, ацетатные буферы, боратные буферы и фосфатные буферы. Примеры буферов включают лимонную кислоту, цитрат натрия, ацетат натрия, уксусную кислоту, фосфат натрия и фосфорную кислоту, аскорбат натрия, винную кислоту, малеиновую кислоту, глицин, лактат натрия, молочную кислоту, аскорбиновую кислоту, имидазол, бикарбонат натрия и угольную кислоту, сукцинат натрия и янтарную кислоту, гистидин и бензоат натрия, и бензойную кислоту.
В некоторых вариантах реализации соединение включают в состав совместно с хелатирующим агентом. Указанный хелатирующий агент может представлять собой любой фармацевтически приемлемый хелатирующий агент. Хелатирующие агенты включают этилендиаминтетрауксусную кислоту (синонимом также является EDTA, эдетовая кислота, версеновая кислота и секвестрен) и производные EDTA, такие как дикалия эдетат, динатрия эдетат, динатрия кальция эдетат, натрия эдетат, тринатрия эдетат и калия эдетат. Другие хелатирующие агенты включают лимонную кислоту и ее производные. Лимонная кислота также известна как моногидрат лимонной кислоты. Производные лимонной кислоты включают безводную лимонную кислоту и тринатрия цитрата дигидрат. Другие хелатирующие агенты включают ниацинамид и его производные, и дезоксихолат натрия и его производные.
В некоторых вариантах реализации соединение включают в состав совместно с антиоксидантом. Указанный антиоксидант может представлять собой любой фармацевтически приемлемый антиоксидант. Антиоксиданты хорошо известны специалисту в данной области техники и включают такие вещества, как аскорбиновая кислота, производные аскорбиновой кислоты (например, аскорбилпальмитат, аскорбилстеарат, натрия аскорбат, кальция аскорбат и т.д.), бутилированный гидроксианизол, бутилированный гидрокситолуол, алкилгаллат, натрия метабисульфат, натрия бисульфат, натрия дитионит, натриевая соль тиогликолевой кислоты, натрия формальдегидсульфоксилат, токоферол и его производные (d-альфа-токоферол, d-альфа-токоферола ацетат, d1-альфа-токоферола ацетат, d-альфа-токоферола сукцинат, бета-токоферол, дельта-токоферол, гамма-токоферол и d-альфа-токоферола полиоксиэтиленгликоль 1000 сукцинат), монотиоглицерин и сульфит натрия. Такие вещества, как правило, добавляют в диапазонах от 0,01 до 2,0%.
В некоторых вариантах реализации соединение включают в состав совместно с криопротектором. Указанный криопротектор может представлять собой любой фармацевтически приемлемый криопротектор. Распространенные криопротекторы включают гистидин, полиэтиленгликоль, поливинилпирролидин, лактозу, сахарозу, маннитол и полиолы.
В некоторых вариантах реализации соединение включают в состав совместно с изотоническим агентом. Указанный изотонический агент может представлять собой любой фармацевтически приемлемый изотонический агент. В данной области техники этот термин и термин «изоосмотический агент» являются взаимозаменяемыми, и известны как соединение, которое добавляют к фармацевтическому препарату для повышения осмотического давления, например, в некоторых вариантах реализации до давления, соответствующего значению для 0,9% раствора хлорида натрия, который изоосмотичен внеклеточным жидкостям человека, таким как плазма. Предпочтительные изотонические агенты представляют собой хлорид натрия, маннитол, сорбитол, лактозу, декстрозу и глицерин.
Фармацевтический препарат может содержать консервант. Распространенные консерванты включают консерванты, выбранные из группы, состоящей из хлорбутанола, парабенов, тимеросала, бензилового спирта и фенола. Подходящие консерванты включают, но не ограничиваются ими: хлорбутанол (0,3-0,9% масс./об.), парабены (0,01-5,0%), тимеросал (0,004-0,2%), бензиловый спирт (0,5-5%), фенол (0,1-1,0%) и т.п.
В некоторых вариантах реализации соединение включают в состав совместно с увлажнителем для обеспечения приятных вкусовых ощущений при пероральном применении. Увлажнители, известные в данной области техники, включают холестерин, жирные кислоты, глицерин, лауриновую кислоту, стеарат магния, пентаэритрит и пропиленгликоль.
В некоторых вариантах реализации в составы включают эмульгатор, например, для обеспечения полного растворения всех вспомогательных веществ, в особенности гидрофобных компонентов, таких как бензиловый спирт. В данной области техники известно множество эмульгаторов, например, полисорбат 60.
Для некоторых вариантов реализации, связанных с пероральным введением, может быть желательным добавление фармацевтически приемлемого ароматизатора и/или подсластителя. В качестве подсластителей подходящими являются такие соединения, как сахарин, глицерин, простой сироп и сорбитол.
8. Введение, лечение и дозирование
В некоторых вариантах реализации технология относится к способам введения дозы аналога нуклеотида, олигонуклеотида, содержащего аналог нуклеотида, или их конъюгата (например, содержащего нацеливающую группу, контрастный агент, маркер, метку и т.д.) субъекту. В некоторых вариантах реализации соединение, его производное или его фармацевтически приемлемую соль вводят в фармацевтически эффективном количестве. В некоторых вариантах реализации соединение, его производное или его фармацевтически приемлемую соль вводят в терапевтически эффективной дозе.
Величину и частоту введения дозы выбирают таким образом, чтобы создать эффективный уровень соединения по существу при отсутствии неблагоприятных эффектов. При введении перорально или внутривенно доза соединения или родственных ему соединений, как правило, будет находиться в диапазоне от 0,001 до 10000 мг/кг/сутки или доза (например, от 0,01 до 1000 мг/кг/сутки или доза; от 0,1 до 100 мг/кг/сутки или доза).
Способы введения фармацевтически эффективного количества включают, без ограничения, введение в парентеральных, пероральных, интраперитонеальных, интраназальных, топических, сублингвальных, ректальных и вагинальных формах. Парентеральные пути введения включают, например, подкожные, внутривенные, внутримышечные, интрастернальные пути инъекций и инфузий. В некоторых вариантах реализации соединение, его производное или его фармацевтически приемлемую соль вводят перорально.
В некоторых вариантах реализации субъекту вводят однократную дозу соединения или родственного ему соединения. В других вариантах реализации вводят несколько доз в два или более моментов времени, разделенных часами, днями, неделями и т.д. В некоторых вариантах реализации соединения вводят в течение длительного периода времени (например, постоянно), например, в течение периода, составляющего месяцы или годы (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более месяцев или лет). В таких вариантах реализации соединения можно вводить на регулярной плановой основе (например, каждый день, каждую неделю и т.д.) на протяжении длительного периода.
Технология также относится к способам лечения субъекта лекарственным средством, подходящим для заболевания субъекта. В соответствии с другим аспектом технологии предложен способ лечения субъекта, нуждающегося в таком лечении, эффективным количеством соединения или его соли. Указанный способ включает введение субъекту эффективного количества соединения или его соли в любом из фармацевтических препаратов, описанных выше, подробно описанных в настоящем документе и/или приведенных в формуле изобретения. Субъект может представлять собой любой субъект, нуждающийся в таком лечении. В приведенном выше описании технология связана с соединением или его солями. Такие соли включают, но не ограничиваются ими, бромидные соли, хлоридные соли, иодидные соли, карбонатные соли и сульфатные соли. Однако следует понимать, что указанное соединение является членом класса соединений, и технология охватывает фармацевтические препараты, способы и наборы, содержащие родственные производные в пределах данного класса. Таким образом, другой аспект технологии охватывает вышеприведенное краткое описание, но понимается в каждом аспекте так, словно любое такое производное может быть использовано во всех случаях, когда встречается «соединение».
В некоторых вариантах реализации субъекта тестируют для оценки наличия, отсутствия или уровня заболевания и/или состояния. Такое тестирование выполняют, например, путем анализа или измерения биомаркера, метаболита, физического симптома, признака и т.д. для определения риска или наличия заболевания или состояния. В некоторых вариантах реализации субъекта лечат соединением на основе результата теста. В некоторых вариантах реализации субъекта лечат, получают образец и измеряют уровень детектируемого агента, а затем субъекта снова лечат исходя из измеренного уровня детектируемого агента. В некоторых вариантах реализации субъекта лечат, получают образец и измеряют уровень детектируемого агента, субъекта снова лечат исходя из измеренного уровня детектируемого агента, а затем получают еще один образец и измеряют уровень детектируемого агента. В некоторых вариантах реализации также используют другие тесты (например, не на основе измерения уровня детектируемого агента) на различных стадиях, например, перед первоначальным лечением в качестве ориентира для первоначальной дозы. В некоторых вариантах реализации последующее лечение корректируют исходя из результата теста, например, изменяют величину дозы, схему применения, идентичность лекарственного средства и т.д. В некоторых вариантах реализации пациента тестируют, лечат, а затем снова тестируют для контроля ответа на терапию и/или изменения терапии. В некоторых вариантах реализации циклы тестирования и лечения можно осуществлять, не ограничиваясь схемой тестирования и лечения, периодичностью или продолжительностью интервала между каждой фазой тестирования и лечения. Таким образом, технология предусматривает различные комбинации тестирования и лечения без ограничения, например, тестирование/лечение, лечение/тестирование, тестирование/лечение/тестирование, лечение/тестирование/лечение, тестирование/лечение/тестирование/лечение, тестирование/лечение/тестирование/лечение/тестирование, тестирование/лечение/тестирование/тестирование/лечение/лечение/лечение/тестирование, лечение/лечение/тестирование/лечение, тестирование/лечение/лечение/тестирование/лечение/лечение и т.д.
Хотя настоящее изобретение относится к некоторым проиллюстрированным вариантам реализации, следует понимать, что данные варианты реализации представлены в качестве примера, а не с целью ограничения.
Примеры
Пример 1 - получение характеристик аналогов нуклеотидов
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, аналоги нуклеотидов характеризовали химико-аналитическими способами. В частности, 3'-О-пропаргил-дАТФ, 3'-О-пропаргил-дЦТФ, 3'-О-пропаргил-дГТФ и 3'-О-пропаргил-дТТФ синтезировали в соответствии со схемами синтеза, описанными в настоящем документе, и характеризовали путем 1Н ЯМР, 31Р ЯМР, анионообменной ВЭЖХ и масс-спектрометрии высокого разрешения. Аналитическое тестирование демонстрировало успешность синтеза и очистки (фигуры X-Y).
Пример 2 - анализы для идентификации совместимых полимераз
В некоторых вариантах реализации технология связана с включением аналогов нуклеотидов в нуклеиновую кислоту. Соответственно, технология обеспечивает анализы для идентификации полимераз, которые узнают аналоги нуклеотидов (например, 3'-О-пропаргил-дНТФ) в качестве субстратов. Например, в некоторых типичных анализах и/или вариантах реализации совместимые полимеразы идентифицировали путем полимеразной реакции достройки (например, реакции достройки одного основания). См., например, Ausebel et al. (eds.), Current Protocols in Molecular Biology. New York: John Wiley & Sons, Inc; Sambrook et al. (1989). Molecular Cloning: A Laboratory Manual. (2nd ed.). Cold Spring Harbor: Cold Spring Harbor Laboratory Press.
Например, идентификация совместимых полимераз включала получение полимеразы для тестирования и реакционного буфера, подходящего для указанной полимеразы. В случае полимераз, получаемых от коммерческого поставщика (например, New England BioLabs, United States Biologicals, Promega, Invitrogen, Worthington, Sigma-Aldrich, Fluka, Finnzymes, Roche, 5 Prime, Qiagen, KAPA Biosystems, Thermo Scientific, Agilent, Life Technologies и т.д.), полимеразу часто поставляли с подходящим реакционным буфером. Типичный реакционный буфер содержал, например, совместимый буфер (например, 20 мМ Трис-HCl), соль (например, 10 мМ KCl), источник магния или марганца (например, 2 мМ MgSO4; 2 мМ MnCl2 и т.д.), детергент (например, 0,1% ТРИТОН Х-100), и имеет подходящее значение рН (например, рН приблизительно 8,8 при приблизительно 25°С). Активность некоторых полимераз повышалась в присутствии других соединений, таких как сульфатные и другие соли (например, 10 мМ (NH4)2SO4). Реакционные смеси для полимеразных реакций достройки, как правило, тестировали с использованием Mg2+ или Mn2+ в качестве кофактора фермента.
Полимеразы тестировали путем получения в реакционной смеси ДНК-матрицы, ДНК-праймера, комплементарного ДНК-матрице, и одного или более нуклеотидов и/или аналогов нуклеотидов. Типичные концентрации матрицы и праймера составляли приблизительно от 1 до 100 нМ, и типичные концентрации нуклеотидов и/или аналогов нуклеотидов составляли приблизительно от 1 до 125 мкМ (например, от 1 до 125 мкМ для каждого нуклеотида и/или аналога нуклеотида, и/или общая концентрация всех нуклеотидов и/или аналогов нуклеотидов составляла от 1 до 500 мкМ). Матрицы и праймеры синтезировали способами, известными в данной области техники (например, с использованием твердых носителей и фосфорамидитной химии), и были доступны от нескольких коммерческих поставщиков (например, Integrated DNA Technologies, Коралвилл, Айова).
Для тестирования полимераз, как правило, получали подвергнутый предварительному отжигу праймер/матрицу. Например, праймер, как правило, ресуспендировали в подходящем буфере (например, Трис-EDTA, рН 8,0) в подходящей концентрации, например, в концентрации от 1 до 500 мкМ (например, 100 мкМ), и матрицу, как правило, ресуспендировали в подходящем буфере (например, Трис-EDTA, рН 8,0) в подходящей концентрации, например, в концентрации от 1 до 500 мкМ (например, 100 мкМ). Затем, подвергнутый предварительному отжигу праймер/матрицу получали путем смешивания приблизительно равных количеств праймера и матрицы в буфере для отжига. Например, подвергнутый предварительному отжигу праймер/матрицу получали путем смешивания приблизительно 100 мкл приблизительно 1-500 мкМ (например, 100 мкМ) раствора праймера с приблизительно 100 мкл приблизительно 1-500 мкМ (например, 100 мкМ) раствора матрицы в приблизительно 800 мкл буфера для отжига (например, 200 мМ Трис, 100 мМ хлорид калия и 0,1 мМ EDTA, рН 8,45) с получением миллилитра раствора праймера/матрицы. Специалист в данной области техники может определить объемы и концентрации, подходящие для конкретного анализа. Затем аликвоту (например, 100 мкл) раствора праймера/матрицы нагревали с денатурацией внутримолекулярных и/или межмолекулярных вторичных структур (например, путем нагревания при приблизительно 85°С-97°С (например, при приблизительно 95°С), например, в течение от 1 до 5 минут (например, 2 минут). Затем указанную аликвоту охлаждали до температуры отжига (например, от 20°С до 60°С (например, 25°С)) и инкубировали в течение от 1 до 10 минут (например, в течение приблизительно 5 минут) с осуществлением отжига праймера и матрицы с образованием праймера/матрицы. Указанный праймер/матрица может быть разведен в подходящем субстратном буфере для разведения (например, 20 мМ Трис, 10 мМ хлорид калия и 0,01 мМ EDTA, рН 8,45; например, разведение буфера для отжига, описанного выше, 1 к 10) для хранения. Например, праймер/матрицу можно развести до конечной концентрации 0,01 мкМ (например, с получением 10× исходного раствора) в субстратном буфере для разведения, поделить на аликвоты и хранить при -20°С.
В данной области техники известны пакеты программного обеспечения, которые помогают создавать матрицы и праймеры для данных анализов. Кроме того, для расчета температур денатурации (например, температур плавления (Tm)) и отжига доступно несколько уравнений. В стандартных источниках описано простое определение значения Tm, которое может быть рассчитано по уравнению: Tm=81,5+0,41 * (% G+C), когда нуклеиновая кислота находится в водном растворе при 1 М NaCl (см., например, Anderson and Young, Quantitative Filter Hybridization, in Nucleic Acid Hybridization (1985)). Другие источники (например, Allawi and SantaLucia, Biochemistry 36: 10581-94 (1997)) содержат более сложные вычисления, которые учитывают характеристики структуры, окружающей среды и последовательности.
Праймер и матрицу или подвергнутую предварительному отжигу матрицу использовали для тестирования полимеразы. Например, анализы достройки праймера проводили с использованием от 1 до 100 нМ (например, 50 нМ) праймера/матрицы, дНТФ (например, смеси 1-125 мкМ каждого дАТФ, дЦТФ, дГТФ, дТТФ, модифицированного дАТФ (например, 3'-О-пропаргил-дАТФ), модифицированного дЦТФ (например, 3'-О-пропаргил-дЦТФ), модифицированного дГТФ (например, 3'-О-пропаргил-дГТФ) и/или модифицированного дТТФ (например, 3'-О-пропаргил-дТТФ)) и полимеразы (например, от 1 до 100 ед. термостабильной/термофильной полимеразы или мезофильной полимеразы) в конечном объеме, составляющем приблизительно от 1 до 100 мкл (например, от 10 до 20 мкл), содержащем подходящий буфер (например, полученный от коммерческого поставщика полимеразы или типичный реакционный буфер, описанный выше). В некоторых анализах реакционная смесь содержала от 1 до 50 ед. (например, 1 ед.) термостабильной пирофосфатазы.
В некоторых анализах использовали смесь дНТФ и модифицированных дНТФ. Например, с помощью некоторых анализов тестировали встраивание одного основания в нуклеиновую кислоту (например, в анализе достройки одного основания). В таком анализе праймер гибридизовали с комплементарной областью в матрице с образованием дуплекса так, что терминальный 3'-конец праймера непосредственно примыкал к партнеру по спариванию оснований тестируемого аналога нуклеотида. В успешном тестировании тестируемая потенциальная полимераза встраивала один аналог нуклеотида на 3'-конце праймера. Доступно множество подходов к детектированию встраивания аналога нуклеотида, в том числе флуоресцентная маркировка, введение массовой метки для масс-спектрометрии, измерение активности фермента с использованием белковой группы и маркировка изотопами.
В частности, анализ позволяет тестировать встраивание модифицированного нуклеотида (например, 3'-О-пропаргил-дНТФ) в 3'-конец праймера, направляемое матрицей. В таком анализе реакционная смесь может содержать три дНТФ и один конкретный модифицированный дНТФ, который присоединяется к 3'-концу праймера под управлением матрицей. Некоторые анализы включали использование четырех отдельных реакционных смесей, содержащих каждый из четырех праймеров, подвергнутых отжигу на матрице (например, четыре праймера/матрицы), полученных таким образом, чтобы каждый из четырех модифицированных нуклеотидов присоединялся к 3'-концу праймера под управлением матрицы. Например, в некоторых вариантах реализации получали праймер/матрицу для тестирования встраивания модифицированного дАТФ (например, 3'-О-пропаргил-дАТФ):
где N представляет собой любой нуклеотид, и «|» означает спаривание оснований по принципу комплементарности между типичным праймером (верхняя цепь) и типичной матрицей (нижняя цепь). В некоторых вариантах реализации получали праймер/матрицу для тестирования встраивания модифицированного дЦТФ (например, 3'-О-пропаргил-дЦТФ):
где N представляет собой любой нуклеотид, и «|» означает спаривание оснований по принципу комплементарности между типичным праймером (верхняя цепь) и типичной матрицей (нижняя цепь). В некоторых вариантах реализации получали праймер/матрицу для тестирования встраивания модифицированного дГТФ (например, 3'-О-пропаргил-дГТФ):
где N представляет собой любой нуклеотид, и «|» означает спаривание оснований по принципу комплементарности между типичным праймером (верхняя цепь) и типичной матрицей (нижняя цепь). В некоторых вариантах реализации получали праймер/матрицу для тестирования встраивания модифицированного дТТФ (например, 3'-О-пропаргил-дТТФ):

где N представляет собой любой нуклеотид, и «|» означает спаривание оснований по принципу комплементарности между типичным праймером (верхняя цепь) и типичной матрицей (нижняя цепь). Праймеры и матрицы могут иметь любую подходящую длину для анализа, и положение достройки одного основания может управляться любым подходящим нуклеотидом матрицы, как правило, в пределах центральной части матрицы.
Полимеразу тестировали в реакционной смеси при температуре, подходящей для полимеразы. Например, мезофильную полимеразу тестировали при температуре от 20°С до 60°С и термофильную полимеразу тестировали при температуре от 80°С до 97°С или выше (например, 100°С или выше). Подходящие температуры указаны в печатных материалах, прилагаемых к коммерчески поставляемым полимеразам; подходящие температуры для другой (например, любой) полимеразы могут быть определены специалистом в данной области техники путем тестирования активности полимеразы в случае стандартных нуклеотидов в диапазоне значений температуры.
В некоторых анализах температуру циклически повторяли между температурой для денатурации нуклеиновых кислот (например, температура плавления), составляющей от приблизительно 85°С до 97°С (например, приблизительно 95°С), в течение от 1 до 5 минут (например, 2 минуты), температурой отжига, составляющей от приблизительно 40°С до 70°С (например, 55°С), в течение от 5 до 60 секунд (например, от 15 до 20 секунд) и температурой достройки, составляющей от приблизительно 60 до 75°С (например, от 70 до 75°С) в течение от 15 до 60 секунд (например, от 20 до 45 секунд), например, на протяжении от 20 до 50 циклов.
Успешное встраивание модифицированного нуклеотида (например, 3'-О-пропаргил-дНТФ) определяли любым количеством способов. В некоторых конкретных анализах количественно определяли размер продукта реакции, чтобы установить был ли присоединен модифицированный нуклеотид (например, 3'-О-пропаргил-дНТФ) к праймеру. В частности, длина продукта, получаемого в случае успешного встраивания, была на одну пару оснований больше, чем известная длина праймера. Праймер можно анализировать в качестве отрицательного контрольного образца для сравнения. Кроме того, может быть оценен полученный путем синтеза положительный контрольный олигонуклеотид, имеющий длину и структуру продукта реакции, ожидаемого в результате успешного встраивания. Для анализа подходит любой способ распознавания нуклеиновых кислот, отличающихся на одно основание, например, гель-электрофорез (например, Agilent Bioanalyzer), масс-спектрометрия, ВЭЖХ и т.д.
Пример 3 - скрининг полимераз
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, проводили эксперименты для идентификации полимераз, способных эффективно встраивать 3'-О-пропаргил-дНТФ в качестве субстратов. В частности, варианты типичных анализов достройки нуклеотидов, описанных в примере 2, использовали для тестирования нескольких ферментов, представляющих собой полимеразу, в том числе тех, которые продаются под торговыми названиями Ampli-Taq (Life Technologies), KAPA HiFi (KAPA Biosystems), KAPA 2G (KAPA Biosystems), ДНК-полимераза Herculase II Fusion (Agilent), ДНК-полимераза PfuUltra II Fusion HS (Agilent), ДНК-полимераза Phire HS II (Thermo Scientific), обратная транскриптаза M-MuLV (NEB), ДНК-полимераза rTth, ДНК-полимераза 9°N (NEB), ДНК-полимераза THERMINATOR I (NEB), ДНК-полимераза THERMINATOR II (NEB), и 5 дополнительных заказных некаталожных полимераз от NEB. Для всех тестируемых полимераз следовали условиям реакции, рекомендуемым коммерческими поставщиками. Тестирования каждой полимеразы проводили с использованием как Mg2+, так и Mn2+ в качестве кофактора в реакционной смеси.
Полученные данные демонстрировали, что полимеразы, полученные из Thermococcus sp.(например, Thermococcus sp. 9°N (например, THERMINATOR I и THERMINATOR II)), встраивали 3'-О-пропаргил-дНТФ, предложенные согласно настоящему изобретению, в нуклеиновую кислоту (таблица 1).

В таблице 1 минус («-») означает, что полимераза не производила детектируемое количество продукта встраивания 3'-О-пропаргил-дНТФ, один плюс («+») означает, что полимераза производила детектируемое количество продукта встраивания 3'-О-пропаргил-дНТФ, и три плюса («+++») означают, что полимераза производила значительное количество продукта встраивания 3'-О-пропаргил-дНТФ. NEB1, NEB2, NEB3, NEB4 и NEB5 означают каждую из пяти тестируемых некоммерческих полимераз от New England BioLabs.
Следует понимать, что анализы (например, описанные в настоящем документе, описанные в иных местах и известные в данной области техники) доступны для идентификации любых полимераз, которые встраивают модифицированные нуклеотиды (например, 3'-О-пропаргил-дНТФ, предложенные согласно настоящему изобретению) в нуклеиновую кислоту. Соответственно, технология не ограничивается применением полимераз Thermococcus sp. 9°N (THERMINATOR I и THERMINATOR II) и предусматривает применение любой подходящей существующей в настоящее время полимеразы или полимеразы, которую еще предстоит обнаружить, которая встраивает модифицированные нуклеотиды (например, 3'-О-пропаргил-дНТФ, предложенные согласно настоящему изобретению) в нуклеиновую кислоту. Эксперименты, описанные в настоящем документе, с применением полимераз Thermococcus sp. 9°N (THERMINATOR II) являются иллюстративными и не ограничивают технологию применением какой-либо конкретной полимеразы.
Пример 4 - включение 3'-О-пропаргил-дНТФ в нуклеиновую кислоту
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, проводили эксперименты для оценки встраивания 3'-О-пропаргил-дНТФ в нуклеиновую кислоту под действием полимеразы. В частности, проводили эксперименты для оценки точного встраивания 3'-О-пропаргил-дНТФ в нуклеиновую кислоту и для оценки терминирующей активности 3'-О-пропаргил-дНТФ. Для оценки данных характеристик аналогов нуклеотидов, предложенных согласно настоящему изобретению, проводили анализы достройки полимеразой с использованием матричной нуклеиновой кислоты, содержащей последовательность из KRAS человека (например, последовательность экзона 2 и фланкирующие последовательности интрона KRAS), и комплементарного праймера (таблица 2).

В таблице 2 «b» означает модификацию биотином, и «U» означает модификацию дезоксиуридином. Включение праймеров в продукты достройки позволяет получить продукты достройки, содержащие урацил. Урацил подходит, например, для расщепления продукта (например, с использованием реагентов для расщепления урацила) в ряде молекулярно-биологических манипуляций (например, отщепление продукта от твердого носителя).
Для тестирования встраивания 3'-О-пропаргил-дТТФ в нуклеиновую кислоту составляли реакционную смесь для достройки полимеразой, содержащую 20 мМ Трис-HCl, 10 мМ (NH4)SO4, 10 мМ KCl, 2 мМ MnCl2, 0,1% Тритон Х-100, 200 пмоль 3'-О-пропаргил-дТТФ, 6,25 пмоль праймера R_ke2_trP1_T_bio (SEQ ID NO: 2) и 2 единицы ДНК-полимеразы Therminator II (New England BioLabs), в конечном объеме реакционной смеси, составляющем 25 мкл. Объем 0,5 пмоль матрицы KRAS (SEQ ID NO: 1) использовали в качестве матрицы (таблица 2). Полимеразную реакцию достройки проводили с использованием профиля температурного циклирования, включающего подвергание реакционной смеси воздействию температуры 95°С в течение 2 минут с последующими 35 циклами 95°С в течение 15 секунд, 55°С в течение 25 секунд и 65°С в течение 35 секунд.
После проведения полимеразной реакции достройки 1 мкл реакционной смеси использовали непосредственно для анализа размера нуклеиновой кислоты путем гель-электрофореза (например, с использованием Agilent 2100 Bioanalyzer и High Sensitivity DNA Assay Chip). Данные, полученные в результате анализа размера, демонстрировали присутствие популяции нуклеиновых кислот, имеющих длину, соответствующую длине праймера, используемого в реакции (например, 48 оснований), и популяции нуклеиновых кислот, имеющих длину, соответствующую длине праймера плюс одно основание (например, 49 оснований). Соответственно, полученные данные демонстрировали успешное встраивание 3'-О-пропаргил-дТТФ на 3'-конце праймера. Кроме того, количества указанных двух популяций нуклеиновых кислот были приблизительно равны, что указывает на устойчивое встраивание 3'-О-пропаргил-дТТФ на 3'-конце праймера с образованием продукта достройки.
Проводили дополнительные эксперименты по достройке полимеразой с использованием условий реакции, описанных выше, и заменой 3'-О-пропаргил-дТТФ и праймера R_ke2_trP1_T_bio на 3'-О-пропаргил-дАТФ и праймер R_ke2_trP1_A_bio (SEQ ID NO: 3); 3'-О-пропаргил-дЦТФ и праймер R_ke2_trP1_C_bio (SEQ ID NO: 5); и 3'-О-пропаргил-дГТФ и праймер R_ke2_trP1_G_bio (SEQ ID NO: 4). Данные, полученные в результате данных экспериментов, подобным образом демонстрировали успешное встраивание 3'-О-пропаргил-дАТФ, 3'-О-пропаргил-дЦТФ и 3'-О-пропаргил-дГТФ соответственно на 3'-конце указанных праймеров.
Пример 5 - получение лесенки фрагментов
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, проводили эксперименты для оценки применения аналогов нуклеотидов согласно настоящей технологии для получения фрагментов нуклеиновых кислот, которые заканчиваются в положениях конкретных оснований. В частности, получали и тестировали реакционные смеси, которые содержали как природные дНТФ, так и каждый из 3'-О-пропаргил-дНТФ по отдельности.
Для тестирования получения фрагмента с помощью 3'-О-пропаргил-дТТФ получали реакционную смесь для получения фрагмента ДНК, содержащую 20 мМ Трис-HCl, 10 мМ (NH4)SO4, 10 мМ KCl, 2 мМ MnCl2, 0,1% Тритон Х-100, 1000 пмоль дАТФ, 1000 пмоль дЦТФ, 1000 пмоль дГТФ, 1000 пмоль дТТФ, 200 пмоль 3'-О-пропаргил-дТТФ, 6,25 пмоль праймера R_ke2_trP1_T_bio (SEQ ID NO: 2) и 2 единицы ДНК-полимеразы Therminator II (New England BioLabs), в конечном объеме реакционной смеси, составляющем 25 мкл. Объем 0,5 пмоль матрицы KRAS (SEQ ID NO: 1) использовали в качестве матрицы. Полимеразную реакцию достройки проводили с использованием профиля температурного циклирования, включающего подвергание реакционной смеси воздействию температуры 95°С в течение 2 минут с последующими 50 циклами 95°С в течение 15 секунд, 55°С в течение 25 секунд и 65°С в течение 35 секунд.
После проведения полимеразной реакции достройки 1 мкл реакционной смеси использовали непосредственно для анализа размера нуклеиновой кислоты путем гель-электрофореза (например, с использованием Agilent 2100 Bioanalyzer и High Sensitivity DNA Assay Chip). Данные, полученные в результате анализа размера, демонстрировали получение в результате реакции популяции фрагментов нуклеиновой кислоты, имеющих диапазон размеров, соответствующих ожидаемым длинам нуклеиновых кислот, комплементарных матрице, и указанная реакция завершалась 3'-О-пропаргил-дТ в каждом положении, в котором ожидали терминацию.
Проводили дополнительные эксперименты по достройке полимеразой с использованием условий реакции, описанных выше, и заменой 3'-О-пропаргил-дТТФ на 3'-О-пропаргил-дАТФ, 3'-О-пропаргил-дЦТФ или 3'-О-пропаргил-дГТФ. Данные, полученные в результате данных экспериментов, подобным образом демонстрировали, что в результате реакций получали популяции фрагментов нуклеиновой кислоты, имеющих диапазон размеров, соответствующих ожидаемым длинам нуклеиновых кислот, комплементарных матрице, и указанные реакции завершались 3'-О-пропаргил-дА, 3'-О-пропаргил-дЦ или 3'-О-пропаргил-дГ в каждом положении, в котором ожидали терминацию.
Пример 6 - синтез 5'-азидо-метил-модифицированного олигонуклеотида
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, синтезировали и получали характеристики олигонуклеотида, содержащего 5'-азидо-метильную модификацию. Синтез модифицированного олигонуклеотида осуществляли с использованием фосфорамидитного химического синтеза. На последнем этапе синтеза использовали фосфорамидитный химический синтез для встраивания 5'-иод-дТ-фосфорамидита в концевом 5'-положении. Затем олигонуклеотид, присоединенный к твердому носителю в реакционной колонне, обрабатывали следующим образом.
Сначала азид натрия (30 мг) ресуспендировали в сухом ДМФА (1 мл), нагревали в течение 3 часов при 55°С и охлаждали до комнатной температуры. Надосадочную жидкость забирали 1 мл шприцем и снова пропускали назад и вперед через реакционную колонну, содержащую 5'-иод-модифицированный олигонуклеотид, и инкубировали в течение ночи при температуре окружающей среды (комнатной) температуре. После инкубации колонну промывали сухим ДМФА, промывали ацетонитрилом, а затем сушили с помощью газообразного аргона. Полученный 5'-азидо-метил-модифицированный олигонуклеотид отщепляли от твердого носителя и снимали с него защиту путем нагревания в водном растворе аммиака в течение 5 часов при 55°С.Конечный продукт представлял собой олигонуклеотид, имеющий последовательность, представленную ниже:
Az-TCTGAGTCGGAGACACGCAGGGATGAGATGGT (SEQ ID NO: 6)
«Az» означает азидо-метильную модификацию на 5'-конце (например, 5'-азидо-метильную модификацию), например, для получения олигонуклеотида, имеющего структуру в соответствии с:
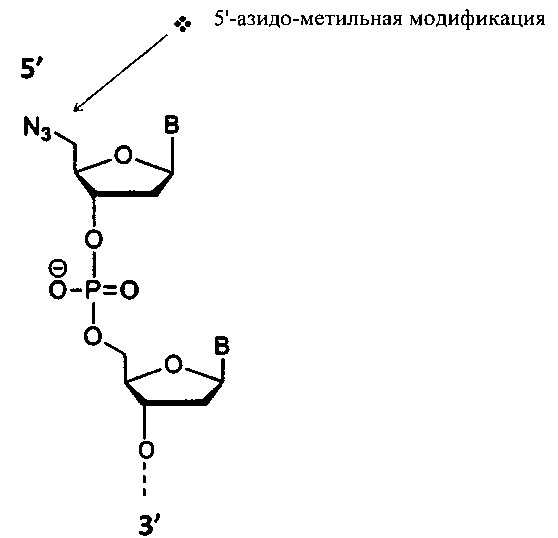 ,
,
где В представляет собой основание нуклеотида (например, аденин, гуанин, тимин, цитозин или природное, или синтетическое нуклеотидное основание, например, модифицированный пурин, такой как гипоксантин, ксантин, 7-метил гуанин; модифицированный пиримидин, такой как 5,6-дигидроурацил, 5-метилцитозин, 5-гидроксиметилцитозин; и т.д.).
Пример 7 - конъюгация 5'-азидо-метил-модифицированного олигонуклеотида и 3'-О-пропаргил-модифицированных фрагментов нуклеиновой кислоты
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, проводили эксперименты для тестирования конъюгации 5'-азидо-метил-модифицированного олигонуклеотида (например, см. пример 6) с 3'-О-пропаргил-модифицированными фрагментами нуклеиновой кислоты (например, см. пример 5) посредством клик-химии. В частности, проводили эксперименты, в которых 5'-азидо-метил-модифицированный олигонуклеотид подвергали химической конъюгации с 3'-О-пропаргил-модифицированными фрагментами ДНК с использованием химической реакции 1,3-диполярного алкин-азидного циклоприсоединения, катализируемой медью (I) («клик-химии»).
Реакцию клик-химии проводили с использованием коммерчески доступных реагентов (baseclick GmbH, Oligo-Click-M Reload kit) в соответствии с инструкциями изготовителя. Вкратце, приблизительно 0,1 пмоль 3'-О-пропаргил-модифицированных фрагментов ДНК, содержащих 5'-биотиновую модификацию, подвергали реакции с приблизительно 500 пмоль 5'-азидо-метил-модифицированного олигонуклеотида (см., например, пример 6, например, SEQ ID NO: 6) с использованием реагента клик-химии в общем объеме 10 мкл. Реакционную смесь инкубировали при 45°С в течение 30 минут. После инкубации надосадочную жидкость переносили в новую микроцентрифужную пробирку и добавляли 40 мкл объем коммерчески поставляемого связывающего и промывочного буфера (например, 1 М NaCl, 10 мМ Трис-HCl, 1 мМ EDTA, рН 7,5). Конъюгированный продукт реакции выделяли из избытка 5'-азидо-метил-модифицированного олигонуклеотида путем инкубации реакционной смеси клик-химии с покрытыми стрептавидином магнитными гранулами (Dynabeads, MyOne Streptavidin С1, Life Technologies) при температуре окружающей среды (комнатной) температуре в течение 15 минут. Отделяли гранулы от надосадочной жидкости с использованием магнита и удаляли надосадочную жидкость. Затем гранулы дважды промывали с использованием связывающего и промывочного буфера, а затем ресуспендировали в 25 мкл буфера ТЕ (10 мМ Трис-HCl, 0,1 мМ EDTA, рН приблизительно 8).
Продукт отщепляли от твердого носителя (гранула) с использованием расщепления урацила (урацилгликозилаза и эндонуклеаза VIII, Enzymatics). В частности, реагенты расщепления урацила использовали для расщепления продуктов реакции в участке модификации дезоксиуридином, расположенном вблизи 5'-концевого положения конъюгированного продукта (см. SEQ ID NO: 2-5). Наконец, надосадочную жидкость, содержащую конъюгированный продукт, очищали с использованием Ampure ХР (Beckman Coulter) в соответствии с протоколом изготовителя и элюировали в 20 мкл буфера ТЕ.
Пример 8 - амплификация конъюгированного продукта
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, проводили эксперименты для получения характеристик химической конъюгации 5'-азидо-метил-модифицированного олигонуклеотида с 3'-О-пропаргил-модифицированными фрагментам нуклеиновой кислоты и для оценки триазольной связи как имитатора природной фосфодиэфирной связи в остове нуклеиновой кислоты. Для тестирования способности полимеразы узнавать конъюгированный продукт в качестве матрицы и проходить триазольную связь во время синтеза, разрабатывали праймеры для ПЦР для получения ампликонов, которые охватывают триазольную связь продуктов конъюгации:
Праймер 1 CCTCTCTATGGGCAGTCGGTGAT SEQ ID NO: 7
Праймер 2 CCATCTCATCCCTGCGTGTCTC SEQ ID NO: 8
Коммерчески доступную смесь для ПЦР (KAPA 2G HS, KAPA Biosystems) использовали для получения 25 мкл реакционной смеси, содержащей в дополнение к компонентам, предусмотренным указанной смесью (например, буфер, полимераза, дНТФ), 0,25 мкМ праймер 1 (SEQ ID NO: 7), 0,25 мкМ праймер 2 (SEQ ID NO: 8) и 2 мкл очищенного конъюгированного продукта (см. пример 7) в качестве матрицы для амплификации. Реакционную смесь подвергали термическому циклированию путем инкубации образца при 95°С в течение 5 минут с последующими 30 циклами 98°С в течение 20 секунд, 60°С в течение 30 секунд и 72°С в течение 20 секунд. Продукты амплификации анализировали путем гель-электрофореза (например, с использованием системы Agilent Bioanalyzer 2100 и High-Sensitivity DNA Chip) с определением распределения по размерам для продуктов реакции.
Анализ продуктов амплификации демонстрировал, что в результате реакции амплификации успешно получали ампликоны с использованием конъюгированных продуктов реакции клик-химии (см. пример 7) в качестве матриц для амплификации. В частности, анализ продуктов амплификации демонстрировал, что полимераза процессировала по матрице и триазольной связи с образованием ампликонов из матрицы. Кроме того, в результате амплификации получали гетерогенную популяцию ампликонов, демонстрирующих диапазон размеров, соответствующих ожидаемым размерам, получаемым путем амплификации терминированных конкретными основаниями фрагментов ДНК путем встраивания 3'-О-пропаргил-дНТФ. Анализ фрагментов также демонстрировал подходящее увеличение размера фрагмента, соответствующее тридцати одному (31) дополнительному основанию из конъюгированного 5'-азидо-метил-модифицированного олигонуклеотида.
Пример 9 - получение лесенки с использованием терминации 3'-О-пропаргил-дНТФ
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, проводили эксперименты для оценки получения терминированных фрагментов нуклеиновой кислоты в реакции, включающей смесь 3'-О-пропаргил-дНТФ и природных (стандартных) дНТФ. В частности, проводили эксперименты для оценки получения фрагментов, терминированных в каждом положении в пределах целевой области, путем встраивания 3'-О-пропаргил-дНТФ, терминирующих цепь, под действием ДНК-полимеразы во время синтеза.
Эксперименты проводили с использованием смеси природных дНТФ и всех четырех из 3'-О-пропаргил-дНТФ в одной реакции. Реакционная смесь для получения фрагментов ДНК содержала 20 мМ Трис-HCl, 10 мМ (NH4)SO4, 10 мМ KCl, 2 мМ MnCl2, 0,1% Тритон Х-100, 1000 пмоль дАТФ, 1000 пмоль дЦТФ, 1000 пмоль дГТФ, 1000 пмоль дТТФ, 100 пмоль 3'-О-пропаргил-дАТФ, 100 пмоль 3'-О-пропаргил-дЦТФ, 100 пмоль 3'-О-пропаргил-дГТФ, 100 пмоль 3'-О-пропаргил-дТТФ, 6,25 пмоль праймера R_ke2_trP1_T_bio (SEQ ID NO: 2) и 2 единицы ДНК-полимеразы Therminator II (New England BioLabs) в объеме реакционной смеси, составляющем 25 мкл. 0,5 пмоль очищенного ампликона, соответствующего области в экзоне 2 KRAS (SEQ ID NO: 1), использовали в качестве матрицы. Полимеразную реакцию достройки термоциклировали путем нагревания до 95°С в течение 2 минут с последующими 45 циклами при 95°С в течение 15 секунд, 55°С в течение 25 секунд и 65°С в течение 35 секунд.
После проведения полимеразной реакции достройки 1 мкл реакционной смеси использовали непосредственно для анализа размера фрагментов ДНК с использованием гель-электрофореза (например, Agilent 2100 Bioanalyzer и High Sensitivity DNA Assay Chip). Анализ размера фрагментов для продуктов реакции демонстрировал успешное получение в результате реакции получения фрагментов лесенки фрагментов нуклеиновой кислоты, имеющих ожидаемые размеры.
Затем 5'-азидо-метил-модифицированный олигонуклеотид (см., например, пример 6, например, SEQ ID NO: 6) подвергали химической конъюгации с терминированными фрагментами ДНК, содержащими 3'-О-пропаргил-дН, с использованием клик-химии, как описано в примере 6 и примере 7 выше. После конъюгации проводили реакцию амплификации с амплификацией конъюгированных продуктов, как описано в примере 8. Анализ размера фрагментов ДНК для ампликонов, полученных из конъюгированных продуктов, демонстрировал ожидаемый сдвиг размера в результате конъюгации 5'-азидо-модифицированного олигонуклеотида с ампликонами, полученными из лесенки фрагментов.
Пример 10 - контроль размера фрагмента
Во время разработки вариантов технологии, предложенной согласно настоящему изобретению, проводили эксперименты для контроля распределения по размерам для терминированных фрагментов нуклеиновой кислоты, полученных в реакции, включающей смесь 3'-О-пропаргил-дНТФ и природных (стандартных) дНТФ, путем корректировки соотношения 3'-О-пропаргил-дНТФ и природных (стандартных) дНТФ. Предполагали, что молярное соотношение 3'-О-пропаргил-дНТФ и природных дНТФ влияет на распределение фрагментов по размеру вследствие конкуренции между 3'-О-пропаргил-дНТФ (которые завершают достройку) и природными дНТФ (которые элонгируют полимеразный продукт) за встраивание в синтезированную нуклеиновую кислоту под действием полимеразы.
Соответственно, проводили эксперименты, в которых оценивали продукты реакций получения лесенки фрагментов в различных молярных соотношениях 3'-О-пропаргил-дНТФ и природных дНТФ. Реакции получения лесенки фрагментов проводили с использованием молярных соотношений природных дНТФ и 3'-О-пропаргил-дНТФ, составляющих 2:1, 10:1 и 100:1. Реакционные смеси для получения фрагментов, используемые в данных экспериментах, содержали 20 мМ Трис-HCl, 10 мМ (NH4)SO4, 10 мМ KCl, 2 мМ MnCl2, 0,1% Тритон Х-100, 1000 пмоль дАТФ, 1000 пмоль дЦТФ, 1000 пмоль дГТФ, 1000 пмоль дТТФ, 6,25 пмоль праймера R_ke2_trP1_T_bio (SEQ ID NO: 2), 2 единицы ДНК-полимеразы Therminator II (New England BioLabs) и 0,5 пмоль очищенного ампликона, соответствующего области в экзоне 2 KRAS (SEQ ID NO: 1), в качестве матрицы в конечном объеме реакционной смеси, составляющем 25 мкл.
Кроме того, реакционные смеси для тестирования соотношения природных дНТФ и 3'-О-пропаргил-дНТФ, составляющего 2:1, содержали 500 пмоль 3'-О-пропаргил-дАТФ, 500 пмоль 3'-О-пропаргил-дЦТФ, 500 пмоль 3'-О-пропаргил-дГТФ и 500 пмоль 3'-О-пропаргил-дТТФ. Реакционные смеси для тестирования соотношения природных дНТФ и 3'-О-пропаргил-дНТФ, составляющего 10:1, содержали 100 пмоль 3'-О-пропаргил-дАТФ, 100 пмоль 3'-О-пропаргил-дЦТФ, 100 пмоль 3'-О-пропаргил-дГТФ и 100 пмоль 3'-О-пропаргил-дТТФ. Реакционные смеси для тестирования соотношения природных дНТФ и 3'-О-пропаргил-дНТФ, составляющего 100:1, содержали 10 пмоль 3'-О-пропаргил-дАТФ, 10 пмоль 3'-О-пропаргил-дЦТФ, 10 пмоль 3'-О-пропаргил-дГТФ и 10 пмоль 3'-О-пропаргил-дТТФ.
Полимеразные реакции достройки подвергали температурному циклированию путем инкубации при 95°С в течение 2 минут с последующими 45 циклами при 95°С в течение 15 секунд, 55°С в течение 25 секунд и 65°С в течение 35 секунд. После полимеразной реакции достройки 5'-азидо-метил-модифицированные олигонуклеотиды (см., например, пример 6, например, SEQ ID NO: 6) подвергали химической конъюгации с фрагментами нуклеиновой кислоты, терминированными 3'-О-пропаргил-дН, с использованием клик-химии, как описано в примере 6 и примере 7. После конъюгации продукты конъюгации использовали в качестве матриц для амплификации для получения ампликонов, соответствующих конъюгированным продуктам, как описано в примере 8. Анализ размера фрагментов осуществляли на конъюгированных продуктах.
Анализ размера фрагментов для амплифицированных продуктов конъюгации, полученных из продуктов с тремя различными условиями молярного соотношения, демонстрировал, что размер фрагментов зависел от соотношения 3'-О-пропаргил-дНТФ и природных дНТФ. Анализ размера фрагментов демонстрировал сдвиг распределения фрагментов по размерам в зависимости от молярных соотношений дНТФ и 3'-О-пропаргил-дНТФ. В случае молярного соотношения 2:1 детектировали более крупные популяции более коротких фрагментов по сравнению с другими двумя условиями молярного соотношения. В случае молярного соотношения 10:1 присутствовала более крупная фракция более длинных фрагментов по сравнению с молярным соотношением 2:1. В случае молярного соотношения 100:1 основная популяция фрагментов содержала более длинные фрагменты ДНК по сравнению с двумя другими молярными соотношениями.
Полное содержание всех публикаций и патентов, упомянутых в вышеприведенном описании, включено в настоящее описание посредством ссылки для всех целей. Различные модификации и вариации описанных композиций, способов и применения технологии будут очевидны специалисту в данной области техники в пределах объема и сущности описанной технологии. Хотя технология описана по отношению к конкретным типичным вариантам реализации, следует понимать, что заявленное изобретение не должно ограничиваться такими конкретными вариантами реализации. Действительно, различные модификации описанных способов реализации настоящего изобретения, которые очевидны специалисту в данной области техники, включены в объем приведенной ниже формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИБЛИОТЕКИ ДЛЯ СЕКВЕНИРОВАНИЯ НОВОГО ПОКОЛЕНИЯ | 2014 |
|
RU2698125C2 |
| ИДЕНТИФИКАЦИЯ И АНАЛИЗ ОБРАЗЦОВ МИКРООРГАНИЗМОВ ПУТЕМ БЫСТРОГО ИНКУБИРОВАНИЯ И ОБОГАЩЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2020 |
|
RU2809853C2 |
| НУКЛЕОТИДЫ, МЕЧЕННЫЕ ЗАРЯДОМ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2751359C2 |
| НОВЫЕ КОМБИНАЦИИ ГАСИТЕЛЯ И РЕПОРТЕРНОГО КРАСИТЕЛЯ | 2019 |
|
RU2795062C2 |
| МОЛЕКУЛА СУБСТРАТА | 2016 |
|
RU2755495C2 |
| ТАГМЕНТАЦИЯ С ПРИМЕНЕНИЕМ ИММОБИЛИЗОВАННЫХ ТРАНСПОСОМ С ЛИНКЕРАМИ | 2018 |
|
RU2783536C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПОЛУЧЕНИЯ БИБЛИОТЕК НУКЛЕИНОВЫХ КИСЛОТ | 2018 |
|
RU2788402C2 |
| МОДИФИЦИРОВАННАЯ ТЕРМОСТАБИЛЬНАЯ ДНК-ПОЛИМЕРАЗА, СПОСОБ ЕЁ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 1997 |
|
RU2235773C2 |
| КОМПОЗИЦИИ, СПОСОБЫ И НАБОРЫ ДЛЯ СИНТЕЗА И ОБНАРУЖЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ | 2017 |
|
RU2757416C2 |
| СПОСОБ АМПЛИФИКАЦИИ ДНК НА ОСНОВЕ ВНЕДРЕНИЯ В ЦЕПЬ | 2015 |
|
RU2729983C2 |



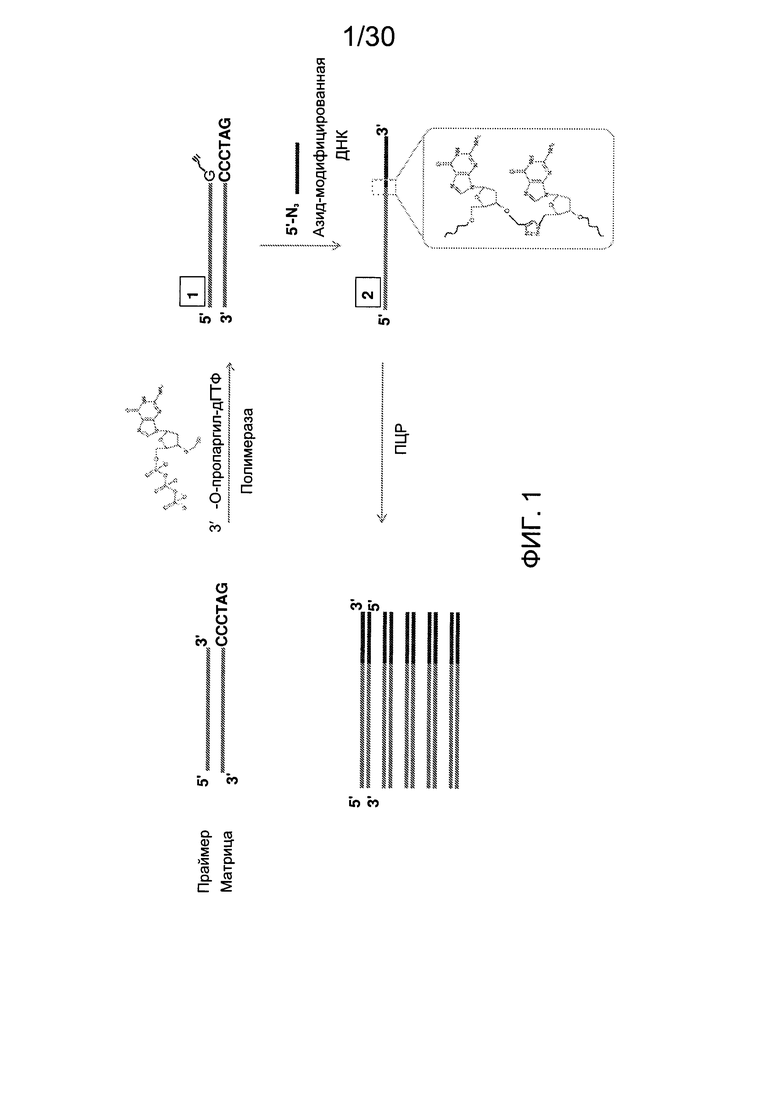
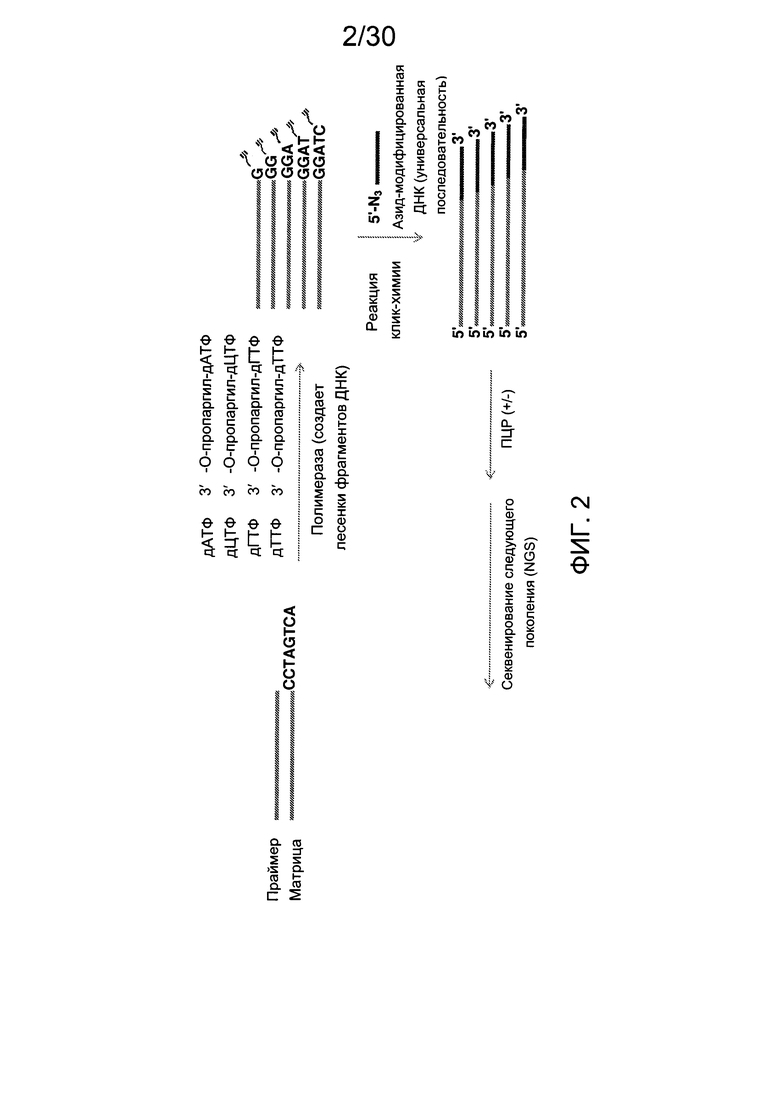
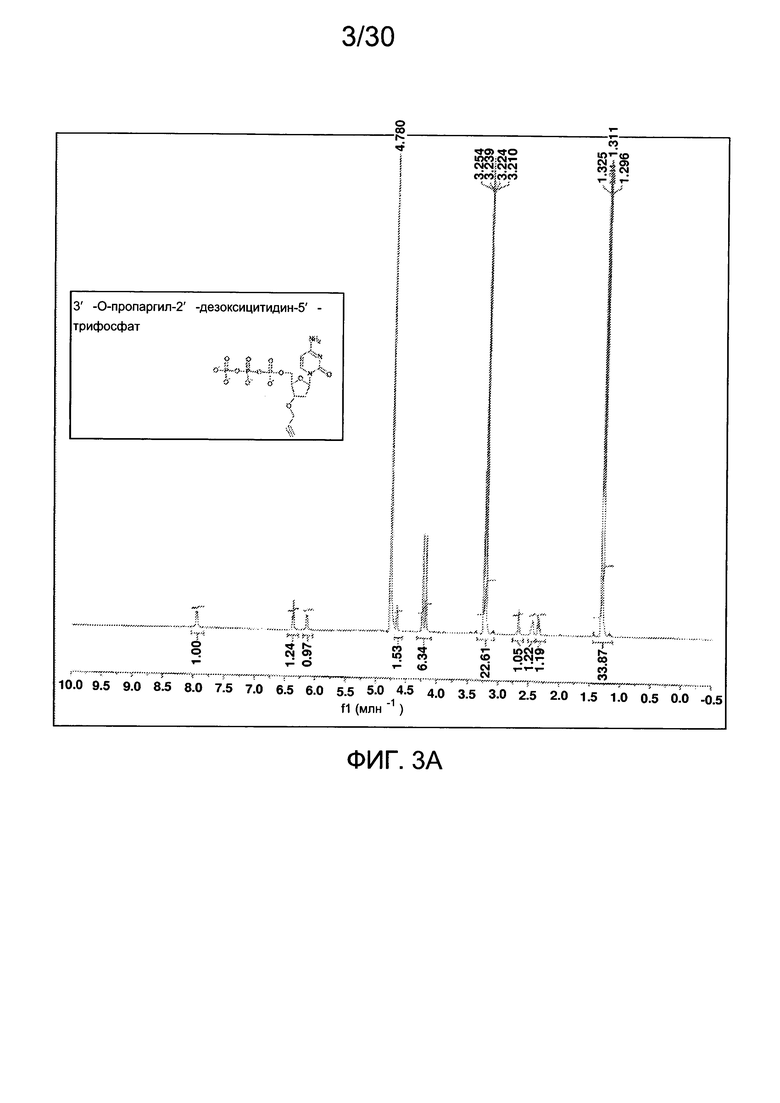
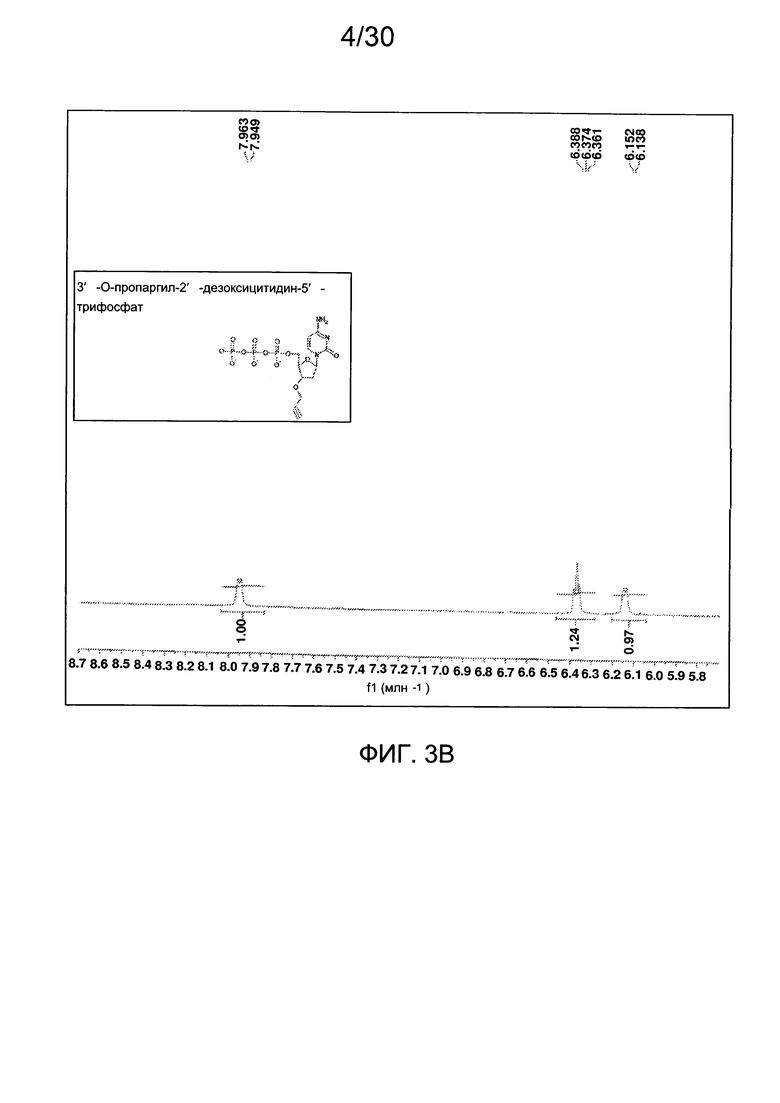
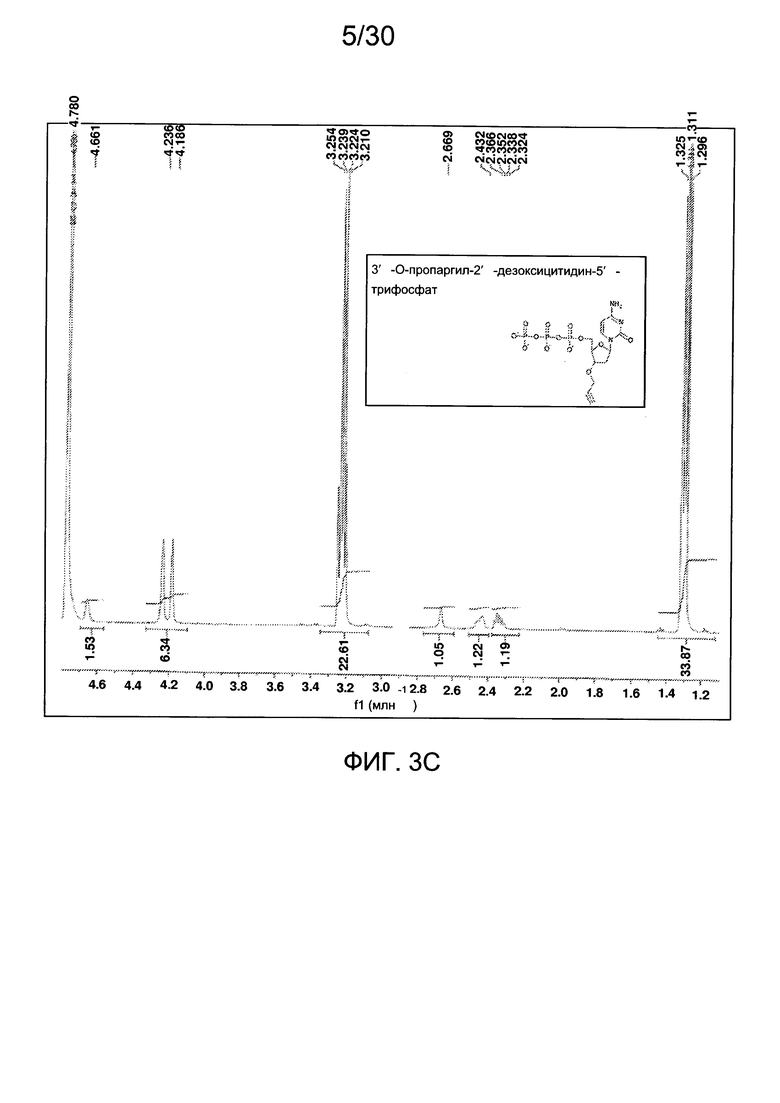
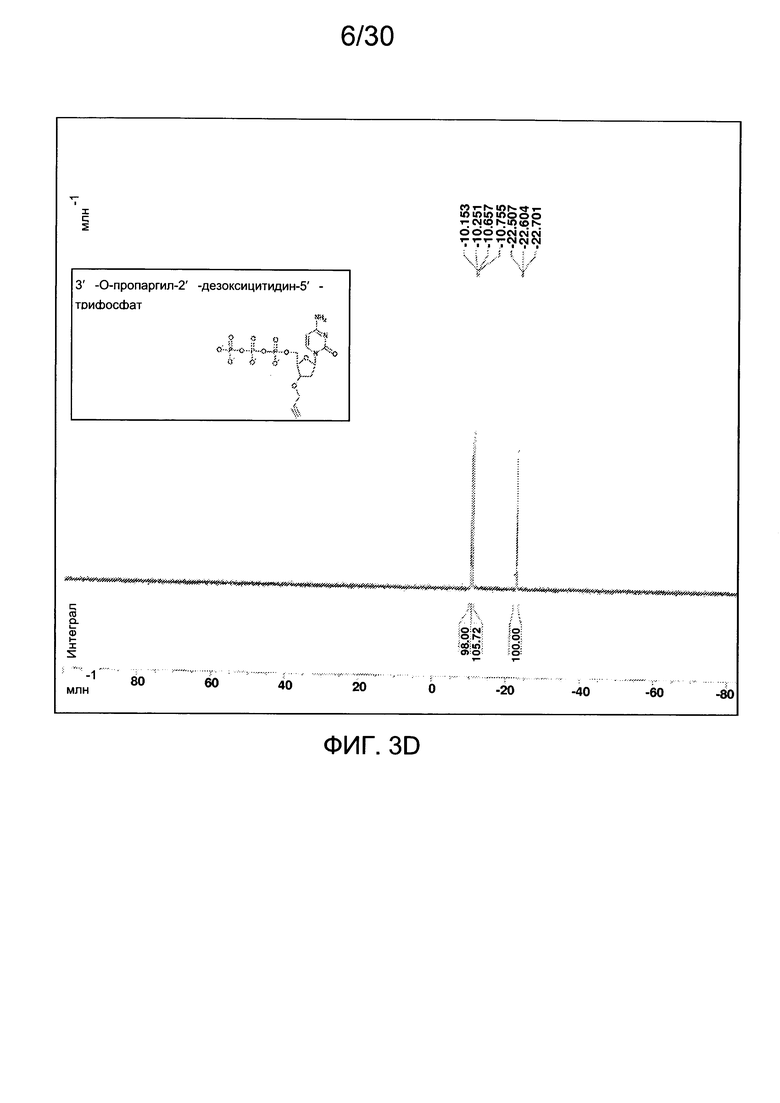

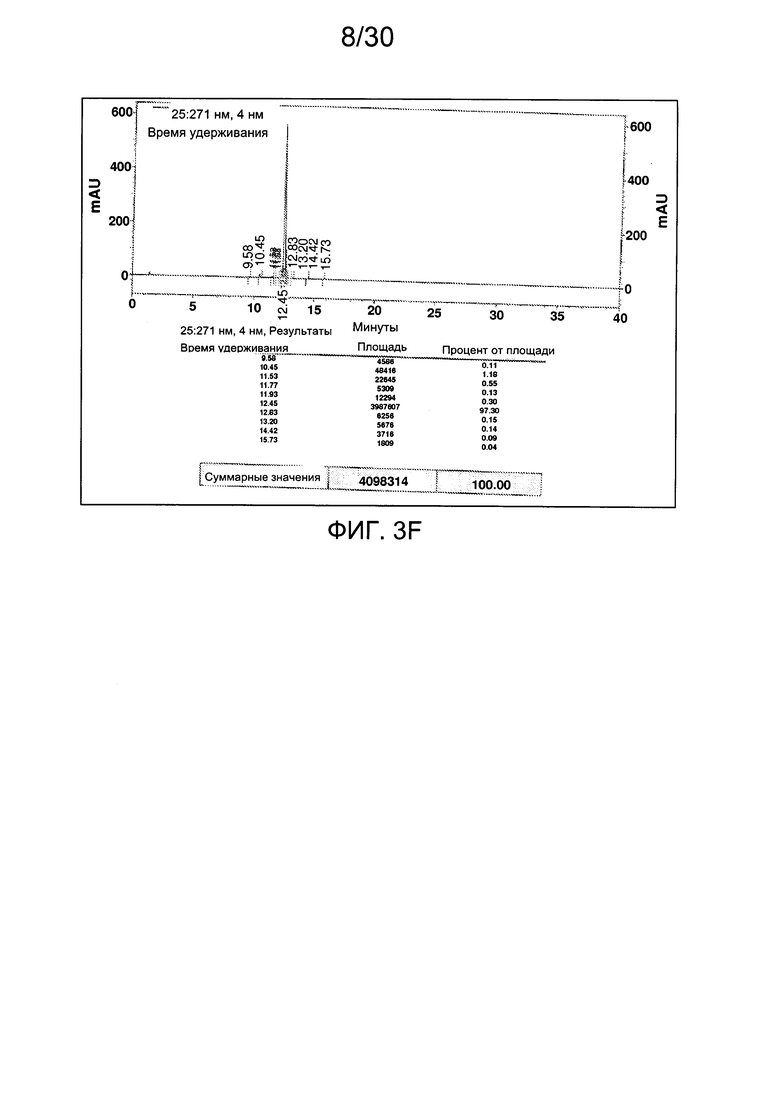
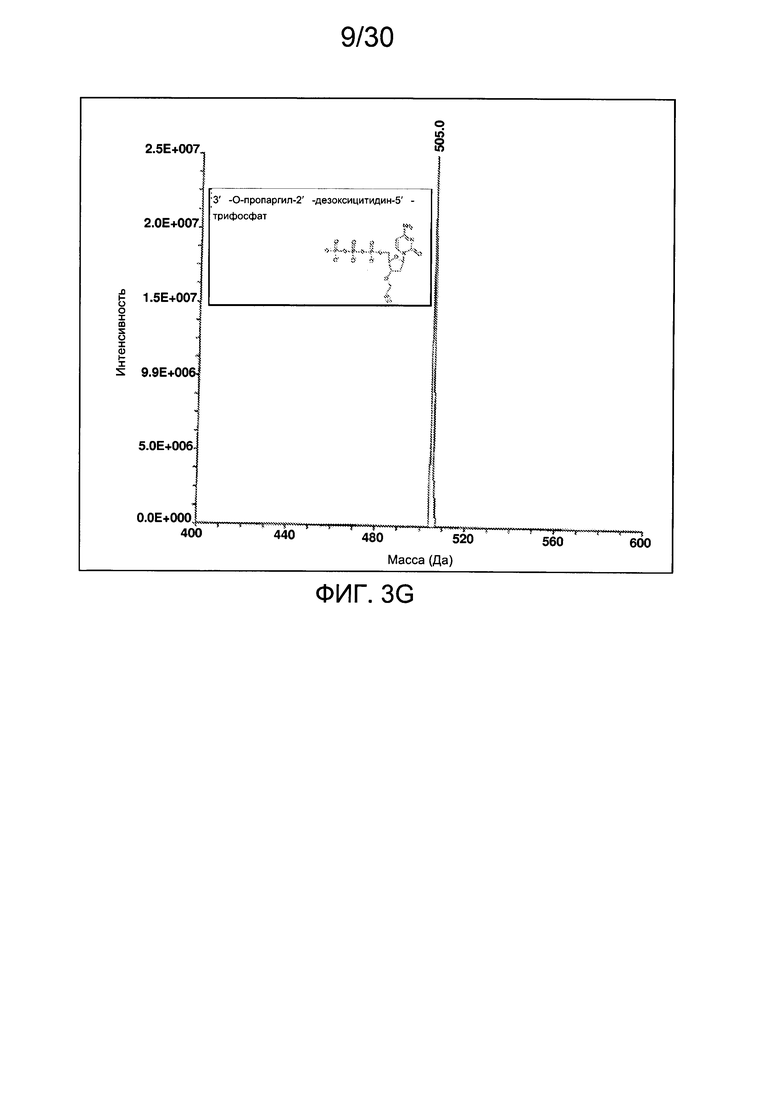
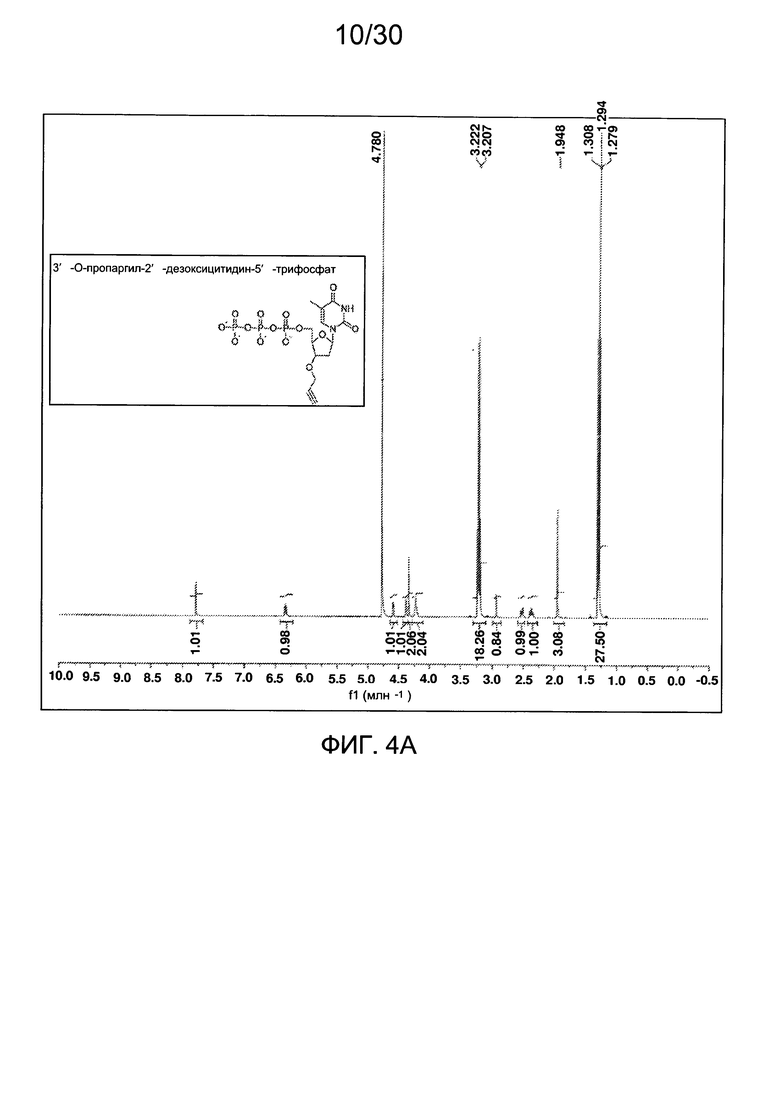
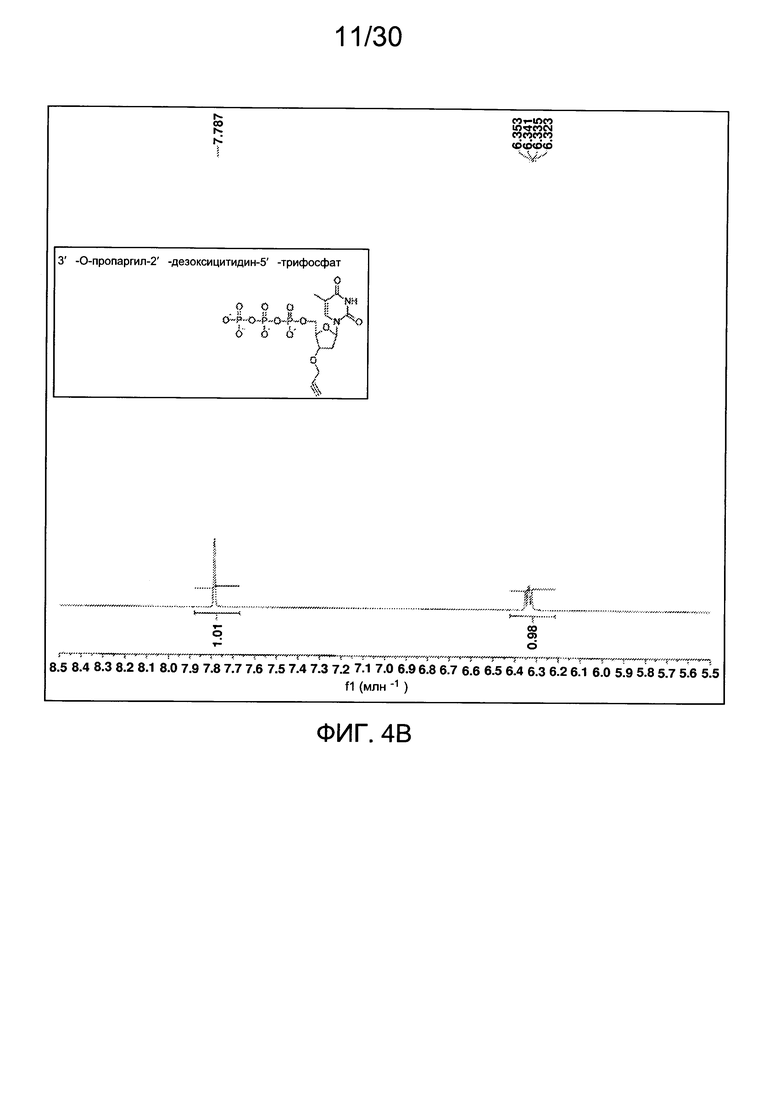
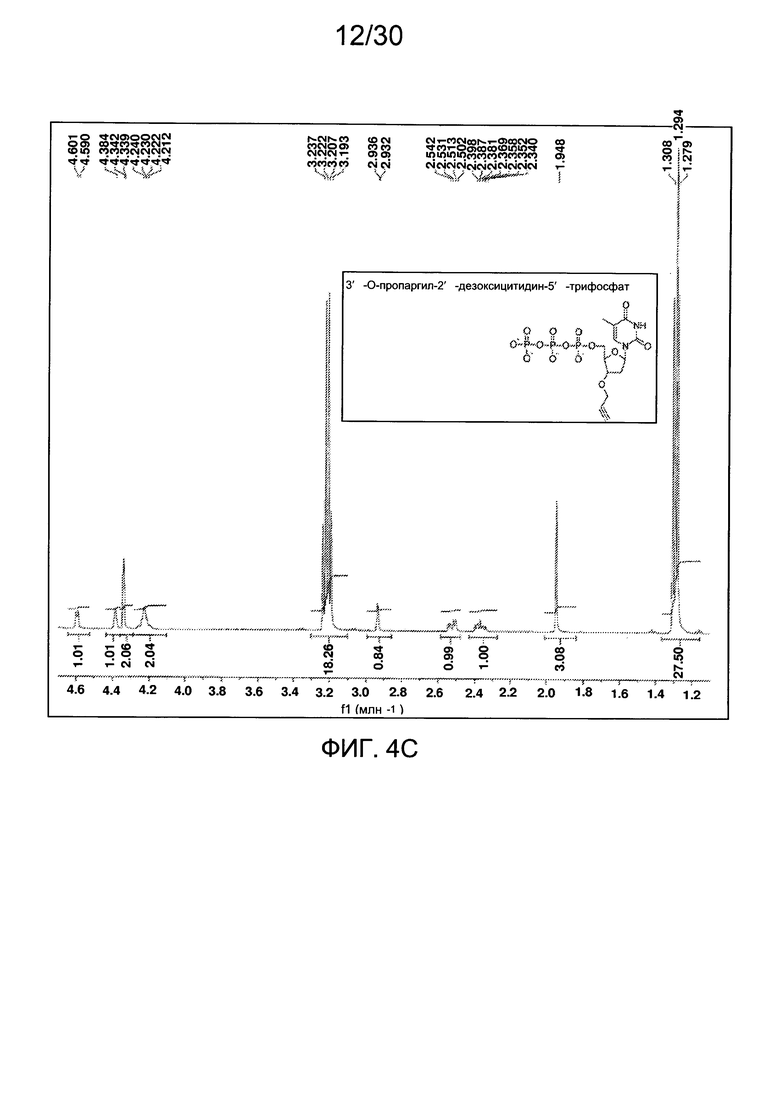

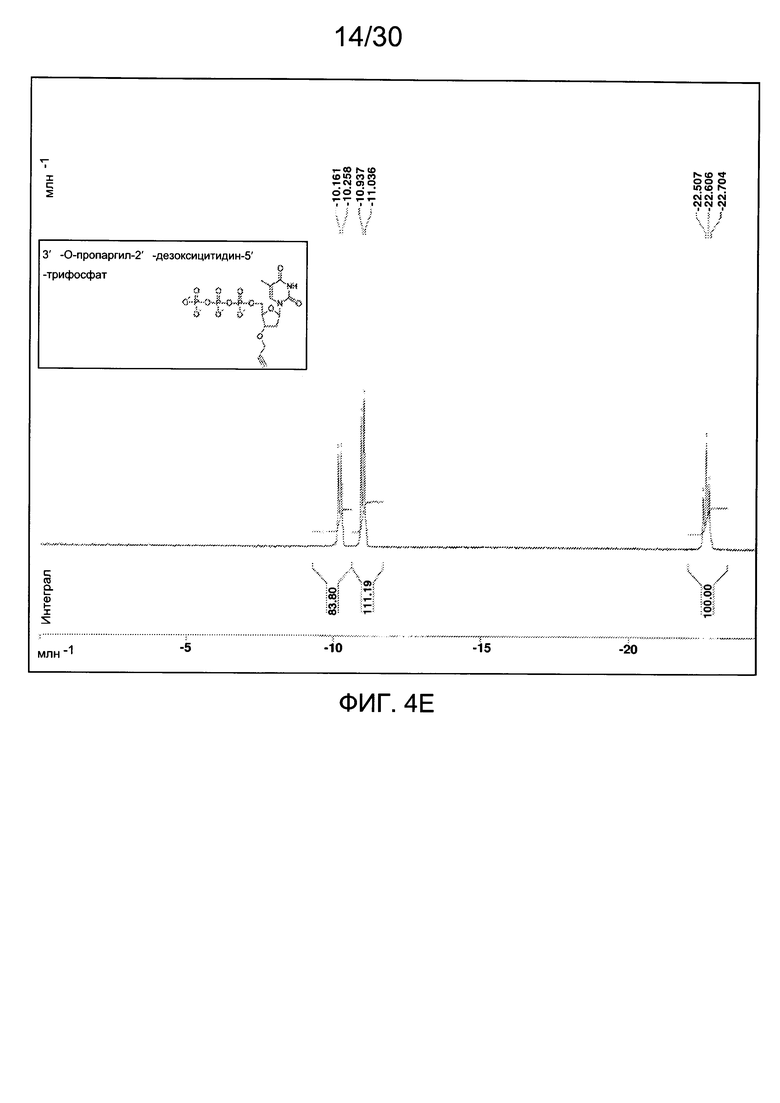
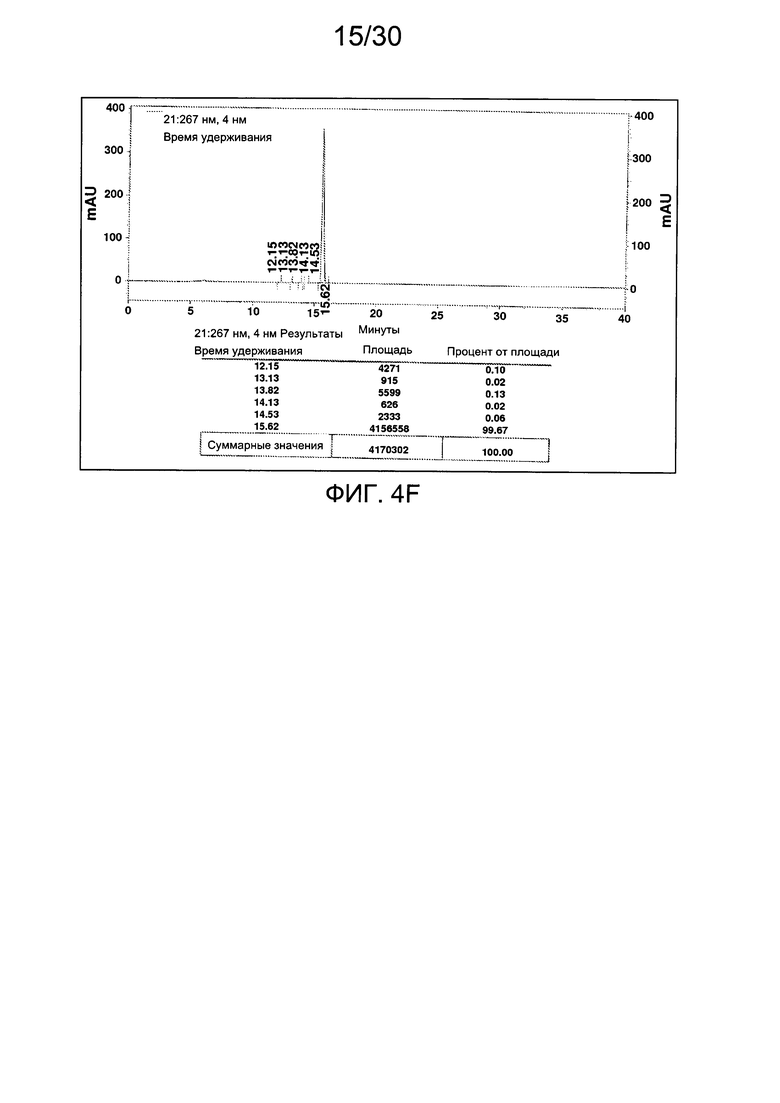
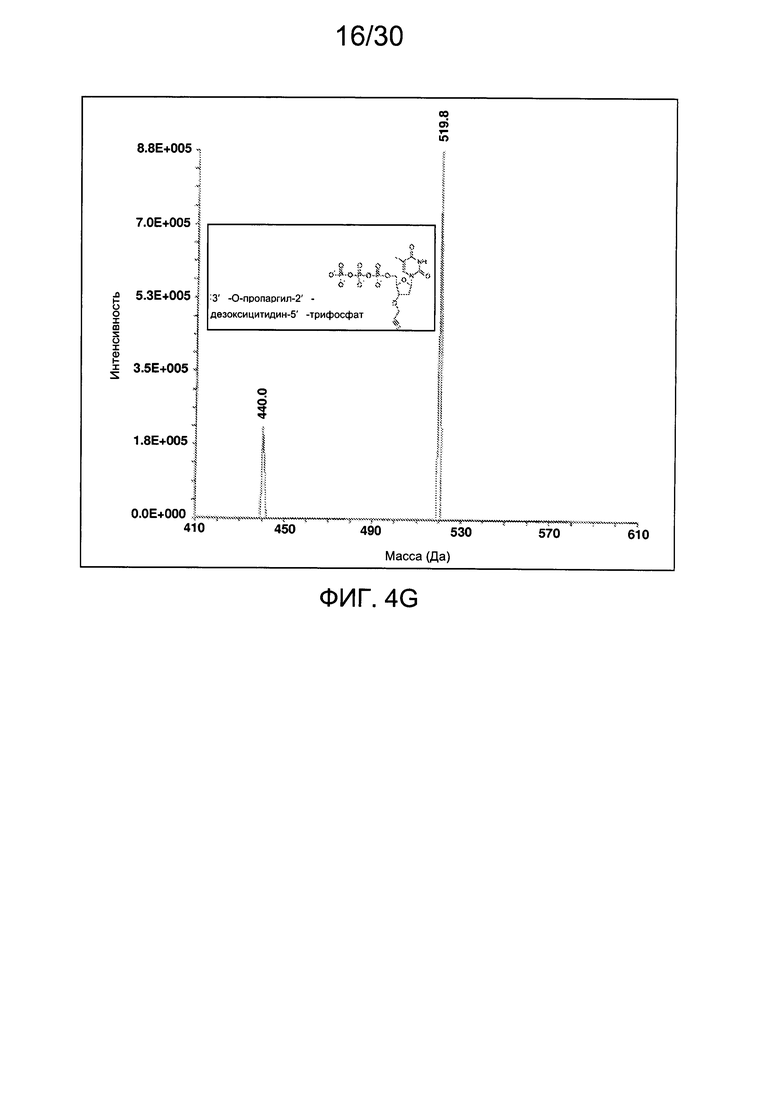

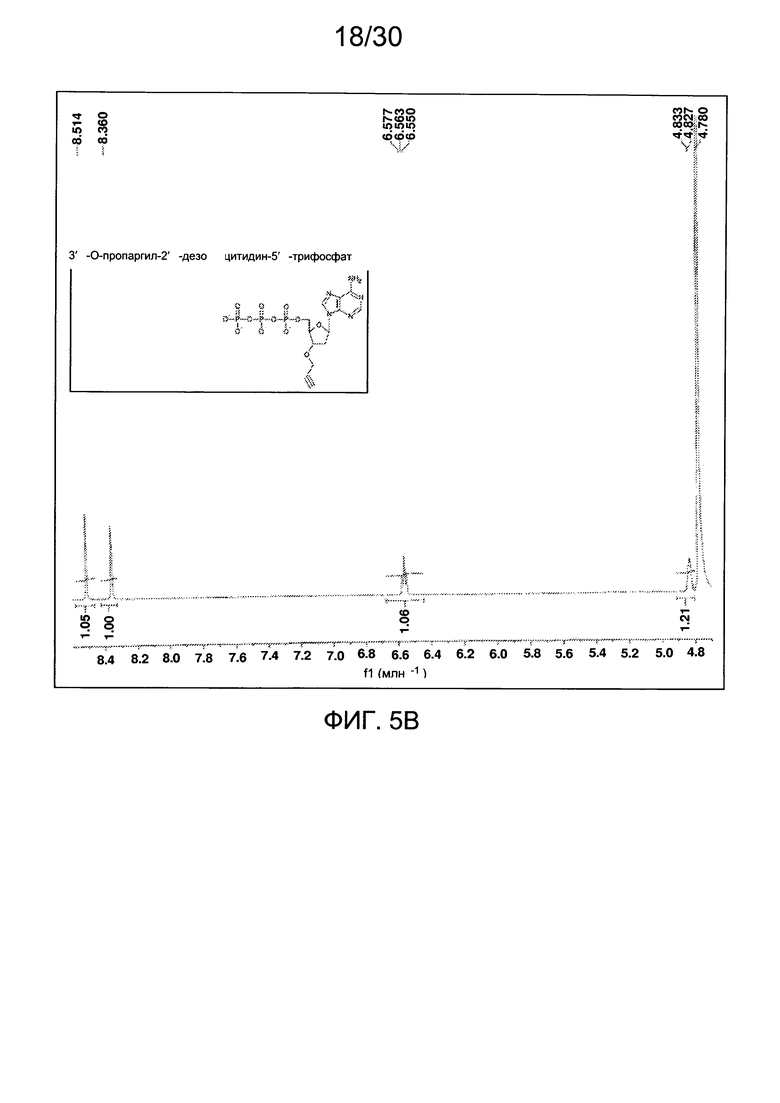
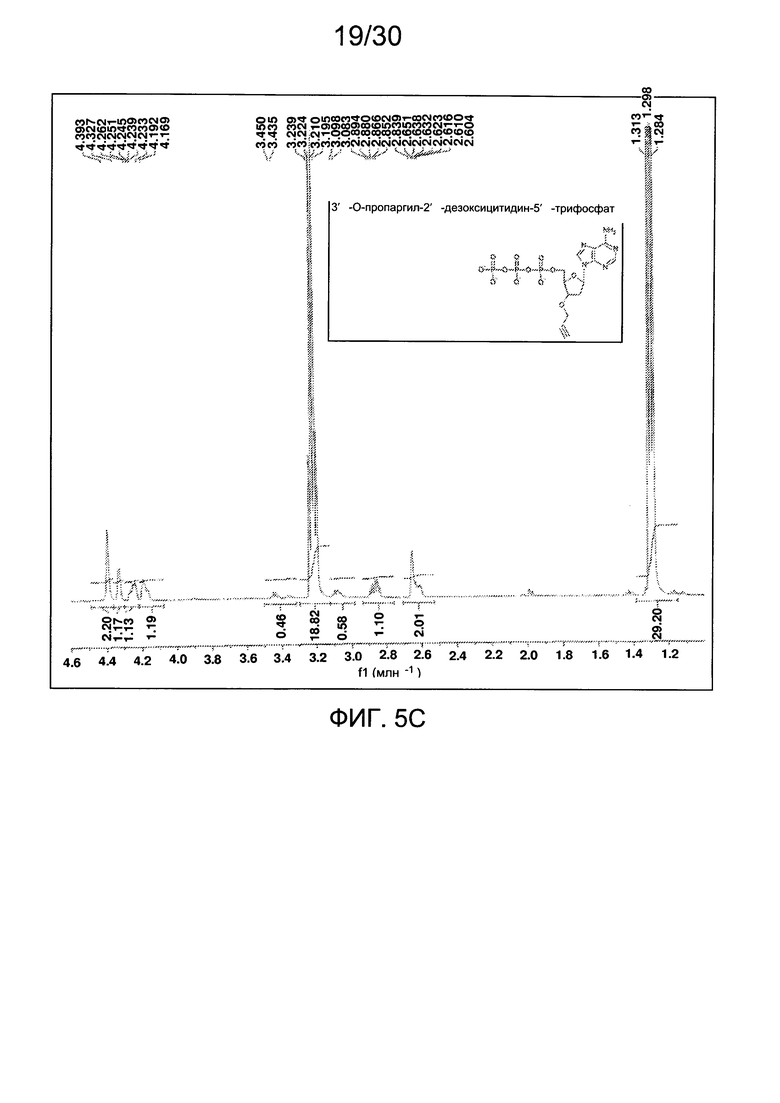
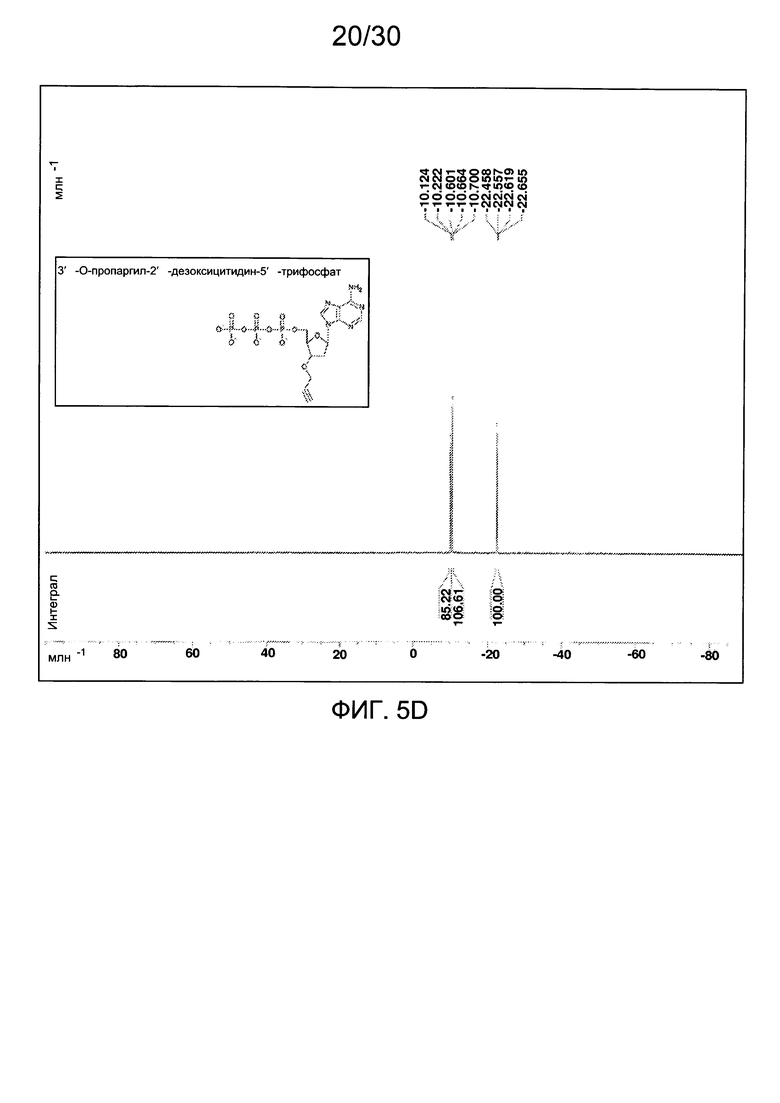
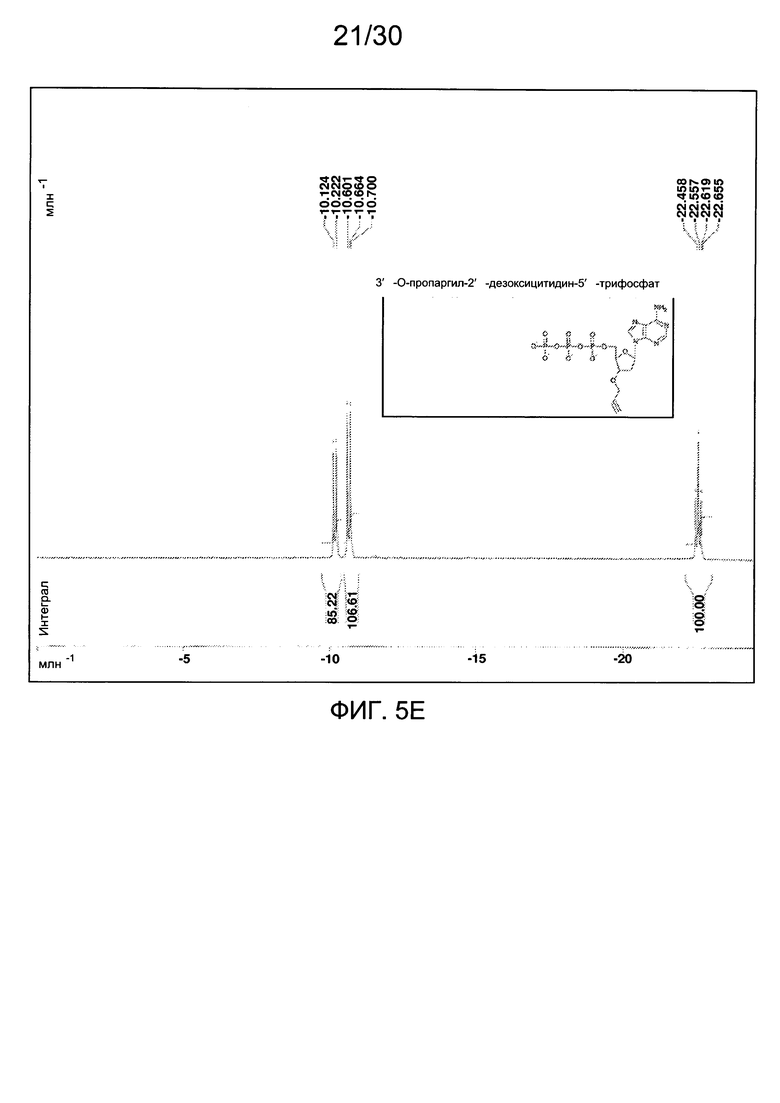
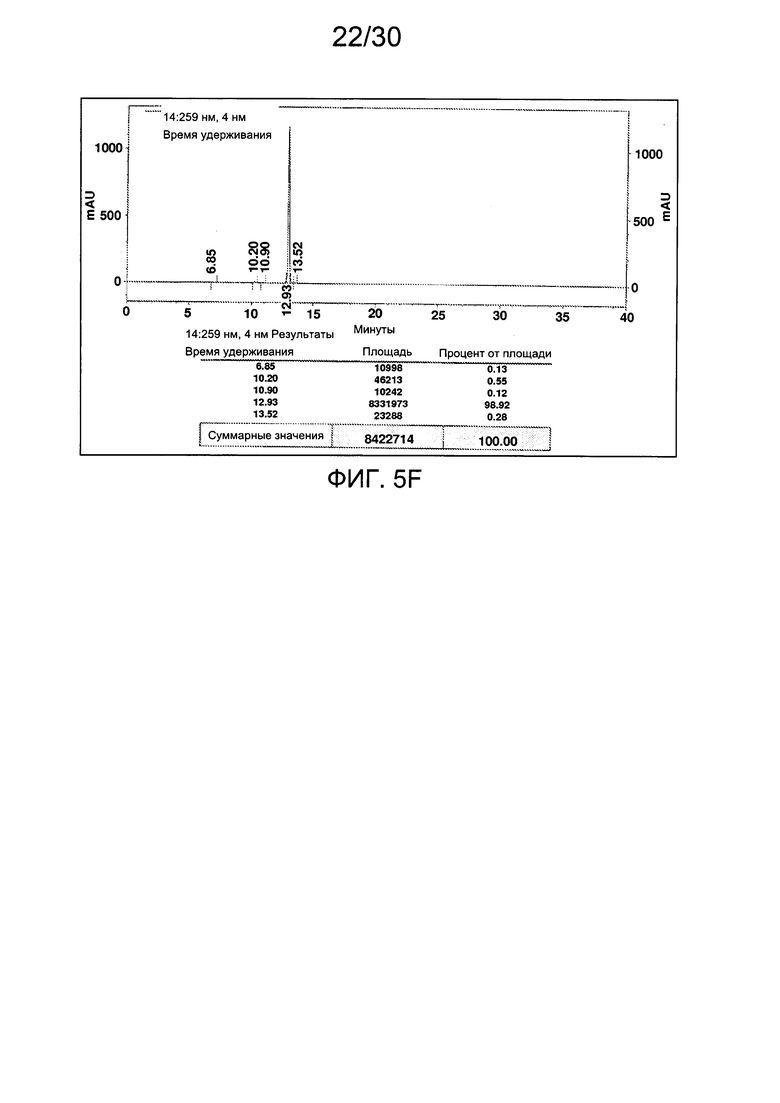
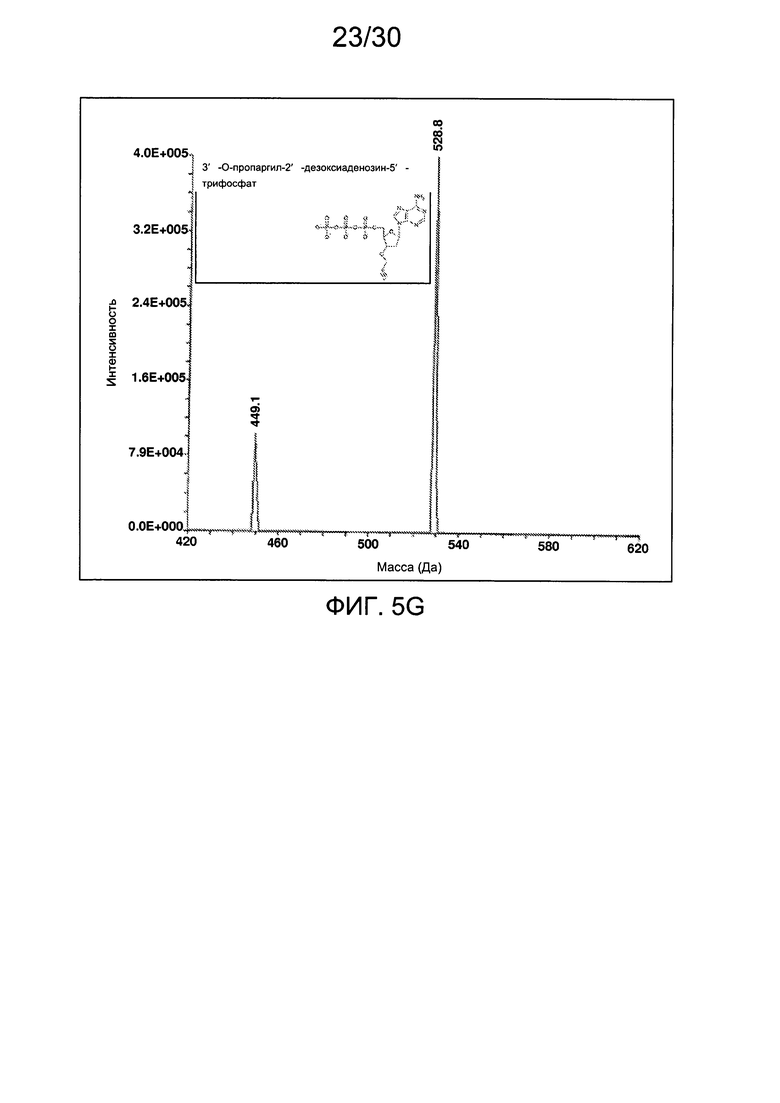
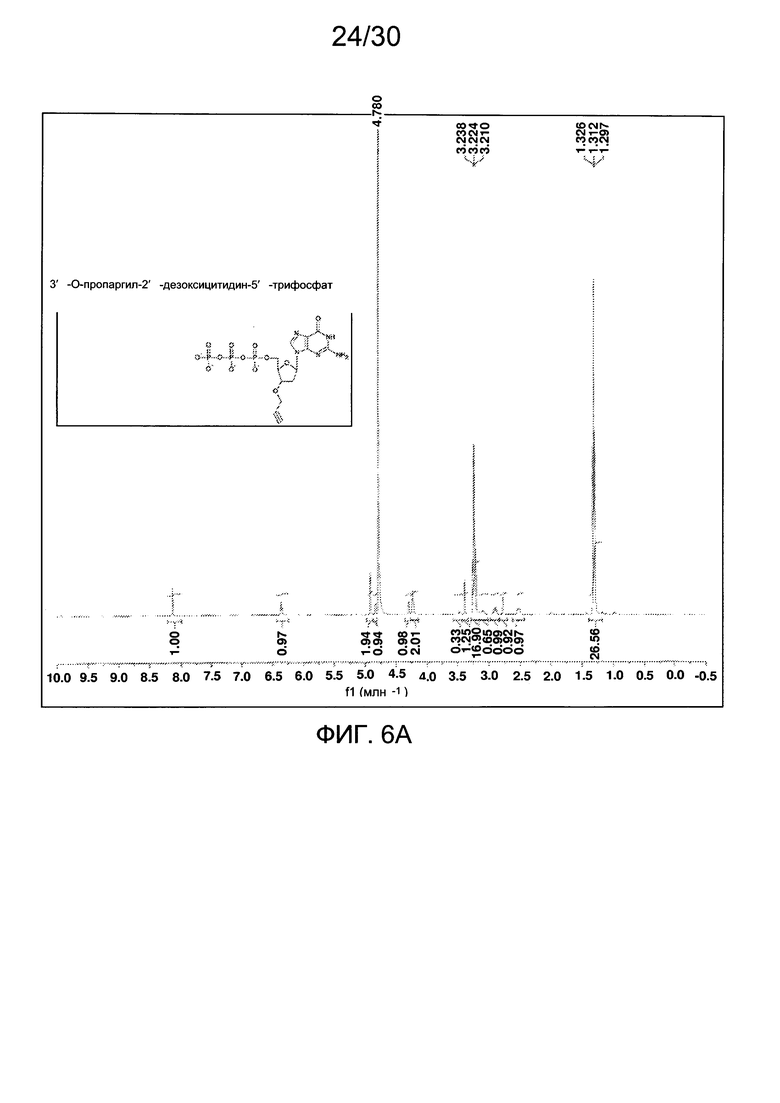
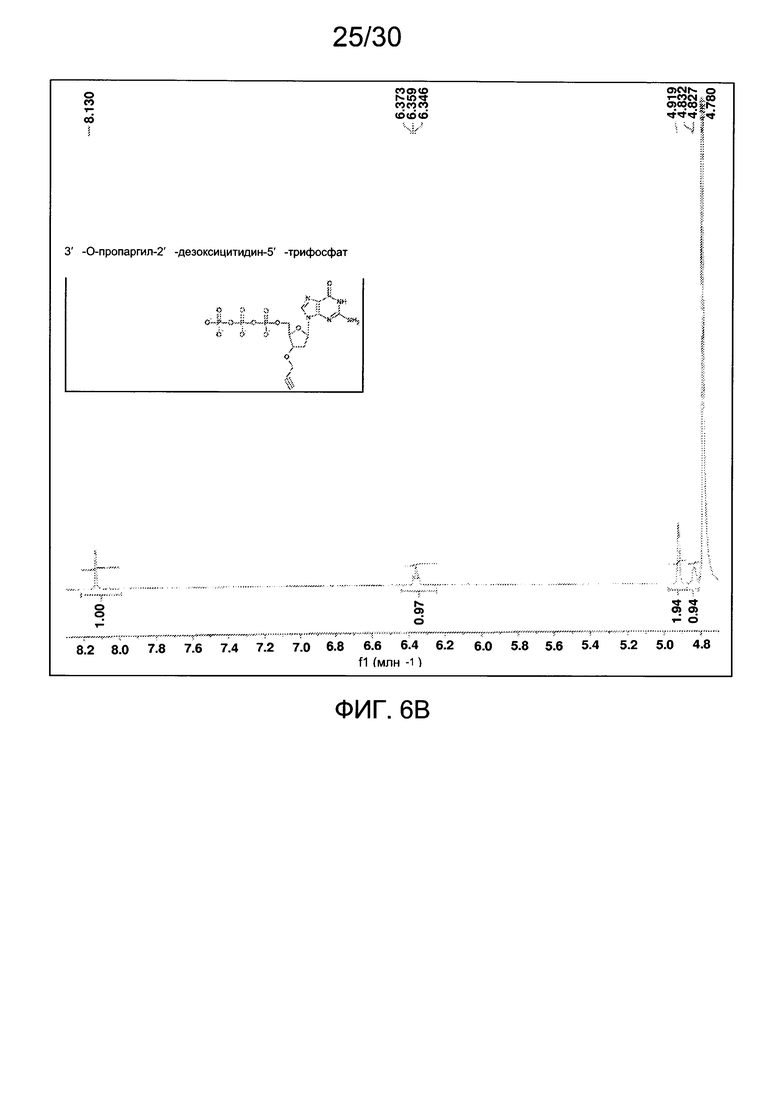

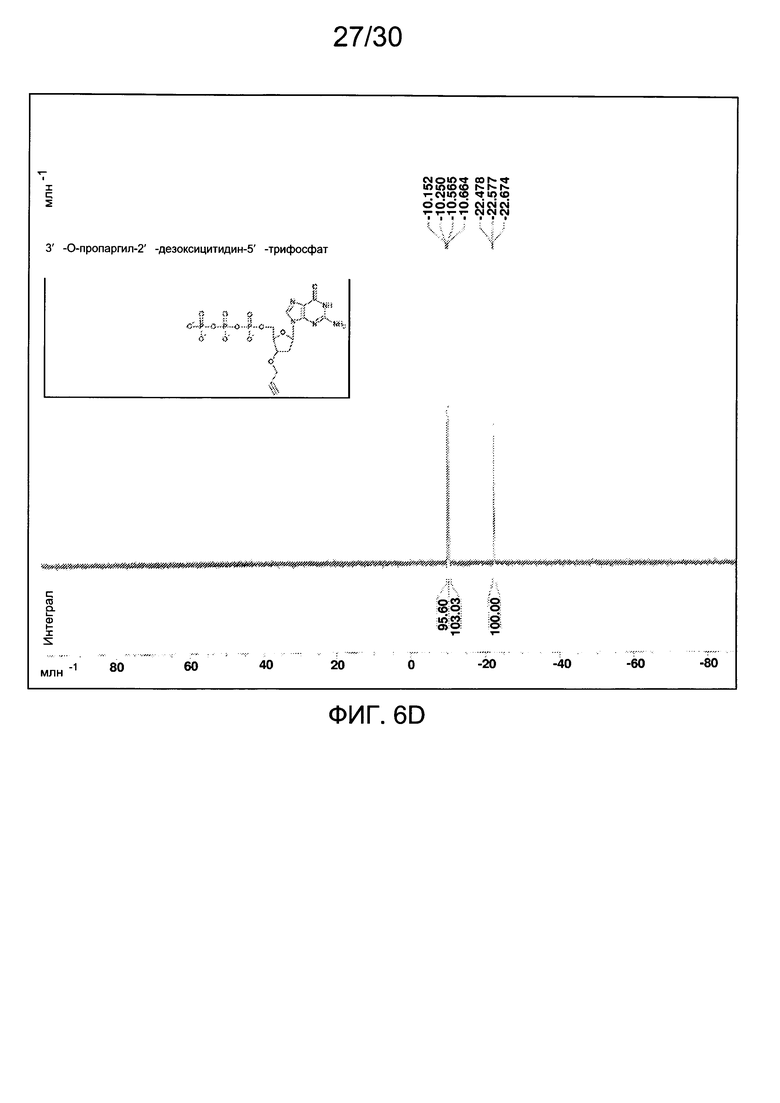
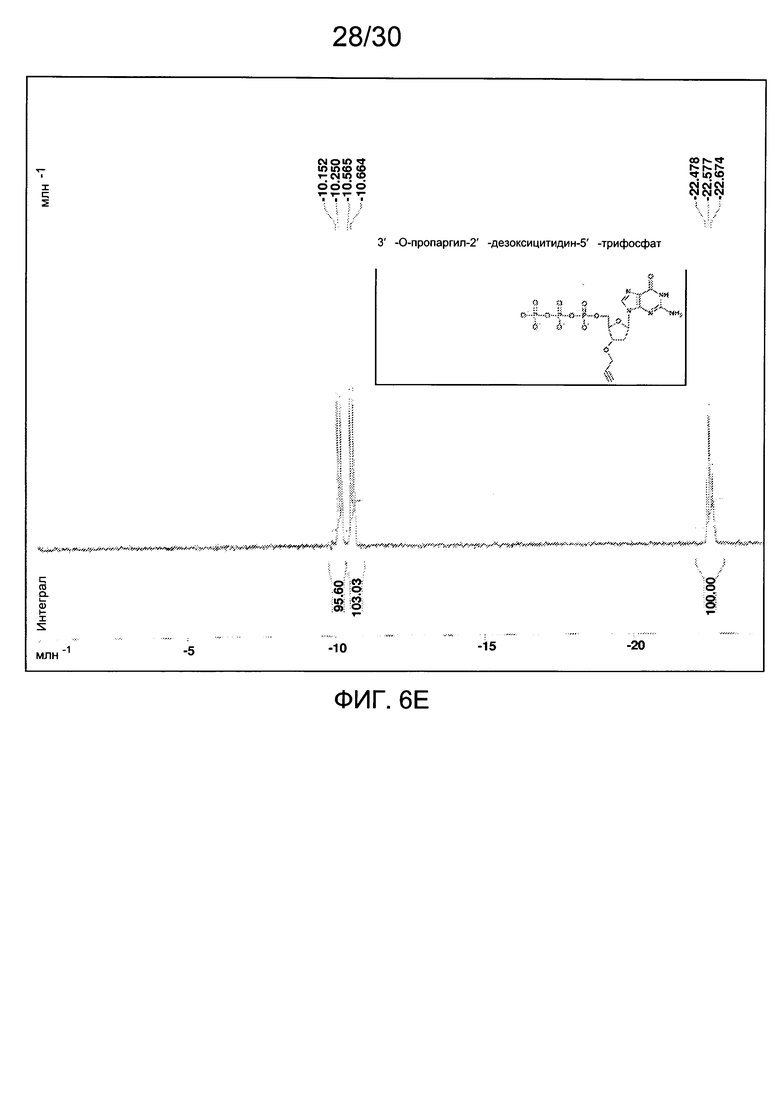
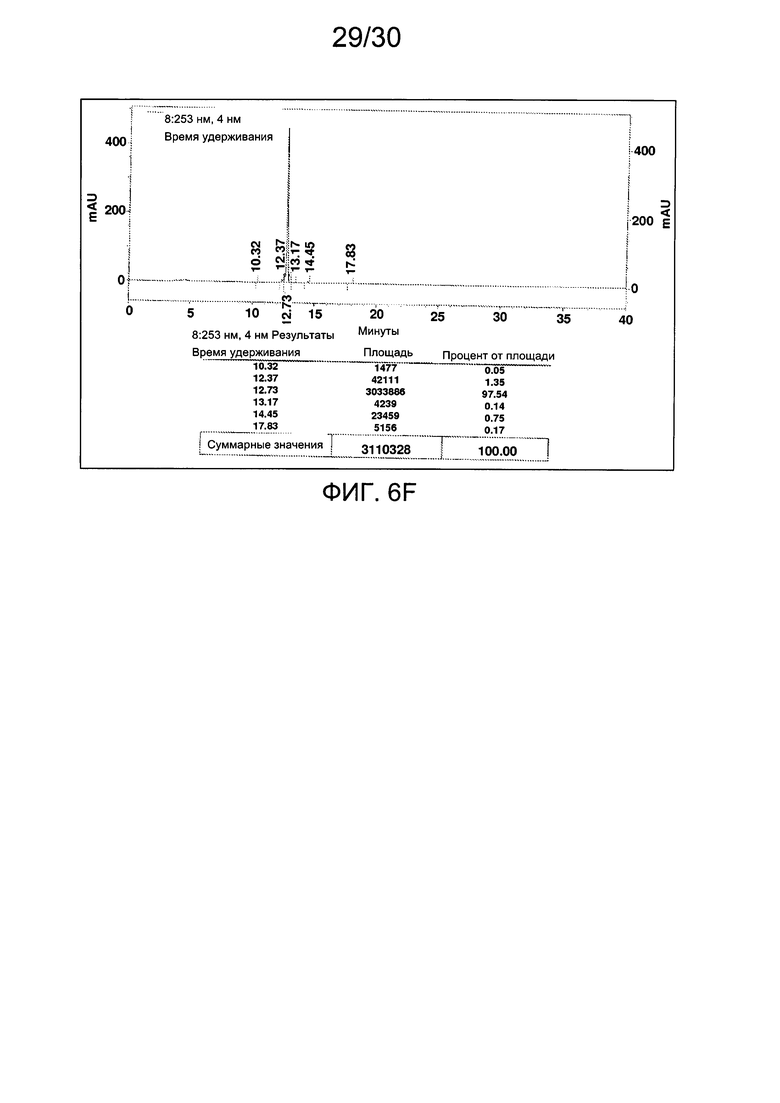
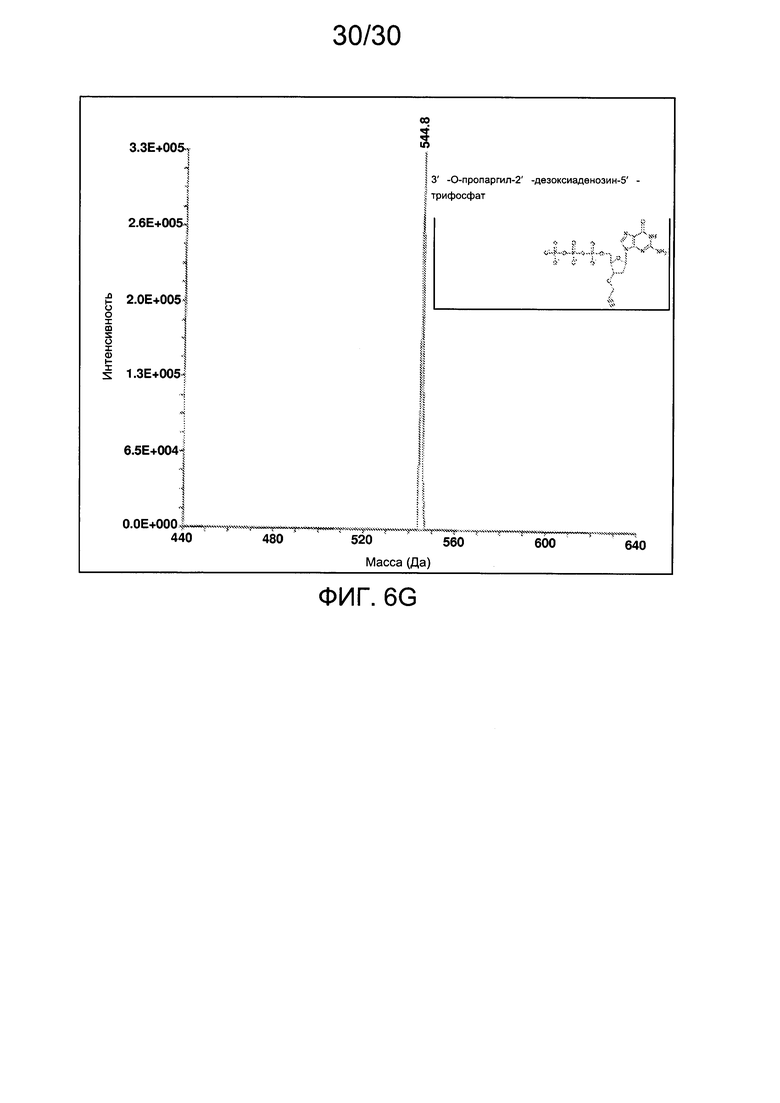
Изобретение относится к биотехнологии и к области молекулярной диагностики. Предложен набор для получения реакционной смеси для синтеза 3'-O-пропаргил-модифицированной нуклеиновой кислоты. Набор содержит по меньшей мере один дезоксинуклеотидтрифосфат (дНТФ), по меньшей мере один 3'-O-пропаргильный аналог нуклеотида и полимеразу, которая способна встраивать 3'-O-пропаргильный аналог нуклеотида в цепь целевой нуклеиновой кислоты. В одном варианте полимераза представляет собой полимеразу Thermococcus sp.9°N-7 и содержит по меньшей мере одну мутацию, выбранную из D141A, Е143А, Y409V и A485L. Изобретение позволяет получать модифицированные нуклеиновые кислоты, которые не существуют в природных биологических системах и имеют диапазон размеров, соответствующих ожидаемым длинам нуклеиновых кислот, комплементарных матрице. 8 з.п. ф-лы, 30 ил., 2 табл., 10 пр.
1. Набор для получения реакционной смеси для синтеза 3'-O-пропаргил-модифицированной нуклеиновой кислоты, содержащий по меньшей мере один дезоксинуклеотидтрифосфат (дНТФ), по меньшей мере один 3'-O-пропаргильный аналог нуклеотида и полимеразу, которая способна встраивать 3'-O-пропаргильный аналог нуклеотида в цепь нуклеиновой кислоты.
2. Набор по п. 1, дополнительно содержащий целевую нуклеиновую кислоту.
3. Набор по п. 1, отличающийся тем, что указанная смесь содержит по меньшей мере один дНТФ и по меньшей мере один 3'-O-пропаргильный аналог нуклеотида в соотношении от 1:500 до 500:1.
4. Набор по п. 1, отличающийся тем, что указанная полимераза представляет собой полимеразу Thermococcus sp.9°N-7 и содержит по меньшей мере одну мутацию, выбранную из D141A, Е143А, Y409V и A485L.
5. Набор по п. 1, содержащий праймер, включающий индексную последовательность нуклеотидов, которая обеспечивает идентификацию целевой нуклеиновой кислоты.
6. Набор по п. 5, отличающийся тем, что указанная индексная последовательность нуклеотидов представляет собой последовательность-идентификатор, которая обеспечивает идентификацию признака нуклеиновой кислоты, с которой связана указанная последовательность-идентификатор.
7. Набор по п. 6, отличающийся тем, что указанный признак представляет собой образец или источник, из которого получена указанная нуклеиновая кислота.
8. Набор по п. 1, содержащий целевую нуклеиновую кислоту, которая представляет собой ампликон.
9. Набор по п. 1, отличающийся тем, что указанную полимеразу, способную встраивать 3'-O-пропаргильный аналог нуклеотида в цепь нуклеиновой кислоты, идентифицируют способом, включающим применение ДНК-матрицы, ДНК-праймера, который комплементарен указанной ДНК-матрице, и способом распознавания нуклеиновых кислот, отличающихся на одно основание.
| US 2013046084 A1, 21.02.2013 | |||
| GARDNER A | |||
| F | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US 2013130919 A1, 23.05.2013 | |||
| EL-SAGHEER et al | |||
| "Synthesis and Polymerase Chain Reaction Amplification of DNA Strands Containing an Unnatural Triazole Linkage" | |||
| J | |||
| Am | |||
| Chem | |||
| Soc., 2009, v | |||
| Способ получения продукта конденсации бетанафтола с формальдегидом | 1923 |
|
SU131A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПРОЧИСТКИ КЕРОСИНО-ГАЗОВЫХ ГОРЕЛОК ТИПА "ПРИМУС" | 1923 |
|
SU3958A1 |
| EL-SAGHEER et al | |||
| "New strategy for the synthesis of chemically modified RNA constructs exemplified by hairpin and hammerhead ribozymes" | |||
| PNAS, 2010, v | |||
| Счетный сектор | 1919 |
|
SU107A1 |
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| Приспособление к генератору переменного тока | 1928 |
|
SU15329A1 |
| EL-SAGHEER et al | |||
| "Biocompatible artificial DNA linker that is read through by DNA polymerases and is functional in Escherichia coli" | |||
| PNAS, 2011, v | |||
| Приспособление для останова мюля Dobson аnd Barlow при отработке съема | 1919 |
|
SU108A1 |
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| Устройство нефтяного отопления для содовых сушил | 1928 |
|
SU11338A1 |
| US 2011045489 A1, 24.02.2011 | |||
| СПОСОБ ПРОВЕДЕНИЯ АЛЛЕЛЬ-СПЕЦИФИЧНОЙ ПЦР ДЛЯ ГЕНОТИПИРОВАНИЯ КРУПНОГО РОГАТОГО СКОТА ПО АЛЛЕЛЯМ А И В ГЕНА КАППА-КАЗЕИНА | 2006 |
|
RU2337141C2 |
Авторы
Даты
2019-05-21—Публикация
2014-08-19—Подача