Область техники, к которой относится изобретение
Настоящее изобретение относится к способам и клеткам для получения по меньшей мере одного рамнолипида из источника углерода.
Предпосылки создания изобретения
На рынке существует общая потребность в поддающихся биологическому разложению поверхностно-активных веществах, которые получают из возобновляемого сырья, в качестве подходящей альтернативы доступным в настоящее время поверхностно-активным веществам, которые получают из нефтехимического сырья. Данная потребность, в частности, усугубляется прогнозируемой нехваткой нефтехимического сырья и возрастающей потребностью в поверхностно-активных веществах. Рамнолипиды представляют собой по меньшей мере один пример такого поверхностно-активного вещества. Рамнолипиды представляют собой перспективный с экономической точки зрения класс, поскольку они фактически могут заменить традиционные поверхностно-активные вещества, изготовленные из нефти или ее продуктов, и, таким образом, постоянно улучшать экологические характеристики получаемых составов.
Данные рамнолипиды содержат по меньшей мере один монорамнозил-липид или два радикала рамнозы (дирамнозил-липида) и один или два остатка жирной 3-гидроксикислоты (Handbook of Hydrocarbon and Lipid Microbiology, 2010). Они обладают поверхностно-активными свойствами, которые необходимы во всех видах применений для использования в качестве поверхностно-активного вещества (смотри Leitermann et al., 2009). В частности, рамнолипиды можно в значительной степени использовать в быту, чистке, косметике, пищевой промышленности, фармацевтике, защите растений и в других применениях.
В используемых в настоящее время способах получения этих рамнолипидов задействованы изоляты дикого типа различных патогенных бактерий человека и животных, в частности, представителей родов Pseudomonas и Burkholderia, (Handbook of Hydrocarbon and Lipid Microbiology, 2010). Тот факт, что эти патогенные организмы способны вызывать заболевания у потребителя, значительно уменьшает приемлемость для потребителя этих традиционно получаемых рамнолипидов. Кроме того, повышенные требования безопасности также повышают себестоимость вследствие повышенных капиталовложений и возможно дополнительных стадий получения. Поскольку продукты, в которых используют эти рамнолипиды, в основном представляют собой получаемые в крупных масштабах химические соединения, которые можно производить при очень низких затратах, то рамнолипиды также необходимо получать при максимально низких, насколько это возможно, затратах без риска для здоровья потребителя и с заданными свойствами.
Доступные в настоящее время способы получения рамнолипидов включают использование этих патогенных организмов и растительных масел в качестве субстрата или субстратного кофактора (Handbook of Hydrocarbon and Lipid Microbiology, 2010). Однако растительные масла представляют собой относительно дорогостоящее сырье по сравнению с другими источниками углерода, такими как, например, глюкоза, сахароза или полисахариды, такие как, например, крахмал, целлюлоза и гемицеллюлоза, глицерин, CO, CO2 или CH4. Также рамнолипиды получают с помощью непатогенных организмов, использующих источники углерода, такие как, например, глюкоза, сахароза или полисахариды, что указано в WO 2012013554 A1.
Однако по-прежнему существует потребность в эффективном получении рамнолипидов (в частности, монорамнозил-липида и/или дирамнозил-липидов) (т.e. дешевом и безопасном для здоровья) и в более чем достаточных количествах с использованием непатогенных организмов и альтернативного возобновляемого сырья.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с одним аспектом настоящее изобретение относится к способу, который может разрешить проблемы, присутствующие в уровне техники. В частности, настоящее изобретение относится к способу получения по меньшей мере одного рамнолипида путем культивирования рекомбинантной клетки в присутствии по меньшей мере одного источника углерода, где источник углерода представляет собой по меньшей мере одну C4-молекулу именно с 4 атомами углерода. Рекомбинантная клетка характеризуется повышенной активностью по меньшей мере одного из ферментов α/β-гидролазы, рамнозилтрансферазы I или рамнозилтрансферазы II по сравнению с клеткой дикого типа. Этот способ может быть особенно предпочтительным, поскольку он может обеспечивать возможность высоко избирательного получения монорамнозил-липидов и/или дирамнозил-липидов со снижением количества получаемых нежелательных побочных продуктов и промежуточных продуктов. Например, может образовываться по меньшей мере меньшее количество промежуточных продуктов, таких как димеры жирных β-гидроксикислот (димеры жирной кислоты), образующихся в соответствии с любым аспектом настоящего изобретения, в сравнении с доступными в настоящее время способами.
Дополнительные преимущества способа в соответствии с любым аспектом настоящего изобретения включают без ограничения тот факт, что можно использовать организмы, которые являются непатогенными и простыми в культивировании. Дополнительное преимущество может включать тот факт, что при использовании способа в соответствии с любым аспектом настоящего изобретения может отсутствовать необходимость в использовании субстратов на основе масел и простых углеводов (например, глюкозы, фруктозы или сахарозы) в качестве единственного субстрата или субстратного кофактора. В соответствии с любым аспектом настоящего изобретения другое преимущество может заключаться в том, что можно получать рамнолипиды с определенными и поддающимися изменению свойствами. В частности, можно также получать дирамнозил-липиды. Дополнительное преимущество может заключаться в том, что рамнолипиды можно получать с более высокими объемной производительностью и выходами углерода, чем при использовании клеток без усиления данных видов активности.
В соответствии с любым аспектом настоящего изобретения рамнолипиды и/или смеси рамнолипидов, которые можно получить с использованием любого аспекта настоящего изобретения, могут также являться объектом настоящего изобретения. Рамнолипиды и смеси, которые можно получить в соответствии с любым аспектом настоящего изобретения, можно преимущественно использовать по меньшей мере в чистящих средствах или средствах по уходу, в косметических, дерматологических или фармацевтических составах, а также в составах для защиты растений, концентратах поверхностно-активных веществ и им подобных.
Выражение «средства по уходу» в данном документе следует рассматривать в значении состава, который удовлетворяет цель поддержания исходной формы изделия, снижая или предупреждая эффекты внешних воздействий (например, время, свет, температуру, давление, загрязнение, химическую реакцию с другими реакционноспособными соединениями, вступающими в контакт с изделием, и им подобными) и старение, загрязнение, усталость материала и/или даже улучшение требуемых положительных свойств изделия. Примеры желаемых положительных свойств изделия могут включать такие характеристики, как улучшенный блеск волос или увеличенная эластичность изделия и им подобные.
«Составы для защиты растений» следует понимать в данном документе как означающие такие составы, которые по природе входящих в их состав препаратов, используют для защиты растения. В частности, это тот случай, когда по меньшей мере одно соединение из группы, включающей гербициды, фунгициды, инсектициды, акарициды, нематоциды, вещества, защищающие от наносимого птицами ущерба, питательные вещества для растений и улучшающие структуру почвы средства, содержится в составе.
Рамнолипиды, получаемые в соответствии любым аспектом настоящего изобретения, можно использовать в качестве компонента средств по уходу и чистящих средств, которые используются в быту, промышленности, в частности, для твердых поверхностей, кожи и/или текстиля.
В соответствии с одним аспектом настоящего изобретения предусмотрен по меньшей мере один способ получения по меньшей мере одного рамнолипида, предусматривающий:
- приведение рекомбинантной клетки в контакт со средой, содержащей источник углерода; и
- культивирование клетки в подходящих условиях для получения рамнолипида из источника углерода при помощи клетки,
где рекомбинантная клетка генетически модифицирована таким образом, что по сравнению с клеткой дикого типа данная клетка характеризуется повышенной активностью по меньшей мере одного из ферментов E1, E2 и E3, где фермент E1 представляет собой α/β-гидролазу, фермент E2 представляет собой рамнозилтрансферазу I и фермент E3 представляет собой рамнозилтрансферазу II, и где источник углерода представляет собой C4-молекулу.
В соответствии с другим аспектом настоящего изобретения предусмотрена клетка, которая способна к образованию по меньшей мере одного рамнолипида из C4-молекулы, где клетка генетически модифицирована таким образом, что по сравнению с клеткой дикого типа данная клетка характеризуется повышенной активностью фермента оксидоредуктазы и по меньшей мере одного из ферментов E1, E2 и E3, где фермент E1 представляет собой α/β-гидролазу, фермент E2 представляет собой рамнозилтрансферазу I и фермент E3 представляет собой рамнозилтрансферазу II.
Более конкретно, клетки в соответствии с любым аспектом настоящего изобретения могут быть способны к образованию рамнолипидов, и по сравнению с их диким типом характеризуются повышенной активностью по меньшей мере одного генного продукта или гомологов генных продуктов rhlA, rhlB и rhlC. По меньшей мере в одном примере гены rhlA, rhlB и rhlC из Pseudomonas aeruginosa можно вводить в организмы GRAS (в целом считающиеся безопасными) (что описано в WO2012013554A1) для получения рамнолипидов из C4-молекул. В одном конкретном примере клетка в соответствии с любым аспектом настоящего изобретения может представлять собой P. putida, штамм KT2440.
В частности, C4-молекула, представленная в данном документе, может представлять собой структуру, содержащую C, H и/или O. В частности, C4-молекула может представлять собой любое соединение, содержащее именно 4 атома углерода (т.e. не более и не менее 4 атомов углерода в каждом звене) в структуре соединения. «C4-молекула» в соответствии с любым аспектом настоящего изобретения относится к органическому соединению, содержащему именно четыре атома C и различное число атомов H, в зависимости от других атомов, находящихся в структуре соединения с 4 атомами углерода. C4-молекула также может содержать атомы O. В частности, C4-молекула в соответствии с любым аспектом настоящего изобретения может представлять собой бутан и продукты окисления бутана. Продукты окисления бутана включают по меньшей мере 1-бутанол, 2-бутанол, 1-бутаналь, бутанон и масляную кислоту. В частности, C4-молекула может быть выбрана из группы, включающей бутан, 1-бутанол, 2-бутанол, 1-бутаналь, бутанон, масляную кислоту и их комбинации. C4-молекула также может представлять собой тетрозу.
Более конкретно, C4-молекула, используемая в соответствии с любым аспектом настоящего изобретения, может быть лишь одним типом C4-молекулы (т.e. только бутаном, 1-бутанолом, 2-бутанолом, 1-бутаналем, бутаноном или масляной кислотой). В одном примере используемая C4-молекула может представлять собой комбинацию любых C4-молекул, выбранных из группы, включающей бутан, 1-бутанол, 2-бутанол, 1-бутаналь, бутанон и масляную кислоту. Например, C4-молекула в соответствии с любым аспектом настоящего изобретения может представлять собой комбинацию бутана и 1-бутанола, бутана и 2-бутанола, бутана и 1-бутаналя, бутана и бутанона, бутана и масляной кислоты и им подобных. В одном примере может быть по меньшей мере 3, 4, 5 или 6 различных C4-молекул, используемых в качестве источника углерода в соответствии с любым аспектом настоящего изобретения. В другом примере может быть представлена комбинация бутана, 1-бутанола и масляной кислоты, используемая в качестве C4-молекулы в соответствии с любым аспектом настоящего изобретения. В другом примере тетрозу можно использовать отдельно или в комбинации с бутаном и продуктами окисления бутана в качестве источника углерода в соответствии с любым аспектом настоящего изобретения.
Среда, используемая в соответствии с любым из аспектов настоящего изобретения, содержит по меньшей мере один источник углерода. Источник углерода в среде может представлять по меньшей мере C4-молекулу. В частности, источник углерода в среде может фактически включать или фактически содержать C4-молекулу. В частности, общее количество C4-молекул составляет по меньшей мере или равняется 20%, 40%, 50%, 60% или 70% по весу от общего содержания углерода в среде молекул источников углерода в виде C4 в общей среде. Более конкретно, общее количество C4-молекулы составляет по меньшей мере или равняется 50%, 70% или 80% по весу от источника углерода в среде. Еще более конкретно, C4-молекула может составлять по меньшей мере или равняться 90% или приблизительно 100% по весу от источника углерода в среде.
В одном примере среда может содержать второй источник углерода. В частности, источник углерода может представлять собой углеводы, такие как, например, глюкоза, сахароза, арабиноза, ксилоза, лактоза, фруктоза, мальтоза, типы мелассы, крахмал, целлюлоза и гемицеллюлоза, масла растительного и животного происхождения и жиры, такие как, например, соевое масло, сафлоровое масло, арахисовое масло, конопляное масло, ятрофное масло, кокосовое масло, калебасовое масло, льняное масло, кукурузное масло, масло из семян мака, масло первоцвета вечернего, оливковое масло, пальмоядровое масло, пальмовое масло, рапсовое масло, кунжутное масло, масло подсолнечника, масло из косточек винограда, ореховое масло, масло зародышей пшеницы и кокосовое масло, жирные кислоты, такие как, например, каприловая кислота, каприновая кислота, лауриновая кислота, миристиновая кислота, пальмитиновая кислота, пальмитолеиновая кислота, стеариновая кислота, арахидоновая кислота, бегеновая кислота, олеиновая кислота, линолевая кислота, линоленовая кислота, гамма-линоленовая кислота и ее сложный метиловый или этиловый эфир, а также смеси жирных кислот, моно-, ди- и триглицериды, содержащие какие-либо жирные кислоты, упомянутые выше, спирты, такие как, например, глицерин, этанол и метанол, углеводороды, такие как метан, углерод-содержащие газы и смеси газов, таких как CO, CO2, синтез-газ или отходящий газ, аминокислоты, такие как L-глутамат или L-валин, или органические кислоты, такие как, например, уксусная кислота. Эти вещества можно использовать по отдельности или в виде смеси. Углеводы, в частности, моносахариды, олигосахариды или полисахариды, можно использовать в качестве источника углерода, что описано в US 601494 и US 6136576, а также углеводороды, в частности, алканы, алкены и алкины, а также одноосновные карбоновые кислоты, полученные из них, и моно-, ди- и триглицериды, полученные из этих одноосновных карбоновых кислот, а также глицерин и ацетат. Можно использовать моно-, ди- и триглицериды, содержащие продукты этерификации глицерина и каприловой кислоты, каприновой кислоты, лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, пальмитолеиновой кислоты, стеариновой кислоты, арахидоновой кислоты, бегеновой кислоты, олеиновой кислоты, линолевой кислоты, линоленовой кислоты и/или гамма-линоленовой кислоты.
Существенное преимущество в соответствии с любым аспектом настоящего изобретения состоит в том, что клетки могут быть способны к образованию рамнолипидов из простейших источников углерода, таких как бутан, так что обеспечение длинноцепочечных источников углерода в среде в соответствии с любым аспектом настоящего изобретения может быть необязательным. Это может быть особенно преимущественным в случае отсутствия в среде в соответствии с любым аспектом настоящего изобретения поддающихся обнаружению карбоновых кислот с длиной цепи более шести атомов углерода, или сложных эфиров, или глицеридов, получаемых из них.
Основные соединения, такие как такие как гидроксид натрия, гидроксид калия, аммиак или аммиачная вода, или кислые соединения, такие как фосфорная кислота или серная кислота, можно предпочтительно использовать в среде для контроля значения pH культуры. Для контроля образования пены можно использовать противовспенивающие средства, такие как, например, сложные полигликолевые эфиры жирных кислот. Подходящие избирательно действующие вещества, такие как, например, антибиотики, можно добавлять в среду для поддержания стабильности плазмид. Для поддержания аэробных условий в культуру можно добавлять кислород или кислородсодержащие смеси газов, такие как, например, воздух.
Температура в культуре, как правило, составляет более или равняется 20°C, 25°C, она также может составлять более или равняться 40°C, при этом преимущественно можно использовать температуру культивирования, которая составляет по меньшей мере или равняется 95°C, в частности, по меньшей мере или равняется 90°C, и более конкретно по меньшей мере или равняется 80°C.
Специалист в данной области поймет, в чем заключаются подходящие условия для культивирования рекомбинантных клеток в соответствии с любым аспектом настоящего изобретения для получения рамнолипидов по меньшей мере из C4-молекулы. Используя основные способы, известные из уровня техники, специалист в данной области будет способен варьировать условия в среде для удовлетворения потребностей соответствующей клетки, используемой в соответствии с любым аспектом настоящего изобретения.
Согласно способу в соответствии с любым аспектом настоящего изобретения, рамнолипиды, образуемые при помощи клеток, можно необязательно выделить из клеток и/или среды. Можно использовать все известные из уровня техники способы выделения низкомолекулярных веществ из сложных композиций. Например, способы, такие как фильтрация, экстрагирование, адсорбция (хроматография), кристаллизация и им подобные, можно использовать для фазы с продуктом.
Выделенный продукт в фазе с продуктом может также содержать другие нежелательные остатки биомассы и других примесей, такие как масла, жирные кислоты и другие составляющие компоненты в виде питательных веществ среды. Отделение этих примесей и им подобных можно осуществлять с помощью процесса без растворителя. Таким образом, например, выделенный продукт можно вначале разбавить водой, чтобы облегчить регулирование значения pH. Фазу с продуктом и водную фазу можно затем гомогенизировать путем превращения рамнолипидов в водорастворимую форму путем снижения или повышения значения pH при помощи кислот или щелочей соответственно. Можно содействовать растворимости рамнолипидов в водной фазе путем инкубирования реакционной смеси при повышенных температурах, например, при 60-90°C, и/или при постоянном перемешивании. Путем последующего повышения или снижения значения pH при помощи щелочей или кислот рамнолипиды затем можно снова превращать в водонерастворимую форму с тем, чтобы их легко отделить от водной фазы. Затем фазу с продуктом можно промыть один или более раз водой для удаления водорастворимых примесей.
Остатки масел можно отделить, например, путем экстрагирования с помощью подходящих растворителей, преимущественно с помощью органических растворителей. В качестве растворителя можно использовать алкан, такой как, например, н-гексан и ему подобные.
В противоположность описанному выше процессу без растворителя, отделение продукта от водной фазы можно осуществить с использованием подходящего растворителя, например, сложного эфира, такого как, например, этилацетат, бутилацетат и им подобные. Данные стадии экстрагирования можно проводить в любой требуемой последовательности. Специалист в данной области сможет легко варьировать последовательность стадий и/или используемых растворителей, которые подходят для клетки и для подлежащего экстрагированию рамнолипида.
В другом примере растворители можно использовать при экстрагировании рамнолипидов, полученных в соответствии с любым аспектом настоящего изобретения. В частности, можно использовать органические растворители. Более конкретно, в качестве растворителя можно использовать н-пентанол. Для удаления растворителя проводят, например, перегонку. Впоследствии лиофилизированный продукт можно дополнительно очистить, например, с помощью хроматографических способов. К примеру, можно использовать осаждение с помощью подходящих растворителей, экстракцию с помощью подходящих растворителей, комплексообразование, например, с помощью циклодекстринов или производных циклодекстрина, кристаллизацию, очистку или выделение с помощью хроматографических способов или превращение рамнолипидов в легко отделяемые производные.
Рекомбинантная клетка, используемая в соответствии с любым аспектом настоящего изобретения, является генетически модифицированной таким образом, что по сравнению с клеткой дикого типа данная клетка характеризуется повышенной активностью по меньшей мере одного из ферментов E1, E2 и E3, где фермент E1 представляет собой α/β-гидролазу, фермент E2 представляет собой рамнозилтрансферазу I и фермент E3 представляет собой рамнозилтрансферазу II. Рекомбинантная клетка, используемая в соответствии с любым аспектом настоящего изобретения, может быть получена в соответствии со способом, раскрытым в WO 2012013554 A1.
В частности, в клетке в соответствии с любым аспектом настоящего изобретения фермент E1 может быть способен катализировать превращение 3-гидроксиалканоил-ACP через 3-гидроксиалканоил-3-гидроксиалкановую кислоту-ACP в гидроксиалканоил-3-гидроксиалкановую кислоту, фермент E2 может представлять собой рамнозилтрансферазу I и может быть способен катализировать превращение dTDP-рамнозы и 3-гидроксиалканоил-3-гидроксиалканоата в a-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоат, и фермент E3 может представлять собой рамнозилтрансферазу II и может быть способен катализировать превращение dTDP-рамнозы и a-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоата в a-L-рамнопиранозил-(1-2)-a-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоат, где эти ферменты E1, E2 и E3 могут быть выбраны из группы, включающей:
по меньшей мере один фермент E1, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6 и их фрагменты;
по меньшей мере один фермент E2, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и их фрагменты; и
по меньшей мере один фермент E3, содержащий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15 и их фрагменты. Фрагмент, соответствующий какому-либо из ферментов E1, E2 или E3, может содержать полипептидную последовательность, в которой не более 25% аминокислотных радикалов модифицированы посредством делеции, вставки, замены или их комбинации по сравнению с последовательностью соответствующего фермента, и фрагмент характеризуется по меньшей мере 10% ферментативной активности соответствующего фермента.
В частности, фермент E1 в клетке в соответствии с любым аспектом настоящего изобретения может быть выбран из группы, включающей:
фермент E1a, содержащий полипептидную последовательность под SEQ ID NO: 2 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 2 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 2, где ферментативную активность фермента E1a можно рассматривать в значении способности превращать 3-гидроксидеканоил-ACP через 3-гидроксидеканоил-3-гидроксидекановую кислоту-ACP в гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E1b, содержащий полипептидную последовательность под SEQ ID NO: 3 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 3 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 3, где ферментативную активность фермента E1b можно рассматривать в значении способности превращать 3-гидроксидеканоил-ACP через 3-гидроксидеканоил-3-гидроксидекановую кислоту-ACP в гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E1c, содержащий полипептидную последовательность под SEQ ID NO: 4 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 4 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 4, где ферментативную активность фермента E1c можно рассматривать в значении способности превращать 3-гидроксидеканоил-ACP через 3-гидроксидеканоил-3-гидроксидекановую кислоту-ACP в гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E1d, содержащий полипептидную последовательность под SEQ ID NO: 5 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 5 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 5, где ферментативную активность фермента E1d можно рассматривать в значении способности превращать 3-гидроксидеканоил-ACP через 3-гидроксидеканоил-3-гидроксидекановую кислоту-ACP в гидроксидеканоил-3-гидроксидекановую кислоту, и
фермент E1e, содержащий полипептидную последовательность под SEQ ID NO: 6 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 6 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 6, где ферментативную активность фермента E1e можно рассматривать в значении способности превращать 3-гидроксидеканоил-ACP через 3-гидроксидеканоил-3-гидроксидекановую кислоту-ACP в гидроксидеканоил-3-гидроксидекановую кислоту.
В частности, фермент E2, используемый в клетке в соответствии с любым аспектом настоящего изобретения, может быть выбран из группы, включающей:
фермент E2a, характеризующийся полипептидной последовательностью под SEQ ID NO: 7 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 7 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 7, где ферментативную активность фермента E2a можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и 3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E2b, характеризующийся полипептидной последовательностью под SEQ ID NO: 8 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 8 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 8, где ферментативную активность фермента E2b можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и 3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E2с, характеризующийся полипептидной последовательностью под SEQ ID NO: 9 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 9 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 9, где ферментативную активность фермента E2с можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и 3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E2d, характеризующийся полипептидной последовательностью под SEQ ID NO: 10 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 10 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 10, где ферментативную активность фермента E2d можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и 3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту, и
фермент E2e, характеризующийся полипептидной последовательностью под SEQ ID NO: 11 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 11 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 11, где ферментативную активность фермента E2e можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и 3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту.
В частности, фермент E3, используемый в клетке в соответствии с любым аспектом настоящего изобретения, может быть выбран из группы, включающей:
фермент E3a, характеризующийся полипептидной последовательностью под SEQ ID NO: 12 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 12 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 12, где ферментативную активность фермента E3a можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-(1-2)-a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E3b, характеризующийся полипептидной последовательностью под SEQ ID NO: 13 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 13 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 13, где ферментативную активность фермента E3b можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-(1-2)-a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту,
фермент E3c, характеризующийся полипептидной последовательностью под SEQ ID NO: 14 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 14 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 14, где ферментативную активность фермента E3c можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-(1-2)-a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту, и
фермент E3d, характеризующийся полипептидной последовательностью под SEQ ID NO: 15 или характеризующийся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 15 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 90% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 15, где ферментативную активность фермента E3d можно рассматривать в значении способности предпочтительно превращать dTDP-рамнозу и a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту в a-L-рамнопиранозил-(1-2)-a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановую кислоту.
Специалист в данной области поймет, что активности, указанные выше для ферментов E1a-E3b, являются лишь конкретным примером иллюстративного выбора широкого спектра активностей данных ферментов; при этом упомянутая соответствующая активность является той, для которой доступен достоверный способ измерения в случае с указанным ферментом. Таким образом, очевидно, что фермент в случае с субстратом, имеющим неразветвленный, насыщенный C10-алкильный радикал, также может быть способен превращать те субстраты, которые содержат C6- или C16-алкильный радикал, который необязательно может быть разветвленным или ненасыщенным.
Рекомбинантную клетку в соответствии с любым аспектом настоящего изобретения можно также генетически модифицировать таким образом, чтобы по сравнению с клеткой дикого типа данная клетка характеризовалась повышенной активностью фермента оксидоредуктазы. В частности, клетку можно генетически модифицировать таким образом, чтобы клетка характеризовалась повышенной активностью E1, E2 или E3 или их комбинаций и оксидоредуктазы. Более конкретно, клетки могут характеризоваться повышенной активностью E1, E2, E3 и оксидоредуктазы. В одном примере клетки характеризуются повышенной активностью E1 и E2 и оксидоредуктазы, или E1 и E3 и оксидоредуктазы, или E2 и E3 и оксидоредуктазы.
Оксидоредуктаза может представлять собой оксидоредуктазу типа alkB. Оксидоредуктазы этого класса, alkB, представляют собой редокс-белки из системы AlkBGT Pseudomonas putida, зависимые от двух вспомогательных полипептидов, alkG и alkT. AlkT представляет собой FAD-зависимую рубредоксинредуктазу, переносящую электроны от NADH к alkG. AlkG представляет собой рубредоксин, железосодержащий редокс-белок, функционирующий в качестве прямого донора электронов для alkB. В одном конкретном примере оксидоредуктаза типа alkB представляет собой alkB из Pseudomonas putida Gpo1 (номер доступа: CAB54050.1 (версия 1), SEQ ID NO: 1, любой используемый в данной заявке номер доступа относится к соответствующей последовательности из базы данных Genbank, управляемой NCBI, при этом ее выпуск относится к выпуску, вышедшему в сеть Интернет с 4 апреля 2014).
Фермент оксидоредуктаза типа alkB характеризуется полипептидной последовательностью под SEQ ID NO: 1 или характеризуется полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с референтной последовательностью под SEQ ID NO: 1 посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 10%, 50%, 80%, в частности, более чем 92% ферментативной активности фермента с референтной последовательностью под SEQ ID NO: 1, где ферментативную активность фермента оксидоредуктазы типа alkB можно рассматривать в значении способности предпочтительно превращать бутан в 1-бутанол и/или 2-бутанол, если бутан используют в качестве источника углерода, то есть если бутан используют в качестве C4-молекулы в соответствии с любым аспектом настоящего изобретения.
Оксидоредуктаза может представлять собой монооксигеназу. В частности, монооксигеназа может представлять собой монооксигеназу типа P450, например, цитохром P450 из Candida tropicalis или из Cicer arietinum. Более конкретно, CYP153 представляет собой монооксигеназу, например, цитохром P450-монооксигеназу из Alcanivorax borkumensis SK2 (YP_691921). Монооксигеназу можно сперва использовать в окислении бутана в спирт.
В другом примере оксидоредуктаза может представлять собой NAD(P)H-зависимую алкогольдегидрогеназу (ADH). В частности, ADH может происходить из Escherichia coli MS 187-1 (ZP_07145023), из Bacillus stearothermophilus (P42328), из Ralstonia eutropha (ACB78191.1), из Lactobacillus brevis (YP_795183.1), из Lactobacillus kefiri (ACF95832.1), из печени лошадей, из Paracoccus pantotrophus (ACB78182.1) или из Sphingobium yanoikuyae (EU427523.1). В одном примере ADH может представлять собой флавин-зависимую ADH, например, из Candida tropicalis (AAS46878.1). ADH можно использовать, если бутанол используют в качестве источника углерода, то есть, если бутанол используют в качестве C4-молекулы в соответствии с любым аспектом настоящего изобретения, получаемой из бутана непосредственно или in situ.
В одном примере оксидоредуктаза может происходить из семейства глюкоза-метанол-холин-оксидоредуктазы, в особенности из Caulobacter sp. K31 (ABZ74557.1). Эту конкретную оксидоредуктазу можно также использовать, если бутанол используют в качестве источника углерода, то есть, если бутанол используют в качестве C4-молекулы в соответствии с любым аспектом настоящего изобретения, получаемой из бутана непосредственно или in situ.
Выражение «повышенная активность фермента» следует понимать как означающее повышенную внутриклеточную активность.
Приведенные ниже описание и определения по отношению к повышенной ферментативной активности в клетках применимы как для повышения активности ферментов E1-E3 и оксидоредуктазы, так и для всех далее упоминаемых в данном раскрытии ферментов, активность которых можно необязательно повышать. В частности, все способы, описанные во всем данном описании по отношению к ферментам E1, E2 и E3, можно использовать и для фермента оксидоредуктазы, который может необязательно присутствовать в рекомбинантной клетке в соответствии с любым аспектом настоящего изобретения.
По сути, повышение ферментативной активности может достигаться путем увеличения числа копий последовательности гена или последовательностей генов, которые кодируют фермент, использования сильного промотора или улучшенного сайта связывания рибосомы, аттенуирования негативной регуляции экспрессии гена, например, с помощью регуляторов транскрипции, или усиления положительной регуляции экспрессии гена, модифицирования использования кодонов в гене, различными способами, увеличивающими время полужизни мРНК или фермента, путем модифицирования регуляции экспрессии гена или использования гена или аллеля, кодирующего соответствующий фермент с повышенной активностью, и необязательного комбинирования данных средств. В соответствии с любым аспектом настоящего изобретения генетически-модифицированные клетки получают, например, путем трансформации, трансдукции, конъюгации или комбинации этих способов с использованием вектора, который содержит требуемый ген, аллель с этим геном или его частями, и необязательно содержит промотор, обеспечивающий возможность экспрессии гена. В частности, гетерологичная экспрессия достигается путем интеграции гена или аллеля в хромосому клетки или внехромосомно реплицирующегося вектора.
В DE-A-10031999 приведен ряд примеров способов повышения ферментативной активности в клетках на примере пируваткарбоксилазы. Специалист в данной области с легкостью использует способы, раскрытые в DE-A-10031999, для повышения ферментативной активности в клетках в соответствии с любым аспектом настоящего изобретения.
Экспрессия упомянутых выше и всех упоминаемых в дальнейшем ферментов или генов поддается выявлению с помощью 1- и/или 2-мерного гель-разделения белков и дальнейшего оптического определения концентрации белка в геле с использованием соответствующего аналитического программного обеспечения. Если повышение ферментативной активности основано исключительно на повышении экспрессии соответствующего гена, то количественное определение ферментативной активности можно определить путем простого сравнения результатов 1- и/или 2-мерного гель-разделения белков между клеткой дикого типа и генетически-модифицированной клеткой. Стандартным способом получения гелей с белками в случае с Сorynebacterium и для идентификации белков является процедура, описанная в публикации Hermann et al., 2001. Концентрацию белков можно проанализировать при помощи Вестерн блот-гибридизации с использованием антитела, специфичного для подлежащего выявлению белка (Sambrook et al., 1989), и последующего оптического анализа с использованием соответствующего программного обеспечения для определения концентрации (Lohaus and Meyer, 1989). Активность ДНК-связывающих белков можно измерить с помощью ДНК-анализов изменения подвижности в геле (также называемых как задержка в геле) (Wilson et al., 2001). Влияние ДНК-связывающих белков на экспрессию белков можно выявить с помощью различных хорошо известных методик с использованием репортерного гена (Sambrook et al., 1989). Внутриклеточные ферментативные активности можно также определить в соответствии с различными стандартными способами (Donahue et al., 2000; Ray et al., 2000; Freedberg et al., 1973). Если в следующих примерах не указаны конкретные способы определения активности определенного фермента, то определение повышения ферментативной активности или определение снижения ферментативной активности можно осуществлять посредством способов, описанных в публикациях Hermann et al., 2001, Lohaus et al., 1998, Lottspeich, 1999 и Wilson et al., 2001.
Если повышение ферментативной активности достигается за счет мутации в эндогенном гене, тогда такие мутации можно индуцировать случайным образом с помощью либо общепринятых способов, таких как, например, путем УФ-облучения или путем воздействия мутагенных химических соединений, или избирательно посредством генноинженерных способов, таких как делеция(делеции), вставка(вставки) и/или замена нуклеотидов(замены нуклеотидов). Модифицированные клетки получают с помощью данных мутаций. Мутированные ферменты представляют собой, в частности, такие ферменты, активность которых или больше не тормозится по типу обратной связи, продуктом или субстратом или тормозится в меньшей степени по меньшей мере по сравнению с ферментом дикого типа.
Если повышение ферментативной активности достигается путем увеличения синтеза фермента, то число копий соответствующих генов может увеличиваться, или может подвергаться мутации промоторный и регуляторный участок или участок связывания рибосомы, расположенный выше структурного гена. Кассеты экспрессии, встроенные выше структурного гена, действуют подобным образом. Посредством по меньшей мере индуцируемых промоторов также является возможным повышение экспрессии гена в любой требуемой точке времени. «Энхансеры» также могут быть отнесены к представляющему интерес гену, который кодирует фермент, в качестве регуляторных последовательностей, которые аналогичным образом вызывают повышение экспрессии гена посредством улучшения взаимодействия между РНК-полимеразой и ДНК. За счет средств по удлинению срока жизни мРНК аналогичным образом улучшается экспрессия. Также путем предупреждения деградации белка-фермента также может быть увеличена ферментативная активность. Гены или конструкции генов в данном случае присутствуют либо в плазмидах, имеющих различное число копий, либо интегрированы и амплифицированы в хромосоме. В другом примере сверхэкспрессия соответствующих генов может достигаться путем модифицирования состава среды и контроля культивирования. Для осуществления этого специалист в данной области найдет указания, в частности, в Martin et al., 1987, Guerrero et al., 1994, Tsuchiya and Morinaga, 1988, Eikmanns et al., 1991, EP-A-0472869, US 4601893, Schwarzer and Pühler, 1991, Reinscheid et al., 1994, LaBarre et al., 1993, WO 96/15246A, Malumbres et al., 1993, JP10229891A, Jensen and Hammer, 1998 и в известных пособиях по генетике и молекулярной биологии. Подобно мутациям, средства, описанные выше, также приводят в результате к генетически модифицированным клеткам, которые можно использовать согласно любому аспекту настоящего изобретения.
Эписомальные плазмиды, например, используют для повышения экспрессии соответствующих генов. В принципе, все подходящие плазмиды или векторы теоретически доступны специалисту в данной области для достижения этой цели. Такие плазмиды и векторы можно найти, например, в брошюрах компаний Novagen, Promega, New England Biolabs, Clontech или Gibco BRL. В частности, описание плазмид и векторов можно обнаружить в: Glover, D. M., 1985, Rodriguez, R.L. and Denhardt, D. T, 1988, Butterworth, Stoneham; Goeddel, D. V., 1990, Fritsch, E. F. and Maniatis, T., 1989.
Плазмидный вектор, который содержит подлежащий амплификации ген, затем превращают в соответствующий штамм путем конъюгации или трансформации. Способ конъюгации описан, например, в Schäfer et al., 1994. Способы трансформации описаны, например, по меньшей мере в Thierbach et al., 1988, Dunican and Shivnan, 1989 и Tauch et al., 1994. После гомологичной рекомбинации посредством события «кроссинговера», полученный в результате штамм содержит по меньшей мере две копии соответствующего гена. Используя данный способ, по меньшей мере число копий генов в штамме можно увеличивать до требуемого числа.
Под используемой в составах выше и в следующих примерах «активностью фермента (Ex), повышенной по сравнению с ее диким типом» всегда следует понимать как означающую активность соответствующего фермента Ex, увеличенную по меньшей мере в 2, в частности, по меньшей мере в 10, более конкретно по меньшей мере в 100, еще более конкретно по меньшей мере в 1000 и наиболее конкретно по меньшей мере в 10000 раз. Клетка в соответствии с любым аспектом настоящего изобретения, которая характеризуется «повышенной активностью фермента (Ex) по сравнению с ее диким типом», в частности, также предусматривает клетку, чей дикий тип не характеризуется или по меньшей мере не характеризуется выявляемой активностью данного фермента Ex, и которая проявляет выявляемую активность данного фермента Ex только после повышения ферментативной активности, например путем сверхэкспрессии. В этом контексте выражение «сверхэкспрессия» или «повышающий экспрессию» состав, используемый в следующих примерах, также предусматривает случай, где исходная клетка, например, клетка дикого типа, не имеет или по меньшей мере не имеет выявляемой экспрессии, a выявляемый синтез фермента Ex индуцирован только рекомбинантными способами. Ex также может относиться к оксидоредуктазe.
Клетка «дикого типа» в данном документе означает клетку, геном которой присутствует в таком состоянии, в котором он образовался в природе в ходе эволюции. Данное выражение используют как для целой клетки, так и для отдельных генов. Следовательно, выражение «дикий тип», в частности, не включает те клетки или те гены, у которых последовательности генов были по меньшей мере частично модифицированы человеком с помощью рекомбинантных способов.
В частности, повышение ферментативной активности по отношению к клетке дикого типа может быть измерено с использованием традиционных способов, известных в данной области. Например, повышенную активность E1, E2 и E3 можно измерить с использованием способов, раскрытых в литературном источнике Burger, M. M., 1963 и Burger, M. M., 1966.
Специалисту в данной области известны замены аминокислотных радикалов в указанной полипептидной последовательности, которые не приводят к значительным изменениям свойств и функции указанного полипептида. Таким образом, например, «консервативные аминокислоты» можно взаимозаменять. Примеры таких подходящих аминокислотных замен включают без ограничения: Ala вместо Ser; Arg вместо Lys; Asn вместо Gln или His; Asp вместо Glu; Cys вместо Ser; Gln вместо Asn; Glu вместо Asp; Gly вместо Pro; His вместо Asn или Gln; Ile вместо Leu или Val; Leu вместо Met или Val; Lys вместо Arg, или Gln, или Glu; Met вместо Leu или Ile; Phe вместо Met, или Leu, или Tyr; Ser вместо Thr; Thr вместо Ser; Trp вместо Tyr; Tyr вместо Trp или Phe; Val вместо Ile вместо Leu. Также известно, что замены, в частности, по N- или C-концу полипептида, в форме, например, аминокислотных вставок или делеций, зачастую не оказывают значительного влияния на функцию полипептида.
Активность фермента можно определить путем разрушения клеток, которые содержат фермент с такой активностью, с помощью способа, известного специалисту в данной области, например, с использованием шаровой мельницы, френч-пресса или ультразвукового дезинтегратора. Затем разделение клеток, клеточного дебриса и средств для разрушения, таких как, например, стеклянные бусины, можно осуществлять с помощью по меньшей мере центрифугирования в течение 10 минут при 13000 об./мин. и 4°C.
Используя полученный в результате бесклеточный неочищенный экстракт, затем можно провести анализ активности ферментов с последующим обнаружением продуктов в LC-ESI-MS. В качестве альтернативы, требуемый фермент можно обогащать при помощи способов, хорошо известных специалисту в данной области, например, при помощи хроматографических способов (таких как аффинная хроматография с никель-нитрилотриуксусной кислотой, аффинная хроматография со стрептавидином, гель-фильтрационная хроматография или ионообменная хроматография), или же очищать до однородного состояния.
Активность фермента E1 может быть определена с использованием образцов ферментов, полученных как описано выше, следующим путем: стандартный образец для анализа может содержать 100 мкМ ACP E. сoli, 1 мM β-меркаптоэтанола, 200 мкМ малонил-кофермента A, 40 мкМ октаноил-кофермента A (для E1a) или додеканоил-кофермента A (для E1b), 100 мкМ NADPH, 2 мкг FabD E. сoli, 2 мкг FabH Mycobacterium tuberculosis, 1 мкг FabG E. сoli, 0,1 M натрий-фосфатного буфера, pH 7,0, и 5 мкг фермента E1 в конечном объеме 120 мкл. ACP, β-меркаптоэтанол и натрий-фосфатный буфер инкубируют в течение 30 мин. при 37°C для полной инактивации ACP. Затем реакцию инициируют путем добавления фермента E1. Реакции можно остановить с использованием 2 мл воды, которую подкисляют с помощью HCl до pH 2,0, а затем дважды экстрагируют с помощью 2 мл смеси хлороформ/метанол (2:1 (объем:объем)). Затем при помощи центрифугирования осуществляют разделение фаз (16100 g, 5 мин., RT). Нижнюю органическую фазу можно полностью удалить путем полного выпаривания вакуумным насосом-центрифугой и осадок можно отобрать в 50 мкл метанола. Нерастворенные составляющие компоненты удаляют в виде осадка путем центрифугирования (16100 g, 5 мин., RT) и образец анализируют посредством LC-ESI-MS. Идентификацию продуктов проводят путем анализа соответствующих выборок ионов и спектров MS2.
Активность фермента E2 может быть определена с использованием образцов ферментов, полученных как описано выше, следующим путем: стандартный образец для анализа может содержать 185 мкл 10 мM tris-HCl (pH 7,5), 10 мкл 125 мM dTDP-рамнозы и 50 мкл неочищенного экстракта белка (приблизительно 1 мг общего белка) или очищенного белка в растворе (5 мкг очищенного белка). Реакцию инициируют путем добавления 10 мкл 10 мM раствора 3-гидроксидеканоил-3-гидроксидекановой кислоты (для E2a) или 3-гидрокситетрадеканоил-3-гидрокситетрадекановой кислоты (для E2b) в этаноле и инкубируют в течение 1 ч. при 30°C со встряхиванием (600 об./мин.). Затем реакционную смесь можно обрабатывать 1 мл ацетона. Нерастворенные составляющие компоненты удаляют в виде осадка путем центрифугирования (16100 g, 5 мин., RT) и образец анализируют посредством LC-ESI-MS. Идентификацию продуктов проводят путем анализа соответствующих выборок ионов и спектров MS2.
Активность фермента E3 может быть определена с использованием образцов ферментов, полученных как описано выше, следующим путем: стандартный образец для анализа может содержать 185 мкл 10 мM tris-HCl (pH 7,5), 10 мкл 125 мM dTDP-рамнозы и 50 мкл неочищенного экстракта белка (приблизительно 1 мг общего белка) или очищенного белка в растворе (5 мкг очищенного белка). Реакцию инициируют путем добавления 10 мкл 10 мM раствора a-L-рамнопиранозил-3-гидроксидеканоил-3-гидроксидекановой кислоты (для E3a) или a-L-рамнопиранозил-3-гидрокситетрадеканоил-3-гидрокситетрадекановой кислоты (для E3b) в этаноле и инкубируют в течение 1 ч. при 30°C со встряхиванием (600 об./мин.). Затем реакционную смесь обрабатывают 1 мл ацетона. Нерастворенные составляющие компоненты осаждают путем центрифугирования (16100 g, 5 мин., RT) и образец анализируют посредством LC-ESI-MS. Идентификацию продуктов проводят путем анализа соответствующих выборок ионов и спектров MS2.
Рекомбинантные клетки в соответствии с любым аспектом настоящего изобретения могут характеризоваться повышенными активностями по меньшей мере E1, E2 и/или E3. В частности, клетки могут характеризоваться повышенной активностью E1, E2 или E3 или их комбинаций. Более конкретно, клетки могут характеризоваться повышенной активностью E1, E2 и E3. В одном примере клетки характеризуются повышенной активностью E1 и E2, или E1 и E3, или E2 и E3.
Активность фермента оксидоредуктазы можно определить с помощью любого способа, известного из уровня техники. В частности, активность оксидоредуктазы типа alkB можно определить с использованием способа, раскрытого в WO 2009/077461 A1, активность монооксигеназ типа P450 можно определить с использованием способа, приведенного в публикации Scheps, D et al., 2011, и активность ADH с помощью способа, приведенного в публикации Benson, S., Shapiro, J., J. Bacteriol. 1976, 126, 794-798.
Таким образом, с целью культивирования и получения указанных выше продуктов генетически модифицированные клетки в соответствии с любым аспектом настоящего изобретения можно приводить в контакт со средой непрерывно или прерывисто в периодическом процессе (периодической культуре), или в процессе периодического культивирования (процесс с подпиткой), или в процессе повторяющегося периодического культивирования (повторяющийся процесс с подпиткой). Также возможен полунепрерывный процесс, такой как описан в GB-A-1009370. Краткое описание известных способов культивирования описано в пособии под авторством Chmiel или в пособии под авторством Storhas. Подлежащая использованию культуральная среда должна в достаточной степени удовлетворять требования соответствующих штаммов. Описания культуральных сред для различных штаммов дрожжей содержатся, например, в Klaus Wolf, 1996.
Клетки в соответствии с любым аспектом настоящего изобретения могут быть прокариотами или эукариотами. Эти клетки могут представлять собой клетки млекопитающих (такие как, например, клетки человека), клетки растений или микроорганизмов, таких как дрожжи, грибы или бактерии, где микроорганизмы являются особенно предпочтительными, а бактерии и грибы являются наиболее предпочтительными.
Подходящие бактерии, дрожжи или грибы представляют собой, в частности, те бактерии, дрожжи или грибы, которые депонированы в Немецкой коллекции микроорганизмов и культур клеток (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH) (DSMZ), Брауншвейг, Германия, в виде штаммов бактерий, дрожжей или грибов. Бактерии, подходящие в соответствии с настоящим изобретением, принадлежат к родам, которые перечислены ниже:
- http://www.dsmz.de/species/bacteria.htm,
дрожжи, подходящие в соответствии с настоящим изобретением, принадлежат к родам, которые перечислены ниже:
- http://www.dsmz.de/species/yeasts.htm,
и грибы, подходящие в соответствии с настоящим изобретением, принадлежат к родам, которые перечислены ниже:
- http://www.dsmz.de/species/fungi.htm.
В частности, клетки могут быть выбраны из родов Aspergillus, Corynebacterium, Brevibacterium, Bacillus, Acinetobacter, Alcaligenes, Lactobacillus, Paracoccus, Lactococcus, Candida, Pichia, Hansenula, Kluyveromyces, Saccharomyces, Escherichia, Zymomonas, Yarrowia, Methylobacterium, Ralstonia, Pseudomonas, Rhodospirillum, Rhodobacter, Burkholderia, Clostridium и Cupriavidus. Более конкретно, клетки могут быть выбраны из группы, включающей Aspergillus nidulans, Aspergillus niger, Alcaligenes latus, Bacillus megaterium, Bacillus subtilis, Brevibacterium flavum, Brevibacterium lactofermentum, Burkholderia andropogonis, B. brasilensis, B. caledonica, B. caribensis, B. caryophylli, B. fungorum, B. gladioli, B. glathei, B. glumae, B. graminis, B. hospita, B. kururiensis, B. phenazinium, B. phymatum, B. phytofirmans, B. plantarii, B. sacchari, B. singaporensis, B. sordidicola, B. terricola, B. tropica, B. tuberum, B. ubonensis, B. unamae, B. xenovorans, B. anthina, B. pyrrocinia, B. thailandensis, Candida blankii, Candida rugosa, Corynebacterium glutamicum, Corynebacterium efficiens, Escherichia coli, Hansenula polymorpha, Kluveromyces lactis, Methylobacterium extorquens, Paracoccus versutus, Pseudomonas argentinensis, P. borbori, P. citronellolis, P. flavescens, P. mendocina, P. nitroreducens, P. oleovorans, P. pseudoalcaligenes, P. resinovorans, P. straminea, P. aurantiaca, P. aureofaciens, P. chlororaphis, P. fragi, P. lundensis, P. taetrolens, P. antarctica, P. azotoformans, 'P. blatchfordae', P. brassicacearum, P. brenneri, P. cedrina, P. corrugata, P. fluorescens, P. gessardii, P. libanensis, P. mandelii, P. marginalis, P. mediterranea, P. meridiana, P. migulae, P. mucidolens, P. orientalis, P. panacis, P. proteolytica, P. rhodesiae, P. synxantha, P. thivervalensis, P. tolaasii, P. veronii, P. denitrificans, P. pertucinogena, P. cremoricolorata, P. fulva, P. monteilii, P. mosselii, P. parafulva, P. putida, P. balearica, P. stutzeri, P. amygdali, P. avellanae, P. caricapapayae, P. cichorii, P. coronafaciens, P. ficuserectae, 'P. helianthi', P. meliae, P. savastanoi, P. syringae, P. tomato, P. viridiflava, P. abietaniphila, P. acidophila, P. agarici, P. alcaliphila, P. alkanolytica, P. amyloderamosa, P. asplenii, P. azotifigens, P. cannabina, P. coenobios, P. congelans, P. costantinii, P. cruciviae, P. delhiensis, P. excibis, P. extremorientalis, P. frederiksbergensis, P. fuscovaginae, P. gelidicola, P. grimontii, P. indica, P. jessenii, P. jinjuensis, P. kilonensis, P. knackmussii, P. koreensis, P. lini, P. lutea, P. moraviensis, P. otitidis, P. pachastrellae, P. palleroniana, P. papaveris, P. peli, P. perolens, P. poae, P. pohangensis, P. psychrophila, P. psychrotolerans, P. rathonis, P. reptilivora, P. resiniphila, P. rhizosphaerae, P. rubescens, P. salomonii, P. segitis, P. septica, P. simiae, P. suis, P. thermotolerans, P. aeruginosa, P. tremae, P. trivialis, P. turbinellae, P. tuticorinensis, P. umsongensis, P. vancouverensis, P. vranovensis, P. xanthomarina, Ralstonia eutropha, Rhodospirillum rubrum, Rhodobacter sphaeroides, Saccharomyces cerevisiae, Yarrowia lipolytica и Zymomonas mobile. Еще более конкретно клетки могут быть выбраны из группы, включающей Pseudomonas putida, Escherichia coli и Burkholderia thailandensis.
В соответствии с любым аспектом настоящего изобретения клетки в форме их дикого типа могут быть неспособны к образованию выявляемых количеств рамнолипидов и/или характеризуются отсутствием активности или невыявляемой активностью ферментов E1, E2, E3 и/или оксидоредуктазы.
В соответствии с любым аспектом настоящего изобретения преимущественно, чтобы клетка была способна в форме ее дикого типа образовывать полигидроксиалканоаты с длиной цепи моноалканоата от C6 до C16. Таким клетками являются, например, Burkholderia sp., Burkholderia thailandensis, Pseudomonas sp., Pseudomonas putida, Pseudomonas aeruginosa, Pseudomonas oleovorans, Pseudomonas stutzeri, Pseudomonas fluorescens, Pseudomonas citronellolis, Pseudomonas resinovorans, Comamonas testosteroni, Aeromonas hydrophila, Cupriavidus necator, Alcaligenes latus и Ralstonia eutropha. В этом контексте клетки в соответствии с любым аспектом настоящего изобретения могут быть генетически модифицированы таким образом, чтобы по сравнению с их диким типом они были способны образовывать меньшее количество полигидроксиалканоатов. Такие клетки описаны, например, по меньшей мере в публикациях De Eugenio et al., 2010, и Rehm et al., 2001. Такая рекомбинантная клетка, способная образовывать меньшее количество полигидроксиалканоатов по сравнению со своим диким типом, в частности, характеризуется тем, что по сравнению со своим диким типом она характеризуется пониженной активностью по меньшей мере одного фермента E9 или E10.
E9 представляет собой полигидроксиалканоатсинтазу, EC:2.3.1., в частности, характеризующуюся полипептидной последовательностью под SEQ ID NO: 20 (E9a) или SEQ ID NO: 21 (E9b), или характеризующуюся полипептидной последовательностью, в которой не более 25%, 20%, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов по сравнению с соответствующей референтной последовательностью под SEQ ID NO: 20 или SEQ ID NO: 21 модифицированы посредством делеции, вставки, замены или их комбинации, и которая также характеризуется по меньшей мере 10%, 50%, в частности, 80%, в частности, более чем 90% ферментативной активности фермента с соответствующей референтной последовательностью под SEQ ID NO: 20 или SEQ ID NO: 21, где ферментативную активность фермента E9 (E9a и E9b) можно рассматривать в значении способности превращать 3-гидроксиалканоил-кофермент A в поли-3-гидроксиалкановую кислоту, в частности, 3-гидрокситетрадеканоил-кофермент A в поли-3-гидрокситетрадекановую кислоту.
E10 представляет собой 3-гидроксиалканоил-АСР:кофермент А-трансферазу, в частности, характеризующуюся полипептидной последовательностью под SEQ ID NO: 22 (E10a) или SEQ ID NO: 23 (E10b), или характеризующуюся полипептидной последовательностью, в которой не более 25%, 20%, в частности, 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с соответствующей референтной последовательностью под SEQ ID NO: 22 или SEQ ID NO: 23 посредством делеции, вставки, замены или их комбинации, и которая также характеризуется по меньшей мере 10%, 50%, в частности, 80%, в частности, более чем 90% ферментативной активности фермента с соответствующей референтной последовательностью под SEQ ID NO: 22 (E10a) или SEQ ID NO: 23 (E10b), где ферментативную активность фермента E10 (E10a и E10b) можно рассматривать в значении способности превращать 3-гидроксиалканоил-AСР в 3-гидроксиалканоил-кофермент А, в частности, 3-гидроксиалканоил-AСР в 3-гидрокситетрадеканоил-кофермент А.
Активность фермента E9 (E9a и E9b) можно определить, например, путем использования образцов, полученных, как описано выше, для ферментов E1-E3, сперва путем смешивания 560 мкл 100 мM tris/HCl, pH 7,5, 20 мкл 35 мM DTNB в DMSO и 20 мкл 41 мM 3-гидроксидеканоил-кофермента A. Затем добавляют 5 мкг очищенного фермента E9 в 100 мкл tris/HCl, pH 7,5, а затем в течение 1 минуты с помощью спектрометра непрерывно регистрируют усиление экстинкции при 412 нм (вызываемого добавлением 5,5’-дитиобис(2-нитробензоата) (DTNB) для высвобождения групп SH) за определенный период времени (ΔE/мин.).
Активность фермента E10 (E10a и E10b) можно определить, например, путем использования образцов, полученных как описано выше для ферментов E1-E3. Стандартный образец для анализа может содержать 3 мM MgCl2, 40 мкм гидроксидеканоил-кофермента A и 20 мкм E. coli ACP в 50 мM tris-HCl, pH 7,5, в общем объеме 200 мкл. Реакцию инициируют путем добавления 5 мкг очищенного фермента E10 в 50 мкл tris/HCl, pH 7,5 и инкубируют в течение 1 ч. при 30°C. Реакцию останавливают путем добавления 50% (вес/объем) трихлоруксусной кислоты и 10 мг/мл BSA (30 мкл). Высвобожденный кофермент A можно определить спектрофотометрически путем регистрирования усиления экстинкции при 412 нм, вызываемого добавлением 5,5’-дитиобис(2-нитробензоата) (DTNB) с высвобождением группы SH за определенный период времени.
Выражение «сниженная активность фермента Ex», используемое со ссылкой на какой-либо аспект настоящего изобретения, можно понимать как означающее активность, сниженную по меньшей мере в 0,5, в частности, по меньшей мере в 0,1, более конкретно по меньшей мере в 0,01, еще более конкретно по меньшей мере в 0,001 и наиболее конкретно по меньшей мере в 0,0001 раз. Выражение «сниженная активность» также подразумевает отсутствие выявляемой активности («нулевая активность»). На снижение активности определенного фермента можно влиять, например, путем избирательной мутации или при помощи других средств, известных специалисту в данной области, для снижения активности определенного фермента.
В частности, специалист в данной области найдет инструкции по модификации и снижению экспрессии белка и сопутствующему понижению ферментативной активности, в особенности для Pseudomonas и Burkholderia, путем изменения активности специфичных генов, как, например, описано по меньшей мере в публикациях Dubeau et al. 2009., Singh & Röhm. 2008., Lee et al., 2009 и им подобным.
Клетки в соответствии с любым аспектом настоящего изобретения характеризуются тем, что снижение ферментативной активности достигается с помощью модификации гена, содержащего одну или более последовательностей нуклеиновых кислот, где модификация выбрана из группы, предусматривающей, включающей вставку чужеродной ДНК в ген, делецию по меньшей мере частей гена, точечные мутации в последовательности гена, РНК-интерференцию (миРНК), антисмысловую РНК или модификацию (вставку, делецию или точечные мутации) регуляторных последовательностей, таких как, например, промоторов и терминаторов или сайтов связывания рибосомы, которые фланкируют ген.
В этом контексте чужеродную ДНК необходимо понимать как означающую любую последовательность ДНК, которая является «чужеродной» по отношению к гену (а не для организма), т.e. в этом контексте последовательности эндогенной ДНК могут также выступать в качестве «чужеродной ДНК». В связи с этим особенно предпочтительно, чтобы изменение активности осуществляли путем вставки селектируемого маркерного гена, то есть чужеродная ДНК представляет собой селектируемый маркерный ген, где предпочтительно вставку осуществляют путем гомологичной рекомбинации в локусе гена.
В частности, клетки, которые можно использовать в соответствии с любым аспектом настоящего изобретения, могут представлять собой клетки Pseudomonas putida, которые характеризуются пониженным синтезом полигидроксиалканоата по сравнению с их диким типом. Такие клетки описаны, например, в виде KTOY01 и KTOY02, в публикациях Ren et al.,1998, Huisman et al., 1991, De Eugenio et al., 2010 и Ouyang et al. 2007.
Рамнолипиды, образованные в соответствии со способом по настоящему изобретению, могут быть представлены в виде по меньшей мере общей формулы (I) или соли на основе нее,
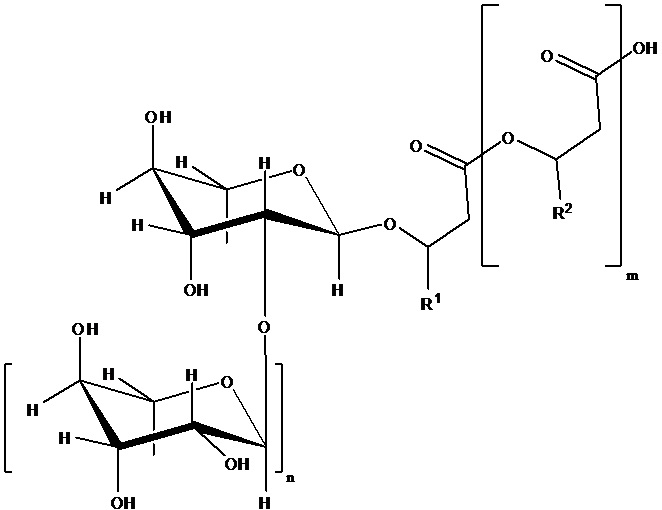
формула (I),
где
m = 2, 1 или 0, в частности 1 или 0,
n = 1 или 0, в частности 1,
R1 и R2 = независимо друг от друга представляют собой одинаковые или различные органические радикалы, имеющие от 2 до 24, предпочтительно от 5 до 13 атомов углерода, в частности, необязательно разветвленные, необязательно замещенные, в частности, гидроксизамещенные, необязательно ненасыщенные, в частности, необязательно моно-, ди- или триненасыщенные алкильные радикалы, которые могут быть выбраны из группы, включающей пентенил, гептенил, ноненил, ундеценил и тридеценил и (CH2)o-CH3 с o = 1-23, предпочтительно 4-12.
В том случае, если клетка в соответствии с любым аспектом настоящего изобретения способна образовывать рамнолипид с m=1, радикал
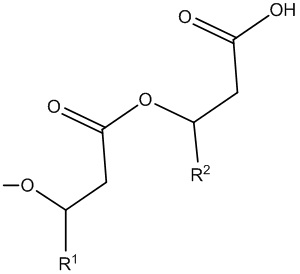
может быть определен с помощью R1 и R2, полученных из 3-гидроксиоктаноил-3-гидроксиоктановой кислоты, 3-гидроксиоктаноил-3-гидроксидекановой кислоты, 3-гидроксидеканоил-3-гидроксиоктановой кислоты, 3-гидроксиоктаноил-3-гидроксидеценовой кислоты, 3-гидроксидеценоил-3-гидроксиоктановой кислоты, 3-гидроксиоктаноил-3-гидроксидодекановой кислоты, 3-гидроксидодеканоил-3-гидроксиоктановой кислоты, 3-гидроксиоктаноил-3-гидроксидодеценовой кислоты, 3-гидроксидодеценоил-3-гидроксиоктановой кислоты, 3-гидроксидеканоил-3-гидроксидекановой кислоты, 3-гидроксидеканоил-3-гидроксидеценовой кислоты, 3-гидроксидеценоил-3-гидроксидекановой кислоты, 3-гидроксидеценоил-3-гидроксидеценовой кислоты, 3-гидроксидеканоил-3-гидроксидодекановой кислоты, 3-гидроксидодеканоил-3-гидроксидекановой кислоты, 3-гидроксидеканоил-3-гидроксидодеценовой кислоты, 3-гидроксидеканоил-3-гидрокситетрадеценовой кислоты, 3-гидрокситетрадеканоил-3-гидроксидеценовой кислоты, 3-гидроксидодеценоил-3-гидроксидекановой кислоты, 3-гидроксидеканоил-3-гидрокситетрадекановой кислоты, 3-гидрокситетрадеканоил-3-гидроксидекановой кислоты, 3-гидроксидеканоил-3-гидрокситетрадеценовой кислоты, 3-гидрокситетрадеценоил-3-гидроксидекановой кислоты, 3-гидроксидодеканоил-3-гидроксидодекановой кислоты, 3-гидроксидодеценоил-3-гидроксидодекановой кислоты, 3-гидроксидодеканоил-3-гидроксидодеценовой кислоты, 3-гидроксидодеканоил-3-гидрокситетрадекановой кислоты, 3-гидрокситетрадеканоил-3-гидроксидодекановой кислоты, 3-гидрокситетрадеканоил-3-гидрокситетрадекановой кислоты, 3-гидроксигексадеканоил-3-гидрокситетрадекановой кислоты, 3-гидрокситетрадеканоил-3-гидроксигексадекановой кислоты или 3-гидроксигексадеканоил-3-гидроксигексадекановой кислоты.
Для специалиста в данной области очевидно, что в соответствии с любым аспектом настоящего изобретения могут образовываться смеси разных рамнолипидов с общей формулой (I).
В этом контексте клетки в соответствии с любым аспектом настоящего изобретения могут быть способны к образованию смесей рамнолипидов с общей формулой (I), которые характеризуются тем, что в более 80% по весу, более 90% по весу, в частности, более 95% по весу образовавшихся рамнолипидов n =1, и радикал, определенный в виде R1 и R2, в менее 10% по весу, менее 5% по весу, в частности менее 2% по весу образовавшихся рамнолипидов получен из 3-гидроксидеканоил-3-гидроксиоктановой кислоты или 3-гидроксиоктаноил-3-гидроксидекановой кислоты,
где указанный % по весу относится к сумме всех образовавшихся рамнолипидов с общей формулой (I).
Поскольку клетки в соответствии с любым аспектом настоящего изобретения можно преимущественно использовать для получения рамнолипидов и поскольку эти рамнолипиды затем необязательно очищают, преимущественно, чтобы клетки в соответствии с любым аспектом настоящего изобретения характеризовались повышенной активностью по меньшей мере фермента E8 по сравнению с их диким типом, который катализирует экспорт рамнолипидов с общей формулой (I) из клетки в окружающую среду.
В связи с этим белки E8 выбраны из группы, включающей
фермент E8, характеризующийся полипептидной последовательностью под SEQ ID NO: 16 (E8a), SEQ ID NO: 17 (E8b), SEQ ID NO: 18 (E8c) или SEQ ID NO: 19 (E8d), или характеризующийся полипептидной последовательностью, в которой не более 25%, не более 20%, в частности, не более 15%, в частности, не более 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных радикалов модифицированы по сравнению с соответствующей референтной последовательностью под SEQ ID NO: 16 (E8a), SEQ ID NO: 17 (E8b), SEQ ID NO: 18 (E8c) или SEQ ID NO: 19 (E8d) посредством делеции, вставки, замены или их комбинации, и который также характеризуется по меньшей мере 50%, 65%, в частности, 80%, в частности, более чем 90% ферментативной активности фермента с соответствующей референтной последовательностью под SEQ ID NO: 16 (E8a), SEQ ID NO: 17 (E8b), SEQ ID NO: 18 (E8c) или SEQ ID NO: 19 (E8d), где ферментативную активность фермента E8 (E8a, E8b E8c и E8d) рассматривают в значении способности экспортировать рамнолипид с общей формулой (I) из клетки в окружающую среду.
Таблица 1. Последовательности ферментов, используемые в соответствии с любым аспектом настоящего изобретения.
Краткое описание графических материалов
Фигура 1 представляет собой столбчатую диаграмму, изображающую состав в процентах образовавшихся рамнолипидных продуктов в зависимости от различных источников углерода.
Примеры
Вышеизложенное описывает предпочтительные варианты осуществления, которые, как будет понятно специалистам в данной области, могут подвергаться изменениям или модификациям при проектировании, построении или эксплуатации без отклонения от объема формулы изобретения. Эти изменения, например, предназначены для охвата объемом формулы изобретения.
При получении рамнолипидов с помощью Pseudomonas putida перед определением концентрации продукта в разных примерах образцы реакционных смесей сразу же после ферментации разбавляли ацетоном в объемном соотношении 1:1 и центрифугировали при 21000 g и 4°C в течение 2 мин. Образец супернатанта анализировали с помощью ВЭЖХ.
Пример 1 (Сравнительный пример не из настоящего изобретения)
Получение рамнолипидов из глюкозы с помощью BS-PP-001
В чашки с агаром LB, содержащие 50 мг/л канамицина, при помощи петли инокулировали штрихом замороженную в глицерине культуру штамма Pseudomonas putida KT2440 pBBR1MCS-2::ABC (BS-PP-001). Способ получения вектора pBBR1MCS-2::ABC представлен в примере 2 в документе DE102010032484A1. Затем Pseudomonas putida трансформировали с помощью вектора и сохраняли. Чашку с агаром инкубировали в течение 24 ч. при 30°C. В 100 мл колбу с перегородками, содержащую 25 мл среды LB с канамицином, инокулировали одиночную культуру, переросшую на чашке с агаром, и инкубировали в термостате со встряхиванием в течение 24 ч. при 30°C и 200 об./мин. для получения прекультуры. Прекультуру центрифугировали при 5500 g при комнатной температуре в течение 10 минут. Затем удаляли супернатант. Осадок ресуспендировали в 25 мл среды M9 (состав: 6,8 г/л Na2PO4.2H2O, 2,4 г/л KH2PO4, 0,4 г/л NaCl, 1,6 г/л NH4Cl, 0,5 г/л MgSO4.7H2O, 1 мл раствора микроэлементов US3, включающего 36,5 г/л 37% насыщенной хлористоводородной кислоты, 1,91 г/л MnCl2.4H2O, 1,87 г/л ZnSO4.7H2O, 0,84 г/л Na-EDTA.2H2O, 0,3 г/л H3BO3, 0,25 г/л Na2MoO4.2H2O, 4,7 г/л CaCl2.2H2O, 17,3 г/л FeSO4.7H2O, 0,15 г/л CuCl2.2H2O). Затем повторяли эту стадию промывки.
В 300 мл ферментер добавляли 180 мл описанной выше среды M9 с 20 г/л глюкозы и с 50 мг/л канамицина. В ферментер вносили большой объем суспензии прекультуры для достижения начальной OD600 0,4. В ходе ферментации устанавливали следующие параметры: пропускание воздуха - 2 нормальных литра/ч., концентрацию растворенного кислорода доводили до 30% путем настройки скорости мешалки. Измерение этих показателей осуществляли с использованием стандартного датчика концентрации кислорода, температуры 30°C, начального значения pH 7,4 (не регулировали на протяжении всего эксперимента). Через 40 ч. ферментации подавали через шприц раствор глюкозы (концентрация в ферментере: 15 г/л). В определенные периоды времени образцы отбирали из ферментера для определения концентрации полученных рамнолипидов и димеров жирных кислот.
Результаты показаны в таблице 2 ниже и на фигуре 1.
Пример 2
Получение рамнолипидов из масляной кислоты с помощью BS-PP-001
Прекультуру получали аналогично примеру 1 с глюкозой.
В 300 мл ферментер добавляли 180 мл описанной в примере 1 среды M9 с 6,5 г/л раствора бутирата натрия и с 50 мг/л канамицина. В ферментер вносили большой объем суспензии прекультуры для достижения начальной OD600 0,4. В ходе ферментации устанавливали следующие параметры: пропускание воздуха - 2 нормальных литра/ч., скорость мешалки 300 об./мин., температура 30°C, начальное значение pH 7,4 (не регулировали на протяжении всего эксперимента). Через 40 ч. ферментации подавали через шприц раствор бутирата натрия (концентрация в ферментере: 5 г/л масляной кислоты). Скорость мешалки увеличивали до 900 об./мин.
В определенные периоды времени образцы отбирали из ферментера для определения концентрации полученных рамнолипидов и димеров жирных кислот.
Результаты показаны в таблице 2 ниже и на фигуре 1.
Пример 3
Получение рамнолипидов из н-бутана с использованием BS-PP-001 + alkB
В чашки с агаром LB, содержащие 50 мг/л канамицина, при помощи петли инокулировали штрихом замороженную в глицерине культуру штамма P. Putida pBBR1MCS-2::ABC pBT10 (BS-PP001 + alkB). Этот штамм получали путем введения в штамм из примера 1 генной конструкции pBT10, описанной на страницах 36 и 37 (SEQ-ID 31) документа WO 2009/077461 A1. Чашки с агаром инкубировали в течение 24 ч. при 30°C.
Три 100 мл колбы с перегородками заполняли 25 мл среды LB, содержащей канамицин, и в каждую инокулировали одиночную культуру, переросшую на чашке с агаром, и инкубировали в термостате со встряхиванием в течение 24 ч. при 30°C и 200 об./мин.
Каждую из трех 1-литровых колб с перегородками использовали для смешивания 75 мл модифицированной среды M9 (состав: 15 г/л глюкозы, 6,8 г/л Na2PO4, 3 г/л KH2PO4, 0,5 г/л NaCl, 2 г/л NH4Cl, 15 г/л дрожжевого экстракта, 0,49 г/л MgSO4x7H2O, 50 мг/л канамицина сульфата, 15 мл/л раствора микроэлементов US3, включающего 36,5 г/л 37% насыщенной хлористоводородной кислоты, 11,91 г/л MnCl2.4H2O, 1,87 г/л ZnSO4.7H2O, 0,84 г/л Na-EDTA.2H2O, 0,3 г/л H3BO3, 0,25 г/л Na2MoO4.2H2O, 4,7 г/л CaCl2.2H2O, 17,3 г/л FeSO4.7H2O, 0,15 г/л CuCl2.2H2O) и прекультуры из 100 мл колб. Культуры инкубировали при 30°C и 200 об./мин. После 3 часов инкубирования гены alkBGT активировали посредством добавления 0,4 мM дициклопропилкетона. Культуры инкубировали в течение дополнительных 16 ч. при 25°C и 200 об./мин.
Культуры из трех колб объединяли и центрифугировали при 5500 g при комнатной температуре в течение 10 минут. Удаляли супернатант. Осадок ресуспендировали в 25 мл среды M9 (состав которой приведен выше). Эту стадию промывания повторяли для удаления глюкозы и других возможных источников углерода.
В 300 мл ферментер вносили 180 мл среды M9 (состав которой приведен выше без источника углерода), 50 мг/л канамицина. В ферментер вносили большой объем суспензии прекультуры из предшествующей стадии для достижения начальной OD600 10. В ходе ферментации устанавливали следующие параметры: пропускание смеси бутан/воздух (25%/75%) - 2 нормальных литра/ч., скорость мешалки 900 об./мин., температура 30°C, начальное значение pH 7,4 (не регулировали на протяжении всего эксперимента). В определенные периоды времени образцы отбирали из ферментера для определения концентрации полученных рамнолипидов и димеров жирных кислот.
Результаты показаны в таблице 2 ниже и на фигуре 1.
Таблица 2. Конечная концентрация полученных рамнолипидов и димеров жирных кислот с учетом используемого субстрата.
Из таблицы 2 можно увидеть, что штамм, имеющий гены rhlA, rhlB и rhlC из P. aeruginosa и вида P. putida KT2440 (BS-PP-001), был способен продуцировать приблизительно 1 г/л продуктов, из которых приблизительно 110 мг/л составляли рамнолипид и 81 мг/л монорамнолипид, а также практически 800 мг димеров нежелательных жирных кислот, если в качестве субстрата использовали глюкозу.
Если в качестве единственного источника углерода использовали бутират, то количество дирамнолипида значительно повышалось, тогда как образовывалась лишь одна треть димеров нежелательных жирных кислот. В другом примере штамм генетически модифицировали для введения гена оксидоредуктазы AlkB из Pseudomonas putida GPO1 и подавали бутан в качестве единственного источника углерода. Приведенные в таблице 2 результаты показали, что образовывалось приблизительно свыше 1000 мг/л дирамнолипида, и не образовывались поддающиеся измерению количества димеров нежелательных жирных кислот.
На фигуре 1 также изображен состав в процентах образовавшегося продукта в зависимости от различных источников углерода. Можно увидеть, что использование бутирата снижает количество димеров нежелательных жирных кислот с 81% до 64%, и при использовании бутана и бутанола образуется количество димеров жирных кислот, которое не поддается измерению.
Пример 4
Получение рамнолипидов из 1-бутанола с использованием BS-PP-001 + alkB
Три 100 мл колбы с перегородками наполняли 25 мл среды LB, содержащей канамицин и тетрациклин, и в каждую инокулировали 100 мкл замороженной в глицерине культуры штамма P. putida pBBR1MCS-2::ABC pBT10 (BS-PP001 + alkB). Этот штамм получали путем введения в штамм из примера 1 генной конструкции pBT10, описанной на страницах 36 и 37 (SEQ-ID 31) документа WO2009/077461A1. Колбы инкубировали в термостате со встряхиванием в течение дополнительных 24 ч. при 30°C и 200 об./мин.
Каждую из трех 1-литровых колб с перегородками использовали для смешивания 75 мл модифицированной среды M9 (состав: 15 г/л глюкозы, 6,8 г/л Na2PO4, 3 г/л KH2PO4, 0,5 г/л NaCl, 2 г/л NH4Cl, 15 г/л дрожжевого экстракта, 0,49 г/л MgSO4x7H2O, 50 мг/л канамицина сульфата, 10 мг/л тетрациклина, 15 мл/л раствора микроэлементов US3, включающего 36,5 г/л 37% насыщенной хлористоводородной кислоты, 11,91 г/л MnCl2.4H2O, 1,87 г/л ZnSO4.7H2O, 0,84 г/л Na-EDTA.2H2O, 0,3 г/л H3BO3, 0,25 г/л Na2MoO4.2H2O, 4,7 г/л CaCl2.2H2O, 17,3 г/л FeSO4.7H2O, 0,15 г/л CuCl2.2H2O) и прекультуры из 100 мл колб. Культуры инкубировали при 30°C и 200 об./мин. После 3 часов инкубирования гены alkBGT активировали посредством добавления 0,4 мM дициклопропилкетона. Культуры инкубировали в течение дополнительных 4 ч. при 30°C и 200 об./мин.
Культуры из трех колб объединяли и центрифугировали при 5500 g при комнатной температуре в течение 10 минут. Удаляли супернатант. Осадок ресуспендировали в 25 мл среды M9 (состав которой приведен выше). Эту стадию промывания повторяли для удаления глюкозы и других возможных источников углерода.
В 300 мл ферментер вносили 180 мл среды M9 (состав которой приведен выше без источника углерода), 50 мг/л канамицина. В ферментер вносили 10 мл суспензии прекультуры из предшествующей стадии для достижения начальной OD600 5. В ходе ферментации устанавливали следующие параметры: пропускание воздуха - 3 нормальных литра/ч., скорость мешалки 700 об./мин., температура 30°C, значение pH 7,0 (регулировали на протяжении всего эксперимента с помощью 5% раствора аммиака). Раствор бутанола подавали с помощью шприца (скорость подачи 0,2 г/(л.*ч.)). В определенные периоды времени образцы отбирали из ферментера для определения концентрации полученных рамнолипидов и димеров жирных кислот.
Результаты приведены в таблице 2 выше.
ССЫЛКИ
1. Handbook of Hydrocarbon and Lipid Microbiology, 2010, pages 3037-51
2. Leitermann et al., 2009
3. Hermann et al., (Electrophoresis, 22: 1712.23 (2001)
4. Sambrook et al., Molecular Cloning: a laboratory manual, 2nd Ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. USA, 1989
5. Lohaus and Meyer (1989) Biospektrum, 5: 32-39; Lottspeich (1999) Angewandte Chemie 111: 2630-2647
6. Wilson et al. (2001) Journal of Bacteriology, 183: 2151-2155
7. Donahue et al. (2000) Journal of Bacteriology 182 (19): 5624-5627
8. Ray et al. (2000) Journal of Bacteriology 182 (8): 2277-2284
9. Freedberg et al. (1973) Journal of Bacteriology 115 (3): 816-823
10. Lohaus et al., Biospektrum 5 32-39 (1998),
11. Lottspeich, Angewandte Chemie 111: 2630-2647 (1999)
12. Wilson et al., Journal of Bacteriology 183: 2151-2155 (2001)
13. Martin et al. Bio/Technology 5, 137-146 (1987)
14. Guerrero et al. Genes 138, 35-41 (1994)
15. Tsuchiya and Morinaga Bio/Technology 6, 428-430 (1988)
16. Eikmanns et al. Genes 102, 93-98 (1991))
17. Schwarzer and Pühler Bio/Technology 9, 84-87 (1991),
18. Reinscheid et al. Applied and Environmental Microbiology 60, 126-132 (1994),
19. LaBarre et al. Journal of Bacteriology 175, 1001-1007 (1993),
20. Malumbres et al. Genes 134, 15-24 (1993),
21. Jensen and Hammer Biotechnology and Bioengineering 58, 191-195 (1998)
22. Glover, D. M. (1985) DNA cloning: a practical approach, Vol. I-III, IRL Press Ltd., Oxford;
23. Rodriguez, R.L. and Denhardt, D. T (eds) (1988) Vectors: a survey of molecular cloning vectors and their uses, 179-204, Butterworth, Stoneham
24. Goeddel, D. V. (1990) Systems for heterologous gene expression, Methods Enzymol. 185, 3-7
25. Sambrook, J.; Fritsch, E. F. and Maniatis, T. (1989), Molecular cloning: a laboratory manual, 2nd ed., Cold Spring Harbor Laboratory Press, New York
26. Schäfer et al., Applied and Environmental Microbiology 60: 756-759 (1994)
27. Thierbach et al., Applied Microbiology and Biotechnology 29: 356-362 (1988)
28. Dunican and Shivnan, Bio/Technology 7: 1067-1070 (1989)
29. Tauch et al., FEMS Microbiology Let-ters 123: 343-347 (1994)
30. De Eugenio et al., Environ Microbiol. 2010. 12(1):207-21
31. Rehm et al., Appl Environ Microbiol. 2001. 67(7):3102-9
32. Dubeau et al. 2009. BMC Microbiology 9:263
33. Singh & Röhm. Microbiology. 2008. 154:797-809
34. Lee et al. FEMS Microbiol Lett. 2009. 297(1):38-48
35. Ren et al., Journal Applied Microbiology and Biotechnology 1998 Jun, 49(6):743-50,
36. Huisman et al., J Biol Chem. 1991 Feb 5;266(4):2191-8
37. De Eugenio et al., Environ Microbiol. 2010. 12(1):207-21
38. Ouyang et al. Macromol Biosci. 2007. 7(2):227-33
39. “Bioprozesstechnik 1. Einführung in die Bioverfahrenstechnik” [Bioprocess Technology 1. Introduction to the Bioprocess Technique] (Gustav Fischer Verlag, Stuttgart, 1991)
40. “Bioreaktoren und periphere Einrichtungen” [Bioreactors and Peripheral Devices], Vieweg Verlag, Brunswick/Wiesbaden, 1994
41. “Nonconventional yeast in biotechnology” (Ed. Klaus Wolf, Springer-Verlag Berlin, 1996)
42. Scheps, D., Malca, H., Hoffmann, B., Nestl, B. M, und Hauer, B. (2011) Org. Biomol. Chem., 9, 6727
43. WO2012013554A1, DE-A-10031999, GB-A-1009370, EP-A-0 472 869, US 4601893, WO-A-96/15246, JP-A-10-229891, WO2009/077461A1
44. Burger, M. M., et al., 1963. J. Biol. Chem. 238:2595-2602.
45. Burger, M. M., et al., 1966. Methods Enzymol. 8:441-445.
| название | год | авторы | номер документа |
|---|---|---|---|
| КЛЕТКИ И СПОСОБ ДЛЯ ПОЛУЧЕНИЯ РАМНОЛИПИДОВ | 2011 |
|
RU2619877C2 |
| БИОТЕХНОЛОГИЧЕСКОЕ ПОЛУЧЕНИЕ ω-ФУНКЦИОНАЛИЗИРОВАННЫХ КАРБОНОВЫХ КИСЛОТ И ИХ СЛОЖНЫХ ЭФИРОВ | 2016 |
|
RU2751363C2 |
| СПОСОБ БИОКАТАЛИТИЧЕСКОГО ОКИСЛЕНИЯ С ПРИМЕНЕНИЕМ ПРОДУКТА ГЕНА alkL | 2011 |
|
RU2573900C2 |
| ПОЛУЧЕНИЕ КСИЛИТА ИЗ ГЛЮКОЗЫ ПРИ ПОМОЩИ РЕКОМБИНАНТНОГО ШТАММА | 2015 |
|
RU2693593C2 |
| Новые трансаминазы и способ дезаминирования аминосоединения с их применением | 2016 |
|
RU2718778C2 |
| СИГНАЛЬНЫЕ ПЕПТИДЫ ТАТ ДЛЯ ПРОДУКЦИИ БЕЛКОВ В ПРОКАРИОТАХ | 2008 |
|
RU2487937C2 |
| СПОСОБЫ ПОВЫШЕНИЯ УСИЛИВАЮЩЕЙ ЦЕЛЛЮЛОЛИТИЧЕСКОЙ АКТИВНОСТИ ПОЛИПЕПТИДА | 2008 |
|
RU2510417C2 |
| ПРИМЕНЕНИЕ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ | 2005 |
|
RU2406759C2 |
| НОВАЯ ФИТАЗА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2712881C2 |
| СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ ИЛИ ПРЕВРАЩЕНИЯ ЦЕЛЛЮЛОЗНОГО МАТЕРИАЛА | 2006 |
|
RU2441912C2 |










































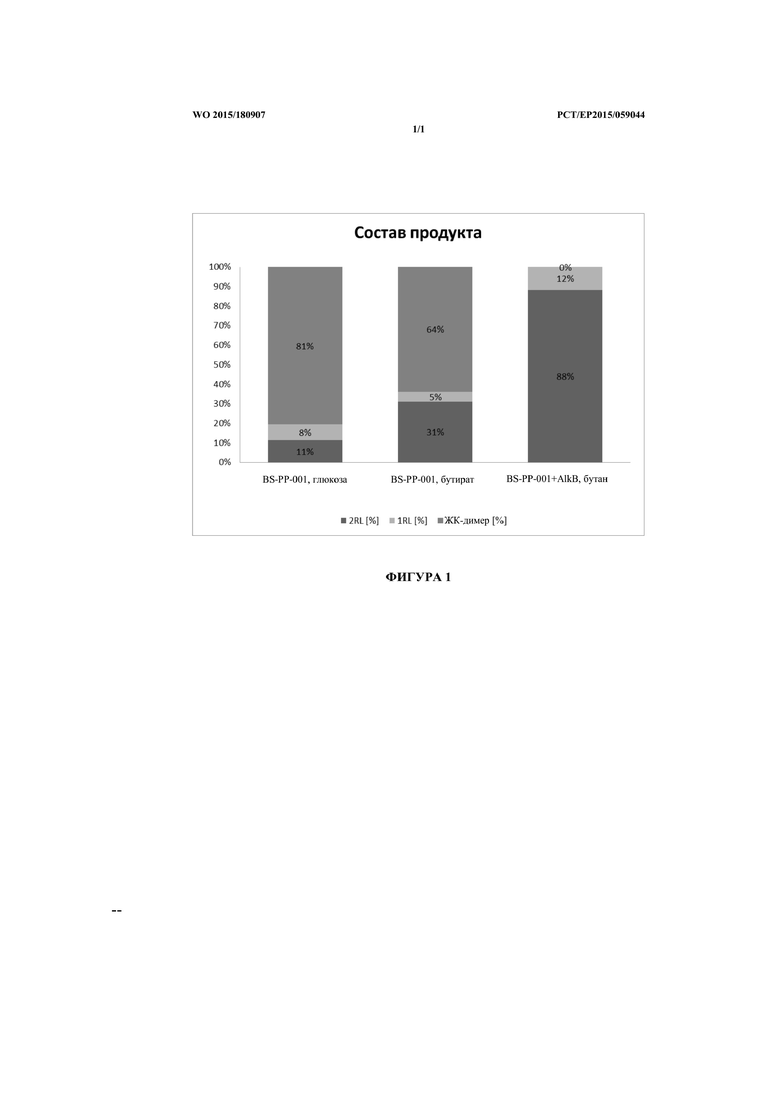
Группа изобретений относится к области биотехнологии. Предложен способ получения по меньшей мере одного рамнолипида, предусматривающий: приведение рекомбинантной клетки в контакт со средой, содержащей источник углерода; и культивирование клетки в подходящих условиях для получения рамнолипида из источника углерода при помощи клетки, где рекомбинантная клетка генетически модифицирована таким образом, что по сравнению с клеткой дикого типа данная клетка характеризуется повышенной активностью ферментов E1, и Е2, и Е3, и оксидоредуктазы типа alkB или повышенной активностью ферментов E1, и Е2, и оксидоредуктазы типа alkB, где фермент E1 представляет собой α/β-гидролазу, фермент Е2 представляет собой рамнозилтрансферазу I и фермент Е3 представляет собой рамнозилтрансферазу II и где источник углерода представляет собой С4-молекулу, где С4-молекула выбрана из группы, включающей бутан, 1-бутанол, 2-бутанол, 1-бутаналь, бутанон, масляную кислоту и их комбинации. Предложена клетка, способная к образованию по меньшей мере одного рамнолипида из С4-молекулы, предназначенная для осуществления указанного способа, где клетка представляет собой бактерию и генетически модифицирована таким образом, что по сравнению с клеткой дикого типа данная клетка характеризуется повышенной активностью ферментов E1, и Е2, и Е3, и оксидоредуктазы типа alkB или повышенной активностью ферментов E1, и Е2, и оксидоредуктазы типа alkB, где С4-молекула выбрана из группы, включающей бутан, 1-бутанол, 2-бутанол, 1-бутаналь, бутанон, масляную кислоту и их комбинации. Группа изобретений обеспечивает возможность получения рамнолипидов (монорамнозил-липидов и/или дирамнозил-липидов) из источника углерода, представляющего собой указанную С4-молекулу, со снижением количества получаемых нежелательных побочных и промежуточных продуктов, таких как димеры жирных β-гидроксикислот. 2 н. и 10 з.п. ф-лы, 1 ил., 2 табл., 4 пр.
1. Способ получения по меньшей мере одного рамнолипида, предусматривающий:
- приведение рекомбинантной клетки в контакт со средой, содержащей источник углерода; и
- культивирование клетки в подходящих условиях для получения рамнолипида из источника углерода при помощи клетки,
где рекомбинантная клетка генетически модифицирована таким образом, что по сравнению с клеткой дикого типа данная клетка характеризуется повышенной активностью ферментов E1, и Е2, и Е3, и оксидоредуктазы типа alkB или повышенной активностью ферментов E1, и Е2, и оксидоредуктазы типа alkB, где фермент E1 представляет собой α/β-гидролазу, фермент Е2 представляет собой рамнозилтрансферазу I и фермент Е3 представляет собой рамнозилтрансферазу II, и
где источник углерода представляет собой С4-молекулу, где С4-молекула выбрана из группы, включающей бутан, 1-бутанол, 2-бутанол, 1-бутаналь, бутанон, масляную кислоту и их комбинации.
2. Способ по п. 1, где оксидоредуктаза выбрана из группы, включающей оксидоредуктазу типа alkB, монооксигеназу и NAD(Р)Н-зависимую алкогольдегидрогеназу (ADH).
3. Способ по любому из предыдущих пунктов, где рекомбинантная клетка характеризуется повышенной активностью ферментов E1, Е2, Е3 и оксидоредуктазы по сравнению с клеткой дикого типа и где С4-молекула представляет собой бутан.
4. Способ по любому из предыдущих пунктов, где среда содержит по меньшей мере 40% по весу С4-молекул от общего содержания углерода в среде.
5. Способ по любому из предыдущих пунктов, где
- фермент E1 способен катализировать превращение 3-гидроксиалканоил-АСР через 3-гидроксиалканоил-3-гидроксиалкановую кислоту-АСР в гидроксиалканоил-3-гидроксиалкановую кислоту,
- фермент Е2 способен катализировать превращение dTDP-рамнозы и 3-гидроксиалканоил-3-гидроксиалканоата в α-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоат; и
- фермент Е3 способен катализировать превращение dTDP-рамнозы и α-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоата в α-L-рамнопиранозил-(1-2)-α-L-рамнопиранозил-3-гидроксиалканоил-3-гидроксиалканоат.
6. Способ по любому из предыдущих пунктов, где
- фермент E1 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6 и их фрагменты,
- фермент Е2 выбран из группы, включающей SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и их фрагменты, и
- фермент Е3 выбран из группы, включающей SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15 и их фрагменты,
где фрагмент содержит полипептидную последовательность, в которой не более 25% аминокислотных радикалов модифицированы посредством делеции, вставки, замены или их комбинации по сравнению с последовательностью соответствующего фермента, и при этом фрагмент характеризуется по меньшей мере 10% ферментной активности соответствующего фермента.
7. Способ по любому из предыдущих пунктов, где клетка выбрана из рода, относящегося к группе, включающей Aspergillus, Corynebacterium, Brevibacterium, Bacillus, Acinetobacter, Alcaligenes, Lactobacillus, Paracoccus, Lactococcus, Candida, Pichia, Hansenula, Kluyveromyces, Saccharomyces, Escherichia, Zymomonas, Yarrowia, Methylobacterium, Ralstonia, Pseudomonas, Rhodospirillum, Rhodobacter, Burkholderia, Clostridium и Cupriavidus.
8. Способ по любому из предыдущих пунктов, где клетка выбрана из группы, включающей P. putida GPp121, P. putida GPp122, P. putida GPp123, P. putida GPp124 и P. putida GPp104, P. putida KT42C1, P. putida KTOY01 или P. putida KTOY02.
9. Способ по любому из предыдущих пунктов, где рамнолипид представлен общей формулой (I),
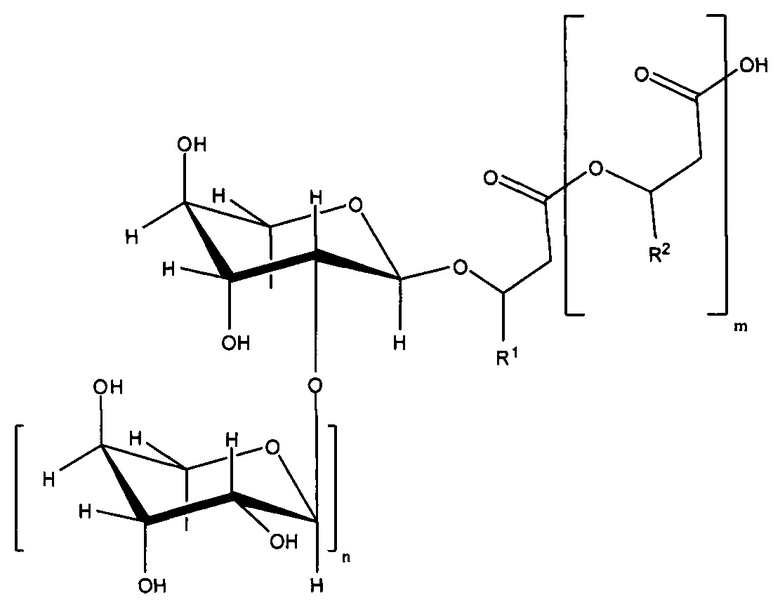
формула (I),
где
m=2, 1 или 0, в частности 1 или 0,
n=1 или 0, в частности 1,
R1 и R2 независимо друг от друга представляют собой одинаковые или различные органические радикалы, имеющие от 2 до 24 атомов углерода, необязательно разветвленные, необязательно замещенные, гидроксизамещенные, необязательно ненасыщенные или необязательно моно-, ди- или триненасыщенные алкильные радикалы.
10. Клетка, способная к образованию по меньшей мере одного рамнолипида из С4-молекулы, предназначенная для осуществления способа по п. 1, где клетка представляет собой бактерию и генетически модифицирована таким образом, что по сравнению с клеткой дикого типа данная клетка характеризуется повышенной активностью ферментов E1, и Е2, и Е3, и оксидоредуктазы типа alkB или повышенной активностью ферментов E1, и Е2, и оксидоредуктазы типа alkB, где фермент E1 представляет собой α/β-гидролазу, фермент Е2 представляет собой рамнозилтрансферазу I и фермент Е3 представляет собой рамнозилтрансферазу II, где С4-молекула выбрана из группы, включающей бутан, 1-бутанол, 2-бутанол, 1-бутаналь, бутанон, масляную кислоту и их комбинации.
11. Клетка по п. 10, где
- оксидоредуктаза выбрана из группы, включающей оксидоредуктазу типа alkB, монооксигеназу и NAD(Р)Н-зависимую алкогольдегидрогеназу (ADH),
- фермент E1 содержит аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6 и их фрагменты,
- фермент Е2 выбран из группы, включающей SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11 и их фрагменты, и
- фермент Е3 выбран из группы, включающей SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO: 14, SEQ ID NO: 15,
и где фрагмент содержит полипептидную последовательность, в которой не более 25% аминокислотных радикалов модифицированы посредством делеции, вставки, замены или их комбинации по сравнению с последовательностью соответствующего фермента, и при этом фрагмент характеризуется по меньшей мере 10% ферментной активности соответствующего фермента.
12. Клетка по любому из пп. 10-11, где клетка выбрана из рода, относящегося к группе, включающей Aspergillus, Corynebacterium, Brevibacterium, Bacillus, Acinetobacter, Alcaligenes, Lactobacillus, Paracoccus, Lactococcus, Candida, Pichia, Hansenula, Kluyveromyces, Saccharomyces, Escherichia, Zymomonas, Yarrowia, Methylobacterium, Ralstonia, Pseudomonas, Rhodospirillum, Rhodobacter, Burkholderia, Clostridium и Cupriavidus.
| WO 2012013554 A1, 02.02.2012 | |||
| DAVID SCHLEHECK et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| MARKUS MICHAEL MULLER et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| Прибор для запора стрелок | 1921 |
|
SU167A1 |
| ERIKA L | |||
| JOHNSON et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Термосно-паровая кухня | 1921 |
|
SU72A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Приспособление для остановки поезда с пути | 1924 |
|
SU950A1 |
| RUYI SHA et al | |||
| The addition of ethanol as defoamerin fermentation of rhamnolipids, Journal of Chemical Technology & Biotechnology Vol | |||
| Торфодобывающая машина с вращающимся измельчающим орудием | 1922 |
|
SU87A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Полу генеративная топка для сжигания влажного торфа | 1921 |
|
SU368A1 |
| КАРТЕЛЬ Н.А | |||
| и др | |||
| Рамнолипиды: перспективы их использования для фиторемедиации, Биотехнология, N4, с.47-60, 2007. | |||
Авторы
Даты
2019-07-12—Публикация
2015-04-27—Подача