Изобретение относится к медицинской иммунологии и может быть использовано для оценки иммунного статуса путем определения функциональной активности классического пути системы комплемента.
Система комплемента является частью иммунной системы и состоит из более чем 30 компонентов, которые действуют каскадным механизмом. Эта система играет ключевую роль, как в клиренсе иммунных комплексов, так и в иммунном ответе на инфекционные агенты, чужеродные антигены, опухолевые и вирус-инфицированные клетки. Система комплемента может активироваться тремя путями: классическим, альтернативным и лектиновым.
Классический путь является Са2+/Mg2+-зависимым каскадом, который в норме активируется при формировании иммунного комплекса (ИК). Компонент С1, первый ферментный комплекс в каскаде, является пентамолекулярным комплексом. Включает одну молекулу C1q и по две молекулы C1r и C1s. С1 комплекс связывается с Fc-фрагментом иммуноглобулинов в составе ИК через C1q и инициирует ферментативный каскад системы комплемента. Как только активируется С1 комплекс, C1s расщепляет компонент С4, приводя к образованию C4b, который затем связывает компонент С2. Иммобилизованный компонент С2 расщепляется при помощи фермента C1s с образованием С3-конвертазы (C4bC2a) классического пути.
Альтернативный путь является Mg2+ - зависимым и активируется рядом разнообразных веществ, включающих полисахариды клеточных стенок дрожжей и бактерий, определенные биополимерные материалы. При иммобилизации C3b на поверхности на него садится фактор В, который под действием фермента, фактора D, расщепляется и образуется С3-конвертаза (C3bBb) альтернативного пути.
Пектиновый путь активирует комплемент при помощи маннан-связывающего лектина (МСЛ) и двух ассоциированных с ним сериновых протеаз (МАСП-1 и МАСП-2) (подобно с C1r и C1s в классическом пути активации комплемента). Как и в классическом пути активации комплемента, для лектинового пути также требуются компоненты С2 и С4. Активация лектинового пути приводит к формированию С3-конвертазы, аналогичной с С3-конвертазой классического пути (C4bC2a) [Ройт А., Бростофф Дж., Мейл Д. Иммунология: Пер. с англ. М: Мир, 2000. - 592 с.].
Субстратом С3-конвертазы трех путей активации является ключевой компонент комплемента, компонент С3, при гидролизе которого образуется С3а (анафилатоксин) и C3b (опсонин). Присоединяя дополнительно молекулу C3b, С3-конвертаза обретает способность гидролизовать компонент С5, который запускает реакцию формирования мембрано-атакующего комплекса (МАК).
При активации комплемента генерируются биологически активные фрагменты белков С3 и С5 (С3а и С5а - анафилатоксины) и C5b-9 (МАК), которые опосредуют воспалительные активности, включающие лейкоцитарный хемотаксис, активацию макрофагов, нейтрофилов и тромбоцитов, тучных и эндотелиальных клеток, повышение сосудистой проницаемости, цитолиз и тканевое повреждение [Sahu A., Lambris J.D. Complement inhibitors a resurget concept in anti-inflamatory therapeutics // Immunopharmacology - 2000. - V. 49. - P. 133-148.].
Дефицит компонентов классического пути активации системы комплемента - C1q, C1r, C1s, С4 или С2 - вызывает предрасположенность организма человека к заболеваниям, обусловленными нарушениями в солюбилизации и клиренсе иммунных комплексов, например, к развитию системной красной волчанки (СКВ). Также показано, что у больных с СКВ вдвое снижено количество рецепторов первого типа к C3b (CR1) на эритроцитах и лейкоцитах [Ройт А., Бростофф Дж., Мейл Д. Иммунология: Пер. с англ. М.: Мир, 2000. - 592 с.]. CR1 и Fc-рецепторы коопирируются для эффективного связывания и фагоцитоза опсонизированных патогенов. Дефицит компонентов системы комплемента составляет не более 2% всех первичных иммунодефицитов и проявляется нарушением опсонизации, фагоцитоза и разрушения микроорганизмов, сопровождается тяжелыми инфекциями, вплоть до сепсиса [Клиническая иммунология и аллергология. Под ред. Г. Лолора-младшего, Т. Фишера и Д. Адельмана. Пер. с англ. М.: Практика, 2000. - 806 с.].
Избыточная (неконтролируемая) активация системы комплемента является частью патогенеза большого числа воспалительных заболеваний. Патологические эффекты могут быть обусловлены повышенной, продолжительной активацией, например, вызванной присутствием иммунных комплексов (системная красная волчанка и связанные с ней заболевания), а также сниженной экспрессией и функцией различных ингибиторов комплемента, или комбинацией этих двух факторов [Carroll M.V., R. В. Sim R.B. Complement in health and disease // Advanced Drug Delivery Reviews. - 2011. - V. 63, №12. - P. 965-975].
Ишемия и последующая реперфузия органов и тканей наблюдается при таких состояниях как инфаркт миокарда или инсульт. Неконтролируемая активация системы комплемента играет важную роль при реперфузионном повреждении. Результатом чего является мультифункциональный воспалительный процесс, вовлекающий генерацию анафилатоксинов, повышенную экспрессию адгезивных белков и тканевых факторов на эндотелиальных клетках и выход из сосудов полиморфно-ядерных лейкоцитов [Banz Y., Rieben R. Role of complement and perspectives for intervention in ischemia-reperfusion damage // Annals of Medicine. - 2012. - V. 44, №3. - P. 205-217].
Для исследования системы комплемента определяют его гемолитическую активность. Суть метода заключается в следующем: 1) разные разведения исследуемой сыворотки добавляют к эритроцитам барана, сенсибилизированным антителами кролика (ЕА); 2) степень гемолиза оценивают фотометрически по выходу гемоглобина в раствор после центрифугирования. Активность комплемента выражают в гемолитических единицах. За одну гемолитическую единицу комплемента (СН50) принимают такое его количество, которое вызывает гемолиз 50% 0,5 мл стандартной суспензии ЕА при 37°С за 45 мин. В 1 мл сыворотки крови человека содержится 20-40 СН50 [Лабораторные методы исследования в клинике: Справочник / Меньшиков В.В., Делеторская Л.Н., Золотницкая Р.П. и др..: Под ред. В.В. Меньшикова. М.: Медицина, 1987. - 368 с.].
Существенным недостатком этого метода является длительность выполнения теста, недостаточная точность (колебания нормальных значений в два раза).
Также из уровня техники известен скрининг-тест активации системы комплемента по классическому пути, основанный на иммуноферментном анализе. Суть теста заключается в определении активности классического пути системы комплемента по образованию и сорбции мембрано-атакующего комплекса (МАК) на подложке 96-ти луночной планшеты, сорбированной агрегированными иммуноглобулинами. Связывание МАК проявляют моноклональными антителами, конъюгированными с ферментом, щелочной фосфатазой, с использованием его субстрата. В качестве стандарта используют лиофильно высушенный препарат сыворотки крови человека. Рассчитывают в процентах функциональную активность классического пути активации комплемента относительно стандарта.
Существенным недостатком ИФА-теста скрининга комплемента по классическому пути является длительность проведения анализа, использование моноклональных антител, которые делают данный анализ недоступным для рутинных исследований. Использование лиофильно высушенной сыворотки в качестве стандарта требуют специальных условий для хранения и транспортировки (-20°С), а также подобный стандарт может завышать активность комплемента при анализе из-за потери функциональной активности самого стандарта при лиофилизации.
Таким образом, на настоящий момент не существует доступного теста для скрининга функциональной активности классического пути системы комплемента для рутинных исследований.
Техническим результатом предлагаемого способа является повышение точности метода исследования функциональной активности классического пути системы комплемента, а также адаптация метода для скрининг-исследований в условиях клинико-диагностических лабораторий.
Указанный результат достигается тем, что определение функциональной активности классического пути системы комплемента проводят с использованием реакции лизиса эритроцитов барана, сенсибилизированных антителами кролика (ЕА), в условиях вероналового солевого буфера (VBS2+) при температуре (37,0±0,5)°С в течение 10 мин. Реакцию комплемент-зависимого лизиса ЕА оценивают турбидиметрически по снижению оптической плотности суспензии ЕА при лизисе, при длине волны 620 нм, затем определяют степень лизиса эритроцитов в опытных пробах по калибровочному графику, где контроль ЕА представляет 0% лизиса, а контроль полного лизиса ЕА - 100% лизис.
Заявленное изобретение поясняется фиг. 1 на которой представлен калибровочный график для оценки степени лизиса в пробах сыворотки. На фиг. 2 представлена раститровка пулированной сыворотки крови по классическому пути активации системы комплемента от 10 здоровых доноров в зависимости от концентрации. На фиг. 3 представлено определение оптимального времени инкубации для оценки функциональной активности классического пути системы комплемента. На фиг. 4 представлен регрессионный анализ функциональной активности классического пути системы комплемента методами турбидиметрии и иммуноферментного анализа.
Способ осуществляют следующим образом. Проводят забор крови, приготовление сыворотки, проведение литического теста и расчет степени лизиса в опытных пробах. Литический тест проводят с использованием стандартизованных (1,5×108 кл/мл) эритроцитов барана, сенсибилизированных антителами кролика (ЕА) в вероналовом солевом буфере, содержащем оптимальное количество ионов Са2+ и Mg2+ (VBS2+). Время проведения скрининг-теста - 10 мин. Суть метода заключается в изменении светорассеивания эритроцитов при их лизисе в 96-ти луночных иммунологических плоскодонных планшетах. Изменение светорассеивания при лизисе эритроцитов определяют спектрофотометрически при длине волны 620 нм с использованием фотометра для иммуноферментного анализа. Для определения степени лизиса эритроцитов используют калибровочный график, где за 0% лизиса принимают оптическую плотность контроля эритроцитов, сенсибилизированных антителами кролика, на спонтанный лизис (50 мкл ЕА + 50 мкл VBS2+), соответственно за 100% лизис принимают оптическую плотность контроля на полный лизис (50 мкл ЕА + 50 мкл Н2О).
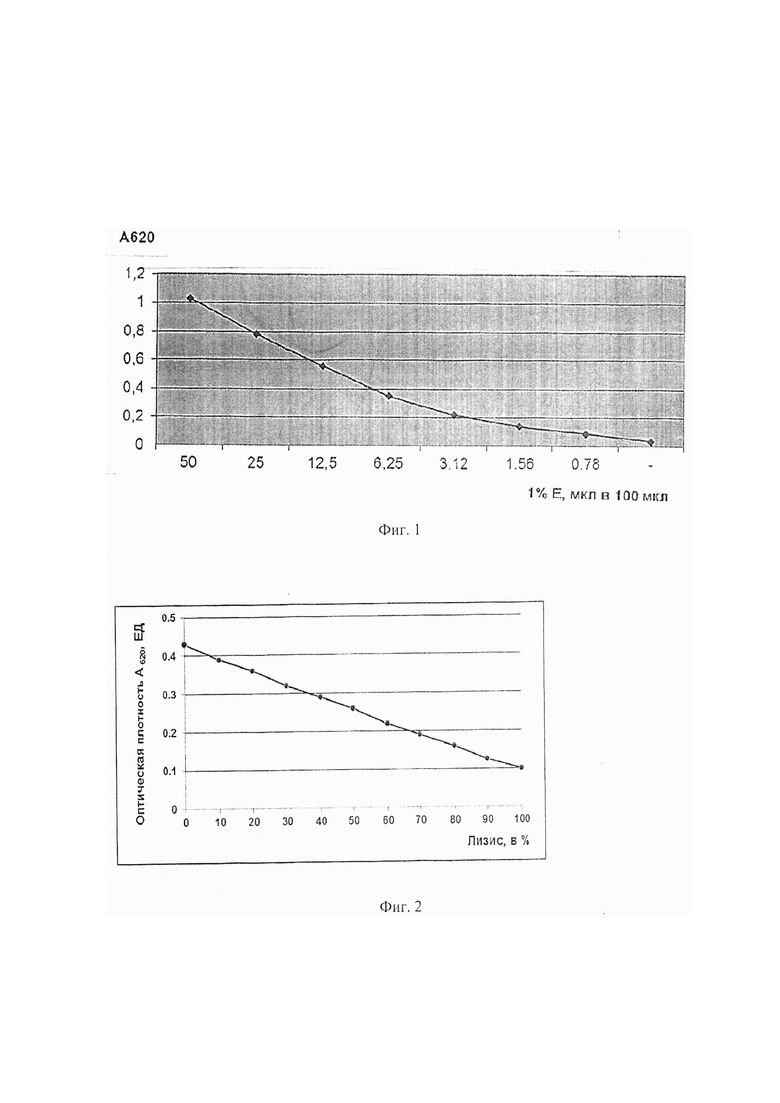
Определение оптимальной концентрации эритроцитов барана для скрининг-теста определения функциональной активности системы комплемента. Эритроциты барана (Е) 3 раза отмывают в вероналовом солевом буфере (VBS2+) центрифугированием в течение 10 мин при 2800 об/мин. Проводят сенсибилизацию эритроцитов барана антителами кролика (ЕА). Строят график зависимости оптической плотности суспензии ЕА при длине волны 620 нм от концентрации. Для этого 1% суспензию ЕА прогрессивно разводят в плоскодонной 96-ти луночной иммунологической планшете в объеме 50 мкл VBS. Объем доводят до 100 мкл тем же буфером. Тщательно перемешивают и измеряют на фотометре для иммуноферментного анализа при А620. Результаты представлены в Фиг. 1.
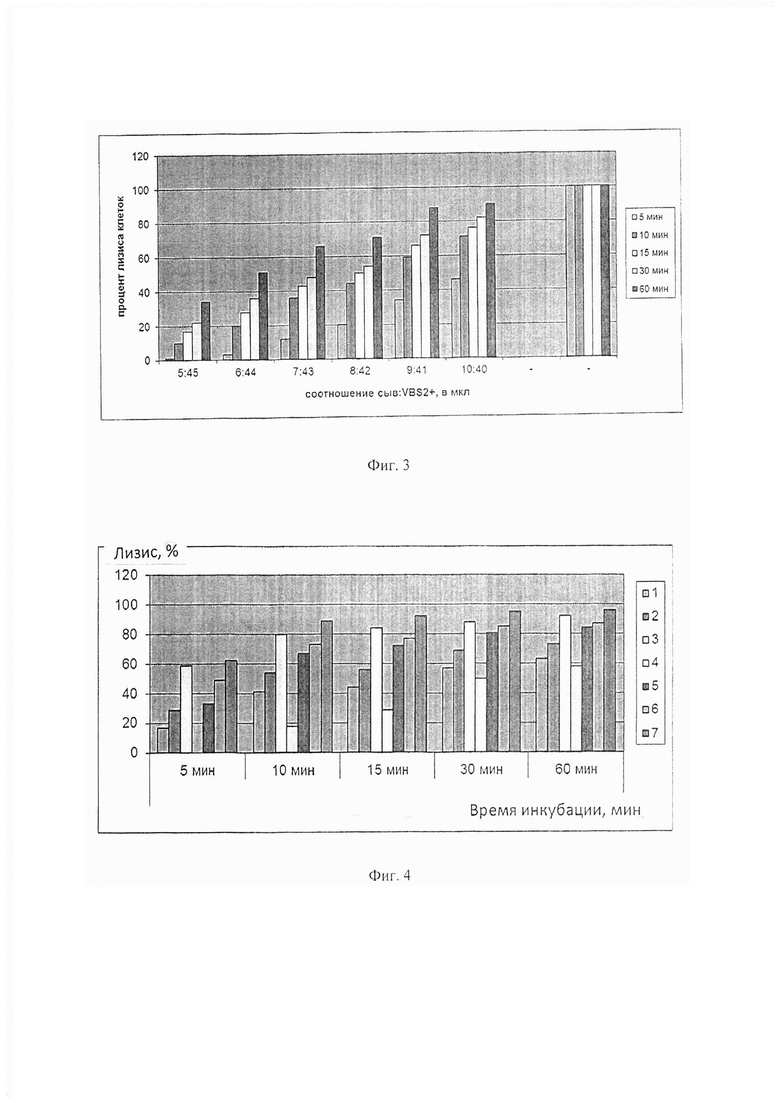
Как видно из данных, представленных на Фиг. 1, наблюдается линейная зависимость оптической плотности суспензии эритроцитов от концентрации в растворе до А620 равной 0,2 ЕД. Ниже 0,2 ЕД при А620 наблюдается незначительный загиб. Поэтому для теста определения функциональной активности классического пути активации системы комплемента нами выбрана концентрация эритроцитов барана, которая в объеме 100 мкл в лунке 96-луночного планшета дает оптическую плотность, равную 0,56, что соответствует концентрации эритроцитов 1,5×108 кл/мл. Для определения степени лизиса эритроцитов нами предложен калибровочный график (фиг. 2), в котором степень лизиса эритроцитов оценивают по снижению оптической плотности при длине волны 620 нм. За 0% лизиса принимают оптическую плотность контроля эритроцитов на спонтанный лизис (50 мкл ЕА + 50 мкл VBS2+), соответственно за 100% лизис принимают оптическую плотность контроля на полный лизис (50 мкл ЕА + 50 мкл Н2О).
Как видно из фиг. 2, калибровочный график позволяет определять степень лизиса эритроцитов в процентах по оптической плотности пробы без стадии центрифугирования и измерения гемоглобина в супернатанте и последующего расчета степени лизиса эритроцитов, что существенно упрощает регистрацию результатов анализа функциональной активности классического пути системы комплемента в рутинных исследованиях.
Титрование пулированной сыворотки крови человека на функциональную активность классического пути системы комплемента методом турбидиметрии. Предварительно от 5 до 10 мкл разведенной (1:7) пулированной сыворотки крови от 10 здоровых доноров добавляли в гемолитическую систему, состоящую из 50 мкл стандартизированных эритроцитов барана, сенсибилизированных антителами кролика (1,5×108 кл/мл), соответствующего объема буфера VBS2+ (конечный объем гемолитической системы 100 мкл) и инкубировали в течение 5, 10, 15, 20 и 60 мин при 37°С. В процессе инкубации измеряли оптическую плотность проб на фотометре для ИФА, содержащего блок с термостатированием и шейкером, при длине волны 620 нм. В качестве контроля были используют: 1 - контроль эритроцитов на спонтанный лизис (50 мкл ЕА + 50 мкл VBS2+); 2 - Контроль на полный лизис (50 ЕА + 50 мкл Н2О). Степень лизиса ЕА в % определяли по калибровочному графику (фиг. 2), где контроль ЕА на спонтанный лизис принимают за 0% лизиса, контроль на полный лизис представляет 100% лизис. Полученные результаты представлены на фиг. 3.
Как видно из фиг. 3, степень лизиса от 10 до 80% зависит линейно от концентрации сыворотки в гемолитической системе при инкубации 10, 15 и 30 мин. Инкубация в течение 5 мин при возрастающих концентрациях сыворотки в пробе характеризуется линейностью с 1% и выше. В то время как 60 минутная инкубация характеризуется линейной зависимостью до 1,13% сыворотки в пробе. Дальнейшее увеличение концентрации сыворотки приводит к «плато» на уровне 90% лизиса. Лизис ЕА на уровне 50% (от 44% до 54% в зависимости от времени инкубации) наблюдается при концентрации сыворотки, равной 1,0 мкл в гемолитической системе, что составляет 1% сыворотки в гемолитической системе.
Таким образом, для дальнейших исследований нами использовалась 1% концентрация сыворотки в тест-системе, содержащая 0,75×108 кл/мл эритроцитов барана, сенсибилизированных антителами кролика.
Определение оптимального времени инкубации для определения функциональной активности системы комплемента. К 8 мкл сыворотки крови, разведенной 1:7 буфером VBS2+, добавляют 42 мкл буфера VBS2+ и 50 мкл стандартизованных (1,5×108 кл/мл) эритроцитов барана, сенсибилизированных антителами кролика (ЕА), в лунки 96-ти луночных плоскодонных планшет для иммуноферментного анализа. Тщательно перемешивают и инкубируют в течение 60 минут при 37°С при постоянном перемешивании. В процессе инкубации измеряют оптическую плотность проб на фотометре Multiscan FC с блоком с термостатирования и шейкером, при длине волны 620 нм через 5, 10, 15, 30 и 60 мин. В качестве контроля ставят: 1 - контроль эритроцитов на спонтанный лизис (50 мкл ЕА + 50 мкл VBS2+); 2 - Контроль на полный лизис (50 ЕА + 50 мкл Н2О). Степень лизиса ЕА в % определяют как описано выше. Полученные результаты представлены на фиг. 4.
Как видно на фиг. 4, максимальный лизис наблюдается первые 10 мин и при дальнейшей инкубации увеличение степени гемолиза зависит от величины 10-ти минутной инкубации. То есть, при высоком лизисе на 10 минуте инкубации продолжение инкубации незначительно увеличивает гемолиз (на 7% для сыворотки №7). При слабом гемолизе на 10 минуте инкубации, дальнейшая инкубация приводит к более высокому гемолизу (на 40% для сыворотки №4).
Таким образом, оптимальным временем инкубации (при данной концентрации эритроцитов (0,75×108 кл/мл) и 1% сыворотки в тестируемой пробе в гемолитической системе при определении функциональной активности системы комплемента) является 10-ти минутная инкубация при 37°С.
Пример 1. Определение функциональной активности классического пути системы комплемента в сыворотках крови относительно здоровых лиц.
К 8 мкл сыворотки крови, разведенной 1:7 буфером VBS2+, добавляют 42 мкл буфера VBS и 50 мкл стандартизированных (1,5×10 кл/мл) эритроцитов барана, сенсибилизированных антителами кролика (ЕА) в лунки иммунологических 96-ти луночных плоскодонных планшет для ИФА. Тщательно перемешивают и инкубируют в течение 10 минут при 37°С при постоянном перемешивании. Степень лизиса ЕА в % определяют как описано выше. Полученные результаты представлены в таблице 1.
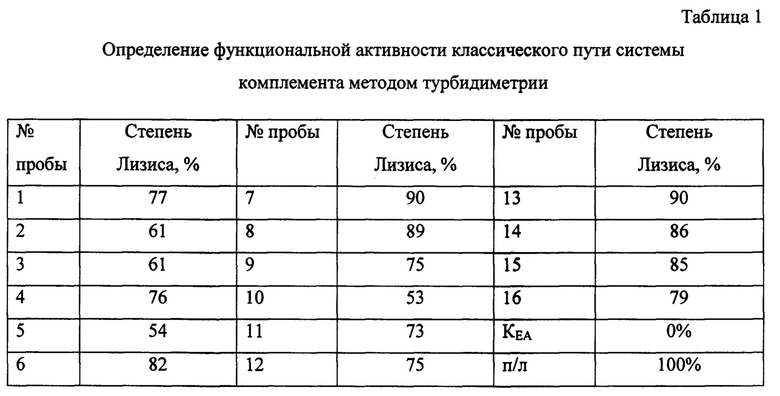
Как видно из данных, представленных в таблице 1, в 4 пробах из 16 (25%) (пробы №7, 8, 13, 14) определяется повышенная функциональная активность системы комплемента (степень лизиса более 85%). В 6 пробах (37,5%) (пробы №1,4, 6, 9, 12, 15) - нормальная активность системы комплемента (степень лизиса от 75 до 85%). В остальных 6 пробах (37,5%) (пробы №2, 3, 5, 10, 11, 16) наблюдается пониженная функциональная активность системы комплемента (степень лизиса менее 75%).
Пример 2. Сравнительные исследования функциональной активности классического пути системы комплемента методами турбидиметрии и иммуноферментного анализа. Проведены сравнительные исследования функциональной активности классического пути системы комплемента предлагаемым турбидиметрическим методом и методом иммуноферментного анализа (ИФА) с использованием набора «EuroDiagnostica» (Швеция). Скрининг-тест определения функциональной активности классического пути комплемента методом турбидиметрии проводили как описано выше. Тест ИФА проводили согласно инструкции, прилагаемой к набору WIESLAB Complement system Classical pathway. Принцип ИФА теста основан на комбинации гемолитического теста с использованием меченных моноклональных антител к неоантигену (C5b-9), появляющемуся при активации системы комплемента. Количество неоантигена пропорционально функциональной активности системы комплемента. В качестве активатора классического пути системы комплемента служат иммобилизованные IgG на подложках 96-ти луночных плоскодонных иммунологических планшет. На первом этапе разведенная 1:99 сыворотка инкубируется в течение 60 мин при 37°С. После инкубации планшета отмывается 4 раза промывочным буфером и повторно инкубируются с конъюгатом моноклональных антител к неоантигену C5b-9 с щелочной фосфататазой. Повторно инкубируют в течение 30 мин и промывают планшету 4 раза. После, на 3 этапе, добавляют субстратный буфер и инкубируют в течение 30 мин при комнатной температуре. Результаты теста измеряют при 405 нм на фотометре для ИФА. Рассчитывают функциональную активность классического пути системы комплемента относительно контрольной сыворотки в процентах. Нормальным значением функциональной активности классического пути комплемента производителем предлагается величина относительной активности комплемента от 69% до 129%.
Результаты исследования 90 проб сывороток относительно здоровых лиц представлены в таблице 2.

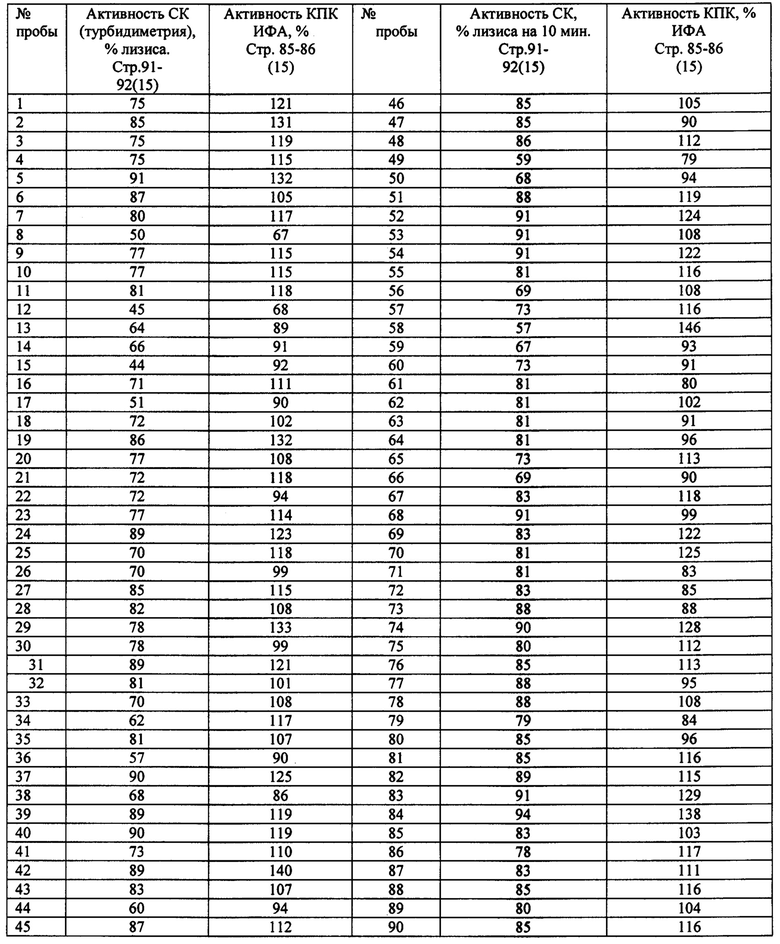
Как видно из данных, представленных в таблице 2, иммуноферментный анализ функциональной активности системы комплемента по классическому пути выявляет в 11 пробах (12%) из тестированных 90 проб сыворотки пониженную (<69%) активность и в 4 пробах (4%) повышенную функциональную активность классического пути системы комплемента (<129%). Суммарно ИФА выявляет 16% изменений функциональной активности системы комплемента. По данным турбидиметрического определения функциональной активности системы комплемента в 30 пробах (33%) выявляется пониженная активность комплемента (степень лизиса менее 75%) и в 22 пробах (24%) повышенную активность классического пути системы комплемента (степень лизиса более 85%). Суммарно предлагаемый тест выявляет 57% изменений функциональной активности системы комплемента.
Таким образом, разница на 41% изменений функциональной активности системы комплемента по использованным тестам связано с более высокой чувствительностью турбидиметрического теста из-за оптимальных условий тестирования по сравнению с иммуноферментным анализом. Как было показано выше, в обоих тестах используется 1 мкл сыворотки в 100 мкл инкубационной системы, только по предлагаемому тесту инкубация проводится в течение 10 мин, в то время как в ИФА тесте - 60 минутная инкубация.
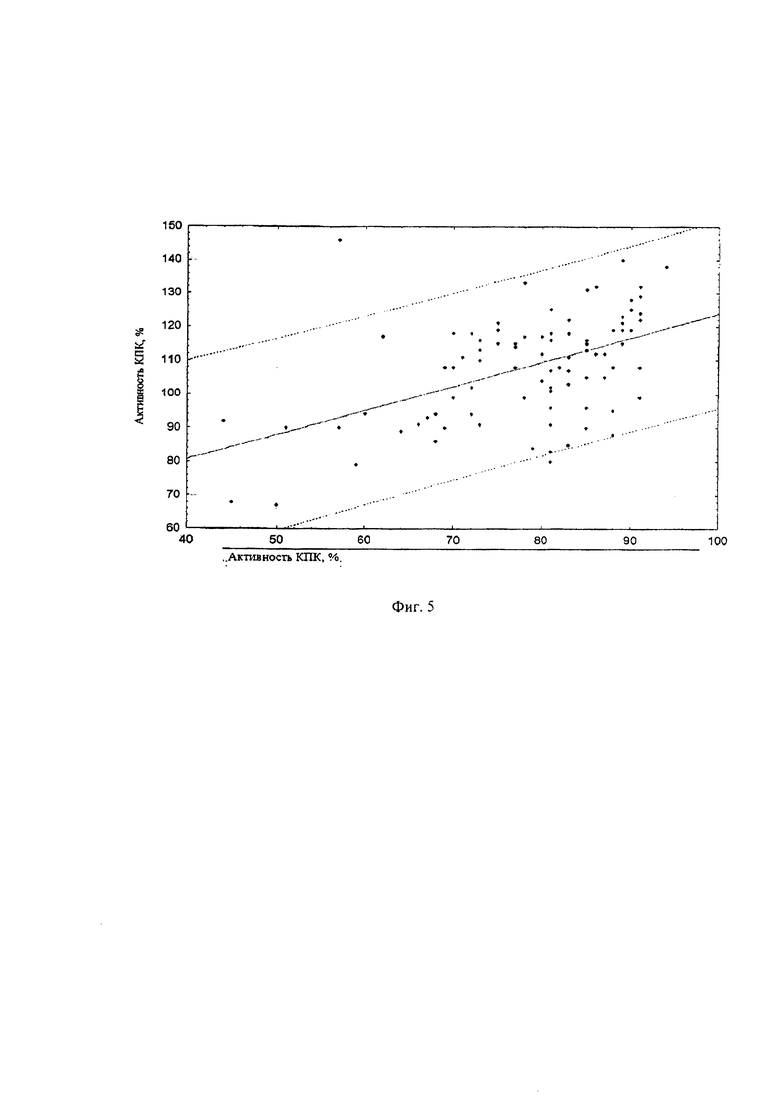
Пример 3. Регрессионный анализ функциональной активности классического пути системы комплемента методами турбидиметрии и иммуноферментного анализа.
Для проверки достоверности полученных результатов проведена оценка корреляционных взаимосвязей методом регрессионного анализа, результаты которого представлены на фиг. 5.
Таким образом, предлагаемый тест определения функциональной активности классического пути системы комплемента коррелирует с иммуноферментным анализом активности классического пути системы комплемента с высокой достоверностью и r=0,4955.
Скрининг-тест для определения функциональной активности классического пути системы комплемента методом турбидиметрии обладает рядом преимуществ, по сравнению с ИФА активности классического пути системы комплемента. Прежде всего: 1) это время анализа 10 мин против минимум 2,5 часов анализа ИФА; 2) для теста требуется только консервированные эритроциты барана, которые хранятся при 4°С минимум 2-3 месяца (низкая себестоимость анализа); 3) для определения степени лизиса не требуется стадия центрифугирования; 4) 10 минутная инкубация при турбидиметрии является более информативной для оценки функциональных изменений классического пути системы комплемента (57% изменений методом турбидиметрии - против 16% изменений, выявленных иммуноферментным анализом, функциональной активности классического пути системы комплемента).
| название | год | авторы | номер документа |
|---|---|---|---|
| Скрининг-тест для определения функциональной активности системы комплемента крысы | 2022 |
|
RU2786208C1 |
| Способ определения активности классического и альтернативного путей системы комплемента мыши | 2022 |
|
RU2800363C1 |
| Способ определения функциональной активности системы комплемента человека для прогноза тяжести течения системной воспалительной реакции | 2021 |
|
RU2756764C1 |
| Способ определения ингибиторного потенциала крови для прогнозирования неконтролируемой активации системы комплемента при Ковид-19 | 2023 |
|
RU2814496C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ СИСТЕМНОЙ ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ В ОРГАНИЗМЕ ЧЕЛОВЕКА ПРИ ЗАБОЛЕВАНИЯХ | 2022 |
|
RU2808416C1 |
| Способ определения комплемент-активирующей функции антител к SARS-CoV-2 для прогнозирования тяжести течения COVID-19 | 2023 |
|
RU2818351C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТАБИЛИЗАЦИИ С3-КОНВЕРТАЗЫ КЛАССИЧЕСКОГО ПУТИ АКТИВАЦИИ КОМПЛЕМЕНТА ЧЕЛОВЕКА | 2013 |
|
RU2549468C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАРУШЕНИЯ ИММУННОГО СТАТУСА | 2002 |
|
RU2247381C2 |
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ ИММУННОЙ СИСТЕМЫ ОРГАНИЗМА ЧЕЛОВЕКА | 2006 |
|
RU2314529C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВЛИЯНИЯ ПРЕПАРАТОВ НА ВЗАИМОДЕЙСТВИЕ КОМПЛЕМЕНТА С КОМПЛЕКСОМ АНТИГЕН-АНТИТЕЛО | 2017 |
|
RU2669342C1 |
Изобретение относится к медицинской иммунологии и может быть использовано для определения функциональной активности классического пути системы комплемента. Для этого проводят реакцию лизиса эритроцитов барана, сенсибилизированных антителами кролика (ЕА), с 1% сывороткой крови человека. Реакцию проводят в течение 10 мин при температуре (37,0±0,5)°С. Регистрируют изменение оптической плотности методом турбидиметрии при длине волны 620 нм. Степень лизиса определяют по калибровочному графику. При степени лизиса менее 75% функциональную активность классического пути системы комплемента оценивают как пониженную. При степени лизиса от 75 до 85% указанную функциональную активность оценивают как нормальную. При степени лизиса более 86% указанную функциональную активность оценивают как повышенную. Изобретение обеспечивает повышение точности и сокращение времени определения функциональной активности классического пути системы комплемента в условиях клинико-диагностических лабораторий. 5 ил., 2 табл., 3 пр.
Скрининг-тест определения функциональной активности классического пути системы комплемента путем проведения реакции лизиса эритроцитов барана, сенсибилизированных антителами кролика (ЕА), 1% сывороткой крови человека при температуре (37,0±0,5)°С, отличающийся тем, что реакцию лизиса ЕА проводят в течение 10 мин, определяют изменение оптической плотности методом турбидиметрии при длине волны 620 нм, степень лизиса определяют по калибровочному графику, где 0% лизиса представляет контроль ЕА на спонтанный лизис, 100% лизиса представляет полный лизис ЕА, при степени лизиса менее 75% оценивают как пониженную, от 75 до 85% как нормальную, более 86% как повышенную функциональную активность классического пути системы комплемента.
| Устройство для проектирования на куполообразный экран | 1931 |
|
SU29355A1 |
| СПОСОБ ОПРЕДЕНИЯ АКТИВНОСТИ КОМПЛЕМЕНТА И ГЕЛЬ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ИСПОЛЬЗОВАНИЯ В СПОСОБЕ | 1996 |
|
RU2124209C1 |
| Устройство для определения достоверности передачи бинарной информации | 1984 |
|
SU1229970A1 |
| EHRNTHALLER C | |||
| et al., New insights of an old defense system: structure, function, and clinical relevance of the complement system, Mol Med | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2019-10-24—Публикация
2018-11-28—Подача