Область техники
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания сортов растений, в том числе трансгенных, продуцентов различных субстанций на основе клеток, тканей или организмов растений.
Уровень техники
Генная терапия - это современный подход, направленный на изменение наследственных и приобретенных свойств путем введения нового генетического материала в клетки организма с целью компенсации или подавления функции мутантного гена и/или исправления генетического дефекта и/или направленного изменения фенотипа путем введения нового и/или изменения существующего генетического материала. Таким образом, несмотря на распространенную ассоциацию с человеком, термин «генная терапия» не ограничен выбором объекта воздействия и может относиться к любому типу живых организмов, в том числе к растениям. Конечным продуктом экспрессии гена может являться молекула РНК или белка. Однако осуществление большей части физиологических процессов в организме связано с функциональной активностью белковых молекул, тогда как молекулы РНК являются либо промежуточным продуктом в синтезе белков, либо осуществляют регуляторные функции. Таким образом, целью генной терапии является, в большинстве случаев, введение в организм генов, обеспечивающих транскрипцию и последующую трансляцию белковых молекул, кодируемых этими генами. В рамках описания настоящего изобретения под экспрессией гена подразумевается продукция белковой молекулы, аминокислотная последовательность которой кодируется этим геном. Мутации в генах могут приводить к полной или частичной потере экспрессии белков или же экспрессии вариантов белковых молекул, обладающих нежелательной функциональной активностью. Введение в организм генотерапевтических векторов, кодирующих тот или иной ген, может обеспечивать экспрессию целевых белков. Однако данный подход носит компенсирующий характер и не направлен на исправление генетических дефектов. С открытием систем направленного (таргетного) редактирования нуклеотидных последовательностей стало возможным, вводя в генотерапевтические векторы различные нуклеазы, обладающие специфическими свойствами (например, Cas9), реализовать подход терапевтического геномного редактирования, которое направлено на исправление мутаций в последовательности ДНК или введения в организм новых последовательностей ДНК в определенные участки генома, что также является таргетной генной терапией. В этом случае происходит восстановление функции за счет исправления генетических дефектов или придание новых свойств за счет введения нового генетического материала.
В настоящее время растения и растительные культуры клеток используются для озеленения различных территорий, производства продуктов питания, субстанций для получения биологически активных веществ, биотехнологических и фармацевтических субстанций, продуктов питания, биотоплива и т.д. Задачи генной терапиирастений включают в себя, но не ограничиваются изменением внешнего вида растений, метаболической активности, способности продуцировать или накапливать те или иные вещества, устойчивости к неблагоприятным воздействия, в том числе к патогенам и вредителям, модуляции биотехнологических свойств (PaolisAetal, 2019). Спектр применения растительных организмов и культур клеток постоянно расширяется, так, например, в биомедицине относительно недавно появилось направление разработки «съедобных вакцин», основанных на использовании для иммунизации растительных субстанций, экспрессирующих те или иные трансгенные белки, в качестве антигенного материала, употребляемого peros (Kong Q. et al., 2002). Таргетная генная терапия растений является инструментом, который позволяет эффективно решать этот круг задач.
ГенCas9кодирует белок-нуклеазу CAS9.CRISPR/Cas9система изначально была открыта как компонент иммунной системы бактерий, который позволяет направленно избавляться бактериальным клеткам от нуклеотидных последовательностей бактериофагов. Поскольку данная система обладает определенной степенью универсальности принципа действия, она нашла широкое применение в биомедицинских и биотехнологических исследованиях. В настоящее время CRISPR/Cas9 система широко используется в рамках научных исследований для редактирования геномов в эукариотических культурах клеток, тканей или целых организмов и обладает потенциалом для разработки средств и способов генной терапии. Принцип работы данной системы заключается в том, что эндонуклеаза CAS9 при помощи gRNA, комплементарной определенной последовательности в геноме, вносит разрывы в цепи ДНК. Целостность ДНК в месте разрывов затем восстанавливается с помощью клеточных систем репарации, которые в качестве матрицы для восстановления могут использовать гомологичную цепь ДНК, содержащую целевую последовательность нуклеотидов, или восстанавливать разрывы путем непосредственного соединения соседних нуклеотидов без репарации вырезанного участка ДНК. Конструирование gRNA осуществляется таким образом, чтобы эта молекула была комплементарна участку ДНК, в котором содержится та или иная мутация или планируется внесение нового генетического материала, что позволяет с помощью нуклеазы CAS9, направленно вырезающей именно этот участок, восстанавливать целостность ДНК определенным целевым образом, что и обуславливает потенциал данного механизма действия в коррекции генетического материала, то есть редактировании геномов.
Тем не менее, одной из основных проблем использования системы CRISPR/Cas9 для редактирования геномов остается проблема доставки комплекса эндонуклеазы и gRNA в клеточное ядро и в целом проблемы фармакокинетики, которые ограничивают проникающую способность молекул в различные органы и ткани или требуют введения слишком высоких концентраций и использования специальных композиций, обеспечивающих проникновение в клетки. Преодолеть данные ограничения позволяет использование генетических векторов для гетерологичной экспрессии гена Саs9. Наиболее изученными векторами в этой области являются лентивирусные, аденовирусные, аденоассоциированные и прочие вектора вирусного происхождения.
Другой проблемой использования CRISPR/Cas9 системы остается риск неспецифического действия эндонуклеазы. В этом ключе использование векторов, которые не интегрируют в геном и обеспечивают только транзиентную экспрессию генов, является потенциально более безопасным, чем, например, использование лентивирусных и аденоассоциированных векторов. Однако использование любых вирусных векторов для доставки в организм тех или иных последовательностей ограничено тропизмом псевдовирусных частиц к различным тканям, что не всегда позволяет осуществлять эффективное проникновение в целевые клетки и органы. Также потенциал использования любых вирусных векторов ограничен, в том числе, их структурными особенностями, предсуществующей устойчивостью и рисками, связанными с генотерапевтическими векторами вирусного происхождения в целом.
Таким образом предшествующий уровень техники свидетельствует о том, что существует потребность в разработке эффективных и безопасных генотерапевтических подходов для доставки Cas9 в целевые клетки, органы и ткани организма растений.
Генотерапевтические векторы, как известно, разделяют на вирусные, клеточные и ДНК-векторы (Guidelineonthequality, non-clinicalandclinicalaspectsofgenetherapymedicinalProductsEMA/CAT/80183/2014). В последнее время в генной терапии все большее внимание уделяется разработке невирусных систем доставки генетического материала, среди которых лидируют плазмидные векторы. Плазмидные векторы лишены недостатков, присущих клеточным и вирусным векторам. В клетке-мишени они существуют в эписомальной форме, не интегрируют в геном, производство их достаточно дешево делают их удобным инструментом генной терапии (Li L, Petrovsky N. // Expert Rev Vaccines. 2016;15(3):313-29).
Тем не менее, ограничениями для использования плазмидных векторов для генной терапии являются: 1) наличие генов устойчивости к антибиотикам для наработки в бактериальных штаммах, 2) наличие различных регуляторных элементов, представленных последовательностями вирусных геномов 3) размер терапевтического плазмидного вектора, определяющий эффективность проникновения вектора в клетку-мишень.
Известно, что Европейское агентство по лекарственным средствам считает необходимым избегать введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies). Данная рекомендация связана, в первую очередь, с потенциальной опасностью проникновения ДНК-вектора или горизонтального переноса генов антибиотикорезистентности в клетки бактерий. Помимо этого, наличие генов антибиотикорезистентности значительно увеличивает размер ДНК-вектора, что приводит к снижению эффективности его проникновения в эукариотические клетки.
Необходимо отметить, что гены антибиотикорезистентности также вносят принципиальный вклад в способ получения ДНК-векторов. В случае наличия генов антибиотикорезистентности штаммы для наработки ДНК-векторов обычно культивируются в среде, содержащей селективный антибиотик, что создает риск наличия следовых количеств антибиотика в недостаточно очищенных препаратах ДНК-векторов. Таким образом, получение ДНК-векторов для генной терапии, в которых отсутствуют гены антибиотикорезистентности, связано с получением штаммов, обладающих такой отличительной особенностью как способность к стабильной амплификации целевых ДНК-векторов в среде без содержания антибиотиков.
Кроме того, Европейское Медицинское Агентство рекомендует избегать наличия в составе терапевтических плазмидных векторов регуляторных элементов для повышения экспрессии целевых генов (промоторов, энхансеров, посттрансляционных регуляторных элементов), являющихся нуклеотидными последовательностями геномов различных вирусов (Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products, http://www.ema.europa.eu/docs/en_GB/document_library/Scien tific_guideline/2015/05/WC500187020.pdf). Данные последовательности, хотя и могут увеличивать уровень экспрессии целевого трансгена, однако создают риск рекомбинации с генетическим материалом вирусов дикого типа и интеграции в геном эукариотической клетки. Более того, целесообразность гиперэкспрессии того или иного гена в целях терапии остается нерешенным вопросом.
Также, существенным моментом является размер терапевтического вектора. Известно, что современные плазмидные векторы зачастую перегружены нефункциональными участками, серьезно увеличивающими размер вектора (Mairhofer J, Grabherr R. // Mol Biotechnol. 2008.39(2):97-104). Например, ген устойчивости к ампициллину в векторах серии pBR322, как правило, состоит из не менее чем 1000 п.н., что составляет более 20% от размера самого вектора. При этом наблюдается обратная зависимость между размером вектора и его способностью проникать в эукариотические клетки - ДНК-векторы с небольшим размером эффективней проникаю в клетки. Так, например, в серии экспериментов по трансфекции клеток НеLа ДНК-векторами с размером от 383 до 4548 п.н. было показано, что разница в эффективности проникновения может достигать двух порядков (отличаться в 100 раз) (Hornstein BD et al. // PLoS ONE. 2016;11(12): e0167537.).
Таким образом при выборе ДНК-вектора в целях безопасности и наибольшей эффективности следует отдавать предпочтение тем конструкциям, в которых не содержатся гены устойчивости к антибиотикам, последовательности вирусного происхождения и размер которых позволяет эффективно проникать в эукариотические клетки. Штамм для получения такого ДНК-вектора в количествах, достаточных для целей генной терапии, должен обеспечивать возможность стабильной амплификации ДНК-вектора с использованием питательных сред, не содержащих антибиотики.
Примером использования рекомбинантных ДНК-векторов для генной терапии является способ получения рекомбинантного вектора для генетической иммунизации по патенту US 9550998 В2. Плазмидный вектор представляет собой суперскученный плазмидный ДНК-вектор и предназначен для экспрессии клонированных генов в клетках животных и человека. Вектор состоит из ориджина репликации, регуляторных элементов, включающих промотор и энхансер цитомегаловируса человека, регуляторные элементы из Т-лимфотропного вируса человека.
Накопление вектора проводят в специальном штамме E.coli без использования антибиотиков за счет антисенс-комплементации гена sacB, введенного в штамм посредством бактериофага. Недостатком данного изобретения является наличие в составе ДНК-вектора регуляторных элементов, представляющих собой последовательности вирусных геномов. Однако данное изобретение не обеспечивает возможности использования для генной терапии растений.
Прототипами настоящего изобретения в части использования генотерапевтических подходов для экспрессии Cas9 в эукариотических клетках растений являются следующие патенты.
В патенте CN 103981216 В описан плазмидный вектор, экспрессирующий ген Cas9, а также содержащий регуляторные элементы, обеспечивающие экспрессию гена Cas9 в клетках растений. Недостатком данного изобретения является наличие в составе вектора генов устойчивости к антибиотикам.
Раскрытие изобретения
Задачей изобретения является конструирование генотерапевтического ДНК-вектора для гетерологичной экспрессии гена Cas9в клетках растений, сочетающего в себе следующие свойства:
I) Эффективность генотерапевтического ДНК-вектора для гетерологичной экспрессии целевого гена в эукариотических клетках.
II) Возможность безопасного применениядля реализации различных методов редактирования геномов растений, в том числе при генетической терапии, за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов.
III) Возможность безопасного применения для реализации различных методов редактирования геномов растений, в том числе при генетической терапии, за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности.
IV) Технологичность получения и возможность наработки генотерапевтического ДНК-вектора в промышленных масштабах.
Пункты II и III предусмотрены в данном техническом решении в соответствии с рекомендациями регуляторных органов к средствам для генной терапии, в частности, Европейского Агентства по лекарственным средствам касательно отказа от введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011, EMA/CAT/GTWP/44236/2009 Committee for advanced therapies) и касательно отказа от введения в разрабатываемые плазмидные векторы для генной терапии элементов вирусных геномов (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products / 23 March 2015, EMA/CAT/80183/2014, Committee for Advanced Therapies).
Задачей изобретения также является конструирование штаммов, несущих этот генотерапевтический ДНК-вектор, для наработки и производства в промышленных масштабах генотерапевтического ДНК-вектора.
Поставленная задача решается за счет того, что создан генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген Cas9, для гетерологичной экспрессии этого целевого гена в клетках растений при геномном редактировании растений, при этом генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 имеет нуклеотидную последовательность SEQID №1.
Созданный генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 имеет ограниченный размер векторной части VTvaf17-Act1, не превышающей 3200 п.н., что обеспечивает ему способность эффективно проникать в клетки растений и экспрессировать клонированный в него целевой ген Cas9.
Способ получения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 заключается в следующем: получают ДНК-вектор VTvaf17-Act1 путем замены в векторе VTvaf17 промоторного региона гена EF1a человека на промоторный регион гена актина первого типа (act1) риса, затем кодирующую часть целевого гена Cas9 клонируют в ДНК-вектор VTvaf17-Act1 и получают генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9.
Заявлено применение генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 для безопасного геномного редактирования растений за счет отсутствия в составе генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 нуклеотидных последовательностей вирусного происхождения и отсутствия генов антибиотикорезистентности.
Способ применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 для гетерологичной экспрессии этого целевого гена в клетках растений при геномном редактировании растений, заключается во введении созданного генотерапевтического ДНК-вектора в клетки, органы и ткани растений совместно с молекулами gRNA или генетическими конструкциями, обеспечивающими экспрессию gRNA или в сочетании обозначенных способов.
Штамм Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, несущий генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 для его наработки с возможностью культивирования штамма без использования антибиотиков.
Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, заключается в электропорации компетентных клеток штамма Escherichia coli SCS110-AF созданным генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 и последующей селекцией стабильных клонов штамма с использованием селективной среды.
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 заключается в масштабировании бактериальной культуры штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9до количеств, необходимых для наращивания бактериальной биомассы в промышленном ферментере, после чего биомассу используют для выделения фракции, содержащей целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9, многостадийно фильтруют и очищают хроматографическими методами.
Изобретение поясняется чертежами, где:
На фиг. 1
приведена схема генотерапевтического ДНК-вектора VTvaf17-Act1, несущего целевой генСаs9, который представляет собой кольцевую двуцепочечную молекулу ДНК, способную к автономной репликации в клетках бактерии Escherichia coli.
На фиг. 1 приведена схема генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9.
На схеме отмечены следующие структурные элементы вектора:
Act1 - промоторная область гена актина риса. Служит для обеспечения высокого уровня транскрипции рекомбинантного гена в большинстве тканей растений;
открытая рамка считывания целевого гена, соответствующая кодирующей части гена Cas9;
hGH-TA - терминатор транскрипции и сайт полиаденилирования гена фактора роста человека;
ori - ориджин репликации, служащий для автономной репликации с однонуклеотидной заменой для повышения копийности плазмиды в клетках большинства штаммов Escherichia coli;
RNA-out - регуляторный элемент PHK-out транспозона Tn 10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании штамма Eshcerichia coli SCS 110.
Отмечены уникальные сайты рестрикции.
На фиг. 2
показаны графики накопления ампликонов кДНК целевого гена, а именно, гена Cas9, в культуре клеток табака Nicotiana tabacum BY-2 cell line (RIKEN BRC, Кат. rpc00001) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 2 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена Cas9 в культуре клеток табака Nicotiana tabacum BY-2 до трансфекции ДНК-вектором VTvaf17-Act1-Cas9;
2 - кДНК гена Cas9в культуре клеток табака Nicotiana tabacum BY-2 после трансфекции ДНК-вектором VTvaf17-Act1-Cas9;
3 - кДНК гена L25в культуре клеток табака Nicotiana tabacum BY-2 до трансфекции ДНК-вектором VTvaf17-Act1-Cas9;
4 - кДНК гена L25в культуре клеток табака Nicotiana tabacum BY-2 после трансфекции ДНК-вектором VTvaf17-Act1-Cas9.
В качестве референтного гена использовали ген L25 (белок L23a 60S субъединицы рибосомы), приведенный в базе данных GenBank под номером LOC107796789.
На фиг. 3
показана диаграмма концентрации белка CAS9 в лизате культуры клеток табака Nicotiana tabacum BY-2 cell line (RIKEN BRC, Кат. rpc00001) через 48 часов после электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген Cas9.
На фиг. 3 отмечены следующие элементы:
культура А - культура клеток табака Nicotiana tabacum BY-2, электропорированных водным раствором без плазмидной ДНК (контроль);
культура В - клеток табака Nicotiana tabacum BY-2, электропорированных ДНК-вектором VTvaf17-Act1;
культура С - клеток табака Nicotiana tabacum BY-2, электропорированных ДНК-вектором VTvaf17-Act1-Cas9.
На фиг. 4
показаны графики накопления ампликонов кДНК целевого гена, а именно, гена Cas9, в культуре Arabidopsis thaliana Т87 (ABRC, Germplasm: T87 / Stock: CCL84839) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 4 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена Cas9 в культуре клеток Arabidopsis thaliana Т87 до трансфекции ДНК-вектором VTvaf17-Act1-Cas9;
2 - кДНК гена Cas9 в культуре клеток Arabidopsis thaliana Т87после трансфекции ДНК-вектором VTvaf17-Act1-Cas9;
3 - кДНК гена Actin-2 в культуре клеток Arabidopsis thaliana Т87 до трансфекции ДНК-вектором VTvaf17-Act1-Cas9;
4 - кДНК гена Actin-2 в культуре клеток Arabidopsis thaliana Т87 после трансфекции ДНК-вектором VTvaf17-Act1-Cas9.
В качестве референтного гена использовали ген Actin-2, приведенный в базе данных GenBank под номером Gene ID: 821411 (At3g18780).
На фиг. 5
показана диаграмма концентрации белка CAS9 в лизате культуры клеток Arabidopsis thaliana Т87 (ABRC, Germplasm: T87 / Stock: CCL84839) через 48 часов после электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген Cas9.
На фиг. 5 отмечены следующие элементы:
культура А - культура клеток Arabidopsis thaliana Т87, электропорированных водным раствором без плазмидной ДНК (отрицательный контроль);
культура В - клеток Arabidopsis thaliana Т87, электропорированных ДНК-вектором VTvaf17-Act1 (отрицательный контроль);
культура С - клеток Arabidopsis thaliana Т87, электропорированных ДНК-вектором VTvaf17-Act1-Cas9.
На фиг. 6
Показано выравнивание секвенированных последовательностей, полученных из микрокаллусов, после трансформации клеток протопластов кукурузы ДНК-вектором VTvaf17-Act1-Cas9 и gRNA с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности направленного геномного редактирования растений при сочетанном введении с gRNA заданной специфичности.
На фиг. 6 отмечены следующие элементы:
WT - исходная последовательность участка гена Zmzb7;
1-4 - идентифицированные направленно редактированные последовательности участка гена Zmzb7.
На фиг. 7
Показана диаграмма относительного количества (в %) семян салата, проросших при 37С.
На фиг. 7 отмечены следующие элементы:
WT - контрольная группа растений;
termoR - группа растений, подвергшихся процедуре геномного редактирования.
Реализация изобретения
На основе ДНК-вектора VTvaf17 размером 3165 п.н. создан генотерапевтический ДНК-вектор, несущий целевой генСas9, предназначенный для гетерологичной экспрессии этого целевого гена в клетках растений. При этом способ получения генотерапевтического ДНК-вектора, несущего целевой ген, заключается в том, что в полилинкер генотерапевтического ДНК-вектора VTvaf17-Act1 клонируют белок-кодирующую последовательность целевого гена Cas9 (кодирует эндонуклеазу CAS9). Известно, что способность ДНК-векторов проникать в эукариотические клетки обусловлена, главным образом, размером вектора. При этом ДНК-векторы с наименьшим размером обладают более высокой проникающей способностью. Таким образом, предпочтительным является отсутствие в составе вектора элементов, которые не несут функциональной нагрузки, но при этом увеличивают размер ДНК-вектора. Данные особенности ДНК-векторов были учтены при получении генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген Саs9, путем отсутствия в составе вектора крупных нефункциональных последовательностей и генов антибиотикорезистентности, что позволило, помимо технологических преимуществ и преимуществ в плане безопасности применения, значительно уменьшить размер полученного генотерапевтического ДНК-вектора VTvaf17-Act1, несущего целевой ген Саs9. Таким образом, способность проникать в эукариотические клетки полученного генотерапевтического ДНК-вектора обусловлена его небольшими размерами.
Генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 получали следующим образом: кодирующую часть целевого гена Cas9 клонировали в генотерапевтический ДНК-вектор VTvaf17-Act1 и получали генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9, SEQ ID №1. Кодирующую часть гена Cas9 размером 4222 п.н. получали путем путем ферментативного синтеза из олигонуклеотидов. Расщепление продукта амплификации специфическими эндонуклеазами рестрикции проводили с учетом оптимальной процедуры дальнейшего клонирования, причем клонирование в генотерапевтический ДНК-вектор VTvaf17-Act1 проводили по сайтам рестрикции, расположенными в полилинкере вектора VTvaf17-Act1. Выбор сайтов рестрикции проводили таким образом, чтобы клонированный фрагмент попадал в рамку считывания экспрессионной кассеты вектора VTvaf17-Act1, при этом белок-кодирующая последовательность не содержала сайты рестрикции для выбранных эндонуклеаз. При этом специалистам в данной области техники понятно, что методическая реализация получения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 может варьировать в рамках выбора известных методов молекулярного клонирования генов, при этом эти способы подпадают под объем настоящего изобретения. Так, например, могут быть использованы различные последовательности олигонуклеотидов для амплификации гена Cas9, различные эндонуклеазы рестрикции или такие лабораторные техники как безлигазное клонирование генов.
Генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 обладает нуклеотидной последовательностью SEQ ID №1. При этом специалистам в данной области техники известно свойство вырожденности генетического кода, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей, отличающихся инсерцией, делецией или заменой нуклеотидов, которые не приводят к изменению полипептидной последовательности, кодируемой целевым геном, и/или не приводят к потере функциональной активности регуляторных элементов вектора VTvaf17-Act1. При этом специалистам в данной области техники известно явление генетического полиморфизма, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей генаСаs9, которые при этом кодируют различные варианты аминокислотных последовательностей белкаCAS9, не отличающихся от приведенных по своей функциональной активности при физиологических условиях.
Способность проникать в эукариотические клетки и функциональную активность, то есть способность экспрессировать целевой ген, полученного генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 подтверждают путем введения в эукариотические клетки полученного вектора и последующим анализом экспрессии специфической мРНК и/или белкового продукта целевого гена. Наличие специфической мРНК в клетках, в которые был введен генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 свидетельствует как о способности полученного вектора проникать в эукариотические клетки, так и о его способности экспрессировать мРНК целевого гена Саs9. При этом, как известно специалистам в данной области техники, наличие мРНК гена является обязательным условием, но не доказательством трансляции белка, кодируемого целевым геном. Поэтому для подтверждения свойства генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 экспрессировать целевой ген на уровне белка в эукариотических клетках, в которые был введен генотерапевтический ДНК-вектор, проводят анализ концентрации белка, кодируемого целевым геном, с использованием иммунологических методов. Наличие белка CAS9 подтверждает эффективность экспрессии целевого гена в эукариотических клетках растений с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген Cas9. Таким образом, для подтверждения эффективности экспрессии и реализуемости способа применения созданного генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего целевой ген, а именно, ген Cas9, использовали следующие методы:
A) ПЦР в реальном времени - изменение накопления ампликонов кДНК целевого гена в лизате клеток растений, после трансфекции различных клеточных линийрастенийгенотерапевтическим ДНК-вектором;
B) Иммуноферментный анализ - изменение количественного уровня целевого белка в лизате клеток растений после трансфекции различных клеточных линий растений генотерапевтическим ДНК-вектором;
C) Секвенирование участка ДНК клеток растения, подвергшегося процедуре геномного редактирования, после сочетанной трансфекции этих клеток генотерапевтическим ДНК-вектора иgRNA.
D) Функциональный тест на проявление фенотипических свойств организма растения, обусловленных направленным геномным редактированием, реализованным путем сочетанного введения генотерапевтического ДНК-вектора и gRNA.
Для подтверждения реализуемости способа применения созданного генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего целевой ген, а именно, ген Cas9 выполняли:
A) трансфекцию генотерапевтическим ДНК-вектором различных клеточных линий растений;
B) сочетанную трансфекцию генотерапевтическим ДНК-вектором и gRNA различных клеточных линий растений;
C) демонстрацию изменения последовательности участка редактируемого гена в клеточной линии растений, подвергшейся направленному геномному редактированию.
D) демонстрацию проявление фенотипических свойств организма растения, обусловленных направленным геномным редактированием, реализованным путем сочетанного введения генотерапевтического ДНК-вектора и gRNA.
Указанные способы применения характеризуются отсутствием потенциальных рисков за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов, и за счет отсутствия в составе генотерапевтического ДНК-вектора генов устойчивости к антибиотикам, что подтверждается отсутствием участков, гомологичных вирусным геномам и генам антибиотикорезистентности в нуклеотидной последовательности генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9(SEQ ID №1).
Как известно специалистам в данной области техники, гены антибиотикорезистентности в составе генотерапевтических ДНК-векторов используются с целью получения этих векторов в препаративных количествах путем наращивания бактериальной биомассы в питательной среде, содержащей селективный антибиотик. В рамках настоящего изобретения в целях возможности безопасного применения генотерапевтического ДНК-вектора VTvaf17-Act1, несущего целевой ген Cas9, использование селективных питательных сред, содержащих антибиотик, не представляется возможным. В качестве технологического решения для получения генотерапевтического ДНК-вектора VTvaf17-Act1, несущего целевой ген Cas9, для возможности масштабирования до промышленных масштабов получения генотерапевтических векторов предлагается способ получения штаммов для наработки указанных генотерапевтических векторов на основе бактерии Escherichia coli SCS110-AF. Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 заключается в получении компетентных клеток штамма Escherichia coli SCS110-AF с введением в эти клетки генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 c помощью методов трансформации (электропорации), общеизвестных специалистам в данной области техники. Полученный штамм Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 используется для наработки генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 c возможностью использования сред без содержания антибиотиков.
Для подтверждения получения штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 проводили трансформацию, селекцию и последующее наращивание с выделением плазмидной ДНК.
Для подтверждения технологичности получения и возможности масштабирования до промышленного производства генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего целевой ген, а именно, ген Cas9, выполняли ферментацию в промышленном масштабе штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, который содержит генотерапевтический ДНК-вектор VTvaf17-Act1, несущий целевой ген Саs9.
Способ масштабирования получения бактериальной массы до промышленных масштабов для выделения генотерапевтического ДНК-вектора VTvaf17-Act1, несущего целевой ген Саs9, заключается в том, что затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 инкубируют в объеме питательной среды без содержания антибиотика обеспечивающим подходящую динамику накопления биомассы, по достижению достаточного количества биомассы в логарифмической фазе роста, бактериальную культуру переносят в промышленный ферментер, после чего растят до достижения стационарной фазы роста, затем выделяют фракцию, содержащую целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 многостадийно фильтруют и очищают хроматографическими методами. При этом специалистам в данной области техники понятно, что условия культивирования штаммов, состав питательных сред (за исключением содержания антибиотиков), используемое оборудование, методы очистки ДНК могут варьировать в рамках стандартных операционных процедур в зависимости от отдельно взятой производственной линии, но известные подходы к масштабированию, промышленному получению и очистке ДНК-векторов с использованием штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 подпадают под объем настоящего изобретения.
Описанное изобретение подтверждается примерами реализации настоящего изобретения.
Изобретение поясняется следующими примерами.
Пример 1.
Получение генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего целевой ген, а именно, ген, кодирующий белок CAS9.
Генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 конструировали на основе вектора VTvaf17 (CELL and Gene Therapy Ltd., ООО PIT), с заменой промоторного региона гена EF1a человека на промоторный регион гена актина первого типа (act1) риса и введением участка ДНК, кодирующего белок Cas9.
Для этого часть вектора VTvaf17 (фрагмент (а)), включающую ориджин репликации, терминатор транскрипции hGH-TA, регуляторный участок транспозона Tn10 PHK-out, полученную путем ПЦР-амплификации участка плазмиды VTvaf17 объединяли с фрагментами ДНК (б) и (в), полученными из разных источников, где
(б) промоторный регион гена актина первого типа риса Act1, полученный путем ПЦР-амплификации участка геномной ДНК риса;
(в) кодирующая часть гена Cas9 размером 4222 п.н., полученная путем ферментативного синтеза из нуклеотидов.
ПЦР-амплификацию проводили с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (NewEnglandBiolabs, США) в соответствии с инструкцией производителя.
Фрагмент (а) получали путем ПЦР-амплификации вектора VTvaf17 с использованием олигонуклеотидов VTvaf-Xho и VTvaf-Sal:
VTvaf-Xho GACCTCGAGGGAGTCAGGCAACTATGGATG
VTvaf-Sal ATAGTCGACCCTGTGACCCCTCCCCAG.
Фрагмент (б) - промоторный регион Act1 - получали путем ПЦР-амплификации участка геномной ДНК риса с использованием олигонуклеотидов PAct-F и PAct-R:
PAct-F TATCTCGAGGTCATTCATATGCTTGAGAAGAG
PAct-R
AGGGTCGACTATAAGCTTACAAAAAAGCTCCGCACGAGGCT.
Затем полученные участки (а) и (б) объединяли путем рестрикции с последующим лигированием по сайтам SalI и XhoI. Таким образом получали генотерапевтический ДНК-вектор VTvaf17-Act1 размером 3162 п.н., который является рекомбинантным, с возможностью селекции без антибиотиков.
Генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 конструировали объединением кодирующей части гена Cas9 размером 4222 п.н. и ДНК-вектора VTvaf17-Act1, расщепленного эндонуклеазами HindlII и SalI.
Кодирующую часть гена Cas9 размером 4222 п.н. получали путем ферментативного синтеза из нуклеотидов с последующей амплификацией с использованием олигонуклеотидов Cas9_F и Cas9_R:
Cas9_F TGTAAGCTTGTAGAAGATGGCCCCAAAGAAGAAG
Cas9_R ATAGTCGACTTACTTTTTCTTTTTTGCCTGG.
Расщепление продукта амплификации кодирующей части гена Cas9 и ДНК-вектора VTvaf17-Act1 проводили эндонуклеазами рестрикции HindlII и SalI (NewEnglandBiolabs, США). В результате получали ДНК-вектор VTvaf17-Act1-Cas9 размером 7369 п.н. с нуклеотидной последовательностью SEQ ID №1 и общей структурой изображенной на фиг. 1.
Пример 2.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего целевой ген, а именно, ген Cas9, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена Cas9, в лизате культуры клеток табака Nicotiana tabacum BY-2 cell line (RIKEN BRC, Кат. rpc00001) после электропорации этих клеток ДНК-вектором VTvaf17-Act1-Cas9, несущим ген Cas9. Клетки выращивали в среде mLS, 0.2 mg/L 2,4-D, рН 5.8 в стандартных условиях (27С, 130 rpm).
Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Введение генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 осуществляли методом электропорации с использованием прибора ВТХ Electro Square Porator Т820 Electropolation System (ВТХ, Т 820) ранее описанным в литературе методом ( Е, Wypijewski K., 2001). В качестве контроля использовали воду без ДНК-вектора, ДНК-вектор VTvaf17-Act1, не содержащий кДНК гена Cas9, в качестве электропорируемых агентов - ДНК-вектор VTvaf17-Act1-Cas9, несущий ген Cas9. После электропорации клетки культивировали в течение 48 часов в среде mLS, 0.2 mg/L 2,4-D, рН 5.8 в стандартных условиях (27С, 130 rpm).
Е, Wypijewski K., 2001). В качестве контроля использовали воду без ДНК-вектора, ДНК-вектор VTvaf17-Act1, не содержащий кДНК гена Cas9, в качестве электропорируемых агентов - ДНК-вектор VTvaf17-Act1-Cas9, несущий ген Cas9. После электропорации клетки культивировали в течение 48 часов в среде mLS, 0.2 mg/L 2,4-D, рН 5.8 в стандартных условиях (27С, 130 rpm).
Суммарную РНК из клеток BY-2 выделяли с использованием Trizol Reagent (Invitrogen, США) согласно рекомендациям производителя. 0.5 мл культуры клеток центрифугировали и отбирали супернатант. К осадку клеток добавляли 1 мл Trizol Reagent и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С. Далее образец центрифугировали при 14000 д в течении 10 мин и снова прогревали в течении 10 мин при 65°С. Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14000g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия, рН 5.2 и равный объем изопропилового спирта. Инкубировали образец при -20°С в течении 10 мин с последующим центрифугированием при 14000 g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Определение уровня экспрессии мРНК гена Cas9 после трансфекции проводили путем оценки динамики накопления ампликонов кДНК методом ПЦР в режиме реального времени. Для получения и амплификации кДНК, специфичной для гена Cas9, использовали олигонуклеотиды hCas9_SF и hCas9_SR:
hCas9_SF CATCGAGCAGATCAGCGAGT
hCas9_SR CGATCCGTGTCTCGTACAGG.
Длина продукта амплификации - 275 п.н.
Реакцию обратной транскрипции и ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) для ПЦР в режиме реального времени. Реакцию проводили в объеме 20 мкл, содержащих: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 мМ хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, США) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 30 сек. В качестве референтного гена использовали ген L25 (белок L23a 60S субъединицы рибосомы), приведенный в базе данных GenBank под номером LOC107796789. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов Cas9 и L25. В качестве отрицательного контроля использовали деионизированную воду. Количество и динамику накопления ампликонов кДНК генов Cas9 и L25 оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 2.
Из фигуры 2 следует, что в результате трансфекции культуры клеток табака Nicotiana tabacum BY-2 cell line генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9, уровень специфической мРНК гена Cas9 вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген Cas9 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 для повышения уровня экспрессии гена Cas9 в клетках растений.
Пример 3.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего ген Cas9, для экспрессии белка CAS9 в клетках растений.
Оценивали изменение количества белка CAS9 в лизате культуры клеток табака Nicotiana tabacum BY-2 cell line (RIKEN BRC, Кат. rpc00001) после трансфекции этих клеток ДНК-вектором VTvaf17-Act1-Cas9, несущим ген Cas9. Клетки выращивали в среде mLS, 0.2 mg/L 2,4-D, рН 5.8 в стандартных условиях (27С, 130 rpm).
Введение генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 осуществляли методом электропорации с использованием прибора ВТХ Electro Square Porator Т820 Electropolation System (BTX, T 820) методом описанным в ( E, Wypijewski K., 2001). В качестве контроля использовали воду без ДНК-вектора (А), ДНК-вектор VTvaf17-Act1, не содержащий кДНК гена Cas9 (В), в качестве электропорируемых агентов - ДНК-вектор VTvaf17-Act1-Cas9, несущий ген Cas9 (С).
E, Wypijewski K., 2001). В качестве контроля использовали воду без ДНК-вектора (А), ДНК-вектор VTvaf17-Act1, не содержащий кДНК гена Cas9 (В), в качестве электропорируемых агентов - ДНК-вектор VTvaf17-Act1-Cas9, несущий ген Cas9 (С).
После электропорацииклетки выращивали в среде mLS, 0.2 mg/L 2,4-D, рН 5.8 в стандартных условиях (27С, 130 rpm). Спустя 48 часов клетки осаждали центрифугированием, отбирали супернатант. К клеточному осадку, полученному из 0,5 мл культуры клеток, добавляли 0,5 мл 0,9% NaCl и 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка CAS9 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Cas9 (CRISPR Associated Protein 9) ELISA Kit (Cell Biolabs Inc, Кат. PRB-5079) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка CAS9, входящим в состав набора. Чувствительность метода составляла не менее 1,5 нг/мл, диапазон измерения - от 1.56 нг/мл до 100 нг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 3.
Из фигуры 3 следует, что в результате электропорации культуры клеток BY-2 генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 установлено наличие белка CAS9 по сравнению с отсутствием такового в контрольных образцах, что подтверждает способность вектора проникать в эукариотические клетки растений и экспрессировать ген Cas9 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 для экспрессии Cas9 в эукариотических клетках растений.
Пример 4.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего целевой ген, а именно, ген Cas9, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена Cas9, в лизате культуры клеток Arabidopsis thaliana Т87 (ABRC, Germplasm: T87 / Stock: CCL84839) после трансфекции этих клеток ДНК-вектором VTvaf17-Act1-Cas9, несущим ген Cas9. Клетки выращивали в среде NT-1 (состав среды на 1 л: 4.3 г MS, 30 г сахарозы, 0.18 г KH2PO4, 1 мг тиамина, 500 мг 2,4-D, 100 мг миоинозитола), рН 5.8 при 24С, 130 rpm.
Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Введение генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 осуществляли методом электропорации с использованием прибора ВТХ Electro Square Porator Т820 Electropolation System (BTX, T 820) аналогично ранее описанному в литературе методом ( Е, Wypijewski K., 2001). В качестве контроля использовали воду без ДНК-вектора, ДНК-вектор VTvaf17-Act1, не содержащий кДНК гена Cas9, в качестве электропорируемых агентов - ДНК-вектор VTvaf17-Act1-Cas9, несущий ген Cas9. После электропорации клетки культивировали в течение 48 часов в среде NT-1, рН 5.8 при 24С, 130 rpm.
Е, Wypijewski K., 2001). В качестве контроля использовали воду без ДНК-вектора, ДНК-вектор VTvaf17-Act1, не содержащий кДНК гена Cas9, в качестве электропорируемых агентов - ДНК-вектор VTvaf17-Act1-Cas9, несущий ген Cas9. После электропорации клетки культивировали в течение 48 часов в среде NT-1, рН 5.8 при 24С, 130 rpm.
Суммарную РНК из клеток Т87 выделяли с использованием Trizol Reagent (Invitrogen, США) согласно рекомендациям производителя. 0.5 мл культуры клеток центрифугировали и отбирали супернатант. К осадку клеток добавляли 1 мл Trizol Reagent и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С. Далее образец центрифугировали при 14000 g в течении 10 мин и снова прогревали в течении 10 мин при 65°С. Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14000 g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия, рН 5.2 и равный объем изопропилового спирта. Инкубировали образец при -20°С в течении 10 мин с последующим центрифугированием при 14000 g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Определение уровня экспрессии мРНК гена Cas9 после трансфекции проводили путем оценки динамики накопления ампликонов кДНК методом ПЦР в режиме реального времени. Для получения и амплификации кДНК, специфичной для гена Cas9, использовали олигонуклеотиды hCas9_SF и hCas9_SR:
hCas9_SF CATCGAGCAGATCAGCGAGT
hCas9_SR CGATCCGTGTCTCGTACAGG.
Длина продукта амплификации - 275 п.н.
Реакцию обратной транскрипции и ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) для ПЦР в режиме реального времени. Реакцию проводили в объеме 20 мкл, содержащих: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 мМ хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, США) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 30 сек. В качестве референтного использовали ген Actin-2 (At3g 18780), амплификацию проводили с коммерческим набором праймеров Control primer set for Arabidopsis Actin-2 gene (Sigma, кат. C3615). В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательность кДНК гена Cas9. В качестве отрицательного контроля использовали деионизированную воду. Количество и динамику накопления ампликонов кДНК генов Cas9 и Actin-2 оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 4.
Из фигуры 4 следует, что в результате трансфекции культуры клеток Arabidopsis thaliana Т87 генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9, уровень специфической мРНК гена Cas9 вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки растений и экспрессировать ген Cas9 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 для повышения уровня экспрессии гена Cas9 в клетках растений.
Пример 5.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего ген Cas9, для экспрессии белка CAS9 в клетках растений.
Оценивали изменение количества белка CAS9 в лизате культуры клеток Arabidopsis thaliana Т87 (ABRC, Germplasm: T87 / Stock: CCL84839) после трансфекции этих клеток ДНК-вектором VTvaf17-Act1-Cas9, несущим ген Cas9. Клетки выращивали как описано в примере 4.
Введение генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 осуществляли методом электропорации с использованием прибора ВТХ Electro Square Porator Т820 Electropolation System (BTX, T 820) методом аналогичным описанному в ( Е, Wypijewski K., 2001). В качестве контроля использовали воду без ДНК-вектора, ДНК-вектор VTvaf17-Act1, не содержащий кДНК гена Cas9, в качестве электропорируемых агентов - ДНК-вектор VTvaf17-Act1-Cas9, несущий ген Cas9.
Е, Wypijewski K., 2001). В качестве контроля использовали воду без ДНК-вектора, ДНК-вектор VTvaf17-Act1, не содержащий кДНК гена Cas9, в качестве электропорируемых агентов - ДНК-вектор VTvaf17-Act1-Cas9, несущий ген Cas9.
После электропорации клетки культивировали в течение 48 часов в среде NT-1, рН 5.8 при 24С, 130 rpm. Спустя 48 часов клетки осаждали центрифугированием, отбирали супернатант. К клеточному осадку, полученному из 0,5 мл культуры клеток, добавляли 0,5 мл 0,9% NaCl и 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка CAS9 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Cas9 (CRISPR Associated Protein 9) ELISA Kit (Cell Biolabs Inc, Кат. PRB-5079) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка CAS9, входящим в состав набора. Чувствительность метода составляла не менее 1,5 нг/мл, диапазон измерения - от 1.56 нг/мл до 100 нг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 5.
Из фигуры 5 следует, что в результате электропорации культуры клеток Т87 генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 установлено наличие белка CAS9 по сравнению с отсутствием такового в контрольных образцах, что подтверждает способность вектора проникать в эукариотические клетки растений и экспрессировать ген Cas9 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 для экспрессии Cas9 в эукариотических клетках растений.
Пример 6
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего ген Cas9, для экспрессии белка CAS9 в клетках растений и его функциональной активности для геномного редактирования растений при сочетанном введении с gRNA.
Методом секвенирования оценивали изменение последовательности ДНК гена Zmzb7 (GRMZM2G027059) кукурузы после трансфекции клеток протопластов кукурузы ДНК-вектором VTvaf17-Act1-Cas9, несущим ген Cas9, в комбинации с gRNA, к участку гена Zmzb7.
Семена кукурузы (Zea mays) обрабатывали 2% гипохлоридом натрия 10 минут, затем промывали стерильной водой 5 раз и помещали в MS среду (Sigma, М5524) проращивали течение 3-5 дней в темноте при 37С, затем подращивали еще 7 дней при 25С. Спустя 5-7 дней отрезали 10-15 листочков, разрезали их на части 1-2 мм в небольшом объеме стерильной воды. Разрезанные листья помещали в 30 мл раствора Plant Protoplast Digest/Wash Solution (Sigma, D9692) и инкубировали в течение 2 часов, перемешивая каждые 20 минут. Полученную суспензию пропускали через нейлоновое сито с размером отверстий 40 мкм, центрифугировали суспензию при 100 g 5 минут. Удаляли супернатант и ресуспендировали осадок в 1 мл MMG буфера, приготовленный следующим образом: 0.8 М маннитол - 2.5 mL, 300 mM MgCl2 - 0.25 мл, 200 mM MES (рН 5.7) - 0.1 мл, стерильная вода до объема 10 мл. Помещали в эппендорф 200 мкл суспензии протопластов с концентрацией 2 *105 клеток/мл. Проводили липофекцию протопластов с использованием Lipofectamine 3000 (Invitrogen, США). Смесь для липофекции готовили следующим образом: 50 мкл Lipofectamine 3000 смешивали с 50 мкл водного раствора, содержащего 100 мкг ДНК-вектора VTvaf17-Act1-Cas9 и 1 мкг gRNA, подобранных к участку гена Zmzb7, мутации в котором приводят к образованию растений-альбиносов. Последовательность gRNA была взята из (Feng etal, 2015).
Готовую смесь для липофекции инкубировали в течение 30 минут при комнатной температуре, затем добавляли к суспензии протопластов и аккуратно перемешивали, инкубировали 30 минут на столе. Затем переносили протопласты в 0,5 мл Protoplast Induction Media (PIM) (Для приготовления 1 л среды используется: 1/2 В5 среда - 1.58 g, сахароза - 103 г, 2,4-D - 0.2 мг, ВАР - 0.3 мг, MES - 0.1 г, CaCl2⋅2H2O - 375 мг, NaFe-EDTA - 18.35 мг, сукцинат натрия - 270 мг)и культивировали в течение 48 ч при 25С. Затем высевали протопласты в лунку 6-луночного культурального планшета и добавляли 0,5 мл среды с 2.4% агарозного покрытия. Сформированные микрокаллусы извлекали из агаризованной среды, выделяли геномную ДНК с использованием набора Wizard® GenomicDNAPurificationKit (Promega, кат. А1620) согласно инструкции производителя и использовали ее для ПЦР амплификации участка гена Zmzb7 (GRMZM2G027059) с праймерами:
ZB7-F CACTTCATGGCCTTCAATAC
ZB7-R GCTGATCCTGTTTCCTGGTC
и последующего секвенирования полученных ампликонов.
Данные секвенирования сравнивали с исходной последовательностью, полученной из контрольных каллусов, которые были трансформированы только раствором gRNA без добавления ДНК-вектора VTvaf17-Act1-Cas9. В результате из 20 проанализированных последовательностей 4 образца содержали редактированную последовательность. Графики, полученные в результате анализа представлены на фиг. 6. На фигуре 6 представлены данные выравнивания 4 редактированных последовательностей относительно контрольной последовательности ДНК.
Из фигуры 6 следует, что в результате липофекции протопластов кукурузы (Zea mays) генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 и gRNA, комплиментарных участку гена Zmzb7 (GRMZM2G027059), в 20% микрокаллусов произошло направленное редактирование последовательности гена, что подтверждает способность вектора проникать в эукариотические клетки растений и экспрессировать ген Cas9 и при помощи gRNA направленно редактировать последовательность выбранного гена. Представленные результаты подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 для таргетного геномного редактирования в клетках растений.
Пример 7
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9, несущего ген Cas9, для экспрессии белка CAS9 в клетках растений и его функциональной активности для геномного редактирования растений при сочетанном введении с gRNA.
Оценивали возможность направленно изменять фенотипические свойства растения путем выполнения процедуры направленного геномного редактирования путем сочетанной липофекции протопластов салата латука (Lactuca sativa var. Chungchima) генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 и gRNA.
Для этого семена салата латука (Lactuca sativa var. Chungchima) обрабатывали 2% гипохлоридом натрия10 минут, затем промывали стерильной водой 5 раз и помещали в MS среду (Sigma, М5524). После образования розетки листьев отрезали 10-15 листьев салата, разрезали их на частиразмером 1-2 мм в небольшом объеме стерильной воды. Разрезанные листья помещали в 30 мл раствора Plant Protoplast Digest/Wash Solution (Sigma, D9692) и инкубировали в течение 2 часов, перемешивая каждые 20 минут. Полученную суспензию пропускали через сито с размером отверстий 100 μm, центрифугировали суспензию при 100 g 5 минут. Удаляли супернатант и ресуспендировали осадок в 1 мл MMG буфера: 0.8 М маннитол 2.5 mL, 300 mM MgCl2 0.25 мл, 200 mM MES (рН 5.7) 0.1 мл, стерильная вода до объема 10 мл. Помещали в эппендорф 200 мкл суспензии протопластов с концентрацией 2 *105 клеток/мл. Проводили липофекцию протопластов с использованием Lipofectamine 3000 (Invitrogen, США). Смесь для липофекции готовили следующим образом: 50 мкл Lipofectamine 3000 смешивали с 50 мкл водного раствора, содержащего 100 мкг ДНК-вектора VTvaf17-Act1-Cas9 и 1 мкг смеси gRNA, подобранных к участку гена LsNCED4 (LOC111879595), контролирующего термоингибирование прорастания семян.
Последовательности gRNA, комплементарные LsNCED4 были сгенерированы с использованием ресурса http://www.e-crisp.org и представляли собой набор олигонуклеотидов:

Готовую смесь для липофекции инкубировали в течение 30 минут при комнатной температуре, затем добавляли к суспензии протопластов и аккуратно перемешивали, инкубировали 30 минут на столе. Затем переносили протопласты в 0,5 мл Protoplast Induction Media (PIM) (Для приготовления 1 л среды используется: 1/2 В5 medium 1.58 g, Sucrose 103 g, 2,4-D 0.2 mg, BAP 0.3 mg, MES 0.1 g, CaCl2⋅2H2O 375 mg, NaFe-EDTA 18.35 mg, Sodium succinate 270 mg). Высевали протопласты в лунку 6-луночного культурального планшетаи добавляли 0,5 мл среды с 2.4% легкоплавкой агарозы. Сформированные микрокаллусы пересаживали в среду Shoot Induction Media (SIM) (Для приготовления 1 л SIM использовали: 4.4 g Sucrose 30 g, 0.1 mg NAA 100 μL (1 mg/mL stock), 0.5 mg BAP 500 μL (0.1 mg/mL stock), Plant agar 6 g). Спустя 4 недели калли пересаживали в MS media и выращивали в стандартном световом режиме (16 часов света, 8 часов темноты). Сформированные растения пересаживали в почву. Собирали семена от каждого растения и помещали их по 10 штук в индивидуальную чашку петри с MS средой, чашки держали в термостате при 35С в течение 7 дней. Спустя 7 дней проводили подсчет проросших семян. Семена растений, полученных из протопластов, в которых произошло направленное редактирование генома, прорастали при повышенной температуре, тогда как семена из контрольных групп не прорастали при 35С. Графические материалы, полученные в результате анализа результатов представлены на фиг. 7.
Из фигуры 7 следует, что в результате липофекции протопластов салата латука (Lactuca sativa var. Chungchima) генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 и gRNA, к участку гена LsNCED4, 50% семян проросло при температуре 35С по сравнению с 1% в контрольных образцах, что подтверждает способность вектора проникать в эукариотические клетки растений и экспрессировать ген Cas9 и при помощи gRNA направленно редактировать последовательность выбранного гена, тем самым направленно изменяя фенотипические свойства растения. Представленные результаты подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 для таргетного геномного редактирования в клетках растений.
Пример 8.
Штамм Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, несущий генотерапевтический ДНК-вектор, и способ его получения.
Конструирование штамма для наработки в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, Cas9, а именно штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, несущего генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 для его наработки с возможностью селекции без использования антибиотиков заключается в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9, после чего клетки высеваются на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. При этом штамм Escherichia coli SCS110-AF для наработки генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 или генотерапевтических ДНК-векторов на его основе с возможностью положительной селекции без использования антибиотиков получали путем конструирования линейного фрагмента ДНК, содержащего регуляторный элемент RNA-in транспозона Tn10 для селекции без применения антибиотиков размером 64 п.н., ген левансахаразы sacB, продукт которого обеспечивает селекцию на сахарозо-содержащей среде размером 1422 п.н., ген устойчивости к хлорамфениколу catR, необходимый для отбора клонов штамма, в которых прошла гомологичная рекомбинация размером 763 п.н. и две гомологичные последовательности, обеспечивающие процесс гомологичной рекомбинации в области гена recA с одновременной его инактивацией размером 329 п.н. и 233 п.н., после чего проводили трансформацию клеток Escherichia coli путем электропорации и отбирали клоны, выжившие на среде, содержащей 10 мкг/мл хлорамфеникола.
Пример 9.
Способ масштабирования получения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген Cas9 до промышленного масштаба.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 (SEQ ID №1) проводили масштабную ферментацию штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, который содержит генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9, несущий целевой ген, а именно Cas9. Штамм Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, получали на базе штамма Escherichia coli SCS110-AF (Cell and Gene Therapy Ltd, Великобритания) по примеру 8 путем электропорации компетентных клеток этого штамма генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9, несущим целевой ген, а именно, Cas9 c последующим высевом трансформированных клеток на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы и отбором отдельных клонов.
Ферментацию полученного штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, несущего генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 проводили в ферментере объемом 10 л с последующим выделением генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9.
Для ферментации штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 готовили среду, содержащую на 10 л: 100 г триптон, 50 г дрожжевой экстракт (Becton Dickinson, США), доводили водой до 8800 мл и автоклавировали при 121 0С 20 мин, затем добавляли 1200 мл 50% (вес/объем) сахарозы. Далее засевали в колбу затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 в объеме 100 мл. Инкубировали в шейкере-инкубаторе 16 ч при 30°С. Переносили затравочную культуру в ферментер Techfors S (Infors НТ, Швейцария), растили до достижения стационарной фазы. Контроль осуществляли измерением оптической плотности культуры при длине волны 600 нм. Клетки осаждали центрифугированием 30 мин при 5000-10000 g. Супернатант удаляли, клеточную массу ресуспендировали в 10% по объему фосфатно-солевого буфера. Повторно центрифугировали 30 мин при 5000-10000 g. Супернатант удаляли, к клеточной массе добавляли раствор 20 мМ TrisCl, 1 мМ ЭДТА, 200 г/л сахароза, рН 8,0 в объеме 1000 мл, тщательно перемешивали до образования гомогенной суспензии. Добавляли раствор яичного лизоцима до конечной концентрации 100 мкг/мл. Инкубировали 20 мин на льду при бережном перемешивании. Далее, добавляли 2500 мл раствора 0,2 М NaOH, 10 г/л додецилсульфат натрия, инкубировали 10 мин на льду при бережном перемешивании, затем добавляли 3500 мл раствора 3М ацетат натрия, 2М уксусная кислота, рН 5-5,5, инкубировали 10 мин на льду при бережном перемешивании. Полученный образец центрифугировали 20-30 мин при 15000 g или более. Раствор аккуратно декантировали, от остатков осадка избавлялись фильтрацией через грубый фильтр (фильтровальную бумагу). Добавляли РНКазу A (Sigma, США) до конечной концентрации 20 нг/мл, инкубировали ночь 16 ч при комнатной температуре. Раствор центрифугировали 20-30 мин при 15000 g, затем фильтровали через мембранный фильтр с порами 0,45 мкм (Millipore, США). Далее проводили ультрафильтрацию через мембрану размером отсечения 100 кДа (Millipore, США) и разбавляли до начального объема буфером 25 мМ TrisCl, рН 7.0. Операцию повторяли три - четыре раза. Наносили раствор, на колонку с 250 мл сорбента DEAE sepharose HP (GE, США), уравновешенную раствором 25 мМ TrisCl, рН 7.0. После нанесения образца колонку промывали тремя объемами этого же раствора, а затем проводили элюцию генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 линейным градиентом от раствора 25 мМ TrisCl, рН 7.0 до раствора 25 мМ TrisCl, рН 7.0, 1М NaCl в объеме пяти объемов колонки. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм. Хроматографические фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9, объединяли и проводили гель-фильтрацию на сорбенте Superdex 200 (GE, США). Колонку уравновешивали фосфатно-солевым буфером. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм, фракции анализировали электрофорезом в агарозном геле. Фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 объединяли и хранили при -20°С. Для оценки воспроизводимости техпроцесса обозначенные технологические операции повторяли пятикратно.
Воспроизводимость техпроцесса и количественные характеристики выхода конечного продукта подтверждают технологичность получения и возможность производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9.
Таким образом, созданный генотерапевтический ДНК-вектор с целевым геном может быть использован для введения в клетки растений, обеспечивая гетерологичную экспрессию эндонуклеазы Cas9, что может использоваться с целью редактирования последовательности генома растений в присутствии gRNA заданной специфичности.
Таким образом, задача, поставленная в данном изобретении, а именно: конструирование генотерапевтического ДНК-вектора для гетерологичной экспрессии гена Cas9 в клетках растений, сочетающего в себе следующие свойства:
I) Эффективность генотерапевтического ДНК-вектора для гетерологичной экспрессии целевого гена в эукариотических клетках растений.
II) Возможность безопасного применения для реализации различных методов редактирования геномов растений, в том числе за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов.
III) Возможность безопасного применения для реализации различных методов редактирования геномов растений, в том числе за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности.
IV) Технологичность получения и возможность наработки генотерапевтического ДНК-вектора в промышленных масштабах.
Также решена задача по конструированию штаммов, несущих генотерапевтический ДНК-вектор.
Решение поставленных задач подтверждается примерами:
для п. I - пример 1, 2, 3, 4, 5; 6; 7; 8; 9;
для п. II - пример 1, 6, 7;
для п. III и п. IV - пример 1, 8, 9.
Промышленная применимость:
Все представленные выше примеры подтверждают промышленную применимость предлагаемого генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген Cas9 для гетерологичной экспрессии гена Cas9 в клетках растений; штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, несущего генотерапевтический ДНК-вектор; способа получения генотерапевтического ДНК-вектора; способа производства в промышленных масштабах генотерапевтического ДНК-вектора.
Перечень сокращений
VTvaf17-Act1 - вектор генотерапевтический, не содержащий последовательностей вирусных геномов и маркеров антибиотикорезистентности (vectortherapeuticvirus-antibiotic-free),
gRNA - guidedRNA,
ДНК - дезоксирибонуклеиновая кислота,
кДНК - комплементарная дезоксирибонуклеиновая кислота,
РНК - рибонуклеиновая кислота,
мРНК - матричная рибонуклеиновая кислота,
п.н. - пар нуклеотидов,
ПЦР - полимеразная цепная реакция,
мл - миллилитр, мкл - микролитр,
куб. мм - кубический миллиметр,
л - литр,
мкг - микрограмм,
мг - миллиграмм,
г - грамм,
мкМ - микромоль,
мМ - миллимоль,
мин - минута,
сек - секунда,
об/мин - обороты в минуту,
нм - нанометр,
см - сантиметр,
мВт - милливатт,
о.е. ф-относительная единица флуоресценции,
PBS - фосфатно-солевой буфер/.
Список литературы
1. Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products, http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf.
2. Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products EMA/CAT/80183/2014.
3. Hornstein BD, Roman D,  Engevik MA, Zechiedrich L. Effects of Circular DNA Length on Transfection Efficiency by Electroporation into HeLa Cells.
Engevik MA, Zechiedrich L. Effects of Circular DNA Length on Transfection Efficiency by Electroporation into HeLa Cells.  ed. PLoS ONE. 2016;11(12):e0167537.
ed. PLoS ONE. 2016;11(12):e0167537.
4. Kong, Q. et al. Oral immunization with hepatitis В surface antigen expressed in transgenic plants. Proceedings of the National Academy of Sciences 98, 11539 - 11544 (2002).
5.  E, Wypijewski K. Electroporated intact BY-2 tobacco culture cells as a model of transient expression study. Acta Biochim Pol. 2001;48(3):657-61.
E, Wypijewski K. Electroporated intact BY-2 tobacco culture cells as a model of transient expression study. Acta Biochim Pol. 2001;48(3):657-61.
6. Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines. 2016;15(3):313-29.
7. Mairhofer J, Grabherr R. Rational vector design for efficient non-viral gene delivery: challenges facing the use of plasmid DNA. Mol Biotechnol. 2008.39(2):97-104.
8. Paolis A, Frugis G, Giannino D, Iannelli MA, Mele G, Rugini E, Silvestri C, Sparvoli F, Testone G, Mauro ML, Nicolodi C, Caretto S. Plant Cellular and Molecular Biotechnology: Following Mariotti's Steps. Plants (Basel). 2019 Jan 10;8(1).
9. Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies.
10. Молекулярная биология, 2011, том 45, №1, с. 44-55.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Селл энд Джин Терапи Лтд (CELL and GENE THERAPY Ltd), Общество с ограниченной ответственностью «Прорывные Инновационные Технологии»,
<120> Генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген Cas9 для гетерологичной экспрессии этого целевого гена в клетках растений при геномном редактировании растений, способ получения и применения генотерапевтического ДНК-вектора, штамм Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора.
<160> 1
<170> BiSSAP 1.3.6
<210> 1
<211> 7369
<212> DNA
<213> Homo Sapiens
<400> 1
ctcgaggtca ttcatatgct tgagaagaga gtcgggatag tccaaaataa aacaaaggta 60
agattacctg gtcaaaagtg aaaacatcag ttaaaaggtg gtataagtaa aatatcggta 120
ataaaaggtg gcccaaagtg aaatttactc ttttctacta ttataaaaat tgaggatgtt 180
ttgtcggtac tttgatacgt catttttgta tgaattggtt tttaagttta ttcgcgattt 240
ggaaatgcat atctgtattt gagtcggttt ttaagttcgt tgcttttgta aatacagagg 300
gatttgtata agaaatatct ttaaaaaacc catatgctaa tttgacataa tttttgagaa 360
aaatatatat tcaggcgaat tccacaatga acaataataa gattaaaata gcttgccccc 420
gttgcagcga tgggtatttt ttctagtaaa ataaaagata aacttagact caaaacattt 480
acaaaaacaa cccctaaagt cctaaagccc aaagtgctat gcacgatcca tagcaagccc 540
agcccaaccc aacccaaccc aacccacccc agtgcagcca actggcaaat agtctccacc 600
cccggcacta tcaccgtgag ttgtccgcac caccgcacgt ctcgcagcca aaaaaaaaaa 660
aagaaagaaa aaaaagaaaa agaaaaacag caggtgggtc cgggtcgtgg gggccggaaa 720
agcgaggagg atcgcgagca gcgacgaggc ccggccctcc ctccgcttcc aaagaaacgc 780
cccccatcgc cactatatac ataccccccc ctctcctccc atccccccaa ccctaccacc 840
accaccacca ccacctcctc ccccctcgct gccggacgac gagctcctcc cccctccccc 900
tccgccgccg ccggtaacca ccccgcccct ctcctctttc tttctccgtt ttttttttcg 960
tctcggtctc gatctttggc cttggtagtt tgggtgggcg agagcggctt cgtcgcccag 1020
atcggtgcgc gggaggggcg ggatctcgcg gctggcgtct ccgggcgtga gtcggcccgg 1080
atcctcgcgg ggaatggggc tctcggatgt agatcttctt tctttcttct ttttgtggta 1140
gaatttgaat ccctcagcat tgttcatcgg tagtttttct tttcatgatt tgtgacaaat 1200
gcagcctcgt gcggagcttt tttgtaagct tgtagaagat ggccccaaag aagaagcgga 1260
aggtcggtat ccacggagtc ccagcagccg acaagaagta cagcatcggc ctggacatcg 1320
gcaccaactc tgtgggctgg gccgtgatca ccgacgagta caaggtgccc agcaagaaat 1380
tcaaggtgct gggcaacacc gaccggcaca gcatcaagaa gaacctgatc ggagccctgc 1440
tgttcgacag cggcgaaaca gccgaggcca cccggctgaa gagaaccgcc agaagaagat 1500
acaccagacg gaagaaccgg atctgctatc tgcaagagat cttcagcaac gagatggcca 1560
aggtggacga cagcttcttc cacagactgg aagagtcctt cctggtggaa gaggataaga 1620
agcacgagcg gcaccccatc ttcggcaaca tcgtggacga ggtggcctac cacgagaagt 1680
accccaccat ctaccacctg agaaagaaac tggtggacag caccgacaag gccgacctgc 1740
ggctgatcta tctggccctg gcccacatga tcaagttccg gggccacttc ctgatcgagg 1800
gcgacctgaa ccccgacaac agcgacgtgg acaagctgtt catccagctg gtgcagacct 1860
acaaccagct gttcgaggaa aaccccatca acgccagcgg cgtggacgcc aaggccatcc 1920
tgtctgccag actgagcaag agcagacggc tggaaaatct gatcgcccag ctgcccggcg 1980
agaagaagaa tggcctgttc ggaaacctga ttgccctgag cctgggcctg acccccaact 2040
tcaagagcaa cttcgacctg gccgaggatg ccaaactgca gctgagcaag gacacctacg 2100
acgacgacct ggacaacctg ctggcccaga tcggcgacca gtacgccgac ctgtttctgg 2160
ccgccaagaa cctgtccgac gccatcctgc tgagcgacat cctgagagtg aacaccgaga 2220
tcaccaaggc ccccctgagc gcctctatga tcaagagata cgacgagcac caccaggacc 2280
tgaccctgct gaaagctctc gtgcggcagc agctgcctga gaagtacaaa gagattttct 2340
tcgaccagag caagaacggc tacgccggct acattgacgg cggagccagc caggaagagt 2400
tctacaagtt catcaagccc atcctggaaa agatggacgg caccgaggaa ctgctcgtga 2460
agctgaacag agaggacctg ctgcggaagc agcggacctt cgacaacggc agcatccccc 2520
accagatcca cctgggagag ctgcacgcca ttctgcggcg gcaggaagat ttttacccat 2580
tcctgaagga caaccgggaa aagatcgaga agatcctgac cttccgcatc ccctactacg 2640
tgggccctct ggccagggga aacagcagat tcgcctggat gaccagaaag agcgaggaaa 2700
ccatcacccc ctggaacttc gaggaagtgg tggacaaggg cgcttccgcc cagagcttca 2760
tcgagcggat gaccaacttc gataagaacc tgcccaacga gaaggtgctg cccaagcaca 2820
gcctgctgta cgagtacttc accgtgtata acgagctgac caaagtgaaa tacgtgaccg 2880
agggaatgag aaagcccgcc ttcctgagcg gcgagcagaa aaaggccatc gtggacctgc 2940
tgttcaagac caaccggaaa gtgaccgtga agcagctgaa agaggactac ttcaagaaaa 3000
tcgagtgctt cgactccgtg gaaatctccg gcgtggaaga tcggttcaac gcctccctgg 3060
gcacatacca cgatctgctg aaaattatca aggacaagga cttcctggac aatgaggaaa 3120
acgaggacat tctggaagat atcgtgctga ccctgacact gtttgaggac agagagatga 3180
tcgaggaacg gctgaaaacc tatgcccacc tgttcgacga caaagtgatg aagcagctga 3240
agcggcggag atacaccggc tggggcaggc tgagccggaa gctgatcaac ggcatccggg 3300
acaagcagtc cggcaagaca atcctggatt tcctgaagtc cgacggcttc gccaacagaa 3360
acttcatgca gctgatccac gacgacagcc tgacctttaa agaggacatc cagaaagccc 3420
aggtgtccgg ccagggcgat agcctgcacg agcacattgc caatctggcc ggcagccccg 3480
ccattaagaa gggcatcctg cagacagtga aggtggtgga cgagctcgtg aaagtgatgg 3540
gccggcacaa gcccgagaac atcgtgatcg aaatggccag agagaaccag accacccaga 3600
agggacagaa gaacagccgc gagagaatga agcggatcga agagggcatc aaagagctgg 3660
gcagccagat cctgaaagaa caccccgtgg aaaacaccca gctgcagaac gagaagctgt 3720
acctgtacta cctgcagaat gggcgggata tgtacgtgga ccaggaactg gacatcaacc 3780
ggctgtccga ctacgatgtg gaccatatcg tgcctcagag ctttctgaag gacgactcca 3840
tcgacaacaa ggtgctgacc agaagcgaca agaaccgggg caagagcgac aacgtgccct 3900
ccgaagaggt cgtgaagaag atgaagaact actggcggca gctgctgaac gccaagctga 3960
ttacccagag aaagttcgac aatctgacca aggccgagag aggcggcctg agcgaactgg 4020
ataaggccgg cttcatcaag agacagctgg tggaaacccg gcagatcaca aagcacgtgg 4080
cacagatcct ggactcccgg atgaacacta agtacgacga gaatgacaag ctgatccggg 4140
aagtgaaagt gatcaccctg aagtccaagc tggtgtccga tttccggaag gatttccagt 4200
tttacaaagt gcgcgagatc aacaactacc accacgccca cgacgcctac ctgaacgccg 4260
tcgtgggaac cgccctgatc aaaaagtacc ctaagctgga aagcgagttc gtgtacggcg 4320
actacaaggt gtacgacgtg cggaagatga tcgccaagag cgagcaggaa atcggcaagg 4380
ctaccgccaa gtacttcttc tacagcaaca tcatgaactt tttcaagacc gagattaccc 4440
tggccaacgg cgagatccgg aagcggcctc tgatcgagac aaacggcgaa accggggaga 4500
tcgtgtggga taagggccgg gattttgcca ccgtgcggaa agtgctgagc atgccccaag 4560
tgaatatcgt gaaaaagacc gaggtgcaga caggcggctt cagcaaagag tctatcctgc 4620
ccaagaggaa cagcgataag ctgatcgcca gaaagaagga ctgggaccct aagaagtacg 4680
gcggcttcga cagccccacc gtggcctatt ctgtgctggt ggtggccaaa gtggaaaagg 4740
gcaagtccaa gaaactgaag agtgtgaaag agctgctggg gatcaccatc atggaaagaa 4800
gcagcttcga gaagaatccc atcgactttc tggaagccaa gggctacaaa gaagtgaaaa 4860
aggacctgat catcaagctg cctaagtact ccctgttcga gctggaaaac ggccggaaga 4920
gaatgctggc ctctgccggc gaactgcaga agggaaacga actggccctg ccctccaaat 4980
atgtgaactt cctgtacctg gccagccact atgagaagct gaagggctcc cccgaggata 5040
atgagcagaa acagctgttt gtggaacagc acaagcacta cctggacgag atcatcgagc 5100
agatcagcga gttctccaag agagtgatcc tggccgacgc taatctggac aaagtgctgt 5160
ccgcctacaa caagcaccgg gataagccca tcagagagca ggccgagaat atcatccacc 5220
tgtttaccct gaccaatctg ggagcccctg ccgccttcaa gtactttgac accaccatcg 5280
accggaagag gtacaccagc accaaagagg tgctggacgc caccctgatc caccagagca 5340
tcaccggcct gtacgagaca cggatcgacc tgtctcagct gggaggcgac aaaaggccgg 5400
cggccacgaa aaaggccggc caggcaaaaa agaaaaagta agtcgaccct gtgacccctc 5460
cccagtgcct ctcctggccc tggaagttgc cactccagtg cccaccagcc ttgtcctaat 5520
aaaattaagt tgcatcattt tgtctgacta ggtgtccttc tataatatta tggggtggag 5580
gggggtggta tggagcaagg ggcaagttgg gaagacaacc tgtagggcct gcggggtcta 5640
ttgggaacca agctggagtg cagtggcaca atcttggctc actgcaatct ccgcctcctg 5700
ggttcaagcg attctcctgc ctcagcctcc cgagttgttg ggattccagg catgcatgac 5760
caggctcagc taatttttgt ttttttggta gagacggggt ttcaccatat tggccaggct 5820
ggtctccaac tcctaatctc aggtgatcta cccaccttgg cctcccaaat tgctgggatt 5880
acaggcgtga accactgctc ccttccctgt ccttacgcgt agaattggta aagagagtcg 5940
tgtaaaatat cgagttcgca catcttgttg tctgattatt gatttttggc gaaaccattt 6000
gatcatatga caagatgtgt atctacctta acttaatgat tttgataaaa atcattaact 6060
agtccatggc tgcctcgcgc gtttcggtga tgacggtgaa aacctctgac acatgcagct 6120
cccggagacg gtcacagctt gtctgtaagc ggatgccggg agcagacaag cccgtcaggg 6180
cgcgtcagcg ggtgttggcg ggtgtcgggg cgcagccatg acccagtcac gtagcgatag 6240
cggagtgtat actggcttaa ctatgcggca tcagagcaga ttgtactgag agtgcaccat 6300
atgcggtgtg aaataccgca cagatgcgta aggagaaaat accgcatcag gcgctcttcc 6360
gcttcctcgc tcactgactc gctgcgctcg gtcgttcggc tgcggcgagc ggtatcagct 6420
cactcaaagg cggtaatacg gttatccaca gaatcagggg ataacgcagg aaagaacatg 6480
tgagcaaaag gccagcaaaa ggccaggaac cgtaaaaagg ccgcgttgct ggcgtttttc 6540
cataggctcc gcccccctga cgagcatcac aaaaatcgac gctcaagtca gaggtggcga 6600
aacccgacag gactataaag ataccaggcg tttccccctg gaagctccct cgtgcgctct 6660
cctgttccga ccctgccgct taccggatac ctgtccgcct ttctcccttc gggaagcgtg 6720
gcgctttctc atagctcacg ctgtaggtat ctcagttcgg tgtaggtcgt tcgctccaag 6780
ctgggctgtg tgcacgaacc ccccgttcag cccgaccgct gcgccttatc cggtaactat 6840
cgtcttgagt ccaacccggt aagacacgac ttatcgccac tggcagcagc cactggtaac 6900
aggattagca gagcgaggta tgtaggcggt gctacagagt tcttgaagtg gtggcctaac 6960
tacggctaca ctagaagaac agtatttggt atctgcgctc tgctgaagcc agttaccttc 7020
ggaaaaagag ttggtagctc ttgatccggc aaacaaacca ccgctggtag cggtggtttt 7080
tttgtttgca agcagcagat tacgcgcaga aaaaaaggat ctcaagaaga tcctttgatc 7140
ttttctacgg ggtctgacgc tcagtggaac gaaaactcac gttaagggat tttggtcatg 7200
agattatcaa aaaggatctt cacctagatc cttttaaatt aaaaatgaag ttttaaatca 7260
atctaaagta tatatgagta aacttggtct gacagttacc aatgcttaat cagtgaggca 7320
cctatctcag cgatctgtct atttcgttca tccatagttg cctgactcc 7369
<---
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ОЛИГОНУКЛЕОТИДОВ
Cas9_F TGTAAGCTTGTAGAAGATGGCCCCAAAGAAGAAG
Cas9_R ATAGTCGACTTACTTTTTCTTTTTTGCCTGG
hCas9_SF CATCGAGCAGATCAGCGAGT
hCas9_SR CGATCCGTGTCTCGTACAGG
ZB7-F CACTTCATGGCCTTCAATAC
ZB7-R GCTGATCCTGTTTCCTGGTC
VTvaf-Xho GACCTCGAGGGAGTCAGGCAACTATGGATG
VTvaf-Sal ATAGTCGACCCTGTGACCCCTCCCCAG
PAct-F TATCTCGAGGTCATTCATATGCTTGAGAAGAG
PAct-R AGGGTCGACTATAAGCTTACAAAAAAGCTCCGCACGAGGCT
gRNAs:
a) GGCCAAAGTTGACTTGGAGA NGG
b) GATGGTTGTACGAGGGGGCA NGG
c) GATGTCGGTTTTATCTTAGG NGG
d) GCTGAACCGCTGGATCAACC NGG
e) GACCAAATCATTGTAGTAAT NGG
f) GCTAATGGGAAACTTTGCGC NGG
g) GTGATCTCGCAACAGATGGA NGG
h) GAGGTGTCCATTGGAGGCGG NGG
i) GTGTCCGGTCCATCATGGTC NGG
j) GCCGGTTTGGTTTATTTTAA NGG



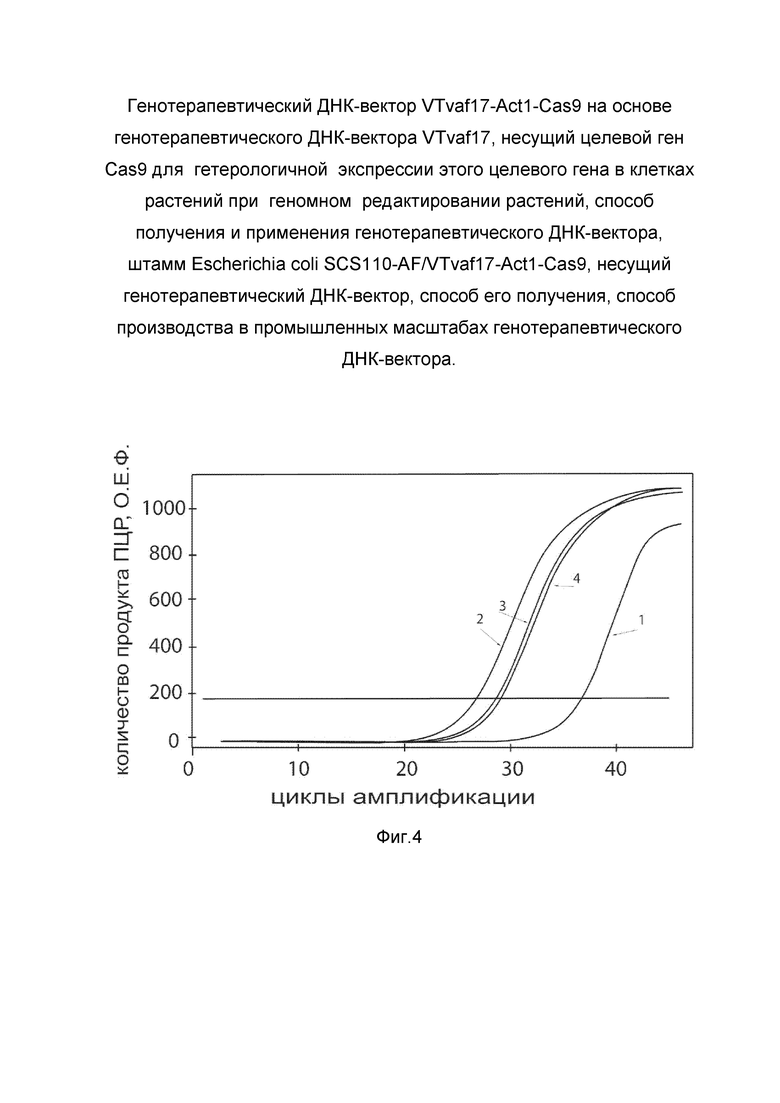
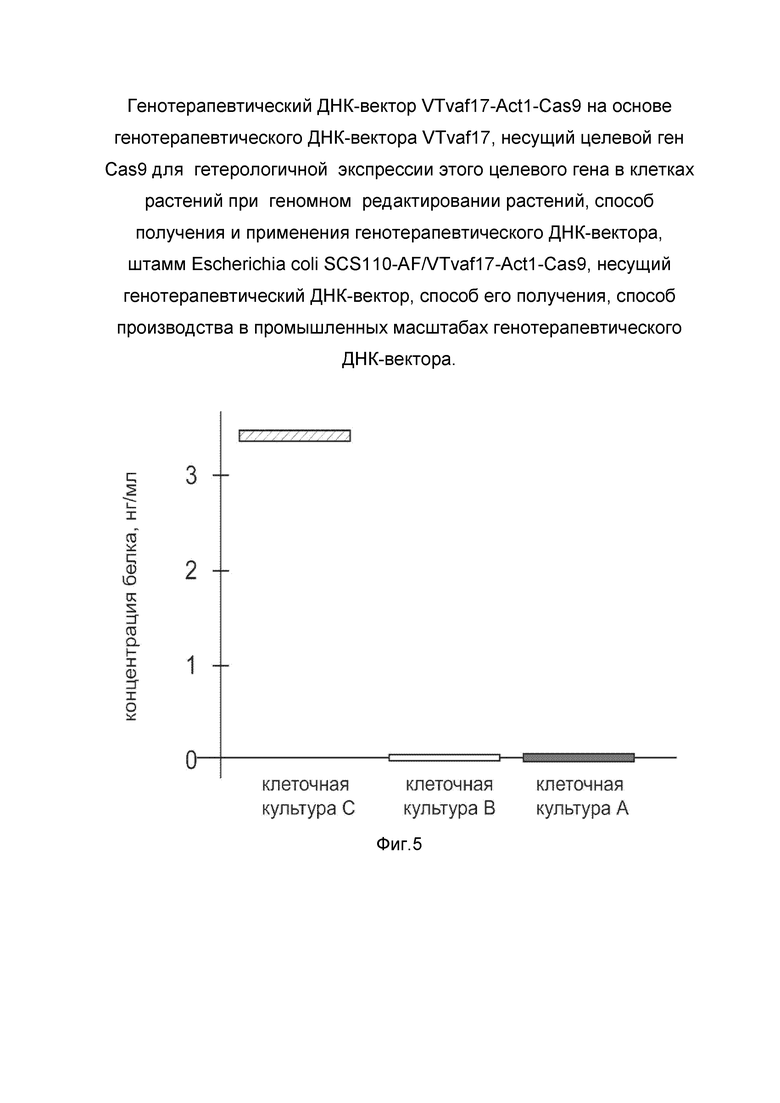

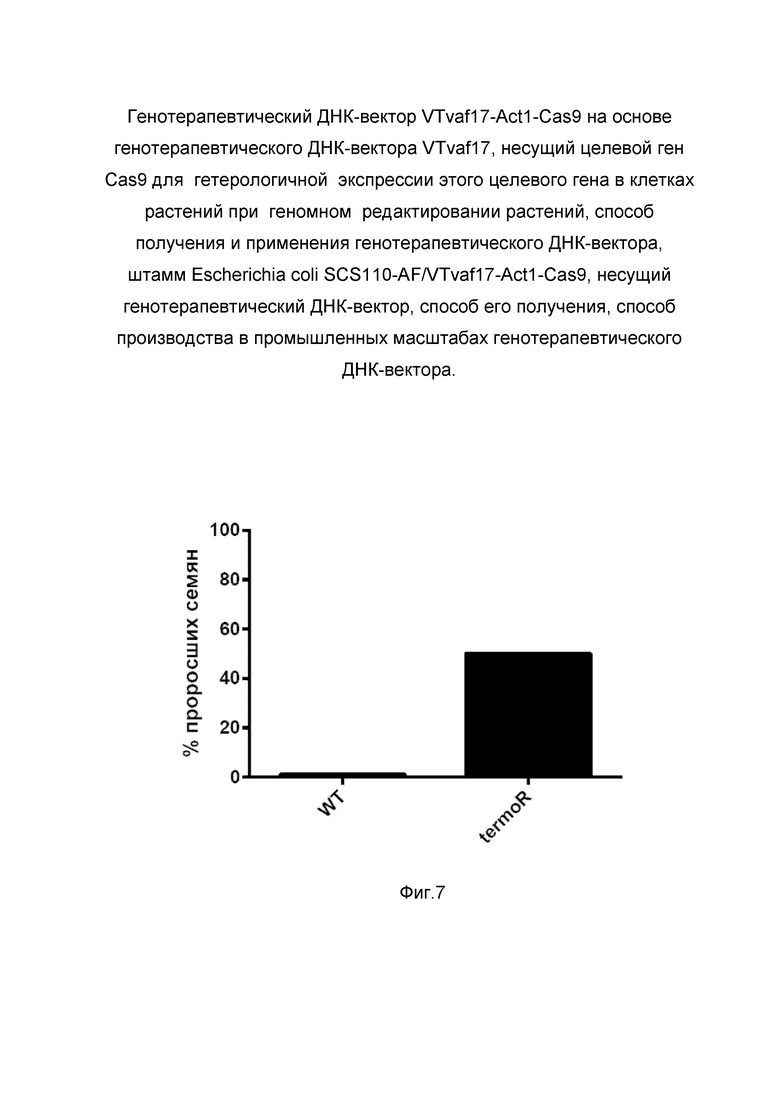
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания сортов растений, в том числе трансгенных. Изобретение представляет собой генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген Cas9, для гетерологичной экспрессии этого целевого гена в клетках растений при геномном редактировании растений, при этом генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 имеет нуклеотидную последовательность SEQID №1. Изобретение можно использовать при геномном редактировании гена в клетках растений. 7 н. и 1 з.п. ф-лы, 7 ил., 9 пр.
1. Генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген Cas9, для гетерологичной экспрессии этого целевого гена в клетках растений при геномном редактировании растений, при этом генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 имеет нуклеотидную последовательность SEQ ID №1.
2. Генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 по п.1, отличающийся тем, что он имеет ограниченный размер векторной части VTvaf17-Act1, не превышающей 3200 п.н., что обеспечивает ему способность эффективно проникать в клетки растений и экспрессировать клонированный в него целевой ген Cas9.
3. Способ получения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 по п.1, заключающийся в следующем: получают ДНК-вектор VTvaf17-Act1 путем замены в векторе VTvaf17 промоторного региона гена EF1a человека на промоторный регион гена актина первого типа (act1) риса, затем кодирующую часть целевого гена Cas9 клонируют в ДНК-вектор VTvaf17-Act1 и получают генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9.
4. Применение генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 по п.1 для безопасного геномного редактирования растений за счет отсутствия в составе генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 нуклеотидных последовательностей вирусного происхождения и отсутствия генов антибиотикорезистентности.
5. Способ применения генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 по п.1, 4 для гетерологичной экспрессии этого целевого гена в клетках растений при геномном редактировании растений, заключающийся во введении генотерапевтического ДНК-вектора по п.1 в клетки, органы и ткани растений совместно с молекулами gRNA или генетическими конструкциями, обеспечивающими экспрессию gRNA или в сочетании обозначенных способов.
6. Штамм Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9, несущий генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 по п.1 для его наработки с возможностью культивирования штамма без использования антибиотиков.
7. Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 по п. 6., заключающийся в электропорации компетентных клеток штамма Escherichia coli SCS110-AF генотерапевтическим ДНК-вектором VTvaf17-Act1-Cas9 по п.1 и последующей селекцией стабильных клонов штамма с использованием селективной среды.
8. Способ производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-Act1-Cas9 по п.1, заключающийся в масштабировании бактериальной культуры штамма Escherichia coli SCS110-AF/VTvaf17-Act1-Cas9 по п.7 до количеств, необходимых для наращивания бактериальной биомассы в промышленном ферментере, после чего биомассу используют для выделения фракции, содержащей целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-Act1-Cas9 по п.1, многостадийно фильтруют и очищают хроматографическими методами.
| US 9550998 B2, 24.01.2017 | |||
| US 9644211 B2, 09.05.2017 | |||
| CN 103981216 A, 13.08.2014 | |||
| ПЛАЗМИДА БЕЗ УСТОЙЧИВОСТИ К АНТИБИОТИКУ | 2010 |
|
RU2548809C2 |
Авторы
Даты
2020-02-26—Публикация
2019-01-25—Подача