Область техники
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии.
Уровень техники
Генная терапия - это современный медицинский подход, направленный на лечение наследственных и приобретенных заболеваний путем введения нового генетического материала в клетки пациента с целью компенсации или подавления функции мутантного гена и/или исправления генетического дефекта. Конечным продуктом экспрессии гена может являться молекула РНК или белка. Однако осуществление большей части физиологических процессов в организме связано с функциональной активностью белковых молекул, тогда как молекулы РНК являются либо промежуточным продуктом в синтезе белков, либо осуществляют регуляторные функции. Таким образом целью генной терапии является, в большинстве случаев, введение в организм генов, обеспечивающих транскрипцию и последующую трансляцию белковых молекул, кодируемых этими генами. В рамках описания настоящего изобретения под экспрессией гена подразумевается продукция белковой молекулы, аминокислотная последовательность которой кодируется этим геном.
Гены ВМР-2, ВМР-7, PDGFA, PDGFB, OPG, входящие в группу генов, играют ключевую роль в ряде процессов в организме человека и животных. Показана связь низких/недостаточных концентраций этих белков с различными неблагоприятными состояниями человека, которая, в ряде случаев, подтверждена нарушениями в нормальной экспрессии генов, кодирующих эти белки. Таким образом, генотерапевтическое повышение экспрессии гена, выбранного из группы генов ВМР-2, ВМР-7, PDGFA, PDGFB, OPG, обладает потенциалом для коррекции различных состояний человека и животных.
Ген OPG (другое название - TNFRSF11B) кодирует белок остеопротегерин (OPG), являющийся ингибитором остеокластогенеза за счет конкурентного связывания RANKL. Взаимодействие рецептора RANK с лигандом RANKL инициирует сигнальный каскад, который приводит к дифференциации и созреванию клеток-предшественников остеокластов в активные остеокласты, способные резорбировать костную ткань. Многие из кальциотропных гормонов и цитокинов, включая витамин D3, паратиреоидный гормон, простагландин Е2 и интерлейкин-11, стимулируют остеокластогенез посредством двойного действия ингибирования продукции OPG и стимулирования продукции RANKL. С другой стороны, эстроген ингибирует продукцию RANKL и RANKL-опопсредованного остеокластогенеза. Современное понимание парадигмы RANK/RANKL/OPG как для дифференциации, так и для активации остеокластов открыло новые возможности для развития возможных видов лечения заболеваний, характеризующихся чрезмерной резорбцией кости. Помимо остеокластогенеза, OPG может способствовать выживанию, пролиферации миграции клеток путем взаимодействия с TRAIL, гликозаминогликанами или протеогликанами. Большое количество исследований in vitro, доклинических и клинических исследований свидетельствуют об участии OPG в заболеваниях сердечнососудистой, костной, иммунной систем, а также онкологических заболеваниях.
Локальное введение рекомбинантного белка OPG, содержащего Fc фрагмент, в место экспериментального механического расшатывания зуба у крыс способствовало восстановлению нормального состояния, и данная стратегия может быть использована в ортодонтологии (Schneider DA et al. // Orthod Craniofac Res. 2015 Apr; 18 Suppl 1:187-95). Эти данные были подтверждены другими группами исследователей ( FJ et al. // Eur J Orthod. 2016 Aug; 38(4):379-85; Hudson JB et al. // Calcif Tissue Int. 2012 Apr; 90(4):330-42). Аналогичные результаты были получены с использованием генотерапевтического подхода (Zhao N et al. // Am J Orthod Dentofacial Orthop. 2012 Jan; 141(1):30-40).
FJ et al. // Eur J Orthod. 2016 Aug; 38(4):379-85; Hudson JB et al. // Calcif Tissue Int. 2012 Apr; 90(4):330-42). Аналогичные результаты были получены с использованием генотерапевтического подхода (Zhao N et al. // Am J Orthod Dentofacial Orthop. 2012 Jan; 141(1):30-40).
Было показано, что повышение экспрессии гена OPG за счет плазмидного вектора, несущего данный ген, подавлял остеокластогенез in vivo и ингибировал снижение высоты альвеолярной кости, вызванное экспериментальным периодонтитом у крыс. Таким образом генотерапевтический подход к повышению экспрессии гена OPG может быть использован в разработке средств для предотвращения прогрессирующей потери пародонтальной кости (Tang Н et al. // J Periodontal Res. 2015 Aug; 50(4):434-43.).
В экспериментальной модели провоспалительного ювенильного остеопороза на мышах было показано, что использование рекомбинантного белка OPG, содержащего Fc фрагмент, способствовало восстановлению нормального баланса остеобластов/остеокластов и предотвращало нарушения роста скелета (Del Fattore A et al. // Osteoporos Int. 2014 Feb; 25(2):681-92).
На модели коллаген-индуцированного артрита использование рекомбинантного аденоассоциированного вирусного вектора, экспрессирующего ген OPG, обладало протективным действием в отношении суставов у крыс (Bao L et al. // Joint Bone Spine. 2012 Oct; 79(5):482-7).
Превентивное локальное введение клеток, трансдуцированных рекомбинантным аденовирусным вектором, экспрессирующим ген OPG, приводило к повышению степени остеоинтеграции и стабильности титановых имплантов у крыс (Yin G et al. // Gene Ther. 2015 Aug; 22(8):636-44). Аналогичные результаты были получены с использованием мышиной модели артропластики коленного сустава в условиях осложнений, вызванных наличием титановых микрочастиц (Zhang L et al. // Gene Ther. 2010 Oct; 17(10):1262-9).
Клинические исследования I фазы рекомбинантного белка OPG (AMGN-0007, Amgen Corp.) у пациентов с дегенеративными изменениями костей, индуцированных радиотерапией, подтвердили его потенциал как терапевтического средства для терапии резорбции костей (Body JJ et al. // Cancer. 2003 Feb 1; 97(3 Suppl): 887-92).
При изучении потенциала OPG в отношении онкологических заболеваний, было показано, что введение лабораторным животным модифицированного рекомбинантного аденовирусного вектора, экспрессирующего ген OPG, содержащий Fc фрагмент, подавляло метастазирование клеток рака простаты в костную ткань и замедляло опухолевую прогрессию (Cody JJ et al. // Lab Invest. 2013 Mar; 93(3):268-78).
В отношении сердечно-сосудистых заболеваний введение клеток, экспрессирующих ген OPG, уменьшало размер атеросклеротических бляшек и снижало кальцификацию сосудов у мышей с дефицитом экспрессии гена OPG (Callegari A et al. // Arterioscler Thromb Vasc Biol. 2013 Nov; 33(11):2491-500).
Гены ВМР-2 и ВМР-7 кодируют костные морфогенетические белки 2 и 7 соответственно. Белки BMPs - цитокины, относящиеся к семейству TGF, которые обнаруживаются преимущественно в костной ткани. Название BMP описывает только одну специфическую функцию, но на самом деле данные белки оказывают на организм ряд других эффектов, а именно: формирование хряща, развитие внутренних органов - морфогенез, пролиферация, апоптоз и дифференцировка клеток. Кроме этого, BMP блокируют миогенез и адипогенез. Некоторые BMPs, включая ВМР-7, ВМР-4 и ВМР-7, играют роль в специализации гемопоэтической ткани из мезодермы зародыша. Они регулируют пролиферацию и дифференцировку человеческих гемопоэтических клеток как у взрослых, так и у новорожденных. К настоящему времени идентифицировано 20 видов BMP. Наиболее полно изученными применительно к регенерации кости и хряща являются ВМР-2 и ВМР-7. Известно, что они способны индуцировать рост кости, а именно, воздействовать на пролиферацию и дифференцировку четырех типов клеток - остеобластов, остеокластов, хондробластов и хондроцитов. In vitro ВМР-3, -4 и -7 способствуют росту остеобластов и производных костных клеток. Место локализации BMP - внеклеточный соединительнотканный матрикс, содержащий остеопрогениторные и мезенхимные клетки. Показано, что BMP распределены по коллагеновым волокнам костной ткани, в клетках остеогенного слоя надкостницы; в умеренных количествах они имеются в клетках пластинчатой кости и в избытке присутствует в тканях зуба. BMP синтезируются остеобластами, хондроцитами и их предшественниками. Отмечена повышенная активность BMP в ростовых зонах большеберцовой кости (эпифиз, метафиз, хрящ). Кроме скелета, BMP экспрессируются во внескелетных тканях организма. Высокое содержание BMP отмечено в простате и плаценте (Paralkar V et al. // J. Biol. Chem. - 1998. - Vol. 273, N 22. - P. 13760-13767).
Многие исследователи отмечают крайне нестабильные или низкие показатели остеоиндуктивности аллогенных костных имплантатов, произведенных в разных тканевых банках. Биологическая оптимизация или активизация остеоиндуктивности аллогенных или ксеногенных костных имплантатов может быть достигнута процессом деминерализации с добавлением остеоиндуктивных белков либо других ростовых факторов. ВМР-2 совместно с деминерализованным костным матриксом в экспериментах на крысах демонстрировал повышенное образование остеоида по сравнению с таковым при применении аутологичной кости (Schwartz Z et al. // J. Periodontol. - 1998. - Vol. 69, N 12. - P. 1337-1345). Добавляя BMP-7 к аллогенному костному имплантату, в экспериментах на собаках получали более высокий процент костных сращений, чем при использовании аутологичной кости (Lewandrowski K. // Spine J. - 2007. - Vol. 7J5. - P. 609-614). Было проведено сравнение по степени влияния на остеогенную дифференцировку мезенхимных стволовых клеток и активность щелочной фосфатазы таких материалов как: деминерализованный костный матрикс (ДКМ), деминерализованный костный матрикс с добавлением ВМР-7 (ДКМ + ВМР-7), костный коллаген + ВМР-7, костный коллаген, замороженный костный имплантат, замороженный костный имплантат с ВМР-7. Выявлено, что ДКМ + ВМР-7 в большей степени стимулировал остеогенную дифференцировку мезенхимных стволовых клеток и активизацию щелочной фосфатазы (Tsiridis Е. et al. // J. Orthop. Res. - 2007. - Vol. 25, N 11. - P. 1425-1437).
Эффективность применения ВМР-7 для достижения костного сращения при вертебральной патологии оказалась сопоставимой или незначительно превосходила эффективность аутологичного костного материала (Johnsson R et al. // Spin. - 2002. - Vol. 27. - P. 2654-2661). В исследовании, включавшем 9 пациентов в возрасте от 21 года до 24 лет с факторами риска костных несращений (недостаточность надпочечников, гипертония, длительное курение, ожирение, гипертиреоз, ревматоидный артрит), выявлено, что ВМР-7 безопасен и эффективен для достижения спондилодеза (Govender S et al. // J. Bone Jt Surg. - 2002. - Vol. 84A. - P. 2123-2134). Vaccaro и соавт. обследовали 36 пациентов, подвергшихся хирургическому лечению по поводу дегенеративного поясничного спондилолиза со стенозом позвоночного канала. У одной части больных применялась паста «Ossigraft» с rhBMP-7 совместно с аутотрансплантатом из гребня подвздошной кости (основная группа), у другой части пациентов - только аутотрансплантат из гребня подвздошной кости (контрольная группа). Через 1 год наблюдения костное сращение констатировано в основной группе в 86%, в контрольной - в 73% случаев, через 4 года - соответственно в 69 и 50% (Vaccaro A.R. et al. // Eur. Spine J. - 2005. - Vol. 14. - P. 623-629). Govender и соавт. сообщают о клиническом применении rhBMP-7 на коллагеновой носителе в дозе 0,75 мг/мл (суммарная доза 6 мг) и 1,50 мг/мл (суммарная доза 12 мг). В исследование были включены 450 пациентов из 11 стран с открытыми переломами большеберцовой кости. Всем пострадавшим производился интрамедуллярный остеосинтез титановым стержнем. Сращение перелома без повторных вмешательств было достигнуто у 74% пациентов. Данные этого исследования способствовали одобрению Европейским агентством по оценке лекарственных продуктов (ЕМЕА) в 2002 г. и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 2004 г. применения rhBMP-7/ACS при лечении открытых переломов большеберцовой кости методом интрамедуллярного остеосинтеза (Govender S et al. // J. Bone Jt Surg. - 2002. - Vol. 84A. - P. 2123-2134).
При использовании rhBMP-7 на коллагеновой губке отмечена идентичная или большая частота достижения костного сращения тел позвонков по сравнению с таковой при применении аутологичного трансплантата из гребня подвздошной кости. Более того при использовании rhBMP-7 сообщается о получении костного сращения у 100% пациентов (Schwender J.D. et al. // J. Spin. Disord. Tech. - 2005. - Vol. 18. - P. S1-S6). При этом отсутствовали осложнения, характерные для хирургического забора аутологичной кости.
Применение rhBMP-7 в виде коллагеновой пасты при лечении больных с открытыми переломами большеберцовой кости способствовало достижению сращения переломов в большем проценте случаев, сокращало частоту повторных хирургических вмешательств (Fricdlaender G. et al. // J. Bone Jt Surg. - 2001. - Vol. 83A. - P. S151-S158). При применении в сочетании с аутологичной костью или аллогенным деминерализованным костным матриксом было показано сокращение сроков заживления переломов по сравнению с таковыми при использовании только аутологичной кости (Bilic R et al. // Int. Orthop. - 2006. - Vol. 30. - P. 128-134).
Успехи в использовании рекомбинантных белков BMPs послужили поводом для ряда работ с использованием генотерапевтических подходов. Так, в различных исследованиях для регенерации костных дефектов успешно были использованы вирусные, плазмидные и клеточные векторы для экспрессии генов BMPs (Schwabe Р et al. // ScientificWorldJournal. 2012; 2012:560142; Wegman F et al. // Eur Cell Mater. 2011 Mar 15; 21:230-42; discussion 242; Wang CJ et al. // Arthroscopy. 2010 Jul; 26(7):968-76; Heggeness MH. // Spine J. 2015 Nov 1; 15(11):2410-1; Wu G et al. // J Craniofac Surg. 2015 Mar; 26(2):378-81; Loozen LD et al. // Tissue Eng Part A. 2015 May; 21(9-10):1672-9). В одной из работ было показано, что генотерапевтический подход с использованием комбинации генов ВМР-2 и ВМР-7 оказывал более выраженный терапевтический эффект, чем использование каждого из этих генов по отдельности (Koh JT et al. // J Dent Res. 2008 Sep; 87(9):845-9).
Помимо применения белков BMPs для регенерации повреждений костной и хрящевой ткани было показано, что повышение экспрессии гена ВМР-7 способствует заживлению ран и предотвращению образования фиброза тканей (Tandon A et al. // PLoS One. 2013 Jun 14; 8(6):e66434; 19; Zhong et al. // Int J Med Sci. 2013; 10(4):441-50.). Также аденовирусный вектор, экспрессирующий ген ВМР-7, оказывает модулирующее действие на эпителиальные клетки в процессе регенерации повреждений глаз (Saika S et al. // Am J Physiol Cell Physiol. 2006 Jan; 290(1):C282-9). Более того, было показано, что аденовирусный вектор, экспрессирующий ВМР-7, способен оказывать благоприятное действие на течение экспериментального язвенного колита у крыс (Нао Z et al. // J Gene Med. 2012 Jul; 14(7):482-90).
Гены PDGFA и PDGFB кодируют факторы роста тромбоцитов (Platelet - derivated growth factors - PDGF) А и В (PDGFA и PDGFB), которые секретируется тромбоцитами на ранней стадии заживления костной ткани. Они обладают митогенной активностью для остеобластов и клеток-предшественников. Кроме того, установлено, что PDGFA и PDGFB принимают участие в ангиогенезе. В последние годы факторы роста тромбоцитов нашли свое применение в стоматологии для оптимизации регенерации костных дефектов. Рандомизированное плацебо-контролируемое исследование на 180 пациентах показало, что в течение 3 месяцев происходило заполнение дефектов зрелой костной тканью. Также данный подход используется после проведения хирургических вмешательств. Кроме того, доставка факторов роста непосредственно в область использования костных материалов в значительной степени улучшает восстановление мягких тканей (Nevins et al. // J. Periodontol. - 2005. - Vol. 76. - P. 2205-2215).
Для регенерации костных повреждений черепа у крыс был успешно применен генотерапевтический подход с использование плазмидного вектора, экспрессирующего ген PDGFB. В результате этой работы было продемонстрировано, что уже через 4 недели наблюдения наблюдался выраженный положительный эффект в заживлении костей свода черепа (Elangovan S et al. // Biomaterials. 2014 Jan; 35(2):737-47).
В экспериментальной работе ex vivo на сердцах мышей и крыс было показано, что аденовирусный вектор, экспрессирующий ген PDGFB способствовал изменению профиля маркеров, предсказывающих успешность трансплантации (Tuuminen R et al. // Transplantation. 2016 Feb; 100(2):303-13). В работе на кроликах и поросятах, рекомбинантные аденоассоциированный вирусный вектор, экспрессирующий, в том числе, ген PDGFB, способствовал неоваскуляризации и улучшению функциональных параметров миокарда (Kupatt С et al. // J Am Coll Cardiol. 2010 Jul 27; 56(5):414-22).
Также было продемонстрировано, что генотерапевтический подход с использованием конструкции, экспрессирующей ген PDGFB, способствовало заживлению повреждений связок у крыс (Nakamura N et al. // Gene Ther. 1998 Sep; 5(9):1165-70).
В работе по изучению заживления и регенерации ран использование аденовирусного вектора, экспрессирующего ген PDGFB, способствовало достижению значительного терапевтического эффекта (Chandler LA et al. // Mol Ther. 2000 Aug; 2(2):153-60).
Использование клеток фибробластов, экспрессирующих ген PDGFA, оказывало заметный положительный эффект при постоперационном заживлении зоны шейного отдела позвоночника и спинного мозга (Ijichi A et al. // Gene Ther. 1996 May; 3(5):389-95).
Генотерапевтический подход с использованием плазмидных векторов, экспрессирующих гены PDGFA и PDGFB, также оказался эффективен в заживлении кожных ран у кроликов (Tyrone JW et al. // J Surg Res. 2000 Oct; 93(2):230-6).
Приведенные данные свидетельствуют о том, что генотерапевтические подходы с использованием генов PDGFA и PDGFB являются перспективным направление в регенеративной медицине, так как способны стимулировать регенерацию как костной ткани, так и окружающих мягких тканей.
Таким образом предшествующий уровень техники свидетельствует о том, гены ВМР-2, ВМР-7, OPG, PDGFA, PDGFB обладают потенциалом для коррекции ряда отклонений, включающих в себя, но не ограничивающихся, повреждениями и дегенартивными изменениями костной и окружающих мягких тканей (в том числе пародонтоз, пародонтит и остопороз), сердечно-сосудистыми, аутоиммунными заболеваниями, раком, наследственными и приобретенными патологическими состояниями, такими как повреждения соединительной ткани, и другими процессами. Этим обусловлено объединение генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB в рамках данного патента в группу генов. Генетические конструкции, обеспечивающие экспрессию белков, кодируемых генами из группы ВМР-2, ВМР-7, OPG, PDGFA, PDGFB могут быть использованы для разработки лекарственных препаратов для предотвращения и терапии различных заболеваний и патологических состояний.
Более того, приведенные данные свидетельствуют о том, что недостаточная экспрессия белков, кодируемых генами ВМР-2, ВМР-7, OPG, PDGFA, PDGFB, входящими в группу генов, связана не только с патологическими состояниями, но и с предрасположенность к их развитию. Также приведенные данные свидетельствуют о том, что недостаточная экспрессия данных белков может не проявляться в явном виде в форме патологии, которая может быть однозначно описана в рамках существующих стандартов клинической практики (например, с применением кода МКБ), однако при этом вызывать состояния, которые неблагоприятны для человека и животных и связанны с ухудшением качества жизни.
Анализ подходов для повышения экспрессии целевых генов подразумевает возможность использования различных генотерапевтических векторов.
Генотерапевтические векторы разделяют на вирусные, клеточные и ДНК-векторы (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products EMA/CAT/80183/2014). В последнее время в генной терапии все большее внимание уделяется разработке невирусных систем доставки генетического материала, среди которых лидируют плазмидные векторы. Плазмидные векторы лишены недостатков, присущих клеточным и вирусным векторам. В клетке-мишени они существуют в эписомальной форме, не интегрируют в геном, производство их достаточно дешево, отсутствие иммунного ответа и побочных реакций на введение плазмидного вектора делают их удобным инструментом генной терапии и генетической профилактики (ДНК-вакцины) (Li L, Petrovsky N. // Expert Rev Vaccines. 2016; 15(3):313-29).
Тем не менее, ограничениями для использования плазмидных векторов для генной терапии являются: 1) наличие генов устойчивости к антибиотикам для наработки в бактериальных штаммах, 2) наличие различных регуляторных элементов, представленных последовательностями вирусных геномов 3) размер терапевтического плазмидного вектора, определяющий эффективность проникновения вектора в клетку-мишень.
Известно, что Европейское агентство по лекарственным средствам считает необходимым избегать введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies). Данная рекомендация связана, в первую очередь, с потенциальной опасностью проникновения ДНК-вектора или горизонтального переноса генов антибиотикорезистентности в клетки бактерий, представленных в организме в составе нормальной или оппортунистической микрофлоры. Помимо этого, наличие генов антибиотикорезистентности значительно увеличивает размер ДНК-вектора, что приводит к снижению эффективности его проникновения в эукариотические клетки.
Необходимо отметить, что гены антибиотикорезистентности также вносят принципиальный вклад в способ получения ДНК-векторов. В случае наличия генов антибиотикорезистентности штаммы для наработки ДНК-векторов обычно культивируются в среде, содержащей селективный антибиотик, что создает риск наличия следовых количеств антибиотика в недостаточно очищенных препаратах ДНК-векторов. Таким образом, получение ДНК-векторов для генной терапии, в которых отсутствуют гены антибиотикорезистентности, связано с получением штаммов, обладающих такой отличительной особенностью как способность к стабильной амплификации целевых ДНК-векторов в среде без содержания антибиотиков.
Кроме того, Европейское Медицинское Агентство рекомендует избегать наличия в составе терапевтических плазмидных векторов регуляторных элементов для повышения экспрессии целевых генов (промоторов, энхансеров, посттрансляционных регуляторных элементов), являющихся нуклеотидными последовательностями геномов различных вирусов (Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products, http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf). Данные последовательности, хотя и могут увеличивать уровень экспрессии целевого трансгена, однако создают риск рекомбинации с генетическим материалом вирусов дикого типа и интеграции в геном эукариотической клетки. Более того, целесообразность гиперэкспрессии того или иного гена в целях терапии остается нерешенным вопросом.
Также, существенным моментом является размер терапевтического вектора. Известно, что современные плазмидные векторы зачастую перегружены нефункциональными участками, серьезно увеличивающими размер вектора (Mairhofer J, Grabherr R. // Mol Biotechnol. 2008. 39(2):97-104). Например, ген устойчивости к ампициллину в векторах серии pBR322, как правило, состоит из не менее чем 1000 п.н., что составляет более 20% от размера самого вектора. При этом наблюдается обратная зависимость между размером вектора и его способностью проникать в эукариотические клетки - ДНК-векторы с небольшим размером эффективней проникаю в клетки человека и животных. Так, например, в серии экспериментов по трансфекции клеток HELA ДНК-векторами с размером от 383 до 4548 п.н. было показано, что разница в эффективности проникновения может достигать двух порядков (отличаться в 100 раз) (Hornstein BD et al. // PLoS ONE. 2016; 11(12):e0167537).
Таким образом при выборе ДНК-вектора в целях безопасности и наибольшей эффективности следует отдавать предпочтение тем конструкциям, в которых не содержатся гены устойчивости к антибиотикам, последовательности вирусного происхождения и размер которых позволяет эффективно проникать в эукариотические клетки. Штамм для получения такого ДНК-вектора в количествах, достаточных для целей генной терапии, должен обеспечивать возможность стабильной амплификации ДНК-вектора с использованием питательных сред, не содержащих антибиотики.
Примером использования рекомбинантных ДНК-векторов для генной терапии является способ получения рекомбинантного вектора для генетической иммунизации по патенту US 9550998 В2. Плазмидный вектор представляет собой суперскученный плазмидный ДНК-вектор и предназначен для экспрессии клонированных генов в клетках животных и человека. Вектор состоит из ориджина репликации, регуляторных элементов, включающих промотор и энхансер цитомегаловируса человека, регуляторные элементы из Т-лимфотропного вируса человека.
Накопление вектора проводят в специальном штамме E.coli без использования антибиотиков за счет антисенс-комплементации гена sacB, введенного в штамм посредством бактериофага. Недостатком данного изобретения является наличие в составе ДНК-вектора регуляторных элементов, представляющих собой последовательности вирусных геномов.
Прототипами настоящего изобретения в части использования генотерапевтических подходов для повышения уровня экспрессии генов из группы ВМР-2, ВМР-7, OPG, PDGFA, PDGFB являются следующие заявки.
Патент US 5942496 A, в котором описывается метод регенерации костной ткани и лечения связанных с костной тканью заболеваний путем введения в клетки или в организм человека или животных генов, выбранных из группы генов, включающих в себя, в том числе, гены ВМР-2 и ВМР-7. Недостатком данного изобретения являются неопределенные требования к свойствам векторов, экспрессирующих данные гены.
Патент US 6300127 B1, в котором описан способ использования векторов, экспрессирующих ген OPG, для регенерации костной ткани. Недостатком данного изобретения является отсутствие требований к безопасности используемых векторов.
Патент ЕР 1017421 В1, в котором описывается метод регенерации повреждений в тканях млекопитающих с использованием рекомбинантного аденовирусного вектора, экспрессирующего ген, выбранный из группы генов, включающих, в том числе, гены PDGFA и PDGFB. Недостатком данного изобретения является использование вектора, содержащего последовательности вирусного происхождения.
Раскрытие изобретения
Задачей изобретения является конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB в организме человека и животных, сочетающих в себе следующие свойства:
I) Эффективность генотерапевтического ДНК-вектора для повышения уровня экспрессии целевых генов в эукариотических клетках.
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов.
III) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности.
IV) Технологичность получения и возможность наработки генотерапевтического ДНК-вектора в промышленных масштабах.
Пункты II и III предусмотрены в данном техническом решении в соответствии с рекомендациями государственных регуляторов к лекарственным средствам для генной терапии, в частности, Европейского Агентства по лекарственным средствам касательно отказа от введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011, EMA/CAT/GTWP/44236/2009 Committee for advanced therapies) и касательно отказа от введения в разрабатываемые плазмидные векторы для генной терапии элементов вирусных геномов (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products / 23 March 2015, EMA/CAT/80183/2014, Committee for Advanced Therapies).
Задачей изобретения также является конструирование штаммов, несущих эти генотерапевтические ДНК-вектора, для наработки и производства в промышленных масштабах генотерапевтических ДНК-векторов.
Поставленная задача решается за счет того, что создан генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB для повышения уровня экспрессии этого целевого гена в организме человека и животных, при этом генотерапевтический ДНК-вектор VTvaf17-BMP-2, или VTvaf17-BMP-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB имеет нуклеотидную последовательность SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно. При этом каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-ВМР-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки и экспрессировать клонированный в него целевой ген, выбранный из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB соответственно. В составе генотерапевтического ДНК-вектора отсутствуют нуклеотидные последовательности вирусного происхождения и отсутствуют гены антибиотикорезистентности, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
Создан также способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген ВМР-2, ген ВМР-7, ген OPG, ген PDGFA, ген PDGFB, который заключается в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17-ВМР-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB получают следующим образом: кодирующую часть целевого гена из группы ВМР-2, или ВМР-7, или OPG, или PDGFA, или PDGFB клонируют в ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17-ВМР-2, SEQ ID №1, или VTvaf17-ВМР-7, SEQ ID №2 или VTvaf17-OPG, SEQ ID №3, или VTvaf17-PDGFA, SEQ ID №4, или VTvaf17-PDGFB, SEQ ID №5 соответственно.
Способ применения созданного генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген ВМР-2, ген ВМР-7, ген OPG, ген PDGFA, ген PDGFB для повышения уровня экспрессии этих целевых генов, заключается во введении выбранного генотерапевтического ДНК-вектора или нескольких выбранных генотерапевтических ДНК-векторов в клетки, органы и ткани человека или животного, и/или во введении в органы и ткани человека или животного аутологичных клеток человека или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором или несколькими выбранными генотерапевтическими ДНК-векторами, или в сочетании обозначенных способов.
Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-ВМР-2, или штамма Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB заключается в электропорации компетентных клеток штамма Escherichia coli SCS110-AF созданным генотерапевтическим ДНК-вектором и последующей селекцией стабильных клонов штамма с использованием селективной среды.
Заявлен штамм Escherichia coli SCS110-AF/VTvaf17-BMP-2, или штамм Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамм Escherichia coli SCS110-AF/VTvaf17-OPG, или штамм Escherichia coli SCS110-AF/VTvaf17-PDGFA или штамм Escherichia coli SCS110-AF/VTvaf17-PDGFB, несущий генотерапевтический ДНК-вектор для его наработки с возможностью культивирования штамма без использования антибиотиков.
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора заключается в масштабировании бактериальной культуры штамма до количеств, необходимых для наращивания бактериальной биомассы в промышленном ферментере, после чего биомассу используют для выделения фракции, содержащей целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-BMP-2 или VTvaf17-BMP-7 или VTvaf17-OPG или VTvaf17-PDGFA или VTvaf17-PDGFB многостадийно фильтруют и очищают хроматографическими методами.
Изобретение поясняется чертежами, где:
На фиг. 1
приведена схема генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB, который представляет собой кольцевую двуцепочечную молекулу ДНК, способную к автономной репликации в клетках бактерии Escherichia coli.
На фиг. 1 приведены схемы, соответствующие:
А - генотерапевтический ДНК-вектор VTvaf17-BMP-2,
В - генотерапевтический ДНК-вектор VTvaf17-BMP-7,
С - генотерапевтический ДНК-вектор VTvaf17-OPG,
D - генотерапевтический ДНК-вектор VTvaf17-PDGFA,
Е - генотерапевтический ДНК-вектор VTvaf17-PDGFB.
На схемах отмечены следующие структурные элементы вектора:
EF1a - промоторная область гена человеческого фактора элонгации EF1A с собственным энхансером, содержащимся в первом интроне гена. Служит для обеспечения высокого уровня транскрипции рекомбинантного гена в большинстве тканей человека;
Рамка считывания целевого гена, соответствующая кодирующей части гена ВМР-2 (фиг. 1А), или ВМР-7 (фиг. 1В), или OPG (фиг. 1С), или PDGFA (фиг. 1D), или PDGFB (фиг. 1Е) соответственно;
hGH-TA - терминатор транскрипции и сайт полиаденилирования гена фактора роста человека;
ori - ориджин репликации, служащий для автономной репликации с однонуклеотидной заменой для повышения копийности плазмиды в клетках большинства штаммов Escherichia coli;
RNA-out - регуляторный элемент РНК-out транспозона Tn 10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании штамма Escherichia coli SCS 110.
Отмечены уникальные сайты рестрикции.
На фиг. 2
показаны графики накопления ампликонов кДНК целевого гена, а именно, гена ВМР-2, в культуре остеобластов человека HOb (Cell Applications, Inc Кат. 406-05а) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-BMP-2 c целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 2 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена ВМР-2 в культуре остеобластов человека HOb до трансфекции ДНК-вектором VTvaf17-BMP-2;
2 - кДНК гена ВМР-2 в культуре остеобластов человека HOb после трансфекции ДНК-вектором VTvaf17-ВМР-2;
3 - кДНК гена В2М в культуре остеобластов человека HOb до трансфекции ДНК-вектором VTvaf17-ВМР-2;
4 - кДНК гена В2М в культуре остеобластов человека HOb после трансфекции ДНК-вектором VTvaf17-ВМР-2.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 3
показаны графики накопления ампликонов кДНК целевого гена, а именно гена ВМР-7, в культуре остеосаркомы человека MG-63 (АТСС® CRL-1427™) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-ВМР-7 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 3 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена ВМР-7 в культуре остеосаркомы человека MG-63 до трансфекции ДНК-вектором VTvaf17-ВМР-7;
2 - кДНК гена ВМР-7 в культуре остеосаркомы человека MG-63 после трансфекции ДНК-вектором VTvaf17-ВМР-7;
3 - кДНК гена В2М в культуре остеосаркомы человека MG-63 до трансфекции ДНК-вектором VTvaf17-ВМР-7;
4 - кДНК гена В2М в культуре остеосаркомы человека MG-63 после трансфекции ДНК-вектором VTvaf17-ВМР-7.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 4
показаны графики накопления ампликонов кДНК целевого гена, а именно гена OPG в клетках культуры фибробластов десен человека линии HGF-1 (АТСС® CRL-2014™) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-OPG с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 4 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена OPG в клетках фибробластов десен человека линии HGF-1 до трансфекции ДНК-вектором VTvaf17-OPG;
2 - кДНК гена OPG в клетках фибробластов десен человека линии HGF-1 после трансфекции ДНК-вектором VTvaf17-OPG;
3 - кДНК гена В2М в клетках фибробластов десен человека линии HGF-1 до трансфекции ДНК-вектором VTvaf17-OPG;
4 - кДНК гена В2М в клетках фибробластов десен человека линии HGF-1 после трансфекции ДНК-вектором VTvaf17-OPG.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 5
показаны графики накопления ампликонов кДНК целевого гена, а именно гена PDGFA, в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) (Cell Applications, Inc Кат. 402K-05а) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-PDGFA с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 5 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена PDGFA в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) до трансфекции ДНК-вектором VTvaf17-PDGFA;
2 - кДНК гена PDGFA в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) после трансфекции ДНК-вектором VTvaf17-PDGFA;
3 - кДНК гена В2М в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) до трансфекции ДНК-вектором VTvaf17-PDGFA;
4 - кДНК гена В2М в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) после трансфекции ДНК-вектором VTvaf17-PDGFA.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 6
показаны графики накопления ампликонов кДНК целевого гена, а именно гена PDGFB, в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) (Cell Applications, Inc Кат. 402K-05a) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-PDGFB с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг. 6 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена PDGFB в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) до трансфекции ДНК-вектором VTvaf17-PDGFB;
2 - кДНК гена PDGFB в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) после трансфекции ДНК-вектором VTvaf17-PDGFB;
3 - кДНК гена В2М в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) до трансфекции ДНК-вектором VTvaf17-PDGFB;
4 - кДНК гена В2М в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) после трансфекции ДНК-вектором VTvaf17-PDGFB.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг. 7
показана диаграмма концентрации белка ВМР-2 в клеточном лизате культуры остеобластов человека HOb после трансфекции этих клеток ДНК-вектором VTvaf17-ВМР-2 с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка ВМР-2 в лизате клеток.
На фиг. 7 отмечены следующие элементы:
культура А - культура остеобластов человека HOb, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура В - культура остеобластов человека HOb, трансфицированных ДНК-вектором VTvaf17;
культура С - культура остеобластов человека HOb, трансфицированных ДНК-вектором VTvaf17-ВМР-2.
На фиг. 8
показана диаграмма концентрации белка ВМР-7 в лизате клеток культуры клеток остеосаркомы человека MG-63 (АТСС® CRL-1427™), после трансфекции этих клеток ДНК-вектором VTvaf17-ВМР-7 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ВМР-7.
На фиг. 8 отмечены следующие элементы:
культура А - культура остеосаркомы человека MG-63, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура В - культура остеосаркомы человека MG-63, трансфицированная ДНК-вектором VTvaf17;
культура С - культура остеосаркомы человека MG-63, трансфицированная ДНК-вектором VTvaf17-ВМР-7.
На фиг. 9
показана диаграмма концентрации белка OPG в лизате культуры клеток фибробластов десен человека линии HGF-1 (АТСС® CRL-2014™) после трансфекции этих клеток ДНК-вектором VTvaf17-OPG с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген OPG.
На фиг. 9 отмечены следующие элементы:
культура А - культура клеток фибробластов десен человека линии HGF-1, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура В - культура клеток фибробластов десен человека линии HGF-1, трансфицированных ДНК-вектором VTvaf17;
культура С - культура клеток фибробластов десен человека линии HGF-1, трансфицированных ДНК-вектором VTvaf17-OPG.
На фиг. 10
показана диаграмма концентрации белка PDGFA в лизате культуры клеток человеческих хондроцитов Human Chondrocytes (НС) (Cell Applications, Inc Кат. 402K-05а) после трансфекции этих клеток ДНК-вектором VTvaf17-PDGFA с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген PDGFA.
На фиг. 10 отмечены следующие элементы:
культура А - культура клеток человеческих хондроцитов Human Chondrocytes (НС), трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура В - культура клеток человеческих хондроцитов Human Chondrocytes (НС), трансфицированных ДНК-вектором VTvaf17;
культура С - культура клеток человеческих хондроцитов Human Chondrocytes (НС), трансфицированных ДНК-вектором VTvaf17-PDGFA.
На фиг. 11
показана диаграмма концентрации белка PDGFB в лизате культуры клеток человеческих хондроцитов Human Chondrocytes (НС) (Cell Applications, Inc Кат. 402K-05a) после трансфекции этих клеток ДНК-вектором VTvaf17-PDGFB с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген PDGFB.
На фиг. 10 отмечены следующие элементы:
культура А - культура клеток человеческих хондроцитов Human Chondrocytes (НС), трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура В - культура клеток человеческих хондроцитов Human Chondrocytes (НС), трансфицированных ДНК-вектором VTvaf17;
культура С - культура клеток человеческих хондроцитов Human Chondrocytes (НС), трансфицированных ДНК-вектором VTvaf17-PDGFB.
На фиг. 12
показана диаграмма концентрации белка PDGFA в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-PDGFA с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген PDGFA.
На фиг. 12 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-PDGFA;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат кожи пациента П1 из интактного участка,
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-PDGFA;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-PDGFA;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
На фиг. 13
показана диаграмма концентрации белка OPG в биоптатах икроножной мышцы трех пациентов после введения в икроножную мышцу этих пациентов генотерапевтического ДНК-вектора VTvaf17-OPG, с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген OPG.
На фиг. 13 отмечены следующие элементы:
П1I - биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-OPG;
П1II - биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат интактного участка икроножной мышцы пациента П1;
П2I - биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-OPG;
П2II - биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат интактного участка икроножной мышцы пациента П2;
П3I - биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-OPG;
П3II - биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат интактного участка икроножной мышцы пациента П3.
На фиг. 14
показана диаграмма концентрации белка ВМР-7 в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-ВМР-7 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ВМР-7.
На фиг. 14 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-ВМР-7;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат кожи пациента П1 из интактного участка;
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-ВМР-7;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-ВМР-7;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
На фиг. 15
показана диаграмма концентрации белка ВМР-7 в биоптатах кожи человека после введения в кожу культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ВМР-7 с целью демонстрации способа применения путем введения аутологичных клеток, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ВМР-7
На фиг. 15 отмечены следующие элементы:
П1С - биоптат кожи пациента П1 в зоне введения культуры аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ВМР-7;
П1В - биоптат кожи пациента П1 в зоне введения аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17;
П1А - биоптат кожи пациента П1 из интактного участка.
На фиг. 16
показана диаграмма концентраций белков: белка ВМР-2 человека, белка ВМР-7 человека, белка OPG человека, белка PDGFA человека, белка PDGFB человека в зоне механического повреждения мягких тканей десен трех крыс линии Wistar после инъекционного введения смеси генотерапевтических векторов: генотерапевтического ДНК-вектора VTvaf17-ВМР-2, генотерапевтического ДНК-вектора VTvaf17-ВМР-7, генотерапевтического ДНК-вектора VTvaf17-OPG, генотерапевтического ДНК-вектора VTvaf17-PDGFA, генотерапевтического ДНК-вектора VTvaf17-PDGFB с целью демонстрации способа применения смеси генотерапевтических ДНК-векторов.
На фиг. 16 отмечены следующие элементы:
К1I - фрагмент поврежденной десны крысы К1 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-ВМР-2, VTvaf17-ВМР-7, VTvaf17-OPG, VTvaf17-PDGFA и VTvaf17-PDGFB;
К1II - фрагмент поврежденной десны крысы К1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К1III - фрагмент десны контрольного интактного участка крысы К1;
К2I - фрагмент поврежденной десны крысы К2 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-ВМР-2, VTvaf17-ВМР-7, VTvaf17-OPG, VTvaf17-PDGFA и VTvaf17-PDGFB;
К2II - фрагмент поврежденной десны крысы К2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К2III - фрагмент десны контрольного интактного участка крысы К2;
К3I - фрагмент поврежденной десны крысы К3 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-ВМР-2, VTvaf17-ВМР-7, VTvaf17-OPG, VTvaf17-PDGFA и VTvaf17-PDGFB;
К3II - фрагмент поврежденной десны крысы К3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К3III - фрагмент десны контрольного интактного участка крысы К3.
На фиг. 17
показаны графики накопления ампликонов кДНК целевого гена OPG в клетках носовой раковины быка ВТ (АТСС® CRL-1390™) до и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-OPG с целью демонстрации способа применения путем введения генотерапевтического ДНК-вектора животным.
На фиг. 17 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена OPG в клетках носовой раковины быка ВТ до трансфекции генотерапевтическим ДНК-вектором VTvaf17-OPG;
2 - кДНК гена OPG в клетках носовой раковины быка ВТ после трансфекции генотерапевтическим ДНК-вектором VTvaf17-OPG;
3 - кДНК гена АСТ в клетках носовой раковины быка ВТ до трансфекции генотерапевтическим ДНК-вектором VTvaf17-OPG;
4 - кДНК гена АСТ в клетках носовой раковины быка ВТ после трансфекции генотерапевтическим ДНК-вектором VTvaf17-OPG.
В качестве референтного гена использовали ген актина быка/коровы (ACT), приведенного в базе данных GenBank под номером АН001130.2.
Реализация изобретения
На основе ДНК-вектора VTvaf17 размером 3165 п.н. созданы генотерапевтические ДНК-векторы, несущие целевые гены человека, предназначенные для повышения уровня экспрессии этих целевых генов в тканях человека и животных. При этом способ получения каждого генотерапевтического ДНК-вектора, несущего целевые гены заключается в том, что в полилинкер генотерапевтического ДНК-вектора VTvaf17 клонируют белок-кодирующую последовательность целевого гена, выбранного из группы генов: ген ВМР-2 (кодирует белок ВМР-2), ген ВМР-7 (кодирует белок ВМР-7), ген OPG (кодирует белок OPG), ген PDGFA (кодирует белок PDGFA), ген PDGFB (кодирует белок PDGFB) человека. Известно, что способность ДНК-векторов проникать в эукариотические клетки обусловлена, главным образом, размером вектора. При этом ДНК-вектора с наименьшим размером обладают более высокой проникающей способностью. Таким образом, предпочтительным является отсутствие в составе вектора элементов, которые не несут функциональной нагрузки, но при этом увеличивают размер ДНК-вектора. Данные особенности ДНК-векторов были учтены при получении генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB путем отсутствия в составе вектора крупных нефункциональных последовательностей и генов антибиотикорезистентности, что позволило, помимо технологических преимуществ и преимуществ в плане безопасности применения, значительно уменьшить размер полученного генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB. Таким образом, способность проникать в эукариотические клетки полученного генотерапевтического ДНК-вектора обусловлена его небольшими размерами.
Каждый из генотерапевтических ДНК-векторов: ДНК-вектор VTvaf17-BMP-2, или VTvaf17-BMP-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB получали следующим образом: кодирующую часть целевого гена ВМР-2, или ВМР-7, или OPG, или PDGFA, или PDGFB клонировали в генотерапевтический ДНК-вектор VTvaf17 и получали генотерапевтический ДНК-вектор VTvaf17-BMP-2, SEQ ID №1, или VTvaf17-BMP-7, SEQ ID №2 или VTvaf17-OPG, SEQ ID №3, или VTvaf17-PDGFA, SEQ ID №4, или VTvaf17-PDGFB, SEQ ID №5 соответственно. Кодирующую часть гена ВМР-2 размером 1219 п.н., или гена ВМР-7 размером 1322 п.н., или гена OPG размером 1207 п.н., или гена PDGFA размером 592 п.н., или гена PDGFB размером 729 п.н. получали путем выделения суммарной РНК из биологического образца ткани здорового человека. Для получения первой цепи кДНК генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB человека использовали реакцию обратной транскрипции. Амплификацию проводили с использованием созданных для этого методом химического синтеза олигонуклеотидов. Расщепление продукта амплификации специфическими эндонуклеазами рестрикции проводили с учетом оптимальной процедуры дальнейшего клонирования, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводили по сайтам рестрикции BamHI, EcoRI, HindIII, KpnI, SalI, NheI расположенными в полилинкере вектора VTvaf17. Выбор сайтов рестрикции проводили таким образом, чтобы клонированный фрагмент попадал в рамку считывания экспрессионной кассеты вектора VTvaf17, при этом белок-кодирующая последовательность не содержала сайты рестрикции для выбранных эндонуклеаз. При этом специалистам в данной области техники понятно, что методическая реализация получения генотерапевтического ДНК-вектора VTvaf17-ВМР-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB может варьировать в рамках выбора известных методов молекулярного клонирования генов, при этом эти способы подпадают под объем настоящего изобретения. Так, например, могут быть использованы различные последовательности олигонуклеотидов для амплификации гена ВМР-2, или ВМР-7, или OPG, или PDGFA, или PDGFB различные эндонуклеазы рестрикции или такие лабораторные техники как безлигазное клонирование генов.
Генотерапевтический ДНК-вектор VTvaf17-ВМР-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGB обладает нуклеотидной последовательностью SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно. При этом специалистам в данной области техники известно свойство вырожденности генетического кода, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей, отличающихся инсерцией, делецией или заменой нуклеотидов, которые не приводят к изменению полипептидной последовательности, кодируемой целевым геном, и/или не приводят к потере функциональной активности регуляторных элементов вектора VTvaf17. При этом специалистам в данной области техники известно явление генетического полиморфизма, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей генов из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB которые при этом кодируют различные варианты аминокислотных последовательностей белков ВМР-2, BMP-7, OPG, PDGFA, PDGFB не отличающихся от приведенных по своей функциональной активности при физиологических условиях.
Способность проникать в эукариотические клетки и функциональную активность, то есть способность экспрессировать целевой ген, полученного генотерапевтического ДНК-вектора VTvaf17-ВМР-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB подтверждают путем введения в эукариотические клетки полученного вектора и последующим анализом экспрессии специфической мРНК и/или белкового продукта целевого гена. Наличие специфической мРНК в клетках, в которые был введен генотерапевтический ДНК-вектор VTvaf17-ВМР-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB свидетельствует как о способности полученного вектора проникать в эукариотические клетки, так и о его способности экспрессировать мРНК целевого гена. При этом, как известно специалистам в данной области техники, наличие мРНК гена является обязательным условием, но не доказательством трансляции белка, кодируемого целевым геном. Поэтому для подтверждения свойства генотерапевтического ДНК-вектора VTvaf17-ВМР-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB экспрессировать целевой ген на уровне белка в эукариотических клетках, в которые был введен генотерапевтический ДНК-вектор, проводят анализ концентрации белков, кодируемых целевыми генами, с использованием иммунологических методов. Наличие белка ВМР-2, или ВМР-7, или OPG, или PDGFA, или PDGFB подтверждает эффективность экспрессии целевых генов в эукариотических клетках и возможность повышения уровня концентрации белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB. Таким образом для подтверждения эффективности экспрессии созданного генотерапевтического ДНК-вектора VTvaf17-ВМР-2, несущего целевой ген, а именно, ген ВМР-2, генотерапевтического ДНК-вектора VTvaf17-ВМР-7, несущего целевой ген, а именно, ген ВМР-7, генотерапевтического ДНК-вектора VTvaf17-OPG, несущего целевой ген, а именно, ген OPG, генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего целевой ген, а именно, ген PDGFA, генотерапевтического ДНК-вектора VTvaf17-PDGFB, несущего целевой ген, а именно, ген PDGFB, использовали следующие методы:
A) ПЦР в реальном времени - изменение накопления ампликонов кДНК целевых генов в лизате клеток человека и животного, после трансфекции различных клеточных линий человека и животного генотерапевтическим ДНК-векторами;
B) Иммуноферментный анализ - изменение количественного уровня целевых белков в лизате клеток человека, после трансфекции различных клеточных линий человека и животного генотерапевтическими ДНК-векторами;
C) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека и животного, после введения в эти ткани генотерапевтических ДНК-векторов;
D) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека, после введения в эти ткани аутологичных клеток этого человека, трансфицированных генотерапевтическими ДНК-векторами.
Для подтверждения реализуемости способа применения созданного генотерапевтического ДНК-вектора VTvaf17-ВМР-2, несущего целевой ген, а именно, ген ВМР-2, генотерапевтического ДНК-вектора VTvaf17-ВМР-7, несущего целевой ген, а именно, ген ВМР-7, генотерапевтического ДНК-вектора VTvaf17-OPG, несущего целевой ген, а именно, ген OPG, генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего целевой ген, а именно, ген PDGFA выполняли:
А) трансфекцию генотерапевтическими ДНК-векторами различных клеточных линий человека и животного;
В) введение генотерапевтических ДНК-векторов в различные ткани человека и животного;
С) введение в ткани животного смеси генотерапевтических ДНК-векторов;
D) введение в ткани человека аутологичных клеток, трансфицированных генотерапевтическими ДНК-векторами.
Указанные способы применения характеризуются отсутствием потенциальных рисков для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов, и за счет отсутствия в составе генотерапевтического ДНК-вектора генов устойчивости к антибиотикам, что подтверждается отсутствием участков, гомологичных вирусным геномам и генам антибиотикорезистентности в нуклеотидных последовательностях генотерапевтического ДНК-вектора VTvaf17-ВМР-2, или генотерапевтического ДНК-вектора VTvaf17-ВМР-7, или генотерапевтического ДНК-вектора VTvaf17-OPG, или генотерапевтического ДНК-вектора VTvaf17-PDGFA, или генотерапевтического ДНК-вектора VTvaf17-PDGFB (SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно).
Как известно специалистам в данной области техники, гены антибиотикорезистентности в составе генотерапевтических ДНК-векторов используются с целью получения этих векторов в препаративных количествах путем наращивания бактериальной биомассы в питательной среде, содержащей селективный антибиотик. В рамках настоящего изобретения в целях возможности безопасного применения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ВМР-2 или ВМР-7, или OPG, или PDGFA, или PDGFB, использование селективных питательных сред, содержащих антибиотик, не представляется возможным. В качестве технологического решения для получения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB для возможности масштабирования до промышленных масштабов получения генотерапевтических векторов предлагается способ получения штаммов для наработки указанных генотерапевтических векторов на основе бактерии Escherichia coli SCS110-AF. Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-BMP-2 или штамма Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB заключается в получении компетентных клеток штамма Escherichia coli SCS110-AF с введением в эти клетки генотерапевтического ДНК-вектора VTvaf17-BMP-2, или ДНК-вектора VTvaf17-BMP-7, или ДНК-вектора VTvaf17-OPG, или ДНК-вектора VTvaf17-PDGFA, или ДНК-вектора VTvaf17-PDGFB соответственно с помощью методов трансформации (электропорации), общеизвестных специалистам в данной области техники. Полученный штамм Escherichia coli SCS110-AF/VTvaf17-ВМР-2, или штамм Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамм Escherichia coli SCS110-AF/VTvaf17-OPG, или штамм Escherichia coli SCS110-AF/VTvaf17-PDGFA, или штамм Escherichia coli SCS110-AF/VTvaf17-PDGFB используется для наработки генотерапевтического ДНК-вектора VTvaf17-ВМР-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA,, или VTvaf17-PDGFB соответственно с возможностью использования сред без содержания антибиотиков.
Для подтверждения получения штамма Escherichia coli SCS110-AF/VTvaf17-BMP-2, или штамма Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB проводили трансформацию, селекцию и последующее наращивание с выделением плазмидной ДНК.
Для подтверждения технологичности получения и возможности масштабирования до промышленного производства генотерапевтического ДНК-вектора VTvaf17-ВМР-2, несущего целевой ген, а именно, ген ВМР-2, генотерапевтического ДНК-вектора VTvaf17-ВМР-7, несущего целевой ген, а именно, ген ВМР-7, генотерапевтического ДНК-вектора VTvaf17-OPG, несущего целевой ген, а именно, ген OPG, генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего целевой ген, а именно, ген PDGFA, генотерапевтического ДНК-вектора VTvaf17-PDGFB, несущего целевой ген, а именно, ген PDGFB, выполняли ферментацию в промышленном масштабе штамма Escherichia coli SCS110-AF/VTvaf17-BMP-2 или штамма Escherichia coli SCS110-AF/VTvaf17-BMP-7 или штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно ВМР-2, или ВМР-7, или OPG, или PDGFA, или PDGFB.
Способ масштабирования получения бактериальной массы до промышленных масштабов для выделения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB заключается в том, что затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-ВМР-2, или штамма Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB инкубируют в объеме питательной среды без содержания антибиотика обеспечивающим подходящую динамику накопления биомассы, по достижению достаточного количества биомассы в логарифмической фазе роста, бактериальную культуру переносят в промышленный ферментер, после чего растят до достижения стационарной фазы роста, затем выделяют фракцию, содержащую целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-ВМР-2, или генотерапевтический ДНК-вектор VTvaf17-ВМР-7, или генотерапевтический ДНК-вектор VTvaf17-OPG, или генотерапевтический ДНК-вектор VTvaf17-PDGFA или генотерапевтический ДНК-вектор VTvaf17-PDGFB многостадийно фильтруют и очищают хроматографическими методами. При этом специалистам в данной области техники понятно, что условия культивирования штаммов, состав питательных сред (за исключением содержания антибиотиков), используемое оборудование, методы очистки ДНК могут варьировать в рамках стандартных операционных процедур в зависимости от отдельно взятой производственной линии, но известные подходы к масштабированию, промышленному получению и очистке ДНК векторов с использованием штамма Escherichia coli SCS110-AF/VTvaf17-BMP-2, или штамма Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB подпадают под объем настоящего изобретения.
Описанное раскрытие изобретения подтверждается примерами реализации настоящего изобретения.
Изобретение поясняется следующими примерами.
Пример 1.
Получение генотерапевтического ДНК-вектора VTvaf17-BMP-2, несущего целевой ген, а именно, гена ВМР-2.
Генотерапевтический ДНК-вектор VTvaf17-BMP-2 конструировали клонированием кодирующей части гена ВМР-2 размером 1219 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции NheI и HindIII. Кодирующую часть гена ВМР-2 размером 1219 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
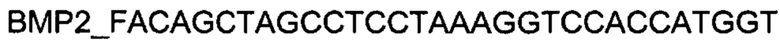
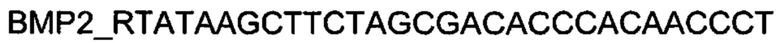
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США).
Генотерапевтический ДНК-вектор VTvaf17 конструировали объединением шести фрагментов ДНК, полученных из разных источников:
(а) ориджин репликации получали путем ПЦР-амплификации участка коммерческой плазмиды pBR322 с внесением точечной мутации;
(б) промоторный регион EF1a получали путем ПЦР-амплификации участка геномной ДНК человека;
(в) терминатор транскрипции hGH-TA получали путем ПЦР-амплификации участка геномной ДНК человека;
(г) регуляторный участок транспозона Tn10 РНК-out получали путем синтеза из олигонуклеотидов;
(д) ген устойчивости к канамицину получали путем ПЦР-амплификации участка коммерческой плазмиды рЕТ-28 человека;
(е) полилинкер получали отжигом двух синтетических олигонуклеотидов.
ПЦР-амплификацию проводили с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (NewEnglandBiolabs, США) в соответствии с инструкцией производителя. Фрагменты имеют перекрывающиеся области для возможности их объединения с последующей ПЦР-амплификацией. Объединяли фрагменты (а) и (б) с использованием олигонуклеотидов Ori-F и EF1-R, а также фрагменты (в), (г) и (д) с использованием олигонуклеотидов hGH-F и Kan-R. Далее полученные участки объединяли путем рестрикции с последующим лигированием по сайтам BamHI и NcoI. В результате получали плазмиду, пока еще не содержащую полилинкер. Для его введения проводили расщепление плазмиды по сайтам BamHI и EcoRI, и лигирование с фрагментом (е). Таким образом, получали вектор размером 4182 п.н., несущий ген устойчивости к канамицину, который фланкирован сайтами рестрикции SpeI. Далее этот участок выщепляли по сайтам рестрикции SpeI, после чего оставшийся фрагмент лигировали сам на себя. Таким образом получали генотерапевтический ДНК-вектор VTvaf17 размером 3165 п.н., который является рекомбинантным, с возможностью селекции без антибиотиков.
Расщепление продукта амплификации кодирующей части гена ВМР-2 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции NheI и HindIII (NewEnglandBiolabs, США).
В результате получали ДНК-вектор VTvaf17-BMP-2 размером 4360 п.н. с нуклеотидной последовательностью SEQ ID №1 и общей структурой изображенной на фиг. 1А.
Пример 2.
Получение генотерапевтического ДНК-вектора VTvaf17-BMP-7, несущего целевой ген, а именно, гена ВМР-7.
Генотерапевтический ДНК-вектор VTvaf17-BMP-7 конструировали клонированием кодирующей части гена ВМР-7 размером 1322 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции NheI и HindIII. Кодирующую часть гена ВМР-7 размером 1322 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:


и коммерческого набора Phusion® High-Fidelity DNA Polymerase (NewEnglandBiolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции NheI и HindIII (NewEnglandBiolabs, США).
В результате получали ДНК-вектор VTvaf17-BMP-7 размером 4463п.н. с нуклеотидной последовательностью SEQ ID №2 и общей структурой изображенной на фиг. 1В.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 3
Получение ДНК-вектора VTvaf17-OPG, несущего целевой ген, а именно, гена OPG человека.
Генотерапевтический ДНК-вектор VTvaf17-OPG конструировали клонированием кодирующей части гена OPG размером 1207 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена OPG размером 1207 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
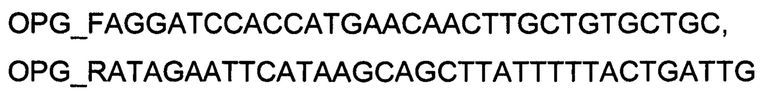
и коммерческого набора Phusion® High-FidelityDNAPolymerase (NewEnglandBiolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (NewEnglandBiolabs, США).
В результате получали ДНК-вектор VTvaf17-OPG размером 4348 п.н. с нуклеотидной последовательностью SEQ ID №3 и общей структурой изображенной на фиг. 1С.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 4.
Получение генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего целевой ген, а именно, гена PDGFA.
Генотерапевтический ДНК-вектор VTvaf17-PDGFA конструировали клонированием кодирующей части гена PDGFA размером 592 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHII и EcoRI. Кодирующую часть гена PDGFA размером 592 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
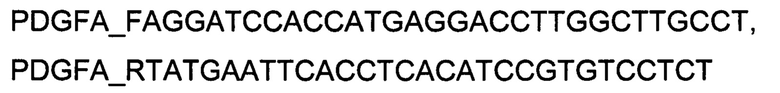
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (NewEnglandBiolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикци и BamHII и EcoRI (NewEnglandBiolabs, США).
В результате получали ДНК-вектор VTvaf17-PDGFA размером 3733 п.н. с нуклеотидной последовательностью SEQ ID №4 и общей структурой изображенной на фиг. 1D.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 5.
Получение генотерапевтического ДНК-вектора VTvaf17-PDGFB, несущего целевой ген, а именно, гена PDGFB.
Генотерапевтический ДНК-вектор VTvaf17-PDGFB конструировали клонированием кодирующей части гена PDGFB размером 729 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции SalI и KpnI. Кодирующую часть гена PDGFB размером 729 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
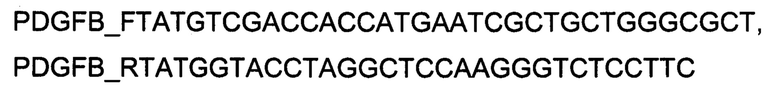
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (NewEnglandBiolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции SalI и KpnI (NewEnglandBiolabs, США).
В результате получали ДНК-вектор VTvaf17-PDGFB размером 3888 п.н. с нуклеотидной последовательностью SEQ ID №5 и общей структурой изображенной на фиг. 1D.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 6.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-BMP-2, несущего целевой ген, а именно, ген ВМР-2, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена ВМР-2, в культуреостеобластов человека HOb (Cell Applications, Inc Кат. 406-05а) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-BMP-2, несущим генВМР-2 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Для оценки изменения накопления мРНК целевого гена ВМР-2, использовалась первичная культура остеобластов человека HOb. Клеточную культуру HOb выращивали в стандартных условиях (37°С, 5% CO2) с использованием питательной среды Human Osteoblast Growth Medium: All-in-one ready-to-use (Cell Applications, Inc Кат. 417-500). В процессе культивирования каждые 48 ч происходила смена ростовой среды.
Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-BMP-2, экспрессирующим ген ВМР-2 человека, проводили с использованием Lipofectamine 3000 (ThermoFisherScientific, США) согласно рекомендациям производителя. В пробирке №1 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора ДНК-вектора VTvaf17-BMP-2(концентрация 500 нг/мкл) и 1 мкл реагента Р3000. Аккуратно перемешивали легким встряхиванием. В пробирке №2 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора Lipofectamin 3000. Аккуратно перемешивали легким встряхиванием. Добавляли содержимое пробирки №1 к содержимому пробирки №2, инкубировали 5 мин при комнатной температуре. Полученный раствор по каплям добавляли к клеткам в объеме 40 мкл.
В качестве контроля использовали клетки HOb, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена ВМР-2 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано выше.
Суммарную РНК из клеток HOb выделяли с использованием Trizol Reagent (Invitrogen, США) согласно рекомендациям производителя. В лунку с клетками добавляли 1 мл Trizol Reagent и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С. Далее образец центрифугировали при 14000 g в течении 10 мин и снова прогревали в течении 10 мин при 65 0С. Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14000 g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия, рН 5.2 и равный объем изопропилового спирта. Инкубировали образец при -20°С в течении 10 мин с последующим центрифугированием при 14000 g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Определение уровня экспрессии мРНК гена ВМР-2 после трансфекции проводили путем оценки динамики накопления ампликонов кДНК методом ПЦР в режиме реального времени. Для получения и амплификации кДНК, специфичной для гена ВМР-2 человека, использовали олигонуклеотиды BMP-2_SF и BMP-2_SR:
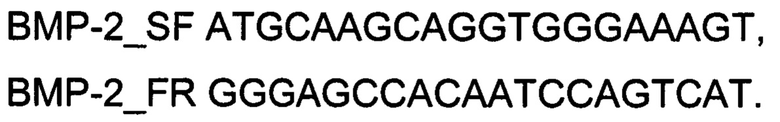
Длина продукта амплификации - 353 п.н.
Реакцию обратной транскрипции и ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) для ПЦР в режиме реального времени. Реакцию проводили в объеме 20 мкл, содержащих: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 мМ хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, США) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 30 сек. В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов ВМР-2 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество динамику накопления ампликонов кДНК генов ВМР-2 и В2Моценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 2.
Из фигуры 2 следует, что в результате трансфекции первичной культуры клеток остеобластов человека HOb генотерапевтическим ДНК-вектором VTvaf17-BMP-2, уровень специфической мРНК гена ВМР-2 человекавырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ВМР-2 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применениягенотерапевтического ДНК-вектора VTvaf17-BMP-2 для повышения уровня экспрессии гена ВМР-2 в эукариотических клетках.
Пример 7.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-BMP-7, несущего целевой ген, а именно, ген BMP-7, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена ВМР-7, в культуре остеосаркомы человека MG-63 (АТСС® CRL-1427™)через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-BMP-7, несущим генВМР-7 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Первичную культуру клеток остеосаркомы человека MG-63 (АТСС® CRL-1427™) выращивали в среде ЕМЕМ (АТСС® 30-2003™) с добавление 10% сыворотки крупного рогатого скота (Панэко, Россия) в стандартных условиях (37°С, 5% CO2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisherScientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-BMP-7, экспрессирующим ген ВМР-7 человека, проводили как описано в примере 6. В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуруклеток остеосаркомы человека MG-63, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена ВМР-7 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 6, за исключением олигонуклеотидов с отличающимися от примера 6 последовательностями. Для амплификации кДНК, специфичной для гена ВМР-7 человека, использовали олигонуклеотиды BMP-7_SF и BMP-7_SR:
Длина продукта амплификации - 459 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов ВМР-7и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов ВМР-7и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 3.
Из фигуры 3 следует, что в результате трансфекции культуры клеток остеосаркомы человека MG-63генотерапевтическим ДНК-вектором VTvaf17-BMP-7, уровень специфической мРНК гена ВМР-7 человекавырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ВМР-7 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-BMP-7 для повышения уровня экспрессии гена ВМР-7 в эукариотических клетках.
Пример 8.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-OPG, несущего целевой ген, а именно, ген OPG, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена OPG в культуре клеток фибробластов десен человека линии HGF-1 (АТСС® CRL-2014™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-OPG, несущим ген OPG человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток фибробластов десен человека линии HGF-1 (АТСС® CRL-2014™) выращивали в среде Dulbecco's Modified Eagle's Medium (DMEM) (АТСС® 30-2002™) с добавлением 10% сыворотки крупного рогатого скота (АТСС® 30-2020™) в стандартных условиях (37°С, 5% CO2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisherScientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-OPG, экспрессирующим ген OPG человека, проводили как описано в примере 6. В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток фибробластов десен человека линии HGF-1, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена OPG до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 6, за исключением олигонуклеотидов с отличающимися от примера 6последовательностями. Для амплификации кДНК, специфичной для гена OPG человека, использовали олигонуклеотиды OPG_SF и OPG_SR:
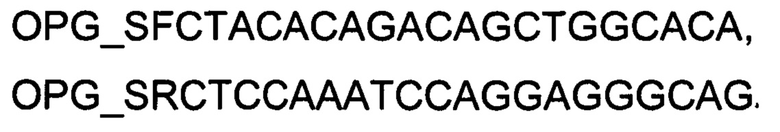
Длина продукта амплификации - 182 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов OPG и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов OPG и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 4.
Из фигуры 4 следует, что в результате трансфекции культуры клеток фибробластов десен человека линии HGF-1 генотерапевтическим ДНК-вектором VTvaf17-OPG уровень специфической мРНК гена OPG человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген OPG на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-OPG для повышения уровня экспрессии гена OPG в эукариотических клетках.
Пример 9.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего целевой ген, а именно, ген PDGFA, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена PDGFA, в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) (Cell Applications, Inc Кат. 402K-05a) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-PDGFA, несущим ген PDGFA человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток хондроцитов человека линии НСвыращивали в среде Human Chondrocyte Growth Medium: All-in-oneready-to-use (Cell Applications, Inc Кат. 402K-05a) стандартных условиях (37°С, 5% CO2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (Thermo Fisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-PDGFA, экспрессирующим ген PDGFA человека, проводили как описано в примере 6. В качестве контроля использовали культуру клеток хондроцитов человека линии НС, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена PDGFA до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 6, за исключением олигонуклеотидов с отличающимися от примера 6последовательностями. Для амплификации кДНК, специфичной для гена PDGFA человека, использовали олигонуклеотиды PDGFA_SF и PDGFA_SR:

Длина продукта амплификации - 180 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов PDGFA и В2М. В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов PDGFA и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа, представлены на фиг. 5.
Из фигуры 5 следует, что в результате трансфекции культуры клеток хондроцитов человека линии НС генотерапевтическим ДНК-вектором VTvaf17-PDGFA, уровень специфической мРНК гена PDGFA человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PDGFA на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-PDGFA для повышения уровня экспрессии гена PDGFA в эукариотических клетках.
Пример 10.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-PDGFB, несущего целевой ген, а именно, ген PDGFB, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена PDGFB, в культуре клеток человеческих хондроцитов Human Chondrocytes (НС) (Cell Applications, Inc Кат. 402K-05a) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-PDGFB, несущим ген PDGFB человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток хондроцитов человека линии НС выращивали в среде HumanChondrocyteGrowthMedium: All-in-oneready-to-use (Cell Applications, Inc Кат. 402K-05a) стандартных условиях (37°С, 5% CO2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisherScientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-PDGFB, экспрессирующим ген PDGFB человека, проводили как описано в примере 6. В качестве контроля использовали культуру клеток хондроцитов человека линии НС, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена PDGFB до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 6, за исключением олигонуклеотидов с отличающимися от примера 6 последовательностями. Для амплификации кДНК, специфичной для гена PDGFB человека, использовали олигонуклеотиды PDGFB_SF и PDGFB_SR:
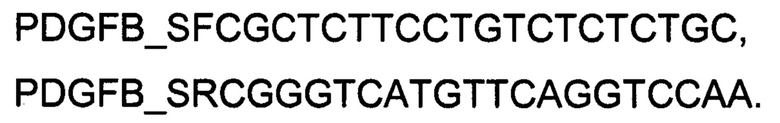
Длина продукта амплификации - 181 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов PDGFB и В2М. В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов PDGFB и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа, представлены на фиг. 6.
Из фигуры 6 следует, что в результате трансфекции культуры клеток хондроцитов человека линии НС генотерапевтическим ДНК-вектором VTvaf17-PDGFB, уровень специфической мРНК гена PDGFB человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PDGFB на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-PDGFB для повышения уровня экспрессии гена PDGFB в эукариотических клетках.
Пример 11.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-BMP-2, несущего ген ВМР-2, для повышения экспрессии белка ВМР-2 в клетках млекопитающих.
Оценивали изменение количества белка ВМР-2 в лизате культуры остеобластов человека HOb (Cell Applications, Inc Кат. 406-05а) после трансфекции этих клеток ДНК-вектором VTvaf17-ВМР-2, несущим ген ВМР-2 человека.
Клеточную культуру остеобластов человека HOb человека выращивали как это описано в примере 6.
Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена ВМР-2 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-ВМР-2, несущий ген ВМР-2 человека (С). Приготовление комплекса ДНК/дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли культуральную среду до конечного объема 60 мкл, затем добавляли 5 мкл SuperFectTransfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл среды, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% CO2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли среду, содержащую 10 мкг/мл гентамицина, и инкубировали 24-48 часов при 37°С в атмосфере 5% CO2.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка ВМР-2 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human ВМР-2 DuoSet ELISA (R&D Systems Кат. DY355-05, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка ВМР-2, входящим в состав набора. Чувствительность метода составляла не менее 50 пг/мл, диапазон измерения - от 50 пг/мл до 4000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 7.
Из фигуры 7 следует, что трансфекция клеток остеобластов человека HOb генотерапевтическим ДНК-вектором VTvaf17-BMP-2приводит к увеличению количества белкаВМР-2 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ВМР-2 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-BMP-2 для повышения уровня экспрессии ВМР-2 в эукариотических клетках.
Пример 12.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-BMP-7, несущего ген ВМР-7, для повышения экспрессии белка ВМР-7 в клетках млекопитающих.
Оценивали изменение количества белка ВМР-7 в лизате клеток остеосаркомы человека MG-63 (АТСС® CRL-1427™) после трансфекции этих клеток ДНК-вектором VTvaf17-BMP-7, несущим ген ВМР-7 человека. Клетки выращивали как описано в примере 7.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена ВМР-7 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-BMP-7, несущий ген ВМР-7 человека (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток MG-63 проводили как описано в примере 11.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка ВМР-7 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор HumanBMP-7 ELISA (Raybiotech, Inc Кат. ELH-BMP7-1, США)согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка ВМР-7, входящим в состав набора. Чувствительность метода составляла не менее 10 пг/мл, диапазон измерения - от 10 пг/мл до 6000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 8.
Из фигуры 8 следует, что трансфекция культуры клеток остеосаркомы человека MG-63 генотерапевтическим ДНК-вектором VTvaf17-BMP-7 приводит к увеличению количества белка ВМР-7 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ВМР-7 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-BMP-7 для повышения уровня экспрессии ВМР-7 в эукариотических клетках.
Пример 13.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-OPG, несущего ген OPG, для повышения экспрессии белка OPG в клетках млекопитающих.
Оценивали изменение количества белка OPG в лизате культуре клеток фибробластов десен человека линии HGF-1 (АТСС® CRL-2014™) после трансфекции этих клеток ДНК-вектором VTvaf17-OPG, несущим ген OPG человека. Клетки культивировали как описано в примере 8.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена OPG (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-OPG, несущий ген OPG человека(С). Приготовление комплекса ДНК-дендример и трансфекцию клеток фибробластов десен человека линии HGF-1 проводили как описано в примере 11.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка OPG проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human Osteoprotegerin (OPG) ELISA (RayBiotech Кат ELH-OPG-1, США)согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка OPG, входящим в состав набора. Чувствительность метода составляла не менее 1 пг/мл, диапазон измерения - от 1 пг/мл до 900 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 9.
Из фигуры 9 следует, что трансфекция культуры клеток фибробластов десен человека линии HGF-1 генотерапевтическим ДНК-вектором VTvaf17-OPG приводит к увеличению количества белка OPG по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген OPG на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-OPG для повышения уровня экспрессии OPG в эукариотических клетках.
Пример 14.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего ген PDGFA, для повышения экспрессии белка PDGFA в клетках млекопитающих.
Оценивали изменение количества белка PDGFA в лизате культуры клеток человеческих хондроцитов Human Chondrocytes (НС) (Cell Applications, Inc Кат. 402K-05a) после трансфекции этих клеток ДНК-вектором VTvaf17-PDGFA, несущим ген PDGFA человека. Клетки культивировали как описано в примере 9.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена PDGFA (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-PDGFA, несущий ген PDGFA человека(С). Приготовление комплекса ДНК-дендримеры и трансфекцию клеток НС проводили как описано в примере.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка PDGFA проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор HumanPDGF-AAELISAKit (SandwichELISA) (LifeSpan Biosciences Кат. LS-F6082-1, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка PDGFA, входящим в состав набора. Чувствительность метода составляла не менее 57 пг/мл, диапазон измерения - от 156 пг/мл до 10000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 10.
Из фигуры 10 следует, что трансфекция культуры клеток человеческих хондроцитов НС генотерапевтическим ДНК-вектором VTvaf17-PDGFA приводит к увеличению количества белка PDGFA по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PDGFA на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-PDGFA для повышения уровня экспрессии PDGFA в эукариотических клетках.
Пример 15.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-PDGFB, несущего ген PDGFB, для повышения экспрессии белка PDGFB в клетках млекопитающих.
Оценивали изменение количества белка PDGFB в лизате культуры клеток человеческих хондроцитов Human Chondrocytes (НС) (Cell Applications, Inc Кат. 402K-05a) после трансфекции этих клеток ДНК-вектором VTvaf17-PDGFB, несущим ген PDGFB человека. Клетки культивировали как описано в примере 10.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена PDGFB (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-PDGFB, несущий ген PDGFB человека(С). Приготовление комплекса ДНК-дендримеры и трансфекцию клеток НС проводили как описано в примере 11.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка PDGFB проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор HumanPDGF-BBELISAKit (SandwichELISA) (LifeSpan Biosciences Кат. LS-F12289, США) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка PDGFB, входящим в состав набора. Чувствительность метода составляла не менее 31,2 пг/мл, диапазон измерения - от 31,2 пг/мл до 2000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 11.
Из фигуры 11 следует, что трансфекция культуры клеток человеческих хондроцитов НС генотерапевтическим ДНК-вектором VTvaf17-PDGFB приводит к увеличению количества белка PDGFB по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PDGFB на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-PDGFB для повышения уровня экспрессии PDGFB в эукариотических клетках.
Пример 16.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего ген PDGFA, для повышения экспрессии белка PDGFA в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего целевой ген, а именно, ген PDGFA и реализуемости способа его применения оценивали изменения количества белка PDGFA в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего ген человека PDGFA.
С целью анализа изменения количества белка PDGFA трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-PDGFA, несущий ген PDGFA и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена PDGFA.
Пациент 1, мужчина 33 лет, (П1); пациент 2, женщина 47 лет, П2); пациент 3, женщина, 43 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-PDGFA, который содержит кДНК гена PDGFA и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена PDGFA, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-PDGFA, несущий ген PDGFA вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-PDGFA, несущего ген PDGFA - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-PDGFA, несущего ген PDGFA (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка методом твердофазного иммуноферментного анализа (ELISA). Количественное определение белка PDGFA проводили методом твердофазного иммуноферментного анализа как это описано в примере 14.
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка PDGFA, входящим в состав набора. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США). Графики, полученные в результате анализа, представлены на фиг. 12.
Из фигуры 12 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-PDGFA, несущего целевой ген PDGFA человека, произошло увеличение количества белка PDGFA в сравнении с количеством белка PDGFA в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген PDGFA человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-PDGFA и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 17.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-OPG, несущего ген OPG, для повышения экспрессии белка OPG в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-OPG, несущего целевой ген OPG и реализуемости способа его применения оценивали изменение количества белка OPG в мышечной ткани человека при введении генотерапевтического ДНК-вектора VTvaf17-OPG, несущего целевой ген, а именно, ген OPG человека.
С целью анализа изменения количества белка OPG трем пациентам вводили в ткань икроножной мышцы генотерапевтический ДНК-вектор VTvaf17-OPG, несущий ген OPG с транспортной молекулой, и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена OPG с транспортной молекулой.
Пациент 1, женщина 40 лет, (П1); пациент 2, мужчина 43 года (П2); пациент 3, мужчина 54 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция), пробоподготовку проводили в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-OPG, несущий ген OPG вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину около 10 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-OPG, несущего ген OPG - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагали медиально на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков мышечной ткани пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-OPG, несущего ген OPG (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактного участка икроножной мышцы (III), используя устройство для взятия биопсии MAGNUM (BARD, США). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 20 куб. мм, масса - около 22 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка OPG проводили методом твердофазного иммуноферментного анализа как это описано в примере 13.
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка OPG, входящим в состав набора. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-proiect.org/). Графики, полученные в результате анализа представлены на фиг. 13.
Из фигуры 13 следует, что в икроножной мышце всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-OPG, несущего целевой ген, а именно, ген OPG человека, произошло увеличение количества белка OPG в сравнении с количеством белка OPG в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген OPG человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-OPG и подтверждает реализуемость способа его применения, в частности при внутримышечном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 18.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-BMP-7, несущего ген ВМР-7, для повышения экспрессии белка ВМР-7 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-BMP-7, несущего целевой ген, а именно, ген ВМР-7 и реализуемости способа его применения оценивали изменения количества белка ВМР-7 в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-BMP-7, несущего ген человека ВМР-7.
С целью анализа изменения количества белка ВМР-7 трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-ВМР-7, несущий генВМР-7 и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена ВМР-7.
Пациент 1, мужчина 62 лет (П1); пациент 2, мужчина 55 лет (П2); пациент 3, женщина 58 лет (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-BMP-7, который содержит кДНК гена ВМР-7 и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена ВМР-7, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК-cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-ВМР-7, несущий генВМР-7 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-ВМР-7, несущего ген ВМР-7 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-ВМР-7, несущего генВМР-7 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка методом твердофазного иммуноферментного анализа как это описано в примере 12.
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка ВМР-7, входящим в состав набора. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 14.
Из фигуры 14 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-ВМР-7, несущего целевой ген ВМР-7 человека, произошло увеличение количества белка ВМР-7 в сравнении с количеством белка ВМР-7 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген ВМР-7 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-BMP-7 и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 19.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-BMP-7, несущего ген ВМР-7 и реализуемости способа его применения для повышения уровня экспрессии белка ВМР-7 в тканях человека путем введения аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-BMP-7.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-BMP-7, несущего ген ВМР-7 и реализуемости способа его применения оценивали изменения количества белка ВМР-7 в коже человека при введении в кожу пациента культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-BMP-7.
Пациенту вводили в кожу предплечья соответствующую культуру аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-BMP-7, несущим ген ВМР-7, и параллельно вводили плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген ВМР-7.
Первичную культуру фибробластов человека выделяли из биоптатов кожи пациента. Используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL, Италия) брали образец биоптата кожи из зоны, защищенной от действия ультрафиолета, а именно за ушной раковиной или с боковой внутренней поверхности в зоне локтевого сустава, размером около 10 кв. мм, массой - около 11 мг. Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Культивирование первичной культуры клеток осуществляли при 37°С в атмосфере, содержащей 5% СO2 в среде DMEM с 10% фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Пересев культуры и смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 5×104 клеток. Культуру фибробластов пациента трансфицировали генотерапевтическим ДНК-вектором VTvaf17-ВМР-7, несущим ген ВМР-7 или плацебо - вектор VTvaf17, не несущий целевой ген ВМР-7.
Трансфекцию осуществляли с помощью катионного полимера полиэтиленимина JETPEI (Polyplus Transfection, Франция), согласно инструкции фирмы-производителя. Клетки культивировали 72 часа и затем вводили пациенту. Введение пациенту культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ВМР-7, и плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, осуществляли туннельным методом в область предплечья иглой 30G длиной 13 мм на глубину около 3 мм. Концентрация модифицированных аутологичных фибробластов в вводимой суспензии составляла примерно 5 млн клеток на 1 мл суспензии, количество вводимых клеток не превышало 15 млн. Очаги введения культуры аутологичных фибробластов располагались на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 4-е сутки после введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-BMP-7, несущим целевой ген, а именно, ген ВМР-7 и плацебо. Взятие биопсии осуществляли из участков кожи пациента в зоне введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-BMP-7, несущим целевой ген, а именно, ген ВМР-7 (С), культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген ВМР-7 (плацебо) (В), а также из участков интактной кожи (А), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу в зоне отбора биоптата пациентов предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка как это описано в примере 12.
Графики, полученные в результате анализа, представлены на фиг. 15.
Из фигуры 15 следует, что в коже пациента в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ВМР-7, несущим ген ВМР-7, произошло увеличение количества белка ВМР-7 в сравнении с количеством белка ВМР-7 в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген ВМР-7 (плацебо), что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-ВМР-7 и подтверждает реализуемость способа его применения для повышения уровня экспрессии ВМР-7 в тканях человека, в частности при введении аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ВМР-7.
Пример 20.
Подтверждение эффективности и реализуемости способа сочетанного применения генотерапевтического ДНК-вектора VTvaf17-ВМР-2, несущего ген ВМР-2, генотерапевтического ДНК-вектора VTvaf17-ВМР-7, несущего ген ВМР-7, генотерапевтического ДНК-вектора VTvaf17-OPG, несущего ген OPG, генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего ген PDGFA, генотерапевтического ДНК-вектора VTvaf17-PDGFB, несущего ген PDGFB, для повышения уровня экспрессии белков ВМР-2, ВМР-7, OPG, PDGFA и PDGFB в тканях млекопитающих.
Оценивали изменение количества белков ВМР-2, ВМР-7, OPG, PDGFA и PDGFB в зоне повреждения десен при введении в эту зону смеси генотерапевтических векторов. Исследование проводили на 3 лабораторных животных - самцах крысы линии Wistar 8 месячного возраста массой 240-290 г. Под наркозом (Золетил в дозе 40 мг/кг массы внутрибрюшинно) животным вводилась игла цельнометаллическая длинной 12 мм в десневой край с вестибулярной поверхности нижних резцов с медиального края вплотную вдоль зуба с небольшим усилием для разрыва тканей.
В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Эквимолярную смесь генотерапевтических ДНК-векторов растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI, приготовленной в соответствии с рекомендациями производителя. Объем вводимого раствора составлял 0,1 мл с суммарным количеством ДНК 100 мкг. Введение раствора осуществляли в мягкие ткани десны с помощью инсулинового шприца. Через 2 сутки после процедуры крыс декапитировали.
Образцы отбирали на 2 сутки после введения генотерапевтических ДНК-векторов. Взятие биопсийного материала осуществляли из участков правой части десны в зоне введения смеси пяти генотерапевтических ДНК-векторов, несущихгеныВМР-2, ВМР-7, OPG, PDGFA, PDGFB (зона I), из участков левой части десны в зоне введения генотерапевтического ДНК-вектора VTvaf17 (плацебо) (зона II), а также из участков верхней десны, не подвергавшихся никаким манипуляциям (зона III). Каждый образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторида, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевых белков как это описано в примере 11 (количественное определение белка ВМР-2), примере 12 (количественное определение белка ВМР-7), примере 13 (количественное определение белка OPG), примере 14 (количественное определение белка PDGFA), примере 15 (количественное определение белка PDGFB). Графики, полученные в результате анализа, представлены на фиг. 16.
Из фигуре 16 следует, что в зоне повреждения десны (зона I), в которую вводилась смесь генотерапевтических векторов: генотерапевтического ДНК-вектора VTvaf17-ВМР-2, несущего целевой ген ВМР-2, генотерапевтического ДНК-вектора VTvaf17-ВМР-7, несущего целевой генВМР-7, генотерапевтического ДНК-вектора VTvaf17-OPG, несущего целевой ген OPG, генотерапевтического ДНК-вектора VTvaf17-PDGFA, несущего целевой ген PDGFA, генотерапевтического ДНК-вектора VTvaf17-PDGFB, несущего целевой ген PDGFB, произошло увеличение количества белков ВМР-2, ВМР-7, OPG, PDGFA и PDGFB по сравнению с зоной II (зона плацебо) и зоной III (интактная зона). Полученные результаты свидетельствуют об эффективности сочетанного применения генотерапевтических ДНК-векторов и подтверждают реализуемость способа применения для повышения уровня экспрессии целевых белков в тканях млекопитающих.
Пример 21.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-OPG, несущего ген OPG и реализуемости способа его применения для повышения уровня экспрессии белка OPG в клетках млекопитающих.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-OPG, несущего ген OPG оценивали изменение накопления мРНК целевого гена OPG в клетках носовой раковины быка ВТ (АТСС® CRL-1390™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-OPG, несущим ген OPG человека.
Клетки носовой раковины быка ВТ (АТСС® CRL-1390™) выращивали в среде DEMEM (АТСС® 30-2002™) с добавлением 10% лошадиной сыворотки Horse Serum (АТСС® 30-2040™) в стандартных условиях. Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-OPG, несущим ген OPG человека и ДНК-вектором VTvaf17, не несущим ген OPG человека (контроль), выделение РНК, реакцию обратной транскрипции, ПЦР амплификации и анализ данных проводили как описано в примере 8. В качестве референтного гена использовали ген актина быка/ коровы (ACT), приведенного в базе данных GenBank под номером АН001130.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности генов OPG и ACT. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов OPG и ACT, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager2.1. (Bio-Rad, USA).
Графики, полученные в результате анализа представлены на фиг. 17.
Из фигуры 17 следует, что в результате трансфекции клеток носовой раковины быка ВТ генотерапевтическим ДНК-вектором VTvaf17-OPG, уровень специфической мРНК гена OPG человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген OPG на уровне мРНК. Представленные результаты подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-OPG для повышения уровня экспрессии гена OPG в клетках млекопитающих.
Пример 22.
Штамм Escherichia coli SCS110-AF/VTvaf17-BMP-2 или штамм Escherichia coli SCS110-AF/VTvaf17-BMP-7 или штамм Escherichia coli SCS110-AFA/Tvaf17-OPG или штамм Escherichia coli SCS110-AF/VTvaf17-PDGFA или штамм Escherichia coli SCS110-AF/VTvaf17-PDGFB, несущий генотерапевтический ДНК-вектор, и способ его получения.
Конструирование штамма для наработки в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов:ВМР-2,ВМР-7,OPG,PDGFA,PDGFBa именно штамма Escherichia coli SCS110-AFA/Tvaf17-BMP-2, или штамма Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AFA/Tvaf17-PDGFA или штамма Escherichia coli SCS110-AFA/Tvaf17-PDGFB, несущего генотерапевтический ДНК-вектор VTvaf17-BMP-2, или VTvaf17-BMP-7, или VTvaf17-OPG, или VTvaf17-РОСРАили VTvaf17-PDGFB соответственно для его наработки с возможностью селекции без использования антибиотиков заключается в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-ВМР-2, или ДНК-вектором VTvaf17-ВМР-7, или ДНК-вектором VTvaf17-OPG, или ДНК-вектором VTvaf17-PDGFA, или ДНК-вектором VTvaf17-PDGFB, после чего клетки высеваются на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. При этом штамм Escherichia coli SCS110-AF для наработки генотерапевтического ДНК-вектора VTvaf17 или генотерапевтических ДНК-векторов на его основе с возможностью положительной селекции без использования антибиотиков получали путем конструирования линейного фрагмента ДНК, содержащего регуляторный элемент RNA-in транспозона Tn10 для селекции без применения антибиотиков размером 64 п.н., ген левансахаразы sacB, продукт которого обеспечивает селекцию на сахарозо-содержащей среде размером 1422 п.н., ген устойчивости к хлорамфениколу catR, необходимый для отбора клонов штамма, в которых прошла гомологичная рекомбинация размером 763 п.н. и две гомологичные последовательности, обеспечивающие процесс гомологичной рекомбинации в области гена recA с одновременной его инактивацией размером 329 п.н. и 233 п.н., после чего проводили трансформацию клеток Escherichia coli путем электропорации и отбирали клоны, выжившие на среде, содержащей 10 мкг/мл хлорамфеникола.
Полученные штаммы для наработки были внесены в коллекции Национального биоресурсного центра - Всероссийская коллекция промышленных микроорганизмов (НБЦ ВКПМ), РФи NCIMB Patent Deposit Service, UKc присвоением регистрационных номеров:
штамм EscherichiacoliSCS110-AF/VTvaf17-ВМР-2- регистрационный № ВКПМ В-13167, дата депонирования 11.05.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43034, дата депонирования 20.04.2018; штамм EscherichiacoliSCS110-AF/VTvaf17-BMP-7 - регистрационный № ВКПМ В-13166, дата депонирования 11.05.2018; INTERNATIONALDEPOSITARYAUTHORITY № NCIMB 43036, дата депонирования 20.04.2018;
штамм EscherichiacoliSCS110-AF/VTvaf17-OPG-регистрационный № ВКПМ B-13272, дата депонирования 16.10.2018; INTERNATIONALDEPOSITARYAUTHORITY № NCIMB43299, дата депонирования 13.12.2018;
штамм EscherichiacoliSCS110-AF/VTvaf17-PDGFA-регистрационный № ВКПМ В-13344, дата депонирования 22.11.2018; INTERNATIONALDEPOSITARYAUTHORITY № NCIMB43252, дата депонирования 08.11.2018;
штамм Escherichia coliSCS110-AF/VTvaf17-PDGFB - регистрационный № ВКПМ В-13271, дата депонирования 16.10.2018; INTERNATIONALDEPOSITARYAUTHORITY № NCIMB43302, дата депонирования 13.12.2018.
Пример 23.
Способ масштабирования получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов:ВМР-2,ВМР-7,OPG,PDGFA, PDGFB до промышленного масштаба.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-ВМР-2 (SEQ ID №1), или VTvaf17-ВМР-7 (SEQ ID №2), или VTvaf17-OPG (SEQ ID №3), или VTvaf17-PDGFA(SEQ ID №4), или VTvaf17-PDGFB (SEQ ID №5) проводили масштабную ферментацию штамма Escherichia coli SCS110-AF/VTvaf17-BMP-2, или штамма Escherichia coli SCS110-AF/VTvaf17-BMP-7, или штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно ВМР-2, или ВМР-7, или OPG, или PDGFA, или PDGFB. Каждый штамм Escherichia coli SCS110-AF/VTvaf17-BMP-2, или Escherichia coli SCS110-AF/VTvaf17-BMP-7, или Escherichia coli SCS110-AF/VTvaf17-OPG, или Escherichia coli SCS110-AF/VTvaf17-РРСРАили Escherichia coli SCS110-AF/VTvaf17-PDGFB получали на базе штамма Escherichia coli SCS110-AF (Cell and Gene Therapy LLC, Великобритания) по примеру 22 путем электропорации компетентных клеток этого штамма генотерапевтическим ДНК-вектором VTvaf17-BMP-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA,или VTvaf17-PDGFB, несущим целевой ген, а именно, ВМР-2, или ВМР-7, или OPG, или PDGFA или PDGFB с последующим высевом трансформированных клеток на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы и отбором отдельных клонов.
Ферментацию полученного штамма Escherichia coli SCS110-AFA/Tvaf17-BMP-2, несущего генотерапевтический ДНК-вектор VTvaf17-ВМР-2 проводили в ферментере объемом 10 л с последующим выделением генотерапевтического ДНК-вектора VTvaf17-ВМР-2.
Для ферментации штамма Escherichia coli SCS110-AF/VTvaf17-ВМР-2 готовили среду, содержащую на 10 л: 100 г триптон, 50 г дрожжевой экстракт (Becton Dickinson, США), доводили водой до 8800 мл и автоклавировали при 121 0С 20 мин, затем добавляли 1200 мл 50% (вес/объем) сахарозы. Далее засевали в колбу затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-ВМР-2 в объеме 100 мл. Инкубировали в шейкере-инкубаторе 16 ч при 30°С. Переносили затравочную культуру в ферментер Techfors S (Infors НТ, Швейцария), растили до достижения стационарной фазы. Контроль осуществляли измерением оптической плотности культуры при длине волны 600 нм. Клетки осаждали центрифугированием 30 мин при 5000-10000 g. Супернатант удаляли, клеточную массу ресуспендировали в 10% по объему фосфатно-солевого буфера. Повторно центрифугировали 30 мин при 5000-10000g. Супернатант удаляли, к клеточной массе добавляли раствор 20 мМ TrisCl, 1 мМ ЭДТА, 200 г/л сахароза, рН 8,0 в объеме 1000 мл, тщательно перемешивали до образования гомогенной суспензии. Добавляли раствор яичного лизоцима до конечной концентрации 100 мкг/мл. Инкубировали 20 мин на льду при бережном перемешивании. Далее, добавляли 2500 мл раствора 0,2 М NaOH, 10 г/л додецилсульфат натрия, инкубировали 10 мин на льду при бережном перемешивании, затем добавляли 3500 мл раствора 3М ацетат натрия, 2М уксусная кислота, рН 5-5,5, инкубировали 10 мин на льду при бережном перемешивании. Полученный образец центрифугировали 20-30 мин при 15000 g или более. Раствор аккуратно декантировали, от остатков осадка избавлялись фильтрацией через грубый фильтр (фильтровальную бумагу). Добавляли РНКазу A (Sigma, США) до конечной концентрации 20 нг/мл, инкубировали ночь 16 ч при комнатной температуре. Раствор центрифугировали 20-30 мин при 15000g, затем фильтровали через мембранный фильтр с порами 0,45 мкм (Millipore, США). Далее проводили ультрафильтрацию через мембрану размером отсечения 100 кДа (Millipore, США) и разбавляли до начального объема буфером 25 мМ TrisCl, рН 7.0. Операцию повторяли три - четыре раза. Наносили раствор, на колонку с 250 мл сорбента DEAE sepharose HP (GE, США), уравновешенную раствором 25 мМ TrisCl, рН 7.0. После нанесения образца колонку промывали тремя объемами этого же раствора, а затем проводили элюцию генотерапевтического ДНК-вектора VTvaf17-ВМР-2 линейным градиентом от раствора 25 мМ TrisCl, рН 7.0 до раствора 25 мМ TrisCl, рН 7.0, 1М NaCl в объеме пяти объемов колонки. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм. Хроматографические фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-ВМР-2, объединяли и проводили гель-фильтрацию на сорбенте Superdex 200 (GE, США). Колонку уравновешивали фосфатно-солевым буфером. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм, фракции анализировали электрофорезом в агарозном геле. Фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-BMP-2 объединяли и хранили при -20°С. Для оценки воспроизводимости техпроцесса обозначенные технологические операции повторяли пятикратно. Все технологические операции для штаммов Escherichia coli SCS110-AF/VTvaf17-BMP-7, или Escherichia coli SCS110-AF/VTvaf17-OPG, или Escherichia coli SCS110-AF/VTvaf17-PDGFA или Escherichia coli SCS110-AF/VTvaf17-РРСРВпроводили аналогичным образом.
Воспроизводимость техпроцесса и количественные характеристики выхода конечного продукта подтверждают технологичность получения и возможность производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-BMP-2, или VTvaf17-ВМР-7, или VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB.
Таким образом, созданный генотерапевтический ДНК-вектор с целевым геном может быть использован для введения в клетки организма животных и человека, характеризующихся сниженной или недостаточной экспрессией белка, кодируемого данным геном, обеспечивая таким образом достижение терапевтического эффекта.
Задача, поставленная в данном изобретении, а именно: конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии генов ВМР-2, ВМР-7, OPG, PDGFA, PDGFB, сочетающих в себе следующие свойства:
I) Эффективность повышения экспрессии целевых генов в эукариотических клетках за счет полученных генотерапевтических векторов с минимальным размером;
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов и генов антибиотикорезистентности;
III) Технологичность получения и возможность наработки в штаммах в промышленных масштабах;
IV) также задача по конструированию штаммов, несущих эти генотерапевтические ДНК-вектора для производства этих генотерапевтических ДНК-векторов решена, что подтверждается примерами:
для п. I - пример 1, 2, 3, 4, 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18, 19, 20, 21;
для п. II - пример 1, 2, 3, 4, 5;
для п. III и п. IV - пример 22, 23.
Промышленная применимость
Все представленные выше примеры подтверждают промышленную применимость предлагаемого генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: генВМР-2, ген ВМР-7, ген OPG, ген PDGFA, ген PDGFB для повышения уровня экспрессии этих целевых генов, штамма Escherichia coli SCS110-AFA/Tvaf17-BMP-2 или Escherichia coli SCS110-AF/VTvaf17-BMP-7 или Escherichia coli SCS110-AF/VTvaf17-OPG или Escherichia coli SCS110-AFA/Tvaf17-PDGFA или Escherichia coli SCS110-AF/VTvaf17-PDGFB, несущего генотерапевтический ДНК-вектор, способа получения генотерапевтического ДНК-вектора, способа производства в промышленных масштабах генотерапевтического ДНК-вектора.
Перечень сокращений
VTvaf17 - вектор генотерапевтический, не содержащий последовательностей вирусных геномов и маркеров антибиотико-резистентности (vectortherapeuticvirus-antibiotic-free),
ДНК - дезоксирибонуклеиновая кислота,
кДНК - комплементарная дезоксирибонуклеиновая кислота,
РНК - рибонуклеиновая кислота,
мРНК - матричная рибонуклеиновая кислота,
п.н. - пар нуклеотидов,
ПЦР - полимеразная цепная реакция,
мл - миллилитр, мкл - микролитр,
куб. мм - кубический миллиметр,
л - литр,
мкг - микрограмм,
мг - миллиграмм,
г - грамм,
мкМ - микромоль,
мМ - миллимоль,
мин - минута,
сек - секунда,
об/мин - обороты в минуту,
нм - нанометр,
см - сантиметр,
мВт - милливатт,
о.е.ф - относительная единица флуоресценции,
РВС - фосфатно-солевой буфер.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Селл энд Джин Терапи Лтд (CELL and GENE THERAPY Ltd), Общество с
ограниченной ответственностью «Прорывные Инновационные Технологии»,
<120> Генотерапевтический ДНК-вектор на основе генотерапевтического
ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов
BMP-2, BMP-7, OPG, PDGFA, PDGFB для повышения уровня экспрессии этих
елевых генов, способ его получения и применения, штамм Escherichia
coli SCS110-AF/VTvaf17-BMP-2 или Escherichia coli SCS110-AF/VTvaf17-BMP-7
или Escherichia coli SCS110-AF/VTvaf17-OPG или Escherichia coli
SCS110-AF/VTvaf17-PDGFA или Escherichia coli SCS110-AF/VTvaf17-PDGFB,
несущий генотерапевтический ДНК-вектор, способ его получения, способ
производства в промышленных масштабах генотерапевтического ДНК-вектора
<160> 5
<170> BiSSAP 1.3.6
<210> 1
<211> 4360
<212> DNA
<213> Homo Sapiens
<400> 1
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagct agcctcctaa aggtccacca tggtggccgg gacccgctgt cttctagcgt 1260
tgctgcttcc ccaggtcctc ctgggcggcg cggctggcct cgttccggag ctgggccgca 1320
ggaagttcgc ggcggcgtcg tcgggccgcc cctcatccca gccctctgac gaggtcctga 1380
gcgagttcga gttgcggctg ctcagcatgt tcggcctgaa acagagaccc acccccagca 1440
gggacgccgt ggtgcccccc tacatgctag acctgtatcg caggcactca ggtcagccgg 1500
gctcacccgc cccagaccac cggttggaga gggcagccag ccgagccaac actgtgcgca 1560
gcttccacca tgaagaatct ttggaagaac taccagaaac gagtgggaaa acaacccgga 1620
gattcttctt taatttaagt tctatcccca cggaggagtt tatcacctca gcagagcttc 1680
aggttttccg agaacagatg caagatgctt taggaaacaa tagcagtttc catcaccgaa 1740
ttaatattta tgaaatcata aaacctgcaa cagccaactc gaaattcccc gtgaccagac 1800
ttttggacac caggttggtg aatcagaatg caagcaggtg ggaaagtttt gatgtcaccc 1860
ccgctgtgat gcggtggact gcacagggac acgccaacca tggattcgtg gtggaagtgg 1920
cccacttgga ggagaaacaa ggtgtctcca agagacatgt taggataagc aggtctttgc 1980
accaagatga acacagctgg tcacagataa ggccattgct agtaactttt ggccatgatg 2040
gaaaagggca tcctctccac aaaagagaaa aacgtcaagc caaacacaaa cagcggaaac 2100
gccttaagtc cagctgtaag agacaccctt tgtacgtgga cttcagtgac gtggggtgga 2160
atgactggat tgtggctccc ccggggtatc acgcctttta ctgccacgga gaatgccctt 2220
ttcctctggc tgatcatctg aactccacta atcatgccat tgttcagacg ttggtcaact 2280
ctgttaactc taagattcct aaggcatgct gtgtcccgac agaactcagt gctatctcga 2340
tgctgtacct tgacgagaat gaaaaggttg tattaaagaa ctatcaggac atggttgtgg 2400
agggttgtgg gtgtcgctag aagcttggta ccgaattccc tgtgacccct ccccagtgcc 2460
tctcctggcc ctggaagttg ccactccagt gcccaccagc cttgtcctaa taaaattaag 2520
ttgcatcatt ttgtctgact aggtgtcctt ctataatatt atggggtgga ggggggtggt 2580
atggagcaag gggcaagttg ggaagacaac ctgtagggcc tgcggggtct attgggaacc 2640
aagctggagt gcagtggcac aatcttggct cactgcaatc tccgcctcct gggttcaagc 2700
gattctcctg cctcagcctc ccgagttgtt gggattccag gcatgcatga ccaggctcag 2760
ctaatttttg tttttttggt agagacgggg tttcaccata ttggccaggc tggtctccaa 2820
ctcctaatct caggtgatct acccaccttg gcctcccaaa ttgctgggat tacaggcgtg 2880
aaccactgct cccttccctg tccttacgcg tagaattggt aaagagagtc gtgtaaaata 2940
tcgagttcgc acatcttgtt gtctgattat tgatttttgg cgaaaccatt tgatcatatg 3000
acaagatgtg tatctacctt aacttaatga ttttgataaa aatcattaac tagtccatgg 3060
ctgcctcgcg cgtttcggtg atgacggtga aaacctctga cacatgcagc tcccggagac 3120
ggtcacagct tgtctgtaag cggatgccgg gagcagacaa gcccgtcagg gcgcgtcagc 3180
gggtgttggc gggtgtcggg gcgcagccat gacccagtca cgtagcgata gcggagtgta 3240
tactggctta actatgcggc atcagagcag attgtactga gagtgcacca tatgcggtgt 3300
gaaataccgc acagatgcgt aaggagaaaa taccgcatca ggcgctcttc cgcttcctcg 3360
ctcactgact cgctgcgctc ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag 3420
gcggtaatac ggttatccac agaatcaggg gataacgcag gaaagaacat gtgagcaaaa 3480
ggccagcaaa aggccaggaa ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc 3540
cgcccccctg acgagcatca caaaaatcga cgctcaagtc agaggtggcg aaacccgaca 3600
ggactataaa gataccaggc gtttccccct ggaagctccc tcgtgcgctc tcctgttccg 3660
accctgccgc ttaccggata cctgtccgcc tttctccctt cgggaagcgt ggcgctttct 3720
catagctcac gctgtaggta tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt 3780
gtgcacgaac cccccgttca gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag 3840
tccaacccgg taagacacga cttatcgcca ctggcagcag ccactggtaa caggattagc 3900
agagcgaggt atgtaggcgg tgctacagag ttcttgaagt ggtggcctaa ctacggctac 3960
actagaagaa cagtatttgg tatctgcgct ctgctgaagc cagttacctt cggaaaaaga 4020
gttggtagct cttgatccgg caaacaaacc accgctggta gcggtggttt ttttgtttgc 4080
aagcagcaga ttacgcgcag aaaaaaagga tctcaagaag atcctttgat cttttctacg 4140
gggtctgacg ctcagtggaa cgaaaactca cgttaaggga ttttggtcat gagattatca 4200
aaaaggatct tcacctagat ccttttaaat taaaaatgaa gttttaaatc aatctaaagt 4260
atatatgagt aaacttggtc tgacagttac caatgcttaa tcagtgaggc acctatctca 4320
gcgatctgtc tatttcgttc atccatagtt gcctgactcc 4360
<210> 2
<211> 4463
<212> DNA
<213> Homo Sapiens
<400> 2
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagct agcgtagagc cggcgcgatg cacgtgcgct cactgcgagc tgcggcgccg 1260
cacagcttcg tggcgctctg ggcacccctg ttcctgctgc gctccgccct ggccgacttc 1320
agcctggaca acgaggtgca ctcgagcttc atccaccggc gcctccgcag ccaggagcgg 1380
cgggagatgc agcgcgagat cctctccatt ttgggcttgc cccaccgccc gcgcccgcac 1440
ctccagggca agcacaactc ggcacccatg ttcatgctgg acctgtacaa cgccatggcg 1500
gtggaggagg gcggcgggcc cggcggccag ggcttctcct acccctacaa ggccgtcttc 1560
agtacccagg gcccccctct ggccagcctg caagatagcc atttcctcac cgacgccgac 1620
atggtcatga gcttcgtcaa cctcgtggaa catgacaagg aattcttcca cccacgctac 1680
caccatcgag agttccggtt tgatctttcc aagatcccag aaggggaagc tgtcacggca 1740
gccgaattcc ggatctacaa ggactacatc cgggaacgct tcgacaatga gacgttccgg 1800
atcagcgttt atcaggtgct ccaggagcac ttgggcaggg aatcggatct cttcctgctc 1860
gacagccgta ccctctgggc ctcggaggag ggctggctgg tgtttgacat cacagccacc 1920
agcaaccact gggtggtcaa tccgcggcac aacctgggcc tgcagctctc ggtggagacg 1980
ctggatgggc agagcatcaa ccccaagttg gcgggcctga ttgggcggca cgggccccag 2040
aacaagcagc ccttcatggt ggctttcttc aaggccacgg aggtccactt ccgcagcatc 2100
cggtccacgg ggagcaaaca gcgcagccag aaccgctcca agacgcccaa gaaccaggaa 2160
gccctgcgga tggccaacgt ggcagagaac agcagcagcg accagaggca ggcctgtaag 2220
aagcacgagc tgtatgtcag cttccgagac ctgggctggc aggactggat catcgcgcct 2280
gaaggctacg ccgcctacta ctgtgagggg gagtgtgcct tccctctgaa ctcctacatg 2340
aacgccacca accacgccat cgtgcagacg ctggtccact tcatcaaccc ggaaacggtg 2400
cccaagccct gctgtgcgcc cacgcagctc aatgccatct ccgtcctcta cttcgatgac 2460
agctccaacg tcatcctgaa gaaatacaga aacatggtgg tccgggcctg tggctgccac 2520
tagaagcttg gtaccgaatt ccctgtgacc cctccccagt gcctctcctg gccctggaag 2580
ttgccactcc agtgcccacc agccttgtcc taataaaatt aagttgcatc attttgtctg 2640
actaggtgtc cttctataat attatggggt ggaggggggt ggtatggagc aaggggcaag 2700
ttgggaagac aacctgtagg gcctgcgggg tctattggga accaagctgg agtgcagtgg 2760
cacaatcttg gctcactgca atctccgcct cctgggttca agcgattctc ctgcctcagc 2820
ctcccgagtt gttgggattc caggcatgca tgaccaggct cagctaattt ttgttttttt 2880
ggtagagacg gggtttcacc atattggcca ggctggtctc caactcctaa tctcaggtga 2940
tctacccacc ttggcctccc aaattgctgg gattacaggc gtgaaccact gctcccttcc 3000
ctgtccttac gcgtagaatt ggtaaagaga gtcgtgtaaa atatcgagtt cgcacatctt 3060
gttgtctgat tattgatttt tggcgaaacc atttgatcat atgacaagat gtgtatctac 3120
cttaacttaa tgattttgat aaaaatcatt aactagtcca tggctgcctc gcgcgtttcg 3180
gtgatgacgg tgaaaacctc tgacacatgc agctcccgga gacggtcaca gcttgtctgt 3240
aagcggatgc cgggagcaga caagcccgtc agggcgcgtc agcgggtgtt ggcgggtgtc 3300
ggggcgcagc catgacccag tcacgtagcg atagcggagt gtatactggc ttaactatgc 3360
ggcatcagag cagattgtac tgagagtgca ccatatgcgg tgtgaaatac cgcacagatg 3420
cgtaaggaga aaataccgca tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg 3480
ctcggtcgtt cggctgcggc gagcggtatc agctcactca aaggcggtaa tacggttatc 3540
cacagaatca ggggataacg caggaaagaa catgtgagca aaaggccagc aaaaggccag 3600
gaaccgtaaa aaggccgcgt tgctggcgtt tttccatagg ctccgccccc ctgacgagca 3660
tcacaaaaat cgacgctcaa gtcagaggtg gcgaaacccg acaggactat aaagatacca 3720
ggcgtttccc cctggaagct ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg 3780
atacctgtcc gcctttctcc cttcgggaag cgtggcgctt tctcatagct cacgctgtag 3840
gtatctcagt tcggtgtagg tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt 3900
tcagcccgac cgctgcgcct tatccggtaa ctatcgtctt gagtccaacc cggtaagaca 3960
cgacttatcg ccactggcag cagccactgg taacaggatt agcagagcga ggtatgtagg 4020
cggtgctaca gagttcttga agtggtggcc taactacggc tacactagaa gaacagtatt 4080
tggtatctgc gctctgctga agccagttac cttcggaaaa agagttggta gctcttgatc 4140
cggcaaacaa accaccgctg gtagcggtgg tttttttgtt tgcaagcagc agattacgcg 4200
cagaaaaaaa ggatctcaag aagatccttt gatcttttct acggggtctg acgctcagtg 4260
gaacgaaaac tcacgttaag ggattttggt catgagatta tcaaaaagga tcttcaccta 4320
gatcctttta aattaaaaat gaagttttaa atcaatctaa agtatatatg agtaaacttg 4380
gtctgacagt taccaatgct taatcagtga ggcacctatc tcagcgatct gtctatttcg 4440
ttcatccata gttgcctgac tcc 4463
<210> 3
<211> 4348
<212> DNA
<213> Homo Sapiens
<400> 3
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatga acaacttgct gtgctgcgcg ctcgtgtttc tggacatctc 1260
cattaagtgg accacccagg aaacgtttcc tccaaagtac cttcattatg acgaagaaac 1320
ctctcatcag ctgttgtgtg acaaatgtcc tcctggtacc tacctaaaac aacactgtac 1380
agcaaagtgg aagaccgtgt gcgccccttg ccctgaccac tactacacag acagctggca 1440
caccagtgac gagtgtctat actgcagccc cgtgtgcaag gagctgcagt acgtcaagca 1500
ggagtgcaat cgcacccaca accgcgtgtg cgaatgcaag gaagggcgct accttgagat 1560
agagttctgc ttgaaacata ggagctgccc tcctggattt ggagtggtgc aagctggaac 1620
cccagagcga aatacagttt gcaaaagatg tccagatggg ttcttctcaa atgagacgtc 1680
atctaaagca ccctgtagaa aacacacaaa ttgcagtgtc tttggtctcc tgctaactca 1740
gaaaggaaat gcaacacacg acaacatatg ttccggaaac agtgaatcaa ctcaaaaatg 1800
tggaatagat gttaccctgt gtgaggaggc attcttcagg tttgctgttc ctacaaagtt 1860
tacgcctaac tggcttagtg tcttggtaga caatttgcct ggcaccaaag taaacgcaga 1920
gagtgtagag aggataaaac ggcaacacag ctcacaagaa cagactttcc agctgctgaa 1980
gttatggaaa catcaaaaca aagaccaaga tatagtcaag aagatcatcc aagatattga 2040
cctctgtgaa aacagcgtgc agcggcacat tggacatgct aacctcacct tcgagcagct 2100
tcgtagcttg atggaaagct taccgggaaa gaaagtggga gcagaagaca ttgaaaaaac 2160
aataaaggca tgcaaaccca gtgaccagat cctgaagctg ctcagtttgt ggcgaataaa 2220
aaatggcgac caagacacct tgaagggcct aatgcacgca ctaaagcatt caaagacgta 2280
ccactttccc aaaactgtca ctcagagtct aaagaagacc atcaggttcc ttcacagctt 2340
cacaatgtac aaattgtatc agaagttatt tttagaaatg ataggtaacc aggtccaatc 2400
agtaaaaata agctgcttat gaattccctg tgacccctcc ccagtgcctc tcctggccct 2460
ggaagttgcc actccagtgc ccaccagcct tgtcctaata aaattaagtt gcatcatttt 2520
gtctgactag gtgtccttct ataatattat ggggtggagg ggggtggtat ggagcaaggg 2580
gcaagttggg aagacaacct gtagggcctg cggggtctat tgggaaccaa gctggagtgc 2640
agtggcacaa tcttggctca ctgcaatctc cgcctcctgg gttcaagcga ttctcctgcc 2700
tcagcctccc gagttgttgg gattccaggc atgcatgacc aggctcagct aatttttgtt 2760
tttttggtag agacggggtt tcaccatatt ggccaggctg gtctccaact cctaatctca 2820
ggtgatctac ccaccttggc ctcccaaatt gctgggatta caggcgtgaa ccactgctcc 2880
cttccctgtc cttacgcgta gaattggtaa agagagtcgt gtaaaatatc gagttcgcac 2940
atcttgttgt ctgattattg atttttggcg aaaccatttg atcatatgac aagatgtgta 3000
tctaccttaa cttaatgatt ttgataaaaa tcattaacta gtccatggct gcctcgcgcg 3060
tttcggtgat gacggtgaaa acctctgaca catgcagctc ccggagacgg tcacagcttg 3120
tctgtaagcg gatgccggga gcagacaagc ccgtcagggc gcgtcagcgg gtgttggcgg 3180
gtgtcggggc gcagccatga cccagtcacg tagcgatagc ggagtgtata ctggcttaac 3240
tatgcggcat cagagcagat tgtactgaga gtgcaccata tgcggtgtga aataccgcac 3300
agatgcgtaa ggagaaaata ccgcatcagg cgctcttccg cttcctcgct cactgactcg 3360
ctgcgctcgg tcgttcggct gcggcgagcg gtatcagctc actcaaaggc ggtaatacgg 3420
ttatccacag aatcagggga taacgcagga aagaacatgt gagcaaaagg ccagcaaaag 3480
gccaggaacc gtaaaaaggc cgcgttgctg gcgtttttcc ataggctccg cccccctgac 3540
gagcatcaca aaaatcgacg ctcaagtcag aggtggcgaa acccgacagg actataaaga 3600
taccaggcgt ttccccctgg aagctccctc gtgcgctctc ctgttccgac cctgccgctt 3660
accggatacc tgtccgcctt tctcccttcg ggaagcgtgg cgctttctca tagctcacgc 3720
tgtaggtatc tcagttcggt gtaggtcgtt cgctccaagc tgggctgtgt gcacgaaccc 3780
cccgttcagc ccgaccgctg cgccttatcc ggtaactatc gtcttgagtc caacccggta 3840
agacacgact tatcgccact ggcagcagcc actggtaaca ggattagcag agcgaggtat 3900
gtaggcggtg ctacagagtt cttgaagtgg tggcctaact acggctacac tagaagaaca 3960
gtatttggta tctgcgctct gctgaagcca gttaccttcg gaaaaagagt tggtagctct 4020
tgatccggca aacaaaccac cgctggtagc ggtggttttt ttgtttgcaa gcagcagatt 4080
acgcgcagaa aaaaaggatc tcaagaagat cctttgatct tttctacggg gtctgacgct 4140
cagtggaacg aaaactcacg ttaagggatt ttggtcatga gattatcaaa aaggatcttc 4200
acctagatcc ttttaaatta aaaatgaagt tttaaatcaa tctaaagtat atatgagtaa 4260
acttggtctg acagttacca atgcttaatc agtgaggcac ctatctcagc gatctgtcta 4320
tttcgttcat ccatagttgc ctgactcc 4348
<210> 4
<211> 3733
<212> DNA
<213> Homo Sapiens
<400> 4
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatga ggaccttggc ttgcctgctg ctcctcggct gcggatacct 1260
cgcccatgtt ctggccgagg aagccgagat cccccgcgag gtgatcgaga ggctggcccg 1320
cagtcagatc cacagcatcc gggacctcca gcgactcctg gagatagact ccgtagggag 1380
tgaggattct ttggacacca gcctgagagc tcacggggtc catgccacta agcatgtgcc 1440
cgagaagcgg cccctgccca ttcggaggaa gagaagcatc gaggaagctg tccccgctgt 1500
ctgcaagacc aggacggtca tttacgagat tcctcggagt caggtcgacc ccacgtccgc 1560
caacttcctg atctggcccc cgtgcgtgga ggtgaaacgc tgcaccggct gctgcaacac 1620
gagcagtgtc aagtgccagc cctcccgcgt ccaccaccgc agcgtcaagg tggccaaggt 1680
ggaatacgtc aggaagaagc caaaattaaa agaagtccag gtgaggttag aggagcattt 1740
ggagtgcgcc tgcgcgacca caagcctgaa tccggattat cgggaagagg acacggatgt 1800
gaggtgaatt ccctgtgacc cctccccagt gcctctcctg gccctggaag ttgccactcc 1860
agtgcccacc agccttgtcc taataaaatt aagttgcatc attttgtctg actaggtgtc 1920
cttctataat attatggggt ggaggggggt ggtatggagc aaggggcaag ttgggaagac 1980
aacctgtagg gcctgcgggg tctattggga accaagctgg agtgcagtgg cacaatcttg 2040
gctcactgca atctccgcct cctgggttca agcgattctc ctgcctcagc ctcccgagtt 2100
gttgggattc caggcatgca tgaccaggct cagctaattt ttgttttttt ggtagagacg 2160
gggtttcacc atattggcca ggctggtctc caactcctaa tctcaggtga tctacccacc 2220
ttggcctccc aaattgctgg gattacaggc gtgaaccact gctcccttcc ctgtccttac 2280
gcgtagaatt ggtaaagaga gtcgtgtaaa atatcgagtt cgcacatctt gttgtctgat 2340
tattgatttt tggcgaaacc atttgatcat atgacaagat gtgtatctac cttaacttaa 2400
tgattttgat aaaaatcatt aactagtcca tggctgcctc gcgcgtttcg gtgatgacgg 2460
tgaaaacctc tgacacatgc agctcccgga gacggtcaca gcttgtctgt aagcggatgc 2520
cgggagcaga caagcccgtc agggcgcgtc agcgggtgtt ggcgggtgtc ggggcgcagc 2580
catgacccag tcacgtagcg atagcggagt gtatactggc ttaactatgc ggcatcagag 2640
cagattgtac tgagagtgca ccatatgcgg tgtgaaatac cgcacagatg cgtaaggaga 2700
aaataccgca tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt 2760
cggctgcggc gagcggtatc agctcactca aaggcggtaa tacggttatc cacagaatca 2820
ggggataacg caggaaagaa catgtgagca aaaggccagc aaaaggccag gaaccgtaaa 2880
aaggccgcgt tgctggcgtt tttccatagg ctccgccccc ctgacgagca tcacaaaaat 2940
cgacgctcaa gtcagaggtg gcgaaacccg acaggactat aaagatacca ggcgtttccc 3000
cctggaagct ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc 3060
gcctttctcc cttcgggaag cgtggcgctt tctcatagct cacgctgtag gtatctcagt 3120
tcggtgtagg tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt tcagcccgac 3180
cgctgcgcct tatccggtaa ctatcgtctt gagtccaacc cggtaagaca cgacttatcg 3240
ccactggcag cagccactgg taacaggatt agcagagcga ggtatgtagg cggtgctaca 3300
gagttcttga agtggtggcc taactacggc tacactagaa gaacagtatt tggtatctgc 3360
gctctgctga agccagttac cttcggaaaa agagttggta gctcttgatc cggcaaacaa 3420
accaccgctg gtagcggtgg tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa 3480
ggatctcaag aagatccttt gatcttttct acggggtctg acgctcagtg gaacgaaaac 3540
tcacgttaag ggattttggt catgagatta tcaaaaagga tcttcaccta gatcctttta 3600
aattaaaaat gaagttttaa atcaatctaa agtatatatg agtaaacttg gtctgacagt 3660
taccaatgct taatcagtga ggcacctatc tcagcgatct gtctatttcg ttcatccata 3720
gttgcctgac tcc 3733
<210> 5
<211> 3733
<212> DNA
<213> Homo Sapiens
<400> 5
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tgaatcgctg ctgggcgctc ttcctgtctc 1260
tctgctgcta cctgcgtctg gtcagcgccg agggggaccc cattcccgag gagctttatg 1320
agatgctgag tgaccactcg atccgctcct ttgatgatct ccaacgcctg ctgcacggag 1380
accccggaga ggaagatggg gccgagttgg acctgaacat gacccgctcc cactctggag 1440
gcgagctgga gagcttggct cgtggaagaa ggagcctggg ttccctgacc attgctgagc 1500
cggccatgat cgccgagtgc aagacgcgca ccgaggtgtt cgagatctcc cggcgcctca 1560
tagaccgcac caacgccaac ttcctggtgt ggccgccctg tgtggaggtg cagcgctgct 1620
ccggctgctg caacaaccgc aacgtgcagt gccgccccac ccaggtgcag ctgcgacctg 1680
tccaggtgag aaagatcgag attgtgcgga agaagccaat ctttaagaag gccacggtga 1740
cgctggaaga ccacctggca tgcaagtgtg agacagtggc agctgcacgg cctgtgaccc 1800
gaagcccggg gggttcccag gagcagcgag ccaaaacgcc ccaaactcgg gtgaccattc 1860
ggacggtgcg agtccgccgg ccccccaagg gcaagcaccg gaaattcaag cacacgcatg 1920
acaagacggc actgaaggag acccttggag cctaggtacc gaattccctg tgacccctcc 1980
ccagtgcctc tcctggccct ggaagttgcc actccagtgc ccaccagcct tgtcctaata 2040
aaattaagtt gcatcatttt gtctgactag gtgtccttct ataatattat ggggtggagg 2100
ggggtggtat ggagcaaggg gcaagttggg aagacaacct gtagggcctg cggggtctat 2160
tgggaaccaa gctggagtgc agtggcacaa tcttggctca ctgcaatctc cgcctcctgg 2220
gttcaagcga ttctcctgcc tcagcctccc gagttgttgg gattccaggc atgcatgacc 2280
aggctcagct aatttttgtt tttttggtag agacggggtt tcaccatatt ggccaggctg 2340
gtctccaact cctaatctca ggtgatctac ccaccttggc ctcccaaatt gctgggatta 2400
caggcgtgaa ccactgctcc cttccctgtc cttacgcgta gaattggtaa agagagtcgt 2460
gtaaaatatc gagttcgcac atcttgttgt ctgattattg atttttggcg aaaccatttg 2520
atcatatgac aagatgtgta tctaccttaa cttaatgatt ttgataaaaa tcattaacta 2580
gtccatggct gcctcgcgcg tttcggtgat gacggtgaaa acctctgaca catgcagctc 2640
ccggagacgg tcacagcttg tctgtaagcg gatgccggga gcagacaagc ccgtcagggc 2700
gcgtcagcgg gtgttggcgg gtgtcggggc gcagccatga cccagtcacg tagcgatagc 2760
ggagtgtata ctggcttaac tatgcggcat cagagcagat tgtactgaga gtgcaccata 2820
tgcggtgtga aataccgcac agatgcgtaa ggagaaaata ccgcatcagg cgctcttccg 2880
cttcctcgct cactgactcg ctgcgctcgg tcgttcggct gcggcgagcg gtatcagctc 2940
actcaaaggc ggtaatacgg ttatccacag aatcagggga taacgcagga aagaacatgt 3000
gagcaaaagg ccagcaaaag gccaggaacc gtaaaaaggc cgcgttgctg gcgtttttcc 3060
ataggctccg cccccctgac gagcatcaca aaaatcgacg ctcaagtcag aggtggcgaa 3120
acccgacagg actataaaga taccaggcgt ttccccctgg aagctccctc gtgcgctctc 3180
ctgttccgac cctgccgctt accggatacc tgtccgcctt tctcccttcg ggaagcgtgg 3240
cgctttctca tagctcacgc tgtaggtatc tcagttcggt gtaggtcgtt cgctccaagc 3300
tgggctgtgt gcacgaaccc cccgttcagc ccgaccgctg cgccttatcc ggtaactatc 3360
gtcttgagtc caacccggta agacacgact tatcgccact ggcagcagcc actggtaaca 3420
ggattagcag agcgaggtat gtaggcggtg ctacagagtt cttgaagtgg tggcctaact 3480
acggctacac tagaagaaca gtatttggta tctgcgctct gctgaagcca gttaccttcg 3540
gaaaaagagt tggtagctct tgatccggca aacaaaccac cgctggtagc ggtggttttt 3600
ttgtttgcaa gcagcagatt acgcgcagaa aaaaaggatc tcaagaagat cctttgatct 3660
tttctacggg gtctgacgct cagtggaacg aaaactcacg ttaagggatt ttggtcatga 3720
gattatcaaa aaggatcttc acctagatcc ttttaaatta aaaatgaagt tttaaatcaa 3780
tctaaagtat atatgagtaa acttggtctg acagttacca atgcttaatc agtgaggcac 3840
ctatctcagc gatctgtcta tttcgttcat ccatagttgc ctgactcc 3888
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ОЛИГОНУКЛЕОТИДОВ
BMP2_F ACAGCTAGCCTCCTAAAGGTCCACCATGGT
BMP2_R TATAAGCTTCTAGCGACACCCACAACCCT
BMP2_SF ATGCAAGCAGGTGGGAAAGT
BMP2_SR GGGAGCCACAATCCAGTCAT
BMP7_F TCAGCTAGCGTAGAGCCGGCGCGATGCA
BMP7_R TATAAGCTTCTAGTGGCAGCCACAGGC
BMP7_SF GCTGGCTGGTGTTTGACATC
BMP7_SR TGGTGGCGTTCATGTAGGAG
OPG_F AGGATCCACCATGAACAACTTGCTGTGCTGC
OPG_R ATAGAATTCATAAGCAGCTTATTTTTACTGATTG
OPG_SF CTACACAGACAGCTGGCACA
OPG_FR CTCCAAATCCAGGAGGGCAG
PDGFA_F AGGATCCACCATGAGGACCTTGGCTTGCCT
PDGFA_R TATGAATTCACCTCACATCCGTGTCCTCT
PDGFA_SF CTGCCCATTCGGAGGAAGAG
PDGFA_FR CTTGACACTGCTCGTGTTGC
PDGFB_F TATGTCGACCACCATGAATCGCTGCTGGGCGCT
PDGFB_R TATGGTACCTAGGCTCCAAGGGTCTCCTTC
PDGFB_SF CGCTCTTCCTGTCTCTCTGC
PDGFB_FR CGGGTCATGTTCAGGTCCAA
<---
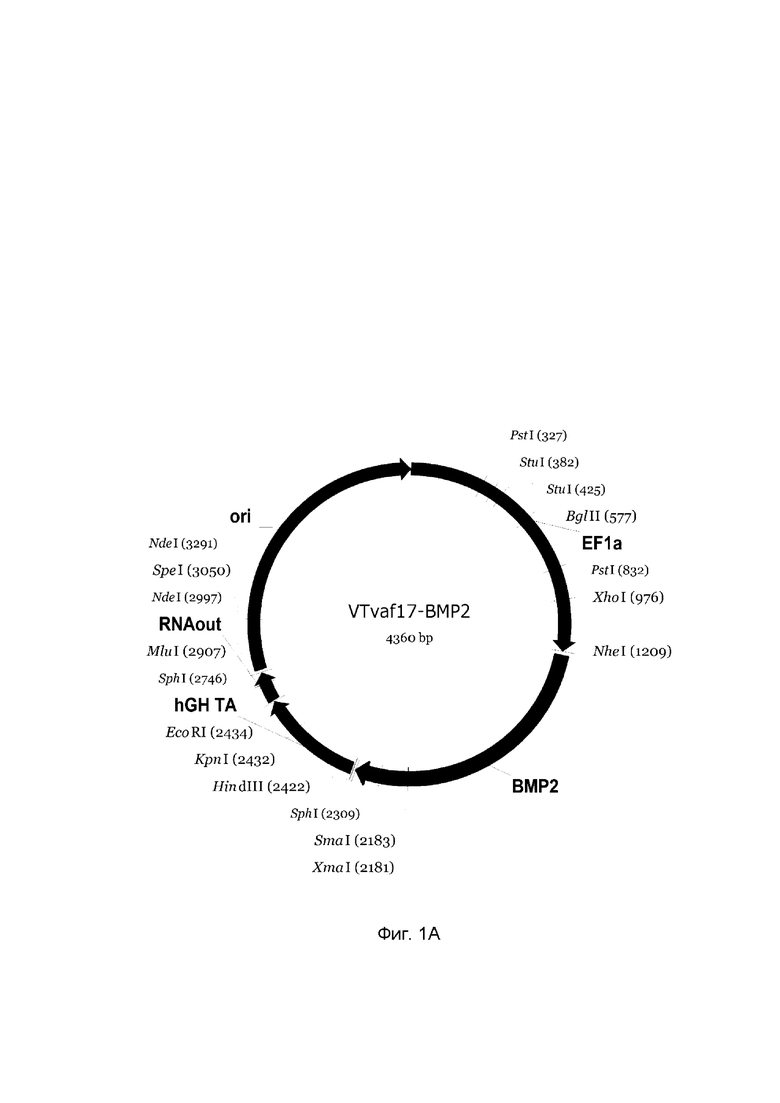

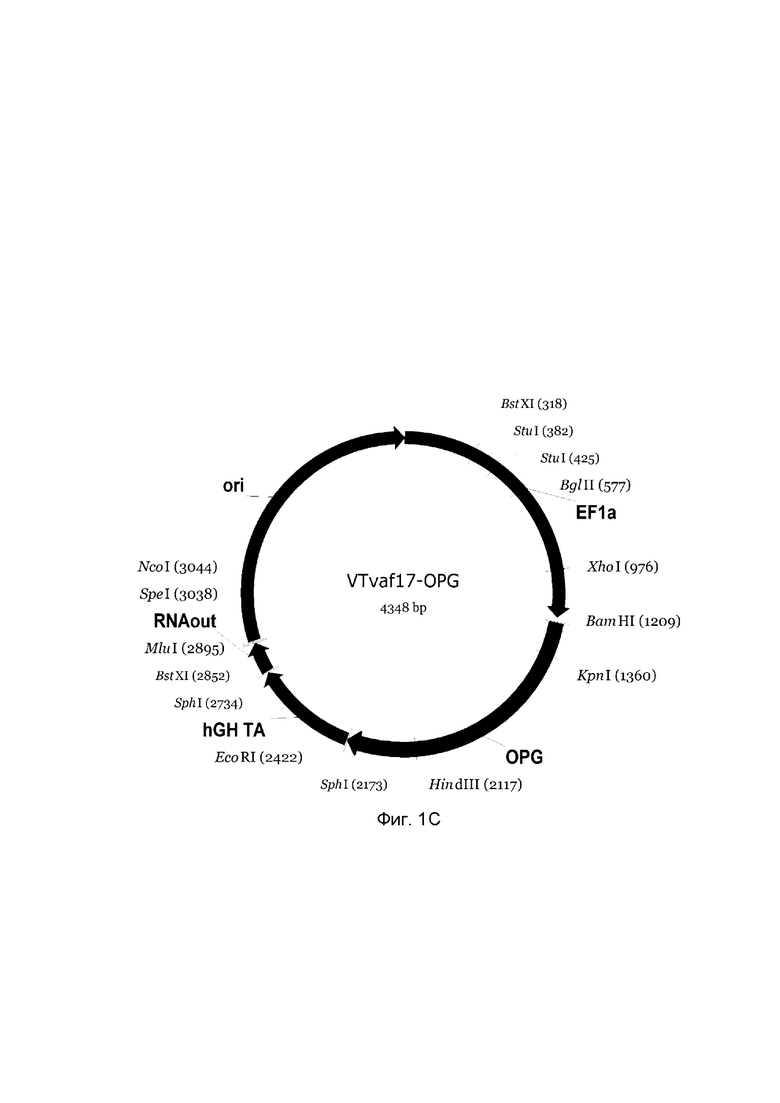
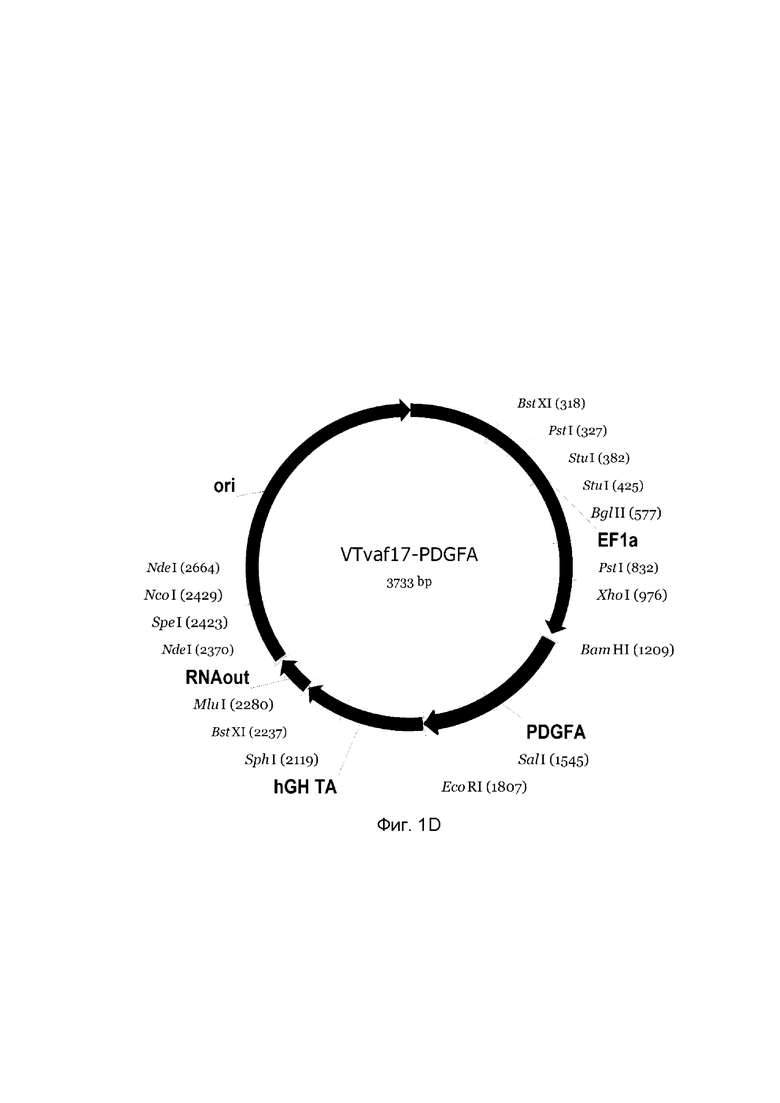
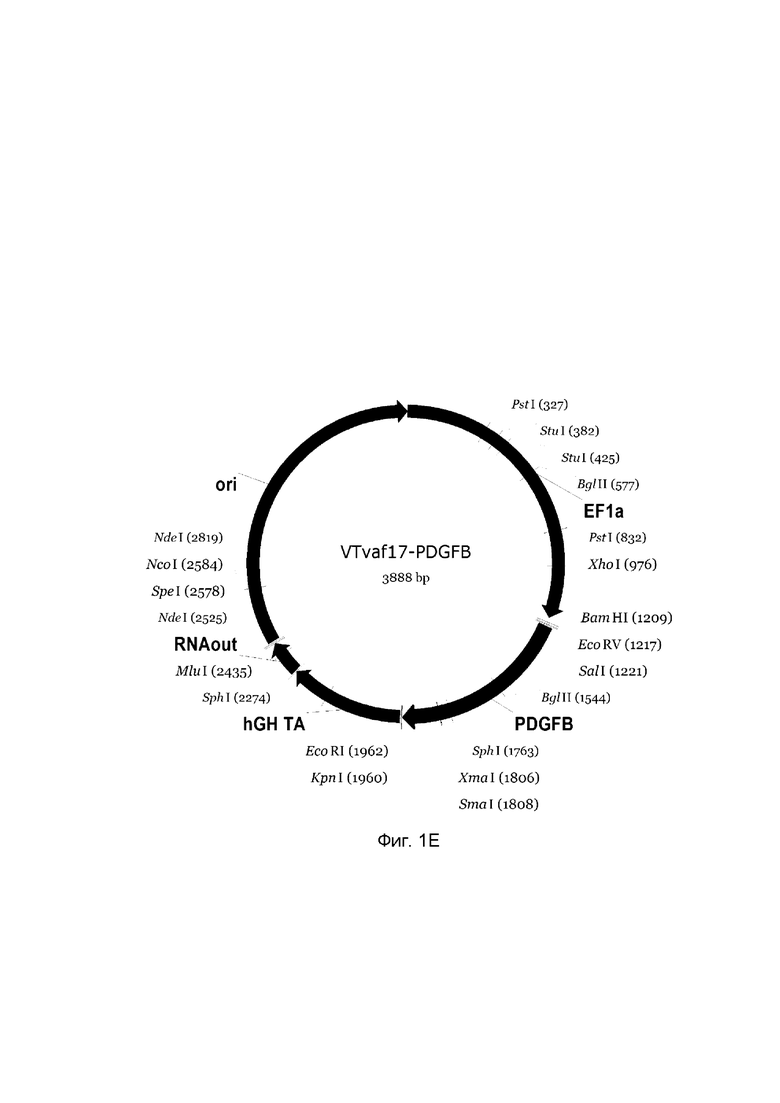
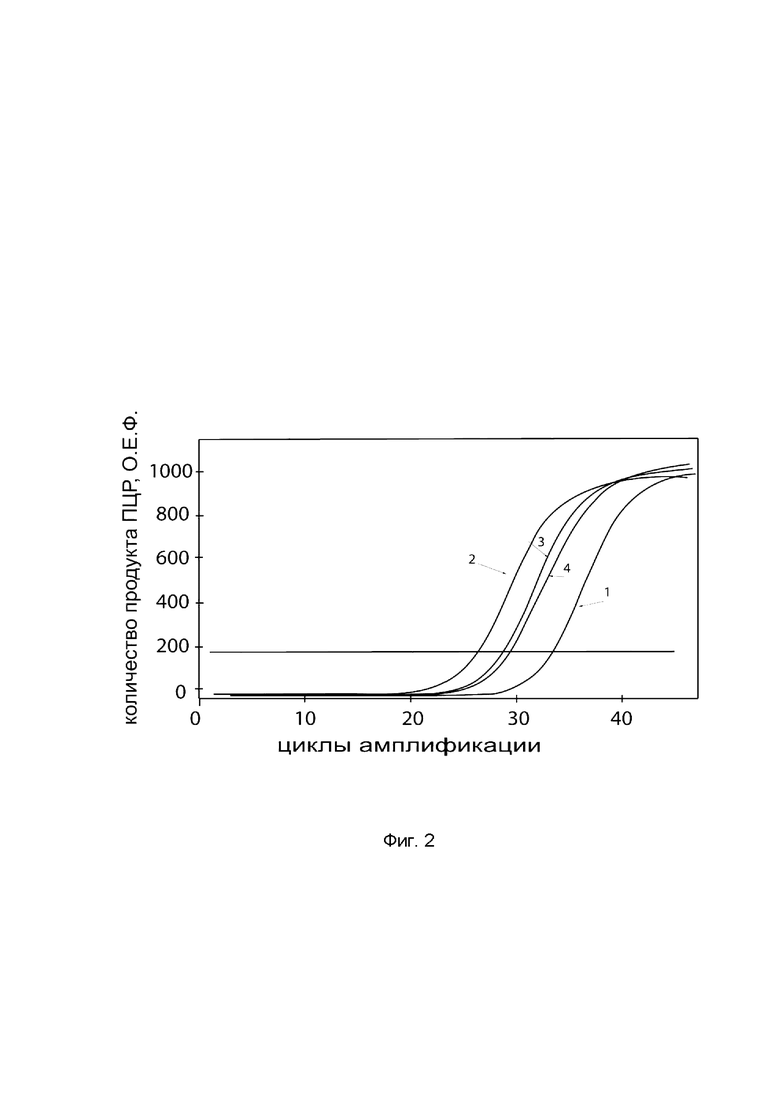
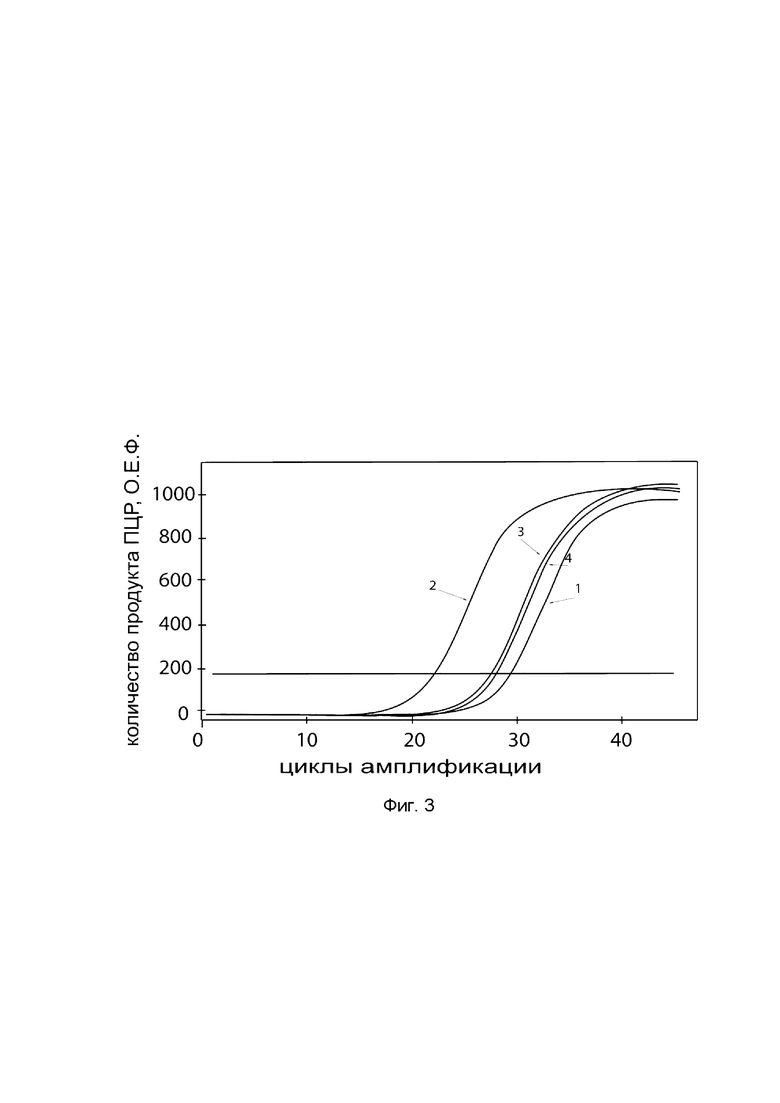
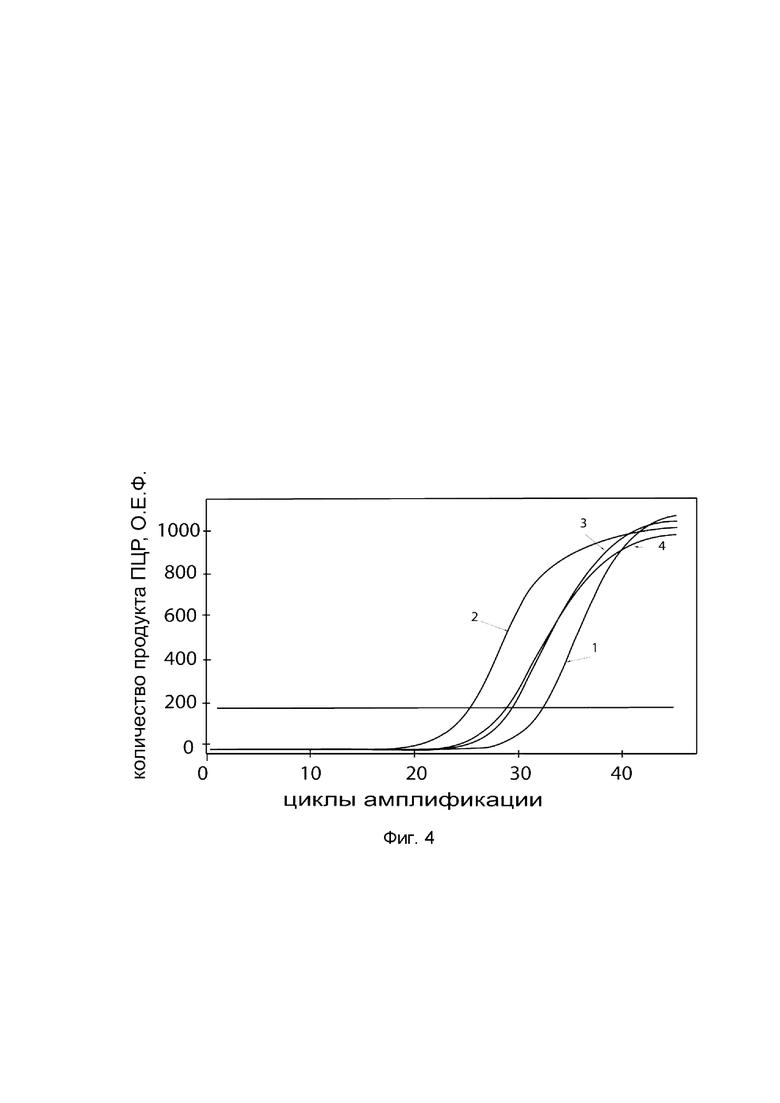

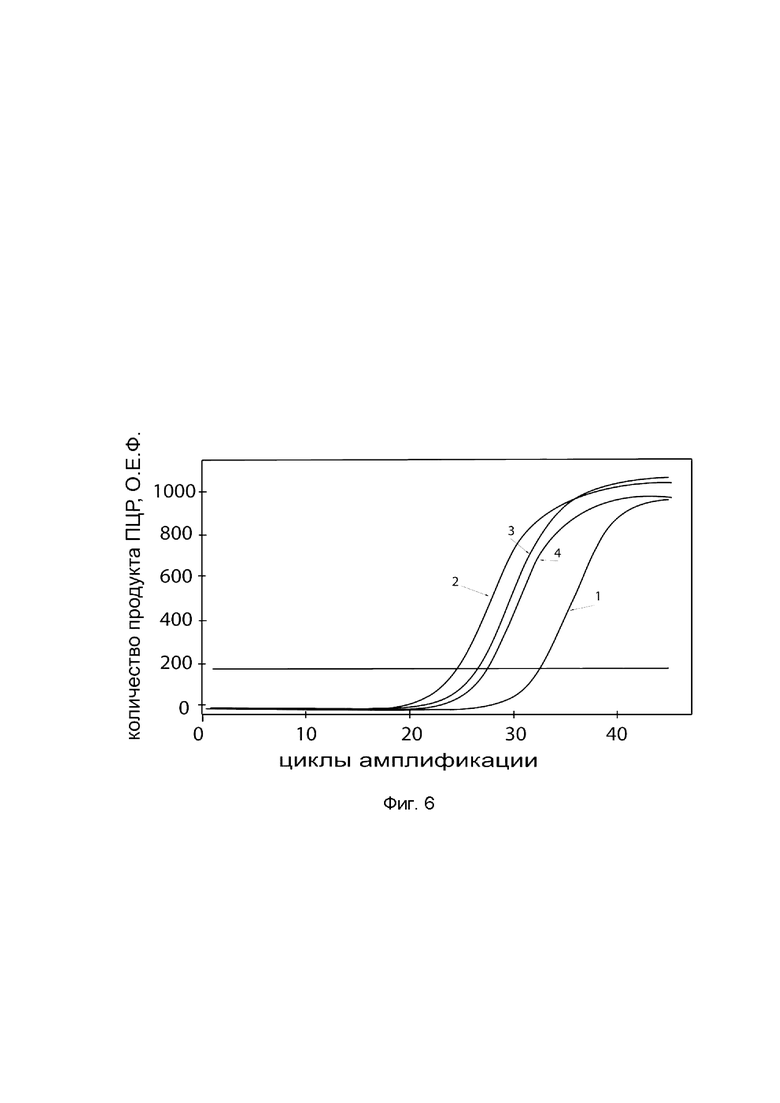

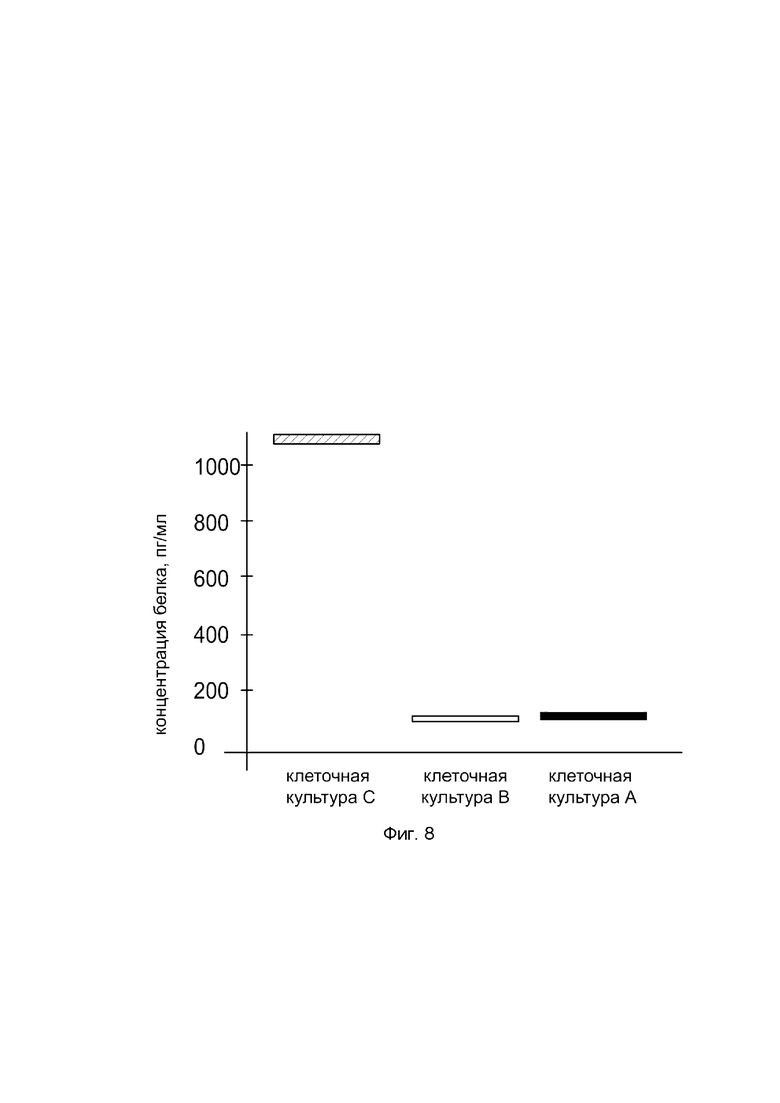
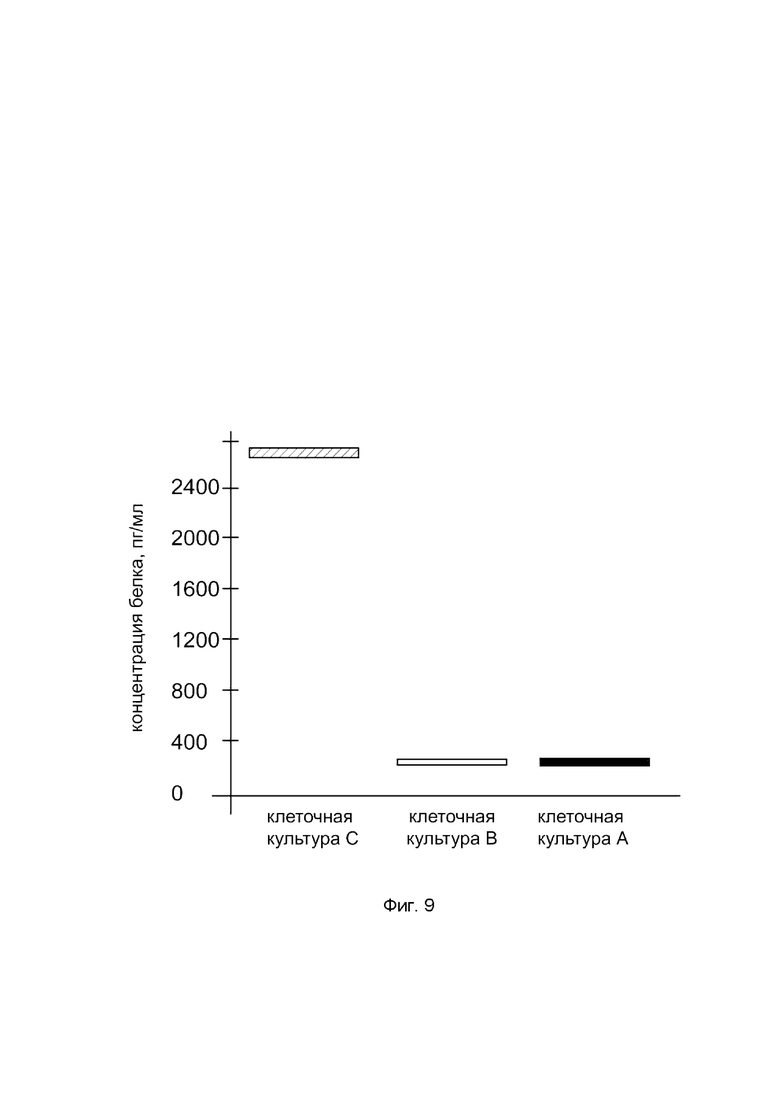
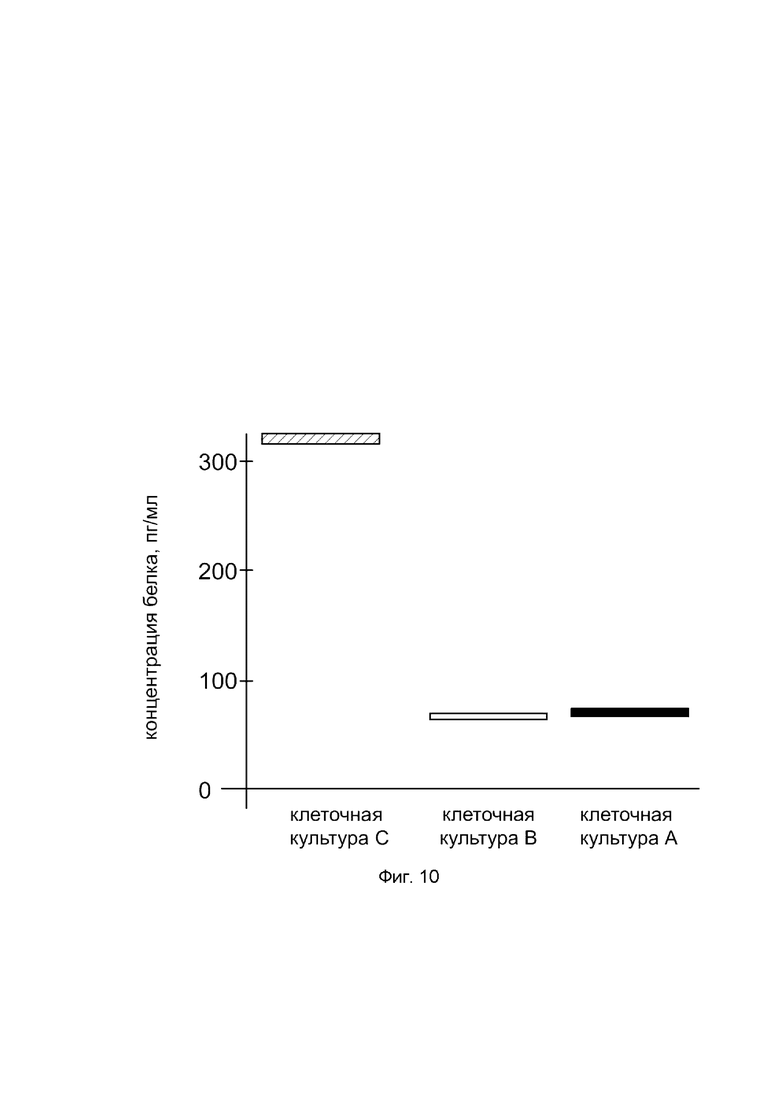
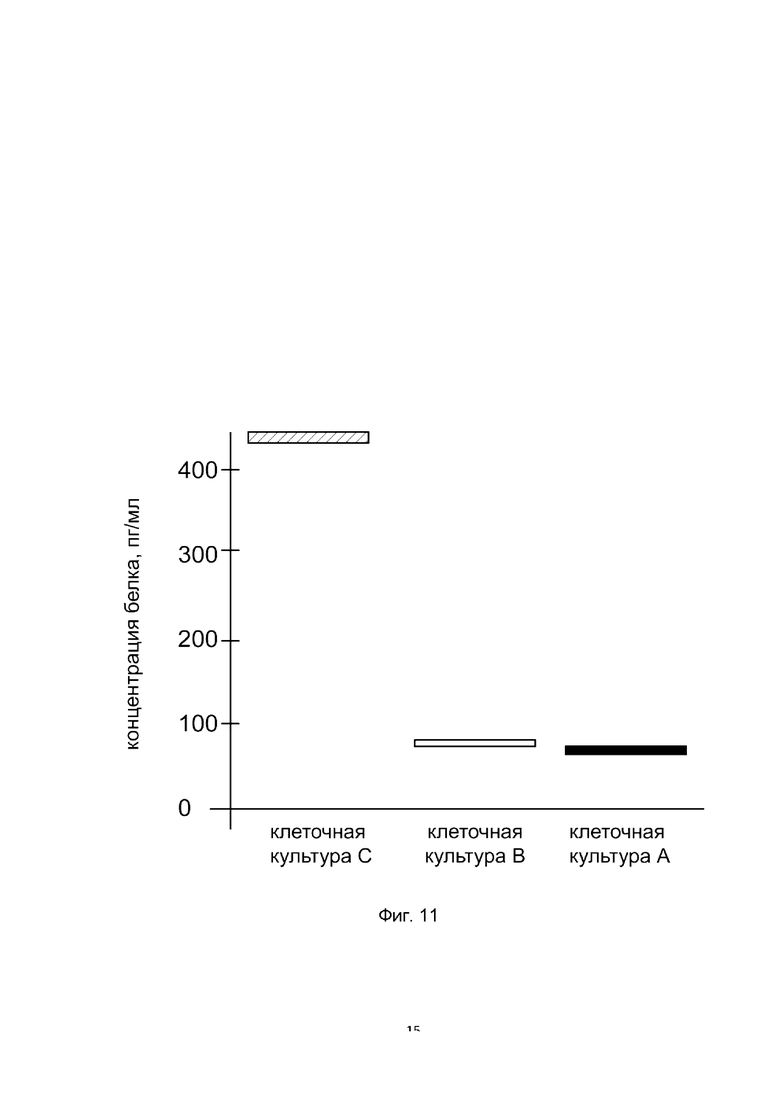

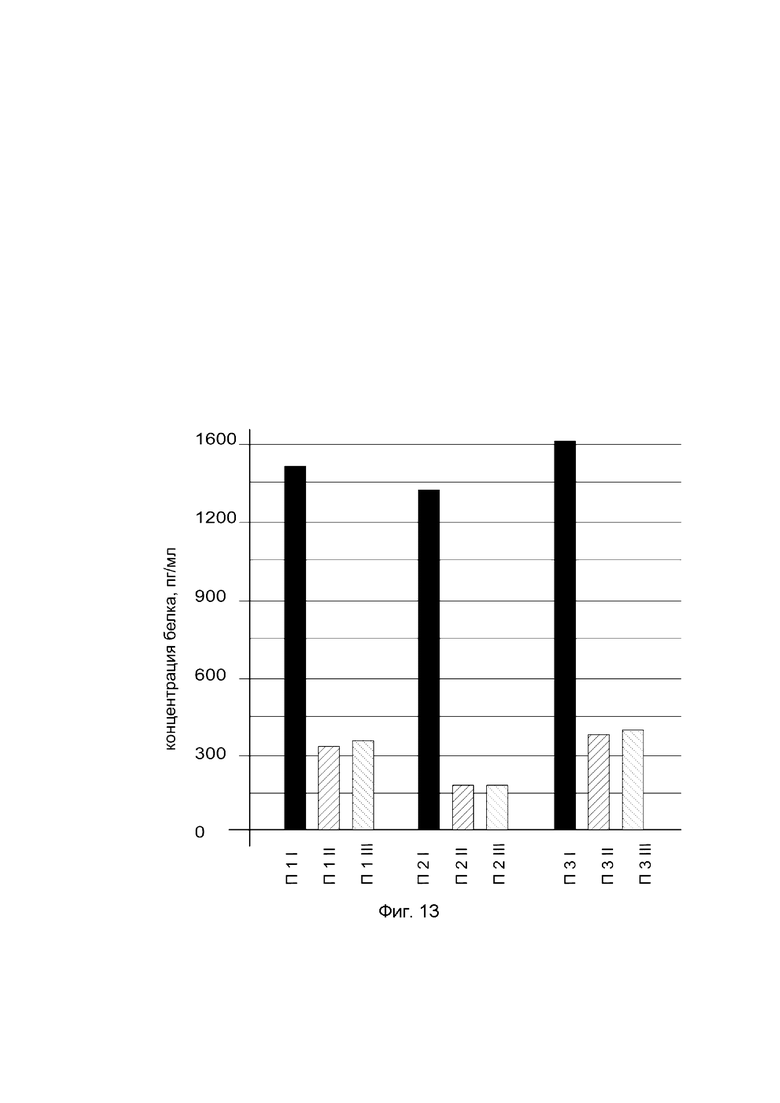
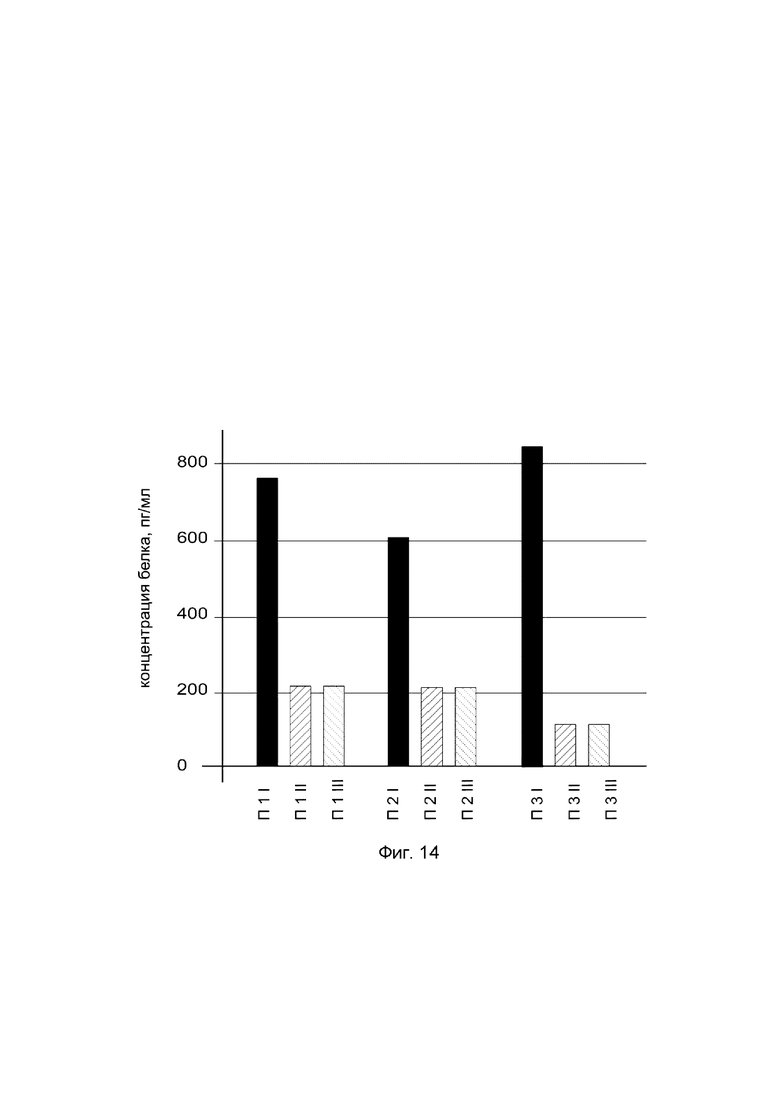
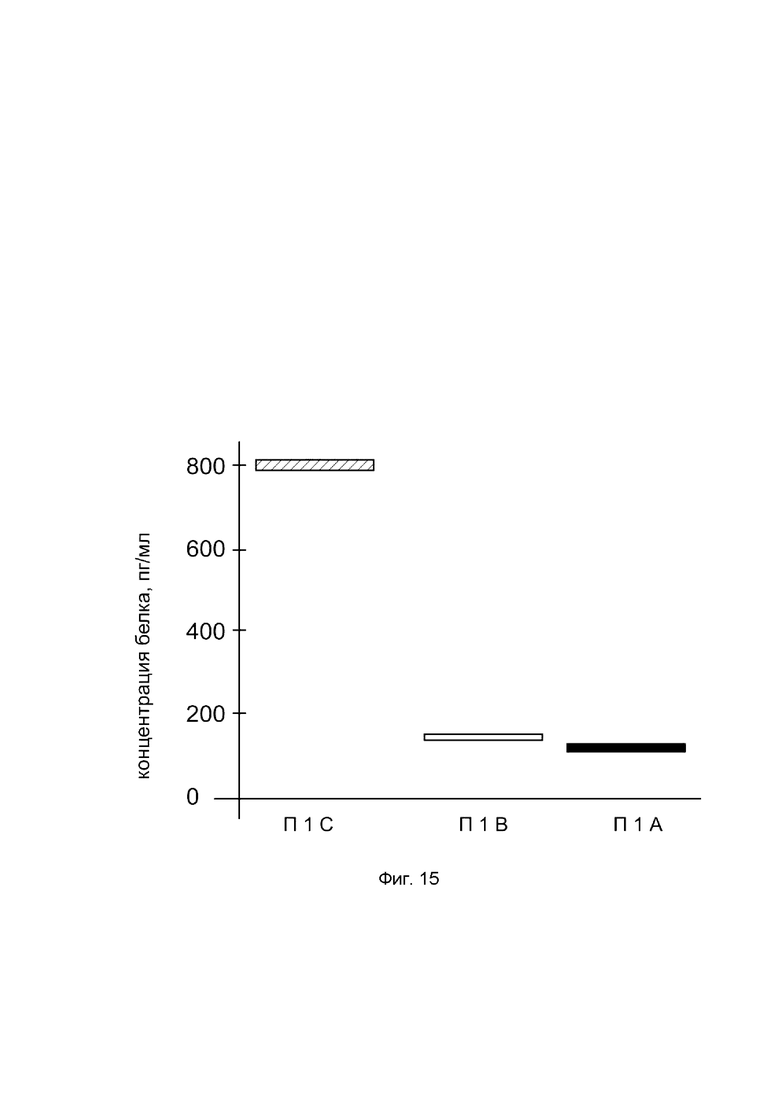
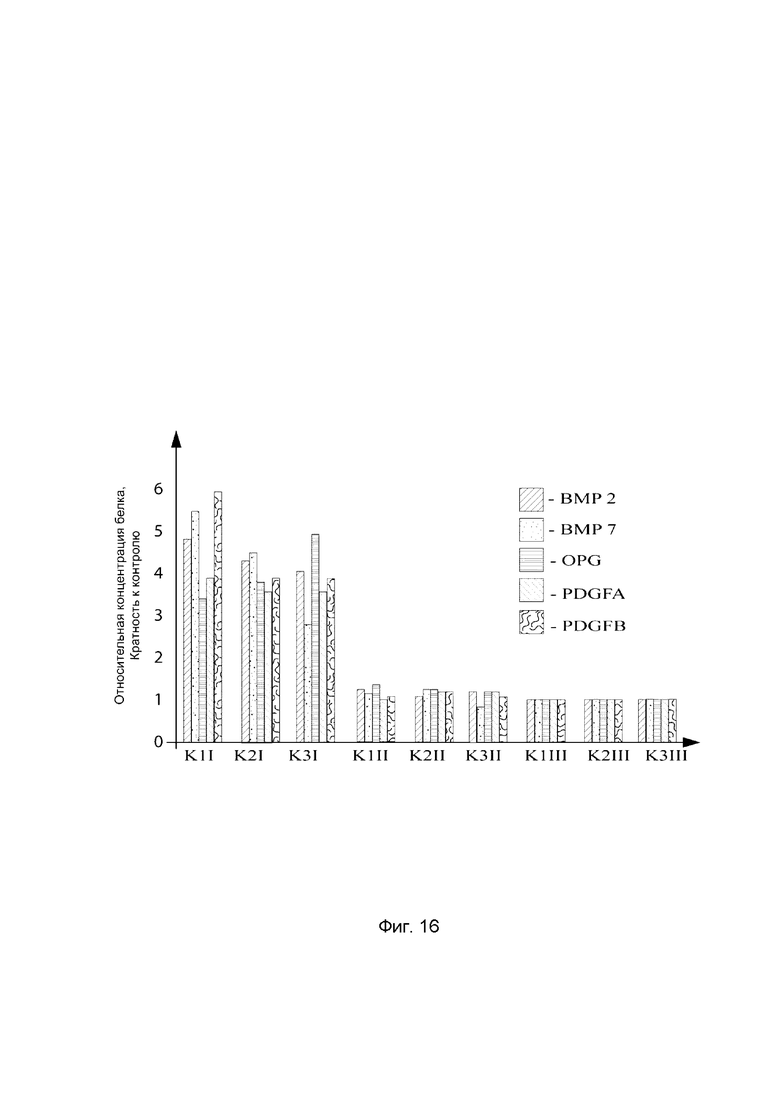
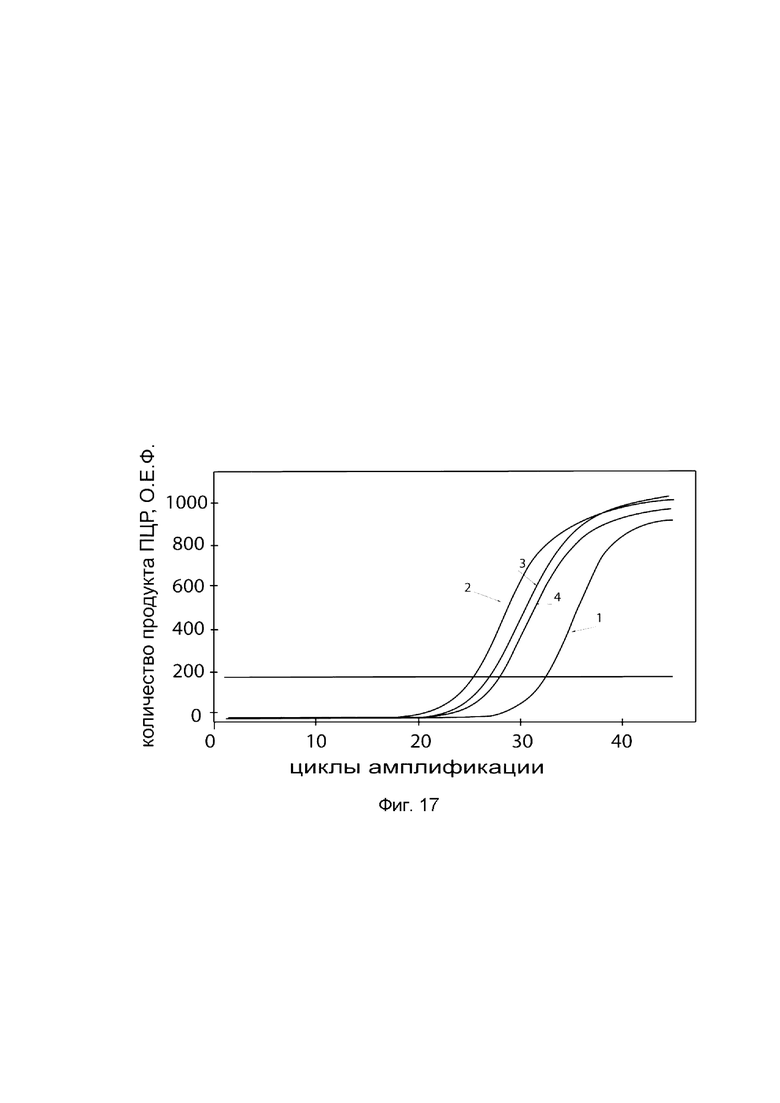
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии. Предложен генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов OPG, PDGFA, PDGFB для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии. При этом генотерапевтический ДНК-вектор VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB имеет нуклеотидную последовательность SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно. Предложены также способ получения указанного вектора, применение вектора, штамм Escherichia coli, несущий указанный вектор, а также способ производства в промышленных масштабах указанного вектора. Изобретение может быть использовано для безопасного применения для генетической терапии человека и животных. 10 н. и 2 з.п. ф-лы, 17 ил., 23 пр.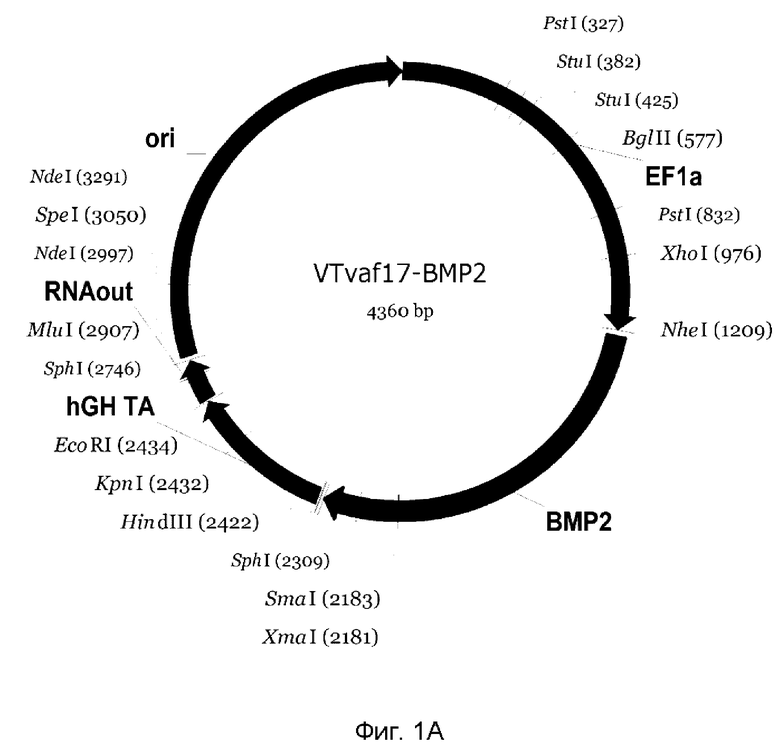
1. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена OPG, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-OPG, с нуклеотидной последовательностью SEQ ID №3.
2. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена PDGFA, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-PDGFA, с нуклеотидной последовательностью SEQ ID №4.
3. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена PDGFB, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-PDGFB, с нуклеотидной последовательностью SEQ ID №5.
4. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген OPG или PDGFA, или PDGFB по пп. 1, или 2, или 3, отличающийся тем, что каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB по пп. 1, или 2, или 3, за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки человека и животных и экспрессировать клонированный в него целевой ген OPG, или PDGFA, или PDGFB.
5. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген OPG, или PDGFA, или PDGFB по пп. 1, или 2, или 3, отличающийся тем, что в составе каждого из созданных генотерапевтических ДНК-векторов: VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB по пп. 1, или 2, или 3, в качестве структурных элементов используют нуклеотидные последовательности, которые не являются генами антибиотикорезистентности, вирусными генами и регуляторными элементами вирусных геномов, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
6. Способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген OPG, или PDGFA, или PDGFB по пп. 1, или 2, или 3, заключающийся в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17-OPG, или VTvaf17-PDGFA, или VTvaf17-PDGFB получают следующим образом: кодирующую часть целевого гена OPG, или PDGFA, или PDGFB клонируют в генотерапевтический ДНК-вектор VTvaf17 и получают генотерапевтический VTvaf17-OPG, SEQ ID №3, или VTvaf17-PDGFA, SEQ ID №4, или VTvaf17-PDGFB, SEQ ID №5 соответственно, при этом кодирующую часть целевого гена OPG, или PDGFA, или PDGFB получают путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщеплением продукта амплификации соответствующими эндонуклеазами рестрикции, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводят по сайтам рестрикции SalI и KpnI или по сайтам рестрикции BamHI и EcoRI, причем селекцию проводят без антибиотиков,
причем при получении генотерапевтического ДНК-вектора VTvaf17-OPG, SEQID №3 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
OPG_FAGGATCCACCATGAACAACTTGCTGTGCTGC
OPG_RATAGAATTCATAAGCAGCTTATTTTTACTGATTG,
а расщепление продукта амплификации и клонирование кодирующей части гена OPG в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-PDGFA, SEQID №4 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
PDGFA_FAGGATCCACCATGAGGACCTTGGCTTGCCT
PDGFA_RTATGAATTCACCTCACATCCGTGTCCTCT,
а расщепление продукта амплификации и клонирование кодирующей части гена PDGFA в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHII и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-PDGFB, SEQID №5 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
PDGFB_FTATGTCGACCACCATGAATCGCTGCTGGGCGCT
PDGFB_RTATGGTACCTAGGCTCCAAGGGTCTCCTTC,
а расщепление продукта амплификации и клонирование кодирующей части гена PDGFB в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI.
7. Способ использования генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген OPG, или PDGFA, или PDGFB по пп. 1, или 2, или 3, для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии, заключающийся в трансфекции выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17, или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, клеток органов и тканей пациента или животного, и/или во введении в органы и ткани пациента или животного аутологичных клеток этого пациента или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17 и/или во введении в органы и ткани пациента или животного выбранного генотерапевтического ДНК-вектора, несущего целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или нескольких выбранных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, или в сочетании обозначенных способов.
8. Способ получения штамма для производства генотерапевтического ДНК-вектора по пп. 1, или 2, или 3, для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии, заключающийся в получении электрокомпетентных клеток штамма Escherichia coliSCS110-AF с последующим проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-OPG, или ДНК-вектором VTvaf17-PDGFA, или ДНК-вектором VTvaf17-PDGFB, после чего клетки высеивают на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола с получением в результате штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB.
9. Штамм Escherichia coli SCS110-AF/VTvaf17-OPG, полученный способом по п. 8, несущий генотерапевтический ДНК-вектор VTvaf17-OPG, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии.
10. Штамм Escherichia coli SCS110-AF/VTvaf17-PDGFA, полученный способом по п. 8, несущий генотерапевтический ДНК-вектор VTvaf17-PDGFA, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии.
11. Штамм Escherichia coli SCS110-AF/VTvaf17-PDGFB, полученный способом по п. 8, несущий генотерапевтический ДНК-вектор VTvaf17-PDGFB, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии.
12. Способ производства в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген OPG, или PDGFA, или PDGFB, по пп. 1, или 2, или 3 для лечения заболеваний, характеризующихся нарушениями регенерации костной и хрящевой тканей, в том числе после проведения хирургических операций, радиотерапии, для оптимизации или активизации остеоиндуктивности аллогенных или ксеногенных костных имплантатов, титановых имплантов в ортодонтологии, для усиления регенерации костных дефектов в стоматологии, заключающийся в том, что генотерапевтический ДНК-вектор VTvaf17-OPG, или генотерапевтический ДНК-вектор VTvaf17-PDGFA, или генотерапевтический ДНК-вектор VTvaf17-PDGFB получают путем того, что засевают в колбу с приготовленной средой затравочную культуру, выбранную из штамма Escherichia coli SCS110-AF/VTvaf17-OPG, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFB, затем инкубируют затравочную среду в шейкере-инкубаторе и переносят ее в промышленный ферментер, после чего растят до достижения стационарной фазы, затем выделяют фракцию, содержащую целевой ДНК-продукт, многостадийно фильтруют и очищают хроматографическими методами.
| US 20030220283 A1, 27.11.2003 | |||
| Способ изготовления полых цилиндрических поковок | 1981 |
|
SU1017421A1 |
| Композиция для восстановления дефектов костной ткани на основе аденовирусных конструкций, несущих кДНК ВМР-2, фибринового геля и синтетического β-трикальцийфосфата и способ ее получения | 2016 |
|
RU2620962C1 |
| DA COSTA R.P | |||
| ET AL | |||
| Gene therapy for osteoporosis | |||
| Acta Ortop Bras | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| KOH JT ET AL | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J Dent Res | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2022-05-16—Публикация
2018-12-24—Подача