Область техники
Изобретение относится к биотехнологии, а именно, к новым ферментам Cas нуклеазам систем CRISPR-Cas, применяемым для разрезания ДНК и редактирования генома различных организмов. Данная технология может применяться в будущем для генной терапии наследственных заболеваний человека, а также для редактирования генома других организмов.
Уровень техники
Изменение последовательности ДНК – одна из актуальных задач биотехнологии на сегодняшний день. Редактирование и изменение геномов эукариотических и прокариотических организмов, а также манипуляции с ДНК in vitro, требуют направленного внесения двунитевых разрывов в последовательности ДНК.
Для решения этой задачи в настоящее время используют следующие методики: искусственные нуклеазные системы, содержащей домены типа «цинковые пальцы», TALEN-системы и бактериальные CRISPR-Cas системы. Первые два метода требуют трудозатратой оптимизации аминокислотной последовательности нуклеазы для узнавания конкретной последовательности ДНК. В отличие от них в случае CRISPR-Cas систем структурами, узнающими ДНК мишень, являются не белки, а короткие направляющие РНК. Разрезание конкретной ДНК мишени не требует синтеза нуклеазы или ее гена de novo, а обеспечивается за счет использования направляющих РНК, комплементарных целевой последовательности. Это делает CRISPR Cas системы удобными и эффективными инструментами разрезания различных ДНК-последовательностей. Методика позволяет осуществлять единовременное разрезание ДНК в нескольких участках при использовании направляющих РНК разной последовательностей. Такой подход используется в том числе для одновременного изменения нескольких генов в эукариотических организмах.
По своей природе CRISPR-Cas системы являются иммунными системами прокариот, способными высоко специфично вносить разрывы в генетический материал вирусов (Mojica F. J. M. et al. Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements //Journal of molecular evolution. – 2005. – Т. 60. – №. 2. – С. 174-182). Аббревиатура CRISPR-Cas расшифровывается как “Clustered Regularly Interspaced Short Palindromic Repeats and CRISPR associated genes” (Jansen R. et al. Identification of genes that are associated with DNA repeats in prokaryotes //Molecular microbiology. – 2002. – Т. 43. – №. 6. – С. 1565-1575), что переводе с английского обозначает “короткие палиндромные повторы, регулярно расположенные группами, и aссоциированные с ними гены”. Все CRISPR-Cas системы состоят из CRISPR кассет и генов, кодирующих различные Cas белки (Jansen R. et al. , Molecular microbiology. – 2002. – Т. 43. – №. 6. – С. 1565-1575). CRISPR кассеты состоят из последовательностей-спейсеров, каждый из которых имеет уникальную нуклеотидную последовательность, и повторяющихся палиндромных повторов (Jansen R. et al. , Molecular microbiology. – 2002. – Т. 43. – №. 6. – С. 1565-1575). В результате транскрипции CRISPR кассет и их последующего процессинга образуются направляющие крРНК, которые вместе с Cas белками формируют эффекторный комплекс (Brouns S. J. J. et al. Small CRISPR RNAs guide antiviral defense in prokaryotes //Science. – 2008. – Т. 321. – №. 5891. – С. 960-964). За счет комплементарного спаривания крРНК с целевым участком ДНК, именуемым протоспейсером, Cas-нуклеаза узнает ДНК-мишень и высоко специфично вносит в нее разрыв.
CRISPR-Cas системы, представленными одиночным белком-эффектором, разделяют на шесть различных типов (от I до VI) в зависимости от Cas белков, входящих в состав систем. В 2013 году впервые было предложено использовать систему CRISPR-Cas9, относящуюся к типу II, для редактирования геномной ДНК клеток человека (Cong L, et al., Multiplex genome engineering using CRISPR/Cas systems. Science. 2013 Feb 15;339(6121):819-23). Система CRISPR-Cas9 II типа отличается простотой состава и механизма работы: для ее функционирования необходимо формирование эффекторного комплекса, состоящего лишь из одного белка Cas9 и двух коротких РНК: крРНК (crRNA) и трейсерной РНК (tracrRNA, или трРНК). Трейсерная РНК комплементарно спаривается с участком крРНК, проиcходящим из CRISPR повтора, образуя вторичную структуру, необходимую для связывания направляющих РНК с Cas эффектором. Определение последовательности направляющих РНК является важным шагом в характеризации неизученных ранее Cas-ортологов. Эффекторный белок Cas9 является РНК-зависимой ДНК эндонуклеазой с двумя нуклеазными доменами (HNH и RuvC), вносящими разрывы в комплементарные нити целевой ДНК, таким образом образуя двунитевой разрыв ДНК (Deltcheva E. et al. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III //Nature. – 2011. – Т. 471. – №. 7340. – С. 602).
На сегодняшний день известно несколько CRISPR-Cas нуклеаз, способных направлено и специфично вносить двунитевые разрывы в ДНК. Технология CRISPR-Cas9 является одной из самых современных и быстроразвивающихся методик внесения разрывов в ДНК различных организмов, начиная от бактериальных штаммов и заканчивая клетками человека, а также in vitro (Song M. The CRISPR/Cas9 system: Their delivery, in vivo and ex vivo applications and clinical development by startups. Biotechnol Prog. 2017 Jul;33(4):1035-1045).
Эффекторному рибонуклеиновому комплексу, состоящему из Cas9 и дуплекса крРНК и тракрРНК, для распознавания и последующего гидролиза ДНК помимо комплементарного соответствия спейсера крРНК и протоспейсера необходимо присутствие PAM (от англ. “PAM” - protospacer adjusted motif) на ДНК мишени (Mojica F. J. M. et al. 2009). PAM представляет собой строго определенную последовательность из нескольких нуклеотидов, расположенных в системах типа II вплотную либо в нескольких нуклеотидах от 3’-конца протоспейсера на нетаргетной цепи. При отсутствии PAM гидролиза связей в ДНК с образованием двунитевого разрыва не происходит. Необходимость присутствия PAM последовательности на мишени повышает специфичность узнавания, но в то же время накладывает ограничение в выборе целевых участков ДНК, в которые необходимо внести разрыв. Таким образом, наличие нужной PAM последовательности, фланирующей ДНК-мишень с 3'-конца, является характеристикой, ограничивающей применение CRISPR-Cas систем на любых участках ДНК.
Различные CRISPR-Cas белки используют для своей работы разные, оригинальные PAM последовательности. Использование CRISPR-Cas белков с новыми разнообразными PAM последовательностями необходимо для обеспечения возможности изменения любого участка ДНК, как in vitro, так и в геноме живых организмов. Изменение эукариотических геномов также требует использования нуклеаз малого размера для обеспечения доставки CRISPR-Cas систем в клетки посредством AAV вирусов.
Несмотря на известность ряда способов разрезания ДНК и изменения последовательности геномной ДНК, на сегодняшний день сохраняется потребность в новых эффективных инструментах для модификации ДНК в различных организмах и в строго определенных местах последовательности ДНК.
Сущность изобретения
Задачей настоящего изобретения является создание новых инструментов для изменения последовательности геномной ДНК одноклеточных или многоклеточных организмов на основе систем CRISPR-Cas9. Существующие в настоящее время системы имеют ограниченное применение из-за специфичной последовательности РАМ, которая должна присутствовать на 3'-конце участка ДНК, подвергающегося модификации. Поиск новых ферментов Cas9 с другими РАМ последовательностями позволит расширить арсенал имеющихся средств для образования двунитевого разрыва в необходимых, строго определенных местах в молекулах ДНК разных организмов. Для решения этой задачи авторами была охарактеризована ранее предсказанная для бактерии Demequina sediminicola (D. sediminicola)
CRISPR нуклеаза II типа DsCas9, которая может быть применена для внесения направленных изменений в геном как этого, так и других организмов. Существенными признаками, отличающими настоящее изобретение, являются: (а) короткая, отличающаяся от других известных последовательность PAM; (б) относительно малый размер охарактеризованного белка DsCas9 – 1021 аминокислотных остатков (а.о.).
Указанная задача решается путем применения белка, содержащего аминокислотную последовательность SEQ ID NO: 1, или содержащего аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 1 и имеет отличия по сравнению с SEQ ID NO: 1 только в неконсервативных аминокислотных остатках, для образования двунитевого разрыва в молекуле ДНК, расположенного непосредственно перед нуклеотидной последовательностью 5’- NA/GNNACN -3’ в указанной молекуле ДНК. В предпочтительных вариантах изобретения данное применение характеризуется тем, что образование двунитевого разрыва в молекуле ДНК происходит при температуре 37 оС.
Указанная задача также решается путем создания способа изменения последовательности геномной ДНК одноклеточного или многоклеточного организма, включающего введение в по меньшей мере одну клетку этого организма эффективного количества: а) либо белка, содержащего аминокислотную последовательность SEQ ID NO: 1, либо нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность SEQ ID NO: 1, и б) либо направляющей РНК, содержащей последовательность, образующую дуплекс с нуклеотидной последовательностью участка геномной ДНК организма, непосредственно примыкающей к нуклеотидной последовательности 5’- NA/GNNACN -3’, и взаимодействующей с указанным белком после образования дуплекса, либо последовательности ДНК, кодирующей указанную направляющую РНК; при этом взаимодействие указанного белка с направляющей РНК и нуклеотидной последовательностью 5’- NA/GNNACN -3’ приводит к образованию двунитевого разрыва в последовательности геномной ДНК, непосредственно примыкающей к последовательности 5’-NA/GNNACN-3’. В некоторых вариантах изобретения данный способ характеризуется тем, что дополнительно включающий введение экзогенной последовательности ДНК одновременно с направляющей РНК.
В качестве направляющей РНК может быть использована смесь из крРНК (crRNA) и трейсерной РНК (tracrRNA), способных образовать комплекс с участком целевой ДНК и белком DsCas9. В предпочтительных вариантах изобретения в качестве направляющей РНК может быть использована гибридная РНК, сконструированная на основе крРНК и трейсерной РНК. Методы конструирования гибридной направляющей РНК известны специалистам (Hsu PD, et al., DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 2013 Sep;31(9):827-32).
Изобретение может быть использовано как для разрезания целевой ДНК in vitro, так и для модификации генома какого-либо живого организма. Модификация генома может проводиться прямым способом – разрезанием генома в соответствующем сайте, а также вставкой экзогенной последовательности ДНК за счет гомологичной репарации.
В качестве экзогенной последовательности ДНК может быть использован любой участок двунитевой или однонитевой ДНК из генома организма, отличного от организма, используемого при введении (или смесь таких участков между собой и с другими фрагментами ДНК), при этом этот участок (или смесь участков) предназначен для интеграции в место двуцепочечного разрыва в целевой ДНК, образованного под действием нуклеазы DsCas9. В некоторых вариантах изобретения в качестве экзогенной последовательности ДНК может быть использован участок двуцепочечной ДНК из генома организма, используемого при введении белка DsCas9, но при этом измененный мутациями (заменой нуклеотидов), а также вставками или делециями одного или нескольких нуклеотидов.
Техническим результатом настоящего изобретения является повышение универсальности доступных систем CRISPR-Cas9, позволяющее использовать нуклеазу Cas9 для разрезания геномной или плазмидной ДНК в большем количестве специфических сайтов и специфических условий.
Краткое описание рисунков
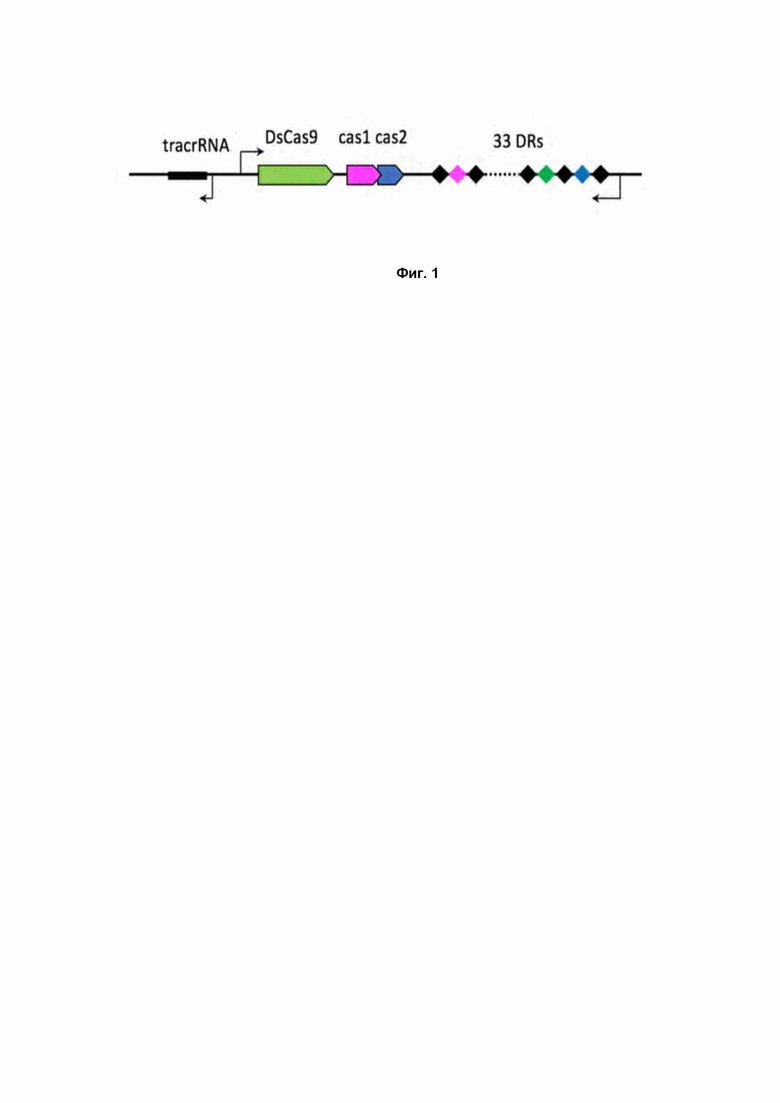
Фиг. 1. Схема устройства локуса CRISPR DsCas9 системы. DR - direct repeat, или прямой повтор - регулярно повторяющийся участок, входящий в состав CRISPR кассеты.
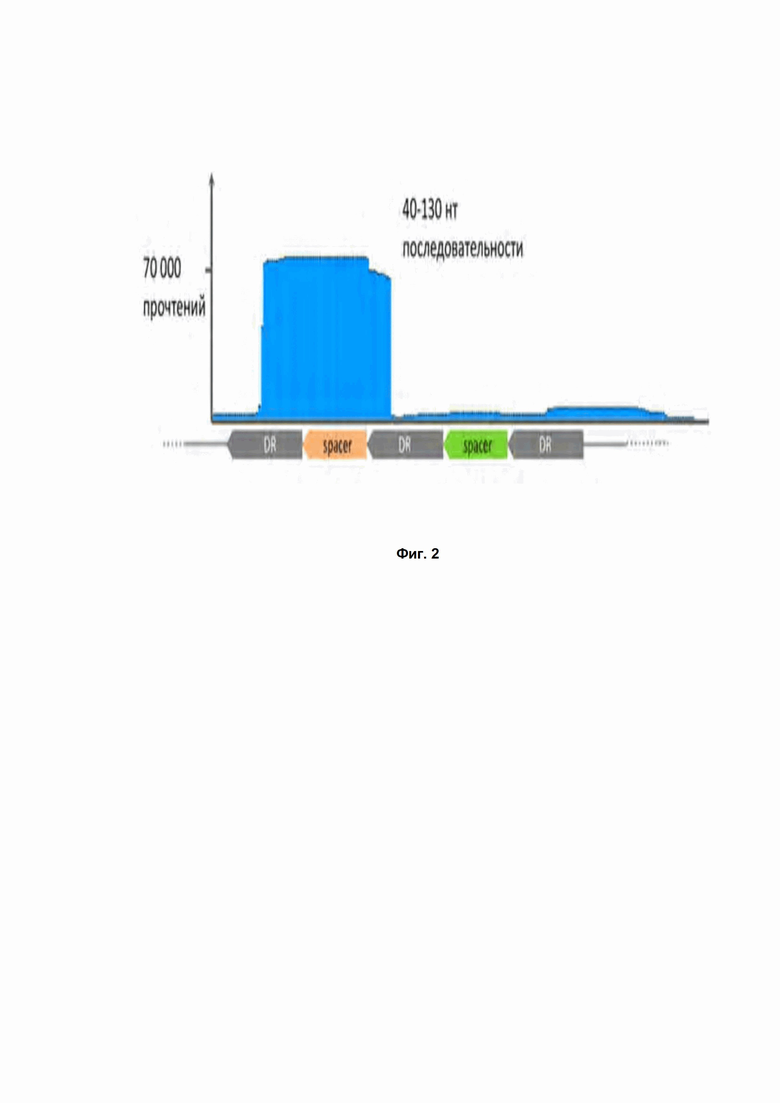
Фиг. 2. Выравнивание прочтений, полученных при секвенировании малых РНК, экстрагированных из клеток, несущих CRISPR DsCas9 систему, на последовательность CRISPR кассеты. DR - прямой повтор; spacer - спейсер, уникальная последовательность CRISPR кассеты, находящаяся между двумя прямыми повторами; нт – нуклеотиды.
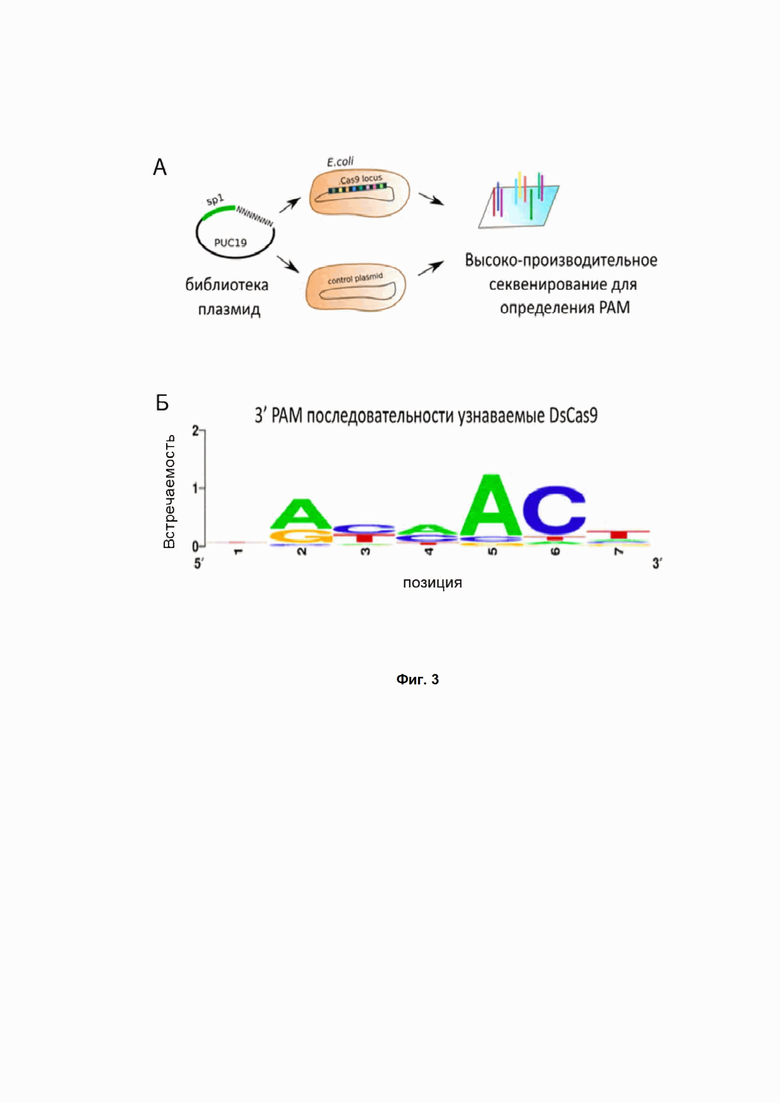
Фиг. 3. (А) PAM скрининг in vitro, схема эксперимента. (Б) Анализ результатов in vitro скрининга нуклеазы PpCas9 для определения PAM. Для каждой позиции обозначены частоты представленности аденина, цитозина, тимина и гуанина. Высота букв соответствует частоте представленности нуклеотида в данной позиции PAM последовательности.
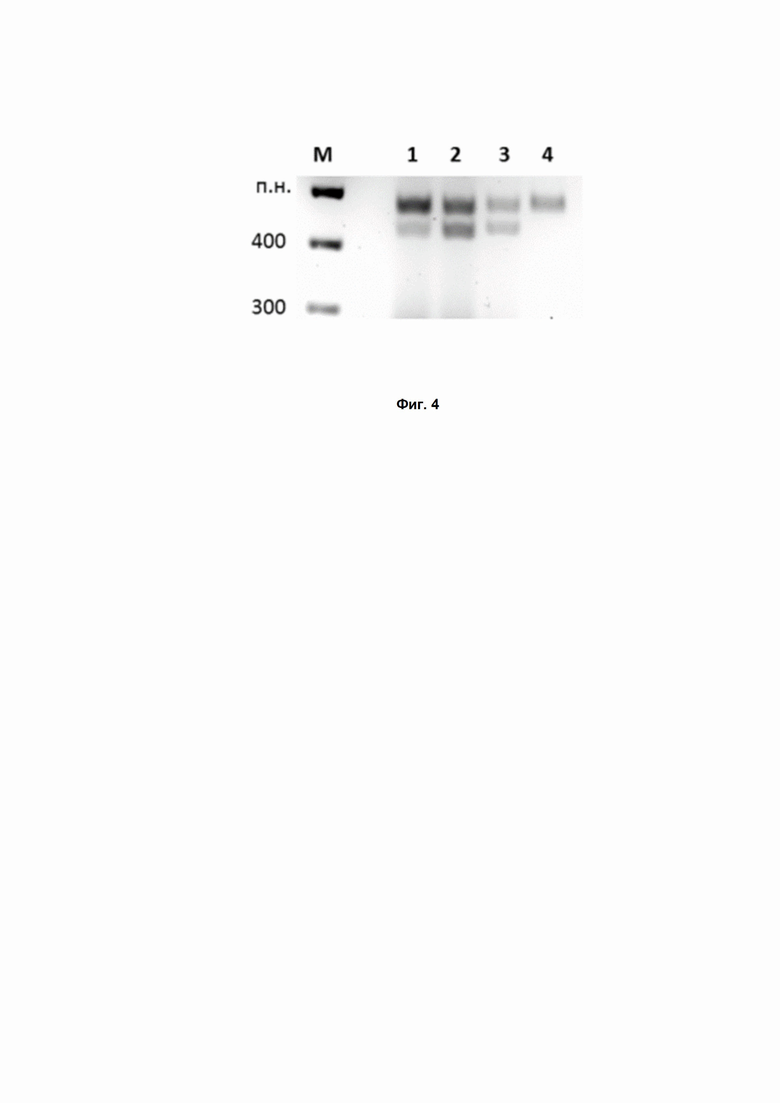
Фиг. 4. Расщепление ДНК с PAM-последовательностью AACAACG белком DsCas9 в различных условиях. М – маркер; 1 – DsCas9, РНК 1X; 2 – DsCas9 2X, РНК 2X; 3 – DsCas9 2X, РНК 1X; 4 – контроль (без добавления РНК).
Фиг. 5. Влияние однонуклеотидных замен в PAM-последовательности на нуклеазную активность белка DsCas9. Специфическое расщепление ДНК с различными вариантами PAM. Соответствующие PAM-последовательности указаны ниже в столбцах в направлении сверху вниз. Стрелкой обозначено положение продукта разрезания ДНК.
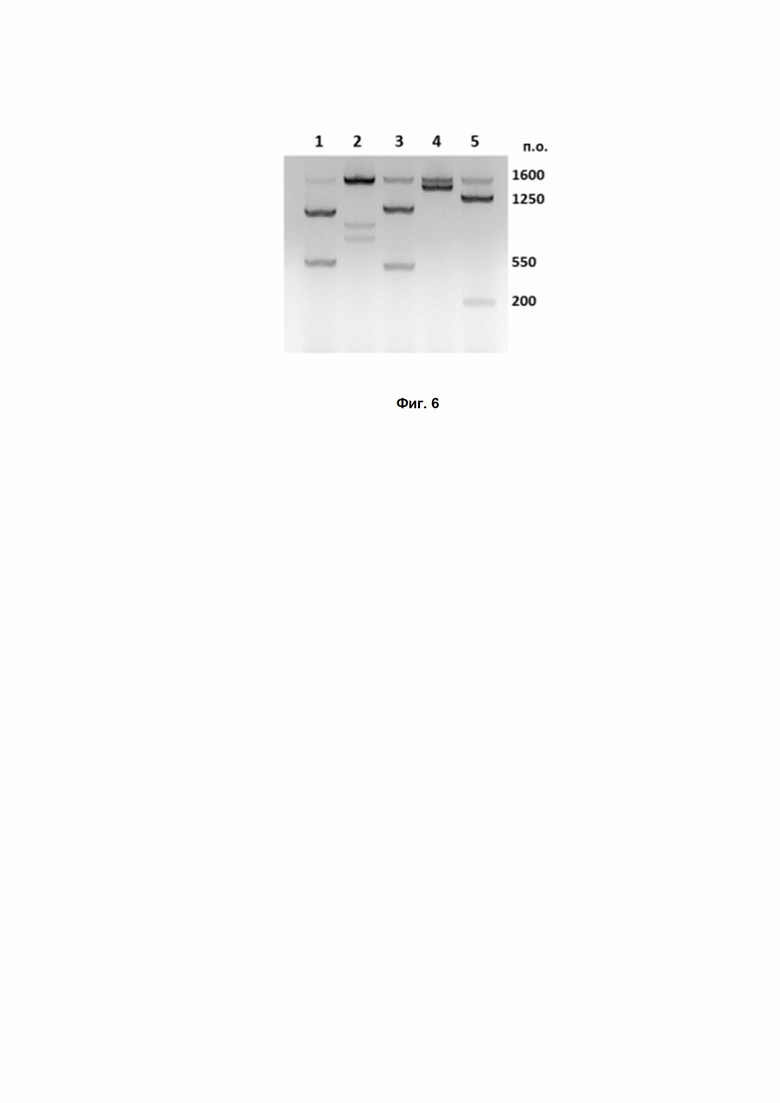
Фиг. 6. In vitro проверка специфичной нуклеазной активности DsCas9 на различных мишенях в рамках гена Grin2B человека. PAM-последовательности: 1 – AACAACT, 2 – CACAACC, 3 – AACTACT, 4 – CACGACT, 5 – TACAAAA.
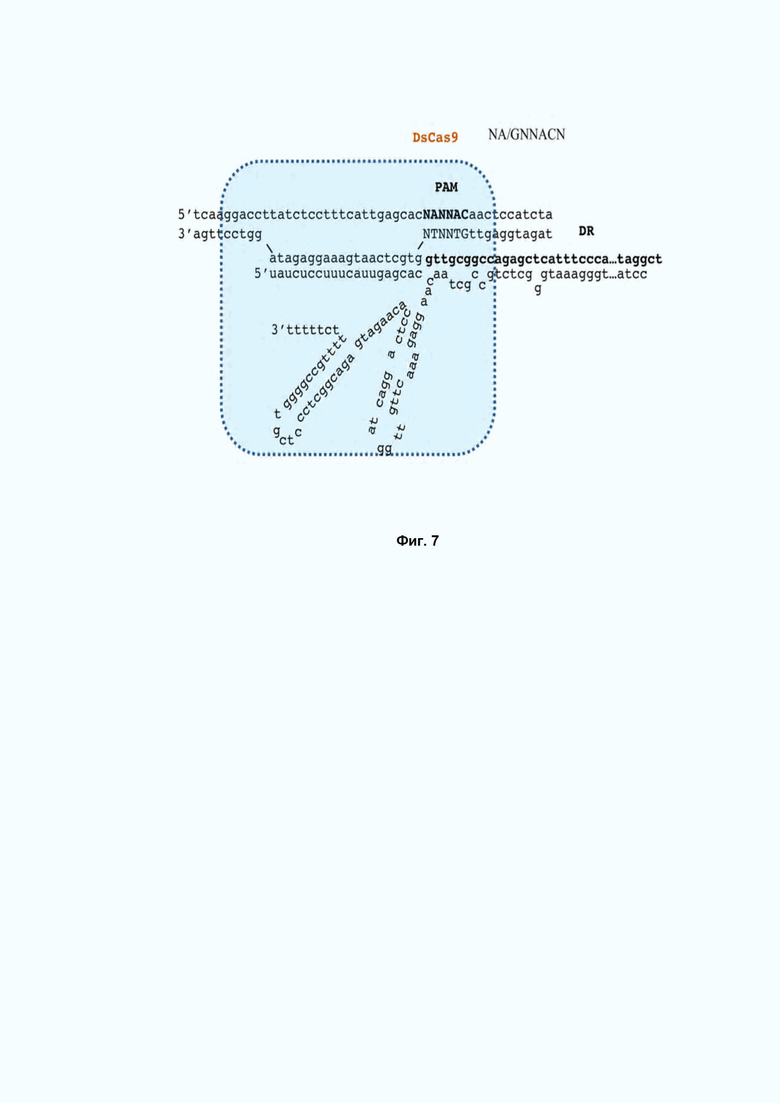
Фиг. 7. Схема рибонуклеопротеинового комплекса DsCas9 с направляющими РНК DR – прямой повтор.
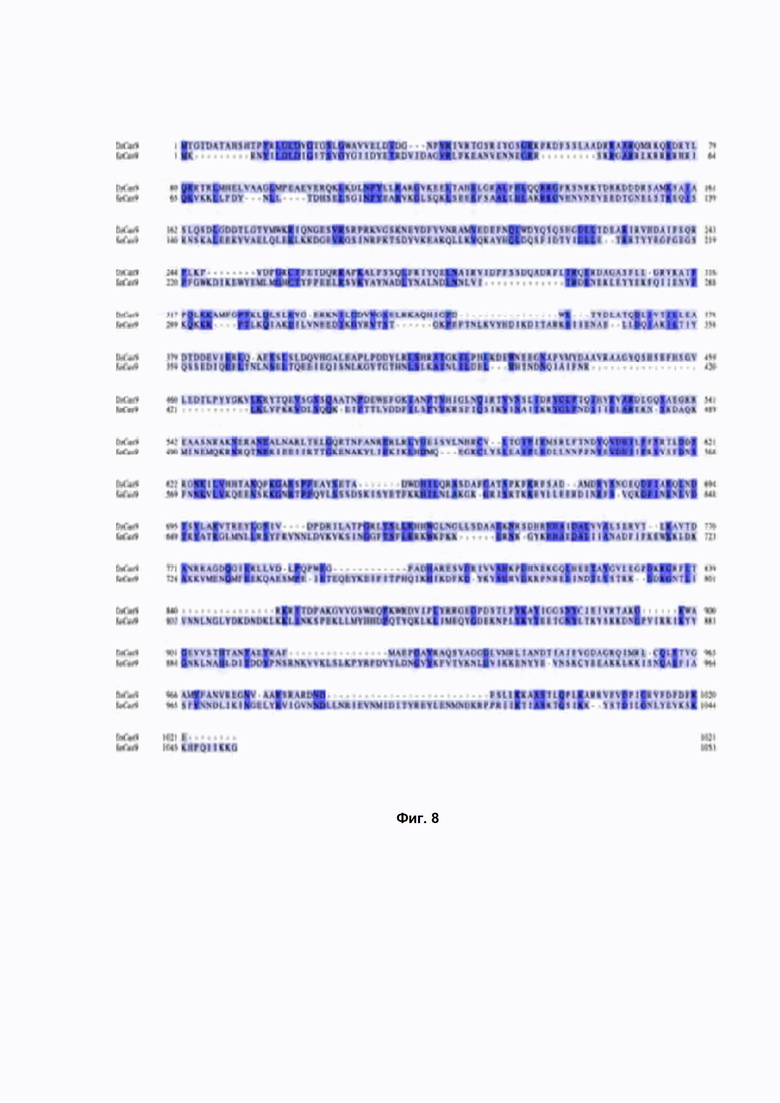
Фиг. 8. Выравнивание аминокислотных последовательностей белков DsCas9 (верхняя последовательность) и Cas9 из Staphylococcus aureus (нижняя последовательность) при помощи программы NCBI BLASTp (default parameters).
Подробное раскрытие изобретения
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из». Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
Используемый здесь термин «процент гомологии двух последовательностей» эквивалентен термину «процент идентичности двух последовательностей». Идентичность последовательностей определяется на основании референсной последовательности. Алгоритмы для анализа последовательности известны в данной области, такие как BLAST, описанный в Altschul et al., J. Mol. Biol., 215, pp. 403-10 (1990). Для целей настоящего изобретения для определения уровня идентичности и сходства между нуклеотидными последовательностями и аминокислотными последовательностями может быть использовано сравнение нуклеотидных и аминокислотных последовательностей, производимое с помощью пакета программ Blast, предоставляемого National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/blast) с использованием содержащего разрывы выравнивания со стандартными параметрами. Процент идентичности двух последовательностей определяется числом положений идентичных аминокислот в этих двух последовательностях с учетом числа пробелов и длины каждого пробела, которые необходимо ввести для оптимального сопоставления двух последовательностей путем выравнивания. Процент идентичности равен числу идентичных аминокислот в данных положениях с учетом выравнивания последовательностей, разделенному на общее число положений и умноженному на 100.
Термин "специфически гибридизуется" относится к ассоциации между двумя одноцепочечными молекулами нуклеиновых кислот или в достаточной степени комплементарными последовательностями, что разрешает такую гибридизацию в предопределенных условиях, обычно использующихся в данной области.
Фраза "двунитевой разрыв, расположенный непосредственно перед нуклеотидной последовательностью РАМ" означает, что двунитевой разрыв в целевой последовательности ДНК будет произведен на расстоянии от 0 до 25 нуклеотидов перед нуклеотидной последовательностью РАМ.
Под экзогенной последовательностью ДНК, вводимой одновременно с направляющей РНК, следует понимать последовательность ДНК, подготовленную специально для специфической модификации двуцепочечной целевой ДНК в месте разрыва, определяемого специфичностью направляющей РНК. Подобной модификацией может быть, например, вставка или делеция определенных нуклеотидов в месте разрыва целевой ДНК. Экзогенной ДНК может служить как участок ДНК из другого организма, так и участок ДНК из того же организма, что и целевая ДНК.
Под белком, содержащим определенную аминокислотную последовательность следует понимать белок, имеющий аминокислотную последовательность, составленную из указанной аминокислотной последовательности и, возможно, других последовательностей, соединённых пептидными связями с указанной аминокислотной последовательностью. Примером других последовательностей может служить последовательность сигнала ядерной локализации (NLS), или другие последовательности, обеспечивающие повышенную функциональность для указанной аминокислотной последовательности.
Под экзогенной последовательностью ДНК, вводимой одновременно с направляющей РНК, следует понимать последовательность ДНК, подготовленную специально для специфической модификации двуцепочечной целевой ДНК в месте разрыва, определяемого специфичностью направляющей РНК. Подобной модификацией может быть, например, вставка или делеция определенных нуклеотидов в месте разрыва целевой ДНК. Экзогенной ДНК может служить как участок ДНК из другого организма, так и участок ДНК из того же организма, что и целевая ДНК.
Под эффективным количеством вводимых в клетку белка и РНК следует понимать такое количество белка и РНК, которое при попадании в указанную клетку будет способно образовать функциональный комплекс, то есть комплекс, который будет специфически связываться с целевой ДНК и производить в ней двунитевой разрыв в месте, определяемом направляющей РНК и РАМ последовательностью на ДНК. Эффективность этого процесса может быть оценена при помощи анализа целевой ДНК, выделенной из указанной клетки с помощью стандартных методов, известных специалистам.
Доставка белка и РНК в клетку может быть осуществлена различными способами. Например, белок может быть доставлен в виде ДНК-плазмиды, которая кодирует ген этого белка, как мРНК для трансляции этого белка в цитоплазме клетки, или как рибонуклеопротеидный комплекс, включающий этот белок и направляющую РНК. Доставка может быть осуществлена различными методами, известными специалистам.
Нуклеиновая кислота, кодирующая компоненты системы, может быть введена в клетку, непосредственно или опосредованно: за счет трансфекции или трансформации клеток известными специалистам способами, за счет использования рекомбинатного вируса, за счет манипуляций с клеткой, таких как микроинъекция ДНК и т.п.
Доставка рибонуклеинового комплекса, состоящего из нуклеазы и направляющих РНК и экзогенной ДНК (при необходимости) может осуществляться путем трансфекции комплексов в клетку или за счет механического введения комплекса внутрь клетки, например, микроинъекции.
Молекула нуклеиновой кислоты, кодирующая белок, который необходимо ввести в клетку, может быть интегрирована в хромосому или может представлять собой внехромосомно реплицирующуюся ДНК. В некоторых вариантах для обеспечения эффективной экспрессии гена белка с вводимой в клетку ДНК необходимо изменить последовательность этой ДНК в соответствии с типом клетки в целях оптимизации кодонов при экспрессии, обусловленное неравномерностью частот встречаемости синонимичных кодонов в кодирующих областях генома различных организмов. Оптимизация кодонов необходима для увеличения экспрессии в клетках животных, растений, грибов или микроорганизмов.
Для функционирования белка, имеющего последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 1, в эукариотической клетке необходимо, чтобы этот белок оказался в ядре этой клетки. Поэтому, в некоторых вариантах изобретения, для образования двунитевых разрывов в целевой ДНК используют белок, имеющий последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 1, и который дополнительно модифицирован с одного или с обоих концов добавлением одного или нескольких сигналов ядерной локализации. Например, может быть использован сигнал ядерной локализации из вируса SV40. Для эффективной доставки в ядро сигнал ядерной локализации может быть отделен от основной последовательности белка спейсерной последовательностью, например, описанной в Shen B, et al. "Generation of gene-modified mice via Cas9/RNA-mediated gene targeting", Cell Res. 2013 May;23(5):720-3. Также, в других вариантах осуществления, может быть использован другой сигнал ядерной локализации, или альтернативный метод доставки указанного белка в ядро клетки.
Настоящее изобретение охватывает применение белка из организма D. sediminicola, гомологичного ранее охарактеризованным белкам Cas9, для внесения двуцепочечных разрывов в молекулы ДНК в строго определенных положениях. Использование CRISPR нуклеаз для внесения направленных изменений в геном имеет ряд преимуществ. Во-первых, специфичность действия системы определяется последовательностью крРНК, что позволяет использовать один тип нуклеазы для всех локусов-мишеней. Во-вторых, методика позволяет доставить в клетку сразу несколько направляющих РНК, комплементарных разным генам-мишеням, что позволяет осуществлять единовременное изменение сразу нескольких генов.
DsCas9 – Cas нуклеаза, найденная в настоящем изобретении в бактериях D. sediminicola. CRISPR Cas9 система из бактерии Demequina sediminicola относится к системам IIC типа и имеет характерное для Cas9 систем устройство локуса. В состав CRISPR кассеты входит 33 прямых повтора (DR, direct repeats) последовательностью
GTTGCGGCCAGAGCTCATTTCCCAGAGCGATAGGCT, перемежающихся уникальными последовательностями, спейсерами. Адаптационный модуль, ответственный за встраивание новых спейсеров в CRISPR кассету, представлены генами Cas1 и Cas2. Рядом с геном эффекторного Cas9 белка была идентифицирована последовательность трейсерной РНК (tracrRNA, трRNA) (Рис. 1).
Для биохимической характеризации белка Cas9 из D. sediminicola (DsCas9) локус, кодирующий основные компоненты системы (гены белков СсCas9, cas1, cas2, а также часть CRSIPR кассеты и трейсерную РНК), был клонирован в малокопийный бактериальный вектор pACYC184. Полученный вектор был трансформирован в клетки E. coli, в которых далее проводилось изучение активности системы.
Определение последовательности направляющих РНК.
Проверка экспресcии генов CRISPR DsCas9 в E. coli проводилась посредством секвенирования малых РНК, экстрагированных из клеток E.coli, несущих систему CRISPR. Анализ результатов секвенирования позволил выяснить последовательности направляющих РНК (Таблица 1, Рис. 2).
Таблица 1. Последовательности направляющих РНК системы CRISPR DsCas9.
Определение PAM последовательности белка DsCas9. Бактериальный PAM скрининг.
Интерференция – это процесс защиты бактериальных клеток от чужеродной ДНК с помощью CRSIPR Cas систем. Для определения PAM последовательности белка DsCas9 клетки E.coli BL21 Star, несущие плазмиду DsCas9_pACYC184, были трансформированы библиотекой плазмид, содержащих последовательность спейсера 5’-TTCATGCACGAAGTCCTCCGCCGCATGTCC-3’ CRISPR кассеты DsCas9 системы, фланкированной рандомизированной семибуквенной последовательностью с 5’ или 3’ конца.
Плазмиды, несущие последовательность, соответствующую PAM системы DsCas9, подвергались деградации под действием CRISPR Cas системы, в то время как остальные плазмиды библиотеки эффективно трансформировались в клетки, придавая им устойчивость к антибиотику ампициллину. После трансформации и инкубации клеток на чашках с антибиотиком колонии смывались с поверхности агара и из них экстрагировали ДНК с помощью Qiagen Plasmid Purification Midi kit. С выделенного пула плазмид ПЦР амплифицировались участки, включающие рандомизированную PAM последовательность, которые затем подвергали высокоэффективному секвенированию на платформе Illumina. Полученные прочтения анализировали: сравнивалась эффективность трансформации плазмид с уникальными PAM, входящими в библиотеку, в клетки, несущие DsCas9_pACYC184, или в контрольные клетки, несущие пустой вектор pACYC184. Полученные результаты анализировали методами биоинформатики. В результате удалось выявить PAM системы DsCas9 – трехбуквенную последовательность NA/GNNACN c 3’ конца протоспейсера (Рис. 3).
Для проверки активности DsCas9 нуклеазы и определения требуемого для DsCas9 PAM мотива, были проведены эксперименты по воссозданию реакции разрезания ДНК in vitro.
Для проверки нуклеазной активности DsCas9 в рамках in vitro скрининга требовалось наличие следующих компонентов реакции:
1) Рекомбинантный белок DsCas9
2) крРНК DsCas9
3) трейсерная РНК DsCas9
4) ДНК-мишень
Определение последовательности направляющих РНК РНК-секвенированием (Таблица 1) позволило синтезировать in vitro молекулы crRNA и tracrRNA. Синтез осуществляли с помощью набора NEB HiScribe T7 RNA synthesis. Двунитевые ДНК мишени представляли собой фрагменты РНК размером 374 пар нуклеотидов (п.н.), содержащие последовательность протоспейсера, фланкированную соответствующими PAM последовательностями c 3’ конца: 5’-
XXXXXXX – вариабельный PAM участок. В зависимосьти от условий эксперимента использовались различные PAM последовательности.
Для разрезания таких мишеней использовали направляющие РНК следующей последовательности:
DsCas9 tracrRNA:
CCUAUCGCUCUGGGAAAUGGGCUCUGCCGCuAACAAGGAGAAACUUGUUGGAUCAGGACUCCACAAGAUGAGACGGCUCCCUCGUGGGGCCGUUUUCUUUUU
DsCas9 крРНК 1:
uaucuccuuucauugagcacGUUGCGGCCAGAGCUCAUUUCCCAGAGCGAUAGGCU
или
DsCas9 крРНК 2:
ucaaggaccuuaucuccuuucauugagcacGUUGCGGCCAGAGCUCAUUUCCCAGAGCGAUAGGCU
Для получения рекомбинантного белка DsCas9 его ген был клонирован в плазмиду pET21a. С N-конца к последовательности DsCas9 был добавлен белок MBP для повышения растворимости. Клетки E.coli Rosetta были трансформированы полученной плазмидой pET21a MBP_DsCas9_6xHis.
500 мкл ночной культуры разводили в 500 мл среды LB, и растили клетки при температуре 37 оС до достижения оптической плотности 0.6 отн.ед. Синтез целевого белка индуцировали добавлением ИПТГ до концентрации 1 мМ, после чего клетки инкубировали при температуре 20 оC в течение 6 часов. Затем проводили центрифугирование клеток на скорости 5000 g в течение 30 минут, полученные осадки замораживали при температуре -20 оС.
Осадки размораживали на льду в течение 30 минут, ресуспензировали в 15 мл лизисного буфера (Tris-HCl 50мМ pH 8, 500 мМ NaCl, β-меркаптоэтанол 1 мМ, имидазол 10 мМ) с добавлением 15 мг лизоцима и снова инкубировали на льду в течение 30 минут. Затем клетки разрушали воздействием ультразвука в течение 30 минут и центрифугировали в течение 40 минут на скорости 16000 g. Полученный супернатант пропускали через фильтр 0,2 мкм и наносили на колонку HisTrap HP 1 mL (GE Healthcare) на скорости 1 мл/мин.
Хроматографию проводили при помощи FPLC хроматографа AKTA (GE Healthcare) на скорости 1 мл/мин. Колонку с нанесенным белком промывали 20 мл лизисного буфера с добавлением 30 мМ имидазола, после чего белок смывали лизисным буфером с добавлением 300 мМ имидазола.
Затем, фракцию белка, полученную в ходе афинной хроматографии, пропускали через гель-фильтрационную колонку Superdex 200 10/300 GL (24мл), уравновешенную следующим буфером: Tris-HCl 50 мМ pH 8, 500 мМ NaCl, 1 мМ DTT. При помощи концентратора Аmicon (с фильтром на 30 кДа) фракции, соответствующие мономерной форме белка DsCas9, сконцентрировали до 3 мг/мл, после чего очищенный белок хранили при температуре -80 оС в буфере, содержащем 10% глицерин.
In vitro реакцию разрезания ДНК проводили в следующих условиях.
Реакционная смесь состояла из:
1X CutSmart буфера (NEB),
5 мМ DTT,
40 нМ ДНК-мишень,
2 мкМ трРНК/крРНК,
400 нМ белка DsCas9.
Реакции проводились при температуре 37 °С
По данным in vivo скрининга были отобраны несколько конкретных PAM-последовательностей, предположительно узнаваемых нуклеазой DsCas9. ДНК-мишени, несущие эти PAM последовательности, проверяли на эффективность разрезания нуклеазой. В результате было установлено узнавание белком DsCas9 следующей 7-нуклеотидной PAM-последовательности: 5’-AACAACG-3’, в согласии с PAM консенсусом 5’-NA/GNNACN-3’ (Рис. 4).
Длина РНК не оказывала влияние на активность DsCas9, в связи с чем для работы была выбрана направляющая РНК меньшей длины, DsCas9 крРНК 1.
С целью выявления позиций PAM последовательности, значимых для специфического узнавания DsCas9, были синтезированы ДНК-мишени, содержащие однонуклеотидные замены в последовательности 5’-AACAACG-3’. Каждый из 7 нуклеотидов PAM поочередно заменяли с пурина на пиримидин или наоборот. Результат реакции in vitro разрезания DsCas9 таких ДНК-мишеней показал значимость нуклеотида C в 6-й позиции PAM последовательности (Рис. 5). Замена C на G в данной позиции привела к нарушению специфического распознавания мишени нуклеазой, что привело к предотвращению разрезания. Замены в остальных позициях никак не сказались на нуклеазной активности DsCas9, что может свидетельствовать о строгом требовании к нуклеотидному составу PAM последоватльности только в 6-й позиции.
В результате исследований in vitro, а также исследований работы системы в бактериях удалось сделать следующий вывод: PAM, распознаваемый нуклеазой DsCas9, соответствует следующей формуле 5’-NA/GNNACN-3’. Причем только С в шестой позиции является строгим требованием DsCas9.
Нижеследующие примеры осуществления способа приведены в целях раскрытия характеристик настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Тестирование активности белка DsCas9 в разрезании различных ДНК мишеней.
Использование Cas нуклеаз для внесения двунитевых разрывов в различных сайтах ДНК клеток человека требует эффективного распознавания нуклеазой разных ДНК-мишеней. Поэтому следующим шагом биохимической характеризации DsCas9 после определения и валидации PAM последовательности являлась проверка эффективности разрезания белком различных сайтов ДНК in vitro.
Способность DsCas9 разрезать различные мишени была проверена на ПЦР фрагменте гена человека grin2b, длиной 1592 пары оснований.
gagagagatggccaaggcttatattctatagagcattatgtccttagtttgatgcatagaataagatttagggtcatatgtggaagtaaaaaggaaggagttctttgtaggtaaaaggtggcaaattatatgaaaatacggtatcagtcattttagggaagtcacgactataggatggcatcaggaaaaaaaaaggaacatttttcaaatgtggctctaacattacttcagctgctaatggtatttgtttaagtttctgtattttggtgtataaatagattggagtaatatgtgttccttataataattggttatatgagaggcagttccacgtagtgtaatagaacacatattggaatacaaaagtcagaagatctgggttcaggtttgtttcacttaattgattggttcatggtcttagaacacttagcttctctgagccttggcgtcaacatttataaaaatggtgataataatgtttttcttattttattccctactgggtcattgtaaggatcaattgaggcaatgttttaaaactactagtcatgtatcagttgttcttgtagtttaatattaagagccagatactaacaaggttactaaagaattttctggctgttgtcctcattgaggcaaacataaggtgaaggcagcaagaatgcagggcttgtgtacttatagccccccacatccagtttatccagcccatgttctgttgctcacctctgctgagcacgtttttctgctcactttgtctggccttgctttccttcagcccaagaacagtacaagggtgggctgtaacaggagggccaggagatttgtgtatgcatactcgcatggctacctggaccactcacaacctcttttcctcctttgtctctgcctgtagctgccaatgactatagcaatagcaccttttattgccttgttcaaggatttctgaggcttttgaaagtttcattttctctcattctgcagagcaaataccagagataagagagtaggctggtagatggagttgggtttggtgctcaatgaaaggagataaggtccttgaattgcagtatctagcctcttctaagacaggttacgtgatgtagatcctattttaacatgctctttctttgtgtttgcagggagtcgacgagttgaagatgaagcccagagcggagtgctgttctcccaagttctggttggtgttggccgtcctggccgtgtcaggcagcagagctcgttctcagaagagcccccccagcattggcattgctgtcatcctcgtgggcacttccgacgaggtggccatcaaggatgcccacgagaaagatgatttccaccatctctccgtggtaccccgggtggaactggtagccatgaatgagaccgacccaaagagcatcatcacccgcatctgtgatctcatgtctgaccggaagatccagggggtggtgtttgctgatgacacagaccaggaagccatcgcccagatcctcgatttcatttcagcacagactctcacccccatcctgggcatccacgggggctcctctatgataatggcagataaggtaaaaaggggctgcagggag
На этом участке было выбрано пять сайтов с последовательностями PAM, предположительно распознаваемыми DsCas9 на основе in vivo и in vitro данных (Таблица 2):
Таблица 2. Последовательности PAM и соответствующего проспейсера, расположенные на гене grin2b человека.
Для распознавания этих сайтов были синтезированы крРНК, с последовательностью прямого повтора (DR) DsCas9, и спейсерной последовательностью, соответствующей выбранным протоспейсерам.
Далее проводилась реакция in vitro разрезания ДНК-мишени белком DsCas9 в комплексе с полученными крРНК и трейсерной РНК. Реакции проводили по стандартной схеме.
Фермент DsCas9 успешно распознал и разрезал все пять мишеней (Рис. 6). Белок показал высокую эффективность в специфическом расщеплении ДНК в случае всех пяти мишеней. Разрезание ДНК специфично: продукты реакции имеют длину, ожидаемую в соответствии с положением сайта узнавания на ДНК.
Таким образом, проведенные исследовательские испытания показали наличие нуклеазной активности у DsCas9, а также позволили определить его PAM последовательность и верифицировать последовательности направляющих РНК.
DsCas9 рибонуклеопротеиновый комплекс специфически вносит разрывы в мишени, ограниченные PAM 5’-NA/GNNACN-3’ c 3’ конца протоспейсера. Схема DsCas9-РНК комплекса представлена на Фиг. 7.
Пример 2. Белки Cas9 из близкородственных организмов, относящихся к D. sediminicola.
На сегодняшний день в D. sediminicola не охарактеризовано ни одного фермента системы CRISPR-Cas9. Сравнимый по размерам белок Cas9 из Staphylococcus aureus идентичен DsCas9 на 30 % (Фиг. 8, степень идентичности была рассчитана по программе BLASTp, default parameters). Похожая степень идентичности была установлена и для других известных белков Cas9 (не показано).
Таким образом, белок DsCas9 существенно отличается по аминокислотной последовательности от других Cas9 белков, изученных на сегодняшний день.
Специалисту в области генетической инженерии очевидно, что полученный и охарактеризованный в данном Описании вариант последовательности белка DsCas9 может быть изменен без изменения функции самого белка (например, направленным мутагенезом аминокислотных остатков, напрямую не влияющих на функциональную активность (Sambrook et al., Molecular Cloning: A Laboratory Manual, (1989), CSH Press, pp. 15.3-15.108)). В частности, специалисту известно, что могут быть изменены неконсервативные аминокислотные остатки, не затрагивающие остатки, определяющие функциональность белка (определяющие его функцию или структуру). Примерами таких изменений могут служить замены неконсервативных аминокислотных остатков на гомологичные. Некоторые из участков, содержащих неконсервативные аминокислотные остатки, приведены на Фиг. 12. В некоторых вариантах осуществления изобретения возможно использование белка, содержащего аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 1 и имеет отличия по сравнению с SEQ ID NO: 1 только в неконсервативных аминокислотных остатках, для образования двунитевого разрыва в молекуле ДНК, расположенного непосредственно перед нуклеотидной последовательностью 5’- NA/GNNACN-3’ в указанной молекуле ДНК. Гомологичные белки могут быть получены путем мутагенеза (например, сайт-направленного или ПЦР-опосредуемого мутагенеза) соответствующих молекул нуклеиновых кислот с последующим тестированием кодируемого модифицированного белка Cas9 на сохранение его функций в соответствии с описанными здесь функциональными анализами.
Пример 3. Описанная в настоящем изобретении система DsCas9 в комплексе с направляющими РНК может быть использована для изменения последовательности геномной ДНК многоклеточного организма, в том числе эукариотического. Для введения система DsCas9 в комплексе с направляющими РНК в клетки этого организма (во все клетки или в часть клеток) могут быть применены различные подходы, известные специалистам. Например, методы доставки CRISPR-Cas9 систем в клетки организмов раскрыты в источниках (Liu C et al., Delivery strategies of the CRISPR-Cas9 gene-editing system for therapeutic applications. J Control Release. 2017 Nov 28;266:17-26; Lino CA et al., Delivering CRISPR: a review of the challenges and approaches. Drug Deliv. 2018 Nov;25(1):1234-1257), и в источниках, раскрытых внутри этих источников.
Для эффективной экспрессии нуклеазы DsCas9 в эукариотических клетках будет желательно провести оптимизацию кодонов для аминокислотной последовательности белка DsCas9 методами, известными специалистам (например, IDT codon optimization tool).
Для эффективной работы нуклеазы DsCas9 в эукариотических клетках необходимо обеспечить импорт этого белка внутрь ядра эукариотической клетки. Для этого можно использовать сигнал ядерной локализации из Т-антигена вируса SV40 (Lanford et al., Cell, 1986, 46: 575–582), соединённый с последовательностью DsCas9 с помощью спейсерной последовательности, описанной в Shen B, et al. "Generation of gene-modified mice via Cas9/RNA-mediated gene targeting", Cell Res. 2013 May;23(5):720-3 или без нее. Таким образом, полная аминокислотная последовательность нуклеазы транспортируемой внутрь ядра эукариотической клетки будет представлять собой следующую последовательность: MAPKKKRKVGIHGVPAA-DsCas9-KRPAATKKAGQAKKKK (далее DsCas9 NLS). Для доставки белка с приведенной выше аминокислотной последовательностью, могут быть использованы по меньшей мере два подхода.
Доставка в виде гена осуществляется путем создания плазмиды, несущей ген DsCas9 NLS под регуляцией промотора (например, CMV промотора) и последовательности, кодирующей направляющие РНК под регуляцией U6 промотора. В качестве ДНК- мишеней используются ДНК последовательности фланкированные 3’- NA/GNNACN -5’, например, последовательности гена grin2b человека:
5’-TCTTAATATTAAACTACAAG-3’
Таким образом, кассета для экспрессии крРНК выглядит следующим образом:
Жирным шрифтом выделена последовательность U6 промотора, далее последовательность, необходимая для узнавания целевой ДНК, последовательность прямого повтора выделена красным цветом.
Кассета для экспрессии трейсерной РНК выглядит следующим образом:
Жирным шрифтом выделена последовательность U6 промотора, далее последовательность, кодирующая трейсерную РНК.
Плазмидную ДНК очищают и трансфицируют в клетки человека HEK293 c помощью реагента Lipofectamine 2000 (Thermo Fisher Scientific). Клетки инкубируют в течение 72 часов, после чего из них выделяется геномная ДНК с помощью колонок для очистки геномной ДНК (Thermo Fisher Scientific). Целевой ДНК сайт анализируется с помощью секвенирования на платформе Illumina с целью определения числа вставок-делеций в ДНК, происходящих в целевом сайте по причине направленного двунитевого разрыва и последующей его репарации.
Для амплификации целевых фрагментов используют праймеры, фланкирующие предположительное место внесения разрыва.
После амплификации пробы готовятся по протоколу реагента Ultra II DNA Library Prep Kit for Illumina (NEB) для подготовки образцов к высокопроизводительному секвенированию. Затем проводится секвенирование на платформе Illumina 300cycles, прямое прочтение. Результаты секвенирования анализируются биоинформатическими методами. В качестве детекции разрезания принимается вставка или делеция нескольких нуклеотидов в целевой последовательности ДНК.
Доставка в виде рибонуклеинового комплекса осуществляется путем инкубации рекомбинантной формы DsCas9 NLS c направляющими РНК в CutSmart буфере (NEB). Рекомбинантный белок получают из бактериальных клеток-продуцентов, очищая его с помощью аффинной хроматографии (NiNTA, Qiagen) разделением по размеру (Superdex 200).
Белок смешивают с РНК в соотношении 1:2:2 (DsCas9 NLS: crRNA :tracrRNA), инкубируют в течение 10 минут на комнатной температуре, затем смесь трансфицируют в клетки.
Далее проводится анализ экстрагированной из них ДНК на предмет вставок-делеций в целевом ДНК сайте (как описано выше).
Охарактеризованная в настоящем изобретении нуклеаза DsCas9 из бактерии D. sediminicola имеет ряд преимуществ относительно ранее охарактеризованных Cas9 белков.
DsCas9 обладает коротким, трехбуквенным, отличным от других известных Cas нуклеаз PAM мотивом, необходимым для функционирования системы. В изобретении было показано, что для функционирования DsCas9 достаточно присутствия короткого PAM мотива, распложенного в нескольких нуклеотидах от протоспейсера.
Известные на сегодняшний день большинство Cas нуклеаз, способных вносить двунитевые разрывы в ДНК, имеют сложные многобуквенные PAM последовательности, ограничивающие выбор последовательностей, пригодных для разрезания. Среди изученных Cas нуклеаз, распознающих короткие PAM, только DsCas9 может распознавать последовательности, фланкированные 3’- NA/GNNACN-5’ мотивом. Несмотря на трехбуквенный PAM возможность использования пуринов A или G во второй позиции расширяет спектр возможных к изменению мишеней.
Второе преимущество DsCas9 – малый размер белка (1021 а.о). На сегодняшний день это единственный изученный малоразмерный белок, обладающий NA/GNNACN PAM последовательностью.
DsСas9 – новая, малоразмерная Cas нуклеаза, имеющая относительно короткий, простой в использовании PAM, отличающийся от известных на сегодняшний день PAM последовательностей других нуклеаз. Белок DsCas9 разрезает с высокой эффективностью различные ДНК-мишени при температуре 37 °С, и может стать основой нового инструмента геномного редактирования.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные случаи приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть, понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Автономная некоммерческая образовательная организация высшего образования «Сколковский институт науки и технологий»
<120> СРЕДСТВО РАЗРЕЗАНИЯ ДНК НА ОСНОВЕ CAS9 БЕЛКА ИЗ БАКТЕРИИ DEMEQUINA SEDIMINICOLA
<130> 1
<160> 2
<210> 1
<211> 1021
<212> PRT
<213> Demequina sediminicola
<220>
<223> белок, гомологичный Cas9
<400> 1
Met Thr Gly Thr Asp Ala Thr Ala His Ser His Thr Pro Tyr Arg Leu
1 5 10 15
Gly Leu Asp Val Gly Thr Gly Ser Leu Gly Trp Ala Val Val Glu Leu
20 25 30
Asp Thr Asp Gly Asn Pro Val Arg Ile Val Arg Thr Gly Ser Arg Ile
35 40 45
Tyr Gly Ser Gly Arg Lys Pro Lys Asp Phe Ser Ser Leu Ala Ala Asp
50 55 60
Arg Arg Ala Ala Arg Gln Met Arg Lys Gln Arg Asp Arg Tyr Leu Gln
65 70 75 80
Arg Arg Thr Arg Leu Met His Glu Leu Val Ala Ala Gly Leu Met Pro
85 90 95
Glu Ala Glu Val Glu Arg Gln Lys Leu Lys Asp Leu Asn Pro Tyr Leu
100 105 110
Leu Arg Ala Arg Gly Val Lys Glu Glu Leu Thr Ala His Glu Leu Gly
115 120 125
Arg Ala Leu Phe His Leu Gln Gln Arg Arg Gly Phe Lys Ser Asn Arg
130 135 140
Lys Thr Asp Arg Lys Asp Asp Asp Arg Ser Ala Met Lys Ser Ala Ile
145 150 155 160
Ala Ser Leu Gln Ser Asp Leu Gly Asp Asp Thr Leu Gly Thr Tyr Met
165 170 175
Trp Lys Arg Ile Gln Asn Gly Glu Ser Val Arg Ser Arg Pro Arg Lys
180 185 190
Val Gly Ser Lys Asn Glu Tyr Asp Phe Tyr Val Asn Arg Ala Met Val
195 200 205
Glu Asp Glu Phe Asn Gln Leu Trp Asp Tyr Gln Ser Gln Ser His Gly
210 215 220
Asp Leu Leu Thr Asp Glu Ala Arg Ile Arg Val His Asp Ala Ile Phe
225 230 235 240
Ser Gln Arg Pro Leu Lys Pro Val Asp Pro Gly Arg Cys Thr Phe Glu
245 250 255
Thr Asp Gln Arg Arg Ala Pro Lys Ala Leu Pro Ser Ser Gln Leu Phe
260 265 270
Arg Ile Tyr Gln Glu Leu Asn Ala Ile Arg Val Ile Asp Pro Phe Ser
275 280 285
Ser Asp Gln Ala Asp Arg Pro Leu Thr Arg Gln Glu Arg Asp Ala Gly
290 295 300
Ala Ser Phe Leu Leu Gly Arg Val Lys Ala Thr Phe Pro Gln Leu Lys
305 310 315 320
Lys Ala Met Phe Gly Pro Thr Lys Leu Gln Leu Ser Leu Glu Tyr Gly
325 330 335
Glu Arg Lys Asn Ile Leu Gly Asp Val Val Gly Ser Glu Leu Arg Lys
340 345 350
Ala Gln His Ile Gly Pro Asp Trp Glu Thr Tyr Asp Leu Ala Thr Gln
355 360 365
Asp Leu Ile Val Thr Ile Leu Leu Glu Ala Asp Thr Asp Asp Glu Val
370 375 380
Ile Glu Arg Leu Gln Ala Glu Ser Ser Leu Ser Leu Asp Gln Val His
385 390 395 400
Gly Ala Leu Glu Ala Pro Leu Pro Asp Asp Tyr Leu Arg Leu Ser His
405 410 415
Arg Ala Ile Gly Lys Ile Leu Pro His Leu Lys Asp Glu Trp Asn Glu
420 425 430
Glu Gly Asn Ala Pro Val Met Tyr Asp Ala Ala Val Arg Ala Ala Gly
435 440 445
Tyr Gln Ser His Ser Glu Phe His Ser Gly Val Leu Glu Asp Thr Leu
450 455 460
Pro Tyr Tyr Gly Lys Val Leu Lys Arg Tyr Thr Gln Glu Val Ser Gly
465 470 475 480
Ser Ser Gln Ala Ala Thr Asn Pro Asp Glu Trp Glu Phe Gly Lys Ile
485 490 495
Ala Asn Pro Thr Val His Ile Gly Leu Asn Gln Ile Arg Thr Val Val
500 505 510
Asn Ser Leu Ile Asp Arg Tyr Gly Leu Pro Thr Gln Ile His Val Glu
515 520 525
Val Ala Arg Asp Leu Gly Gln Ser Ala Glu Gly Arg Arg Glu Ala Ala
530 535 540
Ser Asn Arg Ala Lys Asn Glu Arg Ala Asn Glu Ala Leu Asn Ala Arg
545 550 555 560
Leu Thr Glu Leu Gly Gln Arg Thr Asn Phe Ala Asn Arg Glu Arg Leu
565 570 575
Arg Leu Tyr Asp Glu Ile Ser Val Leu Asn His Arg Cys Val Leu Thr
580 585 590
Gly Ile Pro Ile Glu Met Ser Arg Leu Phe Thr Asn Asp Tyr Gln Val
595 600 605
Asp His Ile Leu Pro Phe Ser Arg Thr Leu Asp Asp Ser Arg Gly Asn
610 615 620
Lys Ile Leu Val His His Thr Ala Asn Gln Phe Lys Gly Ala Arg Ser
625 630 635 640
Pro Phe Glu Ala Tyr Ser Glu Thr Ala Asp Trp Asp His Ile Leu Gln
645 650 655
Arg Ala Ser Asp Ala Phe Gly Ala Thr Ser Pro Lys Phe Lys Arg Phe
660 665 670
Ser Ala Asp Ala Met Asp Arg Tyr Ser Asn Gly Glu Gln Asp Phe Ile
675 680 685
Ala Arg Gln Leu Asn Asp Thr Ser Tyr Leu Ala Arg Val Thr Arg Glu
690 695 700
Tyr Leu Gly Ser Ile Val Asp Pro Asp Arg Ile Leu Ala Thr Pro Gly
705 710 715 720
Arg Leu Thr Ser Leu Leu Arg His His Trp Gly Leu Asn Gly Leu Leu
725 730 735
Ser Asp Ala Ala Glu Lys Asn Arg Ser Asp His Arg His His Ala Ile
740 745 750
Asp Ala Leu Val Val Ala Leu Ser Glu Arg Val Thr Leu Lys Ala Val
755 760 765
Thr Asp Ala Asn Arg Arg Ala Gly Asp Gln Gly Ile Glu Arg Leu Leu
770 775 780
Val Asp Leu Pro Gln Pro Trp Glu Gly Phe Ala Asp His Ala Arg Glu
785 790 795 800
Ser Val Asp Arg Ile Val Val Ser His Lys Pro Asp His Asn Glu Lys
805 810 815
Gly Gln Leu His Glu Glu Thr Ala Tyr Gly Val Leu Glu Gly Pro Asp
820 825 830
Lys Lys Gly Arg Phe Leu Thr Arg Lys Arg Ile Thr Asp Pro Ala Lys
835 840 845
Gly Val Val Gly Ser Trp Glu Gln Pro Lys Trp Arg Asp Val Ile Pro
850 855 860
Leu Tyr Arg Arg Gly Glu Gly Pro Asp Ser Thr Leu Pro Tyr Lys Ala
865 870 875 880
Tyr Ile Gly Gly Ser Asn Tyr Cys Ile Glu Ile Val Arg Thr Ala Lys
885 890 895
Gly Lys Trp Ala Gly Glu Val Val Ser Thr His Thr Ala Asn Thr Ala
900 905 910
Glu Tyr Arg Ala Phe Met Ala Glu Pro Gly Ala Tyr Arg Ala Gln Ser
915 920 925
Tyr Ala Gly Gly Asp Leu Val Met Arg Leu Ile Ala Asn Asp Thr Ile
930 935 940
Ala Ile Glu Val Gly Asp Ala Gly Arg Gln Ile Met Arg Leu Cys Gln
945 950 955 960
Leu Glu Thr Val Gly Ala Met Tyr Phe Ala Asn Val Arg Glu Gly Asn
965 970 975
Val Ala Ala Arg Ser Arg Ala Arg Asp Asn Asp Phe Ser Leu Leu Lys
980 985 990
Lys Ala Ala Ser Thr Leu Gln Pro Leu Lys Ala Arg Arg Val Phe Val
995 1000 1005
Asp Pro Ile Gly Arg Val Phe Asp Pro Asp Phe Lys Glu
1010 1015 1020
<210> 2
<211> 3066
<212> DNA
<213> Demequina sediminicola
<220>
<223> белок, гомологичный Cas9
<400> 2
atgactggca ctgacgccac agcacactcg cacacgccgt accgcctcgg gctcgatgta 60
gggacaggat ctttgggttg ggccgtcgtt gaactcgata ccgacggcaa tcctgtccgc 120
atcgtgcgca ccggctcgcg gatctatggg agcgggcgca aacccaagga cttttcatcg 180
ttagcggccg accggcgtgc cgcacgtcag atgcgcaagc aacgcgaccg ctatcttcaa 240
cgccgcacgc gcctcatgca tgaactggtg gccgccggtc tgatgcccga ggccgaggtg 300
gagcggcaga agctcaagga tctcaacccc tacctgctac gcgctcgtgg ggttaaagag 360
gaactgaccg cccacgaact tggcagggct ctctttcatc tccagcagcg ccgtggcttc 420
aagtcaaatc gcaagacaga ccgcaaggac gacgaccgca gcgcgatgaa gagcgccatc 480
gcatcgctcc aatccgactt gggcgacgac acccttggca cgtacatgtg gaagcggatc 540
cagaacggcg aatctgtgcg gtcccgtccg cgaaaggtcg ggtcaaagaa cgagtacgac 600
ttttacgtga accgcgcgat ggtcgaggat gagttcaatc agttgtggga ctaccaaagc 660
cagtcccacg gcgacctcct cacggacgaa gcccgcatcc gcgttcatga cgccatcttt 720
agccaacgtc cgctcaagcc ggtggacccg gggcgctgca cgttcgaaac agatcagcga 780
cgcgcaccga aggcactccc gagctctcaa ctgttccgca tctaccaaga acttaacgcg 840
atcagagtga tcgatccgtt ctcatcagac caagcagatc gacccctgac gcgtcaggag 900
cgcgatgccg gcgcatcgtt cctcctgggc agggtgaagg ccaccttccc tcaactcaag 960
aaggcgatgt ttgggcccac aaagctccaa ctctcacttg agtacggaga acgcaagaac 1020
atcctgggtg acgtcgtagg aagcgagttg cgcaaagcgc agcacatcgg cccagactgg 1080
gagacgtatg acctcgccac ccaggacctc atcgtgacga tcctgctcga ggcagacact 1140
gacgatgaag tgatcgagcg gcttcaggct gagtcgtcgc tatcgctcga tcaggtccac 1200
ggcgcgcttg aggcaccact cccggacgac tacctacggc tgagccatcg tgcgattggc 1260
aagatcctgc ctcatctcaa ggatgaatgg aatgaagagg gcaatgcacc ggtgatgtat 1320
gacgcggccg tccgtgccgc gggataccaa tcgcactcag agttccacag cggtgttctt 1380
gaagacacgc tcccctatta cgggaaggtg ctgaagcgat acacgcaaga ggtctccggg 1440
agcagccaag ctgctacgaa ccctgacgaa tgggagttcg gcaagatcgc caatccgacc 1500
gtgcacatcg gcctcaatca gatccgcacc gtcgtgaact cactgattga ccgctacggc 1560
ctgcccacac agattcatgt cgaggtagcc cgcgacttgg gccagtcggc tgagggaagg 1620
cgtgaagcag cgtccaaccg tgccaagaat gaacgagcaa acgaagcgct caacgcccgc 1680
ctgaccgaac tgggacaacg caccaacttt gccaatcggg agcggctgcg cctctacgat 1740
gagatctcag tcctcaatca caggtgtgtc ctgacaggca tccccatcga gatgtcgcga 1800
ctgttcacca atgactatca ggttgaccac atcctgccgt tctcccggac cctggacgac 1860
tcgcgcggaa acaagattct ggttcaccac acggccaatc agttcaaggg cgcccggagc 1920
cccttcgagg catactcgga gacggcagac tgggatcaca tccttcaacg cgcaagcgat 1980
gcctttggcg ctacgagccc caagttcaag cgcttttctg ccgacgccat ggacaggtac 2040
tcgaacggcg agcaagactt catcgcccgc caactcaacg acaccagcta cctggcacga 2100
gtgacacgcg agtatctagg gagcatcgtg gatcccgacc ggatcctagc cacaccgggc 2160
agacttactt cgctcttgcg ccaccactgg gggctcaatg gcctgctatc cgatgccgcg 2220
gagaagaacc gctcagatca ccggcaccac gccatcgatg cccttgtcgt tgcactcagt 2280
gagcgagtaa ctctaaaggc cgtcaccgac gccaaccgtc gtgccggtga ccaaggcatc 2340
gaacgcttgc tagtcgacct cccccagccg tgggagggct ttgcggatca tgcccgtgag 2400
tctgttgatc gcattgtggt gtctcacaag ccagatcaca atgagaaagg ccagctccac 2460
gaagagaccg cctatggagt cctggaaggg cccgacaaaa agggcaggtt cctcacccgc 2520
aagcgcatca cggaccctgc caaaggtgtg gtaggcagtt gggagcaacc caagtggcgt 2580
gacgtcattc cgctgtacag gcgcggcgag gggccagact cgacccttcc ctacaaggct 2640
tacattggcg gctccaacta ctgcatcgag atcgtccgaa ctgccaaggg gaaatgggct 2700
ggggaggtag tctccacgca caccgccaac acggccgagt atcgcgcttt catggcagag 2760
ccgggcgcgt atcgcgccca gagttacgcc ggtggtgacc tcgtcatgcg gctcatcgcc 2820
aatgacacca tcgcaatcga agtcggcgat gcgggtcgcc agatcatgag gctgtgccag 2880
ttggagacgg tcggagctat gtacttcgca aatgtgcgtg aaggcaacgt cgcagcacgt 2940
tcacgggctc gagacaacga cttttcgttg ctcaagaagg cggcaagcac acttcagcca 3000
ctcaaggctc ggagagtctt tgttgatccc attggcaggg tttttgaccc tgatttcaag 3060
gagtag 3066
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО РАЗРЕЗАНИЯ ДНК НА ОСНОВЕ CAS9 БЕЛКА ИЗ БАКТЕРИИ PASTEURELLA PNEUMOTROPICA | 2019 |
|
RU2722934C1 |
| ПРИМЕНЕНИЕ CAS9 БЕЛКА ИЗ БАКТЕРИИ PASTEURELLA PNEUMOTROPICA ДЛЯ МОДИФИКАЦИИ ГЕНОМНОЙ ДНК В КЛЕТКАХ | 2019 |
|
RU2724470C1 |
| Средство разрезания ДНК на основе Cas9 белка из бактерии Capnocytophaga ochracea | 2021 |
|
RU2778156C1 |
| СПОСОБ СОЗДАНИЯ НОВЫХ МУТАЦИЙ В ОРГАНИЗМАХ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2833881C1 |
| Средство разрезания двунитевой ДНК с помощью Cas12d белка из Katanobacteria и гибридной РНК, полученной путем слияния направляющей CRISPR РНК и scout РНК | 2020 |
|
RU2771626C1 |
| СИСТЕМА РЕДАКТИРОВАНИЯ ГЕНОМА CRISPR/CAS9 II ТИПА И ЕЕ ПРИМЕНЕНИЕ | 2022 |
|
RU2794774C1 |
| ШТАММ ESCHERICHIA COLI BL21(DE3)PLYSS/PET15B-HISCPF1 - ПРОДУЦЕНТ РНК-НАПРАВЛЯЕМОЙ ЭНДОНУКЛЕАЗЫ CRISPR/CPF1 | 2021 |
|
RU2774120C1 |
| КОМПОНЕНТЫ СИСТЕМЫ CRISPR-CAS, СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ | 2013 |
|
RU2796549C2 |
| НОВЫЕ ФЕРМЕНТЫ И СИСТЕМЫ CRISPR | 2016 |
|
RU2777988C2 |
| КОНСТРУИРОВАНИЕ СИСТЕМ, СПОСОБЫ И ОПТИМИЗИРОВАННЫЕ НАПРАВЛЯЮЩИЕ КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ | 2013 |
|
RU2796017C2 |

Изобретение относится к биотехнологии и касасется применения белка, содержащего аминокислотную последовательность SEQ ID NO: 1 или содержащего аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 1 и имеет отличия по сравнению с SEQ ID NO: 1 только в неконсервативных аминокислотных остатках, для образования двунитевого разрыва в молекуле ДНК, расположенного непосредственно перед нуклеотидной последовательностью 5'-NN/GNNACN-3' в указанной молекуле ДНК. Изобретение позволяет достигнуть упрощения редактирования генома биотехнологически значимой бактерии. 2 н. и 3 з.п. ф-лы, 8 ил., 2 табл., 3 пр.
1. Применение белка, содержащего аминокислотную последовательность SEQ ID NO: 1 или содержащего аминокислотную последовательность, которая по меньшей мере на 95% идентична аминокислотной последовательности SEQ ID NO: 1 и имеет отличия по сравнению с SEQ ID NO: 1 только в неконсервативных аминокислотных остатках, для образования двунитевого разрыва в молекуле ДНК, расположенного непосредственно перед нуклеотидной последовательностью 5'-NA/GNNACN-3' в указанной молекуле ДНК.
2. Применение белка по п. 1, характеризующееся тем, что образование двунитевого разрыва в молекуле ДНК происходит при температуре 37°С .
3. Применение белка по п. 1, где белок содержит аминокислотную последовательность SEQ ID NO: 1.
4. Способ образования двунитевого разрыва в последовательности геномной ДНК одноклеточного или многоклеточного организма, непосредственно примыкающей к последовательности 5'-NA/GNNACN-3', включающий введение в по меньшей мере одну клетку этого организма эффективного количества: а) белка, содержащего аминокислотную последовательность SEQ ID NO: 1, либо нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность SEQ ID NO: 1, и б) направляющей РНК, содержащей последовательность, образующую дуплекс с нуклеотидной последовательностью участка геномной ДНК организма, непосредственно примыкающей к нуклеотидной последовательности 5'-NA/GNNACN-3' и взаимодействующей с указанным белком после образования дуплекса, либо последовательности ДНК, кодирующей указанную направляющую РНК;
при этом взаимодействие указанного белка с указанной направляющей РНК и нуклеотидной последовательностью 5'-NA/GNNACN-3' приводит к образованию двунитевого разрыва в последовательности геномной ДНК, непосредственно примыкающей к последовательности 5'-NA/GNNACN-3'.
5. Способ по п. 4, дополнительно включающий введение экзогенной последовательности ДНК одновременно с направляющей РНК.
| ОПОСРЕДОВАННОЕ НУКЛЕАЗОЙ НАЦЕЛИВАНИЕ С БОЛЬШИМИ НАЦЕЛИВАЮЩИМИ ВЕКТОРАМИ | 2013 |
|
RU2645475C2 |
| WO 2014093661 A2, 19.06.2014 | |||
| RU 2015143201 A, 20.04.2017 | |||
| DELTCHEVA E | |||
| et al | |||
| КОЛЕНЧАТО-РЫЧАЖНЫЙ ПРЕСС ДЛЯ ЦЕМЕНТНЫХ ЧЕРЕПИЦ, ПЛИТОК И Т.П. С МНОГОКРАТНЫМ НАЖАТИЕМ НА ФОРМУЕМУЮ МАССУ | 1922 |
|
SU471A1 |
Авторы
Даты
2020-06-05—Публикация
2019-06-11—Подача