Область изобретения
Настоящее изобретение относится к микроорганизму для получения L-аминокислоты с повышенной активностью α-глюкозидазы и к способу получения L-аминокислоты с его использованием.
Предшествующий уровень техники
L-аминокислоты используют в производстве кормов для животных, лекарственных и косметических средств и получают главным образом путем ферментации с использованием рода Corynebacterium или рода Escherichia. Для получения L-аминокислот были проведены различные исследования, такие как разработка высокопроизводительных штаммов и высокоэффективных технологий процесса ферментации. В частности, главным образом применяли способы, использующие подход, специфичный в отношении целевого материала, такие как увеличение экспрессии генов, кодирующих ферменты, вовлеченные в биосинтез L-аминокислот, или удаление генов, не являющихся необходимыми для биосинтеза (Патент Кореи с регистрационным номером 10-0838038).
Между тем, были проведены различные исследования по увеличению доступности сахара для увеличения продуктивности микроорганизма по целевому веществу, и в то же время имеется постоянная потребность в рассмотрении эффективного состава среды и роста микроорганизмов. Например, была описана технология получения мутантного микроорганизма, обладающего способностью увеличивать доступность целлобиозы путем сверхэкспрессии генов ascB или chbF и в то же время использовать целлобиозу и другие сахара, такие как ксилоза, манноза и галактоза, и получения биотоплива с использованием этого микроорганизма (Патент Кореи с регистрационным номером 10-1484108). Однако существует потребность в продолжении исследований корреляции между доступностью сахара и продуктивностью микроорганизма в отношении L-аминокислот.
Раскрытие изобретения
Техническая задача
Авторы настоящего изобретения неожиданно обнаружили и подтвердили эффект улучшения выхода L-аминокислоты в качестве целевого вещества без добавления изомальтозы и мальтозы в результате введения α-глюкозидазы, которая, как известно, расщепляет изомальтозу и мальтозу, в штамм рода Corynebacterium, тем самым создав настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Corynebacterium с повышенной активностью α-глюкозидазы, продуцирующий L-аминокислоту.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ получения L-аминокислоты, включающий культивирование микроорганизма в среде и выделение L-аминокислоты из культуральной среды или микроорганизма.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ увеличения продуцирования L-аминокислоты, включающий усиление экспрессии α-глюкозидазы в микроорганизме.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить применение α-глюкозидазы для увеличения продуцирования L-аминокислоты.
Полезные эффекты изобретения
Согласно настоящему изобретению микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту, обладает повышенной активностью α-глюкозидазы, что тем самым повышает выход продуцируемой L-аминокислоты. Следовательно, этот микроорганизм может быть очень полезен для получения L-аминокислоты.
Краткое описание графических материалов
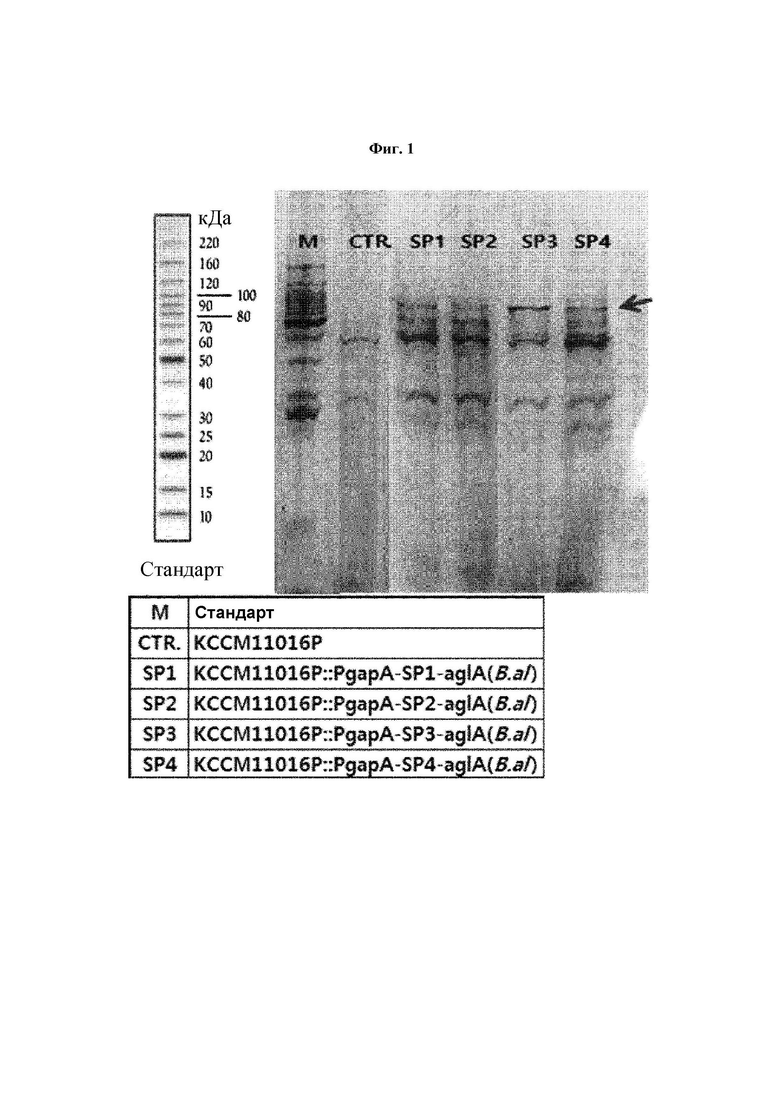
На Фиг. 1 проиллюстрирован результат электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) с подтверждением экспрессии α-глюкозидазы в штаммах Corynebacterium glutamicum.
Наилучшее воплощение изобретения
В частности, настоящее изобретение далее описано следующим образом. Между тем, каждое описание и воплощение, раскрытое в настоящем изобретении, также может быть применено к каждому другому описанию и воплощению. То есть, все комбинации различных компонентов, раскрытых в настоящем описании, входят в объем настоящего изобретения. Дополнительно, конкретное описание, изложенное ниже, может не ограничивать объем настоящего изобретения.
Для выполнения этих задач, в одном аспекте настоящего изобретения предложен микроорганизм рода Corynebacterium, который продуцирует L-аминокислоту, с повышенной активностью α-глюкозидазы. Микроорганизм рода Corynebacterium по настоящему изобретению обладает повышенной активностью α-глюкозидазы для улучшения продуктивности по L-аминокислоте. Соответственно, микроорганизм рода Corynebacterium по настоящему изобретению может быть очень полезен в использовании для получения L-аминокислоты.
В настоящем изобретении термин “α-глюкозидаза” обозначает тип глюкозидазы для расщепления сахара до глюкозы и относится к ферменту, обладающему свойством расщеплять связь α(1→4). В настоящем изобретении α-глюкозидаза может представлять собой белок, обладающий активностью α-глюкозидазы, кодируемый геном aglA, но при условии, что α-глюкозидаза обладает активностью, соответствующей глюкозидазе, которая усилена у микроорганизма рода Corynebacterium для улучшения продуктивности по L-аминокислоте, тип которой конкретно не ограничен. Известно, что белок, обладающий активностью α-глюкозидазы, кодируемый геном aglA, обладает активностью по расщеплению изомальтозы или мальтозы (Glycobiology. 2010 Nov;20(11)), и информация по α-глюкозидазе легко может быть получена специалистом в данной области техники из известной базы данных (например, NCBI, UniProt и так далее). В настоящем изобретении α-глюкозидаза может представлять собой α-глюкозидазу, имеющую происхождение из Bifidobacterium adolescentis, Erwinia amylovora или Saccharomyces cerevisiae, и в частности, α-глюкозидазу, имеющую происхождение из Bifidobacterium adolescentis, но не ограничиваясь этим. α-Глюкозидаза, имеющая происхождение из Bifidobacterium adolescentis, описанная в примере по настоящему изобретению, может представлять собой белок, содержащий аминокислотную последовательность SEQ ID NO: 1, но не ограничена этим. α-Глюкозидаза, имеющая происхождение из Erwinia amylovora, может представлять собой белок, содержащий аминокислотную последовательность SEQ ID NO: 28, но не ограничена этим. α-Глюкозидаза, имеющая происхождение из Saccharomyces cerevisiae, может представлять собой белок, содержащий аминокислотную последовательность SEQ ID NO: 29, но не ограничена этим. Белок, содержащий аминокислотную последовательность SEQ ID NO: 1, можно использовать в комбинации белка, имеющего аминокислотную последовательность SEQ ID NO: 1, и белка, состоящего из аминокислотной последовательности SEQ ID NO: 1.
Далее, даже если “белок или полипептид, содержащий аминокислотную последовательность, входящую в перечень с определенным номером последовательности” раскрыт в настоящем изобретении, если белок обладает активностью такой же или эквивалентной таковой полипептида, содержащего аминокислотную последовательность с соответствующим номером последовательности, очевидно, что белки, имеющие аминокислотную последовательность, которая имеет частичную делецию, модификацию, замену, консервативную замену или вставку, также включены в объем настоящего изобретения. Например, если белок обладает активностью такой же или эквивалентной таковой полипептида, содержащего аминокислотную последовательность с соответствующим номером последовательности, очевидно, что вставка последовательности, которая не изменяет функцию белка, перед и после аминокислотной последовательности, ее природная мутация, молчащая мутация или консервативная замена не исключены, и вставка или мутация последовательности включены в объем настоящего изобретения. Далее, если белок обладает активностью такой же или эквивалентной таковой полипептида, содержащего аминокислотную последовательность с соответствующим номером последовательности, аминокислотная последовательность, имеющая 80% или более гомологии или идентичности, в частности 90% или более, более конкретно 95% или еще более конкретно 99% или более, с аминокислотной последовательностью с соответствующим номером последовательности, может быть включена в объем настоящего изобретения.
Например, белок, обладающий активностью α-глюкозидазы, по настоящему изобретению может представлять собой белок, содержащий аминокислотную последовательность (SEQ ID NO: 1) α-глюкозидазы, имеющей происхождение из Bifidobacterium adolescentis, аминокислотную последовательность (SEQ ID NO: 28) α-глюкозидазы, имеющей происхождение из Erwinia amylovora, или аминокислотную последовательность (SEQ ID NO: 29) α-глюкозидазы, имеющей происхождение из Saccharomyces cerevisiae. Если α-глюкозидаза по настоящему изобретению представляет собой белок, обладающий действием, соответствующим α-глюкозидазе, и повышает активность в микроорганизме рода Corynebacterium с улучшением продуктивности по L-аминокислоте, очевидно, что α-глюкозидаза включена в белок, обладающий активностью α-глюкозидазы, по настоящему изобретению. В частности, при условии, что α-глюкозидаза по настоящему изобретению обладает активностью α-глюкозидазы и повышает активность в микроорганизме рода Corynebacterium с улучшением продуктивности по L-аминокислоте, аминокислотная последовательность, имеющая 80% или более гомологии или идентичности, в частности 90% или более, более конкретно 95% или еще более конкретно 99% или более, с аминокислотной последовательностью SEQ ID NO: 1, SEQ ID NO: 28 или SEQ ID NO: 29, может быть включена в объем настоящего изобретения.
В настоящем изобретении термин “гомология или идентичность” означает степень сходства, ассоциированную с двумя данными аминокислотными последовательностями или последовательностями оснований, и она может быть выражена в процентах. Далее, термины “гомология” и “идентичность” часто можно использовать взаимозаменяемо.
Гомологию или идентичность консервативного полинуклеотида или полипептида определяют путем стандартного матричного алгоритма, и вместе с ним можно использовать штраф за пропуск в последовательности, установленный используемой программой по умолчанию. По существу, гомологичные или идентичные последовательности обычно могут гибридизоваться в умеренно строгих или очень строгих условиях при соответствии по меньшей мере примерно на 50%, 60%, 70%, 80% или 90% полной последовательности или полной длины. В гибридизованном полинуклеотиде также предусматривают полинуклеотид, содержащий вместо кодона вырожденный кодон.
Обладают ли любые два полинуклеотида или полипептида гомологией, сходством или идентичностью, можно определить с использованием известного компьютерного алгоритма, такого как программа "FASTA", с использованием параметров по умолчанию, как например в Pearson et al. (1988)[Proc. Natl. Acad. Sci. USA 85]: 2444. Альтернативно, как выполнено в программе “Needleman” пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277) (версия 5.0.0 или более поздняя версия), гомологию, сходство или идентичность можно определить с помощью алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453) (включая пакет программ GCG (Devereux, J., et al., Nucleic Acids Research 12: 387 (1984)), BLASTP, BLASTN, FASTA (Atschul, [S.] [F.,] [ET AL, J MOLEC BIOL 215]: 403 (1990); Guide to Huge Computers, Martin J. Bishop, [ED.,] Academic Press, San Diego,1994, и [CARILLO ETA/.](1988) SIAM J Applied Math 48: 1073). Например, гомологию, сходство или идентичность можно определить с помощью BLAST или ClustalW от Национального Центра Биотехнологической Информации.
Гомологию, сходство или идентичность полинуклеотида или полипептида можно определить путем сравнения информации о последовательностях с помощью компьютерной программы GAP, например, Needleman et al. (1970), J Mol Biol.48 : 443. В кратком изложении, программа GAP определяет величину, полученную путем деления числа одинаково расположенных символов (то есть нуклеотидов или аминокислот) на общее число символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать: (1) одинарную матрицу числового сравнения (содержащую значения 1 в случае идентичности и 0 в случае неидентичности) и взвешенную матрицу сравнения от Gribskov et al.(1986) Nucl. Acids Res. 14: 6745, как раскрыто в Schwartz и Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp. 353-358 (1979) (альтернативно, матрица замен EDNAFULL (версия EMBOSS NCBI NUC4.4); (2) штраф 3,0 за каждый пропуск и дополнительно штраф 0,10 за каждый символ в каждом пропуске (альтернативно, штраф за внесение пропуска 10, штраф за продление пропуска 0,5) и (3) отсутствие штрафа за окончание пропуска. Соответственно, термины “гомология” или “идентичность”, используемые в настоящем изобретении, отражают соответствие между последовательностями.
В настоящем изобретении термин “консервативная замена” означает замену одной аминокислоты на другую аминокислоту, имеющую сходное структурное и/или химическое свойство. Вариант может иметь, например, одну или более чем одну консервативную замену, в то же время сохраняя одну или более чем одну биологическую активность. Такая аминокислотная замена обычно может происходить на основе полярности, заряда, растворимости и сходства в гидрофобной, гидрофильной и/или амфипатической природе остатков. Например, положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; отрицательно заряженные (кислые) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту; ароматические аминокислоты включают фенилаланин, триптофан и тирозин; и гидрофобные аминокислоты включают аланин, валин, изолейцин, лизин, метионин, фенилаланин, тирозин и триптофан.
Далее, полинуклеотидная последовательность, кодирующая α-глюкозидазу может представлять собой полинуклеотидную последовательность, кодирующую белок, обладающий активностью α-глюкозидазы и имеющий повышенную активность в микроорганизме рода Corynebacterium для улучшения продуктивности по L-аминокислоте. Например, полинуклеотидная последовательность, кодирующая α-глюкозидазу, может представлять собой полинуклеотид, кодирующий α-глюкозидазу, имеющую происхождение из Bifidobacterium adolescentis (SEQ ID NO: 1); α-глюкозидазу, имеющую происхождение из Erwinia amylovora (SEQ ID NO: 28), и α-глюкозидазу, имеющую происхождение из Saccharomyces cerevisiae (SEQ ID NO: 29). Например, полинуклеотидная последовательность может иметь последовательность оснований SEQ ID NO: 2, последовательность оснований SEQ ID NO: 30 и последовательность оснований SEQ ID NO: 31, но последовательность оснований может быть модифицирована в кодирующей области вследствие вырожденности кодонов. Дополнительно, различные модификации могут быть выполнены в кодирующей области в таком диапазоне, чтобы аминокислотная последовательность оставалась без изменений с учетом кодона, предпочтительного для организма для экспрессии последовательности оснований. Полинуклеотидная последовательность может представлять собой полинуклеотид, включающий полинуклеотидную последовательность, кодирующую белок, или полинуклеотидную последовательность, имеющую 80%, 90%, 95% или 99% гомологии или идентичности с таковой. Далее, если полинуклеотидная последовательность представляет собой полинуклеотидную последовательность, кодирующую белок, имеющий гомологию или идентичность и обладающий действием, по существу идентичным или соответствующим таковому данного белка, очевидно, что полинуклеотидная последовательность, которая имеет частичную делецию, модификацию, замену или вставку, включена в объем настоящего изобретения.
Альтернативно, зонд, который может быть получен из известной последовательности гена, например, последовательности, кодирующей белок, обладающий активностью α-глюкозидазы по настоящему изобретению, путем гибридизации с последовательностью, комплементарной полной полинуклеотидной последовательности или ее части в строгих условиях, может быть включен без ограничения. Термин “строгие условия” означает условия, обеспечивающие возможность специфичной гибридизации между полинуклеотидами. Эти условия более конкретно раскрыты в литературе (например, Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989). Например, условия, при которых гибридизуются гены, имеющие высокую степень гомологии, то есть гены, имеющие 80% или более гомологии, в частности 90% или более, более конкретно 95% или более, и еще более конкретно 97% или более, и особенно 99% или более, и не гибридизуются гены, имеющие низкую степень гомологии, или условия промывки общепринятой гибридизации по Саузерну, где промывку выполняют однократно, в частности от 2 до 3 раз, в условиях концентрации соли и температуры, соответствующих 60°C, 1×SSC (стандартный раствор хлорида и цитрата натрия), 0,1% SDS, в частности 60°C, 0,1×SSC, 0,1% SDS и более конкретно 68°C, 0,1× SSC, 0,1% SDS, могут быть включены. Для гибридизации необходимо, чтобы два полинуклеотида имели комплементарные последовательности, даже если несовпадение (mismatch) между основаниями возможно в соответствии со степенью строгости гибридизации. Термин “комплементарный” используется для описания отношения между основаниями полинуклеотидов, которые могут гибридизоваться друг с другом. Например, в ДНК аденозин комплементарен тимину, а цитозин комплементарен гуанину. Соответственно, настоящее изобретение может включать выделенные нуклеотидные сегменты, комплементарные полной последовательности, а также по существу сходную нуклеотидную последовательность. В частности, для полинуклеотидов, обладающих гомологией, используют условия гибридизации, включающие гибридизацию при величине Tm 55°C, и они могут быть определены с использованием вышеуказанных условий. Дополнительно, величина Tm может составлять 60°C, 63°C или 65°C, но не ограничиваясь этим, и может быть соответствующим образом уточнена специалистом в данной области техники в соответствии с его задачей. Подходящая степень строгости гибридизации полинуклеотидов зависит от длины и степени комплементарности полинуклеотида, и переменных, хорошо известных в данной области техники (см. Sambrook et al., выше, 9.50-9.51, 11.7-11.80).
В настоящем изобретении термин “повышение активности” означает, что активность увеличена при сравнении с активностью белка в природном состоянии или состоянии до мутации у исходного микроорганизма, то есть эндогенной активностью, и представляет собой понятие, включающее введение активности, обеспечивающей его активность путем введения в микроорганизм белка, не обладающего активностью определенного белка. Термин “эндогенная активность” означает активное состояние белка, проявляющееся в природном состоянии или немутированном состоянии исходного микроорганизма.
В частности, термин “повышение активности” конкретно не ограничен этим, но может включать повышение активности путем увеличения активности эндогенного гена, амплификации эндогенного гена вследствие внутренних или внешних факторов, введения генов извне, замены или модификации промоторов и увеличения ферментативной активности путем мутации, а также получение какого-либо эффекта помимо его исходной функции путем повышения активности самого белка. Например, “повышение активности” может быть выполнено путем увеличения в клетках числа копий генов, кодирующих белок, способом модификации последовательности, регулирующей экспрессию гена, кодирующего полипептид, способом модификации генов, кодирующих полипептид на хромосоме путем замены генов, кодирующих полипептид на хромосоме, на мутантные гены для повышения активности полипептида или индуцирования мутации в генах, кодирующих полипептид, на хромосоме для повышения активности полипептида и способом введения генов извне или вставки генов в хромосому, но не ограничиваясь этими способами.
Увеличение числа копий генов конкретно не ограничено, но может быть выполнено так, чтобы обеспечить функциональную связь с вектором или вставку в хромосому клетки-хозяина. В частности, в клетку-хозяина может быть введен вектор, который функционально связан с полинуклеотидом, кодирующим белок по настоящему изобретению, и реплицирован, и функционирующий независимо от хозяина. Альтернативно, вектор, который функционально связан с полинуклеотидом для вставки полинуклеотида в хромосому клетки-хозяина, может быть введен в хромосому клетки-хозяина. Вставка полинуклеотида в хромосому может быть выполнена любым способом, известным в данной области техники, например, гомологичной рекомбинацией. Поскольку вектор по настоящему изобретению может быть вставлен в хромосому путем гомологичной рекомбинации, вектор может дополнительно включать маркер селекции для подтверждения вставки в хромосому. Маркер селекции позволяет отбирать клетки, трансформированные вектором, для подтверждения вставки целевого полинуклеотида, и маркеры можно использовать для обеспечения селективных фенотипов, таких как устойчивость к лекарственным средствам, ауксотрофия, устойчивость к цитотоксическим лекарственным средствам или экспрессия поверхностных белков, но не ограничиваясь этим. В среде, обработанной селективным агентом, поскольку только клетки, экспрессирующие маркер селекции, выживают или проявляют различные фенотипы экспрессии, трансформированные клетки могут быть отобраны.
Термин “вектор” в настоящем изобретении относится к ДНК-конструкции, содержащей полинуклеотидную последовательность, кодирующую целевой пептид, которая функционально связана с подходящей последовательностью для регуляции экспрессии целевого белка в подходящем хозяине. Последовательность для регуляции экспрессии включает промотор, способный запускать транскрипцию, любую операторную последовательность для регуляции такой транскрипции, последовательность, кодирующую подходящий сайт связывания мРНК с рибосомой, и последовательность для регуляции терминации транскрипции и трансляции, но не ограничиваясь этим. Вектором можно трансформировать подходящую клетку-хозяина, и затем он может реплицироваться или функционировать независимо от генома хозяина или сам интегрировать в геном. Вектор, используемый в настоящем изобретении, конкретно не ограничен, и можно использовать любой вектор, известный в данной области техники. Примеры векторов, которые обычно используют, включают природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора можно использовать pWE15, M13, λMBL3, λMBL4, λIXII, λASHII, λAPII, λt10, λt11, Charon4A, Charon21A и им подобные, и в качестве плазмидного вектора можно использовать плазмиды на основе pDZ, на основе pBR, на основе pUC, на основе pBluescriptII, на основе pGEM, на основе pTZ, на основе pCL и на основе pET.
Дополнительно, вектор может содержать полинуклеотидную последовательность, кодирующую сигнальный пептид. В настоящем изобретении термин “сигнальный пептид” относится к белку, в котором целевой белок может секретироваться наружу из клетки, и который можно применять для экспрессии в интегрированной или раздельной форме с генами, кодирующими целевой белок. При условии, что сигнальный пептид в настоящем изобретении может секретироваться наружу из клеток, в то же время поддерживая функцию целевого белка, его тип конкретно не ограничен. Например, в настоящем изобретении в качестве примеров сигнального пептида можно использовать CgR0949, NCgl2101, CgR1834 и ST2 (SEQ ID NO: 14-17, соответственно). Более того, известный подходящий сигнальный пептид может быть выбран специалистом в данной области техники с целью использования для экспрессии α-глюкозидазы с секрецией.
В настоящем изобретении термин “трансформация” относится к введению вектора, включающего полинуклеотид, кодирующий целевой белок, в клетку-хозяина таким образом, чтобы белок, кодируемый этим полинуклеотидом, экспрессировался в клетке-хозяине. При условии, что трансформированный полинуклеотид может экспрессироваться в клетке-хозяине, все трансформированные полинуклеотиды включены независимо от того, вставлен ли трансформированный полинуклеотид в хромосому клетки-хозяина и локализован в ней, или он локализован за пределами хромосомы. Дополнительно, полинуклеотид включает ДНК и РНК, кодирующие целевой белок. Полинуклеотид может быть введен в любой форме, при условии что полинуклеотид может быть введен в клетку-хозяина и экспрессироваться. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генетическую конструкцию, включающую все элементы, необходимые для самостоятельной экспрессии. Обычно экспрессионная кассета может включать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания с рибосомой и сигнал терминации трансляции. Экспрессионная кассета может представлять собой самореплицирующийся вектор экспрессии. Кроме того, полинуклеотид также может быть введен в клетку-хозяина как есть и функционально связан с последовательностью, необходимой для экспрессии в клетке-хозяине.
Дополнительно, вышеупомянутый термин “функционально связан” означает, что последовательность гена функционально связана с последовательностью промотора, который запускает и опосредует транскрипцию полинуклеотида, кодирующего целевой пептид по настоящему изобретению.
Далее, модификация последовательности регуляции экспрессии для повышения уровня экспрессии полинуклеотида конкретно не ограничена этим, но может быть выполнена путем индуцирования мутации в последовательности путем делеции, вставки, неконсервативной или консервативной замены или их комбинации в последовательности нуклеиновой кислоты для дополнительного усиления активности последовательности регуляции экспрессии, или может быть выполнена путем замены на последовательность нуклеиновой кислоты, обладающую более сильной активностью. В частности, модификация может быть выполнена путем замены на более сильный промотор. Последовательность регуляции экспрессии конкретно не ограничена этим, но может включать промотор; последовательность оператора; последовательность, кодирующую сайт связывания с рибосомой; последовательность, регулирующую терминацию транскрипции и трансляции, и им подобные.
Вместо исходного промотора сильный промотор может быть соединен с расположенной выше по ходу транскрипции частью единицы экспрессии полинуклеотида, но не ограничиваясь этим. Примеры известных сильных промоторов могут включать промоторы от cj1 до cj7 (Патент Кореи с регистрационным номером 0620092), промоторы spl1, 7 или 13 (Патент Кореи с регистрационным номером 1783170), промотор PgapA, промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага λ, промотор PL и промотор tet.
Кроме того, модификация полинуклеотидной последовательности в хромосоме конкретно не ограничена этим, но может быть выполнена путем индуцирования мутации в последовательности регуляции экспрессии путем делеции, вставки, неконсервативной или консервативной замены или их комбинации в последовательности нуклеиновой кислоты для дополнительного усиления активности полинуклеотидной последовательности или может быть выполнена путем замены на улучшенную полинуклеотидную последовательность, обладающую более сильной активностью. Однако она не ограничена этим.
В усилении активности белка, активность соответствующего белка отсутствует либо его активность или концентрация обычно может быть увеличена в целом до 1%, 10%, 25%, 50%, 75%, 100%, 150%, 200%, 300%, 400% или 500%, вплоть до 1000% или 2000% относительно активности или концентрации белка дикого типа или у исходного штамма микроорганизма, но не ограничиваясь этим.
Микроорганизм рода Corynebacterium по настоящему изобретению обладает повышенной активностью α-глюкозидазы с улучшением продуктивности по L-аминокислоте, как описано выше. Соответственно, микроорганизм рода Corynebacterium по настоящему изобретению можно использовать для продукции L-аминокислоты.
Термин “L-аминокислота” в настоящем изобретении означает основную составляющую единицу белка, который образует тело живого организма, в которой аминогруппа и карбоксильная группа связаны с одним и тем же атомом углерода. L-аминокислота может представлять собой по меньшей мере одну аминокислоту, выбранную из группы, состоящей из, например, L-аланина, L-аргинина, L-аспарагина, L-аспарагиновой кислоты, L-цистеина, L-глутаминовой кислоты, L-глутамина, глицина, L-гистидина, L-изолейцина, L-лейцина, L-лизина, L-метионина, L-фенилаланина, L-пролина, L-серина, L-треонина, L-триптофана, L-тирозина и L-валина. Кроме того, L-аминокислота может представлять собой, например, происходящую из аспарагиновой кислоты L-аминокислоту в пути биосинтеза микроорганизма и может представлять собой L-аминокислоту, образованную путем биосинтеза с использованием L-аспарагиновой кислоты в качестве субстрата или промежуточного соединения. Происходящая из аспарагиновой кислоты L-аминокислота в качестве более конкретного примера может представлять собой по меньшей мере одну аминокислоту, выбранную из группы, состоящей из L-лизина, L-треонина и L-изолейцина, но не ограничиваясь ими.
В настоящем изобретении “микроорганизм, который продуцирует L-аминокислоту” может представлять собой микроорганизм, обладающий способностью продуцировать L-аминокислоту из источников углерода в среде и накапливать ее. Тип микроорганизма, который продуцирует L-аминокислоту, конкретно не ограничен, но может представлять собой микроорганизмы, принадлежащие роду Enterobacter, роду Escherichia, роду Erwinia, роду Serratia, роду Pseudomonas, роду Providencia, роду Corynebacterium и роду Brevibacterium. Более конкретно, микроорганизм может представлять собой микроорганизм, принадлежащий роду Corynebacterium. “Род Corynebacterium” в настоящем изобретении может, в частности, быть представлен Corynebacterium glutamicum, Corynebacterium ammoniagenes, Brevibacterium lactofermentum, Brevibacterium flavum, Corynebacterium thermoaminogenes, Corynebacterium efficiens и им подобными, но не обязательно ограничиваясь ими. Более конкретно, микроорганизм, который продуцирует L-аминокислоту, может представлять собой Corynebacterium glutamicum, но не ограничиваясь им.
Микроорганизм рода Corynebacterium с повышенной активностью α-глюкозидазы может продуцировать L-аминокислоту с более высоким выходом продуцируемой L-аминокислоты по сравнению с микроорганизмом до повышения активности белка, то есть немодифицированным микроорганизмом.
В другом аспекте настоящего изобретения предложен способ получения L-аминокислоты, включающий культивирование микроорганизма рода Corynebacterium, который продуцирует L-аминокислоту, с повышенной активностью α-глюкозидазы.
Способ получения L-аминокислоты может дополнительно включать выделение L-аминокислоты из культуральной среды или из микроорганизма.
Микроорганизм с повышенной активностью α-глюкозидазы и L-аминокислота являются такими как описано выше.
В настоящем изобретении термин “культура” означает выращивание микроорганизма в условиях окружающей среды, регулируемых подходящим образом. Процесс культивирования по настоящему изобретению можно проводить в подходящей среде и в подходящих условиях культивирования, которые известны в данной области техники. Процесс культивирования может быть легко отрегулирован и использован специалистом в данной области техники в соответствии с выбранным штаммом. В частности, культивирование может быть периодическим, непрерывным и периодическим с подпиткой, но не ограничиваясь этим.
Источник углерода, включенный в среду, может включать сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; масла и жиры, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол, и органические кислоты, такие как уксусная кислота. Эти вещества можно использовать по отдельности или в виде смеси, но не ограничиваясь этим. Источник азота, включенный в среду, может включать органические источники азота, такие как пептон, дрожжевой экстракт, мясной сок, солодовый экстракт, кукурузный осадок и соевые бобы; и неорганические источники азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония, и эти источники азота можно использовать по отдельности или в комбинации. Однако источники не ограничены этим. Источник фосфора, включенный в среду, может включать дигидрофосфат калия, гидроортофосфат калия и соответствующие натрийсодержащие соли, но не ограничиваясь ими. Далее, в среду можно включать соли металлов, такие как сульфат магния или сульфат железа, и можно включать аминокислоты, витамины и подходящие предшественники. Эти среды или предшественники можно добавлять в культуру в периодическом или непрерывном режиме, но не ограничиваясь этим.
Во время культивирования такие соединения, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота, добавляют в культуру подходящим способом для подведения pH культуры. Дополнительно, во время культивирования, образование пены можно подавлять путем использования пеногасителя, такого как полициклический сложный эфир жирной кислоты. Кроме того, кислород или кислородсодержащие газы можно вводить в культуру для поддержания аэробного состояния культуры, и газы можно не вводить, или газы азот, водород или диоксид углерода можно вводить для поддержания анаэробного и микроаэробного состояний. Температура культуры обычно может составлять 25°C и 40°C и, в частности, от 27°C до 35°C. Период культивирования может длиться вплоть до получения желаемого выхода полезных веществ и может составлять, в частности, от 10 до 100 часов. Однако настоящее изобретение не ограничено этим.
Согласно настоящему изобретению можно собрать и/или дополнительно очистить L-аминокислоту, полученную на стадии культивирования, и собрать желаемую L-аминокислоту из среды, используя подходящий способ, известный в данной области техники, в соответствии со способом культивирования, например, периодическим, непрерывным способом культивирования или периодическим способом культивирования с подпиткой, но настоящее изобретение не ограничено этим. Например, можно использовать центрифугирование, фильтрование, анионообменную хроматографию, кристаллизацию и высокоэффективную жидкостную хроматографию (HPLC) и можно собрать желаемую L-аминокислоту из среды или из микроорганизма, культивируемого с использованием подходящего способа, известного в данной области техники.
Еще в одном аспекте настоящего изобретения предложен способ увеличения продуцирования L-аминокислоты, включающий повышение активности α-глюкозидазы у микроорганизма.
Еще в одном аспекте настоящего изобретения предложено применение α-глюкозидазы для увеличения продуцирования L-аминокислоты.
Выражение “увеличение продуцирования L-аминокислоты” может означать, что продуктивность по L-аминокислоте увеличена с получением L-аминокислоты с более высоким выходом продуцируемой L-аминокислоты по сравнению с микроорганизмом до повышения активности белка, то есть, немодифицированным микроорганизмом.
Примеры
Здесь и далее настоящее изобретение будет описано более подробно со ссылкой на Примеры. Однако эти Примеры предназначены исключительно для иллюстративных целей, и объем настоящего изобретения не ограничен этими Примерами.
Пример 1: Получение вектора для введения гена α-глюкозидазы
Для подтверждения эффекта гена aglA α-глюкозидазы, например, был получен вектор для вставки гена aglA, имеющего происхождение из Bifidobacterium adolescentis (SEQ ID NO: 2), в хромосому штамма Corynebacterium glutamicum. Для амплификации промотора PgapA, имеющего происхождение из Corynebacterium glutamicum, были синтезированы промотор (SEQ ID NO: 3), разработанный для вставки сайта для фермента рестрикции EcoRI в 5'-конец промотора PgapA, и праймер (SEQ ID NO: 4), разработанный для вставки сайта для фермента рестрикции NdeI в 3'-конец. В результате были получены фрагменты ДНК промотора PgapA, включающие сайт для фермента рестрикции EcoRI на 5'-конце и сайт для фермента рестрикции NdeI на 3'-конце. ПЦР проводили в следующих условиях: после денатурации при 94°C в течение 5 минут 30 раз повторяли денатурацию при 94°C в течение 30 секунд, отжиг при 56°C в течение 30 секунд и полимеризацию при 72°C в течение 30 секунд и затем проводили полимеризацию при 72°C в течение 7 минут.
Праймер для амплификации промотора PgapA
Прямой: 5'-TCAGAATTCTTGGGATTACCATTGAAGCC-3' (SEQ ID NO: 3)
Обратный: 5'-TCACATATGGTGTCTCCTCTAAAGATTGT-3' (SEQ ID NO: 4)
Для амплификации ORF (открытая рамка считывания) гена aglA, имеющего происхождение из Bifidobacterium adolescentis, на основе описанной последовательности оснований, были синтезированы праймеры (SEQ ID NO: 5-8), разработанные для вставки сайта для фермента рестрикции NdeI и сигнального пептида для секреции белка в положение инициирующего кодона, и праймер (SEQ ID NO: 9), разработанный так, чтобы сайт для фермента рестрикции SpeI был включен на конце кодона терминации.
Сигнальный пептид представляет собой белок, который помогает, например, ферменту AglA высвобождаться наружу из клеток, и 4 типа (SEQ ID NO: 14-17) были выбраны и протестированы. Последовательности праймеров и аминокислотные последовательности сигнального пептида являются следующими (Таблица 1).

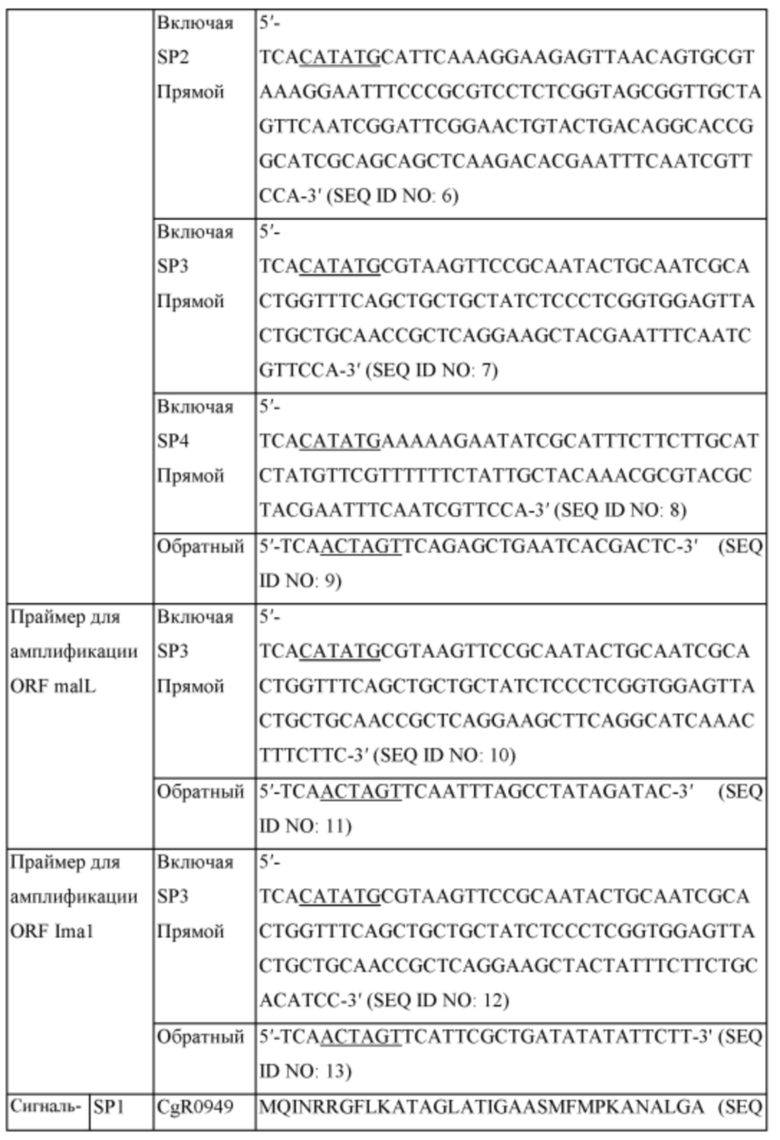

Фрагмент ORF aglA, включающий сайт для фермента рестрикции NdeI и каждый сигнальный пептид на 5'-конце и сайт для фермента рестрикции SpeI на 3'-конце, был получен путем использования геномной ДНК Bifidobacterium adolescentis в качестве матрицы. ПЦР проводили в следующих условиях: после денатурации при 94°C в течение 5 минут 30 раз повторяли денатурацию при 94°C в течение 30 секунд, отжиг при 56°C в течение 30 секунд и полимеризацию при 72°C в течение 2 минут и затем проводили полимеризацию при 72°C в течение 7 минут.
После того, как четыре продукта ПЦР-амплификации были обработаны ферментами рестрикции, сайты для которых включены на обоих концах, вектор pDZ (Патент Кореи с регистрационным номером 10-0924065) был обработан ферментами рестрикции EcoRI и SalI для связывания с полученным фрагментом ДНК для получения векторов pDZ-PgapA-SP1-aglA(B.al), pDZ-PgapA-SP2-aglA(B.al), pDZ-PgapA-SP3-aglA(B.al) и pDZ-PgapA-SP4-aglA(B.al).
Далее, для получения другого микроорганизма с повышенной активностью α-глюкозидазы были получены следующие происходящие из штамма гены α-глюкозидазы. В частности, фрагменты ORF malL и Ima1, включающие сайт для фермента рестрикции NdeI и каждый сигнальный пептид на 5'-конце и сайт для фермента рестрикции SpeI на 3'-конце, были получены с использованием генома EAMY_1858 (malL) Erwinia amylovora CFBP1430 и геномной ДНК IMA1 Saccharomyces cerevisiae в качестве матриц. ПЦР проводили в следующих условиях: после денатурации при 94°C в течение 5 минут 30 раз повторяли денатурацию при 94°C в течение 30 секунд, отжиг при 56°C в течение 30 секунд и полимеризацию при 72°C в течение 2 мин и затем проводили полимеризацию при 72°C в течение 7 минут.
Затем два продукта амплификации ПЦР обрабатывали ферментами рестрикции, сайты для которых включены на обоих концах, вектор pDZ (Патент Кореи с регистрационным номером 10-0924065) обрабатывали ферментами рестрикции EcoRI и SalI для связывания с полученными фрагментами ДНК для получения векторов pDZ-PgapA-SP3-malL(E.am) и pDZ-PgapA-SP3-Ima1(S.ce).
Пример 2: Получение микроорганизма, продуцирующего α-глюкозидазу
Для введения гена, кодирующего α-глюкозидазу, в штамм Corynebacterium glutamicum, 6 векторами, полученными в Примере 1, был трансформирован лизин-продуцирующий штамм Corynebacterium glutamicum KCCM11016P (информация о микроорганизме опубликована в Патенте Кореи с регистрационным номером 10-0159812, где он обозначен как KFCC10881, и затем он повторно депонирован в международном органе депонирования в соответствии с Будапештским договором с получением депозитарного номера KCCM11016P) методом электрического импульса (Van der Rest et al., Appl. Microbiol. Biotechnol. 52:541-545, 1999), и был проведен скрининг колоний, в которые каждый ген был введен путем гомологичной рекомбинации. Для скрининга колоний методом ПЦР использовали праймеры SEQ ID NO: 18 и 19.
Праймер для идентификации переноса гена aglA
Прямой: 5'-GACCATTTATTCGCAACTGTG-3' (SEQ ID NO: 18)
Обратный: 5'-TCTGCAAGGCGTTCGGAATT-3' (SEQ ID NO: 19)
Трансформированные штаммы получили названия KCCM11016P::PgapA-SP1-aglA(B.al), KCCM11016P::PgapA-SP2-aglA(B.al), KCCM11016P::PgapA-SP3-aglA(B.al) KCCM11016P::PgapA-SP4-aglA(B.al), KCCM11016P::PgapA-SP3-malL(E.am) и KCCM11016P::PgapA-SP3-Ima1(S.ce).
Пример 3: Подтверждение экспрессии белка лизин-продуцирующим микроорганизмом, включающим α-глюкозидазу
Материнский штамм Corynebacterium glutamicum KCCM11016P использовали в качестве контрольной группы и 6 типов штаммов KCCM11016P::PgapA-SP1-aglA(B.al), KCCM11016P::PgapA-SP2-aglA(B.al), KCCM11016P::PgapA-SP3-aglA(B.al) KCCM11016P::PgapA-SP4-aglA(B.al), KCCM11016P::PgapA-SP3-malL(E.am) и KCCM11016P::PgapA-SP3-Ima1(S.ce), полученных в Примере 2, культивировали способом, описанным в следующем Примере 4, и затем центрифугировали с высокой скоростью для получения супернатанта. Экспрессию фермента α-глюкозидазы в культуральной среде измеряли методом SDS-PAGE с использованием части полученного супернатанта. В результате была подтверждена экспрессия белка, соответствующего положению 70 кДа (Фиг. 1).
Пример 4: Оценка продуктивности по L-аминокислоте лизин-продуцирующего микроорганизма, включающего α-глюкозидазу
Материнский штамм Corynebacterium glutamicum KCCM11016P использовали в качестве контрольной группы и 6 типов штаммов KCCM11016P::PgapA-SP1-aglA(B.al), KCCM11016P::PgapA-SP2-aglA(B.al), KCCM11016P::PgapA-SP3-aglA(B.al) KCCM11016P::PgapA-SP4-aglA(B.al), KCCM11016P::PgapA-SP3-malL(E.am) и KCCM11016P::PgapA-SP3-Ima1(S.ce), полученных в Примере 2, культивировали следующим способом в течение заданного времени и затем измеряли концентрацию лизина. Результаты представлены в Таблице 2. Сначала каждый штамм инокулировали в колбу с угловыми перегородками на 250 мл, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 30°C в течение 20 часов при 200 об/мин. После этого 1 мл раствора посевной культуры инокулировали в колбу с угловыми перегородками на 250 мл, содержащую 24 мл продукционной среды, и культивировали со встряхиванием при 32°C в течение 72 часов при 200 об/мин. Состав посевной среды и продукционной среды указан ниже. После окончания культивирования концентрацию L-лизина измеряли методом HPLC (Waters 2478).
Посевная среда (pH 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин⋅HCl, 2000 мкг пантотената кальция и 2000 мкг никотина (на 1 л дистиллированной воды)
Продукционная среда (pH 7,0)
100 г глюкозы, 40 г (NH4)2SO4, 2,5 г соевого белка, 5 г твердой фракции кукурузного экстракта, 3 г мочевины, 1 г KH2PO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамин⋅HCl, 2000 мкг пантотената кальция, 3000 мкг никотинамида и 30 г CaCO3 (на 1 л дистиллированной воды)
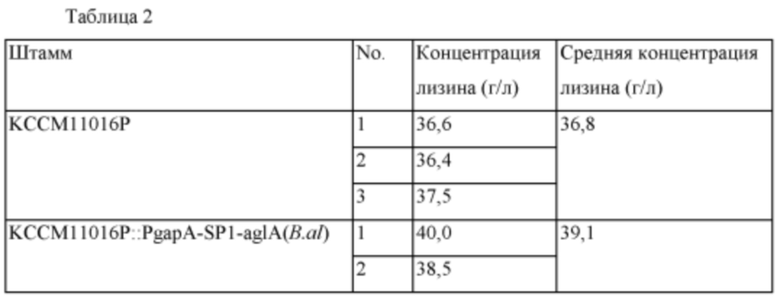
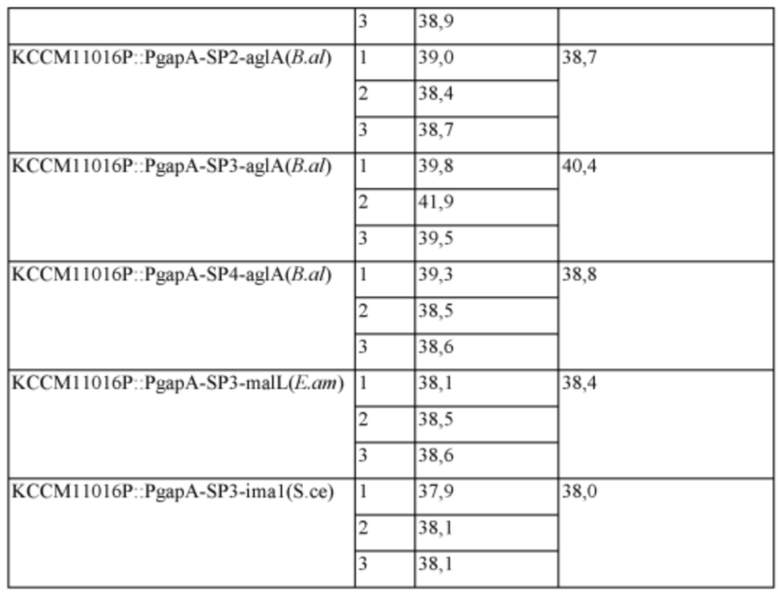
Из этих результатов можно видеть, что у всех шести типов лизин-продуцирующих штаммов с введенной способностью экспрессировать α-глюкозидазу продуктивность по лизину увеличивалась по сравнению с контрольной группой. В частности, самое большое увеличение продуктивности было показано для KCCM11016P::PgapA-SP3-aglA(B.al). В культуре микроорганизма очень существенным результатом является то, что продуктивность по лизину увеличилась по меньшей мере на 3,2% и вплоть до 9,7% вследствие регуляции активности генов, не относящихся к путям биосинтеза. Дополнительно, эффекты повышения продуктивности по L-аминокислоте путем увеличения активности α-глюкозидазы в настоящем изобретении верифицировали путем подтверждения того, что продуктивность по L-аминокислоте увеличивалась без добавления в среду изомальтозы и мальтозы, которые, как полагают, используются в качестве субстратов α-глюкозидазой. Из этих результатов следует, что в случае использования подходящих сигнальных пептидов, выбранных специалистом в данной области техники, ожидается, что будет показана более высокая степень увеличения.
Полученный KCCM11016P::PgapA-SP2-aglA(B.al) был назван Corynebacterium glutamicum CA01-7523 и был депонирован в Корейском Центре Культур Микроорганизмов (KCCM), который является международным органом депонирования, в соответствии с Будапештским договором 5 марта 2018 года с присвоением номера доступа KCCM12228P.
Пример 5: Получение штамма CJ3P с введенной α-глюкозидазой и анализ продуктивности по лизину
Для подтверждения того, что такой же эффект будет показан даже у другого штамма Corynebacterium glutamicum, продуцирующего L-лизин, PgapA-SP3-aglA(B.al) был введен в штамм Corynebacterium glutamicum CJ3P (Binder et al. Genome Biology 2012, 13:R40), обладающий продуктивностью по L-лизину, таким же способом как в Примере 2, путем введения 3 типов вариантов [pyc(P458S), hom(V59A), lysC(T311I)] в штамм Corynebacterium glutamicum ATCC13032 дикого типа для получения штамма с введенной α-глюкозидазой. Полученный штамм был назван CJ3P::PgapA-SP3-aglA(B.al). Штамм CJ3P в качестве контрольной группы и CJ3P::PgapA-SP3-aglA(B.al) культивировали таким же образом как в Примере 4 и анализировали продуктивность по лизину, которая представлена в Таблице 3 ниже.
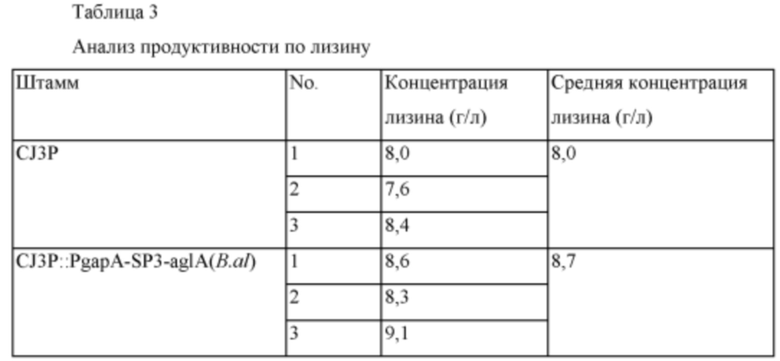
На основании результатов анализа концентрации лизина было подтверждено, что выход лизина был увеличен у штамма с введенной α-глюкозидазой. Дополнительно, в культуре микроорганизмов очень существенным результатом является то, что продуктивность по лизину увеличилась по меньшей мере на 8,8% вследствие регуляции активности генов, не относящихся к путям биосинтеза. Далее, в случае использования подходящих сигнальных пептидов, выбранных специалистом в данной области техники, ожидается, что будет показана более высокая степень увеличения.
Пример 6: Получение треонин-продуцирующего штамма свведенной α-глюкозидазой и анализ продуктивности по треонину
Для того, чтобы точно подтвердить изменение в продуктивности по L-треонину при введении α-глюкозидазы, в ген, кодирующий гомосериндегидрогеназу, продуцирующую гомосерин, который представляет собой общее промежуточное соединение в путях биосинтеза L-треонина и L-изолейцина, был введен вариант и усилен. В частности, для получения штамма известный вариант hom(G378E) (R. Winkels, S. et al., Appl. Microbiol. Biotechnol. 45, 612-620, 1996) был введен в штамм CJ3P:: PgapA-SP3-aglA(B.al), используемый в Примере 5. Далее был получен штамм, в котором вариант hom(G378E) был введен в контрольный CJ3P. Рекомбинантный вектор для введения варианта был получен следующим способом.
Для получения вектора с введенным hom(G378E) сначала были синтезированы праймеры (SEQ ID NO: 20 и 21), в которых сайт распознавания ферментом рестрикции XbaI был вставлен в 5'-фрагмент и в 3'-фрагмент в положениях примерно 600 п.н. выше по ходу транскрипции и ниже по ходу транскрипции от положений 1131-1134 гена hom путем использования геномной ДНК, экстрагированной из штамма Corynebacterium glutamicum ATCC13032 дикого типа, в качестве матрицы. Далее были синтезированы праймеры (SEQ ID NO: 22 и 23) для замены последовательности оснований гена hom. Плазмида pDZ-hom(G378E) была получена таким образом, что фрагменты ДНК (каждый по 600 п.н.), расположенные на 5'- и 3'-концах гена hom, были соединены с вектором pDZ (Патент Кореи с регистрационным номером 10-0924065).
Праймер для вставки сайта распознавания XbaI
5'-фрагмент: 5'-TCCTCTAGACTGGTCGCCTGATGTTCTAC-3' (SEQ ID NO: 20)
3'-фрагмент: 5'-GACTCTAGATTAGTCCCTTTCGAGGCGGA-3' (SEQ ID NO: 21)
Праймер для замены гена hom
5'-GCCAAAACCTCCACGCGATC-3' (SEQ ID NO: 22)
5'-ATCGCGTGGAGGTTTTGGCT-3' (SEQ ID NO: 23)
5'-концевой фрагмент гена был получен методом ПЦР с использованием праймеров (SEQ ID NO: 20 и 22) путем использования хромосомы штамма дикого типа в качестве матрицы. ПЦР проводили в следующих условиях: после денатурации при 94°C в течение 2 минут 30 раз повторяли денатурацию при 94°C в течение 1 минуты, отжиг при 56°C в течение 1 минуты и полимеризацию при 72°C в течение 40 секунд и затем проводили полимеризацию при 72°C в течение 10 минут. Таким же образом фрагмент гена на 3'-конце гена hom получали путем ПЦР с использованием праймеров (SEQ ID NO: 21 и 23). Амплифицированные фрагменты ДНК очищали с использованием набора для очистки ПЦР от Quiagen Corporation и затем использовали в качестве фрагментов ДНК вставки для получения вектора. Между тем, вектор pDZ, обработанный ферментом рестрикции XbaI и прогретый при 65°C в течение 20 минут, и фрагмент ДНК вставки, амплифицированный путем ПЦР, соединяли друг с другом с использованием “Infusion Cloning Kit” и затем трансформированную полученной конструкцией E. coli DH5α высевали на твердую среду LB (Лурия-Бертани), содержащую канамицин (25 мг/л). Проводили скрининг колоний, трансформированных вектором с целевым геном, вставленным путем ПЦР с использованием праймеров SEQ ID NO: 20 и 21, и затем была получена плазмида путем общеизвестного метода выделения плазмид для получения вектора pDZ-hom (G378E) для введения мутанта с заменой оснований hom(G378E) в хромосому.
После этого, полученный вектор pDZ-hom(G378E) вводили в штаммы CJ3P и CJ3P::PgapA-SP3-aglA(B.al) таким же образом как в Примере 2 для получения штаммов CJ3P::hom(G378E) и CJ3P::PgapA-SP3-aglA(B.al)-hom(G378E). Два полученных штамма культивировали таким же образом как в Примере 4 и анализировали концентрацию продуцированного треонина, которая представлена в Таблице 4 ниже.

На основании результатов анализа концентрации треонина было подтверждено, что концентрация треонина была увеличена у штамма с введенной α-глюкозидазой. В культуре микроорганизмов очень существенным результатом является то, что продуктивность по треонину увеличилась на 30% вследствие регуляции активности генов, не относящихся к путям биосинтеза. Далее, в случае использования подходящих сигнальных пептидов, выбранных специалистом в данной области техники, ожидается, что будет показана более высокая степень увеличения.
Пример 7: Получение изолейцин-продуцирующего штамма свведенной α-глюкозидазой и анализ продуктивности по изолейцину
Для подтверждения эффекта введения α-глюкозидазы на продуктивность по L-изолейцину вариант был введен в ген, кодирующий известную L-треониндегидратазу и усилен. В частности, известный вариант ilvA(V323A) (S. Morbach et al., Appl. Enviro. Microbiol., 62(12): 4345-4351, 1996) был введен в штамм CJ3P::PgapA-SP3-aglA(B.al)-hom(G378E), используемый в Примере 6, для получения штамма. Далее был получен штамм, в котором вариант ilvA(V323A) был введен в контроль CJ3P::hom(G378E). Рекомбинантный вектор для введения варианта был получен следующим способом.
Для получения вектора с введенным ilvA(V323A) сначала были синтезированы праймеры (SEQ ID NO: 24 и 25), в которых сайт распознавания ферментом рестрикции XbaI был вставлен в 5'-фрагмент и в 3'-фрагмент в положениях примерно 600 п.н. по ходу транскрипции и ниже по ходу транскрипции от положений 966-969 гена hom путем использования геномной ДНК, экстрагированной из штамма Corynebacterium glutamicum ATCC13032 дикого типа, в качестве матрицы. Далее были синтезированы праймеры (SEQ ID NO: 26 и 27) для замены последовательности оснований гена ilvA. Плазмида pDZ-ilvA(V323A) была получена таким образом, что фрагменты ДНК (каждый по 600 п.н.), расположенные на 5'- и 3'-концах гена ilvA, были соединены с вектором pDZ (Патент Кореи c регистрационным номером 10-0924065).
Праймер для вставки сайта распознавания XbaI
5'-фрагмент: 5'-ACGGATCCCAGACTCCAAAGCAAAAGCG-3' (SEQ ID NO: 24)
3'-фрагмент: 5'-ACGGATCCAACCAAACTTGCTCACACTC-3' (SEQ ID NO: 25)
Праймер для замены гена ilvA
5'-ACACCACGGCAGAACCAGGTGCAAAGGACA-3' (SEQ ID NO: 26)
5'-CTGGTTCTGCCGTGGTGTGCATCATCTCTG-3' (SEQ ID NO: 27)
5'-концевой фрагмент гена был получен методом ПЦР с использованием праймеров (SEQ ID NO: 24 и 26) путем использования хромосомы штамма дикого типа в качестве матрицы. ПЦР проводили в следующих условиях: после денатурации при 94°C в течение 2 минут 30 раз повторяли денатурацию при 94°C в течение 1 минуты, отжиг при 56°C в течение 1 минуты и полимеризацию при 72°C в течение 40 секунд и затем проводили полимеризацию при 72°C в течение 10 минут. Таким же образом фрагмент гена на 3'-конце гена ilvA был получен путем ПЦР с использованием праймеров (SEQ ID NO: 25 и 27). Амплифицированные фрагменты ДНК очищали с использованием набора для очистки ПЦР от Quiagen Corporation и затем использовали в качестве фрагментов ДНК вставки для получения вектора. Между тем, вектор pDZ, обработанный ферментом рестрикции XbaI и прогретый при 65°C в течение 20 минут, и фрагмент ДНК вставки, амплифицированный путем ПЦР, соединяли друг с другом с использованием “Infusion Cloning Kit” и затем трансформированную полученной конструкцией E. coli DH5α высевали на твердую среду LB (Лурия-Бертани), содержащую канамицин (25 мг/л). Проводили скрининг колоний, трансформированных вектором с целевым геном, вставленным путем ПЦР с использованием праймеров SEQ ID NO: 24 и 25, и затем общеизвестным методом выделения плазмид была получена плазмида для получения вектора pDZ-ilvA(V323A) для введения мутанта с заменой оснований ilvA(V323A) в хромосому.
После этого, полученный вектор pDZ-ilvA(V323A) вводили в штаммы CJ3P::hom(G378E) и CJ3P::PgapA-SP3-aglA(B.al)-hom(G378E) таким же образом как в Примере 2 для получения штаммов CJ3P::hom(G378E)-ilvA(V323A) и CJ3P::PgapA-SP3-aglA(B.al)-hom(G378E)-ilvA(V323A). Два полученных штамма культивировали таким же образом как в Примере 4 и анализировали концентрацию продуцированного изолейцина, которая представлена в Таблице 5 ниже.
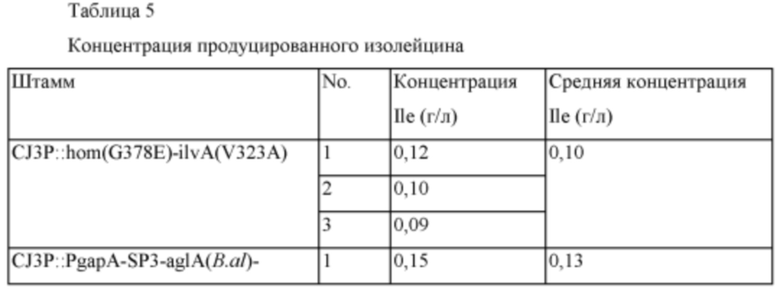
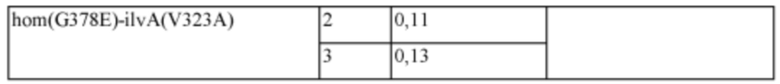
На основании результатов из Таблицы 5 было подтверждено, что концентрация изолейцина была увеличена у штамма с введенной α-глюкозидазой. В культуре микроорганизмов очень существенным результатом является то, что продуктивность по изолейцину увеличилась на 30% вследствие регуляции активности генов, не относящихся к путям биосинтеза. Далее, в случае использования подходящих сигнальных пептидов, выбранных специалистом в данной области техники, ожидается, что будет показана более высокая степень увеличения.
Специалист в данной области техники понимает, что настоящее изобретение как описано выше может быть воплощено в других конкретных формах без отступления от его технической идеи или существенных признаков. Поэтому, следует понимать, что описанные выше воплощения предназначены исключительно для иллюстративных целей и никоим образом не ограничивают объем настоящего изобретения. Объем настоящего изобретения определен прилагаемой формулой изобретения, а не подробным описанием, и это следует понимать так, что значение и объем прилагаемой формулы изобретения и все изменения и модифицированные формы, выведенные из эквивалентных, попадают в объем настоящего изобретения.
--->
<110> CJ CheilJedang Corporation
<120> MICROORGANISM FOR PRODUCING L-AMINO ACID WITH ENHANCED ACTIVITY
OF ALPHA-GLUCOSIDASE AND METHOD FOR PRODUCING L-AMINO ACID USING
THE SAME
<130> OPA19088
<150> KR 10-2018-0116540
<151> 2018-09-28
<160> 31
<170> KoPatentIn 3.0
<210> 1
<211> 606
<212> PRT
<213> Artificial Sequence
<220>
<223> aglA из Bifidobacterium adolescentis
<400> 1
Met Thr Asn Phe Asn Arg Ser Thr Leu Ser Asp Thr Val Arg Ser Asn
1 5 10 15
Gly Ala Thr Pro Asn Pro Trp Trp Ala Asn Ala Val Val Tyr Gln Ile
20 25 30
Tyr Pro Arg Ser Phe Gln Asp Ser Asn Gly Asp Gly Ile Gly Asp Leu
35 40 45
Lys Gly Ile Thr Ser Arg Leu Asp Tyr Leu Ala Asp Leu Gly Val Asp
50 55 60
Val Leu Trp Leu Ser Pro Val Phe Lys Ser Pro Gln Asp Asp Asn Gly
65 70 75 80
Tyr Asp Ile Ser Asp Tyr Gln Asp Ile Asp Pro Leu Phe Gly Thr Met
85 90 95
Ala Asp Met Asp Glu Leu Leu Ala Glu Ala His Lys Arg Gly Leu Lys
100 105 110
Val Ile Met Asp Leu Val Val Asn His Thr Ser Asp Glu His Ala Trp
115 120 125
Phe Gln Ala Ser Arg Asp Lys Asn Asp Pro His Ala Asp Trp Tyr Trp
130 135 140
Trp Arg Pro Ala Lys Pro Gly His Glu Pro Gly Thr Pro Gly Ala Glu
145 150 155 160
Pro Asn Gln Trp Gly Ser Tyr Phe Gly Gly Ser Ala Trp Glu Tyr Asp
165 170 175
Pro Lys Arg Gly Glu Tyr Phe Phe His Gln Tyr Ser Lys Lys Gln Pro
180 185 190
Asp Leu Asn Trp Glu Asn Pro Glu Val Arg Lys Ala Val Tyr Lys Met
195 200 205
Met Asn Trp Trp Met Asp Arg Gly Ile Asp Gly Phe Arg Met Asp Val
210 215 220
Ile Thr Gln Ile Ser Lys Val Ile Asp Lys Asn Gly Lys Leu Pro Gly
225 230 235 240
Glu Ala Gly Ser Glu Ile Ala Asp Asn Pro Val Gly Glu Glu Gly Tyr
245 250 255
Ser Ser Pro Tyr Pro Phe Cys Ser Asp Gly Pro Arg Ile Asp Glu Phe
260 265 270
Leu Ala Glu Met Arg Arg Glu Val Phe Glu Gly Arg Glu Gly Tyr Met
275 280 285
Asn Val Gly Glu Ala Pro Gly Ile Thr Pro Ala Arg Asn Glu His Val
290 295 300
Thr Asp Pro Ala Asn Lys Glu Leu Asp Met Leu Phe Leu Phe Asp His
305 310 315 320
Val Gly Ile Asp Gln Glu Gly Ser Lys Trp Asn Thr Val Pro Phe Glu
325 330 335
Val Lys Asn Leu Arg Asp Arg Met Thr Glu Gln Gln Glu Ala Val Arg
340 345 350
Lys Ala Gly Trp Ala Ser Leu Phe Phe Cys Asn His Asp Gln Pro Arg
355 360 365
Val Val Ser Arg Trp Gly Asn Asp Ser Asp Arg Asp Ser Arg Glu Leu
370 375 380
Ser Ala Lys Ala Phe Gly Met Val Leu His Met His Arg Gly Thr Pro
385 390 395 400
Tyr Ile Tyr Glu Gly Glu Glu Leu Gly Met Thr Asn Ala His Phe Thr
405 410 415
Lys Leu Glu Gln Tyr Arg Asp Leu Glu Ala Leu Asn Gly Tyr Arg Gln
420 425 430
Arg Val Glu Glu Ala Lys Cys Gln Ser Ser Glu Ser Met Met Ala Ala
435 440 445
Leu Ala Leu Ile Gly Arg Asp Asn Ala Arg Thr Pro Met Gln Trp Asp
450 455 460
Ala Ser Lys Tyr Ala Gly Phe Thr Pro Ala Asp Ala Ala Ala Glu Pro
465 470 475 480
Trp Ile Ser Val Asn Pro Asn His Val Glu Ile Asn Ala Ala Glu Glu
485 490 495
Phe Asp Asp Pro Asp Ser Val Tyr Thr Phe Tyr Lys Lys Leu Ile Ala
500 505 510
Met Arg His Asn Ser Ala Thr Ile Ser Thr Gly Glu Trp His Leu Leu
515 520 525
Ala Ala Asp Ser Asp Gln Val Tyr Ala Phe Thr Arg Thr Asn Gly Asp
530 535 540
Asp Thr Ile Leu Val Val Val Asn Leu Thr Asp Arg Ser Ala Ala Leu
545 550 555 560
Pro Ser Asp Val Ala Glu Leu Leu Ser Asp Gly Val Ser Asp Pro Gln
565 570 575
Val Leu Leu Ser Thr Tyr Asp Ala Met His Ser Val Lys Ser Ile Ala
580 585 590
Arg Gly Glu Leu Ala Arg Trp Glu Gly Val Val Ile Gln Leu
595 600 605
<210> 2
<211> 1821
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA из Bifidobacterium adolescentis
<400> 2
atgacgaatt tcaatcgttc cactctttct gacaccgtcc gttcgaatgg cgccaccccg 60
aatccgtggt gggcgaacgc ggtggtctac cagatctatc cccgttcctt ccaggattcc 120
aatggcgatg gcatcggcga tctgaagggc atcaccagcc ggctcgacta tctcgcagat 180
ctcggcgtgg acgtgctatg gctgtccccg gtcttcaagt ccccgcagga cgacaacggc 240
tacgacatct ccgactacca ggacatcgat ccgctgttcg gcacaatggc cgatatggac 300
gagctgcttg ccgaagcgca caagcgcggc ctgaaggtca tcatggacct ggtcgtgaac 360
cacacgtccg acgagcatgc ctggttccag gcttcccgcg acaagaacga tcctcatgcg 420
gattggtatt ggtggcgtcc ggccaagccg ggccatgagc cgggcacgcc cggtgccgag 480
ccgaaccagt ggggctccta tttcggcggc tccgcatggg agtacgatcc gaagcgcggt 540
gaatacttct ttcaccagta ttccaagaag cagcccgacc tcaactggga gaatcccgag 600
gtgcgcaagg ccgtctacaa gatgatgaac tggtggatgg atcgcggcat cgacggcttc 660
cgcatggacg tgatcaccca gatttccaag gtcatcgaca agaacggcaa gttgccgggg 720
gaggcaggat ccgaaatcgc cgataatccg gttggagagg aaggttattc cagcccgtat 780
ccgttctgct ccgacggccc gcgcatcgac gagttcctcg ccgaaatgcg ccgtgaggta 840
ttcgaaggcc gtgaaggcta catgaatgtc ggcgaggctc cgggcatcac cccggcccgt 900
aacgagcacg tcaccgatcc ggccaacaag gaacttgaca tgctattcct gtttgaccat 960
gtcggcatcg accaggaagg ctccaagtgg aataccgtgc cgttcgaggt caaaaacctg 1020
cgcgaccgta tgaccgagca gcaggaggcc gtgaggaagg ccggttgggc cagcctgttc 1080
ttctgcaatc atgaccagcc gcgcgtggtc tcccgttggg gcaacgactc cgaccgcgat 1140
tcgcgcgaac tgagcgccaa ggcgttcggc atggtgctgc acatgcaccg cggcaccccg 1200
tacatttacg aaggcgagga actgggtatg accaacgccc acttcaccaa gctggaacaa 1260
taccgcgatc tggaagccct caacggctat cgccagcgcg tggaggaagc caagtgccag 1320
tcgtccgaat ccatgatggc cgccctcgcc ctcatcggcc gcgacaacgc gcgcaccccc 1380
atgcagtggg acgcctccaa gtatgccggt ttcaccccgg cggacgcggc agccgaaccg 1440
tggatcagcg tcaacccgaa tcatgtggaa atcaacgcgg ccgaggaatt cgacgatccg 1500
gattccgtgt acacgttcta caagaagctc atcgccatgc ggcacaacag cgccaccatc 1560
tccactggcg aatggcatct gctcgccgcc gacagcgatc aggtgtatgc tttcacgcgc 1620
accaatggcg acgacacgat tcttgtcgtg gtcaacctca ccgacaggtc cgcggcgctg 1680
ccttcggacg tggcggagct gctttccgac ggcgtgtccg atccgcaagt actgctcagc 1740
acctatgatg ctatgcatag tgttaaatcg atcgctcgtg gcgagctcgc tcgctgggag 1800
ggagtcgtga ttcagctctg a 1821
<210> 3
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> PgapA-F
<400> 3
tcagaattct tgggattacc attgaagcc 29
<210> 4
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> PgapA-R
<400> 4
tcacatatgg tgtctcctct aaagattgt 29
<210> 5
<211> 124
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA ORF SP1-F для амплификации
<400> 5
tcacatatgc aaataaaccg ccgaggcttc ttaaaagcca ccgcaggact tgccactatc 60
ggcgctgcca gcatgtttat gccaaaggcc aacgcccttg gagcaacgaa tttcaatcgt 120
tcca 124
<210> 6
<211> 148
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA ORF SP2-F для амплификации
<400> 6
tcacatatgc attcaaagga agagttaaca gtgcgtaaag gaatttcccg cgtcctctcg 60
gtagcggttg ctagttcaat cggattcgga actgtactga caggcaccgg catcgcagca 120
gctcaagaca cgaatttcaa tcgttcca 148
<210> 7
<211> 115
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA ORF SP3-F для амплификации
<400> 7
tcacatatgc gtaagttccg caatactgca atcgcactgg tttcagctgc tgctatctcc 60
ctcggtggag ttactgctgc aaccgctcag gaagctacga atttcaatcg ttcca 115
<210> 8
<211> 94
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA ORF SP4-F для амплификации
<400> 8
tcacatatga aaaagaatat cgcatttctt cttgcatcta tgttcgtttt ttctattgct 60
acaaacgcgt acgctacgaa tttcaatcgt tcca 94
<210> 9
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA ORF-R для амплификации
<400> 9
tcaactagtt cagagctgaa tcacgactc 29
<210> 10
<211> 116
<212> DNA
<213> Artificial Sequence
<220>
<223> mall ORF SP3-F для амплификации
<400> 10
tcacatatgc gtaagttccg caatactgca atcgcactgg tttcagctgc tgctatctcc 60
ctcggtggag ttactgctgc aaccgctcag gaagcttcag gcatcaaact ttcttc 116
<210> 11
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> mall ORF-R для амплификации
<400> 11
tcaactagtt caatttagcc tatagatac 29
<210> 12
<211> 116
<212> DNA
<213> Artificial Sequence
<220>
<223> Ima1 ORF SP3-F для амплификации
<400> 12
tcacatatgc gtaagttccg caatactgca atcgcactgg tttcagctgc tgctatctcc 60
ctcggtggag ttactgctgc aaccgctcag gaagctacta tttcttctgc acatcc 116
<210> 13
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Ima1 ORF-R для амплификации
<400> 13
tcaactagtt cattcgctga tatatattct t 31
<210> 14
<211> 33
<212> PRT
<213> Artificial Sequence
<220>
<223> SP1 (CgR0949)
<400> 14
Met Gln Ile Asn Arg Arg Gly Phe Leu Lys Ala Thr Ala Gly Leu Ala
1 5 10 15
Thr Ile Gly Ala Ala Ser Met Phe Met Pro Lys Ala Asn Ala Leu Gly
20 25 30
Ala
<210> 15
<211> 41
<212> PRT
<213> Artificial Sequence
<220>
<223> SP2 (NCgl2101)
<400> 15
Met His Ser Lys Glu Glu Leu Thr Val Arg Lys Gly Ile Ser Arg Val
1 5 10 15
Leu Ser Val Ala Val Ala Ser Ser Ile Gly Phe Gly Thr Val Leu Thr
20 25 30
Gly Thr Gly Ile Ala Ala Ala Gln Asp
35 40
<210> 16
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> SP3 (CgR1834)
<400> 16
Met Arg Lys Phe Arg Asn Thr Ala Ile Ala Leu Val Ser Ala Ala Ala
1 5 10 15
Ile Ser Leu Gly Gly Val Thr Ala Ala Thr Ala Gln Glu Ala
20 25 30
<210> 17
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> SP4 (ST2)
<400> 17
Met Lys Lys Asn Ile Ala Phe Leu Leu Ala Ser Met Phe Val Phe Ser
1 5 10 15
Ile Ala Thr Asn Ala Tyr Ala
20
<210> 18
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA-F для подтверждения
<400> 18
gaccatttat tcgcaactgt g 21
<210> 19
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA-R для подтверждения
<400> 19
tctgcaaggc gttcggaatt 20
<210> 20
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> XbaI-F для вставки
<400> 20
tcctctagac tggtcgcctg atgttctac 29
<210> 21
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> XbaI-R для вставки
<400> 21
gactctagat tagtcccttt cgaggcgga 29
<210> 22
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> hom-F для замены
<400> 22
gccaaaacct ccacgcgatc 20
<210> 23
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> hom-R для замены
<400> 23
atcgcgtgga ggttttggct 20
<210> 24
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> XbaI-F для вставки (2)
<400> 24
acggatccca gactccaaag caaaagcg 28
<210> 25
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> XbaI-R для вставки (2)
<400> 25
acggatccaa ccaaacttgc tcacactc 28
<210> 26
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> ilvA-F для замены
<400> 26
acaccacggc agaaccaggt gcaaaggaca 30
<210> 27
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> ilvA-R для замены
<400> 27
ctggttctgc cgtggtgtgc atcatctctg 30
<210> 28
<211> 599
<212> PRT
<213> Artificial Sequence
<220>
<223> aglA из Erwinia amylovora
<400> 28
Met Ser Gly Ile Lys Leu Ser Ser Val Met Ala Leu Phe Phe Ala Pro
1 5 10 15
Phe Leu Ala Val Ser Ser Gly Gln Val Leu Ala Gly Lys Thr Asp Ile
20 25 30
Ala Thr Thr Gln Val Val His Lys Ser Asp Asp Phe Pro Ala Trp Trp
35 40 45
Lys Gln Ala Val Phe Tyr Gln Val Tyr Pro Arg Ser Phe Lys Asp Thr
50 55 60
Asn Gly Asp Gly Ile Gly Asp Ile Lys Gly Ile Ile Glu Lys Leu Asp
65 70 75 80
Tyr Leu Asn Asn Leu Gly Val Asp Ala Ile Trp Ile Asn Pro His Tyr
85 90 95
Asp Ser Pro Asn Thr Asp Asn Gly Tyr Asp Ile Arg Asp Tyr Arg Lys
100 105 110
Ile Met Lys Glu Tyr Gly Thr Met Glu Asp Phe Asp Arg Leu Ile Ala
115 120 125
Glu Met Asn Lys Arg Asn Met Arg Leu Met Ile Asp Ile Val Ile Asn
130 135 140
His Thr Ser Asp Gln His Arg Trp Phe Val Gln Ser Lys Ser Ser Lys
145 150 155 160
Asp Asn Pro Tyr Arg Glu Tyr Tyr Phe Trp Arg Asp Gly Lys Asn Gly
165 170 175
Gln Pro Pro Asn Asn Tyr Pro Ser Phe Phe Gly Gly Ser Ala Trp Glu
180 185 190
Lys Glu Asp His Ser Gly Gln Tyr Tyr Leu His Tyr Phe Ala Lys Gln
195 200 205
Gln Pro Asp Leu Asn Trp Asp Asn Pro Lys Val Arg Glu Asp Leu Tyr
210 215 220
Ala Met Leu Arg Phe Trp Leu Asp Lys Gly Val Ala Gly Leu Arg Phe
225 230 235 240
Asp Thr Val Ala Thr Tyr Ala Lys Ile Pro Asn Phe Pro Asp Leu Thr
245 250 255
Pro Ser Gln Arg Gln Asn Phe Ala Arg Thr Tyr Thr Glu Gly Pro Ser
260 265 270
Ile His Arg Tyr Ile Lys Glu Met Asn Arg Gln Val Phe Ser His Tyr
275 280 285
Asn Ile Ala Thr Ala Gly Glu Ile Phe Gly Val Pro Leu Glu Lys Ser
290 295 300
Ile Asn Tyr Phe Asp Arg Arg Arg Asn Glu Leu Asn Ile Ala Phe Thr
305 310 315 320
Phe Asp Leu Ile Arg Leu Asp Arg Asn Val Glu Glu Arg Trp Arg Glu
325 330 335
Lys Ala Trp Ser Leu Val Asp Phe Arg Gln Thr Ile Gly Lys Val Asp
340 345 350
Arg Ala Ala Gly Lys Tyr Gly Trp Asn Ala Phe Phe Leu Asp Asn His
355 360 365
Asp Asn Pro Arg Ala Val Ser His Phe Gly Asp Asp Arg Pro Gln Trp
370 375 380
Arg Gln Ala Ser Ala Lys Ala Leu Ala Thr Leu Ile Ile Thr Gln Arg
385 390 395 400
Ala Thr Pro Phe Ile Tyr Gln Gly Ser Glu Leu Gly Met Thr Asn Tyr
405 410 415
Pro Phe Lys Thr Ile Ala Asp Phe Asp Asp Ile Glu Val Lys Gly Phe
420 425 430
Trp Gln Asp Tyr Val Ser Ser Gly Arg Val Asp Pro Glu Asp Phe Met
435 440 445
Arg Asn Val Arg Leu Thr Ser Arg Asp Asn Ser Arg Thr Pro Phe Gln
450 455 460
Trp Asp Glu Ser Ala His Ala Gly Phe Thr Ser Gly Thr Pro Trp Phe
465 470 475 480
Lys Val Asn Pro Asn Tyr Lys Leu Ile Asn Ala Ser Asp Gln Met Lys
485 490 495
Asp Ser Asp Ser Val Phe Asn Tyr Tyr Arg Lys Leu Ile Arg Leu Arg
500 505 510
His Ala Ile Pro Ala Leu Thr Tyr Gly Glu Tyr Lys Asp Leu Asp Pro
515 520 525
Tyr Asn Asp Thr Val Tyr Ala Phe Thr Arg Thr His Gly Asp Lys Arg
530 535 540
Tyr Leu Val Val Ile Asn Phe Lys Glu Asn Lys Val Asn Tyr Arg Leu
545 550 555 560
Pro Gly Gln Leu Ser Ile Arg Gln Thr Leu Ser Glu Ser Ser Ala Ser
565 570 575
Gln Arg Val Ala Asp Asn Ala His Glu Leu Leu Leu Gln Pro Trp Gln
580 585 590
Ser Gly Ile Tyr Arg Leu Asn
595
<210> 29
<211> 589
<212> PRT
<213> Artificial Sequence
<220>
<223> aglA из Saccharomyces cerevisiae
<400> 29
Met Thr Ile Ser Ser Ala His Pro Glu Thr Glu Pro Lys Trp Trp Lys
1 5 10 15
Glu Ala Thr Phe Tyr Gln Ile Tyr Pro Ala Ser Phe Lys Asp Ser Asn
20 25 30
Asp Asp Gly Trp Gly Asp Met Lys Gly Ile Ala Ser Lys Leu Glu Tyr
35 40 45
Ile Lys Glu Leu Gly Ala Asp Ala Ile Trp Ile Ser Pro Phe Tyr Asp
50 55 60
Ser Pro Gln Asp Asp Met Gly Tyr Asp Ile Ala Asn Tyr Glu Lys Val
65 70 75 80
Trp Pro Thr Tyr Gly Thr Asn Glu Asp Cys Phe Ala Leu Ile Glu Lys
85 90 95
Thr His Lys Leu Gly Met Lys Phe Ile Thr Asp Leu Val Ile Asn His
100 105 110
Cys Ser Ser Glu His Glu Trp Phe Lys Glu Ser Arg Ser Ser Lys Thr
115 120 125
Asn Pro Lys Arg Asp Trp Phe Phe Trp Arg Pro Pro Lys Gly Tyr Asp
130 135 140
Ala Glu Gly Lys Pro Ile Pro Pro Asn Asn Trp Lys Ser Tyr Phe Gly
145 150 155 160
Gly Ser Ala Trp Thr Phe Asp Glu Lys Thr Gln Glu Phe Tyr Leu Arg
165 170 175
Leu Phe Cys Ser Thr Gln Pro Asp Leu Asn Trp Glu Asn Glu Asp Cys
180 185 190
Arg Lys Ala Ile Tyr Glu Ser Ala Val Gly Tyr Trp Leu Asp His Gly
195 200 205
Val Asp Gly Phe Arg Ile Asp Val Gly Ser Leu Tyr Ser Lys Val Val
210 215 220
Gly Leu Pro Asp Ala Pro Val Val Asp Lys Asn Ser Thr Trp Gln Ser
225 230 235 240
Ser Asp Pro Tyr Thr Leu Asn Gly Pro Arg Ile His Glu Phe His Gln
245 250 255
Glu Met Asn Gln Phe Ile Arg Asn Arg Val Lys Asp Gly Arg Glu Ile
260 265 270
Met Thr Val Gly Glu Met Gln His Ala Ser Asp Glu Thr Lys Arg Leu
275 280 285
Tyr Thr Ser Ala Ser Arg His Glu Leu Ser Glu Leu Phe Asn Phe Ser
290 295 300
His Thr Asp Val Gly Thr Ser Pro Leu Phe Arg Tyr Asn Leu Val Pro
305 310 315 320
Phe Glu Leu Lys Asp Trp Lys Ile Ala Leu Ala Glu Leu Phe Arg Tyr
325 330 335
Ile Asn Gly Thr Asp Cys Trp Ser Thr Ile Tyr Leu Glu Asn His Asp
340 345 350
Gln Pro Arg Ser Ile Thr Arg Phe Gly Asp Asp Ser Pro Lys Asn Arg
355 360 365
Val Ile Ser Gly Lys Leu Leu Ser Val Leu Leu Ser Ala Leu Thr Gly
370 375 380
Thr Leu Tyr Val Tyr Gln Gly Gln Glu Leu Gly Gln Ile Asn Phe Lys
385 390 395 400
Asn Trp Pro Val Glu Lys Tyr Glu Asp Val Glu Ile Arg Asn Asn Tyr
405 410 415
Asn Ala Ile Lys Glu Glu His Gly Glu Asn Ser Glu Glu Met Lys Lys
420 425 430
Phe Leu Glu Ala Ile Ala Leu Ile Ser Arg Asp His Ala Arg Thr Pro
435 440 445
Met Gln Trp Ser Arg Glu Glu Pro Asn Ala Gly Phe Ser Gly Pro Ser
450 455 460
Ala Lys Pro Trp Phe Tyr Leu Asn Asp Ser Phe Arg Glu Gly Ile Asn
465 470 475 480
Val Glu Asp Glu Ile Lys Asp Pro Asn Ser Val Leu Asn Phe Trp Lys
485 490 495
Glu Ala Leu Lys Phe Arg Lys Ala His Lys Asp Ile Thr Val Tyr Gly
500 505 510
Tyr Asp Phe Glu Phe Ile Asp Leu Asp Asn Lys Lys Leu Phe Ser Phe
515 520 525
Thr Lys Lys Tyr Asn Asn Lys Thr Leu Phe Ala Ala Leu Asn Phe Ser
530 535 540
Ser Asp Ala Thr Asp Phe Lys Ile Pro Asn Asp Asp Ser Ser Phe Lys
545 550 555 560
Leu Glu Phe Gly Asn Tyr Pro Lys Lys Glu Val Asp Ala Ser Ser Arg
565 570 575
Thr Leu Lys Pro Trp Glu Gly Arg Ile Tyr Ile Ser Glu
580 585
<210> 30
<211> 1800
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA из Erwinia amylovora
<400> 30
atgtcaggca tcaaactttc ttcagtcatg gcactcttct tcgccccatt tcttgctgtt 60
agttcaggtc aggtgctcgc aggaaagacg gatatcgcta ccacccaagt ggtgcataag 120
tccgatgact tcccggcatg gtggaagcaa gcggtgtttt accaggttta tccacgcagc 180
ttcaaagaca cgaacggtga tggtattggt gacattaagg gaatcatcga gaagctcgat 240
taccttaaca accttggcgt agatgcgatt tggattaacc cacactacga tagcccaaat 300
actgacaacg gctacgatat tcgtgattac cgcaagatca tgaaagagta cggaaccatg 360
gaagatttcg atcgtttgat cgcagaaatg aataagcgta acatgcgcct catgatcgac 420
atcgttatca accacacttc tgaccagcac cgctggttcg tgcagagcaa gtcgtctaag 480
gataacccgt atcgcgaata ctacttttgg cgcgatggaa agaacggcca accacctaac 540
aactatccgt ccttcttcgg tggttctgcg tgggaaaaag aggaccattc cgggcagtat 600
tatctacatt acttcgctaa acaacagcca gacctgaatt gggataaccc taaggttcgc 660
gaagatttgt acgcgatgct ccggttctgg ctcgacaaag gcgtcgctgg actgcggttc 720
gacaccgtag ccacctacgc taagatcccg aacttccctg acctcacgcc ctcgcaacga 780
cagaattttg cccgaactta taccgaaggt cccagtattc atcggtacat caaagaaatg 840
aacaggcaag tgttttctca ctacaatatc gctacagctg gggagatctt cggcgtcccg 900
ctggaaaagt cgattaacta tttcgaccgt cgacgcaatg aacttaacat tgcatttaca 960
tttgatctga ttcgtttgga tcgtaatgtc gaggaacgct ggcgtgaaaa agcctggtcc 1020
ctggttgatt ttcgccagac gatcggcaag gtagatcgtg cagccggaaa atacggctgg 1080
aacgcattct ttttggacaa ccacgacaac ccacgagctg tctcccactt cggcgatgac 1140
cggcctcaat ggcgccaggc gtctgcaaag gccctggcca ccctgattat cacccagagg 1200
gcgaccccgt ttatctacca gggctccgag ctgggcatga ctaattaccc tttcaagact 1260
atcgcggatt tcgatgacat tgaagtgaag ggtttttggc aggattatgt gagcagcggt 1320
cgagttgacc cagaggattt catgcgcaac gttcgtctaa ccagtcgcga caactcccgc 1380
acacccttcc aatgggacga atcggcccat gctggcttca cctccggcac gccctggttt 1440
aaggtgaacc ctaactataa gctcatcaat gcgtccgatc agatgaagga ttcagattcc 1500
gttttcaact actaccgcaa actcatccgc cttcgccacg ctattcctgc gttgacctac 1560
ggggagtata aagatctgga tccatacaat gacaccgtct acgcatttac ccgcacccac 1620
ggtgacaagc gatacctggt cgtgatcaac tttaaagaga acaaagtcaa ctatcgtttg 1680
cccggtcagc ttagcattcg ccagactctg tccgagtcat cggcatccca acgtgtagcc 1740
gacaatgctc acgagttgct cctgcaacca tggcaatccg gtatctatag gctaaattga 1800
1800
<210> 31
<211> 1770
<212> DNA
<213> Artificial Sequence
<220>
<223> aglA из Saccharomyces cerevisiae
<400> 31
atgactattt cttctgcaca tccagagaca gaaccaaagt ggtggaaaga ggccacgttc 60
tatcaaattt acccagcaag tttcaaagac tctaatgacg atggctgggg tgacatgaaa 120
gggattgcct ccaagctgga gtacatcaaa gagcttggtg ccgatgccat ttggatctca 180
ccattctacg actcgccaca agatgatatg ggttacgata ttgccaacta cgaaaaggtc 240
tggccaacat atggtacgaa tgaagactgc tttgccttga tcgaaaagac acataagctt 300
ggtatgaaat ttatcaccga cttggtcatc aatcactgtt ccagcgaaca tgaatggttc 360
aaagagagca gatcctcgaa gactaatcca aagcgtgact ggttcttctg gagacctcct 420
aaaggttatg acgccgaagg caagccaatt cctccaaaca attggaaatc ctattttggt 480
ggttccgcat ggaccttcga tgaaaagaca caagaattct acttgcgttt gttttgctcc 540
actcaacctg atttgaattg ggagaatgaa gactgtagaa aggcaatcta cgaaagtgcc 600
gttggatact ggttagacca tggtgtagac ggctttagaa ttgatgtcgg aagtttgtac 660
tccaaagttg taggtttacc agatgctcct gttgttgaca aaaactcgac ttggcaatcc 720
agtgatccat acacattgaa tggaccacgt attcacgagt tccatcaaga aatgaatcaa 780
ttcatcagaa acagagtgaa ggatggcagg gagattatga cagttggtga aatgcaacat 840
gcctccgacg aaactaagag actttatacg agtgcttcaa gacacgaact tagtgagtta 900
tttaactttt cccacactga tgtggggact tcacctttgt tccgttacaa cttggtccca 960
tttgaactga aggattggaa gattgccctt gctgagctgt tcaggtacat taatggtaca 1020
gattgttggt caacaatcta tctggaaaat cacgaccaac ctcgttcaat tacgagattt 1080
ggtgacgatt ctcccaagaa ccgtgttatt tctggtaagt tactctctgt gttgctaagt 1140
gccttgaccg gtactctata tgtgtatcag ggacaagagc ttggccaaat caatttcaag 1200
aactggcctg ttgaaaagta cgaggatgtc gaaatcagaa acaactacaa tgccattaaa 1260
gaagagcatg gggaaaactc agaggagatg aaaaagtttt tagaagccat tgcccttatc 1320
tccagggacc atgctagaac acctatgcaa tggtctcgtg aggagccaaa tgctggtttt 1380
tctggtccta gtgctaaacc atggttttac ttgaacgact ctttcagaga aggcattaac 1440
gtcgaagatg aaatcaagga tcccaactcg gttttgaact tctggaagga ggccttgaag 1500
tttagaaagg cgcataaaga cattactgtg tacggatacg atttcgagtt tattgattta 1560
gacaataaga agttgtttag cttcacaaag aagtacaaca ataaaacatt gtttgcggct 1620
ttgaacttta gctctgatgc gacagatttc aagattccaa atgatgattc atcgttcaag 1680
ttagagtttg gaaactatcc aaagaaggag gtagatgcct cttccagaac attgaagcca 1740
tgggaaggaa gaatatatat cagcgaatga 1770
<---
Изобретение относится к области биотехнологии. Описан микроорганизм рода Corynebacterium с повышенной активностью α-глюкозидазы, кодируемой геном aglA, для получения L-аминокислоты, а также способ получения L-аминокислоты с его использованием. Изобретение позволяет увеличить способность продуцировать L-аминокислоту за счет увеличения активности α-глюкозидазы. 4 н. и 7 з.п. ф-лы, 5 табл., 7 пр., 1 ил.
1. Микроорганизм рода Corynebacterium с повышенной активностью α-глюкозидазы, продуцирующий L-аминокислоту, где α-глюкозидаза кодируется геном aglA.
2. Микроорганизм по п. 1, где α-глюкозидаза имеет происхождение из Bifidobacterium adolescentis.
3. Микроорганизм по п. 1, где α-глюкозидаза включает белок, содержащий аминокислотную последовательность SEQ ID NO: 1.
4. Микроорганизм по п. 1, где L-аминокислота представляет собой по меньшей мере одну аминокислоту, выбранную из группы, состоящей из L-лизина, L-треонина и L-изолейцина.
5. Микроорганизм по п. 1, где микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
6. Способ получения L-аминокислоты, включающий культивирование микроорганизма рода Corynebacterium с повышенной активностью α-глюкозидазы, продуцирующего L-аминокислоту, в среде и выделение L-аминокислоты из культуральной среды или из микроорганизма, и где α-глюкозидаза кодируется геном aglA.
7. Способ получения L-аминокислоты по п. 6, где α-глюкозидаза имеет происхождение из Bifidobacterium adolescentis.
8. Способ получения L-аминокислоты по п. 6, где α-глюкозидаза представляет собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 1.
9. Способ получения L-аминокислоты по п. 6, где L-аминокислота представляет собой по меньшей мере одну аминокислоту, выбранную из группы, состоящей из L-лизина, L-треонина и L-изолейцина.
10. Способ увеличения продуцирования L-аминокислоты, включающий усиление экспрессии α-глюкозидазы в микроорганизме рода Corynebacterium, и где α-глюкозидаза кодируется геном aglA.
11. Применение α-глюкозидазы для увеличения продуцирования L-аминокислоты, где α-глюкозидаза кодируется геном aglA.
| US 20140080185 А1, 20.03.2014 | |||
| СМИРНОВ В.А., КЛИМОЧКИН Ю.Н | |||
| Учебное пособие "Ферменты | |||
| Классификация и номенклатура, Ч.III, 2008, Самара, Самарский государственный технический университет, С.20-21 | |||
| NCBI Reference Sequence: WP_011743867.1, alpha-glucosidase [Bifidobacterium adolescentis], 26.09.2017 | |||
| СПОСОБ ФЕРМЕНТАТИВНОГО ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ КОРИНЕФОРМНЫХ БАКТЕРИЙ | 2000 |
|
RU2247778C2 |
| КОРИНЕФОРМНАЯ БАКТЕРИЯ, ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2004 |
|
RU2333247C2 |
Авторы
Даты
2020-09-15—Публикация
2019-04-09—Подача