Область техники
Настоящая заявка относится к новому варианту белка, обладающему L-тирозин-экспортирующей активностью, к микроорганизму для получения L-тирозина, включающему этот вариант белка, и к способу получения L-тирозина с использованием этого микроорганизма.
Предшествующий уровень техники
L-тирозин представляет собой аминокислоту и используется в качестве важного вещества для фармацевтического сырья, пищевых добавок, кормов для животных, биологически активных добавок и т.п. Для того, чтобы получить L-тирозин и другие полезные вещества, проводятся различные исследования для разработки микроорганизмов с высокоэффективным продуцированием и технологий для процессов ферментации.
Процесс получения L-тирозина микроорганизмами начинается с 3-дезокси-D-аробино-гептулозонат-7-фосфата (DAHP), получаемого посредством реакции полимеризации фосфоенолпирувата (PEP), который является промежуточным продуктом гликолиза, с эритрозо-4-фосфатом (Е4Р), который является промежуточным продуктом пентозофосфатного пути. Затем DAHP биосинтезируется из хоризмата в префенат посредством обычного ароматического биосинтетического пути и, наконец, превращается в L-тирозин посредством L-тирозин-биосинтетического пути.
При этом экспрессия гена, способного экспортировать определенную аминокислоту, способствует увеличению продуктивности по соответствующей аминокислоте в микроорганизмах. Усиление L-лизин-экспортирующего гена (lysE) в микроорганизме рода Corynebacterium улучшает продуктивность по лизину (US 6858406 В1). Кроме того, усиление гена rhtC в Е. coli улучшает устойчивость к L-треонину и одновременно также улучшают продуктивность по L-гомосерину, L-треонину и L-лейцину (ЕР 1013765 А1). В ЕР 1016710 В1 описано улучшение продуктивности по L-глутаминовой кислоте, L-лизину, L-треонину, L-аланину, L-гистидину, L-пролину, L-аргинину, L-валину и L-изолейцину путем усиления генов yahN, yeaS, yflK и yggA, функции которых в Е. coli еще не идентифицированы.
Описание
Техническая задача
Однако, до сих пор не сообщалось об экспортирующем белке, демонстрирующем специфичность к L-тирозину. Хотя ген yddG Е. coli известен как белок, экспортирующий ароматические аминокислоты, он демонстрирует более высокую специфичность к L-фенилаланину, чем к L-тирозину или L-триптофану (FEME Microbiol Lett 275 (2007) 312-318). Кроме того, ничего не сообщалось о белке, который может экспортировать L-тирозин или ароматическую аминокислоту (J Ind Microbiol Biotechnol. 2015 May; 42(5):787-97) в микроорганизме рода Corynebacterium, который в основном используется в качестве штамма, производящего ферментацию L-аминокислоты.
Решение технической задачи
Одной из задач настоящего изобретения является предложение варианта белка, в котором 79-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 52 заменена на аланин или глицин; полинуклеотида, кодирующего такую последовательность; и вектора, содержащего такой полинуклеотид.
Другой задачей настоящего изобретения является предложение микроорганизма для продуцирования L-тирозина, включающего один или более вариантов белка; полинуклеотида, кодирующего их; и вектора, содержащего такой полинуклеотид.
Еще одной задачей настоящего изобретения является предложением способа получения L-тирозина, включающего культивирование микроорганизма.
Еще одной задачей настоящего изобретения является предложение композиции для получения L-тирозина, включающей один или более вариантов белка; полинуклеотида; вектора; и микроорганизма.
Положительные эффекты
Микроорганизм, экспрессирующий вариант белка по настоящему изобретению, может значительно улучшать продуцирование L-тирозина по сравнению с родительским штаммом, который не экспрессирует такой вариант белка, и, следовательно, может эффективно продуцировать L-тирозин, используя вариант белка.
Подробное описание предпочтительных воплощений
Ниже настоящее изобретение будет описано подробно. При этом каждое описание и раскрытое здесь воплощение могут быть применены к другим описаниям и воплощениям соответственно. То есть, все комбинации различных раскрытых здесь элементов попадают в объем настоящего изобретения. Кроме того, объем настоящего изобретения не ограничен конкретным описанием, представленным ниже.
Кроме того, специалисты обычной квалификации в данной области способны определить или подтвердить, используя только обычные эксперименты, многие эквиваленты конкретных аспектов описанного здесь изобретения. Кроме того, также предполагается, что эти эквиваленты включены в настоящее описание изобретения.
Кроме того, ряд документов и патентов были упомянуты и процитированы в настоящем описании изобретения. Содержание процитированных документов и патентов включено в настоящий документ посредством ссылки во всей их полноте, и уровень технической области, к которой принадлежит настоящее изобретение, и содержание настоящего изобретения будут описаны более четко.
В одном аспекте настоящей заявки предложен вариант белка, обладающего L-тирозин-экспортирующей активностью, в котором одна или более аминокислот в аминокислотной последовательности SEQ ID NO: 52 заменены другой аминокислотой.
Вариант белка может быть вариантом белка, обладающим L-тирозин-экспортирующей активностью, в котором 79-ая аминокислота от N-конца в аминокислотной последовательности SEQ ID NO: 52 заменена другой аминокислотой.
При использовании здесь термин "L-тирозин" относится к одной из 20 α-аминокислот и классифицируется, как полярная аминокислота или ароматическая аминокислота. Тирозин является коммерчески важной аминокислотой, используемой в качестве предшественника фармацевтических средств, флавоноидов, алкалоидов и т.д.
В настоящем описании "белок, имеющий L-тирозин-экспортирующую активность" может быть белком, обладающим активностью, способной специфически экспортировать L-тирозин из клетки.
Белок, имеющий L-тирозин-экспортирующей активностью, по настоящему изобретению может происходить из белка, обладающего L-тирозин-экспортирующей способностью, полученного из Herbaspirillum rhizosphaerae, но без ограничения им.
В частности, "Herbaspirillum rhizosphaerae" являются грамотрицательной бактерией рода Herbaspirillum. В Корее он может быть выделен из ризосферы в почве, как штамм, выделенный на острове Ульдунг, и т.д.
Хотя белок, обладающий L-тирозин-экспортирующей активностью, происходящий из Herbaspirillum rhizosphaerae, может быть, например, белком, включающим аминокислотную последовательность SEQ ID NO: 52, очевидно, что любая последовательность, обладающая такой же активностью, что и аминокислотная последовательность SEQ ID NO: 52, в которой последовательность, соответствующая положению 79 в SEQ ID NO: 52, заменена другой аминокислотой по настоящему изобретению, отличной от последовательности дикого типа, и посредством этого имеющая способность экспортировать L-тирозин, входит в объем настоящего изобретения без ограничения в отношении ее происхождения в качестве целевого белка, имеющего аминокислотную мутацию остатка, соответствующего положению 79. Белок, включающий аминокислотную последовательность SEQ ID NO: 52, может быть использован взаимозаменяемо с белком, имеющим аминокислотную последовательность SEQ ID NO: 52, и белком, состоящим из аминокислотной последовательности SEQ ID NO: 52.
Более конкретно, белок, обладающий L-тирозин-экспортирующей активностью по настоящему изобретению может быть вариантом белка, включающим аминокислотную последовательность SEQ ID NO: 52.
Белок, включающий аминокислотную последовательность SEQ ID NO: 52, представляет собой белок, обладающий L-триптофан-экспортирующей активностью, и впервые в настоящем изобретении было установлено, что вариант, в котором аминокислота, соответствующая 79-ому положению, мутирована, обладает L-тирозин-экспортирующей активностью.
В настоящем изобретении белок, включающий аминокислотную последовательность SEQ ID NO: 52, представляет собой типичный пример белков, в которые может быть введена мутация, и это не исключает добавление последовательности до или после аминокислотной последовательности SEQ ID NO: 52, мутация, которая может произойти естественным образом, или его молчащая мутация, и когда белок обладает активностью, идентичной или соответствующей белку, включающему аминокислотную последовательность SEQ ID NO: 52, этот белок принадлежит к белкам, в которые может быть введена мутация, по настоящему изобретению.
Например, белок, в который может быть введена мутация по настоящему изобретению, может представлять собой белок, состоящий из аминокислотной последовательности SEQ ID NO: 52 или аминокислотной последовательности, имеющей гомологию с аминокислотной последовательностью SEQ ID NO: 52, составляющую 80%, 90%, 95%, 97% или более. Кроме того, очевидно, что любой белок, имеющий аминокислотную последовательность с делецией, модификацией, заменой или вставкой в часть последовательности, может также входить в объем белка, являющегося мишенью для мутации по настоящему изобретению при условии, что этот белок имеет аминокислотную последовательность с любой из вышеперечисленных гомологий и идентичностей и демонстрирует эффект, соответствующий вышеуказанному белку.
То есть, в настоящем изобретении, хотя он описан как "белок или полипептид, имеющий аминокислотную последовательность с конкретным SEQ ID NO" или "белок или полипептид, включающий аминокислотную последовательность с конкретным SEQ ID NO", очевидно, что любой белок, который имеет делецию, модификацию, замену или вставку в часть аминокислотной последовательности, также может быть использован в настоящем изобретении, при условии, что белок имеет такую же или соответствующую активность с полипептидом, состоящим из аминокислотной последовательности с соответствующим SEQ ID NO. Например, очевидно, что "белок, состоящий из аминокислотной последовательности SEQ ID NO: 52" может входить в объем термина "белок, включающий аминокислотную последовательность SEQ ID NO: 52", при условии, что этот белок имеет такую же или соответствующую активность.
При использовании здесь термин "вариант" относится к белку, имеющему одну или более аминокислот, отличных от указанной последовательности консервативными заменами и/или модификациями, такими, что функции и свойства белка сохраняются. Варианты отличаются от указанных последовательностей заменой, делецией или вставкой нескольких аминокислот. Такие варианты, как правило, могут быть идентифицированы путем модификации одной или более приведенных выше аминокислотных последовательностей белка и оценки свойств модифицированного белка. То есть способность вариантов может быть усилена, не изменена или снижена по сравнению с нативным белком. Кроме того, некоторые варианты могут включать варианты, у которых одна или более частей, например N-концевая лидерная последовательность или трансмембранный домен, удалены. Кроме того, некоторые варианты могут включать в себя те, у которых один или более участков удалены с N- и/или С-конца зрелого белка. Термин "вариант" можно использовать взаимозаменяемо с такими терминами, как модификация, модифицированный белок, модифицированный полипептид, мутант, мутеин, дивергент, вариант и т.д., без ограничений, при условии, что эти термины используют для указания мутации. Для целей настоящей заявки вариант может быть таким, в котором активность белка увеличена по сравнению с нативным белком дикого типа или не модифицированным белком, но не ограничен ими.
При использовании здесь термин "консервативная замена" относится к замене аминокислоты другой аминокислотой, имеющей похожие структурные и/или химические свойства. Вариант может иметь, например, одну или более консервативных замен при сохранении одной или более биологических активностей. Такая аминокислотная замена может, как правило, происходить на основании сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатка.
Например, среди аминокислот, имеющих электрически заряженную боковую цепь, положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; отрицательно заряженные (кислые) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту; и аминокислоты, имеющие незаряженную боковую цепь, включают глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин, серии, треонин, цистеин, тирозин, аспарагин и глутамин.
Кроме того, вариант может также включать делецию или вставку аминокислот, которые оказывают минимальное влияние на свойства и вторичную структуру полипептида. Например, полипептид может быть конъюгирован с сигнальной (или лидерной) последовательностью на N-конце, участвующей в переносе белков котрансляционно или посттрансляционно. Кроме того, полипептид также может быть конъюгирован с другой последовательностью или линкером для идентификации, очистки или синтеза полипептида.
Вариант белка, обладающий L-тирозин-экспортирующей активностью, предложенный в настоящем изобретении, может относиться к варианту, в котором, среди вышеописанных белков, аминокислота в конкретном положении или соответствующим ему заменена другой аминокислотой, и полученная L-тирозин-экспортирующая способность белка превышает 100% по сравнению с такой способностью до мутации.
В настоящем изобретении "замена другой аминокислотой" не ограничена, при условии, что происходит заменена аминокислотой, отличной от аминокислоты до замены. То есть выражение, что лейцин, который является 79-ой аминокислотой от N-конца аминокислотной последовательности SEQ ID NO: 52, заменен "аминокислотой, отличной от лейцина" может быть сформулировано следующим образом "79-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 52 заменена другой аминокислотой". При этом в настоящем изобретении, когда указано, что "конкретная аминокислота была заменена", очевидно, что эта аминокислота заменена аминокислотой, отличной от аминокислоты до замены, даже если конкретно не указано, что аминокислота была заменена другой аминокислотой.
Вариант белка по настоящему изобретению может быть вариантом, в котором 79-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 52 заменена другой аминокислотой, без ограничения этим.
Конкретно, вариант белка по настоящему изобретению может быть вариантом, в котором 79-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 52 заменена аланином, глицином, изолейцином, метионином, серином, пролином, треонином, тирозином, аспарагином, аргинином или триптофаном, но без ограничения ими.
Конкретно, вариант белка по настоящему изобретению может быть вариантом, в котором 79-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 52 заменена аланином, глицином, изолейцином, метионином, треонином, тирозином, аспарагином, аргинином или триптофаном, но без ограничения этим. Конкретно, вариант белка по настоящему изобретению может быть вариантом, в котором 79-ая аминокислота от N-конца аминокислотной последовательности SEQ ID NO: 52 заменена аланином, глицином, но без ограничения ими.
Такой вариант белка по настоящему изобретению обладает повышенной L-тирозин-экспортирующей способностью по сравнению с белком до мутации.
Очевидно, что вариант белка, в котором аминокислота в положении 79 от N-конца аминокислотной последовательности SEQ ID NO: 52 по настоящему изобретению заменена другой аминокислотой, может включать варианты белка, в которых аминокислота, соответствующая положению 79 от N-конца аминокислотной последовательности SEQ ID NO: 52 заменена другой аминокислотой, хотя это положение описано как другое положение, отличное от положения 79, в результате удаления/добавления/вставки на N- или С-конце аминокислотной последовательности SEQ ID NO: 52 или промежуточной аминокислоты, и т.д.
Кроме того, хотя в настоящей заявке вариант белка, в котором 79-ая аминокислота от N-конца SEQ ID NO: 52 заменена другой аминокислотой, был описан как белок, обладающий L-тирозин-экспортирующей активностью, вариант белка, имеющий L-тирозин-экспортирующую активность, по настоящему изобретению, не ограничен вариантом SEQ ID NO: 52, и очевидно, что варианты, имеющие L-тирозин-экспортирующую активность в результате замены "аминокислоты, соответствующей положению 79 от N-конца аминокислотной последовательности SEQ ID NO: 52" другой аминокислотой, в любой аминокислотной последовательности, имеющей такую же активность, что и аминокислотная последовательность SEQ ID NO: 52, или L-тирозин-экспортирующую активность, также попадают в объем вариантов белка по настоящему изобретению.
"Аминокислота, соответствующая положению 79 от N-конца аминокислотной последовательности SEQ ID NO: 52" в любой аминокислотной последовательности может быть идентифицирована посредством различных способов выравнивания последовательностей, известных в данной области.
Вариант белка, в котором аминокислота в положении 79 от N-конца аминокислотной последовательности SEQ ID NO: 52 по настоящему изобретению заменена другой аминокислотой, может быть белком, который включает аминокислотную последовательность SEQ ID NO: 52 или аминокислотную последовательность, имеющую гомологию или идентичность, составляющую 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% или более, и в котором аминокислота, соответствующая положению 79 от N-конца аминокислотной последовательности SEQ ID NO: 52 заменена другой аминокислотой.
Вариант белка по настоящему изобретению может включать любую аминокислотную последовательность из SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NOS: 77-85. В частности, это может быть последовательность, по существу состоящая из любой аминокислотной последовательности с SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NOS: 77-85, и более конкретно, она может состоять из любой из аминокислотных последовательностей с SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NOS: 77-85. В одном воплощении вариант белка по настоящему изобретению может состоять из любой аминокислотной последовательности из SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NOS: 77-83, и в другом воплощении вариант белка по настоящему изобретению может состоять из аминокислотной последовательности SEQ ID NO: 1 или SEQ ID NO: 2, но не ограничен ими.
Вариант белка по настоящему изобретению может включать любую аминокислотную последовательность из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85. Вариант белка по настоящему изобретению может включать любую аминокислотную последовательность из SEQ ID NO: 1, 2 и SEQ ID NO: 77-83. Вариант белка по настоящему изобретению может включать аминокислотную последовательность SEQ ID NO: 1 или 2, но без ограничения ими.
При этом вариант белка по настоящему изобретению может по существу состоять из вышеупомянутой аминокислотной последовательности SEQ ID NO или может состоять из вышеупомянутой аминокислотной последовательности SEQ ID NO, но без ограничения ими.
Кроме того, вариант белка может включать любую аминокислотную последовательность, в которой 79-ая аминокислота в любой из аминокислотных последовательностей SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NOS: 77-85 фиксирована и которая обладает гомологией или идентичностью, составляющей по меньшей мере 80%, 90%, 95%, 96%, 97%, 98% или 99%, но вариант белка не ограничен этим. Кроме того, очевидно, что любой белок, который имеет аминокислотную последовательность с делецией, модификацией, заменой или вставкой в часть последовательности, отличной от аминокислоты в положениях 79, также может быть включен в объем настоящего изобретения, при условии, что аминокислотная последовательность обладает любой из вышеупомянутых гомологий или идентичностей и демонстрирует эффект, соответствующий указанному выше варианту белка.
При использовании здесь термин "гомология" или "идентичность" относится к степени соответствия между двумя приведенными аминокислотными и нуклеотидными последовательностями и может быть выражен в процентах.
Термины "гомология" и "идентичность" часто могут использоваться взаимозаменяемо друг с другом.
Гомология или идентичность последовательности консервативных полинуклеотидов или полипептидов может быть определена с помощью стандартных алгоритмов выравнивания и может быть использована со штрафом за пропуск в последовательности, установленным используемой программой. По сути, гомологичные или идентичные последовательности могут гибридизоваться в умеренных или очень жестких условиях так, что полная длина последовательности или по меньшей мере примерно 50%, 60%, 70%, 80% или 90% или более от полной длины могут гибридизоваться. Также рассматриваются полинуклеотиды, которые содержат вырожденные кодоны вместо кодонов в гибридизованных полинуклеотид ах.
Гомология или идентичность полипептидных или полинуклеотидных последовательностей может быть определена посредством, например, алгоритма BLAST согласно литературе (Karlin and Altschul, Pro. Natl. Acad. Sci. USA, 90, 5873(1993)), или FASTA согласно Pearson {Methods Enzymol, 183, 63, 1990). Ha основании алгоритма BLAST была разработана программа, называемая BLASTN или BLASTX (http://www.ncbi.nlm.nih.gov). Кроме того, имеют ли какие-либо аминокислотные или полинуклеотидные последовательности гомологию, сходство или идентичность друг с другом, можно идентифицировать путем сравнения последовательностей в эксперименте Саузерн-гибридизации в жестких условиях, как определено, и определение соответствующих условий гибридизации входит в компетенцию специалиста данной области, и они могут быть определены посредством метода, хорошо известного специалистам в данной области (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F. M. Ausubel et al., Current Protocols in Molecular Biology).
В другом аспекте настоящего изобретения предложен полинуклеотид, кодирующий вариант белка.
При использовании здесь "полинуклеотид", который представляет собой полимер из нуклеотидов, состоящий из нуклеотидных мономеров, соединенных в длинную цепь посредством ковалентной связи, представляет собой нить ДНК или РНК, имеющую по меньшей мере определенную длину. Более конкретно, это может относиться к фрагменту полинуклеотида, кодирующему вариант белка.
Полинуклеотид, кодирующий вариант белка по настоящему изобретению, может быть включен без ограничения, при условии, что он представляет собой полинуклеотидную последовательность, кодирующую вариант белка, имеющий L-тирозин-экспортирующую способность.
В настоящей заявке ген, кодирующий аминокислотную последовательность белка, являющуюся объектом для мутации, может представлять собой ген wex и может быть получен из Herbaspirillum rhizosphaerae, и, в частности, он может представлять собой нуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 52, но не ограничен этим.
Кроме того, полинуклеотид, кодирующий вариант белка по настоящему изобретению, может претерпевать различные модификации в области кодирования в объеме, не меняющем аминокислотную последовательность полипептида, из-за вырожденности кодонов или при рассмотрении предпочтительных в организме кодонов, в которых вариант белка должен быть экспрессирован. В частности, любая полинуклеотидная последовательность, кодирующая вариант белка, в которой 79-ая аминокислота в аминокислотной последовательности SEQ ID NO: 52 заменена на другую аминокислоту, может быть включена без ограничений.
Например, полинуклеотид по настоящему изобретению может быть вариантом белка по настоящему изобретению, в частности белком, включающим любую аминокислотную последовательность из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NOS: 77-85 или полинуклеотидную последовательность, кодирующую белок, имеющую гомологию или идентичность с ними, но без ограничения этим. Гомология и идентичность являются такими, как описано выше.
Кроме того, полинуклеотид, кодирующий вариант белка, может включать зонд, который может быть получен из известной последовательности генов, например, любой последовательности, кодирующей вариант белка, в которой 79-ая аминокислота в аминокислотной последовательности SEQ ID NO: 52 заменена другой аминокислотой, при гибридизации с последовательностью, комплементарной всей или части полинуклеотидной последовательности в жестких условиях без ограничения.
"Жесткие условия" относятся к условиям, в которых возможна специфическая гибридизация полинуклеотидов. Такие условия более конкретно описаны в литературе (J. Sambrook et al., выше). Например, жесткие условия могут включать условия, в которых гены, имеющие высокую гомологию или идентичность, составляющую 40% или более, в частности 90% или более, в частности 95% или более, еще более конкретно 97% или более, еще более конкретно 99% или более, гибридизируются друг с другом, и гены, имеющие гомологию или идентичность ниже, чем вышеприведенная гомология или идентичность, не гибридизируются друг с другом, или условиях промывки Саузерн-гибридизации, то есть, при однократной промывке, особенно, при двукратной или трехкратной промывке при концентрации соли и температуре, соответствующей 60°С, 1×SSC (цитрат и хлорид натрия), 0,1% SDS (додецилсульфат натрия), особенно 60°С, 0,1×SSC, 0,1% SDS, и более конкретно 68°С, 0,1×SSC, 0,1% SDS. Однако условия не ограничены этими и могут быть соответствующим образом скорректированы специалистами в данной области в зависимости от цели.
Для гибридизации требуется, чтобы два полинуклеотида содержали комплементарные последовательности, хотя возможны несоответствия между основаниями в зависимости от жесткости гибридизации. Термин "комплементарный" используют для описания взаимоотношения между нуклеотидными основаниями, которые могут гибридизоваться друг с другом. Например, в случае ДНК, аденин комплементарен тимину, и цитозин комплементарен гуанину. Следовательно, настоящее изобретение может включать выделенные полинуклеотидные фрагменты, комплементарные всей последовательности, а также полинуклеотидные последовательности в значительной степени похожие на нее.
Как правило, полинуклеотиды, обладающие гомологией, могут быть обнаружены с использованием условий гибридизации, включающих стадию гибридизации при значении Tm 55°С в вышеуказанных условиях. Кроме того, значение Tm может составлять 60°С, 63°С или 65°С, но не ограничено ими, и может быть соответствующим образом скорректировано специалистами в данной области в зависимости от цели.
Соответствующая жесткость гибридизации полинуклеотидов зависит от длины полинуклеотидов и степени комплементарности, и эти переменные хорошо известны в данной области (например, Sambrook et al., выше, 9.50-9.51, 11.7-11.8).
В еще одном аспекте настоящего изобретения предложен вектор, содержащий полинуклеотид, кодирующий вариант белка.
При использовании здесь термин "вектор" относится к ДНК-конструкции, содержащей нуклеотидную последовательность полинуклеотида, кодирующего целевой белок, функционально связанной с подходящей последовательностью регуляции экспрессии так, чтобы обеспечить возможность экспрессии целевого белка в подходящей клетке-хозяине. Регуляторная последовательность экспрессии может включать промотор, способный инициировать транскрипцию, любую последовательность оператора для регуляции транскрипции, последовательность, кодирующую подходящий сайт связывания с рибосомой на мРНК, и последовательность для регулирования прекращения транскрипции и трансляции. При трансформации в подходящую клетку-хозяина вектор может реплицироваться или функционировать независимо от генома хозяина или может интегрировать в его геном.
Вектор, используемый в настоящей заявке, конкретно не ограничен, и может быть использован любой вектор, известный в данной области. Примеры обычно используемого вектора могут включать природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора могут быть использованы pWE15, М13, MBL3, MBL4, ГХП, ASHII, АРП, t10, t11, Charon4A и Charon21A, и т.д.; а в качестве плазмидного вектора могут использоваться векторы, основанные на pBR, pUC, pBluescriptll, pGEM, pTZ, pCL и pET, и т.д. В частности, может быть использован вектор pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 или pCClBAC.
В одном примере полинуклеотид, кодирующий целевой белок в хромосоме, может быть заменен модифицированным полинуклеотидом при помощи вектора для внутриклеточной хромосомной вставки. Вставка полинуклеотида в хромосому может быть выполнена любым методом, известным в данной области, например посредством гомологичной рекомбинации, но без ограничения ей. Вектор может дополнительно включать маркер селекции для подтверждения вставки в хромосому. Маркер селекции предназначен для селекции клеток, трансформированных вектором, то есть для подтверждения того, что молекула целевой нуклеиновой кислоты была введена, и для этого могут быть использованы маркеры, которые обеспечивают селектируемые фенотипы, такие как лекарственная устойчивость, ауксотрофия, устойчивость к клеточным токсическим агентам или экспрессия поверхностных белков. Только клетки, экспрессирующие маркер селекции, способны выживать или демонстрировать разные фенотипы в окружающей среде, обработанной селективным агентом, и, таким образом, трансформированные клетки могут быть отобраны.
В еще одном аспекте настоящего изобретения предложен микроорганизм для продуцирования L-тирозина, включающий один или более вариантов белка; полинуклеотид, кодирующий их; вектор, содержащий полинуклеотид.
Микроорганизм для продуцирования L-тирозина может быть микроорганизмом, имеющим повышенную L-тирозин-продуцирующую способность, включающим один или более вариантов белка; полинуклеотид, кодирующий их; и вектор, содержащий полинуклеотид, по сравнению с микроорганизмом, включающим SEQ ID NO: 52 дикого типа.
Микроорганизм, включающий один или более вариантов белка; полинуклеотид, кодирующий их; и вектор, содержащий полинуклеотид, может быть микроорганизмом, которому придана L-тирозин-продуцирующая способность, но не ограничен им.
При использовании здесь термин "микроорганизм для продуцирования L-тирозина" или "микроорганизм, имеющий L-тирозин-продуцирующую способность" может быть микроорганизмом, имеющим природную способность производить тирозин, или микроорганизмом, в котором тирозин-продуцирующая способность придана родительскому штамму, который не способен продуцировать тирозин.
Микроорганизм может быть микроорганизмом, который может производить L-тирозин из источников углерода в среде в избыточном количестве по сравнению с микроорганизмом дикого типа или не модифицированным микроорганизмом. Кроме того, микроорганизм для продуцирования L-тирозина может быть рекомбинантным микроорганизмом. В частности, микроорганизм может быть микроорганизмом рода Enterobacter, микроорганизмом рода Escherichia, микроорганизмом рода Erwinia, микроорганизмом рода Serratia, микроорганизмом рода Providencia, микроорганизмом рода Corynebacterium или микроорганизмом рода Brevibacterium, но тип микроорганизма конкретно не ограничен при условии, что микроорганизм продуцирует L-тирозин. Более конкретно, микроорганизм может быть микроорганизмом рода С oryneb acterium или микроорганизмом рода Escherichia. Более конкретно, микроорганизм может быть микроорганизмом рода Corynebacterium, например Corynebacterium glutamicum, но не ограничен ими.
Еще более конкретно, микроорганизм рода Escherichia может быть микроорганизмом Escherichia coli, а микроорганизм рода Corynebacterium может быть микроорганизмом Corynebacterium glutamicum, но любой микроорганизм рода Escherichia или рода Corynebacterium, в который белок введен, обладающий L-тирозин-экспортирующей активностью, или активность которого повышена и, таким образом, количество полученного L-тирозина может быть увеличено, может быть включен без ограничения.
Микроорганизм, который может продуцировать L-тирозин путем включения варианта белка по настоящему изобретению; полинуклеотид, кодирующий его; вектор, содержащий такой полинуклеотид, может быть микроорганизмом, экспрессирующим вариант белка по настоящему изобретению.
При использовании здесь термин "экспрессированный/экспрессируемый" белок относится к состоянию, в котором целевой белок введен в микроорганизм или целевой белок модифицирован для экспрессии в микроорганизме. Когда целевой белок представляет собой белок, присутствующий в микроорганизме, этот термин относится к состоянию, в котором активность белка увеличена по сравнению с активностью его эндогенного белка или активностью до его модификации.
Микроорганизм, экспрессирующий вариант белка по настоящему изобретению, может быть микроорганизмом, который был модифицирован для экспрессии варианта белка, и соответственно, в еще одном аспекте настоящего изобретения предложен способ получения микроорганизма, экспрессирующего вариант белка по настоящему изобретению.
Для целей настоящего изобретения, "целевой белок" может быть вариантом белка, имеющим L-тирозин-экспортирующую активность, описанную выше.
В частности, термин "введение белка" означает, что микроорганизм демонстрирует активность конкретного белка, которым этот микроорганизм изначально не обладал, или микроорганизм демонстрирует повышенную активность по сравнению с его эндогенной активностью или активностью белка до модификации. Например, это может означать, что полинуклеотид, кодирующий конкретный белок, введен в хромосому микроорганизма; или вектор, содержащий полинуклеотид, кодирующий конкретный белок, введен в микроорганизм, и это позволяет проявлять активность конкретного белка. Кроме того, термин "повышение активности" означает, что активность конкретного белка, которым обладает микроорганизм, повышена по сравнению с его эндогенной активностью или активностью до модификации. Термин "эндогенная активность" относится к активности конкретного белка, которым исходно обладал родительский штамм до модификации, в случае, когда характеристика микроорганизма изменена в результате генетической мутации, вызванный природным или искусственным фактором.
В частности, повышение активности по настоящему изобретению может быть достигнуто одним или более методами, выбранными из группы, состоящей из: метода увеличения числа внутриклеточных копий гена, кодирующего вариант белка; метода введения мутации в последовательность, контролирующую экспрессию гена, кодирующего вариант белка; метода замены последовательности, контролирующей экспрессию гена, кодирующего вариант белка, имеющего L-тирозин-экспортирующую активность, последовательностью, имеющей сильную активность; метода замены гена, кодирующего нативный белок, обладающий L-тирозин-экспортирующей активностью, в хромосоме геном, кодирующим вариант белка; метода дополнительного введения мутации в ген, кодирующий белок так, чтобы активность варианта белка повышалась; и метода введения варианта белка в микроорганизм, но метод увеличения активности не ограничен этим.
В вышеуказанном методе увеличение числа копий гена может быть выполнено в форме, когда ген функционально связан с вектором, или посредством вставки гена в хромосому клетки-хозяина, но метод конкретно не ограничен этим. В частности, число копий гена может быть увеличено посредством введения вектора в клетку-хозяина, где вектор, с которым полинуклеотид, кодирующий белок по настоящему изобретению, функционально связан и который может реплицироваться и функционировать независимо от клетки-хозяина, введен в клетку-хозяина. Альтернативно, число копий гена может быть увеличено путем введения в хромосому клетки-хозяина вектора, с которым функционально связан полинуклеотид и который может ввести полинуклеотид в хромосому клетки-хозяина. Введение полинуклеотида в хромосому может быть способом, известным в данной области, например посредством гомологичной рекомбинации.
Затем модификацию последовательности контролирования экспрессии для увеличения экспрессии полинуклеотида можно осуществить путем индукции мутации в последовательности нуклеиновой кислоты посредством делеции, вставки, неконсервативной или консервативной замены или их комбинации так, чтобы еще больше усилить активность последовательности контролирования экспрессии; или посредством замены последовательности контролирования экспрессии последовательностью нуклеиновой кислоты с более сильной активностью, но способ модификации последовательности контролирования экспрессии конкретно не ограничен этим. Последовательность контролирования экспрессии может включать промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, последовательности, контролирующие окончание транскрипции и трансляции, и т.д., но последовательность контролирования экспрессии конкретно не ограничена этим.
Сильный промотор может быть связан с расположенной выше единицей экспрессии полинуклеотида вместо исходного промотора, но без ограничения этим. Примеры сильного промотора, известного в данной области, могут включать промоторы cj1 - cj7 (патент KR 10-0620092), промотор lac, промотор trp, промотор trc, промотор tac, промотор фага лямбда PR, промотор PL, промотор tet, промотор gapA, промотор SPL7, промотор SPL13 (sm3) (патент KR 10-1783170), промотор O2 (патент KR 10-1632642), промотор tkt, промотор усс А, и т.д., но сильный промотор не ограничен этим.
Кроме того, модификация последовательности полинуклеотида в хромосоме может быть выполнена путем индукции мутации в последовательности контролирования экспрессии посредством делеции, вставки, неконсервативной или консервативной замены или их комбинации, чтобы еще больше повысить активность полинуклеотидной последовательности; или посредством замены полинуклеотидной последовательности последовательностью полинуклеотида, улучшенной так, чтобы иметь более сильную активность, но способ модификации полинуклеотидной последовательности конкретно не ограничен этим.
Введение и усиление активности белка, как описано выше, может, в общем случае, увеличить активность или концентрацию соответствующего белка по меньшей мере на 1%, 10%, 25%, 50%, 75%, 100%, 150%, 200%, 300%, 400% или 500%, и в лучшем случае на 1000% или 2000%, на основе активности или концентрации белка в штамме микроорганизма дикого типа или немодифицированного микроорганизма, но диапазон увеличения не ограничен этим.
При использовании здесь термин "немодифицированный штамм" не исключает штамм, содержащий мутацию, которая может произойти естественным образом в микроорганизме, и может относиться к самому штамму природного типа или к штамму до изменения его характеристики в результате генетической модификации, вызванной природными или искусственными факторами. "Немодифицированный штамм" может использоваться взаимозаменяемо с терминами "немутантный штамм", "штамм до модификации", "микроорганизм до модификации", "немутантный микроорганизм", "немодифицированный микроорганизм" или "микроорганизм для сравнения". В одном воплощении немодифицированный микроорганизм может быть штаммом, который не включает вариант белка, имеющий L-тирозин-экспортирующую активность по настоящему изобретению.
Микроорганизм по настоящему изобретению может быть природным микроорганизмом самим по себе, имеющим тирозин-продуцирующую способность, микроорганизмом, в котором активность гена, вовлеченного в механизм продуцирования тирозина, увеличена или инактивирована так, чтобы иметь улучшенную тирозин-продуцирующую способность, или микроорганизмом, в котором активность чужеродного гена внесена или повышена так, чтобы иметь улучшенную тирозин-продуцирующую способность.
Для того чтобы придать L-тирозин-продуцирующую способность микроорганизму по настоящему изобретению или увеличить продуцирующую способность, можно использовать модификацию для непрерывного снабжения предшественниками (например эритрозо-4-фосфатом; Е4Р) и эффективное использование энергии, метод увеличения биосинтеза L-тирозина посредством блокирования разветвленных путей в пути биосинтеза L-тирозина или модификацию использования меньшего количества АТФ и т.д.
В частности, в настоящем изобретении родительский штамм L-тирозин-продуцирующего микроорганизма, который модифицирован таким образом, что вариант белка, имеющий L-тирозин-экспортирующую активность, может быть экспрессирован, конкретно не ограничен, при условии, что он является L-тирозин-продуцирующим микроорганизмом. L-тирозин-продуцирующий микроорганизм может быть микроорганизмом, в котором активность гена конкурентного пути, регулятор направленного пути оперона L-тирозина, ген импорта L-тирозина или ген импорта и разложения L-тирозина ослаблен или инактивирован так, чтобы усилить путь биосинтеза L-тирозина; и/или может быть микроорганизмом, в котором регулируется активность оперона L-тирозина.
Например, для модификации микроорганизма активность белка, импортирующего ароматические аминокислоты, может быть ослаблена или удалена по сравнению с его эндогенной активностью (например ослабление/удаление активности aroP), и обратная связь может быть выключена в результате введения мутации в ген, кодирующий белок, вовлеченный в регуляцию обратной связи (например tyrA, aroG). Кроме того, экспрессия гена, кодирующего белок, вовлеченный в снабжение предшественниками (например гена tkt) может быть повышена. Кроме того, активность гена (например pheA) в конкурентном пути может быть ослаблена, ликвидирована или изменена (например изменение в зависимости от концентрации L-триптофана) по сравнению с эндогенной активностью, но без ограничения этим.
В еще одном аспекте настоящего изобретения предложен способ продуцирования L-тирозина, включающий: культивирование в среде микроорганизма, экспрессирующего вариант белка, имеющий L-тирозин-экспортирующую активность по настоящему изобретению.
Вариант белка, экспрессия белка и микроорганизм являются такими, как описано выше.
При использовании здесь термин "культивирование" означает, что микроорганизм выращивается при соответствующих контролируемых условиях окружающей среды. Процесс культивирования по настоящему изобретению может быть осуществлен в подходящей культуральной среде и в условиях культивирования, известных в данной области. Такой процесс культивирования может быть легко скорректирован для использования специалистами в данной области в соответствии с выбранным штаммом. В частности, культивирование может представлять собой периодическое культивирование, непрерывное культивирование и культивирование с подпиткой, но не ограничено этим.
При использовании здесь термин "среда" относится к смеси веществ, содержащей питательные вещества, необходимые для культивирования микроорганизма, в качестве основного ингредиента, и она поставляет питательные вещества и факторы роста, наряду с водой, которая необходима для выживания и роста. В частности, среда и другие условия культивирования, используемые для культивирования микроорганизма по настоящему изобретению, может быть любой средой, используемой для обычного культивирования микроорганизмов без какого-либо конкретного ограничения. Однако микроорганизм по настоящему изобретению можно культивировать в аэробных условиях в обычной среде, содержащей подходящий источник углерода, источник азота, источник фосфора, неорганическое соединение, аминокислоту и/или витамины, при регулировании температуры, рН и т.д.
В настоящей заявке источник углерода может включать углеводы, такие как глюкоза, фруктоза, сахароза, мальтоза и т.д.; сахарные спирты, такие как маннит, сорбит и т.д.; органические кислоты, такие как пировиноградная кислота, молочная кислота, лимонная кислота и т.д.; аминокислоты, такие как глутаминовая кислота, метионин, лизин и т.д. Кроме того, источник углерода может включать природные органические питательные вещества, такие как гидролизат крахмала, патока, сырая меласса, рисовые отруби, маниок, тростниково-сахарная меласса и кукурузный экстракт, и т.д. В частности, могут быть использованы углеводы, такие как глюкоза и стерилизованная предварительно обработанная патока (то есть меласса, превращенная в восстанавливающий сахар) и, кроме того, различные другие источники углерода в соответствующем количестве могут использоваться без ограничения. Эти источники углерода можно использовать по отдельности или в комбинации двух или более видов, но они не ограничены этим.
Источник азота может включать неорганические источники азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония, нитрат аммония и т.д.; аминокислоты, такие как глутаминовая кислота, метионин, глутамин и т.д.; и органические источники азота, такие как пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, экстракт солода, кукурузный экстракт, казеиновый гидролизат, рыба или продукт его разложения, обезжиренный соевый жмых или продукт его разложения, и т.д. Эти источники азота можно использовать по отдельности или в комбинации двух или более видов, но они не ограничены этим.
Источник фосфора может включать монокалия фосфат, дикалия фосфат или соответствующие натрий-содержащие соли и т.д. Примеры неорганического соединения могут включать хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и т.д. Кроме того, могут быть включены аминокислоты, витамины и/или подходящие предшественники. Эти составляющие ингредиенты или предшественники могут быть добавлены в среду порционно или непрерывным способом, но источники фосфора не ограничены ими.
В настоящей заявке значение рН среды может быть скорректировано во время культивирования микроорганизма путем добавления к среде подходящим образом таких соединений, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота, серная кислота, и т.д. Кроме того, при культивировании можно добавить пеногаситель, такой как сложный полигликоле вый эфир жирных кислот, чтобы предупредить пенообразование. Кроме того, кислород или кислородсодержащий газ может быть введен в среду, чтобы поддерживать аэробное состояние среды; или газообразный азот, водород или диоксида углерода может быть введен или никакой газ может быть не введен для поддержания анаэробного или микроаэробного состояния среды, но газ не ограничен вышеперечисленным.
Средняя температура может быть в диапазоне от 20°С до 50°С, и, в частности, от 30°С до 37°С, но не ограничена этим. Культивирование может быть продолжено до получения необходимого количества полезных веществ, и, в частности, период культивирования может составлять от 10 часов до 100 часов, но не ограничен этим.
Способ продуцирования, кроме того, может включать выделение L-тирозина из среды или микроорганизма в зависимости от культивирования.
При выделении L-тирозина, требуемый L-тирозин может быть собран с использованием способа культивирования микроорганизма по настоящему изобретению, например с использованием подходящего метода, известного в данной области, в соответствии с методом периодического культивирования, непрерывного культивирования или культивирования с подпиткой. Например, могут быть использованы такие методы как центрифугирование, фильтрация, обработка с помощью осадителя для кристаллизации белка (метод высаливания), экстракция, ультразвуковое разрушение, ультрафильтрация, диализ, различные виды хроматографии, такие как ситовая хроматография (гель-фильтрация), адсорбционная хроматография, ионообменная хроматография, аффинная хроматография и т.д., ВЭЖХ или их комбинация, но методы не ограничены этим.
Способ продуцирования может включать процесс дополнительной очистки, который может быть выполнен с использованием подходящего метода, известного в данной области, и выделенный L-тирозин может быть очищен.
В еще одном аспекте настоящего изобретения предложена композиция для получения L-тирозина, включающий один или более вариантов белка; полинуклеотид, кодирующий их; вектор, содержащий полинуклеотид; и микроорганизм, экспрессирующий вариант белка.
В еще одном аспекте настоящего изобретения предлагается применение одного или более вариантов белка; полинуклеотида, кодирующего их; вектора, содержащего полинуклеотид; и микроорганизма, экспрессирующий вариант белка в продуцировании L-тирозина.
Вариант белка, кодирующий его полинуклеотид, содержащий его вектор и микроорганизм являются такими, как описано выше.
Композиция по настоящему изобретению может включать дополнительный компонент, который может продуцировать L-тирозин с использованием варианта белка, полинуклеотид, кодирующий его; вектор, содержащий полинуклеотид; и микроорганизм, экспрессирующий вариант белка, без ограничения. Например, она может дополнительно включать любые подходящие эксципиенты или компоненты среды, обычно используемые в композициях для микробной ферментации, но без ограничения этим.
В настоящем описании, если контекст не требует иного, выражения "включать", "включающий", "содержащий" и т.д. означает включение указанного целого числа или группы целых чисел, но следует понимать, что другие целые числа или совокупности целых чисел не исключены.
Способ осуществления изобретения
Настоящее изобретение описано более подробно посредством Примеров и Экспериментальных примеров. Однако эти Примеры и Экспериментальные примеры представлены только для иллюстративных целей и не предполагается, что объем настоящего изобретения не ограничен этими Примерами и Экспериментальными примерами.
Сравнительный пример 1: Конструирование L-тирозин-продуцирующего штамма
Хотя Corynebacterium glutamicum дикого типа способен продуцировать L-тирозин, он не производит L-тирозин в избытке для выделения в культуральную среду. В соответствии с целью настоящего изобретения, чтобы идентифицировать генетическую характеристику, которая увеличивает L-тирозин-продуцирующую способность, использовали штамм с повышенной L-тирозин-продуцирующей способностью, а не штамм дикого типа. Следовательно, L-тирозин-продуцирующий штамм был сконструирован посредством усиления генов, необходимых для получения L-тирозина, на основе штамма Corynebacterium glutamicum АТСС 13869.
Во-первых, для усиления снабжения эритрозо-4-фосфатом (Е4Р) в качестве предшественника L-тирозина, гены tkt были сверхэкспрессированы. В то же время, был удален aroP, ген импортера ароматических аминокислот, который вводит L-тирозин в клетки.
Для генетической манипуляции сначала были получены области, расположенные ниже и выше гена aroP, в которые следовало вводить ген tkt посредством замены. В частности, фрагмент гена в нижерасположенной области гена агоР был получен с использованием праймеров SEQ ID NO: 3 и SEQ ID NO: 4, a фрагмент гена в вышерасположенной области гена aroP был получен с использованием праймеров SEQ ID NO: 5 и SEQ ID NO: 6 на основе хромосомной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы, посредством ПЦР. Полимеразу Solg™ Pfu-X DNA использовали в качестве полимеразы, и ПЦР выполняли в условиях ПЦР-амплификации, представляющих собой денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжиг при 60°С в течение 30 секунд и полимеризация при 72°С в течение 60 секунд, с последующей полимеризацией при 72°С в течение 5 минут.
Кроме того, для получения гена tkt, включающего промотор tkt, был получен фрагмент гена tkt, включающий промотор tkt, с использованием праймеров SEQ ID NO: 7 и SEQ ID NO: 8 на основе хромосомной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы, посредством ПЦР. Полимеразу Solg™ Pfu-X DNA использовали в качестве полимеразы и ПЦР выполняли в условиях ПЦР-амплификации, представляющих собой денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжиг при 60°С в течение 30 секунд и полимеризацию при 72°С в течение 150 секунд, с последующей полимеризацией при 72°С в течение 5 минут.
Амплифицированные вышерасположенные и нижерасположенные области промотора aroP, фрагмент гена tkt, включающий промотор tkt и вектор pDZ (патент KR 10-0924065) для хромосомной трансформации, расщепленные рестриктазой Smal, клонировали с использованием метода сборки Гибсона (DG Gibson et al., NATURE METHODS, Vol.6 No. 5, May 2009, NEBuilder HiFi DNA Assembly Master Mix) с получением рекомбинантной плазмиды, которая была названа pDZ-AaroP::Pn-tkt. Клонирование проводили путем смешивания реагента сборки Гибсона и каждого из фрагментов гена в расчетном количестве молей с последующим инкубацией при 50°С в течение 1 часа.
Последовательности праймеров, используемые для построения каждого из векторов, показаны в таблице 1 ниже.
Сконструированный вектор pDZ-ΔaroP::Pn-tkt трансформировали в штамм Corynebacterium glutamicum АТСС 13869 посредством электропорации и затем подвергали вторичному кроссинговеру с получением штамма, в который введен ген tkt, включающий промотор tkt, при одновременной делеции гена aroP. Соответствующая генетическая манипуляция была подтверждена посредством секвенирования генома и метода ПЦР с использованием праймеров SEQ ID NO: 9 и SEQ ID NO: 10, который может соответственно амплифицировать внешнюю область вышерасположенной и нижерасположенной области гомологичной рекомбинации, в которую был введен соответствующий ген, и полученный штамм был назван СМ06-0001.
Для того, чтобы усилить путь L-тирозина, ген tyrA, который получает регуляцию по типу обратной связи L-тирозином, имеющуюся у Corynebacterium glutamicum, был заменен вариантом tyrA, который не получает регуляцию по типу обратной связи, происходящим из Е. coli, включающим сильный промотор gapA. Известно, что в происходящем из Е. coli белке tyrA обратная связь выключена, когда метионин в положении 53 мутирован в изолейцин и аланин в положении 354 мутирован в валин, и использовали данную форму белка (SEQ ID NO: 11) (Appl. Microbiol. Biotechnol. 75, 103-110 (2007)).
Для генетической манипуляции сначала были получены вышерасположенные и нижерасположенные области гена tyrA, в которые ген tyrA следовало вводить посредством замены. В частности, фрагмент гена в вышерасположенной области гена tyrA был получен с использованием праймеров SEQ ID NO: 12 и SEQ ID NO: 13, a фрагмент гена в нижерасположенной области гена tyrA был получен с использованием праймеров SEQ ID NO: 14 и SEQ ID NO: 15 на основе хромосомной ДНК Corynebacterium glutamicum АТСС 13869 в качестве матрицы, посредством ПЦР. Полимеразу Solg™ Pfu-X DNA использовали в качестве полимеразы и ПЦР осуществляли в условиях амплификации, включающих денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжига при 60°С в течение 30 секунд и полимеризации при 72°С в течение 60 секунд, с последующей полимеризацией при 72°С в течение 5 минут.
Кроме того, для получения происходящего из Е. coli варианта гена tyrA, включающего промотор gapA, был получен фрагмент промотора gapA с использованием праймеров SEQ ID NO: 16 и SEQ ID NO: 17 на основе хромосомной ДНК Corynebacterium glutamicum АТСС 13869 в качестве матрицы, посредством ПЦР, а фрагмент варианта гена tyrA, происходящего из E.coli, был получен с использованием праймеров SEQ ID NO: 18 и SEQ ID NO: 19 на основе происходящей из E.coli синтетической ДНК варианта tyrA в качестве матрицы, посредством ПЦР.
Полимеразу Solg™ Pfu-X DNA использовали, как полимеразу, и ПЦР выполняли в условиях амплификации, включающих денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжига при 60°С в течение 30 секунд и полимеризации при 72°С в течение 60 секунд, с последующей полимеризацией при 72°С в течение 5 минут.
Амлифицированные вышерасположенные и нижерасположенные области гена tyrA, происходящий из Е. coli фрагмент варианта гена tyrA, включающего промотор gapA, и вектор pDZ для хромосомной трансформации, расщепленные с использованием рестриктазы SmaI, клонировали с использованием метода сборки Гибсона с получением рекомбинантной плазмиды, которая была названа pDZ-ΔtyrA::PgapA-tyrAm. Клонирование выполняли путем смешивания реагента сборки Гибсона и каждого из фрагментов гена в расчетном количестве молей с последующим инкубацией при 50°С в течение 1 часа.
Последовательности праймеров, используемые для конструирования каждого из векторов, показаны в Таблице 3 ниже.


Сконструированный вектор pDZ-ΔtyrA::PgapA-tyrAm трансформировали в штамм СМ06-0001 посредством электропорации и затем подвергали вторичному кроссинговеру с получением штамма, в который был введен происходящий из Е. coli вариант гена tyrA, включающий промотор gapA, при одновременном удалении гена tyrA. Соответствующую генетическую манипуляцию подтверждали посредством секвенирования генома и метода ПЦР с использованием праймеров SEQ ID NO: 20 и SEQ ID NO: 21, который может соответственно амплифицировать внешнюю область вышерасположенной области и нижерасположенной области гомологичной рекомбинации, куда был введен соответствующий ген, и полученный штамм был назван СМ06-0002.
Для увеличения продуцирования L-тирозина, ген aroG, вовлеченный в первую стадию общего ароматического биосинтетического пути, был усилен посредством добавления сильного промотора к происходящему из Е. coli варианту aroG с выключенной регуляцией по типу обратной связи. Известно, что в происходящем из Е. coli белке aroG обратная связь выключена, когда пролин в положении 150 заменен на лейцин, и используют данную форму белка (SEQ ID NO: 68) (Appl. Environ. Microbiol. 63, 761-762 (1997)).
Для генетической манипуляции были получены нижерасположенные и вышерасположенные области, в которые следовало вводить ген aroG. В частности, фрагмент гена в вышерасположенной области гена BBD29_14470 был получен с использованием праймеров SEQ ID NO: 23 и SEQ ID NO: 24, и фрагмент гена в нижерасположенной области гена BBD29_14470 был получен с использованием праймеров SEQ ID NO: 25 и SEQ ID NO: 26 на основе хромосомной ДНК Corynebacterium glutamicum АТСС 13869 в качестве матрицы, посредством ПЦР. Полимеразу Solg™ Pfu-X DNA использовали, как полимеразу и ПЦР выполняли в условиях ПЦР-амплификации, представляющих собой денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжига при 60°С в течение 30 секунд и полимеризации при 72°С в течение 60 секунд, и с последующей полимеризацией при 72°С в течение 5 минут.
Амплифицированные вышерасположенные и нижерасположенные области, в которые следовало дополнительно вводить вариант aroG, и вектор pDZ для хромосомной трансформации, расщепленный рестриктазой Smal, клонировали с использованием метода сборки Гибсона с получением рекомбинантной плазмиды, которая была названа pDZ-ΔBBD29_14470. Клонирование выполняли посредством смешивания реагента сборки Гибсона и каждого из фрагментов гена в расчетном количестве молей с последующим инкубацией при 50°С в течение 1 часа.
Кроме того, для получения происходящего из Е. coli варианта гена aroG, включающего промотор gapA, фрагмент промотора gapA был получен с использованием праймеров SEQ ID NO: 27 и SEQ ID NO: 28 на основе хромосомной ДНК Corynebacterium glutamicum АТСС 13869 в качестве матрицы, посредством ПЦР, а происходящий из Е. coli фрагмент варианта гена aroG был получен с использованием праймеров SEQ ID NO: 29 и SEQ ID NO: 30 на основе происходящего из Е. coli синтетического варианта ДНК с выключенной регуляцией по типу обратной связи aroG, в качестве матрицы, посредством ПЦР. Полимеразу Solg™ Pfu-X DNA использовали в качестве полимеразы и ПЦР выполняли в условиях ПЦР-амплификации, представляющих собой денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжига при 60°С в течение 30 секунд и полимеризации при 72°С в течение 60 секунд, и последующей полимеризации при 72°С в течение 5 минут.
Амплифицированный фрагмент варианта гена aroG, включающий промотор gap А, и вектор pDZ-ΔBBD29_14470 для хромосомной трансформации, расщепленные рестриктазой SeaI, клонировали с использованием метода сборки Гибсона с получением рекомбинантной плазмиды, которая была названа pDZ-ABBD29_14470::PgapA-aroGm. Клонирование выполняли посредством смешивания реагента сборки Гибсона и каждого из фрагментов гена в расчетном количестве молей с последующим инкубацией при 50°С в течение 1 часа.
Последовательности праймеров, используемые для конструирования каждого из векторов показаны в Таблице 5 ниже.

Сконструированный вектор pDZ-ΔBBD29_14470::PgapA-aroGm трансформировали в штамм СМ06-0002 посредством электропорации и затем подвергали вторичному кроссинговеру с получением штамма, в который был введен происходящий из Е. coli вариант гена aroG с выключенной регуляцией по типу обратной связи, включающий промотор gapA. Соответствующую генетическую манипуляцию подтверждали посредством секвенирования генома и метода ПЦР с использованием праймеров SEQ ID NO: 31 и SEQ ID NO: 32, которые могут соответственно амплифицировать внешнюю область вышерасположенного района и нижерасположенного участка гомологичной рекомбинации, в которую вводили соответствующий ген, и полученный штамм был назван СМ06-0003.
Можно предвидеть, что при усилении общего пути ароматического продуцирования в большей степени увеличится продуцирование L-тирозина и L-триптофана, при этом продуцирование L-фенилаланина минимизируется в конкурентном пути в увеличенном хоризматном пуле. Однако, если делетировать ген pheA в конкурентном пути, продуцирование L-фенилаланина становится невозможным, и L-фенилаланин необходим, и, таким образом, использовали L-триптофановый механизм регулирования, чтобы не влиять на рост клеток при сохранении низкой концентрации.
Можно предвидеть, что концентрация L-триптофана строго регулируется таким образом, что она не препятствует росту клеток при условии, что L-триптофан имеет низкую концентрации во все время культивирования. Из литературы также известно, что продуцирование L-триптофана одновременно регулируется аттенюаторами и промоторами в соответствии с концентрацией L-триптофана (Appl. Environ Microbiol 59 791, 1993).
Таким образом, ген pheA, отвечающий за продуцирование L-фенилаланина, подвергался воздействию L-триптофанового регуляторного механизма, так что ген pheA мог регулироваться в соответствии с концентрацией L-триптофана.
Для того, чтобы позволить гену pheA регулироваться промотором гена trpE, были получены вышестоящая область, в которую ген следовало вводить, область промотора trpE, и нижестоящая область, в которую ген следовало вводить. В частности, фрагмент гена в вышерасположенной области, в которую следовало вводить ген, был получен с использованием праймеров SEQ ID NO: 33 и SEQ ID NO: 34; фрагмент гена в области промотора trpE был получен с использованием праймеров SEQ ID NO: 35 и SEQ ID NO: 36; и фрагмент гена в нижерасположенной области, в которую следовало вводить ген, был получен с использованием праймеров SEQ ID NO: 37 и SEQ ID NO: 38 на основе хромосомной ДНК Corynebacterium glutamicum АТСС 13869 в качестве матрицы, посредством ПЦР. Полимеразу Solg™ Pfu-X DNA использовали в качестве полимеразы, и ПЦР выполняли в условиях ПЦР-амплификации, представляющих собой денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжига при 60°С в течение 30 секунд и полимеризация при 72°С в течение 30 секунд, с последующей полимеризацией при 72°С в течение 5 минут.
Амплифицированные вышестоящая и нижестоящая области, в которые следовало вводить ген, область промотора trpE и вектор pDZ для хромосомной трансформации, расщепленные рестриктазой Smal, клонировали с использованием метода сборки Гибсона с получением рекомбинантной плазмиды, которая была названа pDZ-ΔPpheA::PtrpE. Клонирование выполняли путем смешивания реагента сборки Гибсона и каждого из фрагментов гена в расчетном количестве молей с последующим инкубацией при 50°С в течение 1 часа.
Сконструированный вектор pDZ-ΔPpheA::PtrpE трансформировали в штамм СМ06-0003 посредством электропорации, затем подвергали вторичному кроссинговеру с получением штамма, в котором ген pheA мог регулироваться промотором trpE. Соответствующую генетическую манипуляцию подтверждали посредством секвенирования генома и метода ПЦР с использованием праймеров SEQ ID NO: 39 и SEQ ID NO: 40, который может соответственно амплифицировать внешнюю область вышерасположенной и нижерасположенной областей гомологичной рекомбинации, куда введен соответствующий ген, и полученный штамм, в который был введен промотор trpE выше pheA, был назван СМ06-0005.
Последовательности праймеров, используемых для конструирования каждого из векторов, показаны в Таблице 7 ниже.

Поскольку производство L-тирозина начинается с PEP и Е4Р в качестве предшественников, использование нефосфотрансферазной системы (PTS) может увеличить поставку PEP, и, таким образом, можно ожидать повышенного продуцирования L-тирозина (Nature biotechnol 14 620, 1996). Таким образом, ptsG, PTS ген штамма, был удален, и был введен происходящий из Zymomonas mobilis АТСС 10988 ген glf, He-PTS ген.
Для того, чтобы удалить ptsG и ввести glf, были получены вышестоящие и нижестоящие области, в которые следовало вводить происходящий из Zymomonas mobilis ген glf. В частности, фрагмент гена в вышерасположенной области гена ptsG был получен с использованием праймеров SEQ ID NO: 41 и SEQ ID NO: 42, а фрагмент гена в нижерасположенной области гена ptsG был получен с использованием праймеров SEQ ID NO: 43 и SEQ ID NO: 44 на основе хромосомной ДНК Corynebacterium glutamicum АТСС 13869 в качестве матрицы, посредством ПЦР. Полимеразу Solg™ Pfu-X DNA использовали в качестве полимеразы, и ПЦР выполняли в условиях ПЦР-амплификации, представляющих собой денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжига при 60°С в течение 30 секунд и полимеризации при 72°С в течение 60 секунд, с последующей полимеризацией при 72°С в течение 5 минут.
Кроме того, для получения гена glf включающего хорошо известный промотор cj7 (SEQ ID NO: 45, корейский патент №10-0620092), был получен фрагмент промотора cj7 с использованием праймеров SEQ ID NO: 46 и SEQ ID NO: 47 на основе синтетической ДНК промотора cj7 в качестве матрицы, посредством ПЦР, и был получен фрагмент гена glf с использованием праймеров SEQ ID NO: 48 и SEQ ID NO: 49 на основе хромосомной ДНК Zymomonas mobilis АТСС10988 в качестве матрицы, посредством ПЦР. Полимеразу Solg™ Pfu-X DNA использовали в качестве полимеразы, и ПЦР выполняли в условиях ПЦР-амплификации, представляющих собой денатурацию при 95°С в течение 5 минут, с последующими 30 циклами денатурации при 95°С в течение 30 секунд, отжига при 60°С в течение 30 секунд и полимеризации при 72°С в течение 60 секунд, с последующей полимеризацией при 72°С в течение 5 минут.
Амплифицированные вышерасположенные и нижерасположенные области гена ptsG, фрагмент гена glf, включающий промотор cj7, и вектор pDZ для хромосомной трансформации, расщепленные рестриктазой Seal, клонировали с использованием метода сборки Гибсона с получением рекомбинантной плазмиды, которая была названа pDZ-ΔptsG::pcj7-glf. Клонирование выполняли посредством смешивания реагента сборки Гибсона и каждого из фрагментов гена в расчетном количестве молей с последующим инкубацией при 50°С в течение 1 часа.
Последовательности праймеров, используемые в сравнительном примере, показаны в Таблице 8 ниже.

Сконструированный вектор pDZ-ΔptsG::pcj7-glf трансформировали в штамм СМ06-0005 посредством электропорации, затем подвергали вторичному кроссинговеру с получением штамма, в который был введен происходящий из Zymomonas mobilis ген glf, включающий промотор cj7. Соответствующую генетическую манипуляцию подтверждали посредством секвенирования генома и метода ПЦР с использованием праймеров SEQ ID NO: 50 и SEQ ID NO: 51, который может соответственно амплифицировать внешнюю область вышерасположенной и нижерасположенной областей района гомологичной рекомбинации, куда введен соответствующий ген, и полученный штамм был назван СМ06-0010.
Сравнительный пример 2: Оценка продуцирующей способности L-тирозин-продуцирующих штаммов
Для подтверждения L-тирозин-продуцирующей способности штаммов, сконструированных в Примере 1, штаммы культивировали и оценивали следующим образом. Каждый из штаммов инокулировали в 250 мл колбу с угловыми перегородками, содержащую 25 мл соответствующей посевной среды, и культивировали с покачиванием при 200 об/мин. при 30°С в течение 20 часов. Затем 1 мл раствора посевной среды инокулировали в 250 мл колбу с угловыми перегородками, содержащую 25 мл соответствующей среды для продуцирования и культивировали с покачиванием при 200 об/мин. при 30°С в течение 24 часов. После культивирования количество произведенного L-тирозина, L-фенилаланина и L-триптофана измеряли с помощью ВЭЖХ.
Посевная среда (рН 7,0)
20 г глюкозы, 10 г пептона, 5 г дрожжевого экстракта, 1,5 г мочевины, 4 г KH2PO4, 8 г K2HPO4, 0,5 г MgSO4⋅7H2O, 100 мкг биотина, 1000 мкг тиамина HCl, 2000 мкг пантотената кальция и 2000 мкг никотинамида (на литр дистиллированной воды).
Среда для продуцирования (рН 7,0)
30 г глюкозы, 15 г (NH4)2SO4, 1,2 г MgSO4⋅7H2O, 1 г KH2PO4, 5 г дрожжевого экстракта, 900 мкг биотина, 4,500 мкг тиамина HCl, 4,500 мкг пантотената кальция, и 30 г СаСО3 (на литр дистиллированной воды).
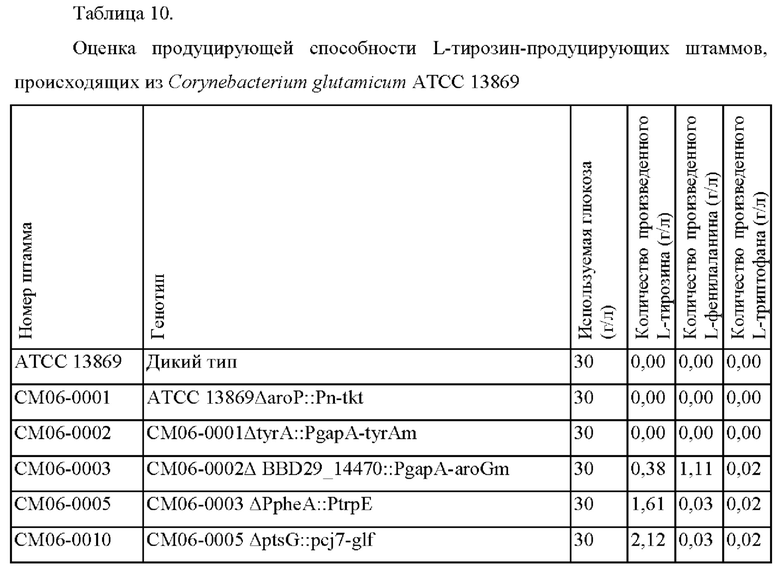
Результаты по производству L-тирозина, L-фенилаланина и L-триптофана в культурах дикого типа Corynebacterium glutamicum АТСС 13869, СМ06-0001, СМ06-0002, СМ06-0003, СМ06-0005 и СМ06-0010 показаны в Таблице 10.
L-тирозин не продуцировался в СМ06-0001, который представляет собой штамм, усиливающий подачу Е4Р, предшественника, полученный в результате удаления гена импорта ароматических аминокислот из штамма дикого типа, и L-тирозин также не был обнаружен в СМ06-0002, в котором ингибирование регуляции tyrA по типу обратной связи было также выключено у СМ06-0001.
Продуцирование L-тирозина и L-фенилаланина было подтверждено в штамме СМ06-0003, в котором был усилен путь производства обычных ароматических соединений посредством выключения ингибирования по типу обратной связью aroG в штамме СМ06-0002. Продуцирование L-тирозина и L-фенилаланина было значительно повышенным по сравнению с предыдущими штаммами, но продуцирование L-триптофана не показало существенного изменения. Кроме того, в случае штамма СМ06-0005, в котором L-фенилаланиновый путь регулировался концентрацией L-триптофана, L-тирозин продуцировался с выходом 5,37%. Продуцирование L-тирозина штаммом СМ06-0005 было улучшено на 283% по сравнению с родительским штаммом СМ06-0003. Из приведенных выше результатов можно сделать вывод, что, когда pheA регулировался концентрацией L-триптофана, продуцирование L-тирозина значительно возрастало.
Кроме того, как и ожидалось, было подтверждено, что продуцирование L-тирозина увеличивалось в СМ06-0010, не-PTS штамме, который может облегчить поставку PEP, по сравнению с СМ06-0005, PTS штаммом. Штамм СМ06-0010 продуцировал L-тирозин с улучшенным выходом 7,06%.
Пример 1: Конструирование штамма с L-триптофан-экспортирующим белком L-тирозин-продуцирующего штамма
Тирозин-экспортирующая способность была подтверждена путем введения нового L-триптофан-экспортирующего белка (WO 2019164348 А1) в L-тирозин-продуцирующий штамм СМ06-0010, полученный в сравнительном примере 1.
Новый L-триптофан-экспортирующий белок представляет собой мембранный белок, происходящий из Herbaspirillum rhizosphaerae и имеет аминокислотную последовательность, представленную SEQ ID NO: 52. Вектором для трансформации, используемым в международном патентной публикации WO 2019164348 А1, был pDZTn-PgapA-Hrh и такой же вектор трансформировали в L-тирозин-продуцирующий штамм СМ06-0010 посредством электропорации (Appl. Microbiol. Biotechnol. (1999) 52:541-545) и затем подвергали вторичному кроссинговеру с получением штамма, в котором одна копия PgapA-Hrh была введена между геном транспозона на хромосоме. Белок, экспрессирующий ген PgapA-Hrh, был назван Wex, и соответствующую генетическую манипуляцию подтверждали посредством секвенирования генома и метода ПЦР с использованием праймеров SEQ ID NO: 53 и SEQ ID NO: 54, который может соответственно амплифицировать внешнюю область вышерасположенной и нижерасположенной области гомологичной рекомбинации, куда введен соответствующий ген.
Таким образом полученный штамм был назван Corynebacterium glutamicum СМ06-0111.
Пример 2: Оценка продуцирующей способности L-тирозин-продуцирующего штамма с введенным L-триптофан-экспортирующим белком Wex
Для подтверждения L-тирозин-продуцирующей способности штамма, полученного в Примере 1, штамм культивировали с использованием метода и состава среды, описанных в сравнительном примере 2.

Результаты продуцирования L-тирозина, L-фенилаланина и L-триптофана в культурах L-тирозин-продуцирующих штаммов СМ06-0010 and СМ06-0111 представлены в вышеприведенной Таблице 12.
Штамм с введенным мембранным белком Wex, который представляет собой экспортер L-триптофана, не продемонстрировал L-тирозин-экспортирующей способности и было невозможно подтвердить, произошло ли увеличение из-за небольшого количества L-триптофана. Соответственно, была предпринята попытка придать субстратную специфичность в отношении L-тирозина посредством введения мутации в мембранный белок Wex.
Пример 3: Замена лейцина, 79-ой аминокислоты, другими аминокислотами в последовательности Wex L-тирозин-продуцирующего штамма
Чтобы обеспечить субстратную специфичность мембранного белка Wex в отношении L-тирозина, лейцин, который представляет собой 79-ую аминокислоту (ниже называемый 79-ый лейцин или 79-ый), был заменен другими аминокислотами, чтобы найти мутанты, которые экспортируют L-тирозин. Чтобы создать мутации аминокислот, отличных от лейцина, выполняли сайт-направленный мутагенез с использованием pDZTn-PgapA-Hrh, используемого в Примере 1 в качестве матрицы. Сайт-направленный мутагенез выполняли следующим образом.


Для того, чтобы заменить лейцин, 79-ую аминокислоту в аминокислотной последовательности Wex, другими аминокислотами, например аланином (A) (SEQ ID NO: 1), глицином (G) (SEQ ID NO: 2), изолейцином (I) (SEQ ID NO: 77), метионином (M) (SEQ ID NO: 78), треонином (T) (SEQ ID NO: 79)), тирозином (Y) (SEQ ID NO: 80), аспарагином (N) (SEQ ID NO: 81), аргинином (R) (SEQ ID NO: 82), триптофаном (W) (SEQ ID NO: 83), серином (S) (SEQ ID NO: 84)) и пролином (P) (SEQ ID NO: 85), готовили смесь для ПЦР, как показано в Таблице 14, с использованием каждой совокупности мутагенных праймеров, указанной в Таблице 15, и ПЦР выполняли с циклом, показанным в Таблице 15. После завершения ПЦР, добавляли 1 мкл рестриктазы DpnI и затем обрабатывали при 37°С в течение 1 часа. Затем 3 мкл ДНК, обработанной DpnI, трансформировали в компетентные клетки DH5a с получением мутантных плазмид pDZTn-PgapA-wex, и каждая мутация была подтверждена посредством секвенирования, как показано в Таблице 15.

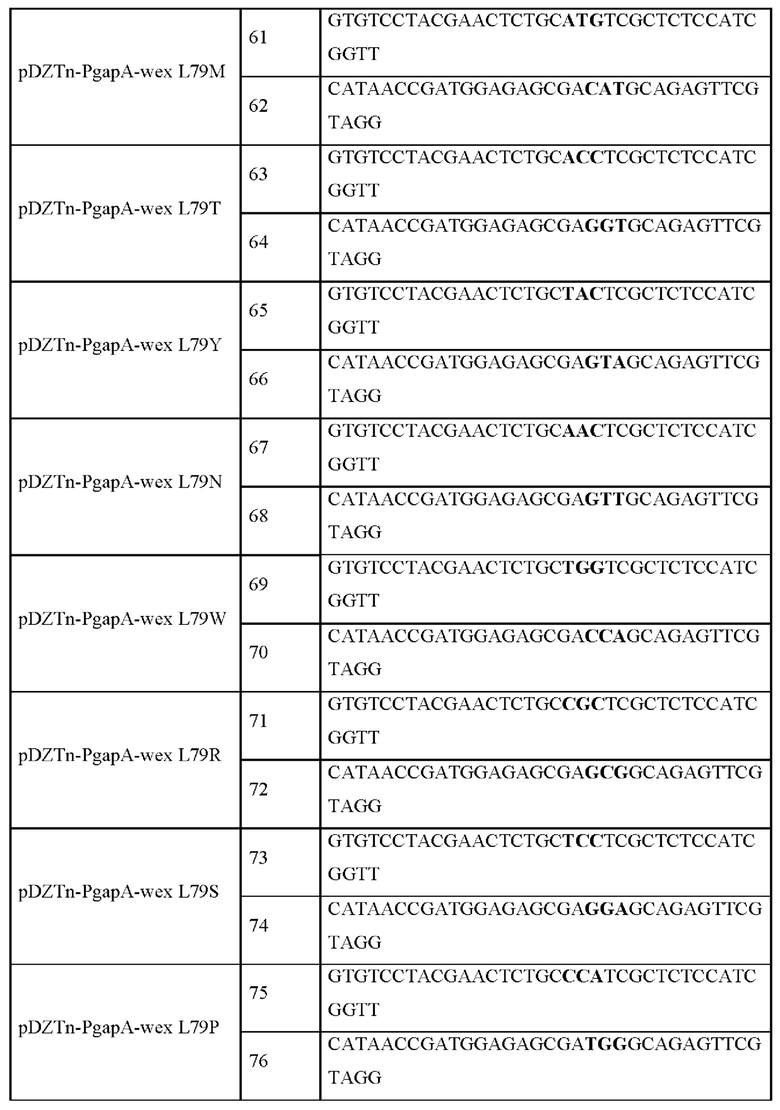
Каждый из векторов pDZTn-PgapA-wex L79A, pDZTn-PgapA-wex L79I, pDZTn-PgapA-wex L79G, pDZTn-PgapA-wex L79M, pDZTn-PgapA-wex L79S, pDZTn-PgapA-wex L79P, pDZTn-PgapA-wex L79T, pDZTn-PgapA-wex L79Y, pDZTn-PgapA-wex L79N, pDZTn-PgapA-wex L79W и pDZTn-PgapA-wex L79R, полученных, как показано в Таблице 15, трансформировали в штамм СМ06-0111, полученный в Примере 2, посредством электропорации, и затем выполняли вторичный кроссинговер с получением 19 штаммов, в которых мутантный ген wex gene был введен в хромосому. Соответствующую генетическую манипуляцию подтверждали посредством секвенирования генома и методом ПЦР с использованием праймеров SEQ ID NO: 53 и SEQ ID NO: 54, который может соответственно амплифицировать внешнюю область вышерасположенной и нижерасположенной областей гомологичной рекомбинации, куда введен соответствующий ген.
Полученные таким образом штаммы были названы СМ06-0112 (wex L79A), СМ06-0114 (wex L79I), СМ06-0115 (wex L79G), СМ06-0117 (wex L79M), CM06-0118 (wex L79S), CM06-0119 (wex L79P), CM06-0120 (wex L79T), CM06-0121 (wex L79Y), CM06-0124 (wex L79N), CM06-0128 (wex L79W) и CM06-0129 (wex L79R).
Для того, чтобы подтвердить количество произведенного тирозина в штаммах СМ06-0112 (wex L79A), СМ06-0114 (wex L79I), СМ06-0115 (wex L79G), СМ06-0117 (wex L79M), CM06-0118 (wex L79S), CM06-0119 (wex L79P), CM06-0120 (wex L79T), CM06-0121 (wex L79Y), CM06-0124 (wex L79N), CM06-0128 (wex L79W) и CM06-0129 (wex L79R), штаммы культивировали таким же образом, как в Примере 2. После завершения культивирования количество произведенного L-тирозина измеряли посредством ВЭЖХ.
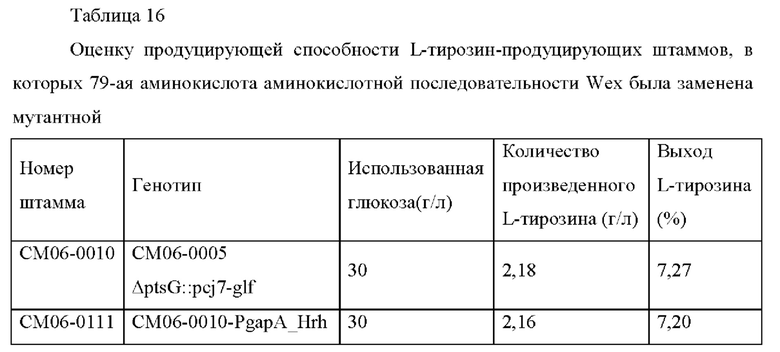
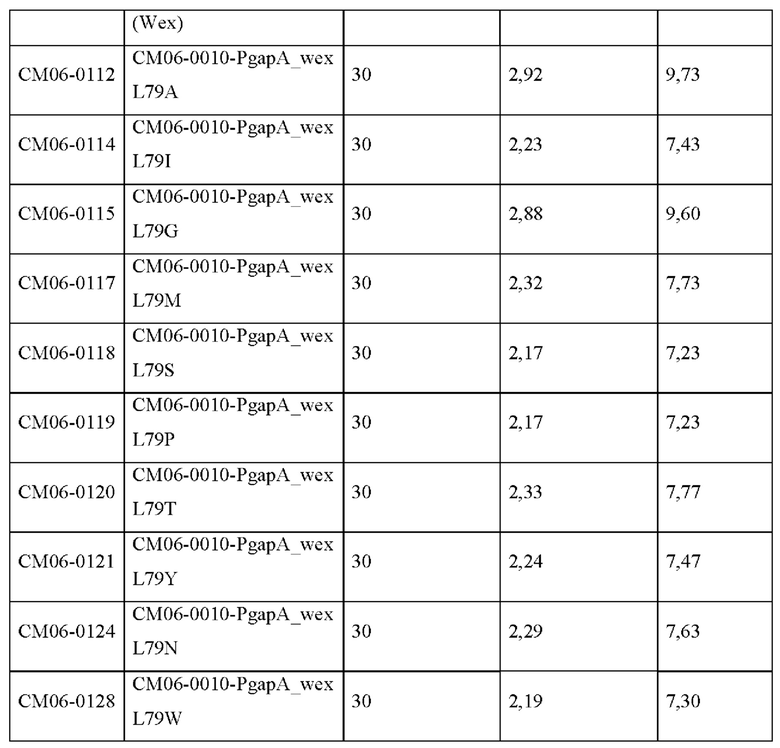
Штамм с введенным мембранным белком Wex дикого типа демонстрировал незначительные эффекты, в то время как штамм СМ06-0112 со введенной мутацией Wex L79A имел концентрацию L-тирозина, составляющую 2,92 г/л в культуре, выращиваемой в колбе, где выход был улучшен на примерно 2,5%р по сравнению с контролем СМ06-0111. Кроме того, было подтверждено, что выход для штамма СМ06-0115 с введенной мутацией Wex L79G также было улучшен на 2,4%р; это подтверждало, что мутант Wex L79A и мутант L79G специфически выделяют L-тирозин.
Штамм СМ06-0112 был депонирован в Корейском центре культур микроорганизмов (КССМ), международном депозитарном органе, в рамках Будапештского договора, 27 апреля 2020 года, с номером доступа КССМ12708Р.
Из вышеизложенного специалист в области, к которой относится настоящее изобретение, может понять, что настоящее изобретение может быть воплощено в других конкретных формах без модификации технических принципов или существенных характеристик настоящего изобретения. В связи с этим, воплощения раскрыты здесь в примерах предназначены только для иллюстративных целей, и их не следует рассматривать как ограничивающиеся объем настоящего изобретения. Напротив, предполагается, что настоящее изобретение охватывает не только приведенные в примерах воплощения, но также различные альтернативы, модификации, эквиваленты и другие воплощений, которые могут быть включены, в пределах объема и существа настоящего изобретения, как определено прилагаемой формулой изобретения.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> НОВЫЙ ВАРИАНТ L-ТИРОЗИН-ЭКСПОРТИРУЮЩЕГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ
L-ТИРОЗИНА С ЕГО ИСПОЛЬЗОВАНИЕМ
<130> OPA21208
<150> KR 10-2020-0063778
<151> 2020-05-27
<160> 85
<170> KoPatentIn 3.0
<210> 1
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> Wex L79A
<400> 1
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Ala Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 2
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> Wex L79G
<400> 2
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Gly Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 3
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 3
tcgagctcgg taccctggga acttgtcgac gctat 35
<210> 4
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 4
tgttcggcaa gcattgtggt gtgggcaatg atcac 35
<210> 5
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 5
attaacggtt aaagtactca ttgtgaggtg gcggg 35
<210> 6
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 6
ctctagagga tccccggagc tgctgtccaa cgtgg 35
<210> 7
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 7
ccacaccaca atgcttgccg aacatttttc ttttc 35
<210> 8
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 8
cacaatgagt actttaaccg ttaatggagt ccttg 35
<210> 9
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 9
acgcgccaag tcggacg 17
<210> 10
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 10
cgcacgatgt ttacctgcg 19
<210> 11
<211> 1122
<212> DNA
<213> Artificial Sequence
<220>
<223> E.coli tyrA_M53I_A354V
<400> 11
atggttgctg aattgaccgc attacgcgat caaattgatg aagtcgataa agcgctgctg 60
aatttattag cgaagcgtct ggaactggtt gctgaagtgg gcgaggtgaa aagccgcttt 120
ggactgccta tttatgttcc ggagcgcgag gcatctattt tggcctcgcg tcgtgcagag 180
gcggaagctc tgggtgtacc gccagatctg attgaggatg ttttgcgtcg ggtgatgcgt 240
gaatcttact ccagtgaaaa cgacaaagga tttaaaacac tttgtccgtc actgcgtccg 300
gtggttatcg tcggcggtgg cggtcagatg ggacgcctgt tcgagaagat gctgaccctc 360
tcgggttatc aggtgcggat tctggagcaa catgactggg atcgagcggc tgatattgtt 420
gccgatgccg gaatggtgat tgttagtgtg ccaatccacg ttactgagca agttattggc 480
aaattaccgc ctttaccgaa agattgtatt ctggtcgatc tggcatcagt gaaaaatggg 540
ccattacagg ccatgctggt ggcgcatgat ggtccggtgc tggggctaca cccgatgttc 600
ggtccggaca gcggtagcct ggcaaagcaa gttgtggtct ggtgtgatgg acgtaaaccg 660
gaagcatacc aatggtttct ggagcaaatt caggtctggg gcgctcggct gcatcgtatt 720
agcgccgtcg agcacgatca gaatatggcg tttattcagg cactgcgcca ctttgctact 780
tttgcttacg ggctgcacct ggcagaagaa aatgttcagc ttgagcaact tctggcgctc 840
tcttcgccga tttaccgcct tgagctggcg atggtcgggc gactgtttgc tcaggatccg 900
cagctttatg ccgacatcat tatgtcgtca gagcgtaatc tggcgttaat caaacgttac 960
tataagcgtt tcggcgaggc gattgagttg ctggagcagg gcgataagca ggcgtttatt 1020
gacagtttcc gcaaggtgga gcactggttc ggcgattacg tgcagcgttt tcagagtgaa 1080
agccgcgtgt tattgcgtca ggcgaatgac aatcgccagt aa 1122
<210> 12
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 12
ttcgagctcg gtaccctatc aaaaccgagt tcttcc 36
<210> 13
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 13
gtcgttttta ggcctcctga caagtgtggc acatac 36
<210> 14
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 14
tgacaatcgc cagtaatttt atcggctgat gattct 36
<210> 15
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 15
actctagagg atccccaacg cgattgcatt cggctc 36
<210> 16
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 16
gtgccacact tgtcaggagg cctaaaaacg accgag 36
<210> 17
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 17
tcaattcagc aaccatgttg tgtctcctct aaagat 36
<210> 18
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 18
ttagaggaga cacaacatgg ttgctgaatt gaccgc 36
<210> 19
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 19
tcatcagccg ataaaattac tggcgattgt cattcg 36
<210> 20
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 20
gcccactagt cgaatccc 18
<210> 21
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 21
ctgtccgcaa cctgtgcg 18
<210> 22
<211> 1053
<212> DNA
<213> Artificial Sequence
<220>
<223> E.coli aroG_P150L
<400> 22
atgaattatc agaacgacga tttacgcatc aaagaaatca aagagttact tcctcctgtc 60
gcattgctgg aaaaattccc cgctactgaa aatgccgcga atacggttgc ccatgcccga 120
aaagcgatcc ataagatcct gaaaggtaat gatgatcgcc tgttggttgt gattggccca 180
tgctcaattc atgatcctgt cgcggcaaaa gagtatgcca ctcgcttgct ggcgctgcgt 240
gaagagctga aagatgagct ggaaatcgta atgcgcgtct attttgaaaa gccgcgtacc 300
acggtgggct ggaaagggct gattaacgat ccgcatatgg ataatagctt ccagatcaac 360
gacggtctgc gtatagcccg taaattgctg cttgatatta acgacagcgg tctgccagcg 420
gcaggtgagt ttctcgatat gatcacccca caatatctcg ctgacctgat gagctggggc 480
gcaattggcg cacgtaccac cgaatcgcag gtgcaccgcg aactggcatc agggctttct 540
tgtccggtcg gcttcaaaaa tggcaccgac ggtacgatta aagtggctat cgatgccatt 600
aatgccgccg gtgcgccgca ctgcttcctg tccgtaacga aatgggggca ttcggcgatt 660
gtgaatacca gcggtaacgg cgattgccat atcattctgc gcggcggtaa agagcctaac 720
tacagcgcga agcacgttgc tgaagtgaaa gaagggctga acaaagcagg cctgccagca 780
caggtgatga tcgatttcag ccatgctaac tcgtccaaac aattcaaaaa gcagatggat 840
gtttgtgctg acgtttgcca gcagattgcc ggtggcgaaa aggccattat tggcgtgatg 900
gtggaaagcc atctggtgga aggcaatcag agcctcgaga gcggggagcc gctggcctac 960
ggtaagagca tcaccgatgc ctgcatcggc tgggaagata ccgatgctct gttacgtcaa 1020
ctggcgaatg cagtaaaagc gcgtcgcggg taa 1053
<210> 23
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 23
tcgagctcgg taccccccgg cggtatcgag gtagt 35
<210> 24
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 24
gacaagttta gtactttaat cacccgcggg gaccc 35
<210> 25
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 25
ggtgattaaa gtactaaact tgtcccgagg gtgag 35
<210> 26
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 26
ctctagagga tcccctatca gtcacttccc tgaga 35
<210> 27
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 27
gcgggtgatt aaagtgaggc ctaaaaacga ccgag 35
<210> 28
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 28
gttctgataa ttcatgttgt gtctcctcta aagat 35
<210> 29
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 29
atgaattatc agaacgacga 20
<210> 30
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 30
cgggacaagt ttagtttacc cgcgacgcgc tttta 35
<210> 31
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 31
ttgatatgac cgcagcctga 20
<210> 32
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 32
ctgcattctc atcgatcttg 20
<210> 33
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 33
ttcgagctcg gtacccggag gggtttccac ctcg 34
<210> 34
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 34
tgggaagctt gtctcaatta tgtctgttgc tcaattagcg 40
<210> 35
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 35
ctaattgagc aacagacata attgagacaa gcttccca 38
<210> 36
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 36
aattggtgcg tcgctcatgg ggcacctacc gaggaa 36
<210> 37
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 37
ttcctcggta ggtgccccat gagcgacgca ccaattgttg 40
<210> 38
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 38
cgactctaga ggatcccccc gaagagttcg gctgcg 36
<210> 39
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 39
ccagcgatga tcgcgccg 18
<210> 40
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 40
atcgccgtgg agccagcc 18
<210> 41
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 41
ttcgagctcg gtacccgagg gctcactgac gttga 35
<210> 42
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 42
cgctgggatg tttctaccgg attcgattcc tcag 34
<210> 43
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 43
cgctcccaga agtaggctca aaccttgccc ataac 35
<210> 44
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 44
ctctagagga tccccctccc ccaaaccacg ctttt 35
<210> 45
<211> 318
<212> DNA
<213> Artificial Sequence
<220>
<223> промотор CJ7
<400> 45
agaaacatcc cagcgctact aatagggagc gttgaccttc cttccacgga ccggtaatcg 60
gagtgcctaa aaccgcatgc ggcttaggct ccaagatagg ttctgcgcgg ccgggtaatg 120
catcttcttt agcaacaagt tgaggggtag gtgcaaataa gaacgacata gaaatcgtct 180
cctttctgtt tttaatcaac atacaccacc acctaaaaat tccccgacca gcaagttcac 240
agtattcggg cacaatatcg ttgccaaaat attgtttcgg aatatcatgg gatacgtacc 300
caacgaaagg aaacactc 318
<210> 46
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 46
ggaatcgaat ccggtagaaa catcccagcg ctact 35
<210> 47
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 47
tactttcaga actcatgagt gtttcctttc gttgg 35
<210> 48
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 48
acgaaaggaa acactcatga gttctgaaag tagtc 35
<210> 49
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 49
gggcaaggtt tgagcctact tctgggagcg ccaca 35
<210> 50
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 50
acattaagtg gtaggcgctg a 21
<210> 51
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 51
cataacaggg cagaacaaac 20
<210> 52
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex AA seq
<400> 52
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Leu Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 53
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 53
cggattatgc caatgatgtg 20
<210> 54
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 54
cacgatcacc aacattcagg 20
<210> 55
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 55
gtgtcctacg aactctgcgc atcgctctcc atcggttatg 40
<210> 56
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 56
cataaccgat ggagagcgat gcgcagagtt cgtaggacac 40
<210> 57
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 57
gtgtcctacg aactctgcat ctcgctctcc atcggttatg 40
<210> 58
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 58
cataaccgat ggagagcgag atgcagagtt cgtaggacac 40
<210> 59
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 59
gtgtcctacg aactctgcgg ctcgctctcc atcggtt 37
<210> 60
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 60
cataaccgat ggagagcgag ccgcagagtt cgtagg 36
<210> 61
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 61
gtgtcctacg aactctgcat gtcgctctcc atcggtt 37
<210> 62
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 62
cataaccgat ggagagcgac atgcagagtt cgtagg 36
<210> 63
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 63
gtgtcctacg aactctgcac ctcgctctcc atcggtt 37
<210> 64
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 64
cataaccgat ggagagcgag gtgcagagtt cgtagg 36
<210> 65
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 65
gtgtcctacg aactctgcta ctcgctctcc atcggtt 37
<210> 66
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 66
cataaccgat ggagagcgag tagcagagtt cgtagg 36
<210> 67
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 67
gtgtcctacg aactctgcaa ctcgctctcc atcggtt 37
<210> 68
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 68
cataaccgat ggagagcgag ttgcagagtt cgtagg 36
<210> 69
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 69
gtgtcctacg aactctgctg gtcgctctcc atcggtt 37
<210> 70
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 70
cataaccgat ggagagcgac cagcagagtt cgtagg 36
<210> 71
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 71
gtgtcctacg aactctgccg ctcgctctcc atcggtt 37
<210> 72
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 72
cataaccgat ggagagcgag cggcagagtt cgtagg 36
<210> 73
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 73
gtgtcctacg aactctgctc ctcgctctcc atcggtt 37
<210> 74
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 74
cataaccgat ggagagcgag gagcagagtt cgtagg 36
<210> 75
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 75
gtgtcctacg aactctgccc atcgctctcc atcggtt 37
<210> 76
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер
<400> 76
cataaccgat ggagagcgat gggcagagtt cgtagg 36
<210> 77
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79I
<400> 77
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Ile Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 78
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79M
<400> 78
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Met Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 79
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79T
<400> 79
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Thr Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 80
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79Y
<400> 80
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Tyr Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 81
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79N
<400> 81
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Asn Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 82
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79R
<400> 82
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Arg Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 83
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79W
<400> 83
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Trp Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 84
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79S
<400> 84
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Ser Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
<210> 85
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> wex L79P
<400> 85
Met Asn Ser Lys Lys Ala Thr Leu Ile Gly Leu Thr Ala Val Val Leu
1 5 10 15
Trp Ser Ser Ile Val Gly Leu Ile Arg Gly Val Ser Glu His Leu Gly
20 25 30
Ala Thr Gly Gly Ala Ala Met Met Tyr Ser Val Ala Ser Leu Phe Leu
35 40 45
Leu Leu Ser Val Gly Phe Pro Lys Leu Gly Ser Phe Pro Lys Lys Tyr
50 55 60
Leu Leu Trp Gly Ser Leu Leu Phe Val Ser Tyr Glu Leu Cys Pro Ser
65 70 75 80
Leu Ser Ile Gly Tyr Ala Asn Thr Gly Arg Gln Ala Ile Glu Val Ser
85 90 95
Met Val Asn Tyr Leu Trp Pro Ala Phe Thr Leu Ile Ala Ala Ile Ala
100 105 110
Phe Asn Arg Gln Arg Ala Asn Trp Met Val Val Pro Gly Phe Ile Leu
115 120 125
Ser Ile Ile Gly Ile Cys Trp Val Leu Gly Gly Asp Gln Gly Leu Asp
130 135 140
Leu Ala Gly Met Leu Gly Asn Val Gln Asp Asn Pro Leu Ser Tyr Gly
145 150 155 160
Leu Ala Phe Leu Gly Ala Val Ile Trp Ala Ala Tyr Cys Thr Val Thr
165 170 175
Ala Arg Leu Ala Lys Gly Lys Asn Gly Val Thr Leu Phe Phe Ile Leu
180 185 190
Val Ala Leu Thr Leu Trp Val Lys Phe Phe Phe Gly Asp His Arg Pro
195 200 205
Met Ser Phe Ser Leu Pro Ala Ile Val Tyr Leu Leu Leu Ala Ala Ala
210 215 220
Ala Met Gly Phe Gly Tyr Ala Ala Trp Asn Val Gly Ile Leu His Gly
225 230 235 240
Asn Val Thr Val Leu Ala Gly Val Ser Tyr Phe Ile Pro Val Phe Ser
245 250 255
Ala Ala Leu Ser Ala Met Val Leu His Ala Pro Leu Pro Arg Ser Phe
260 265 270
Trp Val Gly Ala Ser Leu Val Cys Ala Gly Ser Ile Leu Cys Trp Leu
275 280 285
Ala Thr Arg Ala Arg Arg Ala Ser Ala Ala Gln Glu Asp Ala Val Ala
290 295 300
Asp Cys Leu
305
Изобретение относится к биотехнологии. Предложен вариант белка, имеющий L-тирозин-экспортирующую активность, в котором 79-ая аминокислота от N-конца в аминокислотной последовательности SEQ ID NO: 52 заменена на аланин или глицин. Также предложены полинуклеотид, кодирующий указанный белок, и микроорганизм для продуцирования L-тирозина, содержащий одно или более из (1)-(3): (1) указанный белок; (2) полинуклеотид, кодирующий его; и (3) вектор, содержащий данный полинуклеотид. Также предложен способ продуцирования L-тирозина с использованием указанного микроорганизма. Изобретение позволяет эффективно продуцировать L-тирозин. 4 н. и 3 з.п. ф-лы, 16 табл., 5 пр.
1. Микроорганизм для продуцирования L-тирозина, содержащий одно или более из (1)-(3):
(1) вариант белка, в котором 79-ая аминокислота от N-конца в аминокислотной последовательности SEQ ID NO: 52 заменена на аланин или глицин;
(2) полинуклеотид, кодирующий его; и
(3) вектор, содержащий данный полинуклеотид.
2. Микроорганизм по п. 1, который принадлежит к Corynebacterium sp.
3. Способ продуцирования L-тирозина, включающий: культивирование в среде микроорганизма для продуцирования L-тирозина, который содержит одно или более из
(1)-(3):
(1) вариант белка, у которого 79-ая аминокислота от N-конца в аминокислотной последовательности SEQ ID NO: 52 заменена на аланин или глицин;
(2) полинуклеотид, кодирующий его; и
(3) вектор, содержащий данный полинуклеотид.
4. Способ по п. 3, включающий выделение полученного тирозина.
5. Способ по п. 3, где микроорганизм принадлежит к Corynebacterium sp.
6. Вариант белка, имеющий L-тирозин-экспортирующую активность, в котором 79-ая аминокислота от N-конца в аминокислотной последовательности SEQ ID NO: 52 заменена на аланин или глицин.
7. Полинуклеотид, кодирующий вариант белка, имеющий L-тирозин-экспортирующую активность, по п. 6.
| WO 2019164348 A1, 29.08.2019 | |||
| NCBI Reference Sequence: WP_050478745.1, 06.04.2020 | |||
| aromatic amino acid DMT transporter YddG [Herbaspirillum rhizosphaerae] Найдено онлайн: https://www.ncbi.nlm.nih.gov/protein/WP_050478745.1?report=genbank&log$=prottop&blast_rank=1&RID=BD9MZPWP016 Дата обращения 19.07.2023 | |||
| WO 03044192 A1, 30.05.2003 | |||
| МУТАНТНЫЙ БЕЛОК, КОДИРУЕМЫЙ ГЕНОМ yddG, И СПОСОБ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ РОДА Escherichia | 2012 |
|
RU2530171C2 |
Авторы
Даты
2023-12-05—Публикация
2021-05-27—Подача