Изобретение относится к биотехнологии, в частности к получению ферментов фотодекарбоксилаз жирных кислот.
Фотодекарбоксилазы жирных кислот (ФЖК) представляют собой ферменты, способные производить алканы или алкены из жирных кислот под действием света. Белки этого класса были впервые идентифицированы в 2017 году в зеленых одноклеточных микроводорослях Chlorella variabilis и Chlamydomonas reinhardtii [1]. В качестве субстрата ФЖК могут использовать жирные кислоты средней и большой длины (12-22 атома углерода), которые далее превращаются в соответствующие углеводороды и углекислый газ. Наибольшую активность ФЖК демонстрируют при освещении синим светом с длиной волны между 400 и 520 нм. Ферменты ФЖК принадлежат к суперсемейству флавинадениндинуклеотид (ФАД) - связывающих белков, то есть, ФЖК связывают флавиновый кофермент и используют его при декарбоксилировании жирных кислот. Управление степенью связывания белка с ФАД, а также использование в эксперименте особо отобранных форм флавина вместо природных вариантов позволяет производить контролируемые биохимические и биофизические исследования ФЖК.
Известен способ получения ФЖК из водорослей, являющихся их природным источником - Chlamydomonas reinhardtii, штаммы CC124(nit1 nit2; mt-) и CC125(nit1 nit2; mt+); и Chlorella variabilis штамм NC64A [1]. Кофакторы для ФЖК при этом также синтезируются внутренними системами водорослей. Недостатками данного способа производства являются низкий уровень экспрессии ФЖК и сложность лабораторной работы с нативными организмами. Кроме того, связывание фермента и кофактора является в этом случае неконтролируемым процессом.
Известен способ получения ФЖК в клетках дрожжей Yarrowia lipolytica, штаммы Н222 и JMY5749 [2]. К недостаткам данного способа можно отнести то, что он используется для наблюдения за биосинтезом алканов и алкенов в клетках дрожжей, тогда как для биофизических и структурных исследований, а также некоторых применений в биотехнологии ФЖК должны быть выделены в чистом виде.
Наиболее близким к предлагаемому техническому решению является способ получения ФЖК путем рекомбинантной экспрессии в клетках E. coli, штамм BL21 [1,3-5]. Недостатком использования штамма BL21 для получения ФЖК являются неконтролируемое производство различных флавинов клеткой E.coli, что влечет за собой, соответственно, спонтанное связывание производимыми ФЖК случайных форм флавинов. Такое коферментное разнообразие белков в одном очищенном препарате существенно осложняет последующие биофизические и структурные исследования и их интерпретацию. Кроме того, было показано [1, 4], что при таком способе производства только 50-60% очищенных ФЖК имеют связанный кофактор, что также затрудняет многие последующие исследования и применения в биотехнологии.
Задачей технического решения является производство ФЖК с контролируемым связыванием белка с определенным кофактором.
Технический результат достигается путем использования штаммов E. coli, являющихся рибофлавиновыми ауксотрофами, для производства ФЖК. В данных системах пути собственного биосинтеза рибофлавина бактерией заблокированы, и имеется система импорта рибофлавина из экспрессионной среды. Таким образом, обеспечивается возможность максимально контролируемо и эффективно производить флавин-связывающие белки. Поскольку ФЖК также относятся к этому классу белков, применение данного экспрессионного штамма представляется для них наиболее предпочтительным. Примером такой экспрессионной системы может служить экспрессионный штамм Е. coli CmpX131(DE3) [6, 7]. Данный штамм является рибофлавиновым ауксотрофом и использует бактериальный рибофлавиновый транспортер для импорта рибофлавина из среды. Кроме того, данный штамм имеет систему дополнительной экспрессии флавокиназ - ферментов, катализирующих реакцию перехода рибофлавина в ФАД и ФМН.
Поставленная задача решается следующим образом.
1. Конструирование плазмиды для рекомбинантной экспрессии ФЖК
Рекомбинантные плазмидные ДНК конструируют на основе вектора, обеспечивающего индуцированную экспрессию генов в клетках Е. coli. Плазмида, помимо векторной части, содержит фрагмент ДНК, кодирующий изучаемую ФЖК.
2. Трансформация
В качестве штамма-реципиента используют вариации штаммов Е. coli, являющиеся рибофлавиновыми ауксотрофами. Плазмиды, несущие ген ФЖК, вводят в клетки с помощью процесса трансформации. Трансформированные штаммы отбирают на селективной среде, содержащей антибиотик. Трансформированные штаммы, в ответ на внесение в среду культивирования индуктора, способны производить белок ФЖК.
3. Культивирование
Трансформированный штамм культивируют в подходящей питательной среде с добавлением предпочтительной формы флавина. По достижении культурами штаммов ранней логарифмической фазы роста в среду культивирования вносят индуктор, инициируя тем самым производство целевого белка.
4. Очистка белка
Клетки штамма-продуцента с накопленным целевым белком разрушают, фрагменты клеточных стенок осаждают центрифугированием. ФЖК очищают из цитоплазматической фракции с помощью металл-афинной хроматографии, используя дополнительную последовательность из остатков гистидина в аминокислотной последовательности ФЖК. В качестве финального шага очистки белкового препарата используют метод гель-фильтрации.
Изобретение иллюстрируется следующим конкретным примером.
Пример
На основе экспрессионного вектора рЕТ28а была создана плазмида для рекомбинантной экспрессии ФЖК CvFAP из одноклеточной микроводоросли Chlorella variabilis. К N-концу изучаемой ФЖК были добавлены 6х-гистидиновый таг, белок тиоредоксин и сайт распознавания цистеиновой протеазой TEV. Полученной плазмидой трансформировали клетки Е. coli, штамм CmpX131(DE3). Трансформированные штаммы отбирали на селективной среде, содержащей антибиотик канамицин.
Предкультура трансформированных клеток выращивалась при температуре 15°С и постоянном вращении со скоростью 180 оборотов в минуту до достижения оптической плотности 10 на длине волны 600 нм. В две стеклянные колбы, объемом 2 л, помещалось по 300 мл экспрессионной среды Terrific Broth с добавлением 50 мкМ рибофлавина, растворенного в дистиллированной воде, а также предкультура клеток до конечной оптической плотности 0.1 на длине волны 600 нм. Бактерии культивировали при температуре 37°С и постоянном вращении со скоростью 180 оборотов в минуту до достижения оптической плотности 0.5 на длине волны 600 нм. Экспрессия гена ФЖК инициировалась добавлением 1 мМ ИПТГ и производилась при температуре 15°С и постоянном вращении со скоростью 180 оборотов в минуту в течение 66 часов. Наработанные таким образом клетки собирали центрифугированием клеточной культуры при 10000g в течение 10 мин при температуре 4°С. Полученный клеточный осадок замораживали и хранили при температуре -80°С.
Размороженные клетки ресуспендировали в буферном растворе, содержащем 500 мМ NaCl, 50 мМ Tris-HCl, рН 8.0, в отношении 20% клеток на 80% буферного раствора. Клетки разрушали с помощью прибора Emulsiflex-C5 high pressure homogenizer (Avestin, Ottawa, Ontario, Canada) при давлении 1500 бар. Сразу после разрушения к суспензии добавляли 10% глицерола. Неразрушенные клетки отделяли центрифугированием при 10000 g в течение 10 мин при температуре 4°С. Супернатант центрифугировали в течение 1 часа при 70000g и температуре 4°С.
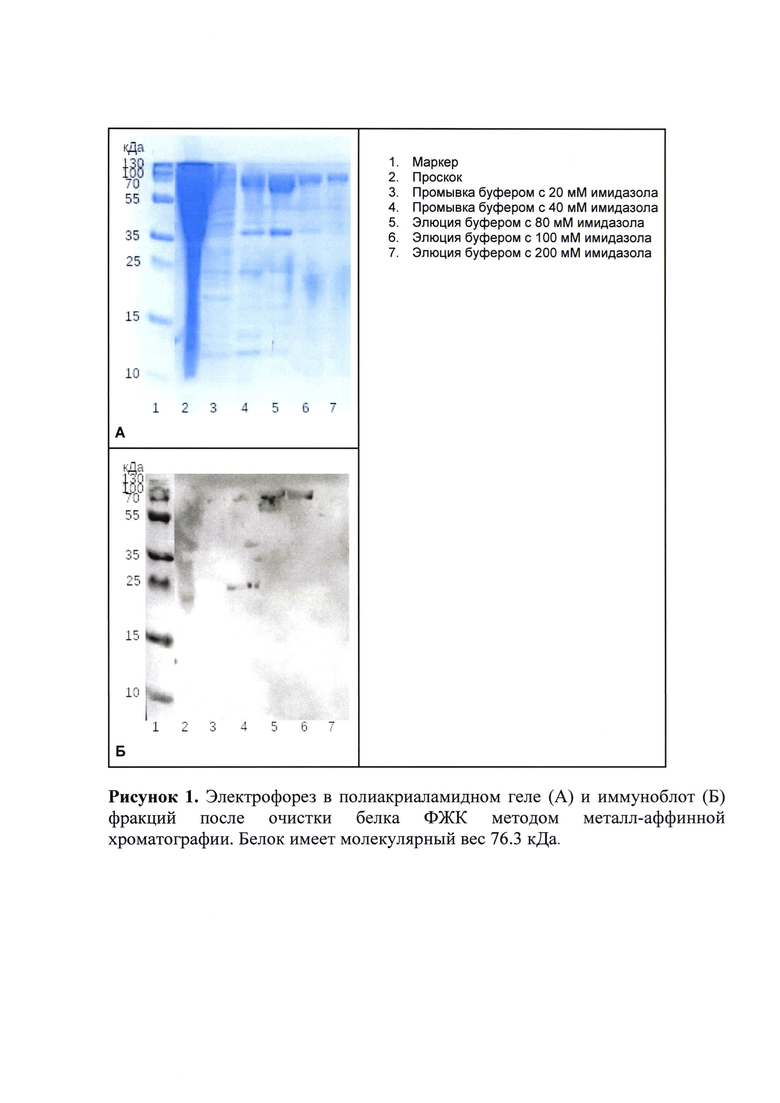
Белок-содержащий супернатант смешивали с 3 мл смолы Ni-NTA (Qiagen, Hilden, Germany) в течение 12 часов при постоянном медленном перемешивании и температуре 4°С. Далее смолу промывали буферными растворами, содержащими 400 мМ NaCl, 50 мМ Tris-HCl, рН 8.0, 10% глицерола, а также 20 мМ и 40 мМ имидазола. Белок элюировали буферными растворами, содержащими 400 мМ NaCl, 50 мМ Tris-HCl, рН 8.0, 10% глицерола, а также 80, 100 и 200 мМ имидазола. Объем каждого из добавляемых буферных растворов составлял 30 мл. Собранные фракции анализировались с помощью электрофореза в полиакриламидном геле (Рисунок 1 А) и с помощью белкового иммуноблота (Рисунок 1 Б).
В качестве финального шага очистки белкового препарата использовали метод гель-фильтрации на хроматографической системе  pure FPLC system с использованием разделяющей колонки Superdex 200 HiLoad column (обе: GE Healthcare, Chicago, IL, USA). Раствор белка после металл-аффинной хроматографии концентрировали и наносили на разделяющую колонку со скоростью 0.5 мл/мин. Для элюции белка использовался буферный раствор, содержащий 400 мМ NaCl, 50 мМ Tris, рН 8.0, 5% глицерола. Белок собирался фракциями, объемом по 1 мл. Пример гель-фильтрационного профиля белка ФЖК на разделяющей колонке Superdex 200 Increase 10/300 GL представлен на Рисунке 2.
pure FPLC system с использованием разделяющей колонки Superdex 200 HiLoad column (обе: GE Healthcare, Chicago, IL, USA). Раствор белка после металл-аффинной хроматографии концентрировали и наносили на разделяющую колонку со скоростью 0.5 мл/мин. Для элюции белка использовался буферный раствор, содержащий 400 мМ NaCl, 50 мМ Tris, рН 8.0, 5% глицерола. Белок собирался фракциями, объемом по 1 мл. Пример гель-фильтрационного профиля белка ФЖК на разделяющей колонке Superdex 200 Increase 10/300 GL представлен на Рисунке 2.
Результатом явилось производство 2 мг белка ФЖК с 1 л культуры путем использования экспрессионной системы E. coli, штамм CmpX131(DE3).
Источники информации
[1]  Blangy, S.; Moulin, S.; Billon, E.; Richaud, P.;
Blangy, S.; Moulin, S.; Billon, E.; Richaud, P.;  Nurizzo, D.;
Nurizzo, D.;  Brettel, K.; Pignol, D.; Amoux, P.; Li-Beisson, Y.; Peltier, G.; Beisson, F. An Algal Photoenzyme Converts Fatty Acids to Hydrocarbons. Science 2017, 357 (6354), 903-907. https://doi.org/10.1126/science.aan6349.
Brettel, K.; Pignol, D.; Amoux, P.; Li-Beisson, Y.; Peltier, G.; Beisson, F. An Algal Photoenzyme Converts Fatty Acids to Hydrocarbons. Science 2017, 357 (6354), 903-907. https://doi.org/10.1126/science.aan6349.
[2] Bruder, S.; Moldenhauer, E.J.; Lemke, R.D.; Ledesma-Amaro, R.; Kabisch, J. Drop-in Biofuel Production Using Fatty Acid Photodecarboxylase from Chlorella Variabilis in the Oleaginous Yeast Yarrowia Lipolytica. Biotechnol. Biofuels 2019,12 (1), 202. https://doi.org/10.1186/s13068-019-1542-4.
[3] Huijbers, M.M.E.; Zhang, W.; Tonin, F.; Hollmann, F. Light-Driven Enzymatic Decarboxylation of Fatty Acids. Angew. Chem. Int. Ed. 2018, 57 (41), 13648-13651. https://doi.org/10.1002/anie.201807119.
[4] Lakavath, В.; Hedison, Т.M.; Heyes, D.J.; Shanmugam, M.; Sakuma, M.; Hoeven, R.; Tilakaratna, V.; Scrutton, N.S. Radical-Based Photoinactivation of Fatty Acid Photodecarboxylases. Anal. Biochem. 2020, 600, 113749. https://doi.org/10.1016/j.ab.2020.113749.
[5] Heyes, D.J.; Lakavath, В.; Hardman, S.J.O.; Sakuma, M.; Hedison, Т.M.; Scrutton, N.S. Photochemical Mechanism of Light-Driven Fatty Acid Photodecarboxylase. ACS Catal. 2020, 10 (12), 6691-6696. https://doi.org/10.1021/acscatal.0c01684.
[6] Mathes, Т.; Vogl, C; Stolz, J.; Hegemann, P. In Vivo Generation of Flavoproteins with Modified Cofactors. J. Mol. Biol. 2009, 385 (5), 1511-1518. https://doi.org/10.1016/j.jmb.2008.11.001.
[7] Mehlhorn, J.; Steinocher, H.; Beck, S.; Kennis, J.Т.M.; Hegemann, P.; Mathes, T. A Set of Engineered Escherichia Coli Expression Strains for Selective Isotope and Reactivity Labeling of Amino Acid Side Chains and Flavin Cofactors. PLoS ONE 2013, 8 (11), e79006. https://doi.org/10.1371/journal.pone.0079006.

Изобретение относится к биотехнологии, в частности к получению ферментов фотодекарбоксилаз жирных кислот (ФЖК). Заявлен способ производства ФЖК с контролируемым связыванием белка с определенным кофактором с использованием рибофлавин-ауксотрофных штаммов Е. coll. Процесс проводят путем конструирования плазмиды для рекомбинантной экспрессии ФЖК, трансформации экспрессионного рибофлавин-ауксотрофного штамма, культивирования трансформированных штаммов и последующей очистки белка ФЖК. Изобретение обеспечивает производство ФЖК в количествах, необходимых для биофизических и структурных исследований. 2 ил., 1 пр.
Способ получения ферментов ФЖК, включающий конструирование плазмиды для рекомбинантной экспрессии ФЖК, трансформацию экспрессионного штамма данной плазмидой, культивирование трансформированных штаммов и очистку белка, отличающийся тем, что плазмида для рекомбинантной экспрессии ФЖК создается на основе экспрессионного вектора pET28a и кодирует ФЖК CvFAP из одноклеточной водоросли Chlorella variabilis, к концу которой добавлены 6х-гистидиновый таг, белок тиоредоксин и сайт распознавания цистеиновой протеазой TEV, и в качестве экспрессионного штамма используется штамм E.coli CmpX131(DE3), который использует бактериальный рибофлавиновый транспортер для импорта рибофлавина из среды и имеет систему дополнительной экспрессии флавокиназ-ферментов, катализирующих реакцию перехода рибофлавина в ФАД и ФМН.
| Huijbers, M.M.E.; Zhang, W.; Tonin, F.; Hollmann, F | |||
| Light-Driven Enzymatic Decarboxylation of Fatty Acids | |||
| Angew | |||
| Chem | |||
| Int | |||
| Ed | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Heyes, D.J.; Lakavath, В.; Hardman, S.J.O.; Sakuma, M.; Hedison, Т.M.; Scrutton, N.S | |||
| Photochemical Mechanism of Light-Driven Fatty Acid | |||
Авторы
Даты
2021-06-28—Публикация
2020-06-26—Подача