РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет на основании предварительной патентной заявки США с серийным номером 62/671266, озаглавленной «MULTIPLEXED METHODS FOR PRODUCTION AND USE OF CELL SURFACE DISPLAY LIBRARIES», поданной 14 мая 2018 г.; и патентной заявки США с серийным номером 62/662126, озаглавленной «MULTIPLEXED METHODS FOR PRODUCTION AND USE OF CELL SURFACE DISPLAY LIBRARIES», поданной 24 апреля 2018 г., обе из которых включены в настоящий документ посредством ссылки в полном объеме и для всех целей.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к автоматизированным многомодульным приборам и мультиплексным способам создания библиотек клеточного поверхностного дисплея с использованием технологии модификации генома.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0003] В следующем далее описании определенные изделия и способы будут описаны в справочных и вводных целях. Ничто из содержащегося в настоящем документе не следует толковать как «признание» предшествующего уровня техники. Заявитель безоговорочно оставляет за собой право наглядно демонстрировать, когда это целесообразно, что изделия и способы, упомянутые в настоящем документе, не являются предшествующим уровнем техники в соответствии с применимыми законодательными положениями.
[0004] Связывание и активацию T-клеточного рецептора (TCR) его специфическим антигеном было трудно идентифицировать в высокопроизводительных системах из-за разнообразия главных комплексов гистосовместимости, множества потенциальных антигенов и разнообразия T-клеток у человека и животных. Общепринятые методы, такие как ВЭЖХ, требуют априорной информации о мишени TCR, и процесс идентификации может быть как длительным, так и трудоемким.
[0005] Таким образом, в данной области существует потребность в лучших и более надежных способах идентификации конкретных антигенов для TCR высокопроизводительным, мультиплексным образом. Настоящее изобретение удовлетворяет данную потребность.
сущностЬ изобретения
[0006] Данное краткое описание предоставлено для ознакомления в упрощенной форме с набором концепций, которые дополнительно описаны ниже в разделе «Подробное описание изобретения». Данное краткое описание не предназначено для установления ключевых или существенных признаков заявленного объекта изобретения, оно также не должно быть использовано для ограничения объема заявленного объекта изобретения. Другие признаки, детали, полезные свойства и преимущества заявленного объекта изобретения станут очевидными из следующего далее подробного описания изобретения, включая аспекты, проиллюстрированные в прилагаемых чертежах и определенные в прилагаемой формуле изобретения.
[0007] Настоящее изобретение относится к композициям, приборам и автоматизированным способам создания мультиплексных дисплеев сконструированных пептидов на клеточной поверхности в популяции клеток. Сконструированные пептиды предпочтительно экспрессируются в клетках в условиях, обеспечивающих как секрецию, так и экспонирование сконструированных пептидов на клеточных поверхностях, таким образом, обеспечивающих доступность сконструированных пептидов для потенциального связывания мишеней. Клеточные популяции могут быть созданы с использованием автоматизированной системы генетической модификации, которая обеспечивает одну или более направленных генетических модификаций в каждой клетке, что дает возможность рационально проектировать библиотеку клеток, экспонирующих сконструированные пептиды на своих поверхностях. Соответственно, в настоящем документе описаны различные автоматизированные способы экспрессии и экспонирования сконструированных пептидов на клетках.
[0008] В некоторых вариантах осуществления изобретение относится к способу создания библиотеки клеток, экспрессирующих сконструированные пептиды, для выявления связывания T-клеточного рецептора (TCR) с антигеном, включающему получение популяции клеток, обработку популяции клеток на приборе для мультиплексной определяемой нуклеазой модификации генома с использованием введенных нуклеиновых кислот и направляемой нуклеиновой кислотой нуклеазы для создания клеток, содержащих нуклеиновые кислоты, кодирующие сконструированные пептиды, предназначенные для экспонирования на поверхности клеток, инкубацию обработанных клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, при этом генетическая модификация приводит к получению нуклеиновых кислот, кодирующих сконструированные пептидные антигены, в клетках, и создание возможности для клеток экспрессировать и экспонировать сконструированные пептиды на поверхности клеток.
[0009] В некоторых аспектах сконструированные пептиды представляют собой предполагаемые TCR-связывающие антигены. В других аспектах сконструированные пептиды включают предсказанные TCR-связывающие области. В некоторых аспектах сконструированные пептиды происходят из геномной последовательности-мишени и содержат вставленный N-концевой или C-концевой маркер, обеспечивающий экспонирование на клеточной поверхности.
[0010] В других вариантах осуществления изобретение относится к способам создания библиотеки клеток, экспрессирующих сконструированные предполагаемые антигены T-клеточных рецепторов (TCR) на поверхности клеток, включающим получение популяции клеток, обработку популяции клеток на приборе для мультиплексной определяемой нуклеазой модификации генома с использованием введенных нуклеиновых кислот и нуклеазы для создания клеток, содержащих нуклеиновые кислоты, кодирующие сконструированные пептиды, предназначенные для экспонирования на поверхности клеток, инкубацию обработанных клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, при этом генетическая модификация приводит к получению нуклеиновых кислот, кодирующих сконструированные пептидные антигены, в клетках, и создание возможности для клеток экспрессировать и экспонировать сконструированные пептидные антигены, которые представляют собой предполагаемые антигены TCR, на поверхности клеток.
[0011] Сконструированные пептидные антигены в популяции генетически модифицированных клеток предпочтительно включают рационально спроектированные пептиды, которые могут быть экспонированы на клеточной поверхности таким образом, что антиген является доступным для связывания с TCR-мишенью, или известным TCR и/или TCR-сиротой. В некоторых аспектах сконструированные пептидные антигены представляют собой известные антигены одного или более TCR.
[0012] В конкретных вариантах осуществления антиген экспонируется на клеточной поверхности в виде части MHC (например, HLA), которая включает пептидный антиген, таким образом образуя лиганд TCR. Соответственно, в некоторых аспектах клетки экспонируют сконструированные пептидные антигены в виде части лиганда. В некоторых аспектах клетки совместно экспрессируют предполагаемые антигены TCR и молекулы MHC.
[0013] Пептидные антигены для использования с системами и способами по изобретению включают известные антигены одного или более TCR, предсказанные антигены для одного или более TCR или случайные пептиды, созданные с использованием нуклеаз в автоматизированных приборах для генетической модификации клеток по настоящему изобретению. В вариантах осуществления экспонируемые пептиды создают путем прямого конструирования для создания пептидных последовательностей на основании предсказаний того, какие антигены могут быть использованы для конкретного TCR.
[0014] В некоторых вариантах осуществления изобретение относится к способам создания библиотеки клеток, экспрессирующих сконструированные пептиды, происходящие из генома(ов) клеток, на поверхности клеток, включающим получение популяции клеток, обработку популяции клеток на приборе для мультиплексной определяемой нуклеазой модификации генома с использованием введенных нуклеиновых кислот и нуклеазы для создания клеток, содержащих нуклеиновые кислоты, кодирующие сконструированные белки, спроектированные с N-концевым или C-концевым маркером, обеспечивающим экспонирование на клеточной поверхности, для экспонирования их на поверхности клеток, инкубацию обработанных клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, при этом генетическая модификация приводит к получению нуклеиновых кислот, кодирующих маркеры, обеспечивающие экспонирование на клеточной поверхности, на N-конце или C-конце сконструированных белков в клетках, и создание возможности для клеток экспрессировать и экспонировать сконструированные белки на поверхности клеток.
[0015] В некоторых вариантах осуществления изобретение относится к мультиплексному способу идентификации пептидов, которые избирательно связывают один или более TCR, включающему получение популяции клеток, обработку популяции клеток с использованием автоматизированной системы для мультиплексной определяемой нуклеазой модификации генома, при этом система включает этапы введения нуклеиновых кислот, кодирующих сконструированные пептидные антигены, и нуклеазы в популяцию клеток, инкубацию клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, создание возможности для генетически модифицированных клеток экспрессировать и экспонировать сконструированные пептидные антигены на поверхности генетически модифицированных клеток, скрининг генетически модифицированных клеток, экспонирующих сконструированные пептидные антигены, против одного или более TCR и идентификацию генетически модифицированных клеток, экспрессирующих сконструированные пептидные антигены, которые избирательно связываются с одним или более TCR.
[0016] В некоторых аспектах изобретение также относится к выделению нуклеиновых кислот, кодирующих сконструированные пептидные антигены, которые избирательно связываются с одним или более TCR, из клеток. В некоторых аспектах изобретение также относится к выделению нуклеиновых кислот, кодирующих сконструированные пептиды, которые избирательно связываются с одним или более предполагаемыми антигенами TCR, из клеток.
[0017] В некоторых аспектах клетки, кодирующие специфические пептиды, идентифицируют путем обнаружения штрихкода, связанного со сконструированными пептидами. В некоторых аспектах клетки, кодирующие специфические пептиды, идентифицируют путем обнаружения штрихкода, связанного со сконструированными пептидными антигенами, которые избирательно связываются с одним или более TCR. В некоторых вариантах осуществления штрихкод используют для выделения и/или дополнительной идентификации или обработки клеток и нуклеиновых кислот, кодирующих пептиды, для дальнейшего анализа. В таких вариантах осуществления штрихкод можно использовать в качестве «рукоятки» для извлечения интересующих клеток для дальнейшего анализа.
[0018] В конкретных аспектах изобретение относится к способу создания библиотеки клеток, экспрессирующих сконструированные пептидные антигены на поверхности клеток, путем получения популяции клеток, генетической модификации популяции клеток с использованием одной или более введенных нуклеиновых кислот, включающих РНК-гид, ковалентно связанную с донорской ДНК (например, гомологичный фрагмент), которая избирательно связывается с интересующей областью генома, и нуклеазы, инкубации клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, при этом генетическая модификация приводит к получению нуклеиновых кислот, кодирующих сконструированные пептидные антигены, в клетках, и создания возможности для клеток экспрессировать и экспонировать сконструированные пептидные антигены на поверхности генетически модифицированных клеток.
[0019] В других конкретных аспектах изобретение относится к способу создания библиотеки клеток, экспрессирующих сконструированные пептидные антигены на поверхности клеток, путем получения популяции клеток, генетической модификации популяции клеток с использованием автоматизированного прибора для мультиплексной определяемой нуклеазой модификации генома и введенных нуклеиновых кислот, включающих модификаторы, и нуклеазы, инкубации клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, при этом генетическая модификация приводит к получению нуклеиновых кислот, кодирующих сконструированные пептидные антигены, в клетках, и создания возможности для клеток экспрессировать и экспонировать сконструированные пептидные антигены на поверхности генетически модифицированных клеток.
[0020] Сконструированные пептидные антигены в популяции генетически модифицированных клеток предпочтительно представляют собой рационально спроектированные пептиды, которые могут быть экспонированы на клеточной поверхности таким образом, что антиген является доступным для связывания с T-клеточным рецептором («TCR»)-мишенью. В некоторых аспектах изобретения сконструированные пептиды происходят из геномных последовательностей-мишеней.
[0021] Различные нуклеазы можно использовать в способах генетической модификации по настоящему изобретению, включая нуклеазы «цинковые пальцы», мегануклеазы, TALEN и направляемые нуклеиновой кислотой нуклеазы (например, РНК-направляемые нуклеазы). Предпочтительно, способы генетической модификации применяют с использованием направляемых нуклеиновой кислотой нуклеаз, и более предпочтительно, РНК-направляемых нуклеаз.
[0022] В конкретных вариантах осуществления изобретение относится к мультиплексным способам идентификации клеток, экспрессирующих сконструированные предполагаемые антигены TCR на их поверхности, включающим получение популяции клеток, генетическую модификацию популяции клеток с использованием автоматизированного прибора для мультиплексной определяемой нуклеазой модификации генома, а также введенных нуклеиновых кислот и нуклеазы, для создания нуклеиновых кислот, кодирующих предполагаемые антигены TCR в клетках, инкубацию клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, создание возможности для клеток экспрессировать и экспонировать сконструированные предполагаемые антигены TCR на их поверхности, скрининг клеток, экспонирующих сконструированные предполагаемые антигены TCR, против мишени и идентификацию клеток, экспрессирующих сконструированные предполагаемые антигены TCR, которые избирательно связываются с мишенью.
[0023] В одном варианте осуществления изобретение относится к мультиплексным способам идентификации клеток, экспрессирующих сконструированные предполагаемые антигены TCR на их поверхности, включающим получение популяции клеток; генетическую модификацию популяции клеток с использованием автоматизированного прибора для мультиплексной определяемой нуклеазой модификации генома, а также введенных нуклеиновых кислот и направляемой нуклеиновой кислотой нуклеазы, с созданием, таким образом, клеток, содержащих нуклеиновые кислоты, кодирующие сконструированные предполагаемые антигены TCR, инкубацию клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, создание возможности для генетически модифицированных клеток экспрессировать и экспонировать сконструированные предполагаемые антигены TCR на их поверхности, скрининг клеток, экспонирующих сконструированные предполагаемые антигены TCR, против мишени, селекцию клеток, экспрессирующих сконструированные предполагаемые антигены TCR, которые избирательно связываются с одним или более TCR-мишенями, и обнаружение или выделение нуклеиновой кислоты, кодирующей антигены. Альтернативно, условия можно варьировать для определения избирательности в разных условиях.
[0024] Обнаружение конкретного пептида в интересующей клетке можно проводить с использованием различных способов, известных в данной области, таких как, например, секвенирование, гибридизация, идентификация штрихкода, характерного для последовательности антигена, и тому подобного. Штрихкоды и другие признаки также можно использовать для дальнейшего анализа, например, путем предоставления основания для идентификации и/или выделения интересующих клеток, кодирующих пептиды, идентифицированные для выяснения связывания TCR.
[0025] В одном аспекте изобретение относится к способам иммобилизации одного или более сконструированных пептидных антигенов на клеточной поверхности путем получения слитых белков для экспонирования одного или более сконструированных пептидных антигенов на поверхности дрожжевой клетки. В одном варианте осуществления изобретение относится к способам экспонирования сконструированного пептидного антигена в виде части антигена MHC (например, HLA) на клеточной поверхности. В конкретных вариантах осуществления клетки экспонируют множество копий одного сконструированного антигена.
[0026] В конкретных вариантах осуществления изобретение относится к способам обеспечения наличия рецепторов или их связывающих областей на клетке.
[0027] В конкретных вариантах осуществления изобретение относится к мультиплексным способам идентификации клеток, экспрессирующих сконструированные предсказанные TCR-связывающие области (например, предсказанные области связывания TCR-сирот) на их поверхности, включающим получение популяции клеток, генетическую модификацию популяции клеток с использованием автоматизированного прибора для мультиплексной определяемой нуклеазой модификации генома и введенных нуклеиновых кислот, а также нуклеазы, для создания нуклеиновых кислот, кодирующих TCR-связывающие области в клетках, инкубацию клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, создание возможности для клеток экспрессировать и экспонировать сконструированные TCR-связывающие области на их поверхности, скрининг клеток, экспонирующих сконструированные TCR-связывающие области, против мишени и идентификацию клеток, экспрессирующих сконструированные TCR-связывающие области, которые избирательно связываются с предполагаемыми антигенами.
[0028] В одном варианте осуществления изобретение относится к мультиплексным способам идентификации клеток, экспрессирующих сконструированные предсказанные связывающие области из TCR (например, TCR-сирот) на их поверхности, включающим: получение популяции клеток, генетическую модификацию популяции клеток с использованием автоматизированного прибора для мультиплексной определяемой нуклеазой модификации генома и введенных нуклеиновых кислот, а также направляемой нуклеиновой кислотой нуклеазы, с получением, таким образом, клеток, содержащих нуклеиновые кислоты, кодирующие сконструированные области связывания TCR, инкубацию клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, создание возможности для генетически модифицированных клеток экспрессировать и экспонировать сконструированные области связывания TCR на их поверхности, скрининг клеток, экспонирующих сконструированные области связывания TCR, против мишени и идентификацию клеток, экспрессирующих сконструированные области связывания TCR, которые избирательно связываются с одним или более предполагаемыми TCR-связывающими антигенами. Альтернативно, условия можно варьировать для определения избирательности в разных условиях.
[0029] Эти аспекты, а также другие признаки и преимущества изобретения описаны ниже более подробно.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0030] Вышеуказанные и другие признаки и преимущества настоящего изобретения будут более понятны из следующего далее подробного описания иллюстративных вариантов осуществления в сочетании с сопроводительными чертежами, в которых:
[0031] На ФИГ. 1 представлено схематическое изображение структуры локусов TCRα и TCRβ.
[0032] На ФИГ. 2 схематически показана реаранжировка генных сегментов TCR в процессе развития T-клетки, с образованием полных экзонов V-домена.
[0033] На ФИГ. 3 представлено схематическое изображение кластера генных сегментов, кодирующих δ-цепь в локусе TCRα.
[0034] На ФИГ. 4A-4D показан автоматизированный многомодульный прибор, и его компоненты, с помощью которого создают на клеточной поверхности библиотеки по изобретению.
[0035] На ФИГ. 5A представлен один вариант осуществления ротационной ростовой бутыли, используемой с ростовым модулем для клеток, описанным в настоящем документе. На ФИГ. 5B представлен вид в перспективе одного варианта осуществления ротационной ростовой бутыли в ростовом модуле для клеток. На ФИГ. 5C представлен вид в разрезе ростового модуля для клеток с ФИГ. 5B. На ФИГ. 5D показан ростовой модуль для клеток с ФИГ. 5B, соединенный со светодиодами, детектором и элементами для регулирования температуры.
[0036] На ФИГ. 6A представлена принципиальная схема проточной фильтрации вдоль потока, используемой в устройстве TFF, предложенном в настоящем документе. На ФИГ. 6B показан вид сверху нижнего элемента конструкции одного варианта осуществления иллюстративного устройства TFF. На ФИГ. 6C показан вид сверху верхнего и нижнего элементов конструкции и мембраны иллюстративного устройства TFF. На ФИГ. 6D показан вид снизу верхнего и нижнего элементов конструкции и мембраны иллюстративного устройства TFF. На ФИГ. 6E-6I представлены разные изображения варианта осуществления модуля TFF, включающего устройство TFF с гидравлически связанными резервуарами для ретентата, фильтрата и обменного буфера.
[0037] На ФИГ. 7A и 7B представлены: вид сверху в перспективе и вид снизу в перспективе, соответственно, проточных устройств для электропорации (в данном случае представлены шесть таких устройств, соединенных вместе). На ФИГ. 7C представлен вид сверху одного варианта осуществления иллюстративного проточного устройства для электропорации. На ФИГ. 7D представлен вид сверху в разрезе устройства для электропорации с ФИГ. 7C. На ФИГ. 7E представлен вид сбоку в разрезе нижней части устройств для электропорации с ФИГ. 7C и 7D.
[0038] На ФИГ. 8A представлена упрощенная схема технологического процесса для разделения на одиночные клетки, генетической модификации и нормализации клеток после модификации генома за счет направляемой нуклеиновой кислотой нуклеазы в плотностенном устройстве. На ФИГ. 8B представлена фотография одного варианта осуществления плотностенного устройства. На ФИГ. 8C-8E представлены фотографии клеток E. coli, разделенных на одиночные клетки (по закону распределения Пуассона) и вырастающих в колонии в микролунках в плотностенном устройстве с проницаемым дном при малом, среднем и большом увеличении, соответственно. На ФИГ. 8F представлена упрощенная блок-схема способов обогащения по живым клеткам, которые были генетически модифицированы методом модификации за счет направляемой нуклеиновой кислотой нуклеазы, в которые не входит разделение на одиночные клетки или использование устройства для разделения, а вместо этого используется рост клеток в жидкости и индукция генетической модификации. На Фигуре 8G показана типичная кривая роста для клеток в культуре. На ФИГ. 8H графически представлена схема способов выращивания, индукции, генетической модификации, обогащения и скрининга для модификации клеток в популяции клеток.
[0039] На ФИГ. 9A и 9B представлен иллюстративный картридж для реагентов, используемый в автоматизированном многомодульном приборе для генетической модификации клеток.
[0040] На ФИГ. 10 представлена блок-схема иллюстративного способа автоматизированной многомодульной генетической модификации клеток для получения библиотек клеток, описанных в настоящем документе.
[0041] На ФИГ. 11 представлена упрощенная блок-схема двух иллюстративных способов (1100a и 1100b), которые могут быть использованы в автоматизированном многомодульном приборе для генетической модификации клеток, включающем устройство для разделения на одиночные клетки.
[0042] На ФИГ. 12 представлена упрощенная блок-схема варианта осуществления иллюстративного автоматизированного многомодульного прибора для обработки клеток, включающего плотностенный модуль для разделения на одиночные клетки/выращивания/генетической модификации/нормализации.
[0043] На ФИГ. 13 представлена упрощенная блок-схема альтернативного варианта осуществления иллюстративного автоматизированного многомодульного прибора для обработки клеток, включающего плотностенный модуль для разделения на одиночные клетки/выращивания/генетической модификации/нормализации.
[0044] На ФИГ. 14 представлена упрощенная блок-схема способа для варианта осуществления иллюстративного автоматизированного многомодульного прибора для обработки клеток.
[0045] На ФИГ. 15 представлена графическая иллюстрация эффективности 2-лопастной ротационной ростовой бутыли и устройства для выращивания клеток, описанных в настоящем документе, для выращивания культуры клеток EC23 в сравнении с общепринятым шейкером для клеток.
[0046] На ФИГ. 16 представлена графическая иллюстрация эффективности 3-лопастной ротационной ростовой бутыли и устройства для выращивания клеток, описанных в настоящем документе, для выращивания культуры клеток EC23 в сравнении с общепринятым шейкером для клеток.
[0047] На ФИГ. 17 представлена графическая иллюстрация эффективности 4-лопастной ротационной ростовой бутыли и устройства для выращивания клеток, описанных в настоящем документе, для выращивания культуры клеток EC138 в сравнении с общепринятым орбитальным шейкером для клеток.
[0048] На ФИГ. 18 представлена графическая иллюстрация эффективности 2-лопастной ротационной ростовой бутыли и устройства для выращивания клеток, описанных в настоящем документе, для выращивания культуры клеток EC138 в сравнении с общепринятым орбитальным шейкером для клеток.
[0049] На ФИГ. 19 графически представлен мониторинг в реальном времени роста культуры клеток EC138 до определенной величины OD600 с использованием устройства для выращивания клеток, описанного в настоящем документе, в котором была использована 2-лопастная ротационная ростовая бутыль.
[0050] На ФИГ. 20 графически представлен мониторинг в реальном времени роста культуры дрожжевых клеток s288c до определенной величины OD600 с использованием устройства для выращивания клеток, описанного в настоящем документе, в котором была использована 2-лопастная ротационная ростовая бутыль.
[0051] На ФИГ. 21A представлен график зависимости проводимости фильтрата от времени обработки с использованием фильтра для культуры E. coli, обработанной в устройстве/модуле для концентрирования клеток, описанном в настоящем документе. На ФИГ. 21B представлен график зависимости проводимости фильтрата от времени обработки с использованием фильтра для дрожжевой культуры, обработанной в устройстве/модуле для концентрирования клеток, описанном в настоящем документе.
[0052] На ФИГ. 22A представлена гистограмма, показывающая результаты электропорации клеток E. coli с использованием устройства по изобретению и сравнительного устройства для электропорации. На ФИГ. 22B представлена гистограмма, показывающая эффективность поглощения, разрезания и генетической модификации для клеток E. coli, трансформированных с использованием FTEP, описанного в настоящем документе, в сравнении с устройством-компаратором для электропорации.
[0053] На ФИГ. 23 представлена гистограмма, показывающая результаты электропорации клеток S. cerevisiae с использованием устройства FTEP по изобретению и сравнительного способа электропорации.
[0054] Следует понимать, что чертежи не обязательно представлены в масштабе, и что аналогичные ссылочные номера относятся к аналогичным деталям.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0055] Все функциональные признаки, описанные в связи с одним вариантом осуществления способов, устройств или приборов, описанных в настоящем документе, должны быть применимы к дополнительным вариантам осуществления способов, устройств или приборов, описанных в настоящем документе, за исключением конкретно указанных случаев, или случаев, когда признак или функция не совместимы с дополнительными вариантами осуществления. Например, если конкретный признак, или функция, специально описан в сочетании с одним вариантом осуществления, но прямо не упомянут в связи с альтернативным вариантом осуществления, следует понимать, что признак, или функция, может быть применен, использован или реализован в сочетании с альтернативным вариантом осуществления, если только признак, или функция, не является несовместимым с альтернативным вариантом осуществления.
[0056] Применение на практике способов, описанных в настоящем документе, может включать использование, если нет иных указаний, общепринятых методов и описаний в области молекулярной биологии (включая рекомбинантные методы), клеточной биологии, биохимии и технологии генетической инженерии, которые входят в компетенцию специалистов в данной области. Такие общепринятые методы и описания можно найти в стандартных лабораторных руководствах, таких как Green and Sambrook, Molecular Cloning: A Laboratory Manual. 4th, ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., (2014); Current Protocols in Molecular Biology, Ausubel, et al. eds., (2017); Neumann, et al., Electroporation and Electrofusion in Cell Biology, Plenum Press, New York, 1989; и Chang, et al., Guide to Electroporation and Electrofusion, Academic Press, California (1992), все из которых включены в настоящий документ посредством ссылки в полном объеме и для всех целей. Описание методов с использованием направляемой нуклеиновой кислотой нуклеазы можно найти, например, в публикациях Genome Editing and Engineering from TALENs and CRISPRs to Molecular Surgery, Appasani and Church (2018); и CRISPR: Methods and Protocols, Lindgren and Charpentier (2015); обе из которых включены в настоящий документ посредством ссылки в полном объеме и для всех целей.
[0057] Следует отметить, что при использовании в настоящем документе и в прилагаемой формуле изобретения форма единственного числа терминов включает соответствующую форму множественного числа, если из контекста четко не следует обратное. Таким образом, например, ссылка на «клетку» относится к одной или более клеткам, и ссылка на «систему» включает ссылку на эквивалентные этапы, способы и устройства, известные специалистам в данной области, и так далее. Кроме того, следует понимать, что такие термины, как «левый», «правый», «верхний», «нижний», «передний», «задний», «боковой», «высота», «длина», «ширина», «выше», «ниже», «внутренний», «внешний», «расположенный внутри», «расположенный снаружи», которые могут быть использованы в настоящем документе, лишь описывают ориентиры и не обязательно ограничивают варианты осуществления настоящего изобретения какой-либо конкретной ориентацией или конфигурацией. Кроме того, такие термины, как «первый», «второй», «третий» и так далее, всего лишь указывают на один из ряда фрагментов, компонентов, этапов, операций, функций и/или ориентиров, раскрытых в настоящем документе, и, аналогично, не обязательно ограничивают варианты осуществления настоящего изобретения какой-либо конкретной конфигурацией или ориентацией.
[0058] Если нет иных указаний, все технические и научные термины, используемые в настоящем документе, имеют то значение, которое им придают специалисты в области, к которой относится настоящее изобретение. Все публикации, упомянутые в настоящем документе, включены посредством ссылки для целей описания и раскрытия устройств, препаратов и методологий, которые могут быть использованы в сочетании с настоящим изобретением.
[0059] При указании диапазона значений понятно, что каждое промежуточное значение между верхним и нижним пределами данного диапазона, а также любое другое указанное или промежуточное значение в указанном диапазоне, входит в объем изобретения. Верхние и нижние границы этих меньших диапазонов могут независимо быть включены в меньшие диапазоны, и также входят в объем изобретения, кроме любого конкретно исключенного предела в указанном диапазоне. Если указанный диапазон включает один или оба из этих пределов, диапазоны за исключением любого, или обоих, из этих включенных пределов также входят в объем изобретения.
[0060] В следующем далее описании приведены многочисленные конкретные детали для более полного понимания настоящего изобретения. Однако специалисту в данной области понятно, что настоящее изобретение можно осуществлять на практике без одной или более из этих конкретных деталей. В других случаях признаки и процедуры, хорошо известные специалистам в данной области, не были описаны во избежание затруднения понимания изобретения. Термины, используемые в настоящем документе, должны иметь простое и обычное значение, понятное специалистам в данной области.
[0061] Используемый в настоящем документе термин «комплементарные» относится нуклеотидам, которые спариваются по принципу Уотсона-Крика, и в частности, относится к нуклеотидам, связанным друг с другом водородными связями, при этом остатки тимина или урацила связаны с остатками аденина двумя водородными связями, а остатки цитозина и гуанина связаны тремя водородными связями. Как правило, нуклеиновая кислота включает нуклеотидную последовательность, описанную как имеющую «процентную комплементарность» или «процентную гомологию» с конкретной второй нуклеотидной последовательностью. Например, нуклеотидная последовательность может иметь 80%, 90% или 100% комплементарность с конкретной второй нуклеотидной последовательностью, это указывает на то, что 8 из 10, 9 из 10 или 10 из 10 нуклеотидов последовательности комплементарны конкретной второй нуклеотидной последовательности. Например, нуклеотидная последовательность 3'-TCGA-5' на 100% комплементарна нуклеотидной последовательности 5'-AGCT-3'; и нуклеотидная последовательность 3'-TCGA-5' на 100% комплементарна области нуклеотидной последовательности 5'-TTAGCTGG-3'.
[0062] Термин «последовательности контроля» ДНК коллективно означает последовательности промотора, сигналов полиаденилирования, последовательности терминации транскрипции, расположенные выше по ходу транскрипции регуляторные домены, точки начала репликации, внутренние участки связывания рибосомы, последовательности ядерной локализации, энхансеры и тому подобное, которые коллективно обеспечивают репликацию, транскрипцию и трансляцию кодирующей последовательности в клетке-реципиенте. Не все из этих видов последовательностей контроля должны присутствовать при условии, что выбранная кодирующая последовательность способна к репликации, транскрипции и, в случае некоторых компонентов, трансляции в соответствующей клетке-хозяине.
[0063] Используемый в настоящем документе термин «донорская ДНК» или «донорская нуклеиновая кислота» относится к нуклеиновой кислоте, которая предназначена для внесения модификации (вставки, делеции, замены) в локус последовательности ДНК за счет гомологичной рекомбинации при помощи направляемых нуклеиновой кислотой нуклеаз. Для управляемой гомологией репарации донорская ДНК должна иметь достаточную гомологию с областями, фланкирующими «разрезаемый сайт» или сайт, который должен быть модифицирован в геномной последовательности-мишени. Длина участка(ов) гомологии будет зависеть, например, от типа и размера вносимой модификации. Во многих случаях, и предпочтительно, донорская ДНК будет иметь две области гомологии последовательностей (например, два участка гомологии) с геномным локусом-мишенью. Предпочтительно, область «вставки» или область «модификации последовательности ДНК» - модификации нуклеиновой кислоты, которую хотят внести в геномный локус-мишень в клетке - будет расположена между двумя областями гомологии. Модификация последовательности ДНК может приводить к изменению одного или более нуклеотидов последовательности-мишени геномной ДНК в одном конкретном сайте или в нескольких конкретных сайтах. Изменение может включать изменение 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 50, 75, 100, 150, 200, 300, 400 или 500, или более, пар нуклеотидов последовательности-мишени. Делеция или вставка может представлять собой делецию или вставку 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 40, 50, 75, 100, 150, 200, 300, 400 или 500, или более, пар нуклеотидов последовательности-мишени.
[0064] Термин «сконструированный пептидный антиген» охватывает природные и синтетические полипептидные и белковые конструкты, которые включают синтетический полипептид или природный пептид, связанный с иными элементами, такие как, например, пептиды для экспонирования MHC пептида, иммобилизованный пептид, репортерный пептид или пептид секреции. Сконструированные пептидные антигены закодированы и/или экспрессируются с рекомбинантной нуклеиновой кислоты, которая может быть сконструирована для включения вариантов последовательности, рекомбинантных промоторов, элементов контроля транскрипции, последовательностей слитых пептидов, других модификаций, или любого сочетания двух или более из них. Представление пептида может включать представление всего, или фрагмента, интересующего белка. В некоторых вариантах осуществления сконструированные пептидные антигены включают связывающий мотив, который модифицируется за счет связывания фермента, что приводит к связыванию второй мишени связывания со связывающим мотивом. В некоторых вариантах осуществления вторая мишень связывания связывается со сконструированным пептидным антигеном внутри клетки.
[0065] Используемый в настоящем документе термин «обогащение» означает обогащение по генетически модифицированным клеткам путем разделения на одиночные клетки, необязательно, индукции, генетической модификации и выращивания разделенных одиночных клеток в колонии конечного размера (например, за счет насыщения или нормализации роста колоний).
[0066] Термины «нуклеиновая кислота-гид» или «РНК-гид», или «гРНК» относятся к полинуклеотиду, содержащему 1) направляющую последовательность, способную гибридизоваться с геномным локусом-мишенью, и 2) каркасную последовательность, способную к взаимодействию или образованию комплекса с направляемой нуклеиновой кислотой нуклеазой.
[0067] Термины «гомология» или «идентичность», или «сходство» означают сходство последовательностей между двумя пептидами или, чаще в контексте настоящего изобретения, между двумя молекулами нуклеиновой кислоты. Термин «гомологичная область» или «участок гомологии» означает область на донорской ДНК с определенной степенью гомологии с последовательностью-мишенью геномной ДНК. Гомологию можно определять путем сравнения положений в каждой из последовательностей, которые могут быть выровнены для целей сравнения. Если положение в сравниваемой последовательности занято таким же нуклеотидом, или аминокислотой, то молекулы являются гомологичными в данном положении. Степень гомологии между последовательностями зависит от числа совпадающих или гомологичных положений, общих для последовательностей.
[0068] Используемые в настоящем документе термины «лидерный пептид», «пептид секреции» или «лидерный пептид секреции» означают любую сигнальную последовательность, которая направляет синтезированный слитый белок прочь от сайта трансляции, включая сигнальные последовательности, которые приводят к тому, что слитый пептид пересекает клеточную мембрану и секретируется.
[0069] Термин «функционально связанные» означает связь элементов, при которой описанные компоненты сконфигурированы так, чтобы выполнять их обычную функцию. Так, последовательности контроля, функционально связанные с кодирующей последовательностью, способны оказывать влияние на транскрипцию и, в некоторых случаях, трансляцию, кодирующей последовательности. Последовательности контроля не обязательно должны быть смежными с кодирующей последовательностью при условии, что они действуют, управляя экспрессией кодирующей последовательности. Таким образом, например, промежуточные не транслируемые, но транскрибируемые, последовательности могут присутствовать между последовательностью промотора и кодирующей последовательностью, и последовательность промотора все-еще может считаться «функционально связанной» с кодирующей последовательностью. Более того, такие последовательности не обязательно должны находиться на одной и той же непрерывной молекуле ДНК (то есть, хромосоме) и могут все-еще иметь взаимодействия, которые приводят к изменению регуляции.
[0070] В настоящем документе термины «белок» и «полипептид» используют взаимозаменяемо. Белки могут состоять исключительно, или не исключительно, из аминокислот.
[0071] Термин «промотор», или «последовательность промотора», означает регуляторную область ДНК, способную связывать РНК-полимеразу и инициировать транскрипцию кодирующей последовательности полинуклеотида или полипептида, такой как матричная РНК, рибосомная РНК, малая ядерная или ядрышковая РНК, РНК-гид или РНК любого вида, транскрибируемая за счет любого вида любой из РНК-полимераз I, II или III. Промоторы могут быть конститутивными или индуцируемыми, и в некоторых вариантах осуществления - в частности, многих вариантах осуществления, в которых используют селекцию, - транскрипция по меньшей мере одного компонента системы генетической модификации с направляемой нуклеиновой кислотой нуклеазой находится под контролем индуцируемого промотора.
[0072] Используемый в настоящем документе термин «селективный маркер» относится к гену, введенному в клетку, который придает признак, подходящий для искусственной селекции. Общие принципы использования селективных маркеров хорошо известны специалистам в данной области. Можно использовать лекарственные средства в качестве селективных маркеров, например, ампициллин/карбенициллин, канамицин, хлорамфеникол, эритромицин, тетрациклин, гентамицин, блеомицин, стрептомицин, рифампицин, пуромицин, гигромицин, бластицидин и G418. В других вариантах осуществления селективные маркеры включают, но без ограничения, сахара, такие как рамноза, рецептор человеческого фактора роста нервов (обнаруживаемый при помощи мАт, например, описанного в патенте США № 6365373); укороченный рецептор человеческого фактора роста (обнаруживаемый при помощи мАт); мутантную дигидрофолатредуктазу человека (DHFR; доступен флуоресцентный субстрат MTX); секретируемую щелочную фосфатазу (SEAP; доступен флуоресцентный субстрат); тимидилатсинтазу человека (TS; придает устойчивость к противораковому средству фтордезоксиуридину); глутатион-S-трансферазу альфа человека (GSTA1; конъюгаты глутатиона с избирательным алкилирующим средством стволовых клеток бусульфаном; хемопротективный селективный маркер в CD34+ клетках); клеточный поверхностный антиген CD24 в гемопоэтических стволовых клетках; человеческий ген CAD для придания устойчивости к N-фосфонацетил-L-аспартату (PALA); человеческий белок множественной лекарственной устойчивости 1 (MDR-1; P-гликопротеин, поверхностный белок, делающий возможной селекцию на основании повышенной устойчивости к лекарственному средству или обогащение методом FACS); человеческий CD25 (IL-2α; обнаруживаемый при помощи мАт-FITC); метилгуанин-ДНК метилтрансферазу (MGMT; селекция с использованием кармустина); и цитидин-дезаминазу (CD; селекция с использованием Ara-C). Используемый в настоящем документе термин «селективная среда» означает среду для роста клеток, в которую было добавлено химическое соединение, или биологическая молекула, позволяющее производить селекцию на наличие или отсутствие селективных маркеров.
[0073] Используемый в настоящем документе термин «специфическое связывание» означает взаимодействие между двумя молекулами, например, сконструированным пептидным антигеном и мишенью для связывания, с аффинностью связывания, характеризующейся константой диссоциации примерно 10-7 M, примерно 10-8 M, примерно 10-9 M, примерно 10-10 M, примерно 10-11 M, примерно 10-12 M, примерно 10-13 M, примерно 10-14 M или примерно 10-15 M.
[0074] Термины «последовательность-мишень геномной ДНК», «последовательность-мишень» или «геномный локус-мишень» относятся к любому локусу in vitro или in vivo, или в нуклеиновой кислоте (например, геноме) клетки или популяции клеток, в котором желательно изменение по меньшей мере одного нуклеотида с использованием системы генетической модификации с направляемой нуклеиновой кислотой нуклеазой. Последовательность-мишень может представлять собой геномный локус или внехромосомный локус.
[0075] Термин «вариант» может означать полипептид или полинуклеотид, который отличается от эталонного полипептида или полинуклеотида, но сохраняет ключевые свойства. Типичный вариант полипептида отличается по аминокислотной последовательности от другого эталонного полипептида. Как правило, различия являются ограниченными, так что последовательности эталонного полипептида и варианта имеют, в целом, высокую степень сходства и, во многих областях, идентичны. Вариант и эталонный полипептид могут отличаться по аминокислотной последовательности из-за одной или более модификаций (например, замен, добавлений и/или делеций). Вариант полипептида может представлять собой консервативно модифицированный вариант. Замещенный или вставленный аминокислотный остаток может быть, или не быть, остатком, закодированным генетическим кодом (например, не существующей в природе аминокислотой). Вариант полипептида может существовать в природе, например, быть аллельным вариантом, или может представлять собой вариант, который, как известно, не существует в природе.
[0076] «Вектор» представляет собой любую из множества нуклеиновых кислот, которые содержат нужную последовательность, или последовательности, для доставки и/или экспрессии в клетке. Векторы, как правило, состоят из ДНК, хотя также доступны векторы в форме РНК. Векторы включают, но без ограничения, плазмиды, фосмиды, фагмиды, вирусные геномы, синтетические хромосомы и тому подобное. Описанный в настоящем документе «движущий вектор» содержит кодирующую последовательность для нуклеазы, используемой в системах и способах с применением направляемой нуклеиновой кислотой нуклеазы по настоящему изобретению. Движущий вектор также может содержать, в бактериальной системе, систему рекомбинационной инженерии λ Red или ее эквивалент. Движущие векторы также, как правило, содержат селективный маркер. Описанный в настоящем документе «модифицирующий вектор» содержит донорскую нуклеиновую кислоту, необязательно, включающую изменение в последовательности-мишени, которое предотвращает связывание нуклеазы в области PAM или спейсера в последовательности-мишени после совершения генетической модификации, и кодирующую последовательность для гРНК. Модифицирующий вектор также может содержать селективный маркер и/или штрихкод. В некоторых вариантах осуществления движущий вектор и модифицирующий вектор могут быть объединены; то есть, все компоненты для генетической модификации и селекции могут находиться на одном векторе. Кроме того, движущий и модифицирующий векторы содержат последовательности контроля, функционально связанные, например, с кодирующей нуклеазу последовательностью, кодирующими последовательностями системы рекомбинационной инженерии (в случае их присутствия), донорскую нуклеиновую кислоту, направляющую нуклеиновую кислоту и селективный маркер(ы).
Клеточные библиотеки, способы скрининга и генетической модификации
[0077] Настоящее изобретения относится к мультиплексным способам и автоматизированным приборам для создания клеточных популяций с дисплеем на клеточной поверхности, при этом способы включают технологии генетической модификации. Клеточные популяции, модифицированные с использованием мультиплексного и автоматизированного оборудования по изобретению, содержат один или более предполагаемых рецепторных антигенов, экспонируемых на клеточной поверхности и доступных для связывания с мишенью для связывания. Клетки, которые могут быть генетически модифицированы и использованы в соответствии с изобретением, включают, но без ограничения, бактериальные клетки, дрожжевые клетки и клетки млекопитающих. Кроме того, клетки, которые генетически модифицируют, могут включать последовательности, которые являются гетерологичными для хозяина (например, генетическая модификация последовательностей млекопитающих, вставленных в дрожжевой или бактериальный геном).
[0078] В частности, способы и автоматизированные приборы, используемые для создания клеток, могут быть использованы для идентификации антигенов, которые специфически связывают T-клеточные рецепторы (TCR). Возможность быстрой и легкой идентификации антигенов, например, предполагаемых антигенов-мишеней TCR-сирот, может быть чрезвычайно полезной в области иммунологии, например, исследований и разработок иммунотерапевтических средств.
[0079] Изобретение также относится к способам мультиплексного дисплея и скрининга антигенов (например, в качестве компонентов лигандов), которые связывают TCR-мишень. В некоторых вариантах осуществления антигены экспонируют на клеточной поверхности с использованием любого из методов клеточного дисплея, описанных в настоящем документе. В некоторых вариантах осуществления антигены находятся в комплексе с MHC и экспонируются на клеточной поверхности в популяции клеток.
[0080] Антигены, которые специфически связываются с T-клеточными рецепторами (TCR), могут быть идентифицированы с использованием различных методов обнаружения, включая выделение клеток и секвенирование введенных антигенных последовательностей или идентификацию методом гибридизации, например, на чипе. В других аспектах штрихкоды, связанные с конкретным экспонируемым антигеном, могут быть идентифицированы и использованы для определения антигенов, которые избирательно связываются с TCR. Штрихкоды могут быть идентифицированы, например, методом секвенирования и/или гибридизации на чипах.
[0081] В некоторых вариантах осуществления клетки, кодирующие сконструированные пептидные антигены, которые избирательно связываются с одной или более интересующими мишенями из клеток, идентифицируют и/или выделяют с использованием штрихкода, связанного с пептидом. В конкретных вариантах осуществления штрихкод используют для дополнительного выделения и/или анализа клеток, экспрессирующих пептиды, идентифицированные как потенциально позволяющие изучать связывание антигена с TCR. В таких вариантах осуществления штрихкод может быть использован в качестве «рукоятки» для извлечения интересующих клеток для дальнейшего анализа.
[0082] В некоторых вариантах осуществления способ включает получение путем модификации генома популяции или библиотеки генетически модифицированных клеток, каждая из которых экспонирует отдельный сконструированный пептидный антиген на ее поверхности, при этом разные сконструированные пептидные антигены создаются путем модификации за счет нуклеазы и впоследствии экспонируются на поверхности разных клеток. В других вариантах осуществления способ генетической модификации приводит к получению популяции или библиотеки генетически модифицированных клеток, при этом каждая генетически модифицированная клетка экспонирует множество разных сконструированных пептидных антигенов на ее поверхности. Клетки, таким образом, могут экспрессировать один или более сконструированных пептидных антигенов, которые экспонируются на клеточной поверхности отдельной клетки популяции, необязательно, в одной или более MHC (например, HLA).
[0083] В некоторых вариантах осуществления изобретение относится к способу экспонирования сконструированного пептидного антигена на клеточной поверхности, включающему генетическую модификацию клетки с использованием направляемой нуклеиновой кислотой нуклеазы для создания нуклеиновой кислоты, кодирующей сконструированный предполагаемый HLA, и инкубацию генетически модифицированной клетки в условиях, достаточных для экспрессии сконструированного HLA.
[0084] В некоторых вариантах осуществления клетки библиотеки экспонируют по меньшей мере 102 сконструированных пептидных антигенов. В некоторых вариантах осуществления клетка экспонирует по меньшей мере 103 сконструированных пептидных антигенов. В некоторых вариантах осуществления клетка экспонирует по меньшей мере 104 сконструированных пептидных антигенов. В некоторых вариантах осуществления клетка экспонирует по меньшей мере 105 сконструированных пептидных антигенов, по меньшей мере 106 сконструированных пептидных антигенов или более. В некоторых вариантах осуществления изобретение относится к библиотеке из любых клеток, описанных в настоящем документе. В некоторых вариантах осуществления библиотека имеет по меньшей мере 108 разных членов. В некоторых вариантах осуществления библиотека имеет по меньшей мере 2, по меньшей мере 5, по меньшей мере 10, по меньшей мере 50, по меньшей мере 100, по меньшей мере 1000, по меньшей мере 10000, по меньшей мере 100000, по меньшей мере 1000000, по меньшей мере 107, по меньшей мере 108, по меньшей мере 109, по меньшей мере 1010 или по меньшей мере 1011 клеток.
[0085] В некоторых вариантах осуществления изобретение относится к популяциям или библиотекам генетически модифицированных клеток, при этом клетки кодируют разные сконструированные пептидные антигены и их варианты, и при этом варианты также содержат связывающий мотив, способный связывать мишень для связывания. В некоторых вариантах осуществления связывающий мотив представляет собой мотив биотинилирования. В некоторых вариантах осуществления библиотека имеет по меньшей мере 108 разных членов. В некоторых вариантах осуществления библиотека имеет по меньшей мере 2, по меньшей мере 5, по меньшей мере 10, по меньшей мере 50, по меньшей мере 100, по меньшей мере 1000, по меньшей мере 10000, по меньшей мере 100000, по меньшей мере 1000000, по меньшей мере 107, по меньшей мере 108, по меньшей мере 109, по меньшей мере 1010 или по меньшей мере 1011 членов.
[0086] Способы генетической модификации, которые можно использовать для создания библиотек или популяций клеток, описаны подробно ниже, как и модули для обработки клеток и приборы, используемые для выполнения направляемой нуклеазой генетической модификации генома.
[0087] Антигены, экспонируемые на генетически модифицированных клетках в библиотеках, могут иметь любую длину, составляющую 3-50 аминокислот, и предпочтительно, 5-20 аминокислот. В конкретных аспектах аминокислотные пептиды экспонируются таким образом, который позволяет соответствующим образом представлять антигенную область пептида, например, 8-11 аминокислот, которые, как известно, являются доступными в MHC на клеточной поверхности.
T-клеточные рецепторы
[0088] T-клеточные рецепторы (TCR) имеют структурное сходство с иммуноглобулинами, закодированы гомологичными генами и собираются путем соматической рекомбинации из наборов генных сегментов, аналогично рекомбинации генов иммуноглобулинов. Локусы TCR имеют примерно одинаковое количество генных сегментов V, но больше генных сегментов J, и наблюдается большая диверсификация соединений между генными сегментами во время реаранжировки генов. Кроме того, известно, что в функциональных TCR не происходит диверсификация их генов V после реаранжировки посредством соматической гипермутации. Результатом этого является TCR, в котором максимальное разнообразие имеет место в центральной части рецептора, которая контактирует со связанным антигеном лиганда.
[0089] Каждая из α и β-цепей TCR состоит из вариабельной (V) амино-концевой области и константной (C) области. Организация локусов TCRα и TCRβ представлена на Фигуре 1. Локус TCRα, аналогично таковым для легких цепей иммуноглобулинов, содержит сегменты генов V и J (Vα и Jα). Локус TCRβ, аналогично таковым для тяжелых цепей иммуноглобулинов, содержит сегменты гена D в дополнение к сегментам генов Vβ и Jβ.
[0090] Генные сегменты TCR проходят реаранжировку в процессе развития T-клетки, с образованием экзонов полного V-домена (Фигура 2). Генные сегменты TCR фланкированы гептамерными и нонамерными сигнальными последовательностями рекомбинации (RSS), которые гомологичны последовательностям, фланкирующим ген иммуноглобулина.
[0091] Дополнительными общими признаками реаранжировки генов иммуноглобулинов и TCR является присутствие P- и N-нуклеотидов в участках соединения между сегментами генов V, D и J реаранжированного гена TCRβ. В T-клетках P- и N-нуклеотиды также добавлены между сегментами генов V и J всех реаранжированных генов TCRα, в то время как лишь примерно половина соединений V-J в генах легких цепей иммуноглобулинов модифицированы добавлением N-нуклеотидов, и они также часто остаются без P-нуклеотидов.
[0092] Лиганд для TCR, как правило, представляет собой пептид, связанный с молекулой MHC. Таким образом, максимальная вариабельность лиганда TCR приходится на связанный антигенный пептид, занимающий центр поверхности, контактирующей с рецептором. Фактически, трехмерная структура сайта узнавания антигена в TCR выглядит в значительной степени аналогично таковому в молекуле антитела.
[0093] Структурное разнообразие TCR в основном является следствием комбинаторного и соединительного разнообразия, возникающего в процессе реаранжировки генов. Вариабельность цепей TCR сконцентрирована в соединительной области, закодированной сегментами генов V, D и J и модифицированной P- и N-нуклеотидами. Локус TCRα содержит намного больше сегментов гена J, чем любой из локусов легких цепей иммуноглобулинов: у человека 61 сегмент гена Jα распределен по примерно 80 м.п.н. ДНК, в то время как локусы легких цепей иммуноглобулинов имеют лишь максимально пять сегментов гена J. Поскольку локус TCRα имеет так много сегментов гена J, возникающая в данной области вариабельность даже больше в случае TCR, чем в случае иммуноглобулинов. Эта область кодирует петли CDR3 в иммуноглобулинах и TCR, которые образуют центр антигенсвязывающего сайта. Таким образом, центр TCR будет в высокой степени вариабельным, в то время как на периферии будет иметь место относительно небольшая вариабельность.
[0094] Небольшое количество T-клеток имеют TCR, состоящий из цепей γ и δ. Кластер генных сегментов, кодирующих δ-цепь, находится полностью внутри локуса TCRα, между сегментами генов Vα и Jα. Смотри Фигуру 3. Поскольку все сегменты гена Vα ориентированы таким образом, что реаранжировка приведет к делеции промежуточной ДНК, любая реаранжировка в локусе α приводит к потере локуса δ. Имеется гораздо меньше сегментов гена V в локусах TCRγ и TCRδ, чем в любом из локусов TCRα или TCRβ, или в любом из локусов иммуноглобулинов. Повышенная вариабельность соединений в δ-цепях может компенсировать небольшое количество сегментов гена V, и оказывает влияние на сосредоточение почти всей вариабельности в рецепторе γ:δ в соединительной области. Как установлено, аминокислоты, составляющие соединительные области, находятся в центре связывающего сайта TCR. У человека локусы TCRγ и TCRδ, подобно локусам TCRα и TCRβ, имеют дискретные сегменты генов V, D и J, и гены C.
[0095] T-клетки, имеющие рецепторы γ:δ, представляют собой отдельную линию дифференцировки T-клеток, и их функции в настоящее время неизвестны. Лиганды для этих рецепторов также в основном неизвестны. Некоторые γ:δ TCR, судя по всему, способны узнавать антиген напрямую, в значительно степени как узнают антитела, без необходимости в представлении молекулой MHC или в процессинге антигена. Соответственно, совместная экспрессия молекулы MHC с предполагаемым антигеном является необязательной.
Клеточный поверхностный дисплей
[0096] Можно использовать разные технологии дисплея с клеточными библиотеками и популяциями, полученными с использованием способов и приборов, описанных в настоящем документе, включая технологии дисплея на поверхности дрожжей, технологии дисплея на поверхности клеток млекопитающих и технологии дисплея на поверхности бактерий. Технологии клеточного поверхностного дисплея включают, но без ограничения, те, которые описаны в USPN 8883692; 8685893 и 6699658; патентных публикациях США №№ 20170218382; 20170088611; 20150307560; 20150203834; 20140221621; 20140031292; 20140235476, 20140221621; 20130184177; 20110008883; 20100233195; 20100210473; 20100216659; 20090280560; 20090111126 и 20040146976. Бактериальные клетки, дрожжевые клетки и клетки млекопитающих, все можно использовать для клеточного поверхностного дисплея.
[0097] В конкретных вариантах осуществления иммобилизация сконструированного пептидного антигена на клеточной поверхности может включать специфические взаимодействия между сконструированным пептидным антигеном и связывающим мотивом на сконструированном пептидном антигене.
[0098] Сконструированные пептидные антигены по изобретению могут быть экспрессированы в любой клетке, которая может быть генетически модифицирована и осуществлять поверхностный дисплей, и изобретение охватывает любую прокариотическую или эукариотическую клетку, включая бактериальные клетки, дрожжевые клетки (например, виды Saccharomyces и/или Picchia), клетки насекомых, клетки Xenopus и клетки млекопитающих. Клетками, которые особенно подходят для экспрессии слитых белков по изобретению, являются клетки E. coli, S. cerevisiae, CHO и 293T. Клетки могут представлять собой клетки «дикого типа» или клетки могут быть оптимизированы в отношении конкретной характеристики или в отношении функции конкретного фермента, который может способствовать белковой экспрессии. Оптимизированные или генетически модифицированные клетки включают клетки, которые обладают оптимизированной способностью к поглощению и поддержанию нуклеиновых кислот, обладающих повышенной способностью к синтезу белка, и/или клетки, которые обладают повышенной способностью к секреции белка. Клетки, которые поддерживают целостность генетически модифицированной нуклеиновой кислоты и синтезированных белков, являются особенно полезными.
[0099] В конкретных аспектах генетически модифицированные клетки имеют мишень для связывания на их поверхности, и клетки инкубируют в условиях, приводящих к секреции сконструированного пептидного антигена, при этом сконструированный пептидный антиген связывается с мишенью для связывания, за счет чего происходит экспонирование сконструированного пептидного антигена на клеточной поверхности.
[00100] Общепринятым используемым организмом для дисплея белков являются дрожжи. Дрожжевой дисплей обладает преимуществами перед технологиями на основе бактерий в том, что дрожжи могут процессировать белки, которым необходим специфический для эндоплазматического ретикулума (ЭР) посттрансляционный процессинг для эффективного сворачивания и активности. При том, что дисплей на клетках млекопитающих также обеспечивает посттрансляционный процессинг, дрожжи обладают преимуществом легкости создания библиотек нуклеиновых кислот, поскольку векторы могут быть более простыми, и в случае дрожжей легче вводить инструменты для генетической модификации (например, модифицирующие векторы) в клетки. Большинство экспрессируемых в дрожжах слитых белков основаны на GPI (гликозил-фосфатидил-инозитол) якорных белках, которые играют важную роль в поверхностной экспрессии белков клеточной поверхности и являются важными для жизнеспособности дрожжей. Один такой якорный белок - альфа-агглютинин - состоит из коровой субъединицы, которая закодирована AGA1 и связана дисульфидными связями с малой связывающей субъединицей, закодированной AGA2. Белки, закодированные библиотеками нуклеиновых кислот, описанными в настоящем документе, можно встраивать в N-концевой области AGA1 или в C-концевой или N-концевой области AGA2. Эти слитые структуры будут приводить к экспонированию полипептида на поверхности дрожжевой клетки.
[00101] В некоторых вариантах осуществления слитые белки для дрожжевого дисплея включают сконструированный пептидный антиген, слитый с N-концевой или C-концевой частью белка, способного к заякориванию в стенке эукариотической клетки (такого как, например, α-агглютинин, AGA1, Flo1 или основной белок клеточной стенки низших эукариот; смотри USPN 6027910 и 6114147, которые включены в настоящий документ посредством ссылки), например, белки, слитые с фрагментом GPI Flol или с функциональным доменом Flol (Kondo et al., Appl. MicroBiol. Biotech., 64: 28-40 (2004)).
[00102] Помимо способов поверхностного дисплея, основанных на известных слитых белках, содержащих якорный мотив GPI, изобретение также охватывает способы дисплея, основанные на новых слитых белках, содержащих модифицированный якорный мотив GPI. Слитые белки по изобретению могут содержать белок, который будет экспонирован (например, один или более сконструированных пептидных антигенов, мишени для связывания, молекулярные мишени, субстраты и так далее, или любое их сочетание), якорь GPI и соответствующие сигнальные последовательности, которые могут быть посттрансляционно модифицированы, когда слитый белок экспрессируется в дрожжах. Когда белок, содержащий якорь GPI и C-концевую сигнальную последовательность, проходит через ЭР, гидрофобная область на C-концевой сигнальной последовательности, прилегающей к якорю GPI, становится погруженной в мембрану ЭР, где она расщепляется протеазой ЭР. Когда протеаза ЭР расщепляет эту C-концевую сигнальную последовательность, она одновременно присоединяет ранее сформированный якорь GPI к новому C-концу сконструированного пептидного антигена (например, мишени для связывания, молекулярной мишени, субстрата и так далее, или любого их сочетания), что в итоге приводит к экспонированию белка (например, мишени для связывания, молекулярной мишени, субстрата и так далее, или любого их сочетания) на клеточной поверхности (смотри, например, публикацию Kondo et al., упомянутую выше). Изобретение охватывает C-концевые последовательности с улучшенными свойствами процессинга, приводящие к улучшенному экспонированию слитых белков, содержащих белки с якорем GPI. Улучшенное экспонирование включает увеличение количества экспонируемых белков и/или увеличение количества правильно экспрессируемых белков. В некоторых вариантах осуществления C-концевые последовательности с улучшенными свойствами процессинга улучшают путем скрининга библиотек, содержащих варианты C-концевых последовательностей, методами, известными в данной области.
[00103] В некоторых вариантах осуществления изобретение относится к способу дисплея сконструированного пептидного антигена на клетке, включающему инкубацию генетически модифицированной клетки, содержащей первую нуклеиновую кислоту, в условиях, достаточных для экспрессии сконструированного пептидного антигена, закодированного первой нуклеиновой кислотой, при этом клетка экспонирует первую мишень для связывания, при этом сконструированный пептидный антиген содержит связывающий мотив, и вторая мишень для связывания соединяется со связывающим мотивом, когда сконструированный пептидный антиген экспрессируется, и при этом экспрессируемый сконструированный пептидный антиген секретируется из клетки и экспонируется на клеточной поверхности за счет связывания второй мишени для связывания с первой мишенью для связывания. В некоторых вариантах осуществления первая мишень для связывания представляет собой авидин-подобный белок. В некоторых вариантах осуществления вторая мишень для связывания представляет собой биотин. В некоторых вариантах осуществления связывающий мотив представляет собой пептид биотинилирования. В некоторых вариантах осуществления присоединение второй мишени для связывания происходит за счет связывающего фермента. В некоторых вариантах осуществления связывающий фермент представляет собой биотин-лигазу.
[00104] В некоторых вариантах осуществления изобретение относится к способу создания библиотеки генетически модифицированных клеток, содержащих сконструированные (генетически модифицированные) пептидные антигены, экспонированные на клеточных поверхностях, включающему введение нескольких модифицирующих векторов в популяцию клеток, создание условий, позволяющих модифицирующим векторам модифицировать нуклеиновые кислоты в клетках; и создание условий, в которых генетически модифицированные клетки экспрессируют сконструированные пептидные антигены и экспонируют сконструированные пептидные антигены на клеточных поверхностях, при этом векторы включают последовательность нуклеазы и донорскую нуклеотидную последовательность, имеющую модификацию в кодирующей области антигена, который будет сконструирован. В конкретных аспектах закодированные сконструированные пептидные антигены содержат уникальный полипептид, связанный с пептидом иммобилизации, при этом пептид иммобилизации содержит первый связывающий мотив, который избирательно связывается со вторым связывающим мотивом, присутствующим на клеточной поверхности генетически модифицированных клеток, и сконструированные пептидные антигены экспрессируются в условиях, достаточных для связывания первого связывающего мотива со вторым связывающим мотивом на клеточной поверхности. Пептид иммобилизации может также, или альтернативно, включать, например, трансмембранный полипептид, якорный мембранный полипептид, GPI-связанный полипептид или естественный поверхностный полипептид.
[00105] В некоторых вариантах осуществления изобретение относится к способу создания библиотеки генетически модифицированных клеток, экспрессирующих сконструированные пептидные антигены, экспонируемые на клеточной поверхности, включающему введение нескольких модифицирующих векторов в популяцию клеток, при этом векторы включают последовательность направляемой нуклеиновой кислотой нуклеазы, РНК-гид и донорскую нуклеиновую кислоту, имеющую модификацию в кодирующей области белка, который будет сконструирован. В конкретных аспектах антигены, которые будут генетически модифицированы, представляют собой закодированные сконструированные пептидные антигены, которые содержат уникальный полипептид, связанный с пептидом иммобилизации, при этом пептид иммобилизации содержит первый связывающий мотив, который избирательно связывается со вторым связывающим мотивом, присутствующим на клеточной поверхности генетически модифицированных клеток, и сконструированные пептидные антигены экспрессируются в условиях, достаточных для связывания первого связывающего мотива со вторым связывающим мотивом на клеточной поверхности.
[00106] В аспектах, которые включают использование пептида иммобилизации или другой молекулы, содержащей связывающий мотив, пептид или мотив может быть связан с C-концом или N-концом сконструированного пептидного антигена.
[00107] В некоторых вариантах осуществления сконструированный пептидный антиген дополнительно содержит лидерный пептид. Лидерный пептид или пептид секреции может быть протеолитически удален из зрелого белка одновременно, или сразу после экспорта белка в просвет внутриклеточного компартмента в секреторном пути. Лидерный пептид может представлять собой природную последовательность или синтетическую последовательность.
[00108] Библиотека генетически модифицированных клеток может иметь по меньшей мере 2, по меньшей мере 5, по меньшей мере 10, по меньшей мере 50, по меньшей мере 100, по меньшей мере 1000, по меньшей мере 10000, по меньшей мере 100000, по меньшей мере 1000000, по меньшей мере по меньшей мере 107, по меньшей мере 108, по меньшей мере 109, по меньшей мере 1010 или по меньшей мере 1011 клеток, содержащих один или более сконструированных пептидных антигенов.
[00109] В некоторых вариантах осуществления экспрессия сконструированных пептидных антигенов в клетках является индуцируемой или временной. В некоторых вариантах осуществления в этапе индукции нет необходимости, и инкубация клетки приводит к экспрессии сконструированного пептидного антигена. В некоторых вариантах осуществления сконструированные пептидные антигены, содержащие первый связывающий мотив, секретируются и связываются со вторым связывающим мотивом, присутствующим на клеточной поверхности, за счет чего происходит экспонирование сконструированного пептидного антигена на клеточной поверхности. В некоторых вариантах осуществления первый связывающий мотив представляет собой авидин, стрептавидин или нейтравидин, и второй связывающий мотив представляет собой биотин. В некоторых вариантах осуществления авидин ковалентно связан с клеточной поверхностью (например, непосредственно или опосредованно). Хотя в некоторых вариантах осуществления первая мишень для связывания экспрессируется клеткой и экспонируется на клеточной поверхности. Например, одна из мишеней для связывания может быть экспрессирована клеткой в виде слитого белка, например в виде слитого белка клеточной стенки или мембранного слитого белка, и экспонирована на поверхности клетки.
Способы скрининга
[00110] Способы по изобретению могут быть полезны для идентификации одного или более пептидов, которые избирательно связываются с TCR. За счет предоставления системы, позволяющей создавать клеточную библиотеку со сконструированными пептидными антигенами, экспонированными на поверхности клеток, в которых они экспрессируются, клетки, экспрессирующие сконструированные пептидные антигены, могут быть идентифицированы с использованием любого анализа, который может быть проведен на клеточной поверхности (например, проведен на клеточном препарате для обнаружения одной или более молекул, экспонированных на клеточной поверхности). Способы по изобретению могут быть использованы для скрининга библиотек, экспрессирующих варианты сконструированных пептидных антигенов, для выявления одного или более TCR, которые избирательно связываются с антигеном(ами).
[00111] Вариант осуществления изобретения относится к способу селекции клеток, экспонирующих сконструированные пептидные антигены с желаемой аффинностью или специфичностью для TCR-мишени, например, известного TCR или TCR-сироты. Некоторые аспекты изобретения относятся к способам скрининга для выявления клеток, экспрессирующих антиген, который может взаимодействовать с конкретной молекулой-мишенью (например, известным TCR или TCR-сиротой) с желаемой специфичностью.
[00112] В некоторых вариантах осуществления изобретение относится к способу скрининга антигенов, включающему экспрессию сконструированного пептидного антигена в клетке, генетически модифицированной с использованием нуклеазы, при этом экспрессируемый сконструированный пептидный антиген секретируется и экспонируется на клеточной поверхности в виде компонента лиганда, специфического для TCR; и оценку связывания лиганда с одним или более TCR. После идентификации конкретного TCR и/или пептида последовательности можно секвенировать, например, с использованием секвенирования нового поколения, например, Illumina HiSeq или MiSeq. В других аспектах конкретный TCR и/или пептид можно идентифицировать путем обнаружения штрихкода, который связан с конкретным TCR и/или пептидом.
[00113] В некоторых вариантах осуществления изобретение относится к способу скрининга антигенов, включающему экспрессию сконструированного пептидного антигена в клетке, генетически модифицированной с использованием направляемой нуклеиновой кислотой нуклеазы (например, РНК-направляемой нуклеазы, такой как нуклеаза CRISPR). Экспрессируемые сконструированные пептидные антигены секретируются и экспонируются на клеточной поверхности в виде компонента лиганда, специфического для TCR, и можно оценивать связывание лиганда с одним или более TCR.
Экспрессия генетически модифицированных белков
[00114] Сконструированные пептидные антигены в генетически модифицированных клетках по изобретению могут экспрессироваться с генетически модифицированных нуклеиновых кислот с использованием способов, известных в данной области. В некоторых вариантах осуществления экспрессия белка является конститутивной. Конститутивная экспрессия включает как экспрессию с нуклеиновых кислот, которые были интегрированы в геном, так и экспрессию с нуклеиновых кислот, которые находятся на эписомных векторах. В некоторых вариантах осуществления экспрессия инициируется событием индукции. В некоторых вариантах осуществления генетически модифицированные нуклеиновые кислоты, кодирующие сконструированные пептидные антигены, функционально связаны с последовательностью инициации, которая регулирует экспрессию сконструированного пептидного антигена. Последовательности инициации, которые могут индуцировать экспрессию, известны в данной области и включают индуцируемые промоторы. В некоторых вариантах осуществления экспрессию белка индуцируют. В некоторых вариантах осуществления экспрессия белка происходит, когда клетку, содержащую нуклеиновую кислоту, кодирующую белок, инкубируют, и в отдельном этапе индукции нет необходимости.
Клеточные библиотеки
[00115] Библиотеки по изобретению включают библиотеки генетически модифицированных клеток, экспрессирующих уникальные сконструированные пептидные антигены. Клетки библиотеки, предпочтительно, генетически модифицируют с использованием нуклеазы, и более предпочтительно, с использованием одной или более нуклеаз (например, направляемой нуклеиновой кислотой нуклеазы) в автоматизированном многомодульном приборе для генетической модификации клеток, описанном подробно в настоящем документе.
[00116] В некоторых вариантах осуществления библиотека предоставляет генетически модифицированные клетки со сконструированными пептидными антигенами в высокой плотности, иммобилизованными на клеточной поверхности. В некоторых вариантах осуществления высокой плотности добиваются путем связывания множества сконструированных полипептидов, экспрессируемых в клетке, с мишенью для связывания клеточной поверхности. В некоторых вариантах осуществления число сконструированных пептидных антигенов, экспонированных в расчете на клетку, составляет более 103, более 104, более 105, более 106, более 107 или более 108 сконструированных пептидных антигенов на клетку. В некоторых вариантах осуществления пептид иммобилизации представляет собой пептид биотинилирования. Экспонируемые антигены могут представлять собой один пептидный антиген, либо два или более пептидных антигенов, в зависимости от стратегии дисплея для клеток. В некоторых вариантах осуществления пептид иммобилизации представляет собой трансмембранный белок. В некоторых вариантах осуществления пептид иммобилизации содержит якорь GPI. В некоторых вариантах осуществления пептид иммобилизации представляет собой пептид, который естественным образом присутствует на клеточной поверхности. В некоторых вариантах осуществления пептид иммобилизации представляет собой пептид, который связывает одну или более молекул, естественным образом присутствующих на клеточной поверхности (например, поверхностные углеводы или белки на клеточной поверхности).
[00117] В некоторых вариантах осуществления библиотеки связывающих белков можно оценивать или подвергать скринингу для идентификации и/или выделения вариантов, которые связываются с одним или более TCR-мишенями. Способы по изобретению могут быть предназначены для идентификации сконструированных пептидных антигенов, которые имеют аффинность для конкретного TCR, превышающую аффинность связывания, характеризующуюся константой диссоциации примерно 10-7 M, примерно 10-8 M, примерно 10-9 M, примерно 10-10 M, примерно 10-11 M, примерно 10-12 M, примерно 10-13 M, примерно 10-14 M или примерно 10-15 M. В некоторых вариантах осуществления способы по изобретению могут быть предназначены для идентификации последовательностей пептидов-мишеней, которые имеют аффинность для TCR, превышающую аффинность связывания, характеризующуюся константой диссоциации примерно 10-7 M, примерно 10-8 M, примерно 10-9 M, примерно 10-10 M, примерно 10-11 M, примерно 10-12 M, примерно 10-13 M, примерно 10-14 M или примерно 10-15 M.
Определяемая нуклеазой генетическая модификация генома
[00118] В некоторых вариантах осуществления в автоматизированном приборе, описанном в настоящем документе, использована система определяемой нуклеазой генетической модификации генома для внесения модификаций в популяцию клеток, позволяющая сконструированным белкам экспонироваться на поверхности клеток. Существует множество разных систем на основе нуклеазы для внесения модификаций в геном организма, и каждую можно использовать или в виде отдельных модифицирующих систем, последовательных модифицирующих систем (например, используя разные определяемые нуклеазой системы последовательно для внесения двух или более геномных модификаций в клетку) и/или рекурсивных модифицирующих систем (например, используя одну определяемую нуклеазой систему для внесения двух или более геномных модификаций в клетку). Иллюстративные системы определяемой нуклеазой генетической модификации генома описаны в настоящем документе, хотя специалист в данной области поймет, после изучения настоящего изобретения, что и другие такие приборы для генетической модификации также могут быть использованы для создания популяций клеток с целью экспонирования на клеточной поверхности сконструированных пептидных антигенов.
[00119] Следует отметить, что в автоматизированных приборах для генетической модификации, описанных в настоящем документе, можно использовать нуклеазы для расщепления генома, внесения модификации в область-мишень, или и того, и другого.
[00120] В конкретных аспектах изобретения система генетической модификации с нуклеазой представляет собой индуцируемую систему, которая позволяет контролировать время внесения генетической модификации. Возможность модулировать активность нуклеазы может уменьшать нецелевое расщепление и способствовать точной модификации генома. Множество разных индуцируемых систем можно использовать с прибором и системами по изобретению, как будет понятно специалисту в данной области после изучения настоящего изобретения.
[00121] В некоторых аспектах расщепление нуклеазой можно использовать с приборами и системами по изобретению для селекции клеток с модификацией генома в области-мишени. Например, клетки, подвергнутые модификации генома, которая удаляет конкретный сайт узнавания нуклеазы (например, за счет гомологичной рекомбинации), можно отбирать с использованием приборов, описанных в настоящем документе, подвергая клетки воздействию нуклеазы после генетической модификации. ДНК в клетках без модификации генома будет расщеплена, и впоследствии они будут ограниченно расти и/или погибать, в то время как клетки, геном которых был модифицирован путем удаления сайта узнавания нуклеазы, не будут затронуты при последующем воздействии нуклеазы.
[00122] В других аспектах клетки для модификации можно обрабатывать определенным образом для расщепления генома до помещения клеток в прибор, и прибор использовать для автоматизированного внесения желательных модификаций генома в такие клетки. Начальное расщепление можно проводить тем же самым, или иным ферментом, чем тот, который был использован для начального события расщепления.
[00123] Когда клетка, или популяция клеток, с ДНК, кодирующей направляемую нуклеиновой кислотой нуклеазу, находится в присутствии индуцирующей молекулы, может происходить экспрессия нуклеазы. Например, экспрессия нуклеазы CRISPR может быть подавлена в присутствии молекулы-репрессора. Когда клетка, или популяция клеток, с ДНК, кодирующей направляемую нуклеиновой кислотой нуклеазу, находится без молекулы, подавляющей экспрессию нуклеазы CRISPR, может происходить экспрессия нуклеазы CRISPR.
[00124] Например, описаны индуцируемые системы для генетической модификации с использованием РНК-направляемой нуклеазы, в которых используют химическую индукцию для ограничения временного воздействия на клетки РНК-направляемой нуклеазы. Dow, et al., Nature Biotechnology Volume 33:390-394 (2015); также индуцируемые лентивирусные экспрессионные векторы доступны от Dharmacon, GE Life Sciences, Lafayette, CO. Для дополнительной информации о методах смотри, например, Campbell, Biochem J., 473(17): 2573-89 (2010).
[00125] В других примерах для индукции генетической модификации в клетках можно использовать индуцируемую вирусом нуклеазу. Смотри, например, Don, Antiviral Res., 130:50-57 (2016). В другом примере для вариантов индуцируемой экспрессии направляемых нуклеиновой кислотой нуклеаз процесс можно запускать и останавливать в человеческих клетках 4-гидрокситамоксифеном (4-HT), производя слияние нуклеазы с гормон-связывающим доменом рецептора эстрогена (ERT2). Liu, et al., Nature Chemical Biology, Volume:12:Pages:980-87 (2016).
[00126] Нуклеазы «цинковые пальцы» (ZFN) представляют собой искусственные ферменты рестрикции, созданные путем слияния ДНК-связывающего домена «цинковый палец» с ДНК-расщепляющим доменом. Домены «цинковые пальцы» могут быть сконструированы для нацеливания на конкретные области-мишени в геноме организма. Смотри, например, Urnov, et al., Nature Reviews Genetics 11, 636-646 (2010). За счет эндогенного аппарата репарации ДНК организма ZFN могут быть использованы для точного изменения области-мишени в геноме. ZFN могут быть использованы для отключения доминантных мутаций у гетерозиготных индивидуумов путем внесения двухцепочечных разрывов («DSB») в ДНК в мутантном аллеле, который, в отсутствие гомологичной матрицы, будет восстанавливаться по механизму негомологичного соединения концов (NHEJ). NHEJ восстанавливает DSB, соединяя вместе два конца, и, как правило, не создает мутации, при условии, что разрез является чистым и несложным. Durai, et al., Nucleic Acids Res. 33 (18): 5978-90 (2005). Этот механизм репарации может быть использован для внесения ошибок в геном за счет «индел» или хромосомной реаранжировки, часто приводя к утрате функциональности генных продуктов, закодированных в данном участке.
[00127] Альтернативно, ДНК можно вводить в геном в присутствии экзогенных двухцепочечных фрагментов ДНК с использованием зависимой от гомологии репарации (HDR). Зависимость HDR от гомологичной последовательности для репарации DSB можно использовать путем вставки нужной последовательности в последовательность, гомологичную фланкирующим последовательностям DSB, которая, при использовании в качестве матрицы в системе HDR, приводит к созданию нужного изменения в интересующей области генома.
[00128] Многие пары ZFN также можно использовать для полного удаления целых больших сегментов геномной последовательности (Lee. et al., Genome Res. 20(1): 81-89 (2009). Удлиненные участки повторов CAG/CTG являются генетическим основанием для более чем дюжины наследственных неврологических заболеваний, включая болезнь Гентингтона, миотоническую дистрофию и некоторые спинально-церебеллярные атаксии. Показано, что в человеческих клетках ZFN могут направлять DSB к повторам CAG и приводить к сжатию повторов от патологически больших до более коротких, менее токсичных, длин (Mittelman, et al., PNAS USA, 106(24): 9607-12 (2009)).
[00129] Мегануклеазы были обнаружены в 1990-х годах, и последующие исследования показали, что они являются особенно многообещающими инструментами для генетической модификации генома, поскольку они способны эффективно индуцировать гомологичную рекомбинацию, создавать мутации в кодирующих или не кодирующих областях генома и изменять рамки считывания кодирующих областей геномов. Смотри, например, Epinat, et al., Nucleic Acids Research, 31(11):2952-62 (2003). Высокая специфичность мегануклеаз придает им высокую степень точности и намного более низкую токсичность для клеток, в сравнении с другими природными ферментами рестрикции.
[00130] Подобные активаторам транскрипции эффекторные нуклеазы (TALEN) представляют собой ферменты рестрикции, которые могут быть сконструированы для разрезания конкретных последовательностей ДНК. Их получают путем слияния ДНК-связывающего домена TAL-эффектора с ДНК-расщепляющим доменом (нуклеазой, разрезающей цепи ДНК). Подобные активаторам транскрипции эффекторы (TALE) могут быть сконструированы для связывания практически с любой желаемой последовательностью ДНК, так что при объединении с нуклеазой могут разрезать ДНК в конкретных участках. (Смотри, например, Miller, et al., Nature Biotechnology, 29(2): 143-48 (2011); Boch, Nature Biotechnology, 29(2): 135-36 (2011)).
[00131] Подобно ZFN, TALEN могут модифицировать геномы за счет внесения DSB. Созданные TALEN сайт-специфические DSB в областях-мишенях восстанавливаются по механизму NHEJ или HDR, что приводит к направленной модификации генома. TALEN можно использовать для внесения «индел», перестановок, или для введения ДНК в геном по механизму NHEJ в присутствии экзогенных двухцепочечных фрагментов ДНК.
[00132] Недавнее открытие в области генетической модификации живых клеток включает модификацию за счет направляемой нуклеиновой кислотой нуклеазы (например, РНК-направляемой нуклеазы). Направляемая нуклеиновой кислотой нуклеаза в комплексе с соответствующей синтетической нуклеиновой кислотой-гидом в клетке может разрезать геном клетки в нужном участке. Нуклеиновая кислота-гид помогает направляемой нуклеиновой кислотой нуклеазе узнавать и разрезать ДНК в конкретной последовательности-мишени. За счет манипуляций с нуклеотидной последовательностью нуклеиновой кислоты-гида направляемую нуклеиновой кислотой нуклеазу можно программировать для нацеливания на любую последовательность ДНК для расщепления при условии, что вблизи находится соответствующий прилегающий к протоспейсеру мотив (PAM). В конкретных аспектах в системе генетической модификации с направляемой нуклеиновой кислотой нуклеазой можно использовать две отдельные молекулы нуклеиновой кислоты-гида, которые объединяются для функционирования в качестве нуклеиновой кислоты-гида, например, CRISPR РНК (crRNA) и трансактивирующую CRISPR РНК (tracrRNA). В других аспектах нуклеиновая кислота-гид может представлять собой одиночную нуклеиновую кислоту-гид, которая включает последовательности как crRNA, так и tracrRNA.
[00133] Как правило, нуклеиновая кислота-гид (например, гРНК) образует комплексы с совместимой направляемой нуклеиновой кислотой нуклеазой, а затем может гибридизоваться с последовательностью-мишенью, тем самым направляя нуклеазу на последовательность-мишень. Нуклеиновая кислота-гид может представлять собой ДНК или РНК; альтернативно, нуклеиновая кислота-гид может содержать как ДНК, так и РНК. В некоторых вариантах осуществления нуклеиновая кислота-гид может содержать модифицированные или не существующие в природе нуклеотиды. В случаях, когда нуклеиновая кислота-гид представляет собой РНК, гРНК может быть закодирована последовательностью ДНК на полинуклеотидной молекуле, такой как плазмида, линейный конструкт, или кодирующая последовательность может находиться в модифицирующей кассете и быть под контролем конститутивного промотора, или в некоторых вариантах осуществления, и предпочтительно, индуцируемого промотора, описанного ниже.
[00134] Нуклеиновая кислота-гид содержит направляющую последовательность, при этом направляющая последовательность представляет собой полинуклеотидную последовательность, имеющую достаточную степень комплементарности с последовательностью-мишенью для гибридизации с последовательностью-мишенью, и направлять за счет специфического для последовательности связывания находящуюся в комплексе направляемую нуклеиновой кислотой нуклеазу на последовательность-мишень. Степень комплементарности между направляющей последовательностью и соответствующей последовательностью-мишенью, при оптимальном выравнивании с использованием соответствующего алгоритма выравнивания, составляет примерно или более примерно 50%, 60%, 75%, 80%, 85%, 90%, 95%, 97,5%, 99%, или более. Оптимальное выравнивание можно определять с использованием любого подходящего алгоритма для выравнивания последовательностей. В некоторых вариантах осуществления направляющая последовательность имеет длину примерно или более примерно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 75, или более, нуклеотидов. В некоторых вариантах осуществления направляющая последовательность имеет длину менее чем примерно 75, 50, 45, 40, 35, 30, 25, 20 нуклеотидов. Предпочтительно, направляющая последовательность имеет длину 10-30 или 15-20 нуклеотидов, или 15, 16, 17, 18, 19 или 20 нуклеотидов.
[00135] В настоящих способах и композициях нуклеиновая кислота-гид предоставлена в виде последовательности, которая будет экспрессироваться с плазмиды или вектора, и содержит как направляющую последовательность, так и каркасную последовательность, в виде одного транскрипта под контролем промотора, и в некоторых вариантах осуществления индуцируемого промотора. Нуклеиновая кислота-гид может быть сконструирована для направления на нужную последовательность-мишень за счет изменения направляющей последовательности таким образом, что направляющая последовательность становится комплементарна нужной последовательности-мишени, вследствие чего происходит гибридизация между направляющей последовательностью и последовательностью-мишенью. Как правило, для создания модификации в последовательности-мишени комплекс гРНК/нуклеаза связывается с последовательностью-мишенью, определяемой РНК-гидом, и нуклеаза узнает последовательность прилегающего к протоспейсеру мотива (PAM) вблизи последовательности-мишени. Последовательность-мишень может представлять собой любой полинуклеотид, эндогенный или экзогенный для прокариотической или эукариотической клетки, или in vitro. Например, последовательность-мишень может представлять собой полинуклеотид, находящийся в ядре эукариотической клетки. Последовательность-мишень может представлять собой последовательность, кодирующую генный продукт (например, белок), или не кодирующую последовательность (например, регуляторный полинуклеотид, интрон, PAM или «избыточную» ДНК).
[00136] Нуклеиновая кислота-гид может быть частью модифицирующей кассеты, которая кодирует донорскую нуклеиновую кислоту. Альтернативно, нуклеиновая кислота-гид может не быть частью модифицирующей кассеты, и вместо этого может быть закодирована на каркасе движущего или модифицирующего вектора. Например, последовательность, кодирующая нуклеиновую кислоту-гид, может быть сначала собрана или вставлена в каркас вектора, с последующей вставкой донорской нуклеиновой кислоты, например, в модифицирующую кассету. В других случаях донорская нуклеиновая кислота, например, в модифицирующей кассете, может быть сначала вставлена, или собрана, в каркас вектора, с последующей вставкой последовательности, кодирующей нуклеиновую кислоту-гид. В других случаях последовательность, кодирующую нуклеиновую кислоту-гид, и донорскую нуклеиновую кислоту (вставленную, например, в модифицирующую кассету) одновременно, но отдельно, вставляют, или собирают в вектор. В других вариантах осуществления обе из последовательности, кодирующей нуклеиновую кислоту-гид, и последовательности, кодирующей донорскую нуклеиновую кислоту, включают в модифицирующую кассету.
[00137] Последовательность-мишень связана с прилегающим к протоспейсеру мотивом (PAM), который представляет собой короткую нуклеотидную последовательность, узнаваемую комплексом гРНК/нуклеаза. Точная предпочтительная последовательность PAM и требования к длине варьируются для разных направляемых нуклеиновой кислотой нуклеаз; однако PAM, как правило, представляют собой последовательности из 2-7 пар нуклеотидов, примыкающие к, или находящиеся вблизи, последовательности-мишени, и, в зависимости от нуклеазы, они могут находиться в 5' или 3'-положении относительно последовательности-мишени. Модификация PAM-взаимодействующего домена направляемой нуклеиновой кислотой нуклеазы может позволить изменять специфичность для PAM, повышать точность узнавания сайта-мишени, снижать точность узнавания сайта-мишени или повышать универсальность направляемой нуклеиновой кислотой нуклеазы. В конкретных вариантах осуществления модификация в геноме последовательности-мишени как вносит желаемое изменение ДНК в последовательность-мишень, например, геномную ДНК клетки, так и удаляет, вносит мутацию или делает неактивной область прилегающего к протоспейсеру мотива (PAM) в последовательности-мишени. Инактивация PAM в последовательности-мишени предотвращает дополнительную модификацию генома клетки в данной последовательности-мишени, например, при последующем воздействии направляемой нуклеиновой кислотой нуклеазы в комплексе с синтетической нуклеиновой кислотой-гидом в более поздних раундах генетической модификации. Таким образом, клетки с модифицированной желаемой последовательностью-мишенью и измененным PAM могут быть отобраны с использованием направляемой нуклеиновой кислотой нуклеазы в комплексе с синтетической нуклеиновой кислотой-гидом, комплементарной последовательности-мишени. В клетках, не подвергшихся первому событию модификации, будет происходить разрезание с внесением двухцепочечного разрыва ДНК и, следовательно, они больше не будут жизнеспособными. В клетках, имеющих желаемую модификацию последовательности-мишени и изменение PAM, не будет происходить разрезание ДНК, поскольку эти генетически модифицированные клетки больше не содержат необходимый сайт PAM, и они будут продолжать расти и размножаться.
[00138] Диапазон последовательностей-мишеней, которые могут узнавать направляемые нуклеиновой кислотой нуклеазы, ограничен необходимостью в конкретных PAM, расположенных вблизи желаемой последовательности-мишени. В результате часто может быть сложно направлять модификации с точностью, которая необходима для генетической модификации генома. Установлено, что нуклеазы могут узнавать некоторые PAM очень хорошо (например, канонические PAM), а другие PAM менее хорошо или плохо (например, неканонические PAM). Поскольку способы, раскрытые в настоящем документе, позволяют идентифицировать генетически модифицированные клетки на фоне генетически не модифицированных клеток, способы позволяют идентифицировать генетически модифицированные клетки, в которых PAM не совсем оптимальны; то есть, способы идентификации генетически модифицированных клеток по настоящему изобретению позволяют идентифицировать генетически модифицированные клетки, даже если эффективность генетической модификации очень низка. Кроме того, настоящие способы расширяют диапазон последовательностей-мишеней, которые могут быть генетически модифицированы, поскольку модификации легче идентифицировать, в том числе в клетках, в которых модификации генома связаны с менее функциональными PAM.
[00139] Что касается нуклеазного компонента системы генетической модификации с направляемой нуклеиновой кислотой нуклеазой, полинуклеотидная последовательность, кодирующая направляемую нуклеиновой кислотой нуклеазу, может быть кодон-оптимизирована для экспрессии в клетках конкретных типов, таких как клетки архей, прокариотические или эукариотические клетки. Эукариотические клетки могут представлять собой клетки дрожжей, грибов, водорослей, растений, животных или человека. Эукариотические клетки могут представлять собой клетки, или быть получены из, конкретного организма, такого как млекопитающее, включая, но без ограничения, человека, мышь, крысу, кролика, собаку или не являющихся людьми млекопитающих, в том числе приматов. Выбор используемой направляемой нуклеиновой кислотой нуклеазы зависит от многих факторов, например, того, какой тип модификации будет произведен в последовательности-мишени и расположен ли соответствующий PAM вблизи желаемой последовательности-мишени. Нуклеазы, которые могут быть использованы в способах, описанных в настоящем документе, включают, но не ограничиваются ими, Cas 9, Cas 12/CpfI, MAD2, или MAD7 или другие MADзимы. Как и в случае нуклеиновой кислоты-гида, нуклеаза может быть закодирована последовательностью ДНК на векторе (например, движущем векторе) и находиться под контролем конститутивного или индуцируемого промотора. В некоторых вариантах осуществления последовательность, кодирующая нуклеазу, находится под контролем индуцируемого промотора, и индуцируемый промотор может быть отдельным, но таким же, как индуцируемый промотор, контролирующий транскрипцию нуклеиновой кислоты-гида; то есть, отдельные индуцируемые промоторы управляют транскрипцией последовательностей нуклеазы и нуклеиновой кислоты-гида, но два индуцируемых промотора могут быть индуцируемыми промоторами одного и того же типа (например, оба являются промоторами pL). Альтернативно, индуцируемый промотор, контролирующий экспрессию нуклеазы, может отличаться от индуцируемого промотора, контролирующего транскрипцию нуклеиновой кислоты-гида; то есть, например, нуклеаза может находиться под контролем индуцируемого промотора pBAD, и нуклеиновая кислота-гид может находиться под контролем индуцируемого промотора pL.
[00140] Другим компонентом системы с направляемой нуклеиновой кислотой нуклеазой является донорская нуклеиновая кислота. В некоторых вариантах осуществления донорская нуклеиновая кислота находится на том же полинуклеотиде (например, модифицирующем векторе или модифицирующей кассете), что и нуклеиновая кислота-гид, и может находиться (но не обязательно) под контролем того же промотора, что и нуклеиновая кислота-гид (например, одного промотора, управляющего транскрипцией как нуклеиновой кислоты-гида, так и донорской нуклеиновой кислоты). Донорская нуклеиновая кислота предназначена служить в качестве матрицы для гомологичной рекомбинации с последовательностью-мишенью, надрезанной или расщепленной направляемой нуклеиновой кислотой нуклеазой в виде части комплекса гРНК/нуклеаза. Полинуклеотид донорской нуклеиновой кислоты может иметь любую подходящую длину, например, примерно или более примерно 20, 25, 50, 75, 100, 150, 200, 500 или 1000 нуклеотидов. В некоторых предпочтительных аспектах донорская нуклеиновая кислота может быть предоставлена в виде олигонуклеотида длиной 20-300 нуклеотидов, более предпочтительно 50-250 нуклеотидов. Донорская нуклеиновая кислота содержит область, которая комплементарна части последовательности-мишени (например, гомологичный участок). При оптимальном выравнивании донорская нуклеиновая кислота перекрывается с (является комплементарной) последовательностью-мишенью по, например, примерно 20, 25, 30, 35, 40, 50, 60, 70, 80, 90 или более нуклеотидам. Во многих вариантах осуществления донорская нуклеиновая кислота содержит два гомологичных участка (области, комплементарные последовательности-мишени), фланкирующих область, содержащую мутацию или различие между донорской нуклеиновой кислотой и матрицей-мишенью. Донорская нуклеиновая кислота имеет по меньшей мере одну мутацию, или изменение, в сравнении с последовательностью-мишенью, например, вставку, делецию, модификацию, или любое их сочетание, в сравнении с последовательностью-мишенью.
[00141] Часто донорская нуклеиновая кислота предоставлена в виде модифицирующей кассеты, которая вставлена в каркас вектора, при этом каркас вектора может содержать промотор, управляющий транскрипцией гРНК, и кодирующую последовательность гРНК, или каркас вектора может содержать промотор, управляющий транскрипцией гРНК, но не саму гРНК. Кроме того, может существовать более одной, например, две, три, четыре, или более, кассет нуклеиновая кислота-гид/донорская нуклеиновая кислота, вставленных в движущий вектор, при этом все нуклеиновые кислоты-гиды находятся под контролем отдельных отличающихся промоторов, отдельных аналогичных промоторов, или при этом все пары нуклеиновая кислота-гид/донорская нуклеиновая кислота находятся под контролем одного промотора. В некоторых вариантах осуществления промотор, управляющий транскрипцией гРНК и донорской нуклеиновой кислоты (или управляющий более чем одной парой гРНК/донорская нуклеиновая кислота), представляет собой индуцируемый промотор, и промотор, управляющий транскрипцией нуклеазы, также представляет собой индуцируемый промотор. Для дополнительной информации, относящейся к модифицирующим кассетам, смотри USPN 9982278, а также USSN 15/948789; 15/116616; 15/948785; 16/056310; 16275439 и 16/275465.
[00142] Индуцируемая модификация обладает преимуществом в том, что разделенные одиночные клетки можно выращивать в течение нескольких или многих удвоений клеток до начала модификации, что увеличивает вероятность того, что клетки с модификациями будут выживать, поскольку двухцепочечные разрезы, вызываемые активной модификацией, очень токсичны для клеток. Эта токсичность приводить как к гибели клеток в генетически модифицированных колониях, так и к возможности задержки роста генетически модифицированных клеток, которые выживают, но должны пройти репарацию и восстановиться после модификации. Однако после того, как генетически модифицированные клетки получают возможность восстановиться, размер колоний генетически модифицированных клеток в итоге сравняется с размером колоний генетически не модифицированных клеток. Кроме того, нуклеиновая кислота-гид может эффективно управлять модификацией более чем одной донорской нуклеиновой кислоты в модифицирующей кассете; например, если желаемые модификации находятся близко друг к другу в последовательности-мишени.
[00143] В дополнение к донорской нуклеиновой кислоте модифицирующая кассета может содержать один или более сайтов праймеров. Сайты праймеров можно использовать для амплификации модифицирующей кассеты, используя олигонуклеотидные праймеры; например, если сайты праймеров фланкируют один или более из других компонентов модифицирующей кассеты.
[00144] Кроме того, как описано выше, донорская нуклеиновая кислота может иметь - в дополнение к по меньшей мере одной мутации относительно последовательности-мишени - одно или более изменений последовательности PAM, которые вносят мутацию, удаляют или инактивируют сайт PAM в последовательности-мишени. Изменение последовательности PAM в последовательности-мишени делает сайт PAM «иммунным» к направляемой нуклеиновой кислотой нуклеазе и защищает последовательность-мишень от дальнейших модификаций в последующих раундах генетической модификации, в случае использования той же нуклеазы.
[00145] Кроме того, модифицирующая кассета может содержать штрихкод. Штрихкод представляет собой уникальную последовательность ДНК, которая соответствует донорской последовательности ДНК, так что штрихкод может идентифицировать модификацию, внесенную в соответствующую последовательность-мишень. Штрихкод, как правило, включает четыре или более нуклеотидов. В некоторых вариантах осуществления модифицирующие кассеты содержат коллекцию донорских нуклеиновых кислот, представляющих, например, полногенные или полногеномные библиотеки донорских нуклеиновых кислот. Библиотеку модифицирующих кассет клонируют в каркасы векторов, при этом, например, каждая отдельная донорская нуклеиновая кислота связана с отдельным штрихкодом.
[00146] Кроме того, в некоторых вариантах осуществления экспрессионный вектор, или кассета, кодирующий компоненты системы с направляемой нуклеиновой кислотой нуклеазой, дополнительно кодирует направляемую нуклеиновой кислотой нуклеазу, содержащую одну или более последовательностей ядерной локализации (NLS), например, примерно или более примерно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, или более, NLS. В некоторых вариантах осуществления сконструированная нуклеаза содержит NLS на амино-конце, или вблизи него, NLS на карбоксильном конце, или вблизи него, либо их сочетание.
[00147] Движущий и модифицирующий векторы содержат последовательности контроля, функционально связанные с последовательностями транскрибируемых компонентов. Как отмечено выше, промоторы, управляющие транскрипцией одного или более компонентов системы генетической модификации с направляемой нуклеиновой кислотой нуклеазой, могут быть индуцируемыми. Был разработан целый ряд систем контроля регуляции генов для контролируемой экспрессии генов в растительных, микробных и животных клетках, включая клетки млекопитающих, в том числе промотор pL (индуцируемый тепловой инактивацией репрессора CI857), промотор pBAD (индуцируемый добавлением арабинозы в среду для роста клеток) и индуцируемый рамнозой промотор (индуцируемый добавлением рамнозы в среду для роста клеток). Другие системы включают контролируемую тетрациклином систему активации транскрипции (Tet-On/Tet-Off, Clontech, Inc. (Palo Alto, CA); Bujard and Gossen, PNAS, 89(12):5547-5551 (1992)), систему, индуцируемую переключением Lac (Wyborski et al., Environ Mol Mutagen, 28(4):447-58 (1996); DuCoeur et al., Strategies 5(3):70-72 (1992); патент США № 4833080), экдизон-индуцируемую систему генной экспрессии (No et al., PNAS, 93(8):3346-3351 (1996)), систему переключения гена cumate (Mullick et al., BMC Biotechnology, 6:43 (2006)) и тамоксифен-индуцируемую систему генной экспрессии (Zhang et al., Nucleic Acids Research, 24:543-548 (1996)), а также и другие. В настоящих способах, используемых в модулях и приборах, описанных в настоящем документе, предпочтительно, если по меньшей мере один из компонентов системы генетической модификации с направляемой нуклеиновой кислотой нуклеазой (например, нуклеаза и/или гРНК) находится под контролем промотора, который активируется повышением температуры, поскольку такой промотор может быть активирован повышением температуры и дезактивирован снижением температуры, таким образом, «выключая» процесс модификации. Следовательно, в случае промотора, который дезактивируется снижением температуры, модификацию в клетке можно выключать, не меняя среду для удаления, например, индуцирующего биохимического средства в среде, которое используют для индукции модификации.
Автоматизированные приборы для генетической модификации клеток и модули для создания библиотек клеточного поверхностного дисплея
Автоматизированные приборы для генетической модификации клеток
[00148] На ФИГ. 4A представлен иллюстративный автоматизированный многомодульный прибор для обработки клеток 400, например, для выполнения одного из иллюстративных технологических процессов, описанных выше, а также дополнительные иллюстративные модули. Прибор 400, например, может быть, и предпочтительно является, сконструированным в виде настольного прибора для использования в условиях лаборатории. Прибор 400 может включать смесь повторно используемых и одноразовых элементов для выполнения различных стадийных процессов в проведении автоматизированного расщепления и/или модификации генома в клетках. Показана платформа 402, обеспечивающая автоматизированную систему механического движения (привод) (не показано), которая обеспечивает контроль движения по оси XYZ, например, для автоматизированной рабочей станции дозирования жидкостей 458, включающей, например, поршневую пипетку, а также модули автоматизированного многомодульного прибора для обработки клеток 400. В некоторых автоматизированных многомодульных приборах для обработки клеток поршневой пипеточный дозатор 432 движется с платформой 402, а различные модули и картриджи для реагентов остаются стационарными; однако в других вариантах осуществления рабочая станция дозирования жидкостей может оставаться стационарной, в то время как различные модули движутся. В автоматизированный многомодульный прибор для обработки клеток 400 также включен картридж для реагентов 410, включающий резервуары 412, и модуль для трансформации 430, а также картридж для промывания 404, включающий резервуары 406. Картридж для промывания 404 может быть спроектирован для вмещения больших пробирок, например, промывающих растворов, или растворов, которые используют часто на всем протяжении итеративного процесса. В одном примере картридж для промывания 404 может быть спроектирован, чтобы оставаться на месте, когда два или более картриджей для реагентов 410 последовательно используют и заменяют. Хотя картридж для реагентов 410 и картридж для промывания 404 показаны на Фигуре 4A в виде отдельных картриджей, содержимое картриджа для промывания 404 может быть включено в картридж для реагентов 410. Примечание: в данном варианте осуществления модуль для трансформации 430 содержится внутри картриджа для реагентов 410; однако в альтернативных вариантах осуществления модуль для трансформации 430 содержится в своем собственном модуле или может быть частью другого модуля, такого как ростовой модуль.
[00149] Картриджи для промывания и для реагентов 404 и 410 в некоторых вариантах осуществления представляют собой одноразовые наборы, используемые в автоматизированном многомодульном приборе для генетической модификации клеток 400. Например, пользователь может открывать и размещать каждый из картриджа для реагентов 410 и картриджа для промывания 404 в шасси автоматизированного многомодульного прибора для генетической модификации клеток перед активацией обработки клеток.
[00150] Также представлена роботизированная система для манипуляций 458, включающая платформу 402 и поршневой пипеточный дозатор 432. В некоторых примерах роботизированная система для манипуляций 458 может включать автоматизированную рабочую станцию дозирования жидкостей, такую как те, которые производит компания Tecan Group Ltd. в Mannedorf, Switzerland, Hamilton Company в Reno, NV (смотри, например, WO2018015544A1), или Beckman Coulter, Inc. в Fort Collins, CO. (смотри, например, US20160018427A1). Наконечники пипетки могут быть предоставлены в блоке наконечников для пипетки (не показано) для использования с поршневым пипеточным дозатором 432.
[00151] В некоторых вариантах осуществления компоненты картриджей 404, 410 маркированы машиночитаемыми знаками (не показано), такими как штрихкоды, для узнавания роботизированной системой для манипуляций 458. Например, роботизированная система для манипуляций 458 может сканировать контейнеры в каждом из картриджей 404, 410 для подтверждения содержимого. В других вариантах осуществления машиночитаемые знаки могут быть нанесены на каждый из картриджей 404, 410, и система обработки информации 426 (показана на ФИГ. 4D) автоматизированного многомодульного прибора для генетической модификации клеток 400 может определять хранящуюся карту материалов на основе машиночитаемых знаков. Иллюстративный автоматизированный многомодульный прибор для обработки клеток 400 на Фигуре 4A дополнительно включает ростовой модуль для клеток 434. (Примечание: все модули, кратко перечисленные здесь, подробно описаны ниже). В варианте осуществления, проиллюстрированном на Фигуре 4A, ростовой модуль для клеток 434 включает две бутыли для роста клеток 418, 420 (описанные более подробно ниже, применительно к ФИГ. 5A-5D), а также модуль для концентрирования клеток 422 (описан более подробно применительно к ФИГ. 6A-6F). В альтернативных вариантах осуществления модуль для концентрирования клеток 422 может быть отделен от ростового модуля для клеток 434, например, находиться в отдельном специальном модуле. Также показан в виде части автоматизированного многомодульного прибора для обработки клеток 400 на Фигуре 4A необязательный модуль для обогащения 440, обслуживаемый, например, роботизированной системой для манипуляций 458 и поршневым пипеточным дозатором 432. Также можно видеть необязательный модуль для сборки/обессоливания нуклеиновых кислот 414, включающий реакционную камеру или бокс для пробирок (не показано) и магнит 416, позволяющий очищать нуклеиновые кислоты с использованием, например, магнитных гранул для твердофазной обратимой иммобилизации (SPRI) (Applied Biological Materials Inc., Richmond, BC). Ростовой модуль для клеток, модуль для концентрирования клеток, модуль для трансформации, модуль для обогащения, картридж для реагентов и сборочный модуль для нуклеиновых кислот описаны более подробно ниже.
[00152] На ФИГ. 4B представлен вид сверху передней части иллюстративного многомодульного прибора для обработки клеток 400, представленного на ФИГ. 4A. Исходные материалы в картриджах (например, в картридже для реагентов 410), например, могут быть размещены в предназначенных для этого областях на платформе 402 прибора 400 в зоне доступа для роботизированного устройства для манипуляций (не показано на этой фигуре). Как показано на ФИГ. 4B, платформа 402 может включать защитную раковину, так что содержимое, которое разливается, капает или переливается из любого из модулей прибора 400, находятся под кромкой защитной раковины. Помимо картриджа для реагентов 410 на ФИГ. 4B также виден картридж для промывания 404, необязательный модуль для обогащения 440 и часть ростового модуля 434. На данном изображении также видны сенсорный дисплей 450, блок управления модуля для трансформации 438, шасси электронных плат 436 и система обработки информации 426.
[00153] На ФИГ. 4C-4D показаны многомодульные приборы для обработки клеток 480, включающие шасси 490 для использования в настольных вариантах прибора для генетической модификации клеток 480. Например, шасси 490 может иметь ширину примерно 24-48 дюймов, высоту примерно 24-48 дюймов и глубину примерно 24-48 дюймов. Шасси 490 может быть, и предпочтительно является, спроектированным для размещения нескольких модулей и одноразовых принадлежностей, используемых в процессе автоматизированной обработки клеток. Кроме того, на шасси 490 может быть установлена роботизированная система для манипуляций 458 для перемещения материалов между модулями.
[00154] Как показано, шасси 490 включает крышку с рукояткой 454 и петлями 456a-456c для подъема крышки и получения доступа к внутренней части шасси 490. Охлаждающая решетка 464 обеспечивает поток воздуха через внутренний вентилятор (не показано). Кроме того, шасси 490 поднимается на регулируемых ножках 470 (показаны ножки 470 a-c). Ножки 470a-470c, например, могут обеспечить дополнительный поток воздуха под шасси 490. В некоторых вариантах осуществления кнопка управления 466 позволяет одним нажатием на кнопку запускать и/или останавливать автоматизированный процесс обработки клеток на шасси 490.
[00155] Внутри шасси 490, в некоторых вариантах осуществления, роботизированная система для манипуляций 458 расположена вдоль платформы 402 над картриджами для материалов 404 и 410. Схема управления, трубки подачи жидкости, элементы управления воздушным насосом, клапаны, тепловые блоки (например, блоки нагрева и охлаждения) и другие механизмы управления в некоторых вариантах осуществления расположены ниже платформы шасси 490, в области блока управления 468. На ФИГ. 4D также виден модуль для обогащения 440 и сборочный модуль для нуклеиновых кислот 414, включающий магнит 416.
[00156] Хотя это не показано, в некоторых вариантах осуществления экран дисплея может быть расположен на передней панели шасси 490, например, поверх части крышки (например, смотри ФИГ. 4B). На экране дисплея может отображаться информация для пользователя, касающаяся статуса обработки в автоматизированном многомодульном приборе для генетической модификации клеток. В другом примере на экране дисплея может отображаться вводная информация от пользователя для проведения обработки клеток.
Ротационный ростовой модуль для клеток
[00157] На ФИГ. 5A представлен один вариант осуществления ротационной ростовой бутыли 500, используемой с устройством для выращивания клеток, описанным в настоящем документе. Ротационная ростовая бутыль представляет собой оптически прозрачный контейнер, имеющий открытый конец 504 для приема жидкой среды и клеток, центральную область бутыли 506, которая составляет основной контейнер для выращивания клеток, коническую, переходящую в суженную, область 518, заключающую в себе по меньшей мере один световой путь 510, закрытый конец 516 и механизм включения привода 512. Ротационная ростовая бутыль имеет центральную продольную ось 520, вокруг которой вращается бутыль, и световой путь 510 обычно перпендикулярен продольной оси бутыли. Первый световой путь 510 расположен в нижней суженной части конической, переходящей в суженную, области 518. Необязательно, некоторые варианты осуществления ротационной ростовой бутыли 500 имеют второй световой путь 508 в конической части конической, переходящей в суженную, области 518. Оба световые пути в данном варианте осуществления расположены в области ротационной ростовой бутыли, которая постоянно заполнена клеточной культурой (клетки+ростовая среда), и на них не влияет скорость вращения ростовой бутыли. Первый световой путь 510 короче, чем второй световой путь 508, что позволяет точно измерять значения OD, когда значения OD культуры клеток в бутыли находятся на высоком уровне (например, на более поздней стадии процесса роста клеток), в то время как второй световой путь 508 позволяет точно измерять значения OD, когда значения OD культуры клеток в бутыли находятся на низком уровне (например, на более ранней стадии процесса роста клеток). Также показана кромка 502, которая позволяет ротационной ростовой бутыли сидеть в ростовом модуле (не показано) и, кроме того, упрощает манипуляции для пользователя.
[00158] В некоторых конфигурациях ротационной ростовой бутыли ротационная ростовая бутыль имеет две или более «лопастей» или внутренних элементов, находящихся в ротационной ростовой бутыли, выступающих от внутренней стенки ротационной ростовой бутыли к центру центральной области бутыли. В некоторых аспектах ширина лопастей или элементов варьируется в зависимости от размера или объема ротационной ростовой бутыли, и может находиться в диапазоне от 1/20 до чуть больше 1/3 диаметра ротационной ростовой бутыли, или от 1/15 до 1/4 диаметра ротационной ростовой бутыли, или от 1/10 до 1/5 диаметра ротационной ростовой бутыли. В некоторых аспектах длина лопастей варьируется в зависимости от размера или объема ротационной ростовой бутыли, и может находиться в диапазоне от 4/5 до 1/4 длины основного корпуса ротационной ростовой бутыли, или от 3/4 до 1/3 длины основного корпуса ротационной ростовой бутыли, или от 1/2 до 1/3 длины основного корпуса ротационной ростовой бутыли. В других аспектах могут быть концентрические ряды выступающих элементов, расположенных на внутренней поверхности основного корпуса ротационной ростовой бутыли, организованные горизонтально или вертикально; и в других аспектах может быть использована спиральная конфигурация выступающих элементов, расположенных на внутренней поверхности основного корпуса ротационной ростовой бутыли. В альтернативных аспектах концентрические ряды выступающих элементов, или спиральная конфигурация, могут располагаться на стойке или в центре ротационной ростовой бутыли. Хотя выше описаны две лопасти, ротационная ростовая бутыль может иметь 3, 4, 5, 6 или более лопастей, и вплоть до 20 лопастей. Количество лопастей будет зависеть, например, от размера или объема ротационной ростовой бутыли. Лопасти могут быть расположены симметрично в виде одной лопасти, выступающей от внутренней стенки бутыли внутрь бутыли, или лопасти могут быть симметрично собраны в группы по 2, 3, 4 или более лопастей в группе (например, пара лопастей напротив другой пары лопастей), выступающие от внутренней стенки бутыли внутрь бутыли. В другом варианте осуществления лопасти могут выступать из середины ротационной ростовой бутыли по направлению к стенкам ротационной ростовой бутыли, например, от стойки или другой опорной конструкции во внутренней части ротационной ростовой бутыли.
[00159] Механизм включения привода 512 связан с мотором (не показан) для вращения бутыли. В некоторых вариантах осуществления мотор приводит в действие механизм включения привода 512 таким образом, что ротационная ростовая бутыль вращается только в одном направлении, и в других вариантах осуществления ротационная ростовая бутыль вращается в первом направлении в течение первого периода времени или с одной периодичностью, вращается во втором направлении (то есть противоположном направлении) в течение второго периода времени или со второй периодичностью, и данный процесс может повторяться так, что ротационная ростовая бутыль (и содержащаяся в ней культура клеток) подвергается колебательным движениям. Первый период времени и второй период времени могут быть одинаковыми или могут быть разными. Период времени может составлять 1, 2, 3, 4, 5 или более секунд, или может составлять 1, 2, 3, 4 или более минут. В другом варианте осуществления на ранней стадии роста клеток ротационная ростовая бутыль может колебаться с первой периодичностью (например, каждые 60 секунд), а затем на более поздней стадии роста клеток ротационная ростовая бутыль может колебаться со второй периодичностью (например, каждую секунду), отличающейся от первой периодичности.
[00160] Ротационная ростовая бутыль 500 может быть многоразового использования или, предпочтительно, ротационная ростовая бутыль является расходным материалом. В некоторых вариантах осуществления ротационная ростовая бутыль является расходным материалом и предоставляется пользователю предварительно заполненной ростовой средой, при этом бутыль герметично закрыта на открытом конце 504 пломбой из фольги. Заполненная средой ротационная ростовая бутыль, упакованная таким образом, может быть частью набора для использования с автономным устройством для выращивания клеток или с ростовым модулем для клеток, который является частью автоматизированного многомодульного прибора для обработки клеток. Для введения клеток в бутыль пользователю нужно лишь отобрать пипеткой нужный объем клеток и, используя наконечник пипетки, проколоть пломбу из фольги в бутыли. Открытый конец 504 может, необязательно, иметь выступающую кромку 502 для наложения на края и размещения в устройстве для выращивания клеток (не показано). В автоматизированных системах ротационная ростовая бутыль 500 может быть маркирована штрихкодом или другим средством идентификации, которое может быть считано сканером, или камерой, являющимися частью автоматизированной системы (не показано).
[00161] Объем ротационной ростовой бутыли 500 и объем клеточной культуры (включая ростовую среду) могут сильно варьироваться, однако объем ротационной ростовой бутыли 500 должен быть достаточно большим, чтобы клеточная культура в ростовой бутыли имела достаточную аэрацию при вращении бутыли. На практике объем ротационной ростовой бутыли 500 может находиться в диапазоне 1-250 мл, 2-100 мл, 5-80 мл, 10-50 мл, или 12-35 мл. Аналогично, объем клеточной культуры (клетки+ростовая среда) должен быть соответствующим для обеспечения надлежащей аэрации в ротационной ростовой бутыли. Таким образом, объем клеточной культуры должен составлять примерно 10-85% от объема ростовой бутыли или 20-60% от объема ростовой бутыли. Например, для 35-мл ростовой бутыли объем клеточной культуры может составлять от примерно 4 мл до примерно 27 мл, или от 7 мл до примерно 21 мл.
[00162] Ротационная ростовая бутыль 500 предпочтительно изготовлена из биосовместимого оптически прозрачного материала - или по меньшей мере часть бутыли, где находится световой путь(и), является прозрачной. Кроме того, материал, из которого изготовлена ротационная ростовая бутыль, должен поддаваться охлаждению до примерно 4°C или ниже, и нагреванию до примерно 55°C или выше, для возможности как проведения термических клеточных анализов, так и долгосрочного хранения при низких температурах. Кроме того, материал, используемый для изготовления бутыли, должен быть способен выдерживать температуры вплоть до 55°C без деформации при вращении. Подходящие материалы включают стекло, поливинилхлорид, полиэтилен, полиамид, полиэтилен, полипропилен, поликарбонат, поли(метилметакрилат (PMMA)), полисульфон, полиуретан, а также сополимеры этих и других полимеров. Предпочтительные материалы включают полипропилен, поликарбонат или полистирол. В некоторых вариантах осуществления ротационная ростовая бутыль изготовлена недорогим способом, например, литьем под давлением или прессованием.
[00163] На ФИГ. 5B-5D представлен вариант осуществления ростового модуля для клеток 550, включающего ротационную ростовую бутыль 500. На ФИГ. 5B представлен вид в перспективе одного варианта осуществления устройства для выращивания клеток 550. На ФИГ. 5C представлен вид в разрезе устройства для выращивания клеток 550 с ФИГ. 5B. На обеих фигурах ротационная ростовая бутыль 500 видна расположенной внутри основного корпуса 526, с выступающей кромкой 502 ротационной ростовой бутыли 500, выступающей над основным корпусом 526. Кроме того, боковые корпуса 522, нижний корпус 532 и фланцы 524 указаны на обеих фигурах. Фланцы 524 используют для соединения устройства для выращивания клеток с нагревательными/охлаждающими устройствами или другой конструкцией (не показано). На ФИГ. 5C показана дополнительная деталь. На ФИГ. 5C верхний подшипник 542 и нижний подшипник 530 показаны расположенными в основном корпусе 526. Верхний подшипник 542 и нижний подшипник 530 поддерживают вертикальную нагрузку ротационной ростовой бутыли 500. Нижний корпус 532 содержит приводной двигатель 536. Устройство для выращивания клеток на ФИГ. 5C имеет два световых пути, основной световой путь 534 и второстепенный световой путь 530. Световой путь 534 соответствует световому пути 510, находящемуся в суженной части конической, переходящей в суженную, области ротационной ростовой бутыли, и световой путь 530 соответствует световому пути 508 в конической части конической, переходящей в суженную, области ротационной ростовой бутыли. Световые пути 510 и 508 не показаны на ФИГ. 5C, но могут быть видны, например, на ФИГ. 5A. Помимо световых путей 534 и 530, имеется эмиссионная плата 528 для освещения светового пути(ей), и детекторная плата 546 для обнаружения света после прохождения света через жидкость для культивирования клеток в ротационной ростовой бутыли.
[00164] Мотор 536, используемый для вращения ротационной ростовой бутыли 500, в некоторых вариантах осуществления представляет собой бесщеточный электродвигатель постоянного тока со встроенными элементами управления приводом, которые можно настроить на поддержание постоянного числа оборотов в минуту (об/мин) от 0 до примерно 3000 об/мин. Альтернативно, можно использовать и моторы других видов, такие как шаговый двигатель, сервопривод, щеточный электродвигатель постоянного тока и тому подобное. Необязательно, мотор 506 также может иметь переключатель направления для изменения на противоположное направления вращения, а также тахометр для определения и выдачи информации о точном количестве об/мин. Мотор контролируется процессором (не показано) в соответствии, например, со стандартными протоколами, запрограммированными в процессоре и/или внесенными пользователем, и мотор может быть спроектирован для изменения количества об/мин для инициации осевого прецессионного движения клеточной культуры, за счет чего усиливается перемешивание, например, для предотвращения агрегации клеток, увеличения аэрации и оптимизации дыхания клеток.
[00165] Основной корпус 526, боковые корпуса 522 и нижний корпус 532 устройства для выращивания клеток 550 могут быть изготовлены из любого подходящего прочного материала, включая алюминий, нержавеющую сталь и другие теплопроводящие материалы, включая пластмассы. Эти конструкции, или их части, могут быть изготовлены различными методами, такими как формообразование из листового металла, литье под давлением, создание структурных слоев, которые сплавляют вместе, и так далее. При том, что предусмотрено, что ротационная ростовая бутыль в некоторых вариантах осуществления может быть использована повторно, но предпочтительно является расходным материалом, остальные компоненты устройства для выращивания клеток 550 предпочтительно являются пригодными для многократного использования и могут работать в качестве автономного настольного устройства или, как в настоящем документе, в качестве модуля в многомодульной системе обработки клеток.
[00166] Процессор (не показано) системы для роста клеток может быть запрограммирован информацией для использования в качестве «холостой пробы» или контроля для растущей клеточной культуры. «Холостая проба» или контроль представляет собой емкость, содержащую только ростовую среду для клеток, которая соответствует 100% пропускания света и 0 OD, в то время как образец с клетками будет отклонять световые лучи и будет иметь более низкий процент пропускания и более высокое значение OD. По мере роста клеток ростовая среда становится более плотной, пропускание света будет уменьшаться, и значение OD будет возрастать. Процессор системы для роста клеток может быть запрограммирован для использования значений длины волны для холостых проб, соответствующей ростовой среде, как правило, используемой при культивировании клеток (например, клеток млекопитающих, бактериальных клеток, животных клеток, дрожжевых клеток и так далее). Альтернативно, можно включать второй спектрофотометр и емкость в систему для роста клеток, при этом второй спектрофотометр используют для считывания холостой пробы через определенные интервалы времени.
[00167] На ФИГ. 5D показано устройство для выращивания клеток в виде части конструкции, включающей устройство для выращивания клеток с ФИГ. 5B в сочетании с источником света 590, детектором 592 и термическими компонентами 594. Ротационная ростовая бутыль 500 вставлена в устройство для выращивания клеток. Компоненты источника света 590 и детектора 592 (например, например, фотодиод с регулировкой усиления для покрытия 5 log) соединены с основным корпусом устройства для выращивания клеток. Показан нижний корпус 532, вмещающий мотор, который вращает ротационную ростовую бутыль, а также один из фланцев 524, который закрепляет устройство для выращивания клеток в конструкции. Также показано устройство Пелтье, или термоэлектрическое охлаждающее устройство 594. В данном варианте осуществления терморегулирование осуществляется путем присоединения, и электрической интеграции, устройства для выращивания клеток 500 к термическому устройству 594 через фланец 504 на основании нижнего корпуса 532. Термоэлектрические охлаждающие устройства способны «перекачивать» тепло в обе стороны от соединения, либо охлаждая поверхность, либо нагревая поверхность в зависимости от направления электрического тока. В одном варианте осуществления температурный датчик используют для измерения температуры основного корпуса, а затем, посредством стандартного электронного пропорционально-интегрально-дифференцирующего (ПИД) регулятора температура ротационной ростовой бутыли 500 контролируется до ± 0,5°C.
[00168] В конкретных вариантах осуществления модуль подведения питания, установленный на задней панели, содержит предохранители и выключатель, который при включении питает внутренние источники питания переменного и постоянного тока (не показаны), активируя процессор. Измерения оптической плотности (OD) в заданные интервалы времени выполняются с использованием светоизлучающего диода (LED) с длиной волны 600 нм (не показан), который связан оптоволокном с нижней суженной частью ротационной ростовой бутыли, которая содержит интересующие клетки. Свет проходит через собирающую оптику в систему детекции, которая состоит из (цифрового) силиконового фотодиода с регулируемым усилением. Как правило, оптическая плотность обычно отображается как абсолютное значение логарифма с основанием 10 коэффициентов передачи по мощности оптического аттенюатора: OD = -log10 (выходная мощность/входная мощность). Поскольку значение OD является мерой оптического затухания - то есть суммой поглощения, рассеяния и отражения - при измерении OD в устройстве для выращивания клеток регистрируется общая передача энергии, так что по мере того, как клетки растут, и популяция становится более плотной, значение OD (потеря сигнала) возрастает. Система OD заранее откалибрована против стандартов OD, и эти значения хранятся во встроенной памяти, доступной для программы измерения.
[00169] При использовании системы клетки инокулируют (клетки могут быть перенесены пипеткой, например, автоматизированной рабочей станцией дозирования жидкостей или пользователем) в ростовую среду, предварительно налитую в ротационную ростовую бутыль, путем прокалывания пломбы из фольги. Программное обеспечение устройства для выращивания клеток устанавливает контрольную температуру для роста, как правило, 30°C, затем медленно начинает вращение ротационной ростовой бутыли. Смесь клеток и ростовой среды медленно движется вертикально вверх по стенкам за счет центробежной силы, что позволяет в ротационной ростовой бутыли обеспечивать большую площадь поверхности смеси нормальным уровнем кислорода в среде. Система мониторинга роста либо непрерывно снимает показания OD, либо производит измерения OD через предварительно заданные или предварительно запрограммированные интервалы времени. Эти результаты хранятся во внутренней памяти и, если требуется, программное обеспечение строит график зависимости показаний от времени для отображения кривой роста. Если требуется усиленное перемешивание, например, для оптимизации условий роста, скорость вращения бутыли может быть изменена для инициации осевого прецессионного движения жидкости, и/или может производиться полная смена направления вращения через запрограммированные интервалы времени. Мониторинг роста может быть запрограммирован для автоматического завершения стадии роста при заданном значении OD, с последующим быстрым охлаждением смеси до более низкой температуры, подавляющей дальнейший рост.
[00170] Одним из применений устройства для выращивания клеток 550 является постоянное измерение оптической плотности растущей клеточной культуры. Одним из преимуществ описанного устройства для выращивания клеток является то, что оптическая плотность может измеряться постоянно (кинетический мониторинг) или с определенными интервалами времени; например, каждые 5, 10, 15, 20, 30 45 или 60 секунд, или каждые 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 минут. При том, что устройство для выращивания клеток было описано в контексте измерения оптической плотности (OD) растущей клеточной культуры, квалифицированный специалист, однако, должен понимать, с учетом идей, описанных в настоящей спецификации, что и другие параметры роста клеток можно измерять помимо, или вместо, значения OD клеточной культуры. Например, спектроскопия с использованием видимого, УФ или ближнего инфракрасного (NIR) света позволяет проводить мониторинг концентрации питательных веществ и/или отходов в клеточной культуре. Кроме того, спектроскопические измерения могут быть использованы для одновременного количественного определения нескольких химических веществ. Несимметричные химические соединения могут быть количественно определены путем определения характерных особенностей поглощения в ближней инфракрасной области спектра. И наоборот, симметричные химические соединения могут быть с легкостью определены количественно с помощью рамановской спектроскопии. Многие важные метаболиты, такие как глюкоза, глутамин, аммиак и лактат, имеют отчетливые спектральные характеристики в ИК-диапазоне, так что их можно с легкостью определять количественно. Количество и частоты света, поглощаемого образцом, могут быть соотнесены с типом и концентрацией химических веществ, присутствующих в образце. Каждый из этих видов измерений имеет конкретные преимущества. FT-NIR обеспечивает максимальную глубину проникновения света и может использоваться для более плотного образца. FT-сред-IR (MIR) предоставляет информацию, которая легче определяема как специфическая для определенных аналитов, поскольку эти длины волн ближе к основным значениям ИК-поглощения. FT-Раман обладает преимуществом, когда необходимо минимизировать помехи из-за воды. Другие спектральные свойства могут быть определены, например, с помощью спектроскопии диэлектрического сопротивления, видимой флуоресценции, поляризации флуоресценции или люминесценции. Кроме того, устройство для выращивания клеток может включать дополнительные датчики для измерения, например, растворенного кислорода, диоксида углерода, pH, проводимости и тому подобного.
Модуль для концентрирования клеток
[00171] На ФИГ. 6A-6I представлены вариации одного варианта осуществления кассеты для концентрирования клеток/замены буфера и модуля, в котором используется проточная фильтрация вдоль потока. В одном варианте осуществления устройства для концентрирования клеток, описанного в настоящем документе, используется проточная фильтрация вдоль потока (TFF), также известная как тангенциальная фильтрация, при которой большая часть подаваемой жидкости протекает по касательной к поверхности фильтра, тем самым уменьшая образования осадка на фильтре (ретентата) в сравнении с «тупиковым» фильтрованием, при котором подача материала происходит непосредственно на фильтр. Вторичные потоки относительно основной подачи также используются для создания сил сдвига, предотвращающих образование осадка на фильтре и засорение мембраны, таким образом приводя к максимальному извлечению частиц, как описано ниже.
[00172] Устройство TFF, описанное в настоящем документе, было разработано с учетом двух основных конструктивных соображений. Во-первых, геометрия устройства TFF приводит к фильтрованию культуры клеток на большой площади поверхности для минимизации времени обработки. Во-вторых, конструкция устройства TFF предназначена для минимизации засорения фильтра. На ФИГ. 6A представлена в общих чертах принципиальная схема 150 проточной фильтрации вдоль потока. В устройстве TFF используется проточная фильтрация вдоль потока, также известная как тангенциальная фильтрация. На ФИГ. 6A показаны клетки, проплывающие над мембраной 124, при этом поступающий поток клеток 152 в среде или буфере подается параллельно мембране 124. TFF отличается от «тупикового» фильтрования, где и поток подается, и падение давления происходит, перпендикулярно мембране или фильтру.
[00173] На ФИГ. 6B показан вид сверху нижнего элемента конструкции одного варианта осуществления устройства/модуля TFF, обеспечивающего проточную фильтрацию вдоль потока. Как можно видеть в варианте осуществления устройства TFF на ФИГ. 6B, устройство TFF 600 включает канальную структуру 616, включающую проточный канал 602b, через который протекает культура клеток. Канальная структура 616 включает один проточный канал 602b, который горизонтально раздваивается мембраной (не показано) через которую буфер или среда могут протекать, но клетки не могут. Этот конкретный вариант осуществления имеет волнистую змеевидную геометрию 614 (то есть, небольшие «изгибы» в проточном канале 602) и змеевидный «зигзагообразный» паттерн, проточный канал 602 пересекает устройство от одного конца с левой стороны устройства до другого конца с правой стороны устройства. Змеевидный паттерн позволяет производить фильтрование на большой площади поверхности относительно размера устройства и общего объема канала, в то время как волнообразность создает вторичный инерционный поток для обеспечения эффективного восстановления мембраны, предотвращая засорение мембраны. Хотя в настоящем документе приведены примеры волнообразной геометрии и змеевидного паттерна, могут быть использованы и другие конфигурации каналов при условии, что канал может быть разделен мембраной, и конфигурация канала обеспечивает поток через модуль TFF в чередующихся направлениях. В дополнение к проточному каналу 602b можно видеть порты 604 и 606 в виде части канальной структуры 616, а также пазы 608. Порты 604 собирают клетки, проходящие через канал с одной стороны мембраны (не показано) («ретентат»), и порты 606 собирают среду («фильтрат» или «пермеат»), проходящую через канал с противоположной стороны мембраны (не показано). В данном варианте осуществления в пазы 608 входят винты или другие крепежные детали (не показано), позволяющие компонентам устройства TFF быть прочно связанными друг с другом.
[00174] Длина 610 и ширина 612 канальной структуры 616 могут варьироваться в зависимости от объема клеточной культуры, которую предстоит выращивать, и оптической плотности клеточной культуры, которую предстоит концентрировать. Длина 610 канальной структуры 616, как правило, составляет от 1 мм до 300 мм или от 50 мм до 250 мм, или от 60 мм до 200 мм, или от 70 мм до 150 мм, или от 80 мм до 100 мм. Ширина канальной структуры 616, как правило, составляет от 1 мм до 120 мм или от 20 мм до 100 мм, или от 30 мм до 80 мм, или от 40 мм до 70 мм, или от 50 мм до 60 мм. Поперечная конфигурация проточного канала 102 может быть круглой, эллиптической, овальной, квадратной, прямоугольной, трапециевидной или неправильной формы. В случае квадратной, прямоугольной или другой формы с прямыми сторонами, в поперечном сечении ширина может составлять от примерно 10 мкм до 1000 мкм или от 200 мкм до 800 мкм, или от 300 мкм до 700 мкм, или от 400 мкм до 600 мкм; и высота от примерно 10 мкм до 1000 мкм или от 200 мкм до 800 мкм, или от 300 мкм до 700 мкм, или от 400 мкм до 600 мкм. Если поперечное сечение проточного канала 602 в основном круглое, овальное или эллиптическое, радиус канала может составлять от примерно 50 мкм до 1000 мкм в гидравлическом радиусе или от 5 мкм до 800 мкм в гидравлическом радиусе, или от 200 мкм до 700 мкм в гидравлическом радиусе, или от 300 мкм до 600 мкм в гидравлическом радиусе, или от примерно 200 до 500 мкм в гидравлическом радиусе.
[00175] При взгляде сверху на устройство/модуль TFF на ФИГ. 6B заметно, что имеются два порта для ретентата 604 и два порта для фильтрата 606, с одним портом каждого типа на обоих концах (например, узких концах) устройства 600. В других вариантах осуществления порты для ретентата и фильтрата могут находиться на одной и той же поверхности одного и того же элемента конструкции (например, верхнего ли нижнего элемента конструкции), или они могут находиться на боковых поверхностях конструкции. В отличие от других устройств TFF, которые функционируют непрерывно, в устройстве/модуле TFF, описанном в настоящем документе, используется периодический способ концентрирования клеток. Общий технологический процесс концентрирования клеток с использованием устройства/модуля TFF включает пропускание клеточной культуры или клеточного образца тангенциально через канальную структуру. Мембрана, разделяющая проточные каналы, удерживает клетки с одной стороны мембраны и позволяет нежелательной среде или буферу протекать через мембрану на сторону фильтрата (например, нижний элемент конструкции 620) в устройстве. В данном процессе фиксированный объем клеток в среде или буфере пропускают через устройство до сбора клеточного образца в один из портов для ретентата 604, и сбора среды/буфера, прошедшей через мембрану, через один или оба порта для фильтрата 606. Все типы прокариотических и эукариотических клеток - как прикрепляющихся, так и не прикрепляющихся - можно выращивать в устройстве TFF. Прикрепляющиеся клетки могут расти на гранулах или других клеточных каркасах, суспендированных в среде, протекающей через устройство TFF.
[00176] В процессе концентрирования клеток прохождение клеточного образца через устройство TFF и сбор клеток в одном из портов для ретентата 604, с одновременным сбором среды в одном из портов для фильтрата 606, считают «одним прохождением» клеточного образца. Перенос между резервуарами для ретентата «переворачивает» культуру. Порты для ретентата и фильтрата, собирающие клетки и среду, соответственно, для конкретного прохождения, находятся на одной и той же стороне устройства/модуля TFF 600, с гидравлическими соединениями, организованными так, что существует два отдельных слоя потока для сторон ретентата и фильтрата, но если порт для ретентата 604 находится на верхнем элементе конструкции устройства/модуля 600 (то есть, клетки движутся вдоль канала над мембраной, и фильтрат (среда) проходит в часть канала под мембраной), то порт для фильтрата 606 будет находиться на нижнем элементе конструкции устройства/модуля 100, и наоборот (то есть, если клеточный образец проходит через канал под мембраной, фильтрат (среда) проходит в часть канала над мембраной). Такую конфигурацию можно видеть более отчетливо на ФИГ. 6C - 6D, где ретентат протекает 660 от портов для ретентата 604, и фильтрат протекает 670 от портов для фильтрата 606.
[00177] После завершения «прохождения» в процессе концентрирования выросших клеток, клеточный образец собирают путем пропускания через порт для ретентата 604 и в резервуар для ретентата (не показано). Для начала другого «прохождения» клеточный образец вновь проходит через устройство TFF, на этот раз с направлением потока, обратном направлению первого прохождения. Клеточный образец собирают путем пропускания через порт для ретентата 604 и в резервуар для ретентата (не показано) на противоположном конце устройства/модуля из порта для ретентата 604, который был использован для сбора клеток в процессе первого прохождения. Аналогично, среду/буфер, которая проходит через мембрану во время второго прохождения, собирают через порт для фильтрата 606 на противоположном конце устройства/модуля от порта для фильтрата 606, который был использован для сбора фильтрата во время первого прохождения, или через оба порта. Этот чередующийся процесс прохождения ретентата (концентрированного клеточного образца) через устройство/модуль повторяют до тех пор, когда клетки концентрируются до желательного объема, и оба порта для фильтрата могут быть открыты во время прохождений для сокращения времени работы. Кроме того, замену буфера можно осуществлять путем добавления нужного буфера (или свежей среды) к клеточному образцу в резервуаре для ретентата, перед началом другого «прохождения», и повторять этот процесс до того момента, когда старая среда или буфер разбавляется и отфильтровывается, и клетки остаются в свежей среде или буфере. Следует отметить, что замену буфера и концентрирование клеток можно проводить (и, как правило, проводят) одновременно.
[00178] На ФИГ. 6C представлен вид сверху верхнего (622) и нижнего (620) элементов конструкции иллюстративного модуля TFF. Опять-таки, видны порты 604 и 606. Как отмечено выше, пазы - такие как пазы 608 на ФИГ. 6B - являются средством закрепления компонентов (верхнего элемента конструкции 622, нижнего элемента конструкции 620 и мембраны 624) устройства/мембраны TFF друг с другом в процессе работы за счет, например, винтов или других аналогичных крепежных деталей. Однако в альтернативных вариантах осуществления клей, такой как склеивающий при надавливании клей, или ультразвуковая сварка, или склеивание растворителем, можно использовать для соединения вместе верхнего элемента конструкции 622, нижнего элемента конструкции 620 и мембраны 624. Действительно, специалист в данной области, руководствуясь идеями настоящего изобретения, может обнаружить и другие конфигурации, позволяющие соединять компоненты устройства TFF, такие как, например, зажимы; парная фурнитура, находящаяся на верхнем и нижнем элементах конструкции; сочетание клеев, сварки, склеивания растворителем и парной фурнитуры; а также другие такие крепежные детали и соединительные приспособления.
[00179] Следует отметить, что имеется один порт для ретентата и один порт для фильтрата на каждом «конце» (например, узких концах) устройства/модуля TFF. Порты для ретентата и фильтрата на левой стороне устройства/модуля будут собирать клетки (поток к 660) и среду (поток к 670), соответственно, во время одного и того же прохождения. Аналогично, порты для ретентата и фильтрата на правой стороне устройства/модуля будут собирать клетки (поток к 660) и среду (поток к 670), соответственно, во время одного и того же прохождения. В данном варианте осуществления ретентат собирают из портов 604 на верхней поверхности устройства TFF, и фильтрат собирают из портов 606 на нижней поверхности устройства. Клетки остаются в проточном канале TFF над мембраной 624, в то время как фильтрат (среда) протекает через мембрану 624, а затем через порты 606; таким образом, конфигурация с верхними портами (для ретентата) и нижними портами (для фильтрата) является практичной. Следует признать, однако, что можно использовать и другие конфигурации портов для ретентата и фильтрата, например, размещение портов как для ретентата, так и для фильтрата, на боковой стороне (в отличие от верхней и нижней поверхностей) устройства TFF. На ФИГ. 6C канальную структуру 602b можно видеть на нижнем элементе конструкции 620 устройства TFF 600. Однако в других вариантах осуществления порты для ретентата и фильтрата могут находиться на одном и том же устройстве TFF.
[00180] На ФИГ. 6C также видна мембрана, или фильтр, 624. Фильтры или мембраны, подходящие для использования в устройстве/модуле TFF, являются устойчивыми к растворителям, свободными от примесей во время фильтрования и способными удерживать клетки интересующих типов или размеров. Например, для удержания мелких клеток, таких как бактериальные клетки, размеры пор должны составлять всего 0,2 мкм, однако для клеток других типов размеры пор могут составлять даже 5 мкм. Действительно, размеры пор, подходящие для использования в устройстве/модуле TFF, включают размеры пор фильтра, составляющие 0,20 мкм, 0,21 мкм, 0,22 мкм, 0,23 мкм, 0,24 мкм, 0,25 мкм, 0,26 мкм, 0,27 мкм, 0,28 мкм, 0,29 мкм, 0,30 мкм, 0,31 мкм, 0,32 мкм, 0,33 мкм, 0,34 мкм, 0,35 мкм, 0,36 мкм, 0,37 мкм, 0,38 мкм, 0,39 мкм, 0,40 мкм, 0,41 мкм, 0,42 мкм, 0,43 мкм, 0,44 мкм, 0,45 мкм, 0,46 мкм, 0,47 мкм, 0,48 мкм, 0,49 мкм, 0,50 мкм и более. Фильтры могут быть изготовлены из любого подходящего инертного материала, включая смешанные сложные эфиры целлюлозы (нитрат и ацетат целлюлозы) (CME), поликарбонат (PC), поливинилиденфторид (PVDF), полиэфирсульфон (PES), политетрафторэтилен (PTFE), нейлон, стекловолокно или металлические субстраты, как в случае лазерного или электрохимического травления. В устройстве TFF, показанном на Фигурах 6C и 6D, не показано гнездо в верхнем 612 и нижнем 620 элементах конструкции, в котором фильтр 624 может быть размещен или закреплен (например, размещен на половину толщины фильтра в каждом из верхнего 612 и нижнего 620 элементов конструкции); однако такое гнездо предусмотрено в некоторых вариантах осуществления.
[00181] На ФИГ. 6D показан вид снизу верхнего и нижнего компонентов иллюстративного модуля TFF, показанного на ФИГ. 6C. На ФИГ. 6D показан вид снизу верхнего (622) и нижнего (620) компонентов иллюстративного модуля TFF. Опять-таки видны порты 604 и 606. Вновь следует отметить, что имеется один порт для ретентата и один порт для фильтрата на каждом конце устройства/модуля. Порты для ретентата и фильтрата на левой стороне устройства/модуля будут собирать клетки (поток к 660) и среду (поток к 670), соответственно, во время одного и того же прохождения. Аналогично, порты для ретентата и фильтрата на правой стороне устройства/модуля будут собирать клетки (поток к 660) и среду (поток к 670), соответственно, во время одного и того же прохождения. На ФИГ. 6D канальную структуру 602a можно видеть на верхнем элементе конструкции 622 устройства TFF 600. Таким образом, следует отметить, что на ФИГ. 6C и 6D имеется канальная структура 602 (602a и 602b) как на верхнем, так и на нижнем, элементах конструкции, с мембраной 624 между верхней и нижней частями канальной структуры. Канальная структура 602 верхнего 622 и нижнего 620 элементов конструкции (602a и 602b, соответственно) стыкуются, создавая проточный канал с мембраной 624, расположенной горизонтально между верхним и нижним элементами конструкции проточного канала, и таким образом разделяющей проточный канал.
[00182] Замену среды (в процессе роста клеток) или замену буфера (в процессе концентрирования клеток или придания клеткам компетентности) производят в устройстве/модуле TFF путем добавления свежей среды к растущим клеткам или нужного буфера к клеткам, сконцентрированным до нужного объема; например, после того, как клетки были сконцентрированы по меньшей мере в 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз, 100 раз, 150 раз, 200 раз или более. Нужную заменяющую среду или заменяющий буфер добавляют к клеткам либо путем добавления в резервуар для ретентата, либо через мембрану со стороны фильтрата, и процесс прохождения клеток через устройство TFF 600 повторяют до того момента, когда клетки будут выращены до нужной оптической плотности, или сконцентрированы до нужного объема, в заменяющей среде, или буфере. Этот процесс можно повторять любое количество раз для достижения желаемого уровня замены буфера и желаемого объема клеток. Заменяющий буфер может содержать, например, глицерин или сорбит, что делает клетки компетентными для трансформации, помимо уменьшения общего объема клеточного образца.
[00183] Устройство TFF 600 может быть изготовлено из любого надежного материала, в котором могут быть просверлены каналы (и ответвления каналов), включая нержавеющую сталь, силикон, стекло, алюминий или пластик, в том числе цикло-олефин сополимер (COC), цикло-олефин полимер (COP), полистирол, поливинилхлорид, полиэтилен, полиамид, полиэтилен, полипропилен, акрилoнитрил-бутадиен поликарбонат, полиэфирэфиркетон (PEEK), поли(метилметилакрилат) (PMMA), полисульфон и полиуретан, а также сополимеры этих и других полимеров. Если устройство/модуль TFF является одноразовым, предпочтительно, оно выполнено из пластика. В некоторых вариантах осуществления материал, используемый для изготовления устройства/модуля TFF, является теплопроводным, так что клеточная культура может быть нагрета или охлаждена до желаемой температуры. В конкретных вариантах осуществления устройство TFF изготовлено прецизионной механической обработкой, лазерной обработкой, электроэрозионной обработкой (для металлических изделий); влажным или сухим травлением (для силиконовых устройств); сухим или влажным травлением, порошковой или пескоструйной обработкой, фотоструктурированием (для стеклянных устройств) или термоформованием, литьем под давлением, горячим тиснением или лазерной обработкой (для пластиковых устройств) с использованием материалов, указанных выше, которые поддаются этой технологии массового производства.
[00184] На ФИГ. 6E представлена иллюстративная конфигурация устройства TFF в сборке, где, как и в других конфигурациях, верхний элемент конструкции и нижний элемент конструкции в сочетании образуют канальную структуру с мембраной, расположенной между верхним и нижним элементами конструкции; однако в данной конфигурации помимо резервуаров для ретентата имеется дополнительный необязательный резервуар для буфера или среды, расположенный между резервуарами для ретентата, и нижним резервуаром для фильтрата или пермеата. В конфигурации устройства TFF 6000, показанной на ФИГ. 6E, 6044 представляет собой верхнюю часть, или крышку, устройства TFF 6000, имеющую три порта 6046, где виден конец пипетки 6048, расположенный в самом правом порту 6046. Верхняя часть 6044 устройства TFF 6000 расположена вблизи, и в процессе работы связана с комбинированной структурой резервуара и верхнего элемента конструкции 6050. Комбинированная структура резервуара и верхнего элемента конструкции 6050 имеет верхнюю поверхность, которая расположена вблизи верхней части, или крышки, 6044 устройства TFF, нижнюю поверхность, которая включает верхний элемент конструкции 6022 устройства TFF, при этом верхний элемент конструкции 6022 устройства TFF ограничивает верхнюю часть проточного канала (не показано), расположенного на нижней поверхности верхнего элемента конструкции 6022 комбинированной структуры резервуара и верхнего элемента конструкции 6050. Кроме того, комбинированная структура резервуара и верхнего элемента конструкции 6050 включает два резервуара для ретентата 6080 и необязательный резервуар для буфера или среды 6082. Резервуары для ретентата гидравлически связаны с верхней частью проточного канала, а резервуар для буфера или среды гидравлически связан с резервуарами для ретентата. На этом изображении устройства TFF 6000 в сборке также видна мембрана 6024, нижний элемент конструкции 6020, который, как описано выше, имеет на его верхней поверхности нижнюю часть канала тангенциального потока (не показано), при этом канальные структуры верхнего элемента конструкции 6022 и нижнего элемента конструкции 6020 (не показаны на данном изображении) стыкуются, образуя один проточный канал. Ниже и рядом с нижним элементом конструкции 6020 находится прокладка 6040, которая размещена между нижним элементом конструкции 6020 и необязательным резервуаром для фильтрата (или пермеата) 6042. Резервуар для фильтрата 6042 гидравлически связан с нижней частью проточного канала, в качестве вместилища для фильтрата или пермеата, который удаляется из клеточной культуры. В процессе работы верхняя часть 6044, комбинированная структура резервуара и верхнего элемента конструкции 6050, мембрана 6024, нижний элемент конструкции 6020, прокладка 6040 и резервуар для фильтрата 6042 соединены и закреплены вместе, образуя непроницаемую для жидкости и воздуха систему. Устройство TFF 1100 в сборке, как правило, имеет высоту от 4 до 25 см или высоту от 5 до 20 см, или высоту от 7 до 15 см; длину от 5 до 30 см или длину от 8 до 25 см, или длину от 10 до 20 см; и имеет глубину от 3 до 15 см или глубину от 5 до 10 см. Иллюстративное устройство TFF имеет высоту 11 см, длину 12 см и глубину 8 см. Резервуары для ретентата, резервуар для буфера или среды, и структуры, образующие канал для тангенциального потока, могут быть спроектированы для их охлаждения до 4°C для поддержания клеток. Размеры змеевидного канала, приведенные выше, а также спецификации и материалы для фильтра и устройства TFF, применимы для варианта осуществления устройства, показанного на ФИГ. 6E-6I. В вариантах осуществления, включая настоящий вариант осуществления, можно выращивать и/или фильтровать вплоть до 120 мл клеточной культуры, или можно выращивать и/или фильтровать вплоть до 100 мл, 90 мл, 80 мл, 70 мл, 60 мл, 50 мл, 40 мл, 30 мл или 20 мл клеточной культуры.
[00185] На ФИГ. 6F представлено перспективное изображение в разобранном виде устройства TFF 6000. В данной конфигурации 6044 представляет собой верхнюю часть, или крышку, устройства TFF 6000, имеющую три порта 6046, где виден конец пипетки 6048, расположенный в самом левом порту 6046. Верхняя часть 6044 устройства TFF 6000 в процессе работы связана с комбинированной структурой резервуара и верхнего элемента конструкции 6050. Комбинированная структура резервуара и верхнего элемента конструкции 6050 имеет верхнюю поверхность, которая в процессе работы расположена вблизи верхней части, или крышки, 6044 устройства TFF, нижнюю поверхность, которая включает верхний элемент конструкции 6022 устройства TFF, при этом верхний элемент конструкции 6022 устройства TFF ограничивает верхнюю часть канала тангенциального потока (не показано). Комбинированная структура резервуара и верхнего элемента конструкции 6050 включает два резервуара для ретентата 6080 и необязательный резервуар для буфера или среды 6082. Резервуары для ретентата гидравлически связаны с верхней частью проточного канала, а необязательный резервуар для буфера или среды гидравлически связан с резервуарами для ретентата. На этом изображении в разобранном виде устройства TFF 6000 также виден нижний элемент конструкции 6020, который, как описано выше, имеет на его верхней поверхности нижнюю часть канала тангенциального потока 6002b (видно на верхней поверхности нижнего элемента конструкции 6020), при этом верхняя и нижняя части канальных структур верхнего элемента конструкции 6022 и нижнего элемента конструкции 6020, соответственно, стыкуются, образуя один проточный канал (мембрана, помещенная между верхним элементом конструкции 6022 и нижним элементом конструкции 6020 в процессе работы, не показана). Под нижним элементом конструкции 6020 находится прокладка 6040, которая в процессе работы находится между нижним элементом конструкции 6020 и резервуаром для фильтрата (или пермеата) 6042. В процессе работы верхняя часть 6044, комбинированная структур резервуара и верхнего элемента конструкции 6050, мембрана (не показано), нижний элемент конструкции 6020, прокладка 6040 и резервуар для фильтрата 6042 соединены и закреплены вместе, образуя непроницаемую для жидкости и воздуха систему. На ФИГ. 6F показаны крепежные детали, которые могут быть использованы для соединения вместе разных структур (верхней части 6044, комбинированной структуры резервуара и верхнего элемента конструкции 6050, мембраны (не показано), нижнего элемента конструкции 6020, прокладки 6040 и резервуара для фильтрата 6042). Однако в качестве альтернативы винтам или другим подобным крепежным деталям различные структуры устройства TFF 6000 можно соединять при помощи клея, такого как склеивающий при надавливании клей, или ультразвуковой сварки, или склеивания растворителем. Кроме того, можно использовать сочетание крепежных деталей, клеев и/или вариантов сварки для соединения различных структур устройства TFF. Специалист в данной области, руководствуясь идеями настоящего изобретения, может обнаружить и другие конфигурации, позволяющие соединять компоненты устройства TFF 6000, такие как, например, зажимы, парная фурнитура и другие такие крепежные детали.
[00186] На ФИГ. 6G показана комбинированная структура резервуара и верхнего элемента конструкции 6050, включающая два резервуара для ретентата 6080 и необязательный резервуар для буфера или среды 6082, а также верхний элемент конструкции 6020, который находится внизу комбинированной структуры резервуара и верхнего элемента конструкции 6050. Верхний элемент конструкции 6022 устройства TFF ограничивает верхнюю часть канала тангенциального потока (не показано), расположенного на нижней поверхности комбинированной структуры резервуара и верхнего элемента конструкции 6050. На ФИГ. 6H представлен вид сверху вниз верхней поверхности комбинированной структуры резервуара и верхнего элемента конструкции 6050, показывающий верхнюю часть резервуаров для ретентата 6080 и резервуара для буфера или среды 6082, а также порты для жидкости или создания вакуума 6046. Резервуары для ретентата гидравлически связаны с верхней частью проточного канала, а резервуар для буфера или среды гидравлически связан с резервуарами для ретентата. На ФИГ. 6I представлен вид снизу вверх нижней поверхности комбинированной структуры резервуара и верхнего элемента конструкции 6050, показывающий верхний элемент конструкции 6020 с верхней частью канала тангенциального потока 6002a, находящегося на нижней поверхности верхнего элемента конструкции 6020. Проточный канал 6002a, находящийся на нижней поверхности верхнего элемента конструкции 6020, в процессе работы стыкуется с нижней частью канала тангенциального потока, находящегося на верхней поверхности нижнего элемента конструкции (не показано на данном изображении, но смотри ФИГ. 6F), при этом верхняя и нижняя части структуры проточного канала стыкуются, образуя один проточный канал.
[00187] В качестве альтернативы модулю TFF, описанному выше, можно использовать модуль для концентрирования клеток, включающий половолоконный фильтр. Примеры фильтров, подходящих для использования по настоящему изобретению, включают мембранные фильтры, керамические фильтры и металлические фильтры. Фильтр может иметь любую форму; фильтр, например, может быть цилиндрическим или практически плоским. Предпочтительно, используемый фильтр представляет собой мембранный фильтр, предпочтительно, половолоконный фильтр. Термин «полое волокно» означает трубчатую мембрану. Внутренний диаметр трубки составляет по меньшей мере 0,1 мм, более предпочтительно по меньшей мере 0,5 мм, наиболее предпочтительно по меньшей мере 0,75 мм, и, предпочтительно, внутренний диаметр трубки составляет не более 10 мм, более предпочтительно не более 6 мм, наиболее предпочтительно не более 1 мм. Фильтровальные модули, содержащие полые волокна, коммерчески доступны от различных компаний, включая G.E. Life Sciences (Marlborough, MA) и InnovaPrep (Drexel, MO). Конкретные примеры систем половолоконных фильтров, которые могут быть использованы, модифицированы или адаптированы для использования в настоящих способах и системах, включают, но без ограничения, те, которые описаны в USPN 9738918; 9593359; 9574977; 9534989; 9446354; 9295824; 8956880; 8758623; 8726744; 8677839; 8677840; 8584536; 8584535 и 8110112.
Сборочный модуль для нуклеиновых кислот
[00188] Конкретные варианты осуществления автоматизированного многомодульного прибора для генетической модификации клеток по настоящему изобретению, необязательно, включают сборочный модуль для нуклеиновых кислот. Сборочный модуль для нуклеиновых кислот предназначен для приема и сборки нуклеиновых кислот, необходимых для оказания содействия нужным событиям генетической модификации генома. Как правило, термин «вектор» означает молекулу нуклеиновой кислоты, способную переносить нужную нуклеиновую кислоту, с которой она была связана, в клетку. Векторы включают, но без ограничения, молекулы нуклеиновой кислоты, которые являются одноцепочечными, двухцепочечными или частично двухцепочечными; молекулы нуклеиновой кислоты, которые имеют один или более свободных концов, не имеют свободные концы (например, кольцевые); молекулы нуклеиновой кислоты, включающие ДНК, РНК, или и то, и другое; а также другие разновидности полинуклеотидов, известные в данной области. Одним из видов вектора является «плазмида», которая представляет собой кольцевую петлю двухцепочечной ДНК, в которую могут быть вставлены дополнительные сегменты ДНК, например, стандартными методами молекулярного клонирования. Другой тип вектора представляет собой вирусный вектор, при этом доставляемые вирусом последовательности ДНК или РНК присутствуют в векторе для упаковки в вирус (например, ретровирусы, дефектные по репликации ретровирусы, аденовирусы, дефектные по репликации аденовирусы и аденосвязанные вирусы). Вирусные векторы также включают полинуклеотиды, переносимые вирусом для трансфекции в клетку-хозяина. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальную точку начала репликации и эписомные векторы млекопитающих). Другие векторы (например, не эписомные векторы млекопитающих) встраиваются в геном клетки-хозяина после введения их в клетку-хозяина и, таким образом, реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы называют в настоящем документе «экспрессионными векторами» или «модифицирующими векторами». Обычные экспрессионные векторы, используемые в методах рекомбинантных ДНК, часто имеют форму плазмиды. Дополнительные векторы включают фосмиды, фагмиды и синтетические хромосомы.
[00189] Рекомбинантные экспрессионные векторы могут включать нуклеиновую кислоту в форме, подходящей для транскрипции, и, в случае некоторых нуклеотидных последовательностей, трансляции и экспрессии нуклеиновой кислоты в клетке-хозяине, это означает, что рекомбинантные экспрессионные векторы включают один или более регуляторных элементов - которые могут быть выбраны в зависимости от клеток-хозяев, которые будут использованы для экспрессии - функционально связанных с нуклеотидной последовательностью, которая будет экспрессироваться. В составе рекомбинантного экспрессионного вектора «функционально связанные» должно означать, что интересующая нуклеотидная последовательность связана с регуляторным элементом(ами) таким образом, который допускает транскрипцию и, в случае некоторых нуклеотидных последовательностей, трансляцию и экспрессию нуклеотидной последовательности (например, в in vitro системе транскрипции/трансляции или в клетке-хозяине, когда вектор введен в клетку-хозяина). Соответствующие методы рекомбинации и клонирования описаны в патентной публикации США № 2004/0171156, содержание которой включено в настоящий документ в полном объеме и для всех целей.
[00190] В некоторых вариантах осуществления регуляторный элемент функционально связан с одним или более элементами системы с нацеливаемой нуклеазой, для управления транскрипцией, и, в случае некоторых нуклеотидных последовательностей, трансляцией и экспрессией одного или более компонентов системы с нацеливаемой нуклеазой.
[00191] Кроме того, полинуклеотидная последовательность, кодирующая направляемую нуклеиновой кислотой нуклеазу, может быть кодон-оптимизирована для экспрессии в конкретных клетках, таких как прокариотические или эукариотические клетки. Эукариотические клетки могут представлять собой клетки дрожжей, грибов, водорослей, растений, животных или человека. Эукариотические клетки могут представлять собой клетки, или быть получены из, конкретного организма, такого как млекопитающее, включая, но без ограничения, человека, мышь, крысу, кролика, собаку или не являющихся людьми млекопитающих, в том числе приматов. Дополнительно или альтернативно, вектор может включать регуляторный элемент, функционально связанный с полинуклеотидной последовательностью, которая, будучи транскрибированной, образует РНК-гид.
[00192] Сборочный модуль для нуклеиновых кислот может быть спроектирован для осуществления широкого спектра методов сборки нуклеиновых кислот автоматизированным образом. Методы сборки нуклеиновых кислот, которые можно осуществлять в сборочном модуле для нуклеиновых кислот раскрытого в настоящем документе автоматизированного многомодульного прибора для генетической модификации клеток, включают, но без ограничения, такие методы сборки, в которых используют эндонуклеазы рестрикции, включая ПЦР, сборку BioBrick (USPN 9361427), клонирование типа IIS (например, сборку GoldenGate, Европейская патентная публикация EP 2 395 087 A1) и циклическую реакцию с лигазой (de Kok, ACS Synth Biol., 3(2):97-106 (2014); Engler, et al., PLoS One, 3(11):e3647 (2008) и USPN 6143527). В других вариантах осуществления методы сборки нуклеиновых кислот, осуществляемые в автоматизированном многомодульном приборе для генетической модификации клеток, основаны на перекрывании между соседними фрагментами нуклеиновых кислот, например, Gibson Assembly®, CPEC, SLIC, циклическая реакция с лигазой и так далее. Дополнительные методы сборки включают репарацию гэпов в дрожжах (Bessa, Yeast, 29(10):419-23 (2012)), клонирование gateway (Ohtsuka, Curr Pharm Biotechnol, 10(2):244-51 (2009)); USPN 5888732; и 6277608) и опосредуемое топоизомеразами клонирование (Udo, PLoS One, 10(9):e0139349 (2015) и USPN 6916632). Эти и другие методы сборки нуклеиновых кислот описаны, например, в публикации Sands и Brent, Curr Protoc Mol Biol., 113:3.26.1-3.26.20 (2016).
[00193] Температура сборочного модуля для нуклеиновых кислот контролируется в зависимости от типа сборки нуклеиновой кислоты, используемой в автоматизированном многомодульном приборе для генетической модификации клеток. Например, если в сборочном модуле для нуклеиновых кислот используют ПЦР, модуль имеет функцию термоциклирования, позволяющую циклически изменять температуру между этапами денатурации, отжига и удлинения. Если в сборочном модуле для нуклеиновых кислот используют методы сборки при одной температуре (например, изотермические методы сборки), модуль обеспечивает возможность достигать и поддерживать температуру, которая оптимизирует конкретный выполняемый процесс сборки. Эти температуры и продолжительность поддержания этих температур могут определяться предварительно запрограммированным набором параметров, что осуществляют при помощи скриптов, или вручную контролироваться пользователем с использованием системы обработки автоматизированного многомодульного прибора для генетической модификации клеток.
[00194] В одном варианте осуществления сборочный модуль для нуклеиновых кислот представляет собой модуль для выполнения сборки с использованием одной изотермической реакции. В некоторых изотермических методах сборки можно комбинировать одновременно до 15 фрагментов нуклеиновой кислоты на основе идентичности последовательности. В некоторых вариантах осуществления метод сборки обеспечивает сборку нуклеиновых кислот, имеющих перекрывание примерно 20-40 нуклеотидов с соседними фрагментами нуклеиновой кислоты. Фрагменты смешивают с коктейлем из трех ферментов - экзонуклеазы, полимеразы и лигазы - наряду с буферными компонентами. Поскольку процесс является изотермическим и может быть осуществлен 1-этапным или 2-этапным способом с использованием одного реакционного сосуда, изотермические реакции сборки являются идеальными для использования в автоматизированном многомодульном приборе для генетической модификации клеток. 1-этапный способ позволяет производить сборку до пяти разных фрагментов с использованием одноэтапного изотермического процесса. Фрагменты и мастер-микс ферментов объединяют и инкубируют при 50°C в течение периода времени до одного часа. Для создания более сложных конструктов с использованием до пятнадцати фрагментов, или для встраивания фрагментов от 100 п.н. до 10 т.п.н., как правило, используют 2-этапный способ, при этом для 2-этапной реакции требуется два отдельных добавления мастер-микс; одно для экзонуклеазы и этапа отжига и второе для полимеразы и этапов лигирования.
Модуль для трансформации клеток
[00195] Помимо модулей для роста клеток, концентрирования клеток и сборки нуклеиновых кислот на ФИГ. 7A - 7E представлены вариации одного варианта осуществления модуля для трансформации клеток (в данном случае, проточного устройства для электропорации), который может быть включен в прибор для выращивания/концентрирования/трансформации клеток. На ФИГ. 7A и 7B представлены: вид сверху в перспективе и вид снизу в перспективе, соответственно, шести соединенных вместе проточных устройств для электропорации 750. На ФИГ. 7A показаны шесть проточных блоков для электропорации 750, собранные на одной основе 756. Каждый из шести проточных блоков для электропорации 750 имеет лунки 752, которые представляют собой входные отверстия для клеточных образцов, и лунки 754, которые представляют собой выходные отверстия для клеточных образцов. На ФИГ. 7B представлен вид снизу в перспективе шести соединенных вместе проточных устройств для электропорации с ФИГ. 7A, на котором также видны шесть проточных блоков для электропорации 750, собранные на одной основе 756. Можно видеть шесть входных лунок 752, по одной для каждого проточного блока для электропорации 750, и можно видеть одну выходную лунку 754 (выходная лунка крайнего слева проточного блока для электропорации 750). Кроме того, на ФИГ. 7B видно входное отверстие 702, выходное отверстие 704, проточный канал 706 и два электрода 708 с каждой стороны сужения в проточном канале 706 в каждом проточном блоке для электропорации 750. После создания шести проточных блоков для электропорации 750 они могут быть отделены друг от друга (например, «отломлены») и использованы по одному или, альтернативно, в некоторых вариантах осуществления два или более проточных блоков для электропорации 750 могут быть использованы параллельно, без разделения.
[00196] В проточных устройствах для электропорации достигается высокая эффективность электропорации клеток при низкой токсичности. Проточные устройства для электропорации по изобретению могут быть особенно легко интегрированы с роботизированными инструментами для манипуляций с жидкостями, которые, как правило, используют в автоматизированных системах, например, поршневыми пипеточными дозаторами. Такие автоматизированные инструменты включают, но без ограничения, стандартные автоматизированные рабочие станции дозирования жидкостей от компаний Tecan (Mannedorf, Switzerland), Hamilton (Reno, NV), Beckman Coulter (Fort Collins, CO) и так далее.
[00197] В общих чертах, микрофлюидная электропорация - с использованием объемов клеточной суспензии менее примерно 10 мл и даже всего лишь 1 мкл - позволяет осуществлять более точный контроль над процессом трансфекции или трансформации, и допускает гибкую интеграцию с другими инструментами обработки клеток, в сравнении со стендовыми устройствами для электропорации. Таким образом, микрофлюидная электропорация предоставляет уникальные возможности, например, для трансформации, обработки и анализа одиночных клеток; создания многоблочных конфигураций устройства для электропорации; а также интегрированного, автоматизированного, многомодульного процессинга и анализа клеток.
[00198] В конкретных вариантах осуществления проточных устройств для электропорации по изобретению уровень токсичности при трансформации позволяет получать более 10% жизнеспособных клеток после электропорации, предпочтительно более 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 70%, 75%, 80%, 85%, 90%, или даже 95% жизнеспособных клеток после трансформации, в зависимости от типа клеток и нуклеиновых кислот, которые вводят в клетки.
[00199] Проточное устройство для электропорации, описанное со ссылкой на ФИГ. 7A-7E, включает корпус с камерой для электропорации, первый электрод и второй электрод, сконфигурированные для взаимодействия с генератором электрических импульсов, электрические контакты которого взаимодействуют с электродами устройства для электропорации. В конкретных вариантах осуществления устройства для электропорации являются автоклавируемыми и/или одноразовыми, и могут быть упакованы с реагентами в картридж для реагентов. Устройство для электропорации может быть спроектировано для электропорации клеток в объемах образцов от 1 мкл до 2 мл, от 10 мкл до 1 мл, от 25 мкл до 750 мкл или от 50 мкл до 500 мкл. Клетки, которые могут быть электропорированы с использованием раскрытых устройств для электропорации, включают клетки млекопитающих (в том числе клетки человека), клетки растений, дрожжей, другие эукариотические клетки, бактерии, археи и клетки других типов.
[00200] В одном иллюстративном варианте осуществления на ФИГ. 7C представлен вид сверху проточного устройства для электропорации 750, имеющего входное отверстие 702 для введения клеток и экзогенного реагента, который должен быть введен методом электропорации в клетки («клеточный образец»), и выходное отверстие 704 для клеточного образца после электропорации. Электроды 708 вводят через электродные каналы (не показано) в устройстве. На ФИГ. 7D представлен вид сверху в разрезе проточного устройства для электропорации 750, с входным отверстием 702, выходным отверстием 704 и электродами 708, расположенными по обе стороны от сужения в проточном канале 706. Вид сбоку в разрезе нижней части проточного устройства для электропорации 750 на ФИГ. 7E показывает, что электроды 708 в данном варианте осуществления расположены в электродных каналах 710 и перпендикулярно проточному каналу 706 так, что клеточный образец перетекает из входного канала 712 через проточный канал 706 к выходному каналу 714, и в процессе клеточный образец протекает в электродные каналы 710, вступая в контакт с электродами 708. В данном аспекте все из входного канала, выходного канала и электродных каналов начинаются с верхней плоскости устройства; однако структура проточного устройства для электропорации, представленная на ФИГ. 7C-7E, является лишь одной из структур, которые могут быть использованы с картриджами для реагентов, описанными в настоящем документе. Дополнительные структуры электродов описаны, например, в USSN 16/147120, дата подачи 24 сентября 2018 г.; 16/147865, дата подачи 30 сентября 2018 г.; и 16/147871, дата подачи 30 сентября 2018 г.
Модуль для обогащения клеток
[00201] В одном необязательном аспекте предложены автоматизированные модули и приборы для модификации генома при помощи направляемой нуклеиновой кислотой нуклеазы, в которых используют методы обогащения клеток, геномы которых были надлежащим образом модифицированы. Модули для обогащения подходят для способов, в которых используют разделение на одиночные клетки и нормализацию для уменьшения ростовой конкуренции между генетически модифицированными и генетически не модифицированными клетками. Разделение на одиночные клетки позволяет преодолеть ростовые преимущества генетически не модифицированных клеток или клеток, имеющих модификации, придающие преимущества или неблагоприятные условия для роста клеток. Способы, модули и приборы можно использовать для клеток всех типов, включая археи, прокариотические и эукариотические (например, дрожжевые, грибковые, растительные и животные) клетки.
[00202] Разделение на одиночные клетки, необязательная индукция генетической модификации и нормализация клеточных колоний приводит к 2-250-кратной, 10-225-кратной, 25-200-кратной, 40-175-кратной, 50-150-кратной, 60-100-кратной или 5-100-кратной эффективности идентификации генетически модифицированных клеток относительно способов предшествующего уровня техники и позволяет использовать новые подходы к созданию сгруппированных или объединенных генетически модифицированных клеток, содержащих геномные библиотеки. Кроме того, способы, модули и приборы могут быть использованы для создания систем итеративной генетической модификации с целью получения комбинаторных библиотек, выявления редких клеточных модификаций и применения высокопроизводительных вариантов обогащения клеток для идентификации модифицирующей активности.
[00203] Композиции и способы, описанные в настоящем документе, позволяют усовершенствовать системы генетической модификации с направляемой нуклеиновой кислотой нуклеазой, в которых направляемые нуклеиновой кислотой нуклеазы (например, РНК-направляемые нуклеазы) используют для модификации конкретных областей-мишеней в геноме организма. На Фигуре 8A представлено плотностенное устройство 850 и схема технологического процесса разделения на одиночные клетки в микролунках плотностенного устройства, при этом в данной схеме процесса одна, или обе, из гРНК и нуклеазы находятся под контролем индуцируемого промотора. В верхней левой части фигуры (i) показано плотностенное устройство 850 с микролунками 852. Секция 854 субстрата 850 показана на (ii), где также показаны микролунки 852. На (iii) показан боковой разрез плотностенного устройства 850 и нагруженные микролунки 852, при этом в данном варианте осуществления было использовано распределение Пуассона; то есть, в каждой микролунке находится одна клетка или клетки отсутствуют, и вероятность того, что в одной микролунке находится более одной клетки, мала. На (iv) представлена схема процесса 840, где на субстрате 850 с микролунками 852 показаны микролунки 856 с одной клеткой, микролунки 857 без клеток и одна микролунка 260 с двумя клетками. На этапе 851 клеткам в микролунках дают возможность удваиваться примерно 2-50 раз, с образованием клональных колоний (v), затем индуцируют модификацию 853 путем нагревания субстрата (например, в случае индуцированной нагреванием модификации) или путем помещения химических веществ над или поверх субстрата (например, сахаров, антибиотиков в случае химически индуцируемой модификации), или путем перенесения плотностенного устройства в другую среду; особенно просто, если плотностенное устройство помещено на проницаемую для жидкости мембрану, которая образует дно микролунок 852. После индукции генетической модификации 853 многие клетки в колониях клеток, которые были генетически модифицированы, погибают в результате двухцепочечных разрезов, вызываемых активной модификацией, и возможно имеет место задержка роста генетически модифицированных клеток, которые выжили, но должны пройти репарацию и восстановиться после модификации (микролунки 858), при этом клетки, которые не подверглись модификации, процветают (микролунки 859) (vi). Всем клеткам позволяют продолжать расти для образования колоний и нормализации, при этом колонии генетически модифицированных клеток в микролунках 858 догоняют по размеру и/или количеству клеток клетки в микролунках 859, которые не подверглись модификации (vii), вследствие старения клеток, поскольку генетически не модифицированные клетки достигают стационарной фазы. После нормализации клеточных колоний можно либо объединять все клетки в микролунках, в этом случае клетки обогащаются по генетически модифицированным клеткам за счет устранения преимуществ для генетически не модифицированных клеток и приспособления к эффектам от модификации; альтернативно, рост колоний в микролунках контролируют после генетической модификации, и медленно растущие колонии (например, клетки в микролунках 858) обнаруживают и отбирают (например, «отбирают наилучшие» из них), что приводит даже к большему обогащению генетически модифицированных клеток.
[00204] При выращивании клеток используемая среда будет зависеть, безусловно, от типа клеток, которые генетически модифицируют - например, клеток бактерий, дрожжей или млекопитающих. Например, среда для роста бактерий включает LB, SOC, минимальную среду M9 и «волшебную» среду; среда для роста дрожжевых клеток включает TPD, YPG, YPAD и синтетическую минимальную среду; и среда для роста клеток млекопитающих включает MEM, DMEM, IMDM, RPMI и среду Хэнка.
[00205] На Фигуре 8B представлена фотография одного варианта осуществления плотностенного устройства, включающего микролунки для разделенных одиночных клеток. Как можно видеть на фотографии, плотностенное устройство имеет диаметр примерно 2 дюйма (~47 мм). Плотностенное устройство на данной фотографии практически представляет собой перфорированный диск из нержавеющей стали 816, при этом перфорация образует стенки микролунок, а фильтр или мембрану используют для создания дна микролунок. Использование фильтра или мембраны (например, 0,22-мкм PVDF тканевого мембранного фильтра Duropore™) позволяет среде и/или питательным веществам проникать в микролунки, но предотвращает вымывание клеток через мембрану из микролунок. Фильтровальные или мембранные элементы конструкции, которые могут быть использованы в плотностенных устройствах и модулях для разделения на одиночные клетки/выращивания/генетической модификации/нормализации, являются устойчивыми к растворителям, свободными от примесей во время фильтрования и способными удерживать клетки интересующих типов или размеров. Например, для удержания мелких клеток, таких как бактериальные клетки, размеры пор должны составлять всего 0,2 мкм, однако для клеток других типов размеры пор могут составлять даже 5 мкм. Действительно, размеры пор, подходящие для использования в устройстве/модуле для концентрирования клеток, включают размеры пор фильтра, составляющие 0,20 мкм, 0,21 мкм, 0,22 мкм, 0,23 мкм, 0,24 мкм, 0,25 мкм, 0,26 мкм, 0,27 мкм, 0,28 мкм, 0,29 мкм, 0,30 мкм, 0,31 мкм, 0,32 мкм, 0,33 мкм, 0,34 мкм, 0,35 мкм, 0,36 мкм, 0,37 мкм, 0,38 мкм, 0,39 мкм, 0,40 мкм, 0,41 мкм, 0,42 мкм, 0,43 мкм, 0,44 мкм, 0,45 мкм, 0,46 мкм, 0,47 мкм, 0,48 мкм, 0,49 мкм, 0,50 мкм и более. Фильтры могут быть изготовлены из любого подходящего инертного материала, включая смешанные сложные эфиры целлюлозы (нитрат и ацетат целлюлозы) (CME), поликарбонат (PC), поливинилиденфторид (PVDF), полиэфирсульфон (PES), политетрафторэтилен (PTFE), нейлон или стекловолокно.
[00206] На фотографии, представленной на Фигуре 8B, перфорации имеют диаметр примерно 152 нм, вследствие чего микролунки имеют объем примерно 2,5 нл, с общим количеством клеток примерно 30000. Расстояние между центрами микролунок составляет примерно 279 нм. Хотя описанные в настоящем документе микролунки имеют объем примерно 2,5 нл, объем микролунок может составлять от 1 до 25 нл или предпочтительно от 2 до 10 нл, и даже более предпочтительно от 2 до 4 нл. Предпочтительный размер/объем микролунок будет зависеть от типа клеток (например, клеток бактерий, дрожжей, млекопитающих). Показанный перфорированный диск выполнен из нержавеющей стали 316; хотя могут быть использованы и другие биосовместимые металлы и материалы. Плотностенное устройство может быть одноразовым или подходящим для повторного использования. Плотностенное устройство, показанное на Фигуре 8B, является круглым, но может иметь любую форму, например, квадрат, прямоугольник, овал и так далее. Круглые плотностенные устройства могут быть использованы, если для подачи в плотностенное устройство питательных веществ через твердую среду используют чашки Петри. Фильтры, используемые для формирования дна лунок плотностенного устройства, включают 0,22-мкм PVDF тканевые мембранные фильтры Duropore™. Кроме того, хотя показано плотностенное устройство с диаметром 2-дюйма (~47 мм), плотностенные устройства могут иметь меньшие или большие размеры, по мере необходимости, и конфигурация плотностенного устройства будет зависеть от того, какие питательные вещества подаются в плотностенное устройство, а также от того, как происходит замена среды. Хотя в настоящем документе описано круглое плотностенное устройство, плотностенные устройства могут иметь любую форму и размер, включая прямоугольные плотностенные устройства с 100 тыс., 200 тыс. или большим количеством лунок, не считая конфигураций плотностенных устройств и кассет, которые являются мультиплексными, например многоуровневыми.
[00207] На Фигурах 8C-8E представлены фотографии клеток E. coli при малом, среднем и большом увеличении, соответственно, разделенные на одиночные клетки по принципу распределения Пуассона в микролунки в плотностенном устройстве с мембранным дном. На Фигуре 8C представлено изображение численного роста при малом увеличении, где более темные микролунки представляют собой микролунки, в которых растут клетки. На Фигуре 8D представлен вид сверху микролунок в плотностенном устройстве, где более темные микролунки представляют собой микролунки, в которых растут клетки. На Фигуре 8E представлена фотография микролунок, где мембрана (например, проницаемая мембрана, которая образует дно микролунок) была удалена, при этом неузорчатые (гладкие) микролунки представляют собой микролунки, в которых клетки не растут, а микролунки с нерегулярной пигментацией/узорчатые представляют собой микролунки, в которых клетки растут, и, как видно на данной фотографии, заполнили микролунки, в которых они растут. На этих фотографиях 0,2-мкм фильтр (мембрана) был прижат к перфорированному металлическому плотностенному устройству, такому как круглое плотностенное устройство, показанное на Фигуре 8B. Перфорированное металлическое плотностенное устройство образует стенки микролунок, а 0,2-мкм фильтр образует дно микролунок. Для загрузки плотностенного устройства клетки E. coli помещали в микролунки с использованием вакуума. Плотностенное устройство+фильтр затем помещали на чашку с LB агаром мембранной стороной вниз, и клетки выращивали в течение ночи при 30°C, затем два дня при комнатной температуре. Мембрану удаляли, и микролунки без дна фотографировали под световым микроскопом. Следует отметить легкость использования разных селективных сред для отбора определенных клеточных фенотипов; то есть, необходимо лишь перенести плотностенное устройство+фильтр в другую чашку или чашку Петри, содержащую нужную селективную среду, или залить нужную селективную среду в субстрат, на котором размещено плотностенное устройство и связанная с ним мембрана.
[00208] Помимо плотностенного устройства для разделения на одиночные клетки, описанного применительно к ФИГ. 8A - 8E, и другие устройства для разделения на одиночные клетки можно использовать в многомодульном приборе для обработки клеток, такие как те, которые описаны в документе USSN 62/735365, озаглавленном «Detection of Nuclease Edited Sequences in Automated Modules and Systems», поданном 24 сентября 2018 г., и USSN 62/781112, озаглавленном «Improved Detection of Nuclease Edited Sequences in Automated Modules and Systems», поданном 18 декабря 2018, включая разделение на одиночные клетки путем помещения на агар, разделение на одиночные клетки путем выделения клеток на функционализированных островках, разделение на одиночные клетки в водных каплях, находящихся в гидрофобной среде-носителе, или разделение на одиночные клетки в полимерном альгинатном каркасе (для данного варианта осуществления разделения на одиночные клетки смотри также документ USSN 62/769805, озаглавленный «Improved Detection of Nuclease Edited Sequences in Automated Modules and Instruments via Bulk Cell Culture», поданный 20 ноября 2018 г.
[00209] В качестве альтернативы разделению на одиночные клетки можно использовать индукцию генетической модификации за счет индуцируемого промотора, управляющего одной, или обеими, из гРНК и нуклеазы, в конкретный момент времени в цикле роста клеток. На Фигуре 8F представлена упрощенная схема технологического процесса для иллюстративных способов 8000 обогащения по генетически модифицированным клеткам. Как показано на Фигуре 8F, способ 8000 начинается с проектирования и синтеза модифицирующих кассет 8002. Как описано выше применительно к направляемой нуклеиновой кислотой генетической модификации, каждая модифицирующая кассета, как правило, содержит гРНК, донорскую ДНК и PAM или спейсерную мутацию. После синтеза отдельных модифицирующих кассет отдельные модифицирующие кассеты могут быть «связаны» или «собраны» вместе, и их амплифицируют и собирают в каркасы модифицирующих векторов 8004. Модифицирующие векторы, содержащие модифицирующие кассеты, затем используют для трансформации клеток 8006, за счет чего создается библиотека трансформированных клеток. В дополнение к векторам, содержащим собранные модифицирующие кассеты, клетки одновременно могут быть трансформированы отдельным движущим вектором, содержащим кодирующую последовательность нуклеазы. Альтернативно, клетки уже могут экспрессировать нуклеазу (например, клетки могут быть уже трансформированы движущим вектором, или кодирующая последовательность нуклеазы может быть стабильно интегрирована в клеточный геном), так что лишь модифицирующий вектор необходимо вводить трансформацией в клетки; или клетки могут быть трансформированы одним вектором, содержащим все компоненты, необходимые для осуществления модификации генома при помощи направляемой нуклеиновой кислотой нуклеазы (например, все из нуклеазы и модифицирующей кассеты), что является предпочтительным в случае использования излечивающих и рекурсивных раундов генетической модификации.
[00210] Можно использовать различные системы доставки для введения (например, трансформации или трансфекции) компонентов системы генетической модификации с направляемой нуклеиновой кислотой нуклеазой в клетку-хозяина 8008. Эти системы доставки включают использование дрожжевых систем, систем липофекции, систем микроинъекции, биолистических систем, виросом, липосом, иммунолипосом, поликатионов, конъюгатов липид:нуклеиновая кислота, вирионов, искусственных вирионов, вирусных векторов, электропорации, проникающих в клетку пептидов, наночастиц, нанопроводов, экзосом. Альтернативно, можно использовать липосомы - молекулярного «троянского коня» - для доставки компонентов системы с направляемой нуклеиновой кислотой нуклеазой через гематоэнцефалический барьер. Особый интерес представляет использование электропорации, в частности, проточной электропорации (либо в виде автономного прибора, либо в виде модуля в автоматизированной многомодульной системе), как описано, например, в USSN 16/024831, поданном 30 июня 2018 г.; 16/024816, поданном 30 июня 2018 г.; 16/147353, поданном 28 сентября 2018 г.; 16/147865, поданном 30 сентября 2018 г.; и 16/147871, поданном 30 июня 2018 г. Если модуль для скрининга/селекции представляет собой один модуль в автоматизированной многомодульной системе генетической модификации клеток, клетки, наиболее вероятно, трансформируют в автоматизированном модуле для трансформации клеток.
[00211] После трансформации 8006 клетки могут быть подвергнуты селекции с использованием селективного маркера 8008. Селективные маркеры используют для отбора клеток, которые получили как движущий, так и модифицирующий, векторы, или клеток, которые были трансформированы одним комбинированным движущим и модифицирующим вектором. Обычно используемые селективные маркеры включают селективные маркеры, представляющие собой лекарственные средства, такие как ампициллин/карбенициллин, канамицин, хлорамфеникол, эритромицин, тетрациклин, гентамицин, блеомицин, стрептомицин, рамноза, пуромицин, гигромицин, бластицидин и G418.
[00212] После того, как клетки, которые были надлежащим образом трансформированы, отобраны 8008, следующим этапом в способе 8000 является выращивание клеток в жидкой среде до момента вступления (или близкого к вступлению) клеток в стационарную фазу роста. Когда клетки находятся в стационарной фазе 8010 (или близко к ней), индуцируют генетическую модификацию 8012 в клетках путем индукции транскрипции одной, или обеих, из нуклеазы и гРНК. После индукции генетической модификации 8012 клетки можно выращивать, делать их электрокомпетентными и подвергать другому раунду генетической модификации 8014.
[00213] На Фигуре 8G представлена типичная кривая роста 8020 для клеток в культуре (зависимость оптической плотности от времени). Изначально имеет место латентная фаза 8022, затем клетки вступают в логарифмическую фазу роста 8024, в которой они растут быстро, и наконец клетки достигают стационарной фазы 8028, в которой клетки больше не делятся. В настоящих способах используют индукцию транскрипции любой, или обеих, из нуклеазы и/или гРНК в момент времени 8026, или позже, когда клетки находятся в стационарной фазе роста, или примерно в ней; то есть, клетки индуцируют в момент нахождения по меньшей мере на 60% в логарифмической фазе роста, или по меньшей мере на 65% в логарифмической фазе роста, или по меньшей мере на 70% в логарифмической фазе роста, или по меньшей мере на 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 79, 98 или 99% в логарифмической фазе роста, и в любой момент времени в стационарной фазе роста.
[00214] На Фигуре 8H представлен иллюстративный протокол 8050 для проведения модификации генома с направляемой нуклеиновой кислотой нуклеазой. На Фигуре 8H представлены протоколы, показанные на Фигуре 8F, для генетической модификации клеток. Сначала библиотеку или коллекцию модифицирующих векторов 8052 (каждый из модифицирующих векторов содержит модифицирующую кассету) вводят 8053 (например, электропорацией) в культивируемые клетки 8054, которые содержат кодирующую последовательность для нуклеазы под контролем конститутивного или индуцируемого промотора (предпочтительно, индуцируемого промотора), 1) содержащуюся на «движущей плазмиде» (чаще всего наряду с селективным маркером), которая уже введена трансформацией в клетки; 2) интегрированную в геном трансформируемых клеток; или 3) кодирующая последовательность для нуклеазы может находиться на модифицирующем векторе. Модифицирующие векторы 8052 содержат донорскую ДНК, изменяющую PAM или спейсер последовательность (чаще всего последовательность, которая инактивирует PAM в сайте-мишени генома), кодирующую последовательность для гРНК под контролем индуцируемого промотора и селективный маркер.
[00215] На этапе 8059 клетки растут до достижения, или почти до достижения, ими стационарной фазы. После достижения клетками стационарной фазы индуцируют генетическую модификацию 8067 (например, при этом индуцируют транскрипцию нуклеазы, гРНК или обеих), и клетки в культуре 8082 генетически модифицируют, после чего оставляют для восстановления после модификации. После восстановления клетки можно высевать 8069, выращивать и объединять 8084. Альтернативно, клетки из культуры 8082 можно высевать 8081, и медленно растущие колонии отбирать 8086, тем самым выбирая наилучшие генетически модифицированные колонии. В другом альтернативном варианте клетки можно оставлять в жидкой культуре, выращивать до соответствующего значения OD, делать их электрокомпетентными и подвергать другому раунду генетической модификации 8088. Данный способ обогащения по генетически модифицированным клеткам является особенно желательным, поскольку его можно осуществлять с высокой пропускной способностью, он не требует высевания клеток и может быть автоматизирован. Индукцию на этапе 8067 можно выполнять, например, с использованием системы промотора pL, при этом промотор pL индуцируют путем повышения температуры клеток в среде до 42°C на период времени, например, от одного до нескольких часов для индукции экспрессии нуклеазы и гРНК с целью разрезания и генетической модификации нуклеиновой кислоты. После индукции генетической модификации температуру культуры 8082 возвращают к уровню 30°C.
[00216] В одном способе 8081 клетки из суммарной жидкой культуры высевают, и отбирают медленно растущие колонии 8086. У генетически модифицированных клеток жизнеспособность ухудшается в период после индукции генетической модификации. В способе селекции, показанном на Фигуре 8H (например, отбор медленно растущих колоний 8081), пользуются задержкой роста в колониях генетически модифицированных клеток для идентификации генетически модифицированных клеток. В некоторых вариантах осуществления размер колоний генетически модифицированных клеток на 20% меньше, чем размер колоний генетически не модифицированных клеток. В некоторых аспектах размер колоний генетически модифицированных клеток на 30%, 40%, 50%, 60%, 70%, 80% или 90% меньше, чем размер колоний генетически не модифицированных клеток. Во многих вариантах осуществления размер колоний генетически модифицированных клеток на 30-80% меньше, чем размер колоний генетически не модифицированных клеток, и в некоторых вариантах осуществления размер колоний генетически модифицированных клеток на 40-70% меньше, чем размер колоний генетически не модифицированных клеток.
Картридж для реагентов
[00217] На ФИГ. 9A представлен картридж для реагентов 922, включающий набор из восемнадцати пробирок или бутылей 940. В некоторых вариантах осуществления одна или более из этих пробирок или бутылей 940 запечатаны прокалываемой фольгой для доступа автоматизированной рабочей станции дозирования жидкостей, например, для соломинки или пипеточного дозатора. В других вариантах осуществления одна или более из этих пробирок или бутылей могут включать запечатываемую прокладку для доступа. В некоторых вариантах осуществления верхняя часть каждой из небольших пробирок или бутылей маркирована машиночитаемыми знаками (не показано) для автоматизированной идентификации содержимого. Машиночитаемые знаки могут включать штрихкод, QR код или другие варианты машиночитаемых кодов. Другие автоматизированные способы идентификации конкретного контейнера могут включать цветовое кодирование, распознавание символов (например, текст, изображение, иконка и так далее) и/или распознавание формы (например, относительной формы контейнера). В некоторых вариантах осуществления вместо маркировки самого сосуда, верхняя поверхность корпуса картриджа и/или крышка картриджа может содержать машиночитаемые знаки для идентификации содержимого. Все небольшие пробирки или бутыли могут иметь одинаковый размер. Альтернативно, в картридже для реагентов 922 могут быть предоставлены пробирки или бутыли нескольких размеров. В иллюстративном примере каждая пробирка или бутыль может быть предназначена для содержания 2-20 мл, 4-10 мл или примерно 5 мл. В некоторых вариантах осуществления, в которых необходимы лишь небольшие объемы некоторых реагентов, можно использовать вкладыши в пробирки для вмещения небольших (например, микроцентрифужных) пробирок в приемной емкости большего размера (не показано).
[00218] В иллюстративном примере каждая из пробирок или бутылей может содержать один из следующих материалов: каркас вектора, олигонуклеотиды, реагенты для сборки нуклеиновых кислот, предоставленный пользователем клеточный образец, индуцирующее средство, магнитные гранулы в буфере, этанол, антибиотик для селекции клеток, реагенты для элюирования клеток и нуклеиновых кислот, масляное покрытие, другие реагенты, а также среда для роста и/или восстановления клеток. Кроме того, модуль для трансформации клеток, например, проточное устройство для электропорации, описанное выше, необязательно, может быть частью картриджа для реагентов.
[00219] В некоторых вариантах осуществления крышка 924, видная на ФИГ. 9B, фиксирует пробирки или бутыли 940 в корпусе картриджа 922 на ФИГ. 9A. Как показано на ФИГ. 9B, крышка 924 может иметь отверстия для доступа к каждой из небольших пробирок или бутылей 940. Три большие отверстия 932 обведены жирной чертой для обозначения положений для добавления предоставляемых пользователем материалов. Предоставляемые пользователем материалы, например, могут включать каркас вектора, олигонуклеотиды и клеточный образец. Кроме того, крышка 924 может иметь машиночитаемые знаки 930 для идентификации типа картриджа (например, доступ к карте содержимого картриджа). Альтернативно, каждое отверстие может быть маркировано отдельно с указанием индивидуального содержимого. В некоторых вариантах осуществления для гарантии размещения предоставляемых пользователем материалов бутыли или пробирки, предназначенные для заполнения в лабораторных условиях, могут иметь уникальную форму или размеры, так что только бутыль или пробирка с клеточным образцом соответствует отверстию для клеточного образца, только бутыль или пробирка с олигонуклеотидами соответствует отверстию для емкости с олигонуклеотидами, и так далее.
Использование устройства для выращивания клеток
[00220] На ФИГ. 10 представлена схема технологического процесса для иллюстративного способа 1000 с использованием автоматизированного многомодульного прибора для генетической модификации клеток, такого как системы, показанные на ФИГ. 4A-4D. Система обработки информации, например, управляет стадиями обработки способа 1000. Например, программный скрипт может определять настройки для каждого этапа обработки и инструкции по перемещению роботизированной системы для манипуляций для осуществления этапов способа 1000. В некоторых вариантах осуществления программный скрипт с инструкциями может быть определен картриджем, вводимым в автоматизированный многомодульный прибор для генетической модификации клеток. Например, картридж может включать машиночитаемые знаки, такие как штрихкод или QR код, включая идентификацию скрипта, хранящегося в памяти автоматизированного многомодульного прибора для генетической модификации клеток. В другом примере картридж может содержать загружаемый скрипт, встроенный в машиночитаемые знаки, такие как радиочастотный (RF) тег. В других вариантах осуществления пользователь может идентифицировать скрипт, например, путем загрузки скрипта через проводное или беспроводное соединение в систему обработки информации автоматизированного многомодульного прибора для генетической модификации клеток или путем выбора хранящегося в памяти скрипта через пользовательский интерфейс автоматизированного многомодульного прибора для генетической модификации клеток. В конкретном примере автоматизированный многомодульный прибор для генетической модификации клеток может включать интерфейс сенсорного экрана для установки пользовательских настроек и активации обработки клеток.
[00221] В некоторых вариантах осуществления способ 1000 начинается с переноса клеток в ростовой модуль для клеток (1002). Ростовой модуль может представлять собой любой ростовой модуль, поддающийся автоматизации, такой как, например, ростовой модуль для клеток 550, описанный применительно к ФИГ. 5B - 5D. В конкретном примере система обработки информации может управлять роботизированной системой для манипуляций при переносе клеток в ростовой модуль. В другом примере клетки могут быть перенесены из одного картриджа для реагентов в ростовой модуль при помощи роботизированной системы для манипуляций. В некоторых вариантах осуществления ростовая бутыль может содержать ростовую среду и может быть предоставлена, например, в виде части набора. В других вариантах осуществления ростовая бутыль может быть заполнена средой, переносимой, например, через устройство для манипуляций с жидкостью, из контейнера для реагентов.
[00222] В некоторых вариантах осуществления перед переносом клеток (например, из картриджа для реагентов или из бутыли, добавленной в прибор) машиночитаемые знаки могут быть просканированы на бутыли или другом контейнере, установленном в положение, предназначенное для клеток, для подтверждения того, что бутыль, или контейнер, маркирована как содержащая клетки. Кроме того, машиночитаемые знаки могут указывать на тип клеток, внесенных в прибор. В некоторых вариантах осуществления в зависимости от типа клеток прибор может выбирать конкретный скрипт для обработки (например, серию инструкций для роботизированной системы для манипуляций, а также настройки и активацию различных модулей).
[00223] В некоторых вариантах осуществления клетки выращивают в ростовом модуле до нужного значения оптической плотности (1004). Например, система обработки информации может контролировать температурные настройки ростового модуля для инкубации клеток во время ростового цикла. Система обработки информации также может получать сигналы от датчиков из ростового модуля, являющиеся показателями оптической плотности, и анализировать сигналы от датчиков для контролирования роста клеток. В некоторых вариантах осуществления пользователь может задавать параметры роста для контролирования роста клеток. Например, температуру и степень перемешивания клеток. Кроме того, в некоторых вариантах осуществления пользователь может вносить изменения в соответствующий процесс роста. В некоторых примерах изменения могут включать информацию, представленную на пользовательском интерфейсе автоматизированного многомодульного прибора для генетической модификации клеток, текстовое сообщение на номер мобильного телефона пользователя, электронное сообщение на учетную запись электронной почты или сообщение, переданное в приложение, выполняющееся на портативном электронном устройстве (например, сотовом телефоне, планшете и так далее). В некоторых вариантах осуществления в ответ на сообщения пользователь может изменять параметры, такие как температура, для корректировки роста клеток. Например, пользователь может вносить измененные параметры через пользовательский интерфейс автоматизированного многомодульного прибора для генетической модификации клеток или через приложение портативного вычислительного устройства, взаимодействующего с автоматизированным многомодульным прибором для генетической модификации клеток, например, пользовательским интерфейсом (смотри элемент 450 на ФИГ. 4B).
[00224] Хотя описание приведено для оптической плотности, в других вариантах осуществления рост клеток в ростовом модуле можно контролировать с использованием иного показателя плотности клеток и их физиологического состояния, такого как, в некоторых примерах, значение pH, уровень растворенного кислорода, высвобожденные ферменты, акустические свойства и электрические свойства.
[00225] В некоторых вариантах осуществления после достижения желаемой оптической плотности (1004) клетки переносят из ростового модуля в фильтровальный модуль или модуль для промывания и концентрирования клеток (1006). Роботизированная система для манипуляций, например, может переносить клетки из ростового модуля в модуль для концентрирования клеток. Модуль для концентрирования клеток, например, может быть (и, как правило, является) предназначен для придания клеткам электрокомпетентности. Смотри ФИГ. 6A-6I применительно к устройству TFF, описанному выше. Клетки делают электрокомпетентными и элюируют в фильтровальный модуль или модуль для промывания и концентрирования клеток (1008). Клетки можно элюировать промывающим раствором. Например, клетки можно элюировать с использованием реагентов из источника реагентов.
[00226] После придания клеткам электрокомпетентности и суспендирования их в соответствующем объеме, например, от 50 мкл до 10 мл, или от 100 мкл до 80 мл, или от 150 мкл до 8 мл, или от 250 мкл до 7 мл, или от 500 мкл до 6 мл, или от 750 мкл до 5 мл, для трансформации (1006) клетки переносят, например, в модуль FTEP (1018). Роботизированная система для манипуляций, например, может переносить клетки из фильтровального модуля в FTEP. Фильтровальный модуль может быть физически соединен с устройством FTEP, или эти модули могут быть отдельными.
[00227] В некоторых вариантах осуществления нуклеиновые кислоты готовят за пределами автоматизированного многомодульного прибора для генетической модификации клеток. Например, собранный вектор или другую собранную нуклеиновую кислоту пользователь может включать в виде реагента перед проведением процесса трансформации и других процессов в способе 1000.
[00228] Однако в других вариантах осуществления нуклеиновые кислоты готовят при помощи автоматизированного многомодульного прибора для генетической модификации клеток. В некоторых вариантах осуществления часть следующих этапов 1010-1016 выполняют параллельно с частью этапов 1002-1008. В некоторых вариантах осуществления по меньшей мере часть следующих этапов выполняют до и/или после этапов 1002-1008.
[00229] В некоторых вариантах осуществления нуклеиновые кислоты, такие как модифицирующий олигонуклеотид и каркас вектора, а также, в некоторых примерах ферменты и другие реакционные компоненты, переносят в сборочный модуль для нуклеиновых кислот (1010). Сборочный модуль для нуклеиновых кислот может быть спроектирован для применения одного или более из широкого разнообразия разных методов сборки нуклеиновых кислот автоматизированным образом. Методы сборки нуклеиновых кислот, которые могут быть использованы в сборочном модуле для нуклеиновых кислот, могут включать, но без ограничения, такие методы сборки, в которых используют эндонуклеазы рестрикции, включая ПЦР, сборку BioBrick, клонирование типа IIS, сборку GoldenGate и циклическую реакцию с лигазой. В других примерах в сборочном модуле для нуклеиновых кислот может быть использован метод сборки на основе перекрывания между соседними фрагментами нуклеиновых кислот, например, Gibson Assembly®, CPEC, SLIC, циклическая реакция с лигазой и так далее, как описано выше. Дополнительные примеры методов сборки, которые могут быть использованы в сборочном модуле для нуклеиновых кислот, включают репарацию гэпов в дрожжах, клонирование gateway и опосредуемое топоизомеразами клонирование. В конкретном примере система обработки информации может управлять роботизированной системой для манипуляций при переносе нуклеиновых кислот в сборочный модуль для нуклеиновых кислот. В другом примере нуклеиновые кислоты могут быть перенесены из картриджа для реагентов в сборочный модуль для нуклеиновых кислот роботизированной системой для манипуляций.
[00230] В некоторых вариантах осуществления - перед переносом каждого из образцов нуклеиновой кислоты, ферментов и других реакционных компонентов - машиночитаемые знаки могут быть просканированы на бутылях или других контейнерах, установленных в положение, предназначенное для этих материалов, для подтверждения того, что бутыли или контейнеры маркированы как содержащие запланированный материал. Кроме того, машиночитаемые знаки могут указывать на тип одного или более образцов нуклеиновой кислоты, ферментов и других реакционных компонентов, внесенных в прибор. В некоторых вариантах осуществления в зависимости от типа(ов) материалов прибор может выбирать конкретный скрипт для обработки (например, серию инструкций для роботизированной системы для манипуляций с целью идентификации дополнительных материалов и/или настройки и активацию сборочного модуля для нуклеиновых кислот).
[00231] В некоторых вариантах осуществления температура сборочного модуля для нуклеиновых кислот контролируется в зависимости от используемого типа сборки нуклеиновой кислоты. Например, если в сборочном модуле для нуклеиновых кислот используют ПЦР, модуль может иметь функцию термоциклирования, позволяющую циклически изменять температуру между этапами денатурации, отжига и удлинения. Если в сборочном модуле для нуклеиновых кислот используют методы сборки при одной температуре, модуль может обеспечивать возможность достигать и поддерживать температуру, которая оптимизирует конкретный выполняемый процесс сборки.
[00232] В некоторых вариантах осуществления контроль температуры осуществляет система обработки информации автоматизированного многомодульного прибора для генетической модификации клеток, такая как система обработки информации. Эти температуры и продолжительность поддержания этих температур могут определяться предварительно запрограммированным набором параметров (например, указанным в скрипте для обработки или в другом пространстве памяти, доступном для системы обработки информации) или вручную контролироваться пользователем через интерфейс системы обработки информации.
[00233] По прошествии времени, достаточного для реакции сборки, в некоторых вариантах осуществления собранную нуклеиновую кислоту можно переносить в модуль для очистки (1014). Система обработки информации, например, может контролировать время для сборки, исходя из одного или более типов реакции, типов материалов и настроек пользователя, введенных в автоматизированный многомодульный прибор для генетической модификации клеток. Роботизированная система для манипуляций, например, может переносить собранную нуклеиновую кислоту в модуль для очистки через интерфейс соломинки или пипеточного дозатора. В другом примере роботизированная система для манипуляций может переносить бутыль, содержащую собранную нуклеиновую кислоту, из камеры сборочного модуля для нуклеиновых кислот в камеру модуля для обессоливания/очистки.
[00234] В некоторых вариантах осуществления собранную нуклеиновую кислоту обессоливают и элюируют в модуле для очистки (1016). В модуле для очистки, например, могут быть удалены нежелательные компоненты смеси для сборки нуклеиновой кислоты (например, соли, минералы и так далее). В некоторых вариантах осуществления модуль для очистки концентрирует собранные нуклеиновые кислоты в меньшем объеме, чем объем, в котором была проведена сборка нуклеиновой кислоты. Примеры способов замены жидкости после сборки нуклеиновой кислоты включают использование магнитных гранул (например, SPRI или Dynal (Dynabeads) от компании Invitrogen Corp. of Carlsbad, CA), кремниевых гранул, кремниевых спин-колонок, стеклянных гранул, осаждения (например, с использованием этанола или изопропанола), щелочного лизиса, осмотической очистки, экстракции бутанолом, мембранных методов разделения, фильтрования и так далее. Например, можно использовать один или более микроконцентраторов, снабженных анизотропными, гидрофильными целлюлозными мембранами с разными размерами пор. В другом примере модуль для обессоливания/очистки может обрабатывать жидкий образец, содержащий нуклеиновую кислоту и ионную соль, путем создания контакта смеси с ионообменной смолой, включая нерастворимую фосфатную соль, удаления жидкости и элюирования нуклеиновой кислоты с ионообменной смолы.
[00235] В иллюстративном варианте осуществления собранную нуклеиновую кислоту можно объединять с магнитными гранулами, такими как гранулы SPRI, в камере модуля для очистки. Собранную нуклеиновую кислоту можно инкубировать при заданной температуре в течение времени, достаточного для связывания собранных нуклеиновых кислот с магнитными гранулами. После инкубации вблизи камеры может быть задействован магнит, так что собранная нуклеиновая кислота может быть промыта и элюирована. После элюирования собранной нуклеиновой кислоты собранную нуклеиновую кислоту переносят в модуль для трансформации (1018). Роботизированная система для манипуляций, например, может переносить собранные нуклеиновые кислоты в модуль для трансформации через интерфейс соломинки или пипеточного дозатора с FTEP, как описано выше. Например, обессоленные собранные нуклеиновые кислоты в процессе переноса могут быть объединены с электрокомпетентными клетками из этапа 108. В других вариантах осуществления модуль для трансформации может принимать и электрокомпетентные клетки, и собранную нуклеиновую кислоту отдельно, и осуществлять смешивание (например, открывать один или более каналов для объединения материалов в общей камере).
[00236] Клетки трансформируют в модуле FTEP (1020). Буфер или среду можно переносить в модуль для трансформации и добавлять к клеткам, так что клетки могут быть суспендированы в буфере или среде, которая благоприятна для выживания клеток в процессе электропорации. Перед переносом буфера или среды машиночитаемые знаки могут быть сканированы на бутыли или другом контейнере или резервуаре, помещенном в положение, предназначенное для буфера или среды, для подтверждения содержимого бутыли, контейнера или резервуара. Кроме того, машиночитаемые знаки могут указывать на типы буферов или сред, помещенных в прибор. В некоторых вариантах осуществления в зависимости от типа буфера или среды прибор может выбирать конкретный скрипт для обработки (например, настройки и активацию модуля для трансформации, подходящие для конкретного буфера или среды). Для электропорации бактериальных клеток можно использовать среды с низкой проводимостью, такие как вода или растворы глицерина, для уменьшения выработки тепла за счет переходного сильного тока. Для дрожжевых клеток можно использовать раствор сорбита. Для электропорации клеток млекопитающих клетки можно суспендировать в среде или буфере с высокой проводимостью, например, MEM, DMEM, IMDM, RPMI, среде Хэнка, PBS, HBSS, HeBS и растворе Рингера. В конкретном примере роботизированная система для манипуляций может переносить буферный раствор в модуль FTEP из картриджа для реагентов. Как описано применительно к ФИГ.7A - 7E, устройство FTEP может представлять собой устройство FTEP одноразового использования и/или устройство FTEP может быть предоставлено в виде части картриджа для реагентов. Альтернативно, как показано на ФИГ. 4A, устройство FTEP может представлять собой отдельный модуль.
[00237] После трансформации клетки переносят во второй модуль для роста/восстановления/генетической модификации (1022), такой как ростовой модуль для клеток, описанный применительно к ФИГ. 5A-5D. Роботизированная система для манипуляций, например, может переносить трансформированные клетки во второй ростовой модуль через интерфейс соломинки или пипеточного дозатора. В другом примере роботизированная система для манипуляций может переносить бутыль, содержащую трансформированные клетки, из камеры модуля для трансформации в камеру второго ростового модуля.
[00238] В некоторых вариантах осуществления второй ростовой модуль действует в качестве модуля для восстановления, в котором клетки могут восстанавливаться после процесса трансформации. В других вариантах осуществления клетки могут быть перенесены в отдельный модуль для восстановления перед переносом во второй ростовой модуль. В процессе восстановления во втором ростовом модуле трансформированные клетки могут поглощать и, в некоторых аспектах, интегрировать введенные нуклеиновые кислоты в клеточный геном. Второй ростовой модуль может быть спроектирован для инкубации клеток при любой определяемой пользователем температуре, оптимальной для роста клеток, предпочтительно 25°, 30° или 37°C.
[00239] В некоторых вариантах осуществления второй ростовой модуль действует в качестве селекционного модуля, в котором происходит отбор трансформированных клеток при помощи антибиотика или другого реагента. В одном примере белковую систему РНК-направляемой нуклеазы (RGN) используют для избирательного расщепления геномов клеток, которые не получили желаемую модификацию. В примере с селективным средством, представляющим собой антибиотик, антибиотик можно добавлять во второй ростовой модуль для осуществления селекции. Подходящие гены устойчивости к антибиотикам включают, но без ограничения, такие гены, как ген устойчивости к ампициллину, ген устойчивости к тетрациклину, ген устойчивости к канамицину, ген устойчивости к неомицину, ген устойчивости к канаванину, ген устойчивости к бластицидину, ген устойчивости к гигромицину, ген устойчивости к пуромицину или ген устойчивости к хлорамфениколу. Роботизированная система для манипуляций, например, может переносить антибиотик во второй ростовой модуль через интерфейс соломинки или пипеточного дозатора. В некоторых вариантах осуществления удалению мертвых клеток способствует использование усилителей лизиса, например, детергентов, осмотического стресса за счет промывания гипотоническими жидкостями, температуры, ферментов, протеаз, бактериофагов, восстанавливающих средств или хаотропных средств. Система обработки информации, например, может изменять факторы среды, такие как температура, для индукции селекции, в то время как роботизированная система для манипуляций может доставлять дополнительные материалы (например, детергенты, ферменты, восстанавливающие средства и так далее) для облегчения селекции. В других вариантах осуществления удаление клеток и/или замену среды путем фильтрования используют для уменьшения фонового содержания мертвых клеток.
[00240] В следующих вариантах осуществления дополнительно или вместо применения селекции второй ростовой модуль служит в качестве модуля для модификации, способствуя модификации генома в трансформированных клетках. Альтернативно, в других вариантах осуществления клетки после восстановления и селекции (в случае ее применения) переносят в отдельный модуль для модификации. Во втором ростовом модуле, в качестве модуля для модификации, индуцируют модификацию клеточных геномов, например, за счет содействия экспрессии введенных нуклеиновых кислот. Для экспрессии нуклеазы и/или нуклеиновых кислот модифицирующей кассеты можно использовать один или более способов химической, световой, вирусной или температурной индукции. Второй ростовой модуль, например, может быть спроектирован для нагревания или охлаждения клеток в процессе температурной индукции. В конкретном примере клетки могут быть индуцированы нагреванием при 42°C-50°C. В качестве дальнейшей иллюстрации клетки после индукции могут быть охлаждены до температуры 0-10°C. В примере химической или вирусной индукции индуцирующее средство может быть перенесено во второй ростовой модуль для индукции генетической модификации. Если индуцируемую нуклеазу и/или модифицирующую кассету вводили в клетки в процессе генетической модификации, она может быть индуцирована путем введения индуцирующей молекулы. В некоторых вариантах осуществления индуцирующее средство или индуцирующую молекулу переносит во второй ростовой модуль роботизированная система для манипуляций, например, через интерфейс пипеточного дозатора или соломинки.
[00241] В некоторых вариантах осуществления, если дополнительная генетическая модификация клеток не желательна (1024), клетки могут быть перенесены из ростового модуля для клеток в блок хранения для более позднего извлечения из автоматизированного многомодульного прибора для генетической модификации клеток (1026). Роботизированная система для манипуляций, например, может переносить клетки в блок хранения через интерфейс соломинки или пипеточного дозатора. В другом примере роботизированная система для манипуляций может переносить бутыль, содержащую клетки, из камеры второго ростового модуля в бутыль или пробирку в блоке хранения.
[00242] В некоторых вариантах осуществления, если дополнительная генетическая модификация клеток желательна (1024), клетки могут быть перенесены в тот же, или иной, фильтровальный модуль и сделаны электрокомпетентными (1008). Кроме того, в некоторых вариантах осуществления новый образец собранной нуклеиновой кислоты может быть получен в сборочном модуле для нуклеиновых кислот в данный момент времени, или, альтернативно, вторая полностью собранная нуклеиновая кислота может быть непосредственно введена в клетки. В некоторых вариантах осуществления перед рекурсивной генетической модификацией может потребоваться пополнение пользователем автоматизированного многомодульного прибора для генетической модификации клеток дополнительными материалами, например, путем внесения одной или более отдельных бутылей, или картриджей, с реагентами.
[00243] Этапы могут быть такими же, или иными, в процессе второго раунда генетической модификации. Например, в некоторых вариантах осуществления после успешного выполнения этапа 1004 селективную ростовую среду переносят в ростовой модуль для осуществления селекции генетически модифицированных клеток после первого раунда генетической модификации. Роботизированная система для манипуляций может переносить селективную ростовую среду из бутыли или контейнера в картридж для реагентов, находящийся в положении, предназначенном для селективной ростовой среды. Перед переносом селективной ростовой среды машиночитаемые знаки могут быть сканированы на бутыли, или другом контейнере или резервуаре, находящейся в положении, предназначенном для селективной ростовой среды, с целью подтверждения содержимого бутыли, контейнера или резервуара. Кроме того, машиночитаемые знаки могут указывать на тип селективной ростовой среды, помещенной в прибор. В некоторых вариантах осуществления в зависимости от типа селективной ростовой среды прибор может выбирать конкретный скрипт для обработки (например, настройки и активацию ростового модуля, которые соответствуют конкретной селективной ростовой среде). Конкретный пример схемы технологического процесса рекурсивной генетической модификации описан на ФИГ. 13.
[00244] В некоторых вариантах осуществления способ 1000 можно приурочить для введения материалов и/или завершения цикла генетической модификации или цикла роста в соответствии с расписанием пользователя. Например, автоматизированный многомодульный прибор для генетической модификации клеток может предоставлять пользователю возможность приурочивать завершение одного или более циклов обработки клеток (например, одной или более рекурсивных генетических модификаций) таким образом, что способ 1000 выполняется с целью завершения в желаемое пользователем время. Расписание, например, можно устанавливать через пользовательский интерфейс. Исключительно для иллюстрации, пользователь может устанавливать время окончания первого цикла на 4:00 PM, так что пользователь может вносить дополнительные картриджи с материалами в автоматизированный многомодульный прибор для генетической модификации клеток, чтобы в течение ночи происходил второй раунд генетической модификации клеток. Таким образом, пользователь может устанавливать расписание программы таким образом, что два или более циклов могут быть запрограммированы на конкретный период времени, например, 24-часовой период времени.
[00245] В некоторых вариантах осуществления при использовании способа 1000 автоматизированный многомодульный прибор для генетической модификации клеток может извещать пользователя о его состоянии на данный момент времени. Например, пользовательский интерфейс может представлять графическую идентификацию текущей стадии обработки. В конкретном примере на передней панели автоматизированного многомодульного прибора для обработки клеток может находиться пользовательский интерфейс (например, сенсорный экран), который представляет анимированное изображение, отображающее текущий статус обработки клеток. Пользовательский интерфейс может также отображать любые пользовательские настройки и/или настройки по умолчанию, связанные с текущей стадией обработки (например, настройки температуры, настройки времени и так далее). В конкретных вариантах осуществления статус может быть передан пользователю через контроллер беспроводной связи.
[00246] При том, что проиллюстрирована конкретная серия операций, в других вариантах осуществления в способ 1000 можно включать больше или меньше этапов. Например, в некоторых вариантах осуществления перед началом каждого раунда генетической модификации можно проводить скрининг содержимого резервуаров, картриджей и/или бутылей, чтобы убедиться, что соответствующие материалы находятся в наличии для проведения обработки. Например, в некоторых вариантах осуществления один или более датчиков изображения (например, сканеров штрихкода, камер и так далее) могут подтверждать содержимое резервуаров в различных положениях в корпусе автоматизированного многомодульного прибора для генетической модификации клеток. В одном примере несколько датчиков изображения могут быть расположены в корпусе автоматизированного многомодульного прибора для генетической модификации клеток, при этом каждый датчик изображения предназначен для определения одного или более материалов (например, машиночитаемых знаков, таких как штрихкоды или QR коды, формы/размеры материалов и так далее). В другом примере по меньшей мере один датчик изображения может перемещаться роботизированной системой для манипуляций в разные положения для определения одного или более материалов. В следующих вариантах осуществления один или более датчиков веса могут определять наличие или отсутствие расходуемых или заменяемых материалов. В иллюстративном примере держатель наконечников для переноса может включать датчик веса для определения того, загружены ли наконечники в данную область. В другом иллюстративном примере оптический датчик может определять, что уровень жидких отходов достиг порогового значения и необходима утилизация перед продолжением обработки клеток, или необходимо добавление жидкости, если минимальный уровень не был достигнут, для продолжения обработки. В некоторых вариантах осуществления запросы на дополнительные материалы, удаление отходов или другие действия пользователя (например, ручная чистка одного или более элементов и так далее) представлены на графическом пользовательском интерфейсе автоматизированного многомодульного прибора для генетической модификации клеток. В некоторых вариантах осуществления автоматизированный многомодульный прибор для генетической модификации клеток связывается с пользователем с запросами на новые материалы или для других действий пользователя, например, через программное приложение, электронную почту или текстовое сообщение.
[00247] На ФИГ. 11 представлены упрощенные схемы технологических процессов для двух альтернативных иллюстративных способов 1100a и 1100b разделения на одиночные клетки для обогащения (1100a) и для отбора лучших вариантов (1100b). Как показано на Фигуре 11, способ 1100a начинается с трансформации клеток 1110 компонентами, необходимыми для проведения генетической модификации при помощи направляемой нуклеиновой кислотой нуклеазы. Например, клетки могут быть трансформированы одновременно отдельными движущим и модифицирующим векторами; клетки могут уже экспрессировать нуклеазу (например, клетки могут быть уже трансформированы движущим вектором, или кодирующая последовательность для нуклеазы может быть стабильно интегрирована в клеточный геном), так что лишь модифицирующий вектор необходимо вводить трансформацией в клетки; или клетки могут быть трансформированы одним вектором, содержащим все компоненты, необходимые для проведения модификации генома при помощи направляемой нуклеиновой кислотой нуклеазы.
[00248] Как описано выше, можно использовать различные системы доставки для введения (например, путем трансформации или трансфекции) компонентов системы генетической модификации с направляемой нуклеиновой кислотой нуклеазой в клетку-хозяина 1110. Эти системы доставки включают использование дрожжевых систем, систем липофекции, систем микроинъекции, биолистических систем, виросом, липосом, иммунолипосом, поликатионов, конъюгатов липид:нуклеиновая кислота, вирионов, искусственных вирионов, вирусных векторов, электропорации, проникающих в клетку пептидов, наночастиц, нанопроводов, экзосом. Альтернативно, можно использовать липосомы - молекулярного «троянского коня» - для доставки компонентов системы с направляемой нуклеиновой кислотой нуклеазой через гематоэнцефалический барьер. Представляет интерес, особенно в контексте многомодульного прибора для генетической модификации клеток, использование электропорации, в частности, проточной электропорации (либо в виде автономного прибора, либо в виде модуля в автоматизированной многомодульной системе), как описано, например, в USSN 16/147120, поданном 28 сентября 2018 г.; 16/147353, поданном 28 сентября 2018 г.; 16/147865, поданном 30 сентября 2018 г. и 16/147871, поданном 30 сентября 2018 г. Если плотностенный модуль для разделения на одиночные клетки/выращивания/генетической модификации/нормализации представляет собой один модуль в автоматизированной многомодульной системе генетической модификации клеток, клетки, наиболее вероятно, трансформируют в автоматизированном модуле для трансформации клеток.
[00249] После трансформации клеток компонентами, необходимыми для проведения генетической модификации при помощи направляемой нуклеиновой кислотой нуклеазы, клетки распределяют по одной в микролунки, например, в плотностенном устройстве 1120; то есть, клетки разбавляют (при необходимости) в жидкой среде для культивирования клеток (в некоторых вариантах осуществления включающей Tween в концентрации 0,1% или менее для достижения хорошего распределения), так что клетки, доставляемые в плотностенное устройство, заполняют микролунки плотностенного устройства в соответствии с распределением Пуассона, или почти распределением Пуассона. Разделение на одиночные клетки имеет место, когда в среднем ½ клетки доставляется в каждую микролунку; то есть, при этом некоторые микролунки содержат одну клетку, и другие микролунки не содержат клетки.
[00250] После того, как клетки в данном варианте осуществления были разделены на одиночные клетки в 1100a, клетки активно подвергаются генетической модификации, поскольку «аппарат» генетической модификации находится под контролем конститутивного промотора. Поскольку клетки подвергаются генетической модификации, они растут в колонии конечного размера 1130; то есть, колонии, возникающие из одиночных клеток, растут до того момента, когда рост клеток достигает пика и нормализуется или насыщается как для генетически модифицированных, так и генетически не модифицированных, клеток. Нормализация происходит, поскольку питательные вещества в среде вокруг растущей колонии клеток истощаются и/или растущие клетки заполняют микролунки и дальнейший рост ограничивается. Опять-таки, в варианте осуществления 1100a, представленном на ФИГ. 11, модифицирующие компоненты находятся под контролем конститутивного промотора; таким образом, генетическая модификация начинается немедленно (или почти немедленно) после трансформации. Однако в других вариантах осуществления, например, в варианте осуществления, показанном на 1100b, который описан ниже, одна, или обе, из нуклеазы и нуклеиновой кислоты-гида (а также, например, компоненты системы рекомбинации «λ red» в бактериальных системах) могут находиться под контролем индуцируемого промотора, в этом случае генетическая модификация может быть индуцирована после, например, нужного числа удвоений клеток. Возвращаясь к способу 1100a, конечного размера колонии объединяют 1140 путем вымывания клональных клеточных колоний из микролунок для смешивания клеток из нормализованных клеточных колоний. Опять-таки, поскольку разделение на одиночные клетки позволяет преодолевать ростовые преимущества генетически не модифицированных клеток или клеток, демонстрирующих адаптивные эффекты в результате произведенных модификаций, разделение на одиночные клетки/нормализация само по себе обогащает общую популяцию клеток клетками, которые были генетически модифицированы; то есть разделение на одиночные клетки в сочетании с нормализацией (например, выращиванием колоний до конечного размера) делает возможным высокопроизводительное обогащение генетически модифицированных клеток.
[00251] Способ 1100b, показанный на ФИГ. 11, аналогичен способу 1100a в том, что интересующие клетки трансформируют 1110 компонентами, необходимыми для проведения генетической модификации при помощи направляемой нуклеиновой кислотой нуклеазы. Как описано выше, клетки могут быть трансформированы одновременно как движущим, так и модифицирующим, векторами, клетки могут уже экспрессировать нуклеазу (например, клетки могут быть уже трансформированы движущим вектором, или кодирующая последовательность для нуклеазы может быть стабильно интегрирована в клеточный геном), так что лишь модифицирующий вектор необходимо вводить трансформацией в клетки; или клетки могут быть трансформированы одним вектором, содержащим все компоненты, необходимые для проведения модификации генома при помощи направляемой нуклеиновой кислотой нуклеазы. Кроме того, если модуль для разделения на одиночные клетки/выращивания/генетической модификации/нормализации представляет собой один модуль в автоматизированном многомодульном приборе для генетической модификации клеток, трансформацию клеток можно производить в автоматизированном модуле для трансформации клеток, описанном выше.
[00252] После трансформации клеток компонентами, необходимыми для проведения генетической модификации при помощи направляемой нуклеиновой кислотой нуклеазы, клетки разбавляют (при необходимости) в жидкой среде, так что клетки, доставляемые в плотностенное устройство, заполняют микролунки плотностенного устройства в соответствии с распределением Пуассона, или почти распределением Пуассона.
[00253] После помещения одиночных клеток в микролунки плотностенного устройства 1120 клеткам позволяют расти, например, на протяжении 2-150 или 5-120, или 10-100 удвоений, образуя клональные колонии 1150. После образования колоний в данном варианте осуществления 1100b индуцируют генетическую модификацию 1160, например, путем активации индуцируемых промоторов, которые контролируют транскрипцию одного или более компонентов, необходимых для генетической модификации при помощи направляемой нуклеиновой кислотой нуклеазы, например, транскрипцию гРНК, нуклеазы, или, в случае бактерий, системы рекомбинационной инженерии. После индукции генетической модификации 1160 многие генетически модифицированные клетки в клональных колониях погибают вследствие двухцепочечных разрывов ДНК, которые образуются в процессе генетической модификации; однако у некоторой процентной доли генетически модифицированных клеток геном становится модифицированным и двухцепочечный разрыв надлежащим образом восстанавливается. Эти генетически модифицированные клетки затем начинают расти и вновь образовывать колонии; однако рост генетически модифицированных колоний, как правило, отстает от роста клональных колоний, где не произошла генетическая модификация. Мелкие или медленно растущие колонии (генетически модифицированных клеток) отбирают в качестве лучших вариантов 1170.
[00254] На ФИГ. 12 представлена упрощенная блок-схема варианта осуществления иллюстративного автоматизированного многомодульного прибора для обработки клеток, включающего плотностенный модуль для разделения на одиночные клетки/выращивания/генетической модификации/нормализации для обогащения генетически модифицированных клеток. Прибор для обработки клеток 1200 может включать корпус 1244, резервуар для клеток, которые должны быть трансформированы или трансфицированы 1202, и ростовой модуль (устройство для выращивания клеток) 1204. Клетки, которые должны быть трансформированы, переносят из резервуара в ростовой модуль для культивирования до достижения клетками целевого значения OD. После достижения клетками целевого значения OD ростовой модуль может охлаждать или замораживать клетки для обработки в более позднее время, или клетки могут быть перенесены в фильтровальный модуль 1230, где клетки делают электрокомпетентными и концентрируют до объема, оптимального для трансформации клеток. Сконцентрированные клетки переносят в устройство для электропорации 1208 (например, модуль для трансформации/трансфекции). Иллюстративные устройства для электропорации, которые могут быть использованы в автоматизированных многомодульных приборах для обработки клеток, включают устройства для проточной электропорации, такие как устройства, описанные в USSN 16/147120, поданном 28 сентября 2018; 16/147353, поданном 28 сентября 2018 г.; 16/147865, поданном 30 сентября 2018 г., и 16/147871, поданном 30 сентября 2018 г., все из которых включены в настоящий документ посредством ссылки в полном объеме.
[00255] Помимо резервуара для хранения клеток система 1200 может включать резервуар для хранения кассет модифицирующих олигонуклеотидов 1216 и резервуар для хранения каркаса экспрессионного вектора 1218. Как кассеты модифицирующих олигонуклеотидов, так и каркас экспрессионного вектора, переносят из картриджа для реагентов в сборочный модуль для нуклеиновых кислот 1220, где кассеты модифицирующих олигонуклеотидов встраиваются в каркас экспрессионного вектора. Собранные нуклеиновые кислоты могут быть перенесены в необязательный модуль для очистки 1222 для обессоливания и/или других процедур очистки и/или концентрирования, необходимых для получения собранных нуклеиновых кислот для трансформации. Альтернативно, предварительно собранные нуклеиновые кислоты, например, модифицирующий вектор, можно хранить в резервуаре 1216 или 1218. После завершения процессов, происходящих в модуле очистки 1222, собранные нуклеиновые кислоты переносят, например, в устройство для электропорации 1205, которое уже содержит культуру клеток, выращенных до целевого значения OD и являющихся электрокомпетентными, через фильтровальный модуль 1230. В устройстве для электропорации 1208 собранные нуклеиновые кислоты вводят в клетки. После электропорации клетки переносят в комбинированный модуль для восстановления/селекции 1210.
[00256] После восстановления и, необязательно, селекции клетки переносят в модуль для разделения на одиночные клетки, генетической модификации и выращивания 1240, где клетки разбавляют и разделяют так, чтобы в среднем одна клетка находилась в одном компартменте. Разделенным одиночным клеткам позволяют расти в течение заранее определенного числа удвоений. После образования этих начальных колоний индуцируют генетическую модификацию, и генетически модифицированным клеткам дают возможность образовывать колонии, которые растут до конечного размера (например, колонии нормализуются). В некоторых вариантах осуществления генетическую модификацию индуцируют одним или более модифицирующими компонентами, находящимися под контролем индуцируемого промотора. В некоторых вариантах осуществления индуцируемый промотор активируют путем повышения температуры и «дезактивируют» путем снижения температуры. Альтернативно, в вариантах осуществления, в которых устройство для разделения на одиночные клетки представляет собой плотностенное устройство, включающее фильтр, образующий дно микролунок, плотностенное устройство можно переносить на чашку (например, чашку с агаром или даже в жидкую среду), содержащую среду с компонентом, который активирует или индуцирует генетическую модификацию, затем переносят в среду, которая дезактивирует генетическую модификацию. После вырастания колоний до конечного размера колонии объединяют. Опять-таки, разделение на одиночные клетки позволяет преодолевать ростовые преимущества генетически не модифицированных клеток и ростовые преимущества, возникающие вследствие адаптационных эффектов других генетический модификаций.
[00257] Все из модулей для восстановления, селекции, разделения на одиночные клетки, индукции, генетической модификации и роста клеток могут быть отдельными, могут быть организованы и объединены, как показано на ФИГ. 12, или могут быть организованы и объединены в других конфигурациях. В конкретных вариантах осуществления все процессы из восстановления, селекции, разделения на одиночные клетки, роста, генетической модификации и нормализации проводят в плотностенном устройстве. Альтернативно, восстановление, селекцию и разбавление, при необходимости, проводят в жидкой среде в отдельном сосуде (модуле), затем клетки переносят в плотностенный модуль для разделения на одиночные клетки/выращивания/индукции/генетической модификации/нормализации.
[00258] После объединения нормализованных колоний клеток клетки можно хранить, например, в модуле для хранения 1212, где клетки можно хранить, например, при температуре 4°C до извлечения клеток для другого исследования. Альтернативно, клетки можно использовать в другом раунде генетической модификации. Многомодульный прибор для обработки клеток контролируется процессором 1242, сконфигурированным для работы с прибором на основе пользовательского ввода, в соответствии с указаниями одного или более скриптов, или на основе комбинации пользовательского ввода и скрипта. Процессор 1242 может контролировать расписание, продолжительность, температуру и функционирование различных модулей системы 500 и распределение реагентов. Например, процессор 1242 может охлаждать клетки после трансформации до желательного начала генетической модификации, когда температура может быть повышена до температуры, благоприятной для модификации генома и роста клеток. Процессор может быть запрограммирован на стандартные параметры протокола, из которых пользователь может выбирать, пользователь может корректировать один или более параметров вручную, или в одном или более скриптах, связанных с картриджем для реагентов, могут быть конкретизированы одна или более операций и/или параметров реакций. Кроме того, процессор может уведомлять пользователя (например, через приложение на смартфоне или другом устройстве), что клетки достигли целевого значения OD, а также информировать пользователя относительно прогрессирующего состояния клеток в разных модулях многомодульной системы.
[00259] Автоматизированный многомодульный прибор для обработки клеток 1200 представляет собой систему для управляемой нуклеазой модификации генома, и может быть использован в качестве системы для одинарной генетической модификации (например, внесения одной или более модификаций в клеточный геном в одном процессе генетической модификации). Представленная на Фигуре 13 система, описанная ниже, предназначена для проведения последовательной генетической модификации, например, с использованием разных управляемых нуклеазой систем последовательно для внесения двух или более модификаций генома в клетке; и/или рекурсивной генетической модификации, например, с использованием одной управляемой нуклеазой системы для последовательного внесения двух или более модификаций генома в клетке.
[00260] На Фигуре 13 представлен другой вариант осуществления многомодульного прибора для обработки клеток. Данный вариант осуществления представляет собой иллюстративную систему, выполняющую рекурсивную генетическую модификацию в популяции клеток. Как и в случае варианта осуществления, показанного на ФИГ. 12, прибор для обработки клеток 1300 может включать корпус 1344, резервуар для клеток, которые должны быть трансформированы или трансфицированы 1302, и ростовой модуль для клеток (включающий, например, ротационную ростовую бутыль) 1304. Клетки, которые должны быть трансформированы, переносят из резервуара в ростовой модуль для культивирования до достижения клетками целевого значения OD. После достижения клетками целевого значения OD ростовой модуль может охлаждать или замораживать клетки для обработки в более позднее время, или клетки могут быть перенесены в фильтровальный модуль 1360, где заменяют буфер для клеток, делают их электрокомпетентными, при этом объем клеток может быть значительно уменьшен. После концентрирования клеток до подходящего объема клетки переносят в устройство для электропорации 1308. Помимо резервуара для хранения клеток многомодульный прибор для обработки клеток включает резервуар для хранения вектора, предварительно собранного с кассетами модифицирующих олигонуклеотидов 1352. Предварительно собранные нуклеотидные векторы переносят в устройство для электропорации 1308, которое уже содержит культуру клеток, выращенных до целевого значения OD. В устройстве для электропорации 1308 нуклеиновые кислоты вводят методом электропорации в клетки. После электропорации клетки переносят в необязательный модуль для восстановления 1356, где клетки оставляют ненадолго для восстановления после трансформации.
[00261] После восстановления клетки могут быть перенесены в модуль для хранения 1312, где клетки можно хранить, например, при 4°C до обработки в более позднее время, или клетки могут быть разбавлены и перенесены в модуль для селекции/разделения на одиночные клетки/выращивания/индукции/генетической модификации/нормализации 1358. В модуле для разделения на одиночные клетки/генетической модификации/выращивания 1358 клетки распределяются так, что в среднем одна клетка находится в одной микролунке. Распределенные клетки могут находиться в селективной среде для отбора клеток, которые были трансформированы или трансфицированы модифицирующим вектором(ами). После разделения одиночные клетки растут на протяжении 2-50 удвоений и образуют колонии. После образования колоний индуцируют генетическую модификацию путем создания условий (таких как, например, температура, добавление индуцирующего или подавляющего химического реагента) для индукции генетической модификации. После проведения генетической модификации клетки оставляют расти до конечного размера колоний (например, нормализации колоний) в микролунках, а затем их можно вымывать из лунок и объединять, после чего переносить в блок хранения (или восстановления) 1314, или можно переносить в ростовой модуль 1304 для другого раунда генетической модификации. Между объединением клеток и переносом клеток в ростовой модуль могут иметь место один или более дополнительных этапов, таких как восстановление клеток, замена среды, концентрирование клеток и так далее, например, путем фильтрования. Следует отметить, что модули для селекции/разделения на одиночные клетки/выращивания/индукции/генетической модификации и нормализации могут представлять собой один и тот же модуль, в котором все процессы происходят в плотностенном устройстве, или селекция и/или разбавление могут происходить в отдельном сосуде перед тем, как клетки переносят в плотностенный модуль для разделения на одиночные клетки/выращивания/индукции/генетической модификации/нормализации (плотностенное устройство). В качестве альтернативы разделению на одиночные клетки, например, в плотностенном устройстве, трансформированные клетки могут расти в - и генетическая модификация может быть индуцирована в - общем объеме жидкости, как описано выше применительно к ФИГ. 8F-8H. После объединения предположительно генетически модифицированных клеток их можно подвергать другому раунду генетической модификации, начиная с выращивания, концентрирования клеток и обработки для придания им электрокомпетентности, а также трансформации другой донорской нуклеиновой кислотой в другой модифицирующей кассете в модуле для электропорации 1308.
[00262] В устройстве для электропорации 1308 клетки, отобранные в первом раунде генетической модификации, трансформируют вторым набором модифицирующих олигонуклеотидов (или олигонуклеотидами другого типа), и цикл повторяют до завершения трансформации и генетической модификации клеток нужным количеством, например, модифицирующих кассет. Многомодульный прибор для обработки клеток, приведенный в качестве примера на Фигуре 13, контролируется процессором 1342, сконфигурированным для работы с прибором на основе пользовательского ввода, или контролируется при помощи одного или более скриптов, включая по меньшей мере один скрипт, связанный с картриджем для реагентов. Процессор 1342 может контролировать расписание, продолжительность и температуру различных процессов, распределение реагентов и другие операции различных модулей прибора 1300. Например, скрипт или процессор может контролировать распределение клеток, реагентов, векторов и модифицирующих олигонуклеотидов; какие модифицирующие олигонуклеотиды используются для модификации клеток и в каком порядке; время, температуру и другие условия, используемые в модуле для восстановления и экспрессии, длину волны, при которой считывается значение OD в ростовом модуле для клеток, целевое значение OD, до которого выращивают клетки, и запланированное время достижения клетками целевого значения OD. Кроме того, процессор может быть запрограммирован для уведомления пользователя (например, через приложение) о прогрессирующем состоянии клеток в автоматизированном многомодульном приборе для обработки клеток.
[00263] Специалисту в данной области должно быть понятно, с учетом описания настоящего изобретения, что описанный процесс может быть рекурсивным и мультиплексным; то есть, клетки можно проводить через этапы технологического процесса, описанного применительно к Фигуре 13, затем полученную генетически модифицированную культуру можно проводить через другой (или несколько, или множество) раунд дополнительной генетической модификации (например, рекурсивной генетической модификации) с использованием других модифицирующих векторов. Например, клетки из раунда 1 генетической модификации можно разбавлять, и аликвоту генетически модифицированных клеток, модифицированных модифицирующим вектором A, можно объединять с модифицирующим вектором B, аликвоту генетически модифицированных клеток, модифицированных модифицирующим вектором A, можно объединять с модифицирующим вектором C, аликвоту генетически модифицированных клеток, модифицированных модифицирующим вектором A, можно объединять с модифицирующим вектором D, и так далее, для второго раунда генетической модификации. После раунда два аликвоту каждых из дважды генетически модифицированных клеток можно подвергать третьему раунду генетической модификации, в котором, например, аликвоты всех из AB-, AC-, AD-генетически модифицированных клеток объединяют с дополнительными модифицирующими векторами, такими как модифицирующие векторы X, Y и Z. Это значит, что дважды генетически модифицированные клетки AB можно объединять с, и генетически модифицировать, векторами X, Y и Z, с получением трижды генетически модифицированных клеток ABX, ABY и ABZ; дважды генетически модифицированные клетки AC можно объединять с, и генетически модифицировать, векторами X, Y и Z , с получением трижды генетически модифицированных клеток ACX, ACY и ACZ; и дважды генетически модифицированные клетки AD можно объединять с, и генетически модифицировать, векторами X, Y и Z, с получением трижды генетически модифицированных клеток ADX, ADY и ADZ, и так далее. В данном процессе можно производить множество пермутаций и комбинаций генетических модификаций, получая в результате очень разнообразные клеточные популяции и клеточные библиотеки. В любом рекурсивном процессе предпочтительно проводить «излечение» от предыдущих движущих и модифицирующих векторов (или одного движущего+модифицирующего вектора в одной векторной системе). «Излечение» представляет собой процесс, в котором один или более векторов, используемых в предшествующем раунде генетической модификации, удаляют из трансформированных клеток. Излечение можно осуществлять, например, путем расщепления вектора(ов) с использованием излечивающей плазмиды, которая лишает модифицирующий и/или движущий вектор (или один комбинированный вектор) функциональности; разбавления вектора(ов) в клеточной популяции за счет роста клеток (то есть, чем больше циклов роста, через которые пройдут клетки, тем меньше дочерних клеток сохранят модифицирующий или движущий вектор(ы)), или, например, путем использования чувствительной к нагреванию точки начала репликации на модифицирующем или движущем векторе (или комбинированном движущем+модифицирующем векторе). Условия для излечивания будут зависеть от механизма, используемого для излечивания; то есть, в данном примере, от того, как излечивающая плазмида расщепляет модифицирующую и/или движущую плазмиду.
[00264] На ФИГ. 14 представлена упрощенная блок-схема варианта осуществления иллюстративного автоматизированного многомодульного прибора для обработки клеток, включающего большой жидкостной ростовой модуль для индуцированной генетической модификации и обогащения по генетически модифицированным клеткам, как описано выше применительно к ФИГ. 8H-8F. Прибор для обработки клеток 1400 может включать корпус 1444, резервуар для клеток, которые должны быть трансформированы или трансфицированы 1402, и ростовой модуль (устройство для выращивания клеток) 1404. Клетки, которые должны быть трансформированы, переносят из резервуара в ростовой модуль для культивирования до достижения клетками целевого значения OD. После достижения клетками целевого значения OD ростовой модуль может охлаждать или замораживать клетки для обработки в более позднее время, или клетки могут быть перенесены в фильтровальный модуль 1430, где клетки делают электрокомпетентными и концентрируют до объема, оптимального для трансформации клеток. Сконцентрированные клетки затем переносят в устройство для электропорации 1408 (например, модуль для трансформации/трансфекции). Иллюстративные устройства для электропорации, используемые в автоматизированном многомодульном приборе для обработки клеток, включают устройства для проточной электропорации, такие как устройства, описанные в USSN 16/147120, поданном 28 сентября 2018 г.; 16/147353, поданном 28 сентября 2018 г.; 16/147865, поданном 30 сентября 2018 г.; и 16/147871, поданном 30 сентября 2018 г., все из которых включены в настоящий документ посредством ссылки в полном объеме.
[00265] Помимо резервуара для хранения клеток система 1400 может включать резервуар для хранения модифицирующих кассет 1416 и резервуар для хранения каркаса экспрессионного вектора 1418. Как кассеты модифицирующих олигонуклеотидов, так и каркас экспрессионного вектора, переносят из картриджа для реагентов в сборочный модуль для нуклеиновых кислот 1420, где кассеты модифицирующих олигонуклеотидов встраиваются в каркас экспрессионного вектора. Собранные нуклеиновые кислоты могут быть перенесены в необязательный модуль для очистки 1422 для обессоливания и/или других процедур очистки и/или концентрирования, необходимых для получения собранных нуклеиновых кислот для трансформации. Альтернативно, предварительно собранные нуклеиновые кислоты, например, модифицирующий вектор, можно хранить в резервуаре 1416 или 1418. После завершения процессов, происходящих в модуле очистки 1422, собранные нуклеиновые кислоты переносят, например, в устройство для электропорации 1408, которое уже содержит культуру клеток, выращенных до целевого значения OD и являющихся электрокомпетентными, через фильтровальный модуль 1430. В устройстве для электропорации 1408 собранные нуклеиновые кислоты вводят в клетки. После электропорации клетки переносят в комбинированный модуль для восстановления/селекции 1410. Для описания примеров многомодульного прибора для генетической модификации клеток смотри USSN 16/024816 и 16/024831, поданные 30 июня 2018 г., оба из которых включены в настоящий документ посредством ссылки в полном объеме.
[00266] После восстановления и, необязательно, селекции клетки переносят в модуль для выращивания, индукции и генетической модификации (объемная жидкая культура) 1440. Клеткам позволяют расти до достижения клетками стационарной фазы роста (или почти таковой), затем индуцируют генетическую модификацию путем индукции транскрипции одной, или обеих, из нуклеазы и гРНК. В некоторых вариантах осуществления генетическую модификацию индуцируют транскрипцией одной, или обеих, из нуклеазы и гРНК, находящихся под контролем индуцируемого промотора. В некоторых вариантах осуществления индуцируемый промотор представляет собой промотор pL, который активируют путем повышения температуры и «дезактивируют» путем снижения температуры.
[00267] Все из модулей для восстановления, селекции, выращивания, индукции, генетической модификации и хранения могут быть отдельными, могут быть организованы и объединены, как показано на ФИГ. 14, или могут быть организованы и объединены в других конфигурациях. В конкретных вариантах осуществления восстановление и селекцию проводят в одном модуле, и выращивание, генетическую модификацию и повторное выращивание проводят в отдельном модуле. Альтернативно, восстановление, селекцию, выращивание, генетическую модификацию и повторное выращивание проводят в одном модуле.
[00268] После генетической модификации и повторного выращивания клеток (например, восстановления после генетической модификации) клетки можно хранить, например, в модуле для хранения 1412, где клетки могут находиться, например, при температуре 4°C до их извлечения для дальнейшего исследования. Альтернативно, клетки можно использовать в другом раунде генетической модификации. Многомодульный прибор для обработки клеток контролируется процессором 1442, сконфигурированным для работы с прибором на основе пользовательского ввода, в соответствии с указаниями одного или более скриптов, или на основе комбинации пользовательского ввода и скрипта. Процессор 1442 может контролировать расписание, продолжительность, температуру и функционирование различных модулей системы 1400 и распределение реагентов. Например, процессор 1442 может охлаждать клетки после трансформации до желательного начала генетической модификации, когда температура может быть повышена до температуры, благоприятной для модификации генома и роста клеток. Процессор может быть запрограммирован на стандартные параметры протокола, из которых пользователь может выбирать, пользователь может корректировать один или более параметров вручную, или в одном или более скриптах, связанных с картриджем для реагентов, могут быть конкретизированы одна или более операций и/или параметров реакций. Кроме того, процессор может уведомлять пользователя (например, через приложение на смартфоне или другом устройстве), что клетки достигли целевого значения OD, а также информировать пользователя относительно прогрессирующего состояния клеток в разных модулях многомодульной системы.
ПРИМЕРЫ
[00269] Следующие примеры приведены с целью предоставления специалистам в данной области полного раскрытия и описания осуществления и применения настоящего изобретения, и не предназначены для ограничения объема того, что авторы заявки считают своим изобретением, они также не должны означать, или подразумевать, что описанные ниже эксперименты являются всеми, или единственными, проведенными экспериментами. Специалисты в данной области поймут, что различные вариации и/или модификации могут быть внесены в изобретение, представленное в конкретных аспектах, без отклонения от сущности или объема изобретения, описанного в широком смысле. Таким образом, настоящие аспекты следует считать во всех отношениях иллюстративными и не ограничивающими.
Пример 1: Выращивание в ростовом модуле для клеток
[00270] Один вариант осуществления устройства для выращивания клеток, описанного в настоящем документе, тестировали относительно обычно используемого шейкера для клеток, встряхивающего 5-мл пробирку, и орбитального шейкера, встряхивающего 125-мл колбу с дефлекторами, для оценки клеточного роста бактериальных и дрожжевых клеток. Кроме того, рост бактериальной клеточной культуры и дрожжевой клеточной культуры контролировали в реальном времени с использованием варианта осуществления устройства для выращивания клеток, описанного в настоящем документе.
[00271] В первом примере 20 мл клеток EC23 (клеток E. coli) в LB выращивали в 35-мл ротационной ростовой бутыли с 2-лопастной конфигурацией при 30°C, используя устройство для выращивания клеток, описанное в настоящем документе. Ротационная ростовая бутыль вращалось со скоростью 600 об/мин и с периодическим изменением движения (то есть, изменялось направление движения) каждую 1 секунду. Параллельно, 5 мл клеток EC23 в LB выращивали в 5-мл пробирке при 30°C и встряхивали с частотой 750 об/мин. OD600 измеряли через определенные интервалы с использованием спектрофотометра NanoDrop™ (Thermo Fisher Scientific). Результаты представлены на ФИГ. 15. С ротационной ростовой бутылью/устройством для выращивания клеток были получены лучшие результаты, чем с шейкером для клеток, при выращивании клеток до OD600 2,6 через период времени немного более 4 часов. Другой эксперимент проводили в тех же условиях (объемы, клетки, изменение движения), единственное отличие заключалось в использовании 3-лопастной ротационной ростовой бутыли с устройством для выращивания клеток, и результаты представлены на ФИГ. 16. Опять-таки, с ротационной ростовой бутылью/устройством для выращивания клеток были получены лучшие результаты, чем с шейкером для клеток, при выращивании клеток до OD600 1,9.
[00272] Проводили два дополнительных эксперимента, в этом случае сравнивая ротационную ростовую бутыль/устройство для выращивания клеток с колбой с дефлекторами и орбитальным шейкером. В одном эксперименте 20 мл клеток EC138 (клеток E. coli) в LB выращивали в 35-мл ротационной ростовой бутыли с 4-лопастной конфигурацией при 30°C. Ротационная ростовая бутыль вращалась со скоростью 600 об/мин и с периодическим изменением движения (то есть, изменялось направление движения) каждую 1 секунду. Параллельно 20 мл клеток EC138 в LB выращивали в 125-мл колбе с дефлекторами при 30°C с использованием орбитального шейкера. OD600 измеряли через определенные интервалы с использованием спектрофотометра NanoDrop™ (Thermo Fisher Scientific). Результаты, представленные на ФИГ. 17, показывают, что ротационная ростовая бутыль/устройство для выращивания клеток была не менее эффективна, чем орбитальный шейкер, при выращивании клеток до OD600 1,0. Во втором эксперименте 20 мл клеток EC138 (клеток E. coli) в LB выращивали в 35-мл ротационной ростовой бутыли с 2-лопастной конфигурацией при 30°C с использованием устройства для выращивания клеток, описанного в настоящем документе. Ротационная ростовая бутыль вращалась со скоростью 600 об/мин и с периодическим изменением движения (то есть, изменялось направление движения) каждую 1 секунду. Параллельно 20 мл клеток EC138 в LB выращивали в 125-мл колбе с дефлекторами при 30°C с использованием орбитального шейкера. OD600 измеряли через определенные интервалы с использованием спектрофотометра NanoDrop™ (Thermo Fisher Scientific). Результаты, представленные на ФИГ. 18, показывают, что что ротационная ростовая бутыль/устройство для выращивания клеток была не менее - или даже более - эффективной, чем орбитальный шейкер при выращивании клеток до OD600 1,2.
[00273] В другом эксперименте использовали ротационную ростовую бутыль/устройство для выращивания клеток для измерения OD600 в реальном времени. На ФИГ. 19 представлен график, показывающий результаты измерения в реальном времени роста культуры клеток EC138 при 30°C с вращением в переменном направлении при использовании 2-лопастной ротационной ростовой бутыли. Следует отметить, что значение OD600 2,6 было достигнуто через 4,4 часа.
[00274] В другом эксперименте использовали ротационную ростовую бутыль/устройство для выращивания клеток для измерения OD600 в реальном времени для дрожжевых клеток s288c в YPAD. Клетки выращивали при 30°C с вращением в переменном направлении, используя 2-лопастную ротационную ростовую бутыль. На ФИГ. 20 представлен построенный по результатам график. Следует отметить, что значение OD600 6,0 было достигнуто через 14 часов.
Пример 2: Концентрирование клеток
[00275] Модуль TFF, описанный выше применительно к ФИГ. 6A-6I, был успешно использован для обработки, и замены буфера, клеток E. coli и дрожжевых культур. При концентрировании культуры E. coli выполняли следующие этапы:
[00276] Сначала 20 мл культуры клеток E. coli в LB, выращенных до OD 0,5-0,62, пропускали через устройство TFF в одном направлении, затем пропускали через устройство TFF в обратном направлении. К этому времени клетки были сконцентрированы до объема примерно 5 мл. Затем 50 мл 10% глицерина добавляли к концентрированным клеткам, и клетки пропускали через устройство TFF в одном направлении, в противоположном направлении, и вновь в первом направлении, всего три прохождения. Опять-таки, клетки были сконцентрированы до объема примерно 5 мл. Вновь 50 мл 10% глицерина добавляли к 5 мл клеток, и клетки пропускали через устройство TFF три раза. Этот процесс повторяли; то есть, вновь 50 мл 10% глицерина добавляли к клеткам, сконцентрированным до объема 5 мл, и клетки три раза пропускали через устройство TFF. После завершения третьего прохождения трех 50-мл промывающих объемов 10% глицерина, клетки вновь концентрировали до примерно 5 мл 10% глицерина. Затем клетки пропускали в чередующихся направлениях через устройство TFF еще три раза, при этом клетки были сконцентрированы до объема примерно 400 мкл.
[00277] Измеряли проводимость фильтрата и время обработки с использованием фильтра для E. coli, результаты представлены на ФИГ. 21A. Эффективность фильтра количественно определяли путем измерения времени и количества прохождений через фильтр, которые были необходимы для достижения целевой электрической проводимости раствора. Удерживание клеток определяли путем сравнения оптической плотности (OD600) культуры клеток до и после фильтрования. Состояние фильтра контролировали путем измерения скорости потока через мембрану во время каждого прохождения через фильтр. Целевая проводимость (~16 мкСм/см) была достигнута через примерно 30 минут при использовании трех промываний 50 мл 10% глицерина и трех прохождений клеток через устройство для каждого промывания. Объем клеток был уменьшен с 20 мл до 400 мкл, и было достигнуто извлечение примерно 90% клеток.
[00278] Тот же процесс повторяли с культурами дрожжевых клеток. Дрожжевую культуру исходно концентрировали до объема примерно 5 мл, используя два прохождения через устройство TFF в противоположных направлениях. Клетки промывали 50 мл 1M сорбита три раза, с тремя прохождениями через устройство TFF после каждого промывания. После третьего прохождения клеток после последнего промывания 1M сорбитом клетки пропускали через устройство TFF два раза, при этом культура дрожжевых клеток была сконцентрирована до объема примерно 525 мкл. На ФИГ. 21B показана эффективность фильтра при замене буфера для дрожжевых клеток, определяемая путем измерения проводимости фильтрата и времени прохождения через фильтр. Целевая проводимость (~10 мкСм/см) была достигнута через примерно 23 минуты при использовании трех промываний 50 мл 1M сорбита и трех прохождений через устройство TFF для каждого промывания. Объем клеток был уменьшен с 20 мл до 525 мкл. Было достигнуто извлечение примерно 90% клеток.
Пример 3: Получение и трансформация электрокомпетентных клеток E. coli и S. cerevisiae
[00279] Для тестирования трансформации на устройстве FTEP создавали электрокомпетентные клетки E. coli. Для создания исходной культуры 6-мл объемы LB хлор-25 (LB с 25 мкг/мл хлорамфеникола) переносили в 14-мл пробирки для культивирования. 25-мкл аликвоту E. coli использовали для инокуляции пробирок с LB хлор-25. После инокуляции пробирки помещали под углом 45° в шейкер-инкубатор, установленный на 250 об/мин и 30°C, для роста в течение ночи, 12-16 часов. Значение OD600 должно составлять от 2,0 до 4,0. 1:100 объем инокулята из 250-мл пробирок с LB хлор-25 переносили в четыре стерильные 500-мл встряхиваемые колбы с дефлекторами, то есть, 2,5 мл на встряхиваемую колбу объемом 250 мл. Колбы помещали в шейкер-инкубатор, установленный на 250 об/мин и 30°C. Рост контролировали путем измерения OD600 каждые 1-2 часа. Когда OD600 культуры достигало значений 0,5-0,6 (примерно 3-4 часа), колбы извлекали из инкубатора. Клетки центрифугировали при 4300 об/мин, 10 мин, 4°C. Супернатант отбрасывали, и 100 мл ледяного 10% глицерина переносили в каждый образец. Клетки осторожно ресуспендировали, и процедуру промывания проводили три раза, каждый раз ресуспендируя клетки в 10% глицерине. После четвертого центрифугирования суспензию клеток переносили в 50-мл коническую пробирку Falcon, и дополнительно добавляли ледяной 10% глицерин для доведения объема до 30 мл. Клетки вновь центрифугировали при 4300 об/мин, 10 мин, 4°C, супернатант отбрасывали, и осадок клеток ресуспендировали в 10 мл ледяного глицерина. Клетки разделяли на аликвоты, содержащие клеточную суспензию, 1:100 разведенную ледяным глицерином.
[00280] Проводили сравнительный эксперимент с электропорацией для определения эффективности трансформации электрокомпетентных клеток E. coli с использованием описанного устройства FTEP. Скорость потока контролировали системой контроля давления. Суспензию клеток с ДНК вносили во входной резервуар FTEP. Трансформированные клетки протекали непосредственно из входного отверстия и входного канала, через проточный канал, через выходной канал и в выходной резервуар, содержащий среду для восстановления. Клетки переносили в пробирку, содержащую дополнительную среду для восстановления, помещали в шейкер-инкубатор на 30°C, встряхивающий при 250 об/мин, на 3 часа. Клетки высевали для определения колониеобразующих единиц (КОЕ) клеток, переживших электропорацию и не поглотивших плазмиду, и КОЕ клеток, переживших электропорацию и поглотивших плазмиду. Планшеты инкубировали при 30°C; колонии E. coli подсчитывали через 24 часа.
[00281] Эксперименты с проточной электропорацией сравнивали с использованием 2-мм кювет для электропорации (Bull dog Bio) при применении in vitro высоковольтного прибора для электропорации (NEPAGENE™ ELEPO21). Готовили пробирки с маточной суспензией клеток с ДНК и использовали в параллельных экспериментах с NEPAGENE™ и проточной электропорацией. Результаты представлены на ФИГ. 22A. На ФИГ. 22A крайние слева столбики, заштрихованные ///, показывают количество введенных клеток, столбики слева, заштрихованные \\\, показывают количество клеток, переживших трансформацию, и столбики справа, заштрихованные ///, показывают количество клеток, которые фактически были трансформированы. Устройство FTEP продемонстрировало эквивалентную трансформацию электрокомпетентных клеток E. coli при разных значениях напряжения в сравнении с прибором для электропорации NEPAGENE™. Как можно видеть, степень выживаемости после трансформации составляет по меньшей мере 90%, и в некоторых вариантах осуществления по меньшей мере 95%, 96%, 97%, 98% или 99%. Степень восстановления (фракция введенных клеток, которые были успешно трансформированы и восстановились) в конкретных вариантах осуществления составляет по меньшей мере 0,001, и предпочтительно от 0,00001 до 0,01. На ФИГ. 25A степень восстановления составляет примерно 0,0001.
[00282] Кроме того, проводили сравнение прибора NEPAGENE™ ELEPO21 и устройства FTEP с точки зрения эффективности трансформации (поглощения), разрезания и генетической модификации. Как показано на ФИГ. 22B, проводили эксперименты в тройном повторе, при этом столбики, заштрихованные ///, показывают количество клеток, введенных для трансформации, и столбики, заштрихованные \\\, показывают количество клеток, которые были трансформированы (поглощение), количество клеток, в которых геном был разрезан нуклеазой, транскрибированной и транслированной с вектора, введенного трансформацией в клетки (разрезание), и количество клеток, в которых была осуществлена генетическая модификация (разрезание и репарация с использованием нуклеазы, транскрибированной и транслированной с вектора, введенного трансформацией в клетки, и с использованием РНК-гида и донорской последовательности ДНК, обе из которых были транскрибированы с вектора, введенного трансформацией в клетки). Опять-таки, можно видеть, что устройство FTEP продемонстрировало эквивалентную эффективность трансформации, разрезания и генетической модификации в сравнении с прибором для электропорации NEPAGENE™. Степень восстановления на ФИГ. 22B в случае FTEP выше, чем 0,001.
[00283] Для тестирования трансформации дрожжей в устройстве FTEP были созданы клетки S. cerevisiae с использованием способов, в целом, описанных в публикации Bergkessel and Guthrie, Methods Enzymol., 529:311-20 (2013). Вкратце, среду YFAP инокулировали для роста в течение ночи, при этом из 3 мл инокулята было получено 100 мл клеток. Обработка каждых 100 мл культуры приводила к получению примерно 1 мл компетентных клеток. Клетки инкубировали при 30°C в шейкере-инкубаторе до достижения значения OD600, составляющего 1,5 ± 0,1.
[00284] Кондиционирующий буфер готовили с использованием 100 мМ ацетата лития, 10 мМ дитиотреитола и 50 мл буфера для каждых 100 мл выращенных клеток и хранили при комнатной температуре. Клетки в 250-мл флаконах собирали центрифугированием при 4300 об/мин в течение 3 минут, и супернатант отбрасывали. Осадок клеток суспендировали в 100 мл холодного 1M сорбита, центрифугировали при 4300 об/мин в течение 3 минут, и супернатант вновь отбрасывали. Клетки суспендировали в кондиционирующем буфере, затем суспензию переносили в соответствующую колбу и встряхивали при 200 об/мин и 30°C в течение 30 минут. Суспензии переносили в 50-мл конические пробирки и центрифугировали при 4300 об/мин в течение 3 минут. Супернатант отбрасывали, и осадок ресуспендировали в холодном 1M сорбите. Эти этапы повторяли три раза для, в общей сложности, трех этапов промывания-центрифугирования-декантации. Осадок суспендировали в сорбите до конечного значения OD 150 ± 20.
[00285] Проводили сравнительный эксперимент с электропорацией для определения эффективности трансформации электрокомпетентных клеток S. cerevisiae с использованием устройства FTEP. Скорость потока контролировали шприцевым насосом (прибор Harvard PHD ULTRA™ 4400). Суспензию клеток с ДНК вносили в 1-мл стеклянный шприц (шприц Hamilton 81320, PTFE соединения Люэра) перед установкой в насос. Подачу энергии от функционального генератора включали сразу же после запуска потока. Обработанные клетки протекали непосредственно в пробирку, содержащую 1M сорбит с карбенициллином. Клетки собирали до того момента, когда такой же объем был подвергнут электропорации в приборе NEPAGENE™, после чего поток и подачу энергии от функционального генератора останавливали. После 3-часового восстановления в шейкере-инкубаторе при 30°C и 250 об/мин, клетки высевали для определения колониеобразующих единиц (КОЕ) клеток, переживших электропорацию и не поглотивших плазмиду, и КОЕ клеток, переживших электропорацию и поглотивших плазмиду. Планшеты инкубировали при 30°C. Колонии дрожжей подсчитывали через 48-76 часов.
[00286] Эксперименты с проточной электропорацией сравнивали с использованием 2-мм кювет для электропорации (Bull dog Bio) при применении in vitro высоковольтного прибора для электропорации (NEPAGENE™ ELEPO21). Готовили пробирки с маточной суспензией клеток с ДНК и использовали в параллельных экспериментах с NEPAGENE™ и проточной электропорацией. Результаты представлены на ФИГ. 23. Устройство продемонстрировало лучшие показатели трансформации и выживания электрокомпетентных клеток S. cerevisiae при напряжении 2,5 кВ в сравнении со способом NEPAGENE™. Введенное количество соответствует общему количеству клеток, которые были обработаны.
Пример 4: Эксперимент с полностью автоматизированной однократной RGN-направляемой генетической модификацией
[00287] Однократная автоматизированная модификация генома с использованием нуклеазы MAD7 была успешно проведена с использованием автоматизированного многомодульного прибора по изобретению. Смотри патент США № 9982279 и USSN 16/024831, поданный 30 июня 2018 г.; 16/024816, поданный 30 июня 2018 г.; 16/147353, поданный 28 сентября 2018 г.; 16/147865, поданный 30 сентября 2018 г.; и 16/147871, поданный 30 июня 2018 г.
[00288] Каркас плазмиды ampR и модифицирующую кассету lacZ_F172* собирали при помощи Gibson Assembly® в «модифицирующий вектор» в изотермическом сборочном модуле для нуклеиновых кислот, включенном в автоматизированный прибор. lacZ_F172 функционально выключает ген lacZ. «lacZ_F172*» указывает на то, что модификация происходит на 172-м остатке в аминокислотной последовательности lacZ. После сборки продукт обессоливали в изотермическом сборочном модуле для нуклеиновых кислот с использованием гранул AMPure, промывали 80% этанолом и элюировали в буфер. Собранный модифицирующий вектор и готовые к рекомбинационной инженерии электрокомпетентные клетки E. coli переносили в модуль для трансформации для электропорации. Клетки и нуклеиновые кислоты объединяли, оставляли для смешивания на 1 минуту и проводили электропорацию в течение 30 секунд. Параметры для порообразующего импульса были следующими: напряжение, 2400 В; длительность, 5 мс; интервал, 50 мс; количество импульсов, 1; полярность, +. Параметры импульсов для переноса были следующими: напряжение, 150 В; длительность, 50 мс; интервал, 50 мс; количество импульсов, 20; полярность, +/-. После электропорации клетки переносили в модуль для восстановления (другой ростовой модуль) и оставляли для восстановления в среде SOC, содержащей хлорамфеникол. Через 1 час к среде добавляли карбенициллин, и клетки оставляли восстанавливаться еще на 2 часа. После восстановления клетки хранили при 4°C до извлечения пользователем.
[00289] После автоматизированного процесса и восстановления аликвоту клеток высевали на агар Мак-Конки с добавлением лактозы (в качестве сахарного субстрата), хлорамфеникола и карбенициллина, и выращивали до появления колоний. Белые колонии представляли собой функционально генетически модифицированные клетки, пурпурные колонии представляли собой генетически не модифицированные клетки. Все перемещения жидкостей выполнялись автоматизированным устройством для манипуляций с жидкостями автоматизированного многомодульного прибора для обработки клеток.
[00290] В результате автоматизированной обработки всего примерно 1,0E-03 клеток были трансформированы (что сопоставимо с результатами для обычных настольных приборов), и эффективность генетической модификации составляла 83,5%. Генетическая модификация lacZ_172 в белых колониях была подтверждена секвенированием генетически модифицированной области генома клеток. Кроме того, этапы автоматизированной обработки клеток наблюдали удаленно с помощью веб-камеры, и были посланы текстовые сообщения для обновления статуса процедуры автоматизированной обработки.
Пример 5: Эксперимент с полностью автоматизированной рекурсивной генетической модификацией
[00291] Рекурсивную генетическую модификацию успешно осуществляли с использованием автоматизированной многомодульной системы обработки клеток. Каркас плазмиды ampR и модифицирующую кассету lacZ_V10* собирали при помощи Gibson Assembly® в «модифицирующий вектор» в изотермическом сборочном модуле для нуклеиновых кислот, включенном в автоматизированную систему. Аналогично генетической модификации lacZ_F172, модификация lacZ_V10 функционально выключает ген lacZ. «lacZ_V10» указывает на то, что модификация имеет место в аминокислотном положении 10 в аминокислотной последовательности lacZ. После сборки продукт обессоливали в изотермическом сборочном модуле для нуклеиновых кислот с использованием гранул AMPure, промывали 80% этанолом и элюировали в буфер. Первый собранный модифицирующий вектор и готовые к рекомбинационной инженерии электрокомпетентные клетки E. coli переносили в модуль для трансформации для электропорации. Клетки и нуклеиновые кислоты объединяли, оставляли для смешивания на 1 минуту и проводили электропорацию в течение 30 секунд. Параметры для порообразующего импульса были следующими: напряжение, 2400 В; длительность, 5 мс; интервал, 50 мс; количество импульсов, 1; полярность, +. Параметры импульсов для переноса были следующими: напряжение, 150 В; длительность, 50 мс; интервал, 50 мс; количество импульсов, 20; полярность, +/-. После электропорации клетки переносили в модуль для восстановления (другой ростовой модуль) и оставляли для восстановления в среде SOC, содержащей хлорамфеникол. Через 1 час к среде добавляли карбенициллин, и клетки оставляли расти еще на 2 часа. Затем клетки переносили в модуль для центрифугирования, после чего производили замену среды. Клетки ресуспендировали в среде TB, содержащей хлорамфеникол и карбенициллин, в которой клетки росли до OD600 2,7, после чего их концентрировали и делали электрокомпетентными.
[00292] В процессе роста клеток готовили второй модифицирующий вектор в изотермическом сборочном модуле для нуклеиновых кислот. Второй модифицирующий вектор содержал ген устойчивости к канамицину, и модифицирующая кассета содержала модификацию galK Y145*. В случае успеха генетическая модификация galK Y145* лишает клетки способности поглощать и метаболизировать галактозу. Генетическая модификация, создаваемая кассетой galK Y154*, вводит стоп-кодон в 154-й аминокислотный остаток, что приводит к изменению кодона для аминокислоты тирозина на стоп-кодон. Эта модификация делает продукт гена galK нефункциональным и лишает клетки способности метаболизировать галактозу. После сборки второй модифицирующий вектор обессоливали в изотермическом сборочном модуле для нуклеиновых кислот с использованием гранул AMPure, промывали 80% этанолом и элюировали в буфер. Собранный второй модифицирующий вектор и электрокомпетентные клетки E. coli (которые были трансформированы первым модифицирующим вектором и отобраны) переносили в модуль для трансформации для электропорации с использованием тех же параметров, которые описаны выше. После электропорации клетки переносили в модуль для восстановления (другой ростовой модуль) и оставляли для восстановления в среде SOC, содержащей карбенициллин. После восстановления клетки хранили при 4°C до извлечения, после чего аликвоту клеток высевали на LB агар с добавлением хлорамфеникола и канамицина. Для количественного определения как lacZ, так и galK, генетических модификаций создавали путем отпечатков реплики планшетов на среде двух типов: 1) агаре Мак-Конки с добавлением лактозы (в качестве сахарного субстрата), хлорамфеникола и канамицина, и 2) агаре Мак-Конки с добавлением галактозы (в качестве сахарного субстрата), хлорамфеникола и канамицина. Все перемещения жидкостей выполнялись автоматизированным устройством для манипуляций с жидкостями автоматизированной многомодульной системы для обработки клеток.
[00293] В данном эксперименте с рекурсивной генетической модификацией 41% подвергнутых скринингу колоний имели как lacZ, так и galK, генетические модификации, результаты были сопоставимы с эффективностью двойной генетической модификации, производимой с использованием «настольных» приборов или вручную.
Пример 6: Проектирование и создание библиотеки дрожжевого дисплея предполагаемых антигенов TCR
[00294] Связывающие мотивы для пептидов, представляемых человеческими молекулами MHC аллеля HLA-A*02, хорошо охарактеризованы (Falk, K., et al., Nature, 1991. 351(6324): p. 290-296; Glanville, J., et al., Nature, 2017. 547(7661): p. 94-98), и многие рестриктированные клинически важные TCR идентифицированы (Johnson, L.A., et al., Blood, 2009. 114(3): p. 535-546). Библиотеку дрожжевого дисплея для скрининга потенциальных HLA-A*02:01 рестриктированных TCR создают следующим образом. Библиотеку из примерно 10000 олигонуклеотидных модифицирующих кассет для введения синтетических пептидов пMHC (Glanville, J, выше) с разными последовательностями в геном S. cerevisiae проектируют и заказывают у компании Agilent (Santa Clara, CA).
[00295] Вкратце, структурные элементы каждой из олигонуклеотидных кассет являются следующими: область промотора, область РНК-гида CRISPR, необязательная область спейсера, гомологичный фрагмент и, необязательно, другие последовательности (например, штрихкоды), полезные для дальнейшего анализа, основанного на функциональном тесте, который будет использован для селекции и/или подтверждения конкретных генетических модификаций. Диапазон длин кассет составляет от 180 нт до 230 нт, в зависимости от вводимой генетической модификации и общего дизайна олигонуклеотидов. Дизайн гомологичного фрагмента включает замену на синонимичные кодоны (при необходимости) для создания сайта рестрикции, используемого для вставки константных областей кассеты. Эти константные области включают тяжелую цепь HLA-A*02:01 и белок AGA2P, обеспечивающий экспонирование на клеточной поверхности. Константная область также может содержать эпитопный маркер для облегчения последующего использования в селекциях.
[00296] Вкратце, структурные элементы каждой из олигонуклеотидных кассет являются следующими: область промотора, область РНК-гида CRISPR, необязательная область спейсера, гомологичный фрагмент и, необязательно, другие последовательности (например, штрихкоды), полезные для дальнейшего анализа, основанного на функциональном тесте, который будет использован для селекции и/или подтверждения конкретных генетических модификаций. Диапазон длин кассет составляет от 180 нт до 230 нт, в зависимости от вводимой генетической модификации и общего дизайна олигонуклеотидов. Дизайн гомологичного фрагмента включает замену на синонимичные кодоны (при необходимости) для создания сайта рестрикции, используемого для вставки константных областей кассеты. Эти константные области включают тяжелую цепь HLA-A*02:01 и белок AGA2P, обеспечивающий экспонирование на клеточной поверхности. Константная область также может содержать эпитопный маркер или штрихкодовую «рукоятку» для облегчения последующего использования в селекциях и дополнительного анализа. Дополнительно или альтернативно, дизайн кассеты может включать добавление «платформы для посадки» для будущего добавления последовательностей. Область РНК-гида CRISPR также может быть направлена на сайт высокоэффективного разрезания и интеграции.
[00297] Необязательно, олигонуклеотидные модифицирующие кассеты могут быть дополнительно обработаны в вырожденных реакциях ПЦР для создания 107-108 пермутаций исходной последовательности антигена TCR. Такую вырожденную ПЦР можно проводить либо до, либо после, введения в геном клеток. Вырожденные реакции ПЦР проводят с праймерами, расположенными над фрагментами запланированного участка модификации, представляющего пептид, экспонированный на конструкте пMHC (Смотри, например, Boder, E.T. and K.D. Wittrup, Nature Biotechnology, 1997. 15(6): p. 553-557; McMahon, C., et al., Nature Structual & Molecular Biology, 2018. 25(3): p. 289-296).
[00298] Важно отметить, что комбинаторное разнообразие последовательностей может быть создано в любом месте на протяжении конструкта тяжелой цепи, представляющего аллель HLA-A, а также в области пептида. Затем отдельная клетка дрожжей экспрессирует случайный пептид, связанный с константной молекулой HLA. HLA-A*02:01 как правило, представляет пептиды длиной 8-11 аминокислот (Hassan, C., et al., The Journal of Biological Chemistry, 2015. 290(5): p. 2593-2603), и библиотеки пептидов с разными длинами создают с использованием пептидов, имеющих длину в этих диапазонах. Библиотека имеет теоретическое разнообразие нуклеотидов, продиктованное композицией и длиной библиотеки, но по проекту должны быть получены одна или более библиотек, представляющих миллионы уникальных пептидов с длиной в диапазоне 8-11 аминокислот. После инкубации клеток и прохождения через процесс генетической модификации, имеется пул генетически модифицированных клеток с экспонированным на поверхности клеток комплексом пMHC, связанным с белком AGA2P. Необязательную начальную селекцию на генетически модифицированные клетки, экспонирующие комплекс пMHC, можно проводить за счет экспонирования эпитопного маркера.
Пример 7: Валидация надлежащей идентификации антигенов TCR с использованием библиотеки дрожжевого дисплея
[00299] Проводят валидационное исследование для определения того, является ли комплекс HLA-A*02:01 на поверхности клеток в библиотеке из Примера 1 свернутым надлежащим образом для представления пептидов. При валидации используют идентификацию клеток, экспонирующих антигены-мишени TCR с известными специфичностями. Вкратце, проектируют систему с использованием библиотеки, созданной, как описано в Примере 1, для валидации библиотек на правильную экспрессию антигенов. В данной системе дрожжевые клетки, экспонирующие конъюгаты пMHC, подвергают воздействию популяции T-клеток, размноженных из одной T-клетки с известным TCR. Используя данную систему, пользователь может правильно соотнести TCR с известным предсказанным антигеном-мишенью. Проводят селекции, используя TCR с известными последовательностями антигенов. После селекции отобранные образцы определяют, например, используя секвенирование штрихкодов, связанных с выбранными антигенами в клетках библиотеки. Лучшие пептидные антигены, идентифицированные с использованием системы по изобретению, способны стимулировать TCR-трансдуцированные T-клетки, несмотря на отличия последовательностей от фактического эпитопа.
Пример 8: Идентификация новых антигенов TCR с использованием библиотеки дрожжевого дисплея
[00300] Для проверки того, можно ли использовать автоматизированную систему для идентификации новых антигенов-мишеней, используют известные TCR и/или TCR-сироты для идентификации антигенов с использованием способов по изобретению. Затем эти идентифицированные антигены могут быть использованы в методах биоинформатики для тестирования множества ожидаемых или потенциальных пептидных антигенов. Эти методы биоинформатики могут быть использованы для попытки определения обычных пептидов, полученных из известных белковых последовательностей, которые также будут связывать репрезентативный TCR. Эти предсказанные пептидные последовательности затем могут быть спроектированы в одну из библиотек Примера 1 или непосредственно протестированы в других анализах. Эти библиотеки, которые затем экспонируют предсказанные пептиды молекул пMHC, могут быть подвергнуты воздействию одного или более TCR-сирот для обнаружения антигенов, специфически связывающих TCR-сироты. Затем эти пептиды идентифицируют как возможные антигены-мишени для TCR.
Пример 9: Идентификация белок-белковых взаимодействий по всему геному
[00301] Белок-белковые взаимодействия традиционно изучали высокоэффективными способами с использованием подходов, основанных на дрожжевых двойных гибридах (Y2H) (Rolland, T., et al., Cell, 2014. 159(5): p. 1212-1226; Huttlin, E.L., et al., 2017. 545(7655): p. 505-509) или масс-спектрометрических анализов (Hein, Marco Y., et al., Cell, 2015. 163(3): p. 712-723. Проточную цитометрию также интенсивно использовали при осуществлении дисплея на поверхности дрожжей, и ее применение было распространено на исследования белок-белковых взаимодействий и ферментативных свойств (Lim, S., et al., Biotechnology Journal, 2017. 12(5): p. 10; Cherf, G.M. and J.R. Cochran, Methods in molecular biology (Clifton, N.J.), 2015. 1319: p. 155-175.
[00302] Дисплей CREATE может быть использован для облегчения быстрого скрининга белок-белковых взаимодействий «один против всех» или «все против всех». Сначала создают библиотеку дисплея CREATE для всего генома, заказывая набор из примерно 6000 олигонуклеотидных модифицирующих кассет у компании Agilent (Santa Clara, CA). Эти олигонуклеотидные модифицирующие кассеты сконфигурированы, как описано в предыдущих примерах, с crRNA, областью спейсера и гомологичным фрагментом. Эти конкретные олигонуклеотидные кассеты также могут, необязательно, содержать оптимально расположенные сайты ферментов рестрикции, если они содержат повторяющуюся последовательность, для облегчения добавления маркера, обеспечивающего экспонирование на поверхности, стандартными методами клонирования. Существует множество маркеров, обеспечивающих экспонирование на поверхности. McMahon, C., et al., выше; Cherf, G.M. and J.R. Cochran, Methods in molecular biology (Clifton, N.J.), 2015, 1319: p. 155-175; Uchański, T., et al., Scientific Reports, 2019, 9(1): p. 382. Они могут быть использованы, и расширять возможности за пределы оригинального способа использования сопряжения дрожжевого белка AGA2P, который, как правило, объединяют в слитом продукте с N-концом интересующего экспонируемого белка или пептида (Boder, E.T. and K.D. Wittrup, выше). Для облегчения экспонирования важных белков, критических для клеточной функции, может быть, необязательно, спроектирован неоптимальный сайт расщепления между маркером, обеспечивающим экспонирование на поверхности, и интересующим белком. Существует множество последовательностей, создающих возможность расщепления, но одним примером является сайт расщепления вируса гравировки табака (TEV), который может быть модифицирован, с получением в результате неоптимального расщепления (Ioannou, M., et al., Mammalian expression vectors for metabolic biotinylation tandem affinity tagging by co-expression in cis of a mammalian codon-optimized BirA biotin ligase. BMC research notes, 2018. 11(1): p. 390-390), и, следовательно, одновременно экспонирования на поверхности нужного белка, с сохранением при этом необходимой для жизнеспособности внутриклеточной концентрации нативного белка. После того, как олигонуклеотидные кассеты были спроектированы, заказаны и впоследствии модифицированы для включения стандартных компонентов, обеспечивающих экспонирование на клеточной поверхности, можно начинать процесс CREATE. Вкратце, как описано ранее, популяцию клеток трансформируют олигонуклеотидными кассетами и инкубируют с использованием автоматизированного прибора, что приводит к получению популяции генетически модифицированных клеток. Эта популяция клеток является такой, что каждая отдельная клетка содержит одну или более генетических модификаций, которые привели к вставке маркера, обеспечивающего экспонирование на клеточной поверхности, в запланированном нужном положении в геноме. Для создания полногеномной библиотеки, в которой экспонированы все белки в дрожжевом геноме, примерно 6572 генетических модификаций пришлось бы сделать для вставки маркеров, обеспечивающих экспонирование на клеточной поверхности, в N-конец всех 6572 аннотированных белков в геноме дрожжей (https://www.yeastgenome.org/genomesnapshot). Это привело бы к получению библиотеки из 6572 отдельных клеток, каждая из которых экспонирует один из 6572 белков на ее поверхности. Эту библиотеку клеток можно затем расщеплять на две популяции, и одну из популяций трансформировать конструктом, экспрессирующим зеленый флуоресцентный белок (GFP). Затем две популяции можно инкубировать вместе и пропускать через проточный цитометр для обнаружения образования дублета (Wersto, R.P., et al., Cytometry, 2001. 46(5): p. 296-306), являющегося показателем положительного белок-белкового взаимодействия. Затем дублеты можно помещать в отдельные секции стандартного 96- или 384-луночного планшета, и последовательность штрихкодов ДНК считывать с кассет, присутствующих в каждой клетке дублета, для определения белок-белкового взаимодействия. Примечательно, что этот метод можно применять универсально, при этом все 6572 GFP-экспрессирующих экспонируемых на поверхности белков инкубируют со всеми 6572 не экспрессирующими GFP экспонируемыми на поверхности белками. Однако его также можно применять в конфигурации «один против всех» или «многие против всех», при этом изоляты с конкретным интересующим белком инкубируют и хранят с использованием проточной цитометрии, как описано выше. Эти варианты «один против всех» или «многие против всех» могут обеспечивать дополнительную специфичность или четкость для определения партнеров индивидуальных белков по двойственному взаимодействию. Следует также отметить, что эту же процедуру можно выполнять на протяжении нескольких раундов скрининга, как это традиционно выполняют в случае дисплея в фагах или дрожжах (Bradbury, A.R.M., et al., Nature Biotechnology, 2011. 29: p. 245) для избирательного обогащения по связывающим партнерам с наивысшей аффинностью и для снижения количества ложноположительных результатов. Его также можно использовать на ранее генетически модифицированном геноме, содержащем патогенные или другие интересующие варианты, введенные при генетической модификации в популяцию клеток перед введением маркеров, обеспечивающих экспонирование на клеточной поверхности. Ранее генетически модифицированные геномы также могут содержать наборы вариантов, специфически спроектированных для нарушения белок-белковых взаимодействий. Примечательно, что, дисплей CREATE также можно использовать для экспонирования более чем одного белка на поверхности одной клетки за счет введения множества маркеров во множество локусов в клетке.
Пример 10: Идентификация поддающихся воздействию лекарственных средств мишеней
[00303] Идентификация мишеней для лекарственных средств и последующего механизма действия остается сложной задачей. Schenone, M., et al., Nature Chemical Biology, 2013. 9: p. 232; Stockwell, B.R., Exploring biology with small organic molecules. Nature, 2004. 432(7019): p. 846-854; Xie, L., L. Xie, and P.E. Bourne, Structure-based systems biology for analyzing off-target binding. Current opinion in structural biology, 2011. 21(2): p. 189-199.
[00304] В обратном генетическом скрининге, как правило, используют вычислительные или иные рациональные методы для предварительного выбора списка вероятных связанных с заболеванием мишеней. Затем проводят биохимический скрининг с использованием библиотеки химических соединений против одной или более из этих связанных с заболеванием мишеней. Однако биохимические анализы часто являются дорогостоящими или трудоемкими, и впоследствии, как правило, ограничиваются небольшим количеством потенциальных мишеней. 17. Wyatt, P.G., et al., Target validation: linking target and chemical properties to desired product profile. Current topics in medicinal chemistry, 2011. 11(10): p. 1275-1283.
[00305] Малое количество возможных целей в биохимическом скрининге часто приводит к невозможности идентификации потенциальных нецелевых мишеней, что может приводить в дальнейшем к сложности понимания побочных эффектов и необходимости этапа «деконволюции» при определении механизма действия. Knight, Z.A., H. Lin, and K.M. Shokat, Nature reviews. Cancer, 2010. 10(2): p. 130-137.
[00306] Напротив, прямой генетический скрининг, как правило, начинают с интересующего фенотипа, а затем проводят скрининг большого числа молекул против модельной системы для обнаружения того, может ли быть нарушен фенотип. Stockwell, B.R., Exploring biology with small organic molecules. Nature, 2004. 432(7019): p. 846-854.
[00307] Это, однако, часто может приводить к непониманию того, какой белок или путь является мишенью для молекулы, и также может приводить к непреднамеренным побочным эффектам при введении в последующих исследованиях или у пациентов. Xie, L., et. al., выше.
[00308] Как прямой, так и обратный, генетический скрининг может сильно выиграть от возможности единообразной оценки связывания лекарственного средства со всеми внутриклеточными белками в простом и экономичном анализе. В случае прямого скрининга он позволит идентифицировать фактические мишени, а в случае обратного скрининга он позволит идентифицировать нецелевые мишени. С использованием способов дисплея CREATE, описанных в настоящем документе, можно эффективно создавать библиотеку, экспонирующую все возможные клеточные белки на поверхности клеток в популяции, а затем подвергать эту популяцию воздействию малой молекулы с присоединенным флуорофором, или другим средством для обнаружения, для определения всех событий связывания белок-лекарственное средство. Сначала создают библиотеку дисплея CREATE, как описано в Примере 5. В этой библиотеке дисплея могут быть, необязательно, экспонированы все белки в геноме, или подгруппа белков, характерных для конкретного пути, или интересующая подгруппа, определенная вычислительными методами. Эта библиотека дисплея также может быть создана в популяции клеток, которые уже содержат один или более патогенных вариантов, идентифицированных заранее и введенных в клеточную популяцию в предыдущих раундах CREATE. Данную библиотеку затем можно подвергать воздействию одной интересующей молекулы с присоединенным органическим флуорофором. Инкубация библиотеки дисплея CREATE с интересующей малой молекулой приводит к комплексам малой молекулы, связанным с клетками, экспонирующими белок, в случае если малая молекула может связывать этот белок. Используя проточную цитометрию, клетки, экспонирующие белок со связанным лигандом, можно сортировать и использовать штрихкоды на кассетах CREATE для определения того, какие белки связаны конкретной малой молекулой. Это приводит к двойному картированию малой молекулы на белок, и позволяет однозначно идентифицировать все возможные партнеры по связыванию конкретной малой молекулы. Необязательно, с использованием закодированной ДНК химической библиотеки или других комбинаторных подходов к скринингу (Zimmermann, G. and D. Neri, Drug discovery today, 2016. 21(11): p. 1828-1834; Szymański, P., M. Markowicz, and E. Mikiciuk-Olasik, International journal of molecular sciences, 2011. 13(1): p. 427-452) можно проводить скрининг «все со всеми» библиотеки химических соединений против библиотеки дисплея CREATE экспонированных на поверхности белков.
Пример 11: Созревание аффинности биологических связывающих веществ для представляющего интерес пути
[00309] Традиционная разработка антител в качестве лекарственных средств была сосредоточена на находящихся на клеточной поверхности или других внеклеточных мишенях, которые могут быть легко доступны для антитела. Однако из примерно 700 белковых молекулярных мишеней, одобренных для лекарственных средств, более половины являются внутриклеточными белками. Смотри, например, Carter, P.J. and G.A. Lazar, Nature Reviews Drug Discovery, 2017. 17: p. 197; Santos, R., et al.,. Drug discovery, 2017. 16(1): p. 19-34; Wang, X., et al., Genome biology and evolution, 2013. 5(7): p. 1291-1297.
[00310] Значительные усилия прилагаются для разработки систем доставки для антител или малых пептидных терапевтических молекул. Stewart, M.P., et al., Nature, 2016. 538: p. 183. Если ожидаемая внутриклеточная доставка антитела или пептида пройдет успешно, тогда способ систематического созревания аффинности антител, которые связываются с одним или более внутриклеточными белками, будет иметь огромную ценность. Используя дисплей CREATE, можно осуществлять экспонирование большой библиотеки внутриклеточных белков на поверхности клеток в популяции и систематически подвергать ее воздействию библиотек дрожжевого или фагового дисплея с целью отбора на моно, би-, или полиспецифические связывающие вещества для набора мишеней. Сначала можно создавать библиотеку дрожжевого дисплея способами, описанными в настоящем документе, или описанными в другом литературном источнике (McMahon, C., et al., выше; Lim S. et al., выше; Cherf, G.M. and J.R. Cochran, выше), в которой многие комбинаторно закодированные белки закодированы в популяции дрожжевых клеток для экспонирования на поверхности. На данном этапе технологический процесс можно осуществлять, как описано в Примере 5. В частности, библиотеку клеток с комбинаторно закодированными пептидами, экспонированными на поверхности, также можно трансформировать последовательностями ДНК, обеспечивающими экспрессию зеленого флуоресцентного белка. Эту библиотеку клеток с вплоть до 10^10 отдельными экспонированными антителами, нанотелами или пептидными фрагментами затем можно инкубировать с библиотекой дисплея CREATE всех внутриклеточных белков. Использование проточной цитометрии и отбора дублетов затем может позволить определять любое взаимодействие попарного связывания между сконструированным пептидом(ами) и одним или более экспонированными на поверхности клеточными белками. Эту процедуру также можно проводить итеративно таким же образом, как осуществляют традиционное созревание аффинности антител с использованием библиотеки дрожжевого дисплея (Cherf, G.M. and J.R. Cochran, выше). Итеративное проведение процедуры на библиотеке экспонированных на поверхности клеточных белков, представляющих конкретный путь, или подгруппы геномных белков, приведет к идентификации высокоаффинных связывающих веществ для всего пути белков. Таким образом можно определять полиспецифические связывающие вещества для ингибирования или идентификации механизма действия для всех путей. Важно отметить, что в полногеномной библиотеке дисплея CREATE имеется встроенный отрицательный контроль для нецелевых эффектов за счет присутствия в растворе всех остальных внутриклеточных белков. Таким образом, выбирая связывающие вещества только для подмножества белков в пути, можно найти оптимум Парето между сильным связыванием с одним или более желательными внутриклеточными белками при одновременной минимизации связывания с нежелательными внутриклеточными белками. Таким образом, в последовательных раундах дисплея CREATE можно проводить созревание аффинности антител для связывания с конкретными мишенями, при этом также производя отбор на минимизацию нецелевого связывания с другими внутриклеточными белками.
[00311] При том, что настоящее изобретение раскрыто вариантами осуществления во многих различных формах, как подробно описано в связи с вариантами осуществления изобретения, понятно, что настоящее описание следует считать иллюстрацией принципов изобретения, и оно не должно ограничивать изобретение конкретными вариантами осуществления, проиллюстрированными и описанными в настоящем документе. Многочисленные вариации могут быть использованы специалистами в данной области без отклонения от сущности изобретения. Объем изобретения будет определяться прилагаемой формулой изобретения и соответствующими эквивалентами. Реферат и название изобретения не следует считать ограничивающими объем настоящего изобретения, поскольку их цель состоит в том, чтобы дать возможность соответствующим органам, а также широкой общественности, быстро определить общий характер изобретения. В следующей далее формуле изобретения, если только не используется термин «средство», никакие из признаков или элементов, перечисленных в ней, не должны толковаться как ограничения «средство плюс функция» в соответствии с 35 U.S.C. §112, ¶6.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СОЗДАНИЯ Т-КЛЕТОК, ПРИГОДНЫХ ДЛЯ АЛЛОГЕННОЙ ТРАНСПЛАНТАЦИИ | 2015 |
|
RU2752933C2 |
| МНОГОЦЕПОЧЕЧНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР И ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2663725C2 |
| НАЦЕЛИВАНИЕ НА КЛЕТКИ, ОПОСРЕДУЕМОЕ ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ | 2018 |
|
RU2783316C2 |
| АВТОМАТИЗИРОВАННЫЙ МНОГОМОДУЛЬНЫЙ ИНСТРУМЕНТ ДЛЯ РЕДАКТИРОВАНИЯ КЛЕТОК (ВАРИАНТЫ) | 2018 |
|
RU2755308C2 |
| ИММУННЫЕ КЛЕТКИ, ДЕФЕКТНЫЕ ПО Suv39h1 | 2018 |
|
RU2784531C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЙ РЕЦЕПТОР, И РОДСТВЕННЫЕ КОМПОЗИЦИИ | 2019 |
|
RU2835579C2 |
| МОДИФИКАЦИЯ B-КЛЕТОК | 2018 |
|
RU2783116C2 |
| АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2792042C2 |
| ИНСЕРЦИЯ ТАРГЕТНОГО ГЕНА ДЛЯ УЛУЧШЕННОЙ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2017 |
|
RU2824204C2 |
| СПОСОБЫ, КОМПОЗИЦИИ И КОМПОНЕНТЫ ДЛЯ РЕДАКТИРОВАНИЯ TGFBR2 ПОСРЕДСТВОМ CRISPR-CAS9 В T-КЛЕТКАХ ДЛЯ ИММУНОТЕРАПИИ | 2018 |
|
RU2798380C2 |
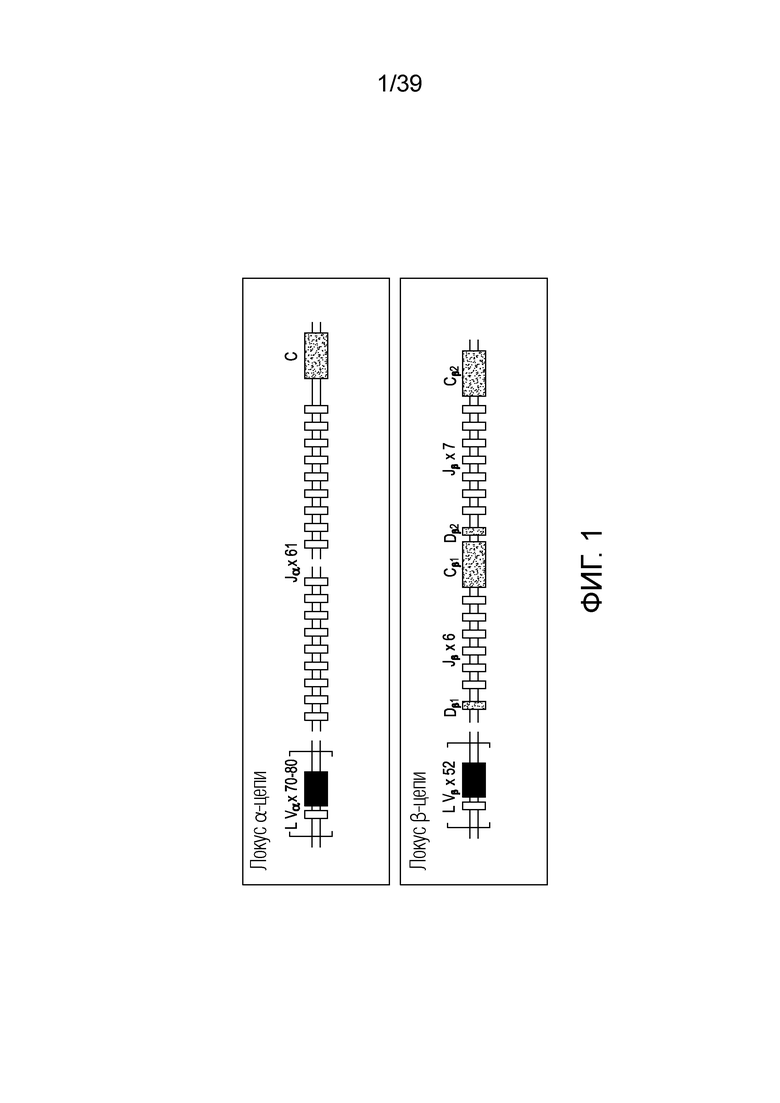

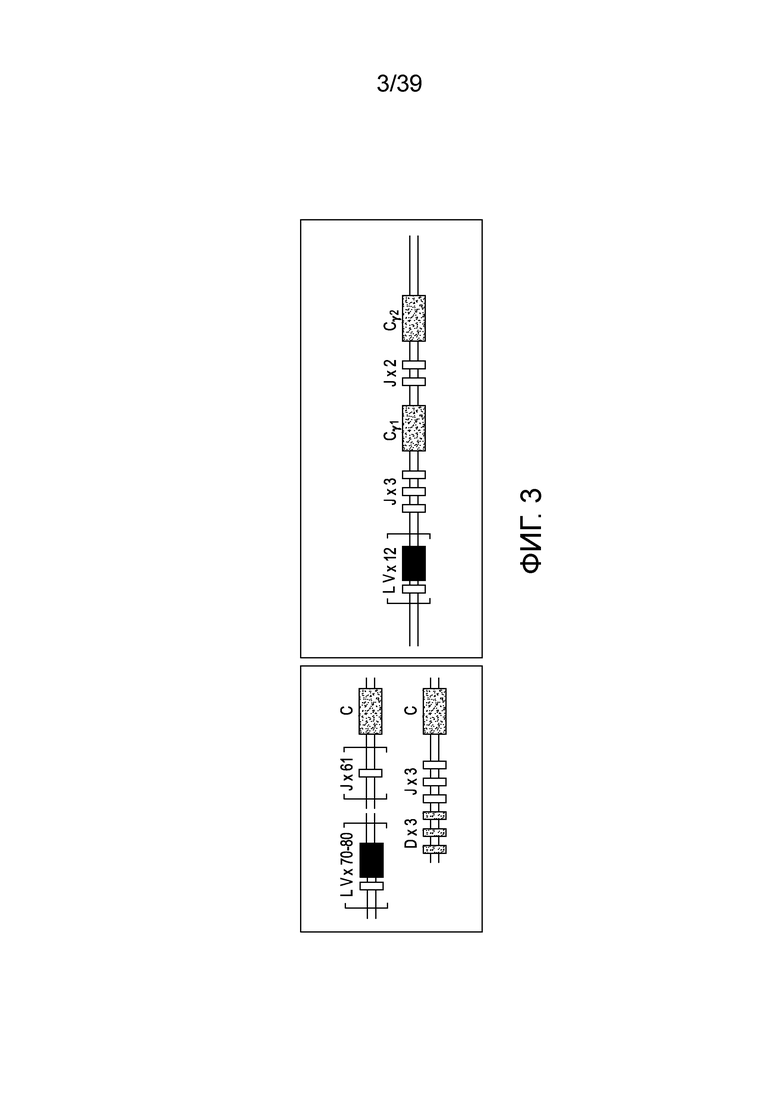

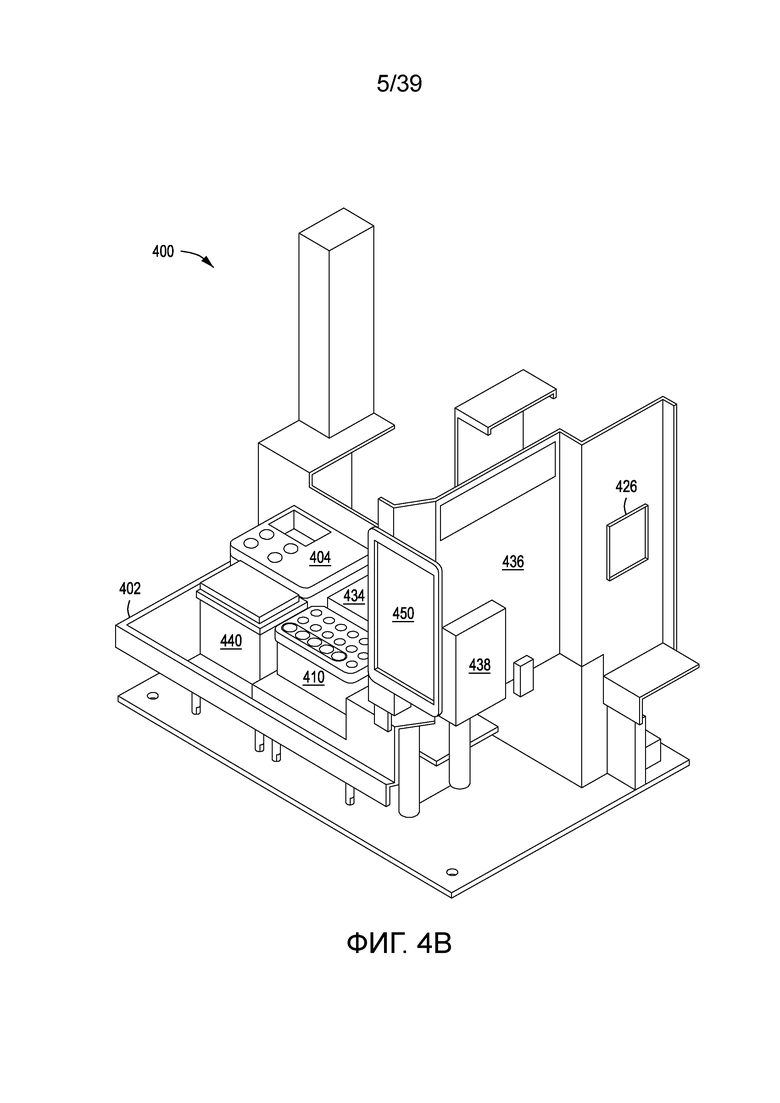

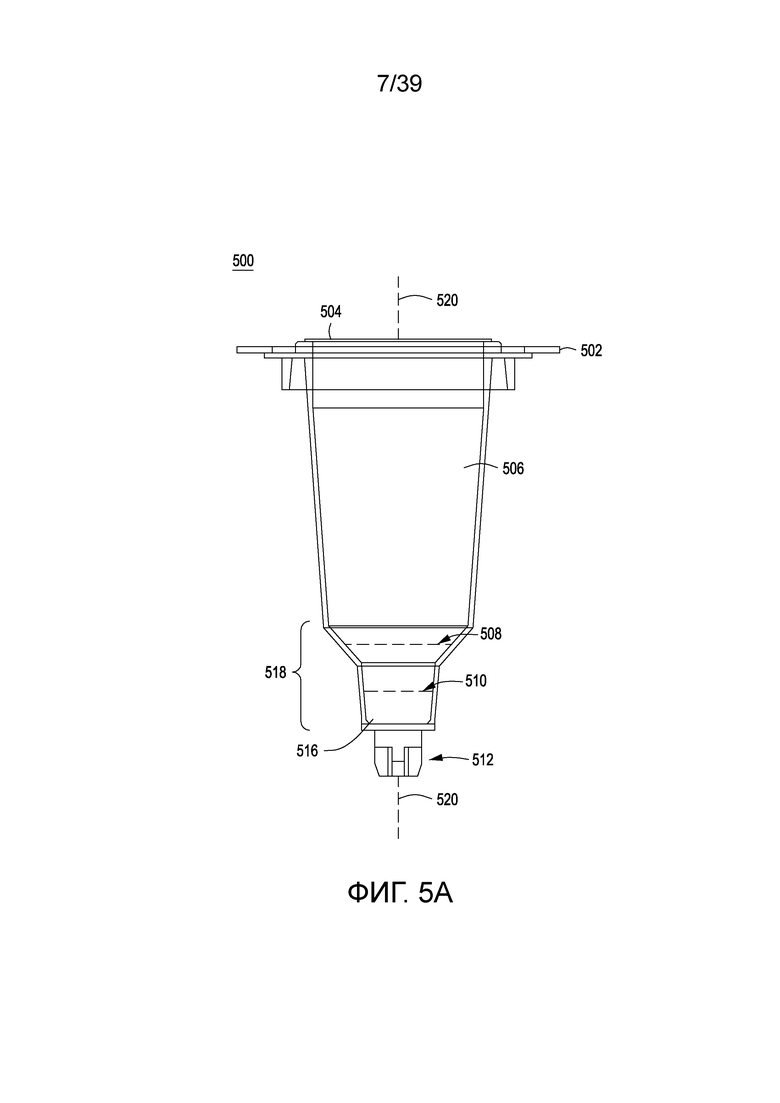


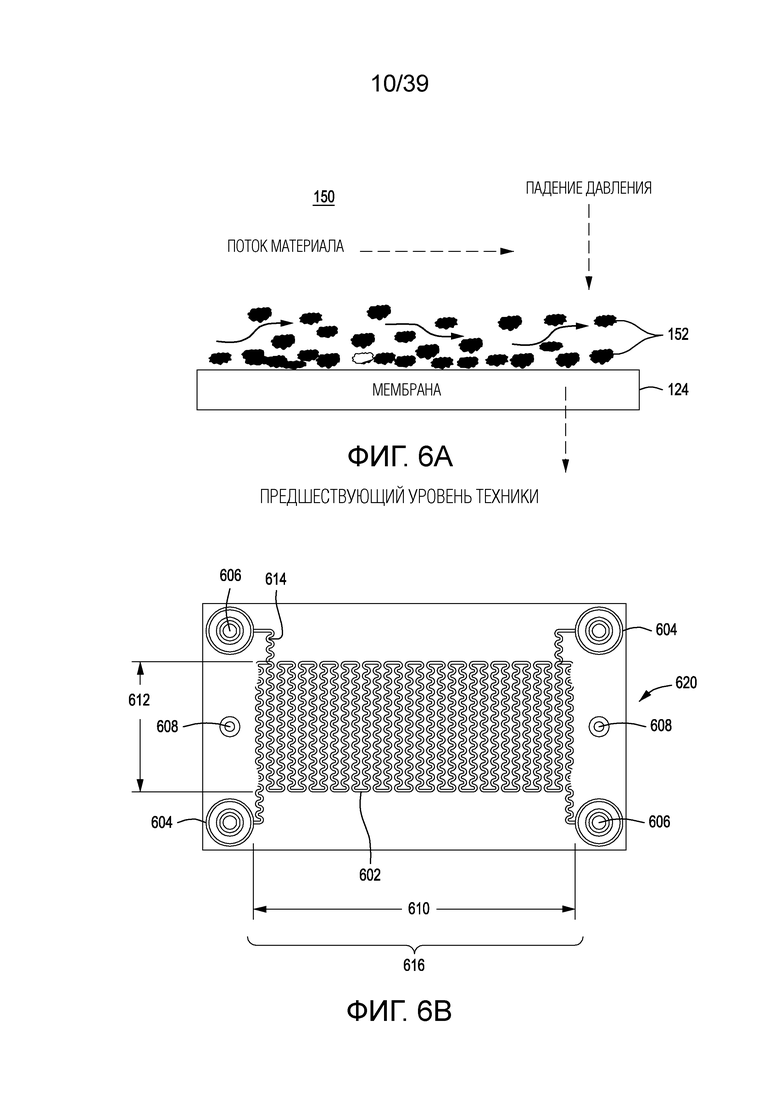
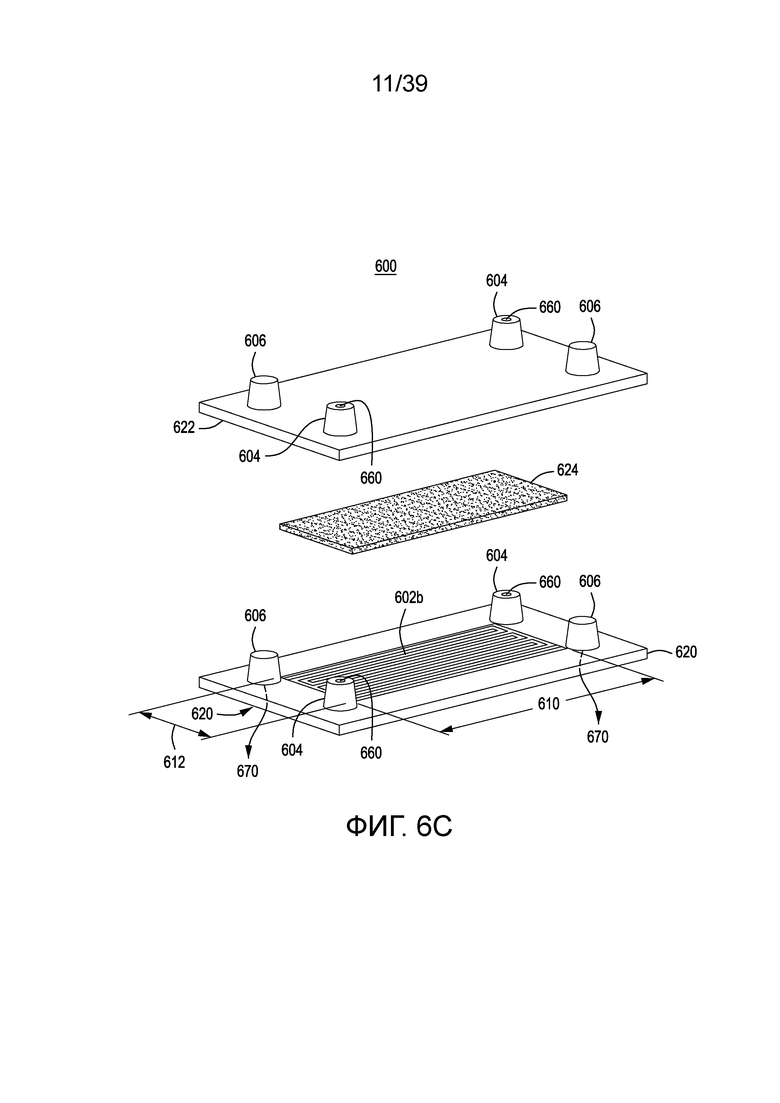



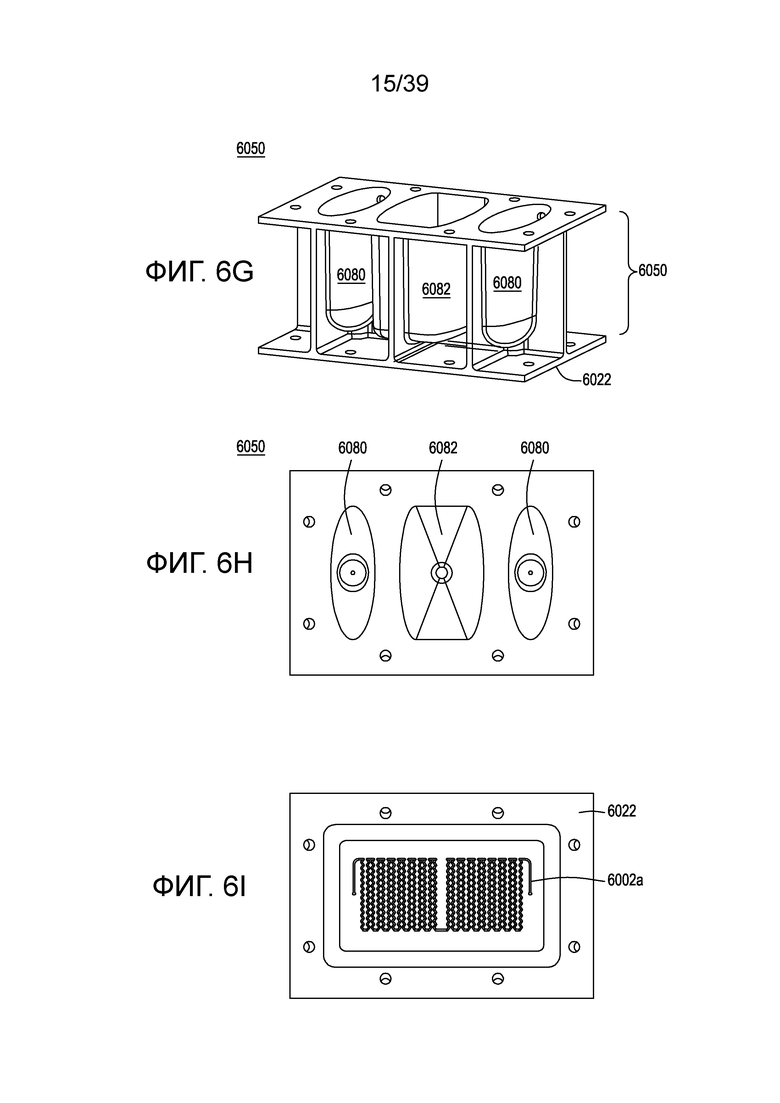
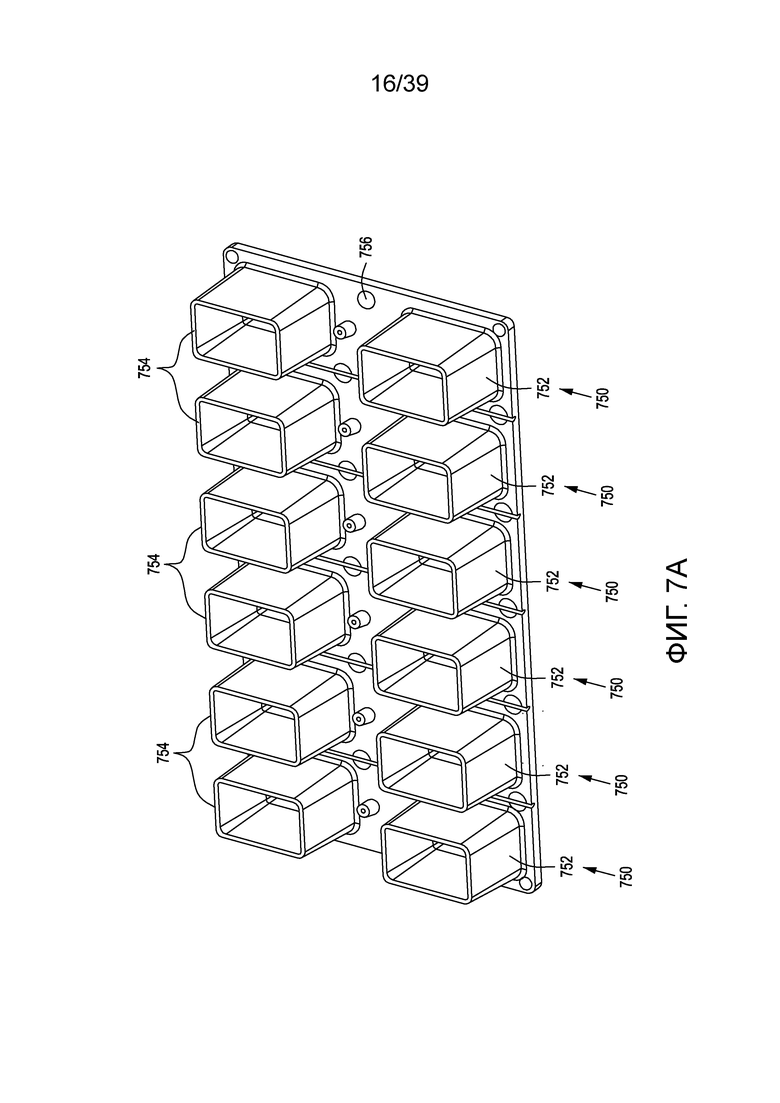
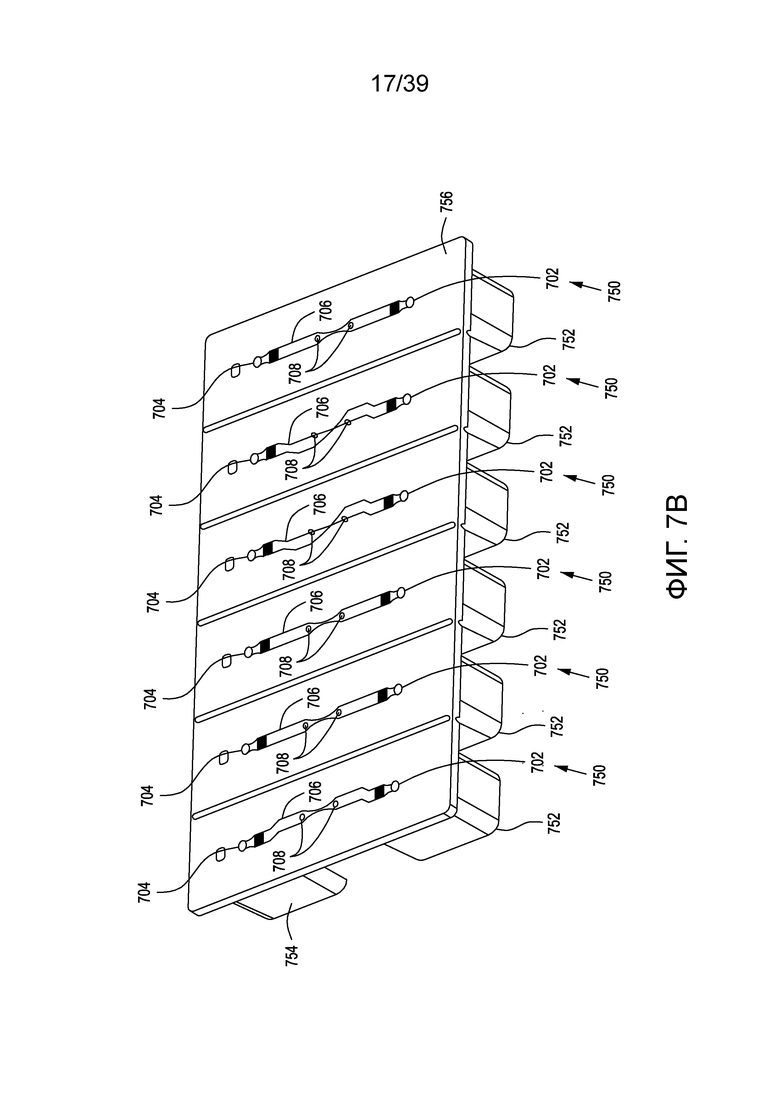
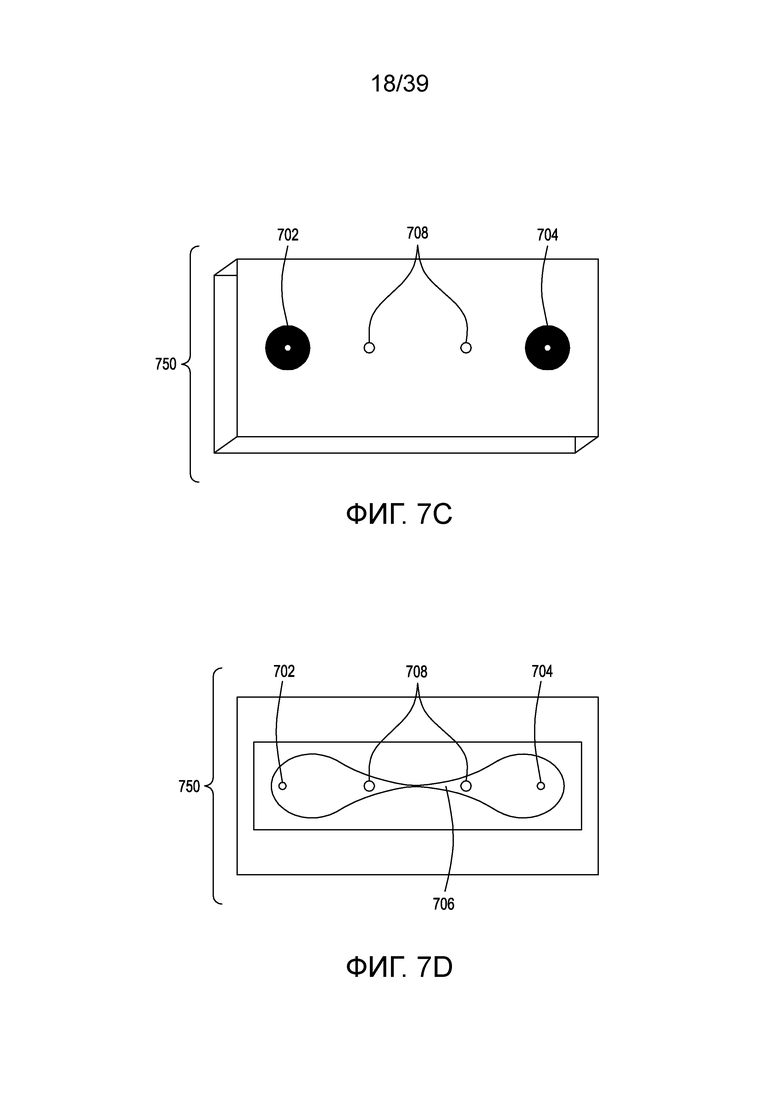
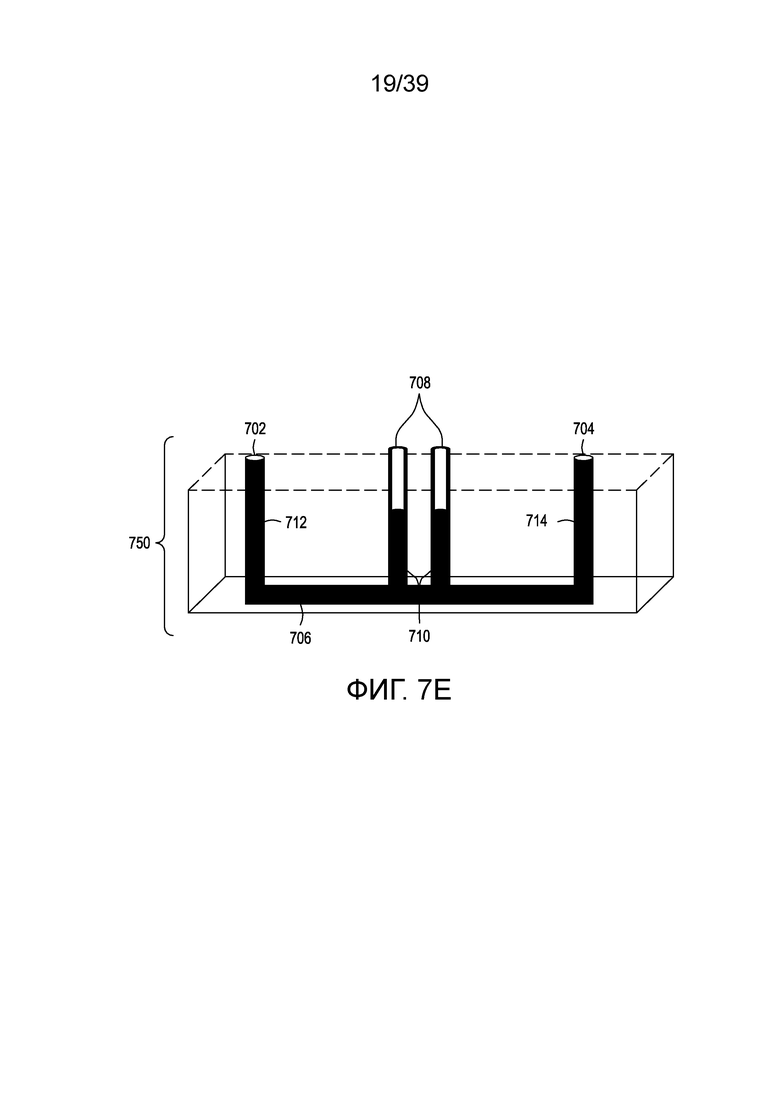
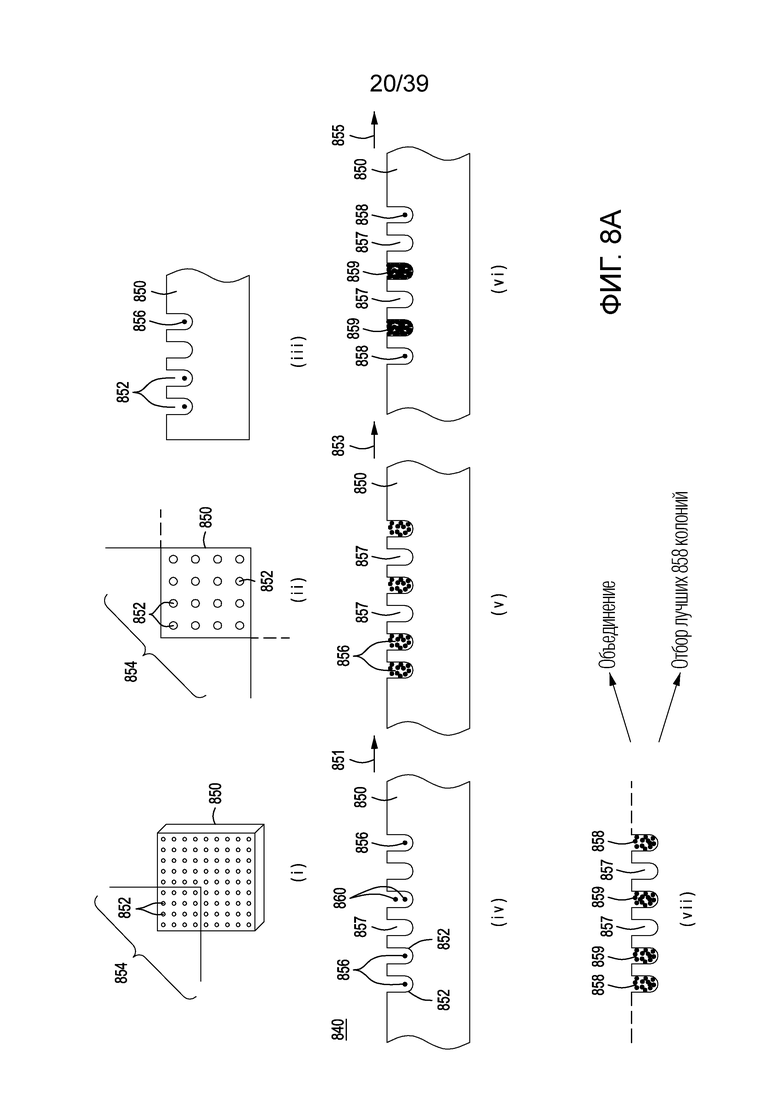



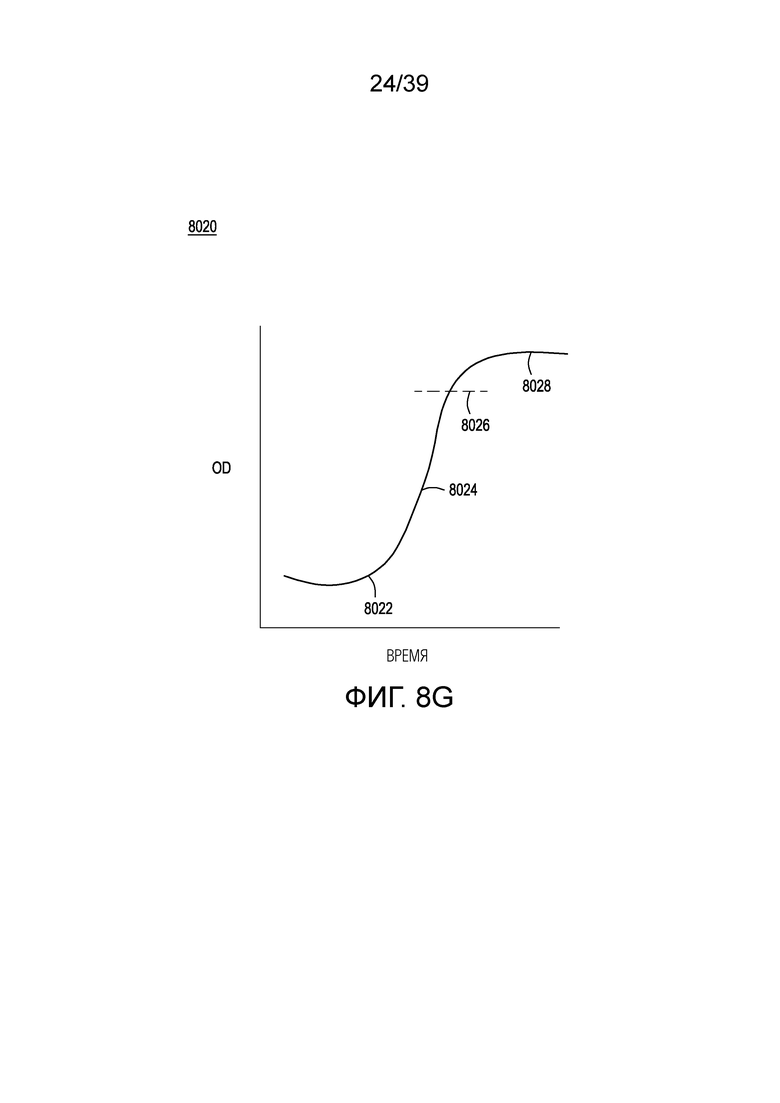
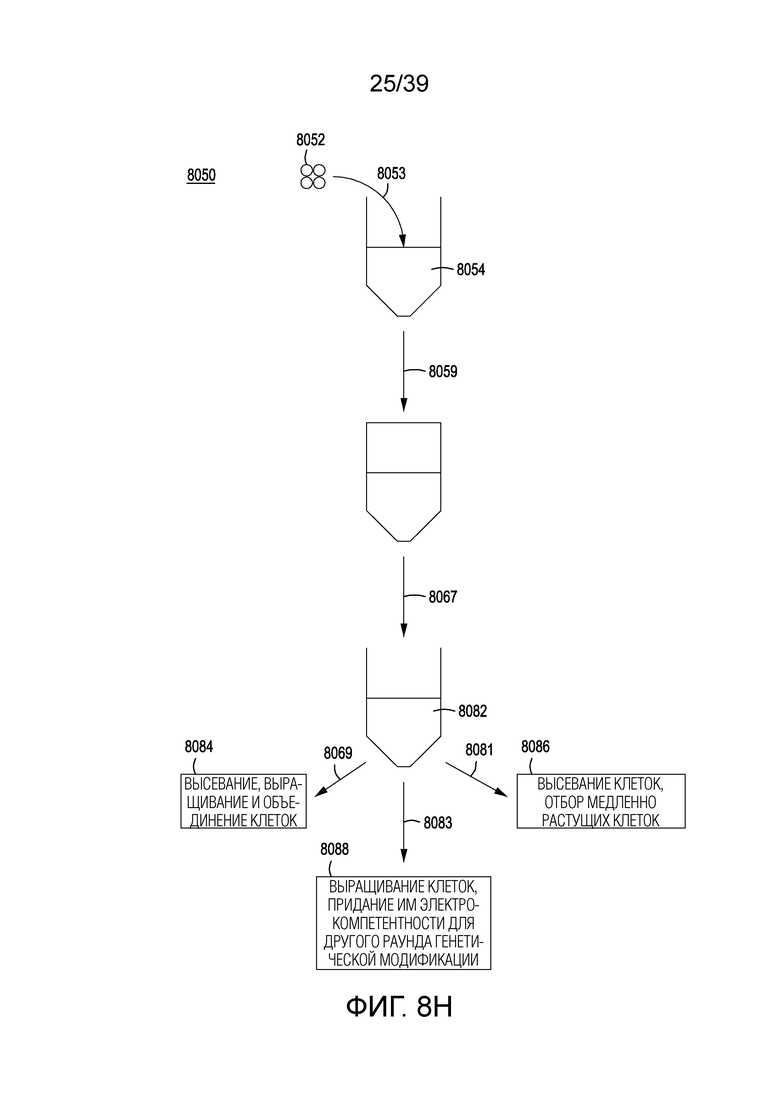





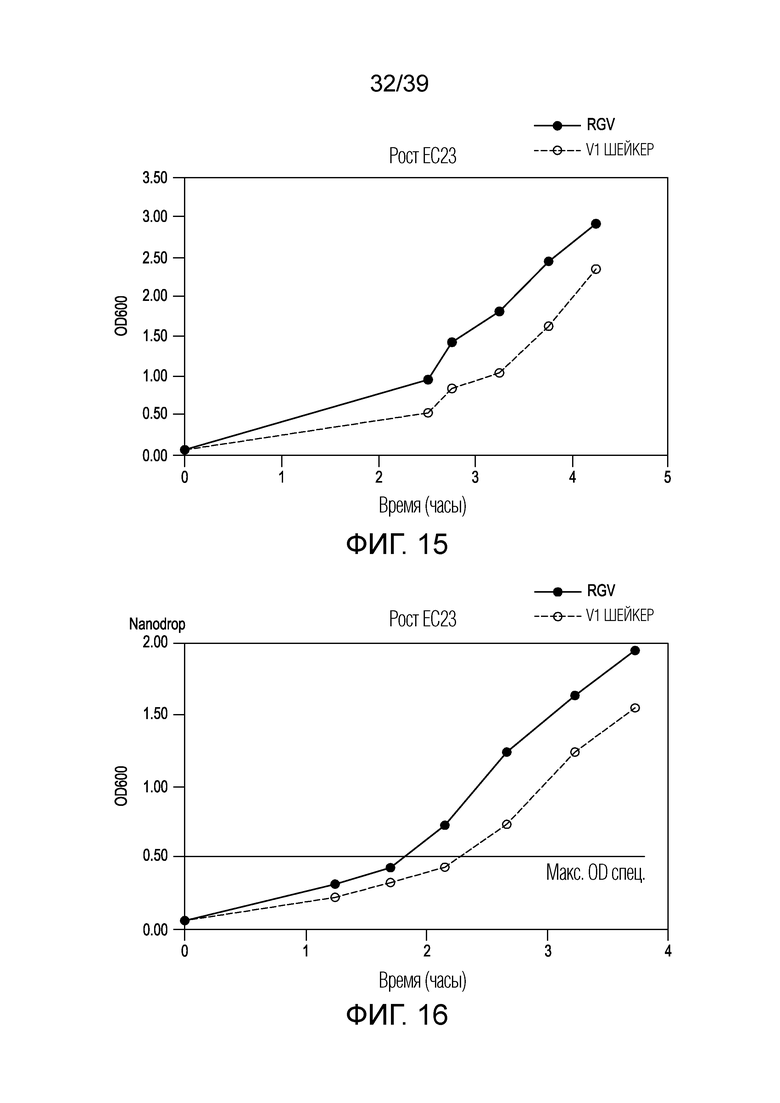

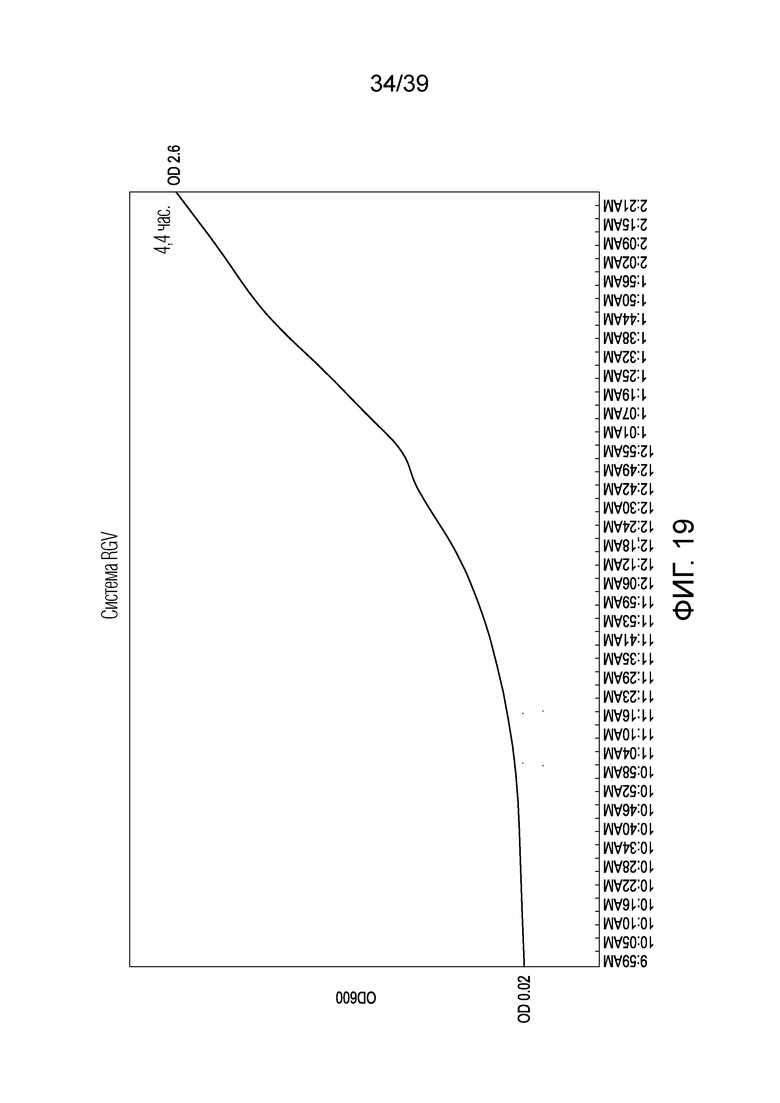

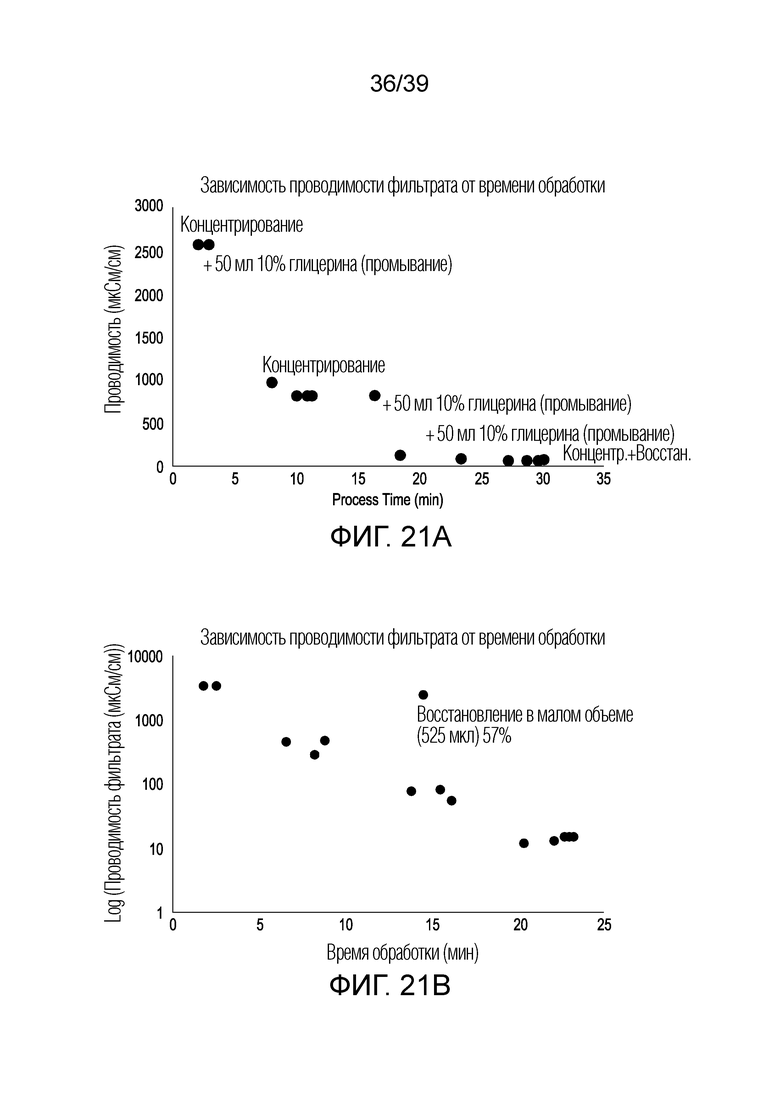
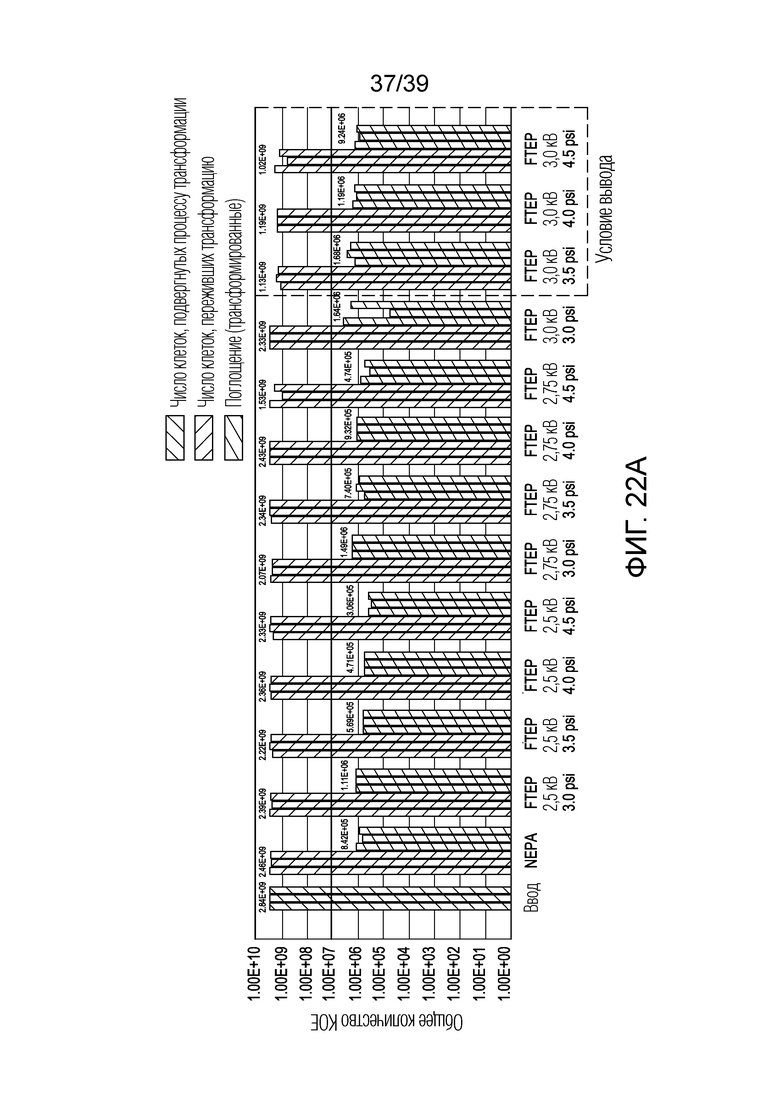

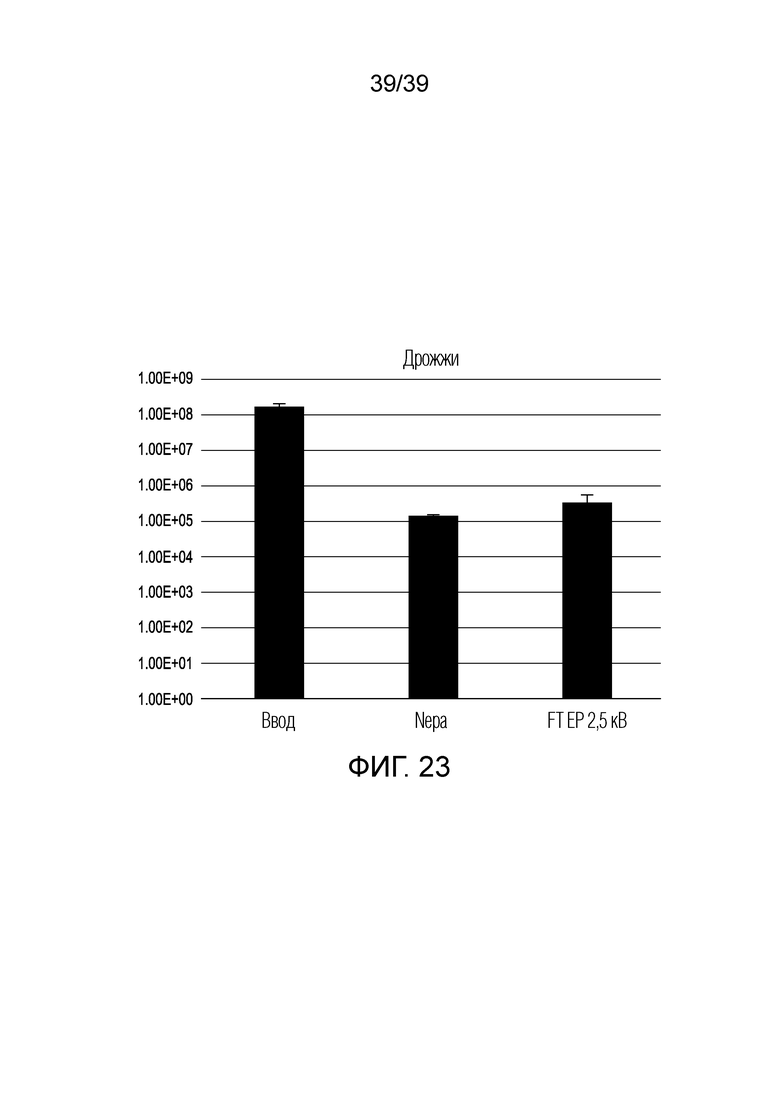
Изобретение относится к биотехнологии. Представлен автоматизированный способ создания библиотеки бактериальных или дрожжевых клеток, экспрессирующих сконструированные предполагаемые антигены T-клеточного рецептора (TCR) на поверхности клеток, включающий: получение популяции бактериальных или дрожжевых клеток, обработку популяции клеток на приборе для мультиплексной определяемой нуклеазой генетической модификации генома, инкубацию обработанных клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, где генетическая модификация приводит к получению нуклеиновых кислот, кодирующих сконструированные пептидные антигены, в клетках и создание возможности для клеток экспрессировать и экспонировать сконструированные пептидные антигены. Изобретение позволяет наиболее высокопроизводительно и надежно проводить идентификацию конкретных антигенов для TCR мультиплексным образом. 7 з.п. ф-лы, 23 ил., 11 пр.
1. Автоматизированный способ создания библиотеки бактериальных или дрожжевых клеток, экспрессирующих сконструированные предполагаемые антигены T-клеточного рецептора (TCR) на поверхности клеток, включающий:
получение популяции бактериальных или дрожжевых клеток;
обработку популяции клеток на приборе для мультиплексной определяемой нуклеазой генетической модификации генома с использованием введенных нуклеиновых кислот и нуклеазы для создания клеток, содержащих нуклеиновые кислоты, кодирующие сконструированные пептиды, предназначенные для экспонирования на поверхности клеток;
инкубацию обработанных клеток для создания возможности генетической модификации нуклеиновой кислоты в клетках, где генетическая модификация приводит к получению нуклеиновых кислот, кодирующих сконструированные пептидные антигены, в клетках; и
создание возможности для клеток экспрессировать и экспонировать сконструированные пептидные антигены, которые представляют собой предполагаемые антигены TCR, на поверхности клеток.
2. Способ по п. 1, где популяция бактериальных или дрожжевых клеток представляет собой дрожжевые клетки.
3. Способ по п. 1 или 2, где клетки экспонируют сконструированные пептидные антигены, которые экспонируются на клетках в виде части лиганда.
4. Способ по п. 1 или 2, где клетки совместно экспрессируют предполагаемые антигены TCR и молекулы MHC.
5. Способ по любому из пп. 1-4, где нуклеаза представляет собой направляемую нуклеиновой кислотой нуклеазу.
6. Способ по п. 5, где нуклеаза представляет собой РНК-направляемую нуклеазу.
7. Способ по любому из пп. 1-6, где один или более сконструированных пептидных антигенов представляют собой предполагаемые антигены одного или более TCR-сирот.
8. Способ по любому из пп. 1-6, где один или более сконструированных пептидных антигенов представляют собой известные антигены одного или более TCR.
| US 20180052176 A1, 22.02.2018 | |||
| WO 2018031950 A1, 15.02.2018 | |||
| US 20040110253 A1, 10.06.2004 | |||
| СПОСОБ СКРИНИНГА БИБЛИОТЕКИ ФАГОВОГО ДИСПЛЕЯ | 2005 |
|
RU2402777C2 |
| CN 107636152 A, 26.01.2018. | |||
Авторы
Даты
2022-04-21—Публикация
2019-04-24—Подача