ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет на основании предварительной заявки на патент США № 62/437622, поданной 21 декабря 2016 года, и предварительной заявки на патент США № 62/520854, поданной 16 июня 2017 года, содержание которых тем самым включено посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение направлено на конъюгаты антитела к cKIT и лекарственного средства и пути их применения для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом, например, реципиента трансплантации гемопоэтических стволовых клеток.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и тем самым включен посредством ссылки во всей своей полноте. Указанная ASCII-копия, созданная 14 декабря 2017 года, имеет название PAT057400-WO-PCT_SL.txt и размер 209938 байт.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
cKIT (CD117) представляет собой одиночную трансмембранную рецепторную тирозинкиназу, которая связывается с лигандом, фактором роста стволовых клеток (SCF). SCF индуцирует гомодимеризацию cKIT, что активирует ее тирозинкиназную активность и приводит к передаче сигналов через пути как PI3-AKT, так и MAPK (Kindblom et al., Am J. Path. 1998 152(5):1259). cKIT первоначало была открыта в качестве онкогена в виде усеченной формы, экспрессируемой ретровирусом кошек (Besmer et al., Nature 1986 320:415-421). Клонирование соответствующего человеческого гена показало, что cKIT является представителем класса рецепторных тирозинкиназ III типа, в состав которого входят такие представители семейства, как FLT3, рецептор CSF-1 и рецептор PDGF. cKIT необходима для развития гемопоэтических клеток, гоноцитов, мастоцитов и меланоцитов. Гемопоэтические клетки-предшественники, например гемопоэтические стволовые клетки (HSC), в костном мозге экспрессируют cKIT на высоком уровне на поверхности клеток. Кроме того, cKIT экспрессируют мастоциты, меланоциты в коже и интерстициальные клетки Кахаля в желудочно-кишечном тракте.
Гемопоэтические стволовые клетки (HSC) способны восстанавливать все клеточные элементы крови и иммунные клетки у реципиента трансплантации и, следовательно, обладают огромным терапевтическим потенциалом. Трансплантация гемопоэтических стволовых клеток широко применяется в качестве видов терапии при лейкозе, лимфоме и других заболеваниях, представляющих угрозу для жизни. Однако с такой трансплантацией ассоциировано множество рисков, в том числе плохое приживление, иммунологическое отторжение, реакция "трансплантат против хозяина" (GVHD) или инфекция. Чтобы предотвратить иммунологическое отторжение трансплантата при аллогенной трансплантации гемопоэтических стволовых клеток, обычно необходимо кондиционирование реципиента с помощью видов циторедуктивного лечения. Современные схемы кондиционирования зачастую настолько токсичны для хозяина, что они противопоказаны большим группам пациентов, которые нуждаются в трансплантации, и/или не могут обеспечиваться в достаточных количествах, чтобы предотвратить реакцию "трансплантат против хозяина". Таким образом, существует необходимость в улучшении способов кондиционирования и трансплантации, а также уменьшении рисков, ассоциированных с трансплантацией гемопоэтических стволовых клеток, и повышении ее эффективности при различных нарушениях.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предусмотрены конъюгаты антитела и лекарственного средства, где антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, соединены с фрагментом, представляющим собой лекарственное средство (например, цитотоксическое средство), необязательно через линкер. Такие конъюгаты антитела и лекарственного средства могут селективно доставлять цитотоксическое средство к клеткам, экспрессирующим cKIT, например, гемопоэтическим стволовым клеткам, тем самым селективно разрушая эти клетки у пациента, например, реципиента трансплантации гемопоэтических стволовых клеток. Предпочтительно конъюгаты антитела к cKIT и лекарственного средства обладают такими фармакокинетическими свойствами, что они не будут присутствовать и/или не будут активны в кровяном русле пациента в течение длительного времени, поэтому их можно применять для кондиционирования реципиентов трансплантации гемопоэтических стволовых клеток перед трансплантацией гемопоэтических стволовых клеток. В некоторых вариантах осуществления в данном документе предусмотрены конъюгаты, содержащие фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT, соединенный с фрагментом, представляющим собой лекарственное средство (например, цитотоксическое средство), необязательно через линкер. Авторы настоящего изобретения неожиданно обнаружили, что полноразмерные антитела к cKIT (например, полноразмерные IgG), их фрагменты F(ab')2 и конъюгаты с токсинами вызывают дегрануляцию мастоцитов, а конъюгаты Fab' или Fab к cKIT и токсина не вызывают дегрануляцию мастоцитов, даже будучи сшитыми и/или мульмеризованными в более крупные комплексы, как можно было бы наблюдать в случае, когда у пациента выработались или имелись предсуществующие антитела к лекарственному средству, распознающие фрагменты Fab. В настоящем изобретении дополнительно предусмотрены фармацевтические композиции, содержащие конъюгаты антитела и лекарственного средства, и способы изготовления и применения таких фармацевтических композиций для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом, например, реципиента трансплантации гемопоэтических стволовых клеток.
В одном аспекте настоящее изобретение направлено на конъюгат формулы (I):
A-(LB-(D)n)y Формула (I);
где:
A представляет собой фрагмент антитела, который специфически связывается с cKIT человека;
LB представляет собой линкер;
D представляет собой цитотоксическое средство;
n составляет целое число от 1 до 10, а y составляет целое число от 1 до 10.
В одном аспекте настоящее изобретение направлено на конъюгат, имеющий структуру формулы (C):
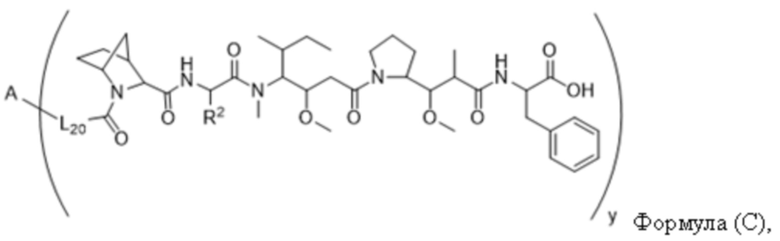
где A, L20, y и R2 являются такими, как определено в данном документе.
В одном аспекте настоящее изобретение направлено на конъюгат, имеющий структуру формулы (D):

где A, L30, y, R1 и R2, являются такими, как определено в данном документе.
В одном аспекте настоящее изобретение направлено на конъюгат, имеющий структуру формулы (E):
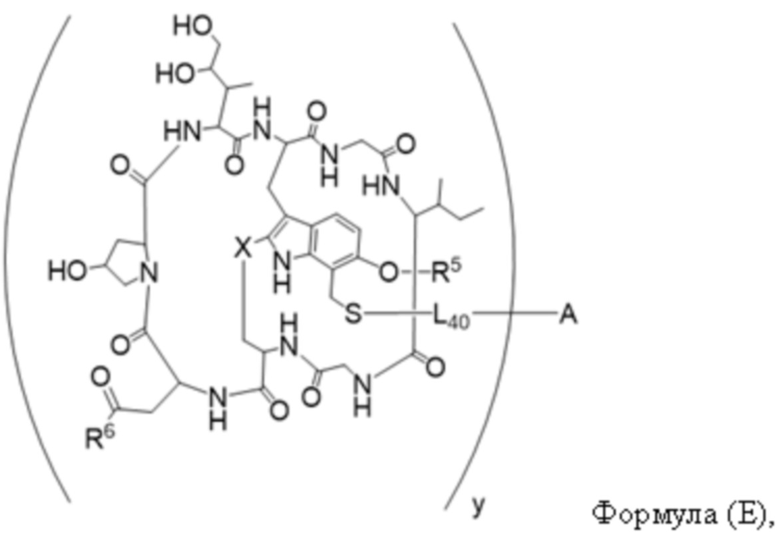
где A, L40, y, X, R5 и R6, являются такими, как определено в данном документе.
В другом аспекте в данном документе предусмотрены антитела и фрагменты антител (например, Fab или Fab'), которые специфически связываются с cKIT человека. Такие антитела и фрагменты антител (например, Fab или Fab') к cKIT можно применять в любом из конъюгатов, описанных в данном документе.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, представляют собой антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с внеклеточным доменом cKIT человека (SEQ ID NO: 112).
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, представляют собой антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с эпитопом в доменах 1-3 cKIT человека (SEQ ID NO: 113)
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, представляют собой антитело или фрагмент антитела (например, Fab или Fab'), описанные в таблице 1.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 1, HCDR2 под SEQ ID NO: 2; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO: 16; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 4, HCDR2 под SEQ ID NO: 5; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:19; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 21.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 6, HCDR2 под SEQ ID NO: 2; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:16; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 7, HCDR2 под SEQ ID NO: 8; HCDR3 под SEQ ID NO: 9; LCDR1 под SEQ ID NO: 22; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 27, HCDR2 под SEQ ID NO: 28; HCDR3 под SEQ ID NO: 29; LCDR1 под SEQ ID NO: 42; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 43.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 30, HCDR2 под SEQ ID NO: 31; HCDR3 под SEQ ID NO: 29; LCDR1 под SEQ ID NO: 44; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 45.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 32, HCDR2 под SEQ ID NO: 28; HCDR3 под SEQ ID NO: 29; LCDR1 под SEQ ID NO: 42; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 43.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 33, HCDR2 под SEQ ID NO: 34; HCDR3 под SEQ ID NO: 35; LCDR1 под SEQ ID NO: 46; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 43.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 1, HCDR2 под SEQ ID NO: 51; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:16; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 4, HCDR2 под SEQ ID NO: 52; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:19; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 21.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 6, HCDR2 под SEQ ID NO: 51; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:16; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 7, HCDR2 под SEQ ID NO: 53; HCDR3 под SEQ ID NO: 9; LCDR1 под SEQ ID NO: 22; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61; HCDR3 под SEQ ID NO: 62; LCDR1 под SEQ ID NO: 75; LCDR2 под SEQ ID NO: 76 и LCDR3 под SEQ ID NO: 77.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 63, HCDR2 под SEQ ID NO: 64; HCDR3 под SEQ ID NO: 62; LCDR1 под SEQ ID NO: 78; LCDR2 под SEQ ID NO: 79 и LCDR3 под SEQ ID NO: 80.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 65, HCDR2 под SEQ ID NO: 61; HCDR3 под SEQ ID NO: 62; LCDR1 под SEQ ID NO:75; LCDR2 под SEQ ID NO: 76 и LCDR3 под SEQ ID NO: 77.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 66, HCDR2 под SEQ ID NO: 67; HCDR3 под SEQ ID NO: 68; LCDR1 под SEQ ID NO: 81; LCDR2 под SEQ ID NO: 79 и LCDR3 под SEQ ID NO: 77.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 86, HCDR2 под SEQ ID NO: 87; HCDR3 под SEQ ID NO: 88; LCDR1 под SEQ ID NO: 101; LCDR2 под SEQ ID NO: 102 и LCDR3 под SEQ ID NO: 103.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 89, HCDR2 под SEQ ID NO: 90; HCDR3 под SEQ ID NO: 88; LCDR1 под SEQ ID NO: 104; LCDR2 под SEQ ID NO: 105 и LCDR3 под SEQ ID NO: 106.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 91, HCDR2 под SEQ ID NO: 87; HCDR3 под SEQ ID NO: 88; LCDR1 под SEQ ID NO: 101; LCDR2 под SEQ ID NO: 102 и LCDR3 под SEQ ID NO: 103.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 92, HCDR2 под SEQ ID NO: 93; HCDR3 под SEQ ID NO: 94; LCDR1 под SEQ ID NO: 107; LCDR2 под SEQ ID NO: 105 и LCDR3 под SEQ ID NO: 103.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность под SEQ ID NO: 10, и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность под SEQ ID NO: 23.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат VH, содержащую аминокислотную последовательность под SEQ ID NO: 36, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 47.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат VH, содержащую аминокислотную последовательность под SEQ ID NO: 54, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 23.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат VH, содержащую аминокислотную последовательность под SEQ ID NO: 69, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 82.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат VH, содержащую аминокислотную последовательность под SEQ ID NO: 95, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 108.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 14, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 40, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 49.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 58, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 73, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 84.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 99, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 110.
В некоторых вариантах осуществления фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 118, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 122.
В некоторых вариантах осуществления фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 118, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 123.
В некоторых вариантах осуществления фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 124, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 128.
В некоторых вариантах осуществления фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 124, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 129.
В некоторых вариантах осуществления фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 130, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 134.
В некоторых вариантах осуществления фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 130, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 135.
В некоторых вариантах осуществления фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 136, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 140.
В некоторых вариантах осуществления фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 141, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 145.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 119, 120 или 121, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 125, 126 или 127, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 49.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 131, 132 или 133, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 137, 138 или 139, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 84.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 142, 143 или 144, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 110.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 12, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 38, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 49.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 56, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 71, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 84.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 97, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 110.
В некоторых вариантах осуществления в данном документе предусмотрены конъюгаты, содержащие фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT (Fab или Fab' к cKIT), соединенный с фрагментом, представляющим собой лекарственное средство (например, цитотоксическое средство), необязательно через линкер. Fab или Fab' к cKIT могут быть любыми из Fab или Fab', описанных в данном документе, например, любыми из Fab или Fab' в таблице 1. Как описано в данном документе, такие конъюгаты Fab' или Fab к cKIT и токсина могут разрушать человеческие клетки HSC in vitro и in vivo, но не вызывают дегрануляцию мастоцитов, даже будучи сшитыми и/или мульмеризованными в более крупные комплексы.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1 представляет собой линейный график, на котором показано, что все протестированные конъюгаты Fab'-(1) к cKIT и DAR4 (подробности состава конъюгатов см. в таблице 2) уничтожали человеческие стволовые клетки и клетки-предшественники (cKIT+ / CD90+ клетки) in vitro, показывая примерно одинаковую активность: J3 (квадраты); J2 (треугольники, направленные вверх); J1 (треугольники, направленные вниз). Контрольный ADC, J6 (ромбы), не уничтожал человеческие HSC в сравнении с PBS-контролем (круги).
ФИГ. 2 представляет собой линейный график, на котором показано, что как конъюгат J4 (квадраты), так и конъюгат J5 (треугольники), связывающие cKIT, приводили к цитолизу мышиных долгосрочных HSC (cKIT+ клетки). В данном анализе цитолиза мышиных HSC более активным был J5 (треугольники), а не J4 (квадраты). Контрольный ADC, J6 (ромбы), не приводил к цитолизу мышиных HSC в сравнении с PBS-контролем (круги).
ФИГ. 3A-3L представляют собой линейные графики, на которых показаны типичные результаты in vitro анализов дегрануляции человеческих мастоцитов, в которых применяли человеческие мастоциты, полученные из HSC периферической крови, и высвобождение бета-гексозаминидазы в качестве регистрируемой величины (оцениваемой по поглощению при 405 нм с вычитанием исходного уровня, основанного на эталонном поглощении при 620 нм). Данные, показанные здесь, собирали в отсутствие SCF. ФИГ. 3A представляет собой линейный график, на котором показано титрование либо конъюгатов Fab'-(1) к cKIT и DAR4 (закрашенные символы, сплошные линии), либо полноразмерных антител к cKIT (незакрашенные символы, пунктирные линии) в виде различных клонов, связывающих cKIT: Ab4/Fab'4 к cKIT (круги), Ab3/Fab'3 к cKIT(квадраты), Ab2/Fab'2 к cKIT (треугольники, направленные вверх), Ab1/Fab'1 к cKIT (треугольники, направленные вниз), и контрольных Ab/Fab' к Her2 (ромбы). ФИГ. 3B представляет собой линейный график, на котором показано титрование антитела к IgE, в качестве положительного контроля дегрануляции мастоцитов. Дегрануляцию мастоцитов наблюдали при всех протестированных концентрациях антитела к IgE. ФИГ. 3C-3J представляют собой линейные графики, на которых показан уровень дегрануляции мастоцитов, запускаемой конъюгатами Fab'-(1) к cKIT и DAR4 (описаны в таблице 2) или контрольными Ab к cKIT, представляющими собой полноразмерные IgG (описаны в таблице 8), при различных концентрациях: отсутствии (незакрашенные ромбы и пунктирные линии); 0,006 нМ (треугольники); 0,098 нМ (ромбы); 1,56 нМ (круги) и 25 нМ (квадраты), когда тестируемые средства были сшиты с применением антитела, специфического в отношении части Fab на антителах-тестируемых средствах (титр нанесен на ось x). На ФИГ. 3C и 3D показано, что дегрануляция мастоцитов не запускалась под действием конъюгата J4 при всех протестированных концентрациях (ФИГ. 3C), в то время как полноразмерное Ab4 к cKIT, будучи сшитым, вызывало дегрануляцию мастоцитов (ФИГ. 3D). На ФИГ. 3E и 3F показано, что дегрануляция мастоцитов не запускалась под действием конъюгата J1 при всех протестированных концентрациях (ФИГ. 3E), в то время как полноразмерное Ab1 к cKIT, будучи сшитым, вызывало дегрануляцию мастоцитов (ФИГ. 3F). На ФИГ. 3G и 3H показано, что дегрануляция мастоцитов не запускалась под действием конъюгата J2 при всех протестированных концентрациях (ФИГ. 3G), в то время как полноразмерное Ab2 к cKIT, будучи сшитым, вызывало дегрануляцию мастоцитов (ФИГ. 3H). На ФИГ. 3I и 3J показано, что дегрануляция мастоцитов не запускалась под действием конъюгата J3 при всех протестированных концентрациях (ФИГ. 3I), в то время как полноразмерное Ab3 к cKIT, будучи сшитым, вызывало дегрануляцию мастоцитов (ФИГ. 3J). ФИГ. 3K и 3L представляют собой линейные графики, на которых показано, что контрольный конъюгат J6 (ФИГ. 3K) или полноразмерное антитело к Her2 (ФИГ. 3L), будучи сшитыми, не вызывали дегрануляцию мастоцитов.
ФИГ. 4 представляет собой точечную диаграмму, на которой показаны относительные количества человеческих HSC, присутствующих в костном мозге гуманизированных мышей NSG после обработки различными средствами. Конъюгат J7 разрушал человеческие HSC (квадраты) в сравнении с PBS-контролем (круги), в то время как контрольный конъюгат J8 (ромбы) не разрушал человеческие HSC в костном мозге.
ФИГ. 5 представляет собой точечную диаграмму, на которой показаны относительные количества человеческих HSC, присутствующих в костном мозге гуманизированных мышей NSG после обработки различными средствами. Конъюгаты Fab'-(1) к cKIT и DAR4 разрушали человеческие HSC в сравнении с PBS-контролем (круги). Протестированные конъюгаты, связывающие cKIT (описаны в таблице 2), были следующими: J3 (квадраты); J2 (треугольники, направленные вверх); J1 (треугольники, направленные вниз). У контрольных мышей, обработанных с помощью J6 (ромбы), разрушение человеческих HSC в костном мозге не наблюдали.
ФИГ. 6 представляет собой столбчатый график, на котором показаны относительные количества HSC, присутствующих в костном мозге мышей C57Bl/6 после обработки различными средствами. Столбик A=мыши, обработанные конъюгатом J4, столбик B=мыши, обработанные конъюгатом J5, столбик C=мыши, обработанные PBS.
ФИГ. 7A-7I представляют собой линейные графики, на которых показаны типичные результаты in vitro анализов дегрануляции человеческих мастоцитов, в которых применяли человеческие мастоциты, полученные из HSC периферической крови, и высвобождение бета-гексозаминидазы в качестве регистрируемой величины (оцениваемой по поглощению при 405 нм с вычитанием исходного уровня, основанного на эталонном поглощении при 620 нм). Данные, показанные здесь, собирали в отсутствие SCF. На линейных графиках показан уровень дегрануляции мастоцитов, запускаемой под действием антител или фрагментов антител при различных концентрациях: 0,006 нМ (треугольники); 0,098 нМ (ромбы); 1,6 нМ (круги) и 25 нМ (квадраты), когда тестируемые средства были сшиты с применением антитела, специфического в отношении части Fab на антителах-тестируемых средствах (титр нанесен на ось x). На ФИГ. 7A-7C показано, что полноразмерное Ab4 к cKIT (HC-E152C-S375C) (ФИГ. 7A) и фрагмент F(ab'4)2 к cKIT (HC-E152C), конъюгированный с соединением (4) (ФИГ. 7B), будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab4 (HC-E152C) при всех протестированных концентрациях (ФИГ. 7C). На ФИГ. 7D-7F показано, что полноразмерное Ab3 к cKIT (HC-E152C-S375C) (ФИГ. 7D) и фрагмент F(ab'3)2 (HC-E152C), конъюгированный с соединением (5) (ФИГ. 7E), будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab3 (E152C), конъюгированного с соединением (4), при всех протестированных концентрациях (ФИГ. 7F). ФИГ. 7G-7I представляют собой линейные графики, на которых показано, что антитело к Her2 (HC-E152C-S375C) (ФИГ. 7G), фрагмент F(ab')2 к Her2 (HC-E152C), конъюгированный с соединением (4) (ФИГ. 7H), или фрагмент Fab к Her2 (HC-E152C), конъюгированный с соединением (7) (ФИГ. 7I), будучи сшитыми, не вызывали дегрануляцию мастоцитов.
ФИГ. 8A-8O представляют собой линейные графики, на которых показаны типичные результаты in vitro анализов дегрануляции человеческих мастоцитов, в которых применяли человеческие мастоциты, полученные из HSC периферической крови, и высвобождение бета-гексозаминидазы в качестве регистрируемой величины (оцениваемой по поглощению при 405 нм с вычитанием исходного уровня, основанного на эталонном поглощении при 620 нм). Данные, показанные здесь, собирали в отсутствие SCF. На линейных графиках показан уровень дегрануляции мастоцитов, запускаемой под действием антител или фрагментов антител при различных концентрациях: 0,006 нМ (треугольники); 0,098 нМ (ромбы); 1,6 нМ (круги) и 25 нМ (квадраты), когда тестируемые средства были сшиты с применением антитела, специфического в отношении части Fab на антителах-тестируемых средствах (титр нанесен на ось x). В качестве эталонного значения на каждый график нанесены результаты для сшивающего антитела отдельно (незакрашенные ромбы, пунктирная линия). На ФИГ. 8A-8C показано, что полноразмерное Ab4 к cKIT (ФИГ. 8A) и фрагмент F(ab'4)2 к cKIT (ФИГ. 8B), будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab4 к cKIT (HC-E152C) при всех протестированных концентрациях (ФИГ. 8C). На ФИГ. 8D-8F показано, что полноразмерное Ab1 к cKIT (ФИГ. 8D) и фрагмент F(ab'1)2 к cKIT (ФИГ. 8E), будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab1 к cKIT (HC-E152C) при всех протестированных концентрациях (ФИГ. 8F). На ФИГ. 8G-8I показано, что полноразмерное Ab2 к cKIT (ФИГ. 8G) и фрагмент F(ab'2)2 к cKIT (ФИГ. 8H), будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab2 к cKIT (HC-E152C) при всех протестированных концентрациях (ФИГ. 8I). На ФИГ. 8J-8L показано, что полноразмерное Ab3 к cKIT (ФИГ. 8J) и фрагмент F(ab'3)2 к cKIT (ФИГ. 8K) вызывали дегрануляцию мастоцитов, будучи сшитыми, при этом отсутствовала дегрануляция мастоцитов, запускаемая фрагментом Fab3 к cKIT (HC-E152C) при всех протестированных концентрациях (ФИГ. 8L). ФИГ. 8M-8O представляют собой линейные графики, на которых показано, что антитело к Her2 (ФИГ. 8M), фрагмент F(ab')2 к Her2 (ФИГ. 8N) или фрагмент Fab к Her2 (HC-E152C) (ФИГ. 8O), будучи сшитыми, не вызывали дегрануляцию мастоцитов.
ФИГ. 9A-9C представляют собой результаты in vitro анализов цитолиза с применением человеческих клеток. Мобилизированные HSC периферической крови культивировали с факторами роста и указанным тестируемым средством в течение 7 дней и жизнеспособность измеряли с помощью проточной цитометрии и подсчета клеток. Тестируемые средства, представляющие собой Fab' к cKIT и DAR4, получали с различными Fab: Fab'1 (ФИГ. 9A), Fab'2 (ФИГ. 9B) или Fab'3 (ФИГ. 9C) к cKIT. Протестированными полезными нагрузками были C1 (незакрашенный квадрат), mc-MMAF (незакрашенный круг), C5 (ромб) или C2 (треугольник). Данные представлены в виде среднего значения со стандартным отклонением, а 3-параметрическую кривую ответа аппроксимировали по трем повторностям, измеренным в одном эксперименте.
ФИГ. 10A-10D представляют собой линейные графики, на которых показана временная динамика формирования химеризма донорских клеток в образцах крови, взятых у подвергнутых трансплантации мышей. Мышам C57BL/6J (n=5 в группе, обрабатываемой антителом к cKIT, или n=2 в группе, обрабатываемой PBS) вводили дозу 10 мг/кг Fab'5 к cKIT-DAR4-C1 (треугольники), 20 мг/кг Fab'5 к cKIT-DAR4-C1 (круги) или PBS (квадраты) в виде инфузии на протяжении семи дней, а затем подвергали трансплантации донорских CD45.1+ клеток спустя два дня. Двух контрольных животных облучали при 1100 рад (ромбы) за один день до проведения трансплантации. На линейных графиках показан процент донорских клеток (CD45.1+), измеренный в популяции всех клеток (ФИГ. 10A), миелоидных клеток (ФИГ. 10B), B-клеток (ФИГ. 10C) или T-клеток (ФИГ. 10D), по результатам FACS-анализа образцов крови, взятых в каждый момент времени. Данные представлены в виде среднего значения со стандартной ошибкой.
ФИГ. 11A-11B представляют собой столбчатые графики, на которых показан химеризм донорских клеток в образцах крови, взятых у подвергнутых трансплантации мышей. Мышам C57BL/6J (n=5 для группы, обрабатываемой антителом к cKIT, или n=2 для группы, обрабатываемой PBS) вводили дозу 10 мг/кг Fab'5 к cKIT-DAR4-C1 (горизонтальные полоски), 20 мг/кг Fab'5 к cKIT-DAR4-C1 (вертикальные полоски), 40 мг/кг Fab'5 к cKIT-DAR4-C1 (закрашенные), 40 мг/кг Fab'5' к cKIT-DAR4-mc-MMAF (шахматный узор) или PBS (незакрашенные, черная граница) в виде инфузии в течение пяти дней, а затем трансплантировали через один день донорские CD45.1+ клетки. Двух контрольных животных облучали при 1100 рад (заштрихованные) за один день до проведения трансплантации. На графиках показан процент донорских клеток (CD45.1+), измеренный в популяции всех клеток (ФИГ. 11A) или миелоидных клеток (ФИГ. 11B), по результатам FACS-анализа образцов крови, взятых в день 28 (левый столбик для каждой группы) или день 56 (правый столбик для каждой группы) после трансплантации. Данные представлены в виде среднего значения со стандартной ошибкой.
ФИГ. 12A-12B представляют собой линейные графики, на которых показана временная динамика формирования химеризма донорских клеток в образцах крови, взятых у подвергнутых трансплантации мышей. Мышей C57BL/6J (n=5 для группы, обрабатываемой средством, связывающимся с cKIT, или n=2 для группы, обрабатываемой PBS) облучали при 300 рад и через три дня или не вводили (квадраты), или вводили дозу 10 мг/кг Fab'5 к cKIT-DAR4-C1 (треугольники) или 20 мг/кг Fab'5 к cKIT-DAR4-C1 (круги) в виде инфузии на протяжении трех дней и затем трансплантировали через два дня донорские CD45.1+ клетки. Дополнительной группе из 5 животных вводили только дозу 10 мг/кг Fab'5 к cKIT-DAR4-C1 (незакрашенные квадраты) в виде инфузии на протяжении трех дней и затем проводили трансплантацию через два дня. Двух контрольных животных облучали при 1100 рад (ромбы) за один день до трансплантации, а двух контрольных животных не подвергали обработке (незакрашенные ромбы) до трансплантации. На линейных графиках показан процент донорских клеток (CD45.1+), измеренный в популяции всех клеток (ФИГ. 12A) или миелоидных клеток (ФИГ. 12B), по результатам FACS-анализа образцов крови, взятых в каждый момент времени. Данные представлены в виде среднего значения со стандартной ошибкой.
ФИГ. 13 представляет собой точечную диаграмму, на которой показаны относительные количества человеческих HSC, присутствующих в костном мозге гуманизированных мышей NSG после обработки различными средствами. Конъюгаты Fab' к cKIT и DAR4 разрушали человеческие HSC в сравнении с PBS-контролем (ромбы). Протестированные конъюгаты, связывающие cKIT (описаны в таблице 2), были следующими: JW (круги); JX (квадраты); JY (треугольники, направленные вверх); JZ (треугольники, направленные вниз).
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем изобретении предусмотрены конъюгаты антитела и лекарственного средства, где антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, соединены с фрагментом, представляющим собой лекарственное средство (например, цитотоксическое средство), необязательно через линкер. Такие конъюгаты антитела и лекарственного средства могут селективно доставлять цитотоксическое средство к клеткам, экспрессирующим cKIT, например, гемопоэтическим стволовым клеткам, тем самым селективно разрушая эти клетки у пациента, например, реципиента трансплантации гемопоэтических стволовых клеток. Предпочтительно конъюгаты антитела к cKIT и лекарственного средства обладают такими фармакокинетическими свойствами, что они не будут присутствовать и/или не будут активны в кровяном русле пациента в течение длительного времени, поэтому их можно применять для кондиционирования реципиентов трансплантации гемопоэтических стволовых клеток перед трансплантацией гемопоэтических стволовых клеток. В некоторых вариантах осуществления в данном документе предусмотрены конъюгаты, содержащие фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT, соединенный с фрагментом, представляющим собой лекарственное средство (например, цитотоксическое средство), необязательно через линкер. Авторы настоящего изобретения неожиданно обнаружили, что полноразмерные антитела к cKIT (например, полноразмерные IgG), их фрагменты F(ab')2 и конъюгаты с токсинами вызывают дегрануляцию мастоцитов, а конъюгаты Fab' или Fab к cKIT и токсина не вызывают дегрануляцию мастоцитов, даже будучи сшитыми и/или мульмеризованными в более крупные комплексы, как можно было бы наблюдать в случае, когда у пациента выработались или имелись предсуществующие антитела к лекарственному средству, распознающие фрагменты Fab. В настоящем изобретении дополнительно предусмотрены фармацевтические композиции, содержащие конъюгаты антитела и лекарственного средства, и способы изготовления и применения таких фармацевтических композиций для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом, например, реципиента трансплантации гемопоэтических стволовых клеток.
Определения
Если не указано иное, подразумевается, что следующие термины и фразы, используемые в данном документе, имеют следующие значения.
Термин "алкил" относится к одновалентной насыщенной углеводородной цепи, содержащей указанное число атомов углерода. Например, C1-6алкил относится к алкильной группе, содержащей от 1 до 6 атомов углерода. Алкильная группа может быть прямой или разветвленной. Типичная разветвленная алкильная группа содержит одну, две или три ветви. Примеры алкильных групп включают без ограничения, метил, этил, пропил (н-пропил и изопропил), бутил (н-бутил, изобутил, втор-бутил и трет-бутил), пентил (н-пентил, изопентил и неопентил) и гексил.
Используемый в данном документе термин "антитело" относится к белковой или полипептидной последовательности, происходящей из молекулы иммуноглобулина, которая специфически связывается с антигеном. Антитела могут быть поликлональными или моноклональными, многоцепочечными или одноцепочечными или интактными иммуноглобулинами, и могут происходить из природных источников или из рекомбинантных источников. Встречающееся в природе "антитело" представляет собой гликопротеин, содержащий по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, соединенные между собой посредством дисульфидных связей. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначаемой в данном документе как VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначаемой в данном документе как VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), которые чередуются с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, в том числе с различными клетками иммунной системы (например, эффекторными клетками) и первым компонентом (C1q) классической системы комплемента. Антитело может быть моноклональным антителом, человеческим антителом, гуманизированным антителом, антителом верблюдовых или химерным антителом. Антитела могут относиться к любому изотипу (например, IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу.
"Определяющие комплементарность домены" или "определяющие комплементарность области" ("CDR") взаимозаменяемо относятся к гипервариабельным областям VL и VH. У цепей антитела CDR представляют собой сайт для связывания белка-мишени, который обуславливает специфичность в отношении такого белка-мишени. В каждой человеческой VL или VH имеется по три CDR (CDR1-3, пронумерованные последовательно от N-конца), составляющие приблизительно 15-20% от вариабельных доменов. CDR могут обозначаться согласно области, к которой они принадлежат, и согласно порядку, в котором они расположены. Например, оба "VHCDR1" или "HCDR1" относятся к первой CDR вариабельной области тяжелой цепи. CDR являются структурно комплементарными эпитопу белка-мишени и, таким образом, непосредственно ответственны за специфичность связывания. Остальные отрезки VL или VH, так называемые каркасные области, проявляют меньшую изменчивость аминокислотной последовательности (Kuby, Immunology, 4th ed., Chapter 4. W.H. Freeman & Co., New York, 2000).
Точные границы аминокислотной последовательности указанной CDR могут быть определены с использованием любой из ряда широко известных схем, в том числе описанных в Kabat et al. (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации по "Kabat"), Al-Lazikani et al., (1997) JMB 273, 927-948 (схема нумерации по "Chothia"), а также нумерация ImMunoGenTics (IMGT) (Lefranc, M.-P., The Immunologist, 7, 132-136 (1999); Lefranc, M.-P. et al., Dev. Comp. Immunol., 27, 55-77 (2003) (схема нумерации "IMGT"). Например, в случае классических форматов согласно Kabat аминокислотные остатки CDR в домене тяжелой вариабельной цепи (VH) имеют номера 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки CDR в домене легкой вариабельной цепи (VL) имеют номера 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). Согласно Chothia аминокислоты CDR в VH имеют номера 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки в VL имеют номера 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). Объединяя определения CDR по Kabat и по Chothia, CDR состоят из аминокислотных остатков 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в человеческой VH и аминокислотных остатков 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в человеческой VL. Согласно IMGT аминокислотные остатки CDR в VH имеют номера примерно 26-35 (CDR1), 51-57 (CDR2) и 93-102 (CDR3), а аминокислотные остатки CDR в VL имеют номера примерно 27-32 (CDR1), 50-52 (CDR2) и 89-97 (CDR3) (нумерация в соответствии с "Kabat"). Согласно IMGT области CDR антитела можно определять с применением программы IMGT/DomainGap Align.
Как легкая, так и тяжелая цепи подразделяются на области структурной и функциональной гомологии. Термины "константный" и "вариабельный" применяются в функциональном смысле. В связи с этим следует понимать, что вариабельные домены из частей как легкой (VL), так и тяжелой (VH) цепей определяют распознавание антигена и специфичность в его отношении. Напротив, константные домены легкой цепи (CL) и тяжелой цепи (CH1, CH2 или CH3 и в некоторых случаях CH4) придают важные биологические свойства, такие как секреция, перемещение через плаценту, связывание с рецептором FcRn, период полувыведения, фармакокинетические свойства и т. п. Принято, что номера доменов константной области увеличиваются по мере их удаления от антигенсвязывающего сайта или амино-конца антитела. N-конец представляет собой вариабельную область, а на C-конце находится константная область; домены CH3 и CL фактически содержат карбокси-концевые домены тяжелой и легкой цепи, соответственно.
Используемый в данном документе термин "фрагмент антитела" или "антигенсвязывающий фрагмент" относится к одной или нескольким частям антитела, которые сохраняют способность специфически взаимодействовать (например, посредством связывания, стерического несоответствия, стабилизации/дестабилизации, пространственного распределения) с эпитопом антигена (например, cKIT). Примеры фрагментов антител включают без ограничения фрагмент Fab, который представляет собой одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; фрагмент Fab', который представляет собой одновалентный фрагмент, состоящий из доменов VL, VH, CL, CH1 и шарнирной области; фрагмент F(ab')2, который представляет собой двухвалентный фрагмент, содержащий два фрагмента Fab, соединенных дисульфидным мостиком в шарнирной области; полуантитело, которое включает одну тяжелую цепь и одну легкую цепь, соединенные дисульфидным мостиком; одноплечевое антитело, которое содержит фрагмент Fab, присоединенный к области Fc; антитело с удаленным доменом CH2, которое содержит два фрагмента Fab, присоединенные к димерам домена CH3 (см. Glaser, J Biol Chem. 2005; 280(50):41494-503); одноцепочечный Fv (scFv); соединенный дисульфидным мостиком Fv (sdFv); фрагмент Fd, состоящий из доменов VH и CH1; фрагмент Fv, состоящий из доменов VL и VH одноплечевого антитела; фрагмент dAb (Ward et al., Nature 341:544-546, 1989), который состоит из домена VH; и выделенную определяющую комплементарность область (CDR) или другие эпитопсвязывающие фрагменты антитела. Например, фрагмент Fab может содержать аминокислотные остатки 1-222 (нумерация EU) тяжелой цепи антитела; в то время как фрагмент Fab' может содержать аминокислотные остатки 1-236 (нумерация EU) тяжелой цепи антитела. Фрагмент Fab или Fab' антитела может быть получен рекомбинантным путем или посредством ферментативного расщепления исходного антитела. Получаемые рекомбинантным путем Fab или Fab' можно конструировать, чтобы ввести аминокислоты для сайт-специфической конъюгации, такие как цистеины (Junutula, J. R.; et al., Nature biotechnology 2008, 26, 925), пирролин-карбоксилизины (Ou, W. et al., Proc Natl Acad Sci USA 2011;108(26):10437-42) или неприродные аминокислоты (например, Tian, F. et al., Proc Natl Acad Sci USA 2014, 111, 1766, Axup, J. Y. et al., Proc Natl Acad Sci USA. 2012, 109, 16101. Аналогичным образом можно добавлять мутации или пептидные метки для облегчения конъюгации за счет фосфопантетеинтрансфераз (Grunewald, J. et al., Bioconjugate chemistry 2015, 26, 2554), формилглицинобразующего фермента (Drake, P. M. et al., Bioconjugate chemistry 2014, 25, 1331), трансглютаминаз (Strop, P. et al., Chemistry & Bioconjugate chemistry 2013, 20, 161), сортазы (Beerli, R. R.; Hell, T.; Merkel, A. S.; Grawunder, U. PloS one 2015, 10, e0131177) или других стратегий конъюгации с применением ферментов. Кроме того, хотя два домена фрагмента Fv, VL и VH, кодируются отдельными генами, их можно соединить с применением рекомбинантных способов с помощью синтетического линкера, который обеспечивает их получение в виде одной белковой цепи, в которой области VL и VH соединяются попарно с образованием одновалентной молекулы (известной как одноцепочечный Fv ("scFv"); см., например, Bird et al., Science 242:423-426, 1988; и Huston et al., Proc. Natl. Acad. Sci. 85:5879-5883, 1988). Предусматривается, что такие одноцепочечные антитела также охватываются термином "антигенсвязывающий фрагмент". Такие антигенсвязывающие фрагменты получают с применением традиционных методик, известных специалистам в данной области техники, и фрагменты подвергают скринингу на применимость таким же способом, что и интактные антитела.
Фрагменты антител или антигенсвязывающие фрагменты также можно вводить в состав однодоменных антител, максител, минител, нанотел, интрател, диател, триател, тетрател, v-NAR и бис-scFv (см., например, Hollinger and Hudson, Nature Biotechnology 23:1126-1136, 2005). Антигенсвязывающие фрагменты можно прививать на остовы на основе полипептидов, таких как фибронектин типа III (Fn3) (см. патент США № 6703199, в котором описаны монотела на основе полипептида фибронектина).
Фрагменты антител или антигенсвязывающие фрагменты можно вводить в состав одноцепочечных молекул, содержащих пару тандемных сегментов Fv (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей (Zapata et al., Protein Eng. 8:1057-1062, 1995; и патент США № 5641870).
Используемый в данном документе термин "моноклональное антитело" или "композиция на основе моноклонального антитела" относится к полипептидам, включающим антитела и антигенсвязывающие фрагменты, которые характеризуются практически идентичной аминокислотной последовательностью или происходят из одного генетического источника. Данный термин также охватывает препараты молекул антител одного молекулярного состава. Композиция на основе моноклонального антитела проявляет одну специфичность и аффинность связывания в отношении конкретного эпитопа.
Используемый в данном документе термин "человеческое антитело" охватывает антитела, имеющие вариабельные области, в которых как каркасные области, так и CDR получены из последовательностей, происходящих от человека. Кроме того, если антитело содержит константную область, то константная область также происходит из таких человеческих последовательностей, например, последовательностей зародышевой линии человека, или мутантных версий последовательностей зародышевой линии человека, или антитела, содержащего консенсусные каркасные последовательности, полученные за счет анализа человеческих каркасных последовательностей, например, как описано в Knappik et al., J. Mol. Biol. 296:57-86, 2000.
Человеческие антитела по настоящему описанию могут содержать аминокислотные остатки, закодированные в человеческих последовательностях (например, мутации, введенные посредством случайного или сайт-специфического мутагенеза in vitro или за счет соматических мутаций in vivo, или консервативные замены, которые содействуют стабильности или облегчают изготовление).
Используемый в данном документе термин "распознавать" относится к антителу или его антигенсвязывающему фрагменту, которые отыскивают свой эпитоп и взаимодействуют (например, связываются) с ним, независимо от того является ли эпитоп линейным или конформационным. Термин "эпитоп" относится к сайту на антигене, с которым специфически связываются антитело или антигенсвязывающий фрагмент по настоящему изобретению. Эпитопы могут быть образованы как смежными аминокислотами, так и несмежными аминокислотами, размещаемыми рядом за счет третичной укладки белка. Эпитопы, образуемые из смежных аминокислот, как правило, сохраняются при воздействии денатуририрующих растворителей, в то время как эпитопы, образуемые за счет третичной укладки, как правило, утрачиваются при обработке денатурирующими растворителями. Эпитоп, как правило, содержит по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот в уникальной пространственной конформации. Способы определения пространственной конформации эпитопов включают методики из уровня техники, например, рентгеноструктурную кристаллографию и 2-мерный ядерный магнитный резонанс (см., например, Epitope Mapping Protocols в Methods in Molecular Biology, Vol. 66, G. E. Morris, Ed. (1996)). "Паратоп" представляет собой часть антитела, которая распознает эпитоп антигена.
Фраза "специфически связывает" или "селективно связывает", когда она применяется в контексте описания взаимодействия между антигеном (например, белком) и антителом, фрагментом антитела или связывающим средством, происходящим из антитела, относится к реакции связывания, которая является определяющей для установления присутствия антигена в неоднородной популяции белков и других биологических веществ, например, в биологическом образце, например, крови, сыворотке, плазме или образце ткани. Таким образом, при некоторых обозначенных условиях проведения иммунологического анализа антитела или связывающие средства, характеризующиеся конкретной специфичностью связывания, связываются с конкретным антигеном в по меньшей мере два раза сильнее, чем фоновый уровень, и практически не связываются в значительном количестве с другими антигенами, присутствующими в образце. В одном аспекте при обозначенных условиях иммунологического анализа антитело или связывающее средство с конкретной специфичностью связывания связывается с конкретным антигеном в по меньшей мере десять (10) раз сильнее относительно фонового уровня, и практически не связывается в значительном количестве с другими антигенами, присутствующими в образце. Специфическое связывание с антителом или связывающим средством в таких условиях может предусматривать то, что антитело или средство должно отбираться за его специфичность в отношении конкретного белка. При желании или необходимости данный отбор можно проводить путем отбрасывания антител, которые вступают в перекрестные реакции с молекулами от другого вида (например, мыши или крысы) или других подтипов. В качестве альтернативы в некоторых аспектах отбирают антитела или фрагменты антител, которые вступают в перекрестные реакции с некоторыми требуемыми молекулами.
Используемый в данном документе термин "аффинность" относится к силе взаимодействия между антителом и антигеном в отдельных антигенных сайтах. В пределах каждого антигенного сайта вариабельная область "плеча" антитела взаимодействует с антигеном посредством слабых нековалентных сил в многочисленных сайтах; чем больше взаимодействий, тем сильнее аффинность.
Термин "выделенное антитело" относится к антителу, которое практически не содержит других антител с отличающейся антигенной специфичностью. Однако выделенное антитело, которое специфически связывается с одним антигеном, может характеризоваться перекрестной реактивностью в отношении других антигенов. Более того, выделенное антитело может практически не содержать другого клеточного материала и/или химических веществ.
Термин "соответствующая последовательность зародышевой линии человека" относится к последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность или подпоследовательность человеческой вариабельной области, которые обладают самой высокой установленной идентичностью аминокислотной последовательности с эталонной аминокислотной последовательностью или подпоследовательностью вариабельной области в сравнении со всеми другими известными аминокислотными последовательностями вариабельной области, закодированными в последовательностях вариабельной области иммуноглобулина зародышевой линии человека. Соответствующая последовательность зародышевой линии человека также может относиться к аминокислотной последовательности или подпоследовательности человеческой вариабельной области, характеризующимися самой высокой идентичностью аминокислотной последовательности с эталонной аминокислотной последовательностью или подпоследовательностью вариабельной области в сравнении со всеми другими подвергнутыми оценке аминокислотными последовательностями вариабельной области. Соответствующей последовательностью зародышевой линии человека могут быть только каркасные области, только определяющие комплементарность области, каркасные и определяющие комплементарность области, вариабельный сегмент (как определено выше) или другие комбинации последовательностей или подпоследовательностей, которые содержат вариабельную область. Идентичность последовательности может быть определена с применением способов, описанных в данном документе, например, выравнивания двух последовательностей с применением BLAST, ALIGN или другого алгоритма выравнивания, известного из уровня техники. Соответствующая последовательность нуклеиновой кислоты или аминокислотная последовательность зародышевой линии человека может характеризоваться по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичностью последовательности с эталонной последовательностью нуклеиновой кислоты или аминокислотной последовательностью вариабельной области.
Целый ряд форматов иммунологического анализа может применяться для отбора антител, характеризующихся специфической иммунной реактивностью в отношении конкретного белка. Например, твердофазные иммунологические анализы ELISA традиционно применяются для отбора антител, характеризующихся специфической реактивностью в отношении белка (см., например, Harlow & Lane, Using Antibodies, A Laboratory Manual (1998), где описаны форматы и условия иммунологического анализа, которые можно применять для определения специфической иммунной реактивности). Как правило, реакция специфического или селективного связывания будет приводить к сигналу, в по меньшей мере два раза превышающему фоновый уровень, и, более типично, в по меньшей мере 10-100 раз превышающему фоновый уровень.
Термин "равновесная константа диссоциации (KD [M])" относится к константе скорости диссоциации (kd [с-1]), поделенной на константу скорости ассоциации (ka [с-1, M-1]). Равновесные константы диссоциации могут быть измерены с применением любого способа, известного из уровня техники. Обычно антитела по настоящему изобретению будут характеризоваться равновесной константой диссоциации, составляющей менее приблизительно 10-7 или 10-8 M, например, менее приблизительно 10-9 M или 10-10 M, в некоторых аспектах менее приблизительно 10-11 M, 10-12 M или 10-13 M.
Термин "биодоступность" относится к системной доступности (т.е. уровням в крови/плазме) заданного количества лекарственного средства, вводимого пациенту. Биодоступность представляет собой абсолютный термин, обозначающий показатель как времени (скорости), в течение которого лекарственное средство достигает общего кровообращения из введенной лекарственной формы, так и общего количества (степени) лекарственного средства в нем.
Используемая в данном документе фраза "состоящий фактически из" относится к родам или видам активных фармацевтических средств, включенных в способ или композицию, а также любым вспомогательным веществам, не проявляющим активность в отношении намеченной цели применения способов или композиций. В некоторых аспектах фраза "состоящий фактически из" однозначно исключает включение одного или нескольких дополнительных активных средств, отличных от конъюгата антитела и лекарственного средства по настоящему изобретению. В некоторых аспектах фраза "состоящий фактически из" однозначно исключает включение одного или нескольких дополнительных активных средств, отличных от конъюгата антитела и лекарственного средства по настоящему изобретению и второго средства, вводимого совместно.
Термин "аминокислота" относится к встречающимся в природе, синтетическим и неприродным аминокислотам, а также аналогам аминокислот и миметикам аминокислот, которые функционируют подобно встречающимся в природе аминокислотам. Встречающиеся в природе аминокислоты представляют собой аминокислоты, закодированные в генетическом коде, а также такие аминокислоты, которые были впоследствии модифицированы, например, гидроксипролин, γ-карбоксиглутамат и O-фосфосерин. Аналоги аминокислот относятся к соединениям, которые характеризуются такой же основной химической структурой, что и встречающаяся в природе аминокислота, то есть имеют α-углерод, который связан с водородом, карбоксильной группой, аминогруппой и R-группой, например, к гомосерину, норлейцину, метионинсульфоксиду, метионинметилсульфонию. Такие аналоги имеют модифицированные R-группы (например, норлейцин) или модифицированные пептидные остовы, но сохраняют такую же основную химическую структуру, что и встречающаяся в природе аминокислота. Миметики аминокислот относятся к химическим соединениям, которые имеют структуру, отличающуюся от общей химической структуры аминокислоты, но которые функционируют подобно встречающейся в природе аминокислоте.
Термин "консервативно модифицированный вариант" применяется в отношении как аминокислотных последовательностей, так и последовательностей нуклеиновой кислоты. Применительно к конкретным последовательностям нуклеиновой кислоты, консервативно модифицированные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или фактически идентичные аминокислотные последовательности, или же, если нуклеиновая кислота не кодирует аминокислотную последовательность, к фактически идентичным последовательностям. Вследствие вырожденности генетического кода любой заданный белок кодируется большим количеством функционально идентичных нуклеиновых кислот. Например, все из кодонов GCA, GCC, GCG и GCU кодируют аминокислоту аланин. Таким образом, в каждом положении, в котором кодоном задан аланин, кодон может быть изменен на любой из соответствующих описанных кодонов без изменения кодируемого полипептида. Такие вариации нуклеиновой кислоты являются "молчащими вариациями", которые представляют собой одну разновидность вариаций с консервативными модификациями. В данном документе каждая последовательность нуклеиновой кислоты, которая кодирует полипептид, также описывает каждую возможную молчащую вариацию нуклеиновой кислоты. Специалист в данной области будет осознавать, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который обычно является единственным кодоном для метионина, и TGG, который обычно является единственным кодоном для триптофана) может быть модифицирован с получением функционально идентичной молекулы. Соответственно, каждая молчащая вариация нуклеиновой кислоты, которая кодирует полипептид, неявно определена в каждой описанной последовательности.
В случае полипептидных последовательностей "консервативно модифицированные варианты" охватывают отдельные замены, делеции или добавления в полипептидной последовательности, которые приводят к замене аминокислоты на аналогичную по химическим свойствам аминокислоту. Таблицы консервативных замен, обеспечивающие функционально аналогичные аминокислоты, хорошо известны из уровня техники. Такие консервативно модифицированные варианты дополняют, а не исключают полиморфные варианты, межвидовые гомологи и аллели. Следующие восемь групп содержат аминокислоты, которые являются консервативными заменами друг для друга: 1) аланин (A), глицин (G); 2) аспарагиновая кислота (D), глутаминовая кислота (E); 3) аспарагин (N), глутамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), метионин (M), валин (V); 6) фенилаланин (F), тирозин (Y), триптофан (W); 7) серин (S), треонин (T); и 8) цистеин (C), метионин (M) (см., например, Creighton, Proteins (1984)). В некоторых аспектах термин "консервативные модификации последовательности" используется для обозначения аминокислотных модификаций, которые не оказывают значительного влияния на характеристики связывания у антитела, содержащего аминокислотную последовательность, или не изменяют их.
Используемый в данном документе термин "оптимизированная" относится к нуклеотидной последовательности, кодирующей аминокислотную последовательность, которая была изменена с применением кодонов, предпочтительных в продуцирующих клетке или организме, обычно в эукариотической клетке, например, дрожжевой клетке, клетке Pichia, грибной клетке, клетке Trichoderma, клетке яичника китайского хомячка (CHO) или человеческой клетке. Оптимизированную нуклеотидную последовательность конструируют таким образом, чтобы полностью или насколько это возможно сохранить аминокислотную последовательность, изначально закодированную в исходной нуклеотидной последовательности, которая также известна как "родительская" последовательность.
Термины "процент идентичности" или "процентная идентичность", в контексте двух или более нуклеиновых кислот или полипептидных последовательностей, относятся к степени, в которой две или более последовательности или подпоследовательности являются одинаковыми. Две последовательности являются "идентичными", если они имеют одинаковую последовательность из аминокислот или нуклеотидов на протяжении области, подлежащей сравнению. Две последовательности являются "практически идентичными", если две последовательности имеют указанную процентную долю аминокислотных остатков или нуклеотидов, которые являются одинаковыми (т.е. 60% идентичность, необязательно 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% идентичность на протяжении указанной области или, если не указано, на протяжении всей последовательности), при сравнении и выравнивании для обеспечения максимального соответствия на протяжении окна сравнения или обозначенной области, как измерено с применением одного из следующих алгоритмов сравнения последовательности или посредством ручного выравнивания и визуального просмотра. Необязательно идентичность существует на протяжении области, длина которой составляет по меньшей мере приблизительно 30 нуклеотидов (или 10 аминокислот), или более предпочтительно на протяжении области, длина которой составляет 100-500 или 1000 или более нуклеотидов (или 20, 50, 200 или более аминокислот).
При сравнении последовательностей обычно одна последовательность выступает в качестве эталонной последовательности, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения последовательностей тестируемую и эталонную последовательности вводят в компьютер, если необходимо, устанавливают координаты подпоследовательностей и устанавливают программные параметры алгоритма для анализа последовательностей. Могут применяться программные параметры по умолчанию или можно устанавливать альтернативные параметры. На основании программных параметров алгоритм сравнения последовательностей затем рассчитывает значения процента идентичности последовательностей для тестируемых последовательностей относительно эталонной последовательности.
Используемое в данном документе "окно сравнения" предусматривает ссылку на сегмент из любого количества смежных положений, выбранных из группы, состоящей из от 20 до 600, обычно от приблизительно 50 до приблизительно 200, чаще от приблизительно 100 до приблизительно 150, в котором последовательность можно сравнивать с эталонной последовательностью с таким же количеством смежных положений, после того как две последовательности подвергли оптимальному выравниванию. Способы выравнивания последовательностей для проведения сравнения хорошо известны из уровня техники. Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма поиска локальной гомологии Смита-Уотермана, Adv. Appl. Math. 2:482c (1970), с помощью алгоритма выравнивания областей гомологии Нидлмана-Вунша, J. Mol. Biol. 48:443 (1970), с помощью способа поиска сходства Пирсона-Липмана, Proc. Natl. Acad. Sci. USA 85:2444 (1988), с помощью компьютерных реализаций таких алгоритмов (GAP, BESTFIT, FASTA и TFASTA в составе пакета программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Мэдисон, Висконсин) или с помощью ручного выравнивания и визуального просмотра (см., например, Brent et al., Current Protocols in Molecular Biology, 2003).
Два примера алгоритмов, которые подходят для определения процента идентичности последовательностей и сходства последовательностей, представляют собой алгоритмы BLAST и BLAST 2.0, которые описаны в Altschul et al., Nuc. Acids Res. 25:3389-3402, 1977; и Altschul et al., J. Mol. Biol. 215:403-410, 1990, соответственно. Программное обеспечение для осуществления анализов BLAST является общедоступным от Национального центра биотехнологической информации. На первом этапе данный алгоритм предусматривает идентификацию пар последовательностей с высоким показателем сходства (HSP) за счет идентификации коротких слов длиной W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют некоторому пороговому баллу T с положительным значением при выравнивании со словом такой же длины в последовательности из базы данных. T известен под названием пороговый балл соседних слов (Altschul et al., выше). Эти первоначальные совпадения соседних слов выступают в качестве "затравок" для начала поисков, чтобы найти более длинные HSP, содержащие их. Совпадения слов продлеваются в обоих направлениях вдоль каждой последовательности до тех пор, пока может увеличиваться суммарный балл выравнивания. Суммарные баллы рассчитывают с применением, в случае нуклеотидных последовательностей, параметров M (вознаграждающий балл за пару совпадающих остатков; всегда >0) и N (штрафной балл за несовпадающие остатки; всегда <0). В случае аминокислотных последовательностей для подсчета суммарного балла применяют матрицу замен. Продление совпадений слов в каждом направлении останавливается, когда суммарный балл выравнивания уменьшается на величину X относительно своего максимального достигнутого значения; суммарный балл стремится к нулю или ниже вследствие накопления одного или нескольких выравниваний остатков с отрицательными баллами; или достигается конец любой из последовательностей. Параметры W, T и X алгоритма BLAST определяют чувствительность и скорость выравнивания. В программе BLASTN (для нуклеотидных последовательностей) в качестве параметров по умолчанию применяется длина слова (W), составляющая 11, ожидание (E), составляющее 10, M=5, N=-4 и сравнение обеих нитей. В случае аминокислотных последовательностей в программе BLASTP в качестве параметров по умолчанию применяется длина слова, составляющая 3, и ожидание (E), составляющее 10, и матрица замен BLOSUM62 (см. Henikoff and Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915), выравнивания (B), составляющие 50, ожидание (E), составляющее 10, M=5, N=-4 и сравнение обеих нитей.
Алгоритм BLAST также осуществляет статистический анализ сходства между двумя последовательностями (см., например, Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5787, 1993). Одной мерой сходства, предусмотренной в алгоритме BLAST, является наименьшая суммарная вероятность (P (N)), которая указывает на вероятность, с которой совпадение между двумя нуклеотидными или аминокислотными последовательностями возникло случайно. Например, нуклеиновая кислота считается схожей с эталонной последовательностью, если наименьшая суммарная вероятность при сравнении тестируемой нуклеиновой кислоты с эталонной нуклеиновой кислотой составляет менее приблизительно 0,2, более предпочтительно менее приблизительно 0,01 и наиболее предпочтительно менее приблизительно 0,001.
Процентную идентичность между двумя аминокислотными последовательностями также можно определить с использованием алгоритма из E. Meyers and W. Miller (Comput. Appl. Biosci. 4:11-17, (1988) который был включен в программу ALIGN (версия 2.0), с применением таблицы весов замен остатков PAM120, штрафа за продление гэпа, составляющего 12, и штрафа за открытие гэпа, составляющего 4. Кроме того, процентная идентичность между двумя аминокислотными последовательностями может быть определена с применением алгоритма Нидлмана-Вунша, J. Mol. Biol. 48:444-453, (1970), который был включен в программу GAP в составе пакета программного обеспечения GCG (доступного на www.gcg.com), с применением либо матрицы Blossom 62, либо матрицы PAM250, и также штрафа за открытие гэпа, составляющего 16, 14, 12, 10, 8, 6 или 4, и штрафа за продление гэпа, составляющего 1, 2, 3, 4, 5 или 6.
Помимо процента идентичности последовательностей, упомянутого выше, еще одним показателем того, что две последовательности нуклеиновой кислоты или полипептида являются практически идентичными, является то, что полипептид, кодируемый первой нуклеиновой кислотой, является иммунологически перекрестно реактивным с антителами, выработка которых индуцирована полипептидом, кодируемым второй нуклеиновой кислотой, как описано ниже. Таким образом, полипептид, как правило, является практически идентичным второму полипептиду, например, если два пептида отличаются только консервативными заменами. Другим показателем того, что две последовательности нуклеиновой кислоты являются практически идентичными, является то, что две молекулы или их комплементарные цепи гибридизируются друг с другом в жестких условиях, как описано ниже. Еще одним показателем того, что две последовательности нуклеиновой кислоты являются практически идентичными, является то, что для амплификации последовательности могут применяться одни и те же праймеры.
Термин "нуклеиновая кислота" используется в данном документе взаимозаменяемо с термином "полинуклеотид" и относится к дезоксирибонуклеотидам или рибонуклеотидам и полимерам на их основе в одно- или двухнитевой форме. Термин охватывает нуклеиновые кислоты, содержащие известные аналоги нуклеотидов или модифицированные остатки или связи в остове, которые являются синтетическими, встречающимися в природе и не встречающимися в природе, которые характеризуются свойствами связывания, подобными эталонной нуклеиновой кислоте, и которые метаболизируются подобно эталонным нуклеотидам. Примеры таких аналогов включают без ограничения фосфоротиоаты, фосфорамидаты, метилфосфонаты, хиральные метилфосфонаты, 2-O-метилрибонуклеотиды, пептидонуклеиновые кислоты (PNA).
Если не указано иное, конкретная последовательность нуклеиновой кислоты также в неявном виде охватывает ее консервативно модифицированные варианты (например, замены на основе вырожденных кодонов) и комплементарные последовательности, а также последовательность, указанную явным образом. А именно, как подробно описано ниже, замены на основе вырожденных кодонов можно проводить за счет создания последовательностей, в которых третье положение в одном или нескольких выбранных (или всех) кодонах заменено на любой из канонических нуклеозидов и/или остаток дезоксиинозина (Batzer et al., Nucleic Acid Res. 19:5081, 1991; Ohtsuka et al., J. Biol. Chem. 260:2605-2608, 1985; и Rossolini et al., Mol. Cell. Probes 8:91-98, 1994).
В контексте нуклеиновых кислот термин "функционально связанный" относится к функциональной взаимосвязи двух или более сегментов полинуклеотида (например, ДНК). Как правило, он относится к функциональной взаимосвязи регулирующей транскрипцию последовательности с транскрибируемой последовательностью. Например, промоторная или энхансерная последовательность является функционально связанной с кодирующей последовательностью, если она стимулирует или модулирует транскрипцию кодирующей последовательности в соответствующей клетке-хозяине или другой системе экспрессии. Обычно регулирующие транскрипцию промоторные последовательности, которые являются функционально связанными с транскрибируемой последовательностью, являются физически смежными с транскрибируемой последовательностью, т.е. они функционируют в цис-положении. Однако некоторые регулирующие транскрипцию последовательности, такие как энхансеры, не обязательно должны быть физически смежными или располагаться в непосредственной близости от кодирующих последовательностей, транскрипцию которых они усиливают.
Термины "полипептид" и "белок" используются в данном документе взаимозаменяемо для обозначения полимера из аминокислотных остатков. Термины применимы к полимерам из аминокислот, в которых один или несколько аминокислотных остатков представляют собой искусственный химический миметик соответствующей встречающейся в природе аминокислоты, а также к полимерам из встречающихся в природе аминокислот и полимеру из не встречающихся в природе аминокислот. Если не указано иное, конкретная полипептидная последовательность также в неявном виде охватывает ее консервативно модифицированные варианты.
Используемый в данном документе термин "конъюгат" или "конъюгат антитела и лекарственного средства" относится к связи антитела или его антигенсвязывающего фрагмента с другим средством, таким как химиотерапевтическое средство, токсин, иммунотерапевтическое средство, зонд для визуализации и т. п. Связь может представлять собой ковалентные связи или нековалентные взаимодействия, такие как посредством электростатических сил. Для образования конъюгата могут использоваться различные линкеры, известные из уровня техники. Кроме того, конъюгат может предусматриваться в форме слитого белка, который может экспрессироваться с полинуклеотида, кодирующего конъюгат. Используемый в данном документе "слитый белок" относится к белкам, созданным за счет соединения двух или более генов или фрагментов генов, которые изначально кодировали отдельные белки (в том числе пептиды и полипептиды). Трансляция слитого гена приводит к единому белку с функциональными свойствами, происходящими из каждого из исходных белков.
Термин "субъект" охватывает человека и отличных от человека животных. Отличные от человека животные охватывают всех позвоночных, например, млекопитающих и отличных от млекопитающих животных, как, например, отличных от человека приматов, овцу, собаку, корову, кур, амфибий и рептилий. За исключением случаев, когда это отмечается, термины "пациент" или "субъект" используются в данном документе взаимозаменяемо.
Используемый в данном документе термин "токсин", "цитотоксин" или "цитотоксическое средство" относится к любому средству, которое является вредным для роста и пролиферации клеток и которое может функционировать с уменьшением, ингибированием или разрушением клетки или злокачественной опухоли.
Используемый в данном документе термин "противораковое средство" относится к любому средству, которое может использоваться для лечения нарушения пролиферации клеток, такого как рак, в том числе без ограничения к цитотоксическим средствам, химиотерапевтическим средствам, лучевой терапии и средствам для лучевой терапии, нацеливающим противораковым средствам и иммунотерапевтическим средствам.
Используемый в данном документе термин "фрагмент, представляющий собой лекарственное средство" или "полезная нагрузка" относится к химическому фрагменту, который конъюгирован с антителом или антигенсвязывающим фрагментом, и может охватывать любое терапевтическое или диагностическое средство, например, противораковое, противовоспалительное, противоинфекционное (например, противогрибковое, антибактериальное, антипаразитарное, противовирусное) или анестетическое средство. В определенных аспектах фрагмент, представляющий собой лекарственное средство, выбран из ингибитора Eg5, ингибитора V-АТФазы, ингибитора HSP90, ингибитора IAP, ингибитора mTor, стабилизатора микротрубочек, дестабилизатора микротрубочек, ауристатина, доластатина, майтанзиноида, MetAP (метионинаминопептидаза), ингибитора ядерного экспорта белков CRM1, ингибитора DPPIV, ингибитора реакций переноса фосфорила в митохондриях, ингибитора синтеза белков, ингибитора киназ, ингибитора CDK2, ингибитора CDK9, ингибитора протеасом, ингибитора кинезина, ингибитора HDAC, ДНК-повреждающего средства, ДНК-алкилирующего средства, ДНК-интеркалятора, средства, связывающего малую бороздку ДНК, ингибитора РНК-полимеразы, аманитина, ингибитора сплайсосомы, ингибитора топоизомеразы и ингибитора DHFR. Способы прикрепления каждого из них к линкеру, совместимому с антителами и способом по настоящему изобретению, известны из уровня техники. См., например, Singh et al., (2009) Therapeutic Antibodies: Methods and Protocols, vol. 525, 445-457. Кроме того, полезная нагрузка может представлять собой зонд для биофизического обнаружения, флуорофор, спиновую метку, зонд для инфракрасного обнаружения, зонд для обнаружения аффинности, хелатор, зонд для спектроскопического обнаружения, радиоактивный зонд, липидную молекулу, полиэтиленгликоль, полимер, спиновую метку, ДНК, РНК, белок, пептид, поверхность, антитело, фрагмент антитела, наночастицу, квантовую точку, липосому, частицу PLGA, сахарид или полисахарид.
Термин "рак" охватывает первичные злокачественные опухоли (например, опухоли, клетки которых не мигрировали в локализации в организме субъекта, отличные от локализации исходной опухоли) и вторичные злокачественные опухоли (например, опухоли, развившиеся за счет метастазирования, миграции опухолевых клеток во вторичные локализации, которые отличны от локализации исходной опухоли).
Термин "cKIT" (также известный как KIT, PBT, SCFR, C-Kit, CD117) относится к тирозинкиназному рецептору, который является представителем семейства III рецепторных тирозинкиназ. Последовательности нуклеиновой кислоты и аминокислотные последовательности изоформ cKIT человека известны и были опубликованы в GenBank под следующими №№ доступа:
NM_000222.2 → NP_000213.1 предшественник изоформы 1 рецептора Kit фактора роста мастоцитов/стволовых клеток;
NM_001093772.1 → NP_001087241.1 предшественник изоформы 2 рецептора Kit фактора роста мастоцитов/стволовых клеток.
По своей структуре рецептор cKIT представляет собой трансмембранный белок I типа, и он содержит сигнальный пептид, 5 Ig-подобных доменов C2 во внеклеточном домене и имеет протеинкиназный домен в своем внутриклеточном домене. Используемый в данном документе термин "cKIT" применяют для совместного обозначения всех встречающихся в природе изоформ белка cKIT или его вариантов.
Термин "вариант" относится к полипептиду, который имеет практически идентичную аминокислотную последовательность с эталонным полипептидом, или кодируется практически идентичной нуклеотидной последовательностью и может характеризоваться одной или несколькими активностями эталонного полипептида. Например, вариант может характеризоваться приблизительно 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокой идентичностью последовательности с эталонным полипептидом, при этом он сохраняет одну или несколько активностей эталонного полипептида.
Используемые в данном документе термины "лечить", "осуществление лечения" или "лечение" любого заболевания или нарушения в одном аспекте относится к уменьшению тяжести заболевания или нарушения (т.е. замедлению, или остановке, или снижению развития заболевания или по меньшей мере одного из его клинических симптомов). В другом аспекте "лечить", "осуществление лечения" или "лечение" относятся к облегчению или уменьшению тяжести по меньшей мере одного физического параметра, в том числе таких, которые могут быть не очевидными для пациента. В еще одном аспекте "лечить", "осуществление лечения" или "лечение" относятся к модулированию заболевания или нарушения либо физическому (например, стабилизации очевидного симптома), либо физиологическому (например, стабилизации физического параметра), либо обоим. В еще одном аспекте "лечить", "осуществление лечения" или "лечение" относятся к предотвращению или отсрочке проявления, или развития, или прогрессирования заболевания или нарушения.
Термин "терапевтически приемлемое количество" или "терапевтически эффективная доза" взаимозаменяемо относится к количеству, достаточному для произведения требуемого результата (т.е. уменьшения размера опухоли, ингибирования роста опухоли, предотвращения метастазирования, ингибирования или предотвращения вирусной, бактериальной, грибковой или паразитарной инфекции). В некоторых аспектах терапевтически приемлемое количество не индуцирует или не вызывает нежелательные побочные эффекты. Терапевтически приемлемое количество можно определять, вводя вначале низкую дозу, а затем постепенно увеличивая данную дозу до тех пор, пока не будет достигнут требуемый эффект. "Терапевтически эффективная доза" молекул по настоящему изобретению может предотвращать проявление или, соответственно, приводить к уменьшению тяжести симптомов заболевания, в том числе симптомов, ассоциированных с раком.
Термин "совместное введение" относится к одновременному присутствию двух активных средств в крови индивидуума. Активные средства, которые вводятся совместно, могут доставляться одновременно или последовательно.
Используемый в данном документе термин 'тиол-малеимид' относится к группе, образуемой за счет реакции тиола с малеимидом, имеющей такую общую формулу:
где Y и Z представляют собой группы, подлежащие соединению с помощью тиол-малеимидной связи, и они могут предусматривать линкерные компоненты, антитела или полезные нагрузки. Тиол-малеимид может формировать следующие структуры с открытым кольцом  и
и  .
.
Используемый в данном документе "расщепляемый" относится к связывающей группе или линкерному компоненту, которые соединяют два фрагмента за счет ковалентных связей, но распадаются с разрывом ковалентной связи между фрагментами при физиологически соответствующих условиях, как правило расщепляемая связывающая группа разрывается in vivo быстрее во внутриклеточной среде, чем при нахождении вне клетки, что вызывает предпочтительное высвобождение полезной нагрузки внутри целевой клетки. Расщепление может быть ферментативным или неферментативным, но обычно приводит к высвобождению полезной нагрузки из антитела без разрушения антитела. При расщеплении некоторая часть связывающей группы или линкерного компонента может оставаться присоединенной к полезной нагрузке, или высвобождение полезной нагрузки может происходить без какого-либо остатка связывающей группы.
Используемый в данном документе "нерасщепляемый" относится к связывающей группе или линкерному компоненту, которые практически не подвергаются распадению при физиологических условиях, например, они устойчивы по меньшей мере в такой же степени, что и часть конъюгата, представляющая собой антитело или антигенсвязывающий фрагмент. Такие связывающие группы иногда называют 'устойчивыми', это означает, что они в достаточной степени устойчивы к разрушению, чтобы удержать полезную нагрузку, присоединенной к антителу или антигенсвязывающему фрагменту до тех пор, пока антитело или антигенсвязывающий фрагмент сами по себе по меньшей мере частично не разрушатся, т.е. разрушение антитела или антигенсвязывающего фрагмента предшествует расщеплению связывающей группы in vivo. При разрушении части, представляющей собой антитело, у ADC с устойчивой или нерасщепляемой связывающей группой часть или вся связывающая группа, например, одна или несколько аминокислотных групп из антитела, могут оставаться присоединенными к полезной нагрузке или фрагменту, представляющему собой лекарственное средство, которые доставляются in vivo.
Фрагмент, представляющий собой линкер-лекарственное средство (LB-(D)n)
В одном аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, предусматривает один или несколько цитотоксинов, ковалентно присоединенных к линкеру (LB), где один или несколько цитотоксинов независимо выбраны из ауристатина, аманитина, майтанзиноида и сапорина.
В другом аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, предусматривает один или несколько цитотоксинов, ковалентно присоединенных к линкеру (LB), где один или несколько цитотоксинов независимо выбраны ауристатина и аманитина.
В одном аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, предусматривает один или несколько цитотоксинов, ковалентно присоединенных к линкеру (LB), где линкер (LB) представляет собой расщепляемый линкер, а один или несколько цитотоксинов независимо выбраны из ауристатина, аманитина, майтанзиноида и сапорина.
В другом аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, предусматривает один или несколько цитотоксинов, ковалентно присоединенных к линкеру (LB), где линкер (LB) представляет собой расщепляемый линкер, а один или несколько цитотоксинов независимо выбраны из ауристатина и аманитина.
В одном аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, предусматривает один или несколько цитотоксинов, ковалентно присоединенных к линкеру (LB), где линкер (LB) представляет собой нерасщепляемый линкер, а один или несколько цитотоксинов независимо выбраны из ауристатина, аманитина, майтанзиноида и сапорина.
В другом аспекте фрагмент, представляющий собой лекарственное средство (D), представляет собой белковый токсин, выбранный из сапорина, противовирусного белка лаконоса (PAP), бриодина 1, буганина, гелонина, рицина, абрина, лектина омелы, модекцина, волкенсина, аспарина, момордина, эбулина, вискумина, шигатоксина, дифтерийного токсина (DT) или экзотоксина Pseudomonas (PE). Такие белковые токсины способны приводить к цитолизу клеток за счет инактивации рибосомы или ингибирования синтеза белков путем нарушения функции фактора элонгации 2 (EF2) (см. Kreitman et al., Immunotoxins for targeted cancer therapy, The AAPS Journal 2006; 8 (3) Article 63; Gadadhar and Karande, Targeted Cancer Therapy: History and Development of Immunotoxins, Глава 1 в Resistance to Immunotoxins in Cancer Therapy, pp 1-31). В некоторых вариантах осуществления белковый токсин представляет собой сапорин. Такой белковый токсин может быть ковалентно присоединен к расщепляемому или нерасщепляемому линкеру (LB).
В другом аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, предусматривает один или несколько цитотоксинов, ковалентно присоединенных к линкеру (LB), где линкер (LB) представляет собой нерасщепляемый линкер, а один или несколько цитотоксинов независимо выбраны из ауристатина или аманитина.
В одном аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, представляет собой соединение, имеющее структуру формулы (A), или его стереоизомеры или фармацевтически приемлемые соли,
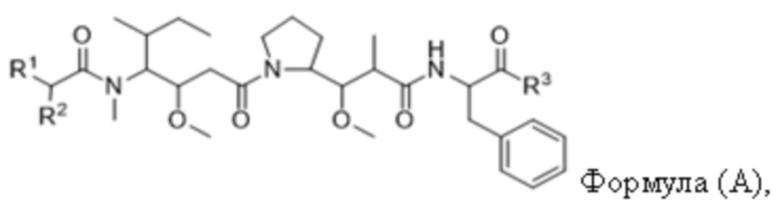
где:
R1 представляет собой  и R3 представляет собой -OH;
и R3 представляет собой -OH;
или
R1 представляет собой  или
или  и R3 представляет собой -L5R14;
и R3 представляет собой -L5R14;
R2 представляет собой C1-C6алкил;
R4 представляет собой -L1R14, -L2R24, -L2R34 или -L3R44;
L1 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, -(CH2)mX1(CH2)m-, -(CH2)mNHC(=O)(CH2)m-, -(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -X3X4C(=O)((CH2)mO)p(CH2)m-, -X3X4C(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-, -(CH2)mC(R7)2-, -(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m- или -(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
L2 представляет собой -((CH2)mO)p(CH2)m-, -(CH2)mX1(CH2)m-, -(CH2)mNHC(=O)(CH2)m-, -(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -X3X4C(=O)((CH2)mO)p(CH2)m-, -X3X4C(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-, -(CH2)mC(R7)2-, -(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m- или -(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
L3 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, -(CH2)mX1(CH2)m-, -(CH2)mNHC(=O)(CH2)m-, -(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -X3X4C(=O)((CH2)mO)p(CH2)m-, -X3X4C(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-, -(CH2)mC(R7)2-, -(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m- или -(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
L4 представляет собой -(CH2)m-;
L5 представляет собой -NHS(=O)2(CH2)mX1L4, -NH((CH2)mO)p(CH2)mX1L4-, -NH((CH2)mO)p(CH2)mX2L4-, -NH((CH2)mO)p(CH2)m-, -NH(CH2)m-, -NH(CH2)mX1(CH2)m-, -NH(CH2)mNHC(=O)(CH2)m-, -NH(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -NH((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -NH((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -NH(CH2)nC(R7)2-, -NH(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m- или -NH(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
, 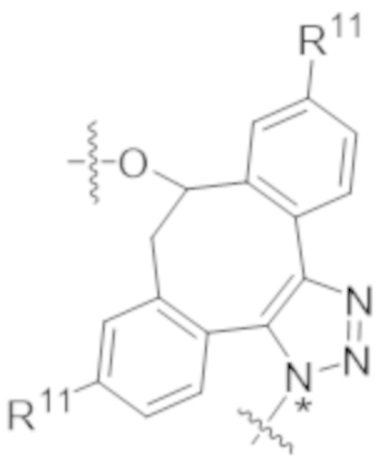 ,
, 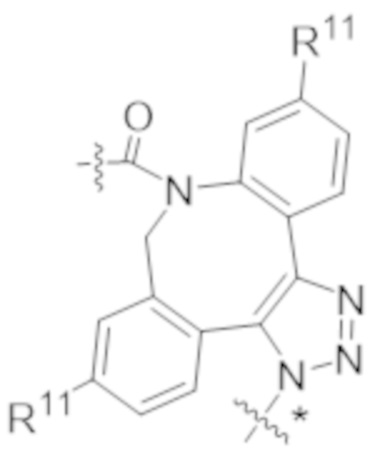 или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X3 представляет собой 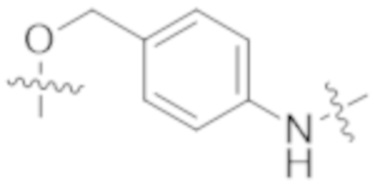 ,
, 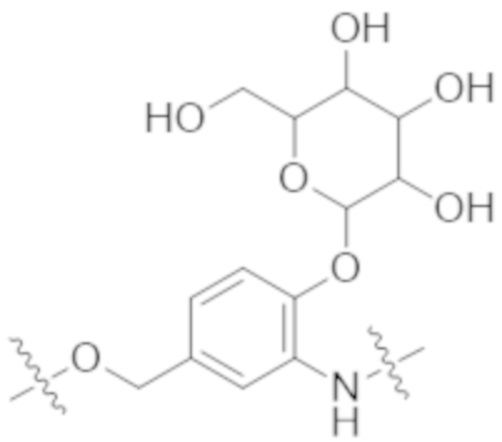 ,
, 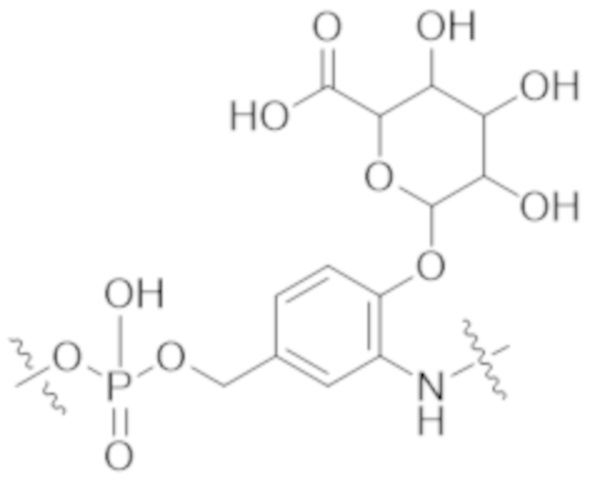 или
или 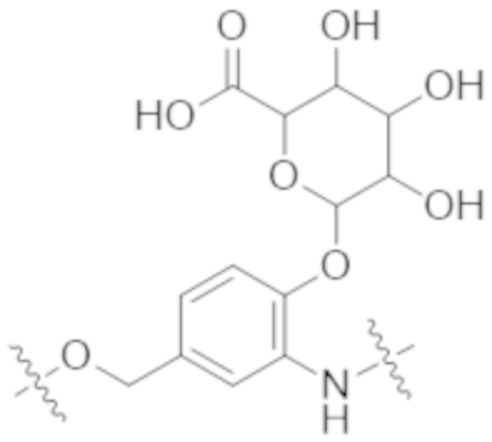 ;
;
X4 представляет собой 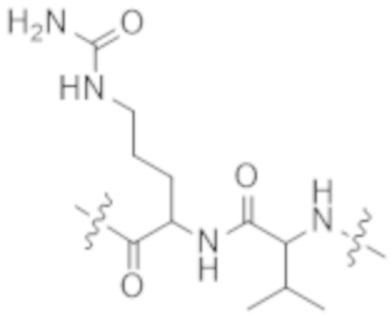 ,
,  ,
, 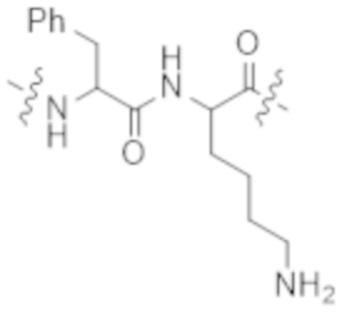 ,
,  ,
,  ,
,  ,
,  или
или 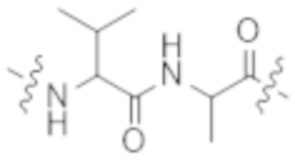 ;
;
R14 представляет собой 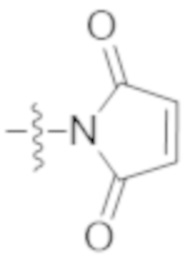 , -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -SSR13, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(=O)NHNH2,
, -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -SSR13, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(=O)NHNH2,  , -CO2H, -NH2,
, -CO2H, -NH2,  ,
,  ,
,  ,
, 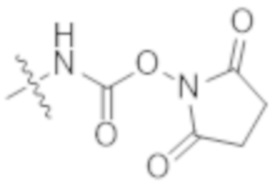 ,
, 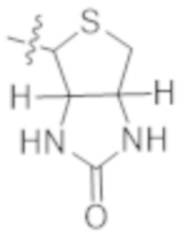 ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 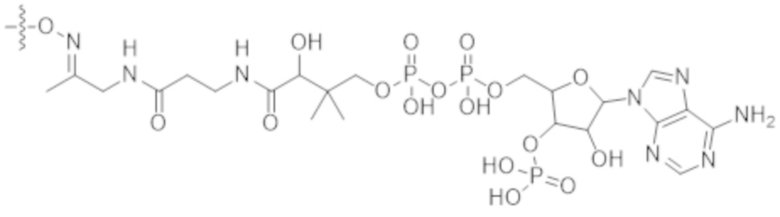 ,
,  ,
,  ,
,  ,
, 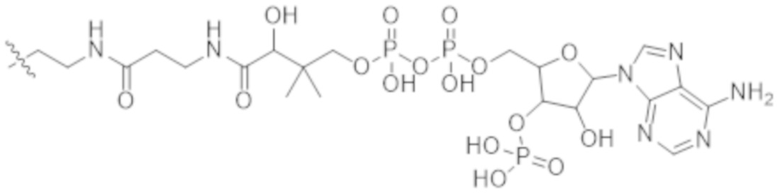 или
или  ;
;
R24 представляет собой  ,
,  ,
, 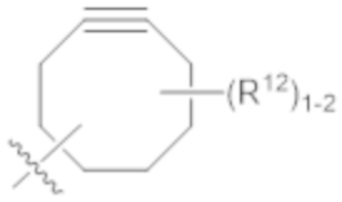 ,
, 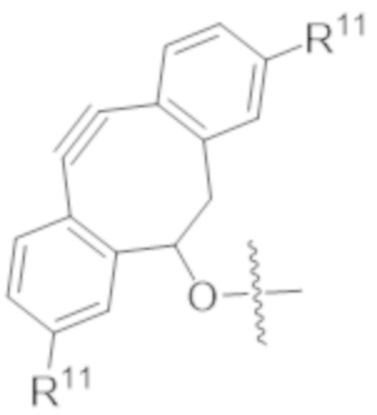 ,
, 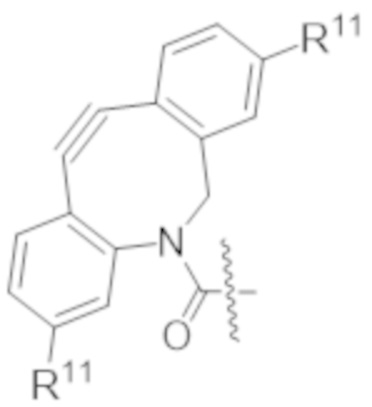 ,
, 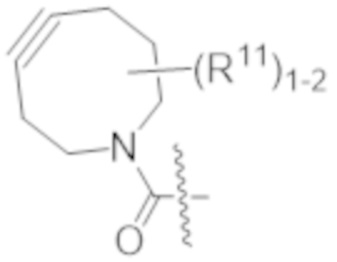 или
или 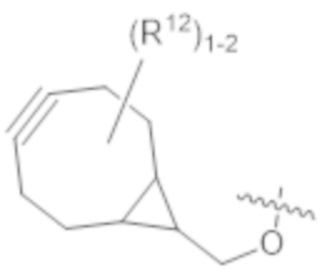 ;
;
R34 представляет собой -N3, -ONH2, -NR7C(=O)CH=CH2, -C(=O)NHNH2, -CO2H, -NH2,
 ,
,  ,
,  или
или  ;
;
R44 представляет собой  ,
,  ,
, 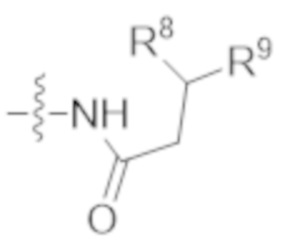 ,
, 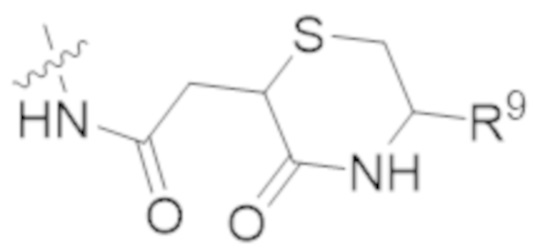 или -NR7C(=O)CH2R8;
или -NR7C(=O)CH2R8;
каждый R7 независимо выбран из H и C1-C6алкила;
R8 представляет собой -S(CH2)nCHR9NH2;
R9 представляет собой -C(=O)OR7;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
R13 представляет собой 2-пиридил или 4-пиридил;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
В другом аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, представляет собой соединение, имеющее структуру формулы (B), или его стереоизомеры или фармацевтически приемлемые соли,
где:
R54 представляет собой -L6R14, -L7R24, -L7R34 или -L8R44;
X представляет собой S(=O), S(=O)2 или S;
R5 представляет собой H, -CH3 или -CD3;
R6 или -NH2 или -OH;
L6 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-, - L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, -(CH2)mX1(CH2)m-, -(CH2)mNHC(=O)(CH2)m-, -(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -(CH2)mC(R7)2- или -(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m-;
L7 представляет собой -((CH2)mO)p(CH2)m-, -(CH2)mX1(CH2)m-, -L4NHC(=O)NH((CH2)mO)p(CH2)m-, - L4NHC(=O)NH ((CH2)mO)p(CH2)m-, -(CH2)mNHC(=O)(CH2)m-, -(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -(CH2)mC(R7)2- или -(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m-;
L8 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-, - L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, -(CH2)mX1(CH2)m-, -(CH2)mNHC(=O)(CH2)m-, -(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -(CH2)mC(R7)2- или -(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m-;
L4 представляет собой -(CH2)m-;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R14 представляет собой  , -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -SSR13, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(=O)NHNH2,
, -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -SSR13, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(=O)NHNH2,  , -CO2H, -NH2,
, -CO2H, -NH2,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R24 представляет собой  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R34 представляет собой -N3, -ONH2, -NR7C(=O)CH=CH2, -C(=O)NHNH2, -CO2H, -NH2,
 ,
,  ,
,  или
или  ;
;
R44 представляет собой  ,
,  ,
,  ,
,  или -NR7C(=O)CH2R8;
или -NR7C(=O)CH2R8;
каждый R7 независимо выбран из H и C1-C6алкила;
R8 представляет собой -S(CH2)nCHR9NH2;
R9 представляет собой -C(=O)OR7;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
R13 представляет собой 2-пиридил или 4-пиридил;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Определенные аспекты и примеры фрагмента, представляющего собой линкер-лекарственное средство по настоящему изобретению, предусмотрены в следующем перечне дополнительных пронумерованных вариантов осуществления. Следует понимать, что признаки, указанные в каждом варианте осуществления, можно объединять с другими указанными признаками с получением дополнительных вариантов осуществления настоящего изобретения.
Вариант осуществления 1. Соединение формулы (A) или его фармацевтически приемлемая соль, имеющее структуру формулы (A-1) или ее фармацевтически приемлемой соли:

где: R4 является таким, как определено выше.
Вариант осуществления 2. Соединение формулы (A) или его фармацевтически приемлемая соль, имеющее структуру формулы (A-2) или формулы (A-3) или их фармацевтически приемлемой соли:
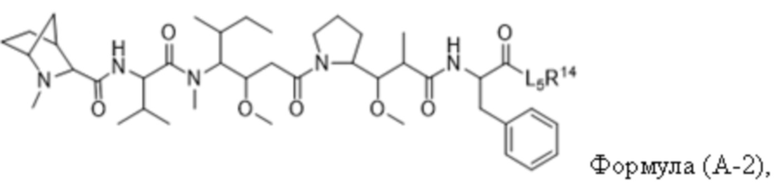
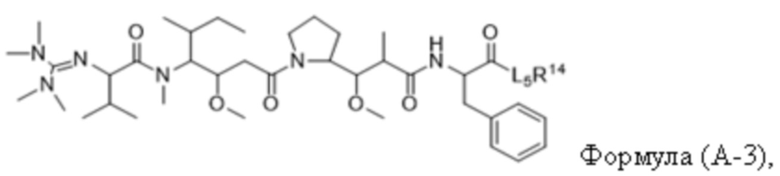
где: L5 и R14 являются такими, как определено выше.
Вариант осуществления 3. Соединение формулы (A) или его фармацевтически приемлемая соль, имеющее структуру формулы (A-1a) или ее фармацевтически приемлемой соли:

где: R4 является таким, как определено выше.
Вариант осуществления 4. Соединение формулы (A) или его фармацевтически приемлемая соль, имеющее структуру формулы (A-2a) или формулы (A-3a) или их фармацевтически приемлемой соли:
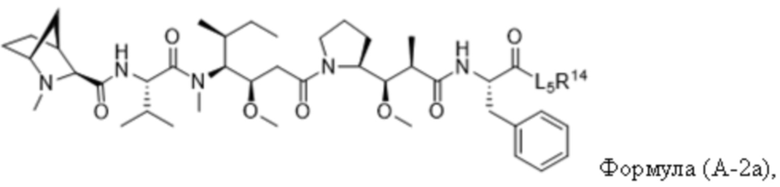
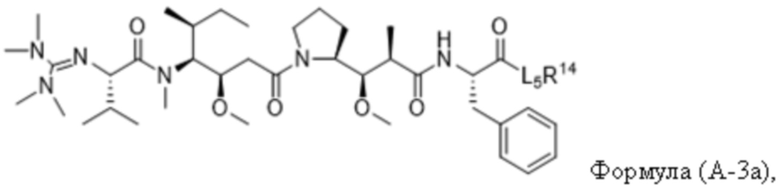
где: L5 и R14 являются такими, как определено выше.
Вариант осуществления 5. Соединение формулы (A), формулы (A-1) или формулы (A-1a) или его фармацевтически приемлемая соль,
где:
R4 представляет собой -L1R14, -L2R24, -L2R34 или -L3R44;
L1 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, -X3X4C(=O)((CH2)mO)p(CH2)m-, -X3X4C(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
L2 представляет собой -((CH2)mO)p(CH2)m-;
L3 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, X3X4C(=O)((CH2)mO)p(CH2)m-, -X3X4C(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
L4 представляет собой -(CH2)m-;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X3 представляет собой  ,
,  ,
,  или
или  ;
;
X4 представляет собой  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R14 представляет собой  , -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(O)NHNH2,
, -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(O)NHNH2,  , -CO2H, -NH2,
, -CO2H, -NH2,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R24 представляет собой  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R34 представляет собой -N3, -ONH2, -NR7C(=O)CH=CH2, -C(O)NHNH2, -CO2H, -NH2,
 ,
,  ,
,  или
или  ;
;
R44 представляет собой  ,
,  ,
,  ,
,  или -NR7C(=O)CH2R8;
или -NR7C(=O)CH2R8;
каждый R7 независимо выбран из H и C1-C6алкила;
R8 представляет собой -S(CH2)nCHR9NH2;
R9 представляет собой -C(=O)OR7;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 6. Соединение формулы (A), формулы (A-2), формулы (A-3), формулы (A-2a) или формулы (A-3a) или его фармацевтически приемлемая соль,
где:
L4 представляет собой -(CH2)m-;
L5 представляет собой -NHS(=O)2(CH2)mX1L4, -NH((CH2)mO)p(CH2)mX1L4-, -NH((CH2)mO)p(CH2)mX2L4-, -NH((CH2)mO)p(CH2)m- или -NH(CH2)m-;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или
 , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R14 представляет собой  , -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(O)NHNH2,
, -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(O)NHNH2,  , -CO2H, -NH2,
, -CO2H, -NH2,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 7. Соединение формулы (A), формулы (A-1) или формулы (A-1a) или его фармацевтически приемлемая соль, где:
R4 представляет собой -L1R14;
L1 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)m- или -(CH2)m-;
L4 представляет собой -(CH2)m-;
L5 представляет собой -NHS(=O)2(CH2)mX1L4;
X1 представляет собой  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R14 представляет собой  , -ONH2,
, -ONH2,  ,
,  или
или  ;
;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 8. Соединение формулы (A), формула (A-2), формулы (A-3), формулы (A-2a) или формулы (A-3a) или его фармацевтически приемлемая соль, где:
L4 представляет собой -(CH2)m-;
L5 представляет собой -NHS(=O)2(CH2)mX1L4;
X1 представляет собой  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R14 представляет собой  , -ONH2,
, -ONH2,  ,
,  или
или  ;
;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 9. Соединение формулы (A), выбранное из:
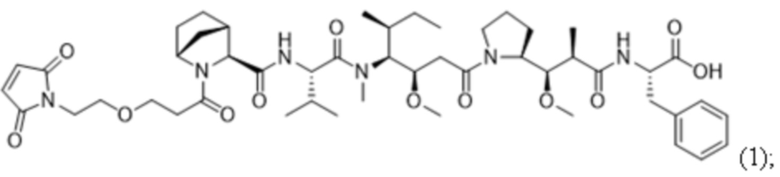
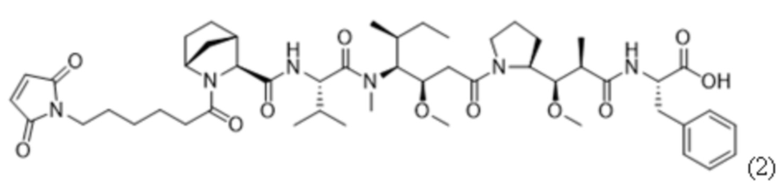
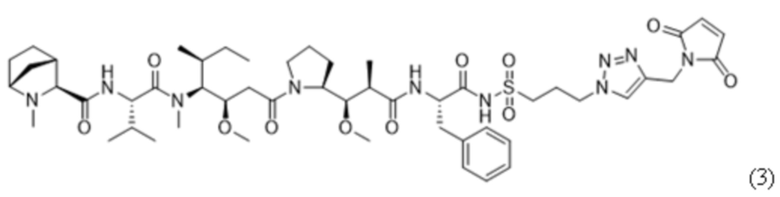 и
и
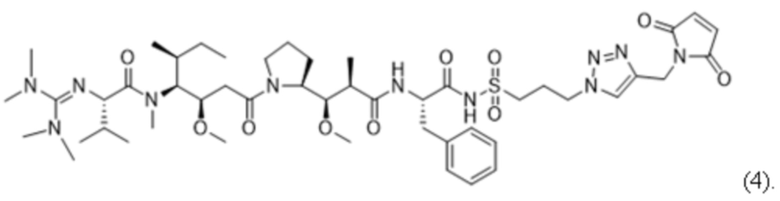
Вариант осуществления 10. Соединение формулы (B) или его фармацевтически приемлемая соль, имеющее структуру формулы (B-1) или ее фармацевтически приемлемой соли:

где: R54, R5 и R6, являются такими, как определено выше.
Вариант осуществления 11. Соединение формулы (B) или его фармацевтически приемлемая соль, имеющее структуру формулы (B-1a) или ее фармацевтически приемлемой соли:
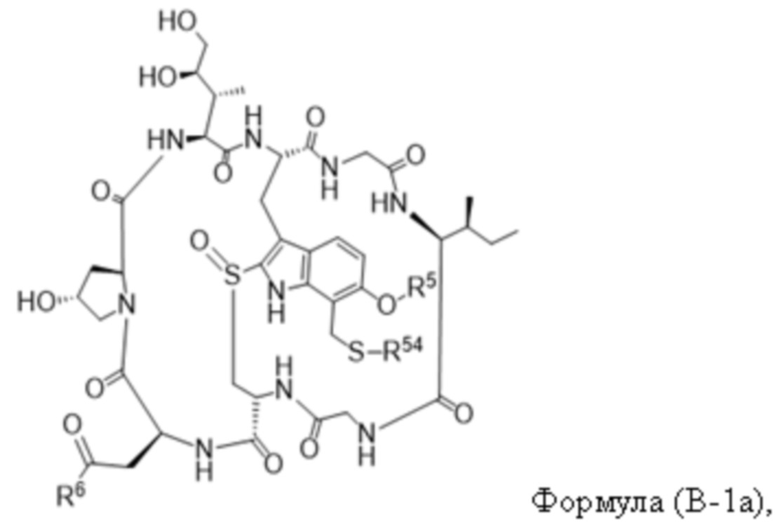
где: R54, R5 и R6, являются такими, как определено выше.
Вариант осуществления 12. Соединение формулы (B), формулы (B-1) или формулы (B-1a) или его фармацевтически приемлемая соль,
где:
R54 представляет собой -L6R14, -L7R24, -L7R34 или -L8R44;
R5 представляет собой H, -CH3 или -CD3;
R6 или -NH2 или -OH;
L6 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-, - L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m- или -(CH2)m-;
L7 представляет собой -((CH2)mO)p(CH2)m-;
L8 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-;
L4 представляет собой -(CH2)m-;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R14 представляет собой  , -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(O)NHNH2,
, -N3, -ONH2, -NR7C(=O)CH=CH2, SH, -S(=O)2(CH=CH2), -NR7S(=O)2(CH=CH2), -NR7C(=O)CH2Br, -NR7C(=O)CH2I, -NHC(=O)CH2Br, -NHC(=O)CH2I, -C(O)NHNH2,  , -CO2H, -NH2,
, -CO2H, -NH2,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R24 представляет собой 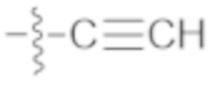 ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R34 представляет собой -N3, -ONH2, -NR7C(=O)CH=CH2, -C(O)NHNH2, -CO2H, -NH2,
 ,
,  ,
,  или
или  ;
;
R44 представляет собой  ,
,  ,
,  ,
,  или -NR7C(=O)CH2R8;
или -NR7C(=O)CH2R8;
каждый R7 независимо выбран из H и C1-C6алкила;
R8 представляет собой -S(CH2)nCHR9NH2;
R9 представляет собой -C(=O)OR7;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 13. Соединение формулы (B), формулы (B-1) или формулы (B-1a) или его фармацевтически приемлемая соль, где:
R54 представляет собой -L6R14;
R5 представляет собой -CH3;
R6 представляет собой -NH2;
L6 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)m-, -L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-, - L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4- или -(CH2)m-;
L4 представляет собой -(CH2)m-;
X1 представляет собой  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R14 представляет собой  , -ONH2,
, -ONH2,  ,
,  или
или  ;
;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 14. Соединение формулы (B), выбранное из:
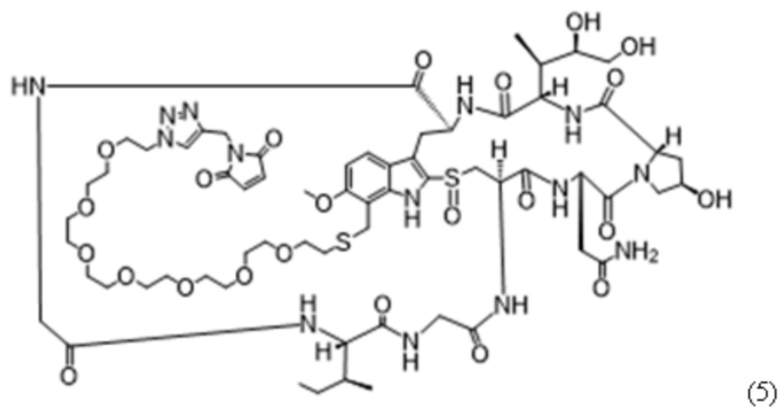 и
и

В другом аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, выбран из:
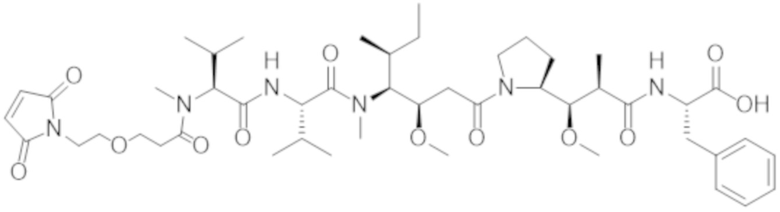 ,
,
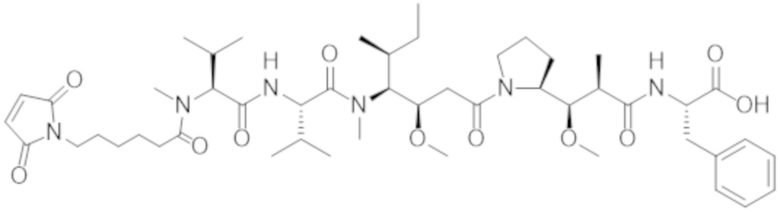 ,
,
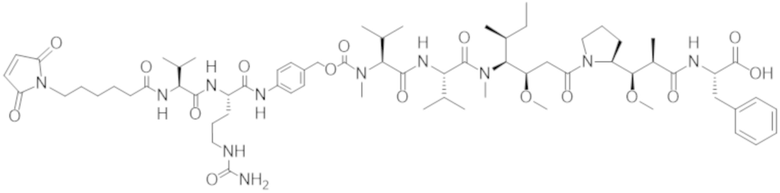 и
и
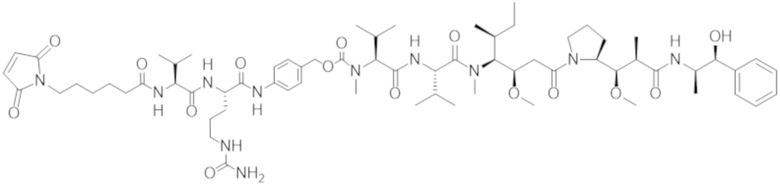
В другом аспекте фрагмент, представляющий собой линкер-лекарственное средство по настоящему изобретению, выбран из:
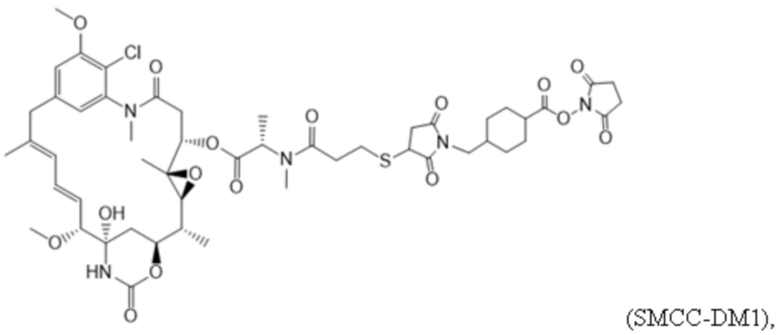
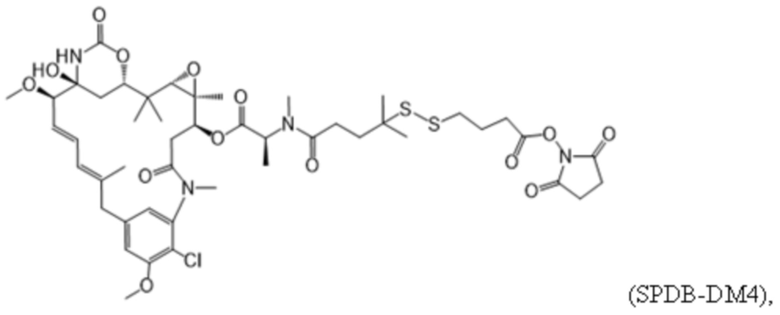
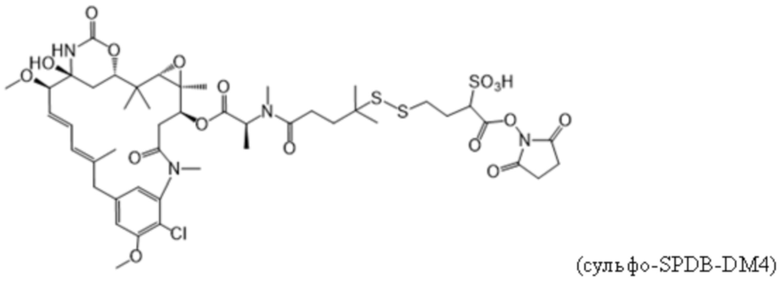 и
и
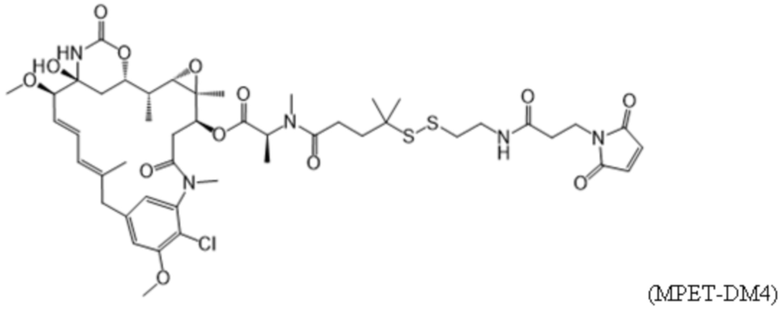
Конъюгаты антитела и лекарственного средства
В настоящем изобретении предусмотрены конъюгаты антитела и лекарственного средства, где антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT, соединены с фрагментом, представляющим собой лекарственное средство (например, цитотоксическое средство), необязательно через линкер. В одном аспекте антитело или фрагмент антитела (например, Fab или Fab') соединены посредством ковалентной связи за счет линкера с фрагментом, представляющим собой лекарственное средство, которое представляет собой цитотоксическое средство.
Конъюгаты антитела и лекарственного средства могут селективно доставлять цитотоксическое средство к клеткам, экспрессирующим cKIT, например, гемопоэтическим стволовым клеткам, тем самым селективно разрушая эти клетки у пациента, например, реципиента трансплантации гемопоэтических стволовых клеток. Предпочтительно конъюгаты антитела к cKIT и лекарственного средства характеризуются коротким периодом полувыведения и будут выводиться из кровяного русла пациента, поэтому их можно применять для кондиционирования реципиентов трансплантации гемопоэтических стволовых клеток до трансплантации гемопоэтических стволовых клеток.
В некоторых вариантах осуществления конъюгаты антитела к cKIT и лекарственного средства, раскрытые в данном документе, модифицированы, чтобы характеризоваться сниженной способностью индуцировать дегрануляцию мастоцитов, даже будучи сшитыми и/или мультимеризованными в более крупные комплексы. Например, конъюгаты антитела к cKIT и лекарственного средства, раскрытые в данном документе, модифицированы, чтобы характеризоваться сниженной способностью индуцировать дегрануляцию мастоцитов, то есть она снижена на приблизительно или по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% в сравнении с полноразмерным антителом к cKIT, фрагментом F(ab')2 или F(ab)2 или их конъюгатом, даже будучи сшитыми и/или мультимеризованными в более крупные комплексы. В некоторых вариантах осуществления конъюгаты антитела к cKIT и лекарственного средства, раскрытые в данном документе, могут содержать фрагмент Fab или Fab' к cKIT. В некоторых вариантах осуществления конъюгаты антитела к cKIT и лекарственного средства, раскрытые в данном документе, могут характеризоваться минимальной активностью индуцирования дегрануляции мастоцитов, например, скорректированной по исходному уровню регистрируемой величиной O.D., составляющей менее 0,25, например, менее 0,2, менее 0,15 или менее 0,1, в анализе высвобождения гексозаминидазы, даже будучи сшитыми и/или мультимеризованными в более крупные комплексы.
В некоторых вариантах осуществления в данном документе предусмотрены конъюгаты, содержащие фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT (Fab или Fab' к cKIT), соединенный с фрагментом, представляющим собой лекарственное средство (например, цитотоксическое средство), необязательно через линкер. Как описано в данном документе, такие конъюгаты Fab' или Fab к cKIT и токсина могут разрушать человеческие клетки HSC in vitro и in vivo, но не вызывают дегрануляцию мастоцитов, даже будучи сшитыми и/или мульмеризованными в более крупные комплексы.
В одном аспекте раскрытия предусмотрен конъюгат формулы (I):
A-(LB-(D)n)y Формула (I);
где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
LB представляет собой линкер;
D представляет собой цитотоксическое средство;
n составляет целое число от 1 до 10, и
y составляет целое число от 1 до 10,
где фрагмент, представляющий собой линкер-лекарственное средство (LB-(D)n), ковалентно присоединен к фрагменту антитела (A).
В одном аспекте настоящее изобретение направлено на конъюгат формулы (II):
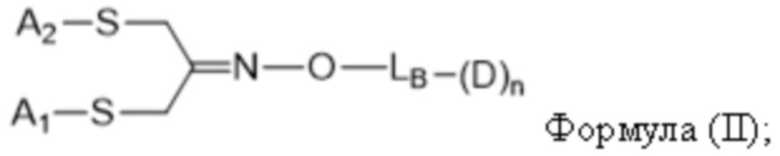
A1 представляет собой фрагмент (например, Fab или Fab') или цепь антитела (например, HC или LC), которые специфически связываются с cKIT человека;
A2 представляет собой фрагмент (например, Fab или Fab') или цепь антитела (например, HC или LC), которые специфически связываются с cKIT человека;
LB представляет собой линкер;
D представляет собой цитотоксическое средство, и
n составляет целое число от 1 до 10,
где фрагмент, представляющий собой линкер-лекарственное средство (LB-(D)n), ковалентно спаривает фрагменты антитела A1 и A2.
В одном аспекте один из нескольких фрагментов, представляющих собой лекарственные средства D, в конъюгатах формулы (I) и формулы (II) независимо выбран из ауристатина, аманитина, майтанзиноида и сапорина.
В другом аспекте один из нескольких фрагментов, представляющих собой лекарственные средства D, в конъюгатах формулы (I) независимо выбраны из ауристатина и аманитина.
В конъюгатах формулы (I) один или несколько фрагментов, представляющих собой линкер-лекарственное средство (LB-(D)n), могут быть ковалентно присоединены к фрагменту антитела, A (например Fab или Fab'), тем самым соединяя ковалентной связью один или несколько фрагментов, представляющих собой лекарственные средства D, с фрагментом антитела A (например Fab или Fab') через линкер LB. LB представляет собой любой химический фрагмент, который способен соединить фрагмент антитела, A (например, Fab или Fab') с одним или несколькими фрагментами, представляющими собой лекарственные средства D. Конъюгаты формулы (I), где один или несколько фрагментов, представляющих собой лекарственные средства D, ковалентно связаны с фрагментом антитела A (например Fab или Fab'), могут быть образованы с применением реагента на основе бифункционального или мультифункционального линкера, имеющего одну или несколько реакционноспособных функциональных групп, которые являются одинаковыми или различными. Одну из реакционноспособных функциональных групп реагента на основе бифункционального или мультифункционального линкера применяют для осуществления реакции с группой на фрагменте антитела, A, в качестве примера, тиольной или аминной (например, на цистеине, N-конце или боковой цепи аминокислоты, такой как лизин), с образованием ковалентной связи с одним концом линкера LB. Такие реакционноспособные функциональные группы реагента на основе бифункционального или мультифункционального линкера включают без ограничения малеимидную, тиольную и NHS-сложноэфирную. Другую реакционноспособную функциональную группу или группы реагента на основе бифункционального или мультифункционального линкера применяют для ковалентного присоединения одного или нескольких фрагментов, представляющих собой лекарственные средства D, к линкеру LB.
В конъюгатах формулы (II) кетоновый мостик образуется за счет реакции боковых тиолов на фрагментах антитела A1 и A2 и 1,3-дигалогенацетона, такого как 1,3-дихлорацетон, 1,3-дибромацетон, 1,3-дийодацетон и биссульфонатные сложные эфиры 1,3-дигидроксиацетона, который тем самым ковалентно спаривает фрагменты антитела A1 и A2. Данный фрагмент, представляющий собой кетоновый мостик, применяют для ковалентного присоединения одного или нескольких фрагментов, представляющих собой лекарственные средства D, к фрагментам антитела A1 и A2 через линкер LB. LB представляет собой любой химический фрагмент, который способен соединить фрагмент антитела, A1 и A2 , с одним или несколькими фрагментами, представляющими собой лекарственные средства D. Конъюгаты формулы (II), где один или несколько фрагментов, представляющих собой лекарственные средства D, ковалентно связаны с фрагментами антитела A1 и A2, могут быть образованы с применением реагента на основе бифункционального или мультифункционального линкера, имеющего одну или несколько реакционноспособных функциональных групп, которые являются одинаковыми или различными. В одном варианте осуществления одна из реакционноспособных функциональных групп реагента на основе бифункционального или мультифункционального линкера представляет собой алкоксиамин, который применяют для осуществления реакции с кетоновым мостиком с образованием оксимной связи с одним концом линкера LB, а другую реакционноспособную функциональную группу или группы реагента на основе бифункционального или мультифункционального линкера применяют для ковалентного присоединения одного или нескольких фрагментов, представляющих собой лекарственные средства D, к линкеру LB. В другом варианте осуществления одна из реакционноспособных функциональных групп реагента на основе бифункционального или мультифункционального линкера представляет собой гидразин, который применяют для осуществления реакции с кетоновым мостиком с образованием гидразоновой связи с одним концом линкера LB, а другую реакционноспособную функциональную группу или группы реагента на основе бифункционального или мультифункционального линкера применяют для ковалентного присоединения одного или нескольких фрагментов, представляющих собой лекарственные средства D, к линкеру LB.
В одном аспекте LB представляет собой расщепляемый линкер. В другом аспекте LB представляет собой нерасщепляемый линкер. В некоторых аспектах LB представляет собой кислотолабильный линкер, фотолабильный линкер, расщепляемый пептидазами линкер, расщепляемый эстеразами линкер, расщепляемый гликозидазами линкер, расщепляемый фосфодиэстеразами линкер, линкер с восстанавливаемой дисульфидной связью, гидрофильный линкер или линкер на основе дикарбоновой кислоты.
В другом аспекте фрагмент, представляющий собой лекарственное средство (D), представляет собой белковый токсин, выбранный из сапорина, противовирусного белка лаконоса (PAP), бриодина 1, буганина, гелонина, рицина, абрина, лектина омелы, модекцина, волкенсина, аспарина, момордина, эбулина, вискумина, шигатоксина, дифтерийного токсина (DT) или экзотоксина Pseudomonas (PE). Такие белковые токсины способны приводить к цитолизу клеток за счет инактивации рибосомы или ингибирования синтеза белков путем нарушения функции фактора элонгации 2 (EF2) (см. Kreitman et al., Immunotoxins for targeted cancer therapy, The AAPS Journal 2006; 8 (3) Article 63; Gadadhar and Karande, Targeted Cancer Therapy: History and Development of Immunotoxins, Глава 1 в Resistance to Immunotoxins in Cancer Therapy, pp 1-31). В некоторых вариантах осуществления белковый токсин представляет собой сапорин. Белковый токсин может быть присоединен фрагменту антитела к cKIT (A) ковалентно через расщепляемый или нерасщепляемый линкер (LB). В некоторых вариантах осуществления белковый токсин соединен с фрагментом антитела к cKIT через дисульфидную или тиоэфирную связь.
Хотя в конкретной молекуле конъюгата отношение лекарственного средства к антителу имеет точное целочисленное значение (например, произведение n и y в формуле (I) и "n" в формуле (II)), известно, что зачастую значение будет представлять собой среднее значение, когда его применяют для описания образца, содержащего множество молекул, вследствие некоторой степени неоднородности, обычно сопряженной со стадией конъюгации. Средняя нагрузка для образца конъюгата обозначается в данном документе как отношение лекарственного средства к антителу (или Fab') или "DAR". В некоторых аспектах DAR составляет от приблизительно 1 до приблизительно 5, и обычно составляет приблизительно 1, 2, 3 или 4. В некоторых аспектах по меньшей мере 50% образца по весу составляет соединение, характеризующееся средним DAR плюс или минус 2, и предпочтительно по меньшей мере 50% образца составляет конъюгат, который подразумевает среднее DAR плюс или минус 1. Другие аспекты включают конъюгаты, в которых DAR составляет приблизительно 2. В некоторых аспектах DAR, составляющее 'приблизительно y', означает, что измеренное значение DAR находится в пределах 20% от произведения n и y в формуле (I). В некоторых аспектах DAR, составляющее 'приблизительно n', означает, что измеренное значение DAR находится в пределах 20% от n в формуле (II).
В одном аспекте среднее молярное отношение лекарственного средства к фрагменту антитела (Fab или Fab') в конъюгатах формулы (I) (т. e. среднее значение произведения n и y, также известное как отношение лекарственного средства к антителу (DAR)) составляет от приблизительно 1 до приблизительно 10, от приблизительно 1 до приблизительно 6 (например, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0), от приблизительно 1 до приблизительно 5, от приблизительно 1,5 до приблизительно 4,5 или от приблизительно 2 до приблизительно 4.
В одном аспекте среднее молярное отношение лекарственного средства к фрагментам антитела A1 и A2 в конъюгатах формулы (II) (т.е. среднее значение n, также известное как отношение лекарственного средства к антителу (DAR)) составляет от приблизительно 1 до приблизительно 10, от приблизительно 1 до приблизительно 6 (например, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0), от приблизительно 1 до приблизительно 5, от приблизительно 1,5 до приблизительно 4,5 или от приблизительно 2 до приблизительно 4.
В одном аспекте предусмотренный в настоящем изобретении конъюгат характеризуется в значительной степени высокой чистотой и имеет один или несколько из следующих признаков: (a) более приблизительно 90% (например, больше или равно приблизительно 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%), предпочтительно более приблизительно 95% разновидностей конъюгата являются мономерными, (b) уровень неконъюгированного линкера в препарате конъюгата составляет менее приблизительно 10% (например, меньше или равно приблизительно 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или 0%) (относительно общего количества линкера), (c) менее 10% молекул конъюгата являются сшитыми (например, менее или равно приблизительно 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или 0%), (d) уровень свободного лекарственного средства (например, ауристатина, аманитина, майтанзиноида или сапорина) в препарате конъюгата составляет менее приблизительно 2% (например, меньше или равно приблизительно 11,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1,0%, 0,9%, 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2%, 0,1%, или 0%) (моль/моль относительно общего количества цитотоксического средства).
В одном аспекте конъюгаты по настоящему изобретению имеют структуру формулы (C):
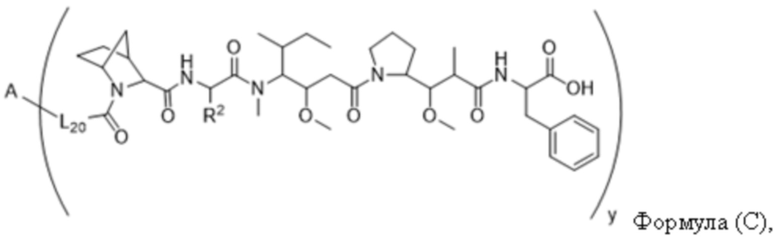
где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
R2 представляет собой C1-C6алкил;
L20 представляет собой -L1R40;
L1 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, -(CH2)mX1(CH2)m-, -(CH2)mNHC(=O)(CH2)m-, -(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -((CH2)mO)pCH2)mC(=O)NH(CH2)m-, X3X4C(=O)((CH2)mO)p(CH2)m-, -X3X4C(=O)(CH2)m-, -X3C(=O)(CH2)nNHC(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-, -(CH2)mC(R7)2-, -(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m- или -(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
L4 представляет собой -((CH2)m;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X3 представляет собой  ,
,  ,
,  или
или  ;
;
X4 представляет собой  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-, 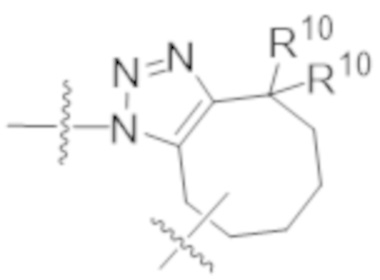 ,
, 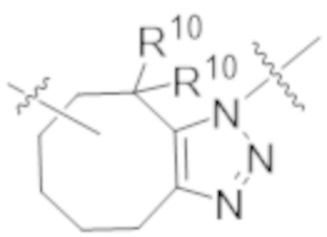 ,
, 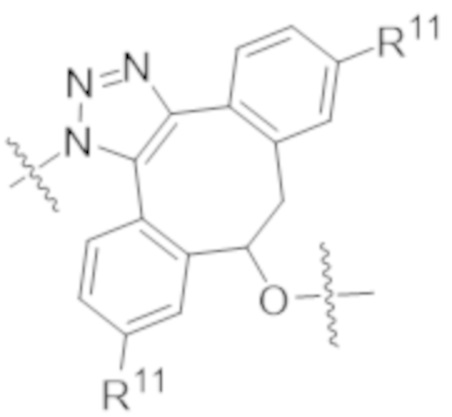 ,
, 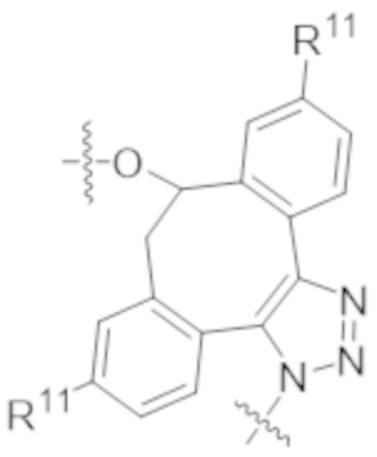 ,
, 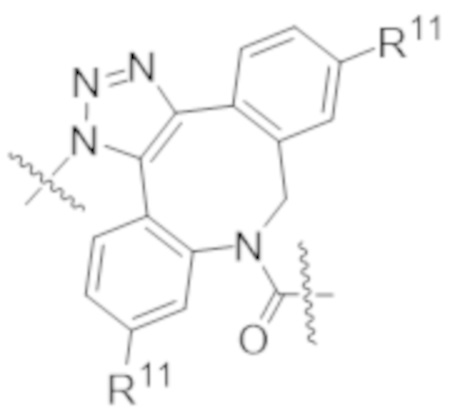 ,
, 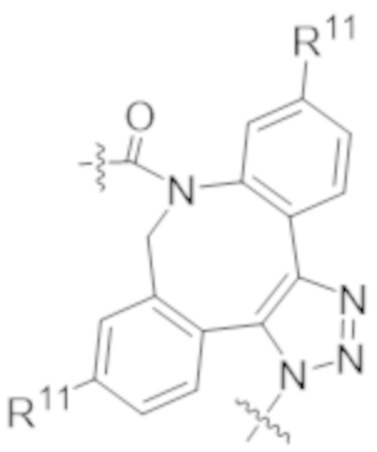 ,
, 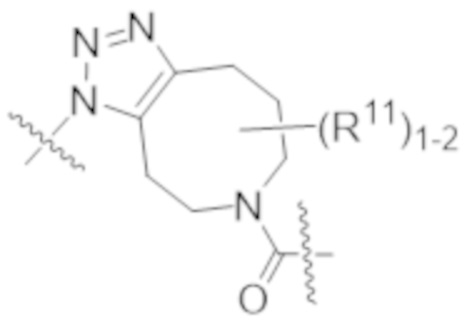 ,
,  ,
,  ,
,  ,
, 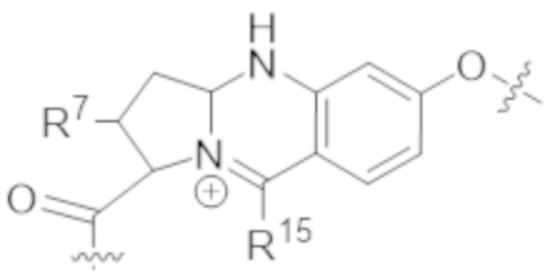 ,
, 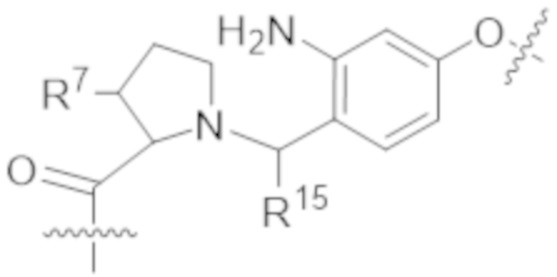 ,
, 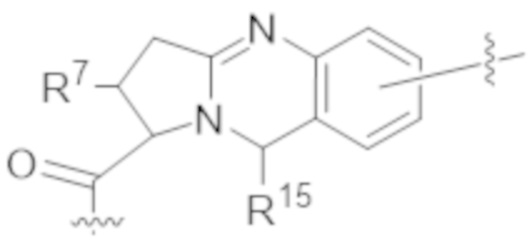 ,
,  ,
, 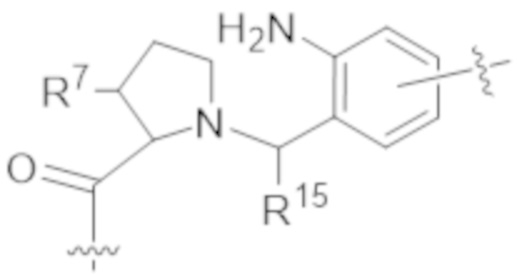 ,
, 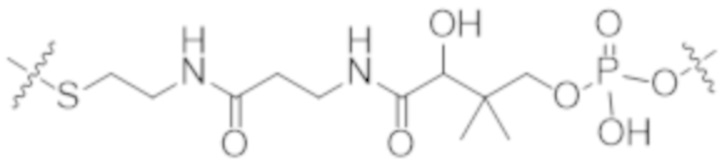 ,
, 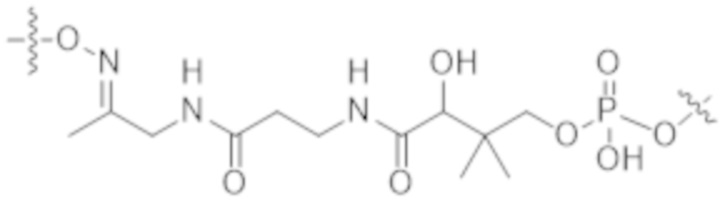 ,
, 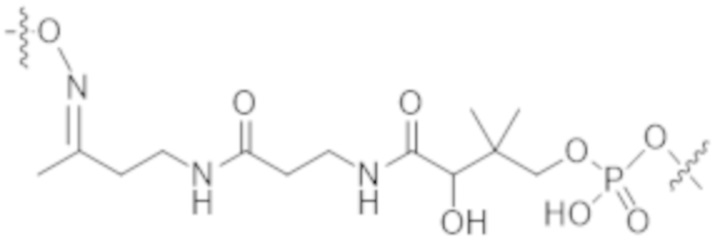 ,
, 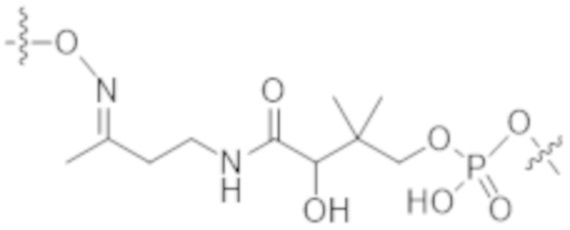 ,
, 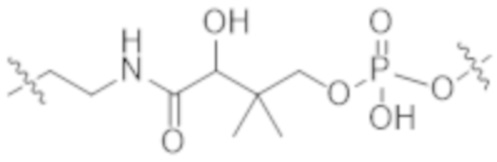 или
или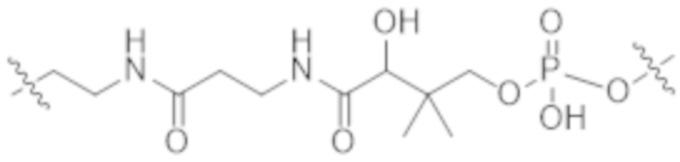 ,
, 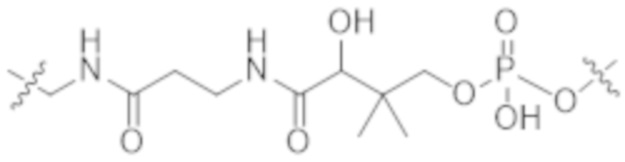 ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый R15 независимо выбран из H, -CH3 и фенила;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
В другом аспекте конъюгаты по настоящему изобретению имеют структуру формулы (D):

где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
R1 представляет собой  или
или  ;
;
R2 представляет собой C1-C6алкил;
L30 представляет собой -L5R40;
L4 представляет собой -((CH2)m;
L5 представляет собой -NHS(=O)2(CH2)mX1L4, -NH((CH2)mO)p(CH2)mX1L4-, -NH((CH2)mO)p(CH2)mX2L4-, -NH((CH2)mO)p(CH2)m-, -NH(CH2)m-, -NH(CH2)mX1(CH2)m-, -NH(CH2)mNHC(=O)(CH2)m-, -NH(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -NH((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -NH((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -NH(CH2)nC(R7)2-, -NH(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m- или -NH(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
X1 представляет собой  ,
,  ,
,  ,
,  или
или
 , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X3 представляет собой  ,
,  ,
,  или
или  ;
;
X4 представляет собой  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ,
,  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый R15 независимо выбран из H, -CH3 и фенила;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
В другом аспекте конъюгаты по настоящему изобретению имеют структуру формулы (E):
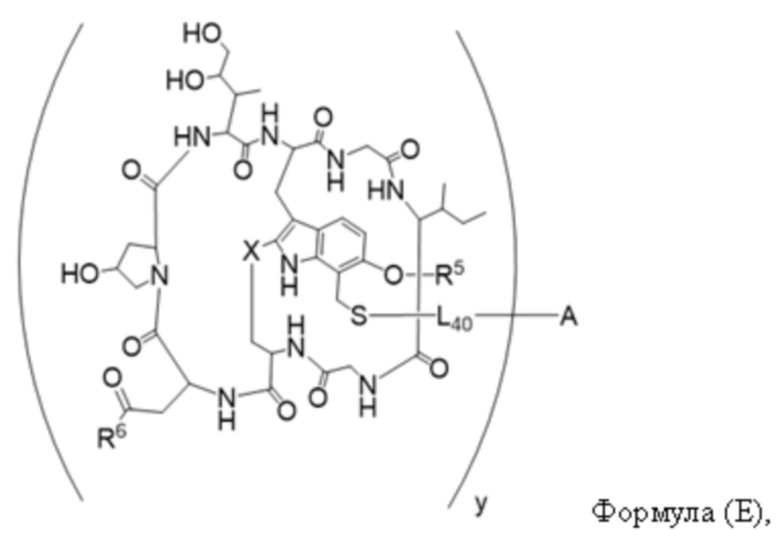
где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
X представляет собой S(=O), S(=O)2 или S;
R5 представляет собой H, -CH3 или -CD3;
R6 представляет собой -NH2 или -OH;
L40 представляет собой -L6R40;
L6 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-, -L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, -(CH2)mX1(CH2)m-, -(CH2)mNHC(=O)(CH2)m-, -(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-, -((CH2)mO)p(CH2)mNHC(=O)(CH2)m, -((CH2)mO)pCH2)mC(=O)NH(CH2)m-, -(CH2)mC(R7)2- или -(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m-;
L4 представляет собой -((CH2)m;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ,
,  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый R15 независимо выбран из H, -CH3 и фенила;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Определенные аспекты и примеры конъюгатов согласно настоящему изобретению предусмотрены в следующем перечне дополнительных пронумерованных вариантов осуществления. Следует понимать, что признаки, указанные в каждом варианте осуществления, можно объединять с другими указанными признаками с получением дополнительных вариантов осуществления настоящего изобретения.
Вариант осуществления 15. Конъюгат, имеющий структуру формулы (C), представляет собой конъюгат, имеющий структуру формулы (C-1):
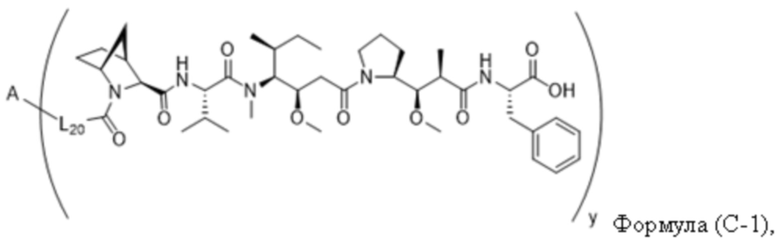
где: A, y, и L20 являются такими, как определено выше.
Вариант осуществления 16. Конъюгат, имеющий структуру формулы (C) или формулы (C-1), где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
L20 представляет собой -L1R40;
L1 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m-, -(CH2)m-, -X3X4C(=O)((CH2)mO)p(CH2)m-, -X3X4C(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)(CH2)m-, -X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-;
L4 представляет собой -((CH2)m;
X1 представляет собой  ,
,  ,
,  ,
,  или
или
 , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X3 представляет собой  ,
,  ,
,  или
или  ;
;
X4 представляет собой  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 17. Конъюгат, имеющий структуру формулы (C) или формулы (C-1), где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
L20 представляет собой -L1R40;
L1 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m- или -(CH2)m-;
L4 представляет собой -((CH2)m;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 18. Конъюгат, имеющий структуру формулы (C) или формулы (C-1), где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
L20 представляет собой -L1R40;
L1 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)m- или -(CH2)m-;
L4 представляет собой -((CH2)m;
X1 представляет собой  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  или
или  ;
;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 19. Конъюгат, имеющий структуру формулы (C) или формулы (C-1), выбранный из:
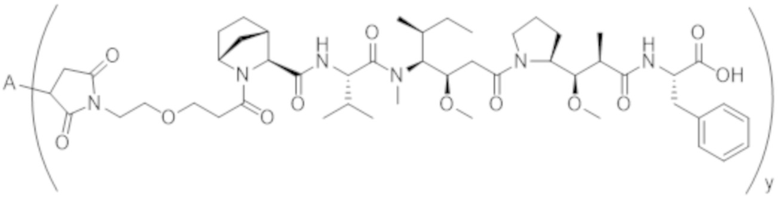 ;
;
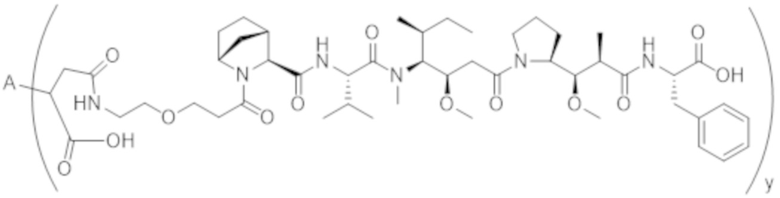 ;
;
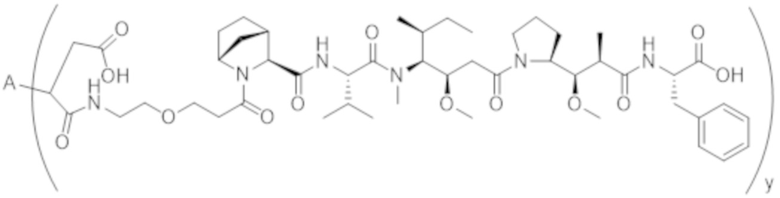 ;
;
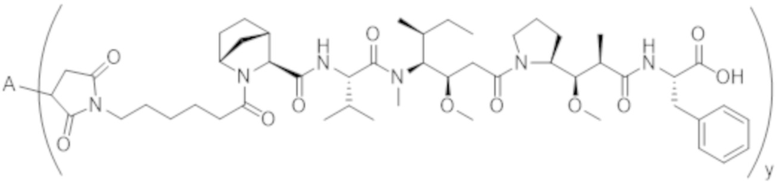 ;
;
 и
и
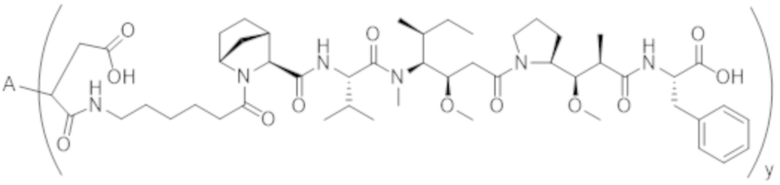 .
.
Вариант осуществления 20. Конъюгат, имеющий структуру формулы (D), представляет собой конъюгат, имеющий структуру формулы (D-1) или формулы (D-2):
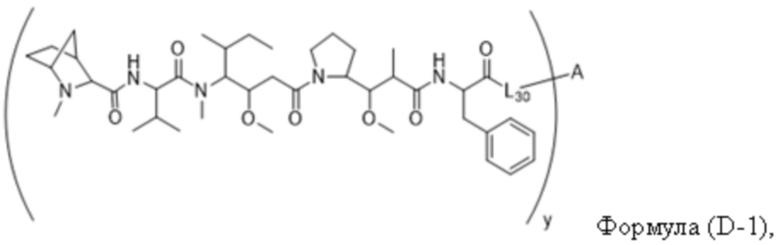
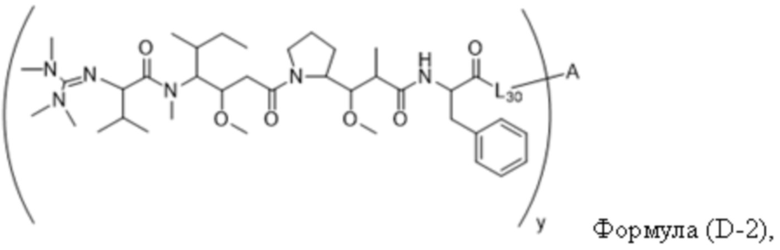
где: A, y и L30 являются такими, как определено выше.
Вариант осуществления 21. Конъюгат, имеющий структуру формулы (D), представляет собой конъюгат, имеющий структуру формулы (D-1a) или формулы (D-2a):
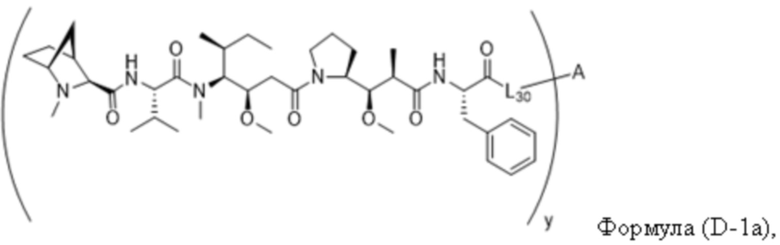

где: A, y и L30 являются такими, как определено выше.
Вариант осуществления 22. Конъюгат, имеющий структуру формулы (D), формулы (D-1), формулы (D-2), формулы (D-1a) или формулы (D-2a), где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
L30 представляет собой -L5R40;
L4 представляет собой -((CH2)m;
L5 представляет собой -NHS(=O)2(CH2)mX1L4, -NH((CH2)mO)p(CH2)mX1L4-, -NH((CH2)mO)p(CH2)mX2L4-, -NH((CH2)mO)p(CH2)m- или -NH(CH2)m-;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 23. Конъюгат, имеющий структуру формулы (D), формулы (D-1), формулы (D-2), формулы (D-1a) или формулы (D-2a),
где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
L30 представляет собой -L5R40;
L4 представляет собой -((CH2)m;
L5 представляет собой -NHS(=O)2(CH2)mX1L4, -NH((CH2)mO)p(CH2)mX1L4-, -NH((CH2)mO)p(CH2)mX2L4-, -NH((CH2)mO)p(CH2)m- или -NH(CH2)m-;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 24. Конъюгат, имеющий структуру формулы (D), формулы (D-1), формулы (D-2), формулы (D-1a) или формулы (D-2a), где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
L30 представляет собой -L5R40;
L4 представляет собой -((CH2)m;
L5 представляет собой -NHS(=O)2(CH2)mX1L4;
X1 представляет собой  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  или
или  ;
;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 25. Конъюгат, имеющий структуру формулы (D), формулы (D-1), формулы (D-2), формулы (D-1a) или формулы (D-2a), выбранный из:
 ;
;
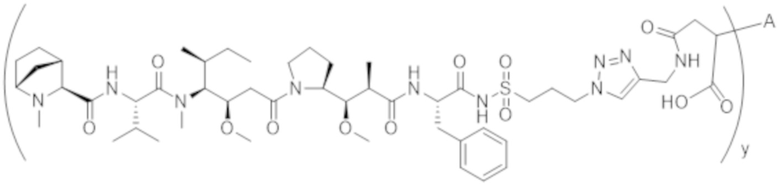 ;
;
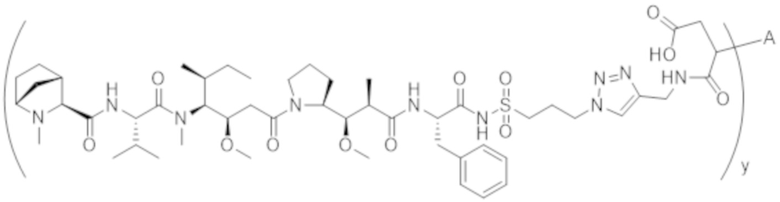 ;
;
 ;
;
 и
и
 .
.
Вариант осуществления 26. Конъюгат, имеющий структуру формулы (E), представляет собой конъюгат, имеющий структуру формулы (E-1):
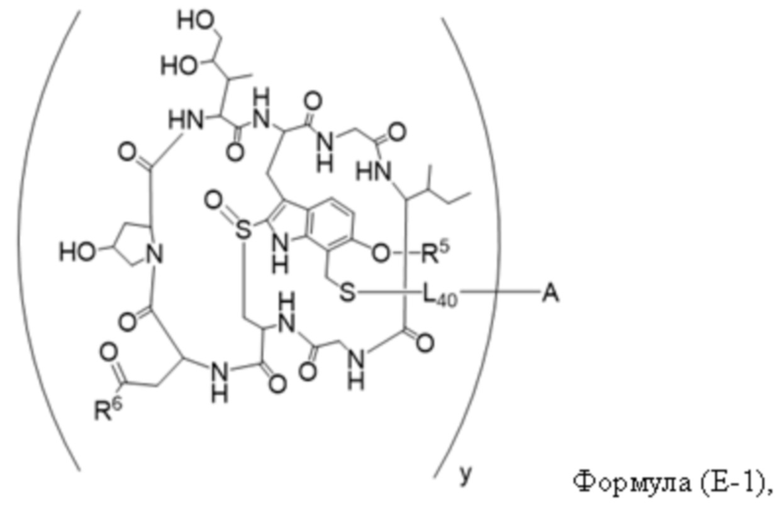
где: A, y, R5, R6 и L40 являются такими, как определено выше.
Вариант осуществления 27. Конъюгат, имеющий структуру формулы (E), представляет собой конъюгат, имеющий структуру формулы (E-1a):
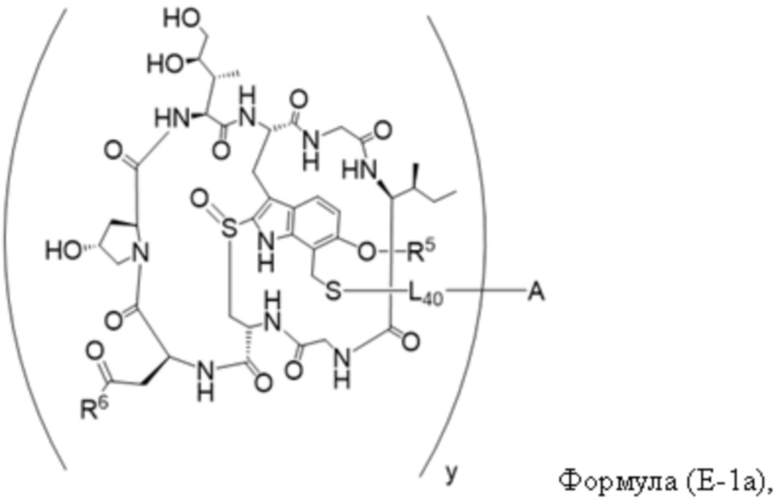
где: A, y, R5, R6 и L40 являются такими, как определено выше.
Вариант осуществления 28. Конъюгат, имеющий структуру формулы (E), формулы (E-1) или формулы (E-1a), где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
R5 представляет собой H, -CH3 или -CD3;
R6 представляет собой -NH2 или -OH;
L40 представляет собой -L6R40;
L6 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-, -L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m- или -(CH2)m-;
L4 представляет собой -((CH2)m;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 29. Конъюгат, имеющий структуру формулы (E), формулы (E-1) или формулы (E-1a), где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
R5 представляет собой H, -CH3 или -CD3;
R6 представляет собой -NH2 или -OH;
L40 представляет собой -L6R40;
L6 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)mX2L4-, -L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-, -L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4-, -((CH2)mO)p(CH2)m- или -(CH2)m-;
L4 представляет собой -((CH2)m;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,
, -NR7C(=O)CH2-, -NHC(=O)CH2-, -S(=O)2CH2CH2-, -(CH2)2S(=O)2CH2CH2-, -NR7S(=O)2CH2CH2, -NR7C(=O)CH2CH2-, -NH-, -C(=O)-, -NHC(=O)-, -CH2NHCH2CH2-, -NHCH2CH2-, -S-,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ;
;
каждый R7 независимо выбран из H и C1-C6алкила;
каждый R10 независимо выбран из H, C1-C6алкила, F, Cl и -OH;
каждый R11 независимо выбран из H, C1-C6алкила, F, Cl, -NH2, -OCH3, -OCH2CH3, -N(CH3)2, -CN, -NO2 и -OH;
каждый R12 независимо выбран из H, C1-6алкила, фтора, бензилокси, замещенного -C(=O)OH, бензила, замещенного -C(=O)OH, C1-4алкокси, замещенного -C(=O)OH, и C1-4алкила, замещенного -C(=O)OH;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 30. Конъюгат, имеющий структуру формулы (E), формулы (E-1) или формулы (E-1a), где:
A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека;
y составляет целое число от 1 до 10;
R5 представляет собой -CH3;
R6 представляет собой -NH2;
L40 представляет собой -L6R40;
L6 представляет собой -((CH2)mO)p(CH2)mX1L4-, -((CH2)mO)p(CH2)m-, -L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-, - L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4- или -(CH2)m-;
L4 представляет собой -((CH2)m;
X1 представляет собой  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  или
или  ;
;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10, и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
Вариант осуществления 31. Конъюгат, имеющий структуру формулы (E), формулы (E-1) или формулы (E-1a), выбранный из:
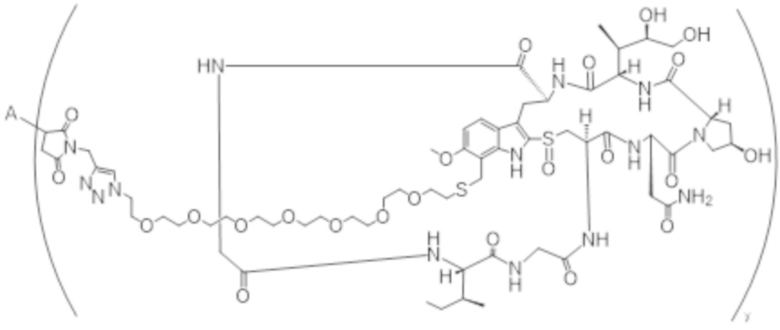 ;
;  ;
;
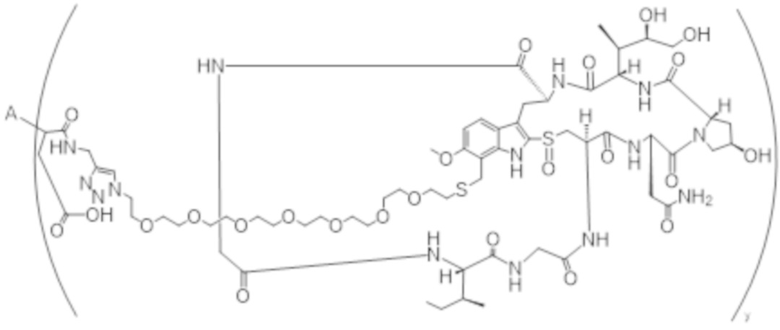 ;
; 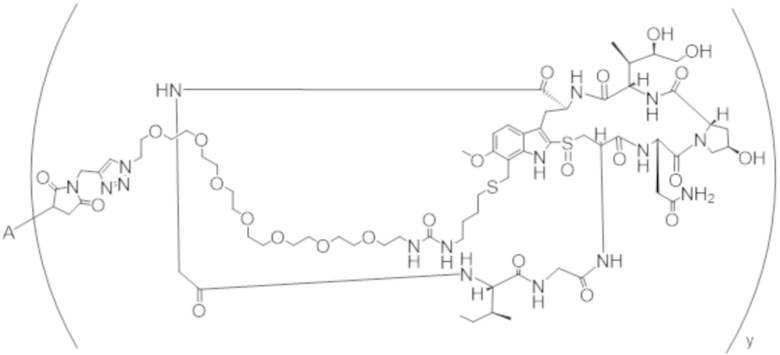 ;
;  и
и  .
.
В другом аспекте конъюгат антитела и лекарственного средства по настоящему изобретению выбран из:
 ;
;
 ;
; 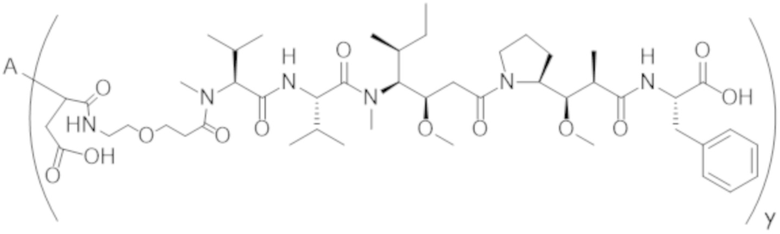 ;
; 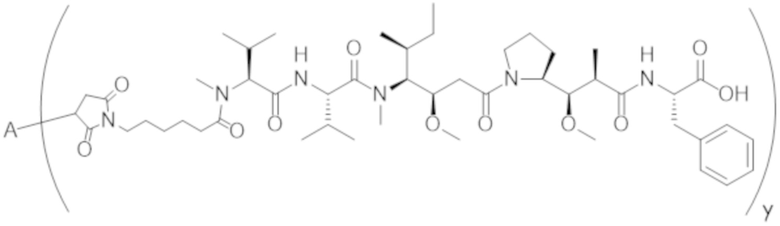 ;
; 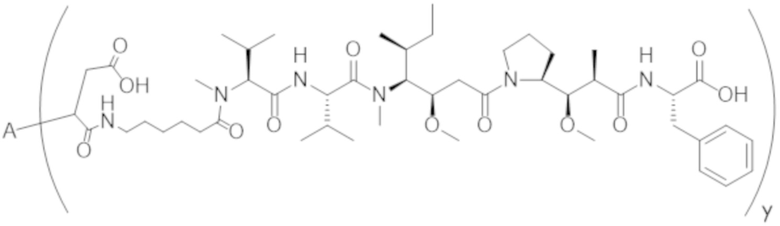 ;
;  ;
; 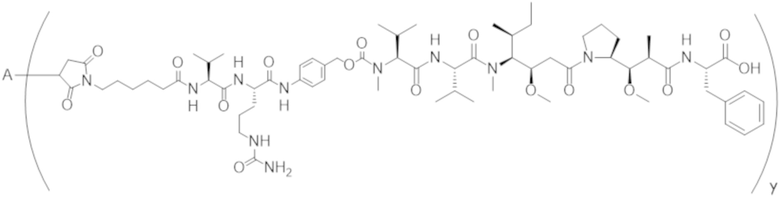 ;
; 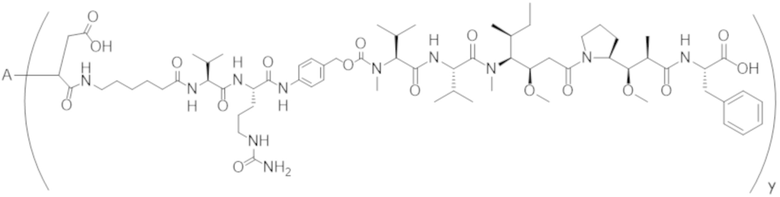 ;
; 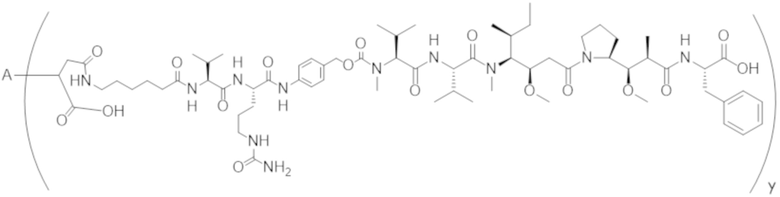 ;
;
 ;
; 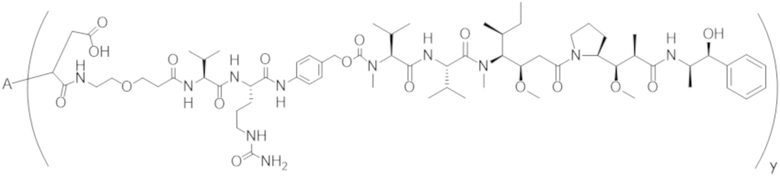 ;
; 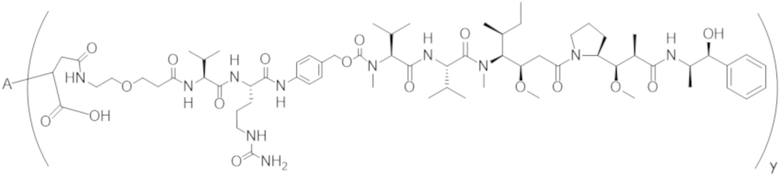 ;
; 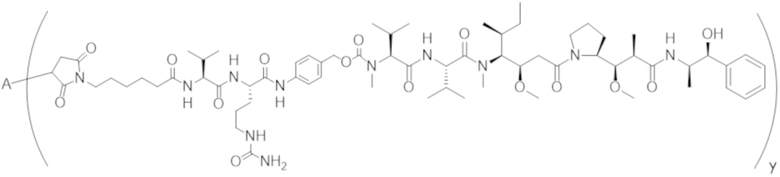 ;
; 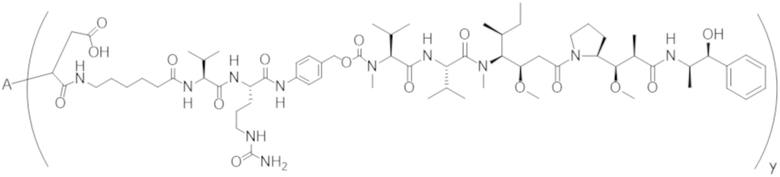 и
и 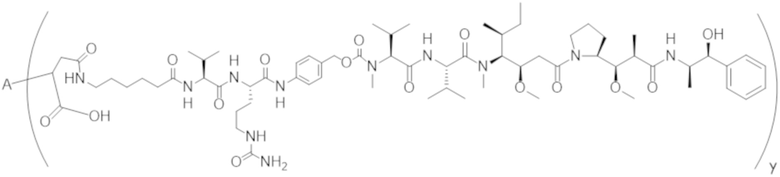 ;
;
где A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека,
и y составляет целое число от 1 до 10.
В другом аспекте конъюгат антитела и лекарственного средства по настоящему изобретению выбран из:
 ;
;
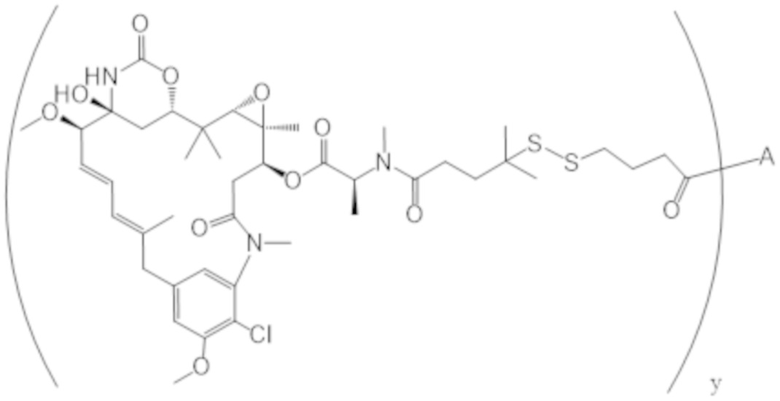 ;
;
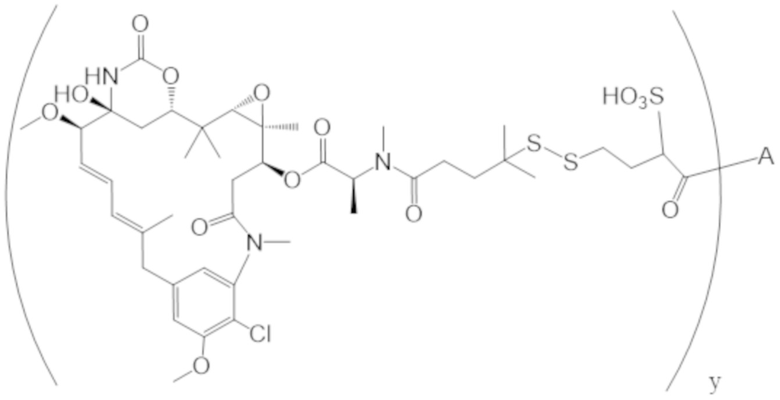 ;
;
 ;
;
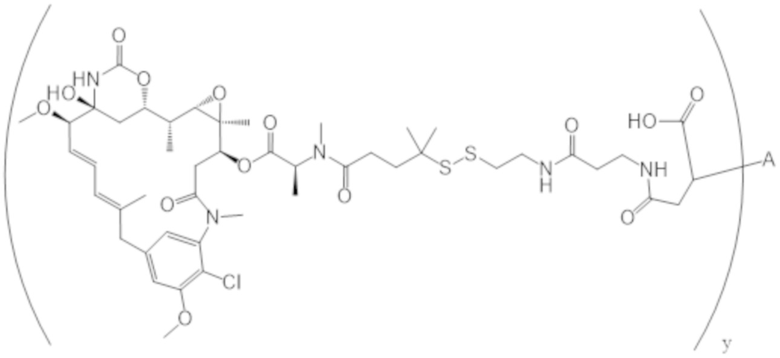 и
и
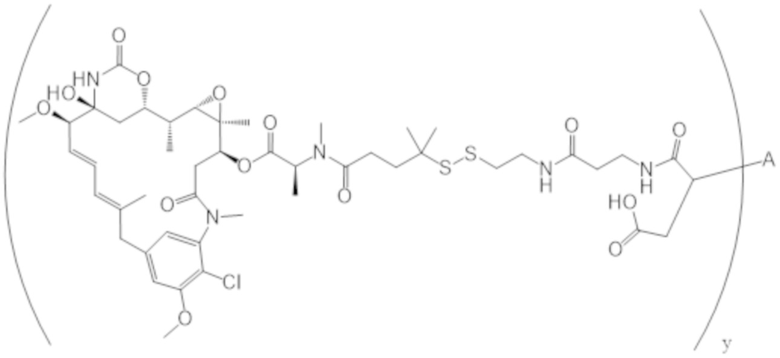 ;
;
где A представляет собой фрагмент антитела (например, Fab или Fab'), который специфически связывается с cKIT человека,
и y составляет целое число от 1 до 10.
Синтез иллюстративных соединений линкер-лекарственное средство
Пример 1. Синтез (S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-(3-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)пропаноил)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропановой кислоты (C1)
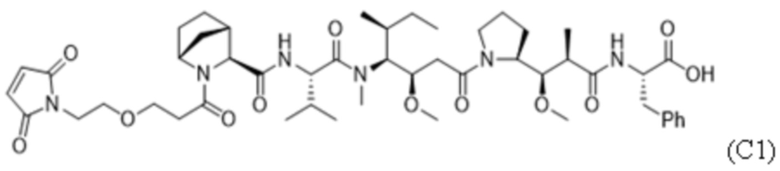
Стадия 1. К раствору BocVal-Dil-Dap-OH (1,00 г, 1,75 ммоль) в N,N-диметилформамиде (DMF, 20,0 мл) при 0°C добавляли N,N-диизопропилэтиламин (DIEA, 0,677 г, 5,25 ммоль) и 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний 3-оксида гексафторфосфат (HATU) (0,731 г, 1,93 ммоль). Затем полученный раствор перемешивали в течение 5 минут и добавляли к раствору HCl-соли метилового сложного эфира L-фенилаланина (0,377 г, 1,75 ммоль) и DIEA (0,226 г, 1,75 ммоль) в DMF (5,0 мл) при 0°C. Реакционную смесь нагревали до комнатной температуры, перемешивали в течение дополнительных 30 минут и затем концентрировали. Остаток очищали посредством HPLC с обращенной фазой с применением системы ISCO, колонка C18, элюировали с помощью 20-90% ацетонитрила в воде с получением BocVal-Dil-Dap-PheOMe: MS масса/заряд 733,4 (M+1); время удерживания 1,47 минуты.
Стадия 2. К раствору BocVal-Dil-Dap-PheOMe (0,683 г, 0,932 ммоль), полученному на стадии 1, в метаноле (20 мл) добавляли HCl (4 н. в 1,4-диоксане, 16 мл). Реакционную смесь перемешивали при комнатной температуре в течение 7 часов и концентрировали. Остаток растворяли в диоксане и лиофилизировали с получением HCl-соли Val-Dil-Dap-PheOMe: MS масса/заряд 633,4 (M+1); время удерживания 0,96 минуты.
Стадия 3. (1R,3S,4S)-N-Boc-2-азабицикло[2.2.1]гептан-3-карбоновую кислоту (12,6 мг, 0,052 ммоль) растворяли в DMF (1 мл) в 15-мл круглодонной колбе. Добавляли DIEA (12,3 мг, 0,095 ммоль) и HATU (19 мг, 0,050 ммоль). Реакционную смесь перемешивали в течение 10 минут и добавляли HCl-соль Val-Dil-Dap-PheOMe (30 мг, 0,090 ммоль) в DMF (1,0 мл). Реакционную смесь перемешивали в течение 1 часа. С помощью LCMS-анализа определили, что реакция завершена, и полученную смесь очищали посредством HPLC с обращенной фазой с применением колонки C18, элюировали с помощью 20-90% ацетонитрила в H2O, содержащей 0,05% трифторуксусной кислоты (TFA). Фракции, содержащие требуемый продукт, объединяли и концентрировали с получением (1R,3S,4S)-трет-бутил 3-(((S)-1-(((3R,4S,5S)-3-метокси-1-((S)-2-((1R,2R)-1-метокси-3-(((S)-1-метокси-1-оксо-3-фенилпропан-2-ил)амино)-2-метил-3-оксопропил)пирролидин-1-ил)-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)карбамоил)-2-азабицикло[2.2.1]гептан-2-карбоксилата: MS масса/заряд 856,6 (M+1); время удерживания 1,67 минуты.
Стадия 4. Продукт, полученный на стадии 3, растворяли в дихлорметане (DCM) (2,0 мл) и обрабатывали с помощью TFA (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. LCMS-анализ показал, что реакция завершена. Реакционную смесь концентрировали с помощью роторного испарителя с получением (S)-метил-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропаноата в виде TFA-соли: MS масса/заряд 756,6 (M+1); время удерживания 1,22 минуты.
Стадия 5. В 25-мл круглодонную колбу добавляли TFA-соль (S)-метил 2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропаноата (38,4 мг, 0,044 ммоль), моногидрат LiOH (50,0 мг, 1,19 ммоль) и смесь растворителей MeOH-H2O (2:1, 4,0 мл). Смесь перемешивали при комнатной температуре в течение 60 часов. С помощью LC-MS-анализа определили, что реакция завершена. Реакционную смесь концентрировали и очищали посредством HPLC с обращенной фазой, колонка C18, элюировали с помощью ацетонитрила в H2O (10-70%), содержащей 0,05% TFA. Фракции, содержащие требуемый продукт объединяли и концентрировали с получением (S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропановой кислоты в виде TFA-соли, MS масса/заряд 742,5 (M+1). Время удерживания 1,15 минуты.
Стадия 6. К раствору 3-(2-(малеимидо)этокси)пропановой кислоты (2,2 мг, 0,010 ммоль) в DMF (1 мл) добавляли HATU (3,7 мг, 0,0098 ммоль) и DIEA (3,6 мг, 0,028 ммоль). Реакционную смесь перемешивали в течение 5 мин и затем добавляли (S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропановую кислоту (8 мг, 0,0093 ммоль) в DMF (0,5 мл). Реакционную смесь перемешивали при rt в течение 1 ч и затем концентрировали и очищали посредством препаративной HPLC (10-60% ацетонитрила в H2O, содержащей 0,05% TFA) с получением (S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-(3-(2-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)этокси)пропаноил)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропановой кислоты (C1). MS масса/заряд 937,5 (M+H). Время удерживания 1,138 мин.
Пример 2. (S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропановая кислота (C2)
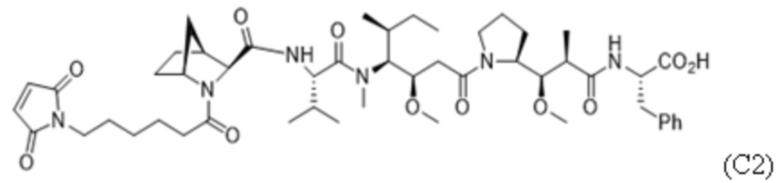
(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропановую кислоту (2) получали в соответствии со способом из примера 1, за исключением того, что на стадии 6
6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексановую кислоту (EMCA) (1,2 мг, 0,0058 ммоль) в DMF (1,0 мл) применяли вместо 3-(2-(малеимидо)этокси)пропановой кислоты. (S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-(6-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)гексаноил)-2-азабицикло[2.2.1]гептан-3-карбоксамидо)-N,3-диметилбутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропановая кислота (2) MS масса/заряд 935,6 (M+1). Время удерживания 1,17 минуты.
Пример 3. (1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-(4-((2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)метил)-1H-1,2,3-триазол-1-ил)пропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)-2-метил-2-азабицикло[2.2.1]гептан-3-карбоксамид (C3)
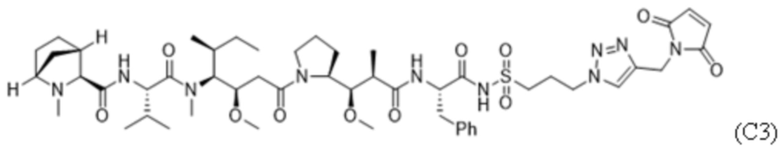
Стадия 1. К перемешиваемому раствору азида натрия (3,50 г, 53,8 ммоль) в воде (25 мл) добавляли раствор 1,3-пропансульфона (6,10 г, 50,0 ммоль) в ацетоне (25 мл). Реакционную смесь перемешивали при комнатной температуре в течение 24 часов и концентрировали до сухого состояния. Полученное твердое вещество суспендировали в диэтиловом эфире (100 мл) и перемешивали с обратным холодильником в течение 1 часа. Суспензию охлаждали до комнатной температуры и твердое вещество собирали фильтрацией, промывали с помощью ацетона и диэтилового эфира и высушивали под вакуумом с получением 3-азидо-1-пропансульфоновой кислоты. MS масса/заряд 188,1(M+1). 1H ЯМР (400 МГц, CD3OD): δ 3,47 (t, J=6,8 Гц, 2H), 2,87 (t, J=7,6 Гц, 2H), 2,07-2,00 (m, 2H).
Стадия 2. 3-азидо-1-пропансульфоновую кислоту (2,07 г, 13,0 ммоль) суспендировали в толуоле. Добавляли PCl5 (2,61 г, 13,0 ммоль). Смесь нагревали с обратным холодильником в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали для удаления нерастворимых веществ. Осадок на фильтре промывали с помощью DCM. Объединенные фильтраты концентрировали с получением 3-азидопропан-1-сульфонилхлорида в виде темно-желтого масла, которое применяли на следующей стадии без дополнительной очистки.
Стадия 3. К NH4OH (5 мл), охлажденному до 0°C, добавляли 3-азидопропан-1-сульфонилхлорид (1,75 г, 9,53 ммоль). Спустя 10 минут реакционную смесь нагревали до комнатной температуры и перемешивали при той же температуре в течение 3 часов. Маслянистая смесь стала прозрачной. Реакционную смесь трижды экстрагировали с помощью EtOAc. Органическую фазу промывали с помощью солевого раствора, высушивали над безводным MgSO4 и концентрировали. Остаточный растворитель дополнительно удаляли под высоким вакуумом в течение 18 часов с получением 3-азидопропан-1-сульфонамида. MS масса/заряд 187,1 (M+1). 1H ЯМР (400 МГц, CDCl3): δ 4,83 (s, 2H), 3,51 (t, J=6,4 Гц, 2H), 3,23 (t, J=7,6 Гц, 2H), 2,17-2,10 (m, 2H).
Стадия 4. (S)-2-((трет-бутоксикарбонил)амино)-3-фенилпропановую кислоту (100 мг, 0,38 ммоль) растворяли в DMF (4 мл), с последующим добавлением DIEA (0,395 мл, 2,26 ммоль) и HATU (358 мг, 0,940 ммоль). Спустя 15 минут добавляли 3-азидопропан-1-сульфонамид (186 мг, 1,13 ммоль). Реакционную смесь перемешивали в течение 2 часов, при этом с помощью LCMS-анализа определили завершение реакции в это время. Затем полученную смесь очищали посредством HPLC с обращенной фазой с применением колонки C18, элюировали с помощью 10-90% ацетонитрила в H2O, содержащей 0,05% TFA. Фракции, содержащие требуемый продукт, объединяли и лиофилизировали с получением (S)-трет-бутил (1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)карбамата. MS масса/заряд 312,1 (M+1-Boc). Время удерживания 1,15 минуты. Полученный таким образом продукт (72,4 мг, 0,176 ммоль) растворяли в 3 M метанольной HCl (5 мл). Растворитель удаляли при пониженном давлении. Остаток поглощали в ацетонитриле и H2O и лиофилизировали с получением (S)-2-амино-N-((3-азидопропил)сульфонил)-3-фенилпропанамида в виде розовато-желтоватого твердого вещества. MS масса/заряд 312,1 (M+1). 1H ЯМР (400 МГц, CD3OD): δ 7,42-7,31 (m, 5H), 4,16-4,13 (m, 1H), 3,51-3,47 (m, 4H), 3,32-3,26 (m, 1H), 3,13-3,08 (m, 1H), 2,00-1,94 (m, 2H).
Стадия 5. К Boc-Val-Dil-Dap-OH (195 мг, 0,34 ммоль), растворенному в DMF (4 мл), добавляли DIEA (132 мг, 1,02 ммоль) и HATU (108 мг, 0,28 ммоль). Реакционную смесь перемешивали в течение 15 минут при комнатной температуре перед добавлением (S)-2-амино-N-((3-азидопропил)сульфонил)-3-фенилпропанамида (59,2 мг, 0,17 ммоль). Реакционную смесь перемешивали в течение дополнительных 2 часов при комнатной температуре. А затем очищали посредством HPLC с обращенной фазой с получением требуемого продукта (95 мг, выход 65%, MS масса/заряд 865,4 (M+1), время удерживания 1,43 минуты). Продукт растворяли в 3 M HCl в MeOH (3 мл). Растворители удаляли под вакуумом. Затем к остатку добавляли ацетонитрил и H2O и раствор лиофилизировали с получением требуемого продукта, (S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-2-амино-3-метил-1-оксобутана. MS масса/заряд 765,4 (M+1). Время удерживания 1,04 минуты.
Стадия 6. К (1R,3S,4S)-2-(трет-бутоксикарбонил)-2-азабицикло[2.2.1]гептан-3-карбоновой кислоте (16,5 мг, 0,068 ммоль) в DMF (2,0 мл) добавляли DIEA (17,6 мг, 0,137 ммоль) и HATU (21,6 мг, 0,057 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут перед добавлением (S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-2-амино-3-метил-1-оксобутана (20 мг, TFA-соль, 0,023 ммоль). Реакционную смесь перемешивали в течение 2 часов при комнатной температуре, при этом с помощью LCMS-анализа определили завершение реакции в это время. Затем полученную смесь очищали посредством HPLC с обращенной фазой с применением колонки C18, элюировали с помощью 10-90% ACN в H2O, содержащей 0,05% TFA. Фракции, содержащие требуемый продукт, объединяли и лиофилизировали с получением (1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)-2-(трет-бутоксикарбонил)-2-азабицикло[2.2.1]гептан-3-карбоксамида. MS масса/заряд 988,5 (M+1). Время удерживания 1,51 минуты. Полученный таким образом продукт (9,4 мг, 0,0095 ммоль) растворяли в метанольной HCl (3 M, 2,0 мл). Растворитель удаляли медленно при пониженном давлении. Остаток растворяли в ацетонитриле и H2O и лиофилизировали с получением (1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)-2-азабицикло[2.2.1]гептан-3-карбоксамида в виде HCl-соли. MS масса/заряд 888,5 (M+1). Время удерживания 1,10 минуты.
Стадия 7. (1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)-2-азабицикло[2.2.1]гептан-3-карбоксамид (8,8 мг, 0,0099 ммоль) растворяли в MeOH (2,0 мл). Добавляли параформальдегид (10,1 мг, 0,337 ммоль) и уксусную кислоту (0,0102 мл), а затем цианоборгидрид натрия (21,2 мг, 0,337 ммоль). Реакционную смесь нагревали при 50°C с перемешиванием в течение 1 часа. Добавляли дополнительный параформальдегид (10,1 мг, 0,337 ммоль), уксусную кислоту (0,0102 мл) и цианоборгидрид натрия (21,2 мг, 0,337 ммоль). Спустя 1 час при 50°C с помощью LCMS-анализа определили завершение реакции. Затем полученную смесь очищали посредством HPLC с обращенной фазой с применением колонки C18, элюировали с помощью 10-90% ACN в H2O, содержащей 0,05% TFA. Фракции, содержащие требуемый продукт, объединяли и лиофилизировали с получением (1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)-2-метил-2-азабицикло[2.2.1]гептан-3-карбоксамида. MS масса/заряд 902,5 (M+1). Время удерживания 1,12 минуты.
Стадия 8. Раствор (1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)-2-метил-2-азабицикло[2.2.1]гептан-3-карбоксамида (5,2 мг, 0,0058 ммоль), 1-(проп-2-ин-1-ил)-1H-пиррол-2,5-диона (1,56 мг, 0,012 ммоль) и CuSO4 (0,7 мг, 0,004 ммоль) в DMF (2,0 мл) и H2O (0,5 мл) обрабатывали натриевой солью L-аскорбиновой кислоты (2,5 мг, 0,014 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Добавляли дополнительные CuSO4 (0,7 мг, 0,004 ммоль) и натриевую соль L-аскорбиновой кислоты (2,5 мг, 0,014 ммоль). После дополнительных 2 часов при комнатной температуре с помощью LCMS-анализа определили завершение реакции. Затем полученную смесь очищали посредством HPLC с обращенной фазой с применением колонки C18, элюировали с помощью 10-90% ацетонитрила в H2O, содержащей 0,05% TFA. Фракции, содержащие требуемый продукт, объединяли и лиофилизировали с получением (1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-(4-((2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)метил)-1H-1,2,3-триазол-1-ил)пропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутан-2-ил)-2-метил-2-азабицикло[2.2.1]гептан-3-карбоксамида (C3). MS масса/заряд 1037,4 (M+1). Время удерживания 1,00 минуты.
Пример 4. Синтез (S)-2-((бис(диметиламино)метилен)амино)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-(4-((2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)метил)-1H-1,2,3-триазол-1-ил)пропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутана (C4)
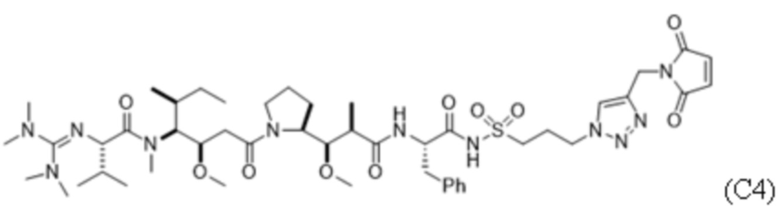
Стадия 1. К перемешиваемому раствору азида натрия (3,5 г, 54 ммоль) в воде (25 мл) добавляли раствор 1,3-пропансульфона (6,1 г, 50 ммоль) в ацетоне (25 мл). Реакционную смесь перемешивали при rt в течение 24 ч и концентрировали. Полученное твердое вещество суспендировали в диэтиловом эфире (100 мл) и перемешивали с обратным холодильником в течение 1 ч. Суспензию охлаждали до rt. Твердое вещество собирали фильтрацией, промывали с помощью ацетона и диэтилового эфира и высушивали под вакуумом с получением 3-азидо-1-пропансульфоновой кислоты. MS масса/заряд 188,1 (M+23). 1H ЯМР (400 МГц, CD3OD): δ 3,47 (t, J=6,8 Гц, 2H), 2,87 (t, J=7,6 Гц, 2H), 2,07-2,00 (m, 2H).
Стадия 2. 3-азидо-1-пропансульфоновую кислоту (2,07 г, 13 ммоль) суспендировали в толуоле. Добавляли PCl5 (2,61 г, 13 ммоль). Смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь охлаждали до rt. Нерастворимые вещества удаляли фильтрацией и промывали с помощью DCM. Объединенный фильтрат концентрировали с получением 3-азидопропан-1-сульфонилхлорида в виде желто-коричневого масла, которое применяли на следующей стадии без дополнительной очистки.
Стадия 3. NH4OH (28%, 5 мл) охлаждали до 0°C. Добавляли 3-азидопропан-1-сульфонилхлорид (1,75 г, 9,53 ммоль). Спустя 10 мин реакционную смесь нагревали до rt и затем перемешивали в течение 3 часов при rt. Две фазы становились однородными. Реакционную смесь трижды экстрагировали с помощью EtOAc. Объединенные органические фазы промывали с помощью солевого раствора, высушивали над MgSO4 и концентрировали на роторном испарителе, а затем с применением высокого вакуума в течение 18 ч с получением 3-азидопропан-1-сульфонамида. MS масса/заряд 187,1 (M+23). 1H ЯМР (400 МГц, CDCl3): δ 4,83 (s, 2H), 3,51 (t, J=6,4 Гц, 2H), 3,23 (t, J=7,6 Гц, 2H), 2,17-2,10 (m, 2H).
Стадия 4. (S)-2-((трет-бутоксикарбонил)амино)-3-фенилпропановую кислоту (100 мг, 0,38 ммоль) растворяли в DMF (4 мл). Добавляли DIEA (0,395 мл, 2,26 ммоль) и HATU (358 мг, 0,94 ммоль). Спустя 15 мин добавляли 3-азидопропан-1-сульфонамид (186 мг, 1,13 ммоль). Реакционную смесь перемешивали в течение 2 ч. С помощью LCMS определили завершение реакции. Реакционную смесь очищали посредством препаративной HPLC с применением 10-90% градиента с получением (S)-трет-бутил-(1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)карбамата. MS масса/заряд 312,1 (M+1-Boc). Время удерживания 1,15 мин. Полученный таким образом продукт (72,4 мг, 0,176 ммоль) растворяли в метанольной HCl (3 M, 5 мл). Растворитель удаляли выпариванием. Остаток лиофилизировали из ацетонитрила и H2O с получением (S)-2-амино-N-((3-азидопропил)сульфонил)-3-фенилпропанамида в виде розовато-желтоватого твердого вещества. MS масса/заряд 312,1 (M+1) 1H ЯМР (400 МГц, CD3OD): δ 7,42-7,31 (m, 5H), 4,16-4,13 (m, 1H), 3,51-3,47 (m, 4H), 3,32-3,26 (m, 1H), 3,13-3,08 (m, 1H), 2,00-1,94 (m, 2H).
Стадия 5. К Boc-Val-Dil-Dap-OH (195 мг, 0,34 ммоль) в DMF (4 мл) добавляли DIEA (132 мг, 1,02 ммоль) и HATU (108 мг, 0,28 ммоль). Их перемешивали 15 мин при rt. Добавляли (S)-2-амино-N-((3-азидопропил)сульфонил)-3-фенилпропанамид (59,2 мг, 0,17 ммоль). Реакционную смесь перемешивали в течение 2 ч при rt. Неочищенный материал очищали посредством препаративной HPLC с получением требуемого продукта (95 мг, выход 65%, MS масса/заряд 865,4 (M+1), время удерживания 1,43 минуты). Продукт растворяли в 3 M HCl в MeOH (3 мл). Растворители удаляли выпариванием. Остаток лиофилизировали из ацетонитрила в воде с получением (S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-2-амино-3-метил-1-оксобутана,  , в виде HCl-соли, MS масса/заряд 765,4 (M+1), время удерживания 1,04 мин.
, в виде HCl-соли, MS масса/заряд 765,4 (M+1), время удерживания 1,04 мин.
Стадия 6. К HCl-соли (S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-2-амино-3-метил-1-оксобутана (20 мг, 0,025 ммоль) в DMF (2 мл) добавляли DIEA (0,024 мл, 0,14 ммоль) и HATU (21,6 мг, 0,057 ммоль). Реакционную смесь перемешивали при rt в течение 2 ч. С помощью LCMS определили завершение реакции. Затем полученную смесь очищали посредством препаративной HPLC с применением 10-90% градиента с получением (S)-2-((бис(диметиламино)метилен)амино)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутана в виде TFA-соли. MS масса/заряд 863,5 (M+1). Время удерживания 1,169 мин.
Стадия 7. TFA-соль (S)-2-((бис(диметиламино)метилен)амино)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-азидопропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутана (87,4 мг, 0,089 ммоль) и 1-(проп-2-ин-1-ил)-1H-пиррол-2,5-дион (24,2 мг, 0,0179 ммоль) суспендировали в t-BuOH и воде из расчета по 3,0 мл каждого. Реакционный сосуд пять раз заполняли N2 с помощью вакуум-наполнительного цикла с N2. Последовательно добавляли дегазированные растворы L-аскорбата натрия (17,7 мг, 0,089 ммоль) в H2O (2,4 мл) и CuSO4 (2,86 мг, 0,018 ммоль) в H2O (0,6 мл) и реакционную смесь перемешивали при rt в течение 5 ч. С помощью LCMS определили завершение реакции. Неочищенный материал очищали посредством препаративной HPLC с применением 20-45% градиента с получением (S)-2-((бис(диметиламино)метилен)амино)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-(4-((2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)метил)-1H-1,2,3-триазол-1-ил)пропилсульфонамидо)-1-оксо-3-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)(метил)амино)-3-метил-1-оксобутана (C4) в виде TFA-соли. MS масса/заряд 998,5 (M+1). Время удерживания 1,014 мин.
Пример 5. Синтез 6'O-метил-7'C-((23-(4-((2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)метил)-1H-1,2,3-триазол-1-ил)-3,6,9,12,15,18,21-гептаоксатрикозантио)метил)-α-аманитина (C5), 7'C-((23-азидо-3,6,9,12,15,18,21-гептаоксатрикозантио)метил)-α-аманитина (A-3) и 6'O-метил-7'C-((23-азидо-3,6,9,12,15,18,21-гептаоксатрикозантио)метил)-α-аманитина (A4)
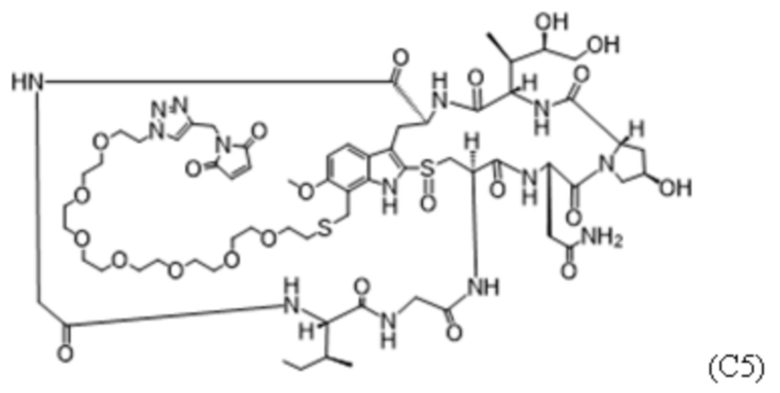
Стадия 1. Формальдегид (0,035 мл, 0,44 ммоль) и 23-азидо-3,6,9,12,15,18,21-гептаоксатрикозан-1-тиол (35 мг, 0,11 ммоль) добавляли к раствору α-аманитина (20 мг, 0,022 ммоль) в MeOH (2 мл). К реакционной смеси добавляли триэтиламин (1,2 мл, 8,7 ммоль) и уксусную кислоту (0,25 мл, 4,4 ммоль) и трижды продували N2-газом. Реакционную смесь перемешивали при 40°C в течение 2 дней. После концентрирования под вакуумом затем остаток очищали посредством HPLC и лиофилизировали с получением 7'C-((23-азидо-3,6,9,12,15,18,21-гептаоксатрикозантио)метил)-α-аманитина. MS (m+1) = 1342,4, RT пика при HPLC=0,834 минуты, 1H-ЯМР (MeOD, 500 МГц) δ 10,65 (s, 1H), 8,81 (m, 1H), 8,59 (d, 1H, J=2,0 Гц), 8,45 (m, 2H), 8,33 (s, 1H), 8,14 (d, 1H, J=10,5 Гц), 8,00 (d, 1H, J=12,0 Гц), 7,90 (d, 1H, J=11,0 Гц), 7,67 (s, 1H), 7,48 (d, 1H, J=11,0 Гц), 6,69 (d, 1H, J=10,5 Гц), 5,25 (m, 1H), 5,12 (m, 1H), 4,74 (bs, 1H), 4,61 (dd, 1H, J=6,5 и 12,0 Гц), 4,51 (m, 2H), 4,29 (dd, 1H, J=10,5 и 23,0 Гц), 4,09 (m, 3H), 3,92 (m, 1H), 3,38~3,73 (m, 43H), 3,29 (m, 2H), 3,21 (m, 1H), 3,06 (m, 1H), 3,12 (m, 1H), 2,91 (m, 1H), 2,56 (m, 2H), 2,39 (m, 2H), 2,00 (m, 1H), 1,60 (m, 2H), 1,15 (m, 1H), 0,94 (d, 3H, J=9,0 Гц), 0,85 (m, 6H).
Стадия 2: 7'C-((23-азидо-3,6,9,12,15,18,21-гептаоксатрикозантио)метил)-α-аманитин (14,0 мг, 0,011 ммоль) и DMSO (1 мл) обрабатывали с помощью метилйодида (0,0007 мл) и K2CO3 (1,5 мг) при rt и перемешивали при rt в течение 1 ч. Дополнительные метилйодид (0,0007 мл) и K2CO3 (1,5 мг) добавляли при rt и перемешивали при rt в течение 2 ч. Дополнительные метилйодид (0,0007 мл) и K2CO3 (1,5 мг) снова добавляли при rt и перемешивали при rt в течение 2 ч. Затем реакционную смесь очищали посредством RP-C18 ISCO и лиофилизировали с получением 6'O-метил-7'C-((23-азидо-3,6,9,12,15,18,21-гептаоксатрикозантио)метил)-α-аманитина. MS (m+2/2) = 679,0, RT пика при HPLC=0,887 минуты, 1H-ЯМР (MeOD, 500 МГц) δ 10,75 (s, 1H), 8,83 (m, 1H), 8,64 (d, 1H, J=2,0 Гц), 8,52 (d, 1H, J=10,0 Гц), 8,47 (d, 1H, J=3,5 Гц), 8,36 (s, 1H), 8,18 (d, 1H, J=8,5 Гц), 8,05 (d, 1H, J=9,5 Гц), 7,96 (d, 1H, J=9,0 Гц), 7,70 (d, 1H, J=9,0 Гц), 7,69 (s, 1H), 6,98 (d, 1H, J=9,0 Гц), 5,33 (m, 1H), 5,18 (m, 1H), 4,80 (bs, 1H), 4,68 (dd, 1H, J=5,5 и 9,5 Гц), 4,56 (m, 2H), 4,35 (dd, 1H, J=9,0 и 18,5 Гц), 4,10~4,21 (m, 3H), 3,97 (m, 1H), 3,92 (s, 3H), 3,45~3,79 (m, 42H), 3,35~3,44 (m, 3H), 3,11 (m, 1H), 2,96 (m, 1H), 2,61 (m, 2H), 2,44 (m, 2H), 2,06 (m, 1H), 1,65 (m, 2H), 1,21 (m, 1H), 0,99 (d, 3H, J=7,0 Гц), 0,90 (m, 6H).
Стадия 3. 6'O-метил-7'C-((23-азидо-3,6,9,12,15,18,21-гептаоксатрикозантио)метил)-α-аманитин (8 мг, 0,006 ммоль) и 1-(проп-2-ин-1-ил)-1H-пиррол-2,5-дион (2 мг, 0,012 ммоль) добавляли к трет-бутанолу (0,5 мл) и реакционную смесь пять раз продували N2-газом. Затем добавляли натриевую соль L-аскорбиновой кислоты (1 мг, 0,006 ммоль), CuSO4 (0,2 мг, 0,0012 ммоль) и 0,5 мл H2O. Реакционную смесь пять раз продували N2-газом и перемешивали при rt в течение 4 ч и затем очищали посредством RP-C18 ISCO с получением 6'O-метил-7'C-((23-(4-((2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)метил)-1H-1,2,3-триазол-1-ил)-3,6,9,12,15,18,21-гептаоксатрикозантио)метил)-α-аманитина (C5). MS (m+2/2) = 746,5, RT пика при HPLC=0,850 минуты, 1H-ЯМР (MeOD, 500 МГц) δ 10,74 (s, 1H), 8,83 (m, 1H), 8,63 (d, 1H, J=2,0 Гц), 8,51 (d, 1H, J=10,0 Гц), 8,47 (d, 1H, J=3,5 Гц), 8,36 (s, 1H), 8,17 (d, 1H, J=8,5 Гц), 8,04 (d, 1H, J=10,0 Гц), 7,96 (d, 1H, J=9,5 Гц), 7,94 (s, 1H), 7,69 (d, 1H, J=9,0 Гц), 6,97 (d, 1H, J=9,0 Гц), 6,83 (s, 2H), 5,34 (m, 1H), 5,17 (m, 1H), 4,79 (bs, 1H), 4,75 (s, 2H), 4,68 (dd, 1H, J=5,0 и 9,5 Гц), 4,56 (m, 2H), 4,52 (t, 1H, J=5,0 Гц), 4,34 (dd, 1H, J=9,0 и 18,5 Гц), 4,08~4,20 (m, 3H), 3,97 (m, 1H), 3,91 (s, 3H), 3,39~3,78 (m, 38H), 3,10 (m, 1H), 2,94 (dd, 1H, J=14,0 и 15,0 Гц), 2,61 (m, 2H), 2,41 (m, 2H), 2,05 (m, 1H), 1,57~1,68 (m, 2H), 1,20 (m,1H), 0,99 (d, 3H, J=7,0 Гц), 0,91 (m, 6H).
Пример 6. Синтез 6'O-метил-7'C-((4-(3-(23-((4-малеимидо)метил-1H-1,2,3-триазол-1-ил)-3,6,9,12,15,18,21-гептаоксатрикозил)уреидо)бутилтио)метил)-α-аманитина (C6)

Стадия 1. Формальдегид (0,027 мл, 0,33 ммоль) и трет-бутил-(4-меркаптобутил)карбамат (i-7) (34 мг, 0,16 ммоль) добавляли к раствору α-аманитина (A) (15 мг, 0,016 ммоль) в MeOH (5 мл) и триэтиламине (0,46 мл, 3,26 ммоль) в 40-мл флаконе и реакционную смесь перемешивали при 40°C в течение 3 дней. После концентрирования под вакуумом остаток растворяли в 2 мл MeOH и добавляли 408 мкл 2 M триметилсилилдиазометана в диэтиловом эфире и смесь перемешивали в течение 2 ч при rt. Затем добавляли еще 408 мкл 2 M триметилсилилдиазометана в диэтиловом эфире и перемешивали при rt в течение 2 ч. Реакционную смесь очищали посредством HPLC и лиофилизировали с получением 6'O-метил-7'C-((4-t-бутоксикарбониламинобутилтио)метил)-α-аманитина (A-4),
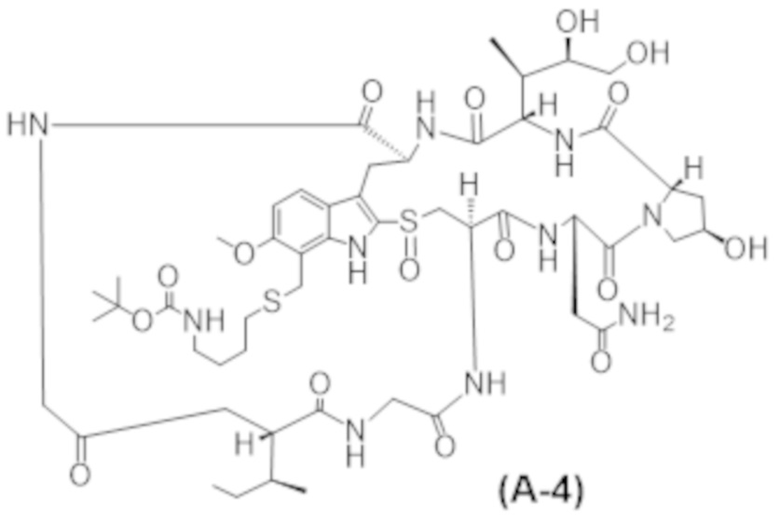 . MS (m+2-boc/2) = 525,8, RT пика при HPLC=0,936 минуты, 1H-ЯМР (MeOD-d4, 400 МГц) δ 10,78 (s, 1H), 8,84 (m, 1H), 8,59 (d, 1H, J=2,4 Гц), 8,48 (s, 1H), 8,46 (d, 1H, J=14,4 Гц), 8,35 (s, 1H), 8,15 (d, 1H, J=8,8 Гц), 8,01 (d, 1H, J=10,0 Гц), 7,92 (d, 1H, J=8,8 Гц), 7,69 (s, 1H), 7,63 (d, 1H, J=8,8 Гц), 6,92 (d, 1H, J=8,8 Гц), 5,28 (m, 1H), 5,13 (m, 1H), 4,73 (bs, 1H), 4,61 (dd, 1H, J=5,6 и 8,4 Гц), 4,51 (m, 2H), 4,30 (dd, 1H, J=8,8 и 18,4 Гц), 4,12 (m, 1H), 4,04 (d, 1H, J=13,2 Гц), 3,94 (d, 1H, J=13,2 Гц), 3,92 (m, 1H), 3,86 (s, 3H), 3,35~3,75 (m, 14H), 3,05 (m, 1H), 2,92 (m, 3H), 2,49 (m, 4H), 2,00 (m, 1H), 1,39~1,65 (m, 8H), 1,37 (s, 9H), 1,15 (m, 1H), 0,93 (d, 3H, J=7,2 Гц), 0,84 (m, 6H).
. MS (m+2-boc/2) = 525,8, RT пика при HPLC=0,936 минуты, 1H-ЯМР (MeOD-d4, 400 МГц) δ 10,78 (s, 1H), 8,84 (m, 1H), 8,59 (d, 1H, J=2,4 Гц), 8,48 (s, 1H), 8,46 (d, 1H, J=14,4 Гц), 8,35 (s, 1H), 8,15 (d, 1H, J=8,8 Гц), 8,01 (d, 1H, J=10,0 Гц), 7,92 (d, 1H, J=8,8 Гц), 7,69 (s, 1H), 7,63 (d, 1H, J=8,8 Гц), 6,92 (d, 1H, J=8,8 Гц), 5,28 (m, 1H), 5,13 (m, 1H), 4,73 (bs, 1H), 4,61 (dd, 1H, J=5,6 и 8,4 Гц), 4,51 (m, 2H), 4,30 (dd, 1H, J=8,8 и 18,4 Гц), 4,12 (m, 1H), 4,04 (d, 1H, J=13,2 Гц), 3,94 (d, 1H, J=13,2 Гц), 3,92 (m, 1H), 3,86 (s, 3H), 3,35~3,75 (m, 14H), 3,05 (m, 1H), 2,92 (m, 3H), 2,49 (m, 4H), 2,00 (m, 1H), 1,39~1,65 (m, 8H), 1,37 (s, 9H), 1,15 (m, 1H), 0,93 (d, 3H, J=7,2 Гц), 0,84 (m, 6H).
Стадия 2: TFA (1 мл) добавляли к 8 мг соединения (A-4) в 40-мл флаконе и полученный раствор оставляли отстоятся при rt в течение 2 мин, а затем концентрировали под вакуумом с получением 6'O-метил-7'C-((4-аминобутилтио)метил)-α-аманитина (A-5), 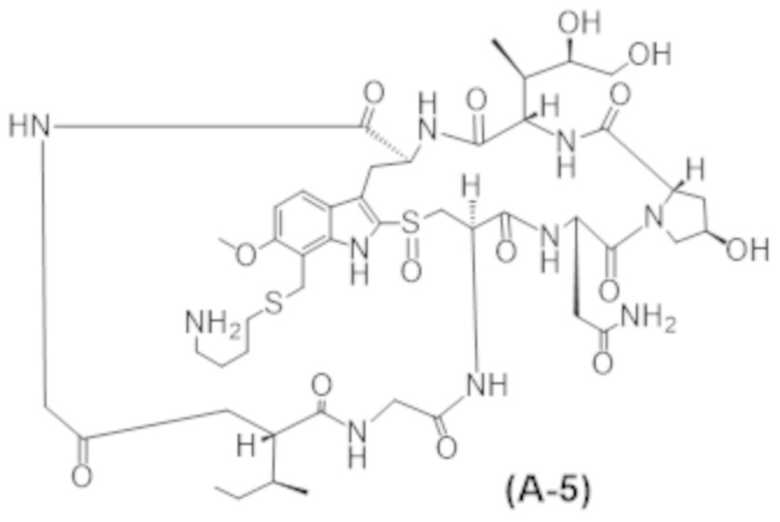 , который применяли без дополнительной очистки. MS (m+1) = 1050,4, RT пика при HPLC=0,635 минуты, 1H-ЯМР (MeOD-d4, 400 МГц) δ 8,87 (m, 1H), 8,58 (d, 1H, J=2,4 Гц), 8,48 (d, 1H, J=10,4 Гц), 8,44 (d, 1H, J=1,6 Гц), 8,16 (d, 1H, J=8,4 Гц), 7,97 (d, 1H, J=9,6 Гц), 7,94 (d, 1H, J=9,2 Гц), 7,62 (d, 1H, J=8,8 Гц), 6,92 (d, 1H, J=9,2 Гц), 5,25 (m, 1H), 5,13 (m, 1H), 4,73 (m, 1H), 4,60 (dd, 1H, J=5,6 и 9,2 Гц), 4,49 (m, 2H), 4,28 (dd, 1H, J=8,8 и 18,4 Гц), 4,12 (m, 1H), 4,04 (d, 1H, J=13,2 Гц), 3,99 (s, 2H), 3,92 (m, 1H), 3,86 (s, 3H), 3,83 (s, 1H), 3,60~3,72 (m, 4H), 3,30~3,60 (m, 10H), 3,00~3,20 (m, 2H), 2,90 (m, 1H), 2,76 (m, 2H), 2,00 (m, 1H), 1,50~1,75 (m, 7H), 1,16 (d, 1H, J=5,6 Гц), 1,24 (d, 2H, J=7,6 Гц), 1,15 (m, 1H), 0,94 (d, 3H, J=6,8 Гц), 0,85 (m, 6H).
, который применяли без дополнительной очистки. MS (m+1) = 1050,4, RT пика при HPLC=0,635 минуты, 1H-ЯМР (MeOD-d4, 400 МГц) δ 8,87 (m, 1H), 8,58 (d, 1H, J=2,4 Гц), 8,48 (d, 1H, J=10,4 Гц), 8,44 (d, 1H, J=1,6 Гц), 8,16 (d, 1H, J=8,4 Гц), 7,97 (d, 1H, J=9,6 Гц), 7,94 (d, 1H, J=9,2 Гц), 7,62 (d, 1H, J=8,8 Гц), 6,92 (d, 1H, J=9,2 Гц), 5,25 (m, 1H), 5,13 (m, 1H), 4,73 (m, 1H), 4,60 (dd, 1H, J=5,6 и 9,2 Гц), 4,49 (m, 2H), 4,28 (dd, 1H, J=8,8 и 18,4 Гц), 4,12 (m, 1H), 4,04 (d, 1H, J=13,2 Гц), 3,99 (s, 2H), 3,92 (m, 1H), 3,86 (s, 3H), 3,83 (s, 1H), 3,60~3,72 (m, 4H), 3,30~3,60 (m, 10H), 3,00~3,20 (m, 2H), 2,90 (m, 1H), 2,76 (m, 2H), 2,00 (m, 1H), 1,50~1,75 (m, 7H), 1,16 (d, 1H, J=5,6 Гц), 1,24 (d, 2H, J=7,6 Гц), 1,15 (m, 1H), 0,94 (d, 3H, J=6,8 Гц), 0,85 (m, 6H).
Стадия 3. Триэтиламин (3 мкл, 18 мкмоль) добавляли к раствору соединения (A-5) (7,5 мг, 7 мкмоль) и 4-нитрофенил-(23-(4-((2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)метил)-1H-1,2,3-триазол-1-ил)-3,6,9,12,15,18,21-гептаоксатрикозил)карбамата (5,0 мг, 7 мкмоль) в DMF (1 мл) и реакционную смесь перемешивали при rt в течение 2 ч, очищали посредством HPLC и лиофилизировали с получением 6'O-метил-7'C-((4-(3-(23-((4-малеимидо)метил-1H-1,2,3-триазол-1-ил)-3,6,9,12,15,18,21-гептаоксатрикозил)уреидо)бутилтио)метил)-α-аманитина (C6). MS (m+2/2) = 803,5, RT пика при HPLC=0,834 минуты, 1H-ЯМР (MeOD-d4, 400 МГц) δ 10,76 (s, 1H), 8,84 (m, 1H), 8,59 (d, 1H, J=2,0 Гц), 8,49 (s, 1H), 8,47 (d, 1H, J=8,0 Гц), 8,15 (d, 1H, J=8,4 Гц), 8,01 (d, 1H, J=9,6 Гц), 7,92 (d, 1H, J=8,8 Гц), 7,90 (s, 1H), 7,63 (d, 1H, J=8,8 Гц), 6,92 (d, 1H, J=9,2 Гц), 6,79 (s, 2H), 5,28 (m, 1H), 5,13 (m, 1H), 4,74 (m, 1H), 4,71 (s, 2H), 4,62 (dd, 1H, J=5,2 и 9,6 Гц), 4,49 (m, 4H), 4,30 (dd, 1H, J=8,8 и 18,4 Гц), 4,14 (m, 1H), 4,04 (d, 1H, J=13,2 Гц), 3,94 (d, 1H, J=13,2 Гц), 3,92 (m, 1H), 3,85 (s, 3H), 3,80 (t, 2H, J=4,8 Гц), 3,35~3,75 (m, 38H), 2,90~3,10 (m, 4H), 2,92 (m, 1H), 2,40 (m, 4H), 2,01 (m, 1H), 1,38~1,65 (m, 6H), 1,15 (m, 1H), 0,94 (d, 3H, J=6,8 Гц), 0,85 (m, 6H).
Пример 7. Синтез тетрафторфенилового сложного эфира 6'O-метил-7'C-((4-(3-(карбокси)пропанкарбоксамидо)бутилтио)метил)-α-аманитина (C7)
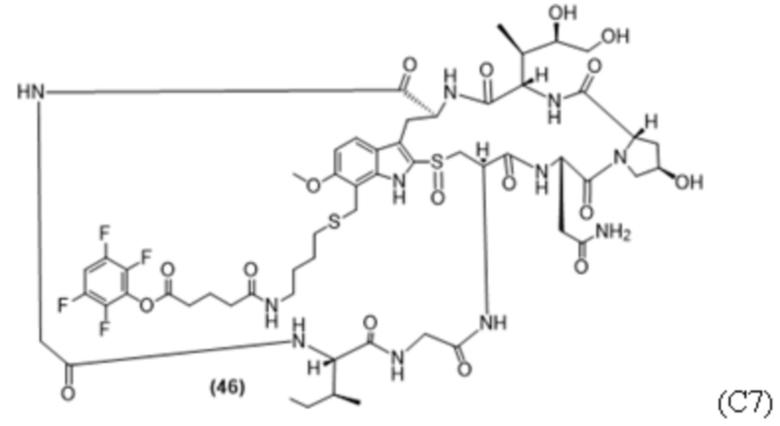
(A-5) (5 мг, 5 мкмоль) и DMF (1 мл) объединяли в 40-мл флаконе с получением прозрачного раствора. Добавляли бис(2,3,5,6-тетрафторфенил)глутарат (2 мг, 5 мкмоль) и DIEA (4 мкл, 20 мкмоль). После этого реакционную смесь перемешивали при rt в течение 2 ч, реакционную смесь очищали посредством HPLC с получением тетрафторфенилового сложного эфира 6'O-метил-7'C-((4-(3-(карбокси)пропанкарбоксамидо)бутилтио)метил)-α-аманитина (C-7). MS (m+1) = 1313,3, RT пика при HPLC=0,996 минуты, 1H-ЯМР (MeOD, 400 МГц) δ 10,78 (s, 1H), 8,85 (m, 1H), 8,59 (s, 1H), 8,49 (s, 1H), 8,47 (d, 1H, J=10,0 Гц), 8,35 (bs, 1H), 8,15 (d, 1H, J=8,0 Гц), 8,01 (d, 1H, J=9,6 Гц), 7,93 (d, 1H, J=8,8 Гц), 7,69 (bs, 1H), 7,63 (d, 1H, J=8,8 Гц), 7,36 (m, 1H), 6,92 (d, 1H, J=8,8 Гц), 5,27 (m, 1H), 5,14 (m, 1H), 4,75 (bs, 1H), 4,61 (dd, 1H, J=5,2 и 9,6 Гц), 4,51 (m, 2H), 4,30 (dd, 1H, J=8,4 и 18,0 Гц), 4,12 (m,1H), 4,00 (d, 1H, J=13,2 Гц), 3,95 (d, 1H, J=13,2 Гц), 3,91 (m, 1H), 3,85 (s, 3H), 3,34~3,70 (m, 9H), 3,08 (m, 4H), 2,91 (m, 1H), 2,73 (t, 2H, J=14,4 Гц), 1,98 (t, 2H, J=7,6 Гц), 1,92~2,04 (m, 1H), 1,40~1,60 (m, 6H), 1,16 (m, 1H), 0,94 (d, 3H, J=6,8 Гц), 0,87 (m, 6H).
Другие соединения формулы (A), формулы (B), формулы (A-1), формулы (A-2), формулы (A-3), формулы (B-1), формулы (A-1a), формулы (A-2a), формулы (A-3a) или формулы (B-1a) можно получать с применением способов из примеров 1-7 и подходящих исходных материалов.
Пример 8.Получение линкера-полезной нагрузки MPET.DM4
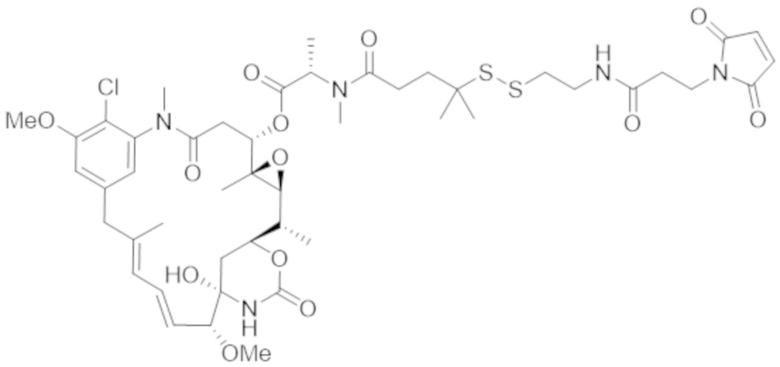
Аналитические способы
Если не указано иное, в Получении промежуточных соединений и Примерах применяли следующие способы HPLC и HPLC/MS.
Анализ LC/MS осуществляли на системе Agilent 1200sl/6140.
Колонка: Waters Acquity HSS T3 C18, 50×2,0, 1,8 мкм
Подвижная фаза: A) H2O+0,05% TFA; B: ацетонитрил+0,035% TFA
Параметры работы насоса:
Обнаружение: Диодно-матричный УФ-детектор при 190 нм - 400 нм
Сканирование при MS: 200-1350 amu
ELSD: 60°C
Параметры MS:
(14S,16S,32S,33S,2R,4S,10E,12E,14R)-86-хлор-14-гидрокси-85,14-диметокси-33,2,7,10-тетраметил-12,6-диоксо-7-аза-1(6,4)-оксазинана-3(2,3)-оксиранa-8(1,3)-бензолaциклотетрадекафан-10,12-диен-4-ил N-(4-((2-(3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропанамидо)этил)дисульфанил)-4-метилпентаноил)-N-метил-L-аланинат
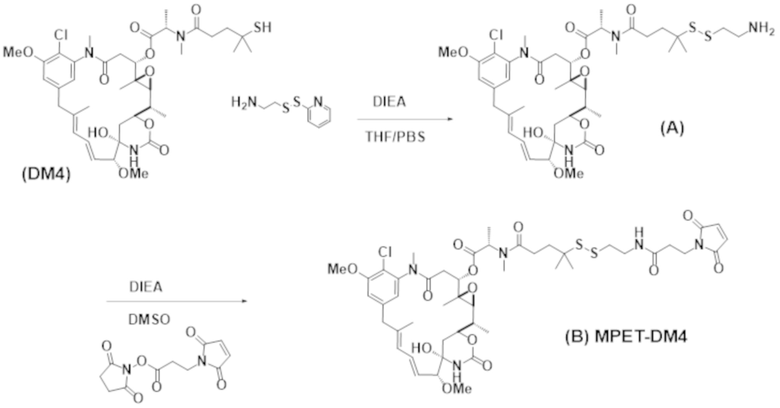
Стадия 1. Получение (14S,16S,32S,33S,2R,4S,10E,12E,14R)-86-хлор-14-гидрокси-85,14-диметокси-33,2,7,10-тетраметил-12,6-диоксо-7-аза-1(6,4)-оксазинана-3(2,3)-оксиранa-8(1,3)-бензолaциклотетрадекафан-10,12-диен-4-ил N-(4-((2-аминоэтил)дисульфанил)-4-метилпентаноил)-N-метил-L-аланината
К DM4 (480 мг, 0,62 ммоль), растворенному в PBS-буфере (10,5 мл) и безводном THF (21 мл), добавляли 2-(пиридин-2-илдисульфанил)этан-1-амин (151 мг, 0,68 ммоль) и DIEA (0,27 мл, 1,54 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин и концентрировали под вакуумом. Водный остаток разбавляли с помощью CH3CN (1 мл) и H2O (2 мл) и очищали посредством ISCO с обращенной фазой, элюировали с помощью 10-60% ацетонитрила в H2O, содержащей 0,05% TFA. Фракции, содержащие требуемый продукт, лиофилизировали с получением требуемого продукта (555 мг, выход 93%). 1H ЯМР (400 МГц, MeOD-d4) δ ppm 0,83 (s, 3 H) 1,21 (d, J=5,0 Гц, 3 H) 1,25 (s, 3 H) 1,28 (s, 3 H) 1,30 (d, J=5,0 Гц, 3 H) 1,45-1,55 (m, 3 H) 1,67 (s, 3 H) 1,84-1,88 (m, 1 H) 1,95-2,01 (m, 1 H) 2,14 (dd, J=5,0 и 15,0 Гц, 1 H) 2,37-2,43 (m, 1 H) 2,53-2,59 (m, 1 H) 2,64 (dd, J=10,0 и 15,0 Гц, 1 H) 2,82-2,89 (m, 5 H) 2,91 (d, J=10,0 Гц, 1 H) 3,16 (dd, J=5,0 и 10,0 Гц, 2 H) 3,20 (s, 3 H) 3,23 (d, J=10,0 Гц, 1 H) 3,35 (s, 3 H) 3,55 (d, J=5,0 Гц, 1 H) 3,58 (d, J=10,0 Гц, 1 H) 4,15-4,20 (m, 1 H) 4,64 (dd, J=5,0 и 10,0 Гц, 1 H) 5,43 (q, J=5,0 Гц, 2 H) 5,66 (dd, J=10,0 и 15,0 Гц, 1 H) ) 6,58 (dd, J=10,0 и 15,0 Гц, 1 H) 6,65 (d, J=10,0 Гц, 1 H) 6,66 (s, 1 H) 7,11 (bs, 1H) 7,28 (bs, 1H); MS масса/заряд 855,3 (M+H), Время удерживания 0,988 минуты.
Стадия 2. Получение (14S,16S,32S,33S,2R,4S,10E,12E,14R)-86-хлор-14-гидрокси-85,14-диметокси-33,2,7,10-тетраметил-12,6-диоксо-7-аза-1(6,4)-оксазинана-3(2,3)-оксиранa-8(1,3)-бензолaциклотетрадекафан-10,12-диен-4-ил N-(4-((2-(3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропанамидо)этил)дисульфанил)-4-метилпентаноил)-N-метил-L-аланината.
К (14S,16S,32S,33S,2R,4S,10E,12E,14R)-86-хлор-14-гидрокси-85,14-диметокси-33,2,7,10-тетраметил-12,6-диоксо-7-аза-1(6,4)-оксазинана-3(2,3)-оксиранa-8(1,3)-бензолaциклотетрадекафан-10,12-диен-4-ил N-(4-((2-аминоэтил)дисульфанил)-4-метилпентаноил)-N-метил-L-аланинату (555 мг, 0,57 ммоль), растворенному в безводном DMSO (7 мл), добавляли 2,5-диоксопирролидин-1-ил 3-(2,5-диоксо-2,5-дигидро-1H-пиррол-1-ил)пропаноат (171 мг, 0,63 ммоль) и DIEA (249 мл, 1,43 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 15 мин и нейтрализовали с применением TFA. Смесь охлаждали до 0°C с помощью бани со льдом, с последующим добавлением CH3CN (2 мл) и H2O (7 мл), а затем очищали посредством ISCO с обращенной фазой, элюируя с помощью 10-70% ацетонитрила в H2O, содержащей 0,05% TFA. Фракции, содержащие требуемый продукт, лиофилизировали с получением требуемого продукта (430 мг, выход 66%). 1H ЯМР (400 МГц, CDCl3) δ ppm 0,81 (s, 3 H) 1,23 (s, 3 H) 1,24 (s, 3 H) 1,25 (s, 1 H) 1,28 (d, J=5,0 Гц, 3 H) 1,31 (d, J=5,0 Гц, 3 H) 1,43-1,49 (m, 1 H) 1,61 (d, J=15,0 Гц, 1 H) 1,64 (s, 3 H) 1,81-1,87 (m, 1 H) 1,94-2,01 (m, 1 H) 2,19 (dd, J=5,0 и 15,0 Гц, 1 H) 2,30-2,36 (m, 1 H) 2,54 (t, J=5,0 Гц, 2 H) 2,61 (dd, J=10,0 и 15,0 Гц, 1 H) 2,70 (t, J=5,0 Гц, 2 H) 2,88 (s, 3 H) 3,00 (d, J=10,0 Гц, 1 H) 3,13 (d, J=10,0 Гц, 1 H) 3,21 (s, 3 H) 3,55 (s, 3 H) 3,45 (q, J=5,0 Гц, 2 H) 3,49 (d, J=5,0 Гц, 1 H) 3,62 (d, J=10,0 Гц, 1 H) 3,83 (t, J=5,0 Гц, 1 H) 3,98 (s, 3 H) 4,32 (m, 1 H) 4,8=5,0 и 10,0 Гц, 1 H) 5,28 (d, J=5,0 Гц, 1 H) 5,66 (dd, J=10,0 и 15,0 Гц, 1 H) ) 6,22 (bs, 1 H) 6,42 (dd, J=10,0 и 15,0 Гц, 1 H) 6,50 (s, 1 H) 6,63 (s, 1 H) 6,66 (d, J=10,0 Гц, 1 H) 6,70 (s, 2H) 6,83(s, 1H); MS масса/заряд 988,3 (M+H-H2O), Время удерживания 1,145 минуты.
3. Конъюгация и получение ADC
Способы получения конъюгата антитела формулы (I)
Общая схема реакции образования конъюгатов формулы (I) показана на схеме 1 ниже:
Схема 1

где: RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой реакционноспособной группой, RG2, присоединенной к фрагменту, представляющему собой линкер-лекарственное средство, обеспечивая тем самым ковалентную связь фрагмента антитела, A, с одним или несколькими фрагментами, представляющими собой линкер-лекарственное средство. Неограничивающими примерами таких реакций с участием групп RG1 и RG2 является малеимидная группа (RG2), реагирующая с тиольной группой (RG1) с получением сукцинимидного кольца, или гидроксиламинная группа (RG2), реагирующая с кетоновой группой (RG1) с получением оксима.
Общая схема реакции образования конъюгатов формулы (II) показана на схеме 2 ниже:
Схема 2
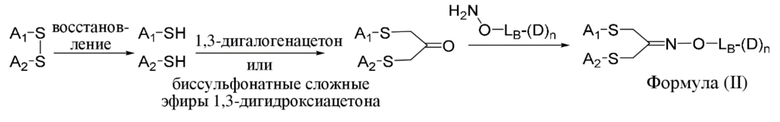
где: A1, A2, LB, D и n являются такими, как определено в данном документе, 1,3-дигалогенацетон выбран из 1,3-дихлорацетона, 1,3-дибромацетона и 1,3-дийодацетона, а стадия восстановления осуществляется с применением восстановителя, выбранного из дитиотреитола (DTT) и трис(2-карбоксиэтил)фосфина гидрохлорида (TCEP-HCl).
Общая схема реакции образования конъюгатов формулы (C) показана на схеме 3 ниже:
Схема 3
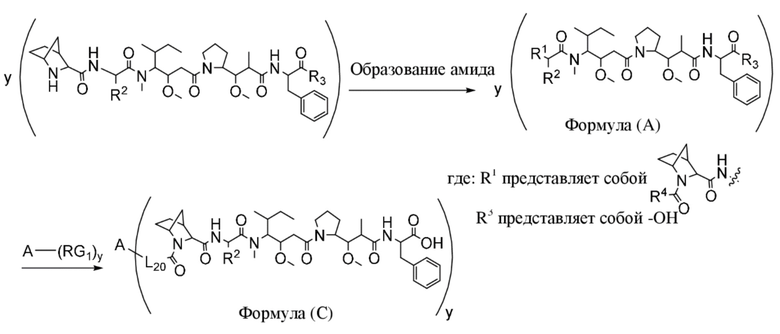 ,
,
где: L20 представляет собой -L1R40; R4 представляет собой -L1R14, -L2R24 или -L2R34, а RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14, R24 или R34 соединения формулы (A) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, R2, L1, L2, R14, R24, R34 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (C-1) показана на схеме 4 ниже:
Схема 4
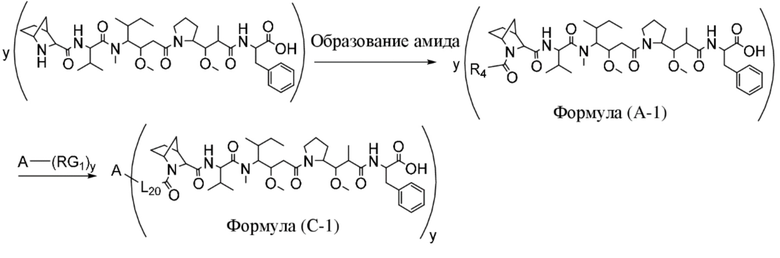 ,
,
где: L20 представляет собой -L1R40; R4 представляет собой -L1R14, -L2R24 или -L2R34, а RG1 представляет собой реакционноспособную группу, которая реагирует с совместимой группой R14, R24 или R34 соединения формулы (A-1) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, L1, L2, R14, R24, R34 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (C-1a) показана на схеме 5 ниже:
Схема 5
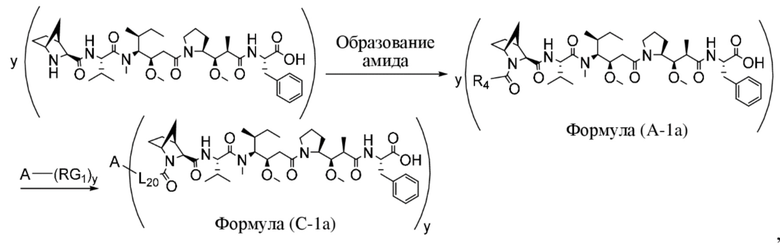 ,
,
где: L20 представляет собой -L1R40; R4 представляет собой -L1R14, -L2R24 или -L2R34 и RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14, R24 или R34 соединения формулы (A-1a) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, L1, L2, R14, R24, R34 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (D) показана на схеме 6 ниже:
Схема 6
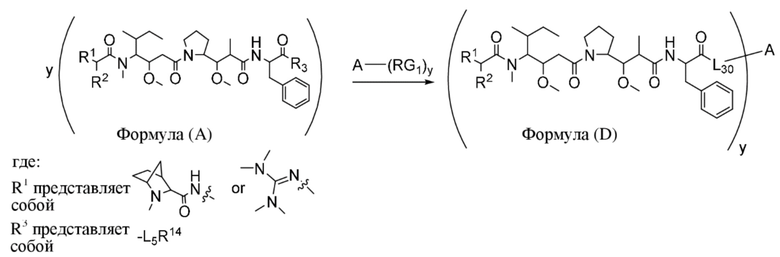 ,
,
где: L30 представляет собой -L5R40; R3 представляет собой -L5R14, а RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14 соединения формулы (A) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, R2, L5, R14 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (D-1) показана на схеме 7 ниже:
Схема 7
 ,
,
где: L30 представляет собой -L5R40, а RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14 соединения формулы (A-2) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, L5, R14 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (D-1a) показана на схеме 8 ниже:
Схема 8
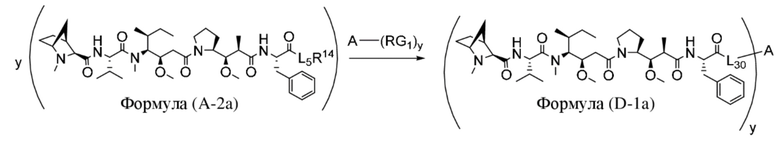 ,
,
где: L30 представляет собой -L5R40, а RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14 соединения формулы (A-2) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, L5, R14 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (D-2) показана на схеме 9 ниже:
Схема 9
 ,
,
где: L30 представляет собой -L5R40, а RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14 соединения формулы (A-3) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, L5, R14 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (D-2a) показана на схеме 10 ниже:
Схема 10
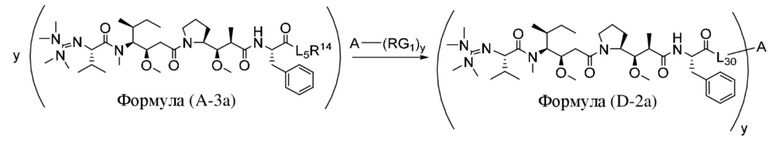 ,
,
где: L30 представляет собой -L5R40, а RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14 соединения формулы (A-3a) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, L5, R14 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (E) показана на схеме 11 ниже:
Схема 11
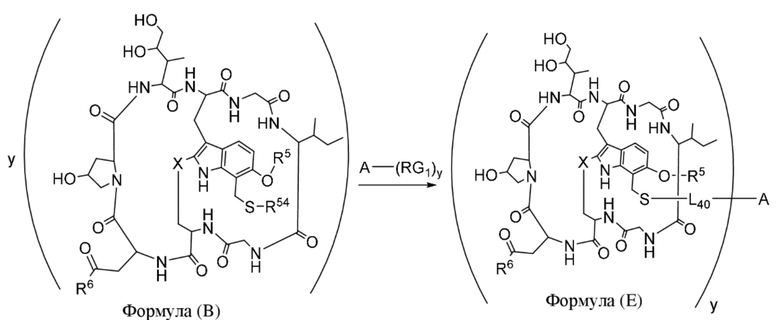 ,
,
где: L40 представляет собой -L6R40; R54 представляет собой -L6R14, -L7R24 или -L7R34 и RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14, R24 или R34 соединения формулы (B) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, X, R5, R6, L6, L7, R14, R24, R34 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (E-1) показана на схеме 12 ниже:
Схема 12
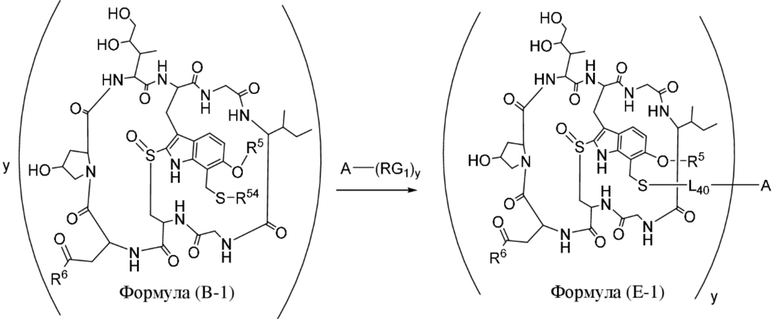 ,
,
где: L40 представляет собой -L6R40; R54 представляет собой -L6R14, -L7R24 или -L7R34 и RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14, R24 или R34 соединения формулы (B-1) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, y, R5, R6, L6, L7, R14, R24, R34 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов формулы (E-1a) показана на схеме 13 ниже:
Схема 13
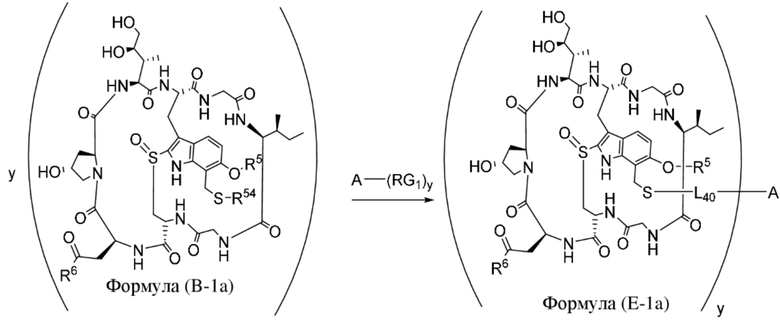 ,
,
где: L40 представляет собой -L6R40; R54 представляет собой -L6R14, -L7R24 или -L7R34 и RG1 представляет собой реакционноспособную группу, исключительно в качестве примера тиольную, или аминную, или кетоновую, которая реагирует с совместимой группой R14, R24 или R34 соединения формулы (B-1a) с образованием соответствующей группы R40. В качестве примера, малеимидная группа реагирует с тиольной с получением сукцинимидного кольца, или гидроксиламинная группа реагирует с кетоновой с получением оксима. A, y, R5, R6, L6, L7, R14, R24, R34 и R40 являются такими, как определено в данном документе.
Общая схема реакции образования конъюгатов, содержащих майтанзиноидный фрагмент, показана на схеме 14 ниже:
Схема 14
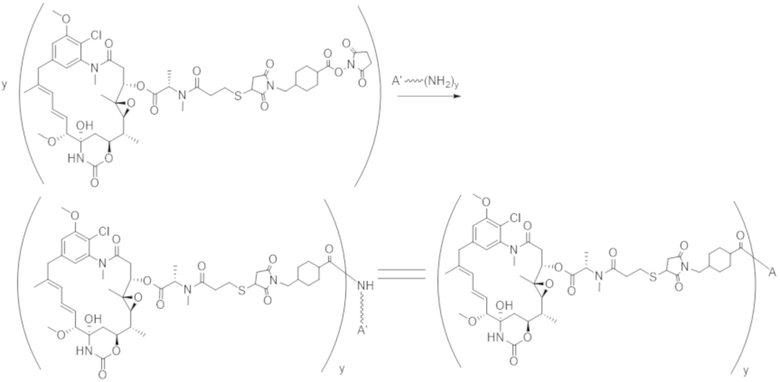 ,
,
где один или несколько NHS-сложных эфиров одного или нескольких линкеров-полезных нагрузок реагируют с одним или несколькими свободными аминами на A (т.е. (A'-(NH2)y), с образованием тем самым конъюгата. A является таким, как определено в данном документе, а A' представляет собой часть A, которая не содержит фрагмент, представляющий собой свободный амин.
Общая схема реакции образования конъюгатов, содержащих майтанзиноидный фрагмент, показана на схеме 15 ниже:
Схема 15
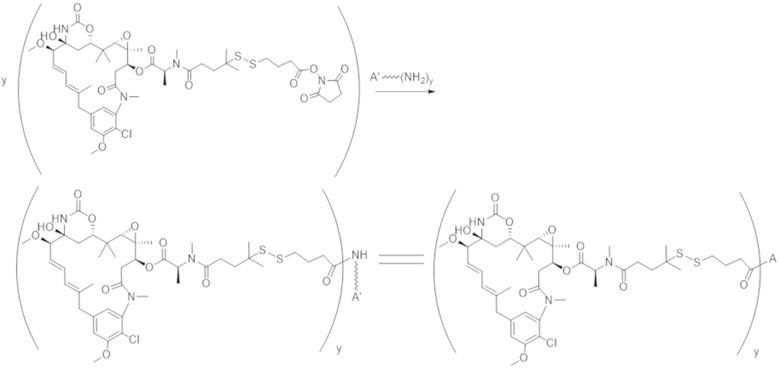 ,
,
где один или несколько NHS-сложных эфиров одного или нескольких линкеров-полезных нагрузок реагируют с одним или несколькими свободными аминами на A (т.е. (A'-(NH2)y), с образованием тем самым конъюгата. A является таким, как определено в данном документе, а A' представляет собой часть A, которая не содержит фрагмент, представляющий собой свободный амин.
Общая схема реакции образования конъюгатов, содержащих майтанзиноидный фрагмент, показана на схеме 16 ниже:
Схема 16
 ,
,
где один или несколько NHS-сложных эфиров одного или нескольких линкеров-полезных нагрузок реагируют с одним или несколькими свободными аминами на A (т.е. (A'-(NH2)y), с образованием тем самым конъюгата. A является таким, как определено в данном документе, а A' представляет собой часть A, которая не содержит фрагмент, представляющий собой свободный амин.
Общая схема реакции образования конъюгатов, содержащих майтанзиноидный фрагмент, показана на схеме 17 ниже:
Схема 17
 ,
,
где один или несколько малеимидов одного или нескольких линкеров-полезных нагрузок реагируют с одним или несколькими свободными тиолами на A (т.е. (A'-(SH)y), с образованием тем самым конъюгата. A является таким, как определено в данном документе, а A' представляет собой часть A, которая не содержит фрагмент, представляющий собой свободный тиол.
4. Определение характеристик и отбор требуемых ADC к cKIT
Определение DAR и агрегация ADC
Значение DAR ADC к cKIT оценивали посредством жидкостной хроматографии-масс-спектрометрии (LC-MS). Отношение соединения-к-антителу экстраполировали на основании данных LC-MS для восстановленных и дегликозилированных образцов (в соответствующих случаях, т.е. если включена Fc). LC-MS обеспечивает возможность получения количественной оценки среднего количества молекул линкер-полезная нагрузка (соединение), присоединенных к антителу в образце конъюгата.
Конъюгаты антитела и лекарственного средства по настоящему изобретению оценивали с применением аналитических способов. Такие аналитическая методология и результаты могут продемонстрировать, что конъюгаты обладают благоприятными свойствами, например, свойствами, которые смогут облегчить их изготовление, облегчить введение пациентам, сделают их более эффективными и/или потенциально более безопасными для пациентов. Одним примером является определение молекулярного размера посредством эксклюзионной хроматографии (SEC), где количество требуемых молекул антитела в образце определено относительно количества высокомолекулярных загрязнителей (например, димера, мультимера или агрегированного антитела) или низкомолекулярных загрязнителей (например, фрагментов антител, продуктов распада или отдельных цепей антитела), присутствующих в образце. Обычно, желательно, например, чтобы они имели более высокие количества мономера и более низкие количества агрегированного антитела, например, вследствие воздействия агрегатов на другие свойства образца антитела, такие как без ограничения скорость выведения, иммуногенность и токсичность. Дополнительным примером является определение гидрофобности посредством хроматографии гидрофобных взаимодействий (HIC), где гидрофобность образца оценивают относительно набора стандартных антител с известными свойствами. Обычно, желательно, чтобы они характеризовались низкой гидрофобностью, вследствие воздействия гидрофобности на другие свойства образца антитела, такие как без ограничения агрегация, агрегация с течением времени, прилипание к поверхности, гепатотоксичность, скорости выведения и фармакокинетический профиль. См. Damle, N.K., Nat Biotechnol. 2008; 26(8):884-885; Singh, S.K., Pharm Res. 2015; 32(11):3541-71.
Отбор ADC к cKIT
Для отбора ADC к cKIT, подходящих для применения в способах, описанных в данном документе, можно применять in vitro анализ цитолиза человеческих гемопоэтических стволовых клеток для проведения скрининга ADC к cKIT в отношении их эффективности и активности. Например, способы, описанные в примере 5, можно применять для проведения скрининга ADC к cKIT. Подходящие ADC к cKIT могут отбираться на основе EC50, например, ADC к cKIT с EC50, составляющей менее 500 мкг/мл, например, менее 100 мкг/мл, менее 50 мкг/мл, менее 10 мкг/мл или менее 5 мкг/мл.
Кроме того, сообщалось, что cKIT экспрессируется на мастоцитах, а фактор роста стволовых клеток (SCF), лиганд cKIT, индуцирует непосредственную дегрануляцию перитонеальных крысиных мастоцитов in vitro и in vivo (Taylor et al., Immunology. 1995 Nov;86(3):427-33). SCF также индуцирует дегрануляцию человеческих мастоцитов in vivo (Costa et al., J Exp Med. 1996; 183(6): 2681-6). Чтобы избежать потенциальных вредных эффектов, вызванных дегрануляцией мастоцитов у реципиентов трансплантации, отбираемые ADC к cKIT можно тестировать в отношении их способности индуцировать дегрануляцию мастоцитов in vitro. Например, эксперименты, описанные в примере 6, можно применять для проведения скрининга ADC к cKIT и подходящие ADC к cKIT можно отбирать на основании минимальной дегрануляции мастоцитов, например, скорректированной по исходному уровню регистрируемой величины O.D, составляющей менее 0,25, например, менее 0,2, менее 0,15 или менее 0,1, в анализе высвобождения бета-гексозаминидазы.
Антитело и фрагменты антител к cKIT
В настоящем изобретении предусмотрены антитела или фрагменты антител (например, антигенсвязывающие фрагменты), которые специфически связываются с cKIT человека. Антитела или фрагменты антител (например, антигенсвязывающие фрагменты) по настоящему изобретению включают без ограничения человеческие моноклональные антитела или их фрагменты, описанные ниже.
В некоторых вариантах осуществления раскрытые в настоящем изобретении антитела или фрагменты антител (например, антигенсвязывающие фрагменты) к cKIT характеризуются сниженной способностью вызывать дегрануляцию мастоцитов, даже будучи сшитыми и/или мультимеризованными в более крупные комплексы, в сравнении с полноразмерным антителом к cKIT. В некоторых вариантах осуществления антитела или фрагменты антител (например, антигенсвязывающие фрагменты) к cKIT, раскрытые в данном документе, модифицированы, чтобы характеризоваться сниженной способностью индуцировать дегрануляцию мастоцитов, даже будучи сшитыми и/или мулитимеризованными в более крупные комплексы. Например, антитела или фрагменты антител (например, антигенсвязывающие фрагменты) к cKIT, раскрытые в данном документе, модифицированы, чтобы характеризоваться сниженной способностью индуцировать дегрануляцию мастоцитов, даже будучи сшитыми и/или мультимеризованными в более крупные комплексы, то есть она снижена на приблизительно или по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% в сравнении с полноразмерным антителом или его фрагментом F(ab')2 или F(ab)2 к cKIT. В некоторых вариантах осуществления антитела или фрагменты антитела (например, антигенсвязывающие фрагменты) к cKIT, раскрытые в данном документе, могут содержать фрагмент Fab или Fab' к cKIT. В некоторых вариантах осуществления антитела или фрагменты антител (например, антигенсвязывающие фрагменты) к cKIT, раскрытые в данном документе, могут характеризоваться минимальной активностью индуцирования дегрануляции мастоцитов, например, скорректированной по исходному уровню регистрируемой величиной O.D., составляющей менее 0,25, например, менее 0,2, менее 0,15 или менее 0,1, в анализе высвобождения гексозаминидазы, даже будучи сшитыми и/или мультимеризованными в более крупные комплексы.
Конъюгаты антитела и лекарственного средства, предусмотренные в данном документе, включают фрагмент антитела (например, Fab или Fab'), связывающий cKIT человека. В некоторых вариантах осуществления конъюгаты антитела и лекарственного средства, предусмотренные в данном документе, включают фрагмент человеческого или гуманизированного антитела (например, Fab или Fab'), который специфически связывается с cKIT человека. В некоторых вариантах осуществления конъюгаты антитела и лекарственного средства, предусмотренные в данном документе, включают человеческий или гуманизированный Fab', который специфически связывается с cKIT человека. В некоторых вариантах осуществления конъюгаты антитела и лекарственного средства, предусмотренные в данном документе, включают человеческий или гуманизированный Fab, который специфически связывается с cKIT человека.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат домен VH, имеющий аминокислотную последовательность любого из доменов VH, описанных в таблице 1 (например, SEQ ID NO: 10, 36, 54, 69, 95). Другие подходящие антитело или фрагмент антитела (например, Fab или Fab') могут содержать домен VH, который характеризуется по меньшей мере 80, 85, 90, 95, 96, 97, 98, или 99 процентной идентичностью последовательности с любым из доменов VH, описанных в таблице 1.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат CDR VH (или HCDR), имеющую аминокислотную последовательность любой из CDR VH (или HCDR), перечисленных в таблице 1. В конкретных аспектах настоящего изобретения предусмотрены антитело или фрагмент антитела (например, Fab или Fab'), содержащие (или в качестве альтернативы состоящие из) один, два, три, четыре, пять или более CDR VH (или HCDR), имеющих аминокислотную последовательность любой из CDR VH (или HCDR), перечисленных в таблице 1.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат домен VL, имеющий аминокислотную последовательность любого из доменов VL, описанных в таблице 1 (например, SEQ ID NO: 23, 47, 82, 108). Другие подходящие антитело или фрагмент антитела (например, Fab или Fab') могут содержать домен VL, который характеризуется по меньшей мере 80, 85, 90, 95, 96, 97, 98, или 99 процентной идентичностью последовательности с любым из доменов VL, описанных в таблице 1.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат CDR VL (или LCDR), имеющую аминокислотную последовательность любой из CDR VL (или LCDR), перечисленных в таблице 1. В конкретных аспектах настоящего изобретения предусмотрены антитело или фрагмент антитела (например, Fab или Fab'), содержащие (или в качестве альтернативы состоящие из) один, два, три, четыре, пять или более CDR VL (или LCDR), имеющих аминокислотную последовательность любой из CDR VL (или LCDR), перечисленных в таблице 1.
Другие антитело или фрагмент антитела (например, Fab или Fab') к cKIT, раскрытые в данном документе, содержат аминокислоты, которые были подвергнуты мутации, но при этом они все еще характеризуются по меньшей мере 60, 70, 80, 90 или 95 процентной идентичностью последовательностей в областях CDR с областями CDR, отраженными в последовательностях, описанных в таблице 1. В некоторых аспектах они содержат мутантные аминокислотные последовательности, в которых не более 1, 2, 3, 4 или 5 аминокислот были подвергнуты мутации в областях CDR в сравнении с областями CDR, отраженными в последовательности, описанной в таблице 1.
В настоящем изобретении также предусмотрены последовательности нуклеиновой кислоты, которые кодируют VH, VL, тяжелую цепь и легкую цепь антитела или фрагмента антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека. Такие последовательности нуклеиновой кислоты могут быть оптимизированы для экспрессии в клетках млекопитающих.
Таблица 1. Последовательности иллюстративных антител и фрагментов антител к cKIT
Другие антитело или фрагмент антитела (например, Fab или Fab') к cKIT, раскрытые в данном документе, включают такие, в которых аминокислоты или нуклеиновые кислоты, кодирующие аминокислоты, были подвергнуты мутации, но при этом они все еще характеризуются по меньшей мере 60, 70, 80, 90 или 95 процентной идентичностью с последовательностями, описанными в таблице 1. В некоторых аспектах они охватывают мутантные аминокислотные последовательности, в которых не более 1, 2, 3, 4 или 5 аминокислот были подвергнуты мутации в вариабельных областях в сравнении с вариабельными областями CDR, отраженными в последовательности, описанной в таблице 1, при этом они сохраняют практически такую же терапевтическую активность.
Поскольку каждое из таких антитела или фрагмента антитела (например, Fab или Fab') может связываться с cKIT, последовательности VH, VL, тяжелой цепи и легкой цепи (аминокислотные последовательности и нуклеотидные последовательности, кодирующие аминокислотные последовательности) можно подвергать "смешиванию и подбору" для создания других антитела или фрагмента антитела (например, Fab или Fab'), связывающих cKIT. Такие подвергнутые "смешиванию и подбору" антитело или фрагмент антитела (например, Fab или Fab'), связывающие cKIT, можно тестировать с применением анализов связывания, известных из уровня техники (например, разновидностей ELISA и других анализов, описанных в разделе Примеры). Когда такие цепи подвергают смешиванию и подбору, последовательность VH из конкретной пары VH/VL следует заменить структурно подобной последовательностью VH. Аналогичным образом, последовательность тяжелой цепи из конкретной пары тяжелая цепь/легкая цепь следует заменить структурно подобной последовательностью тяжелой цепи. Аналогичным образом, последовательность VL из конкретной пары VH/VL следует заменить структурно подобной последовательностью VL. Аналогичным образом, последовательность легкой цепи из конкретной пары тяжелая цепь/легкая цепь следует заменить структурно подобной последовательностью легкой цепи.
Соответственно, в одном аспекте настоящего изобретения предусмотрены выделенное антитело или фрагмент антитела (например, Fab или Fab'), имеющие вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, 36, 54, 69 и 95 (таблица 1); и вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, 47, 82 и 108 (таблица 1); где антитело или фрагмент антитела (например, Fab или Fab') специфически связываются с cKIT человека.
В другом аспекте настоящего изобретения предусмотрено выделенное антитело, имеющее тяжелую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, 38, 56, 71 и 97; и легкую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 25, 49, 84 и 110.
В другом аспекте настоящего изобретения предусмотрен выделенный фрагмент антитела (например, Fab'), имеющий тяжелую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 14, 40, 58, 73 и 99; и легкую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 25, 49, 84 и 110.
В другом аспекте настоящего изобретения предусмотрены антитело или фрагмент антитела (например, Fab или Fab'), связывающие cKIT, которые содержат CDR1, CDR2 и CDR3 тяжелой цепи и легкой цепи, описанные в таблице 1, или их комбинации. Аминокислотные последовательности CDR1 VH (или HCDR1) антител или фрагментов антител (например, Fab или Fab') показаны под SEQ ID NO: 1, 4, 6, 7, 27, 30, 32, 33, 60, 63, 65, 66, 86, 89, 91 и 92. Аминокислотные последовательности CDR2 VH (или HCDR2) антител или фрагментов антител (например, Fab или Fab') и показаны под SEQ ID NO: 2, 5, 8, 28, 31, 34, 51, 52, 53, 61, 64, 67, 87, 90 и 93. Аминокислотные последовательности CDR3 VH (или HCDR3) антител или фрагментов антител (например, Fab или Fab') показаны под SEQ ID NO: 3, 9, 29, 35, 62, 68, 88 и 94. Аминокислотные последовательности CDR1 VL (или LCDR1) антител или фрагментов антител (например, Fab или Fab') показаны под SEQ ID NO: 16, 19, 22, 42, 44, 46, 75, 78, 81, 101, 104 и 107. Аминокислотные последовательности CDR2 VL (или LCDR2) антител или фрагментов антител (например, Fab или Fab') показаны под SEQ ID NO: 17, 20, 76, 79, 102 и 105. Аминокислотные последовательности CDR3 VL (или LCDR3) антител или фрагментов антител (например, Fab или Fab') показаны под SEQ ID NO: 18, 21, 43, 45, 77, 80, 103 и 106.
С учетом того, что каждое из таких антител или фрагментов антител (например, Fab или Fab') может связываться с cKIT человека, и что специфичность связывания с антигеном обеспечивается, в первую очередь, областями CDR1, 2 и 3, последовательности CDR1, 2 и 3 VH (или HCDR1, 2, 3) и последовательности CDR1, 2 и 3 VL (или LCDR1, 2, 3) можно подвергать "смешиванию и подбору" (т.е. CDR из различных антител можно подвергать смешиванию и подбору, хотя каждое антитело должно содержать CDR1, 2 и 3 VH и CDR1, 2 и 3 VL для создания антитела или фрагмента антитела (например, Fab или Fab'), связывающих cKIT. Такие подвергнутые "смешиванию и подбору" антитело или фрагмент антитела (например, Fab или Fab'), связывающие cKIT, можно тестировать с применением анализов связывания, известных из уровня техники. Когда последовательности CDR VH подвергают смешиванию и подбору, последовательность CDR1, CDR2 и/или CDR3 из конкретной последовательности VH следует заменить структурно подобной(-ыми) последовательностью(-ими) CDR. Аналогичным образом, когда последовательности CDR VL подвергают смешиванию и подбору, последовательность CDR1, CDR2 и/или CDR3 из конкретной последовательности VL следует заменить структурно подобной(-ыми) последовательностью(-ями) CDR. Рядовому специалисту в данной области техники будет совершенно очевидно, что новые последовательности VH и VL можно создавать путем замены одной или нескольких последовательностей областей CDR VH и/или VL структурно подобными последовательностями из последовательностей CDR, показанных в данном документе.
Соответственно в настоящем изобретении предусмотрены выделенные антитело или фрагмент антитела (например, Fab или Fab'), содержащие CDR1 тяжелой цепи (HCDR1), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 4, 6, 7, 27, 30, 32, 33, 60, 63, 65, 66, 86, 89, 91 и 92; CDR2 тяжелой цепи (HCDR2), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 5, 8, 28, 31, 34, 51, 52, 53, 61, 64, 67, 87, 90 и 93; CDR3 тяжелой цепи (HCDR3), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 3, 9, 29, 35, 62, 68, 88 и 94; CDR1 легкой цепи (LCDR1), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 16, 19, 22, 42, 44, 46, 75, 78, 81, 101, 104 и 107; CDR2 легкой цепи (LCDR2), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 17, 20, 76, 79, 102 и 105; и CDR3 легкой цепи (LCDR3), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 18, 21, 43, 45, 77, 80, 103 и 106; где антитело специфически связывает cKIT.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 1, HCDR2 под SEQ ID NO: 2; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:16; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 4, HCDR2 под SEQ ID NO: 5; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:19; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 21.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 6, HCDR2 под SEQ ID NO: 2; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:16; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 7, HCDR2 под SEQ ID NO: 8; HCDR3 под SEQ ID NO: 9; LCDR1 под SEQ ID NO: 22; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 27, HCDR2 под SEQ ID NO: 28; HCDR3 под SEQ ID NO: 29; LCDR1 под SEQ ID NO: 42; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 43.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 30, HCDR2 под SEQ ID NO: 31; HCDR3 под SEQ ID NO: 29; LCDR1 под SEQ ID NO: 44; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 45.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 32, HCDR2 под SEQ ID NO: 28; HCDR3 под SEQ ID NO: 29; LCDR1 под SEQ ID NO: 42; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 43.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 33, HCDR2 под SEQ ID NO: 34; HCDR3 под SEQ ID NO: 35; LCDR1 под SEQ ID NO: 46; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 43.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 1, HCDR2 под SEQ ID NO: 51; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:16; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 4, HCDR2 под SEQ ID NO: 52; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:19; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 21.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 6, HCDR2 под SEQ ID NO: 51; HCDR3 под SEQ ID NO: 3; LCDR1 под SEQ ID NO:16; LCDR2 под SEQ ID NO: 17 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 7, HCDR2 под SEQ ID NO: 53; HCDR3 под SEQ ID NO: 9; LCDR1 под SEQ ID NO: 22; LCDR2 под SEQ ID NO: 20 и LCDR3 под SEQ ID NO: 18.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 60, HCDR2 под SEQ ID NO: 61; HCDR3 под SEQ ID NO: 62; LCDR1 под SEQ ID NO: 75; LCDR2 под SEQ ID NO: 76 и LCDR3 под SEQ ID NO: 77.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 63, HCDR2 под SEQ ID NO: 64; HCDR3 под SEQ ID NO: 62; LCDR1 под SEQ ID NO: 78; LCDR2 под SEQ ID NO: 79 и LCDR3 под SEQ ID NO: 80.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 65, HCDR2 под SEQ ID NO: 61; HCDR3 под SEQ ID NO: 62; LCDR1 под SEQ ID NO:75; LCDR2 под SEQ ID NO: 76 и LCDR3 под SEQ ID NO: 77.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 66, HCDR2 под SEQ ID NO: 67; HCDR3 под SEQ ID NO: 68; LCDR1 под SEQ ID NO: 81; LCDR2 под SEQ ID NO: 79 и LCDR3 под SEQ ID NO: 77.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 86, HCDR2 под SEQ ID NO: 87; HCDR3 под SEQ ID NO: 88; LCDR1 под SEQ ID NO: 101; LCDR2 под SEQ ID NO: 102 и LCDR3 под SEQ ID NO: 103.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 89, HCDR2 под SEQ ID NO: 90; HCDR3 под SEQ ID NO: 88; LCDR1 под SEQ ID NO: 104; LCDR2 под SEQ ID NO: 105 и LCDR3 под SEQ ID NO: 106.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 91, HCDR2 под SEQ ID NO: 87; HCDR3 под SEQ ID NO: 88; LCDR1 под SEQ ID NO: 101; LCDR2 под SEQ ID NO: 102 и LCDR3 под SEQ ID NO: 103.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат HCDR1 под SEQ ID NO: 92, HCDR2 под SEQ ID NO: 93; HCDR3 под SEQ ID NO: 94; LCDR1 под SEQ ID NO: 107; LCDR2 под SEQ ID NO: 105 и LCDR3 под SEQ ID NO: 103.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность под SEQ ID NO: 10, и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность под SEQ ID NO: 23.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат VH, содержащую аминокислотную последовательность под SEQ ID NO: 36, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 47.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат VH, содержащую аминокислотную последовательность под SEQ ID NO: 54, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 23.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат VH, содержащую аминокислотную последовательность под SEQ ID NO: 69, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 82.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, содержат VH, содержащую аминокислотную последовательность под SEQ ID NO: 95, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 108.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 14, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 40, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 49.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 58, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 73, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 84.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 99, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 110.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 119, 120 или 121, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 125, 126 или 127, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 49.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 131, 132 или 133, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 137, 138 или 139, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 84.
В некоторых вариантах осуществления фрагмент антитела (например, Fab'), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из SEQ ID NO: 142, 143 или 144, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 110.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 12, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 38, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 49.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 56, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 71, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 84.
В некоторых вариантах осуществления антитело, которое специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 97, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 110.
В определенных аспектах антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с cKIT человека, представляют собой антитело или фрагмент антитела (например, Fab или Fab'), описанные в таблице 1.
1. Антитела, которые связываются с одним и тем же эпитопом
В настоящем изобретении предусмотрены антитело или фрагмент антитела (например, Fab или Fab'), которые специфически связываются с эпитопом в пределах внеклеточного домена рецепторной cKIT человека. В определенных аспектах антитело или фрагмент антитела (например, Fab или Fab') могут связываться с эпитопом в пределах доменов 1-3 внеклеточного домена cKIT человека.
В настоящем изобретении также предусмотрены антитело или фрагмент антитела (например, Fab или Fab'), которые связываются с тем же эпитопом, что и антитело или фрагмент антитела (например, Fab или Fab') к cKIT, описанные в таблице 1. Следовательно, дополнительные антитело или фрагмент антитела (например, Fab или Fab') можно идентифицировать на основании их способности к перекрестной конкуренции (например, к конкурентному ингибированию связывания, статистически значимым образом) с другим антителом или фрагментом антитела (например, Fab или Fab') в анализах связывания cKIT. Высокопроизводительный способ "сортировки" антител на основании их перекрестной конкуренции описан в международной заявке на патент № WO 2003/48731. Способность тестируемых антитела или фрагмента антитела (например, Fab или Fab') ингибировать связывание антитела или фрагмента антитела (например, Fab или Fab'), раскрытых в данном документе, с белком cKIT (например, cKIT человека) демонстрирует, что тестируемые антитело или фрагмент антитела (например, Fab или Fab') могут конкурировать с данными антителом или фрагментом антитела (например, Fab или Fab') за связывании с cKIT; при этом, согласно неограничивающей теории, такие антитело или фрагмент антитела (например, Fab или Fab') могут связываться с одним и тем же или родственным (например, структурно подобным или пространственно близким) эпитопом на белке cKIT, что и антитело или фрагмент антитела (например, Fab или Fab'), с которыми они конкурируют. В определенном аспекте антитело или фрагмент антитела (например, Fab или Fab'), которые связываются с тем же эпитопом на cKIT, что и антитело или фрагмент антитела (например, Fab или Fab'), раскрытые в данном документе, представляют собой человеческие или гуманизированные антитело или фрагмент антитела (например, Fab или Fab'). Такие человеческие или гуманизированные антитело или фрагмент антитела (например, Fab или Fab') могут быть получены и выделены, как описано в данном документе.
2. Модификация каркасной области
Конъюгаты антитела и лекарственного средства, раскрытые в данном документе, могут содержать модифицированные антитело или фрагмент антитела (например, Fab или Fab'), связывающие cKIT, которые содержат модификации каркасных остатков в пределах VH и/или VL, например, для улучшения свойств конъюгата антитела и лекарственного средства.
В некоторых вариантах осуществления модификации каркасной области осуществляют для снижения иммуногенности антитела или конъюгата антитела и лекарственного средства. Например, один подход заключается в том, что один или несколько каркасных остатков "мутируют к первоначальному виду" в направлении соответствующей последовательности зародышевой линии. Такие остатки могут быть идентифицированы посредством сравнения каркасных последовательностей антитела с последовательностями зародышевой линии, из которых происходит антитело. Чтобы последовательности каркасной области "соответствовали" требуемой конфигурации зародышевой линии, остатки могут быть "мутированы к первоначальному виду" в направлении соответствующей последовательности зародышевой линии, например, посредством сайт-направленного мутагенеза. Подразумевается, что такие подвергнутые "мутации к первоначальному виду" антитела или конъюгаты антитела и лекарственного средства также охватываются настоящим изобретением.
Другой тип модификации каркасной области предусматривает мутацию одного или нескольких остатков в пределах каркасной области или даже в пределах одной или нескольких областей CDR, чтобы удалить T-клеточные эпитопы, со снижением тем самым потенциальной иммуногенности антитела или конъюгата антитела и лекарственного средства. Данный подход также называют "деиммунизацией", и он более подробно описан в публикации заявки на патент США № 2003/0153043 от Carr et al.
В качестве дополнения или альтернативы модификациям, осуществляемым в пределах каркасных областей или областей CDR, антитела можно конструировать таким образом, чтобы изменить одно или несколько функциональных свойств антитела, таких как период полувыведения из сыворотки крови, фиксация комплемента. Кроме того, антитело может быть модифицировано химически (например, к антителу можно присоединять один или несколько химических фрагментов), или оно может быть модифицировано для изменения характера его гликозилирования, чтобы, опять-таки, изменить одно или несколько функциональных свойств антитела. Каждый из таких аспектов более подробно описан ниже.
В одном аспекте шарнирную область CH1 модифицируют таким образом, что меняется количество цистеиновых остатков в шарнирной области, например, увеличивается или уменьшается. Данный подход дополнительно описан в патенте США № 5677425 от Bodmer et al. Количество цистеиновых остатков шарнирной области CH1 изменяют, например, чтобы облегчить сборку легкой и тяжелой цепей, чтобы увеличить или уменьшить стабильность антитела, или чтобы обеспечить возможность конъюгации с другой молекулой.
В некоторых вариантах осуществления антитело или фрагмент антитела (например, Fab или Fab'), раскрытые в данном документе, содержат модифицированные или введенные путем конструирования аминокислотные остатки, например, один или несколько цистеиновых остатков, в качестве сайтов для конъюгации с фрагментом, представляющим собой лекарственное средство (Junutula JR, et al.: Nat Biotechnol 2008, 26:925-932). В одном варианте осуществления настоящего изобретения предусмотрены модифицированные антитело или фрагмент антитела (например, Fab или Fab'), содержащие замену одной или нескольких аминокислот на цистеин в положениях, описанных в данном документе. Сайты для цистеиновой замены расположены в константных областях антитела или фрагмента антитела (например, Fab или Fab') и, таким образом, применимы к множеству антител или фрагментов антител (например, Fab или Fab'), и сайты выбирают для обеспечения устойчивых и однородных конъюгатов. Модифицированные антитело или фрагмент могут иметь одну, две или более цистеиновых замен, и такие замены могут применяться в комбинации с другими способами модификации и конъюгации, описанными в данном документе. Способы для вставки цистеина в специфические местоположения антитела известны из уровня техники, см., например, Lyons et al, (1990) Protein Eng., 3:703-708, WO 2011/005481, WO2014/124316, WO 2015/138615. В некоторых вариантах осуществления модифицированное антитело содержит замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 117, 119, 121, 124, 139, 152, 153, 155, 157, 164, 169, 171, 174, 189, 191, 195, 197, 205, 207, 246, 258, 269, 274, 286, 288, 290, 292, 293, 320, 322, 326, 333, 334, 335, 337, 344, 355, 360, 375, 382, 390, 392, 398, 400 и 422 тяжелой цепи антитела, и где нумерация положений соответствует системе EU. В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab или Fab') содержит замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 121, 124, 152, 153, 155, 157, 164, 169, 171, 174, 189 и 207 тяжелой цепи фрагмента антитела (например, Fab или Fab'), и где нумерация положений соответствует системе EU. В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab или Fab') содержит замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 124, 152, 153, 155, 157, 164, 174, 189 и 207 тяжелой цепи фрагмента антитела (например, Fab или Fab'), и где нумерация положений соответствует системе EU.
В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 107, 108, 109, 114, 126, 127, 129, 142, 143, 145, 152, 154, 156, 157, 159, 161, 165, 168, 169, 170, 182, 183, 188, 197, 199, и 203 легкой цепи антитела или фрагмента антитела (например, Fab или Fab'), где нумерация положений соответствует системе EU, и где легкая цепь представляет собой человеческую легкую каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 107, 108, 114, 126, 127, 129, 142, 159, 161, 165, 183 и 203 легкой цепи антитела или фрагмента антитела (например, Fab или Fab'), где нумерация положений соответствует системе EU, и где легкая цепь представляет собой человеческую легкую каппа-цепь. . В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 114, 129, 142, 145, 152, 159, 161, 165 и 197 легкой цепи антитела или фрагмента антитела (например, Fab или Fab'), где нумерация положений соответствует системе EU, и где легкая цепь представляет собой человеческую легкую каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 107, 108, 109, 126, 143, 145, 152, 154, 156, 157, 159, 182, 183, 188, 197, 199 и 203 легкой цепи антитела или фрагмента антитела (например, Fab или Fab'), где нумерация положений соответствует системе EU, и где легкая цепь представляет собой человеческую легкую каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 145, 152 и 197 легкой цепи антитела или фрагмента антитела (например, Fab или Fab'), где нумерация положений соответствует системе EU, и где легкая цепь представляет собой человеческую легкую каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 114 и 165 легкой цепи антитела или фрагмента антитела (например, Fab или Fab'), где нумерация положений соответствует системе EU, и где легкая цепь представляет собой человеческую легкую каппа-цепь.
В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат замену одной или нескольких аминокислот на цистеин в своей константной области в положении, выбранном из 143, 145, 147, 156, 159, 163, 168 легкой цепи антитела или фрагмента антитела (например, Fab или Fab'), где нумерация положений соответствует системе EU, и где легкая цепь представляет собой человеческую легкую каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в положении 143 (согласно нумерации EU) легкой цепи антитела или фрагмента антитела (например, Fab или Fab'), где легкая цепь представляет собой человеческую легкую лямбда-цепь.
В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат комбинацию из замен двух или более аминокислот на цистеин в своих константных областях, и комбинация положений может быть выбрана из любого из положений, перечисленных выше.
В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в одном или нескольких из следующих положений: положение 124 тяжелой цепи, положение 152 тяжелой цепи, положение 153 тяжелой цепи, положение 155 тяжелой цепи, положение 157 тяжелой цепи, положение 164 тяжелой цепи, положение 174 тяжелой цепи, положение 114 легкой цепи, положение 129 легкой цепи, положение 142 легкой цепи, положение 159 легкой цепи, положение 161 легкой цепи или положение 165 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в четырех из следующих положений: положение 124 тяжелой цепи, положение 152 тяжелой цепи, положение 153 тяжелой цепи, положение 155 тяжелой цепи, положение 157 тяжелой цепи, положение 164 тяжелой цепи, положение 174 тяжелой цепи, положение 114 легкой цепи, положение 129 легкой цепи, положение 142 легкой цепи, положение 159 легкой цепи, положение 161 легкой цепи или положение 165 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь.
В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в положении 152 тяжелой цепи, где нумерация положений соответствует системе EU. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в положении 124 тяжелой цепи, где нумерация положений соответствует системе EU. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в положении 165 легкой цепи, где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в положении 114 легкой цепи, где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в положении 143 легкой цепи, где нумерация положений соответствует системе EU, и где легкая цепь представляет собой лямбда-цепь.
В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеины в положении 152 тяжелой цепи и положении 165 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеины в положении 152 тяжелой цепи и положении 114 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеины в положении 152 тяжелой цепи и положении 143 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой лямбда-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеины в положении 124 и положении 152 тяжелой цепи, и где нумерация положений соответствует системе EU.
В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в одном или нескольких из следующих положений: положение 155 тяжелой цепи, положение 189 тяжелой цепи, положение 207 тяжелой цепи, положение 145 легкой цепи, положение 152 легкой цепи или положение 197 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в двух или более (например, 2, 3, 4) из следующих положений: положение 155 тяжелой цепи, положение 189 тяжелой цепи, положение 207 тяжелой цепи, положение 145 легкой цепи, положение 152 легкой цепи или положение 197 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь.
В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в одном или нескольких из следующих положений: положение 124 тяжелой цепи, положение 152 тяжелой цепи, положение 153 тяжелой цепи, положение 155 тяжелой цепи, положение 157 тяжелой цепи, положение 164 тяжелой цепи, положение 174 тяжелой цепи, положение 114 легкой цепи, положение 129 легкой цепи, положение 142 легкой цепи, положение 159 легкой цепи, положение 161 легкой цепи или положение 165 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь. В некоторых вариантах осуществления модифицированные антитело или фрагмент антитела (например, Fab или Fab') содержат цистеин в двух или более (например, 2, 3, 4) из следующих положений: положение 124 тяжелой цепи, положение 152 тяжелой цепи, положение 153 тяжелой цепи, положение 155 тяжелой цепи, положение 157 тяжелой цепи, положение 164 тяжелой цепи, положение 174 тяжелой цепи, положение 114 легкой цепи, положение 129 легкой цепи, положение 142 легкой цепи, положение 159 легкой цепи, положение 161 легкой цепи или положение 165 легкой цепи, и где нумерация положений соответствует системе EU, и где легкая цепь представляет собой каппа-цепь.
В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 118, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 122.
В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 118, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 123.
В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 124, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 128.
В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 124, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 129.
В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 130, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 134.
В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 130, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 135.
В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 136, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 140.
В некоторых вариантах осуществления модифицированный фрагмент антитела (например, Fab), который специфически связывается с cKIT человека, содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 141, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 145.
3. Получение антител или фрагментов антител к cKIT
Антитело или фрагмент антитела (например, Fab или Fab') к cKIT можно получать с помощью любых средств, известных из уровня техники, в том числе без ограничения рекомбинантной экспрессии, химического синтеза или ферментативного расщепления полноразмерных моноклональных антител, которые могут быть получены например, с помощью гибридомы или рекомбинантного получения. Рекомбинантная экспрессия может происходить в любых подходящих клетках-хозяевах, известных из уровня техники, например, клетках-хозяевах, представляющих собой клетки млекопитающих, бактериальных клетках-хозяевах, дрожжевых клетках-хозяевах, клетках-хозяевах, представляющих собой клетки насекомых, или выполняться в бесклеточной системе (например, платформа Sutro's Xpress CF™, http://www.sutrobio.com/technology/).
В настоящем изобретении дополнительно предусмотрены полинуклеотиды, кодирующие антитело или фрагмент антитела (например, Fab или Fab'), описанные в данном документе, например, полинуклеотиды, кодирующие вариабельные области или сегменты тяжелой или легкой цепей, содержащие определяющие комплементарность области, описанные в данном документе. В некоторых аспектах полинуклеотид, кодирующий вариабельные области тяжелой цепи (VH), характеризуется по меньшей мере 85%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, идентичностью последовательности нуклеиновой кислоты с полинуклеотидом, выбранным из группы, состоящей из SEQ ID NO: 11, 37, 55, 70 и 96. В некоторых аспектах полинуклеотид, кодирующий вариабельные области легкой цепи (VL), характеризуется по меньшей мере 85%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичностью последовательности нуклеиновой кислоты с полинуклеотидом, выбранным из группы, состоящей из SEQ ID NO: 24, 48, 83 и 109.
В некоторых аспектах полинуклеотид, кодирующий тяжелую цепь антитела, характеризуется по меньшей мере 85%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичностью последовательности нуклеиновой кислоты с полинуклеотидом под SEQ ID NO: 13, 39, 57, 72 и 98. В некоторых аспектах полинуклеотид, кодирующий легкую цепь антитела, характеризуется по меньшей мере 85%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичностью последовательности нуклеиновой кислоты с полинуклеотидом под SEQ ID NO: 26, 50, 85 и 111.
В некоторых аспектах полинуклеотид, кодирующий тяжелую цепь Fab', характеризуется по меньшей мере 85%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности нуклеиновой кислоты с полинуклеотидом под SEQ ID NO: 15, 41, 59, 74 и 100. В некоторых аспектах полинуклеотид, кодирующий легкую цепь Fab', характеризуется по меньшей мере 85%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентичностью последовательности нуклеиновой кислоты с полинуклеотидом под SEQ ID NO: 26, 50, 85 и 111.
Полинуклеотиды по настоящему изобретению могут кодировать только последовательность вариабельной области антитела или фрагмента антитела (например, Fab или Fab') к cKIT. Они также могут кодировать как вариабельную область, так и константную область антитела или фрагмента антитела (например, Fab или Fab'). Некоторые из полинуклеотидных последовательностей кодируют полипептид, который содержит вариабельные области как тяжелой цепи, так и легкой цепи одного из иллюстративных антитела или фрагмента антитела (например, Fab или Fab') к cKIT.
Полинуклеотидные последовательности можно получать с помощью твердофазного синтеза ДНК de novo или с помощью ПЦР-мутагенеза существующей последовательности (например, последовательностей, которые описаны в Примерах ниже), кодирующей антитело к cKIT или его связывающий фрагмент. Прямой химический синтез нуклеиновых кислот можно осуществлять с помощью способов, известных из уровня техники, таких как фосфотриэфирный способ из Narang et al., Meth. Enzymol. 68:90, 1979; фосфодиэфирный способ из Brown et al., Meth. Enzymol. 68:109, 1979; диэтилфосфорамидитный способ из Beaucage et al., Tetra Lett., 22:1859, 1981; и способ с использованием твердой подложки из патента США № 4458066. Введение мутаций в полинуклеотидную последовательность с помощью ПЦР можно осуществлять, как описано, например, в PCR Technology: Principles and Applications for DNA Amplification, H.A. Erlich (Ed.), Freeman Press, NY, NY, 1992; PCR Protocols: A Guide to Methods and Applications, Innis et al. (Ed.), Academic Press, San Diego, CA, 1990; Mattila et al., Nucleic Acids Res. 19:967, 1991; и Eckert et al., PCR Methods and Applications 1:17, 1991.
Также в настоящем изобретении предусмотрены векторы экспрессии и клетки-хозяева для получения антитела или фрагмента антитела (например, Fab или Fab') к cKIT, описанных выше. Различные векторы экспрессии могут использоваться для экспрессии полинуклеотидов, кодирующих антитело или фрагмент антитела (например, Fab или Fab') к cKIT. Как вирусные, так и невирусные векторы экспрессии можно применять для получения антител в клетке-хозяине, представляющей собой клетку млекопитающего. Невирусные векторы и системы включают плазмиды, эписомные векторы, как правило, с кассетой экспрессии для экспрессии белка или РНК, а также искусственные человеческие хромосомы (см., например, Harrington et al., Nat Genet. 15:345, 1997). Например, невирусные векторы, применимые для экспрессии полинуклеотидов и полипептидов, связывающих cKIT, в клетках млекопитающих (например, человеческих), включают pThioHis A, B и C, pcDNA3.1/His, pEBVHis A, B и C (Invitrogen, Сан-Диего, Калифорния), векторы MPSV и многочисленные другие векторы, известные из уровня техники для экспрессии других белков. Применимые вирусные векторы включают векторы на основе ретровирусов, аденовирусов, аденоассоциированных вирусов, вирусов герпеса, векторы на основе SV40, папилломавируса, вируса Эпштейна-Барр HBP, векторы на основе вируса коровьей оспы и вируса леса Семлики (SFV). См., Brent et al., выше; Smith, Annu. Rev. Microbiol. 49:807, 1995; и Rosenfeld et al., Cell 68:143, 1992.
Выбор вектора экспрессии зависит от предполагаемых клеток-хозяев, в которых следует экспрессировать вектор. Как правило, векторы экспрессии содержат промотор и другие регуляторные последовательности (например, энхансеры), которые функционально связаны с полинуклеотидами, кодирующими антитело или фрагмент антитела (например, Fab или Fab') к cKIT. В некоторых аспектах индуцируемый промотор используют для предотвращения экспрессии встроенных последовательностей в условиях, отличающихся от индуцирующих. Индуцируемые промоторы включают, например, арабинозный, lacZ, металлотионеиновый промотор или промотор белка теплового шока. Культуры трансформированных организмов можно размножать в неиндуцирующих условиях без смещения популяции в направлении кодирующих последовательностей, продукты экспрессии которых лучше переносятся клетками-хозяевами. Для эффективной экспрессии антитела или фрагмента антитела (например, Fab или Fab') к cKIT кроме промоторов также могут быть необходимы или требоваться другие регуляторные элементы. Такие элементы, как правило, включают кодон инициации трансляции ATG и смежный сайт связывания рибосомы или другие последовательности. Кроме того, эффективность экспрессии можно повысить за счет включения энхансеров, соответствующих применяемой клеточной системе (см., например, Scharf et al., Results Probl. Cell Differ. 20:125, 1994; и Bittner et al., Meth. Enzymol., 153:516, 1987). Например, для повышения экспрессии в клетках-хозяевах, представляющих собой клетки млекопитающих, можно применять энхансер SV40 или энхансер CMV.
В векторах экспрессии также может быть предусмотрено положение сигнальной последовательности секреции для образования слитого белка с полипептидами, кодируемыми вставленными последовательностями антитела или фрагмента антитела (например, Fab или Fab') к cKIT. Чаще встраиваемые последовательности антитела или фрагмента антитела (например, Fab или Fab') к cKIT связывают с сигнальными последовательностями перед включением в вектор. Векторы, подлежащие применению для получения последовательностей, кодирующих вариабельные домены легкой и тяжелой цепей антитела или фрагмента антитела (например, Fab или Fab') к cKIT, иногда также кодируют константные области или их части. Такие векторы обеспечивают возможность экспрессии вариабельных областей в виде слитых белков с константными областями, приводя тем самым к получению интактных антител или их фрагментов.
Клетки-хозяева, несущие и экспрессирующие цепи антитела или фрагмента антитела (например, Fab или Fab') к cKIT, могут быть или прокариотическими, или эукариотическими. E. coli является одним прокариотическим хозяином, применимым для клонирования и экспрессии полинуклеотидов по настоящему изобретению. Другие подходящие для применения микробные хозяева включают бацилл, таких как Bacillus subtilis, и других энтеробактерий, таких как Salmonella, Serratia и различные виды Pseudomonas. Для этих прокариотических хозяев также можно создать векторы экспрессии, которые, как правило, содержат последовательности для управления экспрессией, совместимые с клеткой-хозяином (например, точку начала репликации). Кроме того, будет присутствовать любое количество разнообразных хорошо известных промоторов, как, например, лактозная промоторная система, триптофановая (trp) промоторная система, бета-лактамазная промоторная система или промоторная система из фага лямбда. Как правило, промоторы управляют экспрессией, необязательно с помощью операторной последовательности, и имеют последовательности сайта связывания рибосомы и т. п. для инициации и завершения транскрипции и трансляции. Другие микроорганизмы, такие как дрожжи, также можно использовать для экспрессии полипептидов антитела или фрагмента антитела (например, Fab или Fab') к cKIT. Также можно применять клетки насекомых в сочетании с бакуловирусными векторами.
В других аспектах для экспрессии и получения полипептидов антитела или фрагмента антитела (например, Fab или Fab') к cKIT по настоящему изобретению применяют клетки-хозяева, представляющие собой клетки млекопитающих. Например, они могут представлять собой либо линию клеток гибридомы, экспрессирующих эндогенные гены иммуноглобулинов (например, клоны гибридомы из клеток миеломы, как описано в Примерах), либо линию клеток млекопитающих, несущих экзогенный вектор экспрессии (например, клетки миеломы SP2/0, приведенные в качестве примера ниже). Они охватывают любые нормальные мортальные или нормальные или аномальные иммортальные клетки животных или человека. Например, был разработан ряд подходящих линий клеток-хозяев, способных секретировать интактные иммуноглобулины, в том числе линии клеток CHO, различные линии клеток COS, клетки HeLa, линии клеток миеломы, трансформированные B-клетки и гибридомы. Применение тканевой культуры клеток млекопитающих для экспрессии полипептидов в общих чертах обсуждается, например, в Winnacker, From Genes to Clones, VCH Publishers, N.Y., N.Y., 1987. Векторы экспрессии для клеток-хозяев, представляющих собой клетки млекопитающих, могут включать последовательности для управления экспрессией, такие как точка начала репликации, промотор и энхансер (см., например, Queen et al., Immunol. Rev. 89:49-68, 1986), и необходимые сайты, несущие информацию для процессинга, такие как сайты связывания рибосом, сайты сплайсинга РНК, сайты полиаденилирования и последовательности терминатора транскрипции. Такие векторы экспрессии обычно содержат промоторы, происходящие из генов млекопитающих или из вирусов млекопитающих. Подходящие промоторы могут быть конститутивными, специфическими в отношении типа клеток, специфическими в отношении стадии развития и/или модулируемыми или регулируемыми. Применимые промоторы включают без ограничения металлотионеиновый промотор, конститутивный большой поздний промотор аденовируса, индуцируемый дексаметазоном промотор MMTV, промотор SV40, промотор polIII MRP, конститутивный промотор MPSV, индуцируемый тетрациклином промотор CMV (такой как немедленно-ранний промотор CMV человека), конститутивный промотор CMV и комбинации промотор-энхансер, известные из уровня техники.
Способы введения векторов экспрессии, содержащих представляющие интерес полинуклеотидные последовательности, варьируют в зависимости от типа клетки-хозяина. Например, трансфекцию с использованием хлорида кальция обычно используют для прокариотических клеток, тогда как обработку фосфатом кальция или электропорацию можно применять для других клеток-хозяев (см. в общих чертах Sambrook et al., выше). Другие способы включают, например, электропорацию, обработку фосфатом кальция, трансформацию, опосредованную липосомами, инъекцию и микроинъекцию, баллистические способы, виросомы, иммунолипосомы, конъюгаты поликатион:нуклеиновая кислота, депротеинизированную ДНК, искусственные вирионы, слияние со структурным белком VP22 вируса герпеса (Elliot and O'Hare, Cell 88:223, 1997), усиленное средством поглощение ДНК и трансдукцию ex vivo. Чтобы обеспечить длительное получение рекомбинантных белков с высоким выходом, зачастую будет требоваться стабильная экспрессия. Например, линии клеток, которые стабильно экспрессируют цепи антитела или фрагмента антитела (например, Fab или Fab') к cKIT, могут быть получены с применением векторов экспрессии, которые содержат вирусные точки начала репликации или эндогенные элементы экспрессии и ген селектируемого маркера. После введения вектора клетки можно оставить расти в течение 1-2 дней в обогащенной среде перед их переносом на селективную среду. Задачей селектируемого маркера является придание устойчивости к факторам отбора, и его присутствие обеспечивает возможность роста клеток, которые успешно экспрессируют введенные последовательности, в селективных средах. Пролиферацию устойчивых стабильно трансфицированных клеток можно обеспечивать с применением методик тканевой культуры, соответствующих типу клеток.
Фрагменты антитела, такие как Fab или Fab', можно получать за счет протеолитического расщепления молекул иммуноглобулина с применением ферментов, таких как папаин (для получения фрагментов Fab) или пепсин (для получения фрагменты Fab') и т. д. В сравнении с фрагментами Fab фрагменты Fab' также содержат шарнирную область, которая содержит два природных цистеина, образующих дисульфидные связи между двумя тяжелыми цепями молекулы иммуноглобулина.
Пути терапевтического применения
Конъюгаты по настоящему изобретению применимы при целом ряде применений, в том числе без ограничения для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом, например, реципиента трансплантации гемопоэтических стволовых клеток. Соответственно, в данном документе предусмотрены способы разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом, посредством введения пациенту эффективного количества любого из конъюгатов, описанных в данном документе. В данном документе также предусмотрены способы кондиционирования пациента, подлежащего трансплантации гемопоэтических стволовых клеток (например, реципиента трансплантации), посредством введения пациенту эффективного количества любого из конъюгатов, описанных в данном документе, и обеспечения достаточного периода времени, чтобы конъюгаты вывелись из кровяного русла пациента перед проведением трансплантации гемопоэтических стволовых клеток пациенту. Конъюгаты можно вводить пациенту внутривенно. Также предусмотрено применение любых из конъюгатов или фармацевтических композиций, описанных в данном документе, для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом. Дополнительно предусмотрено применение любых из конъюгатов или фармацевтических композиций, описанных в данном документе, при изготовлении лекарственного препарата для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом.
Эндогенные гемопоэтические стволовые клетки обычно постоянно находятся внутри синусов костного мозга. Данное физическое окружение, в котором постоянно находятся стволовые клетки, называют микроокружением стволовых клеток или нишей стволовых клеток. Клетки стромы и другие клетки, входящие в состав данной ниши, обеспечивают растворимые и связанные факторы, которые оказывают множество эффектов. Были выказаны предположения о различных моделях взаимодействия гемопоэтических стволовых клеток и их ниши. Например, была предложена модель, согласно которой во время деления стволовой клетки только одна дочерняя клетка остается в нише, а другая дочерняя клетка покидает нишу для дифференцировки. Было высказано предположение, что эффективность приживления можно увеличивать при селективном разрушении эндогенных гемопоэтических стволовых клеток, открывая тем самым ниши стволовых клеток для приживления донорских стволовых клеток (см., например, WO 2008/067115).
Трансплантация гемопоэтических стволовых клеток (HSC) или трансплантация костного мозга (как она называлась раньше) представляет собой общепринятый вид лечения целого ряда заболеваний, поражающих кроветворные стволовые клетки организма, таких как виды лейкоза, виды тяжелой анемии, дефекты иммунной защиты и некоторые заболевания дефицита ферментов. Такие заболевания зачастую приводят к тому, что пациент нуждается в замене своего костного мозга на новые здоровые клетки крови.
Трансплантация HSC зачастую является аллогенной, это означает, что пациент получает стволовые клетки от другого индивидуума того же вида, кого-нибудь одного из сиблинга, совместимого родственного, идентичного по гаплотипу родственного или неродственного донора-добровольца. По оценкам у приблизительно 30% пациентов, нуждающихся в трансплантации гемопоэтических стволовых клеток, имеется в распоряжении сиблинг, чей тип ткани является подходящим. Остальные 70% пациентов должны полагаться на совместимость с неродственным донором-добровольцем или доступность идентичного по гаплотипу родственного донора. Важно, чтобы характеристики клеток донора и пациента были сопоставимыми. Трансплантация гемопоэтических стволовых клеток также может быть аутогенной, при которой трансплантируемые клетки получены от самого субъекта, т.е. донор и реципиент являются одним и тем же индивидуумом. Кроме того, трансплантации могут быть сингенными, т.е. от генетически идентичного индивидуума, такого как близнец. В дополнительном аспекте трансплантации могут быть ксеногенными, т.е. трансплантат получен от другого вида, что представляет интерес при отсутствии достаточного числа доноров того же вида, например, как в случае трансплантаций органов.
Перед трансплантацией HSC пациенты обычно подвергаются способу предварительной обработки или кондиционирования. Цель данных предварительной обработки или кондиционирования заключается в удалении как можно большего числа нежелательных клеток (например, злокачественных/раковых клеток) в организме, сведении к минимуму отторжения и/или открытия ниши стволовых клеток путем разрушения эндогенных HSC для эффективного приживления донорских стволовых клеток в данные ниши. После этого здоровые HSC донора вводят пациенту внутривенно или, в некоторых случаях, внутрикостно. Однако с трансплантацией HSC ассоциировано множество рисков, в том числе плохое приживление, иммунологическое отторжение, реакция "трансплантат против хозяина" (GVHD) или инфекция. Хотя клетки донора и пациента выглядят одинаковыми в контексте типа ткани, например, совпадают (или идентичны по гаплотипу) молекулы MHC; между такими индивидуумами имеются небольшие отличия, которые иммунные клетки могут воспринимать как опасные. Это означает, что новая иммунная система (белые кровяные клетки из новых стволовых клеток) воспринимает новое тело как "чужеродное", что провоцирует иммунную атаку. Данная реакция, называемая реакция "трансплантат против хозяина" (GVHD), может представлять угрозу для жизни пациента. Для пациентов после трансплантации HSC также характерен повышенный риск инфекций вследствие отсутствия белых кровяных клеток до того, как новый костный мозг начнет функционировать. В некоторых случаях этот период может продолжаться много месяцев до тех пор, пока новая иммунная система не созреет. Некоторые из таких оппортунистических инфекций могут представлять угрозу для жизни.
Таким образом, существует необходимость в улучшении способов кондиционирования и трансплантации, а также уменьшении рисков, ассоциированных с трансплантацией HSC и повышении ее эффективности при различных нарушениях. В данном документе предусмотрены новые конъюгаты антитела и лекарственного средства, которые, за счет специфического цитолиза эндогенных HSC реципиента, а не всех остальных иммунных клеток, перед трансплантацией, поддерживают частично активную иммунную защиту для борьбы с инфекциями сразу после трансплантации, но в то же время обеспечивают непрямой иммуносупрессорный эффект вследствие неспособности субъекта формировать новые иммунные клетки из своих собственных HSC. Поскольку предварительная обработка может быть более слабой, чем химиотерапия или облучение, и приводить к менее серьезным побочным эффектам, она может индуцировать меньше GVHD у пациентов, подвергнутых трансплантации.
Конъюгаты антитела и лекарственного средства, описанные в данном документе, можно было бы применять для разрушения эндогенной гемопоэтической стволовой клетки, например, в способе предварительной обработки/кондиционирования перед трансплантацией гемопоэтических стволовых клеток. Например, конъюгаты по настоящему изобретению можно было бы применять для лечения любого злокачественного состояния/нарушения, при котором могла бы принести пользу трансплантация стволовых клеток, такого как тяжелая апластическая анемия (SAA), синдром Вискотта-Олдрича, синдром Гурлера, наследственный гематофагоцитарный лимфогистиоцитоз (FHL), хронический гранулематоз (CGD), синдром Костмана, тяжелый иммунодефицитный синдром (SCID), другие аутоиммунные нарушения, такие как SLE, рассеянный склероз, IBD, болезнь Крона, язвенный колит, синдром Шегрена, васкулит, волчанка, миастения гравис, болезнь Вегенера, врожденные нарушения обмена веществ и/или другие иммунодефициты.
Кроме того, конъюгаты по настоящему изобретению можно было бы применять для лечения любого злокачественного состояния/нарушения, при котором могла бы принести пользу трансплантация стволовых клеток, такого как гематологические заболевания, гематологические злокачественные опухоли или солидные опухоли (например, рак почки, рак печени, рак поджелудочной железы). Распространенные типы гематологических заболеваний/злокачественных опухолей, которые можно было бы лечить с помощью заявленных способов и антител, представляют собой лейкозы, лимфомы и миелодиспластические синдромы. Лейкоз представляет собой тип рака крови или костного мозга, который характеризуется аномальным увеличением числа незрелых белых кровяных клеток, называемых бластные клетки, и термин лейкоз охватывает острый лимфобластный лейкоз (ALL), острый миелогенный лейкоз (AML), острый моноцитарный лейкоз (AMoL), хронический лимфоцитарный лейкоз (CLL), хронический миелогенный лейкоз (CML) и другие лейкозы, такие как волосатоклеточный лейкоз (HCL), T-клеточный пролимфоцитарный лейкоз (T-PLL), лейкоз из больших зернистых лимфоцитов и Т-клеточный лейкоз взрослых. В одном аспекте настоящего изобретения подвергаемый лечению лейкоз представляет собой острый лейкоз. В дополнительном аспекте лейкоз представляет собой ALL, AML или AMoL. Лимфомы охватывают лейкоз/лимфому из предшественников T-клеток, лимфому Беркитта, фолликулярную лимфому, диффузную В-крупноклеточную лимфому, лимфому из клеток мантийной зоны, B-клеточный хронический лимфоцитарный лейкоз/лимфому, лимфому MALT, фунгоидный микоз, неуточненную периферическую T-клеточную лимфому, форму ходжкинской лимфомы с нодулярным склерозом, смешанноклеточный подтип ходжкинской лимфомы. Миелодиспластический синдром (MDS) - это название группы состояний, которые наблюдаются при повреждении кроветворных клеток в костном мозге. Такое повреждение приводит к низким количествам одного или нескольких типов клеток крови. MDS подразделяется на 7 категорий: рефрактерная цитопения с однолинейной дисплазией (RCUD), рефрактерная анемия с кольцевидными сидеробластами (RARS), рефрактерная цитопения с мультилинейной дисплазией (RCMD), рефрактерная анемия с избытком бластов-1 (RAEB-1), рефрактерная анемия с избытком бластов-2 (RAEB-2), неклассифицированный миелодиспластический синдром(MDS-U) и миелодиспластический синдром, ассоциированный с выделенной del (5q).
В некоторых вариантах осуществления пациент, нуждающийся в разрушении гемопоэтических стволовых клеток (например, реципиент трансплантации гемопоэтических стволовых клеток), может иметь наследственное иммунодефицитное заболевание, аутоиммунное нарушение, нарушение гемопоэза или врожденные нарушения обмена веществ.
В некоторых вариантах осуществления нарушение гемопоэза может быть выбрано из любого из следующих: острого миелоидного лейкоза (AML), острого лимфобластного лейкоза (ALL), острого моноцитарного лейкоза (AMoL), хронического миелоидного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), миелопролиферативных нарушений, миелодиспластических синдромов, множественной миеломы, неходжкинской лимфомы, болезни Ходжкина, апластической анемии, истинной эритроцитарной аплазии, пароксизмальной ночной гемоглобинурии, анемии Фанкони, большой талассемии, серповидноклеточной анемии, тяжелого комбинированного иммунодефицита, синдрома Вискотта-Олдрича, гемофагоцитарного лимфогистиоцитоза.
Врожденные нарушения обмена веществ, также известные как наследственные метаболические заболевания (IMB) или присутствующие при рождении метаболические заболевания, которые представляют собой класс генетических заболеваний, охватывают присутствующие при рождении нарушения углеводного метаболизма, метаболизма аминокислот, метаболизма органических кислот или болезни лизосомного накопления. В некоторых вариантах осуществления врожденные нарушения обмена веществ выбраны из мукополисахаридоза, болезни Гоше, метахроматических лейкодистрофий или адренолейкодистрофий.
Кроме того, конъюгаты по настоящему изобретению можно было бы применять для лечения гастроинтестинальной стромальной опухоли (GIST), такой как GIST, которая является положительной по cKIT. В некоторых вариантах осуществления конъюгаты по настоящему изобретению можно было бы применять для лечения GIST, которая экспрессирует cKIT дикого типа. В некоторых вариантах осуществления конъюгаты по настоящему изобретению можно было бы применять для лечения GIST, которая является резистентной к средству лечения, например, иматинибу (Glivec®/Gleevec®).
Комбинированная терапия
В некоторых случаях конъюгат антитела и лекарственного средства по настоящему изобретению может применяться в комбинации с другой схемой кондиционирования, такой как лучевая терапия или химиотерапия.
В некоторых случаях конъюгат антитела и лекарственного средства по настоящему изобретению может применяться в комбинации с другим терапевтическим средством, таким как противораковое средство, средство против тошноты (или противорвотное средство), обезболивающее, мобилизирующее средство или их комбинации.
Распространенные химиотерапевтические средства, рассматриваемые для применения в видах комбинированной терапии, включают анастрозол (Arimidex®), бикалутамид (Casodex®), блеомицина сульфат (Blenoxane®), бусульфан (Myleran®), бусульфан в виде инъекции (Busulfex®), капецитабин (Xeloda®), N4-пентоксикарбонил-5-дезокси-5-фторцитидин, карбоплатин (Paraplatin®), кармустин (BiCNU®), хлорамбуцил (Leukeran®), цисплатин (Platinol®), кладрибин (Leustatin®), циклоспорин (Sandimmune®, Neoral® или Restasis®), циклофосфамид (Cytoxan® или Neosar®), цитарабин, цитозина арабинозид (Cytosar-U®), цитарабин в виде липосомной инъекции (DepoCyt®), дакарбазин (DTIC-Dome®), дактиномицин (актиномицин D, Cosmegan), даунорубицина гидрохлорид (Cerubidine®), даунорубицина цитрат в виде липосомной инъекции (DaunoXome®), дексаметазон, доцетаксел (Taxotere®), доксорубицина гидрохлорид (Adriamycin®, Rubex®), этопозид (Vepesid®), флударабина фосфат (Fludara®), 5-фторурацил (Adrucil®, Efudex®), флутамид (Eulexin®), тезацитибин, гемцитабин (дифтордезоксицитидин), гидроксимочевину (Hydrea®), идарубицин (Idamycin®), ифосфамид (IFEX®), иринотекан (Camptosar®), L-аспарагиназу (ELSPAR®), лейковорин кальция, мелфалан (Alkeran®), 6-меркаптопурин (Purinethol®), метотрексат (Folex®), митоксантрон (Novantrone®), милотарг, паклитаксел (Taxol®), феникс (иттрий 90/MX-DTPA), пентостатин, полифероспан 20 с имплантатом кармустина (Gliadel®), тамоксифена цитрат (Nolvadex®), тенипозид (Vumon®), 6-тиогуанин, тиотепу, тирапазамин (Tirazone®), топотекана гидрохлорид для инъекции (Hycamptin®), винбластин (Velban®), винкристин (Oncovin®) и винорелбин (Navelbine®).
В некоторых вариантах осуществления конъюгат антитела и лекарственного средства по настоящему изобретению может применяться в комбинации с блокатором CD47, например, антителом к CD47 или его фрагментом. Сообщалось, что микротело к CD47, которое блокирует взаимодействие между CD47 и сигнальным регуляторным белком альфа (SIRPα), может повышать разрушение эндогенных HSC под действием "голого" антитела к c-Kit (Chhabra et al., Science Translational Medicine 8 (351), 351ra105).
В некоторых вариантах осуществления конъюгат антитела и лекарственного средства по настоящему изобретению может применяться в комбинации с другим антителом или его фрагментом, которые специфически связываются с гемопоэтическими стволовыми клетками или гемопоэтическими клетками-предшественниками, например, антителом к CD45 или его фрагментом, антителом к CD34 или его фрагментом, антителом к CD133 или его фрагментом, антителом к CD59 или его фрагментом или антителом к CD90 или его фрагментом. В некоторых вариантах осуществления конъюгаты антитела и лекарственного средства по настоящему изобретению могут применяться в комбинации с ингибитором Dyrk1a, таким как Harmine, INDY, ML315 гидрохлорид, ProINDY, Tocris™ TC-S 7044, Tocris™ TG 003, FINDY, TBB, DMAT, CaNDY и т.д.
В некоторых вариантах осуществления конъюгат антитела и лекарственного средства по настоящему изобретению может применяться в комбинации с одним или нескольким иммуносупрессорами, такими как глюкокортикоиды, например, преднизон, дексаметазон и гидрокортизон; цитостатиками, например, алкилирующими средствами, антиметаболитами, метотрексатом, азатиоприном, меркаптопурином, дактиномицином и т. д.; лекарственными средствами, действующими на иммунофилины, например, такролимусом (Prograf®, Astograf XL® или Envarsus XR®), сиролимусом (рапамицин или Rapamune®) и эверолимусом; интерферонами; опиоидами; TNF-связывающими белками; микофенолатом; финголимодом; мириоцином и т. д. В некоторых вариантах осуществления конъюгат антитела и лекарственного средства по настоящему изобретению может применяться в комбинации с одним или несколькими средствами, которые специфически истощают T клетки, такими как флударабин, циклоспорин, антитело к CD52, например, алемтузумаб, антитимоцитарный глобулин (ATG), антитело к CD3 или его фрагмент, антитело к CD4 или его фрагмент, антитело к CD8 или его фрагмент или антитело к TCR α/β человека или его фрагмент. Виды терапии, направленные на истощение T-клеток, могут снижать реакцию "хозяин против трансплантата", которая могла бы приводить к отторжению трансплантата.
В некоторых вариантах осуществления конъюгат антитела и лекарственного средства по настоящему изобретению может применяться в комбинации с одним или несколькими средствами, выбранными из плериксафора (также известного как AMD3100, Mozobil®), гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), например, сарграмостима (Leukine®), или гранулоцитарного колониестимулирующего фактора (G-CSF), например, филграстима или пегфилграстима (Zarzio®, Zarxio®, Neupogen®, Neulasta®, Nufil®, Religrast®, Emgrast®, Neukine®, Grafeel®, Imumax®, Filcad®).
В одном аспекте конъюгат антитела и лекарственного средства по настоящему изобретению объединен в фармацевтическом комбинированном составе со вторым соединением, характеризующимся противораковыми свойствами, или схема введения доз предусматривает комбинированную терапию с ним. Второе соединение фармацевтического комбинированного состава или схемы введения доз может характеризоваться видами активности, которые взаимно дополняют конъюгат из комбинации, вследствие чего они не оказывают неблагоприятного эффекта друг на друга.
Используемый в данном документе термин "фармацевтическая комбинация" относится либо к фиксированной комбинации в форме единицы дозирования, либо к нефиксированной комбинации или набору из частей для комбинированного введения, где два или более терапевтических средств могут вводиться независимо в одно и то же время или по отдельности в пределах временных интервалов, в частности, когда такие временные интервалы обеспечивают возможность демонстрации кооперативного, например синергетического, эффекта партнеров по комбинации.
Термин "комбинированная терапия" относится к введению двух или более терапевтических средств для лечения терапевтического состояния или нарушения, описанного в настоящем изобретении. Такое введение охватывает совместное введение этих терапевтических средств практически одновременно, например, в одной капсуле, имеющей фиксированное отношение активных ингредиентов. В качестве альтернативы такое введение охватывает совместное введение в виде нескольких или отдельных контейнеров (например, капсулы, порошки и жидкости) для каждого активного ингредиента. Порошки и/или жидкости могут быть восстановлены или разбавлены до требуемой дозы перед введением. Кроме того, такое введение также охватывает применение каждого типа терапевтического средства последовательным образом, либо приблизительно в одно и то же время, либо в разное время. В любом случае схема лечения будет обеспечивать приносящие пользу эффекты комбинации лекарственных средств при лечении состояний или нарушений, описанных в данном документе.
Комбинированная терапия может обеспечивать "синергию" и оказаться "синергетической", т. e. эффект, достигаемый, когда активные ингредиенты применяются вместе, превышает сумму эффектов, которые являются результатом применения соединений по отдельности. Синергетический эффект может быть достигнут, когда активные ингредиенты: (1) составлены вместе и вводятся или доставляются одновременно в виде комбинированного состава с однократной дозой; (2) доставляются по очереди или параллельно как отдельные составы или (3) применяется какая-либо другая схема. При доставке в виде терапии с чередованием синергетический эффект может достигаться, когда соединения вводят или доставляют одно за другим, например, посредством различных инъекций в отдельных шприцах. В целом, во время терапии с чередованием эффективную дозу каждого активного ингредиента вводят одну за другой, т.е. сериями, в то время как при комбинированной терапии эффективную дозу двух или более активных ингредиентов вводят вместе.
Фармацевтические композиции
Чтобы приготовить фармацевтические или стерильные композиции, содержащие один или несколько конъюгатов антитела и лекарственного средства, описанных в данном документе, предусмотренный(-ые) конъюгат(-ы) может(могут) смешиваться с фармацевтически приемлемым носителем или вспомогательным веществом.
Составы терапевтических и диагностических средств могут быть получены путем смешивания с физиологически приемлемыми носителями, вспомогательными веществами или стабилизаторами в форме, например, лиофилизированных порошков, взвесей, водных растворов, лосьонов или суспензий (см., например, Hardman et al., Goodman and Gilman's The Pharmacological Basis of Therapeutics, McGraw-Hill, New York, N.Y., 2001; Gennaro, Remington: The Science and Practice of Pharmacy, Lippincott, Williams, and Wilkins, New York, N.Y., 2000; Avis, et al. (eds.), Pharmaceutical Dosage Forms: Parenteral Medications, Marcel Dekker, NY, 1993; Lieberman, et al. (eds.), Pharmaceutical Dosage Forms: Tablets, Marcel Dekker, NY, 1990; Lieberman, et al. (eds.) Pharmaceutical Dosage Forms: Disperse Systems, Marcel Dekker, NY, 1990; Weiner and Kotkoskie, Excipient Toxicity and Safety, Marcel Dekker, Inc., New York, N.Y., 2000).
В некоторых вариантах осуществления фармацевтическая композиция, содержащая конъюгат антитела по настоящему изобретению, представляет собой лиофилизированный препарат. В некоторых вариантах осуществления фармацевтическая композиция, содержащая конъюгат антитела, представляет собой лиофилизат во флаконе, содержащем конъюгат антитела, гистидин, сахарозу и полисорбат 20. В некоторых вариантах осуществления фармацевтическая композиция, содержащая конъюгат антитела, представляет собой лиофилизат во флаконе, содержащем конъюгат антитела, сукцинат натрия и полисорбат 20. В некоторых вариантах осуществления фармацевтическая композиция, содержащая конъюгат антитела, представляет собой лиофилизат во флаконе, содержащем конъюгат антитела, трегалозу, цитрат и полисорбат 8. Лиофилизат может быть восстановлен, например, с помощью воды, солевого раствора для инъекции. В конкретном варианте осуществления раствор содержит конъюгат антитела, гистидин, сахарозу и полисорбат 20 при pH, составляющем приблизительно 5,0. В другом специфическом варианте осуществления раствор содержит конъюгат антитела, сукцинат натрия и полисорбат 20. В другом специфическом варианте осуществления раствор содержит конъюгат антитела, дегидрат трегалозы, дегидрат цитрата, лимонную кислоту и полисорбат 8 при pH, составляющем приблизительно 6,6. Для внутривенного введения полученный раствор обычно будут дополнительно разбавлять в растворе носителя.
Выбор схемы введения для терапевтического средства зависит от нескольких факторов, в том числе интенсивности метаболизма сыворотки или ткани для объекта, уровня симптомов, иммуногенности объекта и доступности клеток-мишеней в биологической матрице. В некоторых вариантах осуществления схема введения максимизирует количество терапевтического средства, доставляемого пациенту, в соответствии с приемлемым уровнем побочных эффектов. Соответственно, количество доставляемого биологического средства частично зависит от конкретного объекта и тяжести состояния, подлежащего лечению. Руководства по подбору подходящих доз антител, цитокинов и малых молекул являются доступными (см., например, Wawrzynczak, Antibody Therapy, Bios Scientific Pub. Ltd, Oxfordshire, UK, 1996; Kresina (ed.), Monoclonal Antibodies, Cytokines and Arthritis, Marcel Dekker, New York, N.Y., 1991; Bach (ed.), Monoclonal Antibodies and Peptide Therapy in Autoimmune Diseases, Marcel Dekker, New York, N.Y., 1993; Baert et al., New Engl. J. Med. 348:601-608, 2003; Milgrom et al., New Engl. J. Med. 341:1966-1973, 1999; Slamon et al., New Engl. J. Med. 344:783-792, 2001; Beniaminovitz et al., New Engl. J. Med. 342:613-619, 2000; Ghosh et al., New Engl. J. Med. 348:24-32, 2003; Lipsky et al., New Engl. J. Med. 343:1594-1602, 2000).
Определение подходящей дозы выполняет лечащий врач, например, с применением параметров или факторов, которые, как известно или ожидаемо из уровня техники, воздействуют на лечение или, как прогнозируют, воздействуют на лечение. Обычно начинают дозирование с количества, несколько меньшего, чем оптимальная доза, и после этого ее повышают небольшими шагами до тех пор, пока не достигается требуемый или оптимальный эффект по сравнению с любыми отрицательными побочными эффектами. Важные диагностические показатели включают, например, показатели, являющиеся симптомами воспаления или уровень продуцируемых воспалительных цитокинов.
Фактические уровни дозы активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьироваться для того, чтобы получить количество активного ингредиента, которое является эффективным для достижения требуемого терапевтического ответа у конкретного пациента, эффективным в отношении композиции и способа введения, при этом не токсично для пациента. Выбранный уровень дозы будет зависеть от ряда фармакокинетических факторов, в том числе активности конкретных используемых композиций по настоящему изобретению, пути введения, времени введения, скорости выведения конкретного используемого соединения, длительности лечения, других лекарственных средств, соединений и/или материалов, применяемых в комбинации с конкретными используемыми композициями, возраста, пола, массы тела, состояния, общего состояния здоровья и анамнеза пациента, подлежащего лечению, и аналогичных факторов, известных в области техники медицины.
Композиции, содержащие конъюгат антитела по настоящему изобретению, могут вводиться в помощью непрерывной инфузии или с помощью доз с интервалами, составляющими, например, один день, одну неделю, или вводиться 1-7 раз в неделю, раз в две недели, раз в три недели, раз в четыре недели, раз в пять недель, раз в шесть недель, раз в семь недель или раз в восемь недель. Дозы могут вводиться внутривенно, подкожно или внутрикостно. Специфический протокол введения доз является таким, который предусматривает максимальную дозу или частоту введения доз, которые позволяют избежать значительных нежелательных побочных эффектов.
Для конъюгатов антитела по настоящему изобретению доза, вводимая пациенту, может составлять от 0,0001 мг/кг до 100 мг/кг массы тела пациента. Доза может составлять от 0,001 мг/кг до 50 мг/кг, от 0,005 мг/кг до 20 мг/кг, от 0,01 мг/кг до 20 мг/кг, от 0,02 мг/кг до 10 мг/кг, от 0,05 до 5 мг/кг, от 0,1 мг/кг до 10 мг/кг, от 0,1 мг/кг до 8 мг/кг, от 0,1 мг/кг до 5 мг/кг, от 0,1 мг/кг до 2 мг/кг, от 0,1 мг/кг до 1 мг/кг массы тела пациента. Доза конъюгата антитела может быть рассчитана с применением массы пациента в килограммах (кг), умноженной на подлежащую введению дозу в мг/кг.
Дозы конъюгатов антитела по настоящему изобретению могут быть повторными, а введения могут быть разделены менее чем 1 днем, по меньшей мере 1 днем, 2 днями, 3 днями, 5 днями, 10 днями, 15 днями, 30 днями, 45 днями, 2 месяцами, 75 днями, 3 месяцами, 4 месяцами, 5 месяцами или по меньшей мере 6 месяцами. В некоторых вариантах осуществления конъюгат антитела по настоящему изобретению вводят два раза в неделю, раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или менее часто.
Эффективное количество для конкретного пациента может варьироваться в зависимости от таких факторов, как подлежащее лечению состояние, общее состояние здоровья пациента, способ, путь и доза введения и тяжесть побочных эффектов (см., например, Maynard et al., A Handbook of SOPs for Good Clinical Practice, Interpharm Press, Boca Raton, Fla., 1996; Dent, Good Laboratory and Good Clinical Practice, Urch Publ., London, UK, 2001).
Путем введение может быть, например, местное нанесение или нанесение на кожу, инъекция или инфузия посредством подкожного, внутривенного, внутрибрюшинного, внутримозгового, внутримышечного, внутриглазного, внутриартериального, внутриспинномозгового, внутриочагового введения, или системы замедленного высвобождения или имплантат (см., например, Sidman et al., Biopolymers 22:547-556, 1983; Langer et al., J. Biomed. Mater. Res. 15:167-277, 1981; Langer, Chem. Tech. 12:98-105, 1982; Epstein et al., Proc. Natl. Acad. Sci. USA 82:3688-3692, 1985; Hwang et al., Proc. Natl. Acad. Sci. USA 77:4030-4034, 1980; патенты США №№ 6350466 и 6316024). При необходимости композиция может также содержать солюбилизирующее средство и местный анестетик, такой как лидокаин, для облегчения боли в месте инъекции, или их оба. Кроме того, также можно использовать ингаляционное введение, например, за счет применения ингалятора или распылителя и состава со средством в виде аэрозоля. См., например, патенты США №№ 6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации согласно PCT №№ WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, каждая из которых включена в данный документ посредством ссылки во всей своей полноте.
Способы совместного введения или лечения с применением второго терапевтического средства, например, цитокина, стероида, химиотерапевтического средства, антибиотика, или облучения (такого как тотальное облучение тела (TBI)), известны из уровня техники (см., например, Hardman et al., (eds.) (2001) Goodman and Gilman's The Pharmacological Basis of Therapeutics, 10.sup.th ed., McGraw-Hill, New York, N.Y.; Poole and Peterson (eds.) (2001) Pharmacotherapeutics for Advanced Practice:A Practical Approach, Lippincott, Williams & Wilkins, Phila., Pa.; Chabner and Longo (eds.) (2001) Cancer Chemotherapy and Biotherapy, Lippincott, Williams & Wilkins, Phila., Pa.). Эффективное количество терапевтического средства может снижать симптомы на по меньшей мере 10%; по меньшей мере 20%; по меньшей мере приблизительно 30%; по меньшей мере 40% или по меньшей мере 50%.
Дополнительные виды терапии, которые можно применять в комбинации с конъюгатами антитела по настоящему изобретению, можно применять с интервалом менее 5 минут, с интервалом менее 30 минут, с интервалом 1 час, с интервалом приблизительно 1 час, с интервалом от приблизительно 1 до приблизительно 2 часов, с интервалом от приблизительно 2 часов до приблизительно 3 часов, с интервалом от приблизительно 3 часов до приблизительно 4 часов, с интервалом от приблизительно 4 часов до приблизительно 5 часов, с интервалом от приблизительно 5 часов до приблизительно 6 часов, с интервалом от приблизительно 6 часов до приблизительно 7 часов, с интервалом от приблизительно 7 часов до приблизительно 8 часов, с интервалом от приблизительно 8 часов до приблизительно 9 часов, с интервалом от приблизительно 9 часов до приблизительно 10 часов, с интервалом от приблизительно 10 часов до приблизительно 11 часов, с интервалом от приблизительно 11 часов до приблизительно 12 часов, с интервалом от приблизительно 12 часов до 18 часов, с интервалом от 18 часов до 24 часов, с интервалом от 24 часов до 36 часов, с интервалом от 36 часов до 48 часов, с интервалом от 48 часов до 52 часов, с интервалом от 52 часов до 60 часов, с интервалом от 60 часов до 72 часов, с интервалом от 72 часов до 84 часов, с интервалом от 84 часов до 96 часов или с интервалом от 96 часов до 120 часов от введения конъюгатов антитела по настоящему изобретению. Два или более видов терапии могут применяться во время одного и того же визита пациента.
В настоящем изобретении предусмотрены протоколы для введения субъекту, нуждающемуся в этом, фармацевтической композиции, содержащей конъюгаты антитела по настоящему изобретению, отдельно или в комбинации с другими видами терапии. Виды терапии из видов комбинированной терапии по настоящему изобретению могут применяться в отношении субъекта одновременно или последовательно. Терапию из видов комбинированной терапии по настоящему изобретению также можно применять циклически. Циклическая терапия предусматривает введение первого средства терапии в течение некоторого периода времени, а затем введения второго средства терапии в течение некоторого периода времени и повторения такого последовательного введения, т.е. цикла, с целью снижения развития устойчивости к одному из видов терапии (например, средствам), для недопущения или снижения побочных эффектов одного из видов терапии (например, средств) и/или для улучшения эффективности видов терапии.
Виды терапии из видов комбинированной терапии по настоящему изобретению можно применять в отношении субъекта одновременно.
Термин "одновременно" не ограничивается применением видов терапии точно в одно и то же время, а скорее означает, что фармацевтическую композицию, содержащую антитела или их фрагменты по настоящему изобретению, вводят субъекту последовательно и в течение временного интервала таким образом, чтобы антитела или конъюгаты антитела по настоящему изобретению могли действовать вместе с другим(-и) видом(-ами) терапии для обеспечения большей пользы, чем если бы их вводили иным способом. Например, каждый вид терапии может применяться в отношении субъекта в одно и то же время или последовательно в любом порядке в различные моменты времени; однако, если их не применяют в одно и то же время, их следует применять достаточно близко по времени, чтобы обеспечить требуемый терапевтический эффект. Каждый вид терапии можно применять в отношении субъекта по отдельности, в любой подходящей форме и с помощью любого подходящего пути. В различных вариантах осуществления виды терапии применяют в отношении субъекта с интервалом менее 5 минут, с интервалом менее 15 минут, с интервалом менее 30 минут, с интервалом менее 1 часа, с интервалом приблизительно 1 час, с интервалом от приблизительно 1 часа до приблизительно 2 часов, с интервалом от приблизительно 2 часов до приблизительно 3 часов, с интервалом от приблизительно 3 часов до приблизительно 4 часов, с интервалом от приблизительно 4 часов до приблизительно 5 часов, с интервалом от приблизительно 5 часов до приблизительно 6 часов, с интервалом от приблизительно 6 часов до приблизительно 7 часов, с интервалом от приблизительно 7 часов до приблизительно 8 часов, с интервалом от приблизительно 8 часов до приблизительно 9 часов, с интервалом от приблизительно 9 часов до приблизительно 10 часов, с интервалом от приблизительно 10 часов до приблизительно 11 часов, с интервалом от приблизительно 11 часов до приблизительно 12 часов, с интервалом 24 часа, с интервалом 48 часов, с интервалом 72 часа или с интервалом 1 неделя. В других вариантах осуществления два или более видов терапии применяются во время одного и того же визита пациента.
Виды комбинированной терапии могут вводиться субъекту в одной фармацевтической композиции. В качестве альтернативы терапевтические средства из видов комбинированной терапии могут вводиться субъекту одновременно в отдельных фармацевтических композициях. Терапевтические средства могут вводиться субъекту с помощью одного и того же или различных путей введения.
Следует понимать, что примеры и варианты осуществления, описанные в данном документе, предназначены только для иллюстративных целей, и что различные модификации или изменения в их свете будут предложены специалистам в данной области техники и должны быть включены в сущность и область действия настоящей заявки и объем прилагаемой формулы изобретения.
ПРИМЕРЫ
Пример 1. Получение ADC к cKIT
Получение антител и фрагментов антител к cKIT, содержащих сайт-специфические цистеиновые мутации, или без них
Человеческие антитела и фрагменты антител к cKIT получали, как описано ранее в WO2014150937 и WO2016020791.
ДНК, кодирующую вариабельные области тяжелой и легкой цепей антитела к cKIT, амплифицировали из вектора, выделенного в скрининге на основе фагового дисплея, и клонировали в векторы экспрессии для клеток млекопитающих, которые содержат константные области тяжелой цепи человеческого IgG1 и человеческой легкой каппа-цепи или легкой лямбда-цепи. Векторы содержат промотор CMV и сигнальный пептид (MPLLLLLPLLWAGALA (SEQ ID NO: 151) для тяжелой цепи и MSVLTQVLALLLLWLTGTRC (SEQ ID NO: 152) для легкой цепи, а также соответствующие сигнальную последовательность и последовательность отбора для амплификации ДНК в бактериальном хозяине, например, клетках DH5альфа E. coli, временной экспрессии в клетках млекопитающих, например, клетках HEK293, или стабильной трансфекции в клетки млекопитающих, например, клетки CHO. Для введения Cys-мутаций ПЦР с сайт-направленным мутагенезом проводили с применением олигонуклеотидов, разработанных для замены одиночных Cys-остатков в определенном сайте в константных областях кодирующих последовательностей тяжелой цепи или легкой цепи. Примерами мутаций с Cys-заменой являются E152C или S375C в тяжелой цепи; E165C или S114C в легкой каппа-цепи или A143C в легкой лямбда-цепи (все нумерация EU). В некоторых случаях две или более Cys-мутаций объединяли, чтобы получить антитело с несколькими Cys-заменами, например, HC-E152C-S375C, лямбда-LC-A143C-HC-E152C, каппа-LC-E165C-HC-E152C или каппа-LC-S114C-HC-E152C (все нумерация EU). Для получения плазмид, кодирующих фрагменты антител, ПЦР с мутагенезом проводили с олигонуклеотидами, разработанными для удаления или модификации части константной области тяжелой цепи. Например, осуществляли ПЦР с удалением остатков 222-447 (нумерация EU) константной области тяжелой цепи, чтобы непосредственно после остатка 221 (нумерация EU) был закодирован стоп-кодон, с целью осуществления экспрессии конструкции с получением фрагмента Fab. Например, осуществляли ПЦР с удалением остатков 233-447 (нумерация EU) константной области тяжелой цепи, чтобы непосредственно после остатка 232 (нумерация EU) был закодирован стоп-кодон, с целью осуществления экспрессии конструкции с получением фрагмента Fab', содержащего два Cys-остатка шарнирной области IgG1.
Антитела, фрагменты антител и Cys-мутантные антитела или фрагменты антител к cKIT экспрессировали в клетках 293 Freestyle™ за счет совместной трансфекции плазмид для тяжелой цепи и легкой цепи с применением способов временной трансфекции, описанных ранее (Meissner, et al., Biotechnol Bioeng. 75:197-203 (2001)). Экспрессированные антитела очищали из клеточных супернатантов с помощью стандартных способов аффинной хроматографии с применением подходящей смолы, такой как смолы с белком A, белком G, Capto-L или LambdaFabSelect. В качестве альтернативы антитела, фрагменты антител и Cys-мутантные антитела или фрагменты антител к cKIT экспрессировали в клетках CHO за счет совместной трансфекции вектора для тяжелой цепи и вектора для легкой цепи в клетки CHO. Клетки проходили отбор, а затем стабильно трансфицированные клетки культивировали в условиях, оптимизированных для выработки антител. Антитела очищали из клеточных супернатантов, как указано выше.
Восстановление, повторное окисление и конъюгация антител и фрагментов антител к cKIT с токсинами
Соединения, содержащие реакционноспособный фрагмент, например малеимидную группу, вступающий в реакцию с тиольной группой (боковая цепь Cys) на антителе или фрагменте антитела, описанный линкер и функциональный фрагмент, такой как ауристатин или другой токсин, конъюгировали с Cys-остатками, нативными или введенными путем конструирования в антитело, с применением способов, описанных ранее (например, в WO2014124316, WO2015138615, Junutula JR, et al., Nature Biotechnology 26:925-932 (2008)).
Поскольку введенные путем конструирования Cys-остатки в антителах, экспрессируемых в клетках млекопитающих, во время биосинтеза модифицируются за счет аддуктов (дисульфидов), таких как глутатион (GSH) и/или цистеин (Chen et al. 2009), изначально экспрессированный модифицированный Cys не реагирует с реагентами, вступающими в реакцию с тиолами, такими как малеимидо- или бромацетамидная или йодацетамидная группы. Для осуществления конъюгации по введенным путем конструирования Cys-остаткам глутатионовый или цистеиновый аддукты должны быть удалены путем восстановления дисульфидов, что обычно вызывает восстановление всех дисульфидов в экспрессированном антителе. Поскольку нативные Cys-остатки в антителах и фрагментах антител обычно образуют дисульфидные связи с другими Cys-остатками в антителе или фрагменте антитела, они также не реагируют с реагентами, вступающими в реакцию с тиолами, пока дисульфиды не восстановлены. Восстановление дисульфидов можно осуществлять вначале путем воздействия на антитело восстановителем, таким как дитиотреитол (DTT), цистеин или трис(2-карбоксиэтил)фосфина гидрохлорид (TCEP-HCl). Необязательно восстановитель можно удалять, чтобы обеспечить возможность повторного окисления всех нативных дисульфидных связей антитела или фрагмента антитела для возобновления и/или стабилизации функциональной структуры антитела.
В случаях, когда антитело или фрагмент антитела конъюгировали только по введенным путем конструирования Cys-остаткам, для восстановления нативных дисульфидных связей и дисульфидной связи между цистеиновым или GSH аддуктами у введенного(-ых) путем конструирования Cys-остатка(-ов) к очищенным антителам с Cys-мутацией добавляли свежеполученный DTT до конечной концентрации, составляющей 10 мМ или 20 мМ. После инкубации антитела с DTT при 37°C в течение 1 часа смеси диализировали против PBS в течение трех дней с ежедневной заменой буфера для удаления DTT и повторного окисления нативных дисульфидных связей. Процесс повторного окисления отслеживали с помощью HPLC с обращенной фазой, которая позволяла разделять тетрамеры антитела и отдельные молекулы тяжелой и легкой цепи Реакционные смеси анализировали на колонке PRLP-S 4000A (50 мм x 2,1 мм, Agilent), нагретой до 80°C, и элюирование в колонке проводили с помощью линейного градиента 30-60% ацетонитрила в воде, содержащей 0,1% TFA, при расходе 1,5 мл/мин. Элюирование белков из колонки отслеживали при 280 нм. Обеспечивали продолжения диализа до тех пор, пока не завершалось повторное окисление. Повторное окисление возобновляет внутрицепочечные и межцепочечные дисульфиды, при этом диализ обеспечивает возможность того, что цистеины и глутатионы, присоединенные к вновь введенному(-ым) Cys-остатку(-ам), вымываются при диализе. После повторного окисления к повторно окисленным антителам или фрагментам антител в PBS-буфере (pH 7,2) добавляли малеимидсодержащие соединения, как правило, при отношениях 1,5:1, 2:1 или 5:1 к введенному путем конструирования Cys, и инкубации проводили в течение 1 часа. Как правило, избыток свободного соединения удаляли очисткой с пропусканием через белок A или другую подходящую смолу с помощью стандартных способов, а затем заменой буфера на PBS.
В качестве альтернативы, антитела или фрагменты антител с сайтами введенного путем конструирования Cys восстанавливали и повторно окисляли с применением способа "на смоле". Сефарозные гранулы с белком A (1 мл на 10 мг антитела) уравновешивали в PBS (не содержащем солей кальция или магния) и затем добавляли в образец антитела партиями. Исходный 0,5 M раствор цистеина получали путем растворения 850 мг цистеина-HCl в 10 мл раствора, полученного добавлением 3,4 г NaOH к 250 мл 0,5 M фосфата натрия, pH 8,0, а затем 20 мМ цистеина добавляли к взвеси антитело/гранулы и аккуратно смешивали при комнатной температуре в течение 30-60 минут. Гранулы загружали на колонку с гравитационным элюированием и промывали с помощью 50 объемов слоя PBS за менее чем 30 минут. Затем колонку уплотняли гранулами, ресуспендированными в одном объеме слоя PBS. Для модуляции степени повторного окисления необязательно добавляли от 50 нМ до 1 мкМ хлорида меди. Прогресс повторного окисления отслеживали путем изъятия небольшого тестируемого образца из смолы, элюирования в буфере для элюирования IgG (Thermo) и анализа с помощью RP-HPLC, как описано выше. Как только повторное окисление продвигалось до требуемой полноты, можно было инициировать конъюгацию путем непосредственного добавления 2-3 молярного избытка соединения относительно введенных путем конструирования цистеинов и обеспечения возможности прохождения реакции в смеси в течение 5-10 минут при комнатной температуре перед промывкой колонки с помощью по меньшей мере 20 объемов колонки PBS. Конъюгаты антитела элюировали с помощью буфера для элюирования IgG и нейтрализовали с помощью 0,1 объема 0,5 M фосфата натрия, pH 8,0, и проводили замену буфера на PBS. В некоторых случаях, вместо инициирования конъюгации с антителом на смоле колонку промывали с помощью по меньшей мере 20 объемов колонки PBS, и антитело элюировали с помощью буфера для элюирования IgG и нейтрализовали с помощью буфера с pH 8,0. Затем антитела либо применяли для реакций конъюгации, либо подвергали мгновенному замораживанию для будущего применения.
В некоторых случаях требовалась конъюгация по нативным Cys-остаткам, таким как остатки, которые обычно образуют межцепочечную дисульфидную связь между тяжелой цепью и легкой цепью, и Cys-остатки в шарнирной области антитела, которые обычно образуют межцепочечные дисульфидные связи между тяжелой цепью и тяжелой цепью, в отсутствие введенных путем конструирования Cys-остатков или одновременно с конъюгацией, также направленной на введенные путем конструирования Cys-остатки. В таких случаях антитело или фрагмент антитела восстанавливали путем добавления 5-кратного избытка TCEP относительно дисульфидных связей и инкубации образца при 37°C в течение 1 часа. Затем образцы непосредственно подвергали конъюгации или замораживали при < -60°C для будущей конъюгации. К антителам или фрагментам антител в PBS-буфере (pH 7,2) добавляли малеимидсодержащие соединения, как правило, при отношениях 2:1 к Cys-остаткам, применяемым для конъюгации, и инкубации проводили в течение 1 часа. Как правило, избыток свободного соединения удаляли с помощью обессоливающей колонки, а затем более интенсивной заменой буфера на PBS.
Конъюгация по лизиновым остаткам может проводиться за счет осуществления реакции антител или фрагментов антитела с соединением линкер-лекарственное средство, которое содержит группу, реагирующую с аминной группой, такую как NHS-сложноэфирная или тетрафторфенилсложноэфирная (например, соединение (7), SMCC-DM1, сульфо-SPDB-DM4 или SPDB-DM4). В качестве примера соединение (7) конъюгировали по лизиновым остаткам на Fab к HER2-HC-E152C. Конкретно, Fab к HER2-HC-E152C экспрессировали с помощью временной трансфекции в клетках HEK293. Fab захватывали из среды с помощью аффинной очистки с capto-L (GE Healthcare), элюировали в буфер для элюирования IgG (Pierce) и проводили замену буфера на PBS с помощью ультрацентрифужного концентратора (Amicon). К раствору Fab (5,8 мг/мл) добавляли 2-кратный молярный избыток соединения (7). Смесь инкубировали при комнатной температуре в течение 30 минут и затем смесь гасили с помощью 50 мМ Tris, pH 8. Затем полученный конъюгат очищали с помощью препаративной SEC в PBS.
Получение фрагментов антител из полноразмерных антител
В некоторых случаях фрагменты антител получали путем генетической манипуляции с кодирующей последовательностью тяжелой цепи антитела, как описано выше, вследствие чего продуктом экспрессии был фрагмент антитела. В других случаях антитела получали путем ферментативного расщепления полноразмерных антител.
Для получения фрагментов Fab, содержащих остатки 1-222 (нумерация EU) исходного антитела, полноразмерное антитело обрабатывали смолой с иммобилизированным папаином (ThermoFisher Scientific) в соответствии с протоколом производителя. Вкратце, смолу с иммобилизированным папаином готовят путем уравновешивания в буфере для расщепления из свежерастворенного 20 мМ цистеина-HCl, доведенного до pH 7,0. Содержание антитела доводят до примерно 10 мг/мл и проводят замену буфера на буфер для расщепления и добавляют к смоле при отношении, составляющем 4 мг IgG на мл смолы, и инкубируют при 37°C в течение 5-7 часов. Затем смолу удаляют и фрагмент антитела очищают с помощью любой из подходящих аффинных смол, например, интактный IgG и фрагмент Fc отделяют от фрагмента Fab за счет связывания со смолой с белком A, или разделение проводят с помощью эксклюзионной хроматографии.
Для получения фрагментов F(ab')2, содержащих остатки 1-236 (нумерация EU) исходного антитела, полноразмерное антитело обрабатывали с помощью протеолитического фермента. Вкратце, антитело готовят в PBS из расчета примерно 10 мг/мл. Фермент добавляют при отношении 1:100 вес/вес и инкубируют в течение 2 часов при 37°C. Фрагмент антитела очищают с помощью любой из подходящих аффинных смол, например, интактный IgG и фрагмент Fc отделяют от фрагмента Fab за счет связывания со смолой с белком A, или разделение проводят с помощью эксклюзионной хроматографии.
Свойства конъюгатов токсина и антитела и фрагмента антитела к cKIT
Конъюгаты антитела и фрагмента антитела анализировали для определения степени конъюгации. Отношение соединения-к-антителу экстраполировали на основании данных LC-MS для восстановленных и дегликозилированных образцов (в соответствующих случаях). LC/MS обеспечивает возможность получения количественной оценки среднего количества молекул линкер-полезная нагрузка (соединение), присоединенных к антителу в образце конъюгата. Жидкостная хроматография при высоких давлениях (HPLC) разделяет антитело на легкую и тяжелую цепи, а при восстанавливающих условиях разделяет тяжелую цепь (HC) и легкую цепь (LC) в соответствии с количеством групп линкер-полезная нагрузка на цепь. Данные масс-спектров позволяют идентифицировать разновидности компонентов в смеси, например, LC, LC+1, LC+2, HC, HC+1, HC+2 и т. д. На основании средней нагрузки на цепях LC и HC для конъюгата антитела можно рассчитать среднее отношение соединения к антителу. Отношение соединения-к-антителу для указанного образца конъюгата представляет собой среднее количество молекул соединения (линкер-полезная нагрузка), присоединенных к тетрамерному антителу, содержащему две легкие цепи и две тяжелые цепи.
Профиль конъюгатов определяли с применением аналитической эксклюзионной хроматографии (AnSEC) на колонках Superdex 200 10/300 GL (GE Healthcare) и/или Protein KW-803 5 мкм 300×8 мм (Shodex); агрегацию анализировали на основании аналитической эксклюзионной хроматографии.
Получение иллюстративных конъюгатов Fab cKIT и токсина
Для получения конъюгатов Fab' к cKIT и токсина DAR4 или контрольного конъюгата Fab к Her2 и токсина DAR4, 50 мг полноразмерного IgG (WT, без введенных цистеинов) расщепляли с помощью протеолитического фермента. Фрагмент F(ab')2 очищали посредством SEC на колонке Superdex-S200 (GE Healthcare). В качестве альтернативы для получения контрольных конъюгатов, связывающихся с HER2, или конъюгатов Fab' к cKIT и токсина DAR4 вектор, кодирующий HC Fab', трансфицировали в клетки CHO совместно с вектором, кодирующим LC Fab'. Экспрессированный Fab' очищали посредством захвата на смоле с белком G. F(ab')2 или Fab' восстанавливали путем добавления TCEP (5x избыток относительно числа межцепочечных дисульфидов) и проводили непосредственную реакцию с соединением по настоящему изобретению (2,5x избыток относительно числа свободных Cys-остатков). Протекание реакции отслеживали с помощью RP-HPLC, и дополнительные 1x эквиваленты соединения добавляли до завершения реакции. Свободное соединение удаляли с помощью обессоливающей колонки PD10 (GE Healthcare). Экспериментально определили, что DAR составляло ≥3,9. Специфические конъюгаты, исследованные дополнительно в предусмотренных примерах, перечислены в таблице 2.
Для получения конъюгатов Fab к cKIT и токсина DAR2 вектор, кодирующий HC Fab с введенным Cys-остатком (HC 1-221 с E152C согласно нумерации EU) трансфицировали в клетки HEK293 совместно с вектором, кодирующим LC Fab с введенным Cys-остатком (каппа-LC K107C, каппа-LC S114C или каппа-LC E165C согласно нумерации EU). Для получения контрольных конъюгатов Fab к Her2 и токсина DAR2 вектор, кодирующий HC Fab с введенным Cys-остатком (HC 1-222 с E152C согласно нумерации EU и C-концевая His6-метка (SEQ ID NO: 162)) трансфицировали в клетки HEK293 совместно с вектором, кодирующим LC Fab с введенным Cys-остатком (каппа-LC K107C, каппа-LC S114C или каппа-LC E165C согласно нумерации EU). Экспрессированные Fab очищали посредством захвата на смоле с Capto-L (GE Healthcare) и элюирования с помощью стандартного буфера для элюирования IgG (Thermo). Для Fab проводили замену буфера на PBS с применением устройства Amicon ultra. Fab восстанавливали с помощью DTT и обеспечивали возможность повторного окисления при комнатной температуре. После повторного образования межцепочечной дисульфидной связи Fab конъюгировали с соединением 6 (3x избыток относительно числа свободных Cys-остатков). Обеспечивали возможность протекания реакции в течение 30 мин при комнатной температуре и ее отслеживали с помощью RP-HPLC с обнаружением при 310 нм. Конъюгированные Fab очищали пропусканием через смолы с белком A (связывает her2) или capto-L (связывает cKIT) и промывали с помощью PBS+1% Triton X-100 и промывали с помощью большого количества PBS перед проведением элюирования в буфере для элюирования IgG. Затем для Fab проводили замену буфера на PBS с применением устройства Amicon Ultra. Специфические конъюгаты, исследованные дополнительно в предусмотренных примерах, перечислены в таблице 2 ниже с экспериментально определенными значениями DAR.
Для получения конъюгатов F(ab')2 к cKIT и токсина DAR2 вектор, кодирующий HC с введенными Cys-остатками (E152C и S375C согласно нумерации EU), трансфицировали в клетки CHO совместно с вектором, кодирующим LC Fab. Для получения контрольных конъюгатов F(ab')2 к Her2 и токсина DAR2 вектор, кодирующий HC с введенными Cys-остатками (E152C и S375C согласно нумерации EU), трансфицировали в клетки HEK293 совместно с вектором, кодирующим LC Fab. Экспрессированные IgG очищали посредством захвата на смоле с белком A или смоле MabSelectSure (GE Healthcare) и элюирования с помощью стандартного буфера для элюирования IgG (Thermo). Полноразмерные IgG восстанавливали с помощью DTT при комнатной температуре и повторно окисляли после удаления DTT, что отслеживали с помощью RP-HPLC. Затем повторно окисленные IgG расщепляли с помощью протеолитического фермента для получения фрагментов F(ab')2. В случае фрагментов, связывающих cKIT, для F(ab')2 проводили замену буфера на PBS с применением устройства Amicon ultra. В случае фрагментов, связывающих HER2, фракцию F(ab')2 обогащали с помощью препаративной HIC, а затем проводили замену буфера на PBS с применением устройства Amicon ultra. F(ab')2 конъюгировали с соединением 4 или соединением 5 (4x избыток относительно числа свободных Cys-остатков). Обеспечивали возможность протекания реакции в течение 30 мин при комнатной температуре и ее отслеживали с помощью RP-HPLC с обнаружением при 310 нм. Конъюгированные F(ab')2 очищали пропусканием через смолы с capto-L (Ab3 к cKIT), и промывали с помощью PBS+1% Triton X-100, и промывали с помощью большого количества PBS перед элюированием в буфере для элюирования IgG или с помощью препаративной SEC (антитело к her2 и Ab4 к cKIT). Затем F(ab')2 концентрировали и проводили замену буфера на PBS с применением устройства Amicon Ultra. Специфические конъюгаты, исследованные дополнительно в предусмотренных примерах, перечислены в таблице 2 ниже с экспериментально определенными значениями DAR.
Для получения конъюгатов Fab к cKIT и токсина DAR1 вектор, кодирующий HC с введенными Cys-остатками (E152C согласно нумерации EU), трансфицировали в клетки HEK293 совместно с вектором, кодирующим LC Fab. Экспрессированные IgG очищали посредством захвата на смоле с белком A (GE Healthcare) и элюирования с помощью стандартного буфера для элюирования IgG (Thermo). Полноразмерные IgG восстанавливали с помощью DTT при комнатной температуре и повторно окисляли после удаления DTT, что отслеживали с помощью RP-HPLC. IgG расщепляли с помощью иммобилизированного папаина (Thermo) для получения фрагмента Fab. Для Fab проводили замену буфера на PBS с применением устройства Amicon ultra. Fab конъюгировали с соединением 4 (4x избыток относительно числа свободных Cys-остатков). Обеспечивали возможность протекания реакции в течение 30 мин при комнатной температуре и ее отслеживали с помощью RP-HPLC с обнаружением при 310 нм. Конъюгированные Fab очищали посредством препаративной SEC в PBS.
Для получения контрольных конъюгатов Fab к Her2 и токсина DAR1 вектор, кодирующий HC Fab с введенными Cys-остатками (E152C согласно нумерации EU), трансфицировали в клетки HEK293 совместно с вектором, кодирующим LC Fab. Экспрессированные Fab очищали посредством захвата на смоле с Capto-L (GE Healthcare) и элюирования с помощью стандартного буфера для элюирования IgG (Thermo). Для Fab проводили замену буфера на PBS с применением устройства Amicon ultra. Fab конъюгировали с соединением 7 (2x молярный избыток относительно числа Fab). Обеспечивали возможность протекания реакции в течение 30 мин при комнатной температуре и ее отслеживали с помощью RP-HPLC с обнаружением при 310 нм. Конъюгацию останавливали с помощью 50 мМ Tris, pH 8,0. Конъюгированные Fab очищали посредством препаративной SEC в PBS.
Таблица 2. Иллюстративные конъюгаты, связывающие cKIT, или контрольные конъюгаты
(SEQ ID NO: 146)
(SEQ ID NO: 147)
(SEQ ID NO: 148)
(SEQ ID NO: 153)
(SEQ ID NO: 154)
(SEQ ID NO: 155)
(SEQ ID NO: 156)
(SEQ ID NO: 157)
Пример 2. Получение белков внеклеточного домена cKIT человека, яванского макака, мыши и крысы, а также субдоменов 1-3 и 4-5 cKIT для анализов связывания
Гены внеклеточных доменов (ECD) cKIT человека, мыши и крысы синтезировали на основании аминокислотных последовательностей из баз данных GenBank или Uniprot (см. таблицу 3 ниже). Ген на основе кДНК-шаблона для cKIT и 1 ECD яванского макака синтезировали на основании информации об аминокислотных последовательностях, полученной с применением мРНК из различных тканей яванского макака (например, полученных из Zyagen Laboratories; таблица 4 ниже). Все синтезированные фрагменты ДНК клонировали в подходящие векторы экспрессии, например, вектор на основе hEF1-HTLV (pFUSE-mIgG2A-Fc2) с C-концевыми метками для обеспечения возможности очистки.
Таблица 3. Последовательности конструкций на основе cKIT человека, мыши, крысы
QPSVSPGEPSPPSIHPGKSDLIVRVGDEIRLLCTDPGFVKWTFEILDETNENKQNEWITEKAEATNTGKYTCTNKHGLSNSIYVFVRDPAKLFLVDRSLYGKEDNDTLVRCPLTDPEVTNYSLKGCQGKPLPKDLRFIPDPKAGIMIKSVKRAYHRLCLHCSVDQEGKSVLSEKFILKVRPAFKAVPVVSVSKASYLLREGEEFTVTCTIKDVSSSVYSTWKRENSQTKLQEKYNSWHHGDFNYERQATLTISSARVNDSGVFMCYANNTFGSANVTTTLEVVDKGFINIFPMINTTVFVNDGENVDLIVEYEAFPKPEHQQWIYMNRTFTDKWEDYPKSENESNIRYVSELHLTRLKGTEGGTYTFLVSNSDVNAAIAFNVYVNTKPEILTYDRLVNGMLQCVAAGFPEPTIDWYFCPGTEQRCSASVLPVDVQTLNSSGPPFGKLVVQSSIDSSAFKHNGTVECKAYNDVGKTSAYFNFAFKEQIHPHTLFTPRSHHHHHH
QPSVSPGEPSPPSIHPGKSDLIVRVGDEIRLLCTDPGFVKWTFEILDETNENKQNEWITEKAEATNTGKYTCTNKHGLSNSIYVFVRDPAKLFLVDRSLYGKEDNDTLVRCPLTDPEVTNYSLKGCQGKPLPKDLRFIPDPKAGIMIKSVKRAYHRLCLHCSVDQEGKSVLSEKFILKVRPAFKAVPVVSVSKASYLLREGEEFTVTCTIKDVSSSVYSTWKRENSQTKLQEKYNSWHHGDFNYERQATLTISSARVNDSGVFMCYANNTFGSANVTTTLEVVDKGRSHHHHHH
GFINIFPMINTTVFVNDGENVDLIVEYEAFPKPEHQQWIYMNRTFTDKWEDYPKSENESNIRYVSELHLTRLKGTEGGTYTFLVSNSDVNAAIAFNVYVNTKPEILTYDRLVNGMLQCVAAGFPEPTIDWYFCPGTEQRCSASVLPVDVQTLNSSGPPFGKLVVQSSIDSSAFKHNGTVECKAYNDVGKTSAYFNFAFKGNNKEQIHPHTLFTPRSHHHHHH
SQPSASPGEPSPPSIHPAQSELIVEAGDTLSLTCIDPDFVRWTFKTYFNEMVENKKNEWIQEKAEATRTGTYTCSNSNGLTSSIYVFVRDPAKLFLVGLPLFGKEDSDALVRCPLTDPQVSNYSLIECDGKSLPTDLTFVPNPKAGITIKNVKRAYHRLCVRCAAQRDGTWLHSDKFTLKVRAAIKAIPVVSVPETSHLLKKGDTFTVVCTIKDVSTSVNSMWLKMNPQPQHIAQVKHNSWHRGDFNYERQETLTISSARVDDSGVFMCYANNTFGSANVTTTLKVVEKGFINISPVKNTTVFVTDGENVDLVVEYEAYPKPEHQQWIYMNRTSANKGKDYVKSDNKSNIRYVNQLRLTRLKGTEGGTYTFLVSNSDASASVTFNVYVNTKPEILTYDRLINGMLQCVAEGFPEPTIDWYFCTGAEQRCTTPVSPVDVQVQNVSVSPFGKLVVQSSIDSSVFRHNGTVECKASNDVGKSSAFFNFAFKEQIQAHTLFTPLEVLFQGPRSPRGPTIKPCPPCKCPAPNLLGGPSVFIFPPKIKDVLMISLSPIVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNKDLPAPIERTISKPKGSVRAPQVYVLPPPEEEMTKKQVTLTCMVTDFMPEDIYVEWTNNGKTELNYKNTEPVLDSDGSYFMYSKLRVEKKNWVERNSYSCSVVHEGLHNHHTTKSFSRTPGK
SQPSASPGEPSPPSIQPAQSELIVEAGDTIRLTCTDPAFVKWTFEILDVRIENKQSEWIREKAEATHTGKYTCVSGSGLRSSIYVFVRDPAVLFLVGLPLFGKEDNDALVRCPLTDPQVSNYSLIECDGKSLPTDLKFVPNPKAGITIKNVKRAYHRLCIRCAAQREGKWMRSDKFTLKVRAAIKAIPVVSVPETSHLLKEGDTFTVICTIKDVSTSVDSMWIKLNPQPQSKAQVKRNSWHQGDFNYERQETLTISSARVNDSGVFMCYANNTFGSANVTTTLKVVEKGFINIFPVKNTTVFVTDGENVDLVVEFEAYPKPEHQQWIYMNRTPTNRGEDYVKSDNQSNIRYVNELRLTRLKGTEGGTYTFLVSNSDVSASVTFDVYVNTKPEILTYDRLMNGRLQCVAAGFPEPTIDWYFCTGAEQRCTVPVPPVDVQIQNASVSPFGKLVVQSSIDSSVFRHNGTVECKASNAVGKSSAFFNFAFKGNSKEQIQPHTLFTPRSLEVLFQGPGSpplkecppcaapdllggpsvfifppkikdvlmislspmvtcvvvdvseddpdvqiswfvnnvevhtaqtqthredynstlrvvsalpiqhqdwmsgkefkckvnnralpspiektiskprgpvrapqvyvlpppaeemtkkefsltcmitgflpaeiavdwtsngrteqnykntatvldsdgsyfmysklrvqkstwergslfacsvvheglhnhlttktisrslgk
Таблица 4. Последовательности белка cKIT яванского макака
cKIT яванского макака, остатки 25-520-МЕТКА
Экспрессия рекомбинантных белков ECD cKIT
Требуемые рекомбинантные белки cKIT экспрессировали в линиях клеток, происходящих от клеток HEK293 (293FS), предварительно адаптированных для суспензионного культивирования и выращиваемых в бессывороточной среде FreeStyle-293 (Gibco, № по каталогу 12338018). Получение белка как в малом масштабе, так и в большом масштабе осуществляли посредством временной трансфекции и проводили в нескольких смесительных колбах (Nalgene), объемом не более 1 л каждая, с 293Fectin® (Life Technologies, № по каталогу 12347019) в качестве переносчика плазмид. Общую ДНК и 293Fectin применяли при отношении 1:1,5 (вес:объем). Отношение ДНК к культуре составляло 1 мг/л. Супернатанты культуры клеток собирали через 3-4 дня после трансфекции, центрифугировали и стерилизовали фильтрацией до очистки.
Очистка меченых белков ECD
Рекомбинантные белки внеклеточного домена cKIT с Fc-меткой (например, ECD-Fc cKIT человека, cKIT человека (субдомены 1-3, 4-5 ECD)-Fc, cKIT яванского макака-mFc, cKIT крысы-mFc, cKIT мыши-mFc) очищали из супернатанта культуры клеток. Просветленный супернатант пропускали через колонку Sepharose® с белком A, которая была уравновешена с помощью PBS. После промывки до исходного уровня связанный материал элюировали с помощью буфера для элюирования Pierce Immunopure® с низким pH или 100 мМ глицина (pH 2,7) и сразу нейтрализовали с помощью 1/8 объема элюирования 1 M Tris, pH 9,0. Объединенный белок концентрировали при необходимости с применением 15-мл центрифужных концентраторов Amicon® Ultra с отсечением по номинальной молекулярной массе 10 кДа или 30 кДа. Затем пулы очищали с помощью SEC с применением колонки Superdex® 200 26/60 для удаления агрегатов. Затем характеристики очищенного белка определяли с помощью SDS-PAGE и SEC-MALLS (многоугловое лазерное светорассеяние). Концентрацию определяли по поглощению при 280 нм с применением теоретических коэффициентов поглощения, рассчитанных на основании последовательности с помощью Vector NTI.
Пример 3. Связывание Fab к cKIT с субдоменами ECD cKIT
Чтобы улучшить определение сайтов связывания Ab к cKIT, ECD cKIT человека разделяли на cубдомены 1-3 (домен связывания лиганда) и субдомены 4-5 (домен димеризации). Чтобы определить, какие субдомены связывались, использовали анализ сэндвич-ELISA. 1 мкг/мл ECD, разбавленных в 1X забуференным фосфатом солевом растворе, соответствующих субдоменам 1-3, субдоменам 4-5 cKIT или полноразмерному ECD cKIT, покрывали 96-луночные планшеты Immulon® 4-HBX (Thermo Scientific, № по каталогу 3855, Рокфорд, Иллинойс) и инкубировали в течение ночи при 4°C. Планшеты промывали трижды с помощью буфера для промывки (1X забуференный фосфатом солевой раствор (PBS) с 0,01% Tween-20 (Bio-Rad 101-0781)). Планшеты блокировали с помощью 280 мкл/лунка 3% бычьего сывороточного альбумина, разбавленного в 1X PBS, в течение 2 часов при комнатной температуре. Планшеты промывали трижды с помощью буфера для промывки. Антитела готовили из расчета 2 мкг/мл в буфере для промывки с 5-кратными разбавлениями для получения 8 точек и добавляли в планшеты для ELISA из расчета 100 мкл/лунка в трех повторностях. Планшеты инкубировали на орбитальном шейкере со встряхиванием при 200 об/мин в течение 1 часа при комнатной температуре. Планшеты для анализа промывали трижды с помощью буфера для промывки. Вторичное антитело, фрагмент козьего антитела F(ab')2 к человеческому IgG (H+L) (Jackson Immunoresearch, № по каталогу 109-036-088, Вест-Грув, Пенсильвания), готовили при отношении 1:10000 в буфере для промывки и добавляли в планшеты для ELISA из расчета 100 мкл/лунка. Планшеты инкубировали с вторичным антителом в течение 1 часа при комнатной температуре со встряхиванием при 200 об/мин на орбитальном шейкере. Планшеты для анализа промывали трижды с помощью буфера для промывки. Для проявления сигнала ELISA в планшеты добавляли по 100 мкл/лунка TMB-субстрата Sure blue ® (KPL, № по каталогу 52-00-03, Гейтерсбург, Мэриленд) и обеспечивали возможность инкубации в течение 10 минут при комнатной температуре. Для остановки реакции в каждую лунку добавляли по 50 мкл 1 н. хлористоводородной кислоты. Поглощение измеряли при 450 нм с применением планшет-ридера SpectraMax® M5 от Molecular Devices. Чтобы определить ответ на связывание для каждого антитела, показатели оптической плотности усредняли, получали стандартное отклонение значений и наносили на график с применением Excel. Характеристики связывания с cKIT для индивидуальных антител к cKIT можно найти в таблице 5.
Пример 4. Показатели аффинности антител к cKIT
Аффинность антител в отношении ортологов cKIT разных видов, а также в отношении cKIT человека определяли с применением технологии SPR с применением устройства Biacore® 2000 (GE Healthcare, Питтсбург, Пенсильвания) и сенсорных чипов CM5.
Вкратце, в качестве подвижного буфера для всех экспериментов применяли HBS-P (0,01 M HEPES, pH 7,4, 0,15 M NaCl, 0,005% Surfactant P20), дополненный 2% блокирующего буфера Odyssey® (Li-Cor Biosciences, Линкольн, Невада). Уровень иммобилизации и взаимодействий аналитов измеряли по единицам ответа (RU). Пилотные эксперименты осуществляли для тестирования и подтверждения применимости иммобилизации антитела к человеческой Fc-области (номер по каталогу BR100839, GE Healthcare, Питтсбург, Пенсильвания) и захвата тестируемых антител.
Для измерения кинетических показателей осуществляли эксперименты, в которых антитела захватывали на поверхности сенсорного чипа посредством иммобилизированного антитела к человеческой Fc-области, и определяли способность связывания белков cKIT в свободном растворе. Вкратце, 25 мкг/мл антитела к человеческой Fc-области, pH 5, иммобилизировали на сенсорном чипе CM5 за счет иммобилизации по аминной группе, при расходе, составляющем 5 мкл/мин, в обеих проточных ячейках до достижения 10500 RU. Затем инъецировали 0,1-1 мкг/мл тестируемых антител при расходе 10 мкл/мин в течение 1 минуты. Уровни захваченных антител обычно поддерживали ниже 200 RU. Впоследствии внеклеточные домены (ECD) рецептора cKIT разбавляли в виде серии 2-кратных разведений с концентрацией 3,125-50 нМ и инъецировали при расходе, составляющем 40 мкл/мин, в течение 3 мин через обе эталонную и тестируемую проточные ячейки. Протестированные ECD перечислены в таблице ниже (таблица 5). Диссоциацию связывания ECD отслеживали в течение 10 мин. После каждого цикла впрыскиваний поверхность чипа регенерировали с помощью 3 M MgCl2 при расходе 10 мкл/мин в течение 30 секунд. Все эксперименты осуществляли при 25°C и данные ответа глобально аппроксимировали с простой моделью взаимодействия 1:1 (с применением программного обеспечения Scrubber 2 ®, версия 2.0b (BioLogic Software), для получения оценок константы ассоциации (ka), константы диссоциации (kd) и аффинности (KD). В таблице 6 перечислены связывание доменов и аффинность для выбранных антител к cKIT.
Таблица 5. Изотип и источник ECD cKIT
Таблица 6. Аффинность и перекрестная реактивность антител
ECD cKIT яванского макака в SET
cKIT мыши
cKIT крысы
Пример 5. In vitro анализы цитолиза человеческих и мышиных клеток под действием ADC, связывающих cKIT
In vitro анализы жизнеспособности HSC
Человеческие мобилизированные гемопоэтические стволовые клетки (HSC) периферической крови получали из HemaCare (номер по каталогу M001F-GCSF-3). Каждый флакон, содержащий ~1 миллион клеток, оттаивали и разбавляли в 10 мл 1X HBSS и центрифугировали в течение 7 минут при 1200 об/мин. Клеточный осадок ресуспендировали в 18 мл ростовой среды, содержащей три фактора роста (StemSpan SFEM (StemCell Technologies, номер по каталогу 09650) с 50 нг/мл каждого из TPO (R&D Systems, номер по каталогу 288-TP) лиганда Flt3 (Life Technologies, номер по каталогу PHC9413) и IL-6 (Life Technologies, номер по каталогу PHC0063), дополненная аминокислотами (Gibco, номер по каталогу 10378-016)).
Клетки костного мозга от мышей C57BL/6J собирали из бедренных и большеберцовых костей, ресуспендировали в IMDM (HyClone, номер по каталогу SH30228.01) и объединяли. Клетки центрифугировали в течение 10 минут при 300 g. Клеточный осадок ресуспендировали в буфере AutoMACS (1X PBS+0,5% BSA+2 мМ EDTA) при концентрации 100 миллионов клеток в 40 мкл. Смесь антител для истощения по линии дифференцировки (Miltenyi, номер по каталогу 130-090-858) добавляли при концентрации 10 мкл на 100 миллионов клеток. Клетки инкубировали в течение 10 минут в холодной комнате перед добавлением 30 мкл буфера AutoMACS и 20 мкл биотинилированных магнитных гранул на 100 миллионов клеток. Данную новую суспензию инкубировали в холодной комнате в течение 15 минут. Клетки центрифугировали в течение 10 минут при 300 g. Осадок ресуспендировали в 2 мл буфера AutoMACS и пропускали через фильтр для клеток. Клетки отбирали на AutoMACS с применением протокола "истощения". Отрицательную фракцию из сортера центрифугировали в течение 10 минут при 300 g и ресуспендировали в 1 мл HBSS. Ресуспендированные клетки окрашивали с помощью антитела к CD45-PerCP-Cy5.5 (Becton Dickinson, номер по каталогу 550994), антитела к CD48-FITC (eBioscience, номер по каталогу 11-0481-82), антитела к CD150-PE (BioLegend, номер по каталогу 115904) и антитела к Sca-1 (Becton Dickinson, номер по каталогу 560653). Клетки инкубировали при комнатной температуре в течение 30 минут, центрифугировали в течение 5 минут при 300 g и ресуспендировали в 700 мкл буфера FACS для сортировки. Sca-1+ клетки были положительными при сортировке на FACS Aria. После сортировки клетки помещали в ростовые среды, содержащие три фактора роста (StemSpan SFEM с 50 нг/мл TPO (R&D Systems, номер по каталогу 288-TP), лиганда Flt3 (Life Technologies, номер по каталогу PHC9413) и IL-6 (Life Technologies, номер по каталогу PHC0063), дополненная аминокислотами (Gibco, номер по каталогу 10378-016)).
Тестируемые средства разбавляли в двух повторностях в 384-луночном черном планшете для анализа при конечном объеме, составляющем 5 мкл, начиная с 10 мкг/мл и последовательно разводя 1:3. Клетки, полученные выше, добавляли в каждую лунку при конечном объеме, составляющем 45 мкл. Клетки инкубировали при 37°C и 5% кислорода в течение 7 дней. В конце культивирования клетки собирали для окрашивания путем центрифугирования планшета для анализа в течение 4 минут при 1200 об/мин. Затем супернатанты аспирировали, а клетки промывали и переносили в другой 384-луночный планшет (Greiner Bio-One, обработанный для TC, с черными прозрачными лунками с плоским дном, номер по каталогу 781092).
В случае анализов с человеческими клетками каждую лунку окрашивали с помощью антитела к CD34-PerCP (Becton Dickinson, номер по каталогу 340666) и антитела к CD90-APC (Becton Dickinson, номер по каталогу 559869), промывали и ресуспендировали в буфере FACS до конечного объема, составляющего 50 мкл. В случае анализов с мышиными клетками каждую лунку окрашивали с помощью антитела к CD45-PerCP-Cy5.5 (Becton Dickinson, номер по каталогу 550994), антитела к CD48-FITC (eBioscience, номер по каталогу 11-0481-82), антитела к CD150-PE (BioLegend, номер по каталогу 115904), антитела к cKIT-APC (Becton Dickinson, номер по каталогу 553356) и антитела к Sca-1 (Becton Dickinson, номер по каталогу 560653), промывали и ресуспендировали в буфере FACS до конечного объема, составляющего 50 мкл. Затем клетки анализировали на проточном цитометре Becton Dickinson Fortessa и проводили количественную оценку анализа.
Конъюгаты токсина с антителами и фрагментами антител, распознающими cKIT, приводили к цитолизу HSC, как определено в данном анализе. Количественная оценка клеток с помощью FACS показала меньшее число жизнеспособных клеток в лунках, обработанных с помощью конъюгатов токсина, связывающих cKIT, чем в контрольных лунках, обработанных с помощью PBS или конъюгатов токсина с антителами и фрагментами антител изотипического контроля. Данные показаны на ФИГ. 1, ФИГ. 2 и ФИГ. 9 и обобщены в таблице 7. Используемое в данном документе условное название J№ соответствует специфическому № конъюгата, описанному в таблице 2.
Таблица 7. Жизнеспособность клеток после обработки конъюгатами Fab к cKIT и токсина
Пример 6. In vitro анализ дегрануляции человеческих мастоцитов
Зрелые мастоциты получали с применением CD34+ предшественников из мобилизированной периферической крови. CD34+ клетки культивировали в StemSpan SFEM (StemCell Technologies), дополненной рекомбинантным человеческим фактором роста стволовых клеток (rhSCF, 50 нг/мл, Gibco), рекомбинантным человеческим интерлейкином 6 (rhIL-6, 50 нг/мл, Gibco), рекомбинантным человеческим IL-3 (30 нг/мл, Peprotech), GlutaMAX (2 нМ, Gibco), пенициллином (100 Ед/мл, Hyclone) и стрептомицином (100 мкг/мл, Hyclone). Рекомбинантный hIl-3 добавляли только во время первой недели культивирования. После третьей недели половину среды заменяли еженедельно свежей средой, содержащей rhIL-6 (50 нг/мл) и rhSCF (50 нг/мл). Чистоту зрелых мастоцитов оценивали по окрашиванию на поверхности клеток высокоаффинного рецептора IgE (FCεRI, eBioscience) и CD117 (BD). Применяли клетки на 8-12 неделе культивирования.
Полученные мастоциты промывали один раз для удаления SCF и требуемое количество клеток инкубировали в течение ночи в среде для мастоцитов, содержащей rhIL-6 (50 нг/мл) с rhSCF (50 нг/мл) или без него. В качестве положительного контроля дегрануляции мастоцитов порцию клеток сенсибилизировали с помощью человеческого IgE миеломы (100 нг/мл, EMD Millipore). На следующий день готовили разбавления антитела или фрагментов антител к cKIT или их конъюгатов с токсином, мышиного моноклонального антитела к человеческому IgG1 (Fab-специфическое, Sigma), козьего антитела к человеческому IgE (Abcam) и соединения 48/80 (Sigma) в буфере HEPES для дегрануляции (10 мМ HEPES, 137 мМ NaCl, 2,7 мМ KCl, 0,4 мМ двухосновного фосфата натрия, 5,6 мМ глюкозы, pH доведен до 7,4, и смешанный с 1,8 мМ хлорида кальция и 1,3 мМ сульфата магния), дополненном 0,04% бычьего сывороточного альбумина (BSA, Sigma). Тестируемые средства и антитела к IgG1 смешивали вместе в 384-луночном планшете для анализа с лунками с V-образным дном, при этом антитела к IgE и соединение 48/80 тестировали отдельно. Планшет для анализа инкубировали 30 мин при 37°C. Во время инкубации клетки промывали 3 раза с помощью буфера HEPES для дегрануляции+0,04% BSA для удаления среды и несвязанного IgE. Клетки ресуспендировали в буфере HEPES для дегрануляции+0,04% BSA и высевали из расчета 3000 клеток на лунку в планшет для анализа при конечном объеме реакционной смеси, составляющем 50 мкл. Клетки, которые сенсибилизировали с помощью IgE, применяли только с антителом к IgE в качестве положительного контроля дегрануляции. Чтобы произошла дегрануляция, планшет для анализа инкубировали 30 мин при 37°C. Во время данной инкубации буфер p-нитро-N-ацетил-β-D-глюкозамина (pNAG, Sigma) готовили путем обработки ультразвуком 3,5 мг/мл pNAG в цитратном буфере (40 мМ лимонной кислоты, 20 мМ двухосновного фосфата натрия, pH 4,5). Высвобождение β-гексозаминидазы измеряли путем смешивания 20 мл супернатанта клеток с 40 мкл раствора pNAG в 384-луночном планшете с лунками с плоским дном. Данный планшет инкубировали в течение 1,5 часа при 37°C и реакцию останавливали добавлением 40 мкл стоп-раствора (400 мМ глицин, pH 10,7). Поглощение считывали с применением планшет-ридера при λ=405 нм с эталонным фильтром при λ=620 нм.
Контроли в виде полноразмерных IgG, применяемые в анализах дегрануляции мастоцитов, описаны в таблице 8.
Таблица 8. Контроли в виде полноразмерных IgG, применяемые в анализах дегрануляции мастоцитов
(SEQ ID NO: 150)
Как показано на ФИГ. 3A, некоторые клоны класса антагонистических антител к cKIT с меньшей вероятностью вызывают дегрануляцию мастоцитов. Можно дополнительно предположить, что фрагмент Fab или Fab' не может вызывать дегрануляцию мастоцитов. После сшивания с Fab-специфическим антителом (ФИГ. 3C-3J) полноразмерный IgG, в отличие от формата Fab' к cKIT-токсин DAR4, демонстрирует усиление дегрануляции. Это позволяет предположить, что фрагмент Fab' не вызывает дегрануляцию мастоцитов, даже будучи сшитым и мультимеризованным в более крупные комплексы, которые можно было бы наблюдать в случае, когда у пациента выработались или имелись предсуществующие антитела к лекарственному средству, распознающие фрагменты Fab или Fab'.
Пример 7. In vivo разрушение человеческих HSC из хозяина-мыши
Чтобы оценить эффективность тестируемых средств в отношении человеческих HSC in vivo, мышам, имеющим тяжелую иммунную недостаточность (NOD.Cg-Prkdcscid IL2rgtm1Wjl/SzJ, Jackson Laboratory, номер артикула 005557, также известные как NSG), трансплантировали человеческие HSC после проведения сублетального облучения (250 рад в виде гамма-облучения 137Cs). CD34+ гемопоэтические стволовые клетки (HSC) получали от AllCells (номер по каталогу CB008F-S). Каждый флакон, содержащий ~1 миллион клеток, оттаивали, разбавляли в 10 мл 1X HBSS и центрифугировали в течение 7 минут при 1200 об/мин. Клеточный осадок ресуспендировали в HBSS из расчета 100000 клеток/мл. Через 24 часа после облучения всего 20000 клеток на мышь трансплантировали путем инъекции в ретро-орбитальный синус. Человеческим HSC обеспечивали возможность приживления у мышей NSG в течение по меньшей мере 4 недель. Процент химеризма человеческих клеток определяли с помощью проточной цитометрии образцов крови. Для этого кровь окрашивали с помощью следующих антител: антитела к CD45 человека-e450 (eBioscience, № по каталогу 48-0459-42), антитела к CD45 мыши-APC (Becton Dickinson, № по каталогу 559864), антитела к CD33 человека-Pe (Becton Dickinson, № по каталогу 347787), антитела к CD19 человека-FITC (Becton Dickinson, № по каталогу 555422) и антитела к CD3 человека-PeCy7 (Becton Dickinson, № по каталогу 557851). Как только химеризм человеческих клеток был подтвержден, гуманизированным мышам NSG вводили дозу тестируемого средства внутрибрюшинно, b.i.d. Степень химеризма человеческих клеток повторно оценивали после введения дозы. Чтобы оценить присутствие или отсутствие человеческих HSC, мышей умерщвляли и костный мозг выделяли и окрашивали с помощью следующих антител: антитела к CD45 человека-e450 (eBioscience, № по каталогу 48-0459-42), антитела к CD45 мыши-APC (Becton Dickinson, № по каталогу 559864), антитела к CD34 человека-PE (Becton Dickinson, № по каталогу 348057), антитела к CD38 человека-FITC (Becton Dickinson, № по каталогу 340926), антитела к CD11b человека-PE (Becton Dickinson, № по каталогу 555388), антитела к CD33 человека-PeCy7 (Becton Dickinson, № по каталогу 333946), антитела к CD19 человека-FITC (Becton Dickinson, № по каталогу 555412) и антитела к CD3 человека-PeCy7 (Becton Dickinson, № по каталогу 557851). Популяции клеток оценивали посредством проточной цитометрии и анализировали с помощью FlowJo.
В одном конкретном эксперименте мышам вводили дозу 10 мг/кг конъюгата J7 (описанного в таблице 2) дважды в день в течение 1, 2 или 4 дней или конъюгата антитела изотипического контроля J8 дважды в день в течение 4 дней. Мышей умерщвляли в день 21 и их костный мозг анализировали. Как показано на ФИГ. 4, у мышей, обработанных с помощью конъюгата J7 в течение даже 1 дня, показано разрушение человеческих HSC (человеческие CD45+ клетки, человеческие CD34+ клетки, человеческие CD38- клетки), при этом у мышей, обработанных с помощью конъюгата с антителом изотипического контроля, J8, показан неоднородный химеризм, по-видимому, обусловленный неоднородностью при проведении гуманизации перед обработкой, на основании сравнения с группой, обработанной средой-носителем (PBS).
В одном конкретном эксперименте мышам вводили дозу 10 мг/кг конъюгата, связывающего cKIT, J1, J2 или J3, или конъюгата антитела изотипического контроля J6 в течение 2 дней. Мышей умерщвляли в день 21 и их костный мозг анализировали. Как показано на ФИГ. 5, у мышей, обработанных с помощью конъюгата, связывающего cKIT, J1, J2, или J3, показано снижение числа человеческих HSC (человеческие CD45+ клетки, человеческие CD34+ клетки, человеческие CD38- клетки), при этом у мышей, обработанных с помощью конъюгата антитела изотипического контроля, J6, показан неоднородный химеризм.
В одном конкретном эксперименте мышам вводили дозу 10 мг/кг конъюгата, связывающего cKIT, JW, JX, JY или JZ, в течение 2 дней. Мышей умерщвляли в день 21 и их костный мозг анализировали. Как показано на ФИГ. 13, у мышей, обработанных с помощью конъюгата, связывающего cKIT, JW, JX, JY или JZ, показано снижение числа человеческих HSC (человеческие CD45+ клетки, человеческие CD34+ клетки, человеческие CD38- клетки).
Вместе взятые, данные три эксперимента показывают, что конъюгаты Fab к cKIT и токсина или Fab' к cKIT и токсина могли разрушать HSC из костного мозга. Как конъюгаты Fab к cKIT и аманитина (например, J7), так и конъюгаты Fab' к cKIT и ауристатина (например, J1, J2, J3, JW, JX, JY) могли разрушать человеческие HSC in vivo.
Пример 8. In vivo разрушение мышиных HSC у иммунокомпетентных мышей
Чтобы оценить эффективность тестируемых средств в отношении мышиных HSC in vivo, мышам C57BL/6J (самцы, возраст 10 недель, Jackson Laboratory, № артикула 000664) вводили дозу тестируемого средства внутрибрюшинно, b.i.d. Гематологический профиль определяли не ранее чем через один день после введения последней дозы или не позднее чем через 21 день после введения последней дозы с помощью стандартных способов. Чтобы оценить присутствие или отсутствие мышиных HSC, мышей умерщвляли и костный мозг выделяли и окрашивали с помощью следующих антител: антитела к CD45 мыши-PerCP-Cy5.5 (Becton Dickinson, № по каталогу 550994), антитела к cKIT мыши-APC (Becton Dickinson, № по каталогу 553356), антитела к CD48 мыши-FITC (eBioscience, № по каталогу 11-0481-82), антитела к CD150 мыши-PE (BioLegend, № по каталогу 115904), антитела к Sca мыши-V450 (Becton Dickinson, № по каталогу 560653), антитела к Lin мыши-биотина (Miltenyi, № по каталогу 120-001-547) и Pe-Cy7-стрептавидина (Becton Dickinson, № по каталогу 557598). Популяции клеток оценивали посредством проточной цитометрии и анализировали с помощью FlowJo.
В одном конкретном эксперименте мышам дважды в день вводили дозу 10 мг/кг конъюгата, связывающего cKIT, J4 или J5 (описан в таблице 2), или PBS в течение 4 дней. Мышей умерщвляли в день 13 для проведения анализа костного мозга. У групп, обработанных с помощью конъюгата, связывающего cKIT, J4 или J5, показано значительное снижение уровней стволовых клеток и клеток-предшественников (cKIT+) в костном мозге по сравнению с контрольной группой, обработанной с помощью PBS (ФИГ. 6), это показывает, что обработка с помощью конъюгатов Fab' к cKIT и ауристатина, таких как J4 или J5, могла разрушать HSC in vivo у нормальных мышей.
Чтобы определить, является ли разрушение под действием конъюгатов антител или фрагментов антител к cKIT по настоящему изобретению достаточным для обеспечения трансплантации, мышам, обработанным, как описано выше, впоследствии можно проводить трансплантацию HSC. Например, мышам CD45.2, обработанным с помощью конъюгата Fab' к cKIT и токсина, можно трансплантировать донорские HSC, которые могут быть взяты от мышей CD45.1, через примерно одну неделю после введения дозы. В другом примере мышей, обработанных с помощью конъюгата Fab' к cKIT и токсина, можно обрабатывать с помощью иммуносупрессорного средства, такого как средство, вызывающее истощение T-клеток, через примерно одну неделю после введения дозы и за примерно 1-2 дня до проведения трансплантации донорских HSC, которые получены от мышей CD45.1. Одним способом истощения T-клеток является введение мышам антитела к β-цепи TCR мыши (клон H57-597; Biolegend) с дозой 0,5 мг на мышь, q.i.d., в течение двух дней. Истощение T-клеток можно подтвердить путем отбора образца крови для определения гематологического профиля после введения дозы. В таких примерах прогресс трансплантации будут отслеживать путем отыскания химеризма CD45.1 клеток в образцах крови. В таких примерах успех трансплантации можно определять путем умерщвления мышей через примерно 3-4 месяца или 5-6 месяцев после трансплантации для проведения анализа костного мозга с отысканием популяции CD45.1 и CD45.2 HSC. В качестве альтернативы успешную трансплантацию можно определить путем умерщвления мышей через по меньшей мере 4 или 6 месяцев после первичной трансплантации, а также за счет осуществления вторичной трансплантации полностью облученным мышам-хозяевам и отыскания химеризма CD45.1 в образцах крови после вторичной трансплантации.
Пример 9. In vitro анализ дегрануляции человеческих мастоцитов под действием полноразмерного антитела к cKIT, его фрагментов F(ab')2 и Fab и его конъюгатов
Зрелые мастоциты получали и тестировали с применением антитела к cKIT и его фрагментов F(ab')2 и Fab или конъюгатов с токсином, как описано в примере 6.
Как показано на ФИГ. 7A-7C, полноразмерное Ab4 (HC-E152C-S375C) к cKIT и фрагмент F(ab'4)2 (HC-E152C), конъюгированный с соединением (4), будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab4 (HC-E152C) при всех протестированных концентрациях. На ФИГ. 7D-7F показано, что полноразмерное Ab3 (HC-E152C-S375C) к cKIT и фрагмент F(ab'3)2 (HC-E152C), конъюгированный с соединением (3), будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab3 (E152C), конъюгированного с соединением (4), при всех протестированных концентрациях. Это позволяет предположить, что фрагмент Fab или его конъюгаты не вызывают дегрануляцию мастоцитов, даже будучи сшитыми и/или мульмеризованными в более крупные комплексы, как можно было бы наблюдать в случае, когда у пациента выработались или имелись предсуществующие антитела к лекарственному средству, распознающие фрагменты Fab. С другой стороны, фрагменты F(ab')2 и конъюгаты действительно вызывают дегрануляцию мастоцитов на уровне, аналогичном полноразмерному антителу к cKIT, будучи связанными и мультимеризованными в более крупные комплексы.
Пример 10. In vitro анализ дегрануляции человеческих мастоцитов под действием полноразмерного антитела к cKIT и его фрагментов F(ab')2 и Fab
Зрелые мастоциты получали и тестировали с применением антитела к cKIT и его фрагментов F(ab')2 и Fab к cKIT, как описано в примере 6.
Как показано на ФИГ. 8A-8C, полноразмерное Ab4 к cKIT и фрагмент F(ab'4)2, будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab4 (HC-E152C) при всех протестированных концентрациях. На ФИГ. 8D-8F показано, что полноразмерное Ab1 к cKIT и фрагмент F(ab'1)2, будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab1 (HC-E152C) при всех протестированных концентрациях. На ФИГ. 8G-8I показано, что полноразмерное Ab2 к cKIT и фрагмент F(ab'2)2, будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab2 (HC-E152C) при всех протестированных концентрациях. На ФИГ. 8J-8L показано, что полноразмерное Ab3 к cKIT и фрагмент F(ab'3)2, будучи сшитыми, вызывали дегрануляцию мастоцитов, при этом дегрануляция мастоцитов не запускалась под действием фрагмента Fab3 (HC-E152C) при всех протестированных концентрациях. Это позволяет предположить, что фрагменты Fab не вызывают дегрануляцию мастоцитов, даже будучи сшитыми и/или мульмеризованными в более крупные комплексы, как можно было бы наблюдать в случае, когда у пациента выработались или имелись предсуществующие антитела к лекарственному средству, распознающие фрагменты Fab. С другой стороны, фрагменты F(ab')2 действительно вызывают дегрануляцию мастоцитов на уровне, аналогичном полноразмерному антителу к cKIT, будучи связанными и мультимеризованными в более крупные комплексы.
Пример 11. Трансплантация сингенного костного мозга иммунокомпетентным мышам
В конкретном эксперименте мышам C57BL/6J (CD45.2, самцы, возраст 10 недель, Jackson Laboratory, № артикула 000664) вводили дозу 2,5, 5 или 10 мг/мл Fab'5-(1) к c-KIT (Fab'-DAR4) с помощью мини-насоса (Alzet, № по каталогу 2001), размещенного подкожно в области спины. В мини-насосе удерживался объем 200 мкл, и он выполнял инфузию с постоянным расходом, составляющим 1 мкл/час, в течение курса продолжительностью 7 дней. Через семь дней после имплантации мини-насос затем удаляли, чтобы прекратить любое дополнительное введение лекарственного средства. Через сорок восемь часов после удаления мини-насоса мышам трансплантировали костный мозг от мышей-доноров, которые были конгенными по маркерам CD45 (CD45.1, B6.SJL-Ptprca Pepcb/BoyJ, самцы, возраст 10 недель, Jackson Laboratory, № артикула 002014). Прогресс трансплантации отслеживали в периферической крови путем отыскания химеризма CD45.1 клеток с интервалами в один месяц. В данном эксперименте химеризм крови отслеживали в течение 4 месяцев, как показано на ФИГ. 10. Химеризм в периферической крови оценивали с помощью проточной цитометрии. Образцы крови окрашивали с помощью антитела к mCD45.1-PerCP-Cy5.5 (1:100, BD № 560580), антитела к mCD45.2-BUV395 (1:100, BD № 564616), антитела к Mac-PE (1:500, BD № 553331), антитела к GR1-FITC (1:100, BD № 553127), антитела к B220-APC (1:400, BD № 553092) и антитела к CD3-V450 (1:100, BD № 560801), данные получали на проточном цитометре Fortessa (Becton Dickinson) и анализировали с помощью программного обеспечения FlowJo (TreeStar). Уровень химеризма определяли путем сравнения с популяциями, которые были положительными или по CD45.2 (хозяин), или по CD45.1 (донор). Общий уровень донорского химеризма представлен для общей популяции белых кровяных клеток. Кроме того, субпопуляции T- клеток, B-клеток и миелоидных клеток дополнительно оценивали в отношении донорского химеризма. Донорский химеризм T-клеток был основан на отыскании CD45.2 (хозяин) или CD45.1 (донор) на CD3+ клетках. Донорский химеризм B-клеток был основан на отыскании CD45.2 (хозяин) или CD45.1 (донор) на CD45R+ клетках. Химеризм миелоидных клеток был основан на отыскании CD45.2 (хозяин) или CD45.2 (донор) на Mac-1+/Gr-1+ клетках. Данный эксперимент показывает, что у мышей, кондиционированных с помощью конъюгата Fab' к cKIT, могут приживаться донорские клетки, которые воссоздают линии миелоидных клеток, B-клеток и T-клеток, что является показателем успешного приживления HSC.
В другом эксперименте мышам C57BL/6J (CD45.2, самцы, возраст 10 недель, Jackson Laboratory, № артикула 000664) вводили дозу 2,5, 5 или 10 мг/мл Fab'5-(1) к c-KIT (Fab'-DAR4) или 10 мг/мл Fab'5 к c-KIT-mc-ММAF (Fab'-DAR4) с помощью мини-насоса (Alzet, № по каталогу 2001), размещенного подкожно в области спины. В мини-насосе удерживался объем 200 мкл, и он выполнял инфузию с постоянным расходом, составляющим 1 мкл/час, в течение курса продолжительностью 7 дней. Через пять дней после имплантации мини-насос затем удаляли, чтобы прекратить любое дополнительное введение лекарственного средства. Не позднее чем через 24 часа после удаления мини-насоса затем мышам трансплантировали костный мозг от мышей-доноров, которые были конгенными по маркерам CD45 (CD45.1, B6.SJL-Ptprca Pepcb/BoyJ, самцы 10 недель, Jackson Laboratory, № артикула 002014). Прогресс трансплантации отслеживали в периферической крови путем отыскания химеризма CD45.1 клеток с интервалами в один месяц. В данном эксперименте химеризм крови отслеживали в течение 2 месяцев, как показано на ФИГ. 11. Химеризм в периферической крови оценивали с помощью проточной цитометрии. Образцы крови окрашивали с помощью антитела к mCD45.1-PerCP-Cy5.5 (1:100, BD № 560580), антитела к mCD45.2-BUV395 (1:100, BD № 564616), антитела к Mac-PE (1:500, BD № 553331), антитела к GR1-FITC (1:100, BD № 553127), антитела к B220-APC (1:400, BD № 553092) и антитела к CD3-V450 (1:100, BD № 560801), данные получали на проточном цитометре Fortessa (Becton Dickinson) и анализировали с помощью программного обеспечения FlowJo (TreeStar). Уровень химеризма определяли путем сравнения с популяциями, которые были положительными или по CD45.2 (хозяин), или по CD45.1 (донор). Общий уровень донорского химеризма представлен для общей популяции белых кровяных клеток. Кроме того, миелоидные клетки в периферической крови дополнительно оценивали в отношении донорского химеризма. Химеризм миелоидных клеток был основан на отыскании CD45.2 (хозяин) или CD45.2 (донор) на Mac-1+/Gr-1+ клетках. Данный эксперимент показывает, что у мышей, кондиционированных с помощью конъюгата Fab' к cKIT, могут успешно приживаться донорские клетки, которые восполняют миелоидный компартмент в той же степени, что и у мышей, кондиционированных с помощью летального облучения (ФИГ. 11B). Более низкие уровни общего донорского химеризма у мышей, кондиционированных с помощью средства, связывающего cKIT, по сравнению с облученными мышами (ФИГ. 11A), по-видимому, обусловлены более целенаправленно действующей природой кондиционирующего средства, связывающего cKit, которое не удаляет долгоживущие CD45.2+ B-клетки и T-клетки из кровотока.
В другом эксперименте мышей C57BL/6J (CD45.2, самцы, возраст 10 недель, Jackson Laboratory, № артикула 000664) облучали при 300 рад. Спустя три дня им вводили дозу 2,5 или 5 мг/мл Fab'5-(1) к c-KIT (Fab'-DAR4) с помощью мини-насоса (Alzet, № по каталогу 2001), размещенного подкожно в области спины. Одну группу обрабатывали только с помощью облучения, и одну группу обрабатывали только с помощью 2,5 мг/мл Fab'5-(1) к c-KIT (Fab'-DAR4). В мини-насосе удерживался объем 200 мкл, и он выполнял инфузию с постоянным расходом, составляющим 1 мкл/час, в течение курса продолжительностью 7 дней. Через три дня после имплантации мини-насос затем удаляли, чтобы прекратить любое дополнительное введение лекарственного средства. Не позднее чем через 48 часа после удаления мини-насоса затем мышам трансплантировали костный мозг от мышей-доноров, которые были конгенными по маркерам CD45 (CD45.1, B6.SJL-Ptprca Pepcb/BoyJ, самцы 10 недель, Jackson Laboratory, № артикула 002014). Прогресс трансплантации отслеживали в периферической крови путем отыскания химеризма CD45.1 клеток с интервалами в один месяц. В данном эксперименте химеризм крови отслеживали в течение 4 месяцев, как показано на ФИГ. 12. Химеризм в периферической крови оценивали с помощью проточной цитометрии. Образцы крови окрашивали с помощью антитела к mCD45.1-PerCP-Cy5.5 (1:100, BD № 560580), антитела к mCD45.2-BUV395 (1:100, BD № 564616), антитела к Mac-PE (1:500, BD № 553331), антитела к GR1-FITC (1:100, BD № 553127), антитела к B220-APC (1:400, BD № 553092) и антитела к CD3-V450 (1:100, BD № 560801), данные получали на проточном цитометре Fortessa (Becton Dickinson) и анализировали с помощью программного обеспечения FlowJo (TreeStar). Уровень химеризма определяли путем сравнения с популяциями, которые были положительными или по CD45.2 (хозяин), или по CD45.1 (донор). Общий уровень донорского химеризма представлен для общей популяции белых кровяных клеток. Кроме того, миелоидные клетки в периферической крови дополнительно оценивали в отношении донорского химеризма. Химеризм миелоидных клеток был основан на отыскании CD45.2 (хозяин) или CD45.2 (донор) на Mac-1+/Gr-1+ клетках. Данный эксперимент показывает, что конъюгат Fab' к cKIT можно применять в качестве кондиционирующего средства в комбинации с другими средствами, такими как низкодозовое облучение, и что у мышей, кондиционированных таким способом, могут успешно приживаться донорские клетки.
Если не определено иное, технические и научные термины, применяемые в данном документе, имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится настоящее изобретение.
Если не указано иное, все способы, стадии, методики и манипуляции, которые конкретно не описаны подробно, можно было осуществлять и их осуществляли широко известным способом, как будет ясно специалисту в данной области техники. Например, снова сделана ссылка на стандартные руководства и общий уровень техники, упоминаемый в данном документе, а также на дополнительные литературные источники, цитируемые в данном документе. Если не указано иное, каждый из литературных источников, цитируемых в данном документе, включен посредством ссылки во всей своей полноте.
Пункты формулы изобретения являются неограничивающими и представлены ниже.
Хотя конкретные аспекты и пункты формулы изобретения были подробно раскрыты в данном документе, это было выполнено в качестве примера лишь в целях иллюстрации, и не предназначено для ограничений с точки зрения объема прилагаемой формулы изобретения или объема объекта формулы изобретения с любым соответствующим будущим применением. В частности, авторы настоящего изобретения подразумевают, что различные замены, изменения и модификации могут быть выполнены в настоящем изобретении без отклонения от сути и объема настоящего изобретения, определяемого формулой изобретения. Считается, что выбор исходного материала в виде нуклеиновой кислоты, представляющего интерес клона или типа библиотеки, является обычным делом для рядового специалиста в данной области техники, располагающего сведениями об аспектах, описанных в данном документе. Считается, что другие аспекты, преимущества и модификации находятся в пределах объема следующей формулы изобретения. Специалистам в данной области техники будут понятны многие эквиваленты конкретных аспектов настоящего изобретения, описанного в данном документе, или путем проведения всего лишь обычных экспериментов они будут способны установить такие эквиваленты. Предусмотрено, что такие эквиваленты охвачены следующей формулой изобретения. Изменение объема пункта формулы изобретения в позднее поданных соответствующих заявках может быть обусловлено ограничениями патентных законов различных стран и не должно пониматься как отказ от объекта формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
<120> КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ РАЗРУШЕНИЯ
ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
<130> PAT057400-WO-PCT
<140>
<141>
<150> 62/520,854
<151> 2017-06-16
<150> 62/437,622
<151> 2016-12-21
<160> 162
<170> PatentIn версия 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 1
Ser Tyr Ala Ile Ser
1 5
<210> 2
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 2
Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 3
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 3
Gly Gly Tyr Ile Ser Asp Phe Asp Val
1 5
<210> 4
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 4
Gly Gly Thr Phe Ser Ser Tyr
1 5
<210> 5
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 5
Phe Pro Ala Glu Gly Ala
1 5
<210> 6
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 6
Gly Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5 10
<210> 7
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 7
Gly Gly Thr Phe Ser Ser Tyr Ala
1 5
<210> 8
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 8
Ile Phe Pro Ala Glu Gly Ala Pro
1 5
<210> 9
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 9
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val
1 5 10
<210> 10
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 10
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 11
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 11
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgtttagc agctatgcga ttagctgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcgtt atcttcccgg ctgaaggcgc tccgggttac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtggt 300
tacatctctg acttcgatgt ttggggccaa ggcaccctgg tgactgttag ctca 354
<210> 12
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 12
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 13
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 13
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgtttagc agctatgcga ttagctgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcgtt atcttcccgg ctgaaggcgc tccgggttac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtggt 300
tacatctctg acttcgatgt ttggggccaa ggcaccctgg tgactgttag ctcagctagc 360
accaagggcc ccagcgtgtt ccccctggcc cccagcagca agtctacttc cggcggaact 420
gctgccctgg gttgcctggt gaaggactac ttccccgagc ccgtgacagt gtcctggaac 480
tctggggctc tgacttccgg cgtgcacacc ttccccgccg tgctgcagag cagcggcctg 540
tacagcctga gcagcgtggt gacagtgccc tccagctctc tgggaaccca gacctatatc 600
tgcaacgtga accacaagcc cagcaacacc aaggtggaca agagagtgga gcccaagagc 660
tgcgacaaga cccacacctg ccccccctgc ccagctccag aactgctggg agggccttcc 720
gtgttcctgt tcccccccaa gcccaaggac accctgatga tcagcaggac ccccgaggtg 780
acctgcgtgg tggtggacgt gtcccacgag gacccagagg tgaagttcaa ctggtacgtg 840
gacggcgtgg aggtgcacaa cgccaagacc aagcccagag aggagcagta caacagcacc 900
tacagggtgg tgtccgtgct gaccgtgctg caccaggact ggctgaacgg caaagaatac 960
aagtgcaaag tctccaacaa ggccctgcca gccccaatcg aaaagacaat cagcaaggcc 1020
aagggccagc cacgggagcc ccaggtgtac accctgcccc ccagccggga ggagatgacc 1080
aagaaccagg tgtccctgac ctgtctggtg aagggcttct accccagcga tatcgccgtg 1140
gagtgggaga gcaacggcca gcccgagaac aactacaaga ccaccccccc agtgctggac 1200
agcgacggca gcttcttcct gtacagcaag ctgaccgtgg acaagtccag gtggcagcag 1260
ggcaacgtgt tcagctgcag cgtgatgcac gaggccctgc acaaccacta cacccagaag 1320
tccctgagcc tgagccccgg caag 1344
<210> 14
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235
<210> 15
<211> 711
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 15
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgtttagc agctatgcga ttagctgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcgtt atcttcccgg ctgaaggcgc tccgggttac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtggt 300
tacatctctg acttcgatgt ttggggccaa ggcaccctgg tgactgttag ctcagctagc 360
accaagggcc ccagcgtgtt ccccctggcc cccagcagca agtctacttc cggcggaact 420
gctgccctgg gttgcctggt gaaggactac ttccccgagc ccgtgacagt gtcctggaac 480
tctggggctc tgacttccgg cgtgcacacc ttccccgccg tgctgcagag cagcggcctg 540
tacagcctga gcagcgtggt gacagtgccc tccagctctc tgggaaccca gacctatatc 600
tgcaacgtga accacaagcc cagcaacacc aaggtggaca agagagtgga gcccaagagc 660
tgcgacaaga cccacacctg ccccccctgc ccagctccag aactgctggg a 711
<210> 16
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 16
Arg Ala Ser Gln Ser Ile Ser Asn Tyr Leu Ala
1 5 10
<210> 17
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 17
Asp Ala Ser Ser Leu Gln Ser
1 5
<210> 18
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 18
Gln Gln Tyr Tyr Tyr Glu Ser Ile Thr
1 5
<210> 19
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 19
Ser Gln Ser Ile Ser Asn Tyr
1 5
<210> 20
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 20
Asp Ala Ser
1
<210> 21
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 21
Tyr Tyr Tyr Glu Ser Ile
1 5
<210> 22
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 22
Gln Ser Ile Ser Asn Tyr
1 5
<210> 23
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 23
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Glu Ser Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 24
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 24
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc 60
attacctgca gagccagcca gtctatttct aactacctgg cttggtacca gcagaaaccg 120
ggcaaagcgc cgaaactatt aatctacgac gcttcttctc tgcaaagcgg cgtgccgagc 180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg 240
gaagactttg cgacctatta ttgccagcag tactactacg aatctatcac ctttggccag 300
ggcacgaaag ttgaaattaa a 321
<210> 25
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Glu Ser Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 26
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 26
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc 60
attacctgca gagccagcca gtctatttct aactacctgg cttggtacca gcagaaaccg 120
ggcaaagcgc cgaaactatt aatctacgac gcttcttctc tgcaaagcgg cgtgccgagc 180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg 240
gaagactttg cgacctatta ttgccagcag tactactacg aatctatcac ctttggccag 300
ggcacgaaag ttgaaattaa acgtacggtg gccgctccca gcgtgttcat cttccccccc 360
agcgacgagc agctgaagag tggcaccgcc agcgtggtgt gcctgctgaa caacttctac 420
ccccgggagg ccaaggtgca gtggaaggtg gacaacgccc tgcagagcgg caacagccag 480
gagagcgtca ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc 540
ctgagcaagg ccgactacga gaagcataag gtgtacgcct gcgaggtgac ccaccagggc 600
ctgtccagcc ccgtgaccaa gagcttcaac aggggcgagt gc 642
<210> 27
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 27
Ser His Ala Leu Ser
1 5
<210> 28
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 28
Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 29
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 29
Gly Leu Tyr Asp Phe Asp Tyr
1 5
<210> 30
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 30
Gly Gly Thr Phe Ser Ser His
1 5
<210> 31
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 31
Ile Pro Ser Phe Gly Thr
1 5
<210> 32
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 32
Gly Gly Thr Phe Ser Ser His Ala Leu Ser
1 5 10
<210> 33
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 33
Gly Gly Thr Phe Ser Ser His Ala
1 5
<210> 34
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 34
Ile Ile Pro Ser Phe Gly Thr Ala
1 5
<210> 35
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 35
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr
1 5
<210> 36
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 36
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser His
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 37
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 37
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgttttct tctcatgctc tgtcttgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcggt atcatcccgt ctttcggcac tgcggactac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtctg 300
tacgacttcg actactgggg ccaaggcacc ctggtgactg ttagctca 348
<210> 38
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 38
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser His
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 39
<211> 1338
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 39
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgttttct tctcatgctc tgtcttgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcggt atcatcccgt ctttcggcac tgcggactac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtctg 300
tacgacttcg actactgggg ccaaggcacc ctggtgactg ttagctcagc tagcaccaag 360
ggccccagcg tgttccccct ggcccccagc agcaagtcta cttccggcgg aactgctgcc 420
ctgggttgcc tggtgaagga ctacttcccc gagcccgtga cagtgtcctg gaactctggg 480
gctctgactt ccggcgtgca caccttcccc gccgtgctgc agagcagcgg cctgtacagc 540
ctgagcagcg tggtgacagt gccctccagc tctctgggaa cccagaccta tatctgcaac 600
gtgaaccaca agcccagcaa caccaaggtg gacaagagag tggagcccaa gagctgcgac 660
aagacccaca cctgcccccc ctgcccagct ccagaactgc tgggagggcc ttccgtgttc 720
ctgttccccc ccaagcccaa ggacaccctg atgatcagca ggacccccga ggtgacctgc 780
gtggtggtgg acgtgtccca cgaggaccca gaggtgaagt tcaactggta cgtggacggc 840
gtggaggtgc acaacgccaa gaccaagccc agagaggagc agtacaacag cacctacagg 900
gtggtgtccg tgctgaccgt gctgcaccag gactggctga acggcaaaga atacaagtgc 960
aaagtctcca acaaggccct gccagcccca atcgaaaaga caatcagcaa ggccaagggc 1020
cagccacggg agccccaggt gtacaccctg ccccccagcc gggaggagat gaccaagaac 1080
caggtgtccc tgacctgtct ggtgaagggc ttctacccca gcgatatcgc cgtggagtgg 1140
gagagcaacg gccagcccga gaacaactac aagaccaccc ccccagtgct ggacagcgac 1200
ggcagcttct tcctgtacag caagctgacc gtggacaagt ccaggtggca gcagggcaac 1260
gtgttcagct gcagcgtgat gcacgaggcc ctgcacaacc actacaccca gaagtccctg 1320
agcctgagcc ccggcaag 1338
<210> 40
<211> 235
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 40
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser His
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235
<210> 41
<211> 705
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 41
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgttttct tctcatgctc tgtcttgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcggt atcatcccgt ctttcggcac tgcggactac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtctg 300
tacgacttcg actactgggg ccaaggcacc ctggtgactg ttagctcagc tagcaccaag 360
ggccccagcg tgttccccct ggcccccagc agcaagtcta cttccggcgg aactgctgcc 420
ctgggttgcc tggtgaagga ctacttcccc gagcccgtga cagtgtcctg gaactctggg 480
gctctgactt ccggcgtgca caccttcccc gccgtgctgc agagcagcgg cctgtacagc 540
ctgagcagcg tggtgacagt gccctccagc tctctgggaa cccagaccta tatctgcaac 600
gtgaaccaca agcccagcaa caccaaggtg gacaagagag tggagcccaa gagctgcgac 660
aagacccaca cctgcccccc ctgcccagct ccagaactgc tggga 705
<210> 42
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 42
Arg Ala Ser Gln Asp Ile Ser Gln Asp Leu Ala
1 5 10
<210> 43
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 43
Gln Gln Tyr Tyr Tyr Leu Pro Ser Thr
1 5
<210> 44
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 44
Ser Gln Asp Ile Ser Gln Asp
1 5
<210> 45
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 45
Tyr Tyr Tyr Leu Pro Ser
1 5
<210> 46
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 46
Gln Asp Ile Ser Gln Asp
1 5
<210> 47
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Gln Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Leu Pro Ser
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 48
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 48
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc 60
attacctgca gagccagcca ggacatttct caggacctgg cttggtacca gcagaaaccg 120
ggcaaagcgc cgaaactatt aatctacgac gcttcttctc tgcaaagcgg cgtgccgagc 180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg 240
gaagactttg cggtgtatta ttgccagcag tactactacc tgccgtctac ctttggccag 300
ggcacgaaag ttgaaattaa a 321
<210> 49
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Gln Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Leu Pro Ser
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 50
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 50
gatatccaga tgacccagag cccgagcagc ctgagcgcca gcgtgggcga tcgcgtgacc 60
attacctgca gagccagcca ggacatttct caggacctgg cttggtacca gcagaaaccg 120
ggcaaagcgc cgaaactatt aatctacgac gcttcttctc tgcaaagcgg cgtgccgagc 180
cgctttagcg gcagcggatc cggcaccgat ttcaccctga ccattagctc tctgcaaccg 240
gaagactttg cggtgtatta ttgccagcag tactactacc tgccgtctac ctttggccag 300
ggcacgaaag ttgaaattaa acgtacggtg gccgctccca gcgtgttcat cttccccccc 360
agcgacgagc agctgaagag tggcaccgcc agcgtggtgt gcctgctgaa caacttctac 420
ccccgggagg ccaaggtgca gtggaaggtg gacaacgccc tgcagagcgg caacagccag 480
gagagcgtca ccgagcagga cagcaaggac tccacctaca gcctgagcag caccctgacc 540
ctgagcaagg ccgactacga gaagcataag gtgtacgcct gcgaggtgac ccaccagggc 600
ctgtccagcc ccgtgaccaa gagcttcaac aggggcgagt gc 642
<210> 51
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 51
Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 52
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 52
Gly Pro Phe Glu Gly Gln
1 5
<210> 53
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 53
Ile Gly Pro Phe Glu Gly Gln Pro
1 5
<210> 54
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 54
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 55
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 55
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgtttagc agctatgcga ttagctgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcact atcggtccgt tcgaaggcca gccgcgttac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtggt 300
tacatctctg acttcgatgt ttggggccaa ggcaccctgg tgactgttag ctca 354
<210> 56
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 56
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 57
<211> 1344
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 57
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgtttagc agctatgcga ttagctgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcact atcggtccgt tcgaaggcca gccgcgttac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtggt 300
tacatctctg acttcgatgt ttggggccaa ggcaccctgg tgactgttag ctcagctagc 360
accaagggcc caagtgtgtt tcccctggcc cccagcagca agtctacttc cggcggaact 420
gctgccctgg gttgcctggt gaaggactac ttccccgagc ccgtgacagt gtcctggaac 480
tctggggctc tgacttccgg cgtgcacacc ttccccgccg tgctgcagag cagcggcctg 540
tacagcctga gcagcgtggt gacagtgccc tccagctctc tgggaaccca gacctatatc 600
tgcaacgtga accacaagcc cagcaacacc aaggtggaca agagagtgga gcccaagagc 660
tgcgacaaga cccacacctg ccccccctgc ccagctccag aactgctggg agggccttcc 720
gtgttcctgt tcccccccaa gcccaaggac accctgatga tcagcaggac ccccgaggtg 780
acctgcgtgg tggtggacgt gtcccacgag gacccagagg tgaagttcaa ctggtacgtg 840
gacggcgtgg aggtgcacaa cgccaagacc aagcccagag aggagcagta caacagcacc 900
tacagggtgg tgtccgtgct gaccgtgctg caccaggact ggctgaacgg caaagaatac 960
aagtgcaaag tctccaacaa ggccctgcca gccccaatcg aaaagacaat cagcaaggcc 1020
aagggccagc cacgggagcc ccaggtgtac accctgcccc ccagccggga ggagatgacc 1080
aagaaccagg tgtccctgac ctgtctggtg aagggcttct accccagcga tatcgccgtg 1140
gagtgggaga gcaacggcca gcccgagaac aactacaaga ccaccccccc agtgctggac 1200
agcgacggca gcttcttcct gtacagcaag ctgaccgtgg acaagtccag gtggcagcag 1260
ggcaacgtgt tcagctgcag cgtgatgcac gaggccctgc acaaccacta cacccagaag 1320
tccctgagcc tgagccccgg caag 1344
<210> 58
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 58
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235
<210> 59
<211> 711
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 59
caggtgcaat tggtgcagag cggtgccgaa gtgaaaaaac cgggcagcag cgtgaaagtt 60
agctgcaaag catccggagg gacgtttagc agctatgcga ttagctgggt gcgccaggcc 120
ccgggccagg gcctcgagtg gatgggcact atcggtccgt tcgaaggcca gccgcgttac 180
gcccagaaat ttcagggccg ggtgaccatt accgccgatg aaagcaccag caccgcctat 240
atggaactga gcagcctgcg cagcgaagat acggccgtgt attattgcgc gcgtggtggt 300
tacatctctg acttcgatgt ttggggccaa ggcaccctgg tgactgttag ctcagctagc 360
accaagggcc caagtgtgtt tcccctggcc cccagcagca agtctacttc cggcggaact 420
gctgccctgg gttgcctggt gaaggactac ttccccgagc ccgtgacagt gtcctggaac 480
tctggggctc tgacttccgg cgtgcacacc ttccccgccg tgctgcagag cagcggcctg 540
tacagcctga gcagcgtggt gacagtgccc tccagctctc tgggaaccca gacctatatc 600
tgcaacgtga accacaagcc cagcaacacc aaggtggaca agagagtgga gcccaagagc 660
tgcgacaaga cccacacctg ccccccctgc ccagctccag aactgctggg a 711
<210> 60
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 60
Thr Asn Ser Ala Ala Trp Asn
1 5
<210> 61
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 61
Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala Val Ser Val
1 5 10 15
Lys Ser
<210> 62
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 62
Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys Ala Leu Asp Val
1 5 10 15
<210> 63
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 63
Gly Asp Ser Val Ser Thr Asn Ser Ala
1 5
<210> 64
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 64
Tyr Tyr Arg Ser Gln Trp Leu
1 5
<210> 65
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 65
Gly Asp Ser Val Ser Thr Asn Ser Ala Ala Trp Asn
1 5 10
<210> 66
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 66
Gly Asp Ser Val Ser Thr Asn Ser Ala Ala
1 5 10
<210> 67
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 67
Ile Tyr Tyr Arg Ser Gln Trp Leu Asn
1 5
<210> 68
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 68
Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys Ala Leu Asp
1 5 10 15
Val
<210> 69
<211> 127
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 69
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 70
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 70
caggtgcaat tgcagcagag cggtccgggc ctggtgaaac cgagccagac cctgagcctg 60
acctgcgcga tttccggaga tagcgtgagc actaactctg ctgcttggaa ctggattcgt 120
cagagcccga gccgtggcct cgagtggctg ggccgtatct actaccgtag ccagtggctg 180
aacgactatg ccgtgagcgt gaaaagccgc attaccatta acccggatac ttcgaaaaac 240
cagtttagcc tgcaactgaa cagcgtgacc ccggaagata cggccgtgta ttattgcgcg 300
cgtcagctga cttacccgta cactgtttac cataaagctc tggatgtttg gggtcaagga 360
accctggtca ccgtctcctc g 381
<210> 71
<211> 457
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 71
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
245 250 255
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
260 265 270
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
275 280 285
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
290 295 300
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
305 310 315 320
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
325 330 335
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
340 345 350
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
355 360 365
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
370 375 380
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
385 390 395 400
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
405 410 415
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
420 425 430
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
435 440 445
Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 72
<211> 1371
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 72
caggtgcaat tgcagcagag cggtccgggc ctggtgaaac cgagccagac cctgagcctg 60
acctgcgcga tttccggaga tagcgtgagc actaactctg ctgcttggaa ctggattcgt 120
cagagcccga gccgtggcct cgagtggctg ggccgtatct actaccgtag ccagtggctg 180
aacgactatg ccgtgagcgt gaaaagccgc attaccatta acccggatac ttcgaaaaac 240
cagtttagcc tgcaactgaa cagcgtgacc ccggaagata cggccgtgta ttattgcgcg 300
cgtcagctga cttacccgta cactgtttac cataaagctc tggatgtttg gggtcaagga 360
accctggtca ccgtctcctc ggctagcacc aagggcccca gcgtgttccc cctggccccc 420
agcagcaagt ctacttccgg cggaactgct gccctgggtt gcctggtgaa ggactacttc 480
cccgagcccg tgacagtgtc ctggaactct ggggctctga cttccggcgt gcacaccttc 540
cccgccgtgc tgcagagcag cggcctgtac agcctgagca gcgtggtgac agtgccctcc 600
agctctctgg gaacccagac ctatatctgc aacgtgaacc acaagcccag caacaccaag 660
gtggacaaga gagtggagcc caagagctgc gacaagaccc acacctgccc cccctgccca 720
gctccagaac tgctgggagg gccttccgtg ttcctgttcc cccccaagcc caaggacacc 780
ctgatgatca gcaggacccc cgaggtgacc tgcgtggtgg tggacgtgtc ccacgaggac 840
ccagaggtga agttcaactg gtacgtggac ggcgtggagg tgcacaacgc caagaccaag 900
cccagagagg agcagtacaa cagcacctac agggtggtgt ccgtgctgac cgtgctgcac 960
caggactggc tgaacggcaa agaatacaag tgcaaagtct ccaacaaggc cctgccagcc 1020
ccaatcgaaa agacaatcag caaggccaag ggccagccac gggagcccca ggtgtacacc 1080
ctgcccccca gccgggagga gatgaccaag aaccaggtgt ccctgacctg tctggtgaag 1140
ggcttctacc ccagcgatat cgccgtggag tgggagagca acggccagcc cgagaacaac 1200
tacaagacca cccccccagt gctggacagc gacggcagct tcttcctgta cagcaagctg 1260
accgtggaca agtccaggtg gcagcagggc aacgtgttca gctgcagcgt gatgcacgag 1320
gccctgcaca accactacac ccagaagtcc ctgagcctga gccccggcaa g 1371
<210> 73
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 73
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly
245
<210> 74
<211> 738
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 74
caggtgcaat tgcagcagag cggtccgggc ctggtgaaac cgagccagac cctgagcctg 60
acctgcgcga tttccggaga tagcgtgagc actaactctg ctgcttggaa ctggattcgt 120
cagagcccga gccgtggcct cgagtggctg ggccgtatct actaccgtag ccagtggctg 180
aacgactatg ccgtgagcgt gaaaagccgc attaccatta acccggatac ttcgaaaaac 240
cagtttagcc tgcaactgaa cagcgtgacc ccggaagata cggccgtgta ttattgcgcg 300
cgtcagctga cttacccgta cactgtttac cataaagctc tggatgtttg gggtcaagga 360
accctggtca ccgtctcctc ggctagcacc aagggcccca gcgtgttccc cctggccccc 420
agcagcaagt ctacttccgg cggaactgct gccctgggtt gcctggtgaa ggactacttc 480
cccgagcccg tgacagtgtc ctggaactct ggggctctga cttccggcgt gcacaccttc 540
cccgccgtgc tgcagagcag cggcctgtac agcctgagca gcgtggtgac agtgccctcc 600
agctctctgg gaacccagac ctatatctgc aacgtgaacc acaagcccag caacaccaag 660
gtggacaaga gagtggagcc caagagctgc gacaagaccc acacctgccc cccctgccca 720
gctccagaac tgctggga 738
<210> 75
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 75
Ser Gly Asp Asn Leu Gly Asp Gln Tyr Val Ser
1 5 10
<210> 76
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 76
Asp Asp Thr Asp Arg Pro Ser
1 5
<210> 77
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 77
Gln Ser Thr Asp Ser Lys Ser Val Val
1 5
<210> 78
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 78
Asp Asn Leu Gly Asp Gln Tyr
1 5
<210> 79
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 79
Asp Asp Thr
1
<210> 80
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 80
Thr Asp Ser Lys Ser Val
1 5
<210> 81
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 81
Asn Leu Gly Asp Gln Tyr
1 5
<210> 82
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 82
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Leu Gly Asp Gln Tyr Val
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Asp Thr Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Thr Asp Ser Lys Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 83
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 83
gatatcgaac tgacccagcc gccgagcgtg agcgtgagcc cgggccagac cgcgagcatt 60
acctgtagcg gcgataacct gggtgaccaa tacgtttctt ggtaccagca gaaaccgggc 120
caggcgccgg tgctggtgat ctacgacgac actgaccgtc cgagcggcat cccggaacgt 180
tttagcggat ccaacagcgg caacaccgcg accctgacca ttagcggcac ccaggcggaa 240
gacgaagcgg attattactg ccagtctact gactctaaat ctgttgtgtt tggcggcggc 300
acgaagttaa ccgtccta 318
<210> 84
<211> 212
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 84
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Leu Gly Asp Gln Tyr Val
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Asp Thr Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Thr Asp Ser Lys Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala Ala
100 105 110
Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala Asn
115 120 125
Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Ala Val
130 135 140
Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val Glu
145 150 155 160
Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser Ser
165 170 175
Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr Ser
180 185 190
Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val Ala Pro
195 200 205
Thr Glu Cys Ser
210
<210> 85
<211> 636
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 85
gatatcgaac tgacccagcc gccgagcgtg agcgtgagcc cgggccagac cgcgagcatt 60
acctgtagcg gcgataacct gggtgaccaa tacgtttctt ggtaccagca gaaaccgggc 120
caggcgccgg tgctggtgat ctacgacgac actgaccgtc cgagcggcat cccggaacgt 180
tttagcggat ccaacagcgg caacaccgcg accctgacca ttagcggcac ccaggcggaa 240
gacgaagcgg attattactg ccagtctact gactctaaat ctgttgtgtt tggcggcggc 300
acgaagttaa ccgtcctagg ccagcctaag gccgctccct ccgtgaccct gttccccccc 360
agctccgagg aactgcaggc caacaaggcc accctggtgt gcctgatcag cgacttctac 420
cctggcgccg tgaccgtggc ctggaaggcc gacagcagcc ccgtgaaggc cggcgtggag 480
acaaccaccc ccagcaagca gagcaacaac aagtacgccg ccagcagcta cctgagcctg 540
acccccgagc agtggaagag ccacagaagc tacagctgcc aggtcaccca cgagggcagc 600
accgtggaga aaaccgtggc ccccaccgag tgcagc 636
<210> 86
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 86
Asn Tyr Trp Ile Ala
1 5
<210> 87
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 87
Ile Ile Tyr Pro Ser Asn Ser Tyr Thr Leu Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 88
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 88
Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
1 5 10
<210> 89
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 89
Gly Tyr Ser Phe Thr Asn Tyr
1. 5
<210> 90
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 90
Tyr Pro Ser Asn Ser Tyr
1 5
<210> 91
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 91
Gly Tyr Ser Phe Thr Asn Tyr Trp Ile Ala
1 5 10
<210> 92
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 92
Gly Tyr Ser Phe Thr Asn Tyr Trp
1 5
<210> 93
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 93
Ile Tyr Pro Ser Asn Ser Tyr Thr
1 5
<210> 94
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 94
Ala Arg Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
1 5 10 15
<210> 95
<211> 123
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 95
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ala Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Ser Asn Ser Tyr Thr Leu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 96
<211> 369
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 96
caggtgcaat tggtgcagag cggtgcggaa gtgaaaaaac cgggcgaaag cctgaaaatt 60
agctgcaaag gctccggata tagcttcact aactactgga tcgcttgggt gcgccagatg 120
ccgggcaaag gtctcgagtg gatgggcatc atctacccgt ctaacagcta caccctgtat 180
agcccgagct ttcagggcca ggtgaccatt agcgcggata aaagcatcag caccgcgtat 240
ctgcaatgga gcagcctgaa agcgagcgat accgcgatgt attattgcgc gcgtgttccg 300
ccgggtggtt ctatctctta cccggctttc gatcattggg gccaaggcac cctggtgact 360
gttagctca 369
<210> 97
<211> 453
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 97
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ala Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Ser Asn Ser Tyr Thr Leu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 98
<211> 1359
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 98
caggtgcaat tggtgcagag cggtgcggaa gtgaaaaaac cgggcgaaag cctgaaaatt 60
agctgcaaag gctccggata tagcttcact aactactgga tcgcttgggt gcgccagatg 120
ccgggcaaag gtctcgagtg gatgggcatc atctacccgt ctaacagcta caccctgtat 180
agcccgagct ttcagggcca ggtgaccatt agcgcggata aaagcatcag caccgcgtat 240
ctgcaatgga gcagcctgaa agcgagcgat accgcgatgt attattgcgc gcgtgttccg 300
ccgggtggtt ctatctctta cccggctttc gatcattggg gccaaggcac cctggtgact 360
gttagctcag ctagcaccaa gggccccagc gtgttccccc tggcccccag cagcaagtct 420
acttccggcg gaactgctgc cctgggttgc ctggtgaagg actacttccc cgagcccgtg 480
acagtgtcct ggaactctgg ggctctgact tccggcgtgc acaccttccc cgccgtgctg 540
cagagcagcg gcctgtacag cctgagcagc gtggtgacag tgccctccag ctctctggga 600
acccagacct atatctgcaa cgtgaaccac aagcccagca acaccaaggt ggacaagaga 660
gtggagccca agagctgcga caagacccac acctgccccc cctgcccagc tccagaactg 720
ctgggagggc cttccgtgtt cctgttcccc cccaagccca aggacaccct gatgatcagc 780
aggacccccg aggtgacctg cgtggtggtg gacgtgtccc acgaggaccc agaggtgaag 840
ttcaactggt acgtggacgg cgtggaggtg cacaacgcca agaccaagcc cagagaggag 900
cagtacaaca gcacctacag ggtggtgtcc gtgctgaccg tgctgcacca ggactggctg 960
aacggcaaag aatacaagtg caaagtctcc aacaaggccc tgccagcccc aatcgaaaag 1020
acaatcagca aggccaaggg ccagccacgg gagccccagg tgtacaccct gccccccagc 1080
cgggaggaga tgaccaagaa ccaggtgtcc ctgacctgtc tggtgaaggg cttctacccc 1140
agcgatatcg ccgtggagtg ggagagcaac ggccagcccg agaacaacta caagaccacc 1200
cccccagtgc tggacagcga cggcagcttc ttcctgtaca gcaagctgac cgtggacaag 1260
tccaggtggc agcagggcaa cgtgttcagc tgcagcgtga tgcacgaggc cctgcacaac 1320
cactacaccc agaagtccct gagcctgagc cccggcaag 1359
<210> 99
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 99
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ala Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Ser Asn Ser Tyr Thr Leu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly
<210> 100
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 100
caggtgcaat tggtgcagag cggtgcggaa gtgaaaaaac cgggcgaaag cctgaaaatt 60
agctgcaaag gctccggata tagcttcact aactactgga tcgcttgggt gcgccagatg 120
ccgggcaaag gtctcgagtg gatgggcatc atctacccgt ctaacagcta caccctgtat 180
agcccgagct ttcagggcca ggtgaccatt agcgcggata aaagcatcag caccgcgtat 240
ctgcaatgga gcagcctgaa agcgagcgat accgcgatgt attattgcgc gcgtgttccg 300
ccgggtggtt ctatctctta cccggctttc gatcattggg gccaaggcac cctggtgact 360
gttagctcag ctagcaccaa gggccccagc gtgttccccc tggcccccag cagcaagtct 420
acttccggcg gaactgctgc cctgggttgc ctggtgaagg actacttccc cgagcccgtg 480
acagtgtcct ggaactctgg ggctctgact tccggcgtgc acaccttccc cgccgtgctg 540
cagagcagcg gcctgtacag cctgagcagc gtggtgacag tgccctccag ctctctggga 600
acccagacct atatctgcaa cgtgaaccac aagcccagca acaccaaggt ggacaagaga 660
gtggagccca agagctgcga caagacccac acctgccccc cctgcccagc tccagaactg 720
ctggga 726
<210> 101
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 101
Ser Gly Asp Asn Ile Gly Ser Ile Tyr Ala Ser
1 5 10
<210> 102
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 102
Arg Asp Asn Lys Arg Pro Ser
1 5
<210> 103
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 103
Ser Val Thr Asp Met Glu Gln His Ser Val
1 5 10
<210> 104
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 104
Asp Asn Ile Gly Ser Ile Tyr
1 5
<210> 105
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 105
Arg Asp Asn
1
<210> 106
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 106
Thr Asp Met Glu Gln His Ser
1 5
<210> 107
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 107
Asn Ile Gly Ser Ile Tyr
1 5
<210> 108
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 108
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Ile Gly Ser Ile Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Arg Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ser Val Thr Asp Met Glu Gln His Ser
85 90 95
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 109
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 109
gatatcgaac tgacccagcc gccgagcgtg agcgtgagcc cgggccagac cgcgagcatt 60
acctgtagcg gcgataacat cggttctatc tacgcttctt ggtaccagca gaaaccgggc 120
caggcgccgg tgctggtgat ctaccgtgac aacaaacgtc cgagcggcat cccggaacgt 180
tttagcggat ccaacagcgg caacaccgcg accctgacca ttagcggcac ccaggcggaa 240
gacgaagcgg attattactg ctccgttact gacatggaac agcattctgt gtttggcggc 300
ggcacgaagt taaccgtcct a 321
<210> 110
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 110
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Ile Gly Ser Ile Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Arg Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ser Val Thr Asp Met Glu Gln His Ser
85 90 95
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala
100 105 110
Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala
115 120 125
Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Ala
130 135 140
Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val
145 150 155 160
Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser
165 170 175
Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr
180 185 190
Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val Ala
195 200 205
Pro Thr Glu Cys Ser
210
<210> 111
<211> 639
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полинуклеотид"
<400> 111
gatatcgaac tgacccagcc gccgagcgtg agcgtgagcc cgggccagac cgcgagcatt 60
acctgtagcg gcgataacat cggttctatc tacgcttctt ggtaccagca gaaaccgggc 120
caggcgccgg tgctggtgat ctaccgtgac aacaaacgtc cgagcggcat cccggaacgt 180
tttagcggat ccaacagcgg caacaccgcg accctgacca ttagcggcac ccaggcggaa 240
gacgaagcgg attattactg ctccgttact gacatggaac agcattctgt gtttggcggc 300
ggcacgaagt taaccgtcct aggccagcct aaggccgctc cctccgtgac cctgttcccc 360
cccagctccg aggaactgca ggccaacaag gccaccctgg tgtgcctgat cagcgacttc 420
taccctggcg ccgtgaccgt ggcctggaag gccgacagca gccccgtgaa ggccggcgtg 480
gagacaacca cccccagcaa gcagagcaac aacaagtacg ccgccagcag ctacctgagc 540
ctgacccccg agcagtggaa gagccacaga agctacagct gccaggtcac ccacgagggc 600
agcaccgtgg agaaaaccgt ggcccccacc gagtgcagc 639
<210> 112
<211> 503
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 112
Gln Pro Ser Val Ser Pro Gly Glu Pro Ser Pro Pro Ser Ile His Pro
1 5 10 15
Gly Lys Ser Asp Leu Ile Val Arg Val Gly Asp Glu Ile Arg Leu Leu
20 25 30
Cys Thr Asp Pro Gly Phe Val Lys Trp Thr Phe Glu Ile Leu Asp Glu
35 40 45
Thr Asn Glu Asn Lys Gln Asn Glu Trp Ile Thr Glu Lys Ala Glu Ala
50 55 60
Thr Asn Thr Gly Lys Tyr Thr Cys Thr Asn Lys His Gly Leu Ser Asn
65 70 75 80
Ser Ile Tyr Val Phe Val Arg Asp Pro Ala Lys Leu Phe Leu Val Asp
85 90 95
Arg Ser Leu Tyr Gly Lys Glu Asp Asn Asp Thr Leu Val Arg Cys Pro
100 105 110
Leu Thr Asp Pro Glu Val Thr Asn Tyr Ser Leu Lys Gly Cys Gln Gly
115 120 125
Lys Pro Leu Pro Lys Asp Leu Arg Phe Ile Pro Asp Pro Lys Ala Gly
130 135 140
Ile Met Ile Lys Ser Val Lys Arg Ala Tyr His Arg Leu Cys Leu His
145 150 155 160
Cys Ser Val Asp Gln Glu Gly Lys Ser Val Leu Ser Glu Lys Phe Ile
165 170 175
Leu Lys Val Arg Pro Ala Phe Lys Ala Val Pro Val Val Ser Val Ser
180 185 190
Lys Ala Ser Tyr Leu Leu Arg Glu Gly Glu Glu Phe Thr Val Thr Cys
195 200 205
Thr Ile Lys Asp Val Ser Ser Ser Val Tyr Ser Thr Trp Lys Arg Glu
210 215 220
Asn Ser Gln Thr Lys Leu Gln Glu Lys Tyr Asn Ser Trp His His Gly
225 230 235 240
Asp Phe Asn Tyr Glu Arg Gln Ala Thr Leu Thr Ile Ser Ser Ala Arg
245 250 255
Val Asn Asp Ser Gly Val Phe Met Cys Tyr Ala Asn Asn Thr Phe Gly
260 265 270
Ser Ala Asn Val Thr Thr Thr Leu Glu Val Val Asp Lys Gly Phe Ile
275 280 285
Asn Ile Phe Pro Met Ile Asn Thr Thr Val Phe Val Asn Asp Gly Glu
290 295 300
Asn Val Asp Leu Ile Val Glu Tyr Glu Ala Phe Pro Lys Pro Glu His
305 310 315 320
Gln Gln Trp Ile Tyr Met Asn Arg Thr Phe Thr Asp Lys Trp Glu Asp
325 330 335
Tyr Pro Lys Ser Glu Asn Glu Ser Asn Ile Arg Tyr Val Ser Glu Leu
340 345 350
His Leu Thr Arg Leu Lys Gly Thr Glu Gly Gly Thr Tyr Thr Phe Leu
355 360 365
Val Ser Asn Ser Asp Val Asn Ala Ala Ile Ala Phe Asn Val Tyr Val
370 375 380
Asn Thr Lys Pro Glu Ile Leu Thr Tyr Asp Arg Leu Val Asn Gly Met
385 390 395 400
Leu Gln Cys Val Ala Ala Gly Phe Pro Glu Pro Thr Ile Asp Trp Tyr
405 410 415
Phe Cys Pro Gly Thr Glu Gln Arg Cys Ser Ala Ser Val Leu Pro Val
420 425 430
Asp Val Gln Thr Leu Asn Ser Ser Gly Pro Pro Phe Gly Lys Leu Val
435 440 445
Val Gln Ser Ser Ile Asp Ser Ser Ala Phe Lys His Asn Gly Thr Val
450 455 460
Glu Cys Lys Ala Tyr Asn Asp Val Gly Lys Thr Ser Ala Tyr Phe Asn
465 470 475 480
Phe Ala Phe Lys Glu Gln Ile His Pro His Thr Leu Phe Thr Pro Arg
485 490 495
Ser His His His His His His
500
<210> 113
<211> 294
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 113
Gln Pro Ser Val Ser Pro Gly Glu Pro Ser Pro Pro Ser Ile His Pro
1 5 10 15
Gly Lys Ser Asp Leu Ile Val Arg Val Gly Asp Glu Ile Arg Leu Leu
20 25 30
Cys Thr Asp Pro Gly Phe Val Lys Trp Thr Phe Glu Ile Leu Asp Glu
35 40 45
Thr Asn Glu Asn Lys Gln Asn Glu Trp Ile Thr Glu Lys Ala Glu Ala
50 55 60
Thr Asn Thr Gly Lys Tyr Thr Cys Thr Asn Lys His Gly Leu Ser Asn
65 70 75 80
Ser Ile Tyr Val Phe Val Arg Asp Pro Ala Lys Leu Phe Leu Val Asp
85 90 95
Arg Ser Leu Tyr Gly Lys Glu Asp Asn Asp Thr Leu Val Arg Cys Pro
100 105 110
Leu Thr Asp Pro Glu Val Thr Asn Tyr Ser Leu Lys Gly Cys Gln Gly
115 120 125
Lys Pro Leu Pro Lys Asp Leu Arg Phe Ile Pro Asp Pro Lys Ala Gly
130 135 140
Ile Met Ile Lys Ser Val Lys Arg Ala Tyr His Arg Leu Cys Leu His
145 150 155 160
Cys Ser Val Asp Gln Glu Gly Lys Ser Val Leu Ser Glu Lys Phe Ile
165 170 175
Leu Lys Val Arg Pro Ala Phe Lys Ala Val Pro Val Val Ser Val Ser
180 185 190
Lys Ala Ser Tyr Leu Leu Arg Glu Gly Glu Glu Phe Thr Val Thr Cys
195 200 205
Thr Ile Lys Asp Val Ser Ser Ser Val Tyr Ser Thr Trp Lys Arg Glu
210 215 220
Asn Ser Gln Thr Lys Leu Gln Glu Lys Tyr Asn Ser Trp His His Gly
225 230 235 240
Asp Phe Asn Tyr Glu Arg Gln Ala Thr Leu Thr Ile Ser Ser Ala Arg
245 250 255
Val Asn Asp Ser Gly Val Phe Met Cys Tyr Ala Asn Asn Thr Phe Gly
260 265 270
Ser Ala Asn Val Thr Thr Thr Leu Glu Val Val Asp Lys Gly Arg Ser
275 280 285
His His His His His His
290
<210> 114
<211> 222
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 114
Gly Phe Ile Asn Ile Phe Pro Met Ile Asn Thr Thr Val Phe Val Asn
1 5 10 15
Asp Gly Glu Asn Val Asp Leu Ile Val Glu Tyr Glu Ala Phe Pro Lys
20 25 30
Pro Glu His Gln Gln Trp Ile Tyr Met Asn Arg Thr Phe Thr Asp Lys
35 40 45
Trp Glu Asp Tyr Pro Lys Ser Glu Asn Glu Ser Asn Ile Arg Tyr Val
50 55 60
Ser Glu Leu His Leu Thr Arg Leu Lys Gly Thr Glu Gly Gly Thr Tyr
65 70 75 80
Thr Phe Leu Val Ser Asn Ser Asp Val Asn Ala Ala Ile Ala Phe Asn
85 90 95
Val Tyr Val Asn Thr Lys Pro Glu Ile Leu Thr Tyr Asp Arg Leu Val
100 105 110
Asn Gly Met Leu Gln Cys Val Ala Ala Gly Phe Pro Glu Pro Thr Ile
115 120 125
Asp Trp Tyr Phe Cys Pro Gly Thr Glu Gln Arg Cys Ser Ala Ser Val
130 135 140
Leu Pro Val Asp Val Gln Thr Leu Asn Ser Ser Gly Pro Pro Phe Gly
145 150 155 160
Lys Leu Val Val Gln Ser Ser Ile Asp Ser Ser Ala Phe Lys His Asn
165 170 175
Gly Thr Val Glu Cys Lys Ala Tyr Asn Asp Val Gly Lys Thr Ser Ala
180 185 190
Tyr Phe Asn Phe Ala Phe Lys Gly Asn Asn Lys Glu Gln Ile His Pro
195 200 205
His Thr Leu Phe Thr Pro Arg Ser His His His His His His
210 215 220
<210> 115
<211> 741
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 115
Ser Gln Pro Ser Ala Ser Pro Gly Glu Pro Ser Pro Pro Ser Ile His
1 5 10 15
Pro Ala Gln Ser Glu Leu Ile Val Glu Ala Gly Asp Thr Leu Ser Leu
20 25 30
Thr Cys Ile Asp Pro Asp Phe Val Arg Trp Thr Phe Lys Thr Tyr Phe
35 40 45
Asn Glu Met Val Glu Asn Lys Lys Asn Glu Trp Ile Gln Glu Lys Ala
50 55 60
Glu Ala Thr Arg Thr Gly Thr Tyr Thr Cys Ser Asn Ser Asn Gly Leu
65 70 75 80
Thr Ser Ser Ile Tyr Val Phe Val Arg Asp Pro Ala Lys Leu Phe Leu
85 90 95
Val Gly Leu Pro Leu Phe Gly Lys Glu Asp Ser Asp Ala Leu Val Arg
100 105 110
Cys Pro Leu Thr Asp Pro Gln Val Ser Asn Tyr Ser Leu Ile Glu Cys
115 120 125
Asp Gly Lys Ser Leu Pro Thr Asp Leu Thr Phe Val Pro Asn Pro Lys
130 135 140
Ala Gly Ile Thr Ile Lys Asn Val Lys Arg Ala Tyr His Arg Leu Cys
145 150 155 160
Val Arg Cys Ala Ala Gln Arg Asp Gly Thr Trp Leu His Ser Asp Lys
165 170 175
Phe Thr Leu Lys Val Arg Ala Ala Ile Lys Ala Ile Pro Val Val Ser
180 185 190
Val Pro Glu Thr Ser His Leu Leu Lys Lys Gly Asp Thr Phe Thr Val
195 200 205
Val Cys Thr Ile Lys Asp Val Ser Thr Ser Val Asn Ser Met Trp Leu
210 215 220
Lys Met Asn Pro Gln Pro Gln His Ile Ala Gln Val Lys His Asn Ser
225 230 235 240
Trp His Arg Gly Asp Phe Asn Tyr Glu Arg Gln Glu Thr Leu Thr Ile
245 250 255
Ser Ser Ala Arg Val Asp Asp Ser Gly Val Phe Met Cys Tyr Ala Asn
260 265 270
Asn Thr Phe Gly Ser Ala Asn Val Thr Thr Thr Leu Lys Val Val Glu
275 280 285
Lys Gly Phe Ile Asn Ile Ser Pro Val Lys Asn Thr Thr Val Phe Val
290 295 300
Thr Asp Gly Glu Asn Val Asp Leu Val Val Glu Tyr Glu Ala Tyr Pro
305 310 315 320
Lys Pro Glu His Gln Gln Trp Ile Tyr Met Asn Arg Thr Ser Ala Asn
325 330 335
Lys Gly Lys Asp Tyr Val Lys Ser Asp Asn Lys Ser Asn Ile Arg Tyr
340 345 350
Val Asn Gln Leu Arg Leu Thr Arg Leu Lys Gly Thr Glu Gly Gly Thr
355 360 365
Tyr Thr Phe Leu Val Ser Asn Ser Asp Ala Ser Ala Ser Val Thr Phe
370 375 380
Asn Val Tyr Val Asn Thr Lys Pro Glu Ile Leu Thr Tyr Asp Arg Leu
385 390 395 400
Ile Asn Gly Met Leu Gln Cys Val Ala Glu Gly Phe Pro Glu Pro Thr
405 410 415
Ile Asp Trp Tyr Phe Cys Thr Gly Ala Glu Gln Arg Cys Thr Thr Pro
420 425 430
Val Ser Pro Val Asp Val Gln Val Gln Asn Val Ser Val Ser Pro Phe
435 440 445
Gly Lys Leu Val Val Gln Ser Ser Ile Asp Ser Ser Val Phe Arg His
450 455 460
Asn Gly Thr Val Glu Cys Lys Ala Ser Asn Asp Val Gly Lys Ser Ser
465 470 475 480
Ala Phe Phe Asn Phe Ala Phe Lys Glu Gln Ile Gln Ala His Thr Leu
485 490 495
Phe Thr Pro Leu Glu Val Leu Phe Gln Gly Pro Arg Ser Pro Arg Gly
500 505 510
Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu
515 520 525
Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val
530 535 540
Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val Val Val Asp Val
545 550 555 560
Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val
565 570 575
Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser
580 585 590
Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met
595 600 605
Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ala
610 615 620
Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro
625 630 635 640
Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln
645 650 655
Val Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr
660 665 670
Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr
675 680 685
Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu
690 695 700
Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser
705 710 715 720
Val Val His Glu Gly Leu His Asn His His Thr Thr Lys Ser Phe Ser
725 730 735
Arg Thr Pro Gly Lys
740
<210> 116
<211> 741
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 116
Ser Gln Pro Ser Ala Ser Pro Gly Glu Pro Ser Pro Pro Ser Ile Gln
1 5 10 15
Pro Ala Gln Ser Glu Leu Ile Val Glu Ala Gly Asp Thr Ile Arg Leu
20 25 30
Thr Cys Thr Asp Pro Ala Phe Val Lys Trp Thr Phe Glu Ile Leu Asp
35 40 45
Val Arg Ile Glu Asn Lys Gln Ser Glu Trp Ile Arg Glu Lys Ala Glu
50 55 60
Ala Thr His Thr Gly Lys Tyr Thr Cys Val Ser Gly Ser Gly Leu Arg
65 70 75 80
Ser Ser Ile Tyr Val Phe Val Arg Asp Pro Ala Val Leu Phe Leu Val
85 90 95
Gly Leu Pro Leu Phe Gly Lys Glu Asp Asn Asp Ala Leu Val Arg Cys
100 105 110
Pro Leu Thr Asp Pro Gln Val Ser Asn Tyr Ser Leu Ile Glu Cys Asp
115 120 125
Gly Lys Ser Leu Pro Thr Asp Leu Lys Phe Val Pro Asn Pro Lys Ala
130 135 140
Gly Ile Thr Ile Lys Asn Val Lys Arg Ala Tyr His Arg Leu Cys Ile
145 150 155 160
Arg Cys Ala Ala Gln Arg Glu Gly Lys Trp Met Arg Ser Asp Lys Phe
165 170 175
Thr Leu Lys Val Arg Ala Ala Ile Lys Ala Ile Pro Val Val Ser Val
180 185 190
Pro Glu Thr Ser His Leu Leu Lys Glu Gly Asp Thr Phe Thr Val Ile
195 200 205
Cys Thr Ile Lys Asp Val Ser Thr Ser Val Asp Ser Met Trp Ile Lys
210 215 220
Leu Asn Pro Gln Pro Gln Ser Lys Ala Gln Val Lys Arg Asn Ser Trp
225 230 235 240
His Gln Gly Asp Phe Asn Tyr Glu Arg Gln Glu Thr Leu Thr Ile Ser
245 250 255
Ser Ala Arg Val Asn Asp Ser Gly Val Phe Met Cys Tyr Ala Asn Asn
260 265 270
Thr Phe Gly Ser Ala Asn Val Thr Thr Thr Leu Lys Val Val Glu Lys
275 280 285
Gly Phe Ile Asn Ile Phe Pro Val Lys Asn Thr Thr Val Phe Val Thr
290 295 300
Asp Gly Glu Asn Val Asp Leu Val Val Glu Phe Glu Ala Tyr Pro Lys
305 310 315 320
Pro Glu His Gln Gln Trp Ile Tyr Met Asn Arg Thr Pro Thr Asn Arg
325 330 335
Gly Glu Asp Tyr Val Lys Ser Asp Asn Gln Ser Asn Ile Arg Tyr Val
340 345 350
Asn Glu Leu Arg Leu Thr Arg Leu Lys Gly Thr Glu Gly Gly Thr Tyr
355 360 365
Thr Phe Leu Val Ser Asn Ser Asp Val Ser Ala Ser Val Thr Phe Asp
370 375 380
Val Tyr Val Asn Thr Lys Pro Glu Ile Leu Thr Tyr Asp Arg Leu Met
385 390 395 400
Asn Gly Arg Leu Gln Cys Val Ala Ala Gly Phe Pro Glu Pro Thr Ile
405 410 415
Asp Trp Tyr Phe Cys Thr Gly Ala Glu Gln Arg Cys Thr Val Pro Val
420 425 430
Pro Pro Val Asp Val Gln Ile Gln Asn Ala Ser Val Ser Pro Phe Gly
435 440 445
Lys Leu Val Val Gln Ser Ser Ile Asp Ser Ser Val Phe Arg His Asn
450 455 460
Gly Thr Val Glu Cys Lys Ala Ser Asn Ala Val Gly Lys Ser Ser Ala
465 470 475 480
Phe Phe Asn Phe Ala Phe Lys Gly Asn Ser Lys Glu Gln Ile Gln Pro
485 490 495
His Thr Leu Phe Thr Pro Arg Ser Leu Glu Val Leu Phe Gln Gly Pro
500 505 510
Gly Ser Pro Pro Leu Lys Glu Cys Pro Pro Cys Ala Ala Pro Asp Leu
515 520 525
Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val
530 535 540
Leu Met Ile Ser Leu Ser Pro Met Val Thr Cys Val Val Val Asp Val
545 550 555 560
Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val
565 570 575
Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser
580 585 590
Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met
595 600 605
Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Arg Ala Leu Pro Ser
610 615 620
Pro Ile Glu Lys Thr Ile Ser Lys Pro Arg Gly Pro Val Arg Ala Pro
625 630 635 640
Gln Val Tyr Val Leu Pro Pro Pro Ala Glu Glu Met Thr Lys Lys Glu
645 650 655
Phe Ser Leu Thr Cys Met Ile Thr Gly Phe Leu Pro Ala Glu Ile Ala
660 665 670
Val Asp Trp Thr Ser Asn Gly Arg Thr Glu Gln Asn Tyr Lys Asn Thr
675 680 685
Ala Thr Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu
690 695 700
Arg Val Gln Lys Ser Thr Trp Glu Arg Gly Ser Leu Phe Ala Cys Ser
705 710 715 720
Val Val His Glu Gly Leu His Asn His Leu Thr Thr Lys Thr Ile Ser
725 730 735
Arg Ser Leu Gly Lys
740
<210> 117
<211> 527
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 117
Met Tyr Arg Met Gln Leu Leu Ser Cys Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser Gln Pro Ser Val Ser Pro Gly Glu Pro Ser Pro Pro
20 25 30
Ser Ile His Pro Ala Lys Ser Glu Leu Ile Val Arg Val Gly Asn Glu
35 40 45
Ile Arg Leu Leu Cys Ile Asp Pro Gly Phe Val Lys Trp Thr Phe Glu
50 55 60
Ile Leu Asp Glu Thr Asn Glu Asn Lys Gln Asn Glu Trp Ile Thr Glu
65 70 75 80
Lys Ala Glu Ala Thr Asn Thr Gly Lys Tyr Thr Cys Thr Asn Lys His
85 90 95
Gly Leu Ser Ser Ser Ile Tyr Val Phe Val Arg Asp Pro Ala Lys Leu
100 105 110
Phe Leu Val Asp Arg Ser Leu Tyr Gly Lys Glu Asp Asn Asp Thr Leu
115 120 125
Val Arg Cys Pro Leu Thr Asp Pro Glu Val Thr Ser Tyr Ser Leu Lys
130 135 140
Gly Cys Gln Gly Lys Pro Leu Pro Lys Asp Leu Arg Phe Val Pro Asp
145 150 155 160
Pro Lys Ala Gly Ile Thr Ile Lys Ser Val Lys Arg Ala Tyr His Arg
165 170 175
Leu Cys Leu His Cys Ser Ala Asp Gln Glu Gly Lys Ser Val Leu Ser
180 185 190
Asp Lys Phe Ile Leu Lys Val Arg Pro Ala Phe Lys Ala Val Pro Val
195 200 205
Val Ser Val Ser Lys Ala Ser Tyr Leu Leu Arg Glu Gly Glu Glu Phe
210 215 220
Thr Val Thr Cys Thr Ile Lys Asp Val Ser Ser Ser Val Tyr Ser Thr
225 230 235 240
Trp Lys Arg Glu Asn Ser Gln Thr Lys Leu Gln Glu Lys Tyr Asn Ser
245 250 255
Trp His His Gly Asp Phe Asn Tyr Glu Arg Gln Ala Thr Leu Thr Ile
260 265 270
Ser Ser Ala Arg Val Asn Asp Ser Gly Val Phe Met Cys Tyr Ala Asn
275 280 285
Asn Thr Phe Gly Ser Ala Asn Val Thr Thr Thr Leu Glu Val Val Asp
290 295 300
Lys Gly Phe Ile Asn Ile Phe Pro Met Ile Asn Thr Thr Val Phe Val
305 310 315 320
Asn Asp Gly Glu Asn Val Asp Leu Ile Val Glu Tyr Glu Ala Phe Pro
325 330 335
Lys Pro Glu His Gln Gln Trp Ile Tyr Met Asn Arg Thr Phe Thr Asp
340 345 350
Lys Trp Glu Asp Tyr Pro Lys Ser Glu Asn Glu Ser Asn Ile Arg Tyr
355 360 365
Val Ser Glu Leu His Leu Thr Arg Leu Lys Gly Thr Glu Gly Gly Thr
370 375 380
Tyr Thr Phe Leu Val Ser Asn Ser Asp Val Asn Ala Ser Ile Ala Phe
385 390 395 400
Asn Val Tyr Val Asn Thr Lys Pro Glu Ile Leu Thr Tyr Asp Arg Leu
405 410 415
Val Asn Gly Met Leu Gln Cys Val Ala Ala Gly Phe Pro Glu Pro Thr
420 425 430
Ile Asp Trp Tyr Phe Cys Pro Gly Thr Glu Gln Arg Cys Ser Ala Ser
435 440 445
Val Leu Pro Val Asp Val Gln Thr Leu Asn Ala Ser Gly Pro Pro Phe
450 455 460
Gly Lys Leu Val Val Gln Ser Ser Ile Asp Ser Ser Ala Phe Lys His
465 470 475 480
Asn Gly Thr Val Glu Cys Lys Ala Tyr Asn Asp Val Gly Lys Thr Ser
485 490 495
Ala Tyr Phe Asn Phe Ala Phe Lys Gly Asn Asn Lys Glu Gln Ile His
500 505 510
Pro His Thr Leu Phe Thr Pro Arg Ser His His His His His His
515 520 525
<210> 118
<211> 222
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 118
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
<210> 119
<211> 231
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 119
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro
225 230
<210> 120
<211> 233
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 120
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro
225 230
<210> 121
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 121
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Pro
225 230 235
<210> 122
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 122
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Glu Ser Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Cys Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 123
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 123
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Glu Ser Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Cys Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 124
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 124
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser His
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
<210> 125
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 125
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser His
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro
225
<210> 126
<211> 231
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 126
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser His
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro
225 230
<210> 127
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 127
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser His
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Pro
225 230 235
<210> 128
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 128
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Gln Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Leu Pro Ser
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Cys Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 129
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 129
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Gln Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Leu Pro Ser
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Cys Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 130
<211> 222
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 130
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
<210> 131
<211> 231
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 131
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro
225 230
<210> 132
<211> 233
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 132
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro
225 230
<210> 133
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 133
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Pro
225 230 235
<210> 134
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 134
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Glu Ser Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Cys Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 135
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 135
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Glu Ser Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Cys Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 136
<211> 231
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 136
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Cys Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp
225 230
<210> 137
<211> 240
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 137
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
<210> 138
<211> 242
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 138
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro
<210> 139
<211> 247
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 139
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly Pro
245
<210> 140
<211> 212
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 140
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Leu Gly Asp Gln Tyr Val
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Asp Thr Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Thr Asp Ser Lys Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala Ala
100 105 110
Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala Asn
115 120 125
Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Cys Val
130 135 140
Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val Glu
145 150 155 160
Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser Ser
165 170 175
Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr Ser
180 185 190
Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val Ala Pro
195 200 205
Thr Glu Cys Ser
210
<210> 141
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 141
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ala Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Ser Asn Ser Tyr Thr Leu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp
225
<210> 142
<211> 236
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 142
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ala Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Ser Asn Ser Tyr Thr Leu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235
<210> 143
<211> 238
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 143
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ala Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Ser Asn Ser Tyr Thr Leu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235
<210> 144
<211> 243
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 144
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Ile Ala Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Ser Asn Ser Tyr Thr Leu Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Pro Gly Gly Ser Ile Ser Tyr Pro Ala Phe Asp His
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Pro
<210> 145
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 145
Asp Ile Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Ile Gly Ser Ile Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Arg Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ser Val Thr Asp Met Glu Gln His Ser
85 90 95
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys Ala
100 105 110
Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln Ala
115 120 125
Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly Cys
130 135 140
Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly Val
145 150 155 160
Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala Ser
165 170 175
Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser Tyr
180 185 190
Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val Ala
195 200 205
Pro Thr Glu Cys Ser
210
<210> 146
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 146
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235
<210> 147
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 147
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 148
<211> 231
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 148
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys His His His His His His
225 230
<210> 149
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 149
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Cys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 150
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 150
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 151
<211> 16
<212> БЕЛОК
<213> Цитомегаловирус человека
<400> 151
Met Pro Leu Leu Leu Leu Leu Pro Leu Leu Trp Ala Gly Ala Leu Ala
1 5 10 15
<210> 152
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 152
Met Ser Val Leu Thr Gln Val Leu Ala Leu Leu Leu Leu Trp Leu Thr
1 5 10 15
Gly Thr Arg Cys
20
<210> 153
<211> 246
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 153
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Cys Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly
245
<210> 154
<211> 237
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 154
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235
<210> 155
<211> 225
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 155
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His
225
<210> 156
<211> 239
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 156
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235
<210> 157
<211> 225
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 157
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys
225
<210> 158
<211> 232
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 158
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Gln Trp Leu Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gln Leu Thr Tyr Pro Tyr Thr Val Tyr His Lys
100 105 110
Ala Leu Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Cys Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys
225 230
<210> 159
<211> 223
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 159
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Phe Pro Ala Glu Gly Ala Pro Gly Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
<210> 160
<211> 221
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 160
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser His
20 25 30
Ala Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ser Phe Gly Thr Ala Asp Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Tyr Asp Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
<210> 161
<211> 223
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 161
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Thr Ile Gly Pro Phe Glu Gly Gln Pro Arg Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Ile Ser Asp Phe Asp Val Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Cys Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
<210> 162
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетическая 6xHis метка"
<400> 162
His His His His His His
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИПЕПТИДНЫЙ ЛИНКЕР ДЛЯ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2776302C2 |
| СКОНСТРУИРОВАННЫЕ МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И ДРУГИЕ МУЛЬТИМЕРНЫЕ БЕЛКИ С АСИММЕТРИЧНЫМИ МУТАЦИЯМИ В ОБЛАСТИ CH2-CH3 | 2018 |
|
RU2804031C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| АНТИТЕЛА К PAC1 И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2781553C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2020 |
|
RU2841523C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2839153C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| СВЯЗЫВАЮЩИЕСЯ С CD38 И PD-L1 МОЛЕКУЛЫ | 2017 |
|
RU2764201C2 |
| АНТИТЕЛА, СОДЕРЖАЩИЕ ПОЛИПЕПТИД, ВСТРОЕННЫЙ В УЧАСТОК КАРКАСНОЙ ОБЛАСТИ 3 | 2019 |
|
RU2796254C2 |
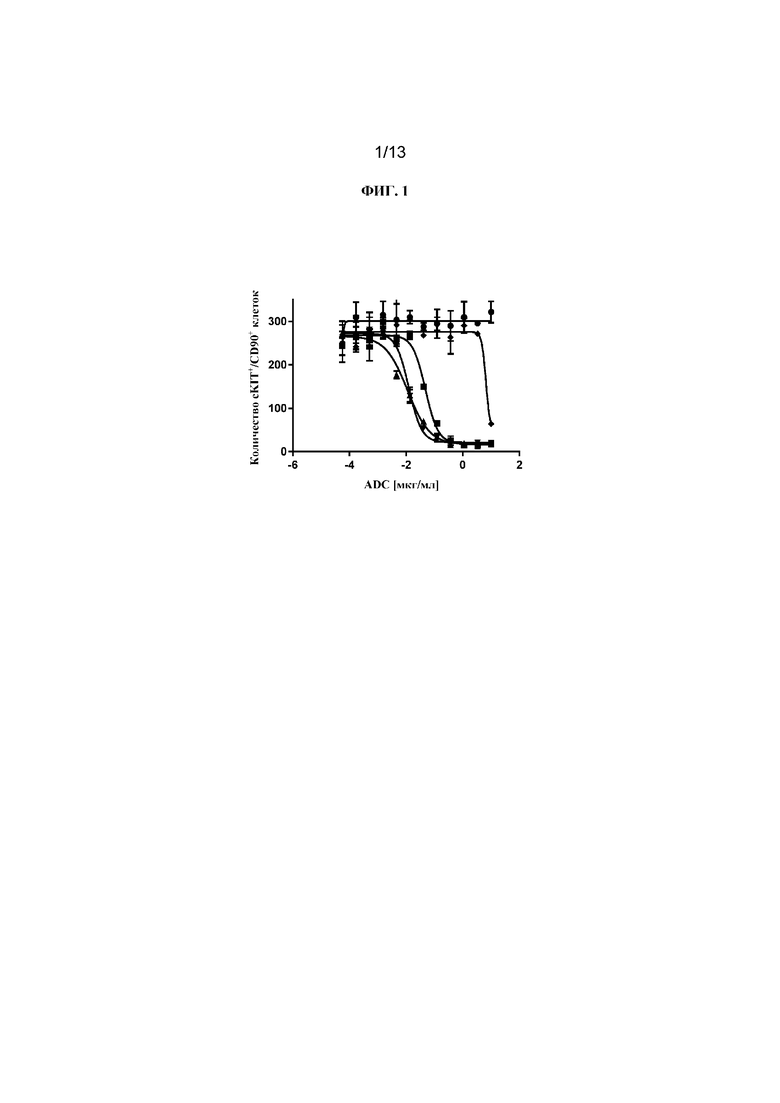
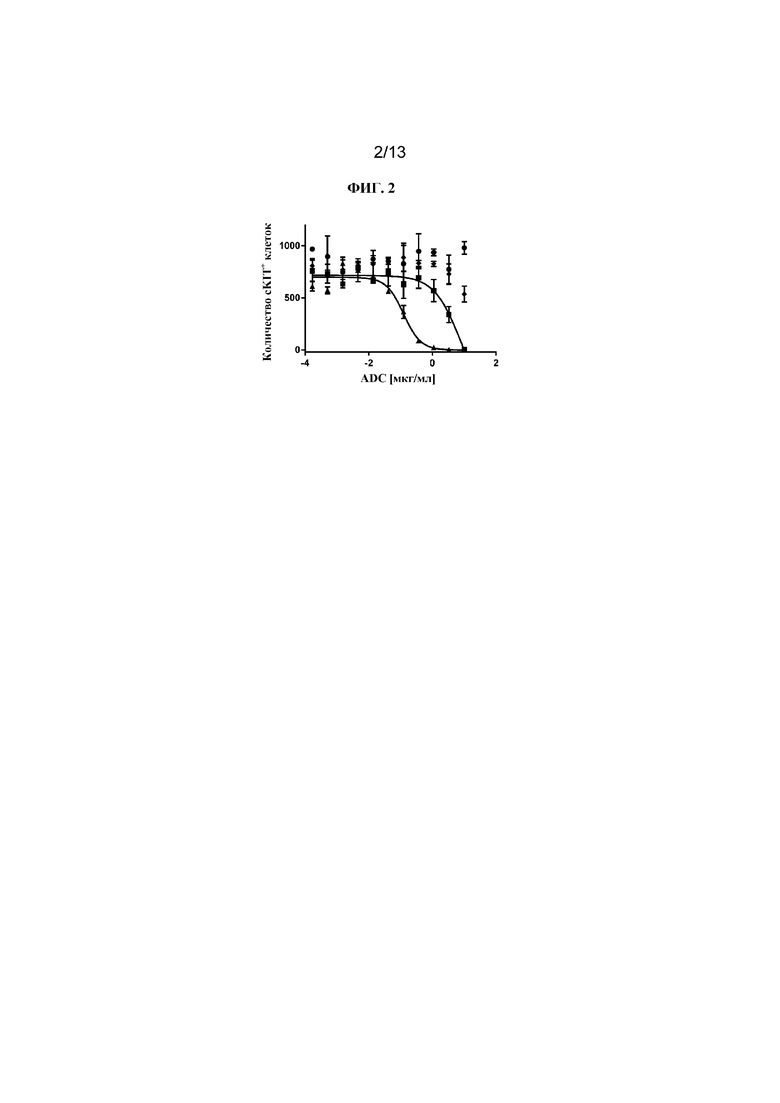
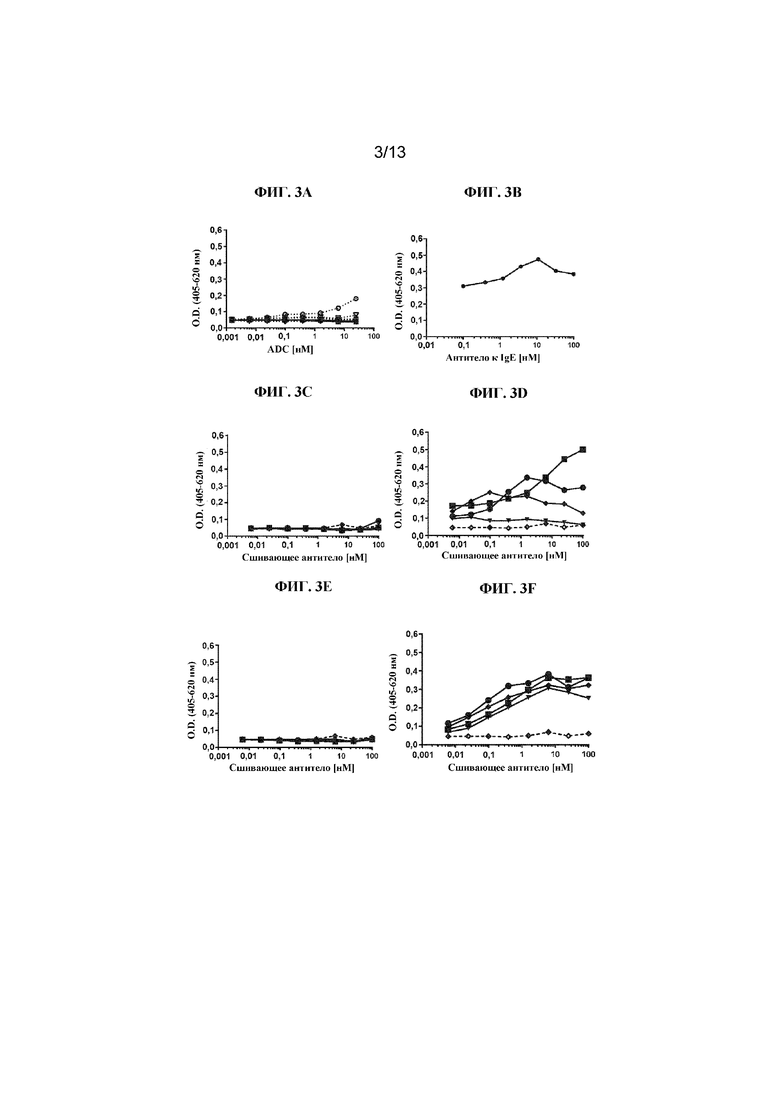

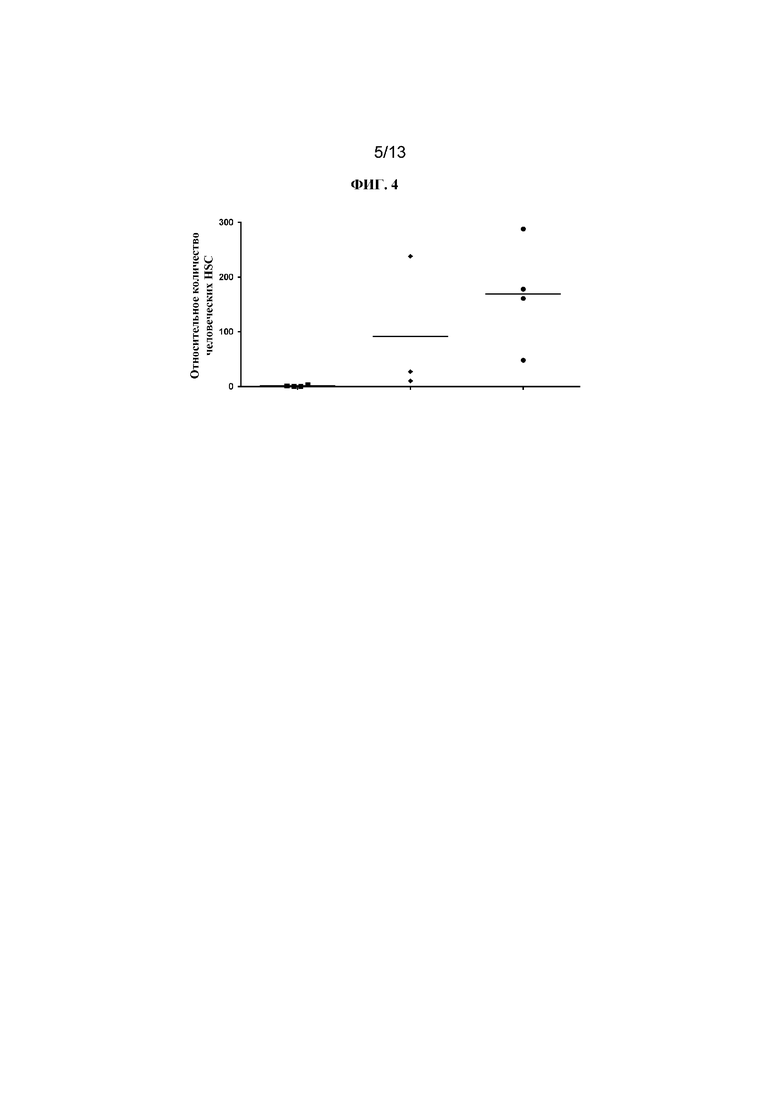

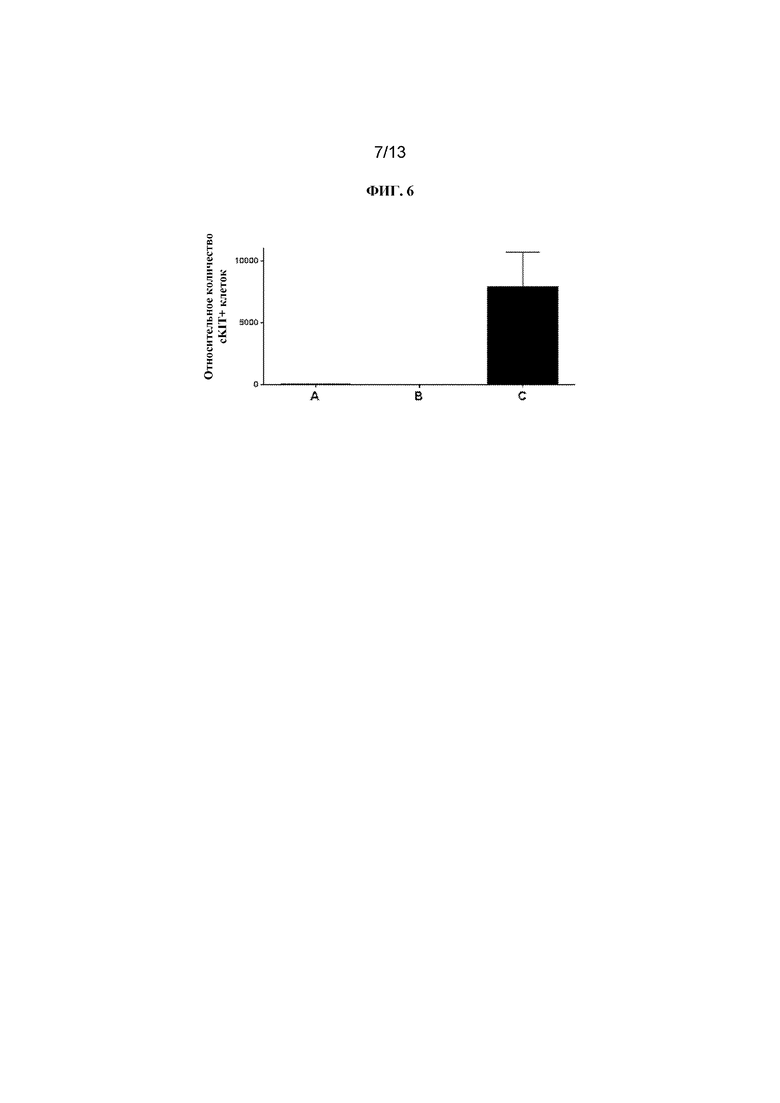
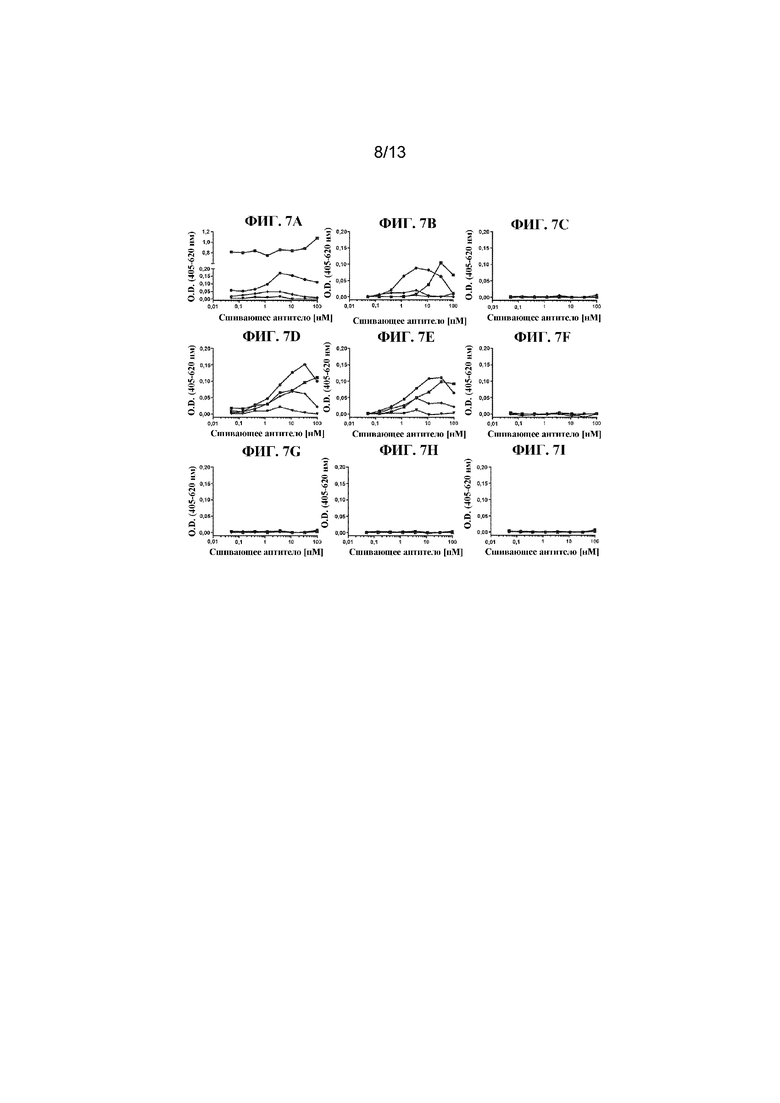

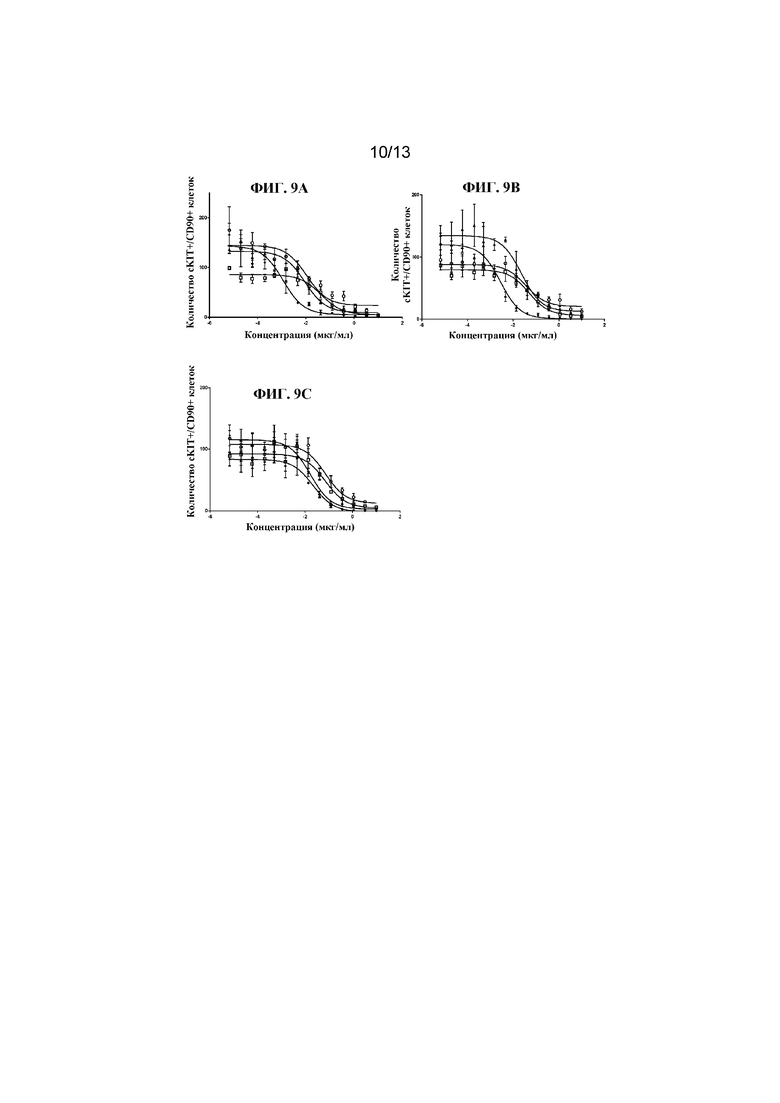


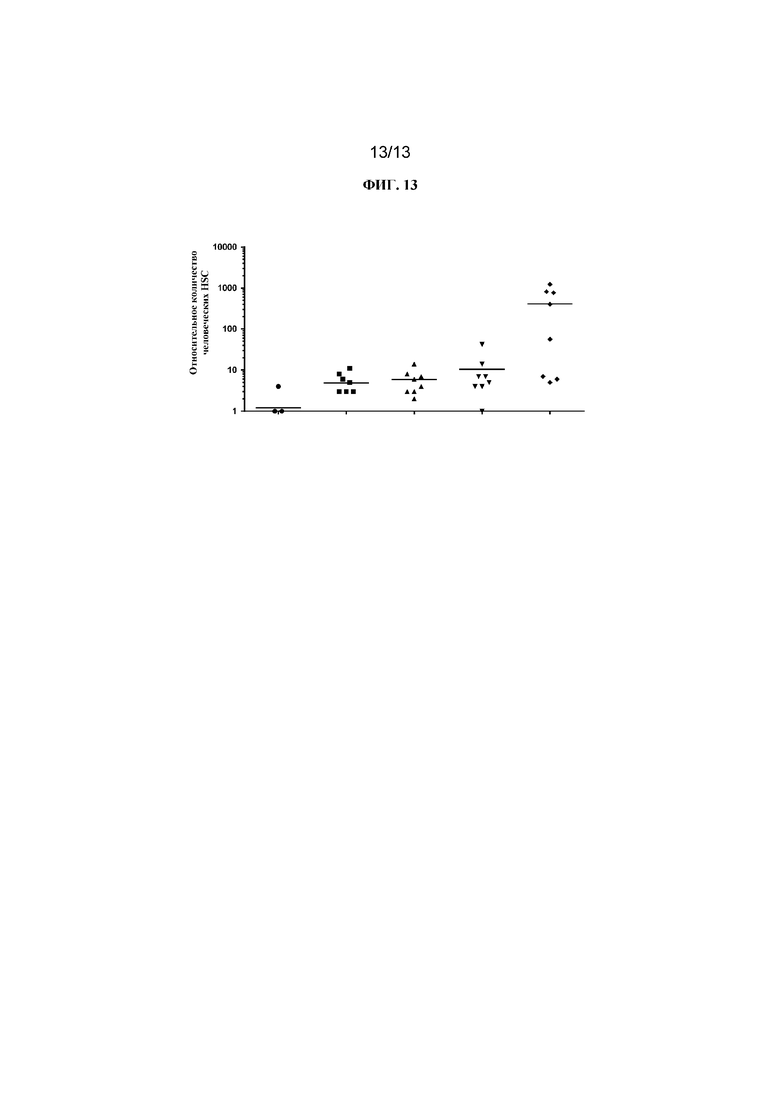
Изобретение относится к области биотехнологии, в частности к новым конъюгатам цитотоксических средств, и может быть применимо в медицине. Изобретение позволяет получить конъюгат антитела, специфически связывающегося с CKIT человека, или его антигенсвязывающего фрагмента с цитотоксическим средством, выбранным из ауристатина, аманитина, майтанзиноида или сапорина. Такой конъюгат не индуцирует дегрануляцию мастоцитов и подходит для разрушения гемопоэтических стволовых клеток, например, при различных наследственных иммунодефицитных заболеваниях, аутоиммунных нарушениях, нарушении гемопоэза или при врожденном нарушении обмена веществ. Изобретение также может быть использовано в медицинской практике для предотвращения иммунологического отторжения трансплантата при аллогенной трансплантации гемопоэтических стволовых клеток. 5 н. и 34 з.п. ф-лы, 11 пр., 8 табл., 13 ил.
1. Конъюгат формулы (I) или его фармацевтически приемлемая соль:

где A представляет собой фрагмент антитела, который специфически связывается с cKIT человека, где фрагмент антитела выбран из любого из следующих:
(1) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 (определяющую комплементарность область 1 тяжелой цепи) под SEQ ID NO: 1, (b) HCDR2 (определяющую комплементарность область 2 тяжелой цепи) под SEQ ID NO: 2 и (c) HCDR3 (определяющую комплементарность область 3 тяжелой цепи) под SEQ ID NO: 3; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 (определяющую комплементарность область 1 легкой цепи) под SEQ ID NO: 16, (e) LCDR2 (определяющую комплементарность область 2 легкой цепи) под SEQ ID NO: 17 и (f) LCDR3 (определяющую комплементарность область 3 легкой цепи) под SEQ ID NO: 18;
(2) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 4, (b) HCDR2 под SEQ ID NO: 5, (c) HCDR3 под SEQ ID NO: 3; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 19, (e) LCDR2 под SEQ ID NO: 20 и (f) LCDR3 под SEQ ID NO: 21;
(3) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 6, (b) HCDR2 под SEQ ID NO: 2, (c) HCDR3 под SEQ ID NO: 3; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 16, (e) LCDR2 под SEQ ID NO: 17 и (f) LCDR3 под SEQ ID NO: 18;
(4) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 7, (b) HCDR2 под SEQ ID NO: 8, (c) HCDR3 под SEQ ID NO: 9; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 22, (e) LCDR2 под SEQ ID NO: 20 и (f) LCDR3 под SEQ ID NO: 18;
(5) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 27, (b) HCDR2 под SEQ ID NO: 28, (c) HCDR3 под SEQ ID NO: 29; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 42, (e) LCDR2 под SEQ ID NO: 17 и (f) LCDR3 под SEQ ID NO: 43;
(6) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 30, (b) HCDR2 под SEQ ID NO: 31, (c) HCDR3 под SEQ ID NO: 29; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 44, (e) LCDR2 под SEQ ID NO: 20 и (f) LCDR3 под SEQ ID NO: 45;
(7) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 32, (b) HCDR2 под SEQ ID NO: 28, (c) HCDR3 под SEQ ID NO: 29; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 42, (e) LCDR2 под SEQ ID NO: 17 и (f) LCDR3 под SEQ ID NO: 43;
(8) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 33, (b) HCDR2 под SEQ ID NO: 34, (c) HCDR3 под SEQ ID NO: 35; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 46, (e) LCDR2 под SEQ ID NO: 20 и (f) LCDR3 под SEQ ID NO: 43;
(9) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 4, (b) HCDR2 под SEQ ID NO: 52, (c) HCDR3 под SEQ ID NO: 3; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 19, (e) LCDR2 под SEQ ID NO: 20 и (f) LCDR3 под SEQ ID NO: 21;
(10) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 6, (b) HCDR2 под SEQ ID NO: 51, (c) HCDR3 под SEQ ID NO: 3; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 16, (e) LCDR2 под SEQ ID NO: 17 и (f) LCDR3 под SEQ ID NO: 18;
(11) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 7, (b) HCDR2 под SEQ ID NO: 53, (c) HCDR3 под SEQ ID NO: 9; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 22, (e) LCDR2 под SEQ ID NO: 20 и (f) LCDR3 под SEQ ID NO: 18;
(12) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 60, (b) HCDR2 под SEQ ID NO: 61, (c) HCDR3 под SEQ ID NO: 62; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 75, (e) LCDR2 под SEQ ID NO: 76 и (f) LCDR3 под SEQ ID NO: 77;
(13) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 63, (b) HCDR2 под SEQ ID NO: 64, (c) HCDR3 под SEQ ID NO: 62; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 78, (e) LCDR2 под SEQ ID NO: 79 и (f) LCDR3 под SEQ ID NO: 80;
(14) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 65, (b) HCDR2 под SEQ ID NO: 61, (c) HCDR3 под SEQ ID NO: 62; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 75, (e) LCDR2 под SEQ ID NO: 76 и (f) LCDR3 под SEQ ID NO: 77;
(15) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 66, (b) HCDR2 под SEQ ID NO: 67, (c) HCDR3 под SEQ ID NO: 68; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 81, (e) LCDR2 под SEQ ID NO: 79 и (f) LCDR3 под SEQ ID NO: 77;
(16) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 86, (b) HCDR2 под SEQ ID NO: 87, (c) HCDR3 под SEQ ID NO: 88; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 101, (e) LCDR2 под SEQ ID NO: 102 и (f) LCDR3 под SEQ ID NO: 103;
(17) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 89, (b) HCDR2 под SEQ ID NO: 90, (c) HCDR3 под SEQ ID NO: 88; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 104, (e) LCDR2 под SEQ ID NO: 105 и (f) LCDR3 под SEQ ID NO: 106;
(18) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 91, (b) HCDR2 под SEQ ID NO: 87, (c) HCDR3 под SEQ ID NO: 88; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 101, (e) LCDR2 под SEQ ID NO: 102 и (f) LCDR3 под SEQ ID NO: 103;
(19) Fab или Fab', содержащих (i) вариабельную область тяжелой цепи, которая содержит (a) HCDR1 под SEQ ID NO: 92, (b) HCDR2 под SEQ ID NO: 93, (c) HCDR3 под SEQ ID NO: 94; и (ii) вариабельную область легкой цепи, которая содержит (d) LCDR1 под SEQ ID NO: 107, (e) LCDR2 под SEQ ID NO: 105 и (f) LCDR3 под SEQ ID NO: 103;
(20) Fab или Fab', содержащих вариабельную область тяжелой цепи (VH), которая содержит SEQ ID NO: 10, и вариабельную область легкой цепи (VL), которая содержит SEQ ID NO: 23;
(21) Fab или Fab', содержащих VH, которая содержит SEQ ID NO: 36, и VL, которая содержит SEQ ID NO: 47;
(22) Fab или Fab', содержащих VH, которая содержит SEQ ID NO: 69, и VL, которая содержит SEQ ID NO: 82;
(23) Fab или Fab', содержащих VH, которая содержит SEQ ID NO: 95, и VL, которая содержит SEQ ID NO: 108;
(24) Fab', содержащего тяжелую цепь, которая содержит SEQ ID NO: 14, и легкую цепь, которая содержит SEQ ID NO: 25;
(25) Fab', содержащего тяжелую цепь, которая содержит SEQ ID NO: 40, и легкую цепь, которая содержит SEQ ID NO: 49;
(26) Fab', содержащего тяжелую цепь, которая содержит SEQ ID NO: 73, и легкую цепь, которая содержит SEQ ID NO: 84;
(27) Fab', содержащего тяжелую цепь, которая содержит SEQ ID NO: 99, и легкую цепь, которая содержит SEQ ID NO: 110;
(28) Fab, содержащего тяжелую цепь, которая содержит SEQ ID NO: 118, и легкую цепь, которая содержит SEQ ID NO: 122;
(29) Fab, содержащего тяжелую цепь, которая содержит SEQ ID NO: 118, и легкую цепь, которая содержит SEQ ID NO: 123;
(30) Fab, содержащего тяжелую цепь, которая содержит SEQ ID NO: 124, и легкую цепь, которая содержит SEQ ID NO: 128;
(31) Fab, содержащего тяжелую цепь, которая содержит SEQ ID NO: 124, и легкую цепь, которая содержит SEQ ID NO: 129;
(32) Fab, содержащего тяжелую цепь, которая содержит SEQ ID NO: 130, и легкую цепь, которая содержит SEQ ID NO: 134;
(33) Fab, содержащего тяжелую цепь, которая содержит SEQ ID NO: 130, и легкую цепь, которая содержит SEQ ID NO: 135;
(34) Fab, содержащего тяжелую цепь, которая содержит SEQ ID NO: 136, и легкую цепь, которая содержит SEQ ID NO: 140;
(35) Fab, содержащего тяжелую цепь, которая содержит SEQ ID NO: 141, и легкую цепь, которая содержит SEQ ID NO: 145;
(36) Fab, содержащего тяжелую цепь, которая содержит аминокислотную последовательность, выбранную из SEQ ID NO: 119, 120 или 121, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 25;
(37) Fab, содержащего тяжелую цепь, которая содержит аминокислотную последовательность, выбранную из SEQ ID NO: 125, 126 или 127, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 49;
(38) Fab, содержащего тяжелую цепь, которая содержит аминокислотную последовательность, выбранную из SEQ ID NO: 137, 138 или 139, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 84; или
(39) Fab, содержащего тяжелую цепь, которая содержит аминокислотную последовательность, выбранную из SEQ ID NO: 142, 143 или 144, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 110;
LB представляет собой линкер, где каждый LB независимо выбран из расщепляемого линкера или нерасщепляемого линкера;
D представляет собой цитотоксическое средство, где каждый D представляет собой цитотоксическое средство, независимо выбранное из ауристатина, аманитина, майтанзиноида или сапорина;
n составляет целое число от 1 до 10 и
y составляет целое число от 1 до 10,
где конъюгат не индуцирует дегрануляцию мастоцитов и где конъюгат подходит для разрушения гемопоэтических стволовых клеток.
2. Конъюгат по п. 1, где n составляет 1, 2, 3, 4, 5, 6, 7 или 8.
3. Конъюгат по п. 1, где y составляет 1, 2, 3 или 4.
4. Конъюгат по любому из пп. 1–3, где каждый D представляет собой цитотоксическое средство, независимо выбранное из ауристатина, аманитина или майтанзиноида.
5. Конъюгат по любому из пп. 1–4, где каждый D представляет собой цитотоксическое средство, независимо выбранное из ауристатина или аманитина.
6. Конъюгат по любому из пп. 1–5, где каждый LB представляет собой расщепляемый линкер.
7. Конъюгат по любому из пп. 1–5, где каждый LB представляет собой нерасщепляемый линкер.
8. Конъюгат по любому из пп. 1-7, имеющий структуру формулы (C)
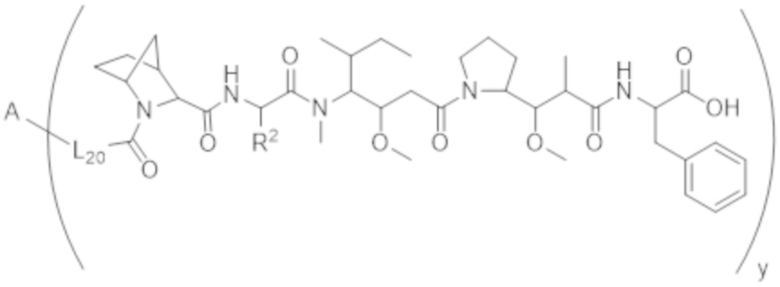 Формула (C),
Формула (C),
где R2 представляет собой C1–C6алкил;
L20 представляет собой -L1R40;
L1 представляет собой –((CH2)mO)p(CH2)mX1L4–, –((CH2)mO)p(CH2)mX2L4–, –((CH2)mO)p(CH2)m–, –(CH2)m–, –(CH2)mX1(CH2)m–, –(CH2)mNHC(=O)(CH2)m–, –(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m–, –((CH2)mO)p(CH2)mNHC(=O)(CH2)m, –((CH2)mO)pCH2)mC(=O)NH(CH2)m–, X3X4C(=O)((CH2)mO)p(CH2)m–, –X3X4C(=O)(CH2)m–, –X3C(=O)(CH2)nNHC(=O)(CH2)m–, –X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m–, –(CH2)mC(R7)2–, –(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m– или –(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m–;
L4 представляет собой –((CH2)m;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
, 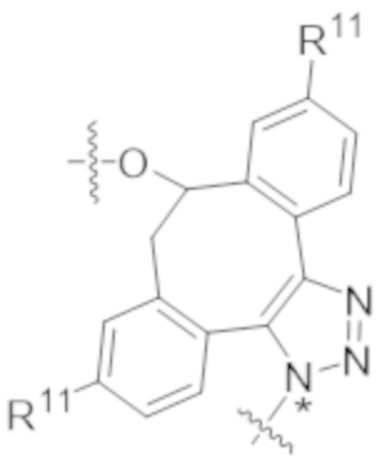 ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X3 представляет собой  ,
,  ,
, 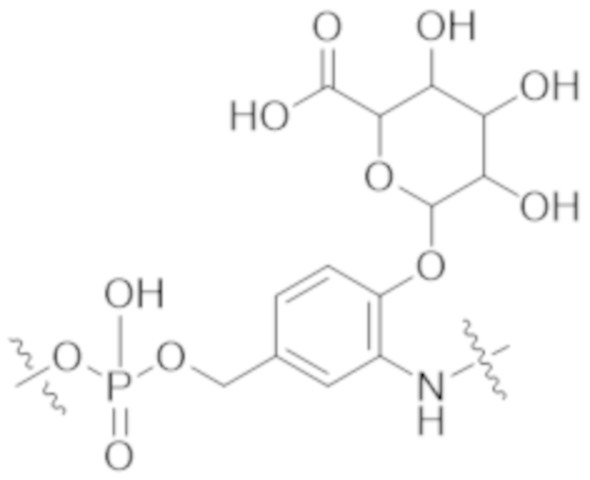 или
или 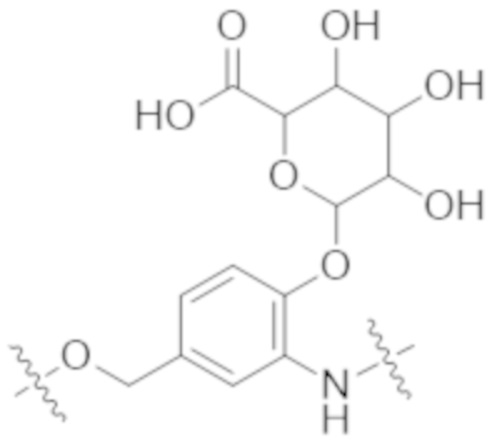 ;
;
X4 представляет собой 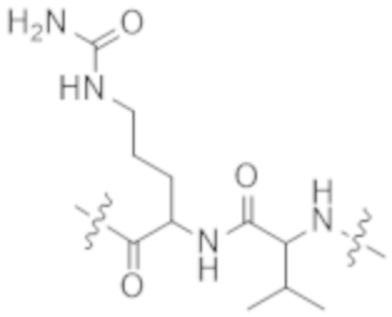 ,
,  ,
,  ,
,  ,
,  ,
, 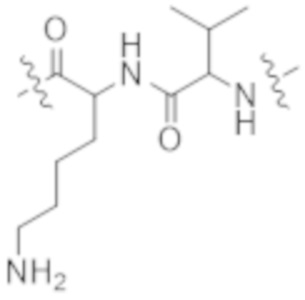 ,
, 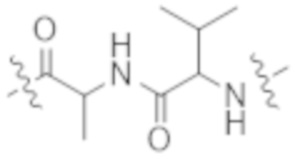 или
или 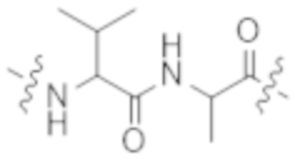 ;
;
R40 представляет собой 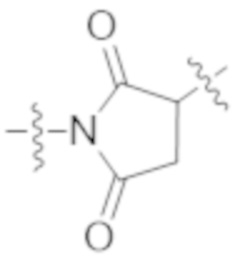 ,
, 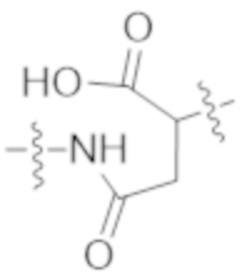 ,
, 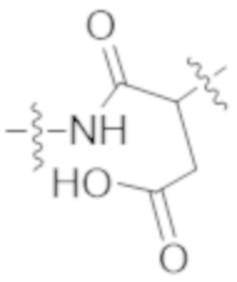 ,
,  ,
,  , –NR7C(=O)CH2–, –NHC(=O)CH2–, –S(=O)2CH2CH2–, –(CH2)2S(=O)2CH2CH2–, –NR7S(=O)2CH2CH2, –NR7C(=O)CH2CH2–, –NH–, –C(=O)–, –NHC(=O)–, –CH2NHCH2CH2–, –NHCH2CH2–, –S–,
, –NR7C(=O)CH2–, –NHC(=O)CH2–, –S(=O)2CH2CH2–, –(CH2)2S(=O)2CH2CH2–, –NR7S(=O)2CH2CH2, –NR7C(=O)CH2CH2–, –NH–, –C(=O)–, –NHC(=O)–, –CH2NHCH2CH2–, –NHCH2CH2–, –S–,  ,
,  ,
, 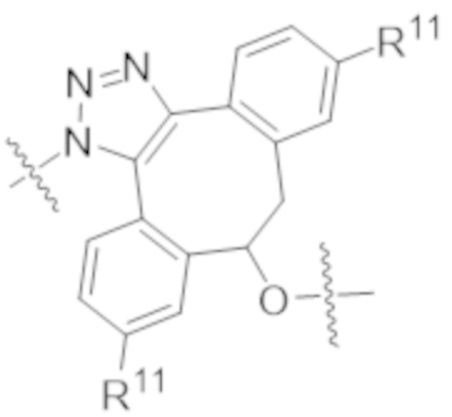 ,
, 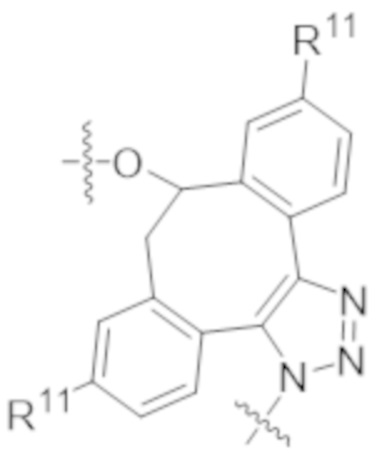 ,
, 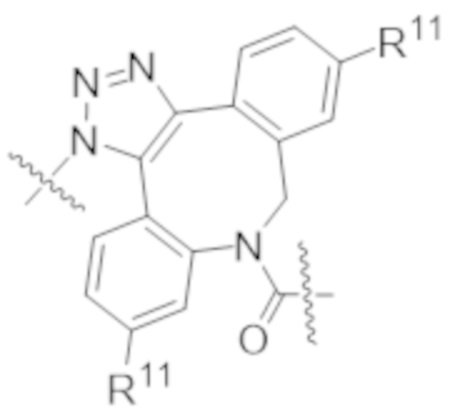 ,
, 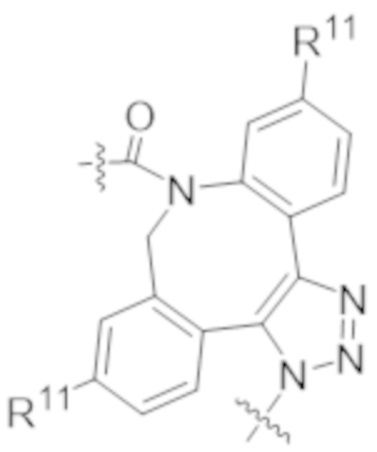 ,
, 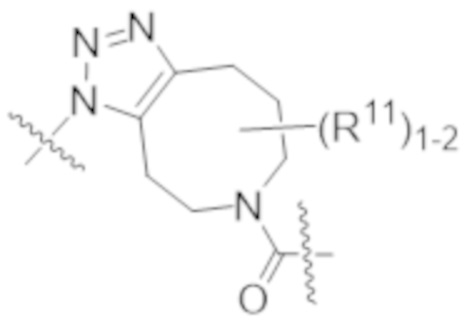 ,
, 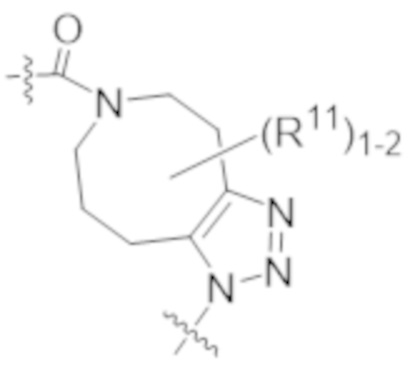 ,
, 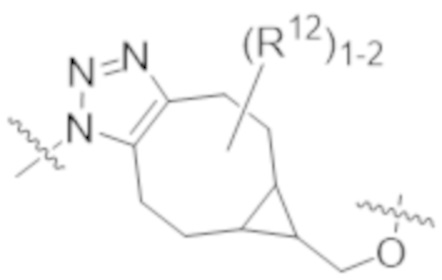 ,
, 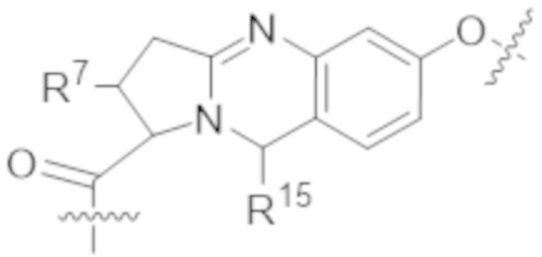 ,
,  ,
,  ,
,  ,
,  ,
, 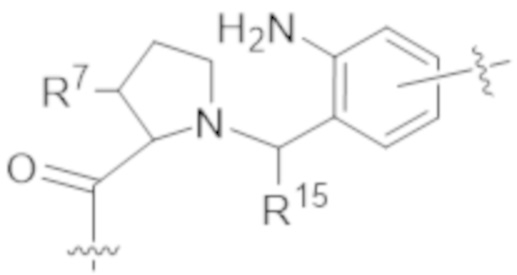 ,
, 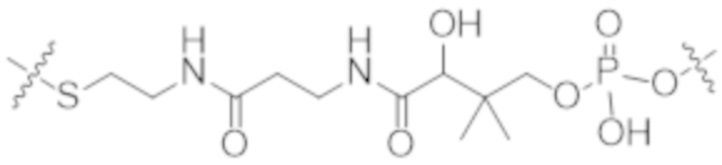 ,
, 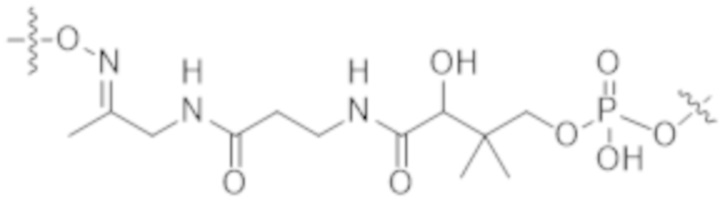 ,
, 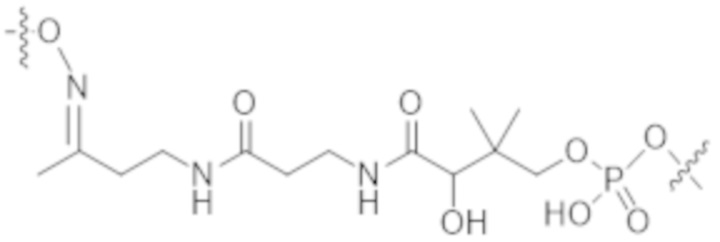 ,
, 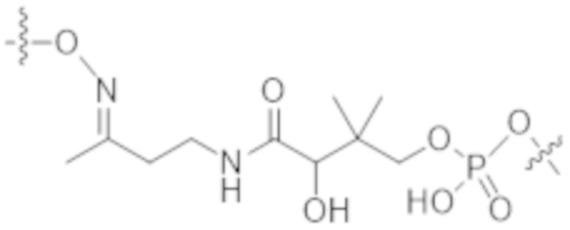 ,
, 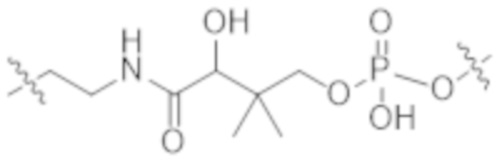 или
или  ,
, 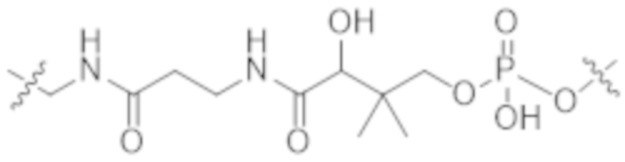 o;
o;
каждый R7 независимо выбран из H и C1–C6алкила;
каждый R10 независимо выбран из H, C1–C6алкила, F, Cl и –OH;
каждый R11 независимо выбран из H, C1–C6алкила, F, Cl, –NH2, –OCH3, –OCH2CH3, –N(CH3)2, –CN, –NO2 и –OH;
каждый R12 независимо выбран из H, C1–6алкила, фтора, бензилокси, замещенного –C(=O)OH, бензила, замещенного –C(=O)OH, C1–4алкокси, замещенного –C(=O)OH, и C1–4алкила, замещенного –C(=O)OH;
каждый R15 независимо выбран из H, –CH3 и фенила;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10 и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
9. Конъюгат по п. 8, выбранный из
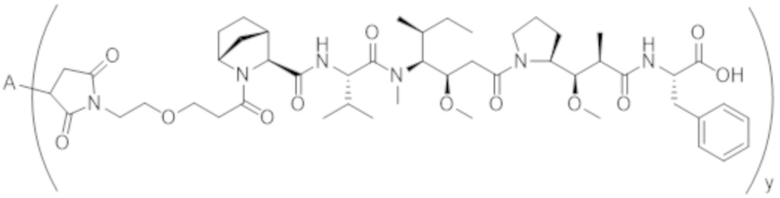 ;
;
 ;
;
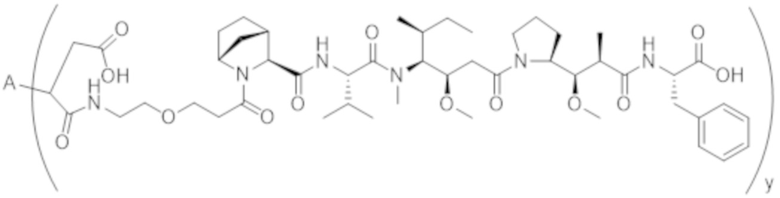 ;
;
 ;
;
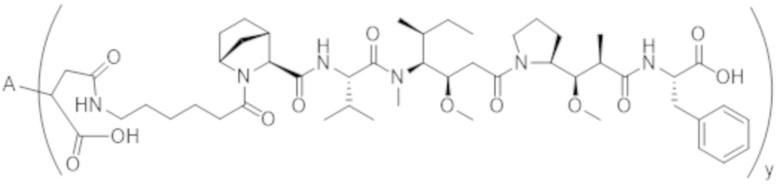 и
и
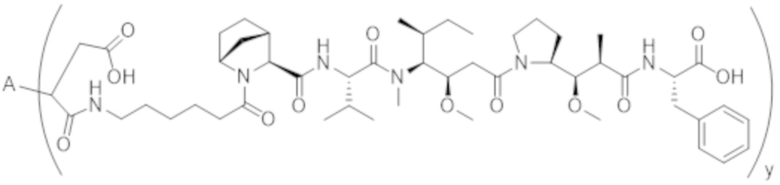 .
.
10. Конъюгат по любому из пп. 1-7, имеющий структуру формулы (D)
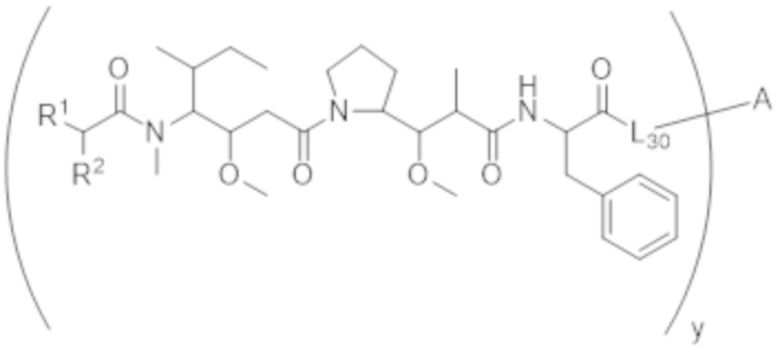 Формула (D),
Формула (D),
где R1 представляет собой 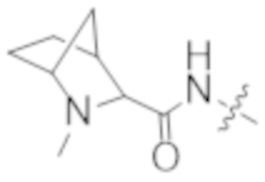 или
или 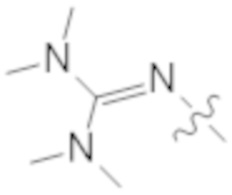 ;
;
R2 представляет собой C1–C6алкил;
L30 представляет собой –L5R40;
L4 представляет собой –((CH2)m;
L5 представляет собой –NHS(=O)2(CH2)mX1L4, –NH((CH2)mO)p(CH2)mX1L4–, –NH((CH2)mO)p(CH2)mX2L4–, –NH((CH2)mO)p(CH2)m–, –NH(CH2)m–, –NH(CH2)mX1(CH2)m–, –NH(CH2)mNHC(=O)(CH2)m–, –NH(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m–, –NH((CH2)mO)p(CH2)mNHC(=O)(CH2)m, –NH((CH2)mO)pCH2)mC(=O)NH(CH2)m–, –NH(CH2)nC(R7)2–, –NH(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m– или –NH(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m–;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , –NR7C(=O)CH2–, –NHC(=O)CH2–, –S(=O)2CH2CH2–, –(CH2)2S(=O)2CH2CH2–, –NR7S(=O)2CH2CH2, –NR7C(=O)CH2CH2–, –NH–, –C(=O)–, –NHC(=O)–, –CH2NHCH2CH2–, –NHCH2CH2–, –S–,
, –NR7C(=O)CH2–, –NHC(=O)CH2–, –S(=O)2CH2CH2–, –(CH2)2S(=O)2CH2CH2–, –NR7S(=O)2CH2CH2, –NR7C(=O)CH2CH2–, –NH–, –C(=O)–, –NHC(=O)–, –CH2NHCH2CH2–, –NHCH2CH2–, –S–,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ,
,  ;
;
каждый R7 независимо выбран из H и C1–C6алкила;
каждый R10 независимо выбран из H, C1–C6алкила, F, Cl и –OH;
каждый R11 независимо выбран из H, C1–C6алкила, F, Cl, –NH2, –OCH3, –OCH2CH3, –N(CH3)2, –CN, –NO2 и –OH;
каждый R12 независимо выбран из H, C1–6алкила, фтора, бензилокси, замещенного –C(=O)OH, бензила, замещенного –C(=O)OH, C1–4алкокси, замещенного –C(=O)OH, и C1–4алкила, замещенного –C(=O)OH;
каждый R15 независимо выбран из H, –CH3 и фенила;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10 и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
11. Конъюгат по п. 10, выбранный из
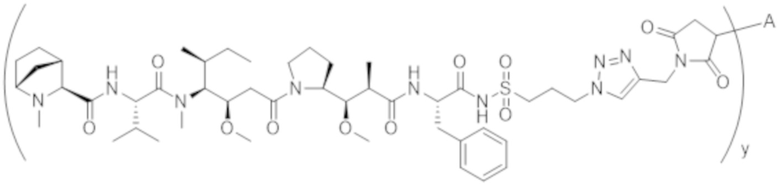 ;
;
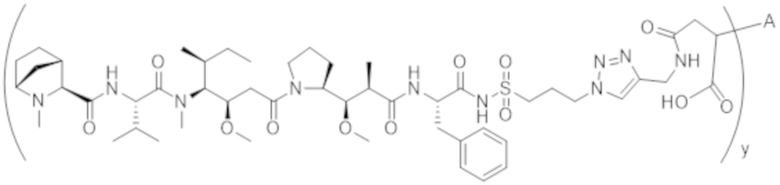 ;
;
 ;
;
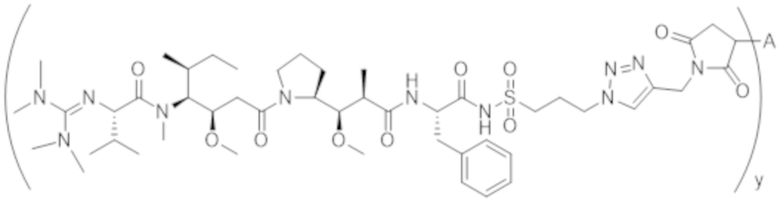 ;
;
 и
и
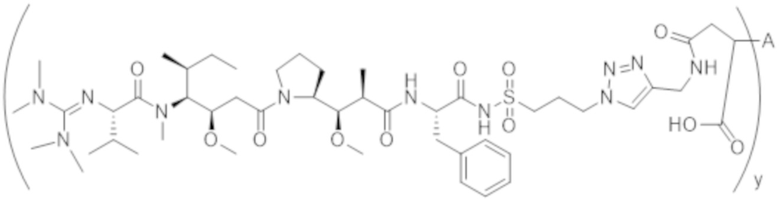 .
.
12. Конъюгат по любому из пп. 1-7, имеющий структуру формулы (E)
 Формула (E),
Формула (E),
где X представляет собой S(=O), S(=O)2 или S;
R5 представляет собой H, –CH3 или –CD3;
R6 представляет собой –NH2 или –OH;
L40 представляет собой –L6R40;
L6 представляет собой –((CH2)mO)p(CH2)mX1L4–, –((CH2)mO)p(CH2)mX2L4–, –L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4–, – L4NHC(=O)NH ((CH2)mO)p(CH2)mX2L4–, –((CH2)mO)p(CH2)m–, –(CH2)m–, –(CH2)mX1(CH2)m–, –(CH2)mNHC(=O)(CH2)m–, –(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m–, –((CH2)mO)p(CH2)mNHC(=O)(CH2)m, –((CH2)mO)pCH2)mC(=O)NH(CH2)m–, –(CH2)mC(R7)2– или –(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m–;
L4 представляет собой –((CH2)m;
X1 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
X2 представляет собой  ,
,  ,
,  ,
,  или
или  , где * указывает на точку присоединения к L4;
, где * указывает на точку присоединения к L4;
R40 представляет собой  ,
,  ,
,  ,
,  ,
,  , –NR7C(=O)CH2–, –NHC(=O)CH2–, –S(=O)2CH2CH2–, –(CH2)2S(=O)2CH2CH2–, –NR7S(=O)2CH2CH2, –NR7C(=O)CH2CH2–, –NH–, –C(=O)–, –NHC(=O)–, –CH2NHCH2CH2–, –NHCH2CH2–, –S–,
, –NR7C(=O)CH2–, –NHC(=O)CH2–, –S(=O)2CH2CH2–, –(CH2)2S(=O)2CH2CH2–, –NR7S(=O)2CH2CH2, –NR7C(=O)CH2CH2–, –NH–, –C(=O)–, –NHC(=O)–, –CH2NHCH2CH2–, –NHCH2CH2–, –S–,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  или
или  ,
,  ;
;
каждый R7 независимо выбран из H и C1–C6алкила;
каждый R10 независимо выбран из H, C1–C6алкила, F, Cl и –OH;
каждый R11 независимо выбран из H, C1–C6алкила, F, Cl, –NH2, –OCH3, –OCH2CH3, –N(CH3)2, –CN, –NO2 и –OH;
каждый R12 независимо выбран из H, C1–6алкила, фтора, бензилокси, замещенного –C(=O)OH, бензила, замещенного –C(=O)OH, C1–4алкокси, замещенного –C(=O)OH, и C1–4алкила, замещенного –C(=O)OH;
каждый R15 независимо выбран из H, –CH3 и фенила;
каждый m независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10 и
каждый p независимо выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и 14.
13. Конъюгат по п. 12, выбранный из:
 ;
; 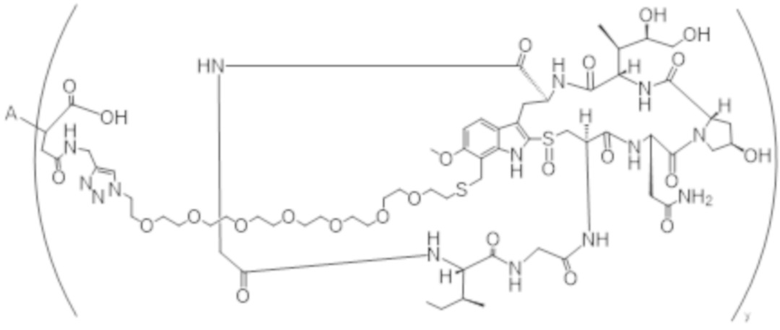 ;
;
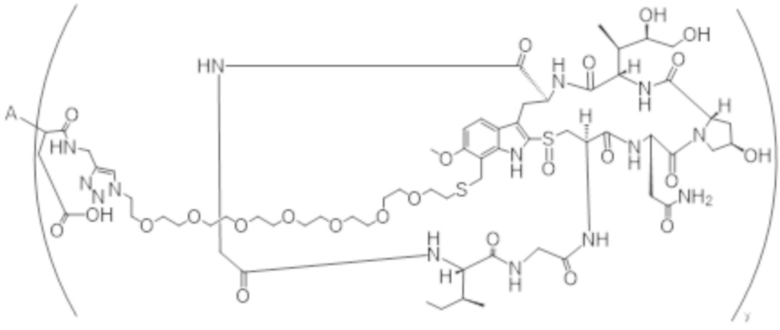 ;
; 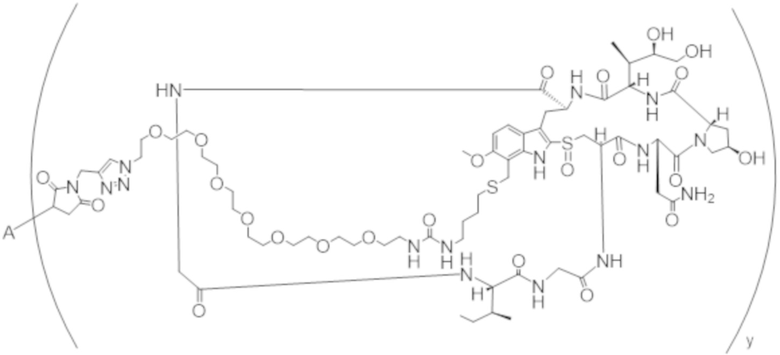 ;
; 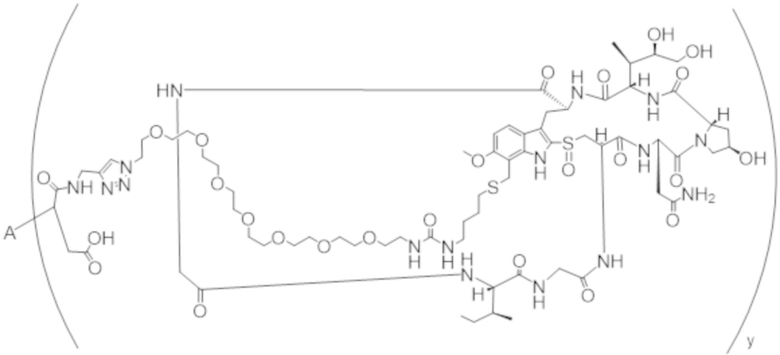 и
и  .
.
14. Конъюгат по любому из пп. 1-7, выбранный из:
 ;
;
 ;
;  ;
; 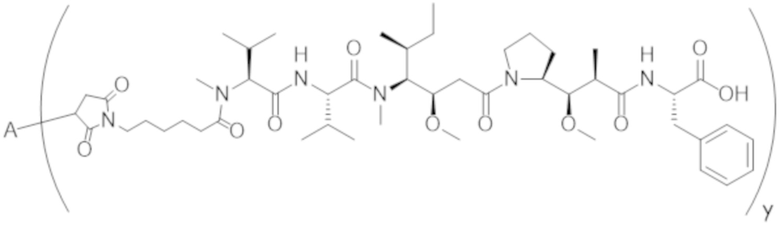 ;
; 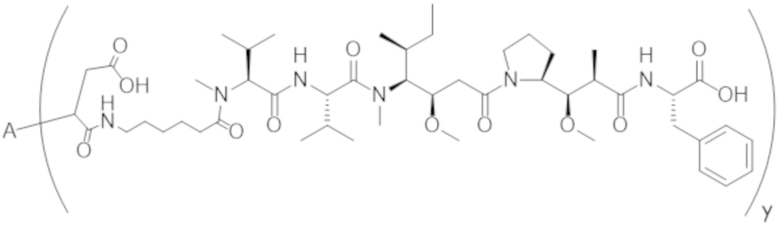 ;
; 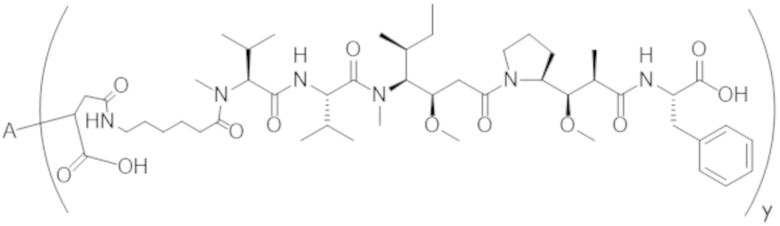 ;
; 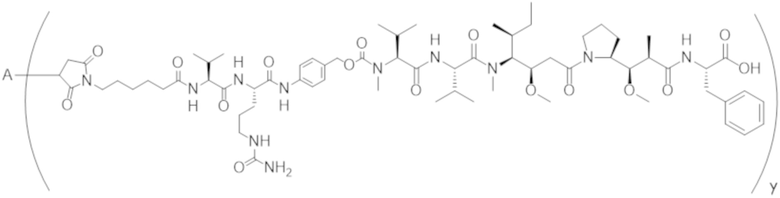 ;
; 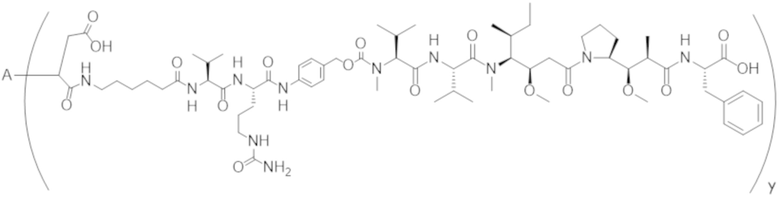 ;
;  ;
;
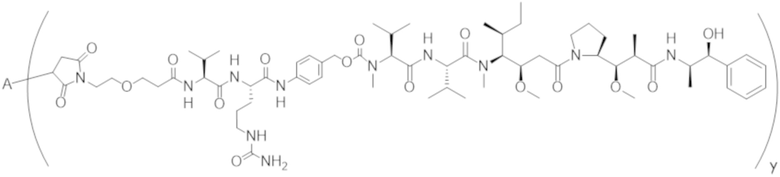 ;
;  ;
; 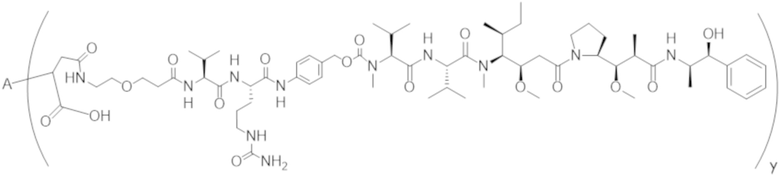 ;
; 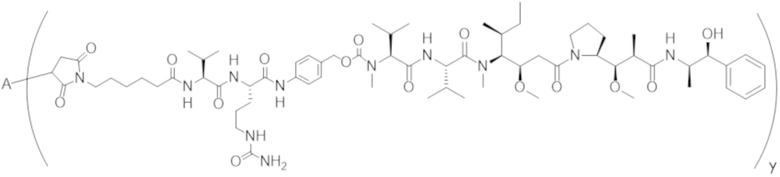 ;
; 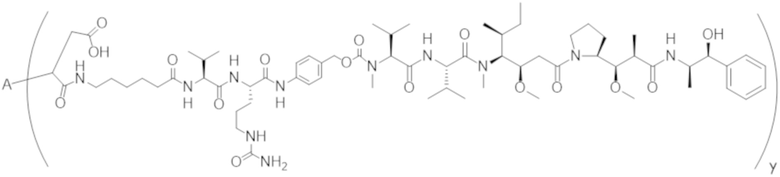 ; и
; и 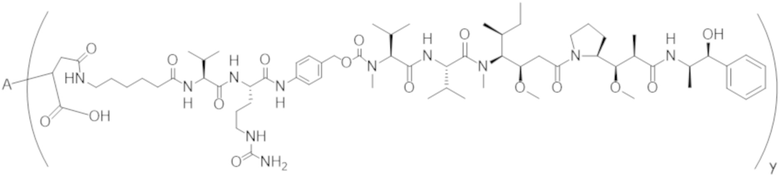 .
.
15. Конъюгат по любому из пп. 1-7, выбранный из:
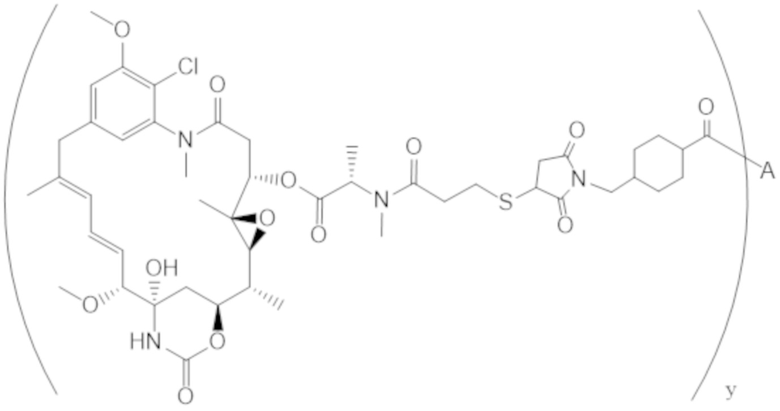 ;
;
 ;
;
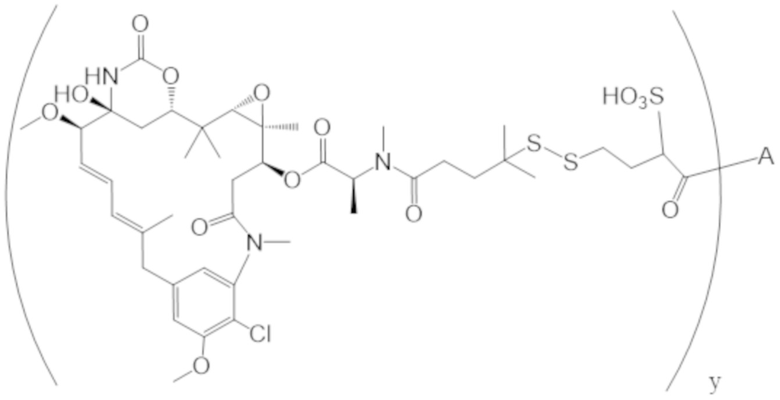 ;
;
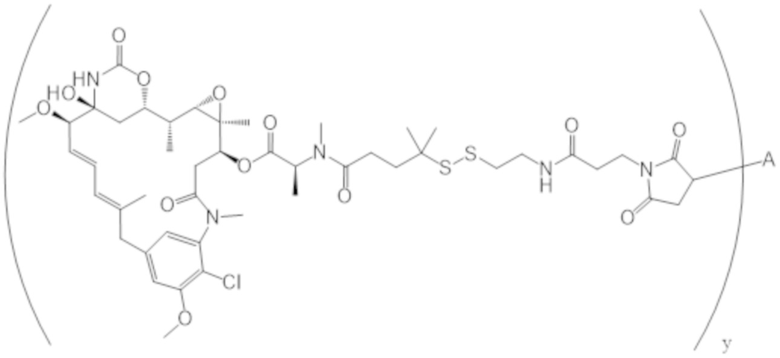 ;
;
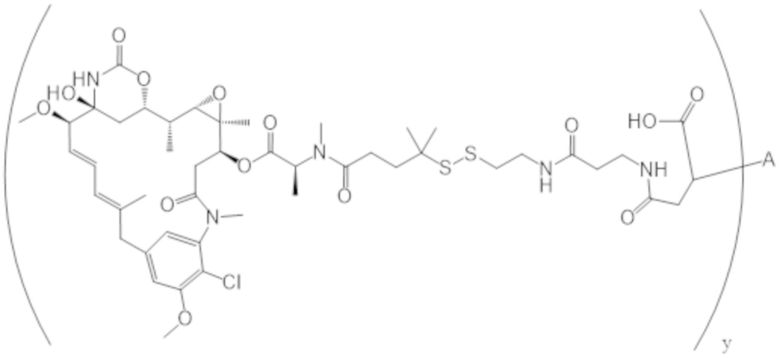 ; и
; и
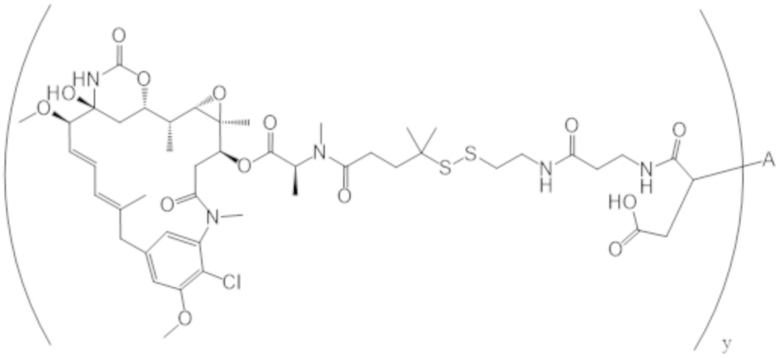 .
.
16. Конъюгат по любому из пп. 1–15, где фрагмент антитела специфически связывается с внеклеточным доменом cKIT человека, включающим SEQ ID NO: 112.
17. Конъюгат по любому из пп. 1–15, где фрагмент антитела специфически связывается с эпитопом в доменах 1–3 cKIT человека, включающим SEQ ID NO: 113.
18. Конъюгат по любому из пп. 1–17, где фрагмент антитела представляет собой человеческие или гуманизированные Fab или Fab'.
19. Конъюгат по любому из пп. 1–7, где фрагмент антитела представляет собой Fab', а линкер (LB) присоединен к нативному цистеиновому остатку в шарнирной области Fab'.
20. Конъюгат по любому из пп. 1–7, где фрагмент антитела содержит по меньшей мере один ненативный цистеин, введенный в константную область, а линкер (LB) присоединен к ненативному цистеину.
21. Конъюгат по любому из пп. 8, 9, 12 или 13, где фрагмент антитела представляет собой Fab', а L20 присоединен к нативному цистеиновому остатку в шарнирной области Fab'.
22. Конъюгат по любому из пп. 8, 9, 12 или 13, где фрагмент антитела содержит по меньшей мере один ненативный цистеин, введенный в константную область, а L20 присоединен к ненативному цистеину.
23. Конъюгат по любому из пп. 10, 11, где фрагмент антитела представляет собой Fab', а L30 присоединен к нативному цистеиновому остатку в шарнирной области Fab'.
24. Конъюгат по любому из пп. 10, 11, где фрагмент антитела содержит по меньшей мере один ненативный цистеин, введенный в константную область, а L30 присоединен к ненативному цистеину.
25. Конъюгат по любому из пп. 20, 22 или 24, где фрагмент антитела содержит цистеин в одном или нескольких из следующих положений (нумерация всех положений согласно EU):
(a) положение 152 тяжелой цепи,
(b) положение 114 или 165 легкой каппа–цепи или
(c) положение 143 легкой лямбда–цепи.
26. Конъюгат по любому из пп. 1–25, где период полувыведения конъюгата составляет менее приблизительно 24–48 часов.
27. Фармацевтическая композиция, содержащая эффективное количество конъюгата по любому из пп. 1–26 и фармацевтически приемлемый носитель, для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом.
28. Фармацевтическая композиция по п. 27, дополнительно содержащая другое терапевтическое средство.
29. Фармацевтическая композиция по п. 27, где композиция представляет собой лиофилизат.
30. Способ разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом, причем способ предусматривает введение пациенту эффективного количества конъюгата по любому из пп. 1–26 или фармацевтической композиции по п. 27 или 28.
31. Способ по п. 30, где пациент является реципиентом трансплантации гемопоэтических стволовых клеток.
32. Способ по п. 31, где способ осуществляют до трансплантации гемопоэтических стволовых клеток пациенту.
33. Способ по любому из пп. 30–32, где пациент имеет наследственное иммунодефицитное заболевание, аутоиммунное нарушение, нарушение гемопоэза или врожденное нарушение обмена веществ.
34. Способ по п. 33, где нарушение гемопоэза выбрано из острого миелоидного лейкоза (AML), острого лимфобластного лейкоза (ALL), острого моноцитарного лейкоза (AMoL), хронического миелоидного лейкоза (CML), хронического лимфоцитарного лейкоза (CLL), миелопролиферативных нарушений, миелодиспластических синдромов, множественной миеломы, неходжкинской лимфомы, болезни Ходжкина, апластической анемии, истинной эритроцитарной аплазии, пароксизмальной ночной гемоглобинурии, анемии Фанкони, большой талассемии, серповидноклеточной анемии, тяжелого комбинированного иммунодефицита, синдрома Вискотта–Олдрича, гемофагоцитарного лимфогистиоцитоза.
35. Способ по п. 33, где врожденное нарушение обмена веществ выбрано из мукополисахаридоза, болезни Гоше, метахроматических лейкодистрофий или адренолейкодистрофий.
36. Способ по любому из пп. 30–32, где пациент имеет незлокачественное заболевание или состояние, выбранное из тяжелой апластической анемии (SAA), синдрома Вискотта–Олдрича, синдрома Гурлера, FHL, CGD, синдрома Костмана, тяжелого иммунодефицитного синдрома (SCID), других аутоиммунных нарушений, таких как SLE, рассеянный склероз, IBD, болезнь Крона, синдром Шегрена, васкулит, волчанка, миастения гравис, болезнь Вегенера, врожденных нарушений обмена веществ и/или других иммунодефицитов.
37. Способ по любому из пп. 30–32, где пациент имеет злокачественное заболевание или состояние, выбранное из миелодиспластических синдромов (MDS), острого лимфобластного лейкоза (ALL), острого миелогенного лейкоза (AML), острого моноцитарного лейкоза (AMoL), хронического лимфоцитарного лейкоза (CLL), хронического миелогенного лейкоза (CML), волосатоклеточного лейкоза (HCL), T–клеточного пролимфоцитарного лейкоза (T–PLL), лейкоза из больших зернистых лимфоцитов, Т–клеточного лейкоза взрослых, лейкоза/лимфомы из предшественников T–клеток, лимфомы Беркитта, фолликулярной лимфомы, диффузной В–крупноклеточной лимфомы, лимфомы из клеток мантийной зоны, B–клеточного хронического лимфоцитарного лейкоза/лимфомы, лимфомы MALT, фунгоидного микоза, неуточненной периферической T–клеточной лимфомы, формы ходжкинской лимфомы с нодулярным склерозом, смешанноклеточного подтипа ходжкинской лимфомы.
38. Применение конъюгата по любому из пп. 1–26 или фармацевтической композиции по любому из пп. 27-29 для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом.
39. Применение конъюгата по любому из пп. 1–26 или фармацевтической композиции по любому из пп. 27-29 в изготовлении лекарственного препарата для разрушения гемопоэтических стволовых клеток у пациента, нуждающегося в этом.
| WO 2015138615 A2, 17.09.2015 | |||
| WO 2014150937 A1, 25.09.2014 | |||
| WO 2016020791 A1, 11.02.2016 | |||
| WO 2008067115 A2, 05.06.2008 | |||
| WO 2016164502 A1, 13.10.2016 | |||
| WO 2004002425 A2, 08.01.2004 | |||
| EA 9026 B1, 26.10.2007. |
Авторы
Даты
2022-10-12—Публикация
2017-12-19—Подача