Средство относится к области медицины и может быть использовано в качестве лекарственного средства у пациентов, страдающих инфекционно-воспалительными заболеваниями стафилококковой этиологии, оказывающего наряду с противомикробным (антистафилококковым) и иммунотропное действие.
Стафилококки входят в постоянный состав кожной микробиоты и могут вызывать различные инфекции кожи и внутренних органов с возможным развитием сепсиса. Проблема нарастающей устойчивости стафилококков и, в частности, S. aureus, к наиболее активно используемым антибиотикам вызывает опасения за эффективность химиотерапии. Кроме того, следует отметить, что применение антибиотиков, как правило, приводит к снижению иммунной защиты организма, что, наряду с прогрессирующей антибиотикорезистентностью, подчеркивает актуальность разработки новых антибактериальных средств, проявляющих также и иммунотропные свойства.
Существующие в настоящее время антимикробные препараты, оказывающие бактериостатическое или бактерицидное влияние на стафилококки, представляют собой сильнодействующие лекарственные вещества, применение которых сопровождается нежелательными побочными эффектами. Клиническая эффективность современных антистафилококковых антибиотиков не всегда коррелирует с данными чувствительности invitro; часто сопровождается формированием вторичных очагов инфекции (мягкие ткани, кость, клапаны сердца, легкие); нередко наблюдается неадекватное дозирование и длительность терапии, что сопровождается осложнениями и рецидивами инфекции. Важным негативным эффектом синтетических противомикробных препаратов является также гепато- и нефротоксичность, а также иммуносупрессивное влияние и быстрое развитие у стафилококка антибиотикорезистентности к данному классу препаратов (https://www.rigla.ru/about/news/2020/antibiotiki-penitsillmovogo-ryada; https://www.rlsnet.ru/ fg_index_id_261.htm; https://www.vidal.ru/vracham/antibiotikikoterapiya/obzor-antibiotik/antibiotiki-penitsilliny; http://antibiotics.ru/ab/013-22.shtml).
Известно соединение по RU 2148580 C1 от 10.05.2002, которое может найти применение в качестве лекарственного антимикробного препарата. Субстанция по RU 2198166 С2 от 10.02.2003 обладает противовирусным, иммуностимулирующим, антихламидийным, противотуберкулезным, анальгезирующим и гепатопротекторным действием. Известно изобретение RU 2130023 С1 от 10.05.1999, где описано средство, обладающее антифлавирусной активностью, что позволяет предположить возможность его использования в медицине в качестве лекарственного средства для лечения клещевого энцефалита.
Наиболее близким аналогом к заявленному средству и способу его применения является соединение по RU 2451683 от 27.05.2012, которое обладает антивирусной, антибактериальной и фунгицидной активностью. Основным недостатком указанного соединения является отсутствие доказанной безопасности и комплексного противомикробного и иммунотропного действия.
Технической задачей заявляемого изобретения является расширение химических групп соединений, рассматриваемых в качестве основы для создания высокоэффективных, нетоксичных противомикробных средств с иммунотропной активностью.
Поставленная задача решается предлагаемым производным пиримидина с формулой
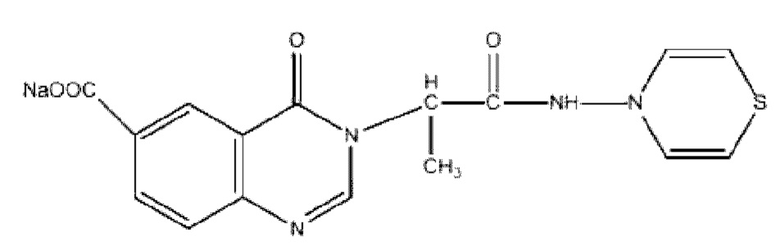
натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилат, синтезирование которого осуществлялось в три стадии, направленных на получение хиназолиноновой системы, тиазинового фрагмента, конденсированного с ацетамидной составляющей, и введение его в С3 положение хиназолинона. Остаток хиназолинона в солевой форме по схеме, предложенной Альпером получен при использовании в качестве исходных веществ имидоилхлорида, монооксида углерода и орто-иоданилина, замещенного карбоксильной группой, в щелочной среде. Увеличение скорости процесса достигалось использованием смеси ацетата палладия и трифенилфосфина в качестве катализатора и осуществлением процесса при пониженной температуре и давлении. Взаимодействием β-аминоэтантиола и 1,2 дихлорэтана был получен 1,4 тиазиновый фрагмент, который впоследствии подвергли конденсации с N-производным в результате реакции хлорного ангидрида 2-хлорпропионовой кислоты с гидрокси ламином.
Пиримидиновые основания являются составной частью нуклеиновых кислот, в связи с чем их производные сочетают в себе несколько видов фармакологической активности. В ряде экспериментов установлено, что соединения этой группы обладают анаболической активностью, оказывают противовоспалительное действие, ускоряют процессы репаративной регенерации, стимулируют клеточные и гуморальные факторы иммунитета, активизируют лейко- и эритропоэз, а также эффективны в качестве противовирусных, противоопухолевых и других средств. Производные пиримидина нашли свое применение в лечении инфекционных, хирургических, неврологических, онкологических и многих других заболеваний и представляют собой группу самых разнообразных химических веществ с широким спектром фармакологической активности.
Новым в предлагаемом изобретении является то, что в качестве активного компонента, обладающего противомикробным (антистафилококковым) и иммунотропным действием, используется производное пиримидина натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилат.
Предлагаемое решение соответствует критерию изобретения "Новизна", что обусловлено уникальностью структуры в связи с наличием в ней пиримидиновой составляющей и гетероциклического остатка тиазина, каждый из которых обуславливает проявление широкого спектра фармакологической активностилекарственными веществами, в том числе противомикробной и иммунотропной. Установлено, что в основе механизма противомикробного действия производных пиримидина лежит их способность подавлять синтез ДНК за счет ингибирования работы бактериальной ДНК-гиразы и топоизомеразы IV типа, что приводит к гибели клетки патогена. Участие тиазинов в образовании активного центра антибиотиков, таких как цефалоспорины, позволяет их рассматривать как фармакологически значимый фрагмент молекулы лекарственного вещества. Одновременное присутствие атомов азота в молекуле тиазина делает возможным их участие в биохимических процессах в качестве мультидентатных лигандов и позволяет использовать в координационной химии для получения новых каркасов с потенциальной биоактивностью. Наличие в структуре атомов кислорода и азота, проявляющих электронодонорную функцию при связывании с молекулами-мишенями с образованием переходных комплексных соединений посредством водородных связей, является важным при активации факторов неспецифического иммунитета. Солевая форма вещества обуславливает его полярность и повышает степень всасывания и биораспределения, а также обеспечивает вариативность при разработке лекарственных форм, в том числе и с использованием нанотехнологий.
Установлено соответствие изобретения условиям изобретательского уровня, поскольку заявленное средство отличается от аналога внесением в качестве основного действующего компонента - пиримидинового производного, обладающего безопасностью, противомикробным (антистафилококковым) и иммунотропным действием.
В эксперименте на лабораторных животных доказана эффективность применения заявляемого средства, обладающего безопасностью, противомикробным (антистафилококковым) и иммунотропным действием.
Сущность заявляемого изобретения и достижение технического результата поясняется на следующих примерах.
Пример 1
Получено средство, обладающее безопасностью, оказывающее противомикробную (антистафилококковую) и иммунотропную активность на основе производного пиримидина.
Оценка острой токсичности исследуемого пиримидинового соединения проводилась на 50 нелинейных крысах-самцах 5-6-месячного возраста с массой от 220 до 250 г.
Все животные были разделены на группы:
- первая группа (контроль) - животные, получавшие интрагастрально эквиобъем дистиллированной воды;
- опытные группы, включающие животных, получавших пиримидиновое соединение в дозах 500; 1000; 2000; 4000 мг/кг в виде суспензии интрагастрально.
Возможные проявления острой токсичности оценивали ежедневно в течение 14 суток после введения соединения на основе оценки общего состояния, двигательной активности, массы тела, состояния волосяного, кожного покрова и слизистых оболочек.
При патоморфологическом исследовании внутренних органов проводили макроскопический анализ и их взвешивание.
При оценке острой токсичности пиримидинового производного натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатбыло установлено, что изучаемая субстанция в дозах 500 и 1000 мг/кг не вызвала изменений общего состояния, волосяного и кожного покрова и слизистых оболочек. Новое соединение в дозах 2000 и 4000 мг/кг способствовало снижению двигательной активности животных в течение первых суток, однако на следующие сутки эти проявления нивелировались.
Следует отметить, что при изучении острой токсичности не было отмечено гибели лабораторных животных, в связи с чем уровень полулетальной дозы невозможно определить. Принимая во внимание полученные результаты, в качестве LD50 была принята максимальная доза 4000 мг/кг. Таким образом, новое пиримидиновое производное натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4 дигидрохиназолин-6-карбоксилат является малотоксичным веществом (безопасным) и относится к 4 классу токсичности.
Пример 2
Изучение противомикробной активности пиримидинового производного натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатпроводили invitro на тест-культуре штамма Staphylococcusaureus, который был выделен из мокроты пациентов, находящихся на лечении в ГБУЗ АО «Городская клиническая больница №3 им. С.М. Кирова», г. Астрахань. Оценку противомикробной активности производного пиримидина проводили методом серийных разведений в мясопептонном бульоне (МПБ) с формированием рядов с различной концентрацией соединения: 128 мкг/мл; 64 мкг/мл; 32 мкг/мл; 16 мкг/мл; 8 мкг/мл; 4 мкг/мл; 2 мкг/мл; 1 мкг/мл; 0,5 мкг/мл; 0,25 мкг/мл. В пробирки засевали культуры микроорганизмов, после чего инкубировали в течение суток при 37°С, центрифугировали и осадок пересевали на питательный агар для культивирования микроорганизмов (ГМФ-агар). Затем проводили визуальную оценку наличия или отсутствия видимого характерного роста (ХР) с последующим установлением минимальной подавляющей концентрации вещества. В качестве контрольных использовали пробирки, содержащие МПБ с внесенными микроорганизмами (положительный контроль).
Изучение противомикробной активности пиримидинового соединения натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилат in vivo приводили, моделируя генерализованную инфекцию внутрибрюшинным введением Staphylococcus aureus в дозе ×108 микробных тел мышам 5-недельного возраста. Животные были разделены на несколько групп: контроль I -получали эквиобъем воды для инъекций; контроль II - животные, инфицированные Staphylococcusaureus и не получавшие лечение; опытные животные, получавшие исследуемое соединение в дозе 39 мг/кг, начиная с дня заражения в течение 7 суток. В процессе лечения животных оценивали их выживаемость. После выведения выживших мышей из эксперимента проводили подсчет индекса обсемененности крови и внутренних органов (селезенка и печень).
При изучении противомикробной активности in vitro производного пиримидина установлено, что в концентрации 128 мкг/мл субстанция оказывает высокую активность в отношении Staphylococcus aureus, в то время как в концентрациях 64 мкг/мл, 32 мкг/мл и 16 мкг/мл отмечается снижение интенсивности характерного роста микроорганизма от 25% до 50% в сравнении с положительным контролем. В разведениях от 8 мкг/мл до 0,25 мкг/мл отмечался рост Staphylococcus aureus более 50% от площади засеваемости питательной среды, что говорит об отсутствии противостафилококковой активности.
При определении подавляющих рост концентрации пиримидинового соединения натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатбыло установлено, что бактерицидную активность в отношении Staphylococcus aureus изучаемая субстанция оказывала в концентрации 128 мкг/мл.
Производное пиримидина натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилат, вводимое в дозе 39 мг/кг существенно снижала летальность лабораторных животных, в результате чего наблюдалась их 100% выживаемость.
При изучении обсемененности внутренних органов и крови установлено, что у животных в группе контроля I не наблюдалось роста Staphylococcus aureus. При введении пиримидинового соединения натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатв дозе39 мг/кг не наблюдался рост микроорганизмов ни во внутренних органах, ни в крови.
Соединение пиримидина натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатспособствует формированию противомикробного иммунитета и оказывает выраженное терапевтическое действие противомикробной направленности в условиях экспериментальной стафилококковой генерализованной инфекции.
Пример 3
Эксперименты по изучению иммунотропной активности проводили на мышах линии СБА обоего пола 3-4-месячного возраста.
Экспериментальное исследование проведено в две серии. В 1 серии с целью изучения дозозависимых иммунотропных свойств животные были разделены на следующие группы (n=9-10): контроль I получал эквиобъем дистиллированной воды; контроль II (животные с экспериментальной иммунодепрессией) получал циклофосфан (Циклофосфамид (ЦФА), ООО «Медиафарм», Россия) в дозе 100 мг/кг, внутрибрюшинно, однократно; опытные животные с экспериментальной иммунодепрессией получали внутрибрюшинно пиримидиновое соединение натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатв дозах 19 мг/кг (опыт №1), 38 мг/кг (опыт №2), 76 мг/кг (опыт №3) и 152 мг/кг (опыт №4) в течение 3 дней. Диапазон доз формировали на основании сведений о молекулярной массе субстанции.
2 серия была посвящена изучению выраженности иммунотропных свойств соединения в зависимости от сроков введения относительно индукции экспериментальной иммунодепрессии. Были сформированы следующие группы животных: контроль I получал эквиобъем дистиллированной воды; контроль II получал циклофосфан в дозе 100 мг/кг, внутрибрюшинно, однократно. В первой опытной группе (опыт №1) ежедневное профилактическое введение вещества натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатначинали за 3 дня до ЦФА, курс составил 3 инъекции. У животных второй опытной группы (опыт №2) ежедневное терапевтическое введение вещества натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатначинали на следующий день после инъекции циклофосфана, курс также составил 3 инъекции. Иммунотропный эффект производного пиримидина оценивали на основании органометрического анализа показателей массы и клеточности иммунокомпетентных органов (тимуса и селезенки), а также реакций гиперчувствительности замедленного типа (РГЗТ) и прямой гемагглютинации (РПГА).
Для проведения органометрического анализа готовили клеточные суспензии в среде 199 из расчета для селезенки 50 мг/мл, для тимуса - 10 мг/мл, фильтровали, отмывали двукратно средой 199 от частиц жировой ткани (по 10 мин при 1500 об/мин), после чего ресуспендировали в среде 199 до исходной концентрации. Суспензии лимфоидных органов для подсчета предварительно 1:1 смешивали с 3% уксусной кислотой, подкрашенной метиленовой синью, и подсчитывали количество ядросодержащих клеток (спленоцитов и тимоцитов) в камере Горяева. При постановке РГЗТ животных иммунизировали подкожно эритроцитами барана (ЭБ) в дозе 1 × 107 в 100 мкл физиологического раствора. Разрешающую дозу ЭБ 1 × 107 вводили в объеме 20 мкл на 5 день после сенсибилизации под апоневротическую пластинку одной из задних конечностей («опытная» лапа), в контрлатеральную («контрольную» лапу) - физиологический раствор. Учет интенсивности местной реакции проводили через 24 ч, подсчитывая индекс РГЗТ по формуле (Мо - Мк) / Мк × 100%, где Мо - масса «опытной» лапы, Мк - масса «контрольной» лапы.
Для проведения РПГА мышей иммунизировали ЭБ в дозе 5 × 106 в 100 мкл физиологического раствора. Через 7 дней после иммунизации получали сыворотку. Для инактивации комплемента сыворотку прогревали при t=56°С в течение 30 мин. Реакцию гемагглютинации проводили в 96-луночных планшетах. Для подавления неспецифического связывания антител реакцию ставили в 50 мкл разводящей жидкости (0,5% раствора бычьего сывороточного альбумина, приготовленного на физрастворе), в которой последовательно двукратно разводили исследуемые сыворотки. После разведения сывороток в лунки вносили по 25 мкл 1% взвеси ЭБ. Предварительный учет результатов РПГА производили через 1 час инкубации при t=37°С, затем планшеты переставляли в холодильник при t=+4°С и через 18 часов реакцию учитывали окончательно. Титр антител (наибольшее разведение сыворотки, при котором наблюдается агглютинация ЭБ) выражали в среднегеометрических показателях.
Проведенное экспериментальное изучение иммунотропных свойств нового пиримидинового соединения натрий-3-(1-((4Н-1,4-тиазин-4-ил)амино)-1-оксопропан-2-ил)-4-оксо-3,4-дигидрохиназолин-6-карбоксилатуказывает на наличие иммуномодулирующих свойств, проявляющихся в дозе 39 мг/кг, при введении в разные сроки относительно индукции экспериментальной иммунодепрессии.
Таким образом, достижением настоящего изобретения является получение средства на основе производного пиримидина, характеризующегося безопасностью, противомикробной (антистафилококковой) и иммунотропной активностью.
Изобретение относится к областям органической химии и медицины, а именно к новому производному пиримидина указанной формулы, обладающему противомикробной и иммунотропной активностью и характеризующемуся безопасностью. 3 пр.

Производное пиримидина с формулой:
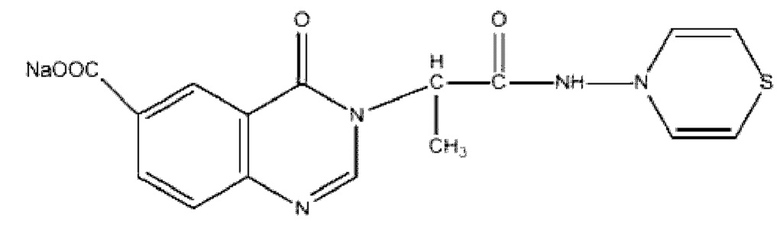 ,
,
характеризующееся безопасностью, противомикробной и иммунотропной активностью.
| 2-(2,5-ДИМЕТИЛ)ПИРАЗОЛИЛ-3-ГИДРОКСИ-4(3H)-ХИНАЗОЛИНОН, ОБЛАДАЮЩИЙ АНТИВИРУСНОЙ, АНТИБАКТЕРИАЛЬНОЙ И ФУНГИЦИДНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2451683C1 |
| 1-АРИЛ-7-МЕТИЛ-2-[β-(5'-НИТРО-2'-ФУРИЛ)ВИНИЛ]-ПИРИДО[2,3-D]ПИРИМИДИН-4-ОНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 1999 |
|
RU2148580C1 |
| ЦИКЛОГЕКСИЛАМИД ХИНОЛИНО (2,1-B) ХИНАЗОЛИН-12-ОН-5-КАРБОНОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ АНТИФЛАВИРУСНУЮ АКТИВНОСТЬ | 1997 |
|
RU2130023C1 |
| 2,4-ДИОКСО-5-АРИЛИДЕНИМИНО-1,3-ПИРИМИДИНЫ | 1998 |
|
RU2198166C2 |
| CN 103732593 A,16.04.2014 | |||
| CN 104844628 A, 19.08.2015. | |||
Авторы
Даты
2023-03-31—Публикация
2022-01-31—Подача