[Область техники]
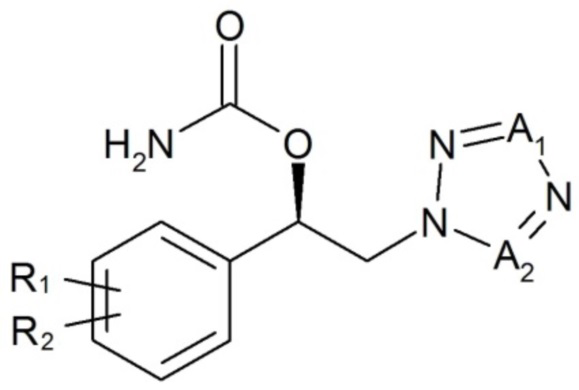
Настоящее изобретение относится к применению карбаматного соединения следующей формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения расстройства развития, включая синдром хрупкой X-хромосомы, синдром Ангельмана или синдром Ретта:
[Формула 1]
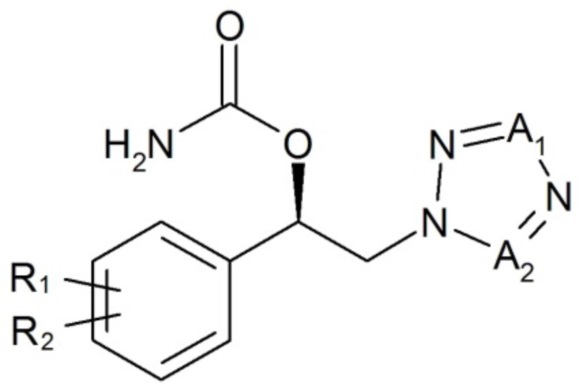 ,
,
где
R1, R2, A1 и A2 имеют значения, определенные в настоящем документе.
[Предпосылки изобретения]
Лечение нарушений развития, таких синдром хрупкой X-хромосомы (FXS), синдром Ретта и синдром Ангельмана, является ограниченным.
Синдром хрупкой X-хромосомы (FXS) представляет собой генетическое нарушение, которое является самой распространенной причиной возникновения аутизма, особенно генетической причиной умственной отсталости у мальчиков. Синдром хрупкой X-хромосомы вызван мутациями в гене fragment X mental retardation 1 (Fmr1), расположенного на хромосоме X. Ген Fmr1 является первым идентифицированным геном, связанным с аутизмом, и он кодирует белок fragment X mental retardation protein (FMRP), РНК-связывающий белок, который регулирует трансляцию. То есть белок FMRP вырабатывается геном Fmr1, необходим для нормального развития мозга, и этот белок недостаточно вырабатывается при синдроме хрупкой X-хромосомы (источник: Центр по контролю и профилактике заболеваний). Эта потеря функции обычно происходит, когда происходит расширение тринуклеотидных повторов CGG в 5'-нетранслируемой области гена Fmr1. Это расширение выглядит как слабый или «хрупкий» конец Х-хромосомы.
Синдром хрупкой X-хромосомы встречается как у мужчин, так и у женщин, но симптомы у женщин относительно легкие по сравнению с ними у мужчин, и заболеваемость у мужчин выше, чем у женщин. Согласно другому сообщению, это расстройство встречается у 1 из 4600 мужчин и 1 из 8000 женщин (Источник: Genetics Home Reference, Национальная медицинская библиотека).
Симптомы синдрома хрупкой X-хромосомы включают задержки в развитии, неспособность к обучению и расстройства социального поведения (избегание взгляда, возбуждение, проблемы с вниманием, взмахи руками, сбивчивая речь или хаотичные движения, чрезмерная активность). У мужчин имеется интеллектуальная инвалидность от умеренной до тяжелой, и у некоторых женщин уровень интеллекта нормальный, а у некоторых имеется интеллектуальная инвалидность. Заболевание аутического спектра часто встречается у людей с синдромом хрупкой X-хромосомы (источник: Центр по контролю и профилактике заболеваний). Кроме того, при синдроме хрупкой X-хромосомы существует риск судорожных припадков, и известно, что около 14% мужчин и около 4% женщин испытывают судорожные припадки (Berry-Kravis et al., 2010, «Seizures in Fragile X Syndrome: Characteristics and Comorbid Diagnoses», Am J Intellect Dev Disabil. 115 (6): 461-72).
Для диагностики синдрома хрупкой X-хромосомы диагностируется аномалия гена Fmr1 путем анализа ДНК крови.
Фундаментального подхода к лечению FXS до сих пор не существует. Может помочь адекватная санитарно-просветительная работа, и иногда для облегчения поведенческих расстройств и судорожных припадков используется лекарственная терапия.
Синдром Ангельмана представляет собой заболевание, которое возникает, когда определенный ген хромосомы 15 не наследуется генетически. Симптомы синдрома Ангельмана включают задержки в развитии, интеллектуальную инвалидность, расстройства социального поведения (легко возбуждаемая личность, чрезмерная активность, проблемы с вниманием) и судорожные припадки.
Кроме того, у людей с синдромом Ангельмана часто встречаются расстройства аутистической категории. Фундаментального лечения синдрома Ангельмана нет до сих пор. Может помочь соответствующая санитарно-просветительская работа, и иногда для облегчения симптомов синдрома Ангельмана, описанных выше, используется лекарственная терапия.
Синдром Ретта представляет собой заболевание, вызванное генетической мутацией гена MECP2. Симптомы синдрома Ретта включают задержки в развитии, интеллектуальную инвалидность, расстройства социального поведения (легко возбуждаемая личность, чрезмерная активность, проблемы с вниманием) и судорожные припадки.
Кроме того, у людей с синдромом Ретта проявляются симптомы, сходные с расстройствами аутистической категории. Фундаментального лечения синдрома Ретта нет до сих пор. Может помочь соответствующая санитарно-просветительская работа, и иногда для облегчения симптомов синдрома Ретта, описанных выше, используется лекарственная терапия.
Таким образом, синдром хрупкой X-хромосомы, синдром Ангельмана и синдром Ретта имеют общие симптомы, включающие задержки в развитии, интеллектуальную инвалидность, расстройства социального поведения, судорожные припадки и расстройства аутистической категории (или подобные симптомы). Кроме того, нет фундаментального лечения синдрома хрупкой X-хромосомы, синдрома Ангельмана и синдрома Ретта, и, следовательно, они имеют общий признак в том, что с целью облегчения их симптомов вводятся лекарства.
[Описание изобретения]
[Задача, решаемая изобретением]
Настоящее изобретение относится к способу облегчения или лечения расстройства развития.
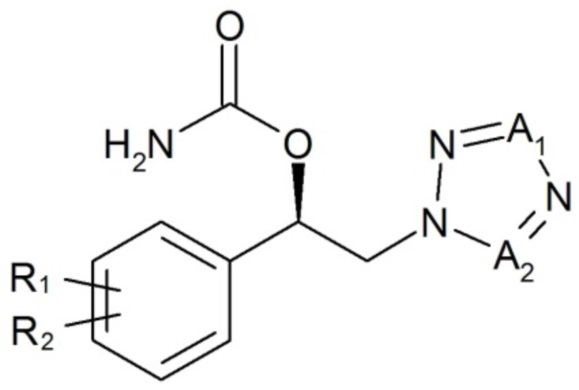
Настоящее изобретение также относится к применению терапевтически эффективного количества карбаматного соединения следующей формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения расстройства развития:
[Формула 1]
 ,
,
где
R1, R2, A1 и A2 имеют значения, определенные в настоящем документе.
Настоящее изобретение относится к способу облегчения или лечения синдрома хрупкой X-хромосомы.
Настоящее изобретение также относится к применению карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения синдрома хрупкой X-хромосомы.
Настоящее изобретение относится также к способу облегчения или лечения синдрома Ангельмана.
Настоящее изобретение также относится к применению карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения синдрома Ангельмана.
Настоящее изобретение относится также к способу облегчения или лечения синдрома Ретта.
Настоящее изобретение также относится к применению карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения синдрома Ретта.
[Техническое решение задачи]
В настоящем изобретении предложен лекарственный препарат для облегчения или лечения расстройства развития, содержащий терапевтически эффективное количество карбаматного соединения следующей формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата:
[Формула 1]
 ,
,
где
R1 и R2, каждый, независимо, выбраны из группы, состоящей из водорода, галогена, C1-C8 алкила, галоген-C1-C8 алкила, C1-C8 тиоалкокси и C1-C8 алкокси; и
один из A1 и A2 представляет собой CH, и другой представляет собой N.
Кроме того, в настоящем изобретении предложен способ облегчения или лечения расстройства развития у субъекта, включающий введение субъекту терапевтически эффективного количества карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
Кроме того, в настоящем изобретении предложено применение карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения расстройства развития.
Кроме того, в настоящем изобретении предложен лекарственный препарат для облегчения или лечения синдрома хрупкой X-хромосомы, содержащий терапевтически эффективное количество карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата
Кроме того, в настоящем изобретении предложен способ облегчения или лечения синдрома хрупкой X-хромосомы у субъекта, включающий введение субъекту терапевтически эффективного количества карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
Кроме того, в настоящем изобретении предложено применение карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения синдрома хрупкой X-хромосомы.
Кроме того, в настоящем изобретении предложен лекарственный препарат для облегчения или лечения синдрома Ангельмана, содержащий терапевтически эффективное количество карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата
Кроме того, в настоящем изобретении предложен способ облегчения или лечения синдрома Ангельмана у субъекта, включающий введение субъекту терапевтически эффективного количества карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
Кроме того, в настоящем изобретении предложено применение карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения синдрома Ангельмана.
Кроме того, в настоящем изобретении предложен лекарственный препарат для облегчения или лечения синдрома Ретта, содержащий терапевтически эффективное количество карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
Кроме того, в настоящем изобретении предложен способ облегчения или лечения синдрома Ретта у субъекта, включающий введение субъекту терапевтически эффективного количества карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
Кроме того, в настоящем изобретении предложено применение карбаматного соединения вышеуказанной формулы 1 или его фармацевтически приемлемой соли, сольвата или гидрата для облегчения или лечения синдрома Ретта.
В соответствии с одним вариантом осуществления настоящего изобретения в приведенной выше формуле 1 R1 и R2, каждый, независимо, выбраны из группы, состоящей из водорода, галогена и C1-C8 алкила.
В одном варианте осуществления настоящего изобретения галоген-C1-C8 алкил представляет собой перфторалкил.
В соответствии с другим вариантом осуществления настоящего изобретения карбаматное соединение вышеуказанной формулы 1 представляет собой (R)-1-(2-хлорфенил)-2-тетразол-2-ил-этиловый эфир карбаминовой кислоты следующей формулы 2:
[Формула 2]
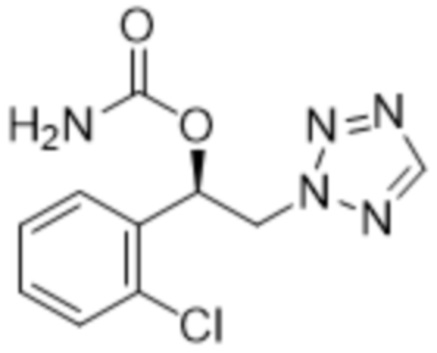 .
.
Специалист в области синтеза соединений может легко получить карбаматные соединения вышеуказанных формул 1 и 2, используя известные соединения или соединения, которые могут быть легко из них получены. В частности, способы получения соединений вышеуказанной формулы 1 подробно описаны в международных публикациях №№ WO 2006/112685 A1, WO 2010/150946 A1 и WO 2011/046380 A2, описания которых включены в настоящий документ посредством ссылки. Соединения вышеуказанной формулы 1 могут быть химически синтезированы любым способом, описанным в вышеприведенных документах, но способы являются только примерами, и порядок стадий действия и тому подобное может быть выборочно изменен при необходимости. Следовательно, вышеупомянутые способы не предназначены для ограничения объема изобретения.
Карбаматные соединения вышеуказанной формулы 1 могут быть использованы для облегчения или лечения расстройства развития, включая синдром хрупкой X-хромосомы, синдром Ангельмана или синдром Ретта.
Карбаматные соединения вышеуказанной формулы 1 могут быть использованы для предупреждения, облегчения или лечения симптомов расстройства развития, включая синдром хрупкой X-хромосомы, синдром Ангельмана или синдром Ретта.
Симптомы расстройства развития включают задержки в развитии, неспособность к обучению, расстройства социального поведения (избегание взгляда, возбуждение, проблемы с вниманием, взмахи руками, сбивчивая речь или хаотичные движения, чрезмерная активность) или судорожные припадки.
Симптомы синдрома хрупкой X-хромосомы включают задержки в развитии, неспособность к обучению и расстройства социального поведения (избегание взгляда, возбуждение, проблемы с вниманием, взмахи руками, сбивчивая речь или хаотичные движения, чрезмерная активность). У мужчин имеется интеллектуальная инвалидность от умеренной до тяжелой, и у некоторых женщин уровень интеллекта нормальный, а у некоторых имеется интеллектуальная инвалидность. Заболевание аутического спектра часто встречается у людей с синдромом хрупкой X-хромосомы (источник: Центр по контролю и профилактике заболеваний). Кроме того, при синдроме хрупкой X-хромосомы существует риск судорожных припадков, и известно, что около 14% мужчин и около 4% женщин испытывают судорожные припадки (Berry-Kravis et al., 2010, «Seizures in Fragile X Syndrome: Characteristics and Comorbid Diagnoses», Am J Intellect Dev Disabil. 115 (6): 461-72).
Симптомы синдрома Ангельмана и синдрома Ретта включают задержки в развитии, интеллектуальную инвалидность, расстройства социального поведения (легко возбуждаемая личность, чрезмерная активность, проблемы с вниманием) и судорожные припадки.
Таким образом, лекарственный препарат и фармацевтическая композиция в соответствии с настоящим изобретением могут быть использованы для предупреждения, облегчения или лечения симптомов расстройства развития, включая синдром хрупкой X-хромосомы, синдром Ангельмана или синдром Ретта, и симптомы включают, но этим не ограничиваются, задержки в развитии, неспособность к обучению, расстройства социального поведения и судорожные припадки.
Кроме того, лекарственный препарат в соответствии с настоящим изобретением может быть использован для облегчения или лечения заболеваний аутического спектра, вызванных синдромом хрупкой X-хромосомы, синдромом Ангельмана и синдромом Ретта, или заболеваний аутического спектра, демонстрирующих симптомы, подобные синдрому хрупкой X-хромосомы, синдрому Ангельмана и синдрому Ретта.
Эффективность соединения вышеуказанной формулы 1 в отношении нарушений развития, включая синдром хрупкой X-хромосомы, синдром Ангельмана или синдром Ретта, можно подтвердить с помощью известных моделей. Например, модель мыши с дефицитом гена Fmr1 представляет несколько клинических симптомов, наблюдаемых при нарушениях развития, таких как синдром хрупкой X-хромосомы, синдром Ангельмана или синдром Ретта, и используется в качестве средства для проверки эффективности лекарственного средства для изучения механизмов заболевания и разработки терапевтических агентов (Bakker et al., 1994, «Fmr1 knockout mice: A model to study fragile X mental retardation», Cell, 15; 78 (1): 23-33). Типичные фенотипы этой мышиной модели включают аудиогенный судорожный припадок, чрезмерную двигательную активность, когнитивный дефицит, проблему внимания и тому подобное.
Дозировка карбаматных соединений формулы 1 для облегчения или лечения вышеуказанных заболеваний обычно может варьироваться в зависимости от тяжести заболевания, веса тела и метаболического статуса субъекта. «Терапевтически эффективное количество» для отдельного пациента относится к количеству активного соединения, достаточному для достижения вышеуказанного фармакологического эффекта, то есть терапевтического эффекта, описанного выше. Терапевтически эффективное количество соединения формулы 1 составляет от 50 до 500 мг, от 50 до 400 мг, от 50 до 300 мг, от 100 до 400 мг, от 100 до 300 мг, от 50 до 200 мг или от 100 до 200 мг в расчете на свободную форму и при введении людям один раз в день.
Соединения по настоящему изобретению можно вводить любым обычным способом, используемым для введения терапевтического агента, таким как пероральное, парентеральное, внутривенное, внутримышечное, подкожное или ректальное введение.
Лекарственный препарат или фармацевтическая композиция в соответствии с одним вариантом осуществления настоящего изобретения могут содержать терапевтически эффективное количество соединения, выбранного из группы, состоящей из карбаматных соединений по настоящему изобретению, их фармацевтически приемлемых солей, сольватов, гидратов и их комбинаций.
Примеры фармацевтически приемлемых солей карбаматных соединений вышеуказанной формулы 1 включают, независимо, ацетат, бензолсульфонат, бензоат, битартрат, кальций ацетат, камсилат, карбонат, цитрат, эдетат, эдисилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликолоиларсанилат, гексилрезорцинат, соли гидрабамина, гидробромид, гидрохлорид, гидрокарбонат, гидроксинафтоат, йодид, изетионат, лактат, лактобионат, малат, малеат, манделат, мезилат, метилнитрат, метилсульфат, мукат, напсилат, нитрат, памоат (эмбонат), пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат или полусукцинат, сульфат или полусульфат, таннат, тартрат, оксалат или полутартрат, теоклат, триэтиодид, соли бензатина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина, прокаина, алюминия, аммония, тетраметиламмония, кальция, лития, магния, калия, натрия и цинка.
Лекарственный препарат или фармацевтическую композицию в соответствии с одним вариантом осуществления настоящего изобретения можно вводить перорально или парентерально. Парентеральное введение может включать внутривенную инъекцию, подкожную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию, эндотелиальное введение, местное введение, интраназальное введение, внутривлагалищное введение, внутрилегочное введение, ректальное введение и тому подобное. В случае перорального введения фармацевтическая композиция в соответствии с одним вариантом осуществления настоящего изобретения может быть составлена в виде простой таблетки (таблетки без покрытия) или такой, где активный агент покрыт оболочкой или защищен от разрушения в желудке. Кроме того, композицию можно вводить с помощью устройства, способного переносить активное вещество в клетку-мишень. Путь введения может варьироваться в зависимости от общего состояния и возраста субъекта, подлежащего лечению, природы лечимого состояния и выбранного активного ингредиента.
Подходящая дозировка лекарственного средства или фармацевтической композиции в соответствии с одним вариантом осуществления настоящего изобретения может варьироваться в зависимости от таких факторов, как способ составления, способ введения, возраст, вес тела и пол пациентов, патологическое состояние, питание, время введения, способ введения, степень экскреции и чувствительность реакции, и врачи, имеющие обычные навыки, могут легко определить и назначить дозировки, эффективные для желаемого лечения или профилактики. Фармацевтическая композиция в соответствии с одним вариантом осуществления может вводиться одной или несколькими дозами, например, от одного до четырех раз в день. Фармацевтическая композиция в соответствии с одним вариантом осуществления может содержать соединения формулы 1 в количестве от 50 до 500 мг, от 50 до 400 мг, от 50 до 300 мг, от 100 до 400 мг, от 100 до 300 мг, от 50 до 200 мг или от 100 до 200 мг, предпочтительно, от 50 до 300 мг, более предпочтительно, от 50 до 200 мг в расчете на свободную форму.
Лекарственный препарат или фармацевтическая композиция в соответствии с одним вариантом осуществления настоящего изобретения могут быть составлены с использованием фармацевтически приемлемого носителя и/или нейтрального вспомогательного вещества в соответствии со способом, который может легко осуществить специалист в данной области, таким образом, их можно изготовить в виде одноразовой дозы или содержащимися в многодозовом контейнере. Вышеуказанная композиция может представлять собой раствор в масле или водной среде, суспензию или эмульсию (эмульсионный раствор), экстракт, порошок, гранулы, таблетку или капсулу и может дополнительно включать диспергирующий или стабилизирующий агент. Кроме того, фармацевтическую композицию можно вводить в виде суппозиториев, спреев, мазей, кремов, гелей, ингаляций или кожных пластырей. Фармацевтическая композиция также может быть изготовлена для введения млекопитающим, более предпочтительно, для введения человеку.
Фармацевтически приемлемые носители могут быть твердыми или жидкими, и они могут быть одним или несколькими, выбранными из наполнителей, антиоксидантов, буферов, бактериостатов, диспергаторов, адсорбентов, поверхностно-активных веществ, связующих веществ, консервантов, разрыхлителей, подсластителей, ароматизаторов, глидантов, агентов, контролирующих высвобождение, смачивающих агентов, стабилизаторов, суспендирующих агентов и смазывающих веществ. Кроме того, фармацевтически приемлемые носители могут быть выбраны из солевого раствора, стерильной воды, раствора Рингера, забуференного солевого раствора, раствора декстрозы, раствора мальтодекстрина, глицерина, этанола и их смесей.
В одном варианте осуществления изобретения подходящие наполнители включают, но не ограничиваются ими, сахар (например, декстроза, сахароза, мальтоза и лактоза), крахмал (например, кукурузный крахмал), сахарный спирт (например, маннит, сорбит, мальтит, эритрит и ксилит), гидролизат крахмала (например, декстрин и мальтодекстрин), целлюлозу или производные целлюлозы (например, микрокристаллическая целлюлоза) или их смеси.
В одном варианте осуществления подходящие связующие включают, но не ограничиваются ими, повидон, коповидон, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, желатин, камедь, сахарозу, крахмал или их смеси.
В одном варианте осуществления подходящие консерванты включают, но не ограничиваются ими, бензойную кислоту, бензоат натрия, бензиловый спирт, бутилированный гидроксианизол, бутилированный гидрокситолуол, хлорбутол, галлат, гидроксибензоат, EDTA или их смеси.
В одном варианте осуществления подходящие разрыхлители включают, но не ограничиваются ими, крахмалгликолят натрия, сшитый поливинилпирролидон, сшитую карбоксиметилцеллюлозу, крахмал, микрокристаллическую целлюлозу или их смеси.
В одном варианте осуществления подходящие подсластители включают, но не ограничиваются ими, сукралозу, сахарин, сахарин натрия, сахарин калия, сахарин кальция, ацесульфам калия или цикламат натрия, маннит, фруктозу, сахарозу, мальтозу или их смеси.
В одном варианте осуществления подходящие глиданты включают, но не ограничиваются ими, диоксид кремния, коллоидный диоксид кремния, тальк и тому подобное.
В одном варианте осуществления подходящие смазывающие вещества включают, но не ограничиваются ими, длинноцепочечные жирные кислоты и их соли, такие как стеарат магния и стеариновая кислота, тальк, глицеридный воск или их смеси.
Как используется в настоящем документе, термины «предотвращать», «предотвращение» и «предупреждение» относятся к уменьшению или устранению вероятности заболевания.
Как используется в настоящем документе, термины «ослаблять», «облегчать» и «ослабление» относятся к ослаблению заболевания и/или сопровождающих его симптомов, полностью или частично.
Как используется в настоящем документе, термины «лечить», «вылечить» и «лечение» относятся к устранению заболевания и/или сопровождающих его симптомов полностью или частично.
Как используется в настоящем документе, термин «субъект» относится к животному, которое является объектом терапии, наблюдения или эксперимента, предпочтительно, млекопитающему (такому как приматы (например, человек), крупный рогатый скот, овцы, козы, лошади, собаки, кошки, кролики, крысы, мыши и т. д.), наиболее предпочтительно, к человеку.
Как используется в настоящем документе, термин «терапевтически эффективное количество» относится к количеству активного соединения или фармацевтической композиции, которое вызывает биологический или медицинский ответ в системе у животного или человека, включая ослабление симптомов заболевания или расстройства, подлежащего лечению, причем указанное количество устанавливается исследователем, ветеринаром, доктором (медиком) или иным клиницистом.
Как используется в настоящем документе, термин «композиция» охватывает продукт, который содержит определенное количество конкретного ингредиента, и любой продукт, который прямо или косвенно получается из комбинации определенных количеств конкретных ингредиентов.
[Эффект изобретения]
Лекарственный препарат и фармацевтическая композиция в соответствии с настоящим изобретением могут эффективно облегчать и лечить нарушение развития, такое как синдром хрупкой X-хромосомы, синдром Ангельмана или синдром Ретта.
[Краткое описание фигур]
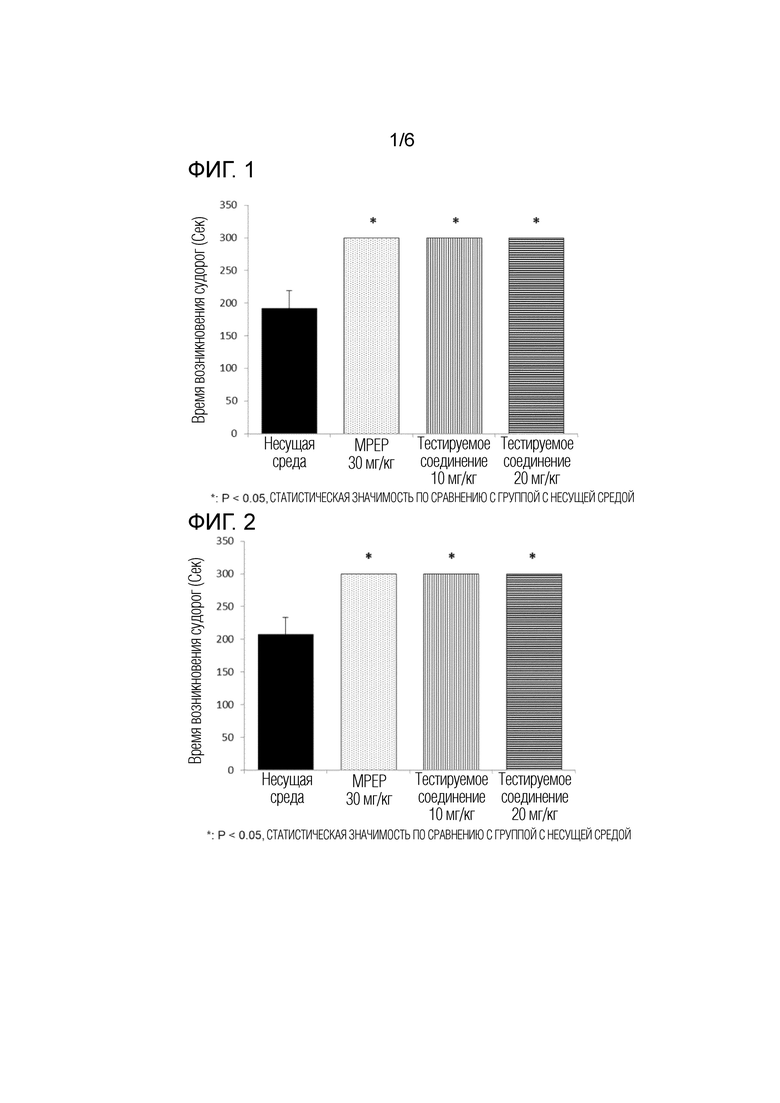
На фигуре 1 показаны результаты супрессивного действия тестируемого соединения (10 мг/кг, 20 мг/кг) и группы положительного контроля (MPEP, 2-метил-6-(фенилэтинил)пиридин) на возникновение судорог в тесте аудиогенных судорожных припадков, выполненном с использованием модели на мышах с дефицитом гена Fmr1.
На фигуре 2 показаны результаты предотвращающего действия тестируемого соединения (10 мг/кг, 20 мг/кг) и группы положительного контроля (MPEP) на остановку дыхания, вызванной судорогами, в тесте аудиогенных судорожных припадков, выполненном с использованием модели на мышах с дефицитом гена Fmr1.
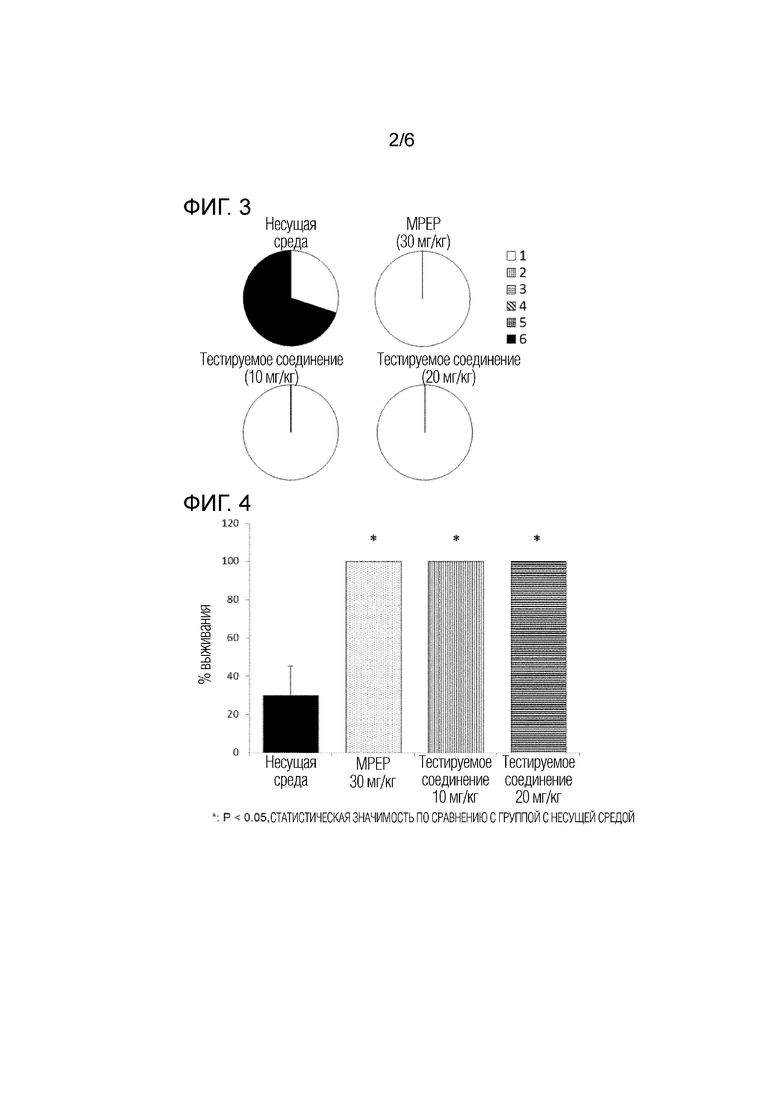
На фигуре 3 показаны результаты регуляторных эффектов тестируемого соединения (10 мг/кг, 20 мг/кг) и группы положительного контроля (MPEP) на оценку судорог в тесте аудиогенных судорожных припадков выполненным с использованием модели на мышах с дефицитом гена Fmr1.
На фигуре 4 показаны результаты действия тестируемого соединения (10 мг/кг, 20 мг/кг) и группы положительного контроля (MPEP) на выживаемость мыши в тесте аудиогенных судорожных припадков выполненным с использованием модели на мышах с дефицитом гена Fmr1.
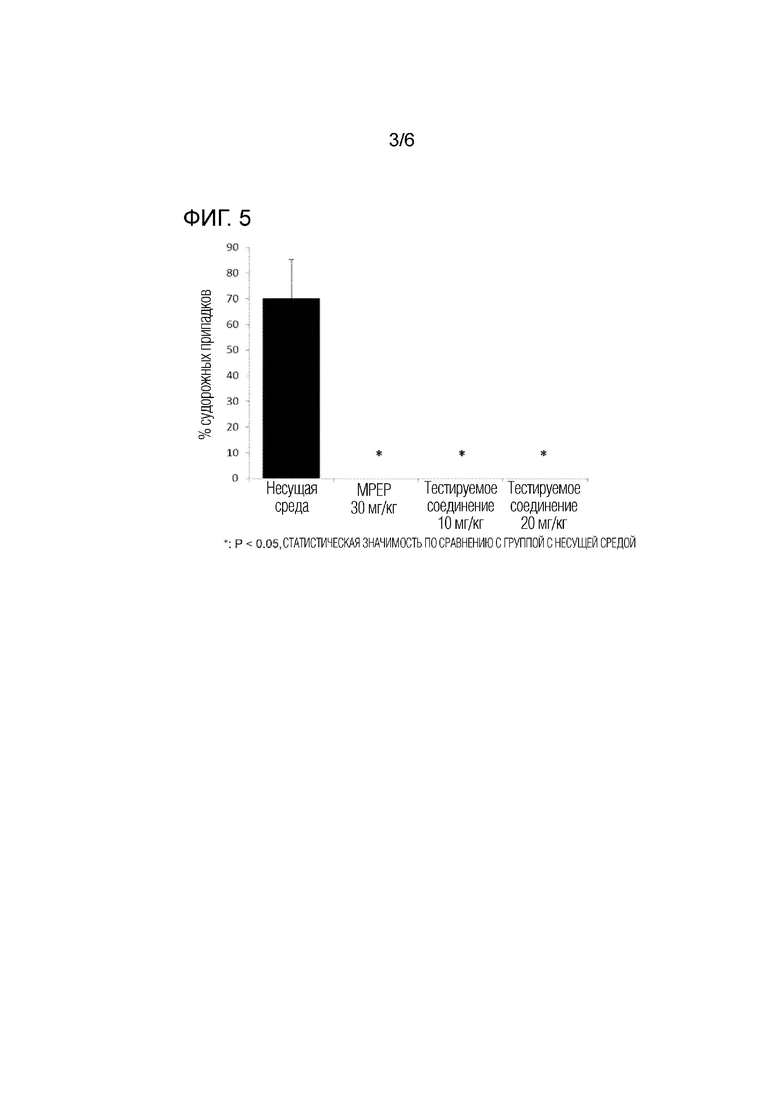
На фигуре 5 показаны результаты действия тестируемого соединения (10 мг/кг, 20 мг/кг) и группы положительного контроля (MPEP) в процентах судорожных припадков в тесте аудиогенных судорожных припадков выполненным с использованием модели на мышах с дефицитом гена Fmr1.
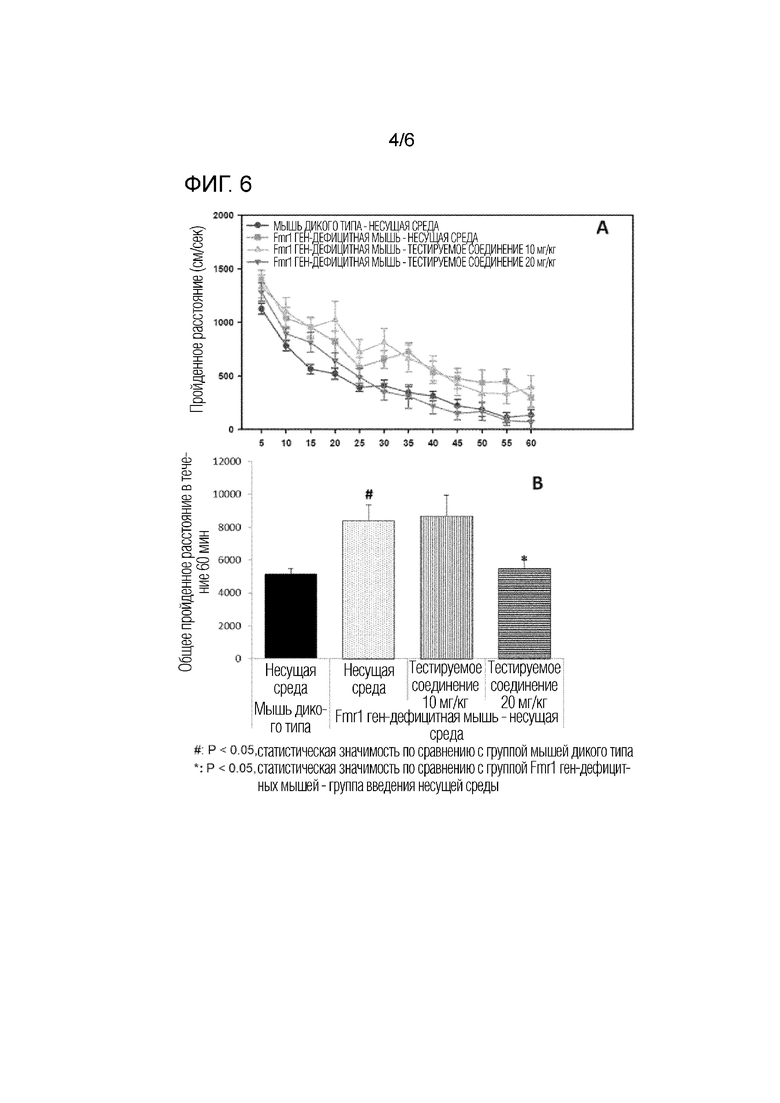
На фигуре 6 показаны результаты действия тестируемого соединения (10 мг/кг, 20 мг/кг) на двигательную активность на модели на мышах с дефицитом гена Fmr1.
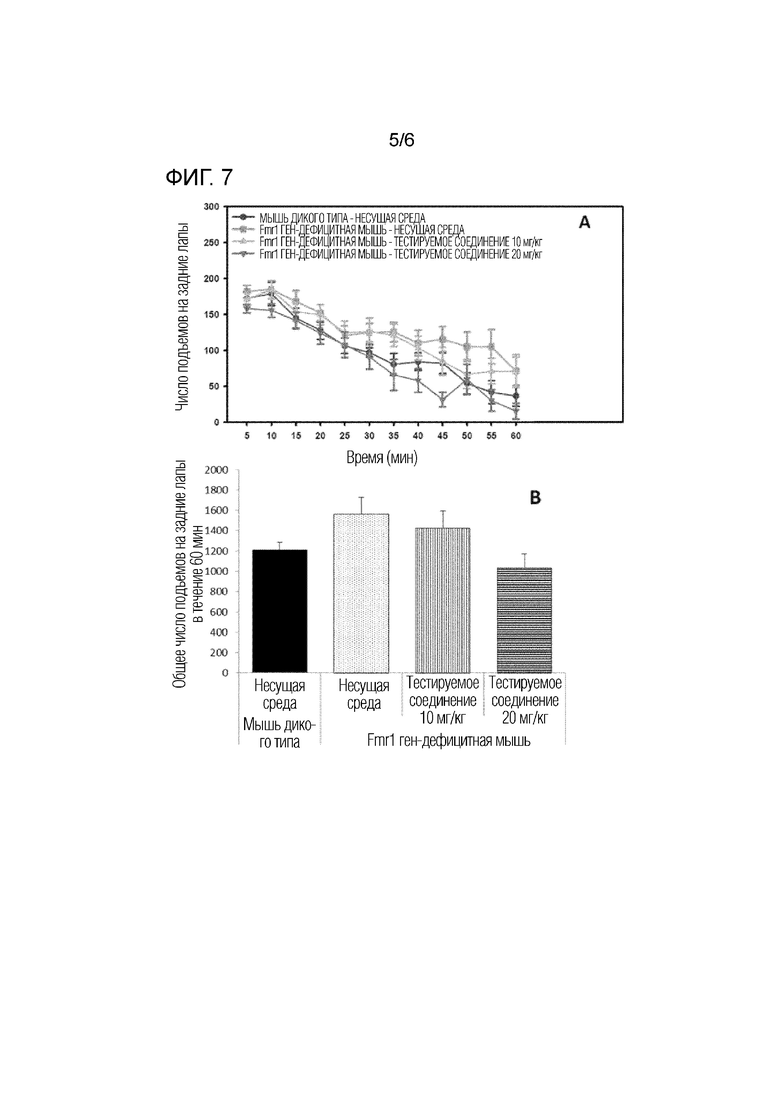
На фигуре 7 показаны результаты действия тестируемого соединения (10 мг/кг, 20 мг/кг) на повышенную активность вставания на задние лапы на модели на мышах с дефицитом гена Fmr1.
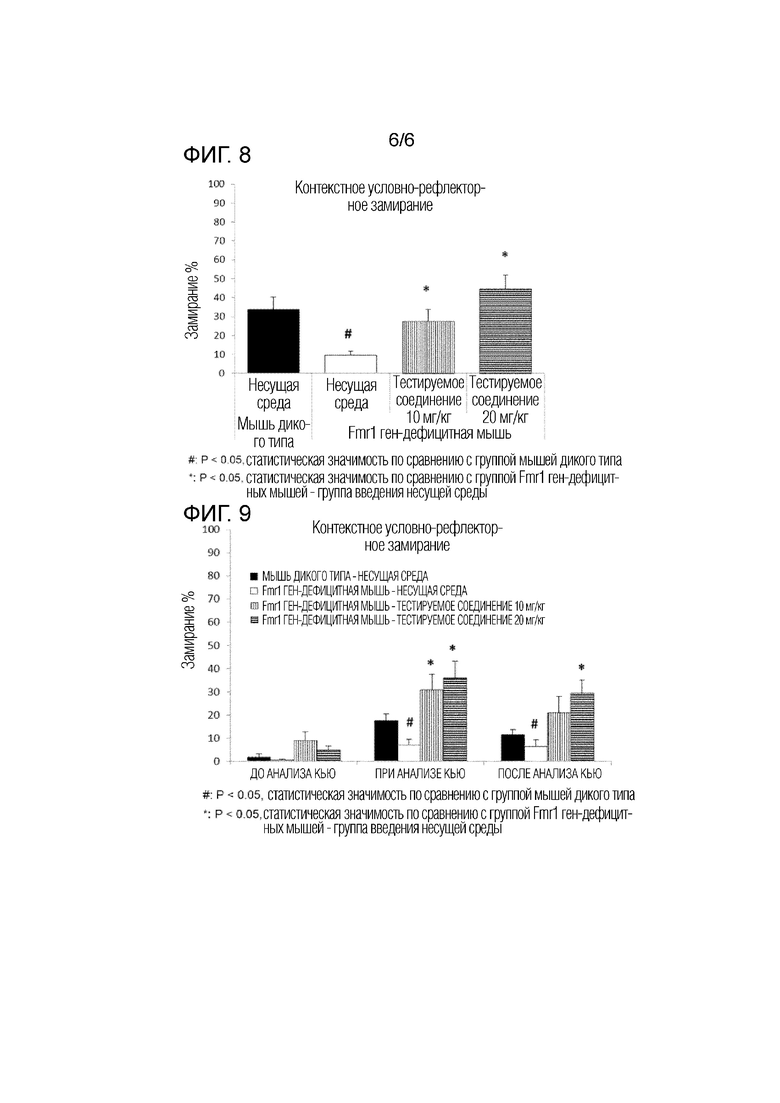
На фигуре 8 показаны результаты действия тестируемого соединения (10 мг/кг, 20 мг/кг) на уменьшенное условно-рефлекторное замирание в тесте контекстного условно-рефлекторного замирания с использованием модели на мышах с дефицитом гена Fmr1.
На фигуре 9 показаны результаты действия тестируемого соединения (10 мг/кг, 20 мг/кг) на уменьшенное условно-рефлекторное замирание в тесте сигнального условно-рефлекторного замирания с помощью сигнала стимула с использованием модели на мышах с дефицитом гена Fmr1.
[Конкретные варианты осуществления изобретения]
Далее настоящее изобретение будет объяснено более подробно с помощью рабочих примеров. Однако следующие рабочие примеры предназначены только для иллюстрации одного или нескольких вариантов осуществления и не предназначены для ограничения объема изобретения.
Пример получения: Синтез (R)-1-(2-хлорфенил)-2-тетразол-2-ил-этилового эфира карбаминовой кислоты
(R)-1-(2-Хлорфенил)-2-тетразол-2-ил-этиловый эфир карбаминовой кислоты (тестируемое соединение) получали в соответствии со способом, описанным в примере получения 50 международной публикации № WO 2010/150946.
Пример 1: Тест на противосудорожную эффективность при аудиогенных судорожных припадках на модели на мышах с дефицитом гена Fmr1
В модели мыши, нокаутированной по гену Fmr1, отсутствует белок FMRP из-за разрушения гена Fmr1, и типичным фенотипом этой мыши является аудиогенный судорожный припадок, чрезмерная двигательная активность, когнитивный дефицит, проблема внимания и тому подобное. Таким образом, мышиная модель с дефицитом гена Fmr1 демонстрирует несколько клинических симптомов, наблюдаемых при нарушениях развития, таких как синдром хрупкой X-хромосомы, синдром Ангельмана или синдром Ретта, и использовалась в качестве средства для проверки эффективности лекарственного средства при исследовании нарушений развития и разработке терапевтических агентов (Kazdoba et al., 2014, «Modeling fragile X syndrome in the Fmr1 knockout mouse», Intractable Rare Dis Res. 2014 Nov; 3(4): 118-133; Bakker et al., 1994, «Fmr1 knockout mice: A model to study fragile X mental retardation», Cell, 15; 78(1): 23-33).
Экспериментальные животные
Самцы мышей с дефицитом гена FVB.129P2-Pde6b+ Tyrc-ch Fmr1tm1Cgr/J были приобретены у компании Jackson Laboratories, и эксперименты с аудиогенными судорожными припадками проводили на 3 недельных особях. После приобретения экспериментальных животных содержали в условиях контролируемого освещения (12 часов освещения/12 часов без освещения) и выдерживали при температуре 20-23ºС и относительной влажности около 50%. Еда и вода были предоставлены ad libitum. Мышей разделяли на группы случайным образом. Исследование проводилось при освещении.
Лекарственный препарат
В качестве положительного контроля использовали MPEP (2-метил-6-(фенилэтинил)пиридин)·HCl, растворяли в стерильном инъецируемом физиологическом растворе и вводили внутрибрюшинно в дозе 30 мг/кг. MPEP готовили в объеме 10 мл/кг и вводили за 30 минут до начала исследования.
Тестируемое соединение растворяли в 30% PEG 300, и использовали две дозы, 10 мг/кг и 20 мг/кг. Тестируемое соединение готовили в объеме 10 мл/кг и вводили за 30 минут до начала исследования. В качестве отрицательного контроля вводили несущую среду (30% PEG 300).
Группы лечения
1. Fmr1 ген-дефицитная мышь - введение несущей среды
2. Fmr1 ген-дефицитная мышь - введение MPEP 30 мг/кг
3. Fmr1 ген-дефицитная мышь - введение 10 мг/кг тестируемого соединения
4. Fmr1 ген-дефицитная мышь - введение 20 мг/кг тестируемого соединения
На группу использовалось десять мышей.
Исследование аудиогенных судорожных припадков
За 30 минут до начала испытания мышам 21 дневного возраста вводили несущую среду, MPEP или тестируемое соединение. Мышей на 15 секунд помещали в камеру из оргстекла и подвергали воздействию звука в 135 децибел (дБ). Во время исследования в течение 5 минут мышей оценивали по следующим критериям, основанным на реакции мыши, времени, потребовавшемся для наступления реакции, и интенсивности судорожного припадка.
0: Нет реакции
1: Дикие бег и прыжки
2: Клонические судороги
3: Клонически-тонические судороги
4: Тонические судороги
5: Остановка дыхания
Были определены и наблюдались следующие конечные результаты, и в случае животных, у которых не было реакции, время реакции устанавливали равным 300 секундам для удобства анализа.
1. Время возникновения судорог (300 секунд, если судороги не происходят)
2. Время до остановки дыхания (300 секунд, если мышь выживает без остановки дыхания)
3. Оценка судорог
4. Процент выживания
5. Процент изъятых
Статистический анализ
Данные были проанализированы с помощью ANOVA, и, если необходимо, был выполнен специальный анализ Fisher PLSD. Средняя интенсивность судорожного припадка была проанализирована непараметрически. Эффект был определен как значимый при р <0,05. Результаты представлены в виде средних значений±стандартная ошибка.
Результаты исследования
1. Вес
Когда вес тела, измеренный до введения лекарственного средства в день испытания, анализировали с помощью одностороннего ANOVA, значимых различий по группам не было.
2. Время возникновения судорожных припадков
У групп, которым вводили MPEP (30 мг/кг) и тестируемое соединение (10 мг/кг, 20 мг/кг), значительно увеличивалось время, необходимое для развития судорожных припадков, по сравнению с группой, которой вводилась несущая среда. У мышей в группах введения MPEP и тестируемого соединения не вызывались судорожные припадки, и, таким образом, время, необходимое для возникновения судорог, было зарегистрировано как 300 секунд (фиг. 1).
3. Время остановки дыхания
У групп, которым вводили MPEP (30 мг/кг) и тестируемое соединение (10 мг/кг, 20 мг/кг), значительно увеличивалось время, необходимое для остановки дыхания, по сравнению с группой, которой вводилась несущая среда. У мышей в группах введения MPEP и тестируемого соединения не вызывалась остановка дыхания, и, таким образом, время, необходимое для остановки дыхания, было зарегистрировано как 300 секунд (фиг. 2)
4. Средняя оценка судорог
В группах, которым вводили MPEP (30 мг/кг) и тестируемое соединение (10 мг/кг, 20 мг/кг), уровень интенсивности судорог у мышей был значительно снижен по сравнению с группой, которой вводили несущую среду (фиг. 3).
5. Процент выживания
В группах, в которых вводили MPEP (30 мг/кг) и тестируемое соединение (10 мг/кг, 20 мг/кг), жизнеспособность мышей была значительно увеличена по сравнению с группой, которой вводили несущую среду, и 100% мышей в группах введения MPEP и тестируемого соединения выжили (фиг. 4).
6. Процент судорожных припадков
В группах, в которых вводили MPEP (30 мг/кг) и тестируемое соединение (10 мг/кг, 20 мг/кг) судорог не было (фиг. 5).
Пример 2: Тест открытого поля и тест условно-рефлекторного замирания на модели на мышах с дефицитом гена Fmr1
Экспериментальные животные
Самцы мышей с дефицитом гена FVB.129P2-Pde6b+ Tyrc-ch Fmr1tm1Cgr/J были приобретены у компании Jackson Laboratories. После приобретения экспериментальных животных содержали в условиях контролируемого освещения (12 часов освещения/12 часов без освещения) и выдерживали при температуре 20-23ºС и относительной влажности около 50%. Еда и вода были предоставлены ad libitum. Мышей разделяли на группы случайным образом. Лекарственные препараты вводили 8 недельным особям один раз в день в течение 6 дней. Исследование проводилось при освещении.
Лекарственный препарат
Тестируемое соединение растворяли в 30% PEG 300, и использовали две дозы, 10 мг/кг и 20 мг/кг. Тестируемое соединение готовили в объеме 10 мл/кг и вводили внутрибрюшинно за 30 минут до начала исследования.
Исследуемая группа
1. Мышь дикого типа - введение несущей среды
2. Fmr1 ген-дефицитная мышь - введение несущей среды
3. Fmr1 ген-дефицитная мышь - введение 10 мг/кг тестируемого соединения
4. Fmr1 ген-дефицитная мышь - введение 20 мг/кг тестируемого соединения
На группу использовалось десять мышей.
Тест открытого поля и тест условно-рефлекторного замирания
1. Локомоторная активность: Тест на локомоторную активность проводили на 4-й день введения при ежедневном введении 8-недельным мышам в течение 6 дней.
Для измерения горизонтальных и вертикальных перемещений использовалась квадратная камера из плексигласа (27,3×27,3×20,3 см), окруженная инфракрасными лучами. Мышей акклиматизировали в лаборатории по меньшей мере за 1 час до испытания, а затем помещали в центр камеры для определения активности в открытом поле в течение 1 часа. Пространство проведения исследования очищалось при каждой смене мышей. Расстояние измерялось по разрыву горизонтального светового луча движением мыши. Почасовое изменение активности и активность вставания (подъем на задних лапах) выражали в 5-минутных единицах. Общее пройденное расстояние и общее число активности вставания были суммой значений за 60 минут.
2. Тест условно-рефлекторного замирания: На 5-й и 6-й дни введения и через 30 минут после введения проводили обучение и исследование эффективности препарата, соответственно. Тест проводился с использованием системы условно-рефлекторного замирания производства Coulbourn Instruments (Пенсильвания, США).
Обучение проводили через 30 минут после введения в день 5 введения. Мышей помещали в камеру кондиционирования и адаптировали к окружающей среде в течение 120 секунд, а затем подвергали воздействию звукового стимула в 6 кГц, 75 дБ (условный раздражитель) в течение 20 секунд. Через 30 секунд после окончания условной стимуляции на лапки мыши применяли электростимуляционный шок 0,5 мА (безусловный раздражитель). Мышей оставляли в камере кондиционирования на дополнительные 60 секунд и затем возвращали в исходную клетку.
Утром 6-го дня через 30 минут после введения мышей помещали в ту же камеру, что и в предыдущий день, и затем обучали в течение 5 минут без шока или других помех для проведения теста эффективности лекарственного средства для контекстной памяти. На 6-й день после 4 часов контекстного теста на кондиционирование, был проведен тест на эффективность лекарственного средства для памяти с помощью сигналов стимула. Мышей подвергали воздействию новой среды в течение 2 минут (до сигнала стимуляции), и условия и стимуляцию применяли всего три раза в течение 20 секунд. Замирании определялось как полная потеря движения и фиксировалось с использованием видеосистемы и программного обеспечения FreezeView (Coulbourn Instruments PA, США). Камеру очищали 70% этанолом при каждой смене мышей.
Статистический анализ
Данные были проанализированы с помощью ANOVA, и, если необходимо, был проведен специальный анализ Fisher PLSD с использованием программного обеспечения Statview. Эффект был определен как значимый при р<0,05. Результаты представлены в виде средних значений±стандартная ошибка.
Результаты теста открытого поля
1. Локомоторная активность
Изменение активности во времени в течение 60 минут показано на фигуре 6A, и сумма общих расстояний перемещения показана на фигуре 6B. В результате анализа ANOVA мыши с дефицитом гена Fmr1, которым вводили несущую среду, показали значительно более высокую активность по сравнению с мышами дикого типа. Кроме того, активность была значительно снижена у мышей с дефицитом гена Fmr1, которым вводили тестируемое соединение (20 мг/кг), по сравнению с группой, получавшей несущую среду.
2. Вставание
Почасовое изменение частоты вставания в течение 60 минут показано на фигуре 7A, и общее число вставаний показано на фигуре 7B. В результате анализа ANOVA у мышей с дефицитом гена Fmr1, которым вводили несущую среду, было выявлено повышенное число вставаний по сравнению с мышами дикого типа, но это не было значительным. Кроме того, активность вставания была понижена у мышей с дефицитом гена Fmr1, которым вводили тестируемое соединение (20 мг/кг), по сравнению с группой, получавшей несущую среду.
Результаты теста условно-рефлекторного замирания
1. Контекстное условно-рефлекторное замирание
Процент замирания в процессе контекстного теста условно-рефлекторного замирания представлен на фигуре 8. В результате анализа ANOVA у мышей с дефицитом гена Fmr1, которым вводили несущую среду, наблюдалось значительное снижение активности замирания по сравнению с мышами дикого типа. Кроме того, активность замирания была значительно повышена у мышей с дефицитом гена Fmr1, которым вводили исследуемое соединение (10 мг/кг, 20 мг/кг), которая была подобна активности у мышей дикого типа, по сравнению с группой, получавшей несущую среду.
2. Тест условно-рефлекторного замирания по сигналу стимула (тест Кью)
Процент замирания в процессе теста условно-рефлекторного замирания по сигналу стимула представлен на фигуре 9. Когда все группы были проанализированы, не было никаких существенных различий между мышами дикого типа и мышами с дефицитом гена Fmr1. Однако t-тест показал значительные различия между мышами дикого типа и мышами с дефицитом гена Fmr1. У мышей с дефицитом гена Fmr1 проводили односторонний анализ ANOVA для сравнения группы, которой вводили тестируемое соединение, с группой, которой вводили несущую среду. Когда время подачи сигнала стимула сравнивали со временем после сигнала стимула, наблюдалось значительное влияние введения на скорость замирания. При подаче сигнала стимула тестируемое соединение значительно увеличивало скорость замирания у мышей с дефицитом гена Fmr1 в обеих дозах. После сигнала стимула наблюдалось значительное увеличение замирания при дозе 20 мг/кг тестируемого соединения.
Настоящее изобретение относится к области медицины и раскрывает применение карбаматного соединения, представленного химической формулой 1, или его фармацевтически приемлемой соли, где R1 и R2, каждый, независимо, выбраны из группы, состоящей из водорода, галогена и C1-C8 алкила; и один из A1 и A2 представляет собой CH, и другой представляет собой N для облегчения или лечения синдрома хрупкой Х-хромосомы. Технический результат изобретения заключается в облегчении или лечении синдрома хрупкой Х-хромосомы с применением карбаматного соединения формулы 1. 5 з.п. ф-лы, 9 ил., 2 пр.
[Формула 1]
1. Применение карбаматного соединения следующей формулы 1 или его фармацевтически приемлемой соли:
[Формула 1]
 ,
,
где
R1 и R2, каждый, независимо, выбраны из группы, состоящей из водорода, галогена и C1-C8 алкила; и
один из A1 и A2 представляет собой CH, и другой представляет собой N, для облегчения или лечения синдрома хрупкой Х-хромосомы.
2. Применение по п.1, где карбаматное соединение формулы 1 представляет собой (R)-1-(2-хлорфенил)-2-тетразол-2-ил-этиловый эфир карбаминовой кислоты следующей формулы 2:
[Формула 2]
 .
.
3. Применение по п.1, для применения для предупреждения, облегчения или лечения симптомов синдрома хрупкой X-хромосомы.
4. Применение по п.3, где симптомом синдрома хрупкой X-хромосомы является задержка в развитии, неспособность к обучению, расстройство социального поведения или судорожные припадки.
5. Применение по п.1, для применения для ослабления или лечения заболевания аутистического спектра, вызванного синдромом хрупкой X-хромосомы.
6. Применение по любому из пп.1-5, где карбаматное соединение формулы 1 используется в количестве от 50 до 500 мг в расчете на свободную форму при введении один раз в день.
| АЗОЛЬНЫЕ СОЕДИНЕНИЯ С НЕЙТРОТЕРАПЕВТИЧЕСКОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2418792C2 |
| WO 2017075222 A1, 04.05.2017 | |||
| US 9351968 B1, 31.05.2016 | |||
| BIALER, M | |||
| et al., Progress Report on New Antiepileptic Drugs: A Summary of the Twelfth Eilat Conference (EILAT XII), Epilepsy Research | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Говорящий кинематограф | 1920 |
|
SU111A1 |
| СПОСОБ ПОЛУЧЕНИЯ (R)-1-АРИЛ-2-ТЕТРАЗОЛИЛЭТИЛОВОГО ЭФИРА КАРБАМИНОВОЙ КИСЛОТЫ | 2009 |
|
RU2508290C2 |
| СПОСОБ ПОЛУЧЕНИЯ (R)-1-АРИЛ-2-ТЕТРАЗОЛИЛЭТИЛОВОГО ЭФИРА КАРБАМИНОВОЙ КИСЛОТЫ | 2010 |
|
RU2539983C2 |
Авторы
Даты
2023-04-05—Публикация
2018-11-13—Подача