ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к области биомедицины, в частности к антителу, которое способно связываться с белком CD38.
УРОВЕНЬ ТЕХНИКИ
Белок CD38 представляет собой бифункциональную экзонуклеазу, которая может катализировать превращение NAD+ в циклическую АДФ-рибозу (cADPR, циклическая АДФ-рибоза) и гидролизовать cADPR до АДФ-рибозы. Белок CD38 является одним из антигенов, экспрессирующихся на злокачественных плазмоцитах и экспрессирующихся в различных злокачественных гематопоэтических клетках, включающих, помимо прочего, клетки множественной миеломы, клетки хронического В-клеточного лимфобластного лейкоза и клетки острого В-клеточного лимфобластного лейкоза.
Однако разработанные в настоящее время антитела к CD38 обладают ограниченной активностью распознавания, ограниченной цитотоксической активностью и ограниченной способностью ингибировать опухоли, поэтому существует острая необходимость в разработке нового антитела к CD38 для разработки новых лекарств.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящей заявке предлагается антитело к CD38 и его применение. Антитело к CD38, предлагаемое в настоящей заявке, может обладать одним или несколькими из следующих свойств: 1) оно может связываться с белком CD38 с более высокой аффинностью и специфичностью; 2) оно может уничтожать клетки CD38+ путем антителозависимой клеточно-опосредованной цитотоксичности (ADCC), комплемент-зависимой цитотоксичности (CDC) и/или апоптоза; 3) оно может уничтожать и повреждать опухолевые клетки и/или подавлять рост опухоли; 4) его можно использовать для профилактики или лечения опухолей; 5) оно может ингибировать связывание белка CD38 с лигандом CD38. В настоящей заявке дополнительно предлагается способ получения и применения антитела к CD38.
С одной стороны, в настоящей заявке предлагается антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38 при значении KD 1×10-9M или ниже.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящей заявке может уничтожать и повреждать опухолевые клетки и/или ингибировать рост опухоли путем специфического связывания с белком CD38.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящей заявке может уничтожать клетки CD38+ путем антителозависимой клеточно-опосредованной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC) и/или апоптоза.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящей заявке не связывается или по существу не связывается с BSA, CD19, TROP2, CD47, AXL или Gas6 и другими неродственными антигенами.
В некоторых вариантах осуществления опухоли включают CD38-положительную опухоль. В некоторых вариантах осуществления CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз.
В некоторых вариантах осуществления опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
В некоторых вариантах осуществления опухолевые клетки включают клетки, выбранные из группы, содержащей клетки Раджи, клетки Дауди, клетки Рамос и клетки RPMI8226.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент связывается с одним или несколькими остатками, соответствующими аминокислотным остаткам 60-89 человеческого белка CD38 при связывании с белком CD38 (при этом аминокислотная последовательность аминокислот 60-89 человеческого белка CD38 показана в SEQ ID NO: 15).
В некоторых вариантах осуществления антитело выбрано из группы, включающей моноклональное антитело, одноцепочечное антитело, химерное антитело, гуманизированное антитело и полностью человеческое антитело.
В некоторых вариантах осуществления антигенсвязывающий фрагмент выбран из группы, включающей Fab, Fab’, F(ab)2, F(ab’)2, Fv и ScFv.
В некоторых вариантах осуществления белок CD38 представляет собой человеческий белок CD38 или белок CD38 обезьян. Например, белок CD38 может не быть мышиным белком CD38 или может не быть крысиным белком CD38.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент в соответствии с настоящей заявкой конкурирует с референсным антителом за связывание с белком CD38, при этом референсное антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, вариабельная область легкой цепи референсного антитела содержит LCDR1, LCDR2 и LCDR3, LCDR1 содержит аминокислотную последовательность, показанную в SEQ ID NO:1; LCDR2 содержит аминокислотную последовательность, показанную в SEQ ID NO:2; LCDR3 содержит аминокислотную последовательность, показанную в SEQ ID NO:3, вариабельная область тяжелой цепи референсного антитела содержит HCDR1, HCDR2 и HCDR3, HCDR1 содержит аминокислотную последовательность, показанную в SEQ ID NO:4; HCDR2 содержит аминокислотную последовательность, показанную в SEQ ID NO:5; и HCDR3 содержит аминокислотную последовательность, показанную в SEQ ID NO:6.
В некоторых вариантах осуществления вариабельная область легкой цепи референсного антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:7, и вариабельная область тяжелой цепи референсного антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:8.
В некоторых вариантах осуществления легкая цепь референсного антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:22. Например, легкая цепь референсного антитела или ее фрагмент содержит аминокислотную последовательность, показанную в любом из SEQ ID NO:11, SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:20.
В некоторых вариантах осуществления тяжелая цепь референсного антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:23. Например, тяжелая цепь референсного антитела или ее фрагмент содержит аминокислотную последовательность, показанную в любом из SEQ ID NO:13, SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:21.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящей заявке содержит легкую цепь антитела или ее фрагмент. В некоторых вариантах осуществления легкая цепь антитела или ее фрагмент содержит LCDR1, и LCDR1 содержит аминокислотную последовательность, показанную в SEQ ID NO:1. В некоторых вариантах осуществления легкая цепь антитела или ее фрагмент содержит LCDR2, и LCDR2 содержит аминокислотную последовательность, показанную в SEQ ID NO:2. В некоторых вариантах осуществления легкая цепь антитела или ее фрагмент содержит LCDR3, и LCDR3 содержит аминокислотную последовательность, показанную в SEQ ID NO:3.
В некоторых вариантах осуществления легкая цепь антитела или ее фрагмент содержит вариабельную область легкой цепи VL, и вариабельная область легкой цепи VL содержит аминокислотную последовательность, показанную в SEQ ID NO:7.
В некоторых вариантах осуществления легкая цепь антитела или ее фрагмент дополнительно содержит человеческую константную область. В некоторых вариантах осуществления человеческая константная область содержит константную область человеческого Igκ.
В некоторых вариантах осуществления легкая цепь антитела или ее фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:22. Например, легкая цепь антитела или ее фрагмент содержит аминокислотную последовательность, показанную в любом из SEQ ID NO:11, SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:20.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь антитела или ее фрагмент. В некоторых вариантах осуществления тяжелая цепь антитела или ее фрагмент содержит HCDR1, и HCDR1 содержит аминокислотную последовательность, показанную в SEQ ID NO:4. В некоторых вариантах осуществления тяжелая цепь антитела или ее фрагмент содержит HCDR2, и HCDR2 содержит аминокислотную последовательность, показанную в SEQ ID NO:5. В некоторых вариантах осуществления тяжелая цепь антитела или ее фрагмент содержит HCDR3, и HCDR3 содержит аминокислотную последовательность, показанную в SEQ ID NO:6.
В некоторых вариантах осуществления тяжелая цепь антитела или ее фрагмент содержит вариабельную область тяжелой цепи VH, и вариабельная область тяжелой цепи VH содержит аминокислотную последовательность, показанную в SEQ ID NO:8.
В некоторых вариантах осуществления тяжелая цепь антитела или ее фрагмент дополнительно содержит человеческую константную область. В некоторых вариантах осуществления человеческая константная область содержит константную область человеческого IgG. В некоторых вариантах осуществления константная область IgG содержит константную область человеческого IgG1.
В некоторых вариантах осуществления тяжелая цепь антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:23. Например, тяжелая цепь антитела или ее фрагмент содержит аминокислотную последовательность, показанную в любом из SEQ ID NO:13, SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:21.
С другой стороны, в настоящей заявке предлагается выделенная молекула нуклеиновой кислоты, которая содержит полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент по настоящей заявке.
В некоторых вариантах осуществления, по меньшей мере, одна из молекул нуклеиновой кислоты является кодон-оптимизированной.
В некоторых вариантах осуществления молекула нуклеиновой кислоты содержит одну или более полинуклеотилных последовательностей, выбранных из группы, включающей SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:12 и SEQ ID NO:14.
С другой стороны, в настоящей заявке предлагается вектор, который содержит молекулу нуклеиновой кислоты по настоящей заявке.
С другой стороны, в настоящей заявке предлагается клетка, которая содержит молекулу нуклеиновой кислоты по настоящей заявке или вектор по настоящей заявке.
С другой стороны, в настоящей заявке предлагается способ получения антитела или его антигенсвязывающего фрагмента. Способ включает культивирование клетки по настоящей заявке в условиях, которые позволяют экспрессировать антитело или его антигенсвязывающий фрагмент.
С другой стороны, в настоящей заявке предлагается фармацевтическая композиция, которая содержит антитело или его антигенсвязывающий фрагмент, молекулу нуклеиновой кислоты, вектор и/или клетку по настоящей заявке, и необязательно фармацевтически приемлемые адъюванты.
С другой стороны, в настоящей заявке предлагается применение антитела или его антигенсвязывающего фрагмента для получения лекарственных средств для профилактики или лечения опухолей.
В некоторых вариантах осуществления опухоли включают CD38-положительную опухоль. В некоторых вариантах осуществления CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз. В некоторых вариантах осуществления опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
С другой стороны, антитело или его антигенсвязывающий фрагмент, предлагаемые в настоящей заявке, можно использовать для профилактики или лечения опухолей.
В некоторых вариантах осуществления опухоли включают CD38-положительную опухоль. В некоторых вариантах осуществления CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз. В некоторых вариантах осуществления опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
С другой стороны, в настоящей заявке предлагается способ профилактики или лечения опухолей. Способ включает введение нуждающемуся в этом индивидууму антитела или его антигенсвязывающего фрагмента, молекулы нуклеиновой кислоты, вектора, клетки и/или фармацевтической композиции по настоящей заявке.
В некоторых вариантах осуществления опухоли включают CD38-положительную опухоль. В некоторых вариантах осуществления CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз. В некоторых вариантах осуществления опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
С другой стороны, в настоящей заявке предлагается способ ингибирования связывания белка CD38 с лигандом CD38, и способ включает введение антитела или его антигенсвязывающего фрагмента, молекулы нуклеиновой кислоты, вектора и/или клетки по настоящей заявке.
В некоторых вариантах осуществления лиганд CD38 содержит CD31.
Дополнительные аспекты и преимущества настоящего изобретения станут очевидными для специалистов в данной области из следующего подробного описания, в котором показаны и описаны только иллюстративные варианты осуществления настоящего изобретения. Многочисленные модификации вариантов осуществления изобретения, описанного в настоящем документе, теперь будут очевидны специалистам в данной области без отклонения от раскрытия. Соответственно, чертежи и описание настоящего изобретения следует рассматривать как иллюстративные по своей природе, но не как ограничивающие.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Конкретные признаки изобретения, изложенные в данной заявке, представлены в прилагаемой формуле изобретения. Особенности и преимущества настоящего изобретения можно лучше понять, обратившись к иллюстративным вариантам осуществления и сопроводительным чертежам. Краткое описание чертежей выглядит следующим образом:
На фиг. 1 представлена физическая карта сборки антитела SG003 по настоящей заявке в вектор, экспрессирующий полноразмерное антитело.
На фиг. 2 представлена связывающая способность антитела SG003 по настоящей заявке по отношению к белку CD38.
На фиг. 3 представлены результаты специфического распознавания белка CD38 антителом SG003 по настоящей заявке.
Фиг. 4A-4D показывают связывающую способность антитела SG003 по настоящей заявке по отношению к белку CD38 на поверхности представленных клеток.
Фиг. 5A-5D показывают ADCC-активность антитела SG003 по настоящей заявке на представленных клетках.
На фиг. 6 представлено ингибирующее действие антитела SG003 по настоящей заявке на рост опухоли.
На фиг. 7 представлено воздействие введения антитела SG003 по настоящей заявке на коэффициент выживаемости мышей.
Фиг. 8A-8B показывают связывающую способность введенного антитела SG003 по настоящей заявке по отношению к молекулам CD38, происходящих из различных родов.
На фиг. 9 представлена связывающая способность антитела SG003 по настоящей заявке со случайными мутациями по отношению к молекулам CD38.
На фиг. 10 представлены подробности связывания эпитопов антитела SG003 по настоящей заявке с белком CD38.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Варианты осуществления настоящего изобретения описаны ниже посредством конкретных вариантов осуществления, и специалисты в данной области могут легко оценить другие преимущества и эффекты по настоящему изобретению из раскрытия настоящего изобретения.
По настоящей заявке термин «антитело» относится, как правило, к пептиду, способному специфически распознавать и/или нейтрализовать определенный антиген. Например, антитело может включать иммуноглобулин, состоящий, по меньшей мере, из двух тяжелых (H) цепей и двух легких (L) цепей, связанных друг с другом посредством дисульфидных связей, и может включать любую молекулу, содержащую антигенсвязывающий фрагмент. Термин «антитело» включает моноклональное антитело, фрагмент антитела или производное антитела, включая, но не ограничиваясь этим, человеческое антитело (полностью человеческое антитело), гуманизированное антитело, химерное антитело, одноцепочечное антитело (например, scFv), и антигенсвязывающий фрагмент антитела (например, Fab, Fab' и (Fab)2 фрагмент). Термин «антитело» дополнительно включает все рекомбинантные формы антитела, такие как антитело, экспрессируемое в прокариотической клетке, негликозилированное антитело и любой антигенсвязывающий фрагмент антитела по настоящей заявке и его производное. Каждая тяжелая цепь может состоять из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи. Каждая легкая цепь может состоять из вариабельной области легкой цепи (VL) и константной области легкой цепи. Области VH и VL могут быть далее подразделены на гипервариабельные области (известные как определяющие комплементарность области (CDR)), которые распределены между более консервативными областями, известными как каркасные области (FR). Каждая VH и VL может состоять из трех CDR и FR, которые могут быть расположены от аминоконца до карбоксиконца в порядке FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Вариабельные области тяжелой цепи и легкой цепи содержат связывающие домены, которые взаимодействуют с антигеном. Константные области антитела могут опосредовать связывание иммуноглобулина с тканью хозяина или фактором, который содержится во множестве клеток (например, эффекторных клеток) иммунной системы, и первым компонентом (Clq) классической системы комплемента.
По настоящей заявке термин «антителосвязывающий фрагмент» относится, как правило, к одному или нескольким фрагментам антитела, которые служат для специфического связывания с антигеном. Антигенсвязывающая функция антитела может быть реализована с помощью полноразмерного фрагмента антитела. Антигенсвязывающая функция антитела также может быть реализована следующим образом: при помощи тяжелой цепи, содержащей фрагмент Fv, ScFv, dsFv, Fab, Fab' или F(ab')2, или легкой цепи, содержащей фрагмент Fv, ScFv, dsFv, Fab, Fab' или F(ab')2; (1) Fab-фрагмента, то есть моновалентного фрагмента, содержащего домены VL, VH, CL и CH; (2) фрагмента F(ab’)2, двухвалентного фрагмента, содержащего два фрагмента Fab, связанных дисульфидной связью в шарнирной области; (3) фрагмента Fd, содержащего домены VH и CH; (4) Fv-фрагмента, содержащего домены VL и VH в одном плече антитела; (5) фрагмента dAb, содержащего домен VH (Ward et al., (1989) Nature 341: 544-546); (6) изолированной определяющей комплементарность области (CDR); и (7) комбинации двух или более изолированных CDR, которые необязательно связаны линкером. Кроме того, может быть дополнительно включена одновалентная одноцепочечная молекула Fv (scFv), образованная спариванием VL и VH (см. Bird et al., (1988) Science 242: 423-426; и Huston et al., (1988)) Proc.Natl.Acad.Sci. 85: 5879-5883). «Антигенсвязывающая группа» может дополнительно содержать иммуноглобулиновый слитый белок, который содержит связывающий домен, выбранный из группы, включающей (1) пептид связывающего домена, слитый с пептидом шарнирной области иммуноглобулина; (2) константную область тяжелой цепи иммуноглобулина CH2, слитую с шарнирной областью; и (3) константную область тяжелой цепи иммуноглобулина CH3, слитую с константной областью CH2.
По настоящей заявке, термины «белок CD38» и «антиген CD38» в настоящем документе используются как взаимозаменяемые и включают любой вариант, изотип и видовой гомолог CD38, которые в природе экспрессируются в клетках или экспрессируются в клетках, трансфицированных геном CD38. По настоящей заявке, CD38 может быть человеческим CD38 с номером доступа в GenBank BAA18966.1. По настоящей заявке, CD38 может быть обезьяньим CD38, таким как CD38 макаки с номером доступа в GenBank AAT36330.1. Белок CD38 по настоящей заявке также может быть известен как АДФ-рибозилциклаза 1, cADPr-гидролаза 1, Cd38-rs1, циклическая АДФ-рибозогидролаза 1, антиген I-19 или NIM-R5. «CD38+ клетка» относится, как правило, к клетке, которая экспрессирует белок CD38. Она также может быть известна как CD38-положительная клетка. «CD38- клетка» относится, как правило, к клетке, которая по существу не экспрессирует белок CD38.
По настоящей заявке термин «белок CD31» относится, как правило, к трансмембранному гликопротеину массой 130-140 кДа, обнаруженному на поверхности тромбоцитов, в соединениях культивируемых эндотелиальных клеток и в миелоидных клеточных линиях, а также известному как молекула адгезии-1 тромбоцитов и эндотелиальных клеток (PECAM-1/CD31). По настоящей заявке, CD31 может быть человеческим CD31 с номером доступа в GenBank NP_000433.4. CD31 может быть использован в качестве лиганда для CD38, чтобы играть роль в тромбозе и ангиогенезе.
По настоящей заявке термин «ADCC» представляет собой антителозависимую клеточно-опосредованную цитотоксичность (ADCC), и, как правило, означает, что клетка с активностью в отношении уничтожения клеток распознает сегмент Fc, покрывающий антиген-мишень, при помощи рецептора Fc (FcR), экспрессируемого на ее поверхности. С помощью ADCC эффекторные клетки иммунной системы активно растворяют клетки-мишени, чьи мембранные поверхностные антигены были связаны со специфическими антителами.
По настоящей заявке термин «CDC» представляет собой комплементзависимую цитотоксичность (CDC) и относится, как правило, к цитотоксическому эффекту, в котором задействован комплемент. То есть, специфическое антитело связывается с соответствующим антигеном на поверхности клеточной мембраны с образованием комплекса и активацией классического пути комплемента. Образующийся мембраноатакующий комплекс оказывает литическое действие на клетку-мишень.
По настоящей заявке термин «злокачественная опухоль», как правило, относится к физиологическому состоянию или описывает физиологическое состояние млекопитающих, которое, как правило, может характеризоваться нарушением регуляции клеточной пролиферации или выживаемости. Примеры злокачественной опухоли включают, но не ограничиваются ими, карциному, лимфому, бластому, саркому и лейкоз, а также лимфоидную злокачественную опухоль. Например, злокачественная опухоль может быть лимфомой.
По настоящей заявке термин «лимфома» относится, как правило, к злокачественной опухоли лимфатической системы. Возникновение лимфомы происходит из-за неконтролируемой пролиферации клеток лимфоузла или клеток лимфы и образования злокачественных клеток с аномальными способностями, которые могут вторгаться в другие ткани на всем протяжении тела. Лимфома имеет много подтипов, где два основных типа представляют собой лимфому Ходжкина и неходжкинскую лимфому. По настоящей заявке термин «лимфома Ходжкина» (ХЛ) относится, как правило, к классу лимфом, продуцируемых лимфоцитами из лейкоцитов. По настоящей заявке термин «неходжкинская лимфома» (НХЛ) относится, как правило, к другим классам лимфом, за исключением лимфомы Ходжкина.
По настоящей заявке термин «лейкоз» относится, как правило, к злокачественному пролиферативному заболеванию кроветворной системы, которое, как правило, относится к классу заболеваний, вызванных массивной пролиферацией и накоплением лейкозных клеток. Клональные лейкозные клетки в значительной степени пролиферируют и накапливаются в костном мозге и других гематопоэтических тканях из-за неконтролируемой пролиферации, нарушенной дифференцировки, ингибирования апоптоза или аналогичных механизмов, инфильтрируют другие негематопоэтические органы и при этом подавляют нормальную гематопоэтическую функцию. Клинически могут быть обнаружены анемия различной степени, кровотечение, лихорадка с инфекцией, а также увеличение печени, селезенки и лимфатических желез, и боль в костях.
По настоящей заявке термин «множественная миелома» (ММ) относится, как правило, к злокачественной опухоли, которая поражает костный мозг из-за аномальной пролиферации плазматических клеток. Множественная миелома вызывает накопление злокачественных клеток в костном мозге, в результате чего вытесняются здоровые клетки крови. Злокачественные клетки вместо нормальных антител вырабатывают ненормальные белки, которые могут вызывать осложнения.
По настоящей заявке термин «клетка Раджи» относится, как правило, к непрерывной клеточной линии человека, способной продуцировать штаммы вируса Эпштейна-Барр. Вирус трансформирует лимфоциты пуповины и индуцирует ранний антиген в клетке Раджи. Клетка Раджи широко используется в качестве хозяина для трансфекции, а также используется для понимания злокачественных опухолей гематопоэтических клеток и других клеток. Кроме того, поскольку клетка Раджи экспрессирует несколько рецепторов, которые экспрессируют определенные компоненты комплемента, а также Fc-рецепторы иммуноглобулинового белка G, она также используется для обнаружения иммунных комплексов.
По настоящей заявке термин «клетка Дауди» относится, как правило, к клеточной линии, полученной из лимфомы Беркитта. Хотя клетка Дауди имеет внутриклеточную тяжелую цепь класса I, на ее поверхности не экспрессируются молекулы лейкоцитарного антигена человека (HLA) класса I. Это связано с тем, что его ген, кодирующий белок β2-микросферы (β2m), является дефектным, так что у белка отсутствует транслируемая мРНК.
По настоящей заявке термин «клетка Рамос» относится, как правило, к клеточной линии лимфомы Беркитта. Клетка не несет штамма вируса Эпштейна-Барр и секретирует IgM.
По настоящей заявке термин «клетка RPMI8226» относится, как правило, к клеточной линии множественной миеломы.
По настоящей заявке термин «KD» используется взаимозаменяемо с «KD» и относится, как правило, к равновесной константе диссоциации для специфического взаимодействия антитело-антиген в M (моль/л). KD можно рассчитать, исходя из концентрации вещества AB и диссоциированных из него веществ A и B: KD= c(A)×c(B)/c(AB). Из этой формулы можно узнать, что чем больше значение KD, тем больше диссоциация и тем слабее аффинность между веществами A и B; наоборот, чем меньше значение KD, тем меньше диссоциация и тем сильнее аффинность между веществами A и B.
По настоящей заявке термин «моноклональное антитело» относится, как правило, к популяции по существу гомологичных антитела, то есть различные антитела в этой популяции одинаковы, за исключением природных мутаций, которые могут существовать в незначительных количествах. Моноклональное антитело является высокоспецифичным и непосредственно нацелено на единственный антигенный сайт. Например, моноклональное антитело можно получать с помощью гибридомной технологии или моноклональное антитело можно получать с помощью способа рекомбинантной ДНК в бактериях, эукариотах или растительных клетках. Моноклональное антитело можно также получить из фаговой библиотеки с использованием технологии, описанной, например, в Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., Mol. Biol., 222: 581-597 (1991).
По настоящей заявке термин «одноцепочечное антитело» (scFv) относится, как правило, к молекуле, образованной путем связывания вариабельной области тяжелой цепи антитела с вариабельной областью легкой цепи через олигопептидный линкер.
По настоящей заявке термин «химерное антитело» относится, как правило, к антителу, в котором часть аминокислотной последовательности каждой тяжелой цепи или легкой цепи гомологична соответствующей аминокислотной последовательности антитела определенного вида или принадлежит к определенной категории, и остальная часть цепи гомологична соответствующей последовательности у другого вида. Например, вариабельная область легкой цепи и тяжелой цепь происходят из вариабельной области вида животных (например, мышь, крыса и т.д.), в то время как константная часть гомологична последовательности антитела другого вида (например, человек). Например, для получения химерных антител, вариабельные области можно получить путем использования не принадлежащих человеку B-клеток или гибридомных клеток, а константную область, соединенную с ними, получить от человека. Преимущество вариабельной области заключается в простоте производства, и на ее специфичность не влияет источник, из которого получена соединенная с ней константная область. В то же время, поскольку константная область химерного антитела может быть получена от человека, возможность антитела вызывать иммунный ответ при инъекции ниже, чем у антитела, в котором константная область получена из источника, не принадлежащего человеку.
По настоящей заявке термин «гуманизированное антитело» относится, как правило, к химерному антителу, которое содержит меньше последовательностей, полученных из не принадлежащих человеку иммуноглобулиновых белков, чтобы снизить иммуногенность, когда гетерологичное антитело вводят людям, и поддерживать полную аффинность связывания с антигеном и специфичность антитела. Например, можно использовать прививку CDR и ее варианты(Jones et al., Nature 321: 522 (1986)), включающие «изменение формы» (Verhoeyen, et al., 1988 Science 239: 1534-1536; Riechmann, et al., 1988 Nature 332: 323-337; Tempest, et al., Bio/Technol 1991 9: 266-271), «гиперхимеризацию» (Queen и др., 1989 Proc Natl Acad Sci USA 86: 10029-10033; Co, et al., 1991 Proc Natl Acad Sci USA 88:2869-2873; Co, et al., 1992 J Immunol 148:1149-1154) и «маскировку поверхностных остатков» (Mark, et al., «Derivation of therapeutically active humanized and veneered anti-CD18 antibodies». In: Metcalf BW, Dalton BJ, eds. Cellular adhesion: molecular definition to therapeutic potential. New York: Plenum Press, 1994: 291-312), реконструкцию поверхности (патент США US5639641) и другие технические способы для гуманизации связывающих доменов из не принадлежащих человеку источников. Если другие области, такие как шарнирные области и домены константной области также происходят из не принадлежащих человеку источников, эти области также могут быть гуманизированы.
По настоящей заявке термин «эпитоп» относится, как правило, к антигенной детерминанте, то есть, группе молекул, распознаваемой иммунной системой (например, антителом). Например, эпитоп может быть прерывистыми трехмерными участками в антигене, распознаваемом иммунной системой. Эпитопы состоят, как правило, из химически активных поверхностных групп молекул (таких как боковые цепи аминокислот или сахаров) и, как правило, имеют определенные трехмерные структурные характеристики, а также определенные характеристики заряда. Эпитопы можно разделить на конформационные эпитопы и неконформационные эпитопы (линейные эпитопы) в соответствии с их структурой. Эпитопы могут состоять из непрерывных остатков или могут быть образованы дискретными остатками, которые становятся смежными из-за сворачивания антигенного полимера.
По настоящей заявке термин «IgG» относится, как правило, к иммуноглобулинам G. IgG представляет собой один из иммуноглобулинов человека, которые дополнительно включают IgA, IgM, IgD и lgE. В соответствии с антигенным отличием γ-цепи в молекуле IgG человеческий IgG имеет четыре подтипа: IgG1, IgG2, IgG3, IgG4. IgG играет важную роль в иммунитете. По настоящей заявке термин «IgG1» относится, как правило, к подтипу с наибольшей долей IgG, который имеет высокую аффинность к рецептору Fc.
По настоящей заявке термин «молекула нуклеиновой кислоты» относится, как правило, к изолированному нуклеотиду, дезоксирибонуклеотиду, рибонуклеотиду или его аналогу любой длины, который может быть выделен из природного окружения или синтезирован искусственно.
По настоящей заявке термин «вектор» относится, как правило, к молекуле нуклеиновой кислоты, способной к саморепликации в подходящем хозяине. Вектор может переносить вставленную молекулу нуклеиновой кислоты в клетки и/или между клетками. Вектор может включать векторы, которые в основном используются для вставки ДНК или РНК в клетку, в основном используются для копирования ДНК или РНК, и в основном используются для транскрипции ДНК или РНК и/или трансляции. Вектор может быть полинуклеотидом, который может быть транскрибирован и транслирован в пептид при введении в подходящую клетку. Как правило, вектор может давать желаемый продукт экспрессии посредством культивирования подходящих клеток, которые содержат вектор.
По настоящей заявке термин «клетка» относится, как правило, к отдельной клетке, клеточной линии или клеточной культуре, которые могут содержать или могли содержать плазмиду или вектор, включающие молекулу нуклеиновой кислоты по настоящей заявке, или могут экспрессировать антитело или его антигенсвязывающий фрагмент по настоящей заявке. «Клетка» может включать потомство одиночной клетки. Из-за естественной, случайной или преднамеренной мутации потомство клетки может не быть полностью идентичным исходной родительской клетке по морфологии или геному, при условии, что потомство клетки может экспрессировать антитело или его антигенсвязывающий фрагмент по настоящей заявке. Клетку можно получать путем трансфекции клеток in vitro вектором по настоящей заявке. Клетка может быть прокариотической клеткой (например, E. coli) или эукариотической клеткой (например, дрожжевая клетка, например, клетка COS, клетка яичника китайского хомяка (CHO), клетка HeLa, клетка HEK293, клетка COS-1, клетка NS0 или миеломная клетка). В некоторых вариантах осуществления клетка представляет собой клетку млекопитающего. Например, клетка млекопитающего может представлять собой клетку CHO-K1. По настоящей заявке термин «рекомбинантная клетка» относится, как правило, к клетке, в которую был введен рекомбинантный экспрессирующий вектор. Рекомбинантная клетка не только включает определенную специфическую клетку, но также включает потомство этих клеток.
В настоящей заявке, термины «белок A» и «ProA» взаимозаменяемы в настоящем документе, и включают белок A, полученный из его природного источника, белок A, полученный путем синтеза (например, с помощью пептидного синтеза или с помощью рекомбинантной технологии), и варианты, которые сохраняют связывающую способность белка. Белок A можно приобретать у Repligen, Pharmacia и Fermatech. Белок A, как правило, иммобилизован на твердофазной подложке носителе. Термин «ProA» также относится к колонке из смолы для аффинной хроматографии или к хроматографической матрице твердой подложки, с которой ковалентно связан белок A.
По настоящей заявке термин «приблизительно» относится, как правило, к отклонению в пределах 0,5-10% от указанного значения, такому как отклонение в пределах 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 5,5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5% или 10% от указанного количества.
По настоящей заявке термин «включать/включающий», как правило, означает «включающий», «содержащий» или «охватывающий». В некоторых случаях термин также означает «являться» или «состоять из».
Антитело, его антигенсвязывающий фрагмент или вариант
В аспекте, в настоящей заявке предлагается антитело или его антигенсвязывающий фрагмент или его вариант, который связывается с белком CD38 с величиной KD 1×10-9 M или ниже (например, величиной KD не больше чем приблизительно 1×10-9M, не больше чем приблизительно 9×10-10M, не больше чем приблизительно 8×10-10M, не больше чем приблизительно 7×10-10M, не больше чем приблизительно 6×10-10M, не больше чем приблизительно 5×10-10M, не больше чем приблизительно 4×10-10M, не больше чем приблизительно 3×10-10M, не больше чем приблизительно 2×10-10M, не больше чем 1×10-10M или не больше чем приблизительно 1×10-11M или ниже).
Антитело или его антигенсвязывающий фрагмент по настоящей заявке может уничтожать CD38+ клетки путем антителозависимой клеточно-опосредованной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC) и/или апоптоза.
Антитело или его антигенсвязывающий фрагмент или вариант по настоящей заявке может уничтожать и повреждать опухолевые клетки и/или ингибировать рост опухоли путем специфического связывания с белком CD38. Например, опухоль может включать CD38-положительную опухоль. Например, CD38-положительную опухоль можно выбирать из группы, включающей множественную миелому, лимфому и лейкоз. Альтернативно, например, опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина. Опухолевую клетку можно выбирать из группы, включающей клетку Раджи, клетку Дауди, клетку Рамос и клетку RPMI8226. По настоящей заявке, антитело или его антигенсвязывающий фрагмент погут уничтожать и повреждать клетки множественной миеломы, лимфомы, лейкоза, неходжкинской лимфомы и лимфомы Ходжкина или ингибировать рост множественной миеломы, лимфомы, лейкоза, неходжкинской лимфомы и лимфомы Ходжкина.
Антитело или его антигенсвязывающий фрагмент в настоящей заявке при связывании с белком C38 может связываться с одним или несколькими остатками, соответствующими аминокислотным остаткам 60-89 человеческого белка CD38. Например, аминокислотные остатки 60-89 человеческого белка CD38 показаны в SEQ ID NO:15.
По настоящей заявке, антитело или его антигенсвязывающий фрагмент может также связываться с аминокислотными остатками, соответствующими аминокислотным остаткам 90-119 человеческого белка CD38, соответствующими аминокислотным остаткам 150-159 человеческого белка CD38, или соответствующими аминокислотным остаткам 180-189 человеческого белка CD38.
По настоящей заявке, антитело или его антигенсвязывающий фрагмент может по существу не связываться с аминокислотными остатками, соответствующими аминокислотным остаткам 170-179 человеческого белка CD38, или не связываться с аминокислотными остатками, соответствующими аминокислотным остаткам 291-300 человеческого белка CD38.
Антитело по настоящей заявке может быть моноклональным антителом, одноцепочечным антителом, химерным антителом, гуманизированным антителом и/или полностью человеческим антителом. Антигенсвязывающий фрагмент антитела по настоящей заявке может быть фрагментом Fab, Fab’, F(ab)2, F(ab’)2, Fv и/или ScFv.
Белок CD38 по настоящей заявке может быть человеческим белком CD38 или обезьяньим белком CD38. Например, белок CD38 может не быть мышиным белком CD38, или может не быть крысиным белком CD38. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящей заявке по существу не связывается с мышиным белком CD38 или крысиным белком CD38.
Антитело или его антигенсвязывающий фрагмент в настоящей заявке может конкурировать с референсным антителом за связывание с белком CD38. Референсное антитело может содержать вариабельную область легкой цепи и вариабельную область тяжелой цепи. Например, вариабельная область легкой цепи референсного антитела может содержать LCDR1, LCDR2 и LCDR3, LCDR1 может содержать аминокислотную последовательность, показанную в SEQ ID NO:1; LCDR2 может содержать аминокислотную последовательность, показанную в SEQ ID NO:2; LCDR3 может содержать аминокислотную последовательность, показанную в SEQ ID NO:3, вариабельная область тяжелой цепи референсного антитела может содержать HCDR1, HCDR2 и HCDR3, HCDR1 может содержать аминокислотную последовательность, показанную в SEQ ID NO:4; HCDR2 может содержать аминокислотную последовательность, показанную в SEQ ID NO:5; и HCDR3 может содержать аминокислотную последовательность, показанную в SEQ ID NO:6.
По настоящей заявке, аминокислотная последовательность вариабельной области легкой цепи референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:7, и аминокислотная последовательность вариабельной области тяжелой цепи референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:8.
По настоящей заявке, легкая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:22. Например, легкая цепь референсного антитела может содержать аминокислотную последовательность, показанную в любой из SEQ ID NO:11, SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:20. Тяжелая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:23; Например, тяжелая цепь референсного антитела может содержать аминокислотную последовательность, показанную в любой из SEQ ID NO:13, SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:21.
Например, легкая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:11, и тяжелая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:13. Например, легкая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:16, и тяжелая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:17. Например, легкая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:18, и тяжелая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:19. Например, легкая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:20, и тяжелая цепь референсного антитела может содержать аминокислотную последовательность, показанную в SEQ ID NO:21.
Антитело или его антигенсвязывающий фрагмент в соответствии с настоящей заявкой может содержать легкая цепь антитела или ее фрагмент.
Например, легкая цепь антитела или ее фрагмент может содержать LCDR1, и LCDR1 может содержать аминокислотную последовательность, показанную в SEQ ID NO:1. Легкая цепь антитела или ее фрагмент может содержать LCDR2, и LCDR2 может содержать аминокислотную последовательность, показанную в SEQ ID NO:2. Легкая цепь антитела или ее фрагмент может содержать LCDR3, и LCDR3 может содержать аминокислотную последовательность, показанную в SEQ ID NO:3.
Легкая цепь антитела или ее фрагмент по настоящей заявке может содержать вариабельную область легкой цепи VL, и вариабельная область легкой цепи VL может содержать аминокислотную последовательность, показанную в SEQ ID NO:7.
По настоящей заявке, легкая цепь антитела или ее фрагмент может содержать константную область Igκ, например, может содержать константную область Igκ человека.
По настоящей заявке, легкая цепь антитела или ее фрагмент может содержать аминокислотную последовательность, показанную в SEQ ID NO:22:
EIVMTQSPASLSASLGQRAX20ISCRASX27SVSX31SAX34SYVHWYQQKSGQPPKLLIYLASX57X58X59SGVPARFSGSGSGTDFTLTIHPVESEDVATYYCHHSRX97X98PX100X101FGSGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:22), где X20=T или S; X27=S или N; X31=S или T; X34=F или Y; X57=N и D; X58=L или I; X59=E или Q; X97=E или Q; X98=L или V; X100=F или S; X101=T или S.
В некоторых вариантах осуществления по сравнению с легкой цепью антитела, показанной в SEQ ID NO:11, легкая цепь антитела или ее фрагмент, по меньшей мере, содержит замену аминокислоты/аминокислот, выбранную из группы, включающей:
(a) замену аминокислоты/аминокислот по X20, X27, X34, X58, X59, X97 и/или X100;
(b) замена аминокислоты/аминокислот по X34, X57, X59, X100 и/или X101; и
(c) замена аминокислоты/аминокислот по X27, X31 и/или X98.
В некоторых вариантах осуществления по сравнению с легкой цепью антитела, показанной в SEQ ID NO:11, легкая цепь антитела или ее фрагмент, по меньшей мере, содержит замену аминокислоты/аминокислот по X20, X27, X34, X58, X59, X97 и/или X100, где аминокислота по X20 может быть замещена T или S; аминокислота по X27 может быть замещена S или N; аминокислота по X34 может быть замещена F или Y; аминокислота по X58 может быть замещена L или I; аминокислота по X59 может быть замещена E или Q; аминокислота по X97 может быть замещена E или Q; и аминокислота по X100 может быть замещена F или S.
В некоторых вариантах осуществления по сравнению с легкой цепью антитела, показанной в SEQ ID NO:11, легкая цепь антитела или ее фрагмент, по меньшей мере, содержит замену аминокислоты/аминокислот по X34, X57, X59, X100 и/или X101, где аминокислота по X34 может быть замещена F или Y; аминокислота по X57 может быть замещена N или D; аминокислота по X59 может быть замещена E или Q; аминокислота по X100 может быть замещена F или S; и аминокислота по X101 может быть замещена T или S.
В некоторых вариантах осуществления по сравнению с легкой цепью антитела, показанной в SEQ ID NO:11, легкая цепь антитела или ее фрагмент, по меньшей мере, содержит замену аминокислоты/аминокислот по X27, X31 и/или X98, где аминокислота по X27 может быть замещена S или N; аминокислота по X31 может быть замещена S или T; и аминокислота по X98 может быть замещена L или V.
Например, легкая цепь антитела или ее фрагмент может содержать аминокислотную последовательность, показанную в любой из SEQ ID NO:11, SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:20.
Антитело или его антигенсвязывающий фрагмент по настоящей заявке может содержать тяжелую цепь антитела или ее фрагмент.
По настоящей заявке, тяжелая цепь антитела или ее фрагмент может содержать HCDR1, и the HCDR1 может содержать аминокислотную последовательность, показанную в SEQ ID NO:4. Тяжелая цепь антитела или ее фрагмент может содержать HCDR2, и HCDR2 может содержать аминокислотную последовательность, показанную в SEQ ID NO:5. Альтернативно, например, тяжелая цепь антитела или ее фрагмент может содержать HCDR3, и HCDR3 может содержать аминокислотную последовательность, показанную в SEQ ID NO:6.
Тяжелая цепь антитела или ее фрагмент может содержать вариабельную область тяжелой цепи VH, и вариабельная область тяжелой цепи VH может содержать аминокислотную последовательность, показанную в SEQ ID NO:8.
По настоящей заявке, тяжелая цепь антитела или ее фрагмент дополнительно содержит константную область человека. Например, константная область человека может содержать константную область IgG человека. Например, константная область IgG может содержать константную область IgG1 человека.
По настоящей заявке, тяжелая цепь антитела или ее фрагмент может содержать аминокислотную последовательность, показанную в SEQ ID NO:23:
QVQLLESGGGLVQPGGSLKLSCVASGX27X28FSLYX33MNWVRQAPGKGLEWIGKIX52P X54SSX57X58X59YX61PSX64KDKFFISRDNAKNTLYLQMTKVRSEDTALYYCARLX100IX102X103G GX106X107YWGQGTTLTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSG ALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTH TCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNA KTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVY TLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTV DKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO:23), где X27=F или Y; X28=D или N; X33=W или Y; X52=N, Q или S; X54=D, E или N; X57=T или S; X58=I или L; X59=N или Q; X61=T или S; X64=L или V; X100=W или Y; X102=A или G; X103=T или S; X106=F или Y; X107=D или N.
В некоторых вариантах осуществления по сравнению с легкой цепью антитела, показанной в SEQ ID NO: 13, легкая цепь антитела или ее фрагмент, по меньшей мере, содержит замену аминокислоты/аминокислот, выбранных из группы, включающей:
(a) замену аминокислоты/аминокислот по X27, X28, X33, X52, X54, X59, X102 и/или X103;
(b) замену аминокислоты/аминокислот по X52, X54, X61, X100 и/или X103; и
(c) замену аминокислоты/аминокислот по X52, X57, X58, X64, X106 и/или X107.
В некоторых вариантах осуществления по сравнению с легкой цепью антитела, показанной в SEQ ID NO: 13, легкая цепь антитела или ее фрагмент, по меньшей мере, содержит замену аминокислоты/аминокислот по X27, X28, X33, X52, X54, X59, X102 и/или X103, где аминокислота по X27 может быть замещена F или Y; аминокислота по X28 может быть замещена D или N; аминокислота по X33 может быть замещена W или Y; аминокислота по X52 может быть замещена N или Q; аминокислота по X54 может быть замещена D или E; аминокислота по X59 может быть замещена N или Q; аминокислота по X102 может быть замещена A или G; и аминокислота по X103 может быть замещена T или S.
В некоторых вариантах осуществления по сравнению с легкой цепью антитела, показанной в SEQ ID NO: 13, легкая цепь антитела или ее фрагмент, по меньшей мере, содержит замену аминокислоты/аминокислот по X52, X54, X61, X100 и/или X103, где аминокислота по X52 может быть замещена N или S; аминокислота по X54 может быть замещена D или N; аминокислота по X61 может быть замещена T или S; аминокислота по X100 может быть замещена W или Y; и аминокислота по X103 может быть замещена T или S.
В некоторых вариантах осуществления по сравнению с легкой цепью антитела, показанной в SEQ ID NO: 13, легкая цепь антитела или ее фрагмент, по меньшей мере, содержит замену аминокислоты/аминокислот по X52, X57, X58, X64, X106 и/или X107, где, аминокислота по X52 может быть замещена N или S; аминокислота по X57 может быть замещена T или S; аминокислота по X58 может быть замещена I или L; аминокислота по X64 может быть замещена L или V; аминокислота по X106 может быть замещена F или Y; и аминокислота по X107 может быть замещена D или N.
В некоторых вариантах осуществления тяжелая цепь антитела может содержать аминокислотную последовательность, показанную в любой из SEQ ID NO:13, SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:21.
В некоторых вариантах осуществления в антителе или его антигенсвязывающем фрагменте по настоящей заявке, LCDR1 может содержать аминокислотную последовательность, показанную в SEQ ID NO:1 или ее вариант; LCDR2 может содержать аминокислотную последовательность, показанную в SEQ ID NO:2 или ее вариант; the LCDR3 может содержать аминокислотную последовательность, показанную в SEQ ID NO:3 или ее вариант; и HCDR1 может содержать аминокислотную последовательность, показанную в SEQ ID NO:4 или ее вариант; HCDR2 может содержать аминокислотную последовательность, показанную в SEQ ID NO:5 или ее вариант; HCDR3 может содержать аминокислотную последовательность, показанную в SEQ ID NO:6 или ее вариант. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG003 или антитело с такими же LCDR1-3 и HCDR1-3. В некоторых вариантах осуществления легкая цепь антитела или его антигенсвязывающего фрагмента по настоящей заявке может содержать вариабельную область легкой цепи, вариабельная область легкой цепи может содержать аминокислотную последовательность, показанную в SEQ ID NO:7 или ее вариант; и тяжелая цепь может содержать вариабельную область тяжелой цепи, вариабельная область тяжелой цепи может содержать аминокислотную последовательность, показанную в SEQ ID NO:8 или ее вариант. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG003 или антитело с такой же вариабельной областью легкой цепи и вариабельной областью тяжелой цепи. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящей заявке может содержать легкую цепь и тяжелую цепь, легкая цепь может содержать аминокислотную последовательность, показанную в SEQ ID NO:11, и тяжелая цепь может содержать аминокислотную последовательность, показанную в SEQ ID NO:13. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG003 или аминокислотную последовательность такой же легкой цепи и тяжелой цепи.
В некоторых вариантах осуществления антитело по настоящей заявке может представлять собой SG003. LCDR1, LCDR2 и LCDR3 из антитела SG003 могут содержать аминокислотные последовательности, как показано в SEQ ID NO.1, SEQ ID NO.2 и SEQ ID NO.3, соответственно; VL может содержать аминокислотную последовательность, как показано в SEQ ID NO.7; HCDR1, LCDR2 и LCDR3 могут содержать аминокислотные последовательности, как показано в SEQ ID NO.4, SEQ ID NO.5 и SEQ ID NO.6, соответственно; VH может содержать аминокислотную последовательность, как показано в SEQ ID NO.8; легкая цепь может содержать аминокислотную последовательность, как показано в SEQ ID NO.11; и тяжелая цепь может содержать аминокислотную последовательность, как показано в SEQ ID NO.13.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящей заявке конкурирует с референсным антителом за связывание с белком CD38 (например, человеческим белком CD38 или обезьяньим белком CD38). Референсное антитело может содержать LCDR1, LCDR2, LCDR3 и HCDR1, HCDR2, HCDR3, и LCDR1 может содержать аминокислотную последовательность, как показано в SEQ ID NO:1; LCDR2 может содержать аминокислотную последовательность, как показано в SEQ ID NO:2; LCDR3 может содержать аминокислотную последовательность, как показано в SEQ ID NO:3; HCDR1 может содержать аминокислотную последовательность, как показано в SEQ ID NO:4; HCDR2 может содержать аминокислотную последовательность, как показано в SEQ ID NO:5; и HCDR3 может содержать аминокислотную последовательность, как показано в SEQ ID NO:6. В некоторых вариантах осуществления референсное антитело может содержать антитело SG003 или антитело с такими же LCDR1, LCDR2, LCDR3 и HCDR1, HCDR2, HCDR3. В некоторых вариантах осуществления референсное антитело может содержать вариабельную область легкой цепи и вариабельную область тяжелой цепи, вариабельная область легкой цепи может содержать аминокислотную последовательность, как показано в SEQ ID NO:7; и вариабельная область тяжелой цепи может содержать аминокислотную последовательность, как показано в SEQ ID NO:8. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG003 или антитело с такой же вариабельной областью легкой цепи и вариабельной областью тяжелой цепи. В некоторых вариантах осуществления референсное антитело может содержать легкую цепь и тяжелую цепь, легкая цепь может содержать аминокислотную последовательность, показанную в SEQ ID NO:11 и тяжелая цепь может содержать аминокислотную последовательность, как показано в SEQ ID NO:13. Например, референсное антитело или его антигенсвязывающий фрагмент может содержать антитело SG003 или антитело с такой же легкой цепью и тяжелой цепью.
Антитело или его антигенсвязывающий фрагмент в настоящей заявке может дополнительно содержать в аминокислотных последовательностях легкой цепи и/или тяжелой цепи одну или несколько случайных мутаций (например, одну или более, одну или несколько замен аминокислот). Например, антитело или его антигенсвязывающий фрагмент может содержать по одному или нескольким сайтам в каркасной области L-FR1~L-FR4 в вариабельной области легкой цепи одну или несколько случайных мутаций (например, одну или более, одну или несколько замен аминокислот), и/или содержать по одному или нескольким сайтам в каркасной области H-FR1~H-FR4 в вариабельной области тяжелой цепи одну или несколько случайных мутаций (например, одну или более, одну или несколько замен аминокислот). Например, после случайной мутации, легкая цепь антитела или его антигенсвязывающего фрагмента может содержать аминокислотную последовательность, показанную в любой из SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:20; и/или, тяжелая цепь антитела или его антигенсвязывающего фрагмента может содержать аминокислотную последовательность, показанную в любой из SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:21. Антитело к CD38, мутированное случайным образом, или его антигенсвязывающий фрагмент все еще имеют способность к специфическому связыванию с человеческим белком CD38 и обезьяньим белком CD38.
В некоторых вариантах осуществления легкая цепь антитела или его антигенсвязывающего фрагмента по настоящей заявке может содержать аминокислотную последовательность, как показано в SEQ ID NO:16; и тяжелая цепь может содержать аминокислотную последовательность, как показано в SEQ ID NO:17; альтернативно, легкая цепь антитела или его антигенсвязывающего фрагмента по настоящей заявке может содержать аминокислотную последовательность, как показано в SEQ ID NO:18; и тяжелая цепь может содержать аминокислотную последовательность, как показано в SEQ ID NO:19; альтернативно, легкая цепь антитела или его антигенсвязывающего фрагмента по настоящей заявке может содержать аминокислотную последовательность, как показано в SEQ ID NO:20; и тяжелая цепь может содержать аминокислотную последовательность, как показано в SEQ ID NO:21.
Белки, пептиды и/или аминокислотные последовательности, предлагаемые в настоящей заявке, следует также понимать как охватывающие следующий объем: вариант или гомолог, имеющий такую же или аналогичную функцию, что и белок или пептид.
По настоящей заявке вариант может быть белком или пептидом, полученным путем замены, делеции или добавления одной или нескольких аминокислот в аминокислотной последовательности белка и/или пептида (например, антитела или его фрагмента, который специфически связывается с белком CD38). Например, функциональный вариант может содержать белок или пептид с модификацией аминокислот путем замены, делеции и/или вставки, по меньшей мере, одной, например, 1-30, 1-20, или 1-10, или например, 1, 2, 3 , 4 или 5 аминокислот. Функциональный вариант может, в основном, сохранять биологическую активность белка или пептида до модификации (например, замещения, делеции или добавления). Например, функциональный вариант может сохранять, по меньшей мере, 60%, 70%, 80%, 90% или 100% биологической активности (например, антигенсвязывающей способности) исходного белка или пептида. Например, замена может быть консервативной заменой.
По настоящей заявке, гомолог может представлять собой белок или пептид, имеющий, по меньшей мере, приблизительно 85% (например, по меньшей мере, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или больше) гомологии последовательности с аминокислотной последовательностью белка и/или пептида (например, антитела или его фрагмента, который специфически связывается с белком CD38).
По настоящей заявке, гомология относится, как правило, к подобию, аналогии или ассоциации между двумя или более последовательностями. «Процент гомологии последовательностей» можно рассчитать следующим образом: две последовательности для выравнивания сравнивают в окне сравнения, чтобы определить число положений с одинаковыми основаниями нуклеиновой кислоты (например, A, T, C, G, I) или с одинаковыми аминокислотными остатками (например, Ala, Pro, Ser, Thr, Gly, Val, Leu, Ile, Phe, Tyr, Trp, Lys, Arg, His, Asp, Glu, Asn, Gln, Cys и Met) в двух последовательностях, чтобы получить число совпадающих положений. Число совпадающих положений делят на общее число положений в окне сравнения (то есть размер окна), и результат умножают на 100 для получения процента гомологии последовательностей. Выравнивание для определения процента гомологии последовательностей можно проводить в соответствии с различными способами, известными в данной области, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включающие любой алгоритм, необходимый для достижения максимального выравнивания в пределах сравниваемой полноразмерной последовательности или в пределах целевой области последовательности. Гомологию также можно определить следующими способами: FASTA и BLAST. Описание алгоритма FASTA можно найти в публикации W. R. Pearson and D. J. Lipman's «Improved Tools for Biological Sequence Comparison», Proceedings of the National Academy of Sciences (Proc. Natl. Acad. Sci.), 85: 2444-2448, 1988; и D. J. Lipman and W. R. Pearson's «Fast and Sensitive Protein Mass Similarity Search», Science, 227: 1435-1441, 1989. Описание алгоритма BLAST можно найти у S. Altschul, W. Gish, W. Miller, E. W. Myers and D. Lipman, «A Basic Local Alignment Search Tool», Journal of Molecular Biology, 215: 403-410, 1990.
Нуклеиновая кислота, вектор, клетка, и способ получения
В другом аспекте настоящей заявки дополнительно предлагается одна или несколько молекул выделенной нуклеиновой кислоты. Одна или несколько молекул нуклеиновой кислоты может содержать полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент по настоящей заявке. Например, полинуклеотид в одной или нескольких молекулах нуклеиновой кислоты может кодировать целое антитело или его антигенсвязывающий фрагмент, и может также кодировать его часть (например, одну или несколько из HCDR1-3, LCDR1-3, VL, VH, легкая цепь или тяжелая цепь).
По меньшей мере, одна из молекул нуклеиновой кислоты из молекул нуклеиновой кислоты по настоящей заявке может быть кодон-оптимизированной. Например, способ оптимизации кодонов включает, в качестве неограничивающих примеров, удаление редких кодонов, коррекцию содержания GC, повышение стабильности мРНК, коррекцию вторичной структуры мРНК, рациональную разработку линкера и коррекцию окружения стартового кодона.
В некоторых вариантах осуществления молекула нуклеиновой кислоты может содержать одну или несколько полинуклеотидных последовательностей, выбранных из группы, включающей SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:12 и SEQ ID NO:14., где SEQ ID NO:9 может кодировать вариабельную область легкой цепи антитела SG003 по настоящей заявке. SEQ ID NO:10 может кодировать вариабельную область тяжелой цепи антитела SG003 по настоящей заявке. SEQ ID NO:12 может кодировать легкую цепь антитела SG003 по настоящей заявке. SEQ ID NO:14 может кодировать тяжелую цепь антитела SG003 по настоящей заявке.
Молекула нуклеиновой кислоты по настоящей заявке может быть выделенной. Например, молекулу нуклеиновой кислоты можно получать или синтезировать следующими способами: (i) молекулу нуклеиновой кислоты можно амплифицировать in vitro, например, получать амплификацией при помощи полимеразной цепной реакции (ПЦР), (ii) молекула нуклеиновой кислоты можно получать путем клонирования и рекомбинации, (iii) молекулу нуклеиновой кислоты можно очищать, например, отделять путем отщепления и электрофоретического фракционирования в геле, или (iv) молекулу нуклеиновой кислоты можно синтезировать, например, путем химического синтеза. В некоторых вариантах осуществления выделенная нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, полученную при помощи технологии рекомбинантной ДНК.
По настоящей заявке нуклеиновую кислоту, кодирующую антитело или его антигенсвязывающий фрагмент, можно получать с помощью различных способов, известных в данной области. Эти способы включают, но не ограничиваются ими, способ с рестрикцией фрагментов или ПЦР с достройкой перекрывающихся участков с использованием синтетических олигонуклеотидов. Для получения подробной информации можно обратиться к Sambrook et al., Molecular cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989; и Ausube et al., Current Protocols in Molecular Biology, Greene Publishing и Wiley-Interscience, New York N.Y., 1993.
В другом аспекте настоящей заявки предлагается один или несколько векторов, которые содержат одну или несколько молекул нуклеиновой кислоты по настоящей заявке. Каждый вектор может содержать одну или несколько молекул нуклеиновой кислоты. Кроме того, вектор может содержать другие гены, такие как маркерный ген, который позволяет отобрать вектор в соответствующих клетках и при соответствующих условиях. Кроме того, вектор может дополнительно содержать элемент контроля экспрессии, который позволяет указанной кодирующей области быть надлежащим образом экспрессированной в соответствующем хозяине. Такой элемент контроля хорошо известен специалистам в данной области и может содержать промотор, участок связывания рибосомы, энхансер и другие элементы контроля, регулирующие транскрипцию гена или трансляцию мРНК и т.д. В некоторых вариантах осуществления последовательность для контроля экспрессии представляет собой регулируемый элемент. Конкретная структура последовательности для контроля экспрессии может варьироваться в зависимости от функций видов или типов клеток, но, как правило, содержит 5'-нетранскрибируемую последовательность и 5'- и 3'-нетранслируемую последовательность, участвующую в инициации транскрипции и трансляции, такую как TATA-бокс, кэпирующую последовательность, последовательность CAAT и т.д. Например, 5'-нетранскрибируемая последовательность для контроля экспрессии может включать промоторную область, а промоторная область может содержать промоторную последовательность для контроля транскрипции функциональной связанной с ней нуклеиновой кислоты. Последовательность для контроля экспрессии может также включать энхансерную последовательность или предшествующую активаторную последовательность. Одна или несколько молекул нуклеиновой кислоты по настоящей заявке могут быть функционально связаны с элементом контроля экспрессии.
Вектор может содержать, например, плазмиды, космиды, вирусы, бактериофаги или другие векторы, широко используемые, например, в генетической инженерии. Например, вектор представляет собой экспрессирующий вектор. Например, экспрессирующий вектор может быть вектором T-easy.
В другом аспекте настоящей заявки предлагается клетка, которая может содержать одну или несколько молекул нуклеиновой кислоты по настоящей заявке и/или один или несколько векторов по настоящей заявке. В некоторых вариантах осуществления каждая клетка или каждый тип клеток может содержать одну молекулу нуклеиновой кислоты или один вектор или один тип молекулы нуклеиновой кислоты или вектора по настоящей заявке. В некоторых вариантах осуществления каждая клетка или каждый тип клеток может содержать более одной (например, два или более) молекулы нуклеиновой кислоты или вектора или более одного типа (например, два или более типов) молекулы нуклеиновой кислоты или векторов по настоящей заявке. Например, вектор по настоящей заявке можно вводить в клетку, такую как эукариотические клетки, такую как растительные клетки, грибные или дрожжевые клетки, и т.д. Вектор по настоящей заявке можно вводить в клетку способом, известным в данной области, таким как электропорация, трансфекция с липофектином, трансфекция с липофектамином, и т.д. Например, клетка может быть клеткой CHO-S.
В другом аспекте настоящей заявки предлагается способ получения антитела или его антигенсвязывающего фрагмента. Способ может включать культивирование клетки по настоящей заявке в условиях, которые позволяют экспрессировать антитело или его антигенсвязывающий фрагмент. Например, целесообразно использовать соответствующие среды для культивирования, соответствующую температуру и время инкубации и так далее. Эти способы известны специалистам в данной области.
В некоторых случаях способ может дополнительно включать этап выделения и/или очистки антитела или его антигенсвязывающего фрагмента. Например, для аффинной хроматографии можно использовать агарозу с белком G или белком A, и антитела в геле и/или высокоэффективную жидкостную хроматографию и т.п. также можно использовать для очистки и выделения антител или антигенсвязывающих фрагментов по настоящей заявке. Например, также можно использовать аффинную очистку с белком A.
Фармацевтическая композиция и применение
В другом аспекте настоящей заявки предлагается фармацевтическая композиция, которая может содержать антитело, его антигенсвязывающий фрагмент или его вариант по настоящей заявке, молекулу нуклеиновой кислоты, вектор, или клетку, и необязательно фармацевтически приемлемый адъювант.
Фармацевтически приемлемый адъювант может содержать буферы, антиоксиданты, консерванты, низкомолекулярные пептиды, белки, гидрофильные полимеры, аминокислоты, сахара, хелатирующие средства, противоионы, комплексные соединения с металлами и/или неионные поверхностно-активные вещества, и т.д.
По настоящей заявке, фармацевтическую композицию можно формулировать для перорального введения, внутривенного введения, внутримышечного введения, введения in situ в месте опухоли, ингаляции, ректального введения, вагинального введения, трансдермального введения или введения через подкожное депо.
Фармацевтическую композицию можно использовать для ингибирования роста опухоли. Например, фармацевтическая композиция по настоящей заявке может ингибировать или смягчать развитие или прогрессирование заболеваний, уменьшать размер опухоли (или даже в основном устранять опухоль), и/или уменьшать и/или стабилизировать проявление болезни.
Фармацевтическая композиция по настоящей заявке может содержать терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента. Терапевтически эффективное количество может представлять собой дозу, необходимую для профилактики и/или лечения (по меньшей мере, частичного лечения) нарушения или состояния (например, злокачественной опухоли) и/или каких-либо осложнений у индивидуума с нарушением или состоянием или с риском развития нарушения или состояния.
С другой стороны, в настоящей заявке предлагается применение антитела или его антигенсвязывающего фрагмента для получения лекарственных средств для профилактики или лечения опухолей.
С другой стороны, в настоящей заявке предлагается антитело или его антигенсвязывающий фрагмент для профилактики или лечения опухолей.
С другой стороны, в настоящей заявке предлагается способ профилактики или лечения опухолей. Способ включает введение нуждающемуся в этом индивидууму антитела или его антигенсвязывающего фрагмента, молекулы нуклеиновой кислоты, вектора, клетки и/или фармацевтической композиции по настоящей заявке.
По настоящей заявке, опухоль может включать CD38-положительную опухоль. Например, CD38-положительную опухоль можно выбирать из группы, включающей множественную миелому, лимфому и лейкоз.
В некоторых вариантах осуществления опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
С другой стороны, в настоящей заявке предлагается способ для ингибирования связывания белка CD38 с лигандом CD38, и способ включает введение антитела или его антигенсвязывающего фрагмента, молекулы нуклеиновой кислоты, вектора и/или клетки по настоящей заявке.
По настоящей заявке, лиганд CD38 может содержать белок CD31.
В некоторых вариантах осуществления способ для ингибирования связывания белка CD38 с лигандом CD38 представляет собой способ in vitro или ex vivo.
Настоящая заявка может включать следующий вариант осуществления:
1. Антитело или его антигенсвязывающий фрагмент, который связывается с белком CD38 с величной KD 1×10-9M или ниже.
2. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 1, которое может уничтожать и повреждать опухолевые клетки и/или ингибировать рост опухоли путем специфического связывания с белком CD38.
3. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-2, которое может уничтожать CD38+ клетки путем антителозависимой клеточноопосредованной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC) и/или апоптоза.
4. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 3, где опухоли включают CD38-положительную опухоль.
5. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 4, где CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз.
6. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 3-5, где опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
7. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 3-6, где опухолевые клетки включают клетки, выбранные из группы, включающей клетку Раджи, клетку Дауди, клетку Рамос и клетку RPMI8226.
8. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-7, которое при связывании с белком CD38 связывается с одним или несколькими остатками, соответствующими аминокислотным остаткам 60-89 человеческого белка CD38.
9. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-8, где антитело выбран из группы, включающей моноклональное антитело, одноцепочечное антитело, химерное антитело, гуманизированное антитело и полностью человеческое антитело.
10. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-9, где антигенсвязывающий фрагмент выбран из группы, включающей фрагменты Fab, Fab’, F(ab)2, F(ab’)2, Fv и ScFv.
11. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-10, где белок CD38 является человеческим белком CD38 или обезьяньим белком CD38.
12. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-11, которое конкурирует с референсным антителом за связывание с белком CD38, где референсное антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, вариабельная область легкой цепи референсного антитела содержит LCDR1, LCDR2 и LCDR3, LCDR1 содержит аминокислотную последовательность, показанную в SEQ ID NO:1; LCDR2 содержит аминокислотную последовательность, показанную в SEQ ID NO:2; LCDR3 содержит аминокислотную последовательность, показанную в SEQ ID NO:3, вариабельная область тяжелой цепи референсного антитела содержит HCDR1, HCDR2 и HCDR3, HCDR1 содержит аминокислотную последовательность, показанную в SEQ ID NO:4; HCDR2 содержит аминокислотную последовательность, показанную в SEQ ID NO:5; и HCDR3 содержит аминокислотную последовательность, показанную в SEQ ID NO:6.
13. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 12, где вариабельная область легкой цепи референсного антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:7, и вариабельная область тяжелой цепи референсного антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:8.
14. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 12-13, где легкая цепь референсного антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:22; и тяжелая цепь референсного антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:23.
15. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-14, которое конкурирует с референсным антителом за связывание с белком CD38, где референсное антитело содержит легкую цепь и тяжелую цепь, где легкая цепь референсного антитела содержит аминокислотную последовательность, показанную в любой из SEQ ID NO:11, SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:20; и тяжелая цепь референсного антитела содержит аминокислотную последовательность, показанную в любой из SEQ ID NO:13, SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:21.
16. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-15, где антитело содержит легкую цепь антитела или ее фрагмент.
17. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 16, где легкая цепь антитела или ее фрагмент содержит LCDR1, и LCDR1 содержит аминокислотную последовательность, показанную в SEQ ID NO:1.
18. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 16-17, где легкая цепь антитела или ее фрагмент содержит LCDR2, и LCDR2 содержит аминокислотную последовательность, показанную в SEQ ID NO:2.
19. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 16-18, где легкая цепь антитела или ее фрагмент содержит LCDR3, и LCDR3 содержит аминокислотную последовательность, показанную в SEQ ID NO:3.
20. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 16-19, где легкая цепь антитела или ее фрагмент содержит вариабельную область легкой цепи VL, и вариабельная область легкой цепи VL содержит аминокислотную последовательность, показанную в SEQ ID NO:7.
21. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 16-20, где легкая цепь антитела или ее фрагмент дополнительно содержит константную область человека.
22. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 21, где человек константная область человека содержит константную область Igκ человека.
23. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 16-22, где легкая цепь антитела или ее фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO:22.
24. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 27, где легкая цепь антитела или ее фрагмент содержит аминокислотную последовательность, показанную в любой из SEQ ID NO:11, SEQ ID NO:16, SEQ ID NO:18 и SEQ ID NO:20.
25. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-24, где антитело содержит тяжелую цепь антитела или ее фрагмент.
26. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 25, где тяжелая цепь антитела или ее фрагмент содержит HCDR1, и HCDR1 содержит аминокислотную последовательность, показанную в SEQ ID NO:4.
27. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 25-26, где тяжелая цепь антитела или ее фрагмент содержит HCDR2, и HCDR2 содержит аминокислотную последовательность, показанную в SEQ ID NO:5.
28. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 25-27, где тяжелая цепь антитела или ее фрагмент содержит HCDR3, и HCDR3 содержит аминокислотную последовательность, показанную в SEQ ID NO:6.
29. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 25-28, где тяжелая цепь антитела или ее фрагмент содержит вариабельную область тяжелой цепи VH, и вариабельная область тяжелой цепи VH содержит аминокислотную последовательность, показанную в SEQ ID NO:8.
30. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 25-29, где тяжелая цепь антитела или ее фрагмент дополнительно содержит константную область человека.
31. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 30, где константная область человека содержит константную область IgG человека.
32. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 31, где константная область IgG содержит константную область IgG1 человека.
33. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 25-32, где, тяжелая цепь антитела содержит аминокислотную последовательность, показанную в SEQ ID NO:23.
34. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 33, где тяжелая цепь антитела содержит аминокислотную последовательность, показанную в любой из SEQ ID NO:13, SEQ ID NO:17, SEQ ID NO:19 и SEQ ID NO:21.
35. Одна или несколько изолированных молекул нуклеиновой кислоты, содержащих полинуклеотид, кодирующий антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-34.
36. Молекула нуклеиновой кислоты в соответствии с вариантом осуществления 35, где, по меньшей мере, одна из молекул нуклеиновой кислоты является кодон-оптимизированной.
37. Молекула нуклеиновой кислоты в соответствии с любым из вариантов осуществления 35-36, где молекула нуклеиновой кислоты содержит одну или несколько полинуклеотидных последовательностей, выбранных из группы, включающей SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:12 и SEQ ID NO:14.
38. Вектор, содержащий молекулу нуклеиновой кислоты в соответствии с любым из вариантов осуществления 35-37.
39. Клетка, содержащая молекулу нуклеиновой кислоты в соответствии с любым из вариантов осуществления 35-37 или вектор в соответствии с вариантом осуществления 38.
40. Способ получения антитела или его антигенсвязывающего фрагмента в соответствии с любым из вариантов осуществления 1-34, включающий культивирование клетки в соответствии с вариантом осуществления 39 в условиях, которые позволяют экспрессировать антитело или его антигенсвязывающий фрагмент.
41. Фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-34, молекулу нуклеиновой кислоты в соответствии с любым из вариантов осуществления 35-37, вектор в соответствии с любым из вариантов осуществления 38, или клетка в соответствии с вариантом осуществления 39, и необязательно фармацевтически приемлемый адъювант.
42. Применение антитела или его антигенсвязывающего фрагмента в соответствии с любым из вариантов осуществления 1-34 для получения лекарственных средств для профилактики или лечения опухолей.
43. Применение в соответствии с вариантом осуществления 42, где опухоли включают CD38-положительную опухоль.
44. Применение в соответствии с вариантом осуществления 43, где CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз.
45. Применение в соответствии с вариантами осуществления 42-44, где опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
46. Антитело или его антигенсвязывающий фрагмент в соответствии с любым из вариантов осуществления 1-34 для профилактики или лечения опухолей.
47. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 46, где опухоли включают CD38-положительную опухоль.
48. Антитело или его антигенсвязывающий фрагмент в соответствии с вариантом осуществления 47, где CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз.
49. Применение в соответствии с любым из вариантов осуществления 46-48, где опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
50. Способ профилактики или лечения опухолей у нуждающегося в этом индивидуума, включающий введение индивидууму антитела или его антигенсвязывающего фрагмента в соответствии с любым из вариантов осуществления 1-34, молекулы нуклеиновой кислоты в соответствии с любым из вариантов осуществления 35-37, вектора в соответствии с вариантом осуществления 38, клетки в соответствии с вариантом осуществления 39, и/или фармацевтической композиции в соответствии с вариантом осуществления 40.
51. Способ в соответствии с вариантом 50, где опухоли включают CD38-положительную опухоль.
52. Способ в соответствии с вариантом 51, где CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз.
53. Способ в соответствии с любым из вариантов осуществления 50-52, где опухоль выбрана из группы, включающей неходжкинскую лимфому и лимфому Ходжкина.
54. Способ для ингибирования связывания белка CD38 с лигандом CD38, включающий введение антитела или его антигенсвязывающего фрагмента в соответствии с любым из вариантов осуществления 1-34, молекулы нуклеиновой кислоты в соответствии с любым из вариантов осуществления 35-37, вектора в соответствии с вариантом осуществления 38, клетки в соответствии с вариантом осуществления 39.
55. Способ в соответствии с вариантом 54, где CD38 лиганд содержит CD31.
Не ограничиваясь какой-либо теорией, следующие примеры предназначены только для объяснения режима работы продуктов, способов или систем по настоящей заявке, но не предназначены для ограничения объема изобретения по настоящей заявке.
ПРИМЕРЫ
Пример 1: Получение гибридомных антител и клонирование генов
Иммунизация мышей: мышей balb/c (приобретенных у Beijing Vital River Labs Animal Technology Co., Ltd.) подкожно (s.c.) иммунизировали три раза адъювантом Фрейнда или неполным адъювантом Фрейнда, смешанным со 100 мкг растворимого антигена CD38 (приобретенного у Beijing Yiqiao Shenzhou Biotechnology Co., Ltd.). В сутки 0 использовали полный адъювант Фрейнда и в сутки 14 и сутки 28 использовали неполный адъювант Фрейнда. Клетки селезенки иммунизированных мышей сливали с миеломными клетками SP2/0 (ATCC) в соответствии со стандартным способом.
Гибридомное слияние: проводили слияние мышиных селезенок в соответствии с общепринятым в настоящее время способом гибридомного слияния, и проводили скрининг слитых гибридомных клеток (105 клеток на лунку) в соответствии со способом скрининга HAT. Через 12 суток супернатант подвергали анализу ELISA с использованием микропланшета, покрытого антигеном CD38. Предпочтительные клоны проводили через второй раунд субклонирования способом серийных разведений. Полученный штамм гибридомы, который стабильно экспрессировал интересующее антитело, сохраняли и использовали для конструирования библиотек.
Получение РНК: РНК получали с использованием набора для выделения РНК с реагентом TRIzol (приобретен у Life technologies). Для получения кДНК, кодирующей ген антитела, использовали набор для обратной транскрипции (приобретен у Beijing Quanshijin Biotechnology Co., Ltd.), и кДНК использовали в качестве матрицы для ПЦР-амплификации гена вариабельной области антитела. Клонировали вектор T-easy, и после клонирования полученные последовательности вариабельной области тяжелой цепи и легкой цепи секвенировали, чтобы затем получить соответствующие аминокислотные последовательности.
Пример 2: Гуманизация и получение антитела
Последовательности вариабельных областей тяжелой и легкой цепей мышиного антитела, полученные в Примере 1, подвергали выравниванию последовательностей с последовательностями человеческого антитела из базы данных NCBI при помощи способа для выравнивания последовательностей онлайн (IgBlast), предлагаемого NCBI, для выявления потенциальных сайтов для гуманизации. Далее, конструировали трехмерную структуру вариабельной области мышиного антитела при помощи SwissModel, для определения сайтов для гуманизации. Проводили гуманизацию по соответствующим сайтам для гуманизациидля получения последовательности гуманизированного антитела.
Гуманизированное антитело назвали SG003, и результаты секвенирования показали, что аминокислотные последовательности LCDR1-3 антитела SG003 показаны в SEQ ID NO.1, SEQ ID NO.2, и SEQ ID NO.3, соответственно; аминокислотная последовательность VL показана в SEQ ID NO.7; нуклеотидная последовательность, кодирующая VL, полученную путем оптимизации кодонов и обратной трансляции, показана в SEQ ID NO.9; аминокислотные последовательности HCDR1-3 антитела SG003 показаны в SEQ ID NO.4, SEQ ID NO.5 и SEQ ID NO.6, соответственно; аминокислотная последовательность VH показана в SEQ ID NO.8; и нуклеотидная последовательность, кодирующая VH, полученную путем оптимизации кодонов и обратной трансляции, показана в SEQ ID NO.10.
Аминокислотная последовательность легкой цепи антитела SG003 показана в SEQ ID NO.11; а кодирующая ее нуклеотидная последовательность показана в SEQ ID NO.12. Аминокислотная последовательность тяжелой цепи антитела SG003 показана в SEQ ID NO.13; а кодирующая ее нуклеотидная последовательность показана в SEQ ID NO.14.
Полученные гены вариабельных областей гуманизированного антитела клонировали в эукариотический экспрессирующий вектор pCMV-163, содержащий ген константной области IgG человека, для конструирования вектора, экспрессирующего целое антитело, с физической картой, показанной на Фиг. 1. На Фиг. 1, показаны различные компоненты эукариотического экспрессирующего вектора pCMV-163, известные в данной области и рекомбинированные в показанном порядке.
Набор с экспрессирующей системой ExpiCHOTM (приобретен у Thermo Fisher Scientific) применяли для трансфекции эукариотического экспрессирующего вектора, кодирующего антитело SG003 в клетки CHO-S для экспрессии, и собирали супернатант клеточной культуры, содержащий интересующий белок. Целевое антитело очищали с использованием общепринятой аффинной очистки с белком A.
Пример 3: Связывание гуманизированного антитела с целевым антигеном
Планшет для ELISA покрывали раствором PBS, содержащим 1 мкг/мл слитого белка CD38-His при 4°C в течение ночи. Планшет затем отмывали раствором PBS, содержащим 0,01% Tween-20 (PBST). 10% эмбриональную телячью сыворотку добавляли к PBST и блокировали при 37°C в течение часа. Затем добавляли различные концентрации антитела SG003 и контрольного антитела даратумумаб (DARZALEX) и проводили реакцию при 37°C в течение часа. После отмывания PBST добавляли меченные пероксидазой хрена (HRP) вторичные козлиные антитела к человеческому IgG (приобретенные у Thermo Fisher Scientific) и проводили реакцию при 37°C в течение 30 минут. Затем планшет отмывали с PBST (5 раз), и оставшиеся капли жидкости удаляли насколько возможно промокательной бумагой. В каждую лунку добавляли 100 мкл TMB (приобретенного в eBioscience) и помещали при комнатной температуре (20±5°C) в темноту в течение 1-5 минут. В каждую лунку добавляли 100 мкл останавливающего раствора 2N H2SO4 для гашения реакции с субстратом. Значение OD считывали при 450 нм с помощью микроспектрофотометра для чтения планшетов и анализировали связывающую способность антитела по отношению к целевому антигену CD38-His. Результаты показывают, что антитело SG003 показало более сильную активность связывания, чем контрольное антитело даратумумаб, и результаты показаны на фиг. 2. На фиг. 2, значение ЕС50 составляет 35,1±10,5 нг/мл, тогда как значение ЕС50 антитела даратумумаб составляет 150,9±105,8 нг/мл.
Пример 4: Определение аффинности гуманизированного антитела
Аффинность антитела анализировали при помощи прибора для взаимодействия биомакромолекул BIACORE (GE). Антитело к человеческому IgG-Fab (приобретено у Abcam) связывали с чипом, и использовали антитело к человеческому IgG для захвата антитела SG003. Концентрация антитела была установлена на 1 мкг/мл, время инъекции составило 60-150 секунд; антиген CD38 применяли в качестве подвижной фазы; использовали шесть градиентов концентрации (3,125, 6,25, 12,5, 25, 50, 100 нМ), время ассоциации составило 120 секунд; время диссоциации составило 1200 секунд; использовали 10 мМ буфер глицин-соляная кислота (pH 2,1) для регенерации в течение 60 секунд. Результаты показали, что антитело SG003 имеет аффинность, показанную в таблице 1.
(106⋅1/Ms)
(10-4⋅1/s)
(10-10M)
Пример 5: Специфическое распознавание целевого антигена гуманизированным антителом
Различные белки, такие как молочный белок (Beijing Bomed Biotechnology Co., Ltd.), BSA (BOVOGEN), CD19 (Beijing Yiqiao Shenzhou Biotechnology Co., Ltd.), TROP2 (Beijing Yiqiao Shenzhou Biotechnology Co., Ltd.), CD47 (Beijing Magpel Biotech Technology Co., Ltd.), CD38 (Beijing Yiqiao Shenzhou Biotechnology Co., Ltd.), Gas6 (R&D) и AXL (ACRO Biosystems) были соответственно использованы для покрытия стрипов для ELISA в концентрации 1 мг/мл при 4°C в течение ночи. После отмывания PBST, добавляли 10% эмбриональную телячью сыворотку и блокировали при 37°C в течение часа. Добавляли антитело SG003 и проводили реакцию при 37°C в течение часа. После отмывания PBST добавляли меченные пероксидазой хрена (HRP) вторичные козлиные антитела к человеческому IgG (приобретенные у Thermo Fisher Scientific) и проводили реакцию при 37°C в течение 30 минут. Затем планшет отмывали с PBST (5 раз), и оставшиеся капли жидкости удаляли насколько возможно промокательной бумагой. В каждую лунку добавляли 100 мкл TMB (eBioscience) и помещали при комнатной температуре (20±5°C) в темноту в течение 1-5 минут. В каждую лунку добавляли 100 мкл останавливающего раствора 2N H2SO4 для гашения реакции с субстратом, и считывали значение OD при 450 нм с помощью микроспектрофотометра для чтения планшетов для анализа связывающей способности антитело-белок.
Результаты показаны на фиг. 3. Результаты на фиг. 3 показывают, что антитело SG003 может специфически распознавать целевой антиген CD38, но не показывает реакции специфического связывания с молочным белком, BSA, CD19, TROP2, CD47, AXL, Gas6 и другими белками.
Пример 6: Связывание гуманизированного антитела с антигеном на клеточной поверхности
Применяли технологию проточного анализа для выявления связывания белков CD38 на поверхностях клеток Раджи, клеток Дауди, клеток Рамос и клеток RPMI8226 с антителом SG003 и контрольным антителом даратумумаб. Собирали клетки в фазе логарифмического роста, корректировали плотность клеток до 5×106 клетки/мл, и предварительно охлаждали на льду. Антитело SG003 и контрольное антитело даратумумаб разбавляли до различных концентраций предварительно охлажденным физиологическим раствором, содержащим 2% FBS. Брали 100 мкл клеток, и добавляли равный объем разведенного антитела для проведения реакции при 4°C в течение 30 минут в темноте. После завершения реакции клетки дважды отмывали. Клетки ресуспендировали в 100 мкл разведенных вторичных антител мыши к IgG, меченных фикоэритрином (приобретены у BD Pharmingen), и проводили реакцию при 4°C в темноте в течение 30 минут. После завершения реакции клетки дважды отмывали предварительно охлажденным физиологическим раствором, содержащим 2% FBS. Клетки ресуспендировали в 400 мкл 1% параформальдегида. Для анализа связывающей способности антител с антигенами на клеточной поверхности использовали проточную цитометрию (BD Calibur).
Результаты показывают, что антитело SG003 может специфически распознавать CD38 на поверхности клеток Раджи, клеток Дауди, клеток Рамос и клеток RPMI8226. Эта активность распознавания значительно выше, чем у контрольного антитела Даратумумаб и зависит от дозы, и значение EC50 для SG003 и клеток Раджи (фиг. 4A) было 34,4 нг/мл, а у Даратумумаба было 49,3 нг/мл. Значение EC50 для SG003 и клеток Дауди (фиг. 4B) было 36,7 нг/мл, а у Даратумумаба было 50,9 нг/мл. Значение EC50 для SG003 и клеток Рамос (фиг. 4C) было 81,5 нг/мл, а у Даратумумаба было 95,1 нг/мл. Значение EC50 для SG003 и клеток RPMI8226 (фиг. 4D) было 140,3 нг/мл, а у Даратумумаба было 176,5 нг/мл.
Пример 7: Антителозависмая клеточноопосредованная цитотоксичность (ADCC) гуманизированного антитела
Сначала, плотность клеток-мишеней (клетки Раджи, клетки Дауди, клетки Рамос и клетки RPMI8226), необходимые для эксперимента, корректировали до 2×105 клетки/мл, ресуспендиовали в буфере для ADCC (среда MEM без фенола красного+1% FBS), и добавляли в 96-луночный планшет (50 мкл/лунку). Затем, 100 мкл антитела SG003 в различных концентрациях добавляли в каждую лунку, перемешивали до гомогенности и инкубировали при 37°C в инкубаторе, содержащем 5% CO2, в течение 30 минут. Затем, плотность необходимых эффекторных клеток NK92MI-CD16a (приобретены у Huabo Bio) корректировали до 1,2×106 клетка/мл, и добавляли к лункам с клетками-мишенями в соотношении клеток-мишеней с эффекторными клетками 1:6. После смешивания, смесь инкубировали при 37°C в течение 4-6 часов в инкубаторе, содержащем 5% CO2, а затем удаляли часть исходного раствора (100 мкл/лунку) в 96-луночном планшете и добавляли в каждую лунку реакционную смесь с LDH из набора для детекции LDH (набор для детекции цитотоксичности, приобретен у Roche) (100 мкл/лунку). Проводили реакцию смеси при 37°C в течение 10 минут. Затем, добавляли останавливающий раствор (50 мкл/лунку) и осторожно перемешивали. Значение OD читали при 492 нм при помощи микроспектрофотометр для чтения планшетов, в качестве фонового значения использовали значение OD при 650 нм. В эксперименте также использовали следующие контрольные группы: контроль 1 был буфер для ADCC, контроль 2 был клетки-мишени+буфер для ADCC, контроль 3 был клетки-мишени+лизат+буфер для ADCC, и контроль 4 был клетки-мишени+эффекторные клетки+буфер для ADCC. Показатель специфического лизиса (%) = ((экспериментальная группа-контроль 4)/(контроль 3 - контроль 2)) ×100%. Кривую доза-эффект анализировали при помощи GraphPad Prism, версии 5.
Результаты показывают, что при тестировании с эффекторными клетками NK92MI-CD16a и клетками-мишенями Раджи антитело SG003 показало очень эффективную активность ADCC (см. Фиг. 5A), при этом значение EC50 для SG003 составило 6,97 нг/мл, а для Даратумумаба составило 17,0 нг/мл. Когда в качестве клетки-мишени использовали клетки Дауди, значение EC50 для SG003 составляло 0,72 нг/мл, а для Даратумумаба составляло 4,6 нг/мл (см. Фиг. 5B). В то же время антитело SG003 также показало эффективную активность ADCC в отношении клеток Рамос (см. Фиг. 5C). Значение EC50 для SG003 составило 0,69±0,007 нг/мл, а для Даратумумаба составило 3,01 нг/мл. Антитело SG003 также показало эффективную активность ADCC в отношении клеток RPMI8226 (см. Фиг. 5D) со значением EC50 для SG003 1,46 нг/мл, а для Даратумумаба 4,94 нг/мл.
Пример 8: Ингибирование опухолевой активности in vivo при помощи гуманизированного антитела
Модель опухоли была создана путем инокуляции клеток Раджи-Luc в мышей CB17 SCID, чтобы оценить эффект антитела SG003 в отношении ингибирования активности опухоли.
Для эксперимента выбирали самок мышей CB17 в возрасте 5-8-недель (приобретенных у Beijing Biocytogen Co., Ltd.). Клетка Раджи-Luc представляет собой стабильную клеточную линию, полученную Beijing Biocytogen Co., Ltd. на основе клетки Раджи, которая трансформировали репортерным геном люциферина. После восстановления и культивирования до необходимого количества, собирали клетки в логарифмической фазе роста и суспендировали до концентрации 5×106 клеток/0,2 мл. Мышам CB17 SCID инокулировали клетки через хвостовую вену в количестве 0,2 мл/мышь. После инокуляции наблюдали при помощи визуализатора для мелких животных за ростом опухоли и массой тела на Сутки 0 и Сутки 7. На Сутки 7, выбирали 18 мышей с умеренными сигналами визуализации опухоли и случайным образом распределяли по трем группам, по шесть мышей в каждой группе. Затем животным стали вводить инъекции. Была контрольная группа с физиологическим раствором, группа положительного контроля (Даратумумаб, приобретено у Johnson&Johnson) и экспериментальная группа (SG003) с дозировкой 200 мкг/кг, один раз в две недели, всего два раза. Затем наблюдали за массой тела, ростом опухоли и коэффициентом выживаемости у мышей.
Результаты показывают, что как Даратумумаб, так и SG003 могут переноситься экспериментальными животными. У животных в каждой группе наблюдали значительное ингибирующее действие на рост опухоли по сравнению с контрольной группой (см. Фиг. 6). На Сутки 7 после первого введения, средняя интенсивность флуоресценции в группах лечения Даратумумабом и антителом SG003 была соответственно (среднее 3,92×107, стандартная ошибка 4,04×106), (среднее 3,19×107, стандартная ошибка 9,32×106), что достоверно ниже средней интенсивности флуоресценции опухоли в контрольной группе (среднее 3,04×108, стандартная ошибка 4,29×107).
Затем дополнительно наблюдали за коэффициентом выживаемости животных. Среднее время выживания в контрольной группе составило 12 суток после распределения по группам, для Даратумумаба - 21 сутки, а для группы с SG003-28 суток. Группа с SG003 превосходит группу с Даратумумабом (см. Фиг.7).
Пример 9: Специфичность распознавания видов для химерного антитела
Внеклеточные белки CD38 (Beijing Yiqiao Shenzhou Biotechnology Co., Ltd.) разных видов - человека (Human), мыши (Mus), крыса (Rattus), яванского макака (Cynomolgus) и т.п. - использовали для покрытия стрипов для ELISA в концентрации 1 мг/мл при 4°C в течение ночи. После отмывания PBST добавляли 10% эмбриональную телячью сыворотку и блокировали при 37°C в течение часа. Добавляли исследуемые антитела SG003 и контрольные антитела Даратумумаб и проводили реакцию при 37°C в течение часа. После отмывания PBST добавляли меченные пероксидазой хрена (HRP) вторичные козлиные антитела к человеческому IgG (приобретенные у Thermo Fisher Scientific) и проводили реакцию при комнатной температуре в течение 30 минут. Планшет отмывали с PBST (5 раз), и оставшиеся капли удаляли насколько возможно промокательной бумагой. В каждую лунку добавляли 100 мкл TMB (приобретен у eBioscience) и помещали при комнатной температуре (20±5°C) в темноту на 1-5 минут. В каждую лунку добавляли 100 мкл останавливающего раствора 2N H2SO4 для гашения реакции с субстратом, и считывали значение OD при 450 нм с помощью микроспектрофотометра для чтения планшетов для анализа связывающей способности антитела к белку CD38 различных видов.
Результаты показывают, что антитело SG003 может распознавать молекулы белка CD38 человека и яванских макак, но не связывается с молекулами белка CD38 мышей и крыс; результаты показаны на Фиг. 8A.
Контрольное антитело Даратумумаб распознает только молекулы человеческого белка CD38 и не связывается с молекулами белка CD38 от мышей, крыс и яванских макак. Результаты показаны на Фиг. 8B.
Пример 10: Поддержание биологической активности гуманизированного антитела после мутации
С помощью технологии генетической инженерии последовательности вариабельной области антитела SG003 можно случайным образом мутировать для получения новых последовательностей вариабельной области антитела, и дополнительно получать новые последовательности легкой цепи и тяжелой цепи антитела. Например, для антитела, полученного после случайной мутации на основе антитела SG003, аминокислотная последовательность легкой цепи может быть SEQ ID NO:16, и аминокислотная последовательность тяжелой цепи может быть SEQ ID NO:17; или, аминокислотная последовательность легкой цепи может быть SEQ ID NO:18, и аминокислотная последовательность тяжелой цепи может быть SEQ ID NO:19; альтернативно, аминокислотная последовательность легкой цепи может быть SEQ ID NO:20, и аминокислотная последовательность тяжелой цепи может быть SEQ ID NO:21. Антитела, содержащие вышеописанную комбинацию легкой цепи и тяжелой цепи после мутации, называются SG003M1-3 в последовательности (например, аминокислотная последовательность легкой цепи антитела SG003M1 представляет собой SEQ ID NO:16, и аминокислотная последовательность тяжелой цепи представляет собой SEQ ID NO:17).
Новое антитело получали при помощи способа из Примера 2, и оценивали активность антитела при помощи способа из Примера 4. Случайным образом мутированное антитело SG003M1-3 может распознавать антиген CD38 (см. Фиг. 9). Определили, что величина EC50 SG003M1 составила 15,72 нг/мл, величина EC50 SG003M2 составила 27,75 нг/мл, и величина EC50 SG003M3 составила 6,10 нг/мл. Выбирали случайным образом SG003M1 и определяли результаты аффинности, как показано в таблице 2.
(106⋅1/Ms)
(10-4⋅1/s)
(10-10 M)
Пример 11: Подтверждение эпитопов для гуманизированного антитела
Для анализа эпитопов антитела SG003, распознающего антиген CD38, использовали способ картирования эпитопов. Мутанты антигена CD38 (Таблица 3, где все мутированные аминокислоты представляют собой аланин) были разработаны с помощью способа аланиновой замены, а CD38 дикого типа, а также различные мутантные гены получали путем полимеразной цепной реакции (ПЦР) и перекрывающихся праймеров (перекрывание) и других методов молекулярной биологии. После разделения и восстановления путем электрофореза в агарозном геле антитело или мутанты расщепляли ферментами для рестрикции HindIII и NheI и клонировали в вектор pEGFP-N1. После секвенирования по правильным последовательностям использовали набор для трансфекции HighGene (ABclonal) для трансфекции вектора, содержащего CD38 дикого типа или мутантный ген, в клетки 293T в соответствии со способом, описанным в инструкции для набора. Через 48 часов после трансфекции клетки собирали путем отщепления трипсином, чтобы приготовить суспензию из одиночных клеток. Клетки-мишени и антитело SG003 инкубировали при рабочей концентрации 10 мкг/мл в течение 30 минут при постоянной температуре 4°C. Затем добавляли GAH-IgG Fc PE (Invitrogen, кат. №: 12-4998-82) и инкубировали при постоянной температуре 4°C в течение 30 минут, и измеряли интенсивность флуоресценции каналов для FITC и PE проточной цитометрией, где интенсивность флуоресценции для FITC представляет собой уровень экспрессии молекулы CD38 и ее мутантов, а интенсивность флуоресценции для PE представляет собой силу связывания антитела SG003 с антигеном.
Результаты проточной цитометрии на Фиг. 10 показывают, что антитело SG003 не связывается с мутантами 21, 22, и 23, что позволяет предположить, что аминокислотная область 60-89 белка CD38 является основным эпитопом, который распознается антителом SG003.
Вышеизложенное подробное описание предоставлено для объяснения и примера, и не предназначено для ограничения объема прилагаемой формулы изобретения. Множество вариантов осуществления, перечисленных в настоящем документе, очевидны специалистам в данной области и находятся в объеме прилагаемой формулы изобретения и ее эквивалентов.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> HANGZHOU SUMGEN BIOTECH CO., LTD.; SUMGEN MAB (BEIJING)
BIOTECH CO., LTD.
<120> АНТИТЕЛА К БЕЛКУ CD38 И ИХ ПРИМЕНЕНИЕ
<130> 0070-PA-008RU
<160> 23
<170> PatentIn version 3.5
<210> 1
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR1
<400> 1
Arg Ala Ser Ser Ser Val Ser Ser Ser Ala Phe Ser Tyr Val His
1 5 10 15
<210> 2
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR2
<400> 2
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 3
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR3
<400> 3
His His Ser Arg Glu Leu Pro Phe Thr
1 5
<210> 4
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR1
<400> 4
Leu Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR2
<400> 5
Lys Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu Lys
1 5 10 15
Asp
<210> 6
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR3
<400> 6
Leu Trp Ile Ala Thr Gly Gly Phe Asp Tyr
1 5 10
<210> 7
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> VL
<400> 7
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Ala Phe Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Leu Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 8
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> VH
<400> 8
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Ala Thr Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 9
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Кодон-оптимизированная нуклеотидная последовательность VL
<400> 9
gagatcgtga tgacccagag ccctgccagc ctgagcgcca gcctgggcca gagggccacc
60
atcagctgca gggccagcag cagcgtgagc agcagcgcct tcagctacgt gcactggtac
120
cagcagaaga gcggccagcc tcctaagctg ctgatctacc tggccagcaa cctggagagc
180
ggcgtgcctg ccaggttcag cggcagcggc agcggcaccg acttcaccct gaccatccac
240
cctgtggaga gcgaggacgt ggccacctac tactgccacc acagcaggga gctgcctttc
300
accttcggca gcggcaccaa gctggagatc aag
333
<210> 10
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Кодон-оптимизированная нуклеотидная последовательность VH
<400> 10
caggtgcagc tgctggagag cggcggcggc ctggtgcagc ctggcggcag cctgaagctg
60
agctgcgtgg ccagcggctt cgacttcagc ctgtactgga tgaactgggt gaggcaggcc
120
cctggcaagg gcctggagtg gatcggcaag atcaaccctg acagcagcac catcaactac
180
acccctagcc tgaaggacaa gttcttcatc agcagggaca acgccaagaa caccctgtac
240
ctgcagatga ccaaggtgag gagcgaggac accgccctgt actactgcgc caggctgtgg
300
atcgccaccg gcggcttcga ctactggggc cagggcacca ccctgaccgt gagcagc
357
<210> 11
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> легкая цепь SG003
<400> 11
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Ala Phe Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Leu Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 12
<211> 657
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность легкой цепи SG003
<400> 12
gagatcgtga tgacccagag ccctgccagc ctgagcgcca gcctgggcca gagggccacc
60
atcagctgca gggccagcag cagcgtgagc agcagcgcct tcagctacgt gcactggtac
120
cagcagaaga gcggccagcc tcctaagctg ctgatctacc tggccagcaa cctggagagc
180
ggcgtgcctg ccaggttcag cggcagcggc agcggcaccg acttcaccct gaccatccac
240
cctgtggaga gcgaggacgt ggccacctac tactgccacc acagcaggga gctgcctttc
300
accttcggca gcggcaccaa gctggagatc aagcgtacgg tggctgcacc atctgtcttc
360
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg
420
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg
480
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc
540
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc
600
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgttag
657
<210> 13
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> тяжелая цепь SG003
<400> 13
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Ala Thr Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 14
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность тяжелой цепи SG003
<400> 14
caggtgcagc tgctggagag cggcggcggc ctggtgcagc ctggcggcag cctgaagctg
60
agctgcgtgg ccagcggctt cgacttcagc ctgtactgga tgaactgggt gaggcaggcc
120
cctggcaagg gcctggagtg gatcggcaag atcaaccctg acagcagcac catcaactac
180
acccctagcc tgaaggacaa gttcttcatc agcagggaca acgccaagaa caccctgtac
240
ctgcagatga ccaaggtgag gagcgaggac accgccctgt actactgcgc caggctgtgg
300
atcgccaccg gcggcttcga ctactggggc cagggcacca ccctgaccgt gagcagcgct
360
agcaccaagg gcccatcggt cttccccctg gcaccctcct ccaagagcac ctctgggggc
420
acagcggccc tgggctgcct ggtcaaggac tacttccccg aaccggtgac ggtgtcgtgg
480
aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca gtcctcagga
540
ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac ccagacctac
600
atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagaaagt tgagcccaaa
660
tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct ggggggaccg
720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag
780
gtcacgtgcg tggtggtgga cgtgagccac gaagaccccg aggtcaagtt caactggtac
840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc
900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag
960
tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac catctccaaa
1020
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg ggatgagctg
1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc
1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg
1200
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag
1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag
1320
aagagcctct ccctgtctcc gggtaaatga
1350
<210> 15
<211> 30
<212> Белок
<213> Homo sapiens
<400> 15
Pro Glu Thr Val Leu Ala Arg Cys Val Lys Tyr Thr Glu Ile His Pro
1 5 10 15
Glu Met Arg His Val Asp Cys Gln Ser Val Trp Asp Ala Phe
20 25 30
<210> 16
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутированная легкая цепь 1
<400> 16
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Ser Ile Ser Cys Arg Ala Ser Asn Ser Val Ser Ser Ser
20 25 30
Ala Tyr Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Ile Gln Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Gln Leu Pro Ser Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 17
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутированная тяжелая цепь 1
<400> 17
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Tyr Asn Phe Ser Leu Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Gln Pro Glu Ser Ser Thr Ile Gln Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Gly Ser Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 18
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутированная легкая цепь 2
<400> 18
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Ala Tyr Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asp Leu Gln Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Leu Pro Tyr Ser Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 19
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутированная тяжелая цепь 2
<400> 19
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Ser Pro Asn Ser Ser Thr Ile Asn Tyr Ser Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Tyr Ile Ala Ser Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 20
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутированная легкая цепь 3
<400> 20
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Asn Ser Val Ser Thr Ser
20 25 30
Ala Phe Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 21
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутированная тяжелая цепь 3
<400> 21
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Ser Pro Asp Ser Ser Ser Leu Asn Tyr Thr Pro Ser Val
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Ala Thr Gly Gly Tyr Asn Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 22
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> формула легкой цепи
<220>
<221> X20
<222> (20)..(20)
<223> X20=T или S
<220>
<221> X27
<222> (27)..(27)
<223> X27=S или N
<220>
<221> X31
<222> (31)..(31)
<223> X31=S или T
<220>
<221> X34
<222> (34)..(34)
<223> X34=F или Y
<220>
<221> X57
<222> (57)..(57)
<223> X57=N или D
<220>
<221> X58
<222> (58)..(58)
<223> X58=L или I
<220>
<221> X59
<222> (59)..(59)
<223> X59=E или Q
<220>
<221> X97
<222> (97)..(97)
<223> X97=E или Q
<220>
<221> X98
<222> (98)..(98)
<223> X98=L или V
<220>
<221> X100
<222> (100)..(100)
<223> X100=F или S
<220>
<221> X101
<222> (101)..(101)
<223> X101=T или S
<400> 22
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Xaa Ile Ser Cys Arg Ala Ser Xaa Ser Val Ser Xaa Ser
20 25 30
Ala Xaa Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Xaa Xaa Xaa Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Xaa Xaa Pro Xaa Xaa Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 23
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> формула тяжелой цепи
<220>
<221> X27
<222> (27)..(27)
<223> X27=F или Y
<220>
<221> X28
<222> (28)..(28)
<223> X28=D или N
<220>
<221> X33
<222> (33)..(33)
<223> X33=W или Y
<220>
<221> X52
<222> (52)..(52)
<223> X52=N, Q или S
<220>
<221> X54
<222> (54)..(54)
<223> X54=D, E или N
<220>
<221> X57
<222> (57)..(57)
<223> 57=T или S
<220>
<221> X58
<222> (58)..(58)
<223> X58=I или L
<220>
<221> X59
<222> (59)..(59)
<223> X59=N или Q
<220>
<221> X61
<222> (61)..(61)
<223> X61=T или S
<220>
<221> X64
<222> (64)..(64)
<223> X64=L или V
<220>
<221> X100
<222> (100)..(100)
<223> X100=W или Y
<220>
<221> X102
<222> (102)..(102)
<223> X102=A или G
<220>
<221> X103
<222> (103)..(103)
<223> X103=T или S
<220>
<221> X106
<222> (106)..(106)
<223> X106=F или Y
<220>
<221> X107
<222> (107)..(107)
<223> X107=D или N
<400> 23
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Xaa Xaa Phe Ser Leu Tyr
20 25 30
Xaa Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Xaa Pro Xaa Ser Ser Xaa Xaa Xaa Tyr Xaa Pro Ser Xaa
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Xaa Ile Xaa Xaa Gly Gly Xaa Xaa Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800923C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811120C2 |
| АНТИТЕЛО ПРОТИВ ПРОТЕИНТИРОЗИНФОСФАТАЗЫ σ РЕЦЕПТОРНОГО ТИПА ЧЕЛОВЕКА | 2012 |
|
RU2715642C2 |
| АНТИТЕЛО ПРОТИВ CD79B, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2817143C2 |
| АНТИ-TSLP АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2834227C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ CD3E/BCMA И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800164C2 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| АНТИТЕЛО К CLDN-18.2 И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2829997C1 |
| СВЯЗЫВАНИЕ СЛИТОГО БЕЛКА С БЕЛКОМ CD47 И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2787521C2 |
| АНТИТЕЛО К PD-L1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778085C2 |

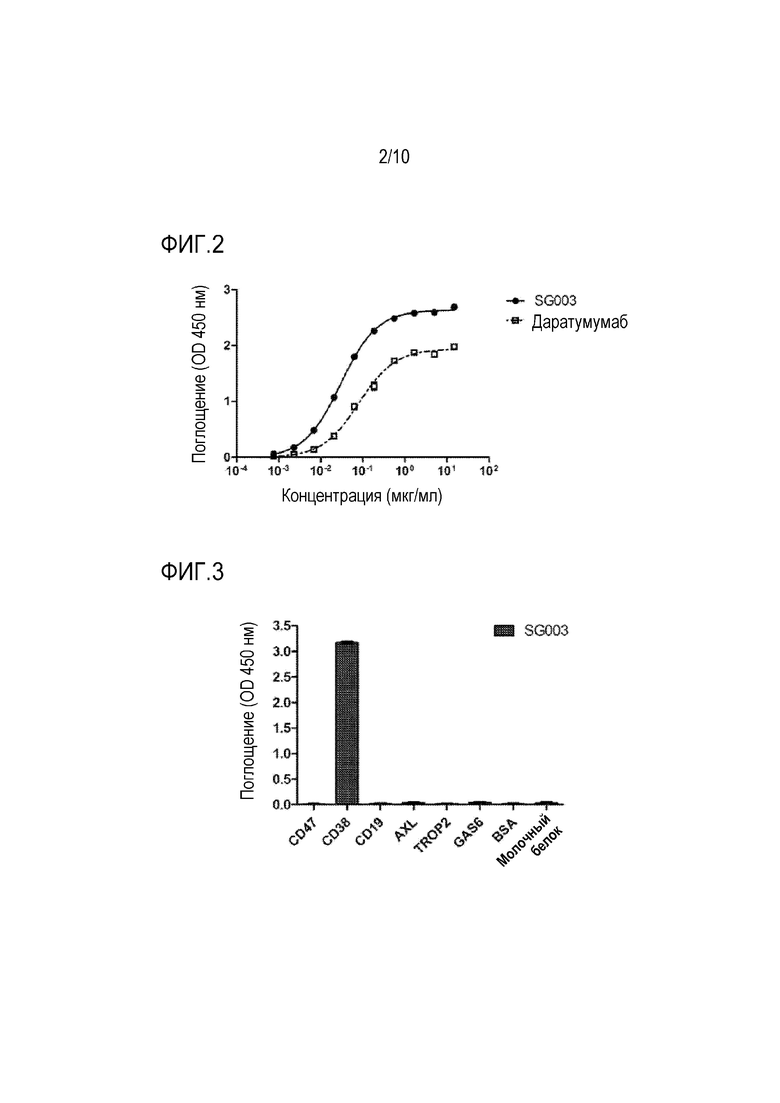
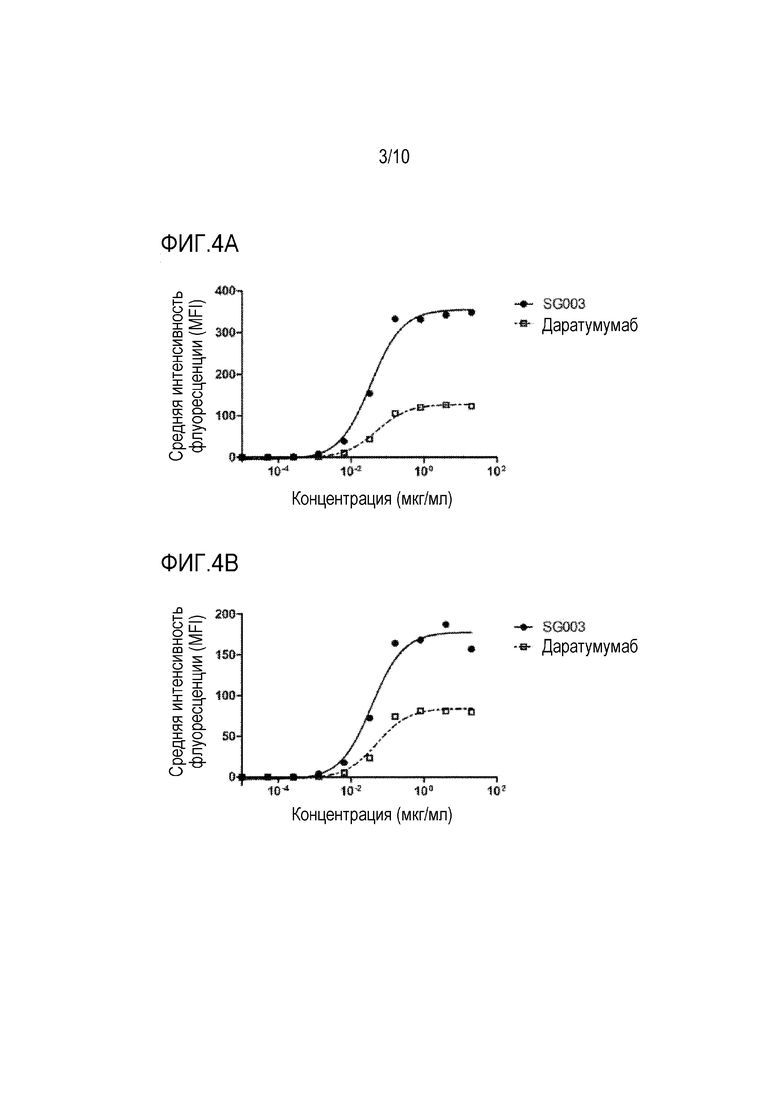
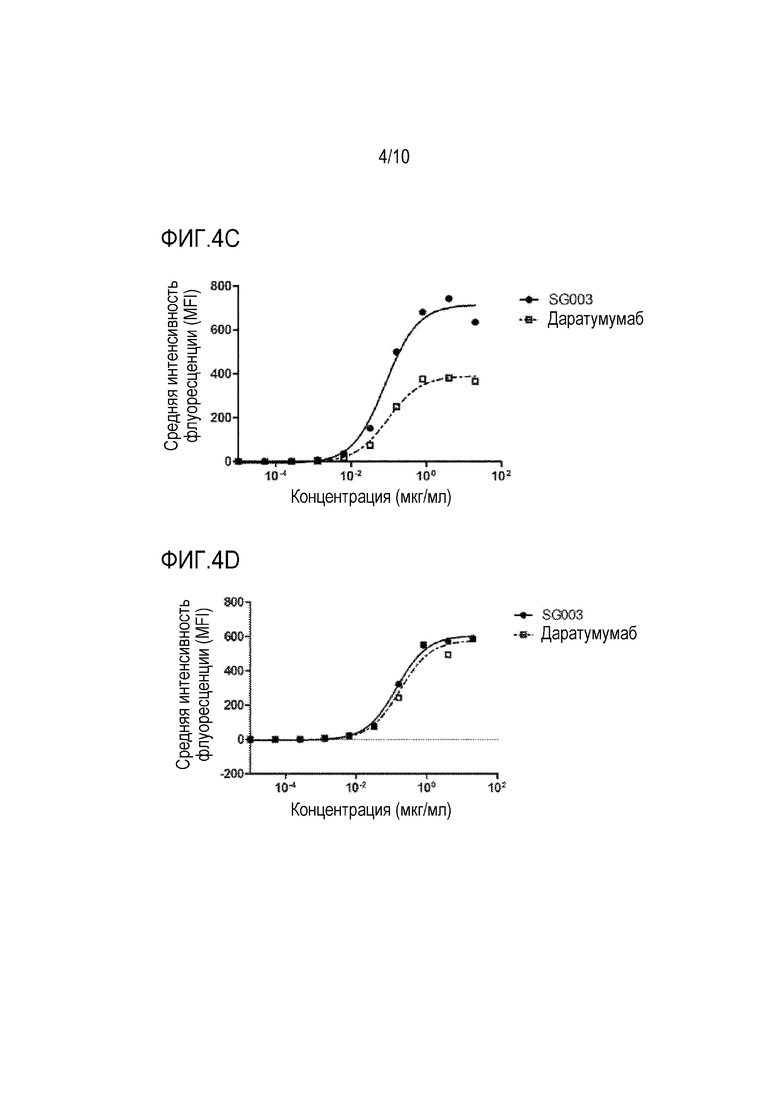
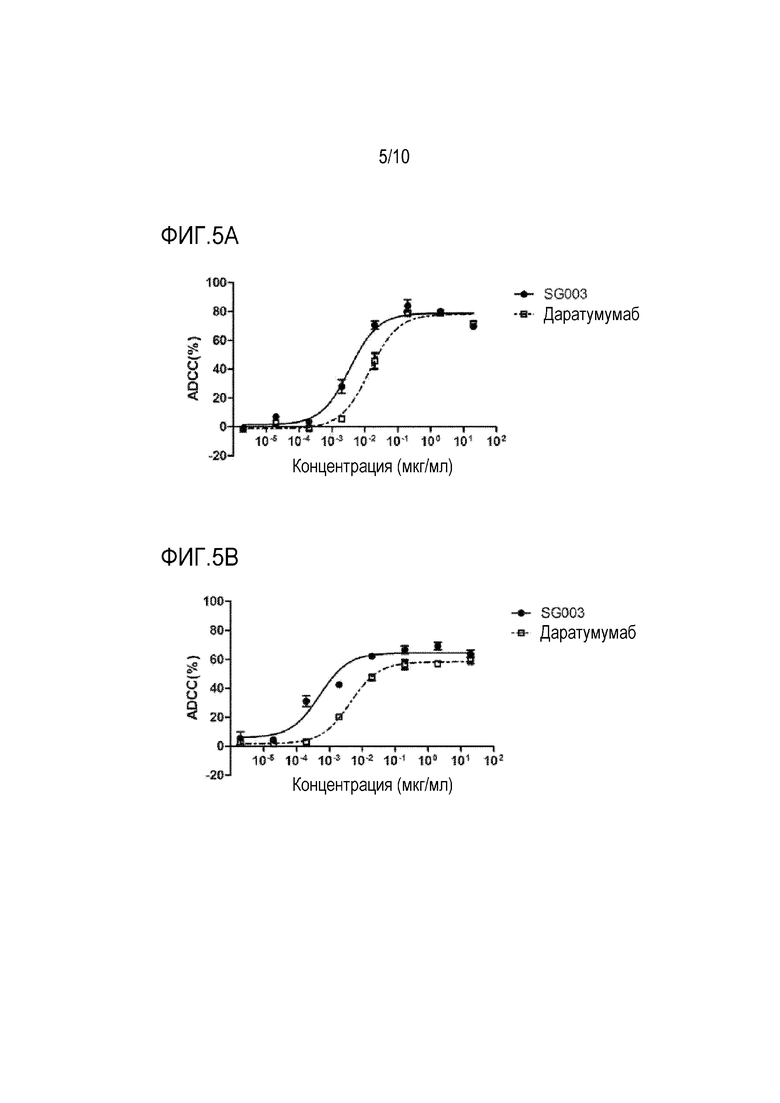
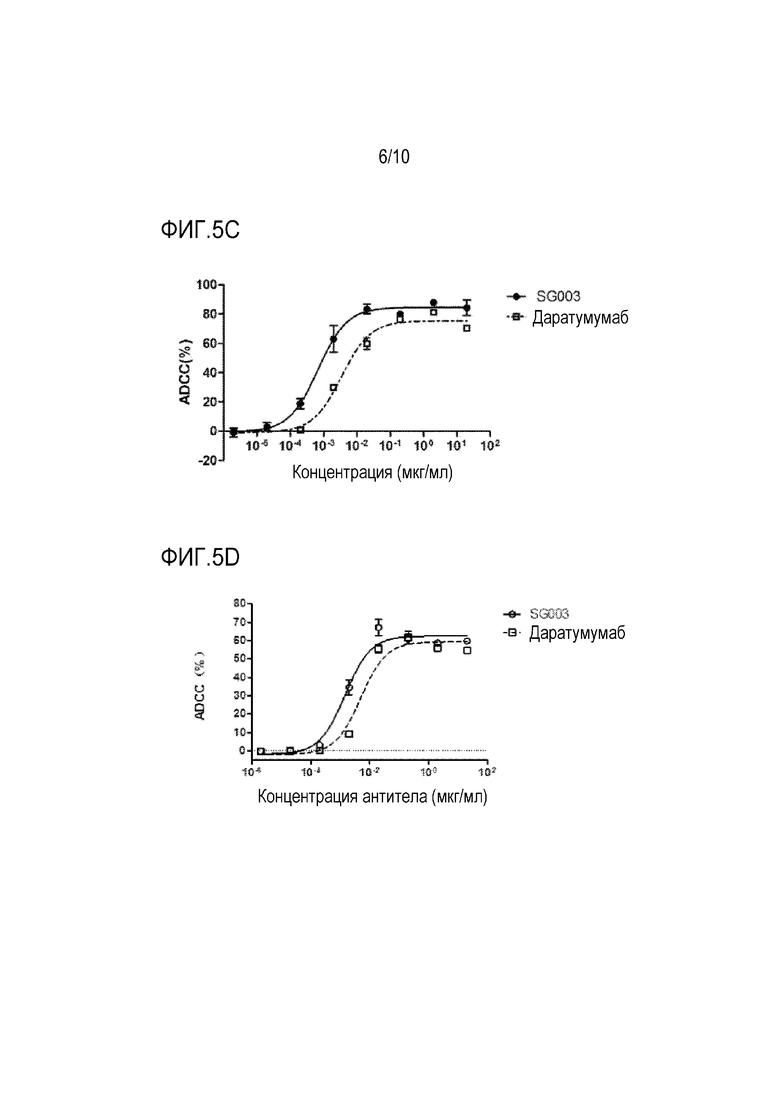

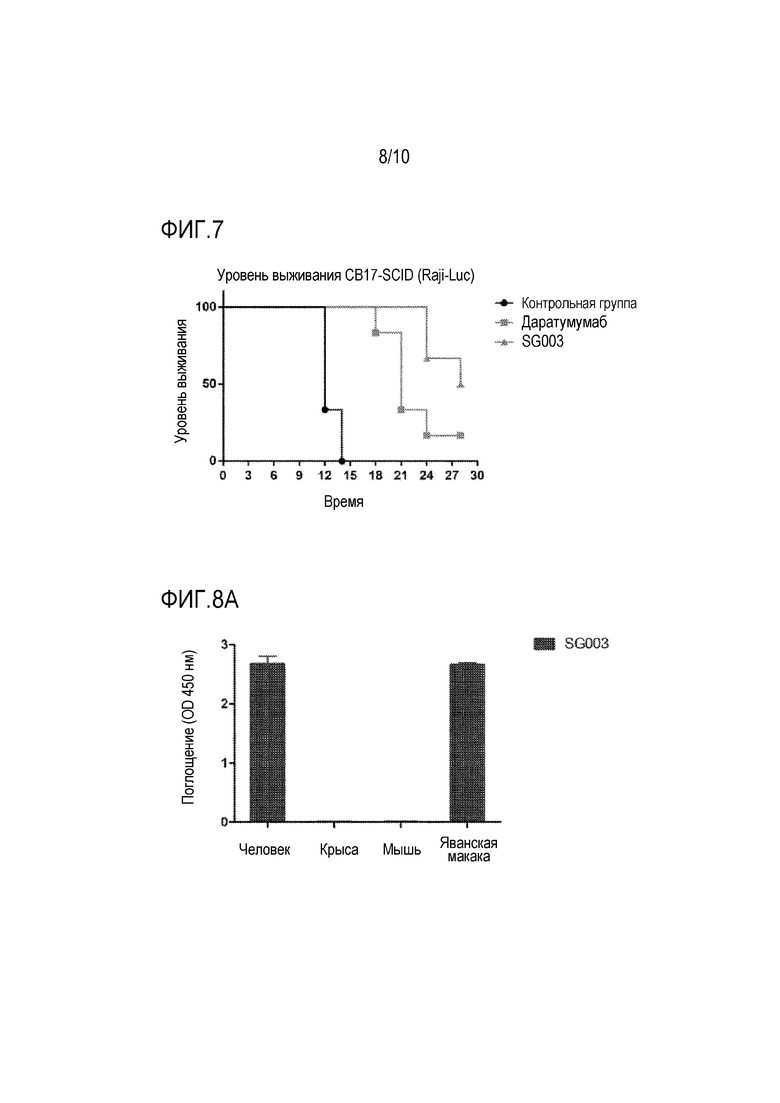
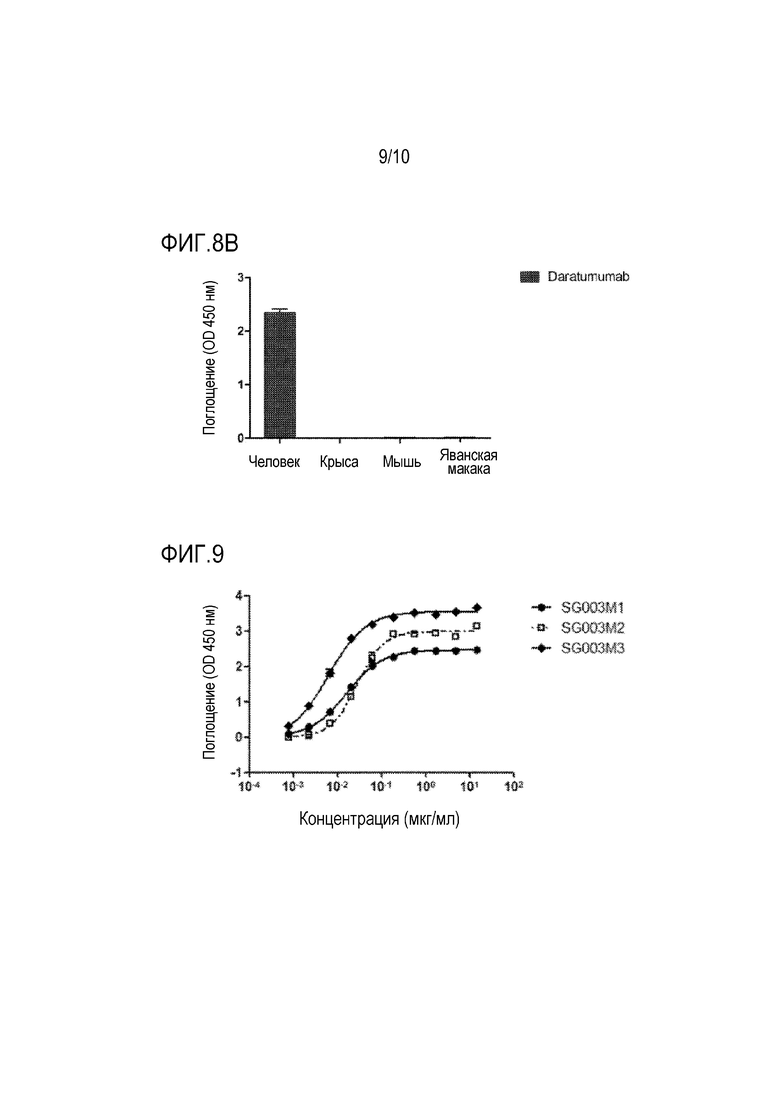
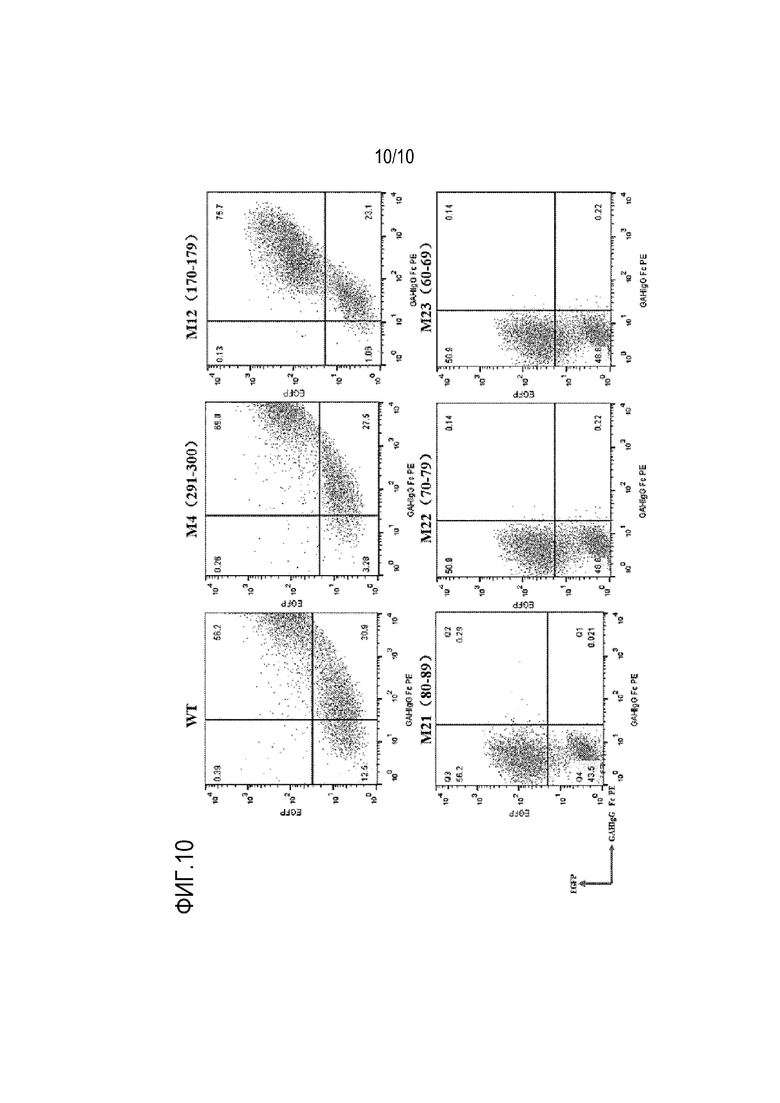
Настоящее изобретение относится к области биотехнологии и биомедицины, в частности к антителам и его антигенсвязывающим фрагментам, способным связываться с белком CD38, к выделенной молекуле нуклеиновой кислоты, кодирующей антитело к CD38, и вектору экспресии, содержащему вышеупомянутую нуклеиновую кислоту; к клетке-хозяину для получения антитела к CD38 или его антигенсвязывающего фрагмента, к способу получения антитела к CD38 или его антигенсвязывающего фрагмента и к фармацевтической композиции для лечения опухолей. Кроме того, предложен способ профилактики или лечения опухолей и способ для ингибирования связывания белка CD38 с лигандом CD38. Антитело или его антигенсвязывающий фрагмент по настоящему изобретению может уничтожать CD38+ клетки путем антителозависимой клеточноопосредованной цитотоксичности (ADCC), комплементзависимой цитотоксичности (CDC) и/или апоптоза. 17 н. и 16 з.п. ф-лы, 3 табл., 11 пр., 10 ил.
1. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее легкую цепь антитела или его фрагмента и тяжелую цепь антитела или его фрагмента,
где легкая цепь антитела или его фрагмента содержит LCDR1, LCDR2 и LCDR3 и тяжелая цепь антитела или его фрагмента содержит HCDR1, HCDR2 и HCDR3,
LCDR1 содержит аминокислотную последовательность SEQ ID NO:1,
LCDR2 содержит аминокислотную последовательность SEQ ID NO:2,
LCDR3 содержит аминокислотную последовательность SEQ ID NO:3,
HCDR1 содержит аминокислотную последовательность SEQ ID NO:4,
HCDR2 содержит аминокислотную последовательность SEQ ID NO:5, и
HCDR3 содержит аминокислотную последовательность SEQ ID NO:6.
2. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее LCDR1, LCDR2 и LCDR3 легкой цепи антитела и HCDR1, HCDR2 и HCDR3 тяжелой цепи антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:16 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:17.
3. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее LCDR1, LCDR2 и LCDR3 легкой цепи антитела и HCDR1, HCDR2 и HCDR3 тяжелой цепи антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:18 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:19.
4. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее LCDR1, LCDR2 и LCDR3 легкой цепи антитела и HCDR1, HCDR2 и HCDR3 тяжелой цепи антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:20 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:21.
5. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее вариабельную область легкой цепи VL легкой цепи антитела и вариабельную область тяжелой цепи VH тяжелой цепи антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:16 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:17.
6. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее вариабельную область легкой цепи VL легкой цепи антитела и вариабельную область тяжелой цепи VH тяжелой цепи антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:18 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:19.
7. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее вариабельную область легкой цепи VL легкой цепи антитела и вариабельную область тяжелой цепи VH тяжелой цепи антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:20 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:21.
8. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее легкую цепь антитела и тяжелую цепь антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:16 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:17.
9. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее легкую цепь антитела и тяжелую цепь антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:18 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:19.
10. Антитело или его антигенсвязывающий фрагмент, которое связывается с белком CD38, содержащее легкую цепь антитела и тяжелую цепь антитела,
легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:20 и
тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:21.
11. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-10, которое связывается с CD38 с величиной KD 1×10-9 M или ниже.
12. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-10, где антитело или его антигенсвязывающий фрагмент уничтожает и повреждает опухолевые клетки и/или ингибирует рост опухоли посредством специфического связывания с белком CD38.
13. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-10, где антитело выбрано из группы, включающей моноклональное антитело, одноцепочечное антитело, химерное антитело, гуманизированное антитело и полностью человеческое антитело.
14. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-10, где антигенсвязывающий фрагмент выбран из группы, включающей фрагменты Fab, Fab’, F(ab)2, F(ab’)2, Fv и ScFv.
15. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-10, где белок CD38 представляет собой человеческий белок CD38 или обезьяний белок CD38.
16. Антитело или его антигенсвязывающий фрагмент по п.1, где легкая цепь антитела или ее фрагмент содержит вариабельную область легкой цепи VL, и вариабельная область легкой цепи VL содержит аминокислотную последовательность SEQ ID NO:7.
17. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-7, где легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:22.
18. Антитело или его антигенсвязывающий фрагмент по п.1, где легкая цепь антитела содержит аминокислотную последовательность SEQ ID NO:11.
19. Антитело или его антигенсвязывающий фрагмент по п.1 или 16, где тяжелая цепь антитела или его фрагмента содержит вариабельную область тяжелой цепи VH, и вариабельная область тяжелой цепи VH содержит аминокислотную последовательность SEQ ID NO:8.
20. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-7, где тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:23.
21. Антитело или его антигенсвязывающий фрагмент по п.1 или 18, где тяжелая цепь антитела содержит аминокислотную последовательность SEQ ID NO:13.
22. Выделенная молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент по любому из пп.1-21.
23. Молекула нуклеиновой кислоты по п.22, где нуклеотид является кодон-оптимизированным.
24. Молекула нуклеиновой кислоты по любому из пп.22-23, где молекула нуклеиновой кислоты содержит одну или несколько полинуклеотидных последовательностей, выбранных из группы, включающей SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:12 и SEQ ID NO:14.
25. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по любому из пп.22-24.
26. Клетка-хозяин для получения антитела или его антигенсвязывающего фрагмента по любому из пп.1-21, содержащая молекулу нуклеиновой кислоты по любому из пп.22-24 или вектор по п.25.
27. Способ получения антитела или его антигенсвязывающего фрагмента по любому из пп.1-21, включающий культивирование клетки по п.26 в условиях, которые позволяют экспрессию антитела или его антигенсвязывающего фрагмента.
28. Фармацевтическая композиция для лечения опухолей, содержащая терапевтически эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-21, молекулу нуклеиновой кислоты по любому из пп.22-24, вектор по п.25 и/или клетку по п.26, и, необязательно, фармацевтически приемлемый адъювант.
29. Способ профилактики или лечения опухолей, включающий введение пациенту антитела или его антигенсвязывающего фрагмента по любому из пп.1-21.
30. Способ по п.29, где опухоли включают CD38-положительную опухоль.
31. Способ по п.30, где CD38-положительная опухоль выбрана из группы, включающей множественную миелому, лимфому и лейкоз.
32. Способ для ингибирования связывания белка CD38 с лигандом CD38, включающий введение антитела или его антигенсвязывающего фрагмента по любому из пп.1-21, молекулы нуклеиновой кислоты по любому из пп.22-24, вектора по п.25 и/или клетки по п.26.
33. Способ по п.32, где лиганд CD38 содержит CD31.
| ЧЕЛОВЕЧЕСКИЕ АНТИ-CD38-АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2402568C2 |
| VAN DE DONK N.W.C.J | |||
| et al., Monoclonal antibodies targeting CD38 in hematological malignancies and beyond | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Vol | |||
| Приспособление для уменьшения дымовой тяги паровоза | 1920 |
|
SU270A1 |
| MX2009004050 A, 28.04.2009 | |||
| WO2006099875 A1, 28.09.2006 | |||
| МНОГОПОРШНЕВОЙ ЦИЛИНДРИЧЕСКИЙ ЗОЛОТНИК | 1918 |
|
SU718A1 |
Авторы
Даты
2022-07-26—Публикация
2019-02-11—Подача