Предлагаемое изобретение относится к коллоидной химии и химии лигнина, в частности к стабилизаторам коллоидного раствора серебра, и может быть использовано в синтезе стабильных растворов коллоидного серебра.
Гидролизный лигнин является техническим лигнином, который образуется как остаток при гидролизе опилок древесины или другого растительного сырья [Холькин Ю.И. Технология гидролизных производств: Учеб. для вузов. / Ю.И. Холькин. М.: Лесн. пром-сть, 1989. 486 с.]. Гидролизный лигнин обычно сжигают на самом гидролизном заводе, а ранее в СССР его вывозили в отвалы, в которых были накоплены миллионы тонн гидролизного лигнина [Rabinovich M.L. Lignin by-products of Soviet hydrolysis industry: Resources, characteristics, and utilization as a fuel // Cellulose Chemistry and Technology. 2014. Vol. 48, N7-8. P. 613-631].
Гидролизный лигнин используют как сырье для производства пеллет [Патент РФ №2671824. Пеллеты из отходов деревообрабатывающего производства (гидролизного лигнина) и способ их изготовления, опубл. 07.11.2018, Бюл. №31]. Из него могут быть получены различные сорбенты, например, для сбора нефти и нефтепродуктов с загрязненной поверхности [Патент РФ №2277437. Сорбент для сбора нефти и нефтепродуктов, способ получения сорбента и способ сбора нефти и нефтепродуктов, опубл. 10.06.2006, Бюл. №16], энтеросорбенты для лечения острых расстройств функций желудочно-кишечного тракта и наружных бактериоадсорбционных средств [Патент РФ №2094052. Способ обработки гидролизного лигнина, опубл. 27.10.1997], для детоксикации организма и дезинфекции [Патент РФ №2440125. Способ получения пасты "Полифепан" из гидролизного лигнина, опубл. 20.01.2012, Бюл. №2], сорбентов для извлечения радионуклидов при реабилитации загрязненных почв [Патент РФ №2317603. Способ реабилитации почвы, загрязненной радиоактивными нуклидами, опубл. 20.02.2008, Бюл. №5], активированные угли, получаемые в результате термохимической активации в присутствии щелочи [Beletskaya M.G. Bogdanovich N.I. The formation of adsorption properties of nanoporous materials by thermochemical activation // Russian Journal of Bioorganic Chemistry. 2014. Vol. 40, N7. P. 721-725, Романенко К.А., Богданович Н.И., Канарский А.В. Получение активных углей пиролизом гидролизного лигнина // Лесн. журн. 2017. №4. С. 162-171. DOI: 10.17238/issn0536-1036.2017.4.162], в том числе сорбенты для детоксикации гербицидов [Спиридонов Ю.Я., Мухин В.Н., Воропаева Н.Л., Романенко К.А., Богданович Н.И., Черная Н.В. Агросорбы на основе гидролизного лигнина // Физикохимия растительных полимеров: Материалы VII международной конференции (03-06 июля 2017 г.) под ред. д-ра наук, проф., засл. деятеля науки РФ К.Г. Боголицына / Сев. (Арктич.) федер. ун-т им. М.В. Ломоносова. Архангельск: САФУ. 276 с.].
Перечисленные выше направления использования и возможного использования гидролизного лигнина основаны на его нерастворимости в воде, что его принципиально отличает от других типов технических лигнинов, таких как сульфатный лигнин и лигносульфонаты, так как сульфатный лигнин растворим в щелочной среде, а лигносульфонаты - во всем диапазоне pH.
Нитрование лигнинов сопровождается окислительной деполимеризацией его макромолекул, в результате чего продукты нитрования становятся лучше растворимы в воде: нитрованный сульфатный лигнин приобретает растворимость в воде при низких значениях pH [Ahmad Z., Paleologou M., Xu C.C. Oxidative depolymerization of lignin using nitric acid under ambient conditions // Industrial Crops and Products. 2021. Vol. 170. Article 113757. DOI: 10.1016/j.indcrop.2021.113757], в зависимости от условий нитрования продукты нитрования гидролизного лигнина также становятся полностью растворимым в воде в щелочной, нейтральной и даже кислой среде [Хабаров Ю.Г., Лахманов Д.Е. Деполимеризация конденсированных лигнинов под действием азотной кислоты // Известия ВУЗов. Лесной журнал. 2014. №5. С. 173-181, Хабаров Ю.Г., Лахманов Д.Е. Изучение взаимодействия конденсированных лигнинов с азотной кислотой в водно-органосольвентной среде // Известия ВУЗов. Лесной журнал. 2015. №2. С. 142-151, Патент РФ №2524343. Способ модификации лигнина. Хабаров Ю.Г., Лахманов Д.Е., САФУ, №2013111076/04, заявл. 12.03.2013, опубл. 27.07.2014, Бюл. №21].
Нитрование сульфатного лигнина, сопровождающееся его окислением, позволяет получать продукты, которые обладают свойствами диспергатора для каолиновых суспензий [Konduri M.K.R., Fatehi P. Designing anionic lignin based dispersant for kaolin suspensions // Colloids and Surfaces A. 2018. Vol. 538. P. 639-650]. Гидролизный лигнин, подверженный окислению и нитрованию в течение 2,5-3 ч при 30-35°C и гидромодуле 1:10 смесью серной и азотной кислот (состав: азотная кислота 8-10%, серная кислота 20-28%, вода 62-70%, может использоваться для понижения вязкости глинистых буровых растворов [Авт. св-во №133016 SU. Способ приготовления нитролигнина, опубл. 1960, Бюл. №21, Чудаков М.И. Промышленное использование лигнина. Изд. 2-е, испр. и доп. М.: Лесн. пром-сть, 1972. 216 с. С. 152-154]. Лигносульфонаты, нитрованные и окисленные азотной кислотой, также могут быть использованы в качестве добавки к буровым растворам, понижающей их вязкость за счет диспергирования глинистых частиц [Zhang J., Chen G., Yang N.W., Wang, Y.G. Preparation of Nitration-oxidation Lignosulfonate as an Eco-friendly Drilling Fluid Additive // Petroleum Science and Technology. 2014. Vol. 32, N 14. P. 1661-1668. https://doi.org/10.1080/10916466.2011.652334].
С другой стороны, нитрование гидролизного лигнина можно провести с сохранением его нерастворимости, используя ацетилнитрат как нитрующий реагент или ограничивая продолжительность реакции с азотной кислотой в среде вода-апротонный растворитель [Лахманов Д.Е., Хабаров Ю.Г., Вешняков В.А., Ёкубжанов М.Р. Нитрование гидролизного лигнина в водно-апротонных средах // Изв. вузов. Лесн. журн. 2020. №5. С. 184-192. DOI: 10.37482/0536-1036-2020-5-184-192]. Нерастворимая часть нитрованного гидролизного лигнина, например, проявляет улучшенные сорбционные свойства по отношению к катионам цинка(II) и свинца(II) по сравнению с исходным гидролизным лигнином [Khvan A.M., Abduazimov B.B., Abduazimov K.A. Nitration of Lignin and Sorptive Properties of the Resulting Products. Chemistry of Natural Compounds. 2002. Vol. 38, P. 471-472. DOI: 10.1023/A:1022128130251].
Растворы коллоидного серебра представляют собой дисперсии наночастиц серебра (наносеребра), стабилизированных, как правило, поверхностно-активными веществами, обеспечивающими их агрегативную устойчивость за счет электростерической стабилизации. Для получения коллоидных растворов серебра часто используется химический способ, основанный на окислительно-восстановительной реакции катионов серебра(I) с каким-либо восстановителем, в результате чего катионы серебра(I) восстанавливаются до металлического серебра. Для предотвращения седиментации металлического серебра за счет агрегации образующихся наночастиц серебра окислительно-восстановительную реакцию проводят в присутствии стабилизаторов, которые также могут выступать в роли восстановителей катионов серебра(I) [Wei L., Lu J., Xu H., Patel A., Chen Z.-S., Chen G. Silver nanoparticles: synthesis, properties, and therapeutic applications // Drug Discovery Today. 2015. Vol. 20, N5. P. 595-601. DOI: 10.1016/j.drudis.2014.11.014; Pryshchepa O., Pomastowski P., Buszewski B. Silver nanoparticles: Synthesis, investigation techniques, and properties // Advances in Colloid and Interface Science. 2020. Vol. 284, Article 102246. DOI: 10.1016/j.cis.2020.102246].
В качестве стабилизаторов растворов коллоидного серебра могут использоваться различные соединения, как синтетические, например, этилтриметиламмония бромид, додецилсульфат натрия, поливинилпирролидон, так и природные (в том числе различные экстракты), которым отдается предпочтение благодаря меньшим рискам для окружающей среды [Syafiuddin A., Salmiati, Salim M.R., Kueh A.B.H., Hadibarata T., Nur H. A Review of Silver Nanoparticles: Research Trends, Global Consumption, Synthesis, Properties, and Future Challenges // Journal of the Chinese Chemical Society. 2017. Vol. 64, N 7. P. 732-756. DOI: 10.1002/jccs.201700067; Hasan K.M.F., Xiaoyi Liu, Shaoqin Z., Horváth P.G., Bak M., Bejó L., Sipos G., Alpár T. Functional silver nanoparticles synthesis from sustainable point of view: 2000 to 2023 - A review on game changing materials // Heliyon. Vol. 8, N12. Article e12322. DOI: 10.1016/j.heliyon.2022.e12322]. Лигнин, являющийся широко распространенным в растительном мире биополимером, также рассматривается в качестве неопасного стабилизатора для наночастиц серебра [Hu S., Hsieh Y.-L. Silver nanoparticle synthesis using lignin as reducing and capping agents: A kinetic and mechanistic study. International Journal of Biological Macromolecules. 2016, Vol. 82, P. 856-862. DOI: 10.1016/j.ijbiomac.2015.09.066].
Известно использование лигносульфонатов для синтеза коллоидного раствора серебра, который образуется в результате реакции глюкозы с аммиачным раствором нитрата серебра в присутствии лигносульфонатов, выполняющих роль стабилизатора [Патент РФ №2756226. Способ получения раствора коллоидного серебра, опубл. 28.09.2021, Бюл. №28; Плахин В.А., Хабаров Ю.Г., Вешняков В.А. Синтез коллоидного серебра с использованием лигносульфонатов // Изв. вузов. Лесн. журн. 2021. №6. С. 184-195. DOI: 10.37482/0536-1036-2021-6-184-195].
Известно применение лигносульфонатов при синтезе коллоидных растворов серебра, где лигносульфонаты выступают одновременно как восстановители катионов серебра(I) и как стабилизаторы образующихся наночастиц серебра [Milczarek, G., Rebis, T., Fabianska, J. One-step synthesis of lignosulfonate-stabilized silver nanoparticles // Colloids and Surfaces B: Biointerfaces. 2013. Vol. 105. P. 335-341. DOI: 10.1016/j.colsurfb.2013.01.010, Saratale, R.G., Cho, S.-K., Saratale, G.D., Kadam, A.A., Ghodake, G.S., Magotra, V.K., Kumar, M., Bharagava, R.N., Varjani, S., Palem, R.R., Mulla, S.I., Kim, D.-S., Shin, H.-S. Lignin-Mediated Silver Nanoparticle Synthesis for Photocatalytic Degradation of Reactive Yellow 4G and In Vitro Assessment of Antioxidant, Antidiabetic, and Antibacterial Activities // Polymers, 2022. Vol. 14, N3. Article 648. DOI: 10.3390/polym14030648].
Известно применение щелочного лигнина [Hu S., Hsieh Y.-L. Silver nanoparticle synthesis using lignin as reducing and capping agents: A kinetic and mechanistic study // International Journal of Biological Macromolecules. 2016. Vol. 82, P. 856-862. DOI: 10.1016/j.ijbiomac.2015.09.066], сульфатного лигнина и аминированного лигнина [Ito N.M., Filho A.A.M., Santos D.J., Santos L.T. Synthesis of silver nanoparticles using modified lignin as a reducing agent // Next Materials. 2024. Vol. 2. Article 100101. DOI: 10.1016/j.nxmate. 2023.100101] в качестве одновременно, и восстановителя, и стабилизатора при синтезе наночастиц серебра.
Известно применение нитрованного сульфатного лигнина в качестве стабилизатора при синтезе коллоидного раствора серебра [Патент РФ №2794897. Стабилизатор коллоидного раствора серебра, опубл. 25.04.2023, Бюл. №12; Плахин В.А., Хабаров Ю.Г., Гаркотин А.Ю., Вешняков В.А., Селянина С.Б., Зубов И.Н. Изучение свойств растворов коллоидного серебра, синтезированных с использованием технических лигнинов. Бутлеровские сообщения. 2022. Т. 71. №9. C.11-17. DOI: 10.37952/ROI-jbc-01/22-71-9-11]. При этом преимуществом использования нитрованного сульфатного лигнина было то, что в отличие от исходного сульфатного лигнина не происходило расслоения коллоидного раствора серебра. Нитрованный сульфатный лигнин получали путем нитрования ацетилнитратом в 1,4-диоксане [Плахин В.А., Хабаров Ю.Г., Гаркотин А.Ю., Вешняков В.А., Селянина С.Б., Зубов И.Н. Изучение свойств растворов коллоидного серебра, синтезированных с использованием технических лигнинов. Бутлеровские сообщения. 2022. Т. 71. №9. C. 11-17. DOI: 10.37952/ROI-jbc-01/22-71-9-11]. Ацетилнитрат [Louw R. Acetyl Nitrate // Encyclopedia of Reagents for Organic Synthesis. - 2001. - 2 p. DOI: 10.1002/047084289X.ra032] является мягким нитрующим реагентом, который практически не проявляет окислительные свойства в условиях нитрования, его использование требует проведения реакций в неводных реакционных смесях. Известно, что нитрование гидролизного лигнина ацтилнитратом в 1,4-диоксане приводит только к его нитрованию без окисления, при этом сохраняется его нерастворимость [Лахманов Д.Е., Хабаров Ю.Г., Вешняков В.А., Ёкубжанов М.Р. Нитрование гидролизного лигнина в водно-апротонных средах // Изв. вузов. Лесн. журн. 2020. №5. С. 184-192. DOI: 10.37482/0536-1036-2020-5-184-192].
Задача изобретения состояла в расширении областей использования нитрованного гидролизного лигнина, что также расширяет использование продуктов химической модификации гидролизного лигнина, а именно использование водорастворимых продуктов нитрования гидролизного лигнина в качестве стабилизатора коллоидного раствора серебра.
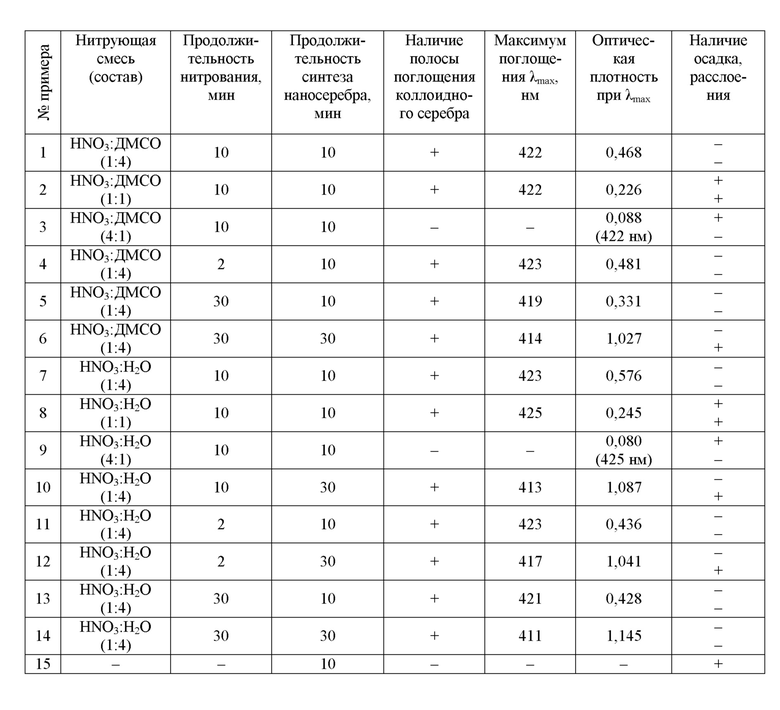
Поставленная задача реализуется следующим образом. Нитрование гидролизного лигнина проводили смесью концентрированной азотной кислоты и диметилсульфоксида или воды с различным соотношением. Реакционную смесь нагревали на кипящей водяной бане, после чего ее охлаждали, подщелачивали раствором аммиака. Полученный щелочной раствор нитрованного гидролизного лигнина использовали при синтезе коллоидного раствора серебра. Его смешивали с растворами глюкозы и нитрата серебра, перемешивали, нагревали на кипящей водяной бане, после чего реакционную смесь охлаждали. Контроль за образованием коллоидного раствора осуществляли с помощью электронной спектроскопии, так как известно, что на электронном спектре коллоидного раствора серебра имеется полоса поглощения с максимумом в области 400…490 нм в зависимости от размера частиц наносеребра [Paramelle D., Sadovoy A., Gorelik S., Free P., Hobleya J., Fernig D.G. A rapid method to estimate the concentration of citrate capped silver nanoparticles from UV-visible light spectra // Analyst. 2014. 139, N19. P. 4855-4861. DOI: 10.1039/C4AN00978A]. Также осуществляли визуальную оценку раствора коллоидного серебра по отсутствию или наличию осадка. Устойчивость коллоидных растворов оценивали по отсутствию или наличию расслоения не менее чем через 4 недели хранения при комнатной температуре.
Пример 1. В мерную пробирку вносили 0,1 г гидролизного лигнина, добавляли 1 мл нитрующей смеси, состоящей из концентрированной азотной кислоты и диметилсульфоксида состава 1:4 по объему. Реакционную смесь нагревали на кипящей водяной бане в течение 10 мин, после чего ее охлаждали, подщелачивали 3 мл 14%-ного раствора аммиака и разбавляли до 25 мл дистиллированной водой. Для синтеза коллоидного раствора серебра в другую мерную пробирку вносили 5 мл подщелочённого аммиаком раствора продуктов нитрования гидролизного лигнина, 3 мл 0,1 М раствора глюкозы, 1 мл 0,1 М раствора нитрата серебра, перемешивали и нагревали на кипящей водяной бане в течение 10 мин. После этого реакционную смесь охлаждали и затем разбавляли до 25 мл дистиллированной водой. Проводили регистрацию электронного спектра полученного раствора, дополнительно разбавленного еще в 50 раз, относительно дистиллированной воды. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 422 нм, оптическая плотность которого при 422 нм составила 0,468. Раствор коллоидного серебра не имел осадка, при хранении расслоения не происходило.
Пример 2. Синтез коллоидного раствора серебра проводили в условиях примера 1, отличающийся тем, что состав нитрующей смеси был 1:1 по объему. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 422 нм, оптическая плотность которого при 422 нм составила 0,226. На дне пробирки с раствором коллоидного серебра присутствовал черный осадок, при хранении произошло расслоение (около 10% объема в верхнем слое стали более прозрачными).
Пример 3. Синтез коллоидного раствора серебра проводили в условиях примера 1, отличающийся тем, что состав нитрующей смеси был 4:1 по объему. В результате был получен окрашенный раствор, на его электронном спектре характерная полоса поглощения коллоидного серебра с максимумом в области 400…490 нм практически отсутствовала, оптическая плотность которого при 422 нм составила 0,088. На дне пробирки с раствором коллоидного серебра присутствовал черный осадок, при хранении расслоения не происходило.
Пример 4. Синтез коллоидного раствора серебра проводили в условиях примера 1, отличающийся тем, что при нитровании гидролизного лигнина реакционную смесь нагревали на кипящей водяной бане в течение 2 мин. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 423 нм, оптическая плотность которого при 423 нм составила 0,481 Раствор коллоидного серебра не имел осадка, при хранении расслоения не происходило.
Пример 5. Синтез коллоидного раствора серебра проводили в условиях примера 1, отличающийся тем, что при нитровании гидролизного лигнина реакционную смесь нагревали на кипящей водяной бане в течение 30 мин. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 419 нм, оптическая плотность которого при 419 нм составила 0,331. Раствор коллоидного серебра не имел осадка, при хранении расслоения не происходило.
Пример 6. Синтез коллоидного раствора серебра проводили в условиях примера 1, отличающийся тем, что при нитровании гидролизного лигнина реакционную смесь нагревали на кипящей водяной бане в течение 30 мин, а продолжительность нагревания при синтезе коллоидного серебра составила 30 мин. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 414 нм, оптическая плотность которого при 414 нм составила 1,027. Раствор коллоидного серебра не имел осадка, при хранении произошло расслоение (около 20% объема в верхнем слое стали более прозрачными).
Пример 7. Синтез коллоидного раствора серебра проводили в условиях примера 1, отличающийся тем, что вместо диметилсульфоксида была использована дистиллированная вода. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 423 нм, оптическая плотность которого при 423 нм составила 0,576. Раствор коллоидного серебра не имел осадка, при хранении расслоения не происходило.
Пример 8. Синтез коллоидного раствора серебра проводили в условиях примера 7, отличающийся тем, что состав нитрующей смеси был 1:1 по объему. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 425 нм, оптическая плотность которого при 425 нм составила 0,245. На дне пробирки с раствором коллоидного серебра присутствовал черный осадок, при хранении произошло расслоение (около 10% объема в верхнем слое стали более прозрачными).
Пример 9. Синтез коллоидного раствора серебра проводили в условиях примера 7, отличающийся тем, что состав нитрующей смеси был 4:1 по объему. В результате был получен окрашенный раствор, на его электронном спектре характерная полоса поглощения коллоидного серебра с максимумом в области 400-490 нм практически отсутствовала, оптическая плотность которого при 425 нм составила 0,080. На дне пробирки с раствором коллоидного серебра присутствовал черный осадок, при хранении расслоения не происходило.
Пример 10. Синтез коллоидного раствора серебра проводили в условиях примера 7, отличающийся тем, что продолжительность нагревания при синтезе коллоидного серебра составила 30 мин. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 413 нм, оптическая плотность которого при 413 нм составила 1,087. Раствор коллоидного серебра не имел осадка, при хранении произошло расслоение (около 10% объема в верхнем слое стали более прозрачными).
Пример 11. Синтез коллоидного раствора серебра проводили в условиях примера 7, отличающийся тем, что при нитровании гидролизного лигнина реакционную смесь нагревали на кипящей водяной бане в течение 2 мин. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 423 нм, оптическая плотность которого при 423 нм составила 0,436. Раствор коллоидного серебра не имел осадка, при хранении расслоения не происходило.
Пример 12. Синтез коллоидного раствора серебра проводили в условиях примера 7, отличающийся тем, что при нитровании гидролизного лигнина реакционную смесь нагревали на кипящей водяной бане в течение 2 мин, а продолжительность нагревания при синтезе коллоидного серебра составила 30 мин. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 417 нм, оптическая плотность которого при 417 нм составила 1,041. Раствор коллоидного серебра не имел осадка, при хранении произошло расслоение (около 5% объема в верхнем слое стали более прозрачными).
Пример 13. Синтез коллоидного раствора серебра проводили в условиях примера 7, отличающийся тем, что при нитровании гидролизного лигнина реакционную смесь нагревали на кипящей водяной бане в течение 30 мин. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 421 нм, оптическая плотность которого при 421 нм составила 0,428. Раствор коллоидного серебра не имел осадка, при хранении расслоения не происходило.
Пример 14. Синтез коллоидного раствора серебра проводили в условиях примера 7, отличающийся тем, что при нитровании гидролизного лигнина реакционную смесь нагревали на кипящей водяной бане в течение 30 мин, а продолжительность нагревания при синтезе коллоидного серебра составила 30 мин. В результате был получен окрашенный раствор, на его электронном спектре присутствовала характерная полоса поглощения коллоидного серебра с максимумом при 411 нм, оптическая плотность которого при 411 нм составила 1,145. Раствор коллоидного серебра не имел осадка, при хранении расслоения не происходило.
Пример 15. Синтез коллоидного раствора серебра проводили в условиях примера 1, отличающийся тем, что окислительно-восстановительная реакция катионов серебра(I) с глюкозой проходила без использования нитрованного гидролизного лигнина как стабилизатора коллоидного раствора, для чего вместо 5 мл подщелочённого аммиаком раствора нитрованного гидролизного лигнина использовали 5 мл дистиллированной воды с добавкой 1 мл 14%-ного раствора аммиака. В результате реакции выделился серый осадок, надосадочный раствор был неокрашенным, коллоидный раствор не образовался.
Результаты примеров сведены в таблице 1, из которой видно, что нитрованный гидролизный лигнин проявляет стабилизирующую способность при синтезе коллоидных растворов серебра, в том случае, если нитрование гидролизного лигнина проводится в течение 2-30 мин на кипящей водяной бане смесями концентрированной азотной кислоты и диметилсульфоксида или воды в соотношении 1:4 по объему. Длительное нагревание при синтезе коллоидного раствора в течение 30 мин приводит к более высоким значениям оптической плотности, однако в коллоидном растворе появляется расслоение, при котором до 20% объема в верхней части становится более прозрачными. Синтезированные коллоидные растворы серебра устойчивы в течение длительного времени (не менее 4 недель).
Таблица 1
| название | год | авторы | номер документа |
|---|---|---|---|
| Стабилизатор коллоидного раствора серебра | 2022 |
|
RU2794897C1 |
| Способ получения раствора коллоидного серебра | 2023 |
|
RU2806006C1 |
| Способ получения стабильного раствора коллоидного серебра | 2022 |
|
RU2792646C1 |
| Способ получения раствора коллоидного серебра | 2020 |
|
RU2756226C1 |
| Способ модификации сульфатного лигнина | 2020 |
|
RU2753533C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУЛЬФИД-ИОНОВ В ВОДНЫХ РАСТВОРАХ | 2024 |
|
RU2835293C1 |
| Способ определения концентрации глюкозы | 2022 |
|
RU2791905C1 |
| СПОСОБ ФОТОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ КАТИОНОВ СЕРЕБРА В ВОДНОМ РАСТВОРЕ | 2024 |
|
RU2835291C1 |
| ЦВЕТОРЕАГЕНТ ДЛЯ ФОТОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ КАТИОНОВ СЕРЕБРА В ВОДНОМ РАСТВОРЕ | 2023 |
|
RU2820125C1 |
| СПОСОБ НИТРОВАНИЯ ГУМИНОВЫХ КИСЛОТ | 2021 |
|
RU2791903C1 |
Изобретение относится к коллоидной химии и химии лигнина, в частности к стабилизаторам коллоидного раствора серебра. Стабилизатор раствора коллоидного серебра представляет собой водорастворимые продукты нитрования гидролизного лигнина, получаемые при нитровании гидролизного лигнина в течение 2-30 мин на кипящей водяной бане смесями концентрированной азотной кислоты и диметилсульфоксида или воды в соотношении 1:4 по объему, последующем охлаждении и подщелачивании 14%-ным раствором аммиака и разбавлении дистиллированной водой. Изобретение обеспечивает стабилизирующие свойства при синтезе коллоидного серебра, образующегося при окислительно-восстановительной реакции катионов серебра и глюкозы в водном растворе аммиака. 1 табл., 15 пр.
Стабилизатор раствора коллоидного серебра, представляющий собой водорастворимые продукты нитрования гидролизного лигнина, получаемые при нитровании гидролизного лигнина в течение 2-30 мин на кипящей водяной бане смесями концентрированной азотной кислоты и диметилсульфоксида или воды в соотношении 1:4 по объему, последующем охлаждении и подщелачивании 14%-ным раствором аммиака и разбавлении дистиллированной водой.
| Стабилизатор коллоидного раствора серебра | 2022 |
|
RU2794897C1 |
| РЕАГЕНТ ДЛЯ ГОМОГЕННОГО НИТРОВАНИЯ СУЛЬФАТНОГО ЛИГНИНА | 2015 |
|
RU2608145C1 |
| СПОСОБ МОДИФИКАЦИИ ЛИГНИНА | 2013 |
|
RU2524343C1 |
| GB 866968 A, 03.05.1961 | |||
| ХАБАРОВ Ю.Г | |||
| и др | |||
| Деполимеризация конденсированных лигнинов под действием азотной кислоты // Известия ВУЗов | |||
| Лесной журнал | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Джино-прядильная машина | 1922 |
|
SU173A1 |
Авторы
Даты
2025-04-04—Публикация
2024-09-02—Подача