Перекрестная ссылка на родственные заявки
Настоящая заявка претендует на приоритет по предварительной заявке на патент США No. 62/713,095, поданной 1 августа 2018 г., содержание которой включено сюда путем ссылки во всей полноте.
Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и включен сюда путем ссылки во всей полноте. ASCII-копия, созданная 30 июля 2019 г., называется 102085_005304_SL и имеет размер 279 927 байт.
Область техники, к которой относится изобретение
Настоящая заявка касается молекул человеческих антител, связывающихся иммуноспецифически с CXCR2 человека.
Уровень техники
Самые распространенные лейкоциты в крови - нейтрофилы. Они являются важными эффекторными клетками врожденного иммунитета и играют главную роль в устранении внеклеточных патогенов. Однако, если рекрутинг нейтрофилов в ткани не контролируется должным образом, то хроническая инфильтрация и активация нейтрофилов может привести к постоянному высвобождению медиаторов воспаления и протеиназ, которые вызывают четкое повреждение ткани.
Миграция и активация нейтрофилов опосредуется взаимодействием рецептора-1 CXC-хемокинов (CXCR1) и рецептора-2 CXC-хемокинов (CXCR2) на плазматической мембране нейтрофилов с хемокинами ELR+CXC (CXCL1, 2, 3, 5, 6, 7 и 8). CXCR2 действует как рецептор с высоким сродством ко всем хемокинам ELR+CXC и играет ключевую роль в мобилизации и привлечении нейтрофилов и моноцитов из крови в ткани. А хемокины CXCL6, 7 и 8 также взаимодействуют и с CXCR1, который модулирует активность окислительной вспышки и высвобождение протеаз из нейтрофилов, что имеет решающее значение для иммунитета к бактериям и грибам.
Повышение числа нейтрофилов в мокроте связывали с фенотипами, связанными с повышенной тяжестью астмы, нечувствительностью к кортикостероидам и хронической затрудненностью дыхания. Нейтрофилия дыхательных путей усиливается при обострении астмы. Нейтрофилия дыхательных путей также характерна для всех клинических фенотипов хронической обструктивной болезни легких (COPD), включая COPD с преобладанием эмфиземы, COPD с частыми обострениями и COPD с признаками высокой активности эозинофилов. Степень нейтрофилии дыхательных путей также коррелирует с тяжестью заболевания и скоростью физиологического спада. Протеиназы нейтрофилов, особенно эластаза нейтрофилов, участвуют во всех патологических проявлениях COPD. Выделяемые нейтрофилами протеиназы также связаны с развитием эмфиземы, способствуют разрушению внеклеточного матрикса и связаны с гиперсекрецией слизи. Эти ассоциации свидетельствуют, что инфильтрация нейтрофилов в дыхательные пути может играть решающую роль в патофизиологических процессах, лежащих в основе тяжелой астмы и COPD.
Хемокины CXCL1, CXCL5 и CXCL8 связываются с CXCR2 и участвуют в рекрутинге нейтрофилов. CXCL1, CXCL5 и CXCL8 возрастают при хроническом воспалении дыхательных путей и повышаются в мокроте или в бронхиальных биоптатах от субъектов с тяжелой нейтрофильной астмой или COPD. Противодействие активации CXCR2 хемокинами открывает потенциальную терапевтическую стратегию за счет снижения привлечения нейтрофилов в ткани и опосредованных нейтрофилами патологий, связанных с этими воспалительными заболеваниями.
Однако хемокиновые рецепторы оказались трудными мишенями для избирательного противодействия. Несмотря на трудности в разработке соединений с требуемой специфичностью к мишени и антагонистической активностью, некоторые низкомолекулярные антагонисты CXCR2 оказались эффективными на животных моделях воспаления. В клинических испытаниях на людях низкомолекулярные антагонисты CXCR2 не проявляли широкой эффективности у субъектов с нейтрофильной астмой или COPD, хотя при исследовании нейтрофилии в мокроте, индуцированной вдыханием озона и липополисахаридами, проявлялась заметная эффективность у здоровых во всем остальном людей. Наблюдалось лишь небольшое улучшение базовой функции легких (FEV1) у пациентов с COPD, продолжавших курить, по сравнению с бывшими курильщиками. На сегодняшний день во всех опубликованных клинических испытаниях использовались низкомолекулярные антагонисты CXCR2. Наиболее изученным является данириксин (GSK 1325756), обратимый и селективный антагонист CXCR2 (IC50 по связыванию CXCL8 = 12,5 нМ), который, как было показано, также блокирует повышающую регуляцию CD11b в нейтрофилах (напр., см. Miller et al., BMC Pharmacol Toxicol 2015, 16: 18). Данириксин не обеспечил основные задачи при COPD в испытании фазы IIb. Другие селективные для CXCR2 молекулы включают SB-566933 (Lazaar et al., Br. J. Clin. Pharmacol. 2011, 72: 282-293) и AZD5069, который избирателен для CXCR2 (в >150 раз менее активен в отношении рецепторов CXCR1 и CCR2b) и не влияет на экспрессию CD11b, индуцированную C5a, LTB4 или fMLP (Nicolls et al., J. Pharmacol. Exp. Ther. 2015, 353: 340-350). Молекулы, которые ингибируют и CXCR2, и CXCR1, включают навариксин (SCH 527123, MK-7123; Todd et al., Pulm Pharmacol Ther. 2016 Dec, 41: 34-39) и ладариксин (DF2156A; Hirose et al., J Genet Syndr Gene Ther. 2013, S3). Эти молекулы проходят исследования по многим показаниям, включая COPD, астму и другие воспалительные заболевания легких, рак и многое другое.
В некоторых исследованиях применение низкомолекулярных антагонистов CXCR2 приводило к заметному нежелательному снижению уровня нейтрофилов в крови (нейтропении), что может ограничивать переносимую дозу таких средств. Нейтропения может быть результатом того, что антагонист не совсем специфичен для CXCR2, и/или если антагонист действует на все связывающиеся с CXCR2 лиганды. CXCL8 и родственные CXC-хемокины, к примеру, играют важную роль в мобилизации зрелых гранулоцитов в периферическую кровь, поэтому сильный антагонизм этих лигандов на CXCR2 может препятствовать нормальной миграции нейтрофилов в кровь. И наоборот, предпочтительный антагонизм нисходящего пути, включающего передачу кальциевых сигналов после связывания лиганда с CXCR2, может противодействовать нежелательной миграции нейтрофилов в легкие при сохранении желательной способности нейтрофилов к мобилизации в кровь.
Сущность изобретения
Предусмотрены молекулы человеческих антител, связывающихся иммуноспецифически с CXCR2 человека. Указанные молекулы человеческих антител являются более избирательными антагонистами CXCR2, чем описанные в настоящее время низкомолекулярные антагонисты CXCR2, более сильными антагонистами вызванной CXCL1 и CXCL5 активации CXCR2, чем описанные в настоящее время антитела-антагонисты CXCR2, и противодействуют привлечению нейтрофилов в ткани без сильного истощения числа циркулирующих нейтрофилов. Молекулы человеческих антител содержат CDR1, CDR2 и CDR3 тяжелой цепи по SEQ ID NO: 167 и CDR1, CDR2 и CDR3 легкой цепи по SEQ ID NO: 168 либо CDR1, CDR2 и CDR3 тяжелой цепи по SEQ ID NO: 226 и CDR1, CDR2 и CDR3 легкой цепи по SEQ ID NO: 227 и ингибируют активацию CXCR2 человека под действием CXCL1 человека или CXCL5 человека. В некоторых воплощениях указанные молекулы человеческих антител способны ингибировать активацию CXCR2 под действием CXCL1 или CXCL5 у субъекта, не вызывая тяжелой стойкой нейтропении.
Также предусмотрены фармацевтические композиции, содержащие молекулы человеческих антител.
Также предусмотрены молекулы нуклеиновой кислоты, кодирующие молекулы человеческих антител, векторы, содержащие молекулы нуклеиновой кислоты, и клетки, трансформированные для экспрессии молекул человеческих антител.
Также предусмотрены способы предотвращения или лечения нейтрофилии в периферических тканях субъектов типа нейтрофилии дыхательных путей. Также предусмотрены способы снижения уровня моноцитов в периферических тканях субъектов. Также предусмотрены способы уменьшения эозинофилии в периферических тканях субъектов.
Также предусмотрены способы снижения острого воспаления дыхательных путей, способы предотвращения или снижения хронического воспаления дыхательных путей, к примеру, при бронхоэктазии, способы снижения опухолевой нагрузки, способы остановки или замедления роста рака, способы уменьшения хронической боли, способы предотвращения или уменьшения нейровоспаления типа как при рассеянном склерозе, способы снижения воспаления в печени, способы снижения воспаления в поджелудочной железе или способы уменьшения симптомов диабета I типа. Способы включают введение субъектам терапевтически или профилактически эффективного количества любых из указанных молекул человеческих антител или любых из раскрытых фармацевтических композиций для лечения или профилактики указанных заболеваний у субъектов.
Также предусмотрены указанные молекулы человеческих антител или фармацевтические композиции для применения при профилактике или лечении нейтрофилии дыхательных путей или острого воспаления легких. Также предусмотрено применение молекул человеческих антител или фармацевтических композиций при изготовлении лекарственных средств для профилактики или лечения нейтрофилии дыхательных путей или острого воспаления легких.
Краткое описание фигур
Сущность изобретения, а также нижеследующее подробное описание станет более понятным при чтении вместе с прилагаемыми чертежами. В целях иллюстрации раскрытых молекул, способов и применений человеческих антител на чертежах представлены типичные воплощения молекул, способов и применений человеческих антител; однако молекулы, способы и применения человеческих антител не ограничиваются приведенными конкретными воплощениями.
На фиг. 1A и 1B представлены результаты типичного исследования доза-эффект по ингибированию индуцированной CXCL8 активации CXCR2 типичными раскрытыми антителами против CXCR2 при измерении на клетках Tango™.
На фиг. 2 представлен точечный график, показывающий активность связывания типичных описанных антител против CXCR2 с природным CXCR2 человека, экспрессированным в нейтрофилах человека, и природным CXCR2 яванских макак, экспрессированным в нейтрофилах макаки. Активность связывания антител определяли в виде средних значений интенсивности флуоресценции (MFI), полученных из 4-8 независимых образцов.
На фиг. 3 представлены результаты типичного исследования доза-эффект по ингибированию опосредованной CXCL1 активации CXCR2 выбранными антителами против CXCR2 при измерении на клетках Tango™.
На фиг. 4A и 4B представлено выравнивание аминокислотных последовательностей типичных вариантов BKO-4A8 с эффективностью, близкой исходному BKO-4A8, и представлена консенсусная последовательность. Фиг. 4A = вариабельные области тяжелой цепи (BKO-4A8 по SEQ ID NO: 17; консенсусная последовательность SEQ ID NO: 167); фиг. 4B = вариабельные области легкой цепи (BKO-4A8 по SEQ ID NO: 18; консенсусная последовательность SEQ ID NO: 168). Расположение участков CDR в этих последовательностях приводится согласно Kabat. Соответственно, 53-й аминокислотный остаток в выравнивании на фиг. 4A имеет номер 52a согласно Kabat (хотя вариант G52aD содержит замену G на D по 53-м остатку, однако остаток именуется 52a). Точно так же на фиг. 4B 96-й аминокислотный остаток именуется 95a. На фиг. 4A представлены SEQ ID NO: 17, 53-75 и 167 и последовательности CDR1, CDR2 и CDR3 по SEQ ID NO: 169-171, соответственно, в порядке появления. На фиг. 4B представлены SEQ ID NO: 18, 76-97 и 168 и последовательности CDR1, CDR2 и CDR3 по SEQ ID NO: 172-174, соответственно, в порядке появления.
На фиг. 5A и 5B представлено выравнивание аминокислотных последовательностей типичных комбинаторных вариантов BKO-4A8 (сокращенно “Var”) с исходным BKO-4A8 и представлена консенсусная последовательность на основе этих вариантов. Фиг. 5A = вариабельные области тяжелой цепи (BKO-4A8 по SEQ ID NO: 17; консенсусная последовательность SEQ ID NO: 226); фиг. 5B = вариабельные области легкой цепи (BKO-4A8 по SEQ ID NO: 18; консенсусная последовательность SEQ ID NO: 227). На фиг. 5A представлены SEQ ID NO: 17, 98-108, 163-165 и 226 и последовательности CDR1, CDR2 и CDR3 по SEQ ID NO: 228-230, соответственно, в порядке появления. На фиг. 5B представлены SEQ ID NO: 18, 109-110 и 227 и последовательности CDR1, CDR2 и CDR3 по SEQ ID NO: 231-232, соответственно, в порядке появления.
На фиг. 6A и 6B представлены результаты исследования доза-эффект по ингибированию опосредованной CXCL1 (фиг. 6A) и CXCL8 (фиг. 6B) активации CXCR2 выбранными антителами BKO-4A8 против CXCR2 и оптимизированными антителами BKO-4A8-101c, BKO-4A8-103c, BKO-4A8-104c и BKO-4A8-105c при измерении на клетках Tango™.
На фиг. 7 представлены результаты исследования доза-эффект по ингибированию опосредованной хемокинами ELR+CXC активации CXCR2 указанным антителом BKO-4A8-101c против CXCR2 при измерении на клетках Tango™.
На фиг. 8 представлены результаты исследования доза-эффект по ингибированию опосредованной CXCL1, CXCL5 и CXCL8 активации CXCR2 указанным антителом BKO-4A8-101c против CXCR2 при измерении по потокам кальция.
На фиг. 9 представлена активность связывания с CXCR2 указанного антитела BKO-4A8 против CXCR2, переформатированного на других константных областях IgG человека, при определении методом проточной цитометрии.
На фиг. 10 представлены результаты исследования доза-эффект по ингибированию опосредованной CXCL8 активации CXCR2 указанным антителом BKO-4A8 против CXCR2, переформатированным на других константных областях IgG человека, при измерении на клетках Tango™.
На фиг. 11 представлены результаты исследования по связыванию антитела BKO-4A8-101c против CXCR2 с различными представителями семейства CXCR человека. Результаты показали, что среди представителей семейства CXCR человека только BKO-4A8-101c связывается с CXCR2.
На фиг. 12A и 12B представлен типичный профиль связывания BKO-4A8-101c (заштрихованная гистограмма) с фенотипически определенными гемопоэтическими клетками периферической крови человека при определении методом проточной цитометрии (N = 8), включая изотипные контроли (незаштрихованная гистограмма IgG человека). Экспрессия была высокой у нейтрофилов (фиг. 12A), тогда как у моноцитов (фиг. 12B) наблюдались промежуточные уровни CXCR2.
На фиг. 13A, 13B и 13C представлены результаты подкожной сенсибилизации и интраназального заражения (на 14-й день) с помощью антигена клеща домашней пыли (HDM), который вызывал признаки острого аллергического (астматического) воспаления в легких у трансгенных мышей с CXCR2 человека. В частности, после контрольного заражения у мышей проявлялось умеренное или выраженное многоочаговое воспаление легких с эозинофилами и легкая или умеренная гиперплазия бокаловидных клеток в бронхиолах по сравнению с контрольными (необработанными) мышами, у которых почти или совсем не было воспаления. Обработка BKO-4A8-mIgG приводила к снижению тяжести патологии, включая значительное снижение числа нейтрофилов (фиг. 13A) и эозинофилов в легких (фиг. 13B) и показателя плотности слизи (фиг. 13C) по сравнению с носителем.
На фиг. 14A и 14B представлены результаты по активности антитела BKO-4A8-101c против CXCR2 на модели острого воспаления легких у яванских макак. Аэрозольная ингаляция липополисахарида (LPS) (в день 0) успешно вызывала признаки острого нейтрофильного воспаления в легких яванских макак. Обработка антителом BKO-4A8-101c против CXCR2 (1 мг/кг) за 1 час до введения LPS в день 0 приводила к значительному снижению числа нейтрофилов в бронхоальвеолярном смыве через 24 часа после введения LPS (фиг. 14A). На число нейтрофилов в периферической крови не влияли три повторных введения BKO-4A8-101c при введении с двухнедельными интервалами в дни 0, 14 и 28. Представлены медианы и интервалы по группам, N = 4 (фиг. 14B).
На фиг. 15A, 15B и 15C представлено избирательное ингибирование индуцированной хемокинами повышающей регуляции CD11b в обогащенных нейтрофилах человека. Антитело против CXCR2 значительно ингибировало ответ на CXCL1 (p=0,0002) (фиг. 15A) и CXCL5 (p=0,0001) (фиг. 15B). Антитело против CXCR2 ингибировало значительно сильнее, чем низкомолекулярный антагонист 5 в тех же анализах (p <0,0058) (фиг. 15A-B). Опосредованное CXCL8 повышение уровня CD11b уменьшалось антагонистом CXCR1 (данные не приводятся), но не антителом против CXCR2 или антагонистом 5 (фиг. 15C).
Раскрытие сущности изобретения
Раскрытые молекулы человеческих антител, способы и применения станут более понятными при обращении к следующему подробному описанию вместе с прилагаемыми фигурами, которые входят в состав этого описания. Следует понимать, что раскрытые молекулы человеческих антител, способы и применения не ограничиваются конкретными молекулами человеческих антител, способами и применениями, описанными и/или приведенными здесь, а используемая при этом терминология предназначается для описания конкретных воплощений только для примера, а не для ограничения заявленных молекул человеческих антител, способов и применений.
Если специально не указано иначе, любое описание насчет возможного механизма или способа действия или причины для усовершенствования служит только для иллюстрации, а раскрытые молекулы человеческих антител, способы и применения не должны ограничиваться правильностью или неправильностью такого предлагаемого механизма или способа действия или причины для усовершенствования.
Описание по всему тексту относится к молекулам человеческих антител и способам применения данных молекул человеческих антител. Если в описании изложен или заявлен признак или воплощение, связанные с молекулами человеческих антител, то такой признак или воплощение в равной степени применимы к способам применения данных молекул человеческих антител. Точно так же, если в описании изложен или заявлен признак или воплощение, связанные со способом применения молекул человеческих антител, то такой признак или воплощение в равной степени применимы к молекулам человеческих антител.
Если здесь приведен или задан диапазон числовых значений, то он включает его конечные точки и все отдельные целые числа и дроби в пределах этого диапазона, а также включает каждый из более узких диапазонов в его пределах, образованных всеми различными возможными комбинациями этих конечных точек и внутренних целых чисел и дробей, составляя подгруппы из большей группы значений в пределах указанного диапазона в той же степени, как если бы каждый из этих более узких диапазонов был указан прямо. Если же приведен диапазон числовых значений, больших, чем указанное значение, то диапазон, тем не менее, является конечным и ограничен на своем верхнем конце тем значением, которое действует в контексте изобретения, как описано здесь. Если же приведен диапазон числовых значений, меньших, чем указанное значение, то диапазон, тем не менее, ограничен на своем нижнем конце значением, отличным от нуля. Рамки изобретения не должны ограничиваться конкретными значениями, указанными при определении диапазона. Все диапазоны являются инклюзивными и могут комбинироваться.
Следует иметь в виду, что некоторые признаки раскрытых молекул человеческих антител, способов и применений, которые для ясности описаны здесь в контексте отдельных воплощений, также могут быть представлены в комбинации в виде единого воплощения. И наоборот, различные признаки раскрытых молекул человеческих антител, способов и применений, которые для краткости описаны в контексте одного воплощения, также могут быть представлены по отдельности или в любой субкомбинации.
По всему описанию и формуле изобретения применяются различные термины, относящиеся к аспектам описания. Таким терминам следует придавать их принятые в данной области значения, если не указано иначе. Другие специально определенные термины следует истолковывать в соответствии с приведенными здесь определениями.
В настоящем изобретении формы единственного числа включают значения множественного числа.
Термин “примерно” в отношении числовых диапазонов, отсечений или конкретных значений применяется для указания того, что приведенные значения могут отличаться вплоть до 10% от указанного значения. Поскольку многие числовые значения, используемые здесь, определяются экспериментально, то специалистам в данной области должно быть понятно, что такие определения могут, а зачастую и будут варьироваться в различных экспериментах. Используемые здесь значения не следует рассматривать как чрезмерно ограничивающие из-за этих присущих им вариаций. Так, термин “примерно” обычно охватывает вариации в ±10% или меньше, вариации в ±5% или меньше, вариации в ±1% или меньше, вариации в ±0,5% или меньше или вариации в ±0,1% или меньше от указанного значения. Когда значения выражаются при помощи приставки “примерно”, то следует понимать, что определенные формы значений составляют другие воплощения.
Ссылка на конкретное числовое значение включает по меньшей мере само это значение, если контекстом четко не требуется иначе.
Термин “включающий” должен включать примеры, охватываемые терминами “состоящий в основном из” и “состоящий из”; точно так же термин “состоящий в основном из” должен включать примеры, охватываемые термином “состоящий из”.
В настоящем изобретении выражение “причем молекула антитела ингибирует индуцированную CXCL1 активацию CXCR2 или индуцированную CXCL5 активацию CXCR2” и подобные выражения относятся к способности описанных молекул человеческих антител уменьшать индуцированную CXCL1 или индуцированную CXCL5 активацию CXCR2 при определении по рекрутингу β-аррестина на клетках Tango™ примерно на 80%, на 85%, на 90%, на 92%, на 95%, на 97% или на 100% по сравнению с уровнем индуцированной CXCL1 и/или CXCL5 активации CXCR2 в отсутствие описанных молекул человеческих антител со значением IC50 от 0,08 до 0,5 нМ при концентрации 1,5-3,4 нМ для CXCL1 и 47,7-150 нМ для CXCL5.
В настоящем изобретении “лечение” и подобные термины относятся к по меньшей мере одному из следующего: уменьшению тяжести и/или частоты симптомов, устранению симптомов, ослаблению или устранению основной причины симптомов, снижению частоты или вероятности симптомов и/или их первопричины и/или исправлению или коррекции повреждений, прямо или косвенно вызванных описанными заболеваниями или расстройствами. Лечение также может включать продление выживаемости по сравнению с ожидаемой выживаемостью у субъектов, не получающих описанные молекулы человеческих антител или содержащие их фармацевтические композиции.
В настоящем изобретении “предотвращение” и подобные термины относятся к профилактическим или поддерживающим мерам. Субъектами для получения таких профилактических или поддерживающих мер являются те, кто подвержен риску возникновения описанных заболеваний или нарушений, например, вследствие генетической предрасположенности или факторов окружающей среды, или же те, кто ранее проходил лечение от описанных заболеваний или нарушений и получает терапевтически эффективные дозы описанных молекул человеческих антител или фармацевтических композиций в качестве поддерживающего лекарства (напр., для поддержания низкого уровня нейтрофилов в легких).
В настоящем изобретении “введение субъекту” и подобные термины обозначают процедуру, при которой описанные молекулы человеческих антител или содержащие их фармацевтические композиции вводятся/предоставляются пациентам с тем, чтобы целевые клетки, ткани или сегменты тела субъекта контактировали с описанными молекулами человеческих антител.
Выражение “терапевтически эффективное количество” означает такое количество описанных молекул человеческих антител или содержащих их фармацевтических композиций, как описано здесь, которое эффективно для достижения конкретного биологического, терапевтического или профилактического результата, без ограничения, типа биологических или терапевтических результатов, раскрытых, описанных или приведенных здесь. Терапевтически эффективное количество может варьироваться в зависимости от таких факторов, как заболевание, возраст, пол и вес индивида, а также способность композиции вызывать требуемые реакции у субъекта. Типичные показатели терапевтически эффективного количества включают, к примеру, улучшение самочувствия субъекта, снижение нейтрофилии в одной или нескольких периферических тканях типа уменьшения нейтрофилии дыхательных путей, снижение числа моноцитов в одной или нескольких периферических тканях, снижение острого воспаления дыхательных путей, снижение хронического воспаления дыхательных путей, например, при бронхоэктазии, снижение опухолевой нагрузки, остановку или замедление роста рака, ослабление хронической боли, снижение нейровоспаления типа как при рассеянном склерозе, снижение воспаления в печени, снижение воспаления в поджелудочной железе или уменьшение симптомов диабета I типа.
В настоящем изобретении “фармацевтически приемлемый носитель” или “фармацевтически приемлемый эксципиент” означает такой материал, который в сочетании с активным ингредиентом (типа раскрытых молекул человеческих антител) позволяет ингредиенту сохранять биологическую активность и не реагирует с иммунной системой субъекта. Примеры включают, без ограничения, любые стандартные фармацевтические носители, как-то фосфатно-солевой буферный раствор, вода, различные типы смачивающих веществ (типа полисорбата 20, полисорбата 80) и такие соли трис(гидроксиметил)аминометана (“трис”), как гидрохлорид, ацетат, малеат и лактат. Также в качестве стабилизирующих веществ можно добавлять аминокислоты (как-то гистидин, глутамин, глутамат, глицин, аргинин), сахара (такие как сахароза, глюкоза, трегалоза), хелаторы (напр., ETDA) и антиоксиданты (напр., восстановленный цистеин). Предпочтительными разбавителями для аэрозольного или парентерального введения являются фосфатно-солевой или нормальный (0,9%) физраствор. Композиции, содержащие такие носители, составляются хорошо известными стандартными методами (напр., см. Remington's Pharmaceutical Sciences, 18th edition, A. Gennaro, ed., Mack Publishing Co., Easton, PA, 1990; и Remington, The Science and Practice of Pharmacy, 20th Ed., Mack Publishing, 2000). В предпочтительных воплощениях фармацевтические композиции представляют собой композиции для парентерального введения.
Термин “субъект” в настоящем изобретении относится к обезьянам типа яванских макак и к людям, наиболее предпочтительно к людям. При этом “субъект” и “пациент” применяются взаимозависимым образом.
Термин “антитело” и подобные термины применяются в широком смысле и включают молекулы иммуноглобулина, включая моноклональные антитела, фрагменты антител, биспецифичные или мультиспецифичные антитела, димерные, тетрамерные или мультимерные антитела и одноцепочечные антитела. Иммуноглобулины могут относиться к пяти основным классам, а именно IgA, IgD, IgE, IgG и IgM, в зависимости от аминокислотной последовательности константного домена тяжелой цепи. IgA и IgG еще подразделяются на изотипы IgA1, IgA2, IgG1, IgG2, IgG3 и IgG4. Легкие цепи антител любого вида позвоночных могут относиться к одному из двух четко различимых типов, а именно каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей их константных доменов.
“Фрагмент антитела” означает часть молекулы иммуноглобулина, которая сохраняет свойства специфического связывания антигена исходного полноразмерного антитела (т.е. ее антигенсвязывающий фрагмент). Типичные фрагменты антител содержат определяющие комплементарность участки тяжелой цепи (HCDR) 1, 2 и 3 и определяющие комплементарность участки легкой цепи (LCDR) 1, 2 и 3. Другие типичные фрагменты антител содержат вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL). Фрагменты антител включают, без ограничения: Fab-фрагмент, моновалентный фрагмент, состоящий из VL, VH, константных доменов легкой (CL) и тяжелой цепи 1 (CH1); F(ab)2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирной области; и Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела. Домены VH и VL могут подвергаться инженерии и соединяться друг с другом через синтетический линкер, образуя различные типы конструкций одноцепочечных антител, в которых домены VH/VL образуют внутримолекулярные или межмолекулярные пары в тех случаях, когда домены VH и VL экспрессируются отдельными конструкциями одноцепочечных антител с образованием моновалентного антигенсвязывающего сайта, типа одноцепочечных Fv (scFv) или диател; как описано, к примеру, в Int. Pat. Pub. Nos. WO 1998/044001, WO 1988/001649, WO 1994/013804 и WO 1992/001047. Эти фрагменты антител получают методами, хорошо известными специалистам в данной области, и фрагменты проверяют на пригодность таким же образом, как и полноразмерные антитела.
Каждая вариабельная область тяжелой цепи или легкой цепи антитела состоит из четырех “каркасных” участков (FR), которые чередуются с тремя “определяющими комплементарность участками” (CDR) в порядке FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (от N- к C-концу). Три CDR в VH обозначаются как HCDR1, HCDR2, HCDR3, а три CDR в VL обозначаются как LCDR1, LCDR2, LCDR3, соответственно. Расположение и размер CDR определяются по правилам, которые идентифицируют участки изменчивости последовательности в вариабельных областях иммуноглобулина (Wu and Kabat, J Exp Med 132:211-50, 1970; Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991). Аминокислотные остатки вариабельной области нумеруются по системе Kabat (ibid.). “Каркасные участки” представляют собой остальные последовательности вариабельной области, отличные от тех, которые определены как CDR.
“Человеческое антитело” означает антитело, содержащее вариабельные области тяжелой и легкой цепи, в которых и каркасные участки, и сайты связывания антигена происходят из последовательностей человеческого происхождения. Если антитело содержит константную область, то константная область также происходит из последовательностей человеческого происхождения. Человеческое антитело содержит вариабельные области тяжелой или легкой цепи, которые “происходят из” последовательностей человеческого происхождения, если вариабельные области антитела получены из системы, в которой используются гены иммуноглобулина зародышевой линии человека или реаранжированные гены иммуноглобулина человека. Такие системы включают библиотеки генов иммуноглобулина человека в системах фагового дисплея и трансгенных животных типа мышей или крыс, несущих локусы иммуноглобулина человека. “Человеческое антитело” может содержать аминокислотные отличия по сравнению с последовательностями иммуноглобулина зародышевой линии человека или реаранжированными последовательностями иммуноглобулина, например, вследствие природных соматических мутаций или преднамеренного введения замен в каркасные участки или сайты связывания антигена. Как правило, “человеческое антитело” по аминокислотной последовательности по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентично аминокислотной последовательности, кодируемой последовательностями иммуноглобулина зародышевой линии человека или реаранжированным геном иммуноглобулина человека. В некоторых случаях “человеческое антитело” может содержать консенсусные последовательности каркасных участков, полученные при анализе каркасных участков человека, например, как описано в Knappik et al., J Mol Biol 296: 57-86, 2000, или синтетический HCDR3, включенный в библиотеку генов иммуноглобулина человека в системе фагового дисплея, как описано, к примеру, в Shi et al., J Mol Biol 397:385-96, 2010; и Int. Pat. Pub. No. WO 2009/085462.
Человеческие антитела, хотя они и происходят из последовательностей иммуноглобулинов человека, могут быть получены в системах типа фагового дисплея со встраиванием синтетических CDR и/или синтетических каркасных участков и/или могут быть подвергнуты мутагенезу in vitro для улучшения свойств антител в вариабельных областях или константных областях либо тех и других, получая антитела, которые в природе не существуют в репертуаре антител зародышевой линии человека in vivo.
“Моноклональное антитело” означает популяцию молекул антител практически одного молекулярного состава. Моноклональное антитело проявляет только одну специфичность связывания и сродство к определенному эпитопу, а в случае биспецифичного моноклонального антитела - двойную специфичность связывания с двумя разными эпитопами. Таким образом, моноклональное антитело означает популяцию антител с одним аминокислотным составом в каждой тяжелой и каждой легкой цепи, за исключением возможных хорошо известных изменений типа удаления C-концевого лизина из тяжелой цепи антитела и вариантов процессинга, при которых происходит неполное отщепление N-концевой лидерной последовательности, которая вырабатывается в клетке и обычно отщепляется при секреции. Например, в патенте США 8241630 описано коммерческое антитело, у которого в 5-15% популяции антител сохраняется лидерная последовательность. Моноклональные антитела могут иметь гетерогенное гликозилирование в популяции антител. Моноклональное антитело может быть моноспецифичным или мультиспецифичным либо моновалентным, бивалентным или поливалентным. В термин моноклональное антитело входят и биспецифичные антитела.
“Эпитоп” означает ту часть антигена, с которой специфически связывается антитело. Эпитопы обычно состоят из химически активных (как-то полярных, неполярных или гидрофобных) поверхностных группировок таких молекул, как аминокислоты или боковые цепи полисахаридов, и могут иметь специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Эпитоп может состоять из смежных и/или несмежных аминокислот, образующих конформационную пространственную единицу. У несмежного эпитопа аминокислоты из различных частей линейной последовательности антигена приходят в непосредственную близость в трехмерном пространстве за счет укладки белковой молекулы.
“Вариант” означает такой полипептид или полинуклеотид, который отличается от эталонного полипептида или эталонного полинуклеотида одной или несколькими модификациями, к примеру, заменами, вставками или делециями.
Выражение “иммуноспецифически связывается” относится к способности описанных молекул человеческих антител предпочтительно связываться со своей мишенью (CXCR2 в случае антител против CXCR2) без предпочтительного связывания с другими молекулами семейства CXCR в образцах, содержащих смешанные популяции молекул. Молекулы человеческих антител, которые иммуноспецифически связываются с CXCR2, практически не содержат других антител, имеющих другую антигенную специфичность (напр., антитело против CXCR2 практически не содержит антител, которые специфически связываются с другими антигенами, чем CXCR2). Однако молекулы антител, которые иммуноспецифически связываются с CXCR2 человека, могут обладать перекрестной реактивностью к другим антигенам типа ортологов CXCR2 человека, включая CXCR2 Macaca fascicularis (яванской макаки). Описанные здесь молекулы антител способны иммуноспецифически связываться как с природным CXCR2 человека, так и с таким CXCR2 человека, который вырабатывается рекомбинантно в клетках млекопитающих или прокариотических клетках.
В настоящем изобретении “тяжелая стойкая нейтропения” означает, что абсолютное число нейтрофилов (ANC) в периферической крови составляет менее 0,4×109 клеток/л на протяжении более 2 недель. Тяжелую стойкую нейтропению можно классифицировать следующим образом:
• 1-я степень означает легкий случай (0,8-1,0×109 клеток/л)
• 2-я степень означает умеренный случай (0,6-0,8×109 клеток/л)
• 3-я степень означает тяжелый случай (0,4-0,6×109 клеток/л)
• 4-я степень означает потенциально опасный для жизни случай (менее 0,4×109 клеток/л)
(см. Таблицу по классификации тяжести нежелательных явлений у взрослых и детей из Отдела СПИД (DAIDS) Национального института аллергии и инфекционных заболеваний, Национальные институты здравоохранения, Министерство здравоохранения и социальных служб США, версия 2.0, ноябрь 2014 г.).
В настоящем изобретении применяются следующие сокращения: вариабельная область тяжелой цепи (VH); вариабельная область легкой цепи (VL); определяющий комплементарность участок (CDR); CDR тяжелой цепи (HCDR); CDR легкой цепи (LCDR); рецептор-2 CXC-хемокинов (CXCR2); и CXC-хемокиновый лиганд 1, 2, 3, 5, 6, 7 и 8 (CXCL1, 2, 3, 5, 6, 7 и 8).
Описанные молекулы антител могут содержать одну или несколько замен, делеций или вставок в каркасных участках и/или константных областях. В некоторых воплощениях молекулы антител IgG4 могут содержать замену S228P. S228 (нумерация остатков по системе EU) находится в шарнирной области молекул антител IgG4. Замена серина (“S”) на пролин (“P”) служит для стабилизации шарнира IgG4 и предотвращения обмена Fab-плеча in vitro и in vivo. В некоторых воплощениях молекулы антител могут содержать одну или несколько модификаций, повышающих время полужизни молекул антител in vivo. Например, в некоторых воплощениях антитела могут содержать замену M252Y, замену S254T и замену T256E (в совокупности именуются как замена “YTE”). M252, S254 и T256 (нумерация остатков по системе EU) располагаются в домене CH2 тяжелой цепи. Замена этих остатков на тирозин (“Y”), треонин (“T”) и глутамат (“E”), соответственно, защищает молекулы антител от лизосомальной деградации, тем самым повышая период полужизни молекул антител в сыворотке. В некоторых воплощениях молекулы антител могут содержать делецию C-концевого остатка лизина тяжелой цепи. Делеция C-концевого остатка лизина тяжелой цепи снижает гетерогенность молекул антител, вырабатываемых клетками млекопитающих. В некоторых воплощениях молекулы антител могут содержать комбинацию замен, делеций или вставок. Например, в некоторых аспектах описанные молекулы антител могут содержать замену S228P и делецию С-концевого остатка лизина тяжелой цепи. Известно, что константные области антител различных классов участвуют в модуляции таких эффекторных функций антител, как антителозависимая клеточная цитотоксичность (ADCC), комплемент-зависимая цитотоксичность (CDC) и антителозависимый фагоцитоз (ADP). В некоторых воплощениях описанные молекулы антител могут содержать одну или несколько замен, делеций или вставок в константных областях, которые модулируют одну или несколько эффекторных функций антител типа снижения или устранения одной или нескольких эффекторных функций. Известны и другие изменения, влияющие на эффекторные функции антител и период полужизни в кровотоке. Напр., см. Saunders KO “Conceptual Approaches to Modulating Antibody Effector Functions and Circulation Half-Life” Front. Immunol. (2019) 10:1296.
Молекулы человеческих антител
Предусмотрены молекулы человеческих антител, связывающихся иммуноспецифически с CXCR2 человека. Молекулы человеческих антител могут содержать CDR1, CDR2 и CDR3 тяжелой цепи по SEQ ID NO: 167 и CDR1, CDR2 и CDR3 легкой цепи по SEQ ID NO: 168 и ингибировать активацию CXCR2 под действием CXCL1 или CXCL5. Приведенные в табл. 19 и на фиг. 4A и 4B, SEQ ID NO: 167 и 168 представляют консенсусную вариабельную область тяжелой цепи и вариабельную область легкой цепи, соответственно (SEQ ID NO: 167 = “консенсусная VH” и SEQ ID NO: 168 = “консенсусная VL”), описанных молекул человеческих антител. Консенсусные последовательности CDR представлены в виде SEQ ID NO: 169, 170, 171, 172, 173 и 174. Нумерация в названиях указанных последовательностей CDR, если не указано иначе, приводится по Kabat. В некоторых воплощениях молекулы человеческих антител могут включать:
CDR1 тяжелой цепи, имеющий аминокислотную последовательность SX1X2X3S, где X1 означает S, Q, H, L, W или Y; Х2 - T или A; а X3 означает M, Q, D, H или W, как представлено в SEQ ID NO: 169;
CDR2 тяжелой цепи, имеющий аминокислотную последовательность AX4SX5X6X7RX8TYYADSVKG, где X4 означает I или H; Х5 - G или D; X6 означает R, S или Q; X7 - G или D; а X8 означает N или S, как представлено в SEQ ID NO: 170;
CDR3 тяжелой цепи, имеющий аминокислотную последовательность QX10X11X12, где X10 означает M, A, Q или K; X11 - G или D; а X12 означает Y, S или K, как представлено в SEQ ID NO: 171;
CDR1 легкой цепи, имеющий аминокислотную последовательность IGTSSDVGGYNYVS, как представлено в SEQ ID NO: 172;
CDR2 легкой цепи, имеющий аминокислотную последовательность X13VX14X15X16PS, где X13 означает E или D; X14 - N, D или S; X15 означает K, A, D или H; а X16 - R или Q, как представлено в SEQ ID NO: 173; и
CDR3 легкой цепи, имеющий аминокислотную последовательность SSX17AGX18NX19FGX20, где X17 означает Y или A; X18 - N, A, S, K, L, W или Y; X19 означает N, Q, D, H, K, L или Y; а X20 - V, A или K, как представлено в SEQ ID NO: 174.
Молекулы человеческих антител могут содержать CDR1, CDR2 и CDR3 тяжелой цепи по SEQ ID NO: 226 и CDR1, CDR2 и CDR3 легкой цепи по SEQ ID NO: 227. Приведенные в табл. 19 и на фиг. 5A и 5B, SEQ ID NO: 226 и 227 представляют консенсусную вариабельную область тяжелой цепи и вариабельную область легкой цепи, соответственно (SEQ ID NO: 226 = “консенсусная VH” и SEQ ID NO: 227 = “консенсусная VL”), описанных молекул человеческих антител. Консенсусные последовательности CDR представлены в виде SEQ ID NO: 228, 229, 230, 201, 231 и 232. В некоторых воплощениях молекулы человеческих антител могут включать:
CDR1 тяжелой цепи, имеющий аминокислотную последовательность SSTX21S, где X21 означает M или Q, как представлено в SEQ ID NO: 228;
CDR2 тяжелой цепи, имеющий аминокислотную последовательность AISGX23GX24X25TYYADSVKG, где X23 означает R или S; X24 - R или G; X25 означает N или S, как представлено в SEQ ID NO: 229;
CDR3 тяжелой цепи, имеющий аминокислотную последовательность QX28GY, где X28 означает M, K или A, как представлено в SEQ ID NO: 230;
CDR1 легкой цепи, имеющий аминокислотную последовательность IGTSSDVGGYNYVS, как представлено в SEQ ID NO: 201;
CDR2 легкой цепи, имеющий аминокислотную последовательность EVX30KRPS, где X30 означает N или S, как представлено в SEQ ID NO: 231; и
CDR3 легкой цепи, имеющий аминокислотную последовательность SSYAGX31NN FGV, где X31 означает N или S, как представлено в SEQ ID NO: 232.
Описанные молекулы человеческих антител могут содержать комбинации CDR тяжелой цепи и легкой цепи, представленных в табл. 1. В некоторых воплощениях, к примеру, молекулы человеческих антител могут содержать CDR1 тяжелой цепи, имеющий аминокислотную последовательность по любой из SEQ ID NO: 175-185, CDR2 тяжелой цепи, имеющий аминокислотную последовательность по любой из SEQ ID NO: 186-192, CDR3 тяжелой цепи, имеющий аминокислотную последовательность по любой из SEQ ID NO: 194-200, CDR1 легкой цепи, имеющий аминокислотную последовательность по SEQ ID NO: 201, CDR2 легкой цепи, имеющий аминокислотную последовательность по любой из SEQ ID NO: 202-209, и CDR3 легкой цепи, имеющий аминокислотную последовательность по любой из SEQ ID NO: 210-225.
Таблица 1. Последовательности CDR тяжелой цепи и легкой цепи
SEQ ID NO: 60
SEQ ID NO: 61
SEQ ID NO: 62
SEQ ID NO: 63
SEQ ID NO: 64
SEQ ID NO: 65
SEQ ID NO: 66
SEQ ID NO: 67
SEQ ID NO: 68
SEQ ID NO: 70
SEQ ID NO: 71
SEQ ID NO: 72
SEQ ID NO: 73
SEQ ID NO: 74
SEQ ID NO: 75
(SEQ ID NO: 98)
(SEQ ID NO: 102)
(SEQ ID NO: 103)
(SEQ ID NO: 104)
(SEQ ID NO: 105)
(SEQ ID NO: 107)
(SEQ ID NO: 108)
SEQ ID NO: 76
SEQ ID NO: 77
SEQ ID NO: 78
SEQ ID NO: 79
SEQ ID NO: 80
SEQ ID NO: 81
SEQ ID NO: 82
SEQ ID NO: 83
SEQ ID NO: 84
SEQ ID NO: 85
SEQ ID NO: 86
SEQ ID NO: 87
SEQ ID NO: 88
SEQ ID NO: 89
SEQ ID NO: 90
SEQ ID NO: 91
SEQ ID NO: 92
SEQ ID NO: 93
SEQ ID NO: 94
SEQ ID NO: 95
SEQ ID NO: 96
SEQ ID NO: 97
(SEQ ID NO: 109)
(SEQ ID NO: 110)
Положения замены остатков определяли по Kabat.
В некоторых аспектах молекулы человеческих антител могут содержать:
CDR1, CDR2 и CDR3 тяжелой цепи по
SEQ ID NO: 176, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 177, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 178, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 179, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 180, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 181, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 182, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 183, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 184, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 185, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 175, SEQ ID NO: 187 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 175, SEQ ID NO: 188 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 175, SEQ ID NO: 189 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 175, SEQ ID NO: 190 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 175, SEQ ID NO: 191 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 175, SEQ ID NO: 192 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 175, SEQ ID NO: 186 и SEQ ID NO: 195, соответственно;
SEQ ID NO: 175, SEQ ID NO: 186 и SEQ ID NO: 196, соответственно;
SEQ ID NO: 175, SEQ ID NO: 186 и SEQ ID NO: 197, соответственно;
SEQ ID NO: 175, SEQ ID NO: 186 и SEQ ID NO: 198, соответственно;
SEQ ID NO: 175, SEQ ID NO: 186 и SEQ ID NO: 199, соответственно; или
SEQ ID NO: 175, SEQ ID NO: 186 и SEQ ID NO: 200, соответственно; и
CDR1, CDR2 и CDR3 легкой цепи по SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 210, соответственно.
В некоторых аспектах молекулы человеческих антител могут содержать:
CDR1, CDR2 и CDR3 тяжелой цепи по SEQ ID NO: 175, SEQ ID NO: 186 и SEQ ID NO: 194, соответственно, и
CDR1, CDR2 и CDR3 легкой цепи по
SEQ ID NO: 201, SEQ ID NO: 203 и SEQ ID NO: 210, соответственно;
SEQ ID NO: 201, SEQ ID NO: 204 и SEQ ID NO: 210, соответственно;
SEQ ID NO: 201, SEQ ID NO: 205 и SEQ ID NO: 210, соответственно;
SEQ ID NO: 201, SEQ ID NO: 206 и SEQ ID NO: 210, соответственно;
SEQ ID NO: 201, SEQ ID NO: 207 и SEQ ID NO: 210, соответственно;
SEQ ID NO: 201, SEQ ID NO: 208 и SEQ ID NO: 210, соответственно;
SEQ ID NO: 201, SEQ ID NO: 209 и SEQ ID NO: 210, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 211, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 212, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 213, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 214, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 215, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 216, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 217, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 218, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 219, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 220, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 221, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 222, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 223, соответственно;
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 224, соответственно; или
SEQ ID NO: 201, SEQ ID NO: 202 и SEQ ID NO: 225, соответственно.
В некоторых аспектах молекулы человеческих антител могут содержать:
CDR1, CDR2 и CDR3 тяжелой цепи по
SEQ ID NO: 182, SEQ ID NO: 192 и SEQ ID NO: 194, соответственно;
SEQ ID NO: 182, SEQ ID NO: 192 и SEQ ID NO: 197, соответственно;
SEQ ID NO: 175, SEQ ID NO: 186 и SEQ ID NO: 197, соответственно; или
SEQ ID NO: 182, SEQ ID NO: 192 и SEQ ID NO: 195, соответственно; и
CDR1 легкой цепи, CDR2 и CDR3 по SEQ ID NO: 201, SEQ ID NO: 205, и SEQ ID NO: 213, соответственно.
Молекулы человеческих антител могут содержать CDR1 тяжелой цепи, имеющий аминокислотную последовательность по SEQ ID NO: 182, CDR2 тяжелой цепи, имеющий аминокислотную последовательность по SEQ ID NO: 192, CDR3 тяжелой цепи, имеющий аминокислотную последовательность по SEQ ID NO: 195, CDR1 легкой цепи, имеющий аминокислотную последовательность по SEQ ID NO: 201, CDR2 легкой цепи, имеющий аминокислотную последовательность по SEQ ID NO: 205, и CDR3 легкой цепи, имеющий аминокислотную последовательность по SEQ ID NO: 213.
Приведенные в табл. 19 и на фиг. 4A и 4B, SEQ ID NO: 167 и 168 представляют консенсусную вариабельную область тяжелой цепи и вариабельную область легкой цепи, соответственно (SEQ ID NO: 167 = “консенсусная VH” и SEQ ID NO: 168 = “консенсусная VL”), описанных молекул человеческих антител. Так, описанные молекулы человеческих антител могут содержать вариабельную область тяжелой цепи, имеющую аминокислотную последовательность EVQLLESGGGLVQPGGSLRLSCAASGFTFS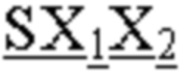
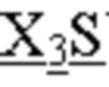 WVRQAPGKGLEWVS
WVRQAPGKGLEWVS RFTISRDNSRNTLYLQMNSLRAEDTAVYYCAX9
RFTISRDNSRNTLYLQMNSLRAEDTAVYYCAX9 WGQGILVTVSS, где X1 означает S, Q, H, L, W или Y; Х2 - Т или А; X3 означает M, Q, D, H или W; X4 - I или H; X5 - G или D; X6 означает R, S или Q; X7 - G или D; X8 - N или S; X9 - I или K; X10 означает M, A, Q или K; X11 - G или D; а X12 означает Y, S или K, как представлено в SEQ ID NO: 167, и вариабельную область легкой цепи, имеющую аминокислотную последовательность QSALTQPPSASGSPGQSVTISC
WGQGILVTVSS, где X1 означает S, Q, H, L, W или Y; Х2 - Т или А; X3 означает M, Q, D, H или W; X4 - I или H; X5 - G или D; X6 означает R, S или Q; X7 - G или D; X8 - N или S; X9 - I или K; X10 означает M, A, Q или K; X11 - G или D; а X12 означает Y, S или K, как представлено в SEQ ID NO: 167, и вариабельную область легкой цепи, имеющую аминокислотную последовательность QSALTQPPSASGSPGQSVTISC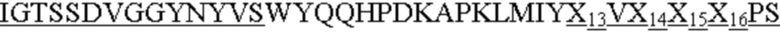 GVPDRFSGSKSGNTASLTVSGLQAEDEADYYC
GVPDRFSGSKSGNTASLTVSGLQAEDEADYYC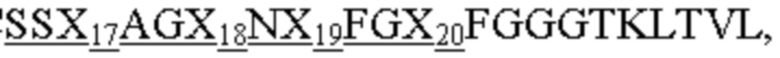 где X13 означает E или D; X14 - N, D или S; X15 означает K, A, D или H; X16 - R или Q; X17 - Y или A; X18 означает N, A, S, K, L, W или Y; X19 означает N, Q, D, H, K, L или Y; а X20 - V, A или K, как представлено в SEQ ID NO: 168. Подчеркнутые остатки представляют консенсусные CDR, как описано выше.
где X13 означает E или D; X14 - N, D или S; X15 означает K, A, D или H; X16 - R или Q; X17 - Y или A; X18 означает N, A, S, K, L, W или Y; X19 означает N, Q, D, H, K, L или Y; а X20 - V, A или K, как представлено в SEQ ID NO: 168. Подчеркнутые остатки представляют консенсусные CDR, как описано выше.
Молекулы человеческих антител могут содержать вариабельную область тяжелой цепи, имеющую аминокислотную последовательность

где X21 означает M или Q; X22 - A или P; X23 означает R или S; X24 - R или G; X25 означает N или S; X26 - R или K; X27 означает I или K; а X28 - M, K или A, как представлено в SEQ ID NO: 226, и вариабельную область легкой цепи, имеющую аминокислотную последовательность QSALTQPPSASGSPGQSVTISC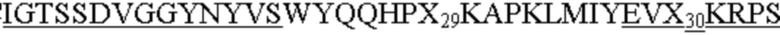 GVPDRFSGSKSGNTASLTVSGLQAEDEADYYC
GVPDRFSGSKSGNTASLTVSGLQAEDEADYYC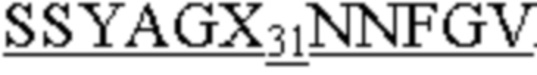 FGGGTKLTVL, где X29 означает D или G; X30 - N или S; а X31 означает N или S, как представлено в SEQ ID NO: 227. Подчеркнутые остатки представляют консенсусные CDR, как описано выше.
FGGGTKLTVL, где X29 означает D или G; X30 - N или S; а X31 означает N или S, как представлено в SEQ ID NO: 227. Подчеркнутые остатки представляют консенсусные CDR, как описано выше.
Молекулы человеческих антител могут включать:
a) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 98, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
b) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 99, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
c) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 100, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
d) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 101, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
e) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 102, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
f) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 103, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
g) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 104, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
h) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 105, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
i) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 106, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
j) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 107, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
k) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 108, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
l) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 162, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
m) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 163, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
n) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 164, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110;
o) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 165, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110; или
p) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 166, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 109 или 110.
В некоторых воплощениях молекулы человеческих антител включают:
a) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 108, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 110;
b) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 162, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 110;
c) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 163, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 110;
d) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 164, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 110;
e) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 165, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 110; или
f) вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 166, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 110.
Молекулы человеческих антител могут включать вариабельную область тяжелой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 108, и вариабельную область легкой цепи, имеющую аминокислотную последовательность по SEQ ID NO: 110.
Описанные молекулы человеческих антител могут содержать константную область тяжелой цепи IgG1, IgG2 или IgG4 человека. В некоторых воплощениях молекулы человеческих антител содержат константную область тяжелой цепи IgG1 человека. Подходящие константные области тяжелой цепи IgG1 человека включают, к примеру, аминокислотную последовательность по SEQ ID NO: 122 или 124. В некоторых аспектах константная область тяжелой цепи IgG1 человека включает аминокислотную последовательность по SEQ ID NO: 122. В некоторых аспектах константная область тяжелой цепи IgG1 человека включает аминокислотную последовательность по SEQ ID NO: 124. В некоторых воплощениях молекулы человеческих антител содержат константную область тяжелой цепи IgG2 человека. В некоторых аспектах константная область тяжелой цепи IgG2 человека включает аминокислотную последовательность по SEQ ID NO: 120. В некоторых воплощениях молекулы человеческих антител содержат константную область тяжелой цепи IgG4 человека. Подходящие константные области тяжелой цепи IgG4 человека включают, к примеру, аминокислотную последовательность по SEQ ID NO: 116 или 118. В некоторых воплощениях константная область тяжелой цепи IgG4 человека включает аминокислотную последовательность по SEQ ID NO: 116. В некоторых аспектах константная область тяжелой цепи IgG4 человека включает аминокислотную последовательность по SEQ ID NO: 118. В некоторых воплощениях константная область тяжелой цепи IgG4 человека содержит замену S228P. В некоторых воплощениях константная область тяжелой цепи IgG4 человека содержит замены M252Y, S254T и T256E. В некоторых воплощениях константная область тяжелой цепи IgG4 человека содержит делецию C-концевого остатка лизина относительно IgG4 дикого типа.
Молекулы человеческих антител могут содержать константную область легкой цепи лямбда (λ) или константную область легкой цепи каппа (κ) человека. В некоторых воплощениях молекулы человеческих антител содержат константную область легкой цепи лямбда II (λ2) человека.
Молекулы человеческих антител могут содержать константную область тяжелой цепи IgG1 человека и константную область легкой цепи лямбда II человека. Молекулы человеческих антител могут содержать константную область тяжелой цепи IgG2 человека и константную область легкой цепи лямбда II человека. Молекулы человеческих антител могут содержать константную область тяжелой цепи IgG4 человека и константную область легкой цепи лямбда II человека.
Молекулы человеческих антител могут представлять собой полноразмерные антитела либо их антигенсвязывающие фрагменты. Подходящие антигенсвязывающие фрагменты включают, к примеру, Fab-фрагменты, F(ab)2-фрагменты или одноцепочечные антитела.
Описанные молекулы человеческих антител являются избирательными антагонистами CXCR2 человека, тем самым ингибируя активацию CXCR2, индуцированную CXCL1 или CXCL5. Описанные молекулы человеческих антител также могут частично ингибировать индуцированную CXCL8 активацию CXCR2. Описанные молекулы человеческих антител также могут проявлять одно или несколько из следующих свойств:
a) ингибировать индуцированный CXCL1 приток кальция в клетках линии HTS002C-Chemiscreen™ с оптимизированным по кальцию хемокиновым рецептором CXCR2 со значением IC50 от 0,8 до 2,4 нМ при концентрации CXCL1 от 1,5 до 3,4 нМ;
b) практически не ингибировать индуцированный CXCL8 приток кальция в клетках линии HTS002C-Chemiscreen™ с оптимизированным по кальцию хемокиновым рецептором CXCR2;
c) ингибировать индуцированный CXCL1 или CXCL5 рекрутинг β-аррестина при анализе на клетках Tango™ со значением IC50 от 0,08 до 0,5 нМ при концентрации от 1,5 до 3,4 нМ для CXCL1 и от 47,7 до 150 нМ для CXCL5; или же
d) уменьшать нейтрофилию дыхательных путей у субъектов с нейтрофилией дыхательных путей, не вызывая тяжелой стойкой нейтропении.
Также предусмотрены фармацевтические композиции, содержащие любые из описанных здесь молекул человеческих антител. В некоторых воплощениях фармацевтические композиции могут содержать любые из описанных здесь молекул человеческих антител в сочетании с фармацевтически приемлемым носителем.
Также предусмотрены молекулы нуклеиновой кислоты, кодирующие любые из описанных здесь молекул человеческих антител. Типичные полинуклеотиды, кодирующие человеческие антитела либо их фрагменты, как описано здесь, представлены в виде SEQ ID NO: 233-247. Типичные полинуклеотиды, кодирующие константные области тяжелой цепи человеческих антител, представлены в виде SEQ ID NO: 248-256.
Также предусмотрены векторы, содержащие описанные здесь молекулы нуклеиновой кислоты.
Также предусмотрены клетки, трансформированные для экспрессии любых из описанных здесь молекул человеческих антител.
Способы лечения и применение
Антагонисты CXCR2 были предметом исследования, включая клинические испытания, при целом ряде заболеваний, включая патологии, связанные с нейтрофильным и/или моноцитарным воспалением, и определенные виды рака, в которых экспрессируется CXCR2 либо имеются элементы подавления нейтрофилами противораковых реакций. Были разработаны низкомолекулярные антагонисты CXCR2, например, от:
(a) COPD (к примеру, см. Miller B. et al. (2017) Late Breaking Abstract - “Danirixin (GSK1325756) improves respiratory symptoms and health status in mild to moderate COPD - results of a 1 year first time in patient study.” European Respiratory Journal, 50);
(b) гриппа (к примеру, см. исследование NCT02469298, описанное на ClinicalTrials.gov под заголовком “Safety, Tolerability and Clinical Effect of Danirixin in Adults With Influenza”);
(c) бронхоэктазии (к примеру, см. De Soyza et al. (2015) “A randomised, placebo-controlled study of the CXCR2 antagonist AZD5069 in bronchiectasis” Eur. Respir. J., 46, 1021-32);
(d) муковисцидоза (к примеру, см. Moss et al. (2013) “Safety and early treatment effects of the CXCR2 antagonist SB-656933 in patients with cystic fibrosis” J. Cyst. Fibros., 12, 241-8);
(e) тяжелой астмы (к примеру, см. Nair et al. (2012) “Safety and efficacy of a CXCR2 antagonist in patients with severe asthma and sputum neutrophils: a randomized, placebo-controlled clinical trial” Clin. Exp. Allergy, 42, 1097-103); и
(f) рака простаты (к примеру, см. исследование NCT03177187, описанное на ClinicalTrials.gov под заголовком “Combination Study of AZD5069 and Enzalutamide”).
Кроме того, имеются данные о том, что антагонизм CXCR2 может быть полезным при хронических заболеваниях верхних дыхательных путей типа хронического риносинусита (к примеру, см. Tomassen et al. (2016) “Inflammatory endotypes of chronic rhinosinusitis based on cluster analysis of biomarkers” J. Allergy Clin. Immunol., 137, 1449-1456 e4); при сосудистых заболеваниях, включая повреждения при ишемии-реперфузии (Stadtmann and Zarbock (2012) “CXCR2: From Bench to Bedside” Front Immunol., 3, 263) и коронарную болезнь сердца (к примеру, см. Joseph et al. (2017) “CXCR2 inhibition - a no-vel approach to treating coronary heart disease (CICADA): study protocol for a randomised controlled trial” Trials, 18, 473); при хронической боли (к примеру, см. Silva et al. (2017) “CXCL1/CXCR2 signaling in pathological pain: Role in peripheral and central sensitization” Neurobiol. Dis., 105, 109-116); при нейровоспалительных заболеваниях (к примеру, см. Veenstra and Ransohoff (2012) “Chemokine receptor CXCR2: physiology regulator and neuroinflammation controller?” J. Neuroimmunol., 246, 1-9), включая рассеянный склероз (например, см. Pierson et al. (2018) “The contribution of neutrophils to CNS autoimmunity” Clin. Immunol., 189, 23-28) и болезнь Альцгеймера (например, см. Liu et al. (2014) “Neuroinflammation in Alzheimer's disease: chemokines produced by astrocytes and chemokine receptors” Int. J. Clin. Exp. Pathol., 7, 8342-55); при алкогольном и неалкогольном стеатогепатите (к примеру, см. French et al. (2017) “The role of the IL-8 signaling pathway in the infiltration of granulocytes into the livers of patients with alcoholic hepatitis” Exp. Mol. Pathol., 103, 137-140; и Ye et al. (2016) “Lipocalin-2 mediates non-alcoholic steatohepatitis by promoting neutrophil-macrophage crosstalk via the induction of CXCR2” J. Hepatol., 65, 988-997); при панкреатите (к примеру, см. Steele et al. (2015) “CXCR2 inhibition suppresses acute and chronic pancreatic inflammation” J. Pathol., 237, 85-97); при диабете (к примеру, см. Citro et al. (2015) “CXCR1/2 inhibition blocks and reverses type 1 diabetes in mice” Diabetes, 64, 1329-40); и при многих типах рака (к примеру, см. Liu et al. (2016) “The CXCL8-CXCR1/2 pathways in cancer” Cytokine Growth Factor Rev., 31, 61-71). Болезнь Бехчета характеризуется активацией нейтрофилов и ее также связывали с CXCR2 (Qiao et al. “CXCR2 expression on neutrophils is upregulated during the relapsing phase of ocular Behcet disease” Curr. Eye Res. 2005, 30:195-203).
Способы включают введение субъектам терапевтически эффективного количества любых из описанных здесь молекул человеческих антител или описанных здесь фармацевтических композиций для лечения или профилактики описанных здесь воспалительных заболеваний. В некоторых воплощениях молекулы человеческих антител или содержащие их фармацевтические композиции вводятся в терапевтически эффективном количестве для лечения нейтрофилии дыхательных путей, которая определяется, к примеру, по числу нейтрофилов в мокроте, или острого воспаления легких. В таких воплощениях у субъектов, получающих молекулы человеческих антител или содержащие их фармацевтические композиции, имеется нейтрофилия дыхательных путей или острое воспаление легких. В некоторых воплощениях молекулы человеческих антител или содержащие их фармацевтические композиции вводятся в терапевтически эффективном количестве для профилактики нейтрофилии дыхательных путей или острого воспаления легких. В таких воплощениях субъекты, получающие молекулы человеческих антител или содержащие их фармацевтические композиции, подвергаются риску возникновения нейтрофилии дыхательных путей или острого воспаления легких, к примеру, вследствие генетической предрасположенности или факторов окружающей среды, или же ранее проходили лечение по поводу нейтрофилии дыхательных путей или острого воспаления легких и получают или должны получать терапевтически эффективные дозы описанных молекул человеческих антител или фармацевтических композиций в качестве поддерживающего лекарства (напр., для поддержания низкого уровня нейтрофилов в легких).
Описанные молекулы человеческих антител или описанные фармацевтические композиции также предусмотрены для применения при профилактике или лечении нейтрофилии дыхательных путей или острого воспаления легких, а также предусмотрено применение любых из описанных молекул человеческих антител или любых из описанных фармацевтических композиций при изготовлении лекарственных средств для профилактики или лечения нейтрофилии в периферических тканях, нейтрофилии дыхательных путей либо острого или хронического воспаления легких.
Нейтрофилия дыхательных путей, острое воспаление легких или то и другое могут быть представлены хронической обструктивной болезнью легких, тяжелой нейтрофильной астмой либо тем и другим.
По крайней мере на одной экспериментальной модели отмечалось, что описанные здесь антитела ингибируют миграцию эозинофилов в легкие в ответ на воспалительные стимулы. Соответственно, эти антитела применимы для лечения воспалительных заболеваний, характеризующихся эозинофилией, таких как эозинофильная астма, аллергический ринит, кожные заболевания, грибковые и паразитарные инфекции, аутоиммунные заболевания (такие как воспалительная болезнь кишечника, нейромиелит зрительного нерва, буллезный пемфигоид, аутоиммунный миокардит, первичный билиарный цирроз печени, эозинофильный гранулематоз с полиангиитом (синдром Черга-Стросса), некоторые виды рака и заболевания костного мозга.
Не придерживаясь какой-либо теории, способность представленных антител к CXCR2 блокировать миграцию эозинофилов в легкие является неожиданной, так как эозинофилы лишены рецептора CXCR2. Для того, чтобы воспалительные клетки мигрировали в какой-либо участок, они должны сначала пересечь выстилку кровеносных сосудов, состоящую из эндотелиальных клеток, в которых, как известно, экспрессируется CXCR2. Соответственно, антитела также способны ингибировать миграцию клеток посредством воздействия на эндотелиальные клетки.
Способность воздействовать на эндотелиальные клетки также указывает на то, что представленные антитела могут влиять на ангиогенез и метастазирование, что важно при раке. Соответственно, здесь предусмотрен способ лечения рака.
ПРИМЕРЫ
Нижеследующие примеры приводятся для дальнейшего описания некоторых из описанных здесь воплощений. Примеры предназначены для иллюстрации, а не для ограничения описанных воплощений.
Общие методы
Создание плазмид для получения антител
Аминокислотные последовательности вариабельных областей подвергали обратной трансляции в последовательности ДНК перед синтезом образующейся de novo ДНК. Синтезированные гены вариабельной области тяжелой цепи субклонировали в экспрессирующий вектор, содержащий последовательность полинуклеотида, кодирующего константную область IgG4 человека, содержащую замену S228P, стабилизирующую шарнирную область (SEQ ID NO: 118). Синтезированные гены вариабельной области легкой цепи лямбда субклонировали в экспрессирующий вектор, содержащий последовательность полинуклеотида, кодирующего аминокислотную последовательность константной области легкой цепи лямбда человека (SEQ ID NO: 134). Синтезированные гены вариабельной области легкой цепи каппа субклонировали в экспрессирующий вектор, содержащий последовательность полинуклеотида, кодирующего аминокислотную последовательность константной области легкой цепи каппа человека (SEQ ID NO: 135).
Краткосрочная экспрессия антител с помощью системы Expi293F™
Антитела получали путем котрансфекции плазмид для тяжелой и легкой цепи антител в клетки Expi293™ (Life Technologies). На каждые 20 мл трансфекции потребовалось 3,6×107 клеток в 20 мл среды для экспрессии в Expi293™. Трансфекцию проводили с помощью реагента ExpiFectamine™ 293 в соответствии с инструкциями производителя.
Антитела собирали центрифугированием (3000×g в течение 20 мин) между 72 и 84 часами после трансфекции. Если не указано иначе, все антитела вырабатывались в виде IgG4 человека, включающего замену S228P, стабилизирующую шарнирную область.
Очистка антител и замена буфера
Антитела очищали из материала, собранного при краткосрочной трансфекции, используя смолу с протеином А (MabSelect™ SuRe™, GE Healthcare) в соответствии с инструкциями производителя.
После элюирования антител проводили замену буфера из лимонной кислоты на PBS по Соренсену, pH 5,8 (59,5 мМ KH2PO4, 7,3 мМ Na2HPO4,2H20, 150 мМ NaCl), используя колонки для обессоливания PD-10 (52-1308-00 BB, GE Healthcare), содержащие 8,3 мл смолы Sephadex™ G-25.
Краткосрочная трансфекция членов семейства CXCR в клетки Expi293F™
Клетки Expi293F™ (Life Technologies) подвергали краткосрочной трансфекции с помощью коммерчески доступного экспрессирующего вектора pTT5 для млекопитающих (Durocher, 2002), содержащего полинуклеотид, кодирующий: CXCR1 человека (SEQ ID NO: 133); или CXCR2 человека (SEQ ID NO: 125); или CXCR3 человека (SEQ ID NO: 128); или CXCR4 человека (SEQ ID NO: 129); или CXCR5 человека (SEQ ID NO: 130); или CXCR6 человека (SEQ ID NO: 131); или CXCR7 человека (SEQ ID NO: 132); или же CXCR2 яванской макаки (SEQ ID NO: 127).
На каждые 10 мл трансфекции готовили комплексы липид-ДНК путем разведения 10 мкг плазмидной ДНК в восстановленной сывороточной среде Opti-MEM™ I (кат. №31985-062) до общего объема 1,0 мл. Разводили 54 мкл реагента ExpiFectamine™ 293 в среде Opti-MEM™ I до общего объема 1,0 мл. Трансфекцию проводили в соответствии с инструкциями производителя. Клетки инкубировали при 37°C в инкубаторе с увлажненной атмосферой с 8% CO2 в воздухе на круговой качалке при 200 об/мин. Примерно через 18-24 часа после трансфекции определяли жизнеспособность клеток и собирали трансфецированные клетки для использования.
Анализ связывания методом проточной цитометрии на краткосрочно трансфецированных клетках Expi293F™
Собранные клетки ресуспендировали в буфере FACS (1×PBS + 0,5% (мас/об) бычьего сывороточного альбумина (BSA) + 2 мМ EDTA, pH 7,2). В 96-луночный круглодонный планшет вносили примерно по 2×105 клеток на лунку. Клетки осаждали центрифугированием при 400 g в течение 5 мин при 4°C и отбрасывали супернатанты. К клеткам добавляли 25 мкл каждого исследуемого антитела или контрольного антитела и инкубировали 30 минут при 4°C. Клетки дважды промывали 100 мкл буфера FACS с последующим центрифугированием при 400 g в течение 5 мин при 4°C.
Для детектирования в соответствующие образцы добавляли 50 мкл вторичного антитела (табл. 2). В качестве положительного контроля использовали коммерчески доступные антитела, связывающиеся с трансфецированными членами семейства CXCR, чтобы убедиться, что клетки экспрессируют рецепторы. Клетки дважды промывали 200 мкл буфера FACS с последующим центрифугированием при 400 g в течение 5 мин при 4°C. Перед анализом образцов клетки ресуспендировали в 100 мкл буфера FACS. Образцы анализировали на цитометре FACSCanto™ II (Beckton-Dickinson) с помощью высокопроизводительного пробоотборника.
Таблица 2. Реагенты, использовавшиеся для метода проточной цитометрии
Анализ активности на клетках с CXCR2 человека
Анализ на клетках Tango™ с CXCR2. Для оценки способности антител ингибировать активацию CXCR2 под действием CXCL8 и CXCL1 использовали коммерчески доступную линию репортерных клеток Tango™ CXCR2-bla U2OS (ThermoFisher Scientific, Австралия). Клетки оттаивали, размножали, культивировали и замораживали в соответствии с инструкциями производителя.
Подготовка клеток Tango™ CXCR2-bla U2OS для использования при клеточном анализе. Протокол производителя был изменен, чтобы использовать 96-луночные планшеты вместо 384-луночных планшетов. Вкратце, собирали делящиеся клетки за день до использования. Клетки собирали и ресуспендировали в среде для анализа (100% FreeStyle™ Expression Medium; Life Technologies; кат. №12338-018) при плотности жизнеспособных клеток в 312 500 клеток/мл. В 96-луночные планшеты с черными стенками и прозрачным дном, обработанные для культивирования тканей, вносили по 128 мкл клеточной суспензии на лунку. Клетки инкубировали 16-20 часов при 37°C в атмосфере с 5% CO2 перед использованием при анализе.
Процедура анализа Tango™. Анализы ставили и проводили, как описано в протоколе производителя. Агонисты, используемые при анализе активности и агонистов, и антагонистов, представлены в табл. 3. Для анализа антагонистов использовали агонисты при концентрациях в диапазоне EC50-EC80. Данные считывали на считывающем флуоресценцию устройстве FlexStation® 3 (Molecular Devices), настроенном с параметрами, приведенными в табл. 4. Рассчитывали соотношения синего/зеленого излучения для каждой лунки путем деления значений синего излучения на значения зеленого излучения. Все кривые ингибирования составляли по четырем параметрам зависимости доза-эффект с помощью GraphPad Prism™ (версия 7.01).
Таблица 3. Агонисты, использовавшиеся при анализе активности на клетках
Таблица 4. Настройки считывающего флуоресценцию устройства FlexStation® 3
Препараты периферической крови
Для анализа связывания антител методом проточной цитометрии использовали цельную лейкоцитарную пленку человека, обогащенные РВМС фракции, полученные из лейкоцитарной пленки периферической крови человека, или цельную кровь яванских макак. Вкратце, кровь не обрабатывали или разбавляли 1:1 в стерильном фильтрованном при комнатной температуре фосфатно-солевом буфере (PBS). Образцы по 30 мл наслаивали на 15 мл Lymphoprep™ (Stem Cell Technologies, кат. №07851). Мононуклеарные клетки периферической крови (PBMC) обогащали центрифугированием при комнатной температуре при 700 g в течение 30 мин без торможения. Извлекали слой РВМС и промывали клетки PBS, содержащим 2 мМ EDTA, с низкоскоростным центрифугированием при 200 g для удаления примеси тромбоцитов. Цельную кровь или обогащенные РВМС фракции ресуспендировали в лизирующем растворе для эритроцитов (BioLegend, 420301). Определяли число жизнеспособных клеток и ресуспендировали клетки при 1×107 клеток на мл в буфере для FACS (1×PBS + 0,5% (мас/об) BSA + 2 мМ EDTA, pH 7,2).
Анализ связывания методом проточной цитометрии на цельной крови или на обогащенных PBMC препаратах. Анализ связывания для выявления CXCR2 в популяциях нейтрофилов крови с помощью исследуемых антител в основном проводили, как описано для анализа на подвергнутых краткосрочной трансфекции клетках Expi293F™. Связывание антител с CXCR2 человека на поверхности нейтрофилов измеряли с помощью антител против CXCR2, напрямую конъюгированных с флуорофором аллофикоцианином (APC). Для сравнения включали соответствующие контрольные изотипные антитела. Инкубировали клетки с линиеспецифичными антителами и с 2 мкг/мл конъюгированного с АРС антитела против CXCR2 или изотипного контроля, приготовленного в ледяном 3% BSA/PBS, как минимум 30 мин при 4°C. В качестве положительного контроля использовали коммерческое антитело против CXCR2 (клон 48331, R&D Systems FAB331A). Популяции нейтрофилов идентифицировали по характерной зернистости и размеру, а также по связыванию коммерческих антител против CD10 (BioLegend, клон Hl10a, кат. №312204). Клетки промывали и фиксировали (буфер для фиксации BioLegend, 420801) перед анализом. Измеряли уровень флуоресценции на поверхности клеток методом проточной цитометрии. Этим методом было установлено, что исследуемые антитела против CXCR2 связываются с нейтрофилами как человека, так и яванских макак.
Получение трансгенных мышей с CXCR2 человека
Мышей с внедренным hCXCR2 получали посредством гомологической рекомбинации в эмбриональных стволовых (ES) клетках со вставкой CXCR2 человека в экзон 1 гена CXCR2 мыши. Единый кодирующий экзон CXCR2 человека вставляли в вектор с 5′- и 3′-плечами, гомологичными геномной локации кодирующего экзона CXCR2 мыши, получая генную структуру, кодирующую CXCR2 человека, но сохраняющую некодирующие и регуляторные элементы мыши. Этот вектор подвергали электропорации в ES-клетки мышей C57Bl/6, которые внедряли в бластоцисты мышей C57Bl/6 и трансплантировали псевдобеременным самкам мышей. Детенышей скрещивали обратно с исходной линией C57Bl/6, а потомство проверяли методом Саузерн-блоттинга на гаметную передачу гена CXCR2 человека. Мышей, гетерозиготных по CXCR2 человека, скрещивали между собой для получения гомозиготной по CXCR2 человека линии и проверяли фенотип по связыванию антител против CXCR2 человека и мыши методом проточной цитометрии.
Сравнительное антитело и низкомолекулярные антагонисты CXCR2
Антагонист 1 - это антитело HY29GL, описанное в Int. Pub. No. WO2015/169811 A2 (VH и VL по SEQ ID NO: 20 и 29 из этой ссылки). Антагонист 2 - антитело CX1_5, описанное в Int. Pub. No. WO2014/170317 A1 (VH и VL по SEQ ID NO: 115 и 114 из этой ссылки). Антагонист 3 - клон 48311 антитела против CXCR2 (R&D Systems, кат. № MAB331-500). Антагонист 4 - клон 6C6 антитела против CXCR2 (BD Biosciences, кат. №555932). Антагонист 5 - низкомолекулярный антагонист CXCR2 данириксин. Антагонист 6 - низкомолекулярный антагонист CXCR2 SCH 527123.
Пример 1. Получение антител против CXCR2
Получение антител против CXCR2 с вариабельными областями человека
Для получения антител против CXCR2 человека использовали трансгенных крыс, созданных для экспрессии антител с вариабельными областями человека (как описано в Int. Pub. No. WO2008/151081). Вкратце, животных раз в неделю подвергали генетической иммунизации с помощью плазмиды, кодирующей аминокислотную последовательность CXCR2 человека (SEQ ID NO: 125) до тех пор, пока не были получены титры антител против CXCR2 человека, по данным проточной цитометрии на положительных по CXCR2 подвергнутых краткосрочной трансфекции клетках HEK-293.
Получение и размножение гибридом, экспрессирующих антитела против CXCR2
Для получения гибридом, вырабатывающих моноклональные антитела к CXCR2 человека, выделяли спленоциты и/или клетки лимфатических узлов от животных с наивысшими титрами антител против CXCR2 и сливали с клетками миеломы мыши (ATCC, CRL-1580). Клетки высеивали примерно при 1×105 клеток/мл в плоскодонные планшеты с последующей двухнедельной инкубацией в селективной среде (10% FCS и 1×HAT (Sigma). Гибридомы размножали путем серийного пассажа с четырьмя заменами среды в 96-луночных планшетах (96-луночные стадии 1-4), а затем, при необходимости, размножали во флаконах Т25 и Т75. В процессе размножения гибридом супернатанты отслеживали на активность связывания CXCR2 клеточным методом ELISA (cELISA) на клетках, подвергнутых краткосрочной трансфекции для экспрессии CXCR2 человека или CXCR2 мыши (SEQ ID NO: 125 или 126, соответственно). Связавшиеся антитела выявляли с помощью вторичного козьего антитела против IgG-HRP крысы (Southern Biotech, #3030-05).
Используя клетки лимфатических узлов и селезенки из трансгенных крыс, созданных для экспрессии последовательностей вариабельных областей человека, получали панели гибридом. Для выявления активности связывания с CXCR2 человека в супернатантах, полученных в процессе размножения гибридом, использовали клеточный метод ELISA (cELISA) (табл. 5). Гибридомы, сохраняюшие после нескольких пассажей экспрессию антител, связывающих CXCR2, отбирали для секвенирования ДНК.
Таблица 5. Связывание супернатантов гибридом с клетками, трансфецированными CXCR2 человека или CXCR2 мыши, при определении методом cELISA
* Единицы флуоресценции относительно положительного контроля (100%)
Секвенирование антител, вырабатываемых клетками гибридом
Выделяли вариабельные домены антител методом полимеразной цепной реакции с обратной транскрипцией (RT-PCR), используя в качестве матрицы РНК, полученную из осадков неклональных клеток гибридомы. РНК выделяли из планшетов с гибридомами с помощью 96-луночного набора для очистки общей РНК Genelute™ (Sigma #RTN9602, RTN9604) в соответствии с методикой производителя. Для стандартной RT-PCR проводили обратную транскрипцию РНК в кДНК с помощью праймера олиго(dT) и набора AccuScript PfuUltra® II RT-PCR (Agilent #600184). Составляли реакции синтеза кДНК в соответствии с методикой производителя и синтез проводили синтез кДНК при 42°C в течение 30 мин. Для ПЦР с быстрой 5'-амплификацией концов кДНК (5'-RACE) проводили обратную транскрипцию РНК в кДНК с помощью набора SMARTer® RACE (Takara) в соответствии с инструкциями производителя, получая кДНК, готовую для 5'-RACE.
Амплификацию вариабельных областей человеческих антител из панели гибридом проводили методом ПЦР с помощью высокоточной ДНК-полимеразы PfuUltra II (Agilent) или Q5 (NEB) в соответствии с инструкциями производителя. Тяжелые цепи из комплекта гибридом амплифицировали с помощью пар праймеров, специфичных для последовательности ДНК константной области тяжелой цепи грызунов и последовательностей ДНК лидерных последовательностей тяжелой цепи человека. Вариабельные области легкой цепи лямбда из панели гибридом амплифицировали таким же образом с помощью пар праймеров, специфичных для последовательности ДНК константной области лямбда человека и последовательностей ДНК лидерных последовательностей цепи лямбда человека.
Концентрацию полученной очищенной ДНК определяли на спектрофотометре методом Nanodrop. Секвенирование ПЦР-фрагментов по Сэнгеру проводили с помощью олигонуклеотидов, составленных для связывания внутри ампликонов тяжелой или легкой цепи. Полученные последовательности ДНК подвергали виртуальной трансляции в аминокислотные последовательности для дальнейшего анализа перед их использованием при получении полноразмерных цепей антител. Для преобразования в полноразмерные человеческие антитела отбирали антитела с уникальными аминокислотными последовательностями.
Рекомбинантные моноклональные антитела, связывающиеся с CXCR2 человека
Гибридомы, отобранные из числа тех, которые секретируют антитела, связывающиеся с CXCR2 (как описано в табл. 5), секвенировали для идентификации ДНК вариабельной области и аминокислот методом ОТ-ПЦР, как описано выше. Затем получали эти вариабельные области антител путем синтеза генов и субклонировали в экспрессирующие векторы для млекопитающих, как описано в «Общих методах». Антитела получали путем совместной экспрессии плазмид тяжелой и легкой цепи в клетках Expi293F™ и очищали методом колоночной хроматографией с протеином А, как описано в «Общих методах». Когда из одних и тех же клеток гибридомы было идентифицировано несколько тяжелых и/или легких цепей, каждую тяжелую цепь спаривали с каждой легкой цепью, а полученные антитела получали суффиксы a, b, c и т.д. Очищенные антитела обессоливали в PBS по Соренсену pH 5,8 и тестировали методом проточной цитометрии на связывание с клетками Expi293F™, трансфецированными CXCR2 человека или CXCR1 человека, а также с ложно-трансфецированными клетками Expi293F™. Из комплекта гибридом для дальнейшей характеристики было идентифицировано 26 антител, которые связываются с CXCR2 человека, но не с CXCR1 человека или с ложно-трансфецированными клетками Expi293F™. Последовательности этих антител приведены в табл. 6.
Таблица 6. Последовательности антител с вариабельной областью человека, связывающихся с CXCR2 человека, но не с близкородственным CXCR1 человека или с ложно-трансфецированными клетками Expi293F™
(SEQ ID NO: 1)
(SEQ ID NO: 2)
(SEQ ID NO: 3)
(SEQ ID NO: 4)
(SEQ ID NO: 5)
(SEQ ID NO: 6)
(SEQ ID NO: 7)
(SEQ ID NO: 8)
(SEQ ID NO: 9)
(SEQ ID NO: 10)
(SEQ ID NO: 11)
(SEQ ID NO: 12)
(SEQ ID NO: 13)
(SEQ ID NO: 14)
(SEQ ID NO: 15)
(SEQ ID NO: 16)
(SEQ ID NO: 17)
(SEQ ID NO: 18)
(SEQ ID NO: 19)
(SEQ ID NO: 20)
SEQ ID NO: 21)
(SEQ ID NO: 22)
(SEQ ID NO: 23)
(SEQ ID NO: 24)
(SEQ ID NO: 25)
(SEQ ID NO: 26)
(SEQ ID NO: 27)
(SEQ ID NO: 28)
(SEQ ID NO: 29)
(SEQ ID NO: 30)
(SEQ ID NO: 31)
(SEQ ID NO: 32)
(SEQ ID NO: 33)
(SEQ ID NO: 34)
(SEQ ID NO: 35)
(SEQ ID NO: 36)
(SEQ ID NO: 37)
(SEQ ID NO: 38)
(SEQ ID NO: 39)
(SEQ ID NO: 40)
(SEQ ID NO: 41)
(SEQ ID NO: 42)
(SEQ ID NO: 43)
(SEQ ID NO: 44)
(SEQ ID NO: 45)
(SEQ ID NO: 46)
(SEQ ID NO: 47)
(SEQ ID NO: 48)
(SEQ ID NO: 49)
(SEQ ID NO: 50)
(SEQ ID NO: 51)
(SEQ ID NO: 52)
Пример 2. Функциональная характеристика антител против CXCR2
Связывание с CXCR2 яванской макаки
Все рекомбинантные антитела, связывающиеся с CXCR2 человека, но не с CXCR1 человека или с ложно-трансфицированными клетками Expi293™, тестировали на связывание с CXCR2 яванской макаки (SEQ ID NO: 127) на клетах Expi293F™, подвергнутых краткосрочной трансфекции плазмидой, кодирующей белок CXCR2 яванской макаки, как описано здесь. Антитела с детектируемым уровнем связывания CXCR2 яванской макаки подвергали дальнейшему изучению.
Связывание с другими членами семейства CXCR человека
Антитела, перекрестно-реактивные с CXCR2 человека и яванской макаки, тестировали методом проточной цитометрии на связывание с другими членами семейства CXCR человека - CXCR3, CXCR4, CXCR5, CXCR6 и CXCR7 на клетках Expi293F™, на подвергнутых краткосрочной трансфекции плазмидой, кодирующей CXCR3 (SEQ ID NO: 128), CXCR4 (SEQ ID NO: 129), CXCR5 (SEQ ID NO: 130), CXCR6 (SEQ ID NO: 131) или CXCR7 человека (SEQ ID NO: 132). Антитела, которые не были избирательными для CXCR2, исключали из дальнейшего анализа.
Ингибирование опосредованной CXCL8 активации CXCR2 человека
Антитела тестировали на клетках Tango™ с CXCR2, используя CXCL8 в качестве агониста, как описано в «Общих методах». Как видно из фиг. 1A и 1B, восемь антител ингибировали индуцированную CXCL8 активацию CXCR2. При этом в качестве положительного контроля использовали коммерчески доступное антитело 6C6 против CXCR2 (BD Biosciences; “BD6C6”).
Связывание антител с CXCR2 человека, экспрессированным в PBMC человека, и с CXCR2 яванской макаки, экспрессированным в PBMC яванской макаки
Восемь антител, ингибировавших опосредованную CXCL8 активацию CXCR 2, тестировали на связывание с нативным CXCR2, экспрессированным в PBMC человека и яванской макаки. Как видно из фиг. 2, два антитела, BKO-4A8 и BKO-8G3_b, проявляли высокую активность связывания с CXCR2 человека и яванской макаки, тогда как третье, BKO-9C3_a, проявляло существенный уровень связывания с CXCR2 человека и связывание выше среднего уровня с CXCR2 яванской макаки.
Ингибирование опосредованной CXCL1 активации CXCR2 человека
Антитела BKO-4A8, BKO-8G3_b и BKO-9C3_a тестировали на клетках Tango™ с CXCR2, используя CXCL1 в качестве агониста, как описано в «Общих методах». Антитело BKO-4A8 оказалось самым сильным из антител, тестируемых в этом формате. Типичные кривые ингибирования CXCL1 активации CXCR2 для этих антител представлены ниже на фиг. 3.
Пример 3. Оптимизация аминокислотной последовательности антитела BKO-4A8 против CXCR2
Конструировали варианты вариабельной области тяжелой и легкой цепи антитела BKO-4A8 против CXCR2 с тем, чтобы оптимизировать последовательность этой молекулы для обеспечения стабильности и технологичности его производства.
Варианты антитела BKO-4A8, содержащие по одной аминокислотной замене, получали, как описано ниже. Сводка по этим вариантам представлена в табл. 7.
Таблица 7. Варианты BKO-4A8
Получение плазмид, кодирующих варианты антител, методом сайт-направленного мутагенеза
Плазмиды, кодирующие цепи антител, требующие замены по отдельной аминокислоте, получали путем репликации нитей плазмиды под действием мутагенных праймеров с помощью высокоточной ДНК-полимеразы. В этом процессе используется суперспиральная двухцепочечная плазмидная ДНК в качестве матрицы и два комплементарных синтетических олигонуклеотидных праймера, причем оба содержат требуемую мутацию. Олигонуклеотидные праймеры, комплементарные каждой из противоположных нитей плазмиды, подвергаются элонгации в циклических реакциях ПЦР без смещения праймера, при этом образуются копии мутантной плазмиды, содержащие ступенчатые надрезы. После цикла реакций ПЦР их обрабатывали рестрикционным ферментом DpnI. DpnI предпочтительно разрезает исходную векторную ДНК, оставляя нетронутыми вновь синтезированные нити.
Для получения вариантов, включающих замены нескольких аминокислот, для которых требовались мутагенные олигонуклеотидные праймеры длиной более 40 нуклеотидов, вышеописанный процесс повторяли для последовательного введения замен или же синтезировали гены de novo путем сборки синтетических олигонуклеотидов. Последовательности всех ДНК-конструкций проверяли путем секвенирования ДНК по Сэнгеру перед использованием.
Получение плазмид, кодирующих варианты антител, путем синтеза полинуклеотидов
Аминокислотные последовательности вариабельных областей подвергали обратной трансляции в последовательности ДНК по технологии GeneOptimizer® перед синтезом образующейся de novo ДНК путем сборки синтетических олигонуклеотидов (GeneArt, Германия). Полинуклеотиды, кодирующие синтезируемые вариабельные области тяжелой цепи вкупе с константной областью IgG4 человека, содержащей замену S228P, стабилизирующую шарнирную область (SEQ ID NO: 118), субклонировали в экспрессирующий вектор. Полинуклеотиды, кодирующие гены синтезируемой вариабельной области легкой цепи лямбда, субклонировали в экспрессирующий вектор, кодирующий константную область легкой цепи лямбда человека (SEQ ID NO: 134).
Связывание вариантов BKO-4A8 с CXCR2
Каждый вариант тяжелой цепи экспрессировали вместе с исходной легкой цепью и наоборот. Полученные антитела очищали и тестировали на связывание с CXCR2 относительно исходного антитела BKO-4A8, как описано здесь. Варианты антител с близкими к исходному BKO-4A8 уровнями связывания представлены в табл. 8.
Таблица 8. Точечные варианты BKO-4A8 с близкими к исходному BKO-4A8 уровнями связывания CXCR2
# Означает, что этот каркасный остаток фланкирует CDR3 тяжелой цепи
На фиг. 4A и 4B представлено выравнивание последовательностей вариабельной области тяжелой цепи и вариабельной области легкой цепи, соответственно, вышеприведенных вариантов антител. Также на этих фигурах представлена консенсусная вариабельная область тяжелой цепи (“консенсусная VH”; SEQ ID NO: 167) и консенсусная вариабельная область легкой цепи (“консенсусная VL”; SEQ ID NO: 168).
Точечные варианты BKO-4A8 с близкой к BKO-4A8 эффективностью ингибирования вызванной CXCL1 или CXCL8 активации CXCR2
Шестнадцать вариантов антител, проявляющих близкие исходному BKO-4A8 уровни связывания с CXCR2, тестировали на эффективность, используя CXCL1 или CXCL8 в качестве агониста, как описано в «Общих методах». Как видно из табл. 9, двенадцать антител проявляли эффективность, близкую к исходному BKO-4A8. На фиг. 4A и 4B представлено выравнивание аминокислотных последовательностей этих вариантов относительно исходных последовательностей тяжелой и легкой цепи.
Таблица 9. Точечные варианты BKO-4A8 с близкой к BKO-4A8 эффективностью ингибирования вызванной CXCL1 или CXCL8 активации CXCR2
# Означает, что этот каркасный остаток фланкирует CDR3 тяжелой цепи
Комбинаторные варианты BKO-4A8
Проводили замену 3 каркасных аминокислот не соответствующих зародышевой линии обратно на те, что находятся в ближайшей последовательности зародышевой линии человека R75K и I94K в тяжелой цепи и D41G в легкой цепи. Также вводили замену A40P в каркасный участок 2 тяжелой цепи.
Была составлена панель комбинаторных вариантов, содержащих две или больше аминокислотных замен, для изучения возможности дальнейшей оптимизации этих последовательностей. В табл. 10 приведены все два варианта легкой цепи и 11 вариантов тяжелой цепи, которые были получены. На фиг. 5A и 5B представлено выравнивание аминокислотных последовательностей с вариабельной областью тяжелой цепи и вариабельной областью легкой цепи исходного BKO-4A8, соответственно. Также на этих фигурах представлена консенсусная вариабельная область тяжелой цепи (“консенсусная VH”; SEQ ID NO: 226) и консенсусная вариабельная область легкой цепи (“консенсусная VL”; SEQ ID NO: 227).
Таблица 10. Комбинаторные варианты BKO-4A8
Каждую тяжелую цепь экспрессировали вместе с каждой легкой цепью для получения вариантов антител с оптимизированной последовательностью. Антитела очищали и тестировали на активность связывания CXCR2, как описано в «Общих методах». Как видно из табл. 11, большинство комбинаторных вариантов антител сохраняли активность связывания CXCR2, близкую к исходному антителу BKO-4A8.
Таблица 11. Сводка по значениям EC50 для связывания комбинаторных вариантов с CXCR2
CXCR2
4A8 дикого типа
(SEQ ID NO: 109)
(SEQ ID NO: 109)
(SEQ ID NO: 110)
(SEQ ID NO: 109)
(SEQ ID NO: 110)
4A8 для VH3
(SEQ ID NO: 109)
(SEQ ID NO: 110)
4A8 для VH4
(SEQ ID NO: 109)
(SEQ ID NO: 110)
4A8 для VH5
(SEQ ID NO: 109)
(SEQ ID NO: 110)
(SEQ ID NO: 109)
(SEQ ID NO: 110)
4A8 для VH7
M34Q, N56S, M96K
(SEQ ID NO: 109)
(SEQ ID NO: 110)
4A8 для VH8
(SEQ ID NO: 109)
(SEQ ID NO: 109)
(SEQ ID NO: 110)
Были получены еще шесть комбинаторных вариантов тяжелой цепи, содержащих 4 и более аминокислотных замен, приведенных в табл. 12. Выравнивание аминокислотных последовательностей с исходной тяжелой цепью BKO-4A8 представлено на фиг. 5A. Для получения вариантов антител каждую тяжелую цепь экспрессировали совместно с легкой цепью c (SEQ ID NO: 110). Антитела очищали и тестировали на активность связывания CXCR2, как описано в «Общих методах». Активность связывания CXCR2 была снижена у антитела 102c и антитела 106c.
Таблица 12. Сводка по значениям EC50 для связывания комбинаторных вариантов с CXCR2
CXCR2
для 101c-103c
Антитела тестировали на эффективность, используя CXCL1 или CXCL8 в качестве агониста, как описано в «Общих методах». Комбинаторные варианты антител 103c, 104c и 105c проявляли меньшую эффективность по сравнению с исходным антителом, тогда как вариант 101c проявлял лучшую эффективность по сравнению с исходным антителом, как видно из табл. 13 и фиг. 6A и 6B.
Таблица 13. Сводка значений IC50 по эффективности действия комбинаторных вариантов на CXCR2
(SEQ ID NO: для VH)
по CXCL8
по CXCL1
Антитело 101c, содержащее вариабельную область тяжелой цепи “101” и вариабельную область легкой цепи “c”, было выбрано для оценки на эффективность клеточным методом из-за его благоприятных отмеченных свойств. Антитело 101c было переименовано в BKO-4A8-101c. BKO-4A8-101c содержит пять оптимизирующих замен в тяжелой и три в легкой цепи. Сравнение BKO-4A8 с BKO-4A8-101c при анализе на эффективность клеточным методом по их способности ингибировать вызванную CXCL1 или CXCL8 активацию CXCR2 показало, что изменения последовательности для оптимизации BKO-4A8-101c также повышают его эффективность по сравнению с исходным BKO-4A8, как видно из фиг. 6A и 6B.
Пример 5. Характеристика антагонистического действия против CXCR2
Характеристика ингибирования BKO-4A8-101c опосредованного лигандами рекрутинга β-аррестина
Для оценки способности антитела BKO-4A8-101c ингибировать рекрутинг β-аррестина к активированному агонистом CXCR2 использовали клетки линии Tango™ с CXCR2 человека. Все лиганды CXCR2 типа хемокинов ELR+CXC человека тестировали в опытах доза-эффект антагониста, используя расчетные значения EC50 агонистов. BKO-4A8-101c ингибировало опосредованную CXCR2 сигнализацию β-аррестина, индуцированную всеми хемокинами ELR+CXC, со сравнимыми значениями IC50 для всех исследованных агонистов (табл. 14). BKO-4A8-101c полностью ингибировало активацию CXCR2 человека под действием CXCL1, 2, 3, 5 и 6 человека дозозависимым образом, но лишь частично ингибировало CXCL7 и CXCL8 в том же диапазоне доз. Репрезентативные данные из 4 независимых экспериментов представлены на фиг. 7.
Не придерживаясь какого-либо предложенного механизма действия, предполагается, что наблюдаемое избирательное антагонистическое действие обеспечивает терапевтическое окно, позволяющее практически полное ингибирование опосредованной CXCL1 и CXCL5 миграции нейтрофилов из кровотока в ткани без существенного влияния на опосредованную CXCL8 миграцию нейтрофилов из костного мозга в кровоток. Частичное ингибирование опосредованного CXCL8 рекрутинга β-аррестина при репортерном анализе свидетельствует, что опосредованный β-аррестином путь интернализации рецептора является функциональным.
Таблица 14. Антагонистическое действие BKO-4A8-101c на CXCR2 при репортерном анализе опосредованного лигандами рекрутинга β-аррестина (n = 7-13)
Характеристика ингибирования BKO-4A8-101c опосредованного лигандами притока кальция
Один из сигнальных путей по нисходящей от активации CXCR2, который играет роль в хемотаксисе клеток, характеризуется мобилизацией (притоком) кальция. Способность BKO-4A8-101c ингибировать индуцированный лигандами CXCR2 человека приток кальция исследовали на коммерчески доступной линии клеток HTS002C-Chemiscreen™ с оптимизированным по кальцию хемокиновым рецептором CXCR2 человека. Все лиганды CXCR2 типа хемокинов ELR+CXC человека тестировали в опытах доза-эффект антагониста, используя расчетные значения EC50 агонистов.
BKO-4A8-101c сильно ингибировало индуцированный CXCL1, 2, 3, 5 и 6 человека приток кальция дозозависимым образом, но только слабо ингибировало CXCL7 и незначительно ингибировало CXCL8 в том же диапазоне доз, как видно из табл. 15. Представлены репрезентативные данные для CXCL1, CXCL5 и CXCL8 (фиг. 8).
Известно, что хемотаксическая реакция нейтрофилов опосредуется через активируемую CXCR2 мобилизацию кальция. Не придерживаясь какого-либо предложенного механизма действия, избирательное антагонистическое действие описанных здесь антител потенциально обеспечивает терапевтическое окно, позволяющее практически полное ингибирование опосредованной CXCL1 и CXCL5 миграции нейтрофилов в легкие без существенного влияния на опосредованную CXCL8 миграцию нейтрофилов из костного мозга в кровоток. Это может способствовать блокированию опосредованной нейтрофилами патологии на участках хронического воспаления без обязательного ухудшения исходных антимикробных функций, опосредованных нейтрофилами.
Таблица 15. Сводка по средним значениям IC50 BKO-4A8-101c для действия хемокинов ELR+CXC человека на CXCR2 человека при анализе притока кальция (n = 4-9)
a Недостаточно данных b Не ингибирует или данные не подходят для построения кривой доза-эффект по четырем точкам
Пример 6. Связывание и функциональная активность антител против CXCR2 in vitro не зависит от Fc-области
Вариабельные области тяжелой цепи из BKO-4A8 форматировали на других константных областях IgG человека, приведенных в табл. 16. Способность очищенных антител связываться с CXCR2 человека обычно оценивали на клетках Expi293F™, подвегнутых краткосрочной трансфекции для экспрессии CXCR2 человека (SEQ ID NO: 125). Связывание BKO-4A8 и его вариантов выявляли путем инкубации конъюгированного с флуорохромом антитела против легкой цепи лямбда IgG человека. Активность связывания у тестируемых антител, определяемая в виде средней интенсивности флуоресценции, не зависела от Fc-области антитела, как видно из фиг. 9.
Таблица 16. Варианты тяжелой цепи BKO-4A8
Для оценки способности антител против CXCR2 ингибировать рекрутирование β-аррестина к активированному агонистом CXCR2 использовали коммерчески доступную линию репортерных клеток Tango™ CXCR2-bla U2OS (ThermoFisher Scientific). Агонисты вносили в пробы в концентрации ЕС50 для анализа антагонистов. Кривые доза-эффект свидетельствуют, что на функциональную активность BKO-4A8 не повлияла модификация последовательности в области Fc, причем все исследуемые антитела проявляли сравнимую антагонистическую активность, как видно из фиг. 10.
Пример 7. Специфичность антитела BKO-4A8-101c против CXCR2
Специфичность антитела BKO-4A8-101c против CXCR2 проверяли путем оценки активности связывания на клетках Expi293F™, подвергнутых краткосрочной трансфекции для экспрессии близкородственных членов семейства CXCR человека, как показано на фиг. 11. Последовательности исследуемых представителей семейства CXCR человека приведены в табл. 19. Связывание BKO-4A8 выявляли путем инкубации конъюгированного с флуорохромом антитела против IgG человека. Было показано, что антитело BKO-4A8-101c против CXCR2 сильно и избирательно связывается с CXCR2 человека.
Пример 8. Анализ связывания методом проточной цитометрии на первичных клетках крови
Для дальнейшей характеристики антитела BKO-4A8-101c против CXCR2 проверяли его способность связываться с CXCR2 на нейтрофилах на антикоагулянтной крови человека. Связывание измеряли, используя BKO-4A8-101c, конъюгированное напрямую с флуорофором APC. Для сравнения включали контрольные антитела соответствующего изотипа, конъюгированные с APC. Клетки инкубировали с линиеспецифичными антителами и 2 мкг/мл конъюгированного с АРС антитела против CXCR2 или изотипного контроля. Измеряли уровень флуоресценции на поверхности клеток методом проточной цитометрии. Остатки клеток и нежизнеспособные клетки исключали на основании характеристик светорассеяния и включения фиксируемого красителя на жизнеспособность Zombie Violet (BioLegend, 423113). Подмножества гемопоэтических клеток идентифицировали на основании экспрессии CD45 вместе с характеристическим размером (прямое рассеяние, FSC) и гранулярностью (боковое рассеяние, SSC) вместе с экспрессией фенотипических маркеров следующим образом: T-лимфоциты = CD3; B-лимфоциты = CD20; моноциты = CD14; и лимфоциты-натуральные киллеры = CD56 (или лимфоциты CD3− CD20− CD16+). Гранулоциты идентифицировали по размеру и гранулярности, а также по отсутствию связывания с линиеспецифичными маркерами: CD3, CD19, CD20, CD56 и CD14. Кроме того, нейтрофилы выявляли по высоким уровням экспрессии CD16 и CD177, а эозинофилы идентифицировали по экспрессии Siglec-8. По этой методике BKO-4A8-101c связывается с нейтрофилами (фиг. 12A) и моноцитами (фиг. 12B) из крови человека. В качестве положительного контроля в эксперименте использовали коммерческое антитело против CXCR2 (BioLegend, 5E8/CXCR2).
Пример 9. Способность очищенных антител ингибировать вызванный агонистами опосредованный CXCR2 функциональный ответ в сравнении со сравнительными антителами и небольшими молекулами
Характеристика ингибирования BKO-4A8-101c опосредованного лигандами рекрутирования β-аррестина по сравнению со сравнительными реагентами
Способность BKO-4A8-101c блокировать активируемую лигандами сигнализацию CXCR2 сравнивали со сравнительными антителами и небольшими молекулами (см. «Общие методы») при анализе рекрутинга β-аррестина к CXCR2 методом Tango™ (Thermo), используя лиганды CXCL1, CXCL5 и CXCL8 человека при расчетных значениях EC50.
BKO-4A8-101c ингибировало опосредованную CXCR2 функциональную активность β-аррестина, вызванную комплектом известных лигандов CXCR2, со сравнимыми значениями IC50 для различных лигандов. Антитело проявляло лиганд-селективное ингибирование CXCR2-зависимого рекрутинга β-аррестина с полным ингибированием CXCL1- и CXCL5- и частичным ингибированием CXCL8-индуцированного рекрутинга β-аррестина (диапазон 70-80%), как видно из табл. 17.
Эффективность ингибирования BKO-4A8-101c опосредованной CXCL1 и CXCL5 сигнализации β-аррестина была близкой или выше, чем наблюдалось для других сравнительных антител и небольших молекул. Исходя из значений IC50, оказалось, что BKO-4A8-101c в 2-39 раз более эффективно ингибирует вызванную лигандом CXCL1 или CXCL5 активацию β-аррестина, но не полностью ингибирует индуцированную CXCL8 активацию CXCR2. Неполное ингибирование опосредованной CXCL8 репортерной активности β-аррестина свидетельствует, что опосредованный β-аррестином путь интернализации рецептора является функциональным.
Таблица 17. Сводка по средним значениям IC50 антагонистов CXCR2 для действия хемокинов ELR+CXC человека на CXCR2 человека при анализе рекрутинга β-аррестина
a Не ингибирует или данные не подходят для построения кривой доза-эффект по четырем точкам
Характеристика ингибирования BKO-4A8-101c мобилизации кальция
Способность антагонистов ингибировать активацию CXCR2 мобилизации кальция, индуцированной CXCL1 и CXCL8, оценивали на коммерчески доступной стабильной линии клеток HTS002C-Chemiscreen™ с оптимизированным по кальцию хемокиновым рецептором CXCR2 человека (Eurofins Pharma Discovery Services). CXC-лиганды вносили в пробы в концентрации ЕС50 (см. табл. 3) для анализа антагонистов. Для измерения мобилизации кальция в клетках использовали набор для анализа кальция Fluo-4 NW (Life Technologies) в соответствии с методикой производителя, который считывали на установке для высокопроизводительного скрининга клеток FLIPR Tetra (Molecular Devices). Использовали пиковый сигнал за вычетом базального сигнала из каждой лунки для построения кривых ингибирования доза-эффект по логистическому уравнению с 4 параметрами и определения значений IC50.
Способность BKO-4A8-101c блокировать индуцированный лигандами приток кальция сравнивали со сравнительными антителами и небольшими молекулами (табл. 18), используя лиганды CXCL1 и CXCL8 человека при расчетных значениях EC50. В табл. 18 представлены значения IC50 из по меньшей мере 3 независимых повторов. BKO-4A8-101c было эквивалентным или более сильным антагонистом CXCL1, чем сравнительные антитела и небольшие молекулы, и сильно ингибировало приток кальция, индуцированный CXCL1 человека. Напротив, BKO-4A8-101c и другие сравнительные антитела практически не ингибировали приток кальция, индуцированный CXCL8, тогда как сравнительные низкомолекулярные антагонисты CXCR2 оказались способными полностью ингибировать индуцированный CXCL8 приток кальция в этом анализе. Хемотаксическая реакция нейтрофилов, опосредованная CXCR2, зависит от мобилизации кальция. Не придерживаясь какого-либо предложенного механизма действия, избирательная антагонистическая активность, отмеченная у BKO-4A8-101c, обеспечивает терапевтическое окно, позволяющее практически полностью ингибировать опосредованную CXCL1 и CXCL5 миграцию нейтрофилов в ткани без существенного воздействия на опосредованную CXCL8 миграцию из костного мозга. Такая избирательность к лигандам также может влиять на градиенты хемокинов, направляющие хемотаксические реакции нейтрофилов.
Таблица 18. Сводка по значениям IC50 антагонистов CXCR2 человека для действия хемокинов ELR+CXC человека на CXCR2 человека при анализе притока кальция
a Не ингибирует или данные не подходят для построения кривой доза-эффект по четырем точкам
Пример 10. Ингибирование антителом против CXCR2 нейтрофилии легких на мышиной модели тяжелой астмы
У сенсибилизированных мышей после интраназального введения провоцирующей дозы экстракта клещей домашней пыли (HDM) развивается воспалительный профиль со смешанной эозинофилией и нейтрофилией легких вместе с гиперплазией бокаловидных клеток. Ранее сообщалось о модели тяжелой астмы с помощью SCH527123, низкомолекулярного антагониста CXCR2 в дозах 10 и 30 мг/кг (обсуждается в Young A. et al. The Effect of the CXCR1/2 Antagonist SCH257123 in a Mouse Model of Severe Asthma. Experimental Biology 2016 Meeting, 2016 San Diego, USA: The FASEB Journal, 1202.10), который работает на мышиных моделях нейтрофильного воспаления (как обсуждается в Chapman R.W. et al. A novel, orally active CXCR1/2 receptor антагонист, Sch527123, inhibits neutrophil recruitment, mucus production, and goblet cell hyperplasia in animal models of pulmonary inflammation. J Pharmacol Exp Ther. (2007) 322, 486-93). Предварительная обработка 10 и 30 мг/кг SCH527123 только подавляла количество нейтрофильных клеток максимум на 30% в BAL, что не отличалось значимо от группы, получавшей носитель клещей домашней пыли (HDM) (что обсуждается в Young et al., supra).
Антитело против CXCR2 BKO-4A8-mIgG1 (SEQ ID NO: 113 и 114) получали путем форматирования вариабельных областей тяжелой и легкой цепи BKO-4A8 на константную область IgG1 мышей с пониженной эффекторной функцией. Самок мышей с внедренным hCXCR2 подвергали сенсибилизации с помощью 50 мкг HDM в полном адъюванте Фрейнда (CFA), вводимого подкожно в день 0, и интраназального повторного введения 50 мг HDM без CFA на 14-й день. Животных обрабатывали носителем или BKO-4A8-mIgG1 (10 мг/кг) путем внутрибрюшинной инъекции на 5-й и 12-й день. Проверяли воспалительные реакции в конечной точке на 16-й день путем общего и дифференциального подсчета клеток в жидкости бронхоальвеолярного смыва (BAL) правого легкого. Левое легкое фиксировали в 10% формалине для гистопатологии и оценки образования слизи.
Обработка антителом против CXCR2 BKO-4A8-mIgG1 перед провокацией HDM приводила к снижению тяжести заболевания, включая значительное (>60%) снижение числа эозинофилов (p = 0,017) и нейтрофилов в BAL и снижение гиперплазии бокаловидных клеток (p = 0,0052) по сравнению с контрольной группой, обработанной носителем, как видно из фиг. 13A, 13B и 13C. Для выявления статистически значимых отличий между группами носителя и обработки проводили статистический анализ с помощью непараметрического непарного t-критерия Манна-Уитни и выявляли выбросы с помощью критерия Граббса (альфа = 0,01). Все статистические анализы проводили с помощью GraphPad Prism™ 7.01.
Снижение числа эозинофилов в BAL на этой модели было неожиданным. Способность BKO-4A8-mIgG1 подавлять миграцию эозинофилов подтверждает его применимость при лечении таких заболеваний с эозинофилией, как эозинофильная астма, наряду с нейтрофильными заболеваниями.
Пример 11. Индуцированное LPS острое воспаление легких у яванских макак
Наивных по биопрепаратам (т.е. не получавших ранее экзогенных биопрепаратов) самцов яванских макак случайным образом разбивали на группы, получавшие носитель или антитело против CXCR2 BKO-4A8-101c внутривенно в дозе 1 мг/кг в дни 0, 14 и 28. Через 1 час после введения исследуемых антител в день 0 животных подвергали воздействию аэрозольного бактериального липополисахарида (LPS) путем ингаляции 20 мкг/л в течение 5 мин (общая доза 20 мкг/кг). Это хорошо обоснованная модель острого воспаления легких. Через 24 часа после воздействия LPS проверяли воспалительные реакции путем общего и дифференциального подсчета клеток в жидкости бронхоальвеолярного смыва левого легкого и сравнивали с соответствующими подсчетами у наивных животных в день 14 перед обработкой. В различные моменты времени брали кровь для дифференциального подсчета клеток и собирали сыворотку для фармакокинетического анализа.
Однократная обработка аэрозолем с LPS вызывала приток нейтрофилов в легкие у животных, получавших носитель. Предварительная обработка 1 мг/кг антитела BKO-4A8-101c против CXCR2 заметно ингибировала индуцированную LPS нейтрофилию легких у яванских макак, как видно из фиг. 14А. Обработка хорошо переносилась без потери массы тела. Как видно из фиг. 14B, обработка BKO-4A8-101c не вызывала заметных изменений числа нейтрофилов в крови после повторного введения антител.
Сигнализация CXCR2 участвует в перемещении нейтрофилов как из костного мозга, так и в периферические ткани в ответ на хемокины, вырабатываемые резидентными клетками ткани после стресса, повреждения или инфекции. CXCR2 связывается с несколькими хемокинами, участвующими в рекрутинге нейтрофилов и хроническом воспалении, включая CXCL1, CXCL5 и CXCL8. Эти хемокины также повышены у пациентов с тяжелой нейтрофильной астмой и COPD. Здесь было показано, что BKO-4A8-101c является сильным и специфическим антагонистом опосредованной CXCR2 сигнализации. Не придерживаясь какого-либо предложенного механизма действия, исходя из его профиля in vitro и эффективности у яванских макак, противовоспалительная активность BKO-4A8-101c, по-видимому, опосредована антагонизмом опосредованной CXCL1 и CXCL5 сигнализации CXCR2. Эти данные подтверждают концепцию о том, что рецептор CXCR2 является преобладающим рецептором хемокинов, контролирующим миграцию нейтрофилов в легкие при воспалительных условиях, и согласуются с отсутствием заметной эффективности гуманизованного нейтрализующего антитела против CXCL8 при введении пациентам с COPD (как обсуждается в Mahler D.A. et al. Efficacy and safety of a monoclonal antibody recognizing interleukin-8 in COPD: a pilot study. Chest (2004) 126, 926-34), подходе, который лишь частично подавляет воспалительную ось CXCR1/CXCR2. Какой-то компонент противовоспалительной активности BKO-4A8-101c может быть опосредован через эндотелиальные и эпителиальные клетки, так как экспрессия CXCR2 в этих типах клеток также участвует в привлечении нейтрофилов и повреждении легких (как обсуждается в Reutershan J. et al. Critical role of endothelial CXCR2 in LPS-induced neutrophil migration into the lung. J. Clin. Invest. (2006) 116, 695-702). Продемонстрированная in vivo эффективность BKO-4A8-101c в ингибировании миграции нейтрофилов в легкие в ответ на стимуляцию LPS, не затрагивающая количество циркулирующих нейтрофилов или какие-либо другие измеряемые параметры безопасности, может быть следствием его высокой специфичности и избирательной антагонистической активности.
Пример 12. Антитело против CXCR2 эффективно занимает рецептор CXCR2 и избирательно подавляет опосредованные CXCR2 реакции нейтрофилов
При анализе занятости рецептора измеряется связывание определенной молекулы или препарата с рецептором, экспрессированным на определенных клетках. Это количественный анализ, который можно использовать для оценки связывания рецептора и других фармакодинамических характеристик.
Занятость рецептора исследовали на клеточной линии, экспрессирующей CXCR2 человека, и нейтрофилах человека, обогащенных из цельной крови. По меньшей мере 85% рецепторов CXCR2 было занято при 2 мкг/мл антитела. Этого количества было достаточно для подавления индуцированного CXCL1 притока кальция более чем на 85% в клетках HTS002C-Chemiscreen™ с оптимизированным по кальцию хемокиновым рецептором CXCR2 человека (результаты не приводятся).
Хотя 2 мкг/мл антитела было достаточно для эффективного противодействия опосредованной CXCR2 сигнализации, оно не влияло на функции нейтрофилов. Конечные мишени хемоаттрактантов C5a и fMLF связываются с рецептором C5a (CD88) и FPR1, соответственно. Оба эти агента индуцируют хемотаксис и экспрессию CD11b, общепринятого маркера активации нейтрофилов, в ответ на инфекцию и воспаление. Антитело к CXCR2 не подавляло возрастание уровня CD11b в нейтрофилах или хемотаксис в ответ на C5a и fMLF (результаты не приводятся).
Антитело к CXCR2 при 10 мкг/мл (70 нМ) эффективно и специфически антагонизировало опосредованные CXCR2 ответы на CXCL1 (p <0,0002, фиг. 15A) и CXCL5 (p <0,0001, фиг. 15B) в нейтрофилах человека, выделенных (до 95%) из цельной крови. Антитело к CXCR2 при 70 нМ проявляло большую эффективность в этом анализе, чем низкомолекулярный антагонист 5 (данириксин) при 1400 нМ. Это согласуется с предыдущими сообщениями о том, что агонист 5 ингибирует индуцированную CXCL1 ex vivo экспрессию CD11b на поверхности нейтрофилов с IC50 = 69 нг/мл [156 нМ] и IC90 = 620 нг/мл (диапазон 158-1080 нг/мл) [1400 нМ, диапазон 356-2443 нМ] (Miller et al. “The pharmacokinetics and pharmacodynamics of danirixin (GSK1325756) - a selective CXCR2 antagonist - in healthy adult subjects” BMC Pharmacology and Toxicology 2015, 16).
Ни CXCR2, ни антагонист 5 не влияли существенно на реакцию нейтрофилов на CXCL8 в этом анализе (фиг. 15C). CXCL8 связывается и с CXCR1, и с CXCR2.
Эти данные свидетельствуют, что антитело к CXCR2 является сильным и селективным ингибитором CXCR2 на нейтрофилах человека.
Специалистам в данной области должно быть понятно, что в предпочтительные воплощения изобретения можно вносить различные изменения и модификации, и такие изменения и модификации можно проводить без отступления от сущности изобретения. Поэтому предполагается, что прилагаемая формула изобретения охватывает все такие эквивалентные варианты, которые соответствуют истинной сути изобретения и попадают в его рамки.
Содержание каждого патента, патентной заявки и публикации, цитируемой или описанной в этом документе, тем самым включено сюда путем ссылки во всей полноте.
Воплощения
Следующий список воплощений предназначен для дополнения, а не для вытеснения или замены предшествующего описания.
Воплощение 1. Молекула человеческого антитела, которая иммуноспецифически связывается с CXCR2 человека, причем молекула антитела включает:
CDR1, CDR2 и CDR3 тяжелой цепи по SEQ ID NO: 167 и CDR1, CDR2 и CDR3 легкой цепи по SEQ ID NO: 168; или же
CDR1, CDR2 и CDR3 тяжелой цепи по SEQ ID NO: 226 и CDR1, CDR2 и CDR3 легкой цепи по SEQ ID NO: 227;
и при этом молекула антитела ингибирует индуцированную CXCL1 активацию CXCR2 или индуцированную CXCL5 активацию CXCR2.
Воплощение 2. Молекула человеческого антитела из воплощения 1, при этом:
CDR1 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 169, CDR2 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 170, CDR3 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 171, CDR1 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 172, CDR2 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 173, а CDR3 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 174; или
CDR1 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 228, CDR2 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 229, CDR3 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 230, CDR1 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 201, CDR2 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 231, а CDR3 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 232.
Воплощение 3. Молекула человеческого антитела из воплощения 1 или 2, при этом:
вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 167, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 168; или
вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 226, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 227.
Воплощение 4. Молекула человеческого антитела из воплощения 3, при этом:
a) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 98, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
b) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 99, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
c) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 100, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
d) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 101, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
e) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 102, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
f) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 103, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
g) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 104, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
h) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 105, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
i) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 106, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
j) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 107, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
k) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 108, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
l) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 162, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
m) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 163, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
n) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 164, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110;
o) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 165, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110; или
p) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 166, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 109 или 110.
Воплощение 5. Молекула человеческого антитела из воплощения 4, при этом:
a) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 108, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 110;
b) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 162, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 110;
c) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 163, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 110;
d) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 164, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 110;
e) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 165, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 110; или
f) вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 166, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 110.
Воплощение 6. Молекула человеческого антитела из воплощения 1 или 2, при этом CDR1 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 182, CDR2 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 192, CDR3 тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 195, CDR1 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 201, CDR2 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 205, а CDR3 легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 213.
Воплощение 7. Молекула человеческого антитела по любому из воплощений 1-6, при этом вариабельная область тяжелой цепи имеет аминокислотную последовательность по SEQ ID NO: 108, а вариабельная область легкой цепи имеет аминокислотную последовательность по SEQ ID NO: 110.
Воплощение 8. Молекула человеческого антитела по любому из воплощений 1-7, при этом антитело содержит константную область тяжелой цепи IgG1 человека.
Воплощение 9. Молекула человеческого антитела из воплощения 8, при этом константная область тяжелой цепи IgG1 человека имеет аминокислотную последовательность по SEQ ID NO: 122 или 124.
Воплощение 10. Молекула человеческого антитела по любому из воплощений 1-7, при этом антитело содержит константную область тяжелой цепи IgG2 человека.
Воплощение 11. Молекула человеческого антитела из воплощения 10, при этом константная область тяжелой цепи IgG2 человека имеет аминокислотную последовательность по SEQ ID NO: 120.
Воплощение 12. Молекула человеческого антитела по любому из воплощений 1-7, при этом антитело содержит константную область тяжелой цепи IgG4 человека.
Воплощение 13. Молекула человеческого антитела по любому из воплощений 1-12, при этом молекула антитела представляет собой Fab-фрагмент, F(ab)2-фрагмент или одноцепочечное антитело.
Воплощение 14. Фармацевтическая композиция, содержащая молекулы человеческого антитела по любому из воплощений 1-13.
Воплощение 15. Молекула нуклеиновой кислоты, кодирующая молекулу человеческого антитела по любому из воплощений 1-13.
Воплощение 16. Вектор, содержащий молекулу нуклеиновой кислоты из воплощения 15.
Воплощение 17. Клетка, трансформированная для экспрессии молекулы человеческого антитела по любому из воплощений 1-13.
Воплощение 18. Способ лечения или профилактики нейтрофилии дыхательных путей или острого воспаления легких у субъекта, который включает:
введение субъекту терапевтически эффективного количества молекулы человеческого антитела по любому из воплощений 1-13 или фармацевтической композиции из воплощения 14 для предотвращения или лечения нейтрофилии дыхательных путей или острого воспаления легких.
Воплощение 19. Способ из воплощения 18, при этом нейтрофилия дыхательных путей или острое воспаление легких либо то и другое представляет собой хроническую обструктивную болезнь легких, тяжелую нейтрофильную астму либо то и другое.
Воплощение 20. Молекула человеческого антитела по любому из воплощений 1-13 или фармацевтическая композиция из воплощения 14 для применения в качестве лекарственного средства.
Воплощение 21. Молекула человеческого антитела по любому из воплощений 1-13 или фармацевтическая композиция из воплощения 14 для применения при профилактике или лечении нейтрофилии дыхательных путей или острого воспаления легких.
Воплощение 22. Применение молекул человеческого антитела по любому из воплощений 1-13 или фармацевтической композиции из воплощения 14 при получении лекарственного средства для профилактики или лечения нейтрофилии дыхательных путей или острого воспаления легких.
Воплощение 23. Применение из воплощения 21 или 22, при этом нейтрофилия дыхательных путей, острое воспаление легких или то и другое представляет собой хроническую обструктивную болезнь легких, тяжелую нейтрофильную астму или то и другое.
Воплощение 24. Способ блокирования хемотаксиса нейтрофилов, включающий воздействие на нейтрофилы человеческим антителом по любому из воплощений 1-13.
Воплощение 25. Способ из воплощения 24, при этом хемотаксис представляет собой миграцию нейтрофилов в легкие.
Воплощение 26. Способ блокирования сигнализации CXCR2 в ответ на CXCL1 и/или CXCL5 в клетках, экспрессирующих сигнализацию CXCR2, включающий воздействие на клетки человеческим антителом по любому из воплощений 1-13.




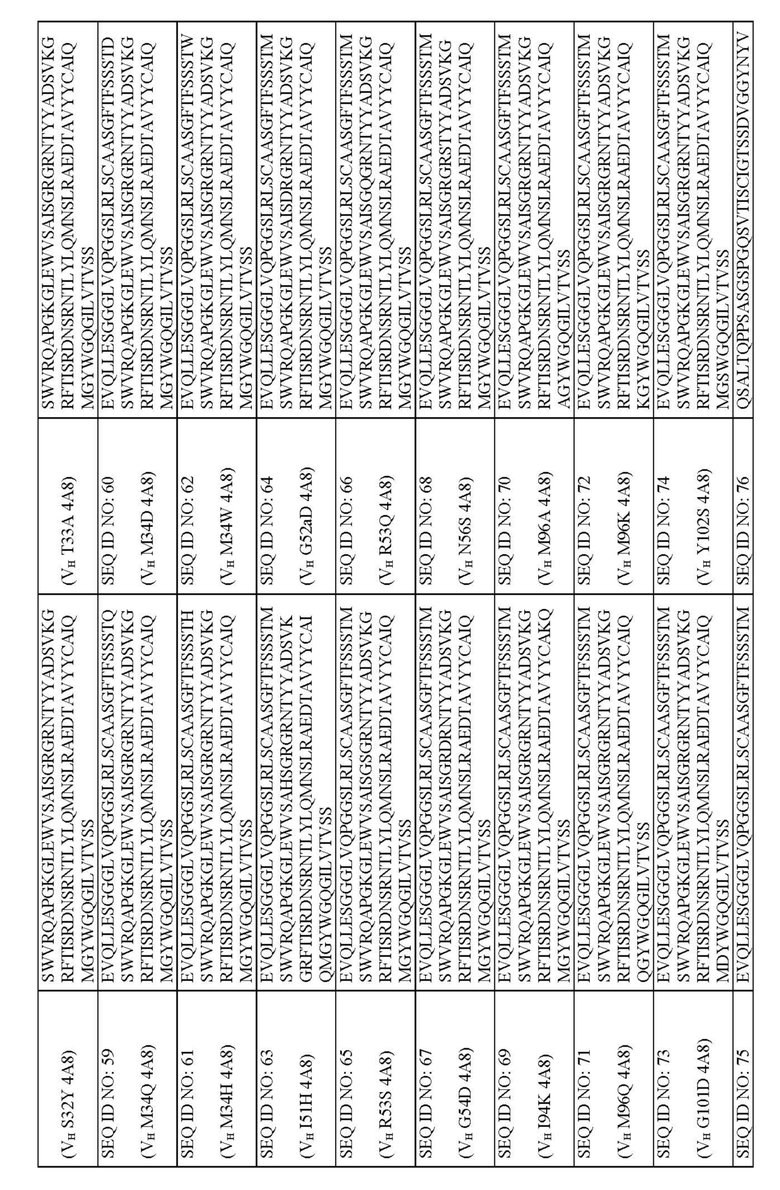

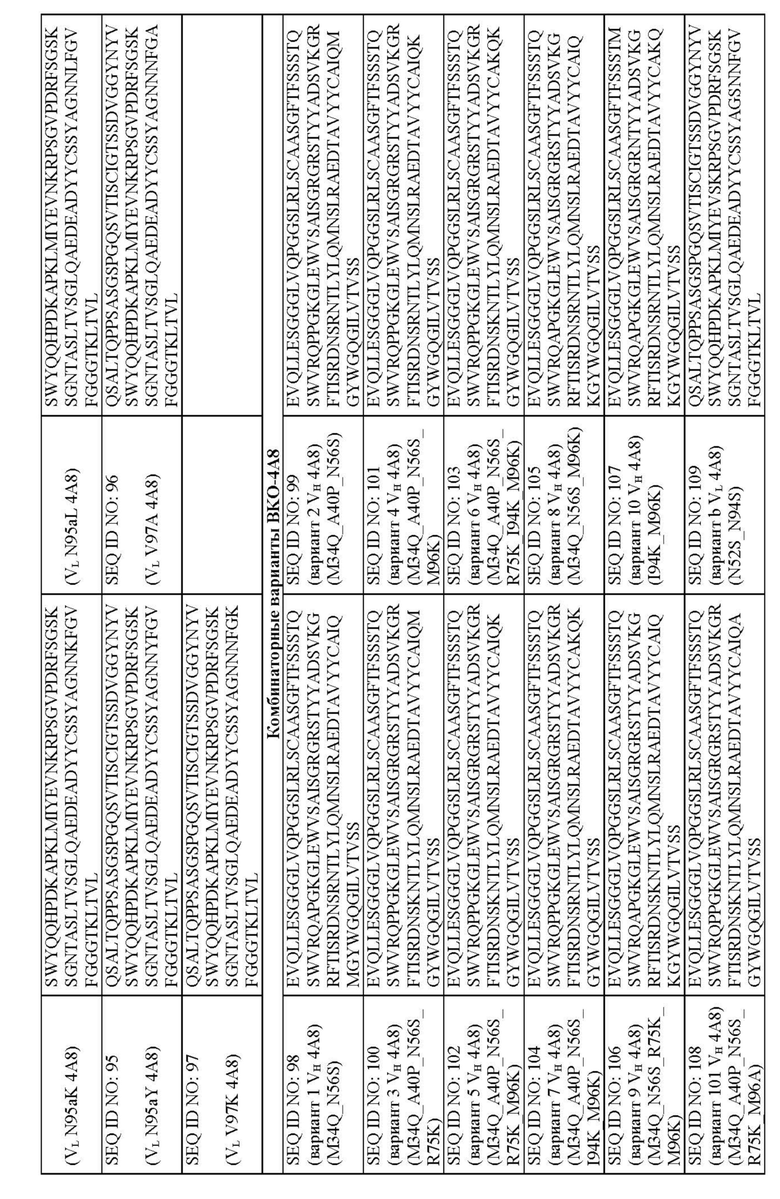
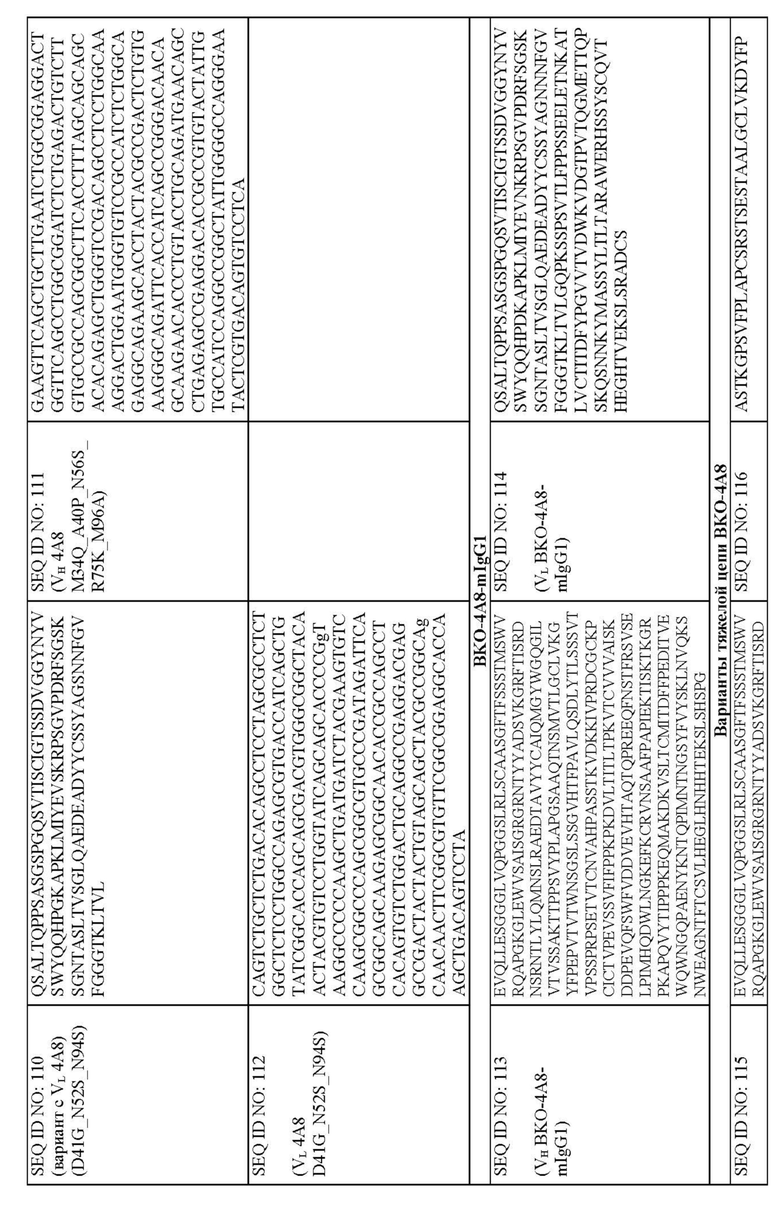





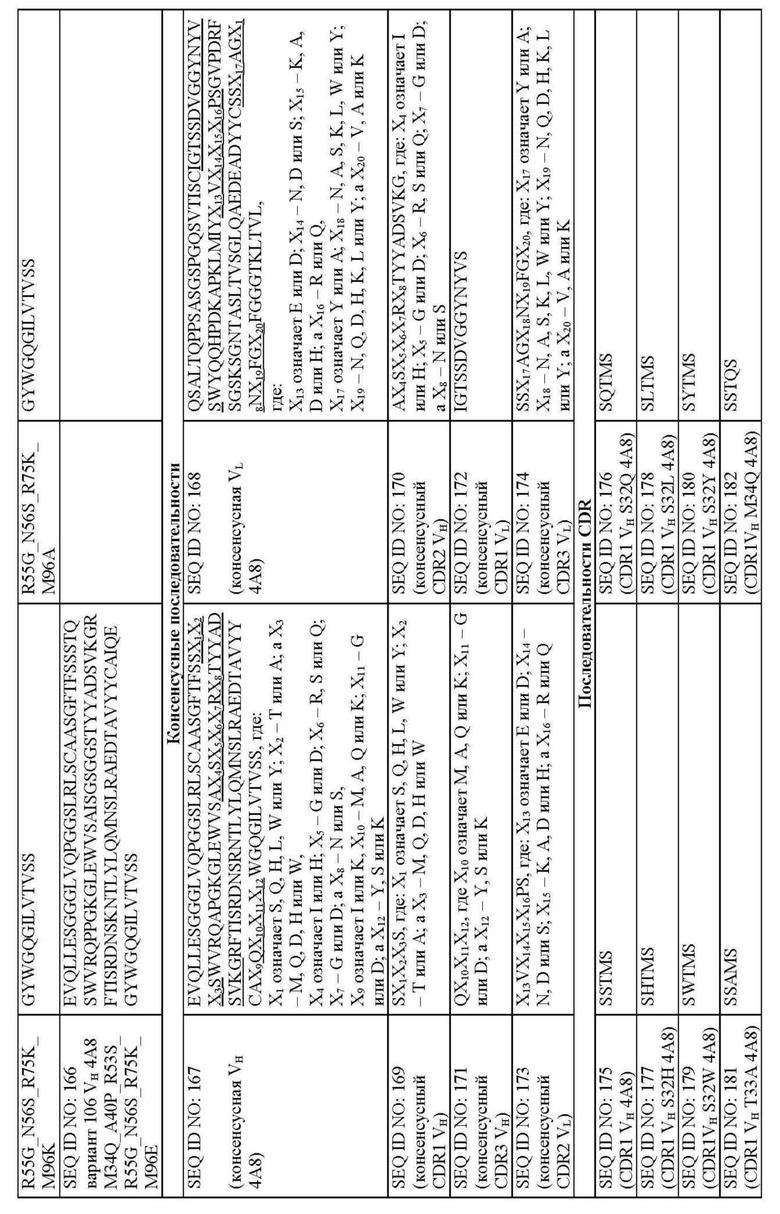
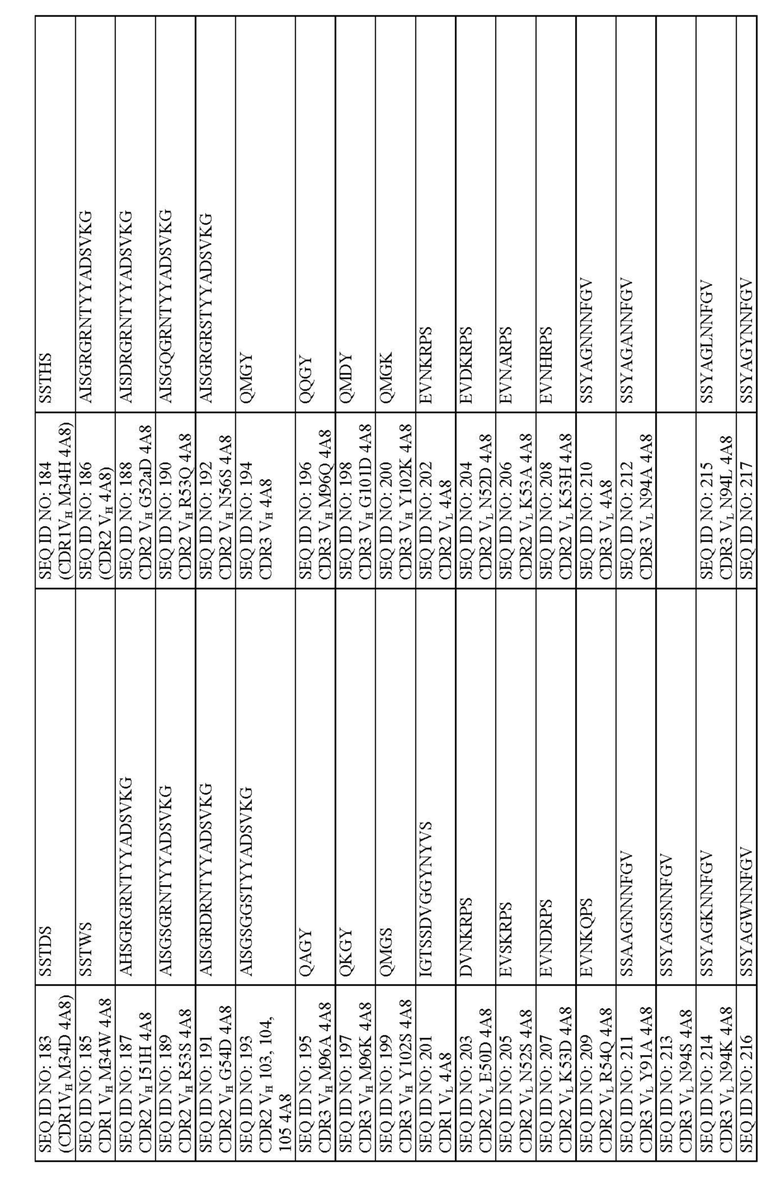
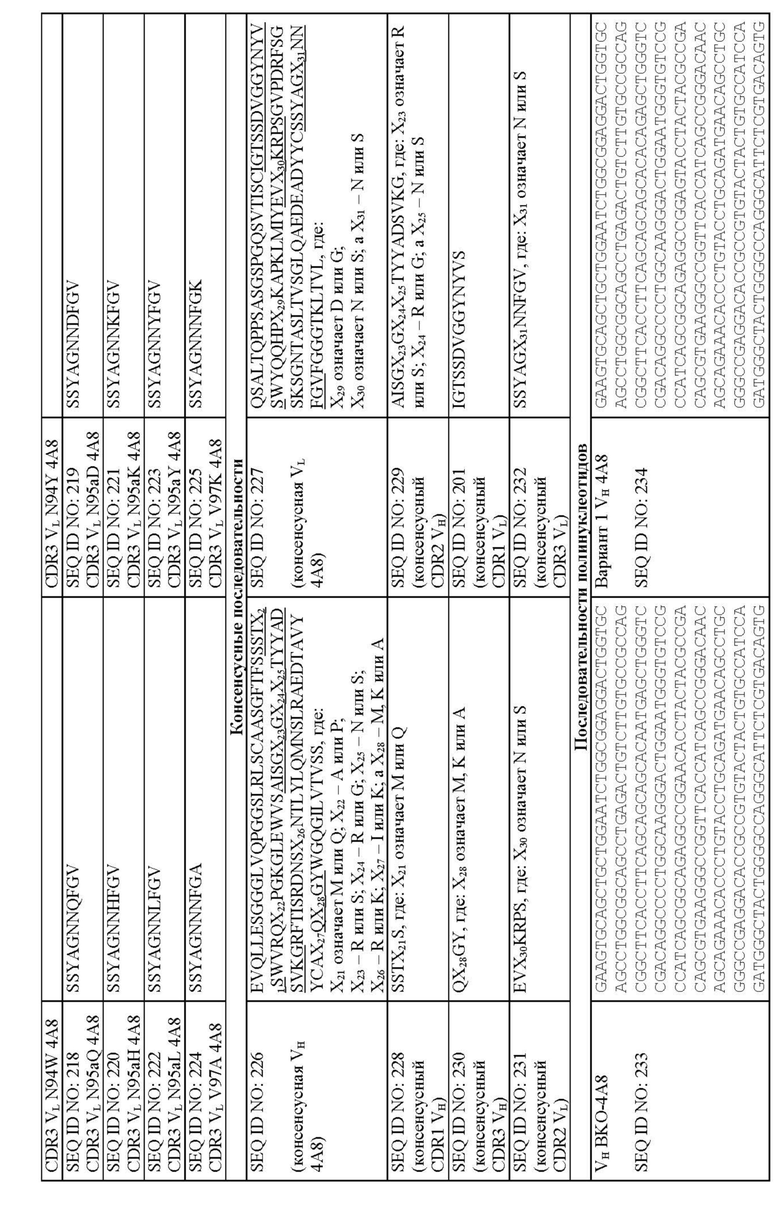



--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CEPHALON, INC.
<120> ANTI-CXCR2 ANTIBODIES AND USES THEREOF
<130> 102085.005304
<140>
<141>
<150> 62/713,095
<151> 2018-08-01
<160> 256
<170> PatentIn version 3.5
<210> 1
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_1A1_VH"
<400> 1
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Arg Thr Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Tyr Ile Gly Ser Ile Tyr Tyr Ser Gly Thr Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Met Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Met Ser Ser Val Thr Ala Ala Asp Ser Ala Val Tyr Tyr
85 90 95
Cys Ala Arg His Gly Arg Val Arg Glu Val Pro Pro Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 2
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_1A1_VL"
<400> 2
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Tyr Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Glu Asn Ser Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Ser Ile Thr Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Thr Ser Gly Asn His
85 90 95
Trp Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 3
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_1B10_VH"
<400> 3
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Arg Thr Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Tyr Ile Gly Ser Ile Tyr Tyr Ser Gly Thr Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Met Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg His Gly Arg Val Arg Glu Val Pro Pro Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 4
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_1B10_VL"
<400> 4
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Tyr Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Glu Asn Ser Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Arg Ile Thr Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Thr Ser Gly Asn His
85 90 95
Trp Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 5
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_1D1_VH"
<400> 5
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Lys Leu Thr Phe Lys Asn Ser
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Gly Ser Gly Gly Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 6
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_1D1_VL"
<400> 6
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 7
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_1H3_VH"
<400> 7
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Ser Arg Ser
20 25 30
Ser Thr Ser Trp Val Arg Gln Thr Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Leu Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 8
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_1H3_VL"
<400> 8
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 9
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_2D8_VH"
<400> 9
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Ala Ile Ser Gly Arg Gly Gly Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Leu Gly Asn Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 10
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_2D8_VL"
<400> 10
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Ile Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Val Ile Tyr Glu Val Asn Met Arg Pro Ser Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asp Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Ser Val Leu
100 105 110
<210> 11
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_3A9_VH"
<400> 11
Gln Val Gln Val Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Val Ser Leu Lys Arg Arg Ile Thr Ile Arg Pro Asp Thr Ser Arg Asn
65 70 75 80
His Phe Ser Leu His Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Val Arg Ala Tyr Cys Gly Gly Gly Ser Cys Leu Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 12
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_3A9_L3_E03_VL"
<400> 12
Gln Ser Ala Leu Thr Gln Pro Ala Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Asn Tyr
20 25 30
Asn Arg Val Ser Trp Tyr Gln Gln His Pro Gly Lys Val Pro Lys Leu
35 40 45
Met Ile Tyr Glu Gly Ser Lys Arg Pro Ser Gly Ile Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Pro Glu Asp Glu Ala Asp Tyr Phe Cys Cys Ser Tyr Ala Gly Ser
85 90 95
Asn Thr Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 13
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_3D6_VH"
<400> 13
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Lys Trp Val
35 40 45
Ser Gly Ile Thr Trp Asn Ser Gly Asn Lys Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Met Lys Gly Ser Gly Thr Tyr Phe Pro Ala Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 14
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_3D6_L6_G06_VL (BKO_5H4_VL)"
<400> 14
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Lys Leu Gly Asp Lys Tyr Ala
20 25 30
Cys Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Ser Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Ser Ser Thr Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 15
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_3F4_VH"
<400> 15
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Leu Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Lys Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Val Gly Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 16
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_3F4_L11_A11_VL"
<400> 16
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Met Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Thr Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Pro
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 17
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_4A8_VH"
<400> 17
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 18
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_4A8_VL"
<400> 18
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 19
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_4F10_VH"
<400> 19
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Phe Asn Pro Asn Asn Gly Gly Thr Asn Tyr Ala Gln Arg Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Thr Ile Arg Leu Trp Phe Asp Asn Trp Phe Asp Ser
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_4F10_VL"
<400> 20
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Ile Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 21
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_5E8_H5_C05_VH"
<400> 21
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Arg Gly Ser Gly Ala Gly Thr Tyr Tyr Ala Asp Ser Met
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asp Thr Leu Tyr
65 70 75 80
Leu Leu Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Lys Leu Glu Ala Val Ser Gly Thr Gly Lys Tyr Phe Gln His Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_5E8_L3_C03_VL"
<400> 22
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Asn Ile Thr Cys Ser Gly Asp Thr Leu Gly Asp Lys Phe Ala
20 25 30
Cys Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Thr Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Lys Ser Gly Ile Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Phe Tyr Cys Gln Ala Trp Asn Ser Arg Gly Val Val
85 90 95
Phe Gly Gly Gly Thr Arg Leu Thr Val Leu
100 105
<210> 23
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_5G11_VH"
<400> 23
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Ser Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 24
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_5G11_VL"
<400> 24
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Phe Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 25
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_5G6_VH"
<400> 25
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Thr Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Phe Asn Pro Asn Asn Gly Gly Thr Asn Tyr Ala Gln Arg Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Thr Ile Arg Leu Trp Phe Asp Asn Trp Phe Asp Ser
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 26
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_5G6_L12_E12_VL"
<400> 26
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Ile Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Trp Val Phe Gly Gly Gly Thr Thr Leu Thr Val Leu
100 105 110
<210> 27
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_6A1_H4_A04_VH"
<400> 27
Gln Val Gln Leu Lys Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Thr Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Met Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Arg Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Gly Glu Val Arg Gly Leu Ile Thr Leu Tyr Trp Tyr Phe Asp Val
100 105 110
Trp Gly Arg Gly Ser Leu Val Thr Val Ser Ser
115 120
<210> 28
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_6A1_E10_VL"
<400> 28
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly Asn His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 29
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_6A2_H1_B01_VH"
<400> 29
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Glu Gly Tyr Asn Tyr Gly Tyr Gly Gly Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 30
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_6A2_L6_A06_VL"
<400> 30
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Lys Leu Gly Asp Lys Tyr Ala
20 25 30
Cys Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Ser Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Ser Ser Thr Val Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 31
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_7C11_H6_B06_VH"
<400> 31
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Ser Arg Asn Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Gly Glu Val Arg Gly Val Phe Thr Leu Tyr Trp Tyr Phe Asp Val
100 105 110
Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 32
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_7C11_G01_VL"
<400> 32
Ser Ser Glu Leu Thr Gln Gly Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asn Ser Leu Arg Phe Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Ile Leu Val Ile Tyr
35 40 45
Asp Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly Tyr Tyr
85 90 95
Met Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 33
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_7G10_H1_B01_VH"
<400> 33
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Ser Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 34
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_7G10_L6_E06_VL"
<400> 34
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Phe Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 35
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_7H8_H3_C03_VH"
<400> 35
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Thr Ala Ile Ser Gly Arg Gly Gly Arg Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Leu Gly Asn Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 36
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_7H8_L10_F10_VL"
<400> 36
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Ile Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Val Ile Tyr Glu Val Asn Met Arg Pro Ser Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asp Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Ser Val Leu
100 105 110
<210> 37
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8B6_VH"
<400> 37
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Asn Ser Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Leu Met Asn Ser Leu Arg Ala Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Lys Leu Gly Tyr Trp Gly Gln Gly Ser Leu Val Thr Val Ser
100 105 110
Ser
<210> 38
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8B6_VL"
<400> 38
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Met Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asp Asn Phe Gly Val Phe Gly Gly Gly Thr Arg Leu Thr Val Leu
100 105 110
<210> 39
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8C4_VH"
<400> 39
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Arg Thr Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Tyr Ile Gly Ser Ile Tyr Tyr Ser Gly Thr Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Met Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg His Gly Arg Val Arg Glu Val Pro Pro Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 40
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8C4_VL"
<400> 40
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Tyr Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Glu Asn Ser Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Arg Ile Thr Gly Thr Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Thr Ser Gly Asn His
85 90 95
Trp Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 41
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8G3_H4_D04_VH"
<400> 41
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Lys Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Arg Leu Gly Tyr Trp Gly Gln Gly Ser Leu Val Thr Val Ser
100 105 110
Ser
<210> 42
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8G3_L1_G01_VL"
<400> 42
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Val Pro Lys Leu
35 40 45
Val Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 43
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8H10_VH"
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Lys Pro Asp Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Gly Trp Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 44
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8H10_VL"
<400> 44
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Phe Thr Gly Thr Ser Arg Asp Val Gly Asp Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Thr Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 45
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8H8_H5_E05_VH"
<400> 45
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Leu Thr Val Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Lys Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Ser Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Val Gly Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 46
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_8H8_L7_H08_VL"
<400> 46
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Met Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Thr Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Val Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Val Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Pro
85 90 95
Asn Asn Phe Gly Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 47
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_9A8_H3_F03_VH"
<400> 47
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Thr Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asn
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Arg Thr Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met His Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Leu Gly Ser Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 48
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_9A8_L1_H02_VL"
<400> 48
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Ala Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Thr Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 49
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_9C3_H8_G08_VH"
<400> 49
Glu Val Gln Val Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Lys Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Leu Gly Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 50
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_9C3_L1_F01_VL"
<400> 50
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Ile Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Val Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Thr Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 51
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_10G10_VH"
<400> 51
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Arg Arg Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Phe Tyr Asn Ser Gly Asn Thr Tyr Tyr Lys Pro Ser
50 55 60
Leu Lys Ser Arg Val Ala Ile Ser Val Asp Thr Pro Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Tyr Ser Ser Gly Gly Phe Asp Pro Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 52
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO_10G10_VL"
<400> 52
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Cys Gln Gln His Pro Gly Lys Ala Pro Lys Ile
35 40 45
Met Ile Phe Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Trp Val Phe Gly Gly Gly Thr Arg Leu Thr Val Leu
100 105 110
<210> 53
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S32Q"
<400> 53
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Gln
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 54
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S32H"
<400> 54
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser His
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 55
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S32L"
<400> 55
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Leu
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 56
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S32W"
<400> 56
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Trp
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 57
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S32Y"
<400> 57
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 58
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH T33A"
<400> 58
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 59
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M34Q"
<400> 59
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 60
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M34D"
<400> 60
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Asp Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 61
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M34H"
<400> 61
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr His Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 62
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M34W"
<400> 62
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Trp Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 63
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH I51H"
<400> 63
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala His Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 64
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH G52aD"
<400> 64
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Asp Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 65
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH R53S"
<400> 65
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 66
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH R53Q"
<400> 66
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Gln Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 67
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH G54D"
<400> 67
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Asp Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 68
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH N56S"
<400> 68
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 69
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH I94K"
<400> 69
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 70
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96A"
<400> 70
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Ala Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 71
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96Q"
<400> 71
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Gln Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 72
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96K"
<400> 72
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 73
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH G101D"
<400> 73
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Asp Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 74
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Y102S"
<400> 74
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Ser Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 75
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Y102K"
<400> 75
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Lys Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 76
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL E50D"
<400> 76
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 77
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N52D"
<400> 77
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asp Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 78
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N52S"
<400> 78
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 79
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL K53A"
<400> 79
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Ala Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 80
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL K53D"
<400> 80
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Asp Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 81
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL K53H"
<400> 81
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn His Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 82
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL R54Q"
<400> 82
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Gln Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 83
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL Y91A"
<400> 83
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Ala Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 84
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N94A"
<400> 84
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ala
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 85
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N94S"
<400> 85
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 86
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N94K"
<400> 86
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Lys
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 87
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N94L"
<400> 87
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Leu
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 88
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N94W"
<400> 88
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Trp
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 89
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N94Y"
<400> 89
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Tyr
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 90
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N95aQ"
<400> 90
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Gln Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 91
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N95aD"
<400> 91
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asp Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 92
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N95aH"
<400> 92
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn His Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 93
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N95aK"
<400> 93
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Lys Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 94
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N95aL"
<400> 94
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Leu Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 95
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N95aY"
<400> 95
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Tyr Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 96
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL V97A"
<400> 96
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Ala Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 97
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL V97K"
<400> 97
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Lys Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 98
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 1 (M34Q_N56S)"
<400> 98
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 99
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 2 (M34Q_A40P_N56S)"
<400> 99
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 100
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 3 (M34Q_A40P_N56S_R75K)"
<400> 100
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 101
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 4 (M34Q_A40P_N56S_M96K)"
<400> 101
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 102
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 5 (M34Q_A40P_N56S_R75K_M96K)"
<400> 102
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 103
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 6 (M34Q_A40P_N56S_R75K_I94K_M96K)"
<400> 103
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 104
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 7 (M34Q_A40P_N56S_I94K_M96K)"
<400> 104
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 105
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 8 (M34Q_N56S_M96K)"
<400> 105
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 106
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 9 (M34Q_N56S_R75K_M96K)"
<400> 106
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 107
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 10 I94K_M96K"
<400> 107
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 108
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 101 M34Q_A40P_N56S_R75K_M96A"
<400> 108
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Ala Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 109
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL variant b N52S_N94S"
<400> 109
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 110
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL variant c D41G_N52S_N94S"
<400> 110
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 111
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="4A8 VH M34Q_A40P_N56S_R75K_M96A"
<400> 111
gaagttcagc tgcttgaatc tggcggagga ctggttcagc ctggcggatc tctgagactg
60
tcttgtgccg ccagcggctt cacctttagc agcagcacac agagctgggt ccgacagcct
120
cctggcaaag gactggaatg ggtgtccgcc atctctggca gaggcagaag cacctactac
180
gccgactctg tgaagggcag attcaccatc agccgggaca acagcaagaa caccctgtac
240
ctgcagatga acagcctgag agccgaggac accgccgtgt actattgtgc catccaggcc
300
ggctattggg gccagggaat actcgtgaca gtgtcctca
339
<210> 112
<211> 333
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="4A8 VL D41G_N52S_N94S"
<400> 112
cagtctgctc tgacacagcc tcctagcgcc tctggctctc ctggccagag cgtgaccatc
60
agctgtatcg gcaccagcag cgacgtgggc ggctacaact acgtgtcctg gtatcagcag
120
caccccggta aggcccccaa gctgatgatc tacgaagtgt ccaagcggcc cagcggcgtg
180
cccgatagat tcagcggcag caagagcggc aacaccgcca gcctcacagt gtctggactg
240
caggccgagg acgaggccga ctactactgt agcagctacg ccggcagcaa caacttcggc
300
gtgttcggcg gaggcaccaa gctgacagtc cta
333
<210> 113
<211> 436
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO-4A8-mIgG1 VH"
<400> 113
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser
115 120 125
Ala Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr
165 170 175
Leu Ser Ser Ser Val Thr Val Pro Ser Ser Pro Arg Pro Ser Glu Thr
180 185 190
Val Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys
195 200 205
Lys Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val
210 215 220
Pro Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val
225 230 235 240
Leu Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Ala Ile
245 250 255
Ser Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val
260 265 270
Glu Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser
275 280 285
Thr Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu
290 295 300
Asn Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala
305 310 315 320
Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro
325 330 335
Gln Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys
340 345 350
Val Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr
355 360 365
Val Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr
370 375 380
Gln Pro Ile Met Asn Thr Asn Gly Ser Tyr Phe Val Tyr Ser Lys Leu
385 390 395 400
Asn Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser
405 410 415
Val Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser
420 425 430
His Ser Pro Gly
435
<210> 114
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO-4A8-mIgG1 VL"
<400> 114
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
Gln Pro Lys Ser Ser Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
115 120 125
Glu Leu Glu Thr Asn Lys Ala Thr Leu Val Cys Thr Ile Thr Asp Phe
130 135 140
Tyr Pro Gly Val Val Thr Val Asp Trp Lys Val Asp Gly Thr Pro Val
145 150 155 160
Thr Gln Gly Met Glu Thr Thr Gln Pro Ser Lys Gln Ser Asn Asn Lys
165 170 175
Tyr Met Ala Ser Ser Tyr Leu Thr Leu Thr Ala Arg Ala Trp Glu Arg
180 185 190
His Ser Ser Tyr Ser Cys Gln Val Thr His Glu Gly His Thr Val Glu
195 200 205
Lys Ser Leu Ser Arg Ala Asp Cys Ser
210 215
<210> 115
<211> 439
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO-4A8 IgG4"
<400> 115
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly
435
<210> 116
<211> 326
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="IgG4"
<400> 116
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 117
<211> 439
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO-4A8 IgG4"
<400> 117
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly
435
<210> 118
<211> 326
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="IgG4"
<400> 118
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 119
<211> 438
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO-4A8 IgG2"
<400> 119
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala
210 215 220
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
305 310 315 320
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
340 345 350
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Pro Gly
435
<210> 120
<211> 325
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="IgG2"
<400> 120
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ser Ser Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly
325
<210> 121
<211> 442
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO-4A8 IgG1"
<400> 121
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Leu Ala Gly Ala Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
340 345 350
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 122
<211> 329
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="IgG1"
<400> 122
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 123
<211> 442
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="BKO-4A8 IgG1"
<400> 123
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
340 345 350
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 124
<211> 329
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="IgG1"
<400> 124
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 125
<211> 360
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="Human CXCR2"
<400> 125
Met Glu Asp Phe Asn Met Glu Ser Asp Ser Phe Glu Asp Phe Trp Lys
1 5 10 15
Gly Glu Asp Leu Ser Asn Tyr Ser Tyr Ser Ser Thr Leu Pro Pro Phe
20 25 30
Leu Leu Asp Ala Ala Pro Cys Glu Pro Glu Ser Leu Glu Ile Asn Lys
35 40 45
Tyr Phe Val Val Ile Ile Tyr Ala Leu Val Phe Leu Leu Ser Leu Leu
50 55 60
Gly Asn Ser Leu Val Met Leu Val Ile Leu Tyr Ser Arg Val Gly Arg
65 70 75 80
Ser Val Thr Asp Val Tyr Leu Leu Asn Leu Ala Leu Ala Asp Leu Leu
85 90 95
Phe Ala Leu Thr Leu Pro Ile Trp Ala Ala Ser Lys Val Asn Gly Trp
100 105 110
Ile Phe Gly Thr Phe Leu Cys Lys Val Val Ser Leu Leu Lys Glu Val
115 120 125
Asn Phe Tyr Ser Gly Ile Leu Leu Leu Ala Cys Ile Ser Val Asp Arg
130 135 140
Tyr Leu Ala Ile Val His Ala Thr Arg Thr Leu Thr Gln Lys Arg Tyr
145 150 155 160
Leu Val Lys Phe Ile Cys Leu Ser Ile Trp Gly Leu Ser Leu Leu Leu
165 170 175
Ala Leu Pro Val Leu Leu Phe Arg Arg Thr Val Tyr Ser Ser Asn Val
180 185 190
Ser Pro Ala Cys Tyr Glu Asp Met Gly Asn Asn Thr Ala Asn Trp Arg
195 200 205
Met Leu Leu Arg Ile Leu Pro Gln Ser Phe Gly Phe Ile Val Pro Leu
210 215 220
Leu Ile Met Leu Phe Cys Tyr Gly Phe Thr Leu Arg Thr Leu Phe Lys
225 230 235 240
Ala His Met Gly Gln Lys His Arg Ala Met Arg Val Ile Phe Ala Val
245 250 255
Val Leu Ile Phe Leu Leu Cys Trp Leu Pro Tyr Asn Leu Val Leu Leu
260 265 270
Ala Asp Thr Leu Met Arg Thr Gln Val Ile Gln Glu Thr Cys Glu Arg
275 280 285
Arg Asn His Ile Asp Arg Ala Leu Asp Ala Thr Glu Ile Leu Gly Ile
290 295 300
Leu His Ser Cys Leu Asn Pro Leu Ile Tyr Ala Phe Ile Gly Gln Lys
305 310 315 320
Phe Arg His Gly Leu Leu Lys Ile Leu Ala Ile His Gly Leu Ile Ser
325 330 335
Lys Asp Ser Leu Pro Lys Asp Ser Arg Pro Ser Phe Val Gly Ser Ser
340 345 350
Ser Gly His Thr Ser Thr Thr Leu
355 360
<210> 126
<211> 359
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="Mouse CXCR2"
<400> 126
Met Gly Glu Phe Lys Val Asp Lys Phe Asn Ile Glu Asp Phe Phe Ser
1 5 10 15
Gly Asp Leu Asp Ile Phe Asn Tyr Ser Ser Gly Met Pro Ser Ile Leu
20 25 30
Pro Asp Ala Val Pro Cys His Ser Glu Asn Leu Glu Ile Asn Ser Tyr
35 40 45
Ala Val Val Val Ile Tyr Val Leu Val Thr Leu Leu Ser Leu Val Gly
50 55 60
Asn Ser Leu Val Met Leu Val Ile Leu Tyr Asn Arg Ser Thr Cys Ser
65 70 75 80
Val Thr Asp Val Tyr Leu Leu Asn Leu Ala Ile Ala Asp Leu Phe Phe
85 90 95
Ala Leu Thr Leu Pro Val Trp Ala Ala Ser Lys Val Asn Gly Trp Thr
100 105 110
Phe Gly Ser Thr Leu Cys Lys Ile Phe Ser Tyr Val Lys Glu Val Thr
115 120 125
Phe Tyr Ser Ser Val Leu Leu Leu Ala Cys Ile Ser Met Asp Arg Tyr
130 135 140
Leu Ala Ile Val His Ala Thr Ser Thr Leu Ile Gln Lys Arg His Leu
145 150 155 160
Val Lys Phe Val Cys Ile Ala Met Trp Leu Leu Ser Val Ile Leu Ala
165 170 175
Leu Pro Ile Leu Ile Leu Arg Asn Pro Val Lys Val Asn Leu Ser Thr
180 185 190
Leu Val Cys Tyr Glu Asp Val Gly Asn Asn Thr Ser Arg Leu Arg Val
195 200 205
Val Leu Arg Ile Leu Pro Gln Thr Phe Gly Phe Leu Val Pro Leu Leu
210 215 220
Ile Met Leu Phe Cys Tyr Gly Phe Thr Leu Arg Thr Leu Phe Lys Ala
225 230 235 240
His Met Gly Gln Lys His Arg Ala Met Arg Val Ile Phe Ala Val Val
245 250 255
Leu Val Phe Leu Leu Cys Trp Leu Pro Tyr Asn Leu Val Leu Phe Thr
260 265 270
Asp Thr Leu Met Arg Thr Lys Leu Ile Lys Glu Thr Cys Glu Arg Arg
275 280 285
Asp Asp Ile Asp Lys Ala Leu Asn Ala Thr Glu Ile Leu Gly Phe Leu
290 295 300
His Ser Cys Leu Asn Pro Ile Ile Tyr Ala Phe Ile Gly Gln Lys Phe
305 310 315 320
Arg His Gly Leu Leu Lys Ile Met Ala Thr Tyr Gly Leu Val Ser Lys
325 330 335
Glu Phe Leu Ala Lys Glu Gly Arg Pro Ser Phe Val Ser Ser Ser Ser
340 345 350
Ala Asn Thr Ser Thr Thr Leu
355
<210> 127
<211> 355
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="cynomolgus CXCR2"
<400> 127
Met Gln Ser Phe Asn Phe Glu Asp Phe Trp Glu Asn Glu Asp Phe Ser
1 5 10 15
Asn Tyr Ser Tyr Ser Ser Asp Leu Pro Pro Ser Leu Pro Asp Val Ala
20 25 30
Pro Cys Arg Pro Glu Ser Leu Glu Ile Asn Lys Tyr Phe Val Val Ile
35 40 45
Ile Tyr Ala Leu Val Phe Leu Leu Ser Leu Leu Gly Asn Ser Leu Val
50 55 60
Met Leu Val Ile Leu His Ser Arg Val Gly Arg Ser Ile Thr Asp Val
65 70 75 80
Tyr Leu Leu Asn Leu Ala Met Ala Asp Leu Leu Phe Ala Leu Thr Leu
85 90 95
Pro Ile Trp Ala Ala Ala Lys Val Asn Gly Trp Ile Phe Gly Thr Phe
100 105 110
Leu Cys Lys Val Val Ser Leu Leu Lys Glu Val Asn Phe Tyr Ser Gly
115 120 125
Ile Leu Leu Leu Ala Cys Ile Ser Val Asp Arg Tyr Leu Ala Ile Val
130 135 140
His Ala Thr Arg Thr Leu Thr Gln Lys Arg Tyr Leu Val Lys Phe Val
145 150 155 160
Cys Leu Ser Ile Trp Ser Leu Ser Leu Leu Leu Ala Leu Pro Val Leu
165 170 175
Leu Phe Arg Arg Thr Val Tyr Leu Thr Tyr Ile Ser Pro Val Cys Tyr
180 185 190
Glu Asp Met Gly Asn Asn Thr Ala Lys Trp Arg Met Val Leu Arg Ile
195 200 205
Leu Pro Gln Thr Phe Gly Phe Ile Leu Pro Leu Leu Ile Met Leu Phe
210 215 220
Cys Tyr Gly Phe Thr Leu Arg Thr Leu Phe Lys Ala His Met Gly Gln
225 230 235 240
Lys His Arg Ala Met Arg Val Ile Phe Ala Val Val Leu Ile Phe Leu
245 250 255
Leu Cys Trp Leu Pro Tyr His Leu Val Leu Leu Ala Asp Thr Leu Met
260 265 270
Arg Thr Arg Leu Ile Asn Glu Thr Cys Gln Arg Arg Asn Asn Ile Asp
275 280 285
Gln Ala Leu Asp Ala Thr Glu Ile Leu Gly Ile Leu His Ser Cys Leu
290 295 300
Asn Pro Leu Ile Tyr Ala Phe Ile Gly Gln Lys Phe Arg His Gly Leu
305 310 315 320
Leu Lys Ile Leu Ala Thr His Gly Leu Ile Ser Lys Asp Ser Leu Pro
325 330 335
Lys Asp Ser Arg Pro Ser Phe Val Gly Ser Ser Ser Gly His Thr Ser
340 345 350
Thr Thr Leu
355
<210> 128
<211> 368
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="human CXCR3"
<400> 128
Met Val Leu Glu Val Ser Asp His Gln Val Leu Asn Asp Ala Glu Val
1 5 10 15
Ala Ala Leu Leu Glu Asn Phe Ser Ser Ser Tyr Asp Tyr Gly Glu Asn
20 25 30
Glu Ser Asp Ser Cys Cys Thr Ser Pro Pro Cys Pro Gln Asp Phe Ser
35 40 45
Leu Asn Phe Asp Arg Ala Phe Leu Pro Ala Leu Tyr Ser Leu Leu Phe
50 55 60
Leu Leu Gly Leu Leu Gly Asn Gly Ala Val Ala Ala Val Leu Leu Ser
65 70 75 80
Arg Arg Thr Ala Leu Ser Ser Thr Asp Thr Phe Leu Leu His Leu Ala
85 90 95
Val Ala Asp Thr Leu Leu Val Leu Thr Leu Pro Leu Trp Ala Val Asp
100 105 110
Ala Ala Val Gln Trp Val Phe Gly Ser Gly Leu Cys Lys Val Ala Gly
115 120 125
Ala Leu Phe Asn Ile Asn Phe Tyr Ala Gly Ala Leu Leu Leu Ala Cys
130 135 140
Ile Ser Phe Asp Arg Tyr Leu Asn Ile Val His Ala Thr Gln Leu Tyr
145 150 155 160
Arg Arg Gly Pro Pro Ala Arg Val Thr Leu Thr Cys Leu Ala Val Trp
165 170 175
Gly Leu Cys Leu Leu Phe Ala Leu Pro Asp Phe Ile Phe Leu Ser Ala
180 185 190
His His Asp Glu Arg Leu Asn Ala Thr His Cys Gln Tyr Asn Phe Pro
195 200 205
Gln Val Gly Arg Thr Ala Leu Arg Val Leu Gln Leu Val Ala Gly Phe
210 215 220
Leu Leu Pro Leu Leu Val Met Ala Tyr Cys Tyr Ala His Ile Leu Ala
225 230 235 240
Val Leu Leu Val Ser Arg Gly Gln Arg Arg Leu Arg Ala Met Arg Leu
245 250 255
Val Val Val Val Val Val Ala Phe Ala Leu Cys Trp Thr Pro Tyr His
260 265 270
Leu Val Val Leu Val Asp Ile Leu Met Asp Leu Gly Ala Leu Ala Arg
275 280 285
Asn Cys Gly Arg Glu Ser Arg Val Asp Val Ala Lys Ser Val Thr Ser
290 295 300
Gly Leu Gly Tyr Met His Cys Cys Leu Asn Pro Leu Leu Tyr Ala Phe
305 310 315 320
Val Gly Val Lys Phe Arg Glu Arg Met Trp Met Leu Leu Leu Arg Leu
325 330 335
Gly Cys Pro Asn Gln Arg Gly Leu Gln Arg Gln Pro Ser Ser Ser Arg
340 345 350
Arg Asp Ser Ser Trp Ser Glu Thr Ser Glu Ala Ser Tyr Ser Gly Leu
355 360 365
<210> 129
<211> 352
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="human CXCR4"
<400> 129
Met Glu Gly Ile Ser Ile Tyr Thr Ser Asp Asn Tyr Thr Glu Glu Met
1 5 10 15
Gly Ser Gly Asp Tyr Asp Ser Met Lys Glu Pro Cys Phe Arg Glu Glu
20 25 30
Asn Ala Asn Phe Asn Lys Ile Phe Leu Pro Thr Ile Tyr Ser Ile Ile
35 40 45
Phe Leu Thr Gly Ile Val Gly Asn Gly Leu Val Ile Leu Val Met Gly
50 55 60
Tyr Gln Lys Lys Leu Arg Ser Met Thr Asp Lys Tyr Arg Leu His Leu
65 70 75 80
Ser Val Ala Asp Leu Leu Phe Val Ile Thr Leu Pro Phe Trp Ala Val
85 90 95
Asp Ala Val Ala Asn Trp Tyr Phe Gly Asn Phe Leu Cys Lys Ala Val
100 105 110
His Val Ile Tyr Thr Val Asn Leu Tyr Ser Ser Val Leu Ile Leu Ala
115 120 125
Phe Ile Ser Leu Asp Arg Tyr Leu Ala Ile Val His Ala Thr Asn Ser
130 135 140
Gln Arg Pro Arg Lys Leu Leu Ala Glu Lys Val Val Tyr Val Gly Val
145 150 155 160
Trp Ile Pro Ala Leu Leu Leu Thr Ile Pro Asp Phe Ile Phe Ala Asn
165 170 175
Val Ser Glu Ala Asp Asp Arg Tyr Ile Cys Asp Arg Phe Tyr Pro Asn
180 185 190
Asp Leu Trp Val Val Val Phe Gln Phe Gln His Ile Met Val Gly Leu
195 200 205
Ile Leu Pro Gly Ile Val Ile Leu Ser Cys Tyr Cys Ile Ile Ile Ser
210 215 220
Lys Leu Ser His Ser Lys Gly His Gln Lys Arg Lys Ala Leu Lys Thr
225 230 235 240
Thr Val Ile Leu Ile Leu Ala Phe Phe Ala Cys Trp Leu Pro Tyr Tyr
245 250 255
Ile Gly Ile Ser Ile Asp Ser Phe Ile Leu Leu Glu Ile Ile Lys Gln
260 265 270
Gly Cys Glu Phe Glu Asn Thr Val His Lys Trp Ile Ser Ile Thr Glu
275 280 285
Ala Leu Ala Phe Phe His Cys Cys Leu Asn Pro Ile Leu Tyr Ala Phe
290 295 300
Leu Gly Ala Lys Phe Lys Thr Ser Ala Gln His Ala Leu Thr Ser Val
305 310 315 320
Ser Arg Gly Ser Ser Leu Lys Ile Leu Ser Lys Gly Lys Arg Gly Gly
325 330 335
His Ser Ser Val Ser Thr Glu Ser Glu Ser Ser Ser Phe His Ser Ser
340 345 350
<210> 130
<211> 372
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="human CXCR5"
<400> 130
Met Asn Tyr Pro Leu Thr Leu Glu Met Asp Leu Glu Asn Leu Glu Asp
1 5 10 15
Leu Phe Trp Glu Leu Asp Arg Leu Asp Asn Tyr Asn Asp Thr Ser Leu
20 25 30
Val Glu Asn His Leu Cys Pro Ala Thr Glu Gly Pro Leu Met Ala Ser
35 40 45
Phe Lys Ala Val Phe Val Pro Val Ala Tyr Ser Leu Ile Phe Leu Leu
50 55 60
Gly Val Ile Gly Asn Val Leu Val Leu Val Ile Leu Glu Arg His Arg
65 70 75 80
Gln Thr Arg Ser Ser Thr Glu Thr Phe Leu Phe His Leu Ala Val Ala
85 90 95
Asp Leu Leu Leu Val Phe Ile Leu Pro Phe Ala Val Ala Glu Gly Ser
100 105 110
Val Gly Trp Val Leu Gly Thr Phe Leu Cys Lys Thr Val Ile Ala Leu
115 120 125
His Lys Val Asn Phe Tyr Cys Ser Ser Leu Leu Leu Ala Cys Ile Ala
130 135 140
Val Asp Arg Tyr Leu Ala Ile Val His Ala Val His Ala Tyr Arg His
145 150 155 160
Arg Arg Leu Leu Ser Ile His Ile Thr Cys Gly Thr Ile Trp Leu Val
165 170 175
Gly Phe Leu Leu Ala Leu Pro Glu Ile Leu Phe Ala Lys Val Ser Gln
180 185 190
Gly His His Asn Asn Ser Leu Pro Arg Cys Thr Phe Ser Gln Glu Asn
195 200 205
Gln Ala Glu Thr His Ala Trp Phe Thr Ser Arg Phe Leu Tyr His Val
210 215 220
Ala Gly Phe Leu Leu Pro Met Leu Val Met Gly Trp Cys Tyr Val Gly
225 230 235 240
Val Val His Arg Leu Arg Gln Ala Gln Arg Arg Pro Gln Arg Gln Lys
245 250 255
Ala Val Arg Val Ala Ile Leu Val Thr Ser Ile Phe Phe Leu Cys Trp
260 265 270
Ser Pro Tyr His Ile Val Ile Phe Leu Asp Thr Leu Ala Arg Leu Lys
275 280 285
Ala Val Asp Asn Thr Cys Lys Leu Asn Gly Ser Leu Pro Val Ala Ile
290 295 300
Thr Met Cys Glu Phe Leu Gly Leu Ala His Cys Cys Leu Asn Pro Met
305 310 315 320
Leu Tyr Thr Phe Ala Gly Val Lys Phe Arg Ser Asp Leu Ser Arg Leu
325 330 335
Leu Thr Lys Leu Gly Cys Thr Gly Pro Ala Ser Leu Cys Gln Leu Phe
340 345 350
Pro Ser Trp Arg Arg Ser Ser Leu Ser Glu Ser Glu Asn Ala Thr Ser
355 360 365
Leu Thr Thr Phe
370
<210> 131
<211> 342
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="human CXCR6"
<400> 131
Met Ala Glu His Asp Tyr His Glu Asp Tyr Gly Phe Ser Ser Phe Asn
1 5 10 15
Asp Ser Ser Gln Glu Glu His Gln Asp Phe Leu Gln Phe Ser Lys Val
20 25 30
Phe Leu Pro Cys Met Tyr Leu Val Val Phe Val Cys Gly Leu Val Gly
35 40 45
Asn Ser Leu Val Leu Val Ile Ser Ile Phe Tyr His Lys Leu Gln Ser
50 55 60
Leu Thr Asp Val Phe Leu Val Asn Leu Pro Leu Ala Asp Leu Val Phe
65 70 75 80
Val Cys Thr Leu Pro Phe Trp Ala Tyr Ala Gly Ile His Glu Trp Val
85 90 95
Phe Gly Gln Val Met Cys Lys Ser Leu Leu Gly Ile Tyr Thr Ile Asn
100 105 110
Phe Tyr Thr Ser Met Leu Ile Leu Thr Cys Ile Thr Val Asp Arg Phe
115 120 125
Ile Val Val Val Lys Ala Thr Lys Ala Tyr Asn Gln Gln Ala Lys Arg
130 135 140
Met Thr Trp Gly Lys Val Thr Ser Leu Leu Ile Trp Val Ile Ser Leu
145 150 155 160
Leu Val Ser Leu Pro Gln Ile Ile Tyr Gly Asn Val Phe Asn Leu Asp
165 170 175
Lys Leu Ile Cys Gly Tyr His Asp Glu Ala Ile Ser Thr Val Val Leu
180 185 190
Ala Thr Gln Met Thr Leu Gly Phe Phe Leu Pro Leu Leu Thr Met Ile
195 200 205
Val Cys Tyr Ser Val Ile Ile Lys Thr Leu Leu His Ala Gly Gly Phe
210 215 220
Gln Lys His Arg Ser Leu Lys Ile Ile Phe Leu Val Met Ala Val Phe
225 230 235 240
Leu Leu Thr Gln Met Pro Phe Asn Leu Met Lys Phe Ile Arg Ser Thr
245 250 255
His Trp Glu Tyr Tyr Ala Met Thr Ser Phe His Tyr Thr Ile Met Val
260 265 270
Thr Glu Ala Ile Ala Tyr Leu Arg Ala Cys Leu Asn Pro Val Leu Tyr
275 280 285
Ala Phe Val Ser Leu Lys Phe Arg Lys Asn Phe Trp Lys Leu Val Lys
290 295 300
Asp Ile Gly Cys Leu Pro Tyr Leu Gly Val Ser His Gln Trp Lys Ser
305 310 315 320
Ser Glu Asp Asn Ser Lys Thr Phe Ser Ala Ser His Asn Val Glu Ala
325 330 335
Thr Ser Met Phe Gln Leu
340
<210> 132
<211> 362
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="human CXCR7"
<400> 132
Met Asp Leu His Leu Phe Asp Tyr Ser Glu Pro Gly Asn Phe Ser Asp
1 5 10 15
Ile Ser Trp Pro Cys Asn Ser Ser Asp Cys Ile Val Val Asp Thr Val
20 25 30
Met Cys Pro Asn Met Pro Asn Lys Ser Val Leu Leu Tyr Thr Leu Ser
35 40 45
Phe Ile Tyr Ile Phe Ile Phe Val Ile Gly Met Ile Ala Asn Ser Val
50 55 60
Val Val Trp Val Asn Ile Gln Ala Lys Thr Thr Gly Tyr Asp Thr His
65 70 75 80
Cys Tyr Ile Leu Asn Leu Ala Ile Ala Asp Leu Trp Val Val Leu Thr
85 90 95
Ile Pro Val Trp Val Val Ser Leu Val Gln His Asn Gln Trp Pro Met
100 105 110
Gly Glu Leu Thr Cys Lys Val Thr His Leu Ile Phe Ser Ile Asn Leu
115 120 125
Phe Gly Ser Ile Phe Phe Leu Thr Cys Met Ser Val Asp Arg Tyr Leu
130 135 140
Ser Ile Thr Tyr Phe Thr Asn Thr Pro Ser Ser Arg Lys Lys Met Val
145 150 155 160
Arg Arg Val Val Cys Ile Leu Val Trp Leu Leu Ala Phe Cys Val Ser
165 170 175
Leu Pro Asp Thr Tyr Tyr Leu Lys Thr Val Thr Ser Ala Ser Asn Asn
180 185 190
Glu Thr Tyr Cys Arg Ser Phe Tyr Pro Glu His Ser Ile Lys Glu Trp
195 200 205
Leu Ile Gly Met Glu Leu Val Ser Val Val Leu Gly Phe Ala Val Pro
210 215 220
Phe Ser Ile Ile Ala Val Phe Tyr Phe Leu Leu Ala Arg Ala Ile Ser
225 230 235 240
Ala Ser Ser Asp Gln Glu Lys His Ser Ser Arg Lys Ile Ile Phe Ser
245 250 255
Tyr Val Val Val Phe Leu Val Cys Trp Leu Pro Tyr His Val Ala Val
260 265 270
Leu Leu Asp Ile Phe Ser Ile Leu His Tyr Ile Pro Phe Thr Cys Arg
275 280 285
Leu Glu His Ala Leu Phe Thr Ala Leu His Val Thr Gln Cys Leu Ser
290 295 300
Leu Val His Cys Cys Val Asn Pro Val Leu Tyr Ser Phe Ile Asn Arg
305 310 315 320
Asn Tyr Arg Tyr Glu Leu Met Lys Ala Phe Ile Phe Lys Tyr Ser Ala
325 330 335
Lys Thr Gly Leu Thr Lys Leu Ile Asp Ala Ser Arg Val Ser Glu Thr
340 345 350
Glu Tyr Ser Ala Leu Glu Gln Ser Thr Lys
355 360
<210> 133
<211> 350
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="Human CXCR1"
<400> 133
Met Ser Asn Ile Thr Asp Pro Gln Met Trp Asp Phe Asp Asp Leu Asn
1 5 10 15
Phe Thr Gly Met Pro Pro Ala Asp Glu Asp Tyr Ser Pro Cys Met Leu
20 25 30
Glu Thr Glu Thr Leu Asn Lys Tyr Val Val Ile Ile Ala Tyr Ala Leu
35 40 45
Val Phe Leu Leu Ser Leu Leu Gly Asn Ser Leu Val Met Leu Val Ile
50 55 60
Leu Tyr Ser Arg Val Gly Arg Ser Val Thr Asp Val Tyr Leu Leu Asn
65 70 75 80
Leu Ala Leu Ala Asp Leu Leu Phe Ala Leu Thr Leu Pro Ile Trp Ala
85 90 95
Ala Ser Lys Val Asn Gly Trp Ile Phe Gly Thr Phe Leu Cys Lys Val
100 105 110
Val Ser Leu Leu Lys Glu Val Asn Phe Tyr Ser Gly Ile Leu Leu Leu
115 120 125
Ala Cys Ile Ser Val Asp Arg Tyr Leu Ala Ile Val His Ala Thr Arg
130 135 140
Thr Leu Thr Gln Lys Arg His Leu Val Lys Phe Val Cys Leu Gly Cys
145 150 155 160
Trp Gly Leu Ser Met Asn Leu Ser Leu Pro Phe Phe Leu Phe Arg Gln
165 170 175
Ala Tyr His Pro Asn Asn Ser Ser Pro Val Cys Tyr Glu Val Leu Gly
180 185 190
Asn Asp Thr Ala Lys Trp Arg Met Val Leu Arg Ile Leu Pro His Thr
195 200 205
Phe Gly Phe Ile Val Pro Leu Phe Val Met Leu Phe Cys Tyr Gly Phe
210 215 220
Thr Leu Arg Thr Leu Phe Lys Ala His Met Gly Gln Lys His Arg Ala
225 230 235 240
Met Arg Val Ile Phe Ala Val Val Leu Ile Phe Leu Leu Cys Trp Leu
245 250 255
Pro Tyr Asn Leu Val Leu Leu Ala Asp Thr Leu Met Arg Thr Gln Val
260 265 270
Ile Gln Glu Ser Cys Glu Arg Arg Asn Asn Ile Gly Arg Ala Leu Asp
275 280 285
Ala Thr Glu Ile Leu Gly Phe Leu His Ser Cys Leu Asn Pro Ile Ile
290 295 300
Tyr Ala Phe Ile Gly Gln Asn Phe Arg His Gly Phe Leu Lys Ile Leu
305 310 315 320
Ala Met His Gly Leu Val Ser Lys Glu Phe Leu Ala Arg His Arg Val
325 330 335
Thr Ser Tyr Thr Ser Ser Ser Val Asn Val Ser Ser Asn Leu
340 345 350
<210> 134
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="Human Lambda light chain constant region"
<400> 134
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 135
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="Human Kappa light chain constant region"
<400> 135
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 136
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S32D"
<400> 136
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Asp
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 137
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S35Q"
<400> 137
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 138
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S35D"
<400> 138
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 139
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH S35K"
<400> 139
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Lys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 140
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH A50S"
<400> 140
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 141
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH R55Q"
<400> 141
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Gln Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 142
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH R55D"
<400> 142
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Asp Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 143
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH R55H"
<400> 143
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly His Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 144
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96S"
<400> 144
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Ser Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 145
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96D"
<400> 145
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Asp Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 146
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96H"
<400> 146
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln His Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 147
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96L"
<400> 147
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Leu Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 148
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96W"
<400> 148
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Trp Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 149
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH M96Y"
<400> 149
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Tyr Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 150
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Y102Q"
<400> 150
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Gln Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 151
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Y102D"
<400> 151
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Asp Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 152
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL V51D"
<400> 152
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Asp Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 153
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL V51Y"
<400> 153
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Tyr Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 154
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL R54D"
<400> 154
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Asp Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 155
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL Y91S"
<400> 155
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Ser Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 156
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL Y91H"
<400> 156
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser His Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 157
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N94H"
<400> 157
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly His
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 158
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N95aS"
<400> 158
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Ser Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 159
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL N95aW"
<400> 159
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Trp Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 160
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL V97S"
<400> 160
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Ser Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 161
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VL V97D"
<400> 161
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Asp Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 162
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 102 M34Q_A40P_N56S_R75K_M96E"
<400> 162
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Glu Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 163
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 103 M34Q_A40P_R53S_R55G_N56S_R75K"
<400> 163
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 164
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 104 M34Q_A40P_R53S_R55G_N56S_R75K_M96K"
<400> 164
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Lys Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 165
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 105 M34Q_A40P_R53S_R55G_N56S_R75K_M96A"
<400> 165
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Ala Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 166
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 VH Variant 106 M34Q_A40P_R53S_R55G_N56S_R75K_M96E"
<400> 166
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Gln Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Glu Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 167
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 Consensus VH"
<220>
<221> VARIANT
<222> (32)..(32)
<223> /replace="Q" or "H" or "L" or "W" or "Y"
<220>
<221> VARIANT
<222> (33)..(33)
<223> /replace="A"
<220>
<221> VARIANT
<222> (34)..(34)
<223> /replace="Q" or "D" or "H" or "W"
<220>
<221> VARIANT
<222> (51)..(51)
<223> /replace="H"
<220>
<221> VARIANT
<222> (53)..(53)
<223> /replace="D"
<220>
<221> VARIANT
<222> (54)..(54)
<223> /replace="S" or "Q"
<220>
<221> VARIANT
<222> (55)..(55)
<223> /replace="D"
<220>
<221> VARIANT
<222> (57)..(57)
<223> /replace="S"
<220>
<221> VARIANT
<222> (98)..(98)
<223> /replace="K"
<220>
<221> VARIANT
<222> (100)..(100)
<223> /replace="A" or "Q" or "K"
<220>
<221> VARIANT
<222> (101)..(101)
<223> /replace="D"
<220>
<221> VARIANT
<222> (102)..(102)
<223> /replace="S" or "K"
<220>
<221> SITE
<222> (1)..(113)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 167
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 168
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 Consensus VL"
<220>
<221> VARIANT
<222> (52)..(52)
<223> /replace="D"
<220>
<221> VARIANT
<222> (54)..(54)
<223> /replace="D" or "S"
<220>
<221> VARIANT
<222> (55)..(55)
<223> /replace="A" or "D" or "H"
<220>
<221> VARIANT
<222> (56)..(56)
<223> /replace="Q"
<220>
<221> VARIANT
<222> (93)..(93)
<223> /replace="A"
<220>
<221> VARIANT
<222> (96)..(96)
<223> /replace="A" or "S" or "K" or "L" or "W" or "Y"
<220>
<221> VARIANT
<222> (98)..(98)
<223> /replace="Q" or "D" or "H" or "K" or "L" or "Y"
<220>
<221> VARIANT
<222> (101)..(101)
<223> /replace="A" or "K"
<220>
<221> SITE
<222> (1)..(111)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 168
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 169
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VH CDR1"
<220>
<221> VARIANT
<222> (2)..(2)
<223> /replace="Q" or "H" or "L" or "W" or "Y"
<220>
<221> VARIANT
<222> (3)..(3)
<223> /replace="A"
<220>
<221> VARIANT
<222> (4)..(4)
<223> /replace="Q" or "D" or "H" or "W"
<220>
<221> SITE
<222> (1)..(5)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 169
Ser Ser Thr Met Ser
1 5
<210> 170
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VH CDR2"
<220>
<221> VARIANT
<222> (2)..(2)
<223> /replace="H"
<220>
<221> VARIANT
<222> (4)..(4)
<223> /replace="D"
<220>
<221> VARIANT
<222> (5)..(5)
<223> /replace="S" or "Q"
<220>
<221> VARIANT
<222> (6)..(6)
<223> /replace="D"
<220>
<221> VARIANT
<222> (8)..(8)
<223> /replace="S"
<220>
<221> SITE
<222> (1)..(17)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 170
Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 171
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VH CDR3"
<220>
<221> VARIANT
<222> (2)..(2)
<223> /replace="A" or "Q" or "K"
<220>
<221> VARIANT
<222> (3)..(3)
<223> /replace="D"
<220>
<221> VARIANT
<222> (4)..(4)
<223> /replace="S" or "K"
<220>
<221> SITE
<222> (1)..(4)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 171
Gln Met Gly Tyr
1
<210> 172
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VL CDR1"
<400> 172
Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr Asn Tyr Val Ser
1 5 10
<210> 173
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VL CDR2"
<220>
<221> VARIANT
<222> (1)..(1)
<223> /replace="D"
<220>
<221> VARIANT
<222> (3)..(3)
<223> /replace="D" or "S"
<220>
<221> VARIANT
<222> (4)..(4)
<223> /replace="A" or "D" or "H"
<220>
<221> VARIANT
<222> (5)..(5)
<223> /replace="Q"
<220>
<221> SITE
<222> (1)..(7)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 173
Glu Val Asn Lys Arg Pro Ser
1 5
<210> 174
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VL CDR3"
<220>
<221> VARIANT
<222> (3)..(3)
<223> /replace="A"
<220>
<221> VARIANT
<222> (6)..(6)
<223> /replace="A" or "S" or "K" or "L" or "W" or "Y"
<220>
<221> VARIANT
<222> (8)..(8)
<223> /replace="Q" or "D" or "H" or "K" or "L" or "Y"
<220>
<221> VARIANT
<222> (11)..(11)
<223> /replace="A" or "K"
<220>
<221> SITE
<222> (1)..(11)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 174
Ser Ser Tyr Ala Gly Asn Asn Asn Phe Gly Val
1 5 10
<210> 175
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 VHCDR1"
<400> 175
Ser Ser Thr Met Ser
1 5
<210> 176
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 S32Q VHCDR1"
<400> 176
Ser Gln Thr Met Ser
1 5
<210> 177
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 S32H VHCDR1"
<400> 177
Ser His Thr Met Ser
1 5
<210> 178
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 S32L VHCDR1"
<400> 178
Ser Leu Thr Met Ser
1 5
<210> 179
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 S32W VHCDR1"
<400> 179
Ser Trp Thr Met Ser
1 5
<210> 180
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 S32Y VHCDR1"
<400> 180
Ser Tyr Thr Met Ser
1 5
<210> 181
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 T33A VHCDR1"
<400> 181
Ser Ser Ala Met Ser
1 5
<210> 182
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 M34Q VHCDR1"
<400> 182
Ser Ser Thr Gln Ser
1 5
<210> 183
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 M34D VHCDR1"
<400> 183
Ser Ser Thr Asp Ser
1 5
<210> 184
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 M34H VHCDR1"
<400> 184
Ser Ser Thr His Ser
1 5
<210> 185
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 M34W VHCDR1"
<400> 185
Ser Ser Thr Trp Ser
1 5
<210> 186
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 VHCDR2"
<400> 186
Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 187
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 I51H VHCDR2"
<400> 187
Ala His Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 188
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 G52aD VHCDR2"
<400> 188
Ala Ile Ser Asp Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 189
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 R53S VHCDR2"
<400> 189
Ala Ile Ser Gly Ser Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 190
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 R53Q VHCDR2"
<400> 190
Ala Ile Ser Gly Gln Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 191
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 G54D VHCDR2"
<400> 191
Ala Ile Ser Gly Arg Asp Arg Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 192
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N56S VHCDR2"
<400> 192
Ala Ile Ser Gly Arg Gly Arg Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 193
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 103,104, 105 VHCDR2"
<400> 193
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 194
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 VHCDR3"
<400> 194
Gln Met Gly Tyr
1
<210> 195
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 M96A VHCDR3"
<400> 195
Gln Ala Gly Tyr
1
<210> 196
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 M96Q VHCDR3"
<400> 196
Gln Gln Gly Tyr
1
<210> 197
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 M96K VHCDR3"
<400> 197
Gln Lys Gly Tyr
1
<210> 198
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 G101D VHCDR3"
<400> 198
Gln Met Asp Tyr
1
<210> 199
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 Y102S VHCDR3"
<400> 199
Gln Met Gly Ser
1
<210> 200
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 Y102K VHCDR3"
<400> 200
Gln Met Gly Lys
1
<210> 201
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 VLCDR1 and Consensus VL CDR1"
<400> 201
Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr Asn Tyr Val Ser
1 5 10
<210> 202
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 VLCDR2"
<400> 202
Glu Val Asn Lys Arg Pro Ser
1 5
<210> 203
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 E50D VLCDR2"
<400> 203
Asp Val Asn Lys Arg Pro Ser
1 5
<210> 204
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N52D VLCDR2"
<400> 204
Glu Val Asp Lys Arg Pro Ser
1 5
<210> 205
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N52S VLCDR2"
<400> 205
Glu Val Ser Lys Arg Pro Ser
1 5
<210> 206
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 K53A VLCDR2"
<400> 206
Glu Val Asn Ala Arg Pro Ser
1 5
<210> 207
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 K53D VLCDR2"
<400> 207
Glu Val Asn Asp Arg Pro Ser
1 5
<210> 208
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 K53H VLCDR2"
<400> 208
Glu Val Asn His Arg Pro Ser
1 5
<210> 209
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 R54Q VLCDR2"
<400> 209
Glu Val Asn Lys Gln Pro Ser
1 5
<210> 210
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 VLCDR3"
<400> 210
Ser Ser Tyr Ala Gly Asn Asn Asn Phe Gly Val
1 5 10
<210> 211
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 Y91A VLCDR3"
<400> 211
Ser Ser Ala Ala Gly Asn Asn Asn Phe Gly Val
1 5 10
<210> 212
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N94A VLCDR3"
<400> 212
Ser Ser Tyr Ala Gly Ala Asn Asn Phe Gly Val
1 5 10
<210> 213
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N94S VLCDR3"
<400> 213
Ser Ser Tyr Ala Gly Ser Asn Asn Phe Gly Val
1 5 10
<210> 214
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N94K VLCDR3"
<400> 214
Ser Ser Tyr Ala Gly Lys Asn Asn Phe Gly Val
1 5 10
<210> 215
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N94L VLCDR3"
<400> 215
Ser Ser Tyr Ala Gly Leu Asn Asn Phe Gly Val
1 5 10
<210> 216
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N94W VLCDR3"
<400> 216
Ser Ser Tyr Ala Gly Trp Asn Asn Phe Gly Val
1 5 10
<210> 217
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N94Y VLCDR3"
<400> 217
Ser Ser Tyr Ala Gly Tyr Asn Asn Phe Gly Val
1 5 10
<210> 218
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N95aQ VLCDR3"
<400> 218
Ser Ser Tyr Ala Gly Asn Asn Gln Phe Gly Val
1 5 10
<210> 219
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N95aD VLCDR3"
<400> 219
Ser Ser Tyr Ala Gly Asn Asn Asp Phe Gly Val
1 5 10
<210> 220
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N95aH VLCDR3"
<400> 220
Ser Ser Tyr Ala Gly Asn Asn His Phe Gly Val
1 5 10
<210> 221
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N95aK VLCDR3"
<400> 221
Ser Ser Tyr Ala Gly Asn Asn Lys Phe Gly Val
1 5 10
<210> 222
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 N95aL VLCDR3"
<400> 222
Ser Ser Tyr Ala Gly Asn Asn Leu Phe Gly Val
1 5 10
<210> 223
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="A48 N95aYVLCDR3"
<400> 223
Ser Ser Tyr Ala Gly Asn Asn Tyr Phe Gly Val
1 5 10
<210> 224
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 V97A VLCDR3"
<400> 224
Ser Ser Tyr Ala Gly Asn Asn Asn Phe Gly Ala
1 5 10
<210> 225
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="4A8 V97K VLCDR3"
<400> 225
Ser Ser Tyr Ala Gly Asn Asn Asn Phe Gly Lys
1 5 10
<210> 226
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 Consensus VH"
<220>
<221> VARIANT
<222> (34)..(34)
<223> /replace="Q"
<220>
<221> VARIANT
<222> (40)..(40)
<223> /replace="P"
<220>
<221> VARIANT
<222> (54)..(54)
<223> /replace="S"
<220>
<221> VARIANT
<222> (56)..(56)
<223> /replace="G"
<220>
<221> VARIANT
<222> (57)..(57)
<223> /replace="S"
<220>
<221> VARIANT
<222> (76)..(76)
<223> /replace="K"
<220>
<221> VARIANT
<222> (98)..(98)
<223> /replace="K"
<220>
<221> VARIANT
<222> (100)..(100)
<223> /replace="K" or "A"
<220>
<221> SITE
<222> (1)..(113)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 226
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ile Gln Met Gly Tyr Trp Gly Gln Gly Ile Leu Val Thr Val Ser
100 105 110
Ser
<210> 227
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="4A8 Consensus VL"
<220>
<221> VARIANT
<222> (43)..(43)
<223> /replace="G"
<220>
<221> VARIANT
<222> (54)..(54)
<223> /replace="S"
<220>
<221> VARIANT
<222> (96)..(96)
<223> /replace="S"
<220>
<221> SITE
<222> (1)..(111)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 227
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Ile Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Asp Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Asn
85 90 95
Asn Asn Phe Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 228
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VH CDR1"
<220>
<221> VARIANT
<222> (4)..(4)
<223> /replace="Q"
<220>
<221> SITE
<222> (1)..(5)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 228
Ser Ser Thr Met Ser
1 5
<210> 229
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VH CDR2"
<220>
<221> VARIANT
<222> (5)..(5)
<223> /replace="S"
<220>
<221> VARIANT
<222> (7)..(7)
<223> /replace="G"
<220>
<221> VARIANT
<222> (8)..(8)
<223> /replace="S"
<220>
<221> SITE
<222> (1)..(17)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 229
Ala Ile Ser Gly Arg Gly Arg Asn Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 230
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VH CDR3"
<220>
<221> VARIANT
<222> (2)..(2)
<223> /replace="K" or "A"
<220>
<221> SITE
<222> (1)..(4)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 230
Gln Met Gly Tyr
1
<210> 231
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VL CDR2"
<220>
<221> VARIANT
<222> (3)..(3)
<223> /replace="S"
<220>
<221> SITE
<222> (1)..(7)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 231
Glu Val Asn Lys Arg Pro Ser
1 5
<210> 232
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Consensus VL CDR3"
<220>
<221> VARIANT
<222> (6)..(6)
<223> /replace="S"
<220>
<221> SITE
<222> (1)..(11)
<223> /note="Variant residues given in the sequence have no
preference with respect to those in the annotations
for variant positions"
<400> 232
Ser Ser Tyr Ala Gly Asn Asn Asn Phe Gly Val
1 5 10
<210> 233
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="BKO-4A8 VH"
<400> 233
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacaa tgagctgggt ccgacaggcc
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggaa cacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcagaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc catccagatg
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 234
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 1"
<400> 234
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacaggcc
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcagaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc catccagatg
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 235
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 2"
<400> 235
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacagcct
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcagaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc catccagatg
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 236
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 3"
<400> 236
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacagcct
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcaaaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc catccagatg
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 237
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 4"
<400> 237
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacagcct
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcagaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc catccagaag
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 238
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 5"
<400> 238
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacagcct
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcaaaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc catccagaag
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 239
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 6"
<400> 239
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacagcct
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcaaaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc caagcagaag
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 240
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 7"
<400> 240
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacagcct
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcagaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc caagcagaag
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 241
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 8"
<400> 241
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacaggcc
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcagaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc catccagaag
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 242
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 9"
<400> 242
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacac agagctgggt ccgacaggcc
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggag tacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcaaaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc catccagaag
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 243
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 10"
<400> 243
gaagtgcagc tgctggaatc tggcggagga ctggtgcagc ctggcggcag cctgagactg
60
tcttgtgccg ccagcggctt caccttcagc agcagcacaa tgagctgggt ccgacaggcc
120
cctggcaagg gactggaatg ggtgtccgcc atcagcggca gaggccggaa cacctactac
180
gccgacagcg tgaagggccg gttcaccatc agccgggaca acagcagaaa caccctgtac
240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actactgtgc caagcagaag
300
ggctactggg gccagggcat tctcgtgaca gtgtcctca
339
<210> 244
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 101"
<400> 244
gaagttcagc tgcttgaatc tggcggagga ctggttcagc ctggcggatc tctgagactg
60
tcttgtgccg ccagcggctt cacctttagc agcagcacac agagctgggt ccgacagcct
120
cctggcaaag gactggaatg ggtgtccgcc atctctggca gaggcagaag cacctactac
180
gccgactctg tgaagggcag attcaccatc agccgggaca acagcaagaa caccctgtac
240
ctgcagatga acagcctgag agccgaggac accgccgtgt actattgtgc catccaggcc
300
ggctattggg gccagggaat actcgtgaca gtgtcctca
339
<210> 245
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 103"
<400> 245
gaagttcagc tgcttgaatc tggcggagga ctggttcagc ctggcggatc tctgagactg
60
tcttgtgccg ccagcggctt cacctttagc agcagcacac agagctgggt ccgacagcct
120
cctggcaaag gactggaatg ggtgtccgcc atctctggca gcggcggcag cacatattac
180
gccgattctg tgaagggcag attcaccatc agccgggaca acagcaagaa caccctgtac
240
ctgcagatga acagcctgag agccgaggac accgccgtgt actattgcgc catccagatg
300
ggctattggg gccagggaat cctcgtgaca gtgtcctca
339
<210> 246
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 104"
<400> 246
gaagttcagc tgcttgaatc tggcggagga ctggttcagc ctggcggatc tctgagactg
60
tcttgtgccg ccagcggctt cacctttagc agcagcacac agagctgggt ccgacagcct
120
cctggcaaag gactggaatg ggtgtccgcc atctctggca gcggcggcag cacatattac
180
gccgattctg tgaagggcag attcaccatc agccgggaca acagcaagaa caccctgtac
240
ctgcagatga acagcctgag agccgaggac accgccgtgt actattgcgc catccagaaa
300
ggctattggg gccagggcat cctcgtgaca gtgtcctca
339
<210> 247
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VH Variant 105"
<400> 247
gaagttcagc tgcttgaatc tggcggagga ctggttcagc ctggcggatc tctgagactg
60
tcttgtgccg ccagcggctt cacctttagc agcagcacac agagctgggt ccgacagcct
120
cctggcaaag gactggaatg ggtgtccgcc atctctggca gcggcggcag cacatattac
180
gccgattctg tgaagggcag attcaccatc agccgggaca acagcaagaa caccctgtac
240
ctgcagatga acagcctgag agccgaggac accgccgtgt actattgtgc catccaggcc
300
ggctattggg gccagggaat actcgtgaca gtgtcctca
339
<210> 248
<211> 987
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="Human IgG1"
<400> 248
gctagcacca agggacccag cgtgttcccc ctggccccca gcagcaagag cacatctggc
60
ggaacagccg ccctgggctg cctggtgaaa gactacttcc ccgagcccgt gaccgtgagc
120
tggaacagcg gagccctgac cagcggcgtg cacacctttc cagccgtgct gcagagcagc
180
ggcctgtaca gcctgagcag cgtggtgaca gtgccctcta gcagcctggg cacccagacc
240
tacatctgca acgtgaacca caagcccagc aacaccaagg tggacaaaaa ggtggaaccc
300
aagagctgcg acaagaccca cacctgtccc ccctgccctg cccctgaact gctgggcgga
360
ccctccgtgt tcctgttccc cccaaagccc aaggacaccc tgatgatcag ccggaccccc
420
gaagtgacct gcgtggtggt ggacgtgtcc cacgaggacc ctgaagtgaa gttcaattgg
480
tacgtggacg gcgtggaagt gcacaacgcc aagaccaagc ccagagagga acagtacaac
540
agcacctacc gggtggtgtc cgtgctgacc gtgctgcacc aggactggct gaacggcaaa
600
gagtacaagt gcaaggtgtc caacaaggcc ctgcctgctc ccatcgagaa aaccatcagc
660
aaggccaagg gccagccccg cgagcctcag gtgtacacac tgccccccag ccgggacgag
720
ctgaccaaga accaggtgtc cctgacctgt ctggtgaaag gcttctaccc cagcgatatc
780
gccgtggaat gggagagcaa cggccagccc gagaacaact acaagaccac cccccctgtg
840
ctggacagcg acggctcatt cttcctgtac agcaagctga ccgtggacaa gagccggtgg
900
cagcagggca acgtgttcag ctgcagcgtg atgcacgagg ccctgcacaa ccactacacc
960
cagaagtccc tgagcctgag ccccggc
987
<210> 249
<211> 987
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="Human IgG1"
<400> 249
gctagcacca agggacccag cgtgttcccc ctggccccca gcagcaagag cacatctggc
60
ggaacagccg ccctgggctg cctggtgaaa gactacttcc ccgagcccgt gaccgtgagc
120
tggaacagcg gagccctgac cagcggcgtg cacacctttc cagccgtgct gcagagcagc
180
ggcctgtaca gcctgagcag cgtggtgaca gtgccctcta gcagcctggg cacccagacc
240
tacatctgca acgtgaacca caagcccagc aacaccaagg tggacaaaaa ggtggaaccc
300
aagagctgcg acaagaccca cacctgtccc ccctgccctg cccctgaact ggctggcgct
360
ccctccgtgt tcctgttccc cccaaagccc aaggacaccc tgatgatcag ccggaccccc
420
gaagtgacct gcgtggtggt ggacgtgtcc cacgaggacc ctgaagtgaa gttcaattgg
480
tacgtggacg gcgtggaagt gcacaacgcc aagaccaagc ccagagagga acagtacaac
540
agcacctacc gggtggtgtc cgtgctgacc gtgctgcacc aggactggct gaacggcaaa
600
gagtacaagt gcaaggtgtc caacaaggcc ctgcctgctc ccatcgagaa aaccatcagc
660
aaggccaagg gccagccccg cgagcctcag gtgtacacac tgccccccag ccgggacgag
720
ctgaccaaga accaggtgtc cctgacctgt ctggtgaaag gcttctaccc cagcgatatc
780
gccgtggaat gggagagcaa cggccagccc gagaacaact acaagaccac cccccctgtg
840
ctggacagcg acggctcatt cttcctgtac agcaagctga ccgtggacaa gagccggtgg
900
cagcagggca acgtgttcag ctgcagcgtg atgcacgagg ccctgcacaa ccactacacc
960
cagaagtccc tgagcctgag ccccggc
987
<210> 250
<211> 978
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="Human IgG4"
<400> 250
gctagcacca agggccccag cgtgttcccc ctggcccctt gtagcagaag caccagcgag
60
agcacagccg ccctgggctg cctggtgaaa gactacttcc ccgagcccgt caccgtgtcc
120
tggaacagcg gagccctgac cagcggcgtg cacacctttc cagccgtgct gcagagcagc
180
ggcctgtaca gcctgagcag cgtggtgaca gtgccctcca gcagcctggg caccaagacc
240
tacacctgta acgtggacca caagcccagc aacaccaagg tggacaagcg ggtggaatct
300
aagtacggcc caccctgccc cccctgccct gcccctgaat ttctgggcgg accctccgtg
360
ttcctgttcc ccccaaagcc caaggacacc ctgatgatca gccggacccc cgaagtgacc
420
tgcgtggtgg tggacgtgtc ccaggaagat cccgaggtcc agttcaattg gtacgtggac
480
ggcgtggaag tgcacaacgc caagaccaag cccagagagg aacagttcaa cagcacctac
540
cgggtggtgt ccgtgctgac cgtgctgcac caggactggc tgaacggcaa agagtacaag
600
tgcaaagtct ccaacaaggg cctgcccagc tccatcgaga aaaccatcag caaggccaag
660
ggccagcccc gcgagcctca ggtgtacaca ctgcccccca gccaggaaga gatgaccaag
720
aaccaggtgt ccctgacctg tctggtgaaa ggcttctacc ccagcgatat cgccgtggaa
780
tgggagagca acggccagcc cgagaacaac tacaagacca ccccccctgt gctggacagc
840
gacggcagct tcttcctgta ctcccggctg accgtggaca agagccggtg gcaggaaggc
900
aacgtcttca gctgcagcgt gatgcacgag gccctgcaca accactacac ccagaagtcc
960
ctgagcctga gcctgggc
978
<210> 251
<211> 978
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="Human IgG4"
<400> 251
gctagcacca agggccccag cgtgttcccc ctggcccctt gtagcagaag caccagcgag
60
agcacagccg ccctgggctg cctggtgaaa gactacttcc ccgagcccgt caccgtgtcc
120
tggaacagcg gagccctgac cagcggcgtg cacacctttc cagccgtgct gcagagcagc
180
ggcctgtaca gcctgagcag cgtggtgaca gtgccctcca gcagcctggg caccaagacc
240
tacacctgta acgtggacca caagcccagc aacaccaagg tggacaagcg ggtggaatct
300
aagtacggcc caccctgccc cccctgccct gcccctgaat ttctgggcgg accctccgtg
360
ttcctgttcc ccccaaagcc caaggacacc ctgtatatca ctcgggagcc cgaagtgacc
420
tgcgtggtgg tggacgtgtc ccaggaagat cccgaggtcc agttcaattg gtacgtggac
480
ggcgtggaag tgcacaacgc caagaccaag cccagagagg aacagttcaa cagcacctac
540
cgggtggtgt ccgtgctgac cgtgctgcac caggactggc tgaacggcaa agagtacaag
600
tgcaaagtct ccaacaaggg cctgcccagc tccatcgaga aaaccatcag caaggccaag
660
ggccagcccc gcgagcctca ggtgtacaca ctgcccccca gccaggaaga gatgaccaag
720
aaccaggtgt ccctgacctg tctggtgaaa ggcttctacc ccagcgatat cgccgtggaa
780
tgggagagca acggccagcc cgagaacaac tacaagacca ccccccctgt gctggacagc
840
gacggcagct tcttcctgta ctcccggctg accgtggaca agagccggtg gcaggaaggc
900
aacgtcttca gctgcagcgt gatgcacgag gccctgcaca accactacac ccagaagtcc
960
ctgagcctga gcctgggc
978
<210> 252
<211> 975
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="Human IgG2"
<400> 252
gctagcacca agggccccag cgtgttccct ctggcccctt gtagcagaag caccagcgag
60
tctacagccg ccctgggctg cctcgtgaag gactactttc ccgagcccgt caccgtgtcc
120
tggaactctg gcgctctgac aagcggcgtg cacacctttc cagccgtgct gcagagcagc
180
ggcctgtact ctctgagcag cgtcgtgacc gtgcccagca gcaatttcgg cacccagacc
240
tacacctgta acgtggacca caagcccagc aacaccaagg tggacaagac cgtggaacgg
300
aagtgctgcg tggaatgccc cccttgtcct gcccctccag tggctggccc ttccgtgttc
360
ctgttccccc caaagcccaa ggacaccctg atgatcagcc ggacccccga agtgacctgc
420
gtggtggtgg atgtgtccca cgaggacccc gaggtgcagt tcaattggta cgtggacggc
480
gtggaagtgc acaacgccaa gaccaagccc agagaggaac agttcaacag caccttccgg
540
gtggtgtccg tgctgaccgt ggtgcatcag gactggctga acggcaaaga gtacaagtgc
600
aaggtgtcca acaagggcct gcccagctcc atcgagaaaa ccatcagcaa gaccaaaggc
660
cagccccgcg agccccaggt gtacacactg cctccaagcc gggaagagat gaccaagaat
720
caggtgtccc tgacctgtct cgtgaaaggc ttctacccct ccgatatcgc cgtggaatgg
780
gagagcaacg gccagcccga gaacaactac aagaccaccc cccccatgct ggacagcgac
840
ggctcattct tcctgtacag caagctgaca gtggacaagt cccggtggca gcagggcaac
900
gtgttcagct gcagcgtgat gcacgaggcc ctgcacaacc actacaccca gaagtccctg
960
agcctgagcc ctggc
975
<210> 253
<211> 333
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="BKO-4A8 VL"
<400> 253
cagtctgctc tgacacagcc tcctagcgcc tctggctctc ctggccagag cgtgaccatc
60
agctgtatcg gcaccagcag cgacgtgggc ggctacaact acgtgtcctg gtatcagcag
120
caccccgaca aggcccccaa gctgatgatc tacgaagtga acaagcggcc cagcggcgtg
180
cccgatagat tcagcggcag caagagcggc aacaccgcca gcctcacagt gtctggactg
240
caggccgagg acgaggccga ctactactgt agcagctacg ccggcaacaa caacttcggc
300
gtgttcggcg gaggcaccaa gctgacagtc cta
333
<210> 254
<211> 333
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VL variant b"
<400> 254
cagtctgctc tgacacagcc tcctagcgcc tctggctctc ctggccagag cgtgaccatc
60
agctgtatcg gcaccagcag cgacgtgggc ggctacaact acgtgtcctg gtatcagcag
120
caccccgaca aggcccccaa gctgatgatc tacgaagtgt ccaagcggcc cagcggcgtg
180
cccgatagat tcagcggcag caagagcggc aacaccgcca gcctcacagt gtctggactg
240
caggccgagg acgaggccga ctactactgt agcagctacg ccggcagcaa caacttcggc
300
gtgttcggcg gaggcaccaa gctgacagtc cta
333
<210> 255
<211> 333
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="Completely synthesized"
<220>
<221> source
<223> /note="4A8 VL variant c"
<400> 255
cagtctgctc tgacacagcc tcctagcgcc tctggctctc ctggccagag cgtgaccatc
60
agctgtatcg gcaccagcag cgacgtgggc ggctacaact acgtgtcctg gtatcagcag
120
caccccggta aggcccccaa gctgatgatc tacgaagtgt ccaagcggcc cagcggcgtg
180
cccgatagat tcagcggcag caagagcggc aacaccgcca gcctcacagt gtctggactg
240
caggccgagg acgaggccga ctactactgt agcagctacg ccggcagcaa caacttcggc
300
gtgttcggcg gaggcaccaa gctgacagtc cta
333
<210> 256
<211> 318
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="lambda constant light chain"
<400> 256
ggtcagccca aggccgctcc cagcgtgacc ctgttccccc caagcagcga ggaactgcag
60
gccaacaagg ccaccctggt gtgcctgatc agcgacttct accctggggc cgtgaccgtg
120
gcctggaagg ccgatagcag ccctgtgaag gccggcgtgg aaaccaccac cccctccaag
180
cagagcaaca acaaatacgc cgccagcagc tacctgtccc tgacccccga gcagtggaag
240
tcccaccggt cctacagctg ccaggtgaca cacgagggca gcaccgtgga aaagaccgtg
300
gcccccaccg agtgcagc
318
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИБРИДНЫЕ БЕЛКИ ВАРИАНТА sPD-1—FC | 2019 |
|
RU2785993C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2841244C2 |
| НОВЫЕ КОНСТРУКЦИИ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА, СОДЕРЖАЩИЕ ДОМЕНЫ TNFR2 | 2019 |
|
RU2808254C2 |
| Антитела против лиганда-1 запрограммированной смерти (PD-L1) и их применение | 2017 |
|
RU2721582C1 |
| АНТИТЕЛА ПРОТИВ БЕЛКА-1 ЗАПРОГРАММИРОВАННОЙ КЛЕТОЧНОЙ СМЕРТИ (PD-1) И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2725950C1 |
| Композиция для предупреждения и лечения заболевания кожи, содержащая вещество, специфично связывающееся с пептидом, имеющим происхождение из виментина | 2018 |
|
RU2751486C1 |
| IL-12 ГЕТЕРОДИМЕРНЫЕ СЛИТЫЕ БЕЛКИ FC | 2019 |
|
RU2819097C2 |
| УЛУЧШЕННЫЕ ОДИНОЧНЫЕ ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ИММУНОГЛОБУЛИНА, СВЯЗЫВАЮЩИЕСЯ С СЫВОРОТОЧНЫМ АЛЬБУМИНОМ | 2017 |
|
RU2765384C2 |
| АНТИТЕЛА К C10ORF54 И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2819627C1 |
| НОВЫЕ ВАРИАНТЫ ГИАЛУРОНИДАЗЫ С УЛУЧШЕННОЙ СТАБИЛЬНОСТЬЮ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2021 |
|
RU2811464C2 |

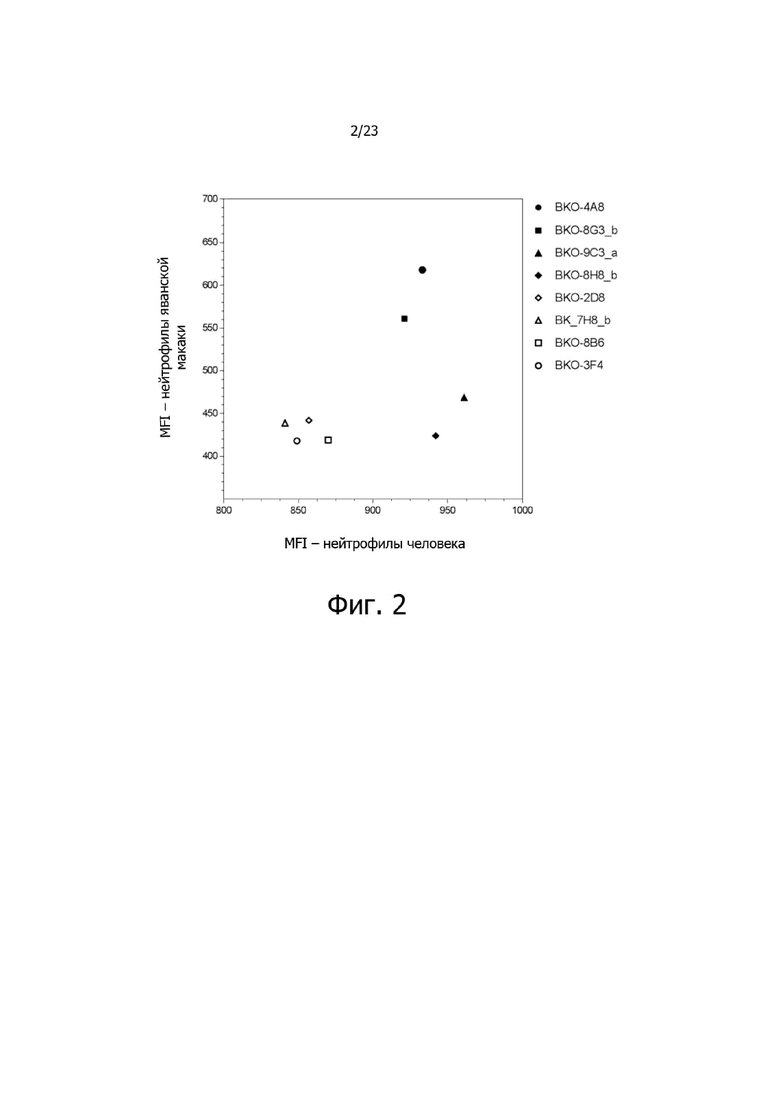
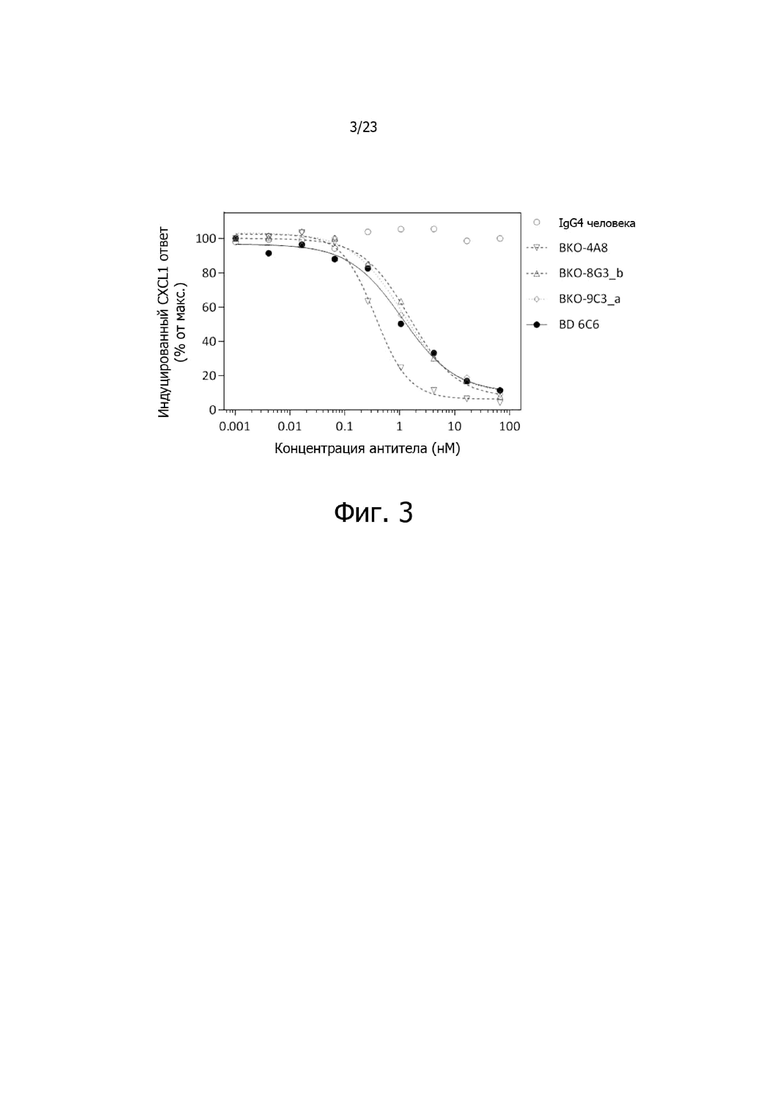
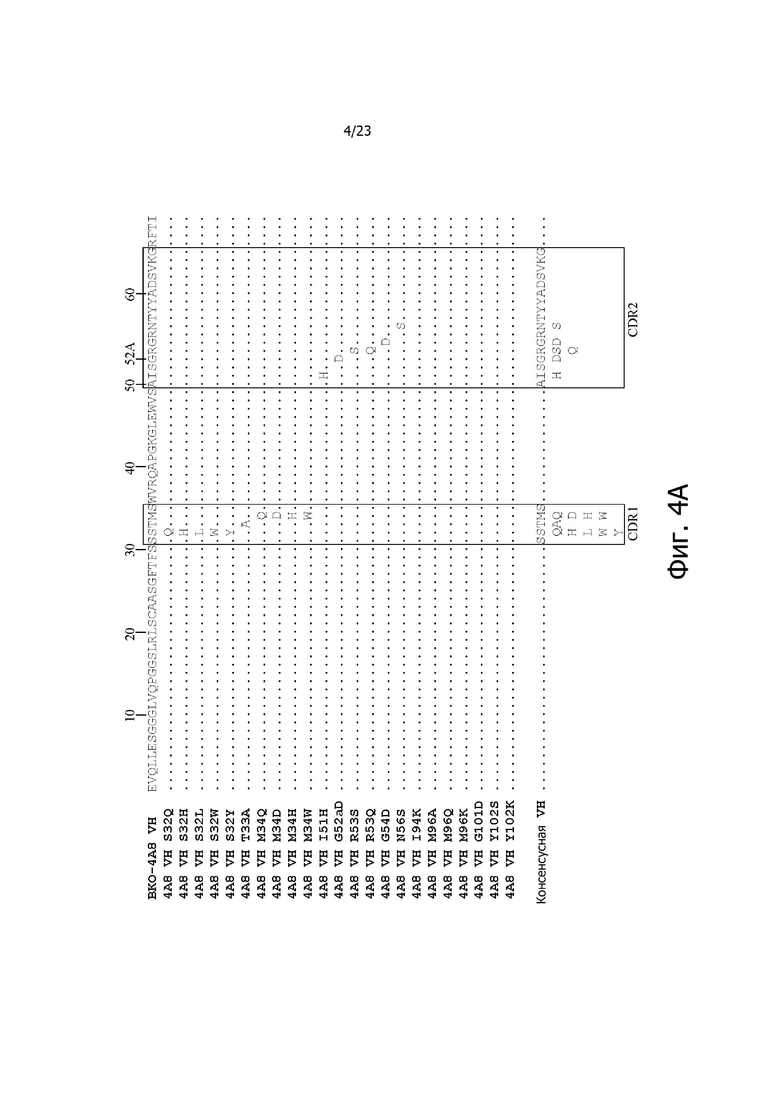
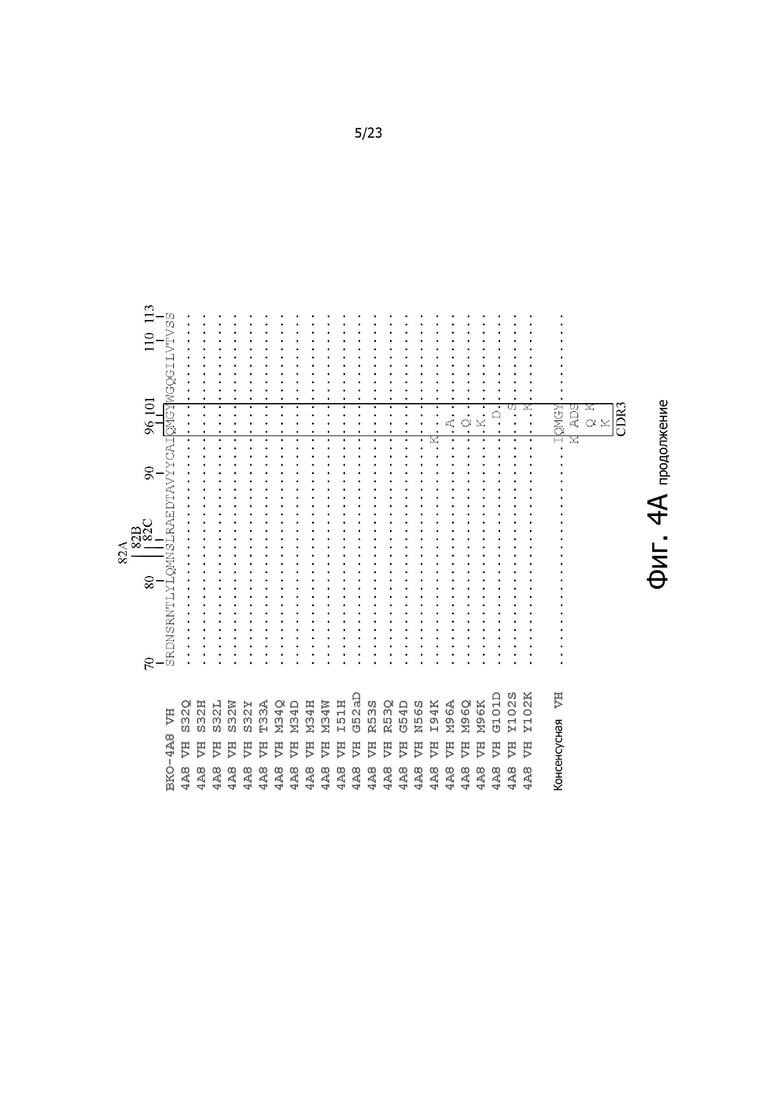
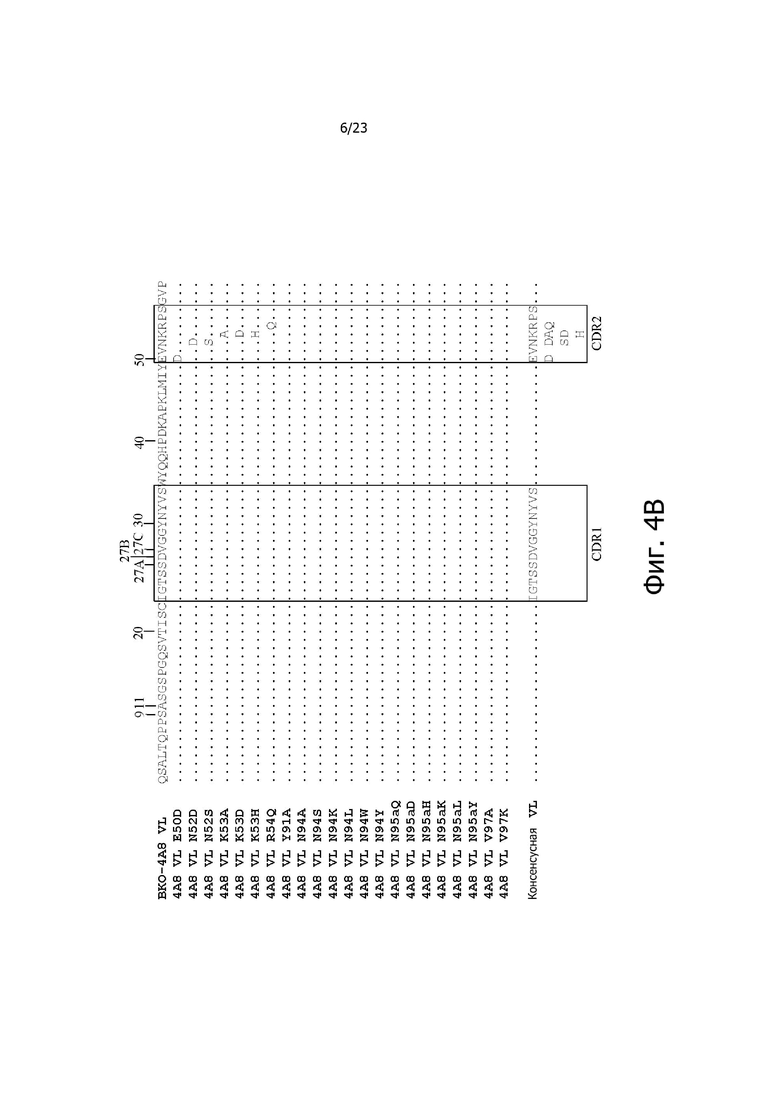
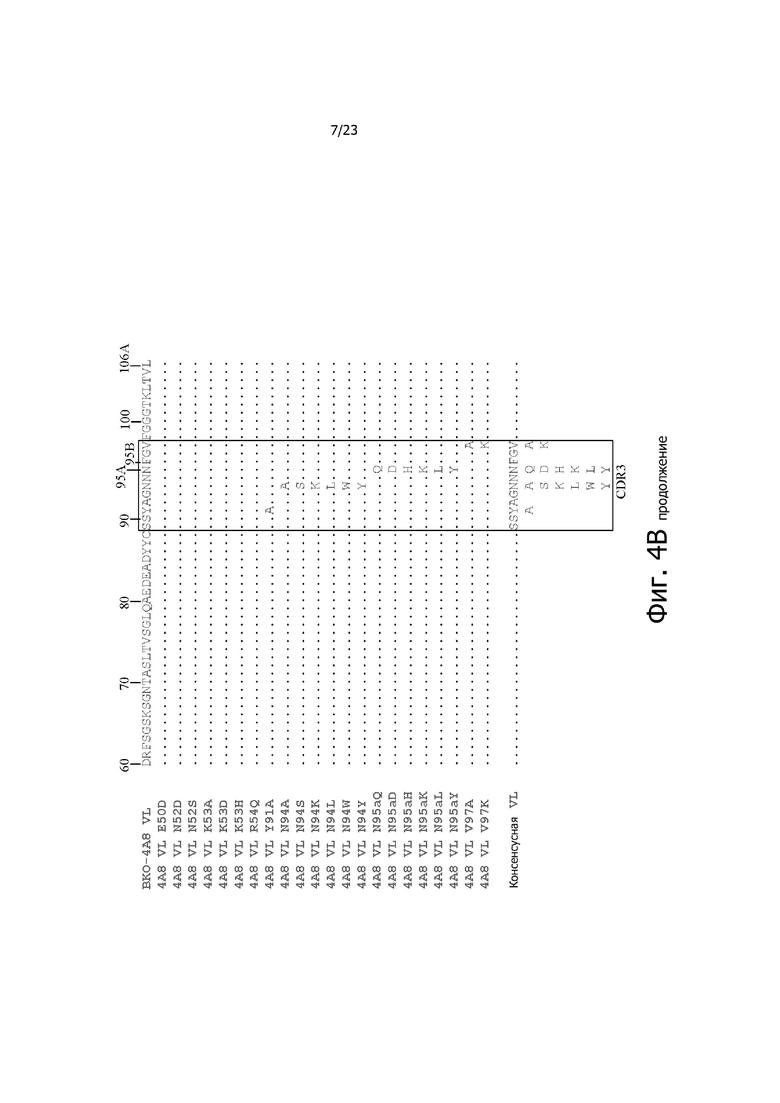
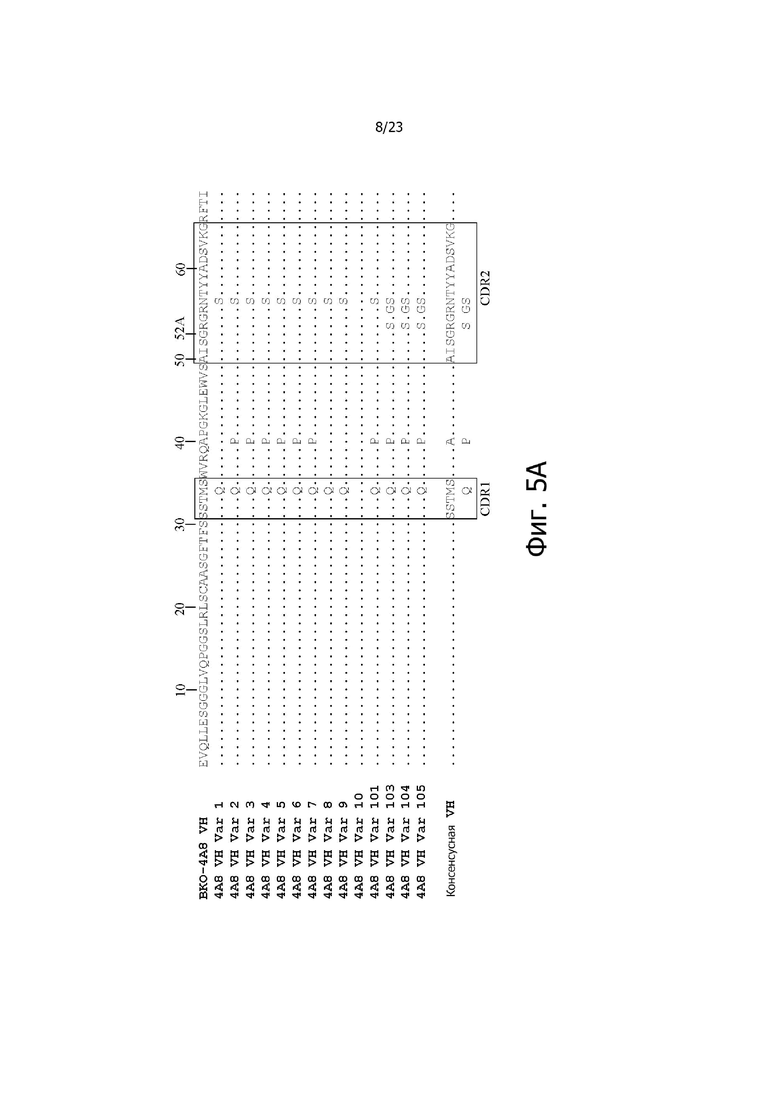
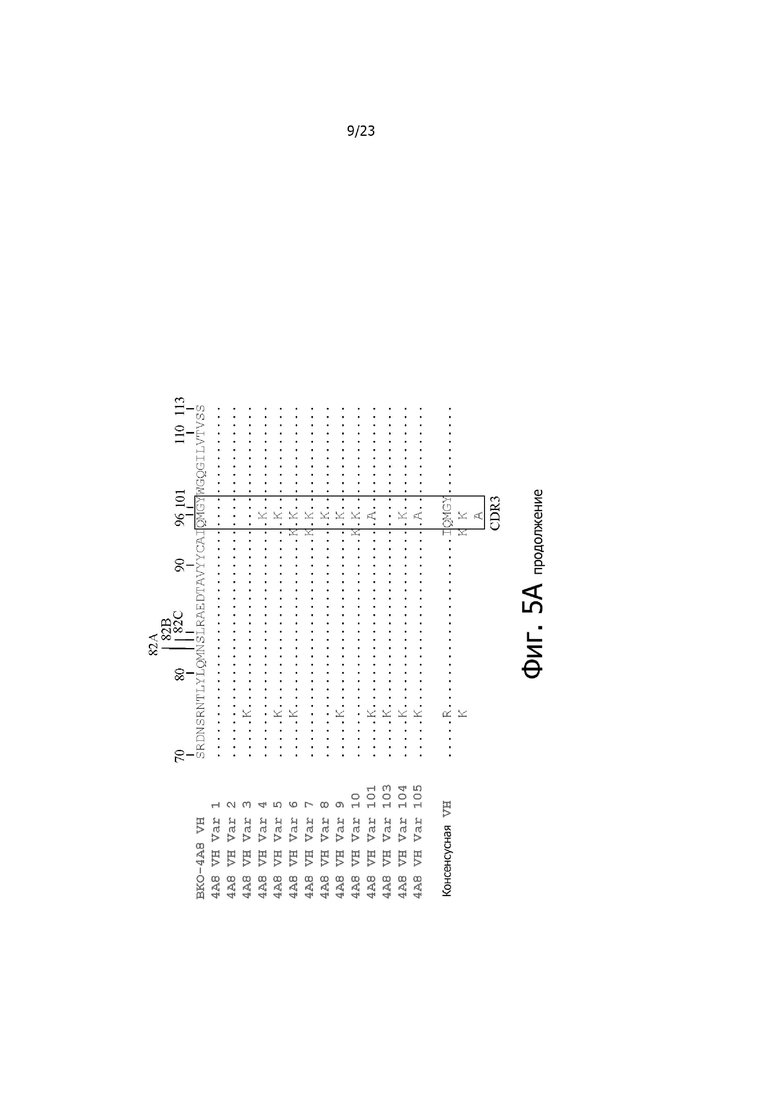
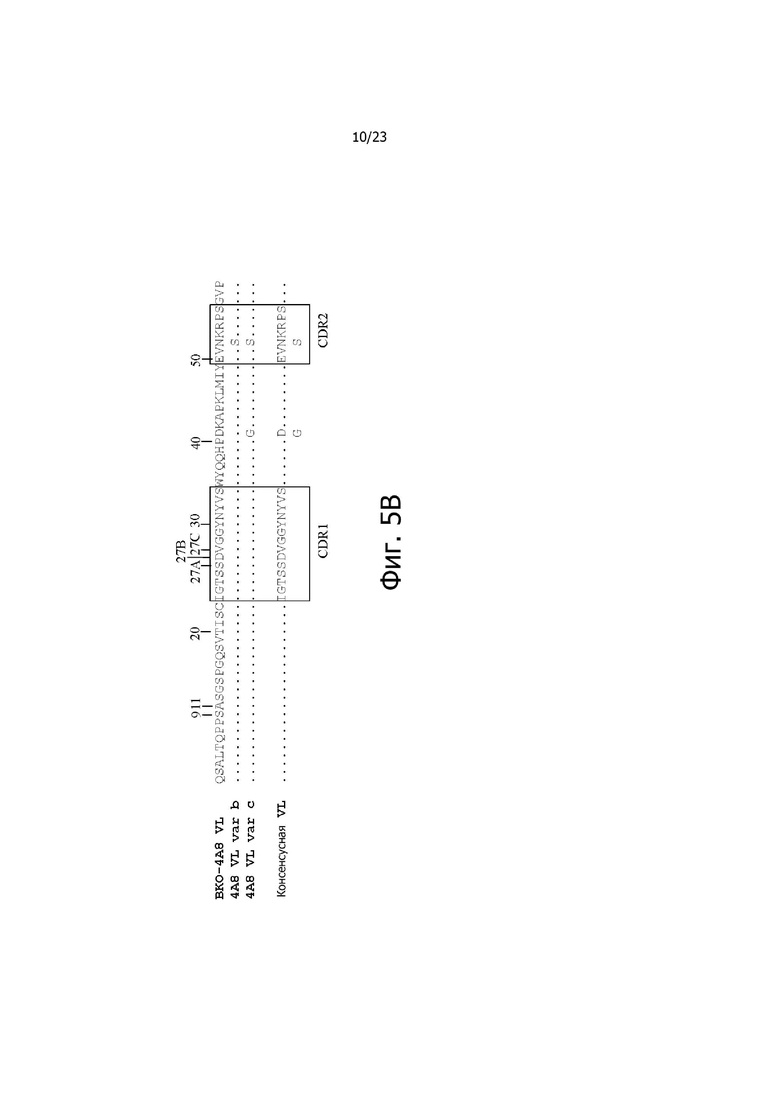
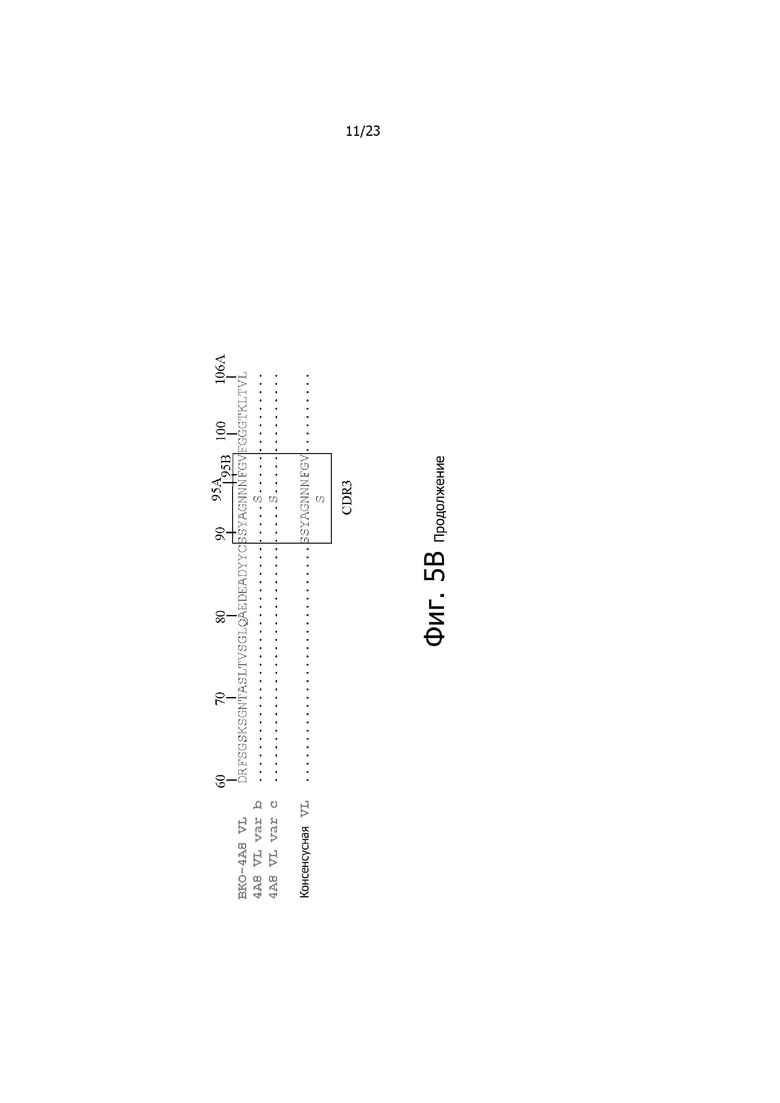
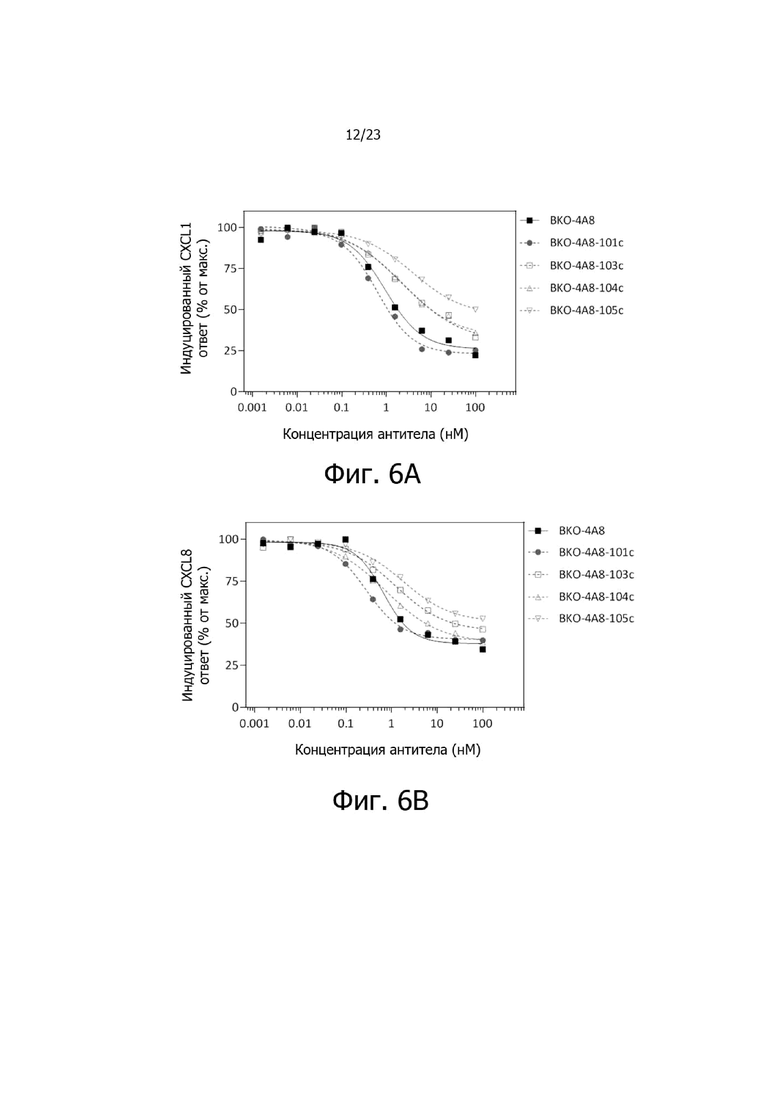
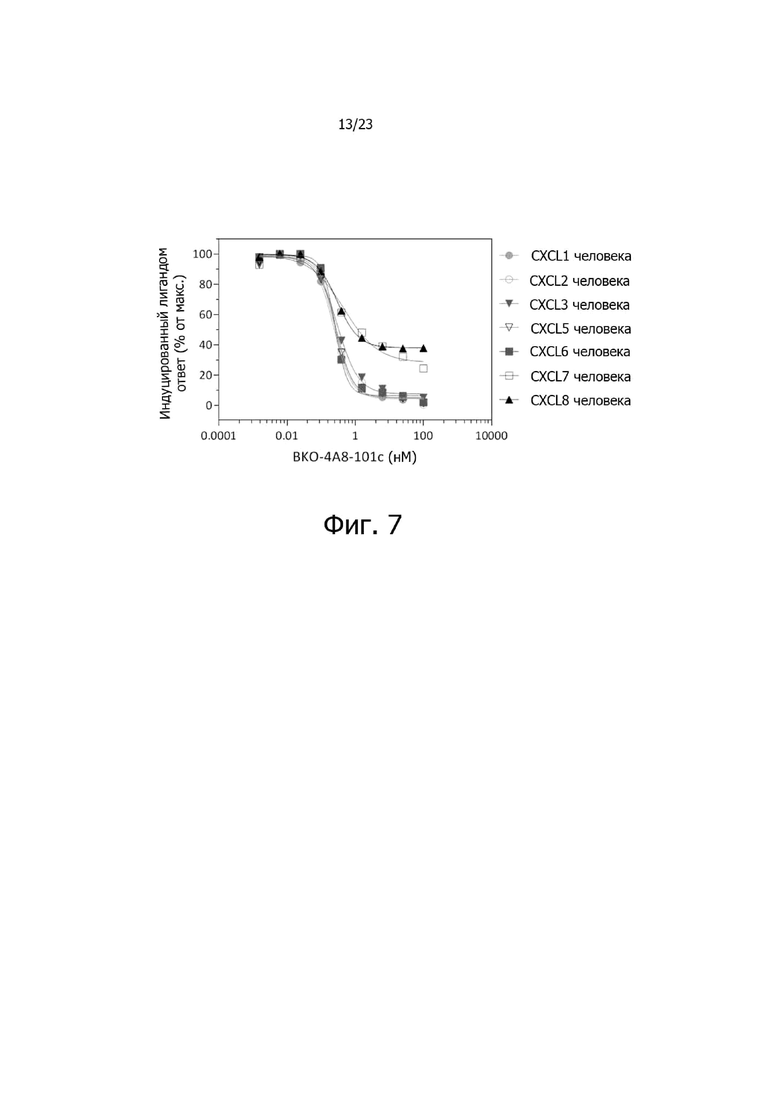
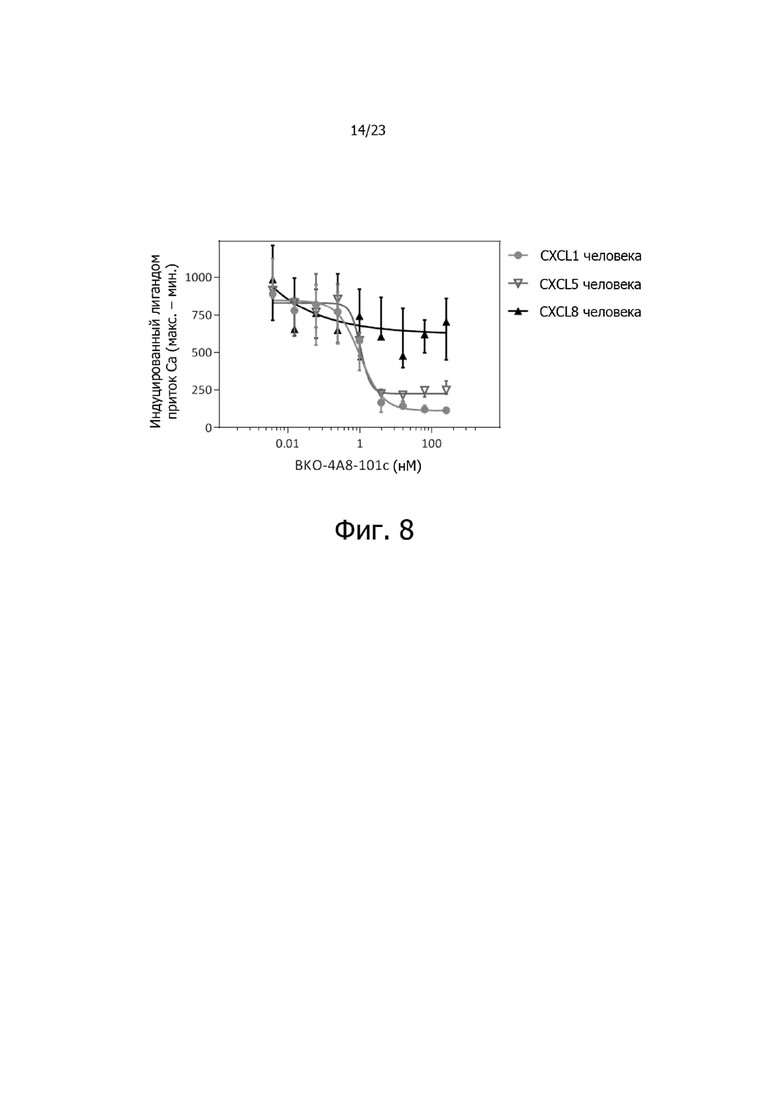
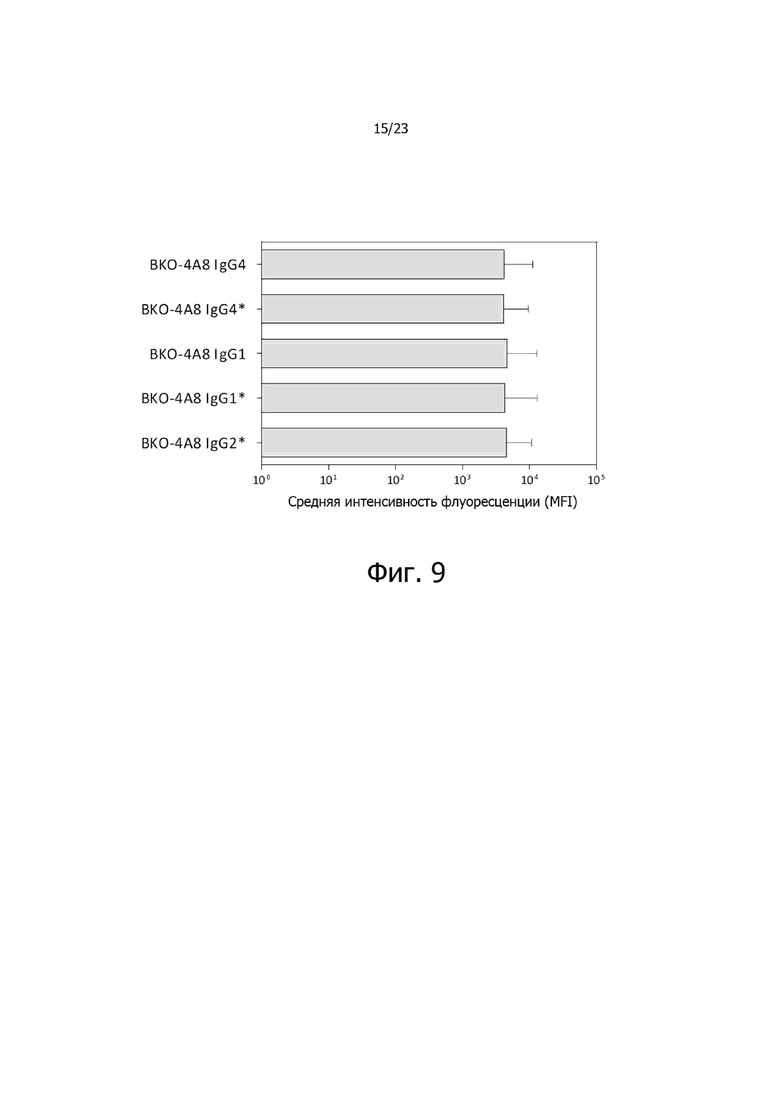
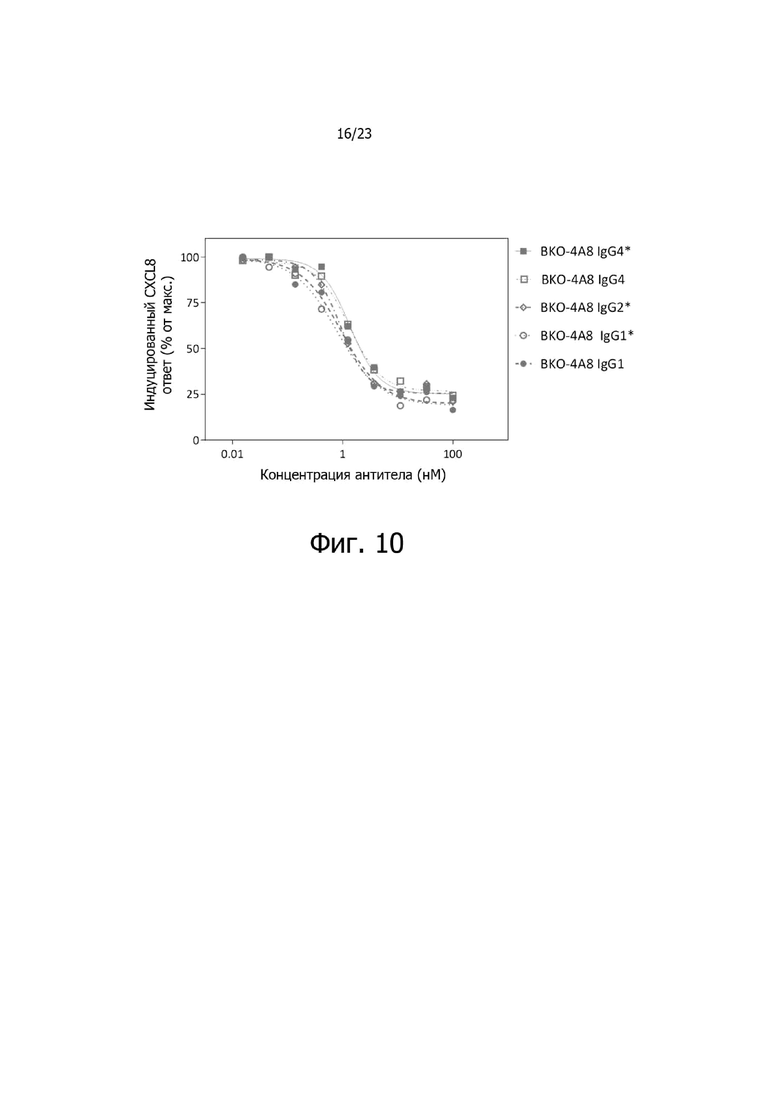
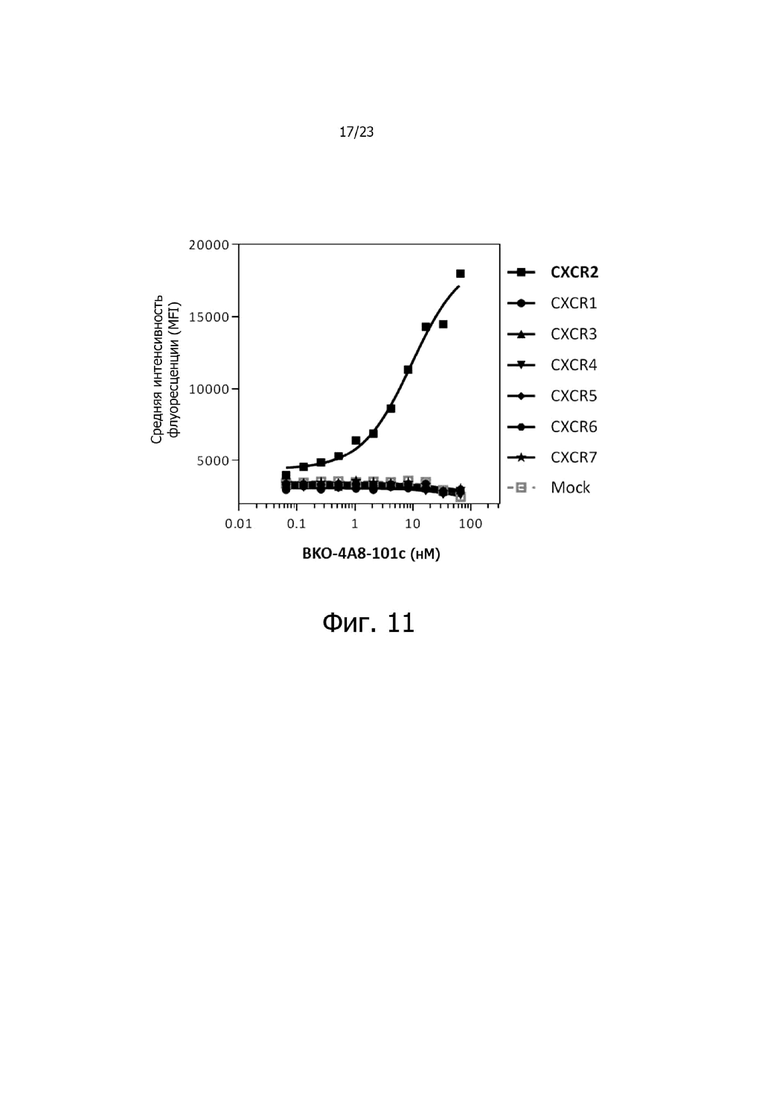
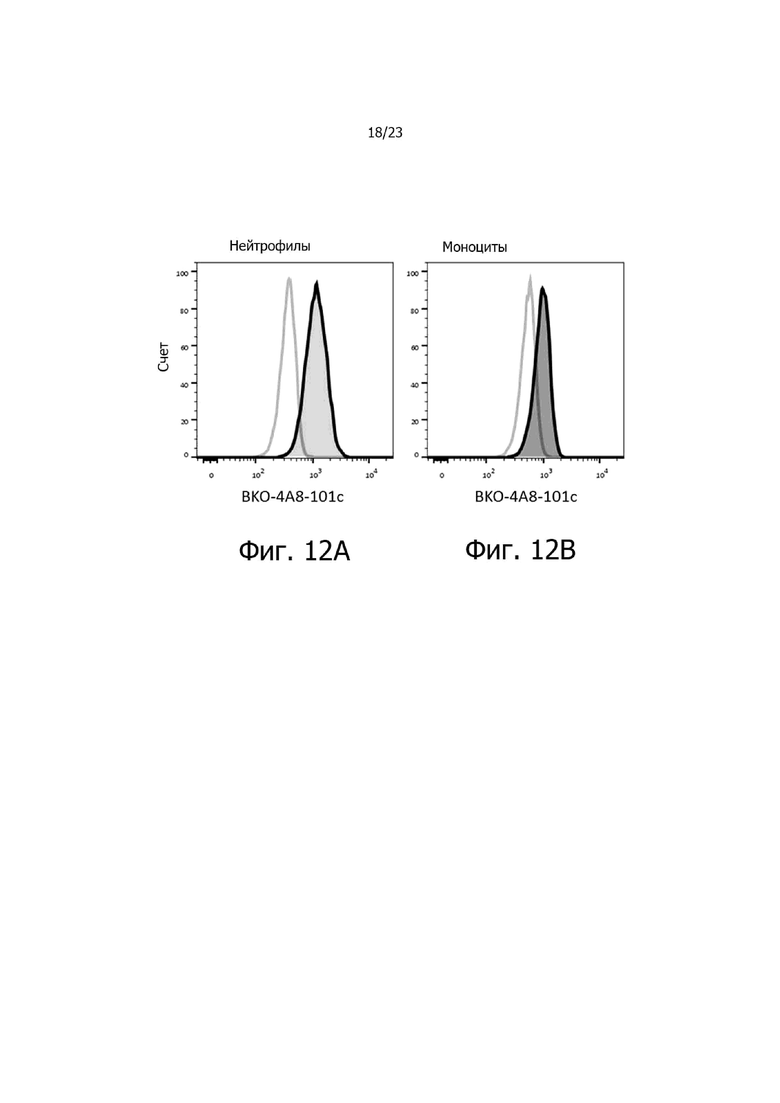
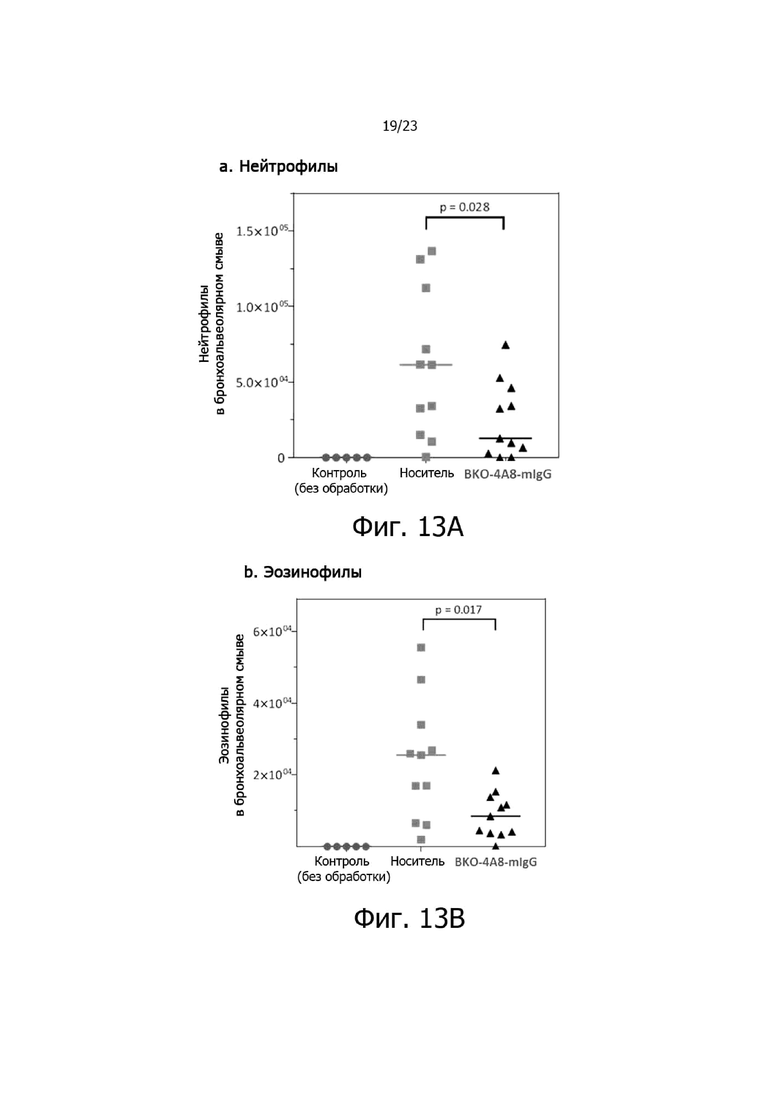

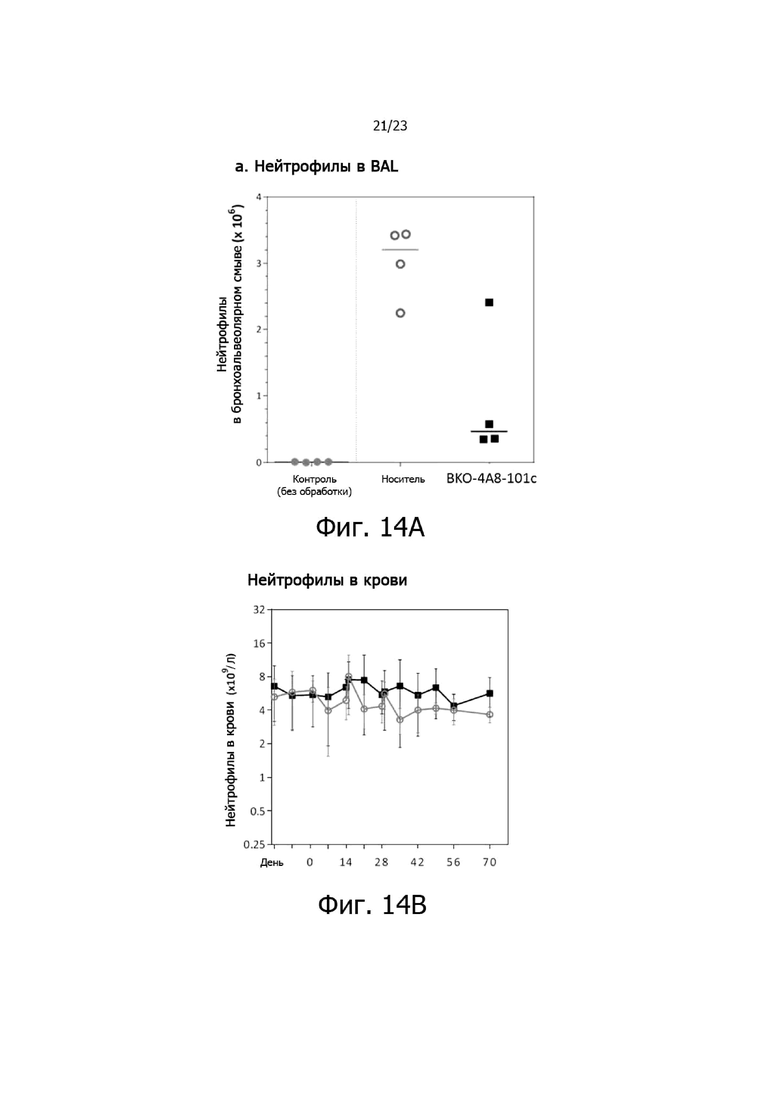
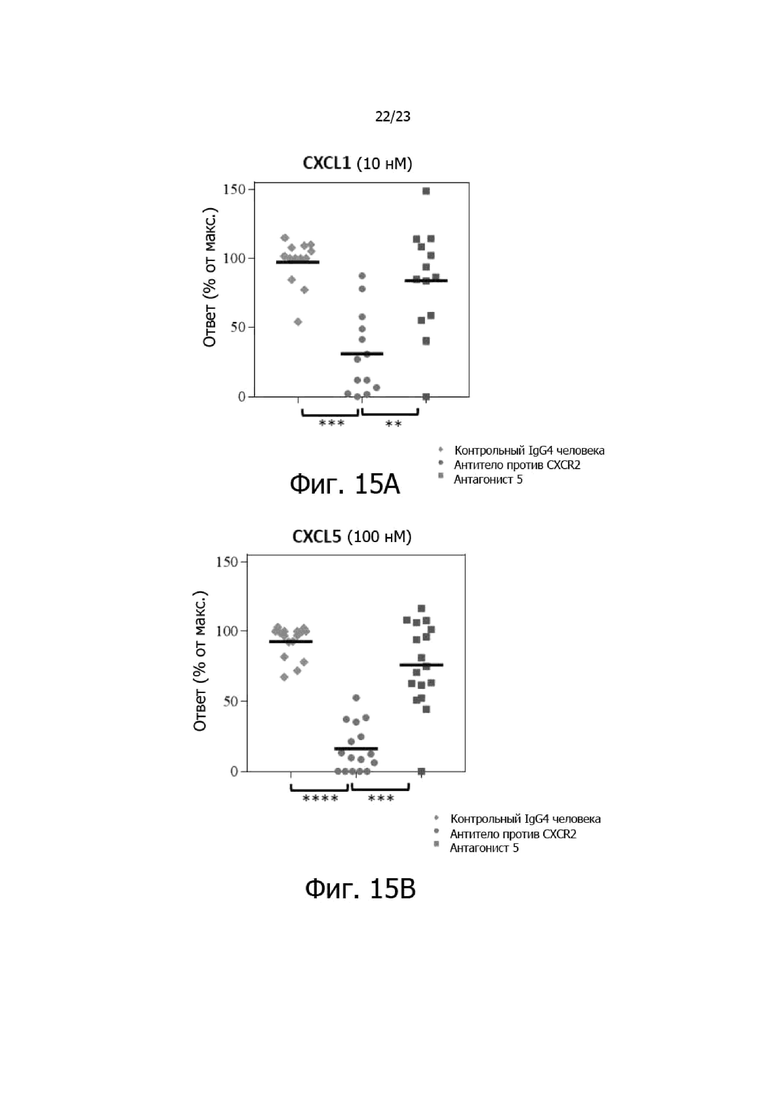

Изобретение относится к области биохимии, в частности к молекуле человеческого антитела, которая иммуноспецифически связывается с CXCR2 человека. Также раскрыты нуклеиновая кислота, кодирующая указанное антитело; вектор или клетка, содержащие указанную нуклеиновую кислоту; фармацевтическая композиция, содержащая указанное антитело. Раскрыты способ лечения с помощью указанного антитела; применение указанного антитела для получения лекарственного средства; способ блокирования хемотаксиса нейтрофилов с помощью указанного антитела; способ блокирования сигнализации CXCR2 в ответ на CXCL1 и/или CXCL5 в клетках, экспрессирующих сигнализацию CXCR2. Изобретение позволяет эффективно лечить такие заболевания, как нейтрофилия дыхательных путей или острое воспаление легких. 9 н. и 16 з.п. ф-лы, 12 пр., 19 табл., 15 ил.
1. Молекула человеческого антитела, которая иммуноспецифически связывается с CXCR2 человека, причем молекула антитела включает:
CDR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 169, CDR2 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 170, CDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 171, CDR1 легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 172, CDR2 легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 173, а CDR3 легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 174; или
CDR1 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 228, CDR2 тяжелой цепи, имеющий аминокислотную последовательность о SEQ ID NO: 229, CDR3 тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 230, CDR1 легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 201, CDR2 легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 231, а CDR3 легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 232,
и при этом молекула антитела ингибирует индуцированную CXCL1 активацию CXCR2 или индуцированную CXCL5 активацию CXCR2.
2. Молекула человеческого антитела по п. 1, при этом:
вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 167, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 168; или
вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 226, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 227.
3. Молекула человеческого антитела по п. 2, при этом:
a) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 98, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
b) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 99, а вариабельная область легкой цепи имеет аминокислотную последовательность о SEQ ID NO: 109 или 110;
c) вариабельная область тяжелой цепи имеет аминокислотную последовательность о SEQ ID NO: 100, а вариабельная область легкой цепи имеет аминокислотную последовательность о SEQ ID NO: 109 или 110;
d) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 101, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
e) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 102, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
f) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 103, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
g) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 104, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
h) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 105, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
i) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 106, а вариабельная область легкой цепи имеет аминокислотную последовательность о SEQ ID NO: 109 или 110;
j) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 107, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
k) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 108, а вариабельная область легкой цепи имеет аминокислотную последовательность о SEQ ID NO: 109 или 110;
l) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 162, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
m) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 163, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
n) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 164, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110;
o) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 165, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110; или
p) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 166, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 109 или 110.
4. Молекула человеческого антитела по п. 3, при этом:
a) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 108, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 110;
b) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 162, а вариабельная область легкой цепи имеет аминокислотную последовательность о SEQ ID NO: 110;
c) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 163, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 110;
d) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 164, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 110;
e) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 165, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 110; или
f) вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 166, а вариабельная область легкой цепи имеет аминокислотную последовательность о SEQ ID NO: 110.
5. Молекула человеческого антитела по п. 1, при этом CDR1 тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 182, CDR2 тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 192, CDR3 тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 195, CDR1 легкой цепи имеет аминокислотную последовательность SEQ ID NO: 201, CDR2 легкой цепи имеет аминокислотную последовательность SEQ ID NO: 205, а CDR3 легкой цепи имеет аминокислотную последовательность SEQ ID NO: 213.
6. Молекула человеческого антитела по любому из пп. 1-5, при этом вариабельная область тяжелой цепи имеет аминокислотную последовательность SEQ ID NO: 108, а вариабельная область легкой цепи имеет аминокислотную последовательность SEQ ID NO: 110.
7. Молекула человеческого антитела по любому из пп. 1-6, при этом антитело содержит константную область тяжелой цепи IgG1 человека.
8. Молекула человеческого антитела по п. 7, при этом константная область тяжелой цепи IgG1 человека имеет аминокислотную последовательность SEQ ID NO: 122 или 124.
9. Молекула человеческого антитела по любому из пп. 1-6, при этом антитело содержит константную область тяжелой цепи IgG2 человека.
10. Молекула человеческого антитела по п. 9, при этом константная область тяжелой цепи IgG2 человека имеет аминокислотную последовательность SEQ ID NO: 120.
11. Молекула человеческого антитела по любому из пп. 1-6, при этом антитело содержит константную область тяжелой цепи IgG4 человека.
12. Молекула человеческого антитела по любому из пп. 1-11, при этом молекула антитела представляет собой Fab-фрагмент, F(ab)2-фрагмент или одноцепочечное антитело.
13. Фармацевтическая композиция для лечения или профилактики нейтрофилии дыхательных путей или острого воспаления легких, содержащая терапевтически эффективное количество молекулы человеческого антитела по любому из пп. 1-12.
14. Молекула нуклеиновой кислоты, кодирующая молекулу человеческого антитела по любому из пп. 1-12.
15. Экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты по п. 14.
16. Клетка, трансформированная для экспрессии молекулы человеческого антитела по любому из пп. 1-12.
17. Способ лечения или профилактики нейтрофилии дыхательных путей или острого воспаления легких у субъекта, который включает
введение субъекту терапевтически эффективного количества молекул человеческого антитела по любому из пп. 1-12 или фармацевтической композиции по п. 13 для предотвращения или лечения нейтрофилии дыхательных путей или острого воспаления легких.
18. Способ по п. 17, при этом нейтрофилия дыхательных путей или острое воспаление легких либо то и другое представляет собой хроническую обструктивную болезнь легких, тяжелую нейтрофильную астму либо то и другое.
19. Молекула человеческого антитела по любому из пп. 1-12 или фармацевтическая композиция по п. 13 для применения в качестве лекарственного средства для профилактики или лечения нейтрофилии в периферических тканях.
20. Молекула человеческого антитела по любому из пп. 1-12 или фармацевтическая композиция по п. 13 для применения при профилактике или лечении нейтрофилии дыхательных путей или острого воспаления легких.
21. Применение молекул человеческого антитела по любому из пп. 1-12 или фармацевтической композиции по п. 13 при получении лекарственного средства для профилактики или лечения нейтрофилии дыхательных путей или острого воспаления легких.
22. Применение по п. 21, при этом нейтрофилия дыхательных путей, острое воспаление легких либо то и другое представляет собой хроническую обструктивную болезнь легких, тяжелую нейтрофильную астму либо то и другое.
23. Способ блокирования хемотаксиса нейтрофилов, включающий воздействие на нейтрофилы человеческим антителом по любому из пп. 1-12.
24. Способ по п. 23, при этом хемотаксис представляет собой миграцию нейтрофилов в легкие.
25. Способ блокирования сигнализации CXCR2 в ответ на CXCL1 и/или CXCL5 в клетках, экспрессирующих сигнализацию CXCR2, включающий воздействие на клетки человеческим антителом по любому из пп. 1-12.
| WO 2014170317 A1, 23.10.2014 | |||
| US 5440021 A, 8.08.1995 | |||
| RU 201710617 2A, 27.07.2015. |
Авторы
Даты
2023-11-09—Публикация
2019-07-31—Подача