Изобретение относится к области биотехнологии и производству цельновирионных вакцин против альфа-коронавируса собак, а именно к способу опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины методом обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) в режиме реального времени с применением разработанной функции зависимости величины порогового цикла амплификации и титра инфекционной активности альфа-коронавируса собак (CCoV) производственного штамма РИЧ (TCCoV RICH).
Альфа-коронавирусное заболевание собак вызывает энтерит от легкой до тяжелой степени у щенков [1]. Данное заболевание представляет собой серьезную проблему, которой уделяют внимание международные организации и ветеринарные службы многих стран мира [2].
Альфа-коронавирус собак принадлежит виду Canine Coronavirus (CcoV), роду Alphacoronavirus, подсемейству Orthocoronavirinae, семейству Coronaviridae.
Нуклеиновая кислота вируса представлена одноцепочечной РНК (+) размером около 29500 н.о. Около 2/3 геномной РНК вируса занимают две большие, частично перекрывающиеся открытые рамки считывания (ORF), ORF1a и ORF1b, которые кодируют два полипротеина, приводящих к образованию вирусной репликазы. С 3'-конца 1/3 генома (примерно 9000 н.о.) состоит из других ORF, кодирующих структурные и неструктурные белки. Структурные белки включают белки S, Е, М и N, кодируемые ORF2, ORF4, ORF5 и ORF6 соответственно [3]. Схема картирования генома CCoV производственного штамма РИЧ для ORF2-ORF6 представлена в таблице 1 с нулевым отсчетом нуклеотидов.
Пять основных генов кодируют следующие белки: шипообразный белок (S-белок), мембранный гликопротеин (М-белок), нуклеокапсид (N-белок), белок оболочки (Е-белок) и ORF1ab (большой полипротеин, известный как репликаза / протеаза). М-белок - мембранный белок с тройным охватом, который является наиболее распространенным белком в вирионе. Он играет центральную роль в сборке и морфогенезе вирионов, а также определяет форму вирусной оболочки. Данный белок рассматривается как центральный организатор сборки вирусной частицы, взаимодействующий со всеми другими основными структурными белками коронавируса. Взаимодействия между М-белками являются основной движущей силой формирования оболочки вириона. Кроме того, для полного формирования вириона ему необходимо взаимодействовать с другими структурными белками коронавируса. Взаимодействие спайкового S-белка с М-белком не требуется для процесса сборки. Однако связывание М- с N-белком стабилизирует нуклеокапсид (комплекс N-белок-РНК), а также внутреннее ядро вирионов и, таким образом, способствует завершению сборки вируса. Таким образом, мембранный белок и его взаимодействия с другими структурными белками необходимы для сборки полных вирусных частиц, содержащих 1 молекулу РНК [3,4].
У молодых щенков, иногда в сочетании с другими патогенами, альфа-коронавирусная инфекция может вызвать сильную диарею, рвоту, обезвоживание, потерю аппетита и смерть. Выделение вируса с калом происходит в течение 6-9 дней после заражения [4]. Длительное выделение вируса было обнаружено с помощью ПЦР у щенков, инфицированных CCoV [5].
Система мер борьбы с альфа-коронавирусной инфекцией у собак и ее профилактики предусматривает иммунизацию животных, а также контроль уровня напряженности поствакцинального иммунитета.
Для вакцинации щенков применяют культуральные вакцины против альфа-коронавирусной инфекции собак. При изготовлении данных вакцин вируссодержащую суспензию исследуют на определение титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ для оценки его активности в клетках. В 1,0 см3 суспензии вируса определяют количество клеточных культуральных инфекционных доз, вызывающих 50%-ное поражение клеток, что фактически отражает концентрацию полных вирусных частиц, содержащих РНК в активном состоянии.
Традиционно для определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ применяют метод титрования в монослойной перевиваемой клеточной линии почки кошки Крэнделла Риса CRFK (Crandell Feline Kidney), с помощью которой вычисляют минимальную дозу вируса, способную вызвать лизис 50% клеток (прототип) [6]. Данный метод имеет некоторые ограничения в применении, а именно: 1) длительная процедура анализа (не менее 3 суток), связанная с поражением клеток вирусом; 2) определенная степень субъективности при оценке результатов исследования; 3) высокая стоимость клеточной линии как тест-системы и затраты на ее поддержание; 4) высокая вероятность риска контаминации культуры клеток.
В связи с этим целесообразно провести поиск альтернативного способа опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральной вакцины на основе метода обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР-РВ).
Предложенный метод является высокочувствительным и специфичным, позволяет определять титр инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в вируссодержащих суспензиях в течение 4 часов, не требует использования культуры клеток для анализа, не предполагает контаминации исследуемых образцов, поскольку во время анализа пробирки закрыты.
Технический результат настоящего изобретения заключается в разработке высокочувствительного, высокоспецифичного, экспрессного, не предполагающего применения линий клеток способа опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральной вакцины методом ОТ-ПЦР-РВ с целью устранения вышеуказанных недостатков.
Данная задача решена благодаря созданию нового опосредованного способа определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральной вакцины при использовании метода ОТ-ПЦР-РВ. Разработанный способ дает возможность: 1) сократить время проведения анализа вируссодержащих суспензий для определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины до 4 ч; 2) исключить вероятность контаминации исследуемого материала; 3) проводить контроль реакции ОТ-ПЦР-РВ с использованием мРНК, синтезированной с применением плазмиды р Jet 1.2 sf GFP и культуры клеток почки новорожденного сирийского хомячка BHK-21/SUSP/ARRIAH [7] для трансфекции; 4) увеличить чувствительность и специфичность анализа за счет применения высокоспецифичных оригинальных праймеров и ДНК-зонда, рассчитанных для М-гена альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины; 5) повысить достоверность проводимого анализа благодаря установлению зависимости между титром инфекционной активности альфа-коронавируса собак производственного штамма РИЧ (Tccov rich) и пороговым циклом амплификации (Ct), представленной в виде логарифмической функции lg TCCoV RICH=-0,2998 × Ct+10,491 с высокой достоверностью аппроксимации (R2=0,9991) и эффективностью амплификации 99,43%. Предложенная модель позволяет опосредованно определять титр инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин.
Сущность изобретения отражена на графических изображениях:
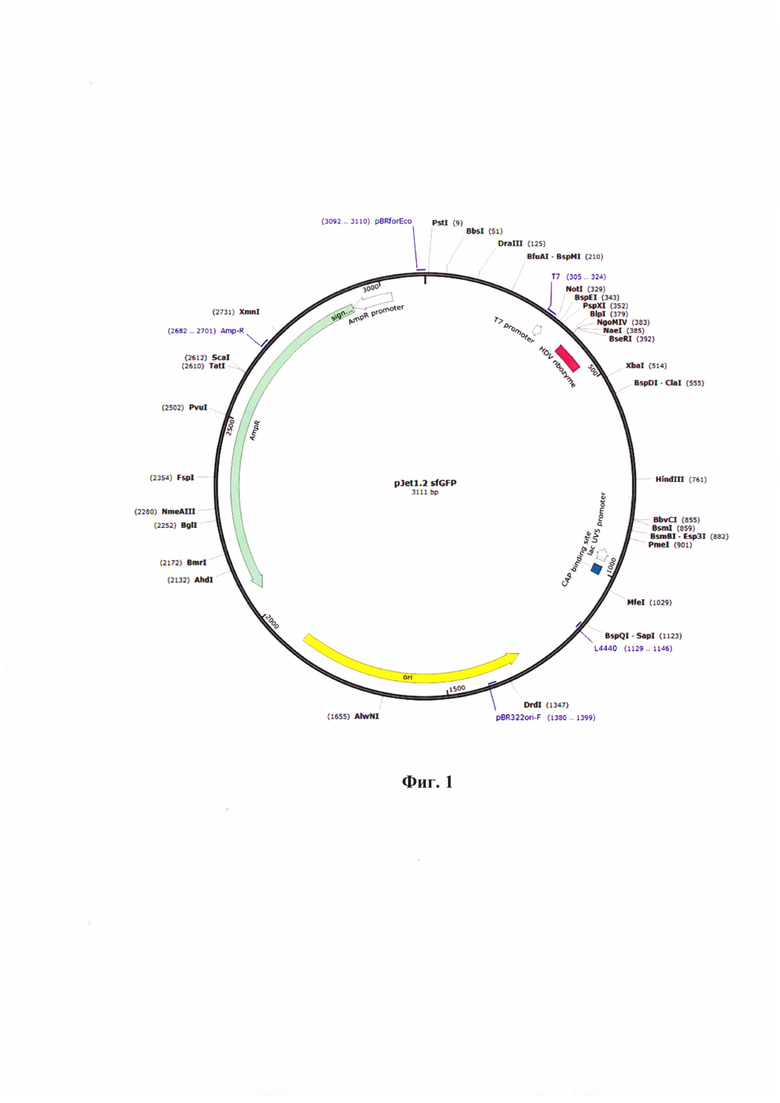
Фиг. 1 - Карта плазмиды р Jet 1.2 sf GFP.
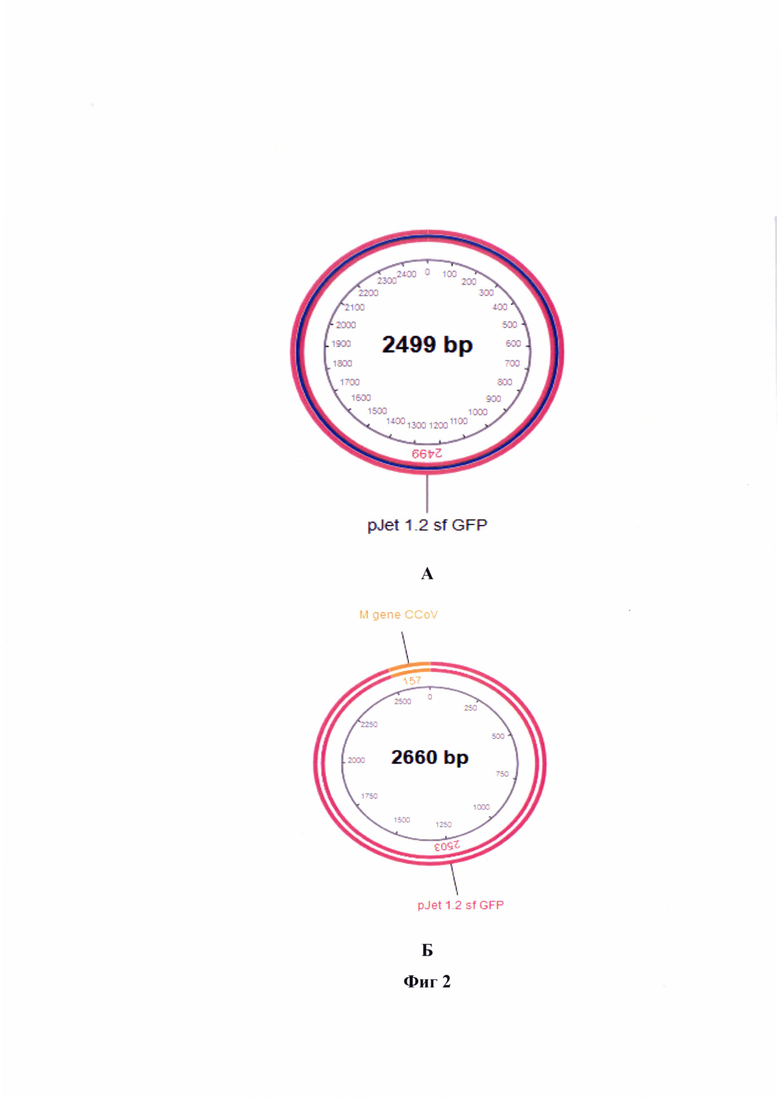
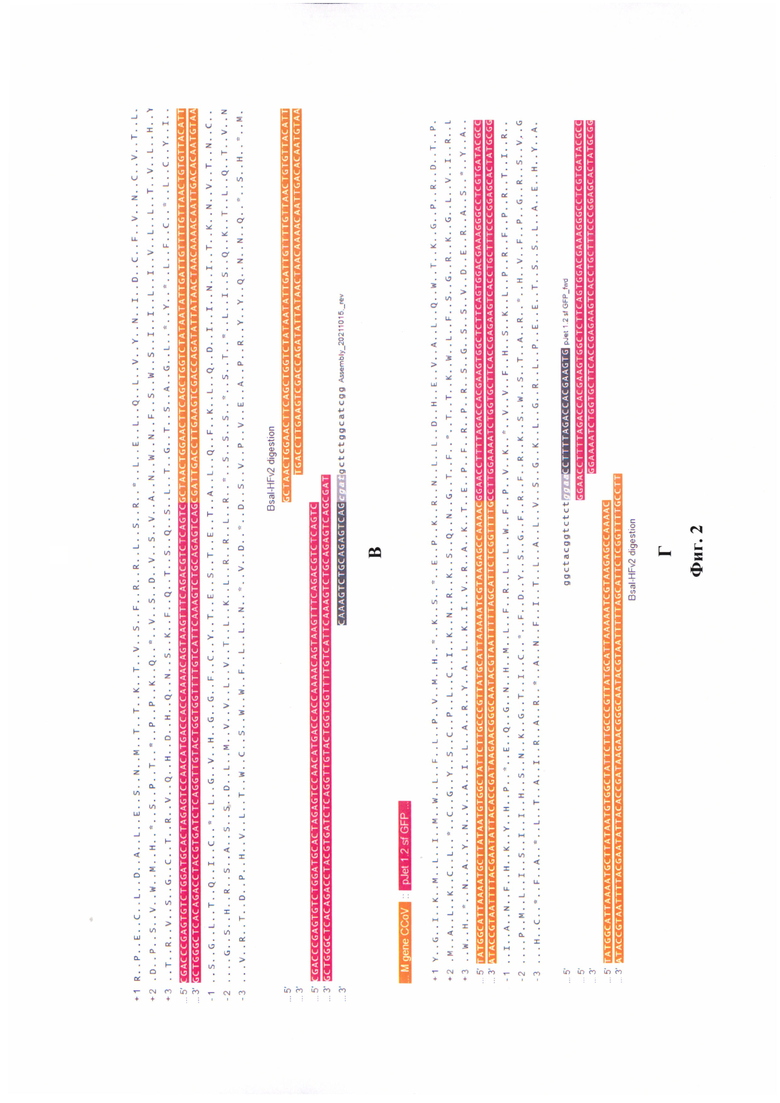
Фиг. 2 - Процесс модифицирования плазмиды р Jet 1.2 sf GFP для клонирования участка М-гена альфа-коронавируса собак. Вставка проводится между участками Т7 promoter и HDV ribozyme. Модель представлена на участках ДНК. Примечание: А - условная карта плазмиды до встраивания, Б - результат встраивания таргетного участка М-гена альфа-коронавируса в плазмиду, В - концевые участки плазмиды и гена (слева), Г - концевые участки гена и плазмиды (справа), Д - электрофореграмма химерной плазмиды после обработки рестриктазой BsaI.
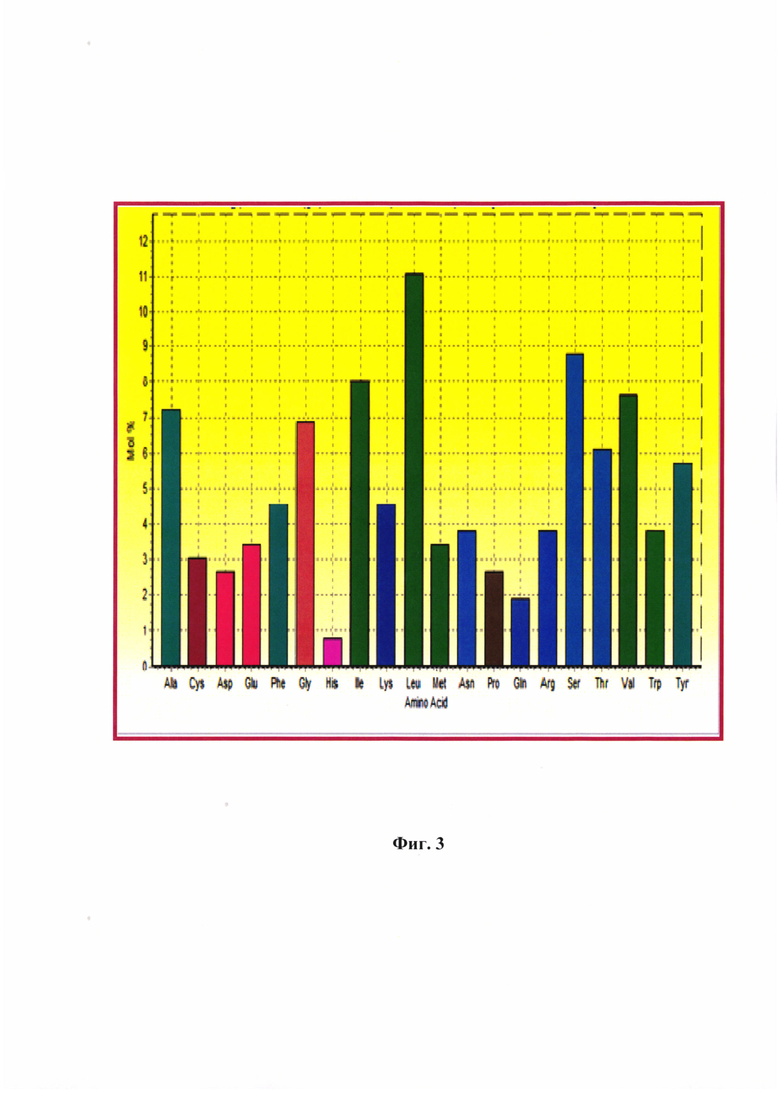
Фиг. 3 - Анализ аминокислотной композиции матриксного белка альфа-коронавируса собак производственного штамма РИЧ. Размер последовательности - 262 а.о.
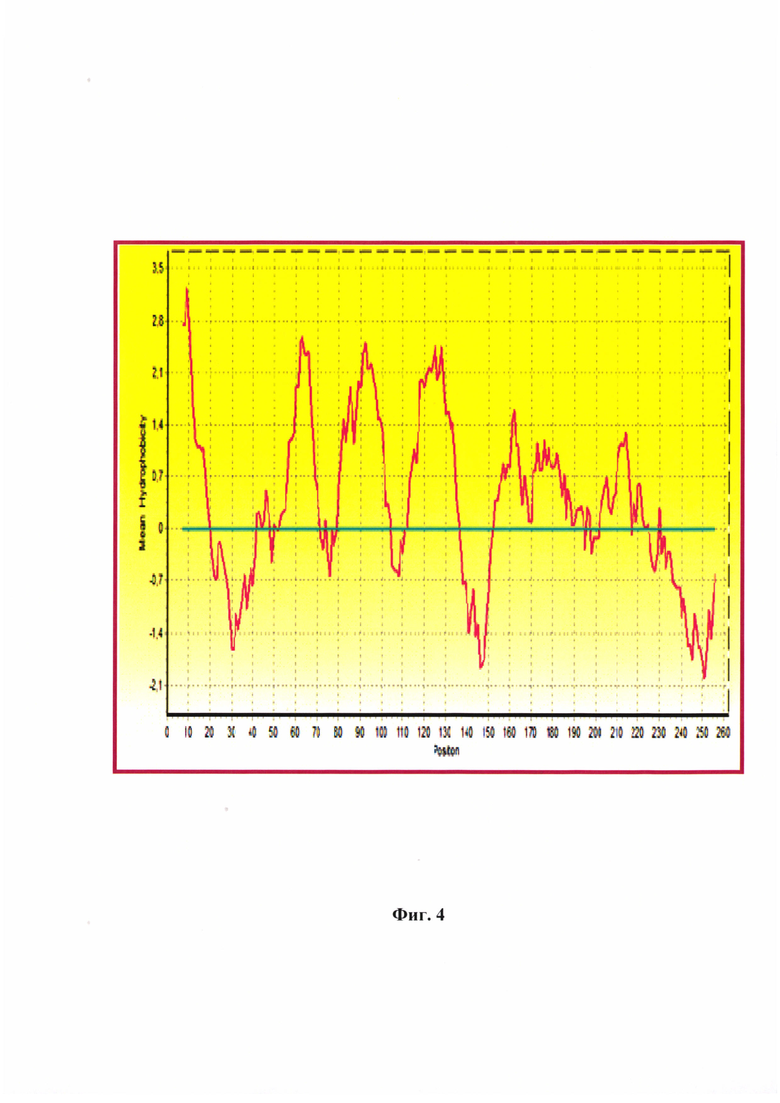
Фиг. 4 - Гидрофобный профиль аминокислотной последовательности матриксного белка альфа-коронавируса собак производственного штамма РИЧ по Kyte and Doolittle [8]. Молекулярный вес (Mw) равен 29540,07 Да.
Фиг. 5 - Дизайн олигонуклеотидного прямого праймера (CCoV RICH-T-F), флуоресцирующего зонда (CCoV RICH-T-P), обратного праймера (CCoV RICH-T-R), обратного праймера в формате RevComp (реверсивная и комплементарная) для амплификации участка М-гена кДНК альфа-коронавируса собак в позициях 26355…26453 п. н. Размер ампликона- 99 п. н.
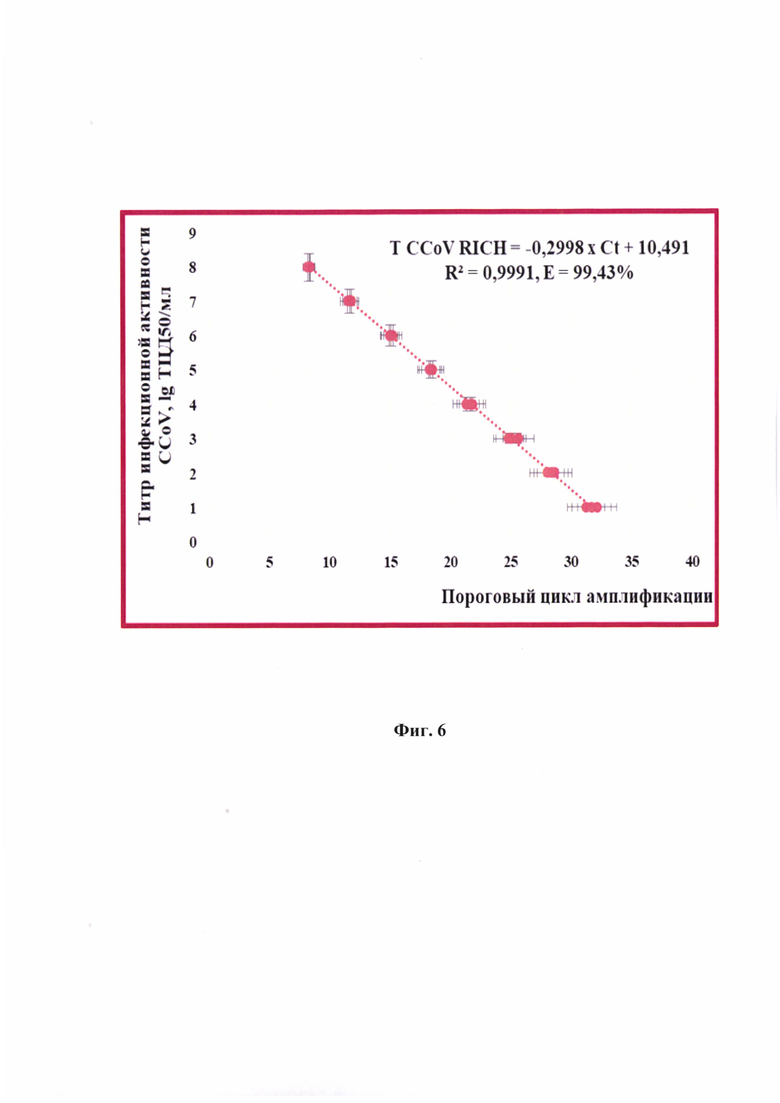
Фиг. 6 - Зависимость титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцин (TCCoV RICH) с помощью метода ОТ-ПЦР-РВ от величины порогового цикла амплификации (Ct) (n=4, отмечены точки, отображающие средние значения пороговых циклов реакции амплификации).
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO:1 представляет последовательность нуклеотидов М-гена кДНК альфа-коронавируса производственного штамма РИЧ;
SEQ ID NO:2 представляет последовательность аминокислот М-гена кДНК альфа-коронавируса производственного штамма РИЧ.
Сущность изобретения заключается в новом подходе по опосредованному определению титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральной вакцины с применением метода ОТ-ПЦР-РВ. Заявляемый способ основан на:
1) элюировании РНК альфа- коронавируса собак производственного штамма РИЧ с применением твердофазного способа экстракции с использованием 5М гуанидинизотиоцианата и изопропилового спирта; 2) проведении обратной транскрипции РНК альфа-коронавируса собак с применением фермента MMLV-ревертазы; 3) амплификации специфического фрагмента М-гена генома альфа-коронавируса собак производственного штамма РИЧ с применением оригинальных олигонуклеотидных специфических прямого и обратного праймеров, а также молекулярного зонда, меченого флуоресцентным красителем FAM (λmax флуоресценции=520 нм) и тушителем свечения RTQ-1 (λmax поглощения=520 нм); 4) проведение реакции амплификации с детекцией ампликонов с помощью флуоресцентного свечения и отображения накопления сигнала в виде сигмоиды, стремящейся к экспоненте; 5) применение в качестве положительного контроля модифицированной плазмиды р Jet 1.2 sf GFP для клонирования участка М-гена кДНК альфа-коронавируса собак (26355…26453 п. н., 99 н.о. мРНК) со вставкой таргетного участка между Т7 promoter и HDV ribozyme с последующей трансфекцией клеток линии BHK-21/SUSP/ARRIAH для синтеза мРНК; 6) опосредованном определении титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ с применением логарифмической функции, выраженной в виде уравнения lg TCCoV RICH=-0,2998 × Ct+10,491 с высокой достоверностью аппроксимации (R2=0,9991) и эффективностью амплификации 99,43%.
В настоящее время метод ПЦР в режиме реального времени применяют для индикации нуклеиновых кислот различных инфекционных агентов, в том числе альфа-коронавируса собак [9-15]. Для опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин ранее данный метод с применением разработанной системы оригинальных праймеров и молекулярного зонда не использовался. Таким образом, сведений об аналогах предлагаемого способа опосредованного определения титра инфекционной активности альфа-коронавируса производственного штамма РИЧ в сырье для культуральных вакцин авторами не обнаружено.
Разработанный способ опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин с помощью метода ОТ-ПЦР-РВ по сравнению с прототипом отличается более высокой чувствительностью, специфичностью и экспрессностью выполнения анализа, и значительным снижением риска контаминации.
В отличие от прототипа разработанный способ включает этап элюирования РНК альфа-коронавируса собак производственного штамма РИЧ; проведение обратной транскрипции РНК альфа-коронавируса собак производственного штамма РИЧ с применением фермента MMLV-ревертазы; амплификацию специфического фрагмента М-гена кДНК (позиции в геноме 26355…26453 п. н., размер ампликона - 99 п. н.) альфа-коронавируса собак производственного штамма РИЧ с применение оригинальных специфических олигонуклеотидных прямого и обратного праймеров, а также молекулярного зонда, меченого флуоресцентным красителем FAM и тушителем свечения RTQ-1; проведение реакции амплификации с детекцией ампликонов с помощью флуоресцентного свечения и отображения накопления сигнала в виде сигмоиды, стремящейся к экспоненте; новый подход к методике опосредованного расчета титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ с применением модели зависимости порогового цикла амплификации для кривой флуоресценции и титра вируса в виде логарифмической функции. Применение в качестве положительного контроля модифицированной плазмиды р Jet 1.2 sf GFP для клонирования участка М-гена кДНК альфа-коронавируса собак (26355…26453 п. н., 99 н.о. мРНК) со вставкой таргетного участка между Т7 promoter и HDV ribozyme с последующей трансфекцией клеток линии BHK-21/SUSP/ARRIAH для синтеза мРНК даст возможность проводить достоверный количественный анализ. Применение предложенного способа позволит сократить время проведения анализа вируссодержащих суспензий для определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин до 4 ч; исключить вероятность контаминации и использование клеточных линий; повысить специфичность и чувствительность анализа; увеличить достоверность проводимого анализа. Таким образом, актуально применять предложенный способ для опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин против данного возбудителя.
Ключевым элементом заявляемого способа является определение значений пороговых циклов кривых реакции амплификации нуклеиновой кислоты альфа-коронавируса собак производственного штамма РИЧ с помощью ОТ-ПЦР-РВ и расчет титра инфекционной активности данного вируса с использованием разработанной логарифмической модели.
Сопоставительный анализ с прототипом позволяет сделать вывод, что новизна и изобретательский уровень заявляемого изобретения заключается в применении способа количественной ПЦР в режиме реального времени, оригинальных специфичных олигонуклеотидных праймеров и молекулярного зонда, рассчитанных на участок М-гена кДНК альфа-коронавируса собак производственного штамма РИЧ (26355…26453 п. н., размер ампликона -99 п. н.), и разработанной логарифмической модели для опосредованного определения титра инфекционной активности данного вируса в сырье культуральных вакцин.
Сущность предлагаемого изобретения пояснена на графическом материале - графике зависимости величины порогового цикла амплификации (Ct) и титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин (TCCoV RICH) (n=4) (фиг. 6).
С целью опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин подготавливают контрольную панель стандартов данного вируса, в качестве которых используют лиофильно высушенные вируссодержащие суспензии альфа- коронавируса собак производственного штамма РИЧ указанного штамма с титрами: 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0; 8,0 lg ТЦД50/см3, которые разводят 1/15 М фосфатно-буферным раствором до требуемого объема и титра. В качестве отрицательных контролей применяют суспензию клеток почки кошки Крэнделла Риса (CRFK), не зараженную альфа-коронавирусом собак.
Из всех стандартных положительных образцов и отрицательных контролей, а также тестируемых проб выделяют РНК с помощью твердофазного метода сорбции на стекловолокнистых фильтрах на колонках с применением 5 М гуанидинизотиоцианата (ГТЦ) и изопропилового спирта. Принцип данного способа заключается в том, что вирионы альфа-коронавируса собак, содержащие РНК, сорбируют на поверхность стекловолокнистого фильтра и очищают от балластных белков и липопротеинов с применением хаотропного агента ГТЦ и пропанола-2 с разной концентрацией. Предложенный способ является простым, безопасным (без применения опасных ароматических углеводородов), экспрессным и эффективным, позволяет избавляться от ингибиторов реакции амплификации (водорастворимые соли калия, натрия, кальция, коллаген, гемоглобин, иммуноглобулины, ЭДТА и др.) при извлечении нуклеиновой кислоты из лизата.
К 100 мкл культуральной суспензии альфа-коронавируса собак производственного штамма РИЧ добавляют 900 мкл 5М ГТЦ, инкубируют содержимое в процессе перемешивания в течение 5 мин., затем продлевают инкубирование в открытом сухом термостате при температуре 60±2°С в течение 2 мин. Полученный лизат пропускают через колонку со стекловолокнистыми фильтрами на установке Promega Vac-Man Vacuum Manifold с поддержанием отрицательного давления, создаваемого вакуумным насосом. На следующем этапе проводят отмывание стекловолокна от балластных составляющих. Для этого в каждую колонку при работающем вакуумном насосе добавляют по 500 мкл 40%-ного раствора пропанола-2, ждут полного прохождения жидкости через фильтр. Для очистки от гидрофобных примесей в каждую пробирку добавляют по 500 мл 80%-ного раствора пропанола-2, затем ту же процедуру со 100%-ным пропанолом-2 проводят дважды. После удаления спирта в колонки добавляют по 50 мкл раствора для элюирования (стандартный буфер ТЕ) и прогревают содержимое при температуре 60±2°С в течение 8-10 мин. После процесса десорбции колонки помещают в пробирки типа Эппендорф объемом 1,5 см3 и центрифугируют в течение 1,5 мин при 13 500 об/мин на настольной микроцентрифуге, отбирают элюаты РНК. Полученный экстракт суммарной РНК хранят при температуре -20±2°С или сразу используют в дальнейшей работе.
На следующем этапе проводят ОТ-ПЦР-РВ для исследования стандартных образцов и проб. В качестве контроля мРНК для проведения данной реакции в одной пробирке, совмещая ОТ и ПЦР-РВ, применяют продукт (специфическая мРНК альфа-коронавируса собак производственного штамма РИЧ) жизнедеятельности клеток линии BHK-21/SUSP/ARRIAH, которые подвергли трансфекции с применением модифицированной плазмиды р Jet 1.2 sf GFP для клонирования участка М-гена кДНК альфа-коронавируса собак (26355…26453 п. н., 99 н.о. мРНК) со вставкой таргетного участка между Т7 promoter и HDV ribozyme.
Для постановки реакции готовят реакционную смесь, рецептура которой представлена в таблице 2. Дизайн праймеров и молекулярного зонда отражены в таблице 3. Расчет праймеров и зонда проводили на основании нуклеотидных последовательностей М-гена альфа-коронавируса собак производственного штамма РИЧ и других изолятов, опубликованных в базах данных GenBank [16] и полученных в рамках исследований в ФГБУ «Федеральный центр охраны здоровья животных» (ФГБУ «ВНИИЗЖ»).
В качестве гомологичных участку М-гена альфа-коронавируса собак производственного штамма РИЧ олигонуклеотидов используют: CCoV RICH-T-F-праймер (5'-AATATTGATTGTTTTGTTAACTGTGTTACAT-3'), CCoV RICH-T-R-праймер (5'-AACGGGCAAGAATAGCCACATTATAAGCAT-3'), CCoV RICH-T-зонд (FAM/RTQ1) (5'-FAM - ACCTCAACGCAGCTGGTTCGTGTATGGCATT-RTQ1-3') в концентрации 5 пМ на реакцию. Для элонгации применяют дезоксирибонуклеозидтрифосфаты с их суммарной концентрацией в реакционной смеси 2 мМ. В качестве основы используют буферный раствор (5х), содержание которого составляет 20% от общего объема реакционной смеси. Буферный раствор включает в свой состав ионы калия (К+) (5×10-2 М) и диметилсульфооксид (DMSO) (1%). В смесь также добавляют хлорид магния до концентрации 3 мМ. В качестве катализаторов обратной транскрипции и ПЦР в режиме реального времени применяют следующие ферменты: MMLV-обратная транскриптаза (1 ед.) и Taq ДНК-зависимую ДНК-полимеразу (1 ед.). В одной пробирке совмещают этапы реакций обратной транскрипции и ПЦР в режиме реального времени. Элюаты суммарной РНК вируса каждого образца добавляют к реакционной смеси по 5 мкл. Итоговый объем смеси для проведения одной реакции составляет 25 мкл.
Олигонуклеотиды для кДНК-матрицы подбирали в соответствии с рядом общих правил, которые отражены в работах В. Deiman и R. Sooknanan [17, 18].
Длины CCoV RICH-T-F-праймера, CCoV RICH-T-R-праймера и CCoV RICH-T-зонда (FAM/RTQ1) составляют 31, 30 и 31 и.о., что соответствует требованиям. Молекулярный вес указанных выше олигонуклеотидов равен 9535,3; 9241,1 и 9502,2 Да, соответственно. Праймеры и зонд очищены в полиакриламидном геле и с помощью высокоэффективной жидкостной хроматографии, соответственно. Нуклеотидная последовательность зонда не комплементарна олигонуклеотидным праймерам. Флуорофор FAM присоединен к 5'-концу, а гаситель флуоресценции RTQ1 - к 3'-концу. Данные условия соответствуют требованиям, предъявляемым к олигонуклеотидным праймерам и молекулярному зонду, которые участвуют в ПЦР в режиме реального времени [17, 18]. В качестве флуоресцентного красителя был выбран FAM с длиной волны максимальной флуоресценцией 520 нм. Для тушения свечения использовали гаситель флуоресценции RTQ1 с длиной волны максимального поглощения при 520 нм и возможном диапазоне гашения 470-570 нм. Иными словами, была выбрана подходящая пара «флуорофор-гаситель».
При анализе нуклеотидных последовательностей олигонуклеотидов установили, что для праймеров и зонда не характерно образование «шпилек», а также не выявлено 3'-комплементарности и сайтов, отжигающих сами на себя. Расчет вероятности образования «шпилек» и димеров олигонуклеотидов проводили при условии, что минимальное количество пар оснований, необходимых для димеризации, - 5, а для образования «шпилек», - 4 [18, 19].
Проведено определение температур плавления (Tm) для олигонуклеотидных праймеров и зонда. Точное определение температуры плавления играет важную роль в молекулярно-биологических исследованиях, в том числе при подборе ДНК-праймеров и зонда для ПЦР в режиме реального времени кДНК альфа-коронавируса собак производственного штамма РИЧ, применяемого для изготовления культуральных вакцин. Для оценки температуры плавления олигонуклеотидов применяли несколько методов. Один из них - метод, учитывающий концентрации ионов К+ и диметилсульфооксида (DMSO) [19]. Другой метод, который применяли в работе, основан на модели ближайших соседей (nearest neighbour, NN) с применением термодинамических показателей [20, 21]:
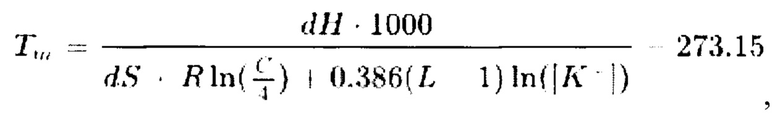
где: dH - дифференциал энтропии (ккал/моль),
dG - дифференциал энергии Гиббса (ккал/моль),
dS - дифференциал энтальпии (кал/0К⋅моль),
С - концентрация олигонуклеотида (М),
L - длина олигонуклеотида,
[К+] - концентрация ионов калия (М),
In - натуральный логарифм.
В данной формуле учитывается длина олигонуклеотида (L), концентрация ионов калия ([К+]=5×10-2 М), газовая постоянная (R=1,987 кал/0К⋅моль), концентрация олигонуклеотида (С=2×10-7 М), значения энтропии (dH) (в ккал/моль) и энтальпии (dS) (в кал/0К⋅моль). Значения dH и dS вычисляли в соответствии с общеизвестными формулами и термодинамическими параметрами для ближайших соседей пар нуклеотидов при концентрации NaCl 1М, температуре 25°С и значении водородного показателя рН 7,0 [20-23].
Физические, термодинамические константы и расчет температур плавления [21] разработанных олигонуклеотидных ДНК-праймеров и молекулярного зонда представлены в таблице 4. Из нее следует, что энтропия, энергия Гиббса и энтальпия для CCoV RICH-T-F-праймера составили 235,2 ккал/моль, 34,3 ккал/моль, 632,0 кал/(0К×моль), соответственно. Энтропия, энергия Гиббса и энтальпия для CCoV RICH-T-R-праймера составили 238,4 ккал/моль, 39,1 ккал/моль, 626,6 кал/(0К×моль), соответственно. Энтропия, энергия Гиббса и энтальпия для CCoV RICH-T-P-зонда (FAM/RTQ1) составили 263,2 ккал/моль, 45,3 ккал/моль, 686,6 кал/(0К×моль), соответственно. Данные значения необходимы для расчета температур плавления представленных олигонуклеотидов. Tm при использовании алгоритма ближайших соседей для CCoV RICH-T-F-праймера, CCoV RICH-T-R-праймера и CCoV RICH-T-P-зонда (FAM/RTQ1) составили 45, 52 и 57°С, соответственно.
При использовании более простого метода, учитывающего концентрации ионов К+ и диметилсульфооксида (DMSO) Tm для прямого, обратного праймеров и зонда составили 62, 68 и 74°С. Температура отжига олигонуклеотидов (Та) должна быть примерно на 1-5°С ниже Tm [20-23].
Экспериментально было выявлено, что температура отжига рассматриваемых олигонуклеотидов составляет 55, 58, 60°С. Для проведения ПЦР в режиме реального времени было решено проводить гибридизацию праймеров и зонда с участком М-гена альфа-коронавируса собак производственного штамма РИЧ при температуре 58°С.
Последовательности праймеров и зонда также проанализировали на наличие внутренних вторичных структур с помощью программы сворачивания нуклеиновых кислот с помощью программы Mfold [24]. Выявлено, что для разработанных олигонуклеотидов наличия внутренних вторичных структур не обнаружено.
Постановку реакции осуществляют в детектирующем термоциклере любой марки при температурных и временных параметрах, сведения о которых представлены в таблице 5.
Обратную транскрипцию проводят при температуре 42°С в течение 15 мин. Перед проведением ПЦР в режиме реального времени осуществляют предварительный прогрев смеси при температуре 95°С в течение 10 мин. для инактивации MMLV-ревертазы.
ПЦР в режиме реального времени включает в себя 3 подэтапа: денатурацию, отжиг олигонуклеотидов, элонгацию. Денатурацию проводили при температуре 95°С в течение 15 с, отжиг олигонуклеотидов - при температуре 58°С в течение 20 с, элонгацию - при температуре 72°С в течение 50 с.
Результаты реакции амплификации кДНК в режиме реального времени анализируют, оценивая и сравнивая графики накопления флуоресцентного сигнала по значениям пороговых циклов амплификации Ct, определенных с помощью пересечения пороговой линии и логарифмическим отображением функции Fl=f (Ct). Учет результатов в реакции происходит на каждом цикле. Флуориметр определяет уровень флуоресценции и строит кинетическую кривую в координатах: уровень флуоресценции - цикл реакции амплификации. В случае присутствия в исследуемой пробе специфической кДНК-матрицы кинетическая кривая имеет экспоненциальную зависимость (график представлен в виде сигмоиды). Положительными считаются пробы, которым соответствуют сигмоиды, полученные при анализе флуоресценции красителя, входящего в состав молекулярного зонда. Пробы считаются отрицательными, если при их анализе отсутствует экспоненциальная кривая.
Устанавливают зависимость между пороговым циклом амплификации и титром инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральной вакцины в процессе построения логарифмической функции. Оценивают величину эффективности реакции амплификации (Е) по формуле: 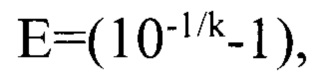 где: к - угловой коэффициент в зависимости
где: к - угловой коэффициент в зависимости  а также достоверность аппроксимации (R2). На основе разработанной модели рассчитывают значение титра инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье для культуральной вакцины.
а также достоверность аппроксимации (R2). На основе разработанной модели рассчитывают значение титра инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье для культуральной вакцины.
Сущность изобретения пояснена примерами, которые не ограничивают объем изобретения.
Пример 1. Анализ М-гена кДНК и матриксного белка альфа-коронавируса собак производственного штамма РИЧ для разработки олигонуклеотидных праймеров и зонда для опосредованного определения титра вируса в сырье для культуральных вакцин
В результате анализа полногеномной нуклеотидной последовательности кДНК альфа-коронавируса собак производственного штамма РИЧ выявили, что для разработки дизайна олигонуклеотидных праймеров и зонда, применяемых в количественном исследовании в ОТ-ПЦР-РВ, целесообразно использовать М-ген, который кодирует матриксный белок, задействованный в различных процессах формирования вириона. Данный белок имеет наибольшее представительство среди всех белков вирусной частицы. М-ген занимает в кДНК позиции 26172…26957 п. н. и кодирует белок размером 262 а.о. Нуклеотидная и аминокислотная последовательности для данного гена отражены в приложении.
При анализе аминокислотной композиции М-белка CCoV производственного штамма РИЧ определили, что в составе полипептида преобладают лейцин (Leu) (11,1%), а также серии (Ser) (8,8%), изолейцин (Не) (8,0%), валин (Val) (7,7%) и аланин (Ala) (7,2%). В сумме они составляют 42,8% от всего аминокислотного состава. Минимальное содержание в данной последовательности у гистидина (Gis) (0,8%) (Фиг. 3). Следует отметить, что перечисленные аминокислоты, которые преобладают в аминокислотной композиции М-белка альфа-коронавируса собак штамма РИЧ, являются неполярными (гидрофобными) (валин, изолейцин, лейцин, аланин) и полярными незаряженными аминокислотами (глицин, серии).
Данный анализ позволяет построить гидрофобный профиль по средним значениям показателя гидрофобности (в модификации Kyte and Doolittle) (Фиг. 4). Как показано на диаграмме, можно выделить семь основных гидрофобных участков в линейной структуре матриксного белка альфа-коронавируса собак производственного штамма РИЧ. Данные области расположены в позициях 9…13, 55…65, 82…97, 115…133, 156…165, 170…187, 208…213 а.о. Гидрофильными являются области в следующих позициях М-белка: 20…40, 75…77, 104…110, 135…150, 230…255 а.о. Данные участки определяют функциональность белковой молекулы, активно участвующей в формировании вириона.
При анализе нуклеотидных последовательностей для разработки дизайна олигонуклеотидных праймеров и зонда был выбран участок в диапазоне 26355…26453 п. н. При анализе подобранных последовательностей, отраженных на Фиг. 5, выявлено, что данные праймеры и зонд позволяют выявлять кДНК альфа-коронавируса собак производственного штамма РИЧ для проведения последующего количественного анализа. Термодинамический анализ для разработанных последовательностей отражен выше и представлен в таблице 4. Экстраполируя данный участок на аминокислотную последовательность (61…94 а.о.), определено, что амплифицируемый участок кДНК будет соответствовать фрагменту обладающему и гидрофобными, и гидрофильными участками. Таким образом, проведен анализ аминокислотной последовательности матриксного белка исследуемого инфекционного агента, подобраны олигонуклеотидные затравки и зонд для проведения опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин.
Пример 2. Получение положительного контроля для опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин
Для проведения опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин был применен метод высокопроцессивного клонирования Golden Gate, позволяющий создать мРНК, кодирующую таргетный участок генома альфа- коронавируса производственного штамма РИЧ.
В качестве вектора встраивания применяли плазмиду pJet 1.2 sf GFP (размер 3111 п. н.) с геном зеленого флуоресцирующего белка (GFP - green fluorescent protein) для трансфекций в эукариотические клетки. Карта данной плазмиды отражена на фиг. 1 и 2 А. Данная плазмида может функционировать в бактериальных клетках и обладает устойчивостью к ампициллину (AmpR). Плазмиду pJet 1.2 sf GFP можно применять для встраивания в нее таргетных участков генов между Т7 promotor и HDV ribozyme. Рибозим вируса гепатита дельта (HDV) представляет собой некодирующую РНК, обнаруженную в вирусе гепатита дельта, которая необходима для репликации вируса и является единственным известным вирусом человека, который использует активность рибозима для заражения своего хозяина. Данная особенность позволяет проводить синтез мРНК нужной последовательности, которую в последующем можно применять в качестве контроля для количественной ОТ-ПЦР-РВ, в частности, для опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцин.
Проводили исследования по конструированию модифицированного участка РНК альфа-коронавируса собак производственного штамма РИЧ в позициях 26355…26453 н.о. (участок РНК М-гена вируса: AAUAUUGAUUGUUUUGUUAACUGUGUUACAUUACGGUAGACCUCAACGCA GCUGGUUCGUGUAUGGCAUUAAAAUGCUUAUAAUGUGGCUAUUCUUGCCC GUU или соответствующий участок ДНК: AATATTGATTGTTTTGTTAACTGTGTTACATTACGGTAGACCTCAACGCAGCTGGTTCGTGTATGGCATTAAAATGCTTATAATGTGGCTATTCTTGCCCGTT). Именно для амплификации данного участка РНК были выше разработаны олигонуклеотидные праймеры и зонд.
На концы выбранной последовательности с помощью ПЦР «пришивали» адапторные последовательности: 5'-конец: 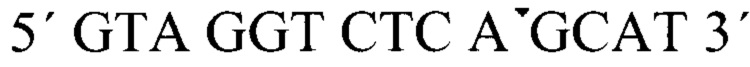 3'-конец:
3'-конец: 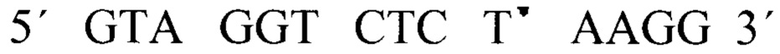 (
( - сайты для разрезания рестриктазой Bsa I).
- сайты для разрезания рестриктазой Bsa I).
Данные адапторы были необходимы для формирования «липких» концов, образующихся после обработки рестриктазой II S. Данные ферменты вносят разрывы не в сайте рестрикции, а на некотором удалении от него, в частности, для рестриктазы Bsa I сайты рестрикции и разрезания следующие: GGTCTCN'NNNN..
Адаптор, расположенный на 3'-конце размещается с учетом reverse-complemente в направлении 5'→3'.
Для получения модифицированной последовательности проводили ПЦР с применением двух следующих праймеров (подчеркнуты участки для комплементарности с последовательностями плазмиды):
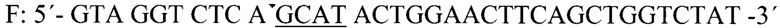
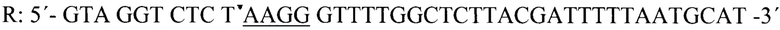
В результате получили ампликоны, содержащие таргетную область и адапторы:
Полученные концевые участки нуклеотидов в таргетной последовательности и плазмиде отражены на фиг. 2 В, 2 Г.
Проводили электрофорез для полученных продуктов ПЦР с последующим их выделением с помощью набора для экстракции ампликонов из агарозного геля.
Плазмиду pJet 1.2 sf GFP и продукты ПЦР обрабатывали рестриктазой BsaI, в результате этого формировались «липкие» 5' и 3'-концы. После соединения в одной пробирке всех компонентов (плазмида и модифицированный кодирующий фрагмент) происходило их лигирование по «липким» концам (фиг. 2 Б).
С помощью программы NEBCutter для разрезания плазмид и линейных ДНК рестриктазами получили электрофореграмму с двумя фрагментами (первый фрагмент: 14-2516 п. н., 2503 п. н., второй фрагмент: 2517-13 п. н., 187 п. н.), как отражено на фиг. 2 Д.
Полученной плазмидой провели трансфекцию компетентных клеток BHK-21/SUSP/ARRIAH in vitro с помощью высокомолекулярного полиэтиленимина для синтеза в процессе экспрессии генов плазмиды участка мРНК альфа-коронавируса собак производственного штамма РИЧ. Полиэтиленимин (ПЭИ) по своей структуре представляет наночастицы катионного типа, состоящие из синтетического полимера продукта реакции полимеризации этиленимина. Данный полимер обладает способностью конденсировать нуклеиновые кислоты, в том числе плазмидные векторы, и эффективно проникать внутрь клетки. Для трансфекции клеток чаще всего применяют низкомолекулярный ПЭИ (молекулярный вес - 25 кДа). Однако он обладает относительно высокой цитотоксичностью по сравнению с высокомолекулярным ПЭИ. По этим причинам в исследовании использовали высокомолекулярный ПЭИ (молекулярный вес - 500 кДа).
Суспензию полученных клеток после трансфекции культивировали в течение 48 ч, подвергали центрифугированию и полученный супернатант использовали в качестве положительного контроля для ОТ-ПЦР-РВ, поскольку он содержал мРНК альфа-коронавируса собак штамма РИЧ.
Пример 3. Выявление зависимости титра инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье для вакцины и порогового цикла реакции амплификации в режиме реального времени
Для выявления зависимости титра инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье для вакцины и порогового цикла реакции амплификации подготавливали контрольную панель суспензий альфа-коронавируса собак штамма РИЧ, в качестве которых использовали очищенные суспензии вируса указанного штамма с титрами: 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0; 8,0 lg ТЦД50/см3. В качестве отрицательных контролей применяли суспензию клеток CRFK, не контаминированную вирусами, бактериями, микоплазмами и грибами.
К 100 мкл культуральной вируссодержащей суспензии альфа-коронавируса собак производственного штамма РИЧ добавляли 900 мкл 5М ГТЦ, инкубировали содержимое в процессе перемешивания в течение 5 мин., затем продлевали инкубирование в открытом сухом термостате при температуре 60±2°С в течение 2 мин. Полученный лизат пропускали через колонку со стекловолокнистыми фильтрами на установке Promega Vac-Man Vacuum Manifold с поддержанием отрицательного давления, создаваемого вакуумным насосом. На следующем этапе проводили отмывание стекловолокна от балластных составляющих. Для этого в каждую колонку при работающем вакуумном насосе добавляли по 500 мкл 40%-ного раствора пропанола-2, ждали полного прохождения жидкости через фильтр. Для очистки от гидрофобных примесей в каждую пробирку добавляли по 500 мл 80%-ного раствора пропанола-2, затем ту же процедуру со 100%-ным пропанолом-2 повторяли дважды. После удаления спирта в колонки добавляли по 50 мкл раствора для элюирования (стандартный буфер ТЕ) и прогревали содержимое при температуре 60±2°С в течение 8-10 мин. После процесса десорбции колонки помещали в пробирки типа Эппендорф объемом 1.5 см3 и центрифугировали в течение 1.5 мин при 13 500 об/мин на настольной микроцентрифуге, отбирали элюаты РНК. Полученный экстракт суммарной РНК хранили при температуре минус 20±2°С, для дальнейшего использования в работе.
На следующем этапе исследования проводили обратную транскрипцию и ПЦР в режиме реального времени для исследования положительных образцов. Для постановки реакции готовили реакционную смесь в соответствии с данными таблицы 2. ОТ-ПЦР в реальном времени осуществляли при температурных и временных параметрах, сведения о которых представлены в таблице 5.
Результаты реакции анализировали, оценивая и сравнивая графики накопления флуоресцентного сигнала по значениям пороговых циклов амплификации Ct, определенных с помощью пересечения пороговой линии и логарифмическим отображением функции Fl=f (Ct). Устанавливали зависимость между пороговым циклом амплификации и титром инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье для вакцины в процессе построения логарифмической функции. Полученные данные отражены на фиг. 6 и выражены в виде логарифмической функции: lg TCCoV RICH=-0,2998 × Ct+10,491 (фиг. 6). Эффективность реакции амплификации составила 99,43%, достоверность аппроксимации - 0,9991, что является высоким показателем достоверности.
Пример 4. Выявление степени достоверности определения титра инфекционной активности альфа-коронавируса собак штамма Рич в сырье для вакцины с применением разработанного способа
Для анализа использовали 180 суспензий культурального альфа-коронавируса собак штамма РИЧ со значениями титра инфекционной активности от 1,00 до 8,00 lg ТЦД50/см3. В качестве положительного контроля применяли суспензию культурального альфа-коронавируса собак штамма РИЧ с титром вируса 6,00 lg ТЦД50/см3. В качестве отрицательного контроля применяли суспензию клеток CRFK, не зараженную вирусами, микоплазмами, бактериями и грибами. Испытуемые пробы и контрольные образцы исследовали в трех повторностях. Этапы экстрагирования нуклеиновых кислот, и постановку ОТ-ПЦР в режиме реального времени проводили, как отражено в примере 3.
Проводили анализ РНК альфа-коронавируса собак штамма РИЧ с помощью разработанного способа опосредованного определения титра вируса. Данные анализа представлены в таблице 6. Интерпретацию результатов проводили, пользуясь разработанной логарифмической функцией lg TCCoV RICH=-0,2998 × Ct+10,491 (R2=0,9991, E=99,43%) с получением значений титра для каждой из 180 проб. Для положительного контроля значение порогового цикла амплификации составило 15,00±0,01 (n=20), что соответствовало титру вируса, равному 5,99 lg ТЦД50/см3. При анализе в культуре клеток значение составляло 6,00 lg ТЦД50/см3. Таким образом, получены сопоставимые значения. При использовании статистического t-критерия и степени свободы df=19 нулевая гипотеза о равенстве полученных средних значений в двух выборках верна. Для отрицательных контролей экспоненциальные графики не были сформированы, что означало отсутствие альфа-коронавируса собак штамма РИЧ в данных образцах.
Анализируемые пробы тестировали классическим методом титрования в монослойной перевиваемой клеточной линии CRFK и в ПЦР в режиме реального времени. Выявили, что данные, полученные с помощью разработанного способа, коррелировали с методом титрования в культуре клеток на 99,2-100% для 8,0-6,0 lg ТЦД50/см3 (n=45), на 98,1-99,2% для 5,9-4,0 lg ТЦД50/см3 (n=45), на 96,8-98,3% для 3,9-1,6 lg ТЦД50/см3 (n=45), на 94,0-96,8% для 1,5-1,0 lg ТЦД50/см3 (n=45) [25-27]. В отдельности каждую пробу исследовали в трех повторностях. Полученные результаты свидетельствовали о высокой степени точности разработанного способа опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины методом ПЦР в режиме реального времени.
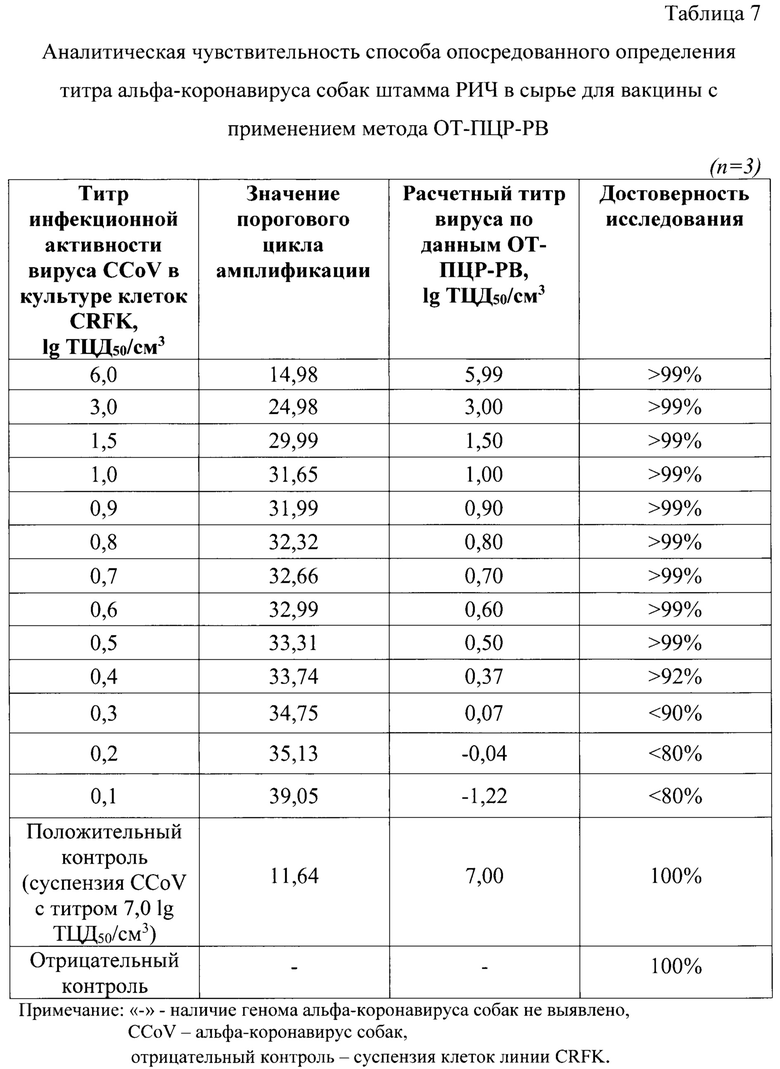
Пример 5. Оценка аналитической чувствительности способа опосредованного определения титра инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье вакцины методом ПЦР в режиме реального времени
При исследовании аналитической чувствительности способа опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ подготавливали серию культуральных суспензий данного вирусного материала с титрами 0,10-6,00 lg ТЦД50/см3. Контрольные образцы тестировали в 3 повторностях. Этапы элюирования нуклеиновой кислоты и постановку ПЦР в режиме реального времени проводили, как описано в примере 3. Результаты определения расчетного значения титра инфекционной активности вируса и степени достоверности представлены в таблице 7. Данные по исследованию контролей достоверные. Выявлено, что аналитическая чувствительность способа опосредованного определения титра инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье для вакцины методом ОТ-ПЦР в режиме реального времени, составляет не менее 0,5 lg ТЦД50/см3 с достоверностью результатов исследования более 99%.
Пример 6. Оценка специфичности способа опосредованного определения титра инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье для вакцины методом ОТ-ПЦР в режиме реального времени
При оценке специфичности способа опосредованного определения титра инфекционной активности альфа-коронавируса собак штамма РИЧ в сырье для вакцины методом ОТ-ПЦР в режиме реального времени, исследовали суспензию альфа-коронавируса собак штамма РИЧ, вирусов ящура, бешенства, инфекционного некроза гемопоэтической ткани лососевых, весенней виремии карповых, инфекционного некроза поджелудочной железы. Количество инфекционных доз вирусов в суспензиях составлял не менее 6,0 lg ТЦД50/см3. Исследования проводили в 3 повторностях.
Этапы элюирования РНК и постановку ОТ-ПЦР в режиме реального времени проводили, как описано в примере 3. В результате проведения реакции амплификации в режиме реального времени с системой олигонуклеотидных праймеров и зондов, специфичной для участка М-гена альфа-коронавируса собак штамма РИЧ, наблюдали построение логистических кривых накопления флуоресцентного сигнала только для альфа-коронавируса. Для проб, содержащих другие вирусы, не наблюдалось формирования графиков экспоненты, и они не выходили за пороговый уровень флуоресцентного сигнала (0,0125 у.е.). Таким образом, разработанный способ является специфичным по отношению к альфа-коронавирусу собак штамма РИЧ и может быть использован для его количественного определения.
Основными преимуществами предлагаемого изобретения является сокращение времени проведения анализа вируссодержащих суспензий для определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины до 4 ч; снижение вероятности контаминации исследуемого материала; возможность проведения контроля реакции ОТ-ПЦР-РВ с использованием мРНК, синтезированной с применением плазмиды р Jet 1.2 sf GFP и культуры клеток почки новорожденного сирийского хомячка BHK-21/SUSP/ARRIAH для трансфекции. Разработанный способ увеличивает чувствительность и специфичность анализа за счет применения высокоспецифичных оригинальных праймеров и ДНК-зонда, рассчитанных для М-гена альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины. Достигнута высокая достоверность проводимого анализа благодаря установлению зависимости между титром инфекционной активности альфа-коронавируса собак производственного штамма РИЧ - TCCoV RICH и пороговым циклом амплификации - Ct, представленной в виде логарифмической функции lg TCCoV RICH=-0,2998 × Ct+10,491 с высокой достоверностью аппроксимации -R2=0,9991 и эффективностью амплификации 99,43%. Предложенная модель позволяет опосредованно определять титр инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральных вакцин.

Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Способ опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины методом ОТ-ПЦР в режиме реального времени»:
1. Naylor M.J., Harrison G.A., Monckton R.P., McOrist S., Lehrbach P.R., Deane E.M. Identification of canine coronavirus strains from faeces by S gene nested PCR and molecular characterization of a new Australian isolate // J. Clin. Microbiol. - 2001. - V. 39. - P. 1036-1041.
2. Bandai C., Ishiguro S., Masuya N., Hohdatsu Т., Mochizuki M. Canine coronavirus infections in Japan: virological and epidemiological aspects // J. Vet. Med. Sci. - 1999. - V. 61. - P. 731-736.
3. Enjuanes, L., Brian, D., Cavanagh, D., Holmes, K., Lai, M.M.C., Laude, H., Masters, P., Rottier, P., Siddell, S., Spaan, W.J.M., Taguchi, F., Talbot, P. Coronaviridae. In: van Regenmortel, M.H.V., Fauquet, С.М., Bishop, D.H.L., Carstens, E.B., Estes, M.K., Lemon, S.M., Maniloff, J., Mayo, M.A., McGeoch, D.J., Pringle, C.R., Wickner, R.B. (Eds.), Virus Taxonomy, Classification and Nomenclature of Viruses. - Academic Press, New York. - 2000. - P. 835-849.
4. Keenan K.P., Jervis H.R., Marchwicki R.H., Binn L.N. Intestinal infection of neonatal dogs with canine coronavirus 1-71: studies by virologic, histologic, histochemical and immunofluorescent techniques // Am. J. Vet. Res. -1976.-V. 37.-P. 247-256.
5. Pratelli A., Tinelli A., Decaro N., Camera M., Elia G., Gentile A., Buonavoglia C. PCR assay for the detection and the identification of atypical canine coronavirus in dogs // J. Virol. Methods - 2002. - V. 106. - P.209-213.
6. Диагностика и профилактика инфекционных болезней кошек и собак: Руководство для практикующих ветеринарных врачей под редакцией Т.И. Алипера. Москва, 2017; 207-212.
7. Патент РФ №2 722 671, 01.10.2019 BHK-21/SUSP/ARRIAH -перевиваемая суспензионная сублиния клеток почки новорожденного сирийского хомячка, предназначенная для репродукции вирусов ящура, бешенства, парагриппа-3, болезни Ауески при производстве противовирусных вакцин, а также для изготовления диагностических и профилактических ветеринарных биопрепаратов // Заявка №2019131190. 01.10.2019 / Лозовой Д.А., Гусева М.Н., Михалишин Д.В. и др.
8. Модель Kyte and Doolittle для расчета средних значений гидрофобности и составления гидрофобного профиля аминокислотных последовательностей белков [Электронный ресурс] https://www.researchgate.net/figure/A-Kyte-Doolittle-Hydrophobicity-plot-of-the-RNase-k-02-protein-Regions-with-values_fig5_262071562. (Дата обращения: 15.01.2022).
9. Heid С, Stevens J., Livak К., Williams P.M. Real time quantitative PCR // Genome Res. - 1996. - V. 6. - P. 986-994.
10. Gut M., Leutenegger C.M., Huder J.B, Pedersen N.C., Lutz H. One-tube fluorogenic reverse transcription-polymerase chain reaction for the quantitation of feline coronaviruses // J. Virol. Methods. - 1999. - V. 77. - P. 37-46.
11. Naylor M.J., Harrison G.A., Monckton R.P., McOrist S., Lehrbach P.R., Deane E.M. Identification of canine coronavirus strains from faeces by S gene nested PCR and molecular characterization of a new Australian isolate // J. Clin. Microbiol.-2001.-V. 39.-P. 1036-1041.
12. Pratelli A., Tempesta M., Greco G., Martella V., Buonavoglia C. Development of a nested PCR assay for the detection of canine coronavirus // J. Virol. Methods - 1999. - V. 80. - P.l 1-15.
13. Pratelli A., Buonavoglia D., Martella V., Tempesta M., Lavazza A., Buonavoglia C. Diagnosis of canine coronavirus infection using nested-PCR // J. Virol. Methods - 2000. - V. 84. - P. 91-94.
14. Pratelli A., Martella V., Elia G., Decaro N., Aliberti A., Buonavoglia D., Tempesta M., Buonavoglia C. Variation of the sequence in the gene encoding for transmembrane protein M of canine coronavirus (CCoV) // Mol. Cell. Probes. - 2001. -V. 15.-P. 229-233.
15. Pratelli A., Tinelli A., Decaro N., Camera M., Elia G., Gentile A., Buonavoglia C. PCR assay for the detection and the identification of atypical canine coronavirus in dogs // J. Virol. Methods - 2002. - V. 106. - P. 209-213.
16. GenBank. [Электронный ресурс] / URL: https://www.ncbi.nlm.nih.gov/Structure/cdd/cddsrv.cgi?uid=394850. (Дата обращения: 14.02.2022).
17. Deiman В., van Aarle P., Sillekens P. Characteristics and applications of nucleic acid sequence based amplification // Mol. Biotech. - 2002. - Vol.20. - P. 163-179.
18. Sooknanan R., van Gemen В., Malek L. Nucleis acid sequence-based amplification // Molecular methods for virus detection-London: Academic press, 1995.-P. 261-285.
19. SantaLucia J. J., Hicks D. The thermodynamics of DNA structural motifs // Annual Review of Biophysics and Biomolecular Structure: journal. - 2004.- Vol. 33. -P. 11-14.
20. The RNA Institute college of arts and science university at Albany. The mfold Web Server. RNA Folding Form. [Электронный ресурс] URL: http://bioinfo.math.rpi.edu/~mfold/dna/forml.cgi (Дата обращения: 19.04.2020).
21. Молекулярный олигокалькулятор. [Электронный ресурс] / URL: http://www.bio.bsu.by/molbiol/oligocalc.html. (Дата обращения: 25.04.2020).
22. Nicolas von Ahsen, Carl Т. Wittwer, Ekkehard Schiitz. Oligonucleotide melting temperatures under per conditions: nearest-neighbor corrections for Mg2+, deoxynucleotide triphosphate, and dimethyl sulfoxide concentrations with comparison to alternative empirical formulas (англ.) // Clinical Chemistry: journal. -2001.-Vol.47, no. 11.-P. 1956-1961.
23. SantaLucia J. J. A unified view of polymer, dumbbell, and oligonucleotide DNA nearest-neighbor thermodynamics (англ.) // Proceedings of the National Academy of Sciences of the United States of America: journal. - 1998. -Vol.95, no. 4.-P. 1460-1465.
24. The mfold Web Server [Электронный ресурс] URL: http://unafold.rna.albany.edu/?q=search/node/ (Дата обращения 18.02.2022).
25. Лакин Г.Ф., Биометрия. - М.: Высшая школа, 1990. - 352 с.
26. СТБ ИСО 5725-2002. «Точность (правильность и прецизионность) методов и результатов измерений». Части 1-6. - 01.11.2002.
27. Vallat В. OIE Quality Standard and Guidelines for Veterinary Laboratories: Infectious Diseases. - 2nd ed. - Paris, France, 2008. - 67 p.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
dtdVersion="V1_3" fileName="Canine coronavirus.xml"
softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2022-09-19">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022121367</ApplicationNumberText>
<FilingDate>2022-08-03</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>045138</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2022-08-03</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">Федеральное государственное
бюджетное учреждение "Федеральный центр охраны здоровья
животных" (ФГБУ ВНИИЗЖ)</ApplicantName>
<ApplicantNameLatin>FGBI ARRIAH</ApplicantNameLatin>
<InventionTitle languageCode="ru">Способ опосредованного определения
титра инфекционной активности альфа-коронавируса собак
производственного штамма РИЧ в сырье для вакцины методом ОТ-ПЦР в
режиме реального времени</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>786</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..786</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Canine Coronavirus</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgaaaattctgctgattctggcgtgcgtgattgcgtgcgcgtgcggcg
aacgttattgcgcgatgattagcgaaagcgataccagctgccgtaacggcaccgatagcacctgcgaaag
ctgctttaacggcggcgatctgatttggcatctggcgaactggaactttagctggagcattattctgatt
gtgtttattaccgtgctgcagtatggccgtccgcagtttagctggtttgtgtatggcattaaaatgctga
ttatgtggctgctgtggccgattgtgctggcgctgaccatttttaacgcgtatagcgaatatcaggtgag
ccgttatgtgatgtttggctttagcattgcgggcgcgattgtgacctttgtgctgtggattatgtatttt
gtgcgtagcattcagctgtatcgtcgtaccaaaagctggtggagctttaacccggaaaccaaagcgattc
tgtgcgtgagcgcgctgggccgtagctatgtgctgccgctggaaggcgtgccgaccggcgtgaccctgac
cctgctgagcggcaacctgtatgcggaaggctttaaaattgcgggcggcatgaacattgataacctgccg
aaatatgtgatggtggcgctgccgagccgtaccattgtgtataccctggtgggcaaaaaactgaaagcga
gcagcgcgaccggctgggcgtattatgtgaaaagcaaagcgggcgattatagcaccgatgcgcgtaccga
taacctgagcgaacaggaaaaactgctgcatatggtg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>262</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..262</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Canine Coronavirus</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MKILLILACVIACACGERYCAMISESDTSCRNGTDSTCESCFNGGDLIW
HLANWNFSWSIILIVFITVLQYGRPQFSWFVYGIKMLIMWLLWPIVLALTIFNAYSEYQVSRYVMFGFSI
AGAIVTFVLWIMYFVRSIQLYRRTKSWWSFNPETKAILCVSALGRSYVLPLEGVPTGVTLTLLSGNLYAE
GFKIAGGMNIDNLPKYVMVALPSRTIVYTLVGKKLKASSATGWAYYVKSKAGDYSTDARTDNLSEQEKLL
HMV</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---


Изобретение относится к области биотехнологии. Описан способ опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины методом ОТ-ПЦР в режиме реального времени. Способ включает стадии составления калибровочной панели положительных контрольных образцов альфа-коронавируса собак производственного штамма РИЧ, экстрагирования РНК из вируссодержащего сырья для вакцины и контролей, составления реакционной смеси для проведения обратной транскрипции и ПЦР в режиме реального времени с олигонуклеотидами, проведение обратной транскрипции. Следующими стадиями являются учет флуоресцентного сигнала каждого образца с помощью флуориметра, определение величины порогового цикла амплификации, установление зависимости порогового цикла амплификации и титра инфекционной активности штамма в сырье для вакцины, а также определение значения титра инфекционной активности штамма. Технический результат заключается в разработке высокочувствительного, высокоспецифичного, экспрессного, не предполагающего применения линий клеток способа опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для культуральной вакцины методом ОТ-ПЦР-РВ. 4 з.п. ф-лы, 10 ил., 7 табл., 6 пр.
1. Способ опосредованного определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в сырье для вакцины методом ОТ-ПЦР в режиме реального времени, включающий следующие стадии:
- составление калибровочной панели положительных контрольных образцов альфа-коронавируса собак производственного штамма РИЧ, в качестве которых используют суспензии с титрами инфекционной активности: 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0; 8,0 lg ТЦД50/см3, а также отрицательный контроль - суспензию клеток из почки кошки Крэнделла Риса CRFK, не зараженную вирусами, микоплазмами, бактериями и грибами;
- экстрагирование РНК из вируссодержащего сырья для вакцины и контролей;
- составление реакционной смеси для проведения обратной транскрипции и ПЦР в режиме реального времени с олигонуклеотидами, специфичными участку М-гена альфа-коронавируса собак производственного штамма РИЧ, используют CCoV RICH-T-F-праймер, CCoV RICH-T-R-праймер, CCoV RICH-Т-Р-зонд (FAM/RTQ1) со следующими последовательностями:
5’-AAT ATT GAT TGT TTT GTT AAC TGT GTT ACA T-3’,
5’-AAC GGG CAA GAA TAG CCA CAT TAT AAG CAT-3’ и
5’- FAM-ACC TCA ACG CAG CTG GTT CGT GTA TGG CAT T –RTQ1-3’, соответственно;
- проведение обратной транскрипции - температура 42°С в течение 15 мин.; предварительная денатурация - температура 95°С в течение 10 мин. и ПЦР в режиме реального времени с последующей детекцией амликонов с помощью детектирующего термоциклера проводят с соблюдением следующих режимов: денатурация - температура 95°С в течение 15 с, отжиг олигонуклеотидов - температура 58°С в течение 20 с, элонгация - температура 72°С в течение 50 с.;
- учет флуоресцентного сигнала каждого образца с помощью флуориметра;
- определение величины порогового цикла амплификации;
- установление зависимости порогового цикла амплификации и титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ в вируссодержащем сырье для вакцины в виде логарифмической функции lg TCCoV RICH=-0,2998 × Ct+10,491, установление достоверности аппроксимации - R2=0,9991 и эффективности реакции амплификации - Е=99,43%;
- определение значения титра инфекционной активности альфа-коронавируса собак штамма РИЧ в образцах вируссодержащего сырья для вакцины на основе разработанной логарифмической модели.
2. Способ по п. 1, отличающийся тем, что для экстрагирования РНК применяют стекловолокнистые фильтры на установке Promega Vac-Man Vacuum Manifold с поддержанием отрицательного давления.
3. Способ по п. 1, отличающийся тем, что смесь компонентов для проведения обратной транскрипции и ПЦР в режиме реального времени включает в свой состав следующие компоненты в расчете на реакцию: CCoV RICH-T-F-праймер, CCoV RICH-T-R-праймер и CCoV RICH-T-P- FAM/RTQ1-зонд - по 5 пМ, смесь дезоксирибонуклеозидтрифосфатов - по 0,20 мМ, MgCl2 - 3 мМ, Taq-буферный раствор Colorless Flexi - 20% от объема реакционной смеси, MMLV-ревертаза - 1 ед., Taq ДНК-полимераза - 1 ед.
4. Способ по п. 1, отличающийся тем, что в нем проводится контроль реакции ОТ-ПЦР-РВ с использованием мРНК, синтезированной с применением модифицированной плазмиды р Jet 1.2 sf GFP и культуры клеток почки новорожденного сирийского хомячка BHK-21/SUSP/ARRIAH после трансфекции с применением высокомолекулярного полиэтиленимина.
5. Способ по п. 1, отличающийся тем, что аналитическая чувствительность разработанного способа определения титра инфекционной активности альфа-коронавируса собак производственного штамма РИЧ составляет не менее 0,5 lg ТЦД50/см3 с достоверностью результатов исследования >99,0%.
| ВАКЦИНА ПРОТИВ ЧУМЫ, АДЕНОВИРУСНЫХ ИНФЕКЦИЙ, ПАРВОВИРУСНОГО И КОРОНАВИРУСНОГО ЭНТЕРИТОВ, ЛЕПТОСПИРОЗА И БЕШЕНСТВА СОБАК | 2013 |
|
RU2546247C2 |
| ВАКЦИНА ПРОТИВ КОРОНАВИРУСНОГО ЭНТЕРИТА СОБАК | 2001 |
|
RU2211705C1 |
| Bandai C., Ishiguro S., Masuya N., Hohdatsu Т., Mochizuki M | |||
| Canine coronavirus infections in Japan: virological and epidemiological aspects // J | |||
| Vet | |||
| Med | |||
| Sci | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| - V | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
| - P | |||
| ПРИБОР ДЛЯ СОЖИГАНИЯ НЕФТИ | 1922 |
|
SU731A1 |
Авторы
Даты
2023-12-07—Публикация
2022-08-03—Подача