Сперанский Дмитрий Леонидович, д.м.н., профессор кафедры онкологии, гематологии и трансплантологии ИНМФО; ВолгГМУ.
Садчикова Елена Владимировна - к.х.н., доцент кафедры технологии органического синтеза химико-технологического института УрФУ.
1 область техники, к которой относится изобретение.
Рак молочной железы (РМЖ) имеет высокую заболеваемость и смертность, как в России, так и в мире, поэтому поиск новых способов его лечения является актуальной проблемой экспериментальной и клинической онкологии. Общеизвестные противоопухолевые препараты недостаточно эффективны, довольно высоко токсичны, к ним быстро развивается резистентность опухолевых клеток. Поэтому поиск и изучение новых лекарственных препаратов, обладающих специфической противоопухолевой активностью против клеток рака молочной железы и при этом невысокой токсичностью по отношению к организму пациента, является весьма актуальным.
2 предшествующий уровень техники.
В последние годы было синтезировано большое количество производных соединений, которые в той или иной степени показали возможности перспективного использования в качестве комбинированной терапии разовых заболеваний.
Начиная с 1980 годов, химические соединения, в основе которых лежит имидазо[5,1-d][1,2,3,5]тетразин, начали широко применяться в качестве противоопухолевых агентов.
Темозоломид используется в клинической практике для лечения некоторых опухолей мозга, а также для усиления терапевтического эффекта ряда препаратов в комбинированной противоопухолевой терапии. При синтезе аналогичных производных было установлено, что заместитель в 3 положении тетразинонового кольца оказывает влияние на устойчивость данных соединений в твердом состоянии и в растворах.
Многие данные свидетельствуют о том, что токсичность митозоломида коррелирует с образованием О6-метилгуанина. Аддукты, образуемые в О6 положении гуанина, считаются наиболее мутагенными и цитотоксичными. Темозоломид является препаратом выбора и используется в качестве средства первой линии для лечения глиом после их хирургической резекции. Однако из-за очень короткого периода полувыведения 1,8 ч и связывания с белками 15% требуется повторное введение препарата. Кроме того, препарат демонстрирует меньшую специфичность к месту, и, таким образом, количество препарата, достигающего места опухоли, становится ограниченным.
Эпирубицин, антрациклиновый противоопухолевый антибиотик, является одним из наиболее активных одиночных агентов, используемых в лечении пациентов с раком молочной железы. Основными побочными эффектами эпирубицина являются острая гематологическая токсичность, ограничивающая дозу, и кумулятивная кардиотоксичность, связанная с дозой. Другие основные побочные эффекты введения эпирубицина включают мукозит, тошноту и рвоту, обратимую алопецию и местные кожные и пузырные реакции.
Разработка и внедрение в практику новых сведений об цитотоксическом и генотоксическом действии новых производных азолоазинов расширяет представления о механизмах действия и мишенях потенциальных противоопухолевых препаратов. Это является теоретической и эмпирической базой для их дальнейшего изучения с целью разработки новых противоопухолевых препаратов и, в итоге, для улучшения эффективности лечения РМЖ, снижения тяжести побочных эффектов и осложнений химиотерапии в онкологической практике.
3. Раскрытие сущности изобретения.
На одном из его этапов, предполагается анализ цитотоксических эффектов. В качестве модели используются клеточные культуры раковой опухоли молочной железы. Изучение дозозависимых цитотоксических свойств проводится при помощи теста MTT, показывающего жизнеспособность клеток в зависимости от введенной концентрации веществ.
В качестве модели использовались культуры клеток рака молочной железы, на которых изучались фармакологические эффекты производных азолотриозина.
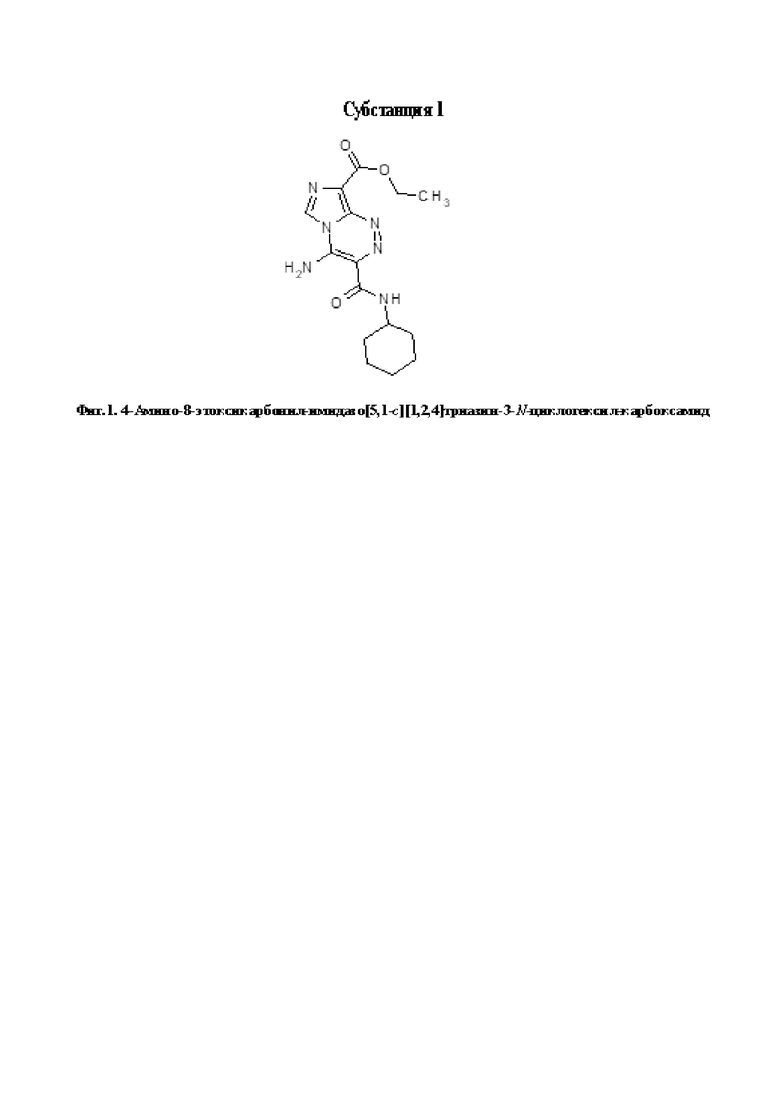
4-Амино-8-этоксикарбонилимидазо[5,1-с][1,2,4]триазин-3-N-циклогексилкарбоксамид (Субстанция 1). Выход 246 мг (74 %), т.пл. 320-321°C. ИК спектр, νmax (KBr), см-1: 520, 570, 615, 660, 690, 715, 775, 820, 880, 990, 1030, 1055, 1155, 1185, 1240, 1280, 1305, 1340, 1360, 1385, 1440, 1505, 1535, 1620, 1655, 1700, 2845, 2925, 2975, 3040, 3090, 3265, 3415. Спектр 1H ЯМР (600 МГц, DMSO-d6), δ, м. д. (J, Гц): 1.13-1.83 (10Н, м, C6H11); 1.33 (3H, т, J = 6.8, ОCH2CH3); 3.82-3.85 (1H, м, C6H11); 4.34 (2H, кв, J = 6.8, ОCH2CH3); 8.71 (1H, д, J = 7.9, NH); 8.77 (1H, с, H-6); 9.35 (1Н, уш.с, NH2); 9.69 (1Н, уш.с, NH2). Спектр 13C ЯМР (151 МГц, DMSO-d6), δ, м. д.: 14.4 (с, OCH2CH3); 24.9 (с, CH2-3',5'); 25.1 (с, CH2-4'); 32.2 (с, CH2-2',6'); 47.7 (с, CH2-1'); 59.8 (с, OCH2CH3); 118.0 (с, С-8); 120.1 (с, С-3); 124.5 (с, С-6); 138.6 (с, С-9); 141.0 (с, С-4); 161.5 (с, C=O); 164.5 (с, C=O). Найдено, %: C 54.09; H 6.02; N 25.41. C15H20N6O3. Вычислено, %: C 54.21; H 6.07; N 25.29.
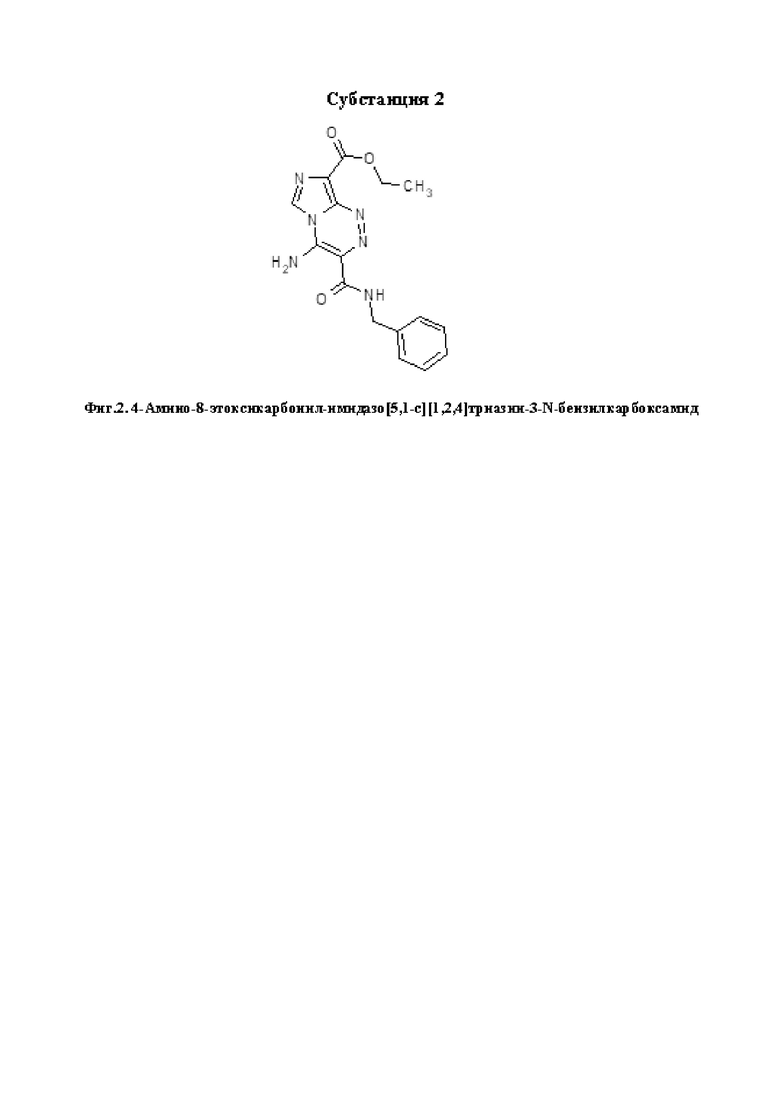
4-Амино-8-этоксикарбонилимидазо[5,1-с][1,2,4]триазин-3-N-бензилкарбоксамид (Субстанция 2). Выход 276 мг (81 %), т.пл. 332-333°C. ИК спектр, νmax (KBr), см-1: 555, 610, 630, 690, 730, 770, 900, 965, 990, 1035, 1070, 1125, 1155, 1205, 1240, 1260, 1290, 1305, 1335, 1365, 1385, 1420, 1455, 1520, 1550, 1620, 1650, 1680, 2900, 2925, 2980, 3025, 3110, 3275, 3345, 3440. Спектр 1H ЯМР (600 МГц, DMSO-d6), δ, м. д. (J, Гц): 1.34 (3H, т, J = 7.1, ОCH2CH3); 4.34 (2H, кв, J = 7.1, ОCH2CH3); 4.53 (2H, д, J = 6.3, NHCH2); 7.22-7.24 (1Н, м, Н-4'); 7.31-7.33 (2H, м, H-3',5'); 7.37 (2H, д, J = 7.6, H-2',6'); 8.79 (1H, с, H-6); 9.37 (1Н, уш.с, NH2); 9.64-9.66 (2Н, м, NH2+NH). Спектр 13C ЯМР (151 МГц, DMSO-d6), δ, м. д.: 14.4 (с, OCH2CH3); 59.8 (с, OCH2CH3); 42.1 (с, CH2); 118.0 (с, С-8); 120.2 (с, С-3); 124.6 (с, С-6); 126.7 (с, С-4'); 127.4 (с, С-2',6'); 128.2 (с, С-3',5'); 138.6 (с, С-9); 139.7 (с, С-1'); 141.0 (с, С-4); 161.5 (с, C=O); 165.6 (с, C=O). Найдено, %: C 56.33; H 4.64; N 24.78. C16H16N6O3. Вычислено, %: C 56.47; H 4.74; N 24.69.
Краткое описание чертежей
Фигура 1 - 4-Амино-8-этоксикарбонилимидазо[5,1-с][1,2,4]триазин-3-N-циклогексилкарбоксамид (Субстанция 1).
Фигура 2 - 4-Амино-8-этоксикарбонилимидазо[5,1-с][1,2,4]триазин-3-N-бензилкарбоксамид (Субстанция 2).
Активность азолоазинов проявляется в экспериментальных исследованиях при терапии: лейкозов, лимфом, асцитной карциномы Эрлиха, некоторых вирусных инфекций и т.д.
Исходя из изложенного, представляется перспективным провести скрининговую оценку потенциальной противоопухолевой активности in vitro и in vivo для группы соединений рассматриваемого класса производных азолоазинов. В настоящей заявке интерес сконцентрирован на азоло[5,1-c][1,2,4].
Пример 1.
Для культивирования клеток в работе были использованы следующие среды, реактивы и готовые смеси веществ: среда MEM без глутамина (ПанЭко, Россия); среда DMEM без глутамина (ПанЭко, Россия); эмбриональная телячья сыворотка (FCS, ПанЭко, Россия); 2 mM раствор L-глутамина (ПанЭко, Россия); 6 mM раствор D-Глюкозы (ПанЭко, Россия); L-аргинин (Реахим, Россия); смесь антибиотиков (1% стрептомицин + 1% пенициллин, АБ) производства ПанЭко, Россия; смесь антибиотик + антимикотик (АА, Healthcare, Австрия); гентамицин (Белмедпрепараты, Беларусь); 70% этиловый спирт (Россия).
Для манипуляций с клетками и определения их жизнеспособности использовали: трипсин 0,25%-ный раствор (ПанЭко, Россия), раствор Версена (ПанЭко, Россия), раствор Хенкса (ПанЭко, Россия), трис-HCl50 ммоль/л буфер рН 7,5 (Sigma), п-хлорфенол 6,0 ммоль/л (Sigma), раствор трипанового синего (Биолот, Россия).
При проведении кометного анализа в работе использовали следующие реактивы: агароза, тип VII (Sigma-Aldrich, США); гидроксид натрия (чда), хлористый натрий (чда), хлористый калий гидрофосфат натрия (чда) и этилендиаминтетраацетат (ЭДТА) производства «Реахим» (Россия); трис-(гидроксиметил)-аминометан (Reanal, Венгрия); диметилсульфоксид производства (ДМСО) «Pancreac» (Испания); ДМСО производства Тульской фармацевтической фабрики (Россия); Тритон Х-100 (SERVA, Германия); хлорид железа(III) 6-водный (ч) (Россия), краситель SYBR Green I (Applichem, Германия); галловая кислота, 3% перекись водорода и 70% этиловый спирт (Россия).
В биохимической части исследования использовали следующие реактивы и киты: коммерческие наборы для определения концентрации лактата Olvex Diagnosticum; молочная кислота (Реахим, Россия); этилендиаминтетрауксусная кислота, ЭДТА (Sigma-Aldrich, Швейцария); хлорид магния (Sigma-Aldrich, Китай); хлорид калия (Sigma-Aldrich, Китай); дигидрофосфат калия (Sigma, США); HEPES цвиттер - ионный органический буфер (ДИАЭМ, Германия); сахароза (Sigma-Aldrich, Швейцария); таурин (Sigma, США); Олигомицин А (Sigma-Aldrich, Германия); 2,4-динитрофенол, ДНФ (Sigma-Aldrich, Германия); ротенон («Sigma-Aldrich», Германия); дрожжи, 3% перекись водорода и 70% этиловый спирт (Россия). Тестируемые вещества растворяли в ДМСО в концентрации 10-2М. К культуре опухолевых клеток аденокарциномы MCF-7 добавляли различные концентрации тестируемых соединений. Каждую концентрацию повторяли трижды. В контрольные лунки вносили раствор ДМСО в концентрации не более 1%.
По истечении срока инкубации, растворы в лунках заменяли на 96% раствор DMSO, растворяя кристаллы формазана, после чего измеряли оптическую плотность при помощи спектрофотометра Olvex Diagnosticum (Россия). После получения результатов МТТ теста, проводили их обработку и построение графиков выживаемости клеток рака молочной железы по IC50. Цитотоксичность оценивали с помощью метода компьютеризированной проточной цитометрии против растворов противоопухолевых препаратов той же концентрации клеточных культур.
Был проведен анализ цитотоксичности посредством МТТ-теста на двух производных азолотриазина (субстанции 1 и 2).
В качестве препарата сравнения использовали эпирубицин.
Проведя оценку цитотоксичности производных азолотриазина по дозозависимым кривым, мы убедились, что не все производные похожи по свойствам и оказывают различий токсический эффект, что вызывает необходимость поиска более подходящих производных. Для выявления разницы между контрольным и опытными образцами проводили статистическое сравнение с культурой клеток без добавления каких-либо веществ. На первом этапе работы мы доказали, что токсичность у производных отличается между собой, что обусловило поиск новых, индивидуальных доз, для построения дозозависимых кривых. На втором этапе были проведены статистические расчеты и на третьем этапе произведен расчет IC50 для оценки выживаемости клеток рака молочной железы MCF-7 по дозозависимым кривым. Концентрация вещества, которая вызывает 50% гибель клеток (IC50) рассчитывается графически по дозозависимой кривой с помощью программного обеспечения Origin (OriginLabCorporation). Значение функции рассчитывается по формуле: 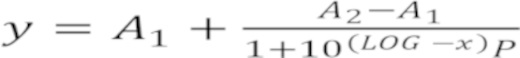 , где А1 и А2 - выживаемость клеток; а значение IC50 по формуле:
, где А1 и А2 - выживаемость клеток; а значение IC50 по формуле: 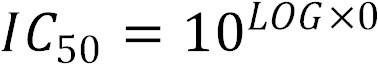 .
.
Вначале был проведен анализ цитотоксичности эпирубицина в МТТ-тесте, как препарата сравнения. Максимальное подавление составило 1,72/0,82 = 2,10. Расчетная концентрация половинного ингибирование IC50 оказалась равной 9,37 мкмоль/л.
Субстанция 1 снижала жизнеспособность клеток РМЖ во всем диапазоне концентраций. Максимальное подавление жизнеспособности было достигнуто при концентрации 5 мкмоль/л и составило 2,61, но и при других концентрациях величины показателя существенно не различались. Расчетная IC50 составила 5,50 мкмоль/л.
Субстанция 2 в умеренной степени вызвала дозозависимое снижение жизнеспособности клеток РМЖ на всем диапазоне концентраций, максимальное подавление Ск/Сmax составило 1,83/0,83 = 2,20 при максимальной концентрации 10 мкмоль/л. Расчетное половинное торможение IC50 было достигнуто при концентрации 8,44 мкмоль/л.
Для эпирубицина показатель IC50 составляет 0,03979±0,0179М; для производного азолотриазина 1 - IC50: 0,00662 ± 0,00104М; для производного азолотриазина 2- IC50: 0,00805 ± 0,00191М, что подтверждает их более специфическую цитотоксическая активность.
Значения IC50 производного азолотриазина (субстанция 1) и производного азолотриазина (субстанция 1) входят в доверительный интервал значений IC50 эпирубицина, что подтверждено статистически. Следовательно, данные производные схожи по цитотоксическому эффекту с препаратом сравнения - эпирубицином, но значимо менее токсичны.
Таким образом, найдены новые соединения - производные азолотриазина, как более специфичный и эффективный, по сравнению с общеизвестными противоопухолевыми химиопрепаратами, эффективность которых постоянно снижается из-за развития резистентности опухолевых клеток к противоопухолевой лекарственной терапии, - новый лекарственный препарат для лечения рака молочной железы, эффективность и безопасность которого доказана за счет использования расширений клеточных технологий.
| название | год | авторы | номер документа |
|---|---|---|---|
| Противоопухолевая композиция цисплатина с ингибитором 6-фосфоглюконатдегидрогеназы | 2019 |
|
RU2693004C1 |
| СПОСОБ ЛЕЧЕНИЯ СОЛИДНЫХ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ МЛЕКОПИТАЮЩИХ | 2024 |
|
RU2841088C2 |
| Разнолигандные комплексы меди(II) с 1H-тетразол-5-уксусной кислотой и производными олигопиридина, проявляющие цитотоксичную активность | 2023 |
|
RU2818953C1 |
| Натрий-кобальт-полигалактуронат, обладающий противоопухолевой активностью | 2023 |
|
RU2794885C1 |
| Способ повышения эффективности ингибиторов иммунных контрольных точек при помощи терапевтической композиции на основе производных индола и пробиотика | 2023 |
|
RU2826495C1 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2012 |
|
RU2491930C1 |
| Способ подбора лекарственных средств для реализации фармакологической индукции митохондриальной дисфункции в макрофагах для противоопухолевой терапии | 2023 |
|
RU2810558C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ В ФОРМЕ САШЕ | 2018 |
|
RU2695326C1 |
| N-МЕТОКСИБЕНЗИЛЬНЫЕ ПРОИЗВОДНЫЕ ДАУНОРУБИЦИНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2019 |
|
RU2704326C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ХИМИОТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2016 |
|
RU2617511C1 |
Группа изобретений относится к области фармацевтики и медицины, а именно к средству с цитотоксической активностью для химиотерапии рака молочной железы и к применению указанного средства для химиотерапии рака молочной железы. Cредство с цитотоксической активностью для химиотерапии рака молочной железы включает действующее вещество или его фармацевтически приемлемую соль или фармацевтическую композицию на основе действующего вещества или его фармацевтически приемлемой соли и фармацевтически приемлемые носители и добавки, согласно изобретению в качестве действующего вещества оно содержит производное азолотриазина, которое представляет собой 4-амино-8-этоксикарбонил-имидазо[5,1-с][1,2,4]триазин-3-N-циклогексил-карбоксамид или 4-амино-8-этоксикарбонил-имидазо[5,1-с][1,2,4]триазин-3-N-бензилкарбоксамид. Применение указанного средства в качестве цитотоксического средства для химиотерапии рака молочной железы. Указанная группа изобретений обладает повышенной эффективностью по сравнению с эпирубицином. 2 н.п. ф-лы, 2 ил., 1 пр.
1. Cредство с цитотоксической активностью для химиотерапии рака молочной железы, включающее действующее вещество или его фармацевтически приемлемую соль или фармацевтическую композицию на основе действующего вещества или его фармацевтически приемлемой соли и фармацевтически приемлемые носители и добавки, отличающееся тем, что в качестве действующего вещества оно содержит производное азолотриазина, которое представляет собой 4-амино-8-этоксикарбонил-имидазо[5,1-с][1,2,4]триазин-3-N-циклогексил-карбоксамид следующей структурной формулы:
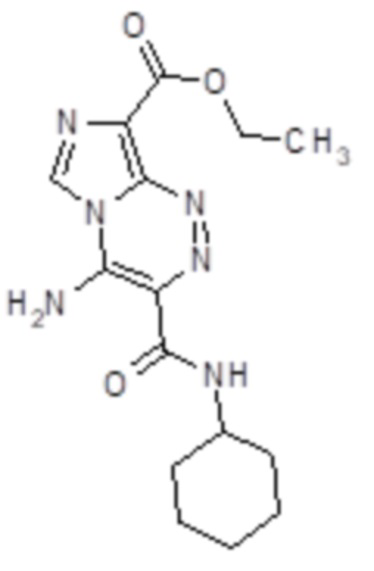
или 4-амино-8-этоксикарбонил-имидазо[5,1-с][1,2,4]триазин-3-N-бензилкарбоксамид следующей структурной формулы:
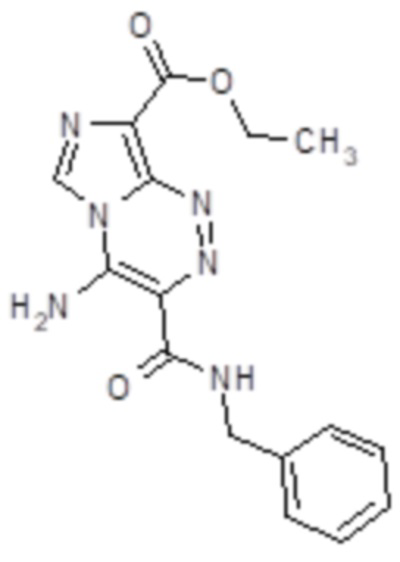
2. Применение средства по п.1 в качестве цитотоксического средства для химиотерапии рака молочной железы.
| EP 3750891 A1, 16.12.2020 | |||
| IZMEST’EV, A.N., et al | |||
| Synthesis and study of the influence of substituents on the cytotoxicity of oxindolylidene derivatives of imidazothiazolotriazinones | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
Авторы
Даты
2024-03-07—Публикация
2022-09-02—Подача