ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ВИДЕ ТЕКСТОВОГО ФАЙЛА ПОСРЕДСТВОМ EFS-WEB
[1] Перечень последовательностей, записанный в файле 10457WO01_ST25.txt, имеет размер 33,5 килобайта, был создан 29 января 2019 года и включен в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[2] Данная заявка в целом относится к композициям и способам для доставки терапевтического белка в центральную нервную систему (ЦНС) для лечения заболеваний и нарушений, при которых нарушается функция ЦНС, как, например, лечения лизосомных болезней накопления. Данная заявка относится к обеспечению терапевтически эффективного количества композиции, содержащей нуклеотид, кодирующий терапевтический белок, конъюгированный с одним или более доменомами доставки, которые проходят через гематоэнцефалический барьер (ВВВ).
УРОВЕНЬ ТЕХНИКИ
[3] Были разработаны подходы к доставке лекарственных средств для преодоления гематоэнцефалического барьера (ВВВ), такие как наноносители, однако они имеют недостатки. Носители характеризуются нестабильностью в кровотоке и нежелательным профилем биораспределения (Gelperina S, et al., 2005, Am J Respir Crit Care Med. 172(12): 1487-90; ссылка на который включена в данный документ в полном объеме посредством ссылки). Эффективность целенаправленного воздействия также была снижена, обусловленная механизмами транспорта в ВВВ и тем, изменило ли болезненное состояние ЦНС целостность барьера. Правильный выбор нацеливающегося фрагмента или носителя должен учитывать нейровоспалительные состояния, которые влияют на эти механизмы транспорта.
[4] Доставка терапевтических белков посредством экспрессии ДНК в печени или других тканях обеспечила удобный подход, устраняющий потребность в болюсной инъекции белка и, следовательно, уменьшающий проблемы, связанные с иммуногенностью. С помощью терапевтического белка, конъюгированного со связывающим рецептор белком, в частности специфическим в отношении клеток рецептором, решают проблему нацеливания терапевтических средств на конкретные ткани. Однако все еще существует необходимость в обеспечении способов, которые эффективно обеспечивают терапевтические средства в ЦНС.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[5] Авторы настоящего изобретения обнаружили, что терапевтические белки, в частности заместительные ферменты, могут эффективно доставляться в центральную нервную систему при связывании со связывающим рецептор белком и при условии, что циркулирующие в крови уровни достигают стабильных уровней с течением времени. Мультидоменный терапевтический белок может доставляться в печень посредством вектора для генной терапии, несущего кодирующую последовательность терапевтического белка и связывающего белок комплекса.
[6] В одном аспекте настоящее изобретение предусматривает способ доставки терапевтического белка в центральную нервную систему (ЦНС) субъекта, предусматривающий введение субъекту композиции, содержащей нуклеотид, кодирующий терапевтический белок, конъюгированный с белком, связывающим рецептор клеточной поверхности (CSR) (CSR-BP) (tpCSR-BP), посредством способа доставки, нацеленного на печень, достаточного для обеспечения терапевтически эффективного количества tpCSR-BP в ЦНС.
[7] В одном варианте осуществления CSR-BP представляет собой антитело или его антигене вязывающий фрагмент, которые специфически связываются с CSR. В другом варианте осуществления терапевтический белок представляет собой лизосомный фермент.
[8] В одном варианте осуществления фермент обладает гидролазной активностью, как, например, гликозилаза, как, например, гликозидаза, как, например, альфа-глюкозидаза или альфа-галактозидаза А. В одном варианте осуществления белок, связывающий рецептор клеточной поверхности (CSR) (CSR-BP), представляет собой антигенсвязывающий белок, который связывается с рецептором интернализации. В одном варианте осуществления рецептор интернализации представляет собой молекулу клеточной поверхности, которая подвергается эндоцитозу и транспортируется в лизосому. В конкретном варианте осуществления рецептор интернализации представляет собой молекулу CD63. В одном варианте осуществления рецептор интернализации представляет собой молекулу ITGA7. В конкретном варианте осуществления CSR-BP представляет собой антитело, фрагмент антитела или одноцепочечный вариабельный фрагмент (scFv), такой как scFv, который связывает CD63 или ITGA7.
[9] В некоторых вариантах осуществления мультидоменный терапевтический белок, описанный в данном документе, содержит один или более из домена(-ов) доставки и ферментный домен, где один или более из домена(-ов) доставки связывают рецептор трансферрина человека (hTfR). В некоторых вариантах осуществления мультидоменный терапевтический белок дополнительно содержит второй домен доставки, который связывается с эффектором интернализации. В некоторых вариантах осуществления второй домен доставки связывается с (i) эффектором интернализации, выбранным из группы, состоящей из CD63, интегрина альфа-7 (ITGA7), MHC-I, Kremen-1, Kremen-2, LRP5, LRP6, LRP8, рецептора трансферрина, LDL-рецептора, рецептора белка 1, родственного LDL, ASGR1, ASGR2, белка-2, подобного белку-предшественнику амилоида (APLP2), апелинового рецептора (APLNR), миелинового и лимфоцитарного белка (MAL), IGF2R, Н+ АТФазы вакуолярного типа, рецептора дифтерийного токсина, фолатного рецептора, глутаматных рецепторов, глутатионового рецептора, лептиновых рецепторов, фагоцитарного рецептора А1-5 (SCARA1-5), SCARB1-3 и CD36; (ii) эффектором интернализации, который экспрессируется в нескольких типах тканей, необязательно выбранным из группы, состоящей из CD63, MHC-I, Н+ АТФазы вакуолярного типа, IGF2R, интегрина альфа-7 (ITGA7), LRP5, LRP6, LRP8, Kremen-2, LDL-рецептора, рецептора белка 1, родственного LDL, белка-2, подобного белку-предшественнику амилоида (APLP2), апелинового рецептора (APLNR), PRLR, MAL (миелиновый и лимфоцитарный белок (MAL), рецептора дифтерийного токсина, HBEGF (гепарин-связывающий фактор роста, подобный EGF), глутатионовых рецепторов, глутаматных рецепторов, лептиновых рецепторов и фолатных рецепторов; (iii) эффектором интернализации, который преимущественно экспрессируется тканями кости и/или хряща, необязательно выбранным из группы, состоящей из коллагена X, интегрина альфа-10 (ITGA10), рецептора 3 фактора роста фибробластов (FGFR3), изоформы С рецептора фактора роста фибробластов (FGFR3C), белка 1, связывающего гиалуронан и протеогликан (CRTL1), аггрекана, коллагена II и Kremen-1; (iv) эффектором интернализации, который преимущественно экспрессируется моноцитами, макрофагами или микроглией, необязательно выбранным из группы, состоящей из фагоцитарного рецептора А1-5 (SCARA1-5), SCARB1-3, CD36, MSR1 (макрофагальный фагоцитарный рецептор 1), MRC1 (макрофагальный маннозный рецептор 1), VSIG4 (белок 4, содержащий домен V-набора и иммуноглобулина), CD68 (макросиалин) и CSF1R (рецептор колониестимулирующего фактора 1 макрофагов); (v) эффектором интернализации, который преимущественно экспрессируется клетками почек, необязательно выбранным из группы, состоящей из CDH16 (Cadheri-16), CLDN16 (Claudn-16), KL (Klotho), PTH1R (рецептор паратиреоидного гормона), SLC22A13 (семейство 22 транспортеров растворенных веществ, представитель 13), SLC5A2 (котранспортер 2 натрия/глюкозы) и UMOD (уромодулин). В других определенных вариантах осуществления эффектор интернализации представляет собой специфический в отношении мышц интернализатор, такой как BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерин, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергический рецептор (никотиновый) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14 В, содержащий богатый лейцином повтор), дистрогликан (DAG1) и POPDC3 (белок 3, содержащий домен Popeye); (vi) эффектор интернализации, преимущественно экспрессируемый клетками печени, необязательно ASGR1 или ASGR2; (vii) эффектор интернализации, преимущественно экспрессируемый клетками мышц, необязательно выбран из группы, состоящей из BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерина, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергического рецептора (никотиновый) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14 В, содержащий богатый лейцином повтор), дистрогликана (DAG1) и POPDC3 (белок 3, содержащий домен Рореуе), и/или (viii) эффекторный белок интернализации, выбранный из группы, состоящей из ITGA7, CD9, CD63, ALPL2, MSR1, ASGR1, ASGR2 или PRLR. В некоторых вариантах осуществления второй домен доставки связывается с эффектором интернализации CD63. В некоторых вариантах осуществления по меньшей мере один из одного или более домена(-ов) доставки содержит антигенсвязывающий белок. В некоторых вариантах осуществления каждый из одного или более домена(-ов) доставки содержит антигенсвязывающий белок. В некоторых вариантах осуществления по меньшей мере один из одного или более домена(-ов) доставки содержит одноцепочечный вариабельный фрагмент (scFv). В некоторых вариантах осуществления по меньшей мере один из одного или более домена(-ов) доставки содержит полуантитело. В некоторых вариантах осуществления домен доставки, который связывает hTfR, представляет собой scFv, где полуантитело связывает CD63, где ферментный домен представляет собой GAA, и где GAA конъюгирован с карбокси-концом полуантитела, которое связывает CD63. В некоторых вариантах осуществления каждый из одного или более домена(-ов) доставки содержит scFv. В некоторых вариантах осуществления по меньшей мере один scFv слит с Fc. В некоторых вариантах осуществления Fc предусматривает изотип IgG4 человека дикого типа или его производное. В некоторых вариантах осуществления GAA конъюгирован с карбокси-концом Fc. В некоторых вариантах осуществления мультидоменный терапевтический белок содержит scFv к hTfR и scFv к hCD63. В некоторых вариантах осуществления оба из scFv к hTfR и scFv к hCD63 соединены по своим карбокси-концам с одним ферментом GAA. В некоторых вариантах осуществления домен доставки представляет собой scFv к hTfR, и ферментный домен связан с карбокси-концом VL-домена scFv. В некоторых вариантах осуществления мультидомен дополнительно содержит второй домен доставки, связанный с N-концом VH-домена scFv к hTfR. В некоторых вариантах осуществления второй домен доставки представляет собой scFV к hCD63. В некоторых вариантах осуществления ферментный домен содержит аминокислотную последовательность, представленную под SEQ ID NO: 1.
[10] Также предусматриваются мультидоменные терапевтические белки, содержащие по меньшей мере два домена доставки и по меньшей мере один ферментный домен, где каждый из двух доменов доставки независимо выбран из группы, состоящей из антитела, полуантитела и scFv, и где по меньшей мере один или более доменов доставки ассоциированы с по меньшей мере одним ферментным доменом, где предпочтительно один или более доменов доставки ковалентно связаны с по меньшей мере одним ферментным доменом. В некоторых вариантах осуществления мультидоменный терапевтический белок содержит не более двух доменов доставки. В некоторых вариантах осуществления только один из доменов доставки связан с по меньшей мере одним ферментным доменом. В некоторых вариантах осуществления каждый из по меньшей мере двух доменов доставки ковалентно связан с ферментным доменом. В некоторых вариантах осуществления каждый из по меньшей мере двух доменов доставки ковалентно связан с одним и тем же ферментным доменом. В некоторых вариантах осуществления каждый из по меньшей мере двух доменов доставки ковалентно связан с отличным ферментным доменом. В некоторых вариантах осуществления мультидоменный терапевтический белок содержит не более двух доменов доставки, где первый домен доставки предусматривает полуантитело, и при этом второй домен доставки предусматривает scFv. В некоторых вариантах осуществления scFv слит с Fc. В некоторых вариантах осуществления полуантитело ковалентно связано по своему карбокси-концу с первым ферментным доменом и/или где scFv ковалентно связан по своему карбокси-концу с Fc и необязательно вторым ферментным доменом. В некоторых вариантах осуществления мультидоменный терапевтический белок содержит не более двух доменов доставки, где каждый из первого и второго домена доставки предусматривает scFv. В некоторых вариантах осуществления как первый, так и второй scFv является ковалентно связанным с ферментным доменом. В некоторых вариантах осуществления мультидоменный терапевтический белок содержит от N-конца к С-концу: первый scFv, второй scFv и ферментный домен. В некоторых вариантах осуществления по меньшей мере один домен доставки связывает молекулу, обеспечивающую транспорт в лизосому, и по меньшей мере один домен доставки связывает эффектор трансцитоза. В некоторых вариантах осуществления молекула, обеспечивающая транспорт в лизосому, выбрана из группы, состоящей из CD63, ITGA7, CD9, CD63, CD81, CD82 или CD151, и где эффектор трансцитоза выбран из группы, состоящей из рецептора LDL, рецептора IgA, рецептора трансферрина, неонатального Fc-рецептора, рецептора инсулина, CD98 и басигина. В некоторых вариантах осуществления мультидоменный терапевтический белок предусматривает структуру, представленную на фигуре 1С, фигуре 1D, фигуре 1Е или фигуре 1F.
[11] Также в данном документе предусмотрены полинуклеотиды, которые кодируют мультидоменные терапевтические белки, описанные в данном документе. В некоторых вариантах осуществления в данном документе предусмотрен полинуклеотид, дополнительно содержащий последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус. В некоторых вариантах осуществления полинуклеотид дополнительно содержит последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус, где последовательность вирусной нуклеиновой кислоты представляет собой последовательность нуклеиновой кислоты аденоассоциированного вируса (AAV). В некоторых вариантах осуществления полинуклеотид дополнительно содержит последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус, где последовательность вирусной нуклеиновой кислоты представляет собой последовательность нуклеиновой кислоты аденоассоциированного вируса (AAV), и где последовательность нуклеиновой кислоты AAV содержит последовательность внутреннего концевого повтора и необязательно тканеспецифический регуляторный элемент, такой как специфический в отношении печени промотор или специфический в отношении нейронов промотор. В некоторых вариантах осуществления полинуклеотид дополнительно содержит последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус, где последовательность вирусной нуклеиновой кислоты представляет собой последовательность нуклеиновой кислоты аденоассоциированного вируса (AAV), содержащую последовательность внутреннего концевого повтора, которая предусматривает SEQ ID NO:6, SEQ ID NO:7 или и то и другое, и необязательно тканеспецифический регуляторный элемент, такой как специфический в отношении печени промотор или специфический в отношении нейронов промотор. В некоторых вариантах осуществления полинуклеотид дополнительно содержит тканеспецифический регуляторный элемент, предусматривающий последовательность, представленную под SEQ ID NO: 8 и/или SEQ ID NO: 9.
[12] В одном аспекте настоящее изобретение предусматривает вектор для генной терапии, такой как вектор на основе AAV, который содержит последовательность нуклеиновой кислоты, кодирующую терапевтический белок, конъюгированный с CSR-BP или слитый с ним, например полинуклеотид, описанный в данном документе. В некоторых вариантах осуществления вектор для генной терапии выбран из группы, состоящей из вирусного вектора, где вирусный вектор необязательно представляет собой природный вирус, сконструированный вирус или химерный вирус, и полинуклеотида без дополнительных средств, предусматривающего полинуклеотид, описанный в данном документе, полинуклеотидный комплекс, где полинуклеотидный комплекс необязательно представляет собой липидную наночастицу, содержащую полинуклеотид по любому из пунктов 20-25 и липиды, и любой их комбинации. В некоторых вариантах осуществления вектор для генной терапии представляет собой вирусный вектор, выбранный из группы, состоящей из ретровируса, аденовируса, вируса простого герпеса, поксвируса, вируса осповакцины, лентивируса или аденоассоциированного вируса. В некоторых вариантах осуществления вектор для генной терапии представляет собой AAV9, Anc80, химеру AAV2/8 и/или AAV, псевдотипированный в отношении конкретной ткани, например печени или нейронной ткани.
[13] В одном варианте осуществления терапевтический белок, нуклеотид, кодирующий его, и/или вектор для генной терапии, содержащий нуклеотид, кодирующий его, применяют для лечения субъекта, нуждающегося в заместительной ферментной терапии, например в способе доставки терапевтического белка в центральную нервную систему (ЦНС) субъекта, предусматривающем введение субъекту композиции, содержащей нуклеотид, кодирующий мультидоменный терапевтический белок, посредством способа доставки, нацеленного на печень, достаточного для обеспечения терапевтически эффективного количества мультидоменного терапевтического белка в ЦНС, где мультидоменный терапевтический белок содержит домен доставки и ферментный домен. В некоторых вариантах осуществления субъект представляет собой животное. В некоторых вариантах осуществления субъект представляет собой человека.
[14] В одном аспекте вектор на основе AAV, содержащий полинуклеотид, кодирующий слитый белок scFv-гидролаза, вводят субъекту-человеку или отличному от человека субъекту. Впоследствии полинуклеотид интегрируется в геномный локус в печени, и продуцируется закодированный слитый белок. В другом варианте осуществления полинуклеотид транскрибируется эписомально в печени, и продуцируется закодированный слитый белок. В конкретном варианте осуществления слитый белок представляет собой слитый белок, предусматривающий scFv к CD63 и GAA, или слитый белок, предусматривающий scFv к ITGA7 и GAA, субъект-человек или отличный от человека субъект характеризуется недостатком эндогенной активности GAA, и активность GAA эффективно восстанавливается у субъекта.
[15] В одном аспекте настоящее изобретение предусматривает способ лечения субъекта (человека или отличного от человека субъекта) с дефицитом фермента посредством введения пациенту вектора для генной терапии, содержащего ген, кодирующий терапевтический белок, конъюгированный или слитый с CSR-BP.
[16] В данном документе описаны способы доставки терапевтического белка в центральную нервную систему (ЦНС) субъекта, предусматривающие введение субъекту композиции, содержащей нуклеотид, кодирующий мультидоменный терапевтический белок, с помощью способа доставки, нацеленного на печень, достаточного для обеспечения терапевтически эффективного количества мультидоменного терапевтического белка в ЦНС, где мультидоменный терапевтический белок содержит домен доставки и ферментный домен. В некоторых вариантах осуществления домен доставки представляет собой антитело или его антиген связывающий фрагмент, которые специфически связываются с эффектором интернализации. В некоторых вариантах осуществления терапевтический белок представляет собой лизосомный фермент. В некоторых вариантах осуществления лизосомный фермент представляет собой GAA. В некоторых вариантах осуществления композиция, содержащая нуклеотид, вводится посредством вирусного вектора. В некоторых вариантах осуществления вирусный вектор представляет собой вектор на основе AAV. В некоторых вариантах осуществления композицию, содержащую нуклеотид, вводят в дозе, составляющей по меньшей мере 2×1012 вирусных геномов на килограмм (в. г. /кг). В некоторых вариантах осуществления эффектор интернализации экспрессируется на поверхности клеток, выбранных из группы, состоящей из клеток в ЦНС, эпителиальных клеток и клеток, которые проникают через гематоэнцефалический барьер. В некоторых вариантах осуществления домен доставки связывает эффектор интернализации. В некоторых вариантах осуществления эффектор интернализации (i) выбран из группы, состоящей из CD63, интегрина альфа-7 (ITGA7), MHC-I, Kremen-1, Kremen-2, LRP5, LRP6, LRP8, рецептора трансферрина, рецептора LDL, LDL-рецептора, рецептора белка 1, родственного LDL, ASGR1, ASGR2, белка-2, подобного белку-предшественнику амилоида (APLP2), апелинового рецептора (APLNR), миелинового и лимфоцитарного белка (MAL), IGF2R, Н+ АТФазы вакуолярного типа, рецептора дифтерийного токсина, фолатного рецептора, глутаматных рецепторов, глутатионового рецептора, лептиновых рецепторов, фагоцитарного рецептора А1-5 (SCARA1-5), SCARB1-3 и CD36; (ii) экспрессируется в нескольких типах тканей, например, CD63, MHC-I, Н+ АТФаза вакуолярного типа, IGF2R, интегрин альфа-7 (ITGA7), LRP5, LRP6, LRP8, Kremen-2, рецептор LDL, рецептор белка 1, родственного LDL, белок-2, подобный белку-предшественнику амилоида (APLP2), апелиновый рецептор (APLNR), PRLR, MAL (миелиновый и лимфоцитарный белок (MAL), рецепторы дифтерийного токсина, HBEGF (гепарин-связывающий фактор роста, подобный EGF), глутатионовые рецепторы, глутаматные рецепторы, лептиновые рецепторы и фолатные рецепторы, при этом у субъекта необязательно проявляются один или более симптомов болезни, выбранной из группы, состоящей из болезни Фабри, болезни Гоше, MPS I, MPS II, MPS IIIA, MPS IIIB, MPS HID, MPS IVB, MPS VI, MPS VII, MPS IX, болезни Помпе, дефицита лизосомной кислой липазы, метахроматической лейкодистрофии, болезни Ниманна-Пика типов А, В и С2, альфа-маннозидоза, дефицита нейраминидазы, сиалидоза, аспартилглюкозаминурии, комбинированного дефицита сапозинов, атипической болезни Гоше, липогранулематоза Фарбера, фукозидоза и бета-маннозидоза; (iii) преимущественно экспрессируется тканью кости и/или хряща, например коллаген X, интегрин альфа 10 (ITGA10), рецептор 3 фактора роста фибробластов (FGFR3), изоформа С рецептора фактора роста фибробластов (FGFR3C), белок 1, связывающий гиалуронан и протеогликан (CRTL1), аггрекан, коллаген II и Kremen-1, при этом у субъекта необязательно проявляются один или более симптомов болезни, выбранной из группы, состоящей из MPS I, MPS II, MPS IIIA, MPS IIIB, MPS HID, MPS IVA, MPS IVB, MPS VI, MPS VII, MPS IX, бета-маннозидоза, болезни Гоше, атипической болезни Гоше, комбинированного дефицита сапозинов, аспартилглюкозаминурии, липогранулематоза Фарбера, сиалидоза, дефицита нейраминидазы и альфа-маннозидоза; (iv) преимущественно экспрессируется моноцитами, макрофагами или микроглией, например фагоцитарный рецептор A1-5 (SCARA1-5), SCARB1-3, CD36, MSR1 (макрофагальный фагоцитарный рецептор 1), MRC1 (макрофагальный маннозный рецептор 1), VSIG4 (белок 4, содержащий домен V-набора и иммуноглобулина), CD68 (макросиалин) и CSF1R (рецептор колониестимулирующего фактора 1 макрофагов), при этом у субъекта необязательно проявляются один или более симптомов болезни, выбранной из группы, состоящей из дефицита лизосомной кислой липазы, болезни Гоше, атипичной болезни Гоше, комбинированного дефицита сапозинов и липогранулематоза Фарбера; (v) преимущественно экспрессируется клетками почек, например CDH16 (Cadhen-16), CLDN16 (Claudn-16), KL (Klotho), PTH1R (рецептор паратиреоидного гормона), SLC22A13 (семейство 22 транспортеров растворенных веществ, представитель 13), SLC5A2 (котранспортер 2 натрия/глюкозы) и UMOD (уромодулин), при этом у субъекта необязательно проявляются один или более симптомов или диагностировано заболевание, выбранное из группы, состоящей из болезни Фабри, синдрома Альпорта, поликистозной болезни почек и тромботической тромбоцитопенической пурпуры; (vi) преимущественно экспрессируется клетками печени, например ASGR1 или ASGR2, при этом у субъекта необязательно проявляются один или более симптомов или диагностировано заболевание, выбранное из группы, состоящей из дефицита лизосомной кислой липазы, болезни Гоше, MPS VI, MPS VII, MPS II, болезни Ниманна-Пика типов А, В и С2, сиалидоза, дефицита нейраминидазы, атипичной болезни Гоше, комбинированного дефицита сапозинов, липогранулематоза Фарбера; (vii) преимущественно экспрессируется клетками мышц, например BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерин, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергический рецептор (никотиновый) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14 В, содержащий богатый лейцином повтор), дистрогликан (DAG1) и POPDC3 (белок 3, содержащий домен Рореуе), при этом у субъекта необязательно проявляются один или более симптомов или диагностируется болезнь Помпе; (viii) выбран из группы, состоящей из ITGA7, CD9, CD63, ALPL2, MSR1, ASGR1, ASGR2 или PRLR; и/или (ix) представляет собой CD63. В некоторых вариантах осуществления домен доставки представляет собой одноцепочечный вариабельный фрагмент (scFv). В некоторых вариантах осуществления белок, связывающий рецептор клеточной поверхности (CSR) (CSR-BP), предусматривает аминокислотную последовательность с SEQ ID NO:2. В некоторых вариантах осуществления терапевтический белок содержит гидролазу. В некоторых вариантах осуществления терапевтический белок содержит гликозилазу. В некоторых вариантах осуществления терапевтический белок содержит гликозидазу. В некоторых вариантах осуществления терапевтический белок содержит альфа-глюкозидазу. В некоторых вариантах осуществления терапевтический белок содержит аминокислотную последовательность с SEQ ID NO:1, или SEQ ID NO: 13 или их фрагмент. В некоторых вариантах осуществления терапевтический белок содержит антитело к Абета или к тау. В некоторых вариантах осуществления полинуклеотид предусматривает последовательность нуклеиновой кислоты с SEQ ID NO: 11. В некоторых вариантах осуществления ферментный домен содержит альфа-глюкозидазу, и при этом уровни гликогена в любой ткани ЦНС у субъекта снижены в течение по меньшей мере девяти месяцев после лечения. В некоторых вариантах осуществления у субъекта имеется болезнь Помпе. В некоторых вариантах осуществления вводимая композиция, содержащая нуклеотид, обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, который составляет по меньшей мере 1 мкг/мл. В некоторых вариантах осуществления терапевтический белок содержит гликозидазу, такую как GAA (например, с SEQ ID NO:1) или GLA (например, UniProtKB №Р06280, аминокислоты 32-429, SEQ ID NO: 13), и пациент имеет болезнь Помпе или болезнь Фабри. В некоторых вариантах осуществления CSR-BP представляет собой антигенсвязывающий белок, который связывается с рецептором интернализации, таким как CD63 или ITGA7. В некоторых вариантах осуществления CSR-BP представляет собой молекулу scFv, которая связывает CD63. В некоторых вариантах осуществления CSR-BP представляет собой молекулу scFv, которая связывает ITGA7. В некоторых вариантах осуществления вектор для генной терапии представляет собой вектор на основе AAV, содержащий полинуклеотид, который кодирует слитый терапевтический белок, содержащий фрагмент, связывающий CD63, и GAA. В некоторых вариантах осуществления вектор для генной терапии представляет собой вектор на основе AAV, содержащий полинуклеотид, который кодирует слитый терапевтический белок, содержащий фрагмент, связывающий ITGA7, и GAA.
[17] В некотором варианте осуществления терапевтический белок содержит ферментный домен, представляющий собой GAA, и высокие уровни GAA в сыворотке крови поддерживаются в сыворотке крови пациента в течение по меньшей мере 12 недель после введения вектора для генной терапии. В некоторых вариантах осуществления терапевтический белок содержит фермент GAA, и уровни гликогена в ткани ЦНС у пациента значительно снижены. В некоторых вариантах осуществления терапевтический белок содержит фермент GAA, и уровни гликогена поддерживаются на уровнях, характерных для дикого типа, в течение 3 месяцев, 6 месяцев или 9 месяцев после введения вектора для генной терапии. В некоторых вариантах осуществления терапевтический белок содержит фермент GAA, и мышечная сила пациента после лечения восстанавливается до уровней, характерных для дикого типа.
[18] В одном аспекте настоящее изобретение предусматривает способ снижения степени накопления гликогена в ткани, в частности в ткани ЦНС, у субъекта-человека или отличного от человека субъекта путем введения вектора для генной терапии, содержащего полинуклеотид, который кодирует терапевтический белок, слитый с CSR-BP. В некоторых вариантах осуществления вектор для генной терапии вводится в дозе, достаточной для обеспечения порогового уровня терапевтического белка, слитого с CSR-BP, в сыворотке крови. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 1 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 2 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 3 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 4 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 5 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 6 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 7 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 8 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 9 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 10 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 11 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 12 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 13 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 14 мкг/мл. В некоторых вариантах осуществления пороговый уровень составляет по меньшей мере 15 мкг/мл. В одном варианте осуществления ткань представляет собой ткань мозжечка, спинного мозга или гиппокампа. В одном варианте осуществления субъект-человек или отличный от человека субъект имеет болезнь Помпе. В одном варианте осуществления терапевтический белок содержит слитый белок, содержащий scFv к CD63 и GAA. В другом варианте осуществления терапевтический белок содержит слитый белок, содержащий scFv к ITGA7 и GAA.
ГРАФИЧЕСКИЕ МАТЕРИАЛЫ
[19] На фигуре 1А схематически представлены мультидоменные терапевтические белки. На панели А изображен мультидоменный терапевтический белок, содержащий биспецифическое антитело (ii) и заместительный фермент (i). На панели В изображен слитый полипептид фермент-Fc (i), ассоциирующийся со специфическим в отношении эффектора интернализации полуантителом (ii) с образованием мультидоменного терапевтического белка. На панели С изображен заместительный фермент (шестиугольник), ковалентно связанный с С-концом тяжелой цепи антитела к эффектору интернализации. На панели D изображен заместительный фермент (шестиугольник), ковалентно связанный с N-концом тяжелой цепи антитела к эффектору интернализации. На панели Е изображен заместительный фермент (шестиугольник), ковалентно связанный с С-концом легкой цепи антитела к эффектору интернализации. На панели F изображен заместительный фермент (шестиугольник), ковалентно связанный с N-концом легкой цепи антитела к эффектору интернализации. На панели G изображен заместительный фермент (шестиугольник), ковалентно связанный с С-концом одноцепочечного вариабельного фрагмента (scFv), содержащего область VH (заштрихованный столбик) и область VL (незакрашенный столбик). На панели Н изображен заместительный фермент (шестиугольник), ковалентно связанный с двумя доменами scFv, где первый scFv (i) служит в качестве первого домена доставки, и второй scFv (ii) служит в качестве второго домена доставки. Дополнительные мультидоменные терапевтические белки, не показанные на фигуре 1А, включают без ограничения мультидоменные терапевтические белки, содержащие два или более доменов доставки и по меньшей мере один ферментный домен. В качестве неограничивающих примеров антитела, полутела и домены scFv, изображенные на панелях АН на данной фигуре, могут представлять собой любой тип домена доставки, и дополнительные домены доставки или заместительные ферменты также могут быть ассоциированы с тем, чтобы получить мультидоменный терапевтический белок. Неограничивающие примеры мультидоменных терапевтических белков, содержащих два или более доменов доставки, дополнительно изображены на фигурах 1С, 1D и 1F, которые включают заместительный фермент (изображен как, без ограничения, GAA), ковалентно связанный с первым полуантителом, специфическим в отношении эффектора интернализации, которое соединено со вторым слиянием специфического в отношении эффектора интернализации scFv-Fc, которое может или не может также быть ковалентно связанным с заместительным ферментом (изображен как, без ограничения, GAA), с образованием мультидоменного терапевтического белка (фигуры 1С и 1D), заместительный фермент (изображен как, без ограничения, GAA), ковалентно связанный с С-концом каждого из полуантитела, специфического в отношении эффектора интернализации, которое служит в качестве первого домена доставки, и слияния специфического в отношении эффектора интернализации scFv-Fc, которое служит в качестве второго домена доставки, где при этом как полуантитело, специфическое в отношении эффектора интернализации, и при этом связано вместе с образованием мультидоменного терапевтического белка (фигура 1D), так и заместительный фермент, ковалентно связанный с первым scFv, связан, например, посредством линкера, со вторым scFv (фигура 1F).
[20] На фигуре 1В представлены неограничивающие примерные иллюстрации векторов для генной терапии на основе AAV, каждый из которых кодирует мультидоменный терапевтический белок, представленный на панели G фигуры 1А, где scFv представляет собой scFv к CD63 человека, а заместительный фермент представляет собой GAA (например, scFv к hCD63::hGAA; см., например, аминокислотную последовательность, представленную под SEQ ID NO: 10). Аминокислоты 1-117 из SEQ ID NO: 10 предусматривают аминокислотную последовательность вариабельного домена тяжелой цепи (VH) антитела H4H12450N; аминокислоты 118-132 из SEQ ID NO: 10 предусматривают аминокислотную линкерную последовательность между вариабельными доменами тяжелой и легкой цепей H4H12450N; аминокислоты 133-240 из SEQ ID NO: 364 предусматривают аминокислотную последовательность вариабельного домена легкой цепи (VL) антитела H4H12450N; аминокислоты 241-245 из SEQ ID NO: 10 предусматривают аминокислотную линкерную последовательность между scFv к hCD63 и GAA; и аминокислоты 246-1128 из SEQ ID NO: 10 предусматривают аминокислотную последовательность заместительного фермента GAA или его биологически активную часть. Иллюстративные последовательности 5'ITR и 3'ITR соответственно представлены под SEQ ID NO: 6 и SEQ ID NO: 7. На панели А данной фигуры представлен иллюстративный вектор для специфической в отношении печени экспрессии, содержащий иллюстративный специфический в отношении печени энхансер (например, без ограничения, Serpina1; приведенный под SEQ ID NO: 9), иллюстративный специфический в отношении печени промотор (например, без ограничения, TTR; приведенный под SEQ ID NO: 8), иллюстративный сигнальный пептид; последовательность нуклеиновой кислоты, кодирующей мультитерапевтический домен scFv к hCD63::hGAA (SEQ ID NO: 10) и поли-А хвост. На панели В данной фигуры представлен иллюстративный вектор, аналогичный показанному на панели А, с иллюстративным промотором убиквитина вместо специфического в отношении печени энхансера и специфических в отношении печени промоторных последовательностей. На панели С данной фигуры представлен иллюстративный вектор, аналогичный показанному на панели А, с иллюстративным специфическим в отношении нейрона промотором вместо специфического в отношении печени энхансера (например, SerpinA1) и промотора (например, TTR). На панели D данной фигуры представлен иллюстративный вектор, аналогичный показанному на панели А, с иллюстративным специфическим в отношении нейрона промотором в комбинации со специфическим в отношении печени (например, SerpinA1) энхансером и промотором (например, TTR).
[21] На фигуре 1С представлены неограничивающие примерные иллюстрации векторов экспрессии, каждый из которых кодирует мультидоменный терапевтический белок согласно изображению, где полуантитело представляет собой антитело к CD63, scFv представляет собой scFv к рецептору транферрина человека, и где заместительный фермент представляет собой GAA (например, scFv к hTfR::hGAA).
[22] На фигуре 1D представлены неограничивающие примерные иллюстрации векторов экспрессии, каждый из которых кодирует мультидоменный терапевтический белок согласно изображению, где полуантитело представляет собой антитело к CD63, где scFv представляет собой scFv к рецептору транферрина человека (TfR), и Fc-домен представляет собой Fc IgG4 человека, и где заместительный фермент представляет собой GAA (например, scFv к hTfR::hGAA).
[23] На фигуре 1Е представлены неограничивающие примерные иллюстрации векторов экспрессии, каждый из которых кодирует мультидоменный терапевтический белок представленный на панели Н фигуры 1А, где один из двух scFv представляет собой scFv к CD63 человека, другой из двух scFv представляет собой scFv к рецептору трансферрина человека (TfR), и заместительный фермент представляет собой GAA (например, scFv к hCD63::hGAA::scFV к TfR).
[24] На фигуре IF представлены неограничивающие примерные иллюстрации векторов экспрессии, каждый из которых кодирует мультидоменный терапевтический белок согласно изображению, где один из двух scFv представляет собой scFv к CD63 человека, другой из двух scFv представляют собой scFv к рецептору трансферрина человека (TfR), и заместительный фермент представляет собой GAA (например, scFv к hCD63::scFV к TfR::GAA или scFV к TfR::scFv к hCD63::GAA).
[25] На фигуре 1G представлены неограничивающие примерные иллюстрации векторов экспрессии, каждый из которых кодирует мультидоменный терапевтический белок, который изображен на панели G фигуры 1А, где scFv представляет собой scFv к рецептору трансферрина человека (TfR), и заместительный фермент представляет собой GAA (например, scFV к TfR::GAA).
[26] Фигура 2 представляет собой столбчатую диаграмму, изображающую количество накопленного гликогена в микрограммах на миллиграмм ткани в зависимости от доставленного фермента. На оси X изображены ткани от мыши CD63hu/hu; GAA-/- слева направо: сердце, четырехглавая мышца, икроножная мышца, диафрагма, камбаловидная мышца и длинная мышца-разгибатель пальцев (EDL). Блоки дорожки 1 отображают количество накопленного гликогена в мышиной модели болезни Помпе, не подвергнутой обработке. Блоки дорожки 6 отображают количество накопленного гликогена в мышиной модели дикого типа, не подвергнутой обработке. Блоки линии 2 отображают количество накопленного гликогена в мышиной модели болезни Помпе, которую подвергали обработке с помощью AAV-hGAA (вектор на основе аденоассоциированного вируса, содержащий ген, кодирующий GAA человека) в дозе 1010 в. г. Блоки линии 3 отображают количество накопленного гликогена в мышиной модели болезни Помпе, которую подвергали обработке с помощью AAV-hGAA в дозе 1011 в. г. Блоки линии 4 отображают количество накопленного гликогена в мышиной модели болезни Помпе, которую подвергали обработке с помощью AAV с scFv к hCD63::hGAA (вектор на основе аденоассоциированного вируса, содержащий ген, кодирующий домен scFv к CD63 человека, связанный с GAA человека) в дозе 1010 в. г. Блоки линии 5 отображают количество накопленного гликогена в мышиной модели болезни Помпе, которую подвергали обработке с помощью AAV с scFv к hCD63::hGAA в дозе 1011 в. г.
[27] Фигура 3 представляет собой диаграмму, изображающую средний уровень гликогена, измеренный (мкг/мг) в скелетной мышечной ткани каждой мыши через 3 месяца после инъекции AAV. Каждое значение измерения наносили на график в виде зависимости от степени воздействия GAA (т.е. уровня в сыворотке крови) на каждую мышь, которую подвергали обработке с помощью конкретной конструкции на основе фермента в конкретной дозе. Закрашенные квадраты обозначают AAV-hGAA в дозе 1010 в. г. Закрашенные треугольники обозначают AAV-hGAA в дозе 1011 в. г. Закрашенные перевернутые треугольники обозначают AAV с scFv к hCD63::hGAA в дозе 1010 в. г. Закрашенные ромбы обозначают AAV с scFv к hCD63::hGAA в дозе 1011 в. г.
[28] Фигура 4 представляет собой точечный график, изображающий средний уровень гликогена в сердечной мышце, измеренный (мкг/мг) в ткани сердца через 3 месяца после инъекции AAV, в зависимости от степени воздействия GAA (т.е. уровней в сыворотке крови) на каждую мышь, которую подвергали обработке с помощью конкретной конструкции на основе фермента при конкретной дозе. Закрашенные квадраты обозначают AAV-hGAA в дозе 1010 в. г. Закрашенные треугольники обозначают AAV-hGAA в дозе 1011 в. г. Закрашенные перевернутые треугольники обозначают AAV с scFv к hCD63::hGAA в дозе 1010 в. г. Закрашенные ромбы обозначают AAV с scFv к hCD63::hGAA в дозе 1011 в. г.
[29] Фигура 5 представляет собой точечный график, изображающий титры антител к GAA через 3 месяца после инъекции AAV в зависимости от степени воздействия GAA (т.е. уровней в сыворотке крови) на каждую мышь, которую подвергали обработке с помощью конкретной конструкции на основе фермента при конкретной дозе. Незакрашенные квадраты обозначают AAV-hGAA в дозе 1010 в. г. Незакрашенные круги обозначают AAV-hGAA в дозе 1011 в. г. Незакрашенные ромбы обозначают AAV с scFv к hCD63::hGAA в дозе 1010 в. г. Шестиугольники обозначают AAV с scFv к hCD63::hGAA в дозе 1011 в. г.
[30] Фигура 6 представляет собой точечный график, изображающий титры антител к GAA через 3 месяца после инъекции AAV в зависимости от конструкции на основе фермента и дозы. Круги обозначают контрольных мышей, получающих пустой вектор на основе AAV. Квадраты обозначают AAV-hGAA в дозе 1010 в. г. Треугольники обозначают AAV-hGAA в дозе 1011 в. г. Перевернутые треугольники обозначают AAV с scFv к hCD63::hGAA в дозе 1010 в. г. Ромбы обозначают AAV с scFv к hCD63::hGAA в дозе 1011 в. г.
[31] Фигура 7А представляет собой линейный график, изображающий уровни GAA в сыворотке крови (произвольные единицы «a.u.»; ось Y) в зависимости от времени в неделях после инъекции вектора для генной терапии. Квадраты (нижняя линия) обозначают AAV-hGAA в дозе 1010 в. г. Треугольники (вторая линия сверху) обозначают AAV-hGAA в дозе 1011 в. г. Перевернутые треугольники (третья линия сверху) представляют собой AAV с scFv к hCD63::hGAA в дозе 1010 в. г. Ромбы (верхняя линия) обозначают AAV с scFv к hCD63::hGAA в дозе 1011 в. г.
[32] Фигура 7 В представляет собой гистограмму, изображающую соотношения mRNA (mRNA hGAA относительно mRNA mGADPH) после введения конструкций на основе AAV мышам CD63 HumIn с нокаутом GAA (мыши GAA-/-, CD63hu/hu) или мышам GAA+/+, CD63hu/hu таким образом: (1) необработанный контроль (2) AAV-специфический в отношении печени промотор-hGAA (1е10 в. г), (3) AAV-специфический в отношении печени промотор-hGAA (1e11 в. г. ), (4) AAV-специфический в отношении печени промотор-фрагмент, связывающий hCD63::hGAA (1e10 в. г.), (5) AAV-специфический в отношении печени промотор-фрагмент, связывающий hCD63::hGAA (1e11 в. г.) или (6) необработанный контроль (GAA+/+, CD63hu/hu). Экспрессия GAA в печени была обнаружена при всех инъекциях конструкции на основе AAV.
[33] Фигура 7С представляет собой график, на котором сравнивается уровень GAA в сыворотке крови с уровнем экспрессии РНК GAA у мышей, получающих AAV, кодирующий слитый белок (квадраты), и мышей, получающих AAV, кодирующий GAA (обе конструкции обеспечивали специфический в отношении печени промотор (LSP) для управления экспрессией).
[34] Фигура 7D представляет собой гистограмму, изображающую гепатоциты человека Huh-7, временно трансфицированные конструкциями, управляемыми специфическим в отношении печени промотором, кодирующими hGAA, scFv к hCD63::GAA (слитая конструкция) или контрольную несвязывающую слитую конструкцию scFv::GAA. Для обеих слитых конструкций scFv::GAA было характерным более высокое соотношение белка в секретируемом супернатанте, чем hGAA отдельно через 3 дня после трансфекции. Добавление М6Р в супернатант в течение экспериментального периода для уменьшения CI-MPR-опосредованного захвата не влияло на соотношение. (*=р<0,05, n=3).
[35] Фигура 7Е представляет собой столбчатую диаграмму, изображающую количество титра GAA в сыворотке крови в зависимости от доставленного вектора. На оси X изображена титры в сыворотке крови гуманизированных по CD63 мышей с нокаутом (GAA-/-; CD63hu/hu), которым вводили плазмиды, кодирующие GAA или слитый ScFv-GAA слева направо: 1) контроль (без обработки); 2) обработка с помощью AAV-LSP-hGAA (1e10 в. г. /мышь); 3) обработка с помощью AAV-LSP-hGAA (1e11 в. г. /мышь); 4) обработка с помощью AAV-LSP-фрагмент, связывающий CD63:: hGAA (1e10 в. г. /мышь) и 5) обработка с помощью AAV-LSP-фрагмент, связывающий CD63:: hGAA (1e11 в. г. /мышь).
[36] Фигура 8 представляет собой флуоресцентные микрофотографии, изображающие лизосомы, окрашенные по lampl в мышечных волокнах мыши, контрастно окрашенных с помощью DAPI для выявления ядер. На панелях А и А1 изображены клетки четырехглавой мышцы, полученные от необработанной мыши дикого типа (GAA+/+) и окрашенные по lamp1 (панель А) и ядру (панель А1). На панелях В и В1 изображены клетки четырехглавой мышцы, полученные от необработанной мыши с нокаутом по GAA (GAA-/-) и окрашенные по lamp1 (панель В) и ядру (панель В1). На панелях С и С1 изображены клетки четырехглавой мышцы, полученные от мыши GAA-/-, которую подвергали обработке с помощью конструкции на основе AAV-hGAA, и окрашенные по lamp1 (панель С) и ядру (панель С1). На панелях D и D1 изображены клетки четырехглавой мышцы, полученные от мыши GAA-/-, которую подвергали обработке с помощью конструкции на основе AAV с scFv к hCD63::hGAA, и окрашенные по lamp1 (панель D) и ядру (панель D1).
[37] На фигуре 9 изображены линейные графики, показывающие силу захвата и эффективность выполнения теста с вращающимся барабаном у мышей, обработанных с помощью либо AAV-LSP-hGAA, либо AAV-LSP-фрагмент, связывающий hCD63::hGAA. Измерения при ускорении вращающегося барабана (А) и измерения силы захвата передних конечностей (В) у мышей с GAA дикого типа (перевернутый треугольник), необработанного контроля (квадрат), мышей, обработанных с помощью AAV-LSP-hGAA (1e11 в. г. /мышь) (треугольник), или мышей, обработанных с помощью AAV-LSP-фрагмент, связывающий hCD63::hGAA (1e11 в. г. /мышь) (круг), проводили с месячными интервалами в течение 6 месяцев. Планки погрешностей представляют собой +/- SD. N=8-10 для всех групп.
[38] На фигуре 10А и фигуре 10В показано применение других мембранных белков в качестве направляющих, таких как слитые белки на основе scFv к ITGA7 (интегрин альфа-7), для направления GAA. На фигуре 10А показана активность GAA (ось Y) миобластов мыши С2С12, инкубированных в течение ночи с комплексом фрагмент, связывающий мышиный CD63, и GAA или комплексом фрагмент, связывающий мышиный ITGA7, и GAA св присутствии 5 мМ М6Р или без. На фигуре 10В показаны мыши с нокаутом GAA, гуманизированные по CD63 (GAA-/-; CD63hu/hu), которым вводили плазмиды, кодирующие формат scFv::GAA комплекса фрагмент, связывающий hCD63, и GAA (2) или формат полноразмерный IgG4::GAA фрагмента, связывающего интегрин альфа-7 мыши (3), путем гидродинамической доставки (HDD), затем уровни гликогена в ткани измеряли через 3 недели после HDD. Необработанные контрольные мыши GAA-/-; CD63hu/hu (1) и необработанные контрольные мыши с GAA дикого типа, GAA+/+; CD63hu/hu (4) также тестировали в отношении уровней гликогена в тех же тканях.
[39] На фигуре 11 проиллюстрирован сывороточный клиренс полноразмерного антитела к CD63, слитого с GAA (т.е. полноразмерное антитело IgG4), у мышей CD63hu/hu по сравнению с мышами CD63+/+ WT. Плазмиды, экспрессирующие тяжелую и легкую цепи антитела к CD63, слитые с GAA, инъецировали через хвостовую вену каждой мыши. Наблюдали, что сывороточный pK антитела к CD63 (IgG4 полной длины)::GAA выводится из сыворотки крови в течение 24 часов.
[40] Фигура 12А представляет собой точечный график, изображающий уровни GAA в сыворотке крови (произвольные единицы «a.u.»; ось Y) через один месяц после инъекции AAV как функция в зависимости от конструкции на основе фермента и дозы. Квадраты обозначают AAV-LSP-Δ8GAA. Треугольники обозначают AAV-scFv к hCD63::GAA. Обе конструкции обеспечивали специфический в отношении печени промотор (LSP) для управления экспрессией). Доза представлена в виде количества вирусного генома (в. г. ) на килограмм (кг) мыши.
[41] На фигуре 12В представлены результаты дот-блоттинга, изображающие уровни гликогена в микрограммах на миллиграмм ткани (сердце, квадрицепс, диафрагма или трицепс) в зависимости от уровня GAA в сыворотке крови. Квадраты обозначают AAV-LSP-Δ8GAA. Треугольники обозначают AAV-scFv к hCD63::GAA. Обе конструкции обеспечивали специфический в отношении печени промотор (LSP) для управления экспрессией).
[42] Фигура 13 представляет собой столбчатую диаграмму, изображающую количество накопленного гликогена в микрограммах на миллиграмм ткани ЦНС в зависимости от доставленного фермента/вектора (9-месячное исследование). На оси X изображены образцы каждой ткани ЦНС (спинной мозг, мозжечок или гиппокамп), взятые у мышей дикого типа, представляющих собой объект сравнения (каждая линия 4), или мышей с нокаутом (GAA-/-), которые не подвергались обработке (каждая линия 1) или которым вводили плазмиды, кодирующие GAA (каждая линия 2), или слитый ScFv-GAA (каждая линия 3). Неожиданное обнаружение состояло в том, что мыши, обработанные с помощью слитого белка, демонстрировали более сильное снижение содержания гликогена, накапливающегося в ткани ЦНС, по сравнению с доставкой вектора, кодирующего GAA без какого-либо слитого связывающего домена.
[43] Фигура 14А представляет собой диаграмму, изображающую количество накопленного гликогена на мг ткани спинного мозга (мкг гликогена/мг ткани; ось Y) через 3 месяца после доставки GAA посредством AAV в конкретной векторной конструкции при конкретной дозе (в. г. =вирусные геномы). Уровни гликогена приведены для мышей дикого типа (линия 1; ось X) по сравнению с мышами с нокаутом (GAA-/-), которые не подвергались обработке (линия 2; ось X) или которым вводили плазмиды, кодирующие GAA (каждая линия 3; ось X), или различные дозы слитого белка, предусматривающего scFv к CD63 и GAA (линии 4-6; ось X). Уровни накопленного гликогена в спинном мозге снижались при увеличении дозы слитого ScFv-GAA, при этом доза 1e11 в. г. обеспечивала большую благоприятную пользу для субъекта, чем эквивалентная доза только GAA (без слияния).
[44] Фигура 14В представляет собой диаграмму, изображающую количество накопленного гликогена на мг ткани головного мозга (мкг гликогена/мг ткани; ось Y) через 3 месяца после доставки GAA посредством AAV в конкретных векторных конструкциях при конкретной дозе (в. г. =вирусные геномы). Уровни гликогена приведены для мышей дикого типа (линия 1; ось X) по сравнению с мышами с нокаутом (GAA-/-), которые не подвергались обработке (линия 2; ось X) или которым вводили плазмиды, кодирующие GAA (каждая линия 3; ось X), или различные дозы слитого белка, предусматривающего ScFv к CD63 и GAA (линии 4 6; ось X). Уровни накопленного гликогена в головном мозге снижались при увеличении дозы слитого ScFv-GAA, при этом доза 1e11 в. г. обеспечивала большую благоприятную пользу для субъекта, чем эквивалентная доза только GAA (без слияния).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[45] Настоящее изобретение не ограничено описанными конкретными вариантами осуществления, композициями, способами и условиями эксперимента, поскольку такие варианты осуществления, композиции, способы и условия могут варьировать. Терминология, используемая в данном документе, предназначена только для целей описания конкретных вариантов осуществления и не предназначена быть ограничивающей, поскольку объем настоящего изобретения будет ограничиваться только прилагаемой формулой изобретения.
[46] Хотя при практическом осуществлении или тестировании настоящего изобретения можно применять любые способы и материалы, аналогичные описанным в данном документе или эквивалентные им, в данном документе описаны лишь некоторые предпочтительные способы и материалы. Все публикации, упомянутые в данном документе, включены в данный документ в полном объеме посредством ссылки. Если не определено иное, то все технические и научные термины, используемые в данном документе, имеют такое же значение, как это обычно понимает специалист в области техники, к которой принадлежит настоящее изобретение.
[47] «Гематоэнцефалический барьер» относится к полупроницаемому мембранному барьеру, отделяющему кровь от головного мозга и внеклеточной жидкости в центральной нервной системе. Барьер блокирует проход или избирательно транспортирует определенные вещества в головной мозг и спинной мозг. Гематоэнцефалический барьер образуется эндотелиальными клетками головного мозга.
[48] «Терапевтически эффективное количество» относится к количеству или дозе вектора, доставляемого субъекту таким образом, что у субъекта достигается стабильный уровень кодируемого терапевтического белка в крови (уровень в сыворотке/плазме крови). В целом, в способе можно применять концентрации вектора от приблизительно 1×109 до приблизительно 1×1016 геномов. Доза для доставки в печень может составлять приблизительно от 1×1010 до 5×1013 геномов AAV на 1 кг. Дозу будут корректировать для установления равновесия между терапевтически благоприятным эффектом проникания через гематоэнцефалический барьер с достижением требуемого эффекта молекулы и любыми побочными эффектами, и такие дозы могут варьировать в зависимости от используемого рекомбинантного вектора. Уровни экспрессии трансгена можно мониторить в кровотоке путем удаления части сыворотки крови или плазмы крови для определения частоты введения доз векторов, которые обеспечат достижение равновесной концентрации циркулирующего белка. Специалист в данной области может определить конкретные значения для эффективного количества, например, путем проведения экспериментов для определения стабильных уровней терапевтического белка в крови в течение нескольких последовательных дней, недель или месяцев после доставки вектора. Подходящие эксперименты для тестирования циркулирующего терапевтического белка известны из уровня техники, в том числе без ограничения вестерн-блоттинг, ELISA, LC-MS и т.д. В одном примере терапевтически эффективное количество слитого белка scFv-GAA в ЦНС представляет собой количество вирусного вектора, который продуцирует достаточное количество слитого белка scFv-GAA для уменьшения содержания накопленного гликогена в ткани ЦНС, например в ткани спинного мозга, мозжечка или гиппокампа.
Нарушения ЦНС
[49] Может обеспечиваться благоприятный эффект в отношении различных нарушений, связанных с головным мозгом, в зависимости от способа доставки терапевтических белков, описанных в данном документе. Нарушения ЦНС и нарушения с неврологическими симптомами, которые поддаются лечению белковыми терапевтическими средствами, включают без ограничения: больезнь Альцгеймера, рак головного мозга, болезнь Бехчета, церебральную системную красную волчанку, болезнь Крейтцфельда-Якоба, деменцию, эпилепсию, энцефалит, атаксию Фридрейха, синдром Гийена-Барре, болезнь Гоше, головную боль, гидроцефалию, болезнь Хантингтона, внутричерепную гипертензию, лейкодистрофию, мигрень, миастению гравис, мышечную дистрофию, рассеянный склероз, нарколепсию, невропатию, синдром Прадера-Вилли, болезнь Паркинсона, синдром Ретта, синдром беспокойных ног, нарушения сна, субарахноидальное кровоизлияние, инсульт, черепно-мозговую травму, невралгию тройничного нерва, транзиторную ишемическую атаку и синдром фон Гиппеля-Линдау (ангиоматоз).
[50] Доставка слитого терапевтического белка, связывающегося с антителом к CD63, в ЦНС, может быть особенно предпочтительной вследствие его повсеместной экспрессии, его роли в качестве мембранного белка внеклеточных везикул (EV; например, экзосомы) и ассоциации с интегринами. Другие рецепторы клеточной поверхности с подобными свойствами в качестве эффекторов интернализации включают: ITGA7, CD9, CD63, CD81, CD82 и CD151 и могут быть тканеспецифическими или специфическими в отношении типа клеток с целью усилить требуемую локализацию поглощения, которое рассматривается по всему описанию.
[51] Также было показано, что доставка слитого терапевтического белка, связывающегося с антителом к трансферрину, в ЦНС является особенно предпочтительной. Транспорт и доставка терапевтических белков, таким образом, будет усиливаться с помощью механизмов доставки, таких как слияние с антителом к рецептору конкретных мишеней гематоэнцефалического барьера (ВВВ). Было показано, что некоторые мишени ВВВ являются предпочтительными для поглощения ЦНС (Zuchero, et al., 6 January 2016, Neuron, 89(1): 70-82; Boado, RJ et al., Mol Pharm. 2014 Aug 4; 11(8): 2928-2934; каждая из которых включена в данный документ в полном объеме посредством ссылки). Другие рецепторы клеточной поверхности с подобными к рецепторам трансферрина свойствами поглощения ВВВ, включают без ограничения: рецептор инсулина, CD98 и басигин (Bsg).
[52] В некоторых вариантах осуществления используют нацеленную доставку терапевтического белка в ткани ЦНС (например, головной мозг) с применением антитела к рецептору трансферрина, или антитела к рецептору инсулина, или антитела к CD98, или антитела к Bsg. Терапевтический белок также может быть слит с антителом, представляющим собой эффектор интернализации, которые обсуждаются по всему описанию. В некоторых вариантах осуществления используется нацеленная доставка терапевтического белка в ЦНС и периферийные ткани с использованием домена доставки антитела к рецептору инсулина, например, для усиления поглощения, как в головном мозге, так и в периферических тканях (Boado, RJ et al., 2014, выше; Yu et al., 25 May 2011, Science Transl Med. 3:84ra44, каждая из которых включена в данный документ в полном объеме посредством ссылки).
[53] Иллюстративные антитела к рецептору трансферрина, рецептору инсулина, к CD98 и к Bsg и их части, которые можно применять в качестве части мультидоменного терапевтического белка, описанного в данном документе, хорошо известны из уровня техники (см., например, US20170174778; US20150196663; US9629801; US20180002433; WO2016081643; US20180134797; WO2014189973; US20150110791; US9708406; US20170260292; WO2016081640; US20180057604; US9611323; WO2012075037; WO2018210898, US20180344869, US20180282408, US20170051071, WO2016207240, WO2015101588, US20160324984; US20180222993; WO2017055542; US20180222992; WO2017055540; Cabezon, I., et al. Mol Pharm. 2015 Nov 2; 12(11):4137-45; Yu YJ, et al. Sci Transl Med (2014) 6:261ra154; Couch, et al. Sci Transl Med. 2013 May 1;5(183):183ra57, 1-12 и Yu et al., 2011, выше, в отношении неограничивающих иллюстративных антител к рецептору трасферрина; см., например, WO2017214456, WO2017214458, WO2017214462; WO2008017828; WO2015146132; WO2016094566; WO2013078377; WO2017026497; Hayes GM et al. Int. J. Cancer (2015) 137:710-20 и Bixby, et al. American Society Hematology 2015 Meeting, Abstract# 3809 в отношении неограничивающих иллюстративных антител к CD98; см., например, WO2011112566; US20110223176; US20140079711; WO2010036460; US8618264; WO2005092381; WO2018165619 и WO2017186182 в отношении неограничивающих иллюстративных антител к BSG; см., например, US8974791; WO2013081706; US20160152719; US20160208006; US20170114152; Pardridge, WM et al. BioDmgs. Apr 2018;32(2): 169-176; Boado RJ et al. Mol. Pharm. (2016) 13:3241-6; Cieniewicz AM, et al. Diabetes (2017) 66:206 217; Bexwada, P. et al. J Pharmacol Exp Ther. 2016;356(2):466-73 и Bedinger, DH, et al. J Pharmacol Exp Ther. 2015 Apr;353(1):35-3 в отношении неограничивающих иллюстративных антител к рецептору инсулина; ссылка каждого из которых включена в данный документ в полном объеме посредством ссылки). Специалист в данной области может легко обеспечивать связывание этих хорошо известных антител или их антиген связывающих частей (например, scFv, полученные из них) с терапевтическим белком, описанным в данном документе, для получения и применения мультидоменного терапевтического белка, описанного в данном документе.
Лизосомные болезни накопления
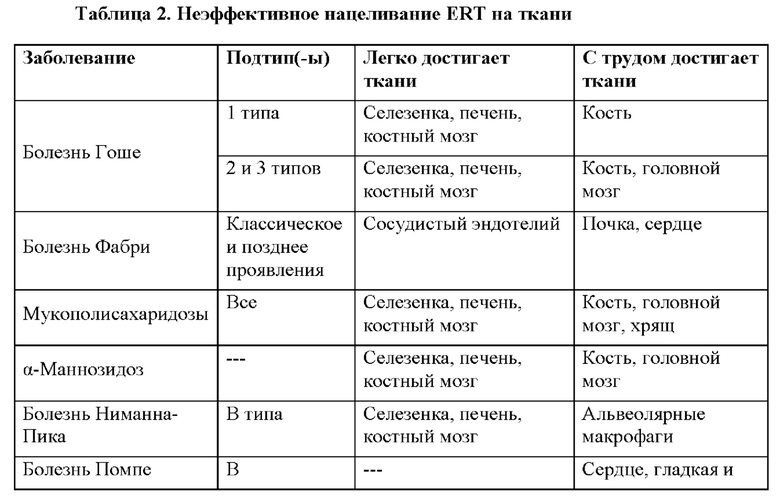
[54] «Заболевания, связанные с дефицитом ферментов» включают нелизосомные болезни накопления, такие как болезнь Краббе (галактозилцерамидаза), фенилкетонурия, галактоземия, болезнь кленового сиропа, митохондриальные нарушения, атаксия Фридрейха, синдром Зеллвегера, адренолейкодистрофия, болезнь Вильсона, гемохроматоз, дефицит орнитинтранскарбамилазы, метилмалоновая ацидемия, пропионовая ацидемия, и лизосомные болезни накопления. Термин «лизосомные болезни накопления» включает любое нарушение, возникшее в результате дефекта функции лизосомы. На данный момент идентифицировали приблизительно 50 лизосомных болезней накопления, наиболее известные из которых включают болезнь Тея-Сакса, болезнь Гоше и болезнь Ниманна-Пика. Патогенез этих заболеваний объясняют накоплением продуктов неполного разрушения в лизосоме, обычно из-за утраты белковой функции. Лизосомные болезни накопления вызываются утратой функции или истощением вариантов в белках, чья нормальная функция заключается в разрушении или координации разрушения лизосомного содержимого. Белки; связанные с лизосомными болезнями накопления, предусматривают ферменты, рецепторы и другие трансмембранные белки (например, NPC1), посттрансляционные модифицирующие белки (например, сульфатаза), белки переноса через мембрану, а также неферментные кофакторы и другие растворимые белки (например, ганглиозидный активатор GM2). Таким образом, лизосомные болезни накопления охватывают больше нарушений помимо тех нарушений, которые вызваны дефектными ферментами per se, и включают в себя любое нарушение, вызванное любым молекулярным дефектом. Таким образом, используемый в данном документе термин «фермент» охватывает те другие белки, ассоциированные с лизосомными болезнями накопления.
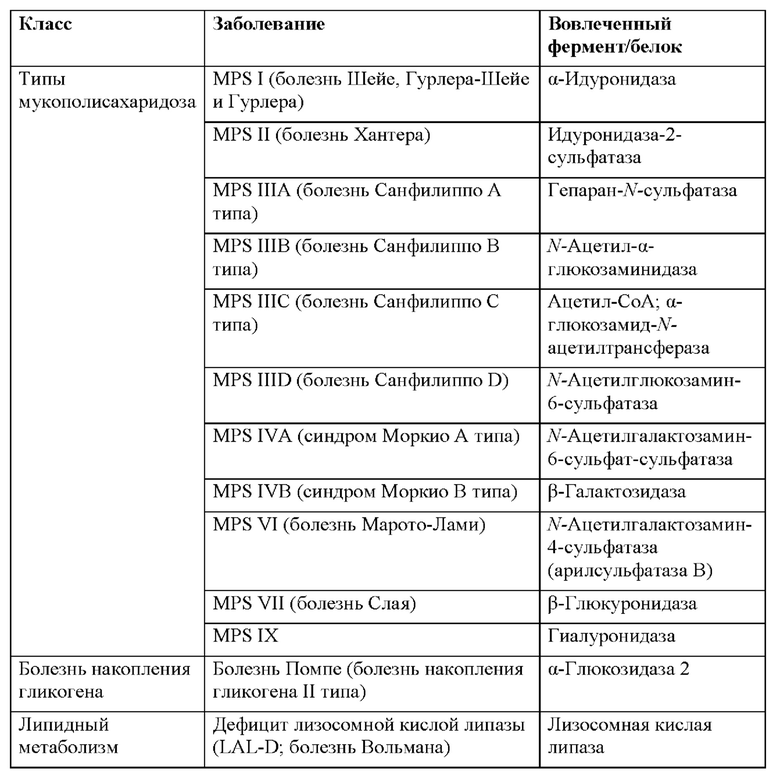
[55] Природа молекулярного повреждения влияет на тяжесть заболевания во многих случаях, т.е. полная утрата функции, как правило, ассоциирована с пренатальным или неонатальным проявлением и предусматривает тяжелые симптомы; частичная утрата функции ассоциирована с менее выраженным (относительно) и более поздним проявлением заболевания. Как правило, требуется восстановить только небольшое процентное отношение активности, чтобы исправить метаболические дефекты в дефицитных клетках. В таблице 1 перечисляются некоторые из более распространенных лизосомных болезней накопления и белки, ассоциированные с утратой функции при них. Лизосомные болезни накопления, как правило, описаны у Desnick and Schuchman, 2012.
[56] Лизосомные болезни накопления составляют класс редких заболеваний, которые влияют на разрушение многочисленных субстратов в лизосоме. Такие субстраты включают в себя сфинголипиды, мукополисахариды, гликопротеины, гликоген и олигосахариды, которые могут накапливаться в клетках больных, что приводит к смерти клеток. Органы, поражаемые лизосомными болезнями накопления, включают в себя центральную нервную систему (ЦНС), периферическую нервную систему (ПНС), легкие, печень, кость, скелетную и сердечную мускулатуру и ретикулоэндотелиальную систему.
[57] Варианты лечения лизосомных болезней накопления включают заместительную ферментную терапию (ERT), субстрат-редуцирующую терапию, фармакологическую шаперон-опосредованную терапию, терапию с трансплантацией гемопоэтических стволовых клеток и генную терапию. Пример субстрат-редуцирующей терапии включает в себя применение миглустата или элиглустата для лечения болезнь Гоше 1 типа. Эти лекарственные средства действуют путем блокирования активности синтазы, что снижает последующее продуцирование субстрата. Терапию с использованием гемопоэтических стволовых клеток (HSCT), например, используют для облегчения и замедления негативного фенотипа центральной нервной системы у пациентов с некоторыми формами MPS. См. R.M. Boustany, «Lysosomal storage diseases-the horizon expands», 9(10) Nat. Rev. Neurol. 583-98, Oct. 2013; ссылка для которого включена в данный документ в полном объеме посредством ссылки. В таблице 1 приводятся некоторые лизосомные болезни накопления и ассоциированные с ними ферменты или другие белки.
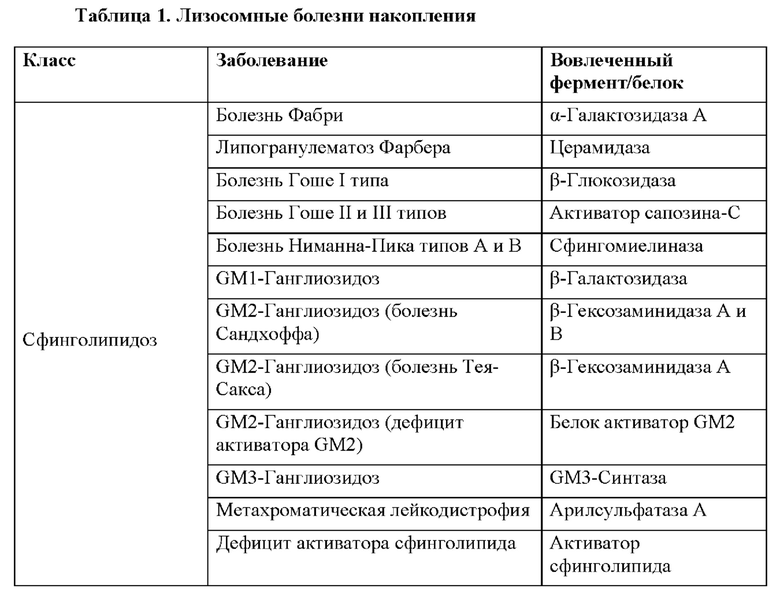
[58] Двумя наиболее распространенными LSD являются болезнь Помпе и болезнь Фабри. Болезнь Помпе, уровень заболеваемости которой, по оценкам, составляет 1 на 10000, вызывается дефектным лизосомным ферментом альфа-глюкозидазой (GAA), который приводит к недостаточному процессингу лизосомного гликогена. Накопление лизосомного гликогена происходит преимущественно в скелетной, сердечной и печеночной тканях. Раннее проявление болезни Помпе вызывает кардиомегалию, гипотонию, гепатомегалию и смерть вследствие кардиореспираторной недостаточности, обычно в возрасте до 2 лет. Проявление болезни Помпе во взрослом возрасте наблюдается только от двадцати до шестидесяти лет и обычно затрагивает только скелетную мускулатуру. Доступные в настоящее время средства для лечения включают MYOZYME®/LUMIZYME® (алглюкозидаза альфа) от Genzyme, который представляет собой рекомбинантную человеческую альфа-глюкозидазу, которую получают в клетках СНО и которую вводят посредством внутривенной инфузии.
[59] Болезнь Фабри, общий уровень заболеваемости которой, включая легкие случаи с поздним началом, по оценкам, составляет 1 на 3000, вызывается дефектным лизосомным ферментом альфа-галактозидазой A (GLA), который приводит к накоплению глоботриаозилцерамида в кровеносных сосудах и других тканях и органах. Симптомы, ассоциированные с болезнью Фабри включают в себя боль из-за повреждения нерва и/или обструкции небольших сосудов, почечную недостаточность и полное разрушение, сердечные осложнения, такие как высокое кровяное давление и кардиомиопатия, дерматологические симптомы, такие как образование ангиокератомы, ангидроз или гипергидроз, а также глазные проблемы, такие как воронковидная кератопатия, клиновидная катаракта и сосудистые нарушения конъюктивы и сетчатки. Доступные в настоящее время средства для лечения включают FABRAZYME® (агалзидаза бета) от Genzyme, который представляет собой рекомбинантную человеческую альфа-галактозидазу А, которую получают в клетках СНО и которую вводят посредством внутривенной инфузии; REPLAGAL™ (агалзидаза альфа) от Shire, который представляет собой рекомбинантную человеческую альфа-галактозидазу А, которую получают в клетках фибробластов человека и которую вводят посредством внутривенной инфузии; и GALAFOLD™ (мигаластат или 1-дезоксигалактоноджиримицин) от Amicus, который представляет собой низкомолекулярный шаперон для перорального введения, который обеспечивает сдвиг фолдинга альфа-галактозидазы А от аномальной к функциональной конформации.
[60] Текущие способы лечения лизосомных болезней накопления не особо оптимальны. Например, ERT, как правило, должна вводиться с высокой частотой и при высокой дозе, например дважды в неделю и до 40 мг/кг. Также некоторые замещаемые ферменты могут быть иммунологически перекрестнореагирующими (CRIM), стимулирующими продуцирование IgG у субъекта и, таким образом, препятствующими доставке фермента в лизосому посредством манноза-6-фосфатного (М6Р) рецептора. IgG может экранировать остатки М6Р заместительного фермента, и комплекс антиген-IgG-антитело может попадать в клеточные лизосомы через Fc-рецептор с шунтированием тем самым заместительного фермента преимущественно в макрофаги.
[61] Доставка заместительных ферментов в соответствующие пораженные ткани также неэффективна (см. таблицу 2 и Desnick & Schuchman, «Enzyme replacement therapy for lysosomal diseases: lessons from 20 years of experience and remaining challenges», 13 Annu. Rev. Genomics Hum. Genet. 307-35, 2012), ссылка на которую включена в данный документ в полном объеме посредством ссылки. Например, пациенты, подвергшиеся длительной заместительной ферментной терапии в отношении болезни Помпе в младенческом возрасте, все равно могут страдать гиперназальной речью, остаточной мышечной слабостью, птозом, остеопенией, потерей слуха, подвергаться риску аспирации, дисфагией, сердечной аритмией и затруднением при глотании. Дозы заместительного фермента часто должны увеличиваться со временем до 40 мг/кг раз в неделю или раз в две недели.

[62] Эндогенный манноза-6-фосфатный рецептор (MPR) опосредует транспорт большинства рекомбинантных ферментов в лизосому. Существуют две комплементарных формы MPR: катион-независимый (CI-MPR) и катион-зависимый (CD-MPR). У нокаутов по любой из форм не секретируются лизосомные ферменты. Лизосомные гидролазы синтезируются в эндоплазматическом ретикулуме и перемещаются в сеть цис-стороны аппарата Гольджи, где они ковалентно модифицируются путем добавления манноза-6-фосфатных (М6Р) групп.Образование данного маркера зависит от последовательного эффекта двух лизосомных ферментов: UDP-N-ацетилглюкозамин-1-фосфотрансферазы (G1cNac-фосфотрансфераза) и N-ацетилглюкозамин-1-фосфодиэстер-α-N-ацетил-глюкозаминидазы (экспонирующий фермент). G1cNac-фосфотрансфераза катализирует перенос G1cNAc-1-фосфатного остатка от UDP-G1cNAc в С6 положения выбранных манноз в высокоманнозных олигосахаридах гидролаз. Затем экспонирующий фермент удаляет концевой G1cNAc, экспонируя сигнал распознавания М6Р. В сети транс-Гольджи сигнал М6Р обеспечивает сегрегацию лизосомных гидролаз от всех других типов белков посредством селективного связывания с М6Р-рецепторами. Покрытые клатрином везикулы давали отпочковывание от транс-сети Гольджи и сливались с поздними эндосомами. При низком рН в поздней эндосоме гидролазы диссоциируются от М6Р-рецепторов, и пустые рецепторы возвращаются в аппарат Гольджи для следующих раундов транспорта.
[63] За исключением β-глюкоцереброзидазы, которая доставляется посредством маннозного рецептора, рекомбинантные лизосомные ферменты предусматривают М6Р-гликозилирование и доставляются в лизосому главным образом посредством CI-MPR/IGF2R. Опосредованная гликозилированием/CI-MPR доставка заместительного фермента, однако, не достигает всех клинически релевантных тканей (таблица 2). Улучшение заместительной ферментной терапии акцентировали на улучшении доставки CI-MPR с помощью (i) усиления экспрессии CI-MPR на поверхности с использованием β2-агониста кленбутерола (Koeberl et al., «Enhanced efficacy of enzyme replacement therapy in Pompe disease through mannose-6-phosphate receptor expression in skeletal muscle», 103(2) Mol. Genet. Metab. 107-12, 2011, ссылка на которую включена в данный документ в полном объеме посредством ссылки), (ii) повышения количества остатков М6Р в ферменте (Zhu et al., «Conjugation of mannose-6-phosphate-containing oligosaccharides to acid alpha-glucosidase improves the clearance of glycogen in Pompe mice», 279(48) J. Biol. Chem. 50336-1, 2004, ссылка на которую включена в данный документ в полном объеме посредством ссылки) или (iii) слияния домена IGF-II с ферментом (Maga et al., «Glycosylation-independent lysosomal targeting of acid alpha-glucosidase enhances muscle glycogen clearance in Pompe mice», 288(3) J. Biol. Chem. 1428 38, 2013, ссылка на которую включена в данный документ в полном объеме посредством ссылки).
[64] При лечении большого количества лизосомных болезней накопления с помощью заместительной ферментной терапии или генной терапии получают неудовлетворительный результат в основном из-за недостаточно эффективного нацеливания заместительного фермента на соответствующие ткань или орган, отрицательных иммунологических реакций у хозяина-реципиента и низкого значения времени полужизни в сыворотке крови. Существует потребность в улучшенных способах заместительной ферментной терапии, которые усилят и обеспечат лучшее биораспределение в ткани и поглощение фермента лизосомой, особенно в головном мозге и спинном мозге, без нежелательных субарахноидальных введений. Заявители разработали улучшенную заместительную ферментную терапию с использованием контролируемой связывающим белком CI-MPR-независимой доставки ферментов и экспрессии в печени для обеспечения фермента в лизосоме целевых пораженных тканей, в частности тканей ЦНС.
[65] Лизосомные болезни накопления могут быть систематизированы по типу продукта, который накапливается в дефектной лизосоме. Сфинголипидоз представляет собой класс заболеваний, которые влияют на метаболизм сфинголипидов, которые являются липидами, содержащими жирные кислоты, соединенные с алифатическими аминоспиртами (обзор в S. Hakomori, «Glycosphingolipids in Cellular Interaction, Differentiation, and Oncogenesis», 50 Annual Review of Biochemistry 733-764, July 1981, ссылка на которую включена в данный документ в полном объеме посредством ссылки). Накопленные продукты сфинголипидоза включают в себя ганглиозиды (например, заболевание Тея-Сакса), гликолипиды (например, заболевание Фабри) и глюкоцереброзиды (например, заболевание Гоше).
[66] Мукополисахаридозы представляют собой группу заболеваний, которые влияют на метаболизм глюкозаминогликанов (GAGS или мукополисахаридов), которые представляют собой длинные неразветвленные цепи повторяющихся дисахаридов, которые помогают строить кость, хрящ, сухожилия, роговицу, кожу и соединительную ткань (обзор в J. Muenzer, «Early initiation of enzyme replacement therapy for the mucopolysaccharidoses», 111(2) Mol. Genet. Metab. 63-72 (Feb. 2014); Sasisekharan et al., «Glycomics approach to structure-function relationships of glycosaminoglycans», 8(1) Ann. Rev. Biomed. Eng. 181-231 (Dec. 2014); ссылка на которую включена в данный документ в полном объеме посредством ссылки). Накопленные продукты мукополисахаридоза включают в себя гепарана сульфат, дерматана сульфат, кератина сульфат, различные формы хондроитина сульфата и гиалуроновую кислоту. Например, синдром Моркио А типа обуславливается дефектом в лизосомном ферменте галактоза-6-сульфат-сульфатаза, который приводит к накоплению кератина сульфата и хондроитин-6-сульфата в лизосомах.
[67] Болезни накопления гликогена (также известные как гликогеноз) являются результатом неспособности клетки к метаболизму (к созданию или разрушению) гликогена. Метаболизм гликогена модерируется различными ферментами или другими белками, в том числе глюкоза-6-фосфатазой, кислой альфа-глюкозидазой, линеаризирующим гликоген ферментом, разветвляющим гликоген ферментом, мышечной гликогенфосфорилазой, печеночной гликогенфосфорилазой, мышечной фосфофруктокиназой, киназой фосфорилазы, переносчиком глюкозы, альдолазой А, бета-энолазой и гликогенсинтазой. Типичной болезнью лизосомного накопления/накопления гликогена является болезнь Помпе, при которой дефектная кислая альфа-глюкозидаза вызывает накопление гликогена в лизосомах. Симптомы включают гепатомегалию, мышечную слабость, сердечную недостаточность, а в случае инфантильного варианта смерть в возрасте до 2 лет (см. DiMauro and Spiegel, «Progress and problems in muscle glycogenosis», 30(2) Acta Myol. 96-102 (Oct. 2011), ссылка на которую включена в данный документ в полном объеме посредством ссылки).
[68] «Мультидоменный терапевтический белок» предусматривает (i) один белок, который содержит более чем один функциональный домен, (ii) белок, который содержит более чем одну полипептидную цепь, и (iii) смесь из более чем одного белка или более чем одного полипептида. Термин «полипептид», как правило, означает отдельную цепь аминокислот, соединенных вместе пептидными связями. Термин «белок» охватывает термин «полипептид», но также включает в себя более сложные структуры. То есть отдельный полипептид является белком, и белок может содержать один или более полипептидов, ассоциированных в структуру более высокого порядка. Например, гемоглобин является белком, содержащим четыре полипептида: два альфа-глобиновых полипептида и два бета-глобиновых полипептида. Миоглобин также является белком, но он содержит только один миоглобиновый полипептид.
[69] Мультидоменный терапевтический белок содержит один или более из полипептида(-ов) и по меньшей мере два домена, выполняющих две функции. Один из этих доменов представляет собой «ферментный домен», который обеспечивает замещение активности дефектного белка, ассоциированного с заболеванием, связанным с дефицитом ферментов. Другой из этих доменов представляет собой «домен доставки», который обеспечивает связывание с эффектором интернализации. Таким образом, один полипептид, который обеспечивает замещение активности фермента и способность связываться с эффектором интернализации (также известный, как белок, связывающий эффектор интернализации (активность домена доставки), представляет собой Мультидоменный терапевтический белок. Также смесь белков, где один белок предусматривает ферментативную функцию, а другой белок предусматривает активность связывания с эффектором интернализации, представляет собой Мультидоменный терапевтический белок. На фигуре 1А изображены различные примеры мультидоменных терапевтических белков. В одном примере (фигура 1А, панель А) мультидоменный терапевтический белок содержит фермент (представленный шестиугольником) и биспецифическое антитело (IE-BP), которое связывает фермент (пунктирные линии) и эффектор интернализации (сплошные линии). В данном случае одно плечо биспецифического антитела нековалентно связывается с ферментом, а другое плечо нековалентно связывается с эффектором интернализации, тем самым обеспечивая интернализацию заместительного фермента в клетку или субклеточный компартмент. В другом примере (панель В) мультидоменный терапевтический белок предусматривает один белок, содержащий два полипептида, при этом один полипептид обладает функцией фермента, а другой обладает функцией домена доставки. В данном случае фермент слит с Fc-доменом иммуноглобулина или константной областью тяжелой цепи, которая ассоциируется с Fc-доменом полуантитела к ферменту, с образованием бифункционального мультидоменного терапевтического белка. Вариант осуществления, изображенный на панели В, аналогичен таковому на панели А, за исключением того, что фермент ковалентно присоединен к одному из полуантител, а не посредством взаимодействия антиген-антитело по вариабельному домену иммуноглобулина полуантитела.
[70] В других примерах мультидоменный терапевтический белок состоит из фермента, ковалентно связанного (непосредственно или опосредованно с помощью линкера) с доменом доставки. В одном варианте осуществления фермент присоединен к С-концу молекулы иммуноглобулина (например, к тяжелой цепи или, в качестве альтернативы, к легкой цепи). В других вариантах осуществления фермент присоединен к N-концу молекулы иммуноглобулина (например, к тяжелой цепи или, в качестве альтернативы, к легкой цепи). В данных примерах молекула иммуноглобулина представляет собой домен доставки. В еще одном варианте осуществления фермент присоединен к С-концу молекулы scFv, которая связывает эффектор интернализации.
[71] В одном варианте осуществления мультидоменный терапевтический белок содержит по меньшей мере два, а в некоторых вариантах осуществления не более двух, домена доставки, каждый из которых направлен в отношении отдельных эпитопов либо на одном и том же антигене, либо на двух разных антигенах. В одном варианте осуществления первый домен доставки связывается с молекулой лизосомального транспорта, или другим эффектором интернализации (например, CD63), или другим подобным рецептором клеточной поверхности, таким как ITGA7, CD9, CD63, CD81, CD82, или CD151. В другом варианте осуществления второй домен доставки связывается с эффектором трансцитоза для обеспечения трансклеточного транспорта мультидоменного терапевтического белка. В одном варианте осуществления эффектор трансцитоза представляет собой, среди прочего, рецептор LDL, рецептор IgA, рецептор трансферрина или неонатальный Fc-рецептор (FcRn). В конкретном варианте осуществления домен доставки, обеспечивающий трансцитоз, предусматривает молекулу, которая связывается с рецептором трансферрина, такую как, например, антитело к рецептору трансферрина или молекула scFv к рецептору трансферрина. Публикация Tuma and Hubbard, «Tran scytosis: Crossing Cellular Barriers», Physiological Reviews, 83(3): 871-935 (1 июля 2003 г.) включена в данный документ посредством ссылки в отношении рецепторов клеточной поверхности, которые опосредуют трансцитоз, которые применимы при практическом осуществлении настоящего изобретения. В одном варианте осуществления второй домен доставки связывается с рецептором трансферрина или другим аналогичным белком клеточной поверхности, таким как рецептор инсулина, CD98 или басигин (Bsg). Каждый мультидоменный терапевтический белок, содержащий по меньшей мере два домена доставки, также содержит по меньшей мере один ферментный домен, например, каждый из по меньшей мере двух доменов доставки может или не может быть независимо ассоциирован с ферментным доменом способом, описанным в данном документе (например, посредством взаимодействия антиген-антитело, посредством прямой ковалентной связи, посредством непрямой ковалентной связи и т.д.), где по меньшей мере один из по меньшей мере двух доменов доставки ассоциирован с ферментным доменом. Дополнительно, каждый из по меньшей мере двух доменов доставки может независимо содержать антитело, полуантитело или scFv (например, scFv, слитый с Fc).
[72] «Ферментный домен» или «фермент» означает любой белок, ассоциированный с этиологией или физиологическим эффектом заболевания, связанного с дефицитом ферментов. Фермент предусматривает собственно фермент, транспортный белок, рецептор или другой белок, который является дефектным и который рассматривается в роли молекулярного повреждения, вызывающего заболевание. Фермент также предусматривает любой белок, который может обеспечивать аналогичную или достаточную биохимическую или физиологическую активность, который обеспечивает замещение или обход молекулярного повреждения при заболевании. Например, «изозим» может использоваться в качестве фермента. Примеры белков, связанных с лизосомной болезнью накопления, включают белки, приведенные в таблице 1 как «вовлеченный фермент/белою), а также любой известный или открытый позже белок или другую молекулу, которые обеспечивают обход молекулярного дефекта при заболевании, связанном с дефицитом ферментов.
[73] В некоторых вариантах осуществления фермент представляет собой гидролазу, включая эстеразы, гликозилазы, гидролазы, которые действуют на эфирные связи, пептидазы, линейные амидазы, дифосфатазы, кетонгидролазы, галогеназы, фосфоамидазы, сульфогидролазы, сульфиназы, десульфиназы и т.п. В некоторых вариантах осуществления фермент представляет собой гликозилазу, включая гликозидазы и N-гликозилазы. В некоторых вариантах осуществления фермент представляет собой гликозидазу, включая альфа-амилазу, бета-амилазу, глюкан-1,4-альфа-глюкозидазу, целлюлозу, эндо-1,3(4)-бета-глюканазу, инулиназу, эндо-1,4-бета-ксиланазу, эндо-1,4-b-ксиланазу, декстраназу, хитиназу, полигалактуронидазу, лизоцим, экзо-альфа-сиалидазу, альфа-глюкозидазу, бета-глюкозидазу, альфа-галактозидазу, бета-галактозидазу, альфа-маннозидазу, бета-маннозидазу, бета-фруктофуранозидазу, альфа, альфа-трегалозу, бета-глюкуронидазу, ксилан-эндо-1,3-бета-ксилозидазу, амило-альфа-1,6-глюкозидазу, гиалуроноглюкозаминидазу, гиалуроноглюкуронидазу и т.п.
[74] В случае болезни Помпе, при которой молекулярным дефектом является дефект активности α-глюкозидазы, ферменты включают альфа-глюкозидазу человека и «изозимы», такие как другие альфа-глюкозидазы, сконструированная рекомбинантная альфа-глюкозидаза, другие глюкозидазы, рекомбинантные глюкозидазы, любой белок, сконструированный с возможностью гидролиза концевого нередуцирующего 1-4-связанного остатка альфа-глюкозы с высвобождением одной молекулы альфа-глюкозы, любой фермент ЕС 3.2.1.20, природные или рекомбинантные углеводные гидролазы для гликогена или крахмалов при низком рН, а также гликозилгидролазы, такие как сахараза-изомальтаза, мальтаза-глюкоамилаза, глюкозидаза II и нейтральная альфа-глюкозидаза.
[75] Термин «эффектор интернализации» включает белок, в некоторых случаях рецепторный белок, который способен интернализоваться в клетку, или который в противном случае участвует в ретроградном мембранном транспорте или способствует ему. Эффектор для интернализации, эффектор интернализации, рецептор для интернализации и рецептор интернализации применяют взаимозаменяемо в данном документе. В некоторых случаях эффектор интернализации представляет собой белок, который подвергается трансцитозу; т.е. белок интернализуется с одной стороны клетки и транспортируется на другую сторону клетки (например, от апикальной к базальной). Во многих вариантах осуществления эффекторный белок интернализации представляет собой белок, экспрессируемый на клеточной поверхности, или растворимый внеклеточный белок. Однако в настоящем изобретении также рассматриваются варианты осуществления, в которых эффекторный белок интернализации экспрессируется во внутриклеточном компартменте, таком как эндосома, эндоплазматический ретикулум, аппарат Гольджи, лизосома и т.д. Например, белки, участвующие в ретроградном мембранном транспорте (например, пути от ранних/рециркулирующих эндосом к транс-сети Гольджи), могут служить в качестве эффекторных белков интернализации в различных вариантах осуществления настоящего изобретения. В любом случае связывание домена доставки с эффекторным белком интернализации приводит к тому, что весь мультидоменный терапевтический белок и любые связанные с ним молекулы (например, фермент), также интерн ализуются в клетку. Как объясняется ниже, эффекторные белки интернализации включают белки, которые непосредственно интернализуются в клетку, а также белки, которые опосредованно интернализуются в клетку.
[76] Эффекторные белки интернализации, которые непосредственно интернализуются в клетку, включают в себя связанные с мембраной молекулы с по меньшей мере одним внеклеточным доменом (например, трансмембранные белки, GPI-заякоренные белки и т.д.), которые подвергаются клеточной интернализации и предпочтительно обрабатываются посредством пути внутриклеточной деградации и/или рециркуляции. Конкретные неограничивающие примеры эффекторных белков интернализации, которые непосредственно интернализуются в клетку, включают, например, CD63, MHC-I (например, HLA-B27), Kremen-1, Kremen-2, LRP5, LRP6, LRP8, рецептор трансферрина, LDL-рецептор, рецептор белка 1, родственного LDL, ASGR1, ASGR2, белок-2, подобный белку-предшественнику амилоида (APLP2), апелиновый рецептор (APLNR), MAL (миелиновый и лимфоцитарный белок, также известный как VIP17), IGF2R, Н+ АТФазу вакуолярного типа, рецептор дифтерийного токсина, фолатный рецептор, глутаматные рецепторы, глутатионовые рецепторы, лептиновые рецепторы, фагоцитарные рецепторы (например, SCARA1-5, SCARB1-3, CD36) и т.д.
[77] В одном варианте осуществления эффектор интернализации экспрессируется в нескольких типах тканей и применим в лечении, где требуется нацеливание как на ЦНС, так и на периферический тип клеток. Эффекторы интернализации, применимые в транспорте как в клетки ЦНС, так и в периферические типы клеток включают без ограничения CD63, MHC-I, Н+АТФазу вакуолярного типа, IGF2R, интегрин альфа-7 (ITGA7), LRP5, LRP6, LRP8, Kremen-2, рецептор LDL, рецептор белка 1, родственного LDL, белок-2, подобный белку-предшественнику амилоида (APLP2), апелиновый рецептор (APLNR), PRLR, MAL (миелиновый и лимфоцитарный белок (MAL), рецептор дифтерийного токсина, HBEGF (гепарин-связывающий фактор роста, подобный EGF), глутатионовые рецепторы, глутаматные рецепторы, лептиновые рецепторы и фолатные рецепторы. В определенных вариантах осуществления эффектор интернализации представляет собой рецептор пролактина (PRLR). Было обнаружено, что PRLR представляет собой не только мишень для определенных терапевтических применений, но также является эффективным эффекторным белком интернализации исходя из его высокой скорости интернализации и возобновления. Потенциал PRLR как эффекторного белка интернализации, например, проиллюстрирован в WO2015/026907, где показано, в том числе, что антитела к PRLR эффективно интернализуются PRLR-экспрессирующими клетками in vitro.
[78] Эффекторы интернализации для нацеливания, экспрессируемые несколькими типами клеток, могут быть применимы, если требуется нацеливание как на ЦНС, так и на периферический тип клеток, например в лечении заболевания, такого как болезнь Фабри, болезнь Гоше, MPS I, MPS II, MPS IIIA, MPS IIIB, MPS HID, MPS IVB, MPS VI, MPS VII, MPS IX, болезнь Помпе, дефицит лизосомальной кислой липазы, метахроматическая лейкодистрофия, болезнь Ниманна-Пика типов А, В и С2, альфа-маннозидоз, дефицит нейраминидазы, сиалидоз, аспартилглюкозаминурия, комбинированный дефицит сапозина, атипическая болезнь Гоше, липогранулематоз Фарбера, фукозидоз и бета-маннозидоз.
[79] В другом варианте осуществления эффектор интернализации экспрессируется в нескольких типах тканей. В одном примере эффектор интернализации может нацеливаться преимущественно в отношении костной и хрящевой ткани. Эффекторы, применимые в транспорте в ЦНС и в одной или обеих из костной и хрящевой тканей, включают без ограничения коллаген X, интегрин альфа 10 (ITGA10), рецептор 3 фактора роста фибробластов (FGFR3), изоформу С рецептора фактора роста фибробластов (FGFR3C), белок 1, связывающий гиалуронан и протеогликан (CRTL1), аггрекан, коллаген II и Kremen-1. Такие эффекторы применимы в лечении, где требуется нацеливание как на ЦНС, так и на скелетную и хрящевую ткани.
[80] Эффекторы интернализации для нацеливания, преимущественно экспрессируемые костной и хрящевой тканями, могут быть применимы, если требуется нацеливание как на ЦНС, так и на скелетную и хрящевую ткани, например в лечении заболевания, такого как MPS I, MPS II, MPS IIIA, MPS IIIB, MPS IIID, MPS IVA, MPS IVB, MPS VI, MPS VII, MPS IX, бета-маннозидоз, болезнь Гоше, атипическая болезнь Гоше, комбинированный дефицит сапозина, аспартилглюкозаминурия, липогранулематоз Фарбера, сиалидоз, дефицит нейраминидазы, мукополисазаридозы и альфа-маннозидоз.
[81] В еще одном варианте осуществления эффектор интернализации экспрессируется преимущественно в конкретном типе ткани или клеток, таких как макрофаги, моноциты и микроглия. Эффекторы, пригодные для транспорта в ЦНС и в макрофаги, включают без ограничения фагоцитарный рецептор А1-5 (SCARA1-5), SCARB1-3, CD36, MSR1 (макрофагальный фагоцитарный рецептор 1), MRC1 (макрофагальный маннозный рецептор 1), VSIG4 (белок 4, содержащий домен V-набора и иммуноглобулина), CD68 (макросиалин) и CSF1R (рецептор колониестимулирующего фактора 1 макрофагов). Такие эффекторы применимы в лечении, где требуется нацеливание как на ЦНС, так и на макрофаги. Макрофаги ЦНС могут называться микроглией.
[82] Эффекторы интернализации для нацеливания, экспрессируемые преимущественно макрофагами (моноцитами или микроглией), могут быть применимы, если требуется нацеливание как на ЦНС, так и макрофаги (или микроглию), например при лечении заболевания, такого как дефицит лизосомальной кислой липазы, болезнь Гоше, атипичная болезнь Гоше, комбинированный дефицит сапозина и липогранулематоз Фарбера.
[83] В определенных вариантах осуществления эффектор интернализации представляет собой специфический в отношении почки эффектор интернализации, такой как CDH16 (Cadheri-16), CLDN16 (Claudn-16), KL (Klotho), PTH1R (рецептор паратиреоидного гормона), SLC22A13 (семейство 22 транспортеров растворенных веществ, представитель 13), SLC5A2 (котранспортер 2 натрия/глюкозы) и UMOD (уромодулин).
[84] Эффекторы интернализации для нацеливания, преимущественно экспрессируемые в почке, могут быть применимы, если требуется нацеливание как на ЦНС, так и на ткань почки, например в лечении заболевания, такого как болезнь Фабри, синдром Альпорта, поликистозная болезнь почек и тромботическая тромбоцитопеническая пурпура.
[85] В еще одном варианте осуществления эффектор интернализации экспрессируется преимущественно в конкретном типе ткани или клеток, таком как клетки печени. Эффекторы, применимые в транспорте в ЦНС и в печень, включают без ограничения ASGR1 и ASGR2. Такие эффекторы применимы в лечении, где требуется нацеливание как на ЦНС, так и на клетки печени.
[86] Эффекторы интернализации для нацеливания, экспрессируемые преимущественно в печени, могут быть применимы, если требуется нацеливание как на ЦНС, так и на клетки печени, например в лечении заболевания, такого как дефицит лизосомальной кислой липазы, болезнь Гоше, MPS VI, MPS VII, MPS II, болезнь Ниманна-Пика типов А, В и С2, сиалидоз, дефицит нейраминидазы, атипическая болезнь Гоше, комбинированный дефицит сапозина, липогранулематоз Фарбера.
[87] В некоторых вариантах осуществления эффектор интернализации представляет собой специфический в отношении мышц интернализатор, такой как BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерин, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергический рецептор (никотиновый) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14 В, содержащий богатый лейцином повтор), дистрогликана (DAG1) и POPDC3 (белок 3, содержащий домен Рореуе).
[88] Эффекторы интернализации для нацеливания, экспрессируемые преимущественно мышцами, могут быть применимы, если требуется нацеливание как на ЦНС, так и на мышечную ткань, например в лечении заболевания, такого как болезнь Помпе.
[89] В некоторых вариантах осуществления эффектор интернализации представляет собой ITGA7, ITGA10, CD9, CD63, ALPL2, MSR1, ASGR1, ASGR2 или PRLR. Антитела к ITGA7, ITGA10, CD9, CD63, APLP2, MSR1, ASGR1, ASGR2 или PRLR хорошо известны из уровня техники (см., например, R & D Systems «Integrm alpha 7: Products» в отношении иллюстративных неограничивающих антител к IGTA7; см., например, US8048991, US20120034625, US8563255, US20140099716, US20160319023, WO2018138322 и US10087253 в отношении иллюстративных неограничивающих примеров антител к ITGA10; см., например, WO201102982; WO2014185908; US20160115229; WO2017134197; US9738717 и de Goeij BE et al. Mol. Cancer Ther. (2016) Nov;15(11):2688-2697 в отношении иллюстративных неограничивающих антител к CD63; см., например, US543153A; US5441931A; US5677146A и US5935854A в отношении иллюстративных неограничивающих антител к APLP2; см., например, описание продукта МАВ27081 от R&D Systems; описание продукта AF2708 от R&D Systems; описание продукта ab1515707 от AbCam; Yu X, et al., J. Biol. Chem., 2011;286(21): 18795-806 и N Nishijima, et al., Front Immunol, 2017;8(0):379 в отношении иллюстративных неограничивающих примеров антител к MSR1; см., например, WO2017058944 в отношении иллюстративных неограничивающих примеров антител к asgr1; см., например, антитела к ASGR2 от Origene, доступные по ссылке www.origene.com/category/antibodies?q=ASGR2&sub_category=Primary+Antibodies&readivines-Human в отношении неограничивающих иллюстративных антител к ASGR2; см., например, US9649374; US9302015; US20130171147; US10106616; WO2015026907; US9777063; WO2011069795; US20130272968; US20140141003; WO2011069799; US20120315276; WO2012163932; US9241989; WO2012136519; WO2011069798; WO2019011719; US8883979; US20140065158; WO2015187596; US9353186; WO2018102304; US20130022606; US9688764; US20130129739; US20160002342; US20150056222; US20150056221; US20170008965; US20150093393; WO2011069797; US20160251442; US20180094066; WO2014036076; US20180185504; US20140271659; WO2011069794; WO2014143909; US20160319029; US9545451; US9023357; US20150252116; WO2011069796, Kelly MP, et al., Mol. Cancer Ther. (2017) Jul; 16(7): 1299-1311; Otto С.et al. Endocrinology (2015) 156:4365-73 2017-01-20 и Andreev J et al., Mol. Cancer Ther. (2017) Apr; 16(4): 681 693 в отношении иллюстративных неограничивающих антител PRLR; где каждая ссылка включена в данный документ в полном объеме посредством ссылки). Специалист в данной области может легко обеспечивать связывание этих хорошо известных антител или их антиген связывающих частей (например, scFv, полученные из них) с терапевтическим белком, описанным в данном документе, для получения и применения мультидоменного терапевтического белка, описанного в данном документе.
[90] В вариантах осуществления, в которых эффектор интернализации (IE) непосредственно интернализуется в клетку, домен доставки может представлять собой, например, антитело или антигенсвязывающий фрагмент антитела, которое специфически связывается с IE, или лиганд или часть лиганда, который специфически взаимодействует с IE. Например, если IE представляет собой Kremen-1 или Kremen-2, то домен доставки может содержать лиганд Kremen (например, DKK1) или его Kremen-связывающую часть или состоять из таких. В качестве другого примера, если IE является рецепторной молекулой; такой как ASGR1, то домен доставки может содержать лиганд, специфический в отношении рецептора (например, асиалоорозомукоида [ASOR] или бета-Ga1NAc), или его рецептор-связывающую часть или состоять из них.
[91] Эффекторные белки интернализации, которые опосредованно интернализуются в клетку, включают белки и полипептиды, которые не интернализуются сами по себе, а интернализуются в клетку после связывания или иным образом ассоциации со вторым белком или полипептидом, который непосредственно интернализуется в клетку. Белки, которые опосредованно интернализуются в клетку, предусматривают, например, растворимые лиганды, которые способны связываться с рецепторной молекулой интернализации, экспрессируемой на клеточной поверхности. Неограничивающим примером растворимого лиганда, который (опосредованно) интернализуется в клетку благодаря его взаимодействию с рецепторной молекулой интернализации, экспрессируемой на клеточной поверхности, является трансферрин. В вариантах осуществления, где IE представляет собой трансферрин (или другой опосредованно интернализуемый белок), связывание домена доставки с IE и взаимодействие IE с рецептором трансферрина (или другой рецепторной молекулой интернализации, экспрессируемой на клеточной поверхности) приводит к тому, что весь домен доставки и любые молекулы, связанные с ним (например, фермент), интернализуются в клетку одновременно с интернализацией IE и его партнера по связыванию.
[92] В вариантах осуществления, в которых IE интернализуется в клетку опосредованно, домен доставки может представлять собой, например, антитело, антиген связывающий фрагмент антитела или scFv, которые специфически связывают IE, или рецептор или часть рецептора, которые специфически взаимодействуют с растворимым эффекторным белком. Например, если IE представляет собой цитокин, то домен доставки может содержать соответствующий рецептор цитокина или его лиганд-связывающую часть или состоять из таких.
[93] Примером IE является CD63, который является представителем тетраспанинового суперсемейства белков клеточной поверхности, которые пересекают клеточную мембрану четыре раза. CD63 экспрессируется практически во всех тканях и, как полагают, вовлекается в формирование и стабилизацию комплексов передачи сигнала. CD63 локализуется в клеточной мембране, лизосомной мембране и поздней эндосомальной мембране. CD63, как известно, ассоциируется с интегринами и может быть вовлечен в эпителиальный-мезенхимальный переход. См. Н. Maecker et al., «The tetraspanin superfamily: molecular facilitators», 11(6) FASEB J. 428-2, May 1997 и M. Metzelaar et al., «CD63 antigen. A novel lysosomal membrane glycoprotein, cloned by a screening procedure for intracellular antigens in eukaryotic cells», 266 J. Biol. Chem. 3239-3245, 1991; где каждая ссылка включена в данный документ в полном объеме посредством ссылки.
[94] Другим примером IE является подобный предшественнику амилоида-бета (А4) белок 2 («APLP2»), повсеместно экспрессируемый представитель семейства АРР (белка-предшественника амилоида). APLP2 представляет собой связанный с мембраной белок, который, как известно, взаимодействует с молекулами главного комплекса гистосовместимости (МНС) класса I (например, Kd). Он связывает Kd на клеточной поверхности и интернализуется клатрин-зависимым образом вместе с Kd. См. Tuli et al., «Mechanism for amyloid precursor-like protein 2 enhancement of major histocompatibility complex class I molecule degradation», 284 The Journal of Biological Chemistry 34296-34307 (2009); ссылка на которую включена в данный документ в полном объеме посредством ссылки.
[95] Другим примером IE является рецептор пролактина (PRLR). Рецептор пролактина является представителем семейства цитокиновых рецепторов I типа и при связывании с лигандом и последующей димеризации активирует «тирозинкиназы Jak2, Fyn и Тес, фосфатазу SHP-2, фактор обмена гуаниновых нуклеотидов Vav и супрессор передачи сигнала SOCS» (см. Clevenger and Kline, «Prolactin receptor signal transduction,» 10(10) Lupus 706-18 (2001), реферат; где каждая ссылка включена в данный документ в полном объеме посредством ссылки). Рецептор пролактина подвергается эндоцитотическому рециклингу и может быть найден в лизосомных фракциях. См. Genty et al., «Endocytosis and degradation of prolactin and its receptor in Chinese hamster ovary cells stably transfected with prolactin receptor cDNA», 99(2) Mol. Cell Endocrinol. 221-8 (1994) и Ferland et al., «The effect of chloroquine on lysosomal prolactin receptors in rat liver», 115(5) Endocrinology 1842-9 (1984), ссылка на которую включена в данный документ в полном объеме посредством ссылки.
[96] Как используется в данном документе «иммунологическая реакция», как правило, означает иммунологический ответ пациента на посторонний или «чужой» белок. Этот иммунологический ответ включает аллергическую реакцию и развитие антител, которые препятствуют эффективности заместительного фермента. У некоторых пациентов может не продуцироваться какой-либо нефункционирующий белок, что, таким образом, делает заместительный фермент «чужеродным» белком. Например, повторная инъекция рекомбинантной GLA (rGLA) страдающим болезнью Фабри пациентам, у которых отсутствует GLA, зачастую приводит к аллергической реакции. У других пациентов продуцирование антител против rGLA, как было показано, снижает эффективность заместительного фермента при лечении заболевания. См., например, Tajima et al. («Use of a Modified α-N-Acetylgalactosaminidase (NAGA) in the Development of Enzyme Replacement Therapy for Fabry Disease», 85(5) Am. J. Hum. Genet. 569-580 (2009)), ссылка на которую включена в данный документ в полном объеме посредством ссылки, в которой обсуждается применение модифицированной NAGA в качестве «изозима» для замещения GLA. Модифицированная NAGA не обладает иммунологической перекрестной реактивностью в отношении GLA и «не реагировала с сывороткой крови от пациента с заболеванием Фабри, регулярно получающего лечение в виде рекомбинантной GLA». Id, реферат.
[97] «Иммуносупрессор» включает лекарственные средства и/или белки, которые приводят к общей иммуносупрессии, и может использоваться для предупреждения возникновения перекрестнореагирующих иммунологических материалов (CRIM) к заместительным ферментам, например GAA или GLA, соответственно у пациентов с болезнью Помпе или Фабри. Неограничивающие примеры иммуносупрессоров включают метотрексат, микофенолата мофетил, циклофосфамид, рапамицин, алкилирующие ДНК средства, антитело к CD20, антитело к BAFF, антитело к CD3, антитело к CD4 и любую их комбинацию.
[98] Регуляторные элементы, например промоторы, которые являются специфическими в отношении определенной ткани, например печени, усиливают экспрессию последовательностей нуклеиновых кислот, например генов, находящихся под контролем такого регуляторного элемента, в ткани, в отношении которой данный регуляторный элемент является специфическим. Неограничивающие примеры специфических в отношении печени регуляторных элементов, например специфических в отношении печени промоторов, можно найти в Chuah et al. (2014) Mol. Ther. 22:1605-13, ссылка на которую включена в данный документ в полном объеме посредством ссылки.
[99] Термин «белок» означает любой аминокислотный полимер, имеющий более чем приблизительно 20 аминокислот, ковалентно связанных посредством амидных связей. Белки содержат одну или более аминокислотных полимерных цепей, общеизвестных в уровне техники как «полипептиды». Таким образом, полипептид может быть белком, а белок может содержать несколько полипептидов с образованием одной функционирующей биомолекулы. В некоторых белках могут присутствовать дисульфидные мостики (т.е. между цистеиновыми остатками с образованием цистина). Такие ковалентные связи могут находиться в одной полипептидной цепи или между двумя отдельными полипептидными цепями. Например, дисульфидные мостики необходимы для надлежащей структуры и функции инсулина, иммуноглобулинов, протамина и т.п.Новый обзор по образованию дисульфидных связей см. в Oka and Bulleid, «Forming disulfides in the endoplasmic reticulum», 1833(11) Biochim Biophys Acta 2425-9 (2013), ссылка на которую включена в данный документ в полном объеме посредством ссылки.
[100] Используемый в данном документе термин «белок» включает биотерапевтические белки, рекомбинантные белки, применяемые в исследовании или терапии, белки-ловушки и другие Fc-слитые белки, химерные белки, антитела, моноклональные антитела, антитела человека, биспецифические антитела, фрагменты антител, нанотела, химеры на основе рекомбинантных антител, слитые белки на основе scFv, цитокины, хемокины, пептидные гормоны и т.п.Белки могут быть получены с использованием рекомбинантных клеточных систем продуцирования, таких как система бакуловируса насекомых, дрожжевые системы (например, Pichia sp.), системы млекопитающих (например, клетки СНО и производные СНО, подобно клеткам СНО-K1). В отношении нового обзора, в котором обсуждаются биотерапевтические белки и их продуцирование, см. Ghaderi et al., «Production platforms for biotherapeutic glycoproteins. Occurrence, impact, and challenges of non-human sialylation», 28 Biotechnol Genet Eng Rev. 147 75 (2012), ссылка на которую включена в данный документ в полном объеме посредством ссылки.
[101] Используемый в данном документе термин «антитело» включает молекулы иммуноглобулинов, содержащие четыре полипептидные цепи, две тяжелые (Н) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно обозначаемую в данном документе как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначаемую в данном документе как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен CL. VH- и VL-области могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), чередующиеся с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут быть сокращены как HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут быть сокращены как LCDR1, LCDR2 и LCDR3. Термин «высокоаффинное» антитело относится к тем антителам, которые характеризуются аффинностью связывания со своей мишенью, составляющей по меньшей мере 10-9 М, по меньшей мере 10-10 М; по меньшей мере 10-11 М или по меньшей мере 10-12 М, что измерено с помощью поверхностного плазменного резонанса, например BIACORE™, или определения аффинности в растворе посредством ELISA. Термин «антитело» может охватывать антитела любого типа, такие как, например, моноклональные или поликлональные. Кроме того, антитело может быть любого происхождения, например, происходить от млекопитающего или не млекопитающего. В одном варианте осуществления антитело может происходить от млекопитающего или птицы. В дополнительном варианте осуществления антитело может быть человеческого происхождения и может дополнительно представлять собой человеческое моноклональное антитело.
[102] Фраза «биспецифическое антитело» включает в себя антитело, способное селективно связывать два или более эпитопов. Как правило, биспецифические антитела содержат две различные тяжелые цепи, при этом каждая тяжелая цепь специфически связывается с отдельным эпитопом - либо на двух разных молекулах (например, антигенах), либо на одной и той же молекуле (например, на одном и том же антигене). Если биспецифическое антитело способно селективно связываться с двумя разными эпитопами (первым эпитопом и вторым эпитопом), то аффинность первой тяжелой цепи по отношению к первому эпитопу, как правило, будет на по меньшей мере один, два, или три, или четыре порядка ниже аффинности первой тяжелой цепи по отношению ко второму эпитопу, и наоборот. Эпитопы, распознаваемые биспецифическим антителом, могут находиться на одной и той же или на отличной мишени (например, на одном и том же или на отличном белке). Биспецифические антитела могут быть получены, например, путем объединения тяжелых цепей, которые распознают разные эпитопы одного и того же антигена. Например, последовательности нуклеиновой кислоты, кодирующие вариабельные последовательности тяжелой цепи, которые распознают разные эпитопы одного и того же антигена, могут быть слиты с последовательностями нуклеиновой кислоты, кодирующими разные константные области тяжелой цепи, и такие последовательности могут быть экспрессированы в клетке, которая экспрессирует легкую цепь иммуноглобулина. Типичное биспецифическое антитело имеет две тяжелые цепи, каждая из которых содержит три CDR тяжелой цепи, за которыми следует (от N-конца к С-концу) СН1-домен, шарнир, СН2-домен и СН3-домен, и легкую цепь иммуноглобулина, либо которая не обеспечивает антиген связывающую специфичность, но которая при этом может ассоциироваться с каждой тяжелой цепью, либо которая может ассоциироваться с каждой тяжелой цепью и которая может связываться с одним или более эпитопами, связывающимися антиген связывающим и областями тяжелой цепи, либо которая может ассоциироваться с каждой тяжелой цепью и обеспечивать связывание либо одной, либо обеих тяжелых цепей с одним или обоими эпитопами.
[103] Фраза «тяжелая цепь» или «тяжелая цепь иммуноглобулина» включает последовательность константной области тяжелой цепи иммуноглобулина из любого организма и, если не указано иное, включает вариабельный домен тяжелой цепи. Вариабельные домены тяжелой цепи включают в себя три CDR тяжелой цепи и четыре области FR, если не указано иное. Фрагменты тяжелых цепей включают в себя CDR, CDR и FR, а также их комбинации. Типичная тяжелая цепь после вариабельного домена (от N-конца к С-концу) содержит СН1-домен, шарнир, СН2-домен и СН3-домен. Функциональный фрагмент тяжелой цепи включает в себя фрагмент, который способен специфически распознавать антиген (например, распознавать антиген с KD в микромолярном, наномолярном или пикомолярном диапазонах), который способен экспрессироваться и секретироваться клеткой и который содержит по меньшей мере одну CDR.
[104] Фраза «легкая цепь» включает последовательность константной области легкой цепи иммуноглобулина из любого организма и, если не указано иное, включает каппа и лямбда легкие цепи человека. Вариабельные (VL) домены легкой цепи, как правило, включают в себя три CDR легкой цепи и четыре каркасных (FR) области, если не указано иное. Как правило, легкая цепь полной длины включает в себя, от амино-конца к карбоксильному концу, VL-домен, который включает в себя FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, и константный домен легкой цепи. Легкие цепи, которые могут быть использованы согласно настоящему изобретению, предусматривают, например, те, которые не связываются селективно либо с первым, либо со вторым антигеном, селективно связываемым антигенсвязывающим белком. Подходящие легкие цепи предусматривают цепи, которые могут быть идентифицированы путем скрининга по наиболее часто используемым легким цепям в имеющихся библиотеках антител (библиотеках WET или in silico), при этом легкие цепи существенно не нарушают аффинность и/или селективность антигенсвязывающих доменов антигенсвязывающих белков. Подходящие легкие цепи включают в себя цепи, которые могут связываться с одним или обоими эпитопами, которые связываются антигенсвязывающими областями антигенсвязывающего белка.
[105] Фраза «вариабельный домен» включает аминокислотную последовательность легкой или тяжелой цепей иммуноглобулина (модифицированных, если требуется), которые содержат следующие аминокислотные области, в последовательности от N-конца к С-концу (если не указано иное): FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. «Вариабельный домен» предусматривает аминокислотную последовательность, способную сворачиваться в канонический домен (VH или VL), имеющий структуру двойных бета-складчатых слоев, где бета-складчатые слои соединяются дисульфидной связью между остатками первого бета-складчатого слоя и второго бета-складчатого слоя.
[106] Фраза «определяющая комплементарность область» или термин «CDR» предусматривают аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты генов иммуноглобулина организма, которая в норме (т.е. у животного дикого типа) находится между двумя каркасными областями в вариабельной области легкой или тяжелой цепей молекулы иммуноглобулина (например, антитела или рецептора Т-клетки). CDR может кодироваться, например, последовательностью зародышевой линии, или перегруппированной, или неперегруппированной последовательностью, и, например, наивной или зрелой В-клеткой или Т-клеткой. В некоторых случая (например, для CDR3) CDR могут кодироваться двумя или более последовательностями (например, последовательностями зародышевой линии), которые не являются смежными (например, в неперегруппированной последовательности нуклеиновой кислоты), но являются смежными в последовательности нуклеиновой кислоты В-клетки, например, как результат сплайсинга или соединения последовательностей (например, рекомбинация V-D-J с образованием CDR3 тяжелой цепи).
[107] Термин «фрагмент антитела» относится к одному или более фрагментам антитела, которые сохраняют способность специфического связывания с антигеном. Примеры связывающих фрагментов, охватываемых термином «фрагмент антитела», включают (i) Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al. (1989) Nature 241:544 546, ссылка на которую включена в данный документ в полном объеме посредством ссылки), который состоит из домена VH, (vi) выделенную CDR и (vii) scFv, который состоит из двух доменов Fv-фрагмента, VL и VH, связанных синтетическим линкером с образованием одной белковой цепи, в которой области VL и VH спариваются с образованием одновалентных молекул. Другие формы одноцепочечных антител, таких как диатела, также охватываются термином «антитело» (см., например, Holliger et al. (1993) PNAS USA 90:6444-6448; Poljak et al. (1994) Structure 2:1121-1123, ссылка на которую включена в данный документ в полном объеме посредством ссылки).
[108] Фраза «Fc-содержащий белок» включает антитела, биспецифические антитела, иммуноадгезины и другие связывающие белки, которые содержат по меньшей мере функциональную часть областей СН2 и СН3 иммуноглобулина. «Функциональная часть» относится к областям СН2 и СН3, которые могут связывать Fc-рецептор (например, FcyR или FcRn, т.е. неонатальный Fc-рецептор) и/или которые могут участвовать в активации комплемента. Если области СН2 и СН3 содержат делеции, замены и/или вставки или другие модификации, которые делают их неспособными связывать какой-либо Fc-рецептор, а также неспособными активировать комплемент, то области СН2 и СН3 не являются функциональными.
[109] Fc-содержащий белок может предусматривать модификации в доменах иммуноглобулина, в том числе модификации, которые влияют на одну или более из эффекторных функций связывающего белка (например, модификации, которые влияют на связывание FcyR, связывание FcRn и, таким образом, время полужизни и/или активность CDC). Такие модификации включают без ограничения следующие модификации и их комбинации, обозначенные на основании нумерации константной области иммуноглобулина согласно EU: 238, 239, 248, 249, 250, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 297, 298, 301, 303, 305, 307, 308, 309, 311, 312, 315, 318, 320, 322, 324, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 337, 338, 339, 340, 342, 344, 356, 358, 359, 360, 361, 362, 373, 375, 376, 378, 380, 382, 383, 384, 386, 388, 389, 398, 414, 416, 419, 428, 430, 433, 434, 435, 437, 438 и 439.
[110] Например, и без ограничения, связывающий белок представляет собой Fc-содержащий белок, и проявляет увеличенное время полужизни в сыворотке крови (по сравнению с таким же Fc-содержащим белком без указанной(-ых) модификации(-й)), и характеризуется модификацией в положении 250 (например, Е или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т); или модификацией в положении 428 и/или 433 (например, L/R/SI/P/Q или K) и/или 434 (например, H/F или Y); или модификацией в положении 250 и/или 428; или модификацией в положении 307 или 308 (например, 308F, V308F) и 434. В другом примере модификация может предусматривать модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 2591 (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); модификацию 307 и/или 308 (например, 308F или 308Р).
[111] Используемый в данном документе термин «антигенсвязывающий белок» относится к полипептиду или белку (один или более полипептидов, объединенных в функциональную единицу), который специфически распознает эпитоп на антигене, таком как специфический в отношении клетки антиген и/или целевой антиген в соответствии с настоящим изобретением. Антигенсвязывающий белок может быть полиспецифическим. Термин «полиспецифический» по отношению к антигенсвязывающему белку означает, что белок распознает разные эпитопы, либо на одном и том же антигене, либо на разных антигенах. В соответствии с настоящим изобретением полиспецифическая антигенсвязывающая молекула может представлять собой один многофункциональный полипептид или может представлять собой мультимерный комплекс из двух или более полипептидов, ковалентно или нековалентно связанных друг с другом. Термин «антигенсвязывающий белок» включает антитела или их фрагменты по настоящему изобретению, которые могут быть связаны или совместно экспрессированы с другой функциональной молекулой, например другим пептидом или белком. Например, антитело или его фрагмент могут быть функционально связаны (например, путем химического сочетания, генетического слияния, нековалентной ассоциации или прочего) с одним или более другими молекулярными объектами, такими как белок или его фрагмент, с получением биспецифической или полиспецифической антигенсвязывающей молекулы со второй специфичностью связывания.
[112] Используемый в данном документе термин «эпитоп» относится к части антигена, которая распознается полиспецифическим антигенсвязывающим полипептидом. Один антиген (такой как антигенный полипептид) может иметь более чем один эпитоп. Эпитопы можно определить как структурные или функциональные. Функциональные эпитопы, как правило, составляют подгруппу структуральных эпитопов и определяются как такие остатки, которые непосредственно обусловливают аффинность взаимодействия между антигенсвязывающим полипептидом и антигеном. Также эпитопы могут быть конформационными, то есть состоять из нелинейных аминокислот. В определенных вариантах осуществления эпитопы могут включать детерминанты, которые представляют собой химически активные поверхностные структуры молекул, таких как аминокислоты, боковые цепи сахаров, фосфорильные группы или сульфонильные группы, и, в определенных вариантах осуществления могут иметь специфические характеристики трехмерных структур и/или специфические характеристики заряда. Эпитопы, образованные непрерывными аминокислотами, как правило, сохраняются при воздействии денатурирующими растворителями, в то время как эпитопы, образованные посредством укладки в третичную структуру, утрачиваются при обработке денатурирующими растворителями.
[113] Термин «домен» относится к любой части белка или полипептида, обладающего конкретной функцией или структурой. Предпочтительно домены в соответствии с настоящим изобретением связываются со специфическими по отношению к клетке или целевыми антигенами. Домены, связывающие антиген, специфический в отношении клетки, или целевой антиген, и т.п., как используется в данном документе, включают любой имеющийся в норме, получаемый ферментативным путем, синтетический или получаемый с помощью методик генной инженерии полипептид или гликопротеин, который специфически связывает антиген.
[114] Термины «полутело» или «полуантитело», которые используются взаимозаменяемо, относятся к половине антитела, которая по существу содержит одну тяжелую цепь и одну легкую цепь. Тяжелые цепи антитела могут формировать димеры так, что тяжелая цепь одного полуантител а может ассоциироваться с тяжелой цепью, ассоциированной с другой молекулой (например, другим полуантителом) или другим Fc-содержащим полипептидом. Два слегка отличающихся Fc-домена могут «гетеродимеризоваться», как при образовании биспецифических антител или других гетеродимеров, -тримеров, -тетрамеров и т.п. См. Vincent and Murini, «Current strategies in antibody engineering: Fc engineering and pH-dependent antigen binding, bispecific antibodies and antibody drug conjugates», 7 Biotechnol. J. 1444-1450 (20912) и Shimamoto et al., «Peptibodies: A flexible alternative format to antibodies,» 4(5) MAbs 586-91 (2012), где каждая ссылка включена в данный документ в полном объеме посредством ссылки.
[115] В одном варианте осуществления вариабельный домен полуантитела специфически распознает эффектор интернализации, и Fc-домен полуантитела димеризуется с Fc-слитым белком, который содержит заместительный фермент (например, пептитело) Id, 586.
[116] Термин «одноцепочечный вариабельный фрагмент» или «scFv» включает одноцепочечный слитый полипептид, содержащий вариабельную область тяжелой цепи иммуноглобулина (VH) и вариабельную область легкой цепи иммуноглобулина (VL). В некоторых вариантах осуществления VH и VL соединены линкерной последовательностью из 10-25 аминокислот. Полипептиды scFv могут также содержать другие аминокислотные последовательности, такие как CL- или CHI-области. Молекулы scFv могут быть получены с помощью фагового дисплея или изготовлены путем прямого субклонирования тяжелых и легких цепей из гибридомы или В-клетки. Публикация Ahmad et al., Clinical and Developmental Immunology, volume 2012, article ID 98025 включена в данный документ посредством ссылки в отношении способов получения фрагментов scFv посредством фагового дисплея и клонирования домена антитела.
[117] Термины «альфа-глюкозидаза» (или «α-глюкозидаза»), «α-глюкозидазная активность», «GAA» и «GAA-активность» используются взаимозаменяемо и относятся к любому белку, который облегчает гидролиз 1,4-альфа-связей гликогена и крахмала в глюкозе. GAA также известна, в том числе, как ЕС 3.2.1.20, мальтаза, глюкоинвертаза, глюкозидосахараза, мальтаза-глюкоамилаза, альфа-глюкопиранозидаза, глюкозидоинвертаза, альфа-D-глюкозидаза, альфа-глюкозидгидролаза, альфа-1,4-глюкозидаза и альфа-D-глюкозидглюкогидролаза. GAA может быть обнаружена в лизосоме и в щеточной кайме тонкого кишечника. У пациентов, страдающих болезнью Помпе, отсутствует функционирующая лизосомная α-глюкозидаза. См. S. Chiba, «Molecular mechanism in alpha-glucosidase and glucoamylase», 61(8) Biosci. Biotechnol. Biochem. 1233-9 (1997) и Hesselink et al., «Lysosomal dysfunction in muscle with special reference to glycogen storage disease type II», 1637(2) Biochim. Biophys. Acta. 164-70 (2003), ссылка на которую включена в данный документ в полном объеме посредством ссылки.
[118] Термины «альфа-галактозидаза А» (или «α-галактозидаза А»), «активность α-галактозидазы А», «α-галактозидаза», «активность α-галактозидазы», «GLA» и «GLA-активность» используются взаимозаменяемо и относятся к любому белку, который облегчает гидролиз терминальных α-галактозильных фрагментов из гликолипидов и гликопротеинов, а также гидролизует α-D-фукозиды. GLA также известна, в том числе, как ЕС 3.2.1.22, мелибиаза, α-D-галактозидаза, α-галактозидаза А, α-галактозидгалактогидролаза, α-D-галактозидгалактогидролаза. GLA является лизосомным ферментом, кодируемым связанным с Х-хромосомой геном GLA. Дефекты в GLA могут приводить к болезни Фабри, при котором гликолипид, известный как глоботриаозилцерамид (также известный как Gb3, GL-3 или церамидтригексозид) накапливается внутри кровеносных сосудов (т.е. выраженная васкулопатия), что приводит к боли и ухудшению в функционировании почки, сердца, кожи и/или цереброваскулярных тканей, а также других тканей и органов. См., например, Prabakaran et al. «Mannose 6-phosphate receptor and sortilin mediated endocytosis of α-galactosidase A in kidney endothelial cells», 7(6) PLoS One e39975 pp. 1-9 (2012), ссылка на которую включена в данный документ в полном объеме посредством ссылки.
[119] В одном аспекте настоящее изобретение предусматривает способ лечения пациента (или субъекта), страдающего лизосомной болезнью накопления, путем введения пациенту «мультидоменного терапевтического белка». Мультидоменный терапевтический белок попадает в клетки пациента и доставляет в лизосомы фермент или ферментативную активность (т.е. «заместительный фермент»), которые замещают фермент (т.е «эндогенный фермент») или ферментативную активность, которые ассоциированы с LSD. В одном варианте осуществления мультидоменный терапевтический белок доставляется пациенту с помощью вектора для генной терапии, который содержит полинуклеотид, который кодирует мультидоменный терапевтический белок.
[120] Виды LSD включают сфинголипидоз, мукополисахаридоз и болезни накопления гликогена. В некоторых вариантах осуществления LSD представляет собой любую одну или более из болезни Фабри, болезни Гоше I типа, болезни Гоше II типа, болезни Гоше III типа, болезни Ниманна-Пика типа А, болезни Ниманна-Пика типа BGM1-ганглиозидоз, болезни Сандхоффа, болезни Тея-Сакса, дефицита активатора GM2, GM3-ганглиозидоза, метахроматической лейкодистрофии, дефицита активатора сфинголипида, болезни Шейе, болезни Гурлера-Шейе, болезни Гурлера, болезни Хантера, синдрома Санфилиппо А, синдрома Санфилиппо В, синдрома Санфилиппо С, синдрома Санфилиппо D, синдрома Моркио А, синдрома Моркио В, болезни Марото-Лами, болезни Слая, MPS IX и болезни Помпе. В соответствии с конкретным вариантом осуществления LSD представляет собой болезнь Фабри. В соответствии с другим вариантом осуществления LSD представляет собой болезнь Помпе.
[121] В некоторых вариантах осуществления мультидоменный терапевтический белок содержит (а) заместительный фермент и (b) молекулярный объект, который связывает эффектор интернализации (домен доставки). В некоторых случаях заместительный фермент представляет собой одно или более из α-галактозидазы, β-галактозидазы, α-глюкозидазы, β-глюкозидазы, активатора сапозина-С, церамидазы, сфингомиелиназы, β-гексозаминидазы, активатора GM2, CM3-синтазы, арилсульфатазы, активатора сфинголипида, α-идуронидазы, идуронидаза-2-сульфатазы, гепарин-N-сульфатазы, N-ацетил-α-глюкозаминидазы, α-глюкозамид-N-ацетилтрансферазы, N-ацетилглюкозамин-6-сульфатазы, N-ацетилгалактозамин-6-сульфат-сульфатазы, N-ацетилгалактозамин-4-сульфатазы, β-глюкуронидазы и гиалуронидазы.
[122] В некоторых случаях у пациента не может продуцироваться достаточно белка, так что заместительный фермент распознается организмом пациента как «чужой», и после введения заместительного фермента происходит иммунологическая реакция. Это нежелательно. Поэтому, в некоторых вариантах осуществления заместительный фермент разрабатывают или продуцируют таким образом, чтобы избежать индуцирования иммунологической реакции у субъекта. Одним таким решением является применение «изозима» в качестве заместительного фермента. Изозим достаточно близок «собственному» белку пациента, однако обладает активностью заместительного фермента, достаточной для облегчения симптомов LSD.
[123] В одном конкретном варианте осуществления, при котором LSD представляет собой болезнь Помпе, и эндогенный фермент представляет собой α-глюкозидазу (GAA), изозим может представлять собой любое из кислой α-глюкозидазы, сахаразы-изомальтазы (SI), мальтазы-глюкоамилазы (MGAM), глюкозидазы II (GANAB) и нейтральной α-глюкозидазы (С GNAC). В другом конкретном варианте осуществления, при котором LSD представляет собой болезнь Фабри, и эндогенный фермент представляет собой α-галактозидазу A (GLA), изозим может представлять собой α-N-ацетилгалактозаминидазу, сконструированную с возможностью получения GLA-активности.
[124] В данном документе предусмотрены способы, отличные от применения изозима, для снижения уровня перекрестнореагирующих иммунологических материалов (CRIM) против заместительного фермента. Как показано на фигурах 5 и 6, введение мультидоменного терапевтического белка (например, посредством вектора для генной терапии), содержащего домен, связывающий эффектор инетрнализации, и ферментный домен, снижает уровень CRIM против заместительного фермента, поступающего при введении контрольного терапевтического белка (где отсутствует эффекторный домен интернализации и содержится ферментный домен). Таким образом, в одном варианте осуществления снижения уровня CRIM против фермента у пациента с дефицитом фермента включает введение пациенту мультидоменного терапевтического белка (или кодирующей его нуклеиновой кислоты, например вектора для генной терапии, содержащего ген, кодирующий мультидоменный терапевтический белок, где мультидоменный терапевтический белок содержит домен доставки (например, белок, связывающий эффектор интернализации) и ферментный домен.
[125] Мультидоменный терапевтический белок содержит компонент, представляющий собой белок, связывающий эффектор интернализации, который обеспечивает поглощение заместительного фермента в клетку. Таким образом, в некоторых вариантах осуществления эффектор интернализации может представлять собой CD63, MHC-I, Kremen-1, Kremen-2, LRP5, LRP6, LRP8, рецептор трансферрина, LDL-рецептор, рецептор белка 1, родственного LDL, ASGR1, ASGR2, белок-2, подобный белку-предшественнику амилоида (APLP2), апелиновый рецептор (APLNR), PRLR (рецептор пролактина), MAL (миелиновый и лимфоцитарный белок, также известный, как VIP17), IGF2R, Н+ АТФазу вакуолярного типа, рецептор дифтерийного токсина, фолатный рецептор, глутаматные рецепторы, глутатионовый рецептор, лептиновый рецептор, фагоцитарный рецептор, SCARA1-5, SCARB1-3 и CD36. В определенных вариантах осуществления эффектор интернализации представляет собой специфический для почки интернализатор, такой как CDH16 (Cadheri-16), CLDN16 (Claudn-16), KL (Klotho), PTH1R (рецептор паратиреоидного гормона), SLC22A13 (семейство 22 транспортеров растворенных веществ, представитель 13), SLC5A2 (котранспортер 2 натрия/глюкозы) и UMOD (уромодулин). В других определенных вариантах осуществления эффектор интернализации представляет собой специфический в отношении мышц интернализатор, такой как BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерин, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергический рецептор (никотиновый) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14В, содержащий богатый лейцином повтор), дистрогликан (DAG1) и POPDC3 (белок 3, содержащий домен Рореуе). В некоторых вариантах осуществления эффектор интернализации представляет собой ITGA7, CD9, CD63, APLP2, ASGR1, ASGR2 или PRLR.
[126] В некоторых вариантах осуществления белок, связывающий эффектор интернализации, предусматривает антиген связывающий белок, который включает, например, слитую с рецептором молекулу, молекулу-ловушку, молекулу слияния с рецептором Fc, антитело, Fab-фрагмент, F(ab')2-фрагмент, Fd-фрагмент, Fv-фрагмент, молекулу одноцепочечного Fv (scFv), dAb-фрагмент, выделенную определяющую комплементарность область (CDR), пептид CDR3, конформационно затрудненный пептид FR3-CDR3-FR4, домен-специфическое антитело, однодоменное антитело, антитело с удаленным доменом, химерное антитело, антитело с привитой CDR, диатело, триатело, тетратело, минитело, нанотело, одновалентное нанотело, двухвалентное нанотело, иммунофармацевтическое средство на основе модульного белка малого размера (SMIP), верблюжье антитело (гомодимерное антитело на основе тяжелой цепи VHH), вариабельный домен IgNAR акулы.
[127] В одном варианте осуществления молекулярный объект, который связывается с эффектором интернализации, представляет собой антитело, фрагмент антитела или другой антигенсвязывающий белок. Например, молекулярный объект может представлять собой биспецифическое антитело, в котором одно плечо связывается с эффектором интернализации (например, ITGA7, CD9, CD63, PRLR, APLP2, ASGR1, ASGR2), а другое плечо связывается с заместительным ферментом. В данном документе мультидоменный терапевтический белок содержит биспецифическое антитело и заместительный фермент (фигура 1А). В конкретном варианте осуществления заболевание, подлежащее лечению, представляет собой болезнь Фабри, и мультидоменный терапевтический белок содержит GLA и биспецифическое антитело, которое связывает GLA и CD63. В конкретном варианте осуществления заболевание, подлежащее лечению, представляет собой болезнь Фабри, и мультидоменный терапевтический белок содержит GLA и биспецифическое антитело, которое связывает GLA и ITGA7. В другом конкретном варианте осуществления заболевание, подлежащее лечению, представляет собой болезнь Помпе, и мультидоменный терапевтический белок содержит GAA и биспецифическое антитело, которое связывает GAA и CD63. В другом конкретном варианте осуществления заболевание, подлежащее лечению, представляет собой болезнь Помпе, и мультидоменный терапевтический белок содержит GAA и биспецифическое антитело, которое связывает GAA и ITGA7.
[128] В другом варианте осуществления молекулярный объект, который связывается с эффектором интернализации, содержит полуантитело, и заместительный фермент содержит Fc-домен (слитый полипептид фермент-Fc). В одном варианте осуществления Fc-домен слитого полипептида фермент-Fc ассоциирует с Fc-доменом полуантитела, специфического в отношении эффектора интернализации, с образованием мультидоменного терапевтического белка (фигура 1В).
[129] В других вариантах осуществления заместительный фермент ковалентно связан с белком, связывающим эффектор интернализации. Вариант осуществления, представляющий собой слитый полипептид фермент-Fc: полуантитело, описанный в предыдущем параграфе (см. также фигура 1В), попадает в этот класс, поскольку димер Fc может быть скреплен с помощью одного или более дисульфидных мостиков. Ковалентная связь между доменом активности фермента или полипептидом и доменом или полипептидом, связывающими эффектор интернализации, может представлять собой любой тип ковалентной связи, т.е. любую связь, которая предусматривает распределение электронов. В некоторых случаях ковалентная связь представляет собой пептидную связь между двумя аминокислотами, такую, что заместительный фермент и белок, связывающий эффектор интернализации, полностью или частично формируют непрерывную полипептидную цепь, как в слитом белке. В некоторых случаях часть заместительного фермента и белок, связывающий эффектор интернализации, связаны непосредственно. В других случаях для прикрепления двух частей используется линкер. См. Chen et al., «Fusion protein linkers: property, design and functionality», 65(10) Adv Drug Deliv Rev. 1357-69 (2013).
[130] Термин «линкер» или «спейсер» относится к короткому (например, 2 25 аминокислот) полипептиду, который, как правило, обеспечивает правильную укладку одного или более связанных компонентов слитого белка, например, VH, связанного с VL scFv, терапевтического белка (например, заместительного фермента), связанного с доменом доставки (например, антителом к эффектору интернализации) мультидоменного терапевтического белка, как описано в данном документе. Линкер обеспечивает область гибкого соединения компонента слитого белка, обеспечивая независимое движение двух концов молекулы, и может играть важную роль в сохранении соответствующих функций каждого из двух фрагментов. Следовательно, область гибкого соединения в некоторых случаях действует как линкер, который объединяет две части вместе, и как спейсер, который обеспечивает образование собственных биологических структур каждой из двух их частей и не влияет на другую часть. Кроме того, область гибкого соединения должна обеспечивать создание эпитопа, который не будет распознаваться иммунной системой субъекта как чужеродный, другими словами, не будет рассматриваться как иммуногенный. Выбор линкера может также оказывать влияние на активность связывания слитой молекулы. (См. Huston, et al, 1988, PNAS, 85:16:5879-83; Robinson & Bates, 1998, PNAS 95(11):5929-34; Arai, et al. 2001, PEDS, 14(8):529-32 и Chen, X. et al., 2013, Advanced Drug Delivery Reviews 65:1357-1369). В одном варианте осуществления домен доставки присоединен к терапевтическому полипептиду или его фрагменту посредством одного или более пептидных линкеров. В другом варианте осуществления вариабельные области scFv антитела связаны друг с другом или их фрагментом посредством одного или более пептидных линкеров.
[131] Длина линкерной цепи может составлять 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 15 или более аминокислотных остатков, но как правило от 5 до 25 остатков. Примеры линкеров включают полиглициновые линкеры, такие как Gly-Gly, Gly-Gly-Gly (3Gly), 4Gly, 5Gly, 6Gly, 7Gly, 8Gly или 9Gly. Примеры линкеров также включают пептидные линкеры Gly-Ser, такие как Ser-Gly, Gly-Ser, Gly-Gly-Ser, Ser-Gly-Gly, Gly-Gly-Gly-Ser, Ser-Gly-Gly-Gly, Gly-Gly-Gly-Gly-Ser, Ser-Gly-Gly-Gly-Gly, Gly-Gly-Gly-Gly-Gly-Ser, Ser-Gly-Gly-Gly-Gly-Gly, Gly-Gly-Gly-Gly-Gly-Gly-Ser, Ser-Gly-Gly-Gly-Gly-Gly-Gly, (Gly-Gly-Gly-Gly-Ser)n и (Ser-Gly-Gly-Gly-Gly)n, где n=1-10. (Gly-Gly-Gly-Gly-Ser)n и (Ser-Gly-Gly-Gly-Gly)n также известны как (G4S)n и (S4G)n, соответственно.
[132] В конкретном варианте осуществления терапевтический белок, например заместительный фермент, ковалентно связан с С-концом тяжелой цепи (см. фигуру 1С) или с С-концом легкой цепи (фигура 1Е) антитела к эффектору интернализации. В некоторых вариантах осуществления заместительный фермент ковалентно связан с N-концом тяжелой цепи (см. фигуру 1D) или с N-концом легкой цепи (фигура 1F) антитела к эффектору интернализации. В некоторых вариантах осуществления фермент соединен с С-концом домена scFv антитела к эффектору интернализации (фигура 1G).
[133] В некоторых случаях, особенно если терапевтический белок, например заместительный фермент, в норме не подвергается протеолитическому расщеплению в лизосоме, в таких вариантах осуществления мультидоменного терапевтического белка, которые предусматривают слияние антитело-фермент, добавляют расщепляемый линкер. В некоторых вариантах осуществления между антителом и заместительным ферментом вставляют расщепляемый катепсином линкер для обеспечения удаления антитела в лизосоме с целью а) возможного способствования сохранению ферментативной активности с помощью удаления стерически крупного антитела и b) возможного увеличения времени полужизни фермента в лизосоме.
[134] В одном конкретном варианте осуществления мультидоменный терапевтический белок доставляется пациенту или клетке в составе вектора для генной терапии, который содержит полинуклеотид, который кодирует мультидоменный терапевтический белок. В одном варианте осуществления мультидоменный терапевтический белок содержит домен доставки и ферментный домен. В конкретном варианте осуществления домен доставки связывается с эффектором интернализации, таким как CD63, MHC-I, Kremen-1, Kremen-2, LRP5, LRP6, LRP8, рецептор трансферрина, LDL-рецептор, рецептор белка 1, родственный LDL, ASGR1, ASGR2, белок-2, подобный белку-предшественнику амилоида (APLP2), апелиновый рецептор (APLNR), MAL (миелиновый и лимфоцитарный белок (MAL), IGF2R, Н+ АТФаза вакуолярного типа, рецептор дифтерийного токсина, фолатный рецептор, глутаматные рецепторы, глутатионовый рецептор, лептиновые рецепторы, фагоцитарный рецептор А1-5 (SCARA1-5), SCARB1-3 или CD36. В одном варианте осуществления домен доставки представляет собой одноцепочечный вариабельный фрагмент (scFv), который связывается с CD63 (т.е. scFv к CD63). В другом варианте осуществления домен доставки представляет собой одноцепочечный вариабельный фрагмент (scFv), который связывается с ITGA7 (т.е. scFv к ITGA7).
[135] В одном конкретном варианте осуществления ферментный домен мультидоменного терапевтического белка предусматривает гидролазу. В конкретном варианте осуществления ферментный домен предусматривает гидролазу, которая представляет собой гликозилазу. В более конкретном варианте осуществления ферментный домен предусматривает гликозилазу, которая представляет собой гликозидазу. В более конкретном варианте осуществления ферментный домен представляет собой гликозидазу, которая представляет собой альфа-глюкозидазу.
[136] В целом, в данном документе раскрыты композиции, содержащие полинуклеотиды, и их применение, например (м)РНК, ДНК и их модифицированные формы, которые кодируют мультидоменный терапевтический белок, содержащий эффекторный домен интернализации и ферментный домен, в лечении лизосомных болезней накопления, например, для снижения уровня гликогена и/или усиления иммунной толерантности к GAA у пациента с болезнью Помпе.
[137] Термин «полинуклеотид» включает полимер из нуклеотидов (например, РНК или ДНК), который кодирует по меньшей мере один полипептид, включая слитые полипептиды, например мультидоменный терапевтический полипептид, содержащий эффекторный домен интернализации и ферментный домен. Используемый в данном документе термин полинуклеотид охватывает полимеры, содержащие как модифицированные, так и немодифицированные нуклеотиды. Полинуклеотид может содержать одну или более кодирующих и некодирующих областей. Полинуклеотид может быть очищен из природных источников, получен с применением рекомбинантных систем экспрессии и необязательно очищен, химически синтезирован и т.д. Где это уместно, например, в случае химически синтезированных молекул, полинуклеотид может содержать нуклеозидные аналоги, такие как аналоги, содержащие химически модифицированные основания или сахара, модификации основной цепи и т.д. Полинуклеотидная последовательность представлена в направлении от 5'- к 3'-концу, если не указано иное. В некоторых вариантах осуществления полинуклеотид представляет собой или содержит природные нуклеозиды (например, аденозин, гуанозин, цитидин, уридин); аналоги нуклеозидов (например, 2-аминоаденозин, 2-тиотимидин, инозин, пирролопиримидин, 3-метиладенозин, 5-метилцитидин, С-5-пропинилцитидин, С-5-пропинилуридин, 2-аминоаденозин, С5-бромуридин, С5-фторуридин, С5-йодуридин, С5-пропинилуридин, С5-пропинилцитидин, С5-метилцитидин, 2-аминоаденозин, 7-дезазааденозин, 7-дезазагуанозин, 8-оксоаденозин, 8-оксогуанозин, Щ(6)-метилгуанин и 2-тиоцитидин); химически модифицированные основания; биологически модифицированные основания (например, метилированные основания); интеркалированные основания; модифицированные сахара (например, 2'-фторрибоза, рибоза, 2'-дезоксирибоза, арабиноза и гексоза); и/или модифицированные фосфатные группы (например, фосфоротиоатные и 5'-N-фосфорамидитные связи).
[138] В некоторых вариантах осуществления полинуклеотид содержит один или более нестандартных нуклеотидных остатка. Нестандартные нуклеотидные остатки могут включать, например, 5-метилцитидин («5mC»), псевдоуридин («ψU») и/или 2-тиоуридин («2sU»). См., например, патент США №8278036 или WO2011012316, каждый из которых включен в данный документ в полном объеме посредством ссылки, в связи с обсуждением таких остатков и их включения в полинуклеотид. Присутствие нестандартных нуклеотидных остатков может сделать полинуклеотид более стабильным и/или менее иммуногенным, чем контрольный полинуклеотид с той же последовательностью, но содержащий только стандартные остатки. В дополнительных вариантах осуществления полинуклеотид может содержать один или более нестандартных нуклеотидных остатков, выбранных из изоцитозина, псевдоизоцитозина, 5-бромурацила, 5-пропинилурацила, 6-аминопурина, 2-аминопурина, инозина, диаминопурина и 2-хлор-6-аминопурина, цитозинов, а также комбинации этих модификаций и других модификаций нуклеиновых оснований. Определенные варианты осуществления могут, кроме того, включать дополнительные модификации фуранозного кольца или нуклеинового основания. Дополнительные модификации могут включать, например, модификации или замены сахара (например, одну или более из модификации 2'-O-алкила, блокированной нуклеиновой кислоты (LNA)). В некоторых вариантах осуществления полинуклеотид может образовывать комплекс или быть гибридизованным с дополнительными полинуклеотидами и/или пептидо-полинуклеотидами (PNA). В вариантах осуществления, где модификация сахара представляет собой 2'-O-алкил-модификацию, такая модификация может включать без ограничения 2'-дезокси-2'-фтор-модификацию, 2'-O-метил-модификацию, 2'-O-метоксиэтил-модификацию и 2'-дезокси-модификацию. В определенных вариантах осуществления любая из этих модификаций может присутствовать в 0-100% нуклеотидов, например, в более чем 0%, 1%, 10%, 25%, 50%, 75%, 85%, 90%, 95% или в 100% нуклеотидов, входящих в состав, по отдельности или в комбинации. В некоторых вариантах осуществления полинуклеотид включает молекулы информационной РНК (mRNA), которые могут быть или могут не быть модифицированными, например, которые могут содержать или могут не содержать модифицированы нуклеотид, с помощью хорошо известных способов с целью повышения их стабильности и/или снижения их иммуногенности. В некоторых вариантах осуществления полинуклеотид включает молекулы ДНК, которые могут, которые могут быть или могут не быть модифицированы, например, которые могут содержать или могут не содержать модифицированный нуклеотид, с помощью хорошо известных способов с целью повышения их стабильности и/или снижения их иммуногенности.
[139] В некоторых вариантах осуществления полинуклеотид также включает «последовательность нуклеиновой кислоты, нацеливающуюся на локус». Последовательность, нацеливающаяся на локус, обеспечивает возможность интеграции поли нуклеотида, кодирующего мультидоменный терапевтический белок, в геном клетки-хозяина реципиента. В некоторых вариантах осуществления последовательность, нацеливающаяся на локус, включает фланкирующие гомологичные плечи для обеспечения гомологичной рекомбинации. В некоторых вариантах осуществления последовательность, нацеливающаяся на локус, включает последовательности направляющей РНК и фермент Cas типа II для обеспечения интеграции (т.е. способ на основе CRISPR-Cas9). В некоторых вариантах осуществления последовательность, нацеливающаяся на локус, включает направляющие последовательности распознавания нуклеазы с «цинковыми пальцами» (ZFN) для обеспечения интеграции. В некоторых вариантах осуществления последовательность, нацеливающаяся на локус, включает последовательности распознавания эффекторной нуклеазы, подобной активаторам транскрипции (TALEN), для обеспечения интеграции. В других вариантах осуществления последовательность, нацеливающаяся на локус, включает код «один остаток-один нуклеотид», используемый нуклеазами, полученными на основе BuD, для обеспечения интеграции.
[140] В некоторых вариантах осуществления геномный локус, в который интегрируется полинуклеотид, кодирующий мультидоменный терапевтический белок, представляет собой локус «безопасной гавани». В одном варианте осуществления локус «безопасной гавани» обеспечивает высокую экспрессию мультидоменного терапевтического белка, не мешая при этом экспрессии основных генов или не стимулируя экспрессию онкогенов или других вредных генов. В одном варианте осуществления геномный локус находится внутри или поблизости локуса экспрессируемого в печени альбумина (Alb), локуса EESYR, локуса SARS, положения 188083272 на хромосоме 1 человека или его ортолога у млекопитающего, отличного от человека, положения 3046320 на хромосоме 10 человека или его ортолога у млекопитающего, отличного от человека, положения 67328980 на хромосоме 17 человека или его ортолога у млекопитающего, отличного от человека, сайта аденоассоциированного вируса 1 (AAVS1) на хромосоме, в норме имеющегося сайта интеграции вируса AAV на хромосоме 19 человека или его ортолога у млекопитающего, отличного от человека, гена рецептора хемокина 5 (CCR5), гена рецептора хемокина, кодирующего корецептор HIV-1, или локуса Rosa26 у мыши или его ортолога у млекопитающего, отличного от мыши. В одном варианте осуществления геномный локус представляет собой сайт аденоассоциированного вируса. В одном варианте осуществления геномный локус для интеграции выбирают в соответствии со способом согласно публикации Papapetrou и Schambach, J. Molecular Therapy, vol. 24 (4):678-684, April 2016, которая включена в данный документ посредством ссылки в отношении поэтапного выбора геномного локуса «безопасной гавани» для интеграции вектора для генной терапии; см. также публикацию Barzel et al. Nature, vol. 517:360-364, полностью включенную в данный документ посредством ссылки в отношении нацеливания гена без промотора в локус экспрессируемого в печени альбумина (Alb).
[141] В некоторых вариантах осуществления полинуклеотид, например ДНК, также содержит промотор, функционально связанный с последовательностью нуклеиновой кислоты, кодирующей мультидоменный терапевтический белок. В конкретном варианте осуществления промотор представляет собой тканеспецифический промотор, который управляет экспрессией гена в конкретной ткани. В одном варианте осуществления тканеспецифический промотор представляет собой специфический для печени энхансер/промотор, полученный из serpinal (например, SEQ ID NO:9), и/или представляет собой промотор TTR (SEQ ID NO:8). В других вариантах осуществления промотор представляет собой промотор CMV. В других вариантах осуществления промотор представляет собой промотор убиквитина С.
[142] В одном варианте осуществления «вектор для генной терапии», кодирующий мультидоменный терапевтический белок, представляет собой любой вектор, способный доставлять полинуклеотид, кодирующий мультидоменный терапевтический белок, хозяину, например, пациенту. В некоторых вариантах осуществления вектор для генной терапии нацелен на конкретную клетку-хозяина или орган, например, для локальной доставки, например тканеспецифической доставки. Как правило, в случае локальной доставки требуется, чтобы белок (например, мультидоменный терапевтический белок), кодируемый mRNA, транслировался и экспрессировался главным образом в органе и/или органом, например, в печени, где в результате этого образовывалось бы депо, например, депо в печени для продуцирования (и секреции) белка. В некоторых вариантах осуществления вектор для генной терапии доставляет полинуклеотид мультидоменного терапевтического белка в печень пациента с образованием депо в печени. См., например, публикацию DeRosa et al. Gene Therapy, vol. 10:699 707, полностью включенную в настоящий документ посредством ссылки. В некоторых вариантах осуществления вектор для генной терапии доставляет полинуклеотид, кодирующий мультидоменный терапевтический белок, в мышечную ткань пациента. В некоторых вариантах осуществления вектор для генной терапии доставляет полинуклеотид, кодирующий мультидоменный терапевтический белок, в мозг пациента.
[143] Любой природный или сконструированный вектор для генной терапии доставки, известный в настоящее время или который будет разработан в будущем, может быть использован в осуществлении настоящего изобретения. В некоторых вариантах осуществления вектор для генной терапии представляет собой вирусный вектор, например, содержит вирус, вирусный капсид, вирусный геном и т.д. В некоторых вариантах осуществления вектор для генной терапии представляет собой полинуклеотид без дополнительных средств, например эписому. В некоторых вариантах осуществления вектор для генной терапии включает полинуклеотидный комплекс. Иллюстративные неограничивающие полинуклеотидные комплексы для применения в качестве вектора для генной терапии включают липоплексы, полимерсомы, полипексы, дендримеры, неорганические наночастицы (например, покрытые полинуклеотидом золото, диоксид кремния, оксид железа, фосфат кальция и т.д.). В некоторых вариантах осуществления вектор для генной терапии, описанный в данном документе, содержит комбинацию вирусного вектора, полинуклеотидов без дополнительных средств и полинуклеотидных комплексов.
[144] В одном варианте осуществления вектор для генной терапии представляет собой вирус, включая ретровирус, аденовирус, вирус простого герпеса, поксвирус, вирус осповакцины, лентивирус или аденоассоциированный вирус. В одном варианте осуществления вектор для генной терапии представляет собой аденоассоциированный вирус (AAV), включая серотипы AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10 и AAV11 или их сконструированные варианты или варианты, возникшие в результате естественного отбора.
[145] В одном варианте осуществления полинуклеотид также содержит последовательность нуклеиновой кислоты аденоассоциированного вируса (AAV). В одном варианте осуществления вектор для генной терапии представляет собой химерный аденоассоциированный вирус, содержащий генетические элементы из двух или более серотипов. Например, вектор на основе AAV с генами rep из AAV1 и генами cap из AAV2 (обозначенные как AAV1/2 или AAV RC1/2) можно использовать в качестве вектора для генной терапии для доставки полинуклеотида мультидоменного терапевтического белка в клетку или клетку нуждающегося пациента. В одном варианте осуществления вектор для генной терапии представляет собой AAV1/2, AAV1/3, AAV1/4, AAV 1/5, AAV1/6, AAV1/7, AAV1/8, AAV1/9, AAV1/10, AAV1/11, AAV2/1, AAV2/3, AAV2/4, AAV2/5, AAV2/6, AAV2/7, AAV2/8, AAV2/9, AAV2/10, AAV2/11, AAV3/1, AAV3/2, AAV3/4, AAV3/5, AAV3/6, AAV3/7, AAV3/8, AAV3/9, AAV3/10, AAV3/10, AAV4/1, AAV4/2, AAV4/3, AAV4/5, AAV4/6, AAV4/7, AAV4/8, AAV4/9, AAV4/10, AAV4/11, AAV5/1, AAV5/2, AAV5/3, AAV5/4, AAV5/6, AAV5/7, AAV5/8, AAV5/9, AAV5/10, AAV5/11, AAV6/1, AAV6/2, AAV6/3, AAV6/4, AAV6/5, AAV6/7, AAV6/8, AAV6/9, AAV6/10, AAV6/10, AAV7/1, AAV7/2, AAV7/3, AAV7/4, AAV7/5, AAV7/6, AAV7/8, AAV7/9, AAV7/10, AAV7/11, AAV8/1, AAV8/2, AAV8/3, AAV8/4, AAV8/5, AAV8/6, AAV8/7, AAV8/9, AAV8/10, AAV8/11, AAV9/1, AAV9/2, AAV9/3, AAV9/4, AAV9/5, AAV9/6, AAV9/7, AAV9/8, AAV9/10, AAV9/11, AAV10/1, AAV10/2, AAV10/3, AAV10/4, AAV10/5, AAV10/6, AAV10/7, AAV10/8, AAV10/9, AAV10/11, AAV11/1, AAV11/2, AAV11/3, AAV11/4, AAV11/5, AAV11/6, AAV11/7, AAV11/8, AAV11/9, AAV11/10, химерный вирусный вектор или их производные. Публикация Gao et al., «Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy», PNAS 99(18): 11854-11859, Sep.3, 2002, включена в данный документ посредством ссылки в отношении векторов на основе AAV и химерных вирусных векторов, применимых в качестве векторов для генной терапии, а также их конструирования и применения.
[146] В более конкретном варианте осуществления вектор для генной терапии представляет собой химерный вектор на основе AAV с последовательностью гена rep серотипа 2 и последовательностью cap серотипа 8 («AAV2/8» или «AAV RC2/8»).
[147] В некоторых вариантах осуществления вектор для генной терапии представляет собой вирусный вектор, который был подвергнут псевдотипированию (например, сконструирован) для нацеливания на конкретную клетку, например гепатоцит.Многие из достижений в направленной генной терапии с применением вирусных векторов можно кратко описать как нерекомбинаторную (отличную от генетической) или рекомбинаторную (генетическую) модификацию вирусного вектора, которая приводит к псевдотипированию, расширению тропизма и/или изменению мишени тропизма естественного вирусного вектора. (Обзор в Nicklin и Baker (2002) Curr. Gene Ther. 2:273 93; Verheiji и Rottier (2012) Advances Virol 2012:1-15; ссылки на каждую из которых включены в данный документ в полном объеме посредством ссылки). В подходах, отличных от генетических, обычно используют адаптор, который распознает как поверхностный белок вируса дикого типа (немодифицированный), так и клетку-мишень. Растворимые псевдорецепторы (для вируса дикого типа), полимеры, такие как полиэтиленгликоль, и антитела или их части применяли в качестве вирус-связывающего домена адапторов, тогда как для связывающего клетку домена описанных выше адапторов применяли природные лиганды, представляющие собой пептиды или витамины, а также антитела и их части. Например, замена мишени вирусного вектора на клетку-мишень может быть выполнена после связывания комплекса вектор:адаптор с белком, экспрессируемым на поверхности клетки-мишени, например белком клеточной поверхности. Такой подход применяли для AAV (Bartlett et al. (1999) Nat. Biotechnol. 14: 2777-2785), аденовирусов (Hemminki et al. (2001) Cancer Res. 61: 6377-81; van Beusechem et al. (2003) Gene Therapy 10:1982-1991; Einfeld, et al. (2001) J. Virol. 75:11284-91; Glasgow et al. (2009) PLOS One 4:e8355), герпесвирусов (Nakano et al. (2005) Mol. Ther. 11:617-24) и парамиксовирусов (Bian et al. (2005) Cancer Gene Ther. 12:295-303; Bian et al. (2005) Int. J. Oncol. 29:1359-69), коронавирусов (Haijema et al. (2003) J. Virol. 77:4528-4538; Wurdinger et al. (2005) Gene Therapy 12:1394-1404; ссылка на каждую из которых включена в данный документ посредством ссылки).
[148] Более популярным подходом являлась рекомбинаторная генетическая модификация вирусных капсидных белков и, таким образом, поверхности вирусного капсида. При непрямых рекомбинаторных подходах вирусный капсид модифицируется с помощью гетерологичного «каркаса», который затем связывается с адаптором. Адаптор связывается с каркасом и клеткой-мишенью. (Arnold et al. (2006) Mol. Ther. 5:125-132; Ponnazhagen et al. (2002) J. Virol. 76:12900-907; см. также WO 97/05266, ссылка на каждую из которых включена в данный документ посредством ссылки). Каркасы, такие как (1) Fc-связывающие молекулы (например, Fc-рецепторы, белок А и т.д.), которые связываются с Fc антител-адапторов, (2) (стрепт)авидин, который связывается с биотинилированными адапторами, (3) биотин, который связывается с адапторами, слитыми со (стрепт)авидином, и (4) пары связывания белок: белок, которые образуют изометрические пептидные связи, такие как SpyCatcher, который связывает адаптор SpyTagged, были включены в Ad (Pereboeva et al. (2007) Gene Therapy 14: 627-637; Park et al. (2008) Biochemical and Biophysical Research Communications 366: 769 774; Henning et al. (2002) Human Gene Therapy 13:1427-1439; Banerjee et al. (2011) Bioorganic and Medicinal Chemistry Letters 21:4985-4988), AAV (Gigout et al. (2005) Molecular Therapy 11:856-865; Stachler et al. (2008) Molecular Therapy 16:1467-1473) и тогавирус (Quetglas et al. (2010) Virus Research 153:179-196; Ohno et al. (1997) Nature Biotechnology 15:763-767; Klimstra et al. (2005) Virology 338:9-21; ссылки на каждую из которых включены в данный документ посредством ссылки).
[149] При прямом рекомбинаторном подходе к нацеливанию нацеливающий лиганд непосредственно вставляется в вирусный капсид или соединяется с ним, то есть белковые вирусные капсиды модифицируются для экспрессии гетерологичного лиганда. Лиганд, кроме того, перенаправляет, например, связывает рецептор или маркер, преимущественно или исключительно экспрессируемый на клетке-мишени. (Stachler et al. (2006) Gene Ther. 13:926-931; White et al. (2004) Circulation 109:513-519; ссылки на каждую из которых включены в данный документ в полном объеме посредством ссылки). Прямые рекомбинаторные подходы применяли для AAV (Park et al., (2007) Frontiers in Bioscience 13:2653 59; Girod et al. (1999) Nature Medicine 5:1052-56; Grifman et al. (2001) Molecular Therapy 3:964-75; Shi et al. (2001) Human Gene Therapy 12:1697-1711; Shi and Bartlett (2003) Molecular Therapy 7:515 525, ссылки на каждую из которых включены в данный документ в полном объеме посредством ссылки), ретровируса (Dalba et al. Current Gene Therapy 5:655-667; Tai and Kasahara (2008) Frontiers in Bioscience 13:3083-3095; Russell and Cosset (1999) Journal of Gene Medicine 1:300-311; Erlwein et al. (2002) Virology 302:333-341; Chadwick et al. (1999) Journal of Molecular Biology 285:485-494; Pizzato et al. (2001) Gene Therapy 8:1088-1096), поксвируса (Guse et al. (2011) Expert Opinion on Biological Therapy 11:595 608; Galmiche et al. (1997) Journal of General Virology 78:3019 3027; Paul et al. (2007) Viral Immunology 20:664 671), парамиксовируса (Nakamura and Russell (2004) Expert Opinion on Biological Therapy 4:1685 1692; Hammond et al. (2001) Journal of Virology 75:2087-2096; Galanis (2010) Clinical Pharmacology and Therapeutics 88:620-625; Blechacz and Russell (2008) Current Gene Therapy 8:162-175; Russell and Peng (2009) Current Topics in Microbiology and Immunology 330:213-241) и герпесвируса (Shah and Breakefield (2006) Current Gene Therapy 6:361-370; Campadelli-Fiume et al. (2011) Reviews in Medical Virology 21:213 226; ссылки на каждую из которых включены в данный документ в полном объеме посредством ссылки).
[150] В некоторых вариантах осуществления вектор для генной терапии, описанный в данном документе, подвергается псевдотипированию в отношении тех тканей, которые особенно подходят для генерации регуляторного ответа, например толерантности, например к заместительному ферменту. Такие ткани включают без ограничения слизистую ткань, например, кишечно-ассоциированную лимфоидную ткань (GALT), гемопоэтические стволовые клетки и печень. В некоторых вариантах осуществления вектор для генной терапии или ген, кодирующий мультидоменный терапевтический белок, описанный в данном документе, экспрессируются под контролем промоторов, специфических для этих тканей, например специфического в отношении печени промотора.
[151] В некоторых вариантах осуществления вектор для генной терапии, описанный в данном документе, предусматривает полинуклеотид без дополнительных средств. Например, в некоторых вариантах осуществления полинуклеотид, кодирующий мультидоменный терапевтический полипептид, можно вводить, например, внутримышечно, непосредственно в орган для образования депо, внутривенно и т.д. Дополнительные хорошо известные способы улучшенной доставки полинуклеотидов без дополнительных средств включают без ограничения электропорацию, сонопорацию, применение генной пушки для «стрельбы» частицами золота, покрытыми полинуклеотидами, магнитофекцию и гидродинамическую доставку.
[152] В некоторых вариантах осуществления вектор для генной терапии, описанный в данном документе, содержит полинуклеотидные комплексы, такие как без ограничения наночастицы (например, самоорганизующиеся наночастицы полинуклеотидов, самоорганизующиеся наночастицы на основе полимеров, неорганические наночастицы, липидные наночастицы, полупроводниковые/металлические наночастицы), гели и гидрогели, полинуклеотидные комплексы с катионами и анионами, микрочастицы и любые их комбинации.
[153] В некоторых вариантах осуществления полинуклеотиды, раскрытые в данном документе, могут быть составлены в виде самоорганизующихся наночастиц. В качестве неограничивающего примера полинуклеотиды могут использоваться для получения наночастиц, которые могут использоваться в системе доставки для полинуклеотидов (см., например, международную публикацию №WO2012125987; которая включена в данный документ в полном объеме посредством ссылки). В некоторых вариантах осуществления полинуклеотидные самоорганизующиеся наночастицы могут содержать ядро из полинуклеотидов, раскрытых в данном документе, и полимерную оболочку. Полимерная оболочка может представлять собой любой из полимеров, описанных в данном документе, и они известны из уровня техники. В дополнительном варианте осуществления полимерная оболочка может применяться для защиты полинуклеотидов в ядре.
[154] В некоторых вариантах осуществления эти самоорганизующиеся наночастицы могут представлять собой микрогубки, образованные из длинных полимеров, состоящих из полинуклеотидных «шпилек», которые формируются в кристаллические «плиссированные» листы перед самоорганизацией в микрогубки. Эти микрогубки представляют собой плотно упакованные губчатые микрочастицы, которые могут функционировать как эффективный носитель и могут доставлять груз в клетку. Диаметр микрогубок может составлять от 1 до 300 нм. Микрогубки можно объединять в комплексы с другими веществами, известными из уровня техники, для образования более крупных микрогубок. В качестве неограничивающего примера микрогубку можно объединять в комплекс со средством для формирования наружного слоя, способствующего клеточному поглощению, таким как поликатион полиэтиленим (PEI). Этот комплекс может образовывать частицы диаметром 250 нм, которые могут оставаться стабильными при высоких температурах (150°С). (Grabow and Jaegar, Nature Materials 2012, 11:269 269; включенный в данный документ в полном объеме посредством ссылки). Кроме того, эти микрогубки могут обладать способностью проявлять исключительную степень защиты от разложения рибонуклеазами. В другом варианте осуществления самоорганизующиеся наночастицы на основе полимера, такие как без ограничения микрогубки, могут являться полностью программируемыми наночастицами. Геометрию, размер и стехиометрию наночастиц можно точно контролировать, чтобы создать оптимальную наночастицу для доставки груза, такого как без ограничения полинуклеотиды.
[155] В некоторых вариантах осуществления полинуклеотиды могут быть составлены в неорганических наночастицах (патент США №8257745, включенный в данный документ в полном объеме посредством ссылки). Неорганические наночастицы могут включать без ограничения глинистые вещества, которые набухают в воде. В качестве неограничивающего примера неорганическая наночастица может включать синтетические смектитовые глины, которые изготовлены из простых силикатов (см., например, патенты США №№5585108 и 8257745, каждый из которых включен в данный документ в полном объеме посредством ссылки).
[156] В некоторых вариантах осуществления полинуклеотид может быть составлен в виде диспергируемой в воде наночастицы, содержащей полупроводниковый или металлический материал (публикация патента США №20120228565; включенная в данный документ в полном объеме посредством ссылки) или составлен в виде магнитной наночастицы (публикации патента США №№20120265001 и 20120283503; каждая из которых включена в данный документ в полном объеме посредством ссылки). Диспергируемые в воде наночастицы могут представлять собой гидрофобные наночастицы или гидрофильные наночастицы.
[157] В некоторых вариантах осуществления полинуклеотиды, раскрытые в данном документе, могут быть инкапсулированы в любой гидрогель, известный из уровня техники, который может образовывать гель при инъекции субъекту. Гидрогели представляют собой сеть полимерных цепей, которые являются гидрофильными, и иногда находятся в виде коллоидного геля, в котором вода является дисперсионной средой. Гидрогели являются (они могут содержать более 99% воды) природными или синтетическими полимерами с высокой абсорбционной способностью. Гидрогели также обладают степенью гибкости, очень близкой к такой в живых тканях, благодаря значительному содержанию в них воды. Описанный в данном документе гидрогель может применяться для инкапсулирования липидных наночастиц, которые являются биосовместимыми, биоразлагаемыми и/или пористыми.
[158] В качестве неограничивающего примера гидрогель может представлять собой гидрогель, функционализированный с помощью аптамера. Гидрогель, функционализированный с помощью аптамера, может быть запрограммирован на высвобождение одного или более полинуклеотидов с применением гибридизации полинуклеотидов. (Battig et al., J. Am. Chem. Society. 2012 134:12410-12413; включенный в данный документ в полном объеме посредством ссылки). В некотором варианте осуществления полинуклеотид может быть инкапсулирован в липидную наночастицу, а затем липидная наночастица может быть инкапсулирована в гидрогель.
[159] В некоторых вариантах осуществления полинуклеотиды, раскрытые в данном документе, могут быть инкапсулированы в фибриновый гель, фибриновый гидрогель или фибриновый клей. В другом варианте осуществления полинуклеотиды могут быть составлены в виде липидной наночастицы или быстро удаляемой липидной наночастицы перед инкапсулированием в фибриновый гель, фибриновый гидрогель или фибриновый клей. В еще одном варианте осуществления полинуклеотиды могут быть составлены в виде липоплекса перед инкапсулированием в фибриновый гель, гидрогель или фибриновый клей. Фибриновые гели, гидрогели и клеи содержат два компонента: раствор фибриногена и раствор тромбина с высоким содержанием кальция (см., например, Spicer and Mikos, Journal of Controlled Release 2010. 148: 49-55; Kidd et al. Journal of Controlled Release 2012. 157:80-85; каждый из которых включен в данный документ в полном объеме посредством ссылки). Концентрация компонентов фибринового геля, гидрогеля и/или клея может быть изменена для изменения характеристик, размера ячеек сети и/или характеристик разложения геля, гидрогеля и/или клея, таких как без ограничения изменение характеристик высвобождения фибринового геля, гидрогеля и/или клея. (См., например, Spicer and Mikos, Journal of Controlled Release 2010. 148: 49-55; Kidd et al. Journal of Controlled Release 2012. 157:80-85; Catelas et al. Tissue Engineering 2008. 14:119-128; каждый из которых включен в данный документ в полном объеме посредством ссылки). Этот признак может быть полезным в случае использования для доставки полинуклеотида, раскрытого в данном документе. (См., например, Kidd et al. Journal of Controlled Release 2012. 157:80-85; Catelas et al. Tissue Engineering 2008. 14:119-128; каждый из которых включен в данный документ в полном объеме посредством ссылки).
[160] В некоторых вариантах осуществления полинуклеотид, раскрытый в данном документе, может содержать катионы или анионы. В одном варианте осуществления составы содержат катионы металлов, такие как без ограничения Zn2+, Са2+, Cu2+, Mg+ и их комбинации. В качестве неограничивающего примера составы могут содержать полимеры и полинуклеотид, образующие комплекс с катионом металла (см., например, патенты США №№6265389 и 6555525, каждый из которых включен в данный документ в полном объеме посредством ссылки).
[161] В некоторых вариантах осуществления полинуклеотид может быть составлен в виде наночастиц и/или микрочастиц. Эти наночастицы и/или микрочастицы могут быть отлиты в форму любого размера и химического состава. В качестве примера наночастицы и/или микрочастицы могут быть получены с применением технологии PRINT® от LIQUIDA TECHNOLOGIES.RTM. (Моррисвилль, Северная Каролина, США) (см., например, международную публикацию № WO 2007024323; которая включена в данный документ в полном объеме посредством ссылки).
[162] В некоторых вариантах осуществления полинуклеотиды, раскрытые в данном документе, могут быть составлены в виде наночастиц NanoJacket и NanoLiposome от Keystone Nano (Стейт Колледж, Пенсильвания, США). Наночастицы NanoJacket изготовлены из соединений, которые в норме содержатся в организме, включая кальций, фосфат, и могут также включать небольшое количество силикатов. Размер наночастиц NanoJacket может составлять от 5 до 50 нм, и их можно применять для доставки гидрофильных и гидрофобных соединений, таких как без ограничения полинуклеотиды, первичные конструкции и/или полинуклеотид. Наночастицы NanoLiposome получают из липидов, таких как без ограничения липиды, которые в норме содержатся в организме. Размер наночастиц NanoLiposome может составлять 60-80 нм и их можно использовать для доставки гидрофильных и гидрофобных соединений, таких как без ограничения полинуклеотиды, первичные конструкции и/или полинуклеотид. В одном аспекте полинуклеотиды, раскрытые в данном документе, составлены в виде наночастицы NanoLiposome, такой как без ограничения Ceramide NanoLiposome.
[163] В одном варианте осуществления мультидоменный терапевтический белок представляет собой слитый белок, содержащий scFv к CD63 и GAA, или слитый белок, содержащий scFv к ITGA7 и GAA. Введение слитого белка, содержащего scFv к CD63 и GAA, или слитого белка, содержащего scFv к ITGA7 и GAA, посредством AAV-доставки обеспечивает долгосрочное стабильное продуцирование GAA в сыворотке крови пациента после введения вектора для генной терапии, содержащего мультидоменный терапевтический белок. В одном варианте осуществления уровень содержания GAA в сыворотке крови пациента-реципиента в ≥1,5 раза 100 раз, в ≥1,5 раза 10 раз, в ≥2,5 раза, в 2,5 раза 3 раза, в 2,5 раза, в 2,6 раза, в 2,7 раза, в 2,8 раза, в 2,9 раза, в 3,0 раза, в 3,1 раза, в 3,2 раза, в 3,3 раза, в 3,4 раза, в 3,5 раза, в 3,6 раза, в 3,7 раза, в 3,8 раза, в 3,9 раза, в 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз или в 10 раз выше, чем уровни содержания в сыворотке крови пациента, получающего GAA, не соединенный с доменом доставки, спустя 1 месяц, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после введения вектора для генной терапии, содержащего мультидоменный терапевтический белок.
[164] В одном варианте осуществления введение слитого белка, содержащего scFv к CD63 и GAA, или слитого белка, содержащего scFv к ITGA7 и GAA, посредством AAV-доставки обеспечивает долговременное стабильное снижение уровней содержания накопленного гликогена у пациентов с болезнью Помпе. В одном варианте осуществления уровни содержания гликогена в сердечной, скелетной мышце и ткани печени у пациента снижаются до уровней, характерных для дикого типа (без заболевания). В одном варианте осуществления уровни содержания гликогена в сердечной, скелетной мышце и ткани печени у пациента поддерживаются на уровнях, характерных для дикого типа, спустя 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после введения вектора для генной терапии, содержащего мультидоменный терапевтический белок.
[165] В одном варианте осуществления введение слитого белка, содержащего scFv к CD63 и GAA, или слитого белка, содержащего scFv к ITGA7 и GAA, посредством AAV-доставки обеспечивает долгосрочное восстановление мышечной силы у пациентов с болезнью Помпе. В одном варианте осуществления сила пациента, измеренная по силе захвата, восстанавливается до нормы (т.е. нормального уровня, характерного для состояния без заболевания) через 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после введения вектора для генной терапии, содержащего мультидоменный терапевтический белок.
[166] В другом аспекте настоящее изобретение предусматривает композицию, обладающую ферментной активностью и содержащую антигенсвязывающий белок, где фермент ассоциирован с заболеванием, связанным с дефицитом ферментов (LSD), и белком, связывающим эффектор интернализации. Ферменты (включающие белки, которые не являются каталитическими per se), ассоциированные с лизосомными болезнями накопления, включают, например, любые возможные гидролазы, α-галактозидазу, β-галактозидазу, α-глюкозидазу, β-глюкозидазу, активатор сапозина-С, церамидазу, сфингомиелиназу, β-гексозаминидазу, активатор GM2, GM3-синтазу, арилсульфатазу, активатор сфинголипида, α-идуронидазу, идуронидаза-2-сульфатазу, гепарин-N-сульфатазу, N-ацетил-α-глюкозаминидазу, α-глюкозамид-N-ацетилтрансферазу, N-ацетилглюкозамин-6-сульфатазу, N-ацетилгалактозамин-6-сульфат-сульфатазу, N-ацетилгалактозамин-4-сульфатазу, β-глюкуронидазу, гиалуронидазу и т.п.
[167] Белки, связывающие эффектор интернализации, например, включают молекулу слияния с рецептором, молекулу-ловушку, молекулу слияния с рецептором Fc, антитело, Fab-фрагмент, F(ab')2-фрагмент, Fd-фрагмент, Fv-фрагмент, молекулу одноцепочечного Fv (scFv), dAb-фрагмент, выделенную определяющую комплементарность область (CDR), пептид CDR3, конформационно затрудненный пептид FR3-CDR3-FR4, домен-специфическое антитело, однодоменное антитело, антитело с удаленным доменом, химерное антитело, антитело с привитой CDR, диатело, триатело, тетратело, минитело, нанотело, одновалентное нанотело, двухвалентное нанотело, иммунофармацевтическое средство на основе модульного белка малого размера (SMIP), верблюжье антитело (гомодимерное антитело на основе тяжелой цепи VHH), вариабельный домен IgNAR акулы, другие антигенсвязывающие белки и т.п.
[168] Эффекторы интернализации включают, например, CD63, MHC-I, Kremen-1, Kremen-2, LRP5, LRP6, LRP8, рецептор трансферрина, LDL-рецептор, рецептор белка 1, родственного LDL, ASGR1, ASGR2, белок-2, подобный белку-предшественнику амилоида (APLP2), апелиновый рецептор (APLNR), PRLR (рецептор пролактина), MAL (миелиновый и лимфоцитарный белок, также известный, как VIP17), IGF2R, Н+ АТФазу вакуолярного типа, рецептор дифтерийного токсина, фолатный рецептор, глутаматные рецепторы, глутатионовый рецептор, лептиновый рецептор, фагоцитарный рецептор, SCARA1-5, SCARB1-3 и CD36. В определенных вариантах осуществления эффектор интернализации представляет собой специфический для почки интернализатор, такой как CDH16 (Cadheri-16), CLDN16 (Claudn-16), KL (Klotho), PTH1R (рецептор паратиреоидного гормона), SLC22A13 (семейство 22 транспортеров растворенных веществ, представитель 13), SLC5A2 (котранспортер 2 натрия/глюкозы) и UMOD (уромодулин). В других определенных вариантах осуществления эффектор интернализации представляет собой специфический в отношении мышц интернализатор, такой как BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерин, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергический рецептор (никотиновый) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14В, содержащий богатый лейцином повтор), дистрогликан (DAG1) и POPDC3 (белок 3, содержащий домен Рореуе). В некоторых вариантах осуществления эффектор интернализации представляет собой ITGA7, CD9, CD63, ALPL2, ASGR1, ASGR2 или PRLR.
[169] В некоторых вариантах осуществления фермент ковалентно связан (т.е. электроны распределяются между атомами) с антигенсвязывающим белком. В одном конкретном варианте осуществления белок, связывающий эффектор интернализации, состоит из полуантитела или содержит таковое; фермент слит с Fc-слитым доменом (например, на С-конце); и Fc-домен, который ковалентно связан с ферментом, ассоциируется с Fc-доменом антигенсвязывающего белка так, что ассоциация предусматривает один или более дисульфидных мостиков. Данный конкретный вариант осуществления схематически изображен на фигуре 1А, панель В.
[170] В другом конкретном варианте осуществления белок, связывающий эффектор интернализации (домен доставки), состоит из антитела или фрагмента антитела или содержит таковые, и фермент ковалентно связан с антителом или фрагментом антитела. В конкретном варианте осуществления домен доставки представляет собой антитело, и фермент ковалентно связан (непосредственно с помощью пептидной связи или опосредованно с помощью линкера) с С-концом тяжелой цепи или легкой цепи антитела (фигура 1А, панели С или Е, соответственно). В другом конкретном варианте осуществления домен доставки представляет собой антитело, и фермент ковалентно связан (непосредственно с помощью пептидной связи или опосредованно с помощью линкера) с N-концом тяжелой цепи или легкой цепи антитела (фигура 1А, панели D или F, соответственно).
[171] В некоторых вариантах осуществления фермент и домен доставки не связаны ковалентно, а объединены в смесь. Домен доставки и фермент могут связываться посредством нековалентных сил с образованием комплекса. Например, в одном конкретном варианте осуществления домен доставки представляет собой биспецифическое антитело, в котором одно плечо антитела связывается с эффектором интернализации, а другое плечо связывается с ферментом. Данный вариант осуществления схематически изображен на фигуре 1А, панель А.
[172] В некоторых вариантах осуществления фермент представляет собой GAA или обладает активностью GAA (например, изозим с активностью GAA), и эффектор интернализации представляет собой ITGA7, CDH15, CD9, CD63, APLP2, ASGR1, ASGR2 или PRLR. В конкретном варианте осуществления фермент представляет собой GAA или обладает активностью GAA, домен интернализации представляет собой CD63, и домен доставки представляет собой биспецифическое антитело со специфичностью в отношении CD63 и GAA. В конкретном варианте осуществления фермент представляет собой GAA или обладает активностью GAA, домен интернализации представляет собой ITGA7, и домен доставки представляет собой биспецифическое антитело со специфичностью в отношении ITGA7 и GAA.
[173] В некоторых вариантах осуществления фермент представляет собой GLA или обладает активностью GLA (например, изозим с активностью GAA), и эффектор интернализации представляет собой ITGA7, CD9, CD63, APLP2, ASGR1, ASGR2 или PRLR. В конкретном варианте осуществления фермент представляет собой GLA или обладает активностью GLA, домен интернализации представляет собой CD63, и домен доставки представляет собой биспецифическое антитело со специфичностью в отношении CD63 и GLA. В конкретном варианте осуществления фермент представляет собой GLA или обладает активностью GLA, домен интернализации представляет собой ITGA7, и домен доставки представляет собой биспецифическое антитело со специфичностью в отношении ITGA7 и GLA.
Фармацевтические композиции и их введение
[174] Фармацевтические составы могут дополнительно содержать фармацевтически приемлемое вспомогательное вещество, которое, как используется в данном документе, включает любые возможные растворители, дисперсионные среды, разбавители или другие жидкие среды-носители, средства для диспергирования или суспендирования, поверхностно-активные средства, изотонические средства, загущающие или эмульгирующие средства, консерванты, твердые связующие вещества, смазывающие вещества и т.п., подходящие для конкретной требуемой лекарственной формы. В публикации Remington's The Science and Practice of Pharmacy, 21.sup.st Edition, A. R. Gennaro (Lippincott, Williams & Wilkins, Baltimore, Md., 2006; которая включена в данный документ в полном объеме посредством ссылки), раскрыты различные вспомогательные вещества, используемые при составлении фармацевтических композиций, и известные методики для их получения. За исключением случаев, когда какая-либо обычная среда на основе вспомогательного вещества несовместима с веществом или его производными, например, из-за какого-либо нежелательного биологического эффекта или из-за другого взаимодействия вредным образом с любым другим компонентом(-ами) фармацевтической композиции, предполагается, что ее использование находится в пределах объема настоящего изобретения.
[175] В некоторых вариантах осуществления фармацевтически приемлемое вспомогательное вещество является чистым на по меньшей мере 95%, меньшей мере 96%, меньшей мере 97%, меньшей мере 98%, меньшей мере 99% или меньшей мере 100%. В некоторых вариантах осуществления вспомогательное вещество одобрено для применения у людей и для ветеринарного применения. В некоторых вариантах осуществления вспомогательное вещество одобрено Управлением по контролю качества продуктов и лекарственных препаратов США. В некоторых вариантах вспомогательное вещество характеризуется фармацевтической степенью чистоты. В некоторых вариантах осуществления вспомогательное вещество соответствует стандартам Фармакопеи США (USP), Европейской Фармакопеи (ЕР), Британской Фармакопеи и/или Международной Фармакопеи.
[176] Фармацевтически приемлемые вспомогательные вещества, применяемые в получении фармацевтических композиций, включают без ограничения инертные разбавители, диспергирующие и/или гранулирующие средства, поверхностно-активные средства и/или эмульгаторы, дезинтегрирующие средства, связующие средства, консерванты, буферные средства, смазывающие средства и/или масла. Такие вспомогательные вещества могут быть необязательно включены в фармацевтические композиции.
[177] Иллюстративные разбавители включают без ограничения карбонат кальция, карбонат натрия, фосфат кальция, дикальция фосфат, сульфат кальция, гидрофосфат кальция, фосфат натрия, лактозу, сахарозу, целлюлозу, микрокристаллическую целлюлозу, каолин, маннит, сорбит, инозит, хлорид натрия, сухой крахмал, кукурузный крахмал, сахарную пудру и т.д. и/или их комбинации.
[178] Иллюстративные гранулирующие и/или диспергирующие средства включают без ограничения картофельный крахмал, кукурузный крахмал, крахмал тапиоки, натрия крахмала гликолят, глины, альгиновую кислоту, гуаровую камедь, мякоть цитрусовых, агар, бентонит, целлюлозу и продукты переработки древесины, натуральную губку, катионообменные смолы, карбонат кальция, силикаты, карбонат натрия, сшитый поли(винилпирролидон) (кросповидон), карбоксиметилкрахмал натрия (крахмалгликолят натрия), карбоксиметилцеллюлозу, сшитую карбоксиметилцеллюлозу натрия (кроскармеллозу), метилцеллюлозу, предварительно желатинизированный крахмал (крахмал 1500), микрокристаллический крахмал, нерастворимый в воде крахмал, карбоксиметилцеллюлозу кальция, алюмосиликат магния (VEEGUM®), лаурилсульфат натрия, соединения четвертичного аммония и т.д. и/или их комбинации.
[179] Иллюстративные поверхностно-активные средства и/или эмульгаторы включают без ограничения природные эмульгаторы (например, акацию, агар, альгиновую кислоту, альгинат натрия, трагакант, хондрукс, холестерин, ксантан, пектин, желатин, яичный желток, казеин, ланолин, холестерин, воск и лецитин), коллоидные глины (например, бентонит [силикат алюминия] и VEEGUM® [алюмосиликат магния]), производные аминокислот с длинной цепью, высокомолекулярные спирты (например, стеариловый спирт, цетиловый спирт, олеиловый спирт, моностеарат триацетина, дистеарат этиленгликоля, глицерилмоностеарат и моностеарат пропиленгликоля, поливиниловый спирт), карбомеры (например, карбоксиполиметилен, полиакриловая кислота, полимер акриловой кислоты и карбоксивиниловый полимер), каррагенан, производные целлюлозы (например, карбоксиметилцеллюлозу натрия, порошкообразную целлюлозу, гидроксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу), сложные эфиры сорбитана и жирных кислот (например, полиоксиэтиленсорбитанмонолаурат [TWEEN® 20], полиоксиэтиленсорбитан [TWEEN® 60], полиоксиэтиленсорбитанмоноолеат [TWEEN® 80], сорбитанмонопальмитат [SPAN® 40], сорбитанмоностеарат [SPAN® 60], сорбитантристеарат [SPAN® 65], глицерилмоноолеат, сорбитанмоноолеат [SPAN® 80]), сложные эфиры полиоксиэтилена (например, полиоксиэтиленмоностеарат [MYRJ® 45], полиоксиэтиленовое гидрогенизированное касторовое масло, полиэтоксилированное касторовое масло, полиоксиметиленстеарат и SOLUTOL®), сложные эфиры сахарозы и жирных кислот, сложные эфиры жирных кислот и полиэтиленгликоля (например, CREMOPHOR®), эфиры полиоксиэтилена (например, полиоксиэтиленовый эфир лаурилового спирта [BRIJ® 30]), поли(винилпирролидон), монолаурат диэтиленгликоля, олеат триэтаноламина, олеат натрия, олеат калия, этилолеат, олеиновую кислоту, этиллаурат, лаурилсульфат натрия, PLUORINC® F 68, POLOXAMER® 188, бромид цетримония, хлорид цетилпиридиния, хлорид бензалкония, докузат натрия и т.д. и/или их комбинации.
[180] Иллюстративные связывающие средства включают без ограничения крахмал (например, кукурузный крахмал и крахмальную пасту); желатин; сахара (например, сахарозу, глюкозу, декстрозу, декстрин, мелассу, лактозу, лактит, маннит); природные и синтетические камеди (например, гуммиарабик, альгинат натрия, экстракт ирландского мха, камедь «панвар», камедь гхатти, слизь из оболочек семян подорожника блошиного, карбоксиметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, ацетилцеллюлозу, поли(винилпирролидон), алюмосиликат магния (Veegum®) и арабогалактан лиственницы); альгинаты; полиэтиленоксид; полиэтиленгликоль; неорганические соли кальция; кремниевую кислоту; полиметакрилаты; воски; воду; спирт и т.д. и их комбинации.
[181] Иллюстративные консерванты могут включать без ограничения антиоксиданты, хелатирующие средства, антимикробные консерванты, противогрибковые консерванты, спиртовые консерванты, кислотные консерванты и/или другие консерванты. Иллюстративные антиоксиданты включают без ограничения альфа-токоферол, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидроксианизол, бутилированный гидрокситолуол, монотиоглицерин, метабисульфит калия, пропионовую кислоту, пропилгаллат, аскорбат натрия, бисульфат натрия, метабисульфит натрия и/или сульфит натрия. Иллюстративные хелатирующие средства включают этилендиаминтетрауксусную кислоту (EDTA), моногидрат лимонной кислоты, динатрия эдетат, дикалия эдетат, эдетовую кислоту, фумаровую кислоту, яблочную кислоту, фосфорную кислоту, натрия эдетат, винную кислоту и/или тринатрия эдетат. Иллюстративные антимикробные консерванты включают без ограничения хлорид бензалкония, хлорид бензетония, бензиловый спирт, бронопол, цетримид, хлорид цетилпиридиния, хлоргексидин, хлорбутанол, хлоркрезол, хлороксиленол, крезол, этиловый спирт, глицерин, гексетидин, имидомочевину, фенол, феноксиэтанол, фенилэтиловый спирт, фенилмеркуриевый нитрат, пропиленгликоль и/или тимеросал. Иллюстративные противогрибковые консерванты включают без ограничения бутилпарабен, метилпарабен, этилпарабен, пропилпарабен, бензойную кислоту, гидроксибензойную кислоту, бензоат калия, сорбат калия, бензоат натрия, пропионат натрия и/или сорбиновую кислоту. Иллюстративные спиртовые консерванты включают без ограничения этанол, полиэтиленгликоль, фенол, фенольные соединения, бисфенол, хлорбутанол, гидроксибензоат и/или фенилэтиловый спирт. Иллюстративные кислотные консерванты включают без ограничения витамин А, витамин С, витамин Е, бета-каротин, лимонную кислоту, уксусную кислоту, дегидроуксусную кислоту, аскорбиновую кислоту, сорбиновую кислоту и/или фитиновую кислоту. Другие консерванты включают без ограничения токоферол, токоферола ацетат, детероксим мезилат, цетримид, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВИТ), этилендиамин, лаурилсульфат натрия (SLS), лауретсульфат натрия (SLES), бисульфит натрия, метабисульфит натрия, сульфит калия, метабисульфит калия, GLYDANT PLUS®, PHENONIP®, метилпарабен, GERMALL® 115, GERMABEN® II, NEOLONE.TM., KATHON.TM. и/или EUXYL®.
[182] Иллюстративные буферные средства включают без ограничения цитратные буферные растворы, ацетатные буферные растворы, фосфатные буферные растворы, хлорид аммония, карбонат кальция, хлорид кальция, цитрат кальция, глубионат кальция, глюцептат кальция, глюконат кальция, D-глюконовую кислоту, глицерофосфат кальция, лактат кальция, пропановую кислоту, левулинат кальция, пентановую кислоту, двухосновный фосфат кальция, фосфорную кислоту, трехосновный фосфат кальция, гидроксид-фосфат кальция, ацетат калия, хлорид калия, глюконат калия, смеси на основе калия, двухосновный фосфат калия, одноосновный фосфат калия, смеси на основе фосфата калия, ацетат натрия, бикарбонат натрия, хлорид натрия, цитрат натрия, лактат натрия, двухосновный фосфат натрия, одноосновный фосфат натрия, смеси на основе фосфата натрия, трометамин, гидроксид магния, гидроксид алюминия, альгиновую кислоту, апирогенную воду, изотонический солевой раствор, раствор Рингера, этиловый спирт и т.д. и/или их комбинации.
[183] Иллюстративные смазывающие средства включают без ограничения стеарат магния, стеарат кальция, стеариновую кислоту, диоксид кремния, тальк, солод, глицерилбегенат, гидрогенизированные растительные масла, полиэтиленгликоль, бензоат натрия, ацетат натрия, хлорид натрия, лейцин, лаурилсульфат магния, лаурилсульфат натрия и т.д. и их комбинации.
[184] Иллюстративные масла включают без ограничения масла миндаля, косточки абрикоса, авокадо, бабассу, бергамота, семян черной смородины, бурачника, можжевельника, ромашки, канола, тмина, карнаубы, касторовое, коричное, масло какао, кокосовое, печени трески, кофе, кукурузы, семян хлопчатника, эму, эвкалипта, примулы вечерней, рыбы, семян льна, гераниоловое, тыквы, виноградных косточек, фундука, иссопа, изопропилмиристатное, жожобы, плодов лакового дерева, лавандиновое, лавандовое, лимона, лицеа кубебы, макадамского ореха, мальвы, семян манго, семян пенника лугового, норки, мускатного ореха, оливковое, апельсина, атлантического большеголова, пальмовое, пальмоядровое, косточки персика, арахисовое, маковое, семян тыквы, рапсовое, рисовых отрубей, розмарина, сафлоровое, сандаловое, камелии горной, пряное, облепиховое, кунжутное, масло ши, кремниевое, соевое, подсолнечное, чайного дерева, расторопши, камелии, ветиверовое, грецкого ореха и зародышей пшеницы. Иллюстративные масла включают без ограничения бутилстеарат, каприловый триглицерид, каприновый триглицерид, циклометикон, диэтилсебацинат, диметикон 360, изопропилмиристат, минеральное масло, октилдодеканол, олеиловый спирт, силиконовое масло и/или их комбинации.
[185] Вспомогательные вещества, такие как масло какао и воски для суппозиториев, красящие средства, покрывающие средства, подсластители, вкусовые добавки и/или ароматизирующие добавки, могут присутствовать в композиции по усмотрению составителя.
[186] Доставка
[187] Настоящее изобретение охватывает доставку вектора для генной терапии (например, полинуклеотидов) любым подходящим путем, принимая во внимание вероятные достижения в области доставки лекарственных средств. Доставка может быть без дополнительных средств или в составе.
[188] Доставка без дополнительных средств
[189] Полинуклеотиды по настоящему изобретению могут быть доставлены к клетке без применения дополнительных средств. Используемый в данном документе термин «без дополнительных средств» относится к доставке полинуклеотидов без средств, которые способствуют трансфекции. Например, полинуклеотиды, доставленные в клетку, могут не содержать модификаций. Полинуклеотиды без дополнительных средств могут быть доставлены в клетку с применением способов введения, известных из уровня техники и описанных в данном документе.
[190] Доставка в составе
[191] Полинуклеотиды могут быть составлены с применением способов, описанных в данном документе. Составы могут содержать полинуклеотиды и могут дополнительно содержать без ограничения средства для проникновения в клетку, фармацевтически приемлемый носитель, средство доставки, биоразрушаемый или биосовместимый полимер, растворитель и депо для доставки с замедленным высвобождением. mRNA в виде составленных полинуклеотидов может быть доставлена в клетку с применением способов введения, известных в данной области техники и описанных в данном документе.
[192] Введение
[193] Полинуклеотиды по настоящему изобретению можно вводить с помощью любого пути, который обеспечивает терапевтически эффективный результат. Эти пути включают без ограничения: энтеральное, гастроэнтеральное, эпидуральное, пероральное, трансдермальное, эпидуральное (перидуральное), интрацеребральное (в головной мозг), интрацеребровентрикулярное (в желудочки головного мозга), накожное (нанесение на кожу), внутрикожное (собственно в кожу), подкожное (под кожу), назальное введение (через нос), внутривенное (в вену), внутриартериальное (в артерию), внутримышечное (в мышцу), внутрисердечное (в сердце), внутрикостная инфузия (в костный мозг), интратекальное (в позвоночный канал), внутрибрюшинное (инфузия или инъекция в брюшину), внутрипузырная инфузия, интравитреальное (в глаз), интракавернозная инъекция (в основание полового члена), интравагинальное введение, внутриматочное, экстраамниотическое введение, трансдермальное (диффузия через неповрежденную кожу для системного распределения), трансмукозальное (диффузия через слизистую оболочку), инсуффляцию (вдувание), сублингвальное, сублабиальное, клизму, глазные капли (на конъюнктиву) или ушные капли. В конкретных вариантах осуществления композиции можно вводить таким образом, чтобы они могли проникать через гематоэнцефалический барьер, сосудистый барьер или другой эпителиальный барьер. Неограничивающие пути введения полинуклеотидов, первичных конструкций или mRNA по настоящему изобретению описаны ниже.
[194] Парентеральное и инъекционное введение
[195] Жидкие лекарственные формы для парентерального введения включают без ограничения фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и/или настойки. В дополнение к действующим веществам жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие средства и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности хлопковое, арахисовое, кукурузное, зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси. Помимо инертных разбавителей пероральные композиции могут содержать вспомогательные вещества, такие как смачивающие средства, эмульгирующие и суспендирующие средства, подсластители, вкусовые добавки и/или ароматизирующие средства. В определенных вариантах осуществления для парентерального введения композиции смешивают с солюбилизирующими средствами, такими как CREMOPHOR®, спирты, масла, модифицированные масла, гликоли, полисорбаты, циклодекстрины, полимеры и/или их комбинации.
[196] Инъецируемые лекарственные препараты, например, стерильные инъецируемые водные или масляные суспензии, могут быть составлены в соответствии с известным уровнем техники с использованием подходящих диспергирующих средств, смачивающих средств и/или суспендирующих средств. Стерильные инъецируемые препараты могут представлять собой стерильные инъецируемые растворы, суспензии и/или эмульсии в нетоксичных приемлемых для парентерального введения разбавителях и/или растворителях, например, как раствор в 1,3-бутандиоле. Среди приемлемых сред-носителей и растворителей, которые можно применять, представлены вода, раствор Рингера, U.S.Р. и изотонический раствор хлорида натрия. Стерильные нелетучие масла обычно используются в качестве растворителя или суспендирующей среды. Для данной цели можно использовать любое щадящее нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота, могут применяться в получении инъецируемых препаратов.
[197] Инъецируемые составы могут быть стерилизованы, например, путем фильтрования через задерживающий бактерии фильтр и/или путем включения стерилизующих средств в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной инъецируемой среде перед применением.
[198] Чтобы продлить эффект действующего вещества, часто желательно замедлить абсорбцию действующего вещества при подкожной или внутримышечной инъекции. Это может быть достигнуто путем применения жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Скорость абсорбции лекарственного средства затем зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. В качестве альтернативы отсроченная абсорбция парентерально вводимой лекарственной формы достигается путем растворения или суспендирования лекарственного средства в масляной среде-носителе. Инъецируемые депо-формы получают путем формирования микроинкапсулированных матриц лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства и полимера и природы конкретного применяемого полимера можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают сложные поли(ортоэфиры) и поли(ангидриды). Составы, представляющие собой инъецируемое депо, получают путем захватывания лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма.
[199] Введение депо
[200] Как описано в данном документе, в некоторых вариантах осуществления композиция составлена в виде депо для пролонгированного высвобождения. Как правило, мишенью для введения является конкретный орган или ткань («ткань-мишень»).
[201] В некоторых аспектах изобретения полинуклеотиды пространственно удерживаются внутри или вблизи ткани-мишени. Предусмотрен способ обеспечения ткани-мишени субъекта-млекопитающего композицией путем приведения ткани-мишени (которая содержит одну или более клеток-мишеней) в контакт с композицией в условиях, при которых композиция, в частности компонент(-ы) нуклеиновой кислоты композиции, по сути удерживается в ткани-мишени, что означает то, что по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 85, 90, 95, 96, 97, 98, 99, 99,9, 99,99 или более чем 99,99% композиции удерживается в ткани-мишени. Преимущественно, уровень удержания определяют путем измерения количества нуклеиновой кислоты, присутствующей в композиции, которая попадает в одну или более клеток-мишеней. Например, по меньшей мере 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 85, 90, 95, 96, 97, 98, 99, 99,9, 99,99 или более 99,99% нуклеиновых кислот, вводимых субъекту, присутствуют в клетке в период времени после введения. Например, внутримышечную инъекцию субъекту-млекопитающему выполняют с использованием водной композиции, содержащей полинуклеотид и реагент для трансфекции, и удержание композиции определяют путем измерения количества рибонуклеиновой кислоты, содержащейся в мышечных клетках.
[202] Аспекты настоящего изобретения направлены на способы обеспечения ткани-мишени субъекта-млекопитающего композицией путем приведения ткани-мишени (содержащей одну или более клеток-мишеней) в контакт с композицией в условиях, при которых композиция по сути удерживается в ткани-мишени. Композиция содержит эффективное количество полинуклеотида, такое что полипептид, представляющий интерес, продуцируется в по меньшей мере одной клетке-мишени. Как правило, композиции содержат средство для проникновения в клетку, хотя также рассматривается нуклеиновая кислота «без дополнительных средств» (такая как нуклеиновые кислоты без средства для проникновения в клетку или другого средства), и фармацевтически приемлемый носитель.
[203] В некоторых обстоятельствах требуется увеличение количества белка, продуцируемого клетками в ткани. Предпочтительно, это увеличение продуцирования белка пространственно ограничено клетками в ткани-мишени. Таким образом, предусмотрены способы увеличения продуцирования белка, представляющего интерес, в ткани субъекта-млекопитающего. Предусмотрена композиция, которая содержит полинуклеотиды, отличающаяся тем, что для единицы количества композиции установлено, что она обеспечивает продуцирование полипептида, представляющего интерес, в значительном проценте клеток, содержащихся в предварительно определенном объеме ткани-мишени.
[204] В некоторых вариантах осуществления композиция содержит несколько различных полинуклеотидов, где один или более полинуклеотидов кодируют полипептид, представляющий интерес. Необязательно композиция также содержит средство для проникновения в клетку, чтобы способствовать внутриклеточной доставке композиции. Определяют дозу композиции, необходимую для обеспечения продуцирования полипептида, представляющего интерес, в значительном проценте клеток, содержащихся в предварительно определенном объеме ткани-мишени (как правило, без индуцирования значительного уровня продуцирования полипептида, представляющего интерес, в ткани, расположенной рядом с предварительно определенным объемом или дистально от ткани-мишени). После этого определения определенную дозу вводят непосредственно в ткань субъекта-млекопитающего.
[205] В одном варианте осуществления настоящее изобретение предусматривает доставку полинуклеотидов с помощью более чем одной инъекции или с помощью инъекций в соответствии с методом дробления дозы.
[206] В одном варианте осуществления настоящее изобретение может удерживаться вблизи ткани-мишени с применением небольшого одноразового резервуара с лекарственным средством, пластыря-насоса или осмотического насоса. Неограничивающие примеры пластырей-насосов включают насосы, производимые и/или распространяемые BD® (Франклин Лейке, Нью-Джерси, США), Insulet Corporation (Бедфорд, Массачусетс, США), SteadyMed Therapeutics (Сан-Франциско, Калифорния, США), Medtronic (Миннеаполис, Миннесота, США) (например, MiniMed), UniLife (Йорк, Пенсильвания, США), Valeritas (Бриджуотер, Нью-Джерси, США) и SpringLeaf Therapeutics (Бостон, Массачусетс, США). Неограничивающий пример осмотического насоса включает насос, изготовленный DURECT® (Купертино, Калифорния, США) (например, DUROS® и ALZET®).
[207] Введение доз
[208] Настоящее изобретение предусматривает способы, включающие введение вектора для генной терапии, содержащего полинуклеотид, кодирующий мультидоменный терапевтический полипептид, и необязательно введение впоследствии мультидоменного терапевтического полипептида субъекту, нуждающемуся в этом. В некоторых вариантах осуществления способ включает введение вектора для генной терапии, содержащего полинуклеотид, кодирующий мультидоменный терапевтический полипептид, в терапевтически эффективном количестве пациенту, нуждающемуся в этом, где терапевтически эффективное количество является достаточным для того, чтобы устранить необходимость в последующем введении мультидоменного терапевтического полипептида. Соответственно, в некоторых вариантах осуществления способ лечения пациента с дефицитом фермента, нуждающегося в этом, например снижение уровней содержания гликогена и/или снижение CRIM к GAA у пациента с болезнью Помпе, включает введение пациенту вектора для генной терапии, содержащего полинуклеотид, кодирующий мультидоменный терапевтический белок, содержащий заместительный фермент, например, слитый белок, содержащий scFv к CD63::GAA, например, мультидоменный терапевтический белок, содержащий последовательность, представленную под SEQ ID NO: 11, в терапевтически эффективном количестве, где терапевтически эффективное количество устраняет необходимость в последующем введении пациенту заместительного фермента, например GAA или его производных. В некоторых вариантах осуществления способ лечения пациента с дефицитом фермента и который нуждается в этом, например, снижение уровня содержания гликогена и/или снижение CRIM к GAA у пациента с болезнью Помпе, включает введение пациенту вектора для генной терапии, содержащего полинуклеотид, кодирующий мультидоменный терапевтический белок, содержащий заместительный фермент, например слитый белок scFv к CD63::GAA, например, мультидоменный терапевтический белок, содержащий последовательность, представленную под SEQ ID NO: 11, в терапевтически эффективном количестве, и дополнительно включает введение пациенту терапевтически эффективного количества заместительного фермента. Нуклеиновые кислоты, белки или комплексы или фармацевтические композиции, композиции для визуализации, диагностические или профилактические композиции на их основе могут быть введены субъекту с использованием любого количества и любого пути введения, эффективного для предупреждения, лечения, диагностики или визуализации заболевания, нарушения и/или состояния (например, заболевания, нарушения и/или состояния, связанного с дефицитом кратковременной памяти).
[209] Точное требуемое количество будет варьироваться от субъекта к субъекту, в зависимости от вида, возраста и общего состояния субъекта, тяжести заболевания, конкретной композиции, способа ее введения, способа ее действия и т.п.
[210] Доза вирусных векторов на основе AAV, например, единиц дозы в геномах вектора/на килограмм веса тела (в. г./кг), необходимая для достижения требуемого эффекта или «терапевтического эффекта» (например, определенной концентрации заместительного фермента в сыворотке крови) будет отличаться на основе нескольких факторов, включая без ограничения: путь введения AAV, уровень экспрессии, необходимый для достижения терапевтического эффекта, конкретное заболевание или нарушение, подлежащее лечению, и стабильность экспрессии мультидоменного терапевтического белка. Специалист в данной области может легко определить диапазон доз вириона AAV для лечения субъекта с конкретным заболеванием или нарушением, исходя из вышеупомянутых факторов, а также других факторов, хорошо известных из уровня техники, см., например, документ CDER «Guideline for Industry Utilizing in the Maximum Safe Start Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers», июль 2005 г., включенный в данный документ в полном объеме посредством ссылки. Эффективное количество AAV, как правило, находится в диапазоне от приблизительно 10 мкл до приблизительно 100 мл раствора, содержащего от приблизительно 109 до 1016 копий генома на субъект. Могут использоваться другие объемы раствора. Как правило, используемый объем будет зависеть, среди прочего, от размера субъекта, дозы AAV и пути введения. В некоторых вариантах осуществления подходящей является дозировка от приблизительно 1010 до 1012 вирусного генома AAV на субъект. В некоторых вариантах осуществления AAV вводят в дозе, составляющей 1010, 1011,1012, 1013, 1014 или 1015 копий генома на субъект. В некоторых вариантах осуществления AAV вводят в дозе, составляющей 1010, 1011, 1012, 1013 или 1014 вирусных геномов на кг. В некоторых вариантах осуществления вводят по меньшей мере 2×1012 вирусных геномов на килограмм (в. г./кг). В некоторых вариантах осуществления вводимая доза обеспечивает пороговый уровень мультидоменного терапевтического белка в сыворотке крови. В некоторых вариантах осуществления пороговый уровень терапевтического белка в сыворотке крови составляет по меньшей мере 1 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 2 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 3 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 4 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 5 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 6 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 7 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 8 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 9 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 10 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 11 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 12 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 13 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 14 мкг/мл. В некоторых вариантах осуществления вводимая доза обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий более чем 15 мкг/мл.
[211] Композиции в соответствии с настоящим изобретением обычно составляют в виде дозированной лекарственной формы для простоты введения и однородности дозирования. Однако понятно, что общее суточное применение композиций по настоящему изобретению может определяться лечащим врачом, исходя из результатов медицинской оценки. Конкретный терапевтически эффективный, профилактически эффективный или подходящий для визуализации уровень дозы для любого конкретного пациента будет зависеть от множества факторов, включая нарушение, подлежащее лечению, и тяжесть нарушения; активность конкретного применяемого соединения; конкретную применяемую композицию; возраст, вес тела, общее состояние здоровья, пол и режим питания пациента; время введения, способ введения и скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарственные средства, применяемые в комбинации или одновременно с конкретным применяемым соединением; и подобные факторы, хорошо известные в области медицины.
[212] Неограничивающие и иллюстративные варианты осуществления перечислены ниже.
Вариант осуществления 1. Способ доставки терапевтического белка в центральную нервную систему (ЦНС) субъекта, предусматривающий введение субъекту композиции, содержащей нуклеотид, кодирующий мультидоменный терапевтический белок, посредством способа доставки, нацеленного на печень, достаточного для обеспечения терапевтически эффективного количества мультидоменного терапевтического белка в ЦНС, где мультидоменный терапевтический белок содержит домен доставки и ферментный домен.
Вариант осуществления 2. Способ согласно варианту осуществления 1, где домен доставки представляет собой антитело или его антигенсвязывающий фрагмент, которые специфически связываются с эффектором интернализации.
Вариант осуществления 3. Способ согласно варианту осуществления 1 или варианту осуществления 2, где терапевтический белок представляет собой лизосомный фермент.
Вариант осуществления 4. Способ согласно варианту осуществления 3, где лизосомный фермент представляет собой GAA.
Вариант осуществления 5. Способ согласно любому из вариантов осуществления 1-4, где композицию, содержащую нуклеотид, вводят посредством вирусного вектора, где необязательно композицию, содержащую нуклеотид, вводят в дозе, составляющей по меньшей мере 2×1012 вирусных геномов на килограмм (в. г./кг).
Вариант осуществления 6. Способ согласно варианту осуществления 5, где вирусный вектор представляет собой вектор на основе AAV.
Вариант осуществления 7. Способ согласно любому из вариантов осуществления 1-6, где эффектор интернализации экспрессируется на поверхности клеток, выбранных из группы, состоящей из клеток в ЦНС, эпителиальных клеток и клеток, которые проникают через гематоэнцефалический барьер.
Вариант осуществления 8. Способ согласно любому из вариантов
осуществления 1-7, где домен доставки связывает эффектор интернализации,
(i) выбранный из группы, состоящей из CD63, интегрина альфа-7 (ITGA7), MHC-I, Kremen-1, Kremen-2, LRP5, LRP6, LRP8, рецептора трансферрина, рецептора LDL, рецептора белка 1, родственного LDL, ASGR1, ASGR2, белка-2, подобного белку-предшественнику амилоида (APLP2), апелинового рецептора (APLNR), миелинового и лимфоцитарного белка (MAL), IGF2R, Н+ АТФазы вакуолярного типа, рецептора дифтерийного токсина, фолатного рецептора, глутаматных рецепторов, глутатионового рецептора, лептиновых рецепторов, фагоцитарного рецептора А1-5 (SCARA1-5), SCARB1-3 и CD36;
(ii) экспрессируемый в нескольких типах тканей, необязательно выбранный из группы, состоящей из CD63, MHC-I, Н+ АТФазы вакуолярного типа, IGF2R, интегрина альфа-7 (ITGA7), LRP5, LRP6, LRP8, Kremen-2, рецептора LDL, рецептора белка 1, родственного LDL, белка-2, подобного белку-предшественнику амилоида (APLP2), апелинового рецептора (APLNR), PRLR, MAL (миелиновый и лимфоцитарный белок (MAL), рецепторов дифтерийного токсина, HBEGF (гепарин-связывающий фактор роста, подобный EGF), глутатионовых рецепторов, глутаматных рецепторов, лептиновых рецепторов и фолатных рецепторов,
где у субъекта необязательно проявляется один или более симптомов заболевания, выбранного из группы, состоящей из болезни Фабри, болезни Гоше, MPS I, MPS II, MPS IIIA, MPS IIIB, MPS HID, MPS IVB, MPS VI, MPS VII, MPS IX, болезни Помпе, дефицита лизосомной кислой липазы, метахроматической лейкодистрофии, болезни Ниманна-Пика типов А, В и С2, альфа-маннозидоза, дефицита нейраминидазы, сиалидоза, аспартилглюкозаминурии, комбинированного дефицита сапозинов, атипической болезни Гоше, липогранулематоза Фарбера, фукозидоза и бета-маннозидоза;
(iii) преимущественно экспрессируемый тканями кости и/или хряща, необязательно выбранный из группы, состоящей из коллагена X, интегрина альфа 10 (ITGA10), рецептора 3 фактора роста фибробластов (FGFR3), изоформы С фактора роста фибробластов (FGFR3C), белка 1, связывающего гиалуронан и протеогликан (CRTL1), аггрекана, коллагена II и Kremen-1,
где у субъекта необязательно проявляется один или более симптомов заболевания, выбранного из группы, состоящей из MPS I, MPS II, MPS IIIA, MPS IIIB, MPS HID, MPS IVA, MPS IVB, MPS VI, MPS VII, MPS IX, бета-маннозидоза, болезни Гоше, атипической болезни Гоше, комбинированного дефицита сапозинов, аспартилглюкозаминурии, липогранулематоза Фарбера, сиалидоза, дефицита нейраминидазы и альфа-маннозидоза;
(iv) преимущественно экспрессируемый моноцитами, макрофагами или микроглией, необязательно выбранным из группы, состоящей из фагоцитарного рецептора A1-5 (SCARA1-5), SCARB1-3, CD36, MSR1 (макрофагальный фагоцитарный рецептор 1), MRC1 (макрофагальный маннозный рецептор 1), VSIG4 (белок 4, содержащий домен V-набора и иммуноглобулина), CD68 (макросиалин) и CSF1R (рецептор колониестимулирующего фактора 1 макрофагов),
где у субъекта необязательно проявляется один или более симптомов заболевания, выбранного из группы, состоящей из дефицита лизосомной кислой липазы, болезни Гоше, атипической болезни Гоше, комбинированного дефицита сапозинов и липогранулематоза Фарбера;
(v) преимущественно экспрессируемый клетками почек, необязательно выбранный из группы, состоящей из CDH16 (Cadheri-16), CLDN16 (Claudn-16), KL (Klotho), PTH1R (рецептор паратиреоидного гормона), SLC22A13 (семейство 22 транспортеров растворенных веществ, представитель 13), SLC5A2 (натрий-глюкозный котранспортер 2) и UMOD (уромодулин),
где у субъекта необязательно проявляется один или более симптомов или диагностировано заболевание, выбранное из группы, состоящей из болезни Фабри, синдрома Альпорта, поликистозной болезни почек и тромботической тромбоцитопенической пурпуры;
(vi) преимущественно экспрессируемый клетками печени, необязательно ASGR1 или ASGR2,
где у субъекта необязательно проявляется один или более симптомов или диагностировано заболевание, выбранное из группы, состоящей из дефицита лизосомной кислой липазы, болезни Гоше, MPS VI, MPS VII, MPS II, болезни Ниманна-Пика типов А, В и С2, сиалидоза, дефицита нейраминидазы, атипической болезни Гоше, комбинированного дефицита сапозинов, липогранулематоза Фарбера;
(vii) преимущественно экспрессируемый клетками мышц, необязательно выбранный из группы, состоящей из BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерина, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергический рецептор (никотиновый) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14В, содержащий богатый лейцином повтор), дистрогликан (DAG1) и POPDC3 (белок 3, содержащий домен Рореуе),
где у субъекта необязательно проявляется один или более симптомов или диагностирована болезнь Помпе;
(viii) выбранный из группы, состоящей из ITGA7, CD9, CD63, ALPL2, MSR1, ASGR1, ASGR2 или PRLR; или
(ix) который представляет собой CD63.
Вариант осуществления 9. Способ согласно любому из вариантов
осуществления 1-8, где домен доставки представляет собой одноцепочечный вариабельный фрагмент (scFv).
Вариант осуществления 10. Способ согласно любому из вариантов осуществления 1-9, где белок, связывающий рецептор клеточной поверхности (CSR) (CSR-BP), содержит аминокислотную последовательность под SEQ ID NO:2.
Вариант осуществления 11. Способ согласно любому из вариантов осуществления 1-10, где терапевтический белок содержит гидролазу.
Вариант осуществления 12. Способ согласно любому из вариантов осуществления 1-11, где терапевтический белок содержит гликозилазу.
Вариант осуществления 13. Способ согласно любому из вариантов осуществления 1-12, где терапевтический белок содержит гликозидазу.
Вариант осуществления 14. Способ согласно любому из вариантов осуществления 1-13, где терапевтический белок содержит альфа-глюкозидазу.
Вариант осуществления 15. Способ согласно любому из вариантов осуществления 1-14, где терапевтический белок содержит аминокислотную последовательность под SEQ ID NO: 1 или SEQ ID NO: 13 или ее фрагмент.
Вариант осуществления 16. Способ согласно любому из вариантов осуществления 1-15, где терапевтический белок содержит антитело к Абета или к тау.
Вариант осуществления 17. Способ согласно любому из вариантов осуществления 1-16, где полинуклеотид содержит последовательность нуклеиновой кислоты под SEQ ID NO: 11.
Вариант осуществления 18. Способ согласно любому из вариантов осуществления 1-17, где ферментный домен содержит альфа-глюкозидазу, и где уровни гликогена в любой ткани ЦНС у субъекта снижены в течение по меньшей мере девяти месяцев после лечения.
Вариант осуществления 19. Способ согласно любому из вариантов осуществления 1-18, где у субъекта имеется болезнь Помпе.
Вариант осуществления 20. Способ согласно любому из вариантов осуществления 1-19, где вводимая композиция, содержащая нуклеотид, обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий по меньшей мере 1 мкг/мл.
Вариант осуществления 21. Мультидоменный терапевтический белок, содержащий один или более домен(-ов) доставки и ферментный домен, где один или более домен(-ов) доставки связывают рецептор трансферрина человека (hTfR).
Вариант осуществления 22. Мультидоменный терапевтический белок согласно варианту осуществления 21, дополнительно содержащий второй домен доставки, который связывается с эффектором интернализации.
Вариант осуществления 23. Мультидоменный терапевтический белок согласно варианту осуществления 22, где второй домен доставки связывается с
(i) эффектором интернализации, выбранным из группы, состоящей из CD63, интегрина альфа-7 (ITGA7), MHC-I, Kremen-1, Kremen-2, LRP5, LRP6, LRP8, рецептора трансферрина, рецептора LDL, рецептора белка 1, родственного LDL, ASGR1, ASGR2, белка-2, подобного белку-предшественнику амилоида (APLP2), апелинового рецептора (APLNR), миелинового и лимфоцитарного белка (MAL), IGF2R, Н+ AT Фазы вакуолярного типа, рецептора дифтерийного токсина, фолатного рецептора, глутаматных рецепторов, глутатионового рецептора, лептиновых рецепторов, фагоцитарного рецептора A1-5 (SCARA1-5), SCARB1-3 и CD36;
(ii) эффектором интернализации, экспрессируемым в нескольких типах тканей, необязательно выбранным из группы, состоящей из CD63, MHC-I, Н+ АТФазы вакуолярного типа, IGF2R, интегрина альфа-7 (ITGA7), LRP5, LRP6, LRP8, Kremen-2, рецептора LDL, рецептора белка 1, родственного LDL, белка-2, подобного белку-предшественнику амилоида (APLP2), апелинового рецептора (APLNR), PRLR, MAL (миелиновый и лимфоцитарный белок (MAL), рецепторов дифтерийного токсина, HBEGF (гепарин-связывающий фактор роста, подобный EGF), глутатионовых рецепторов, глутаматных рецепторов, лептиновых рецепторов и фолатных рецепторов;
(iii) эффектором интернализации, преимущественно экспрессируемым тканями кости и/или хряща, необязательно выбранным из группы, состоящей из коллагена X, интегрина альфа 10 (ITGA10), рецептора 3 фактора роста фибробластов (FGFR3), изоформы С фактора роста фибробластов (FGFR3C), белка 1, связывающего гиалуронан и протеогликан (CRTL1), аггрекана, коллагена II и Kremen-1;
(iv) эффектором интернализации, преимущественно экспрессируемым моноцитами, макрофагами или микроглией, необязательно выбранным из группы, состоящей из фагоцитарного рецептора A1-5 (SCARA1-5), SCARB1-3, CD36, MSR1 (макрофагальный фагоцитарный рецептор 1), MRC1 (макрофагальный маннозный рецептор 1), VSIG4 (белок 4, содержащий домен V-набора и иммуноглобулина), CD68 (макросиалин) и CSF1R (рецептор колониестимулирующего фактора 1 макрофагов);
(v) эффектором интернализации, преимущественно экспрессируемым клетками почек, необязательно выбранным из группы, состоящей из CDH16 (Cadheri-16), CLDN16 (Claudn-16), KL (Klotho), PTH1R (рецептор паратиреоидного гормона), SLC22A13 (семейство 22 транспортеров растворенных веществ, представитель 13), SLC5A2 (натрий-глюкозный котранспортер 2) и UMOD (уромодулин). В других определенных вариантах осуществления эффектор интернализации представляет собой специфический в отношении мышц интернализатор, такой как BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерин, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергический рецептор (никотиновый) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14В, содержащий богатый лейцином повтор), дистрогликан (DAG1) и POPDC3 (белок 3, содержащий домен Рореуе);
(vi) эффектором интернализации, преимущественно экспрессируемым клетками печени, необязательно ASGR1 или ASGR2;
(vii) эффектором интернализации, преимущественно экспрессируемым клетками мышц, необязательно выбранным из группы, состоящей из BMPR1A (рецептор 1А костного морфогенетического белка), m-кадгерина, CD9, MuSK (киназа, специфическая в отношении мышц), LGR4/GPR48 (рецептор 48, сопряженный с G-белком), холинергического рецептора (никотинового) альфа 1, CDH15 (Cadheri-15), ITGA7 (интегрин альфа-7), CACNG1 (субъединица гамма-1 кальциевого канала L-типа), CACNA1S (субъединица альфа-15 кальциевого канала L-типа), CACNG6 (субъединица гамма-6 кальциевого канала L-типа), SCN1B (субъединица бета-1 натриевого канала), CHRNA1 (субъединица альфа рецептора ACh), CHRND (субъединица дельта рецептора ACh), LRRC14B (белок 14В, содержащий богатый лейцином повтор), дистрогликана (DAG1) и POPDC3 (белок 3, содержащий домен Рореуе), или
(viii) белком, являющимся эффектором интернализации, выбранным из группы, состоящей из ITGA7, CD9, CD63, ALPL2, MSR1, ASGR1, ASGR2 или PRLR.
Вариант осуществления 24. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 21-23, где второй домен доставки связывается с эффектором интернализации CD63.
Вариант осуществления 25. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 21-24, где по меньшей мере один из одного или более домена(-ов) доставки содержит антиген связывающий белок.
Вариант осуществления 26. Мультидоменный терапевтический белок согласно варианту осуществления 25, где каждый из одного или более домена(-ов) доставки содержит антигенсвязывающий белок.
Вариант осуществления 27. Мультидоменный терапевтический белок согласно любому из варианту осуществления 21-26, где по меньшей мере один из одного или более домена(-ов) доставки содержит одноцепочечный вариабельный фрагмент (scFv).
Вариант осуществления 28. Мультидоменный терапевтический белок согласно любому из варианту осуществления 21-27, где по меньшей мере один из одного или более домена(-ов) доставки содержит полуантитело.
Вариант осуществления 29. Мультидоменный терапевтический белок согласно варианту осуществления 28, где домен доставки, который связывает hTfR, представляет собой scFv, где полуантитело связывает CD63, где ферментный домен представляет собой GAA, и где GAA конъюгирован с карбокси-концом полуантитела, которое связывает CD63.
Вариант осуществления 30. Мультидоменный терапевтический белок согласно варианту осуществления 27, где каждый из одного или более домена(-ов) доставки содержит scFv.
Вариант осуществления 31. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 27-30, где по меньшей мере один scFv слит с Fc.
Вариант осуществления 32. Мультидоменный терапевтический белок согласно варианту осуществления 31, где Fc предусматривает изотип IgG4 человека дикого типа или его производное.
Вариант осуществления 33. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 31-32, где GAA конъюгирован с карбокси-концом Fc.
Вариант осуществления 34. Мультидоменный терапевтический белок согласно варианту осуществления 30, содержащий scFv к hTfR, scFv к hCD63.
Вариант осуществления 35. Мультидоменный терапевтический белок согласно варианту осуществления 34, где оба из scFv к TfR и scFv к hCD63 связаны по своим карбокси-концам с одним ферментом GAA.
Вариант осуществления 36. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 21-27, где домен доставки представляет собой scFv к hTfR, и ферментный домен связан с карбокси-концом VL-домена scFv.
Вариант осуществления 37. Мультидоменный терапевтический белок согласно варианту осуществления 36, дополнительно содержащий второй домен доставки, связанный с N-концом VH-домена scFv к hTfR.
Вариант осуществления 38. Мультидоменный терапевтический белок согласно варианту осуществления 37, где второй домен доставки представляет собой scFV к hCD63.
Вариант осуществления 39. Мультидоменный терапевтический белок согласно любому из предыдущих вариантов осуществления, где ферментный домен содержит аминокислотную последовательность, представленную под SEQ ID NO: 1.
Вариант осуществления 40. Полинуклеотид, кодирующий Мультидоменный терапевтический белок согласно любому из вариантов осуществления 21-39 или вариантов осуществления 50-64.
Вариант осуществления 41. Полинуклеотид согласно варианту осуществления 40, дополнительно содержащий последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус.
Вариант осуществления 42. Полинуклеотид согласно варианту осуществления 40 или варианту осуществления 41, дополнительно содержащий последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус, где последовательность вирусной нуклеиновой кислоты представляет собой последовательность нуклеиновой кислоты аденоассоциированного вируса (AAV).
Вариант осуществления 43. Полинуклеотид согласно любому из вариантов осуществления 40-42, дополнительно содержащий последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус, где последовательность вирусной нуклеиновой кислоты представляет собой последовательность нуклеиновой кислоты аденоассоциированного вируса (AAV), и где последовательность нуклеиновой кислоты AAV содержит последовательность внутреннего концевого повтора и необязательно тканеспецифический регуляторный элемент, такой как специфический в отношении печени промотор или специфический в отношении нейронов промотор.
Вариант осуществления 44. Полинуклеотид согласно любому из вариантов осуществления 40-43, дополнительно содержащий последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус, где последовательность вирусной нуклеиновой кислоты представляет собой последовательность нуклеиновой кислоты аденоассоциированного вируса (AAV), содержащую последовательность внутреннего концевого повтора, которая содержит SEQ ID NO: 6, SEQ ID NO: 7 или и то и другое, и необязательно тканеспецифический регуляторный элемент, такой как специфический в отношении печени промотор или специфический в отношении нейронов промотор.
Вариант осуществления 45. Полинуклеотид согласно любому из вариантов осуществления 40-44, дополнительно содержащий тканеспецифический регуляторный элемент, содержащий последовательность, представленную под SEQ ID NO: 8 и/или SEQ ID NO: 9.
Вариант осуществления 46. Вектор для генной терапии, содержащий Полинуклеотид согласно любому из вариантов осуществления 40-45.
Вариант осуществления 47. Вектор для генной терапии согласно варианту осуществления 46, где вектор для генной терапии выбран из группы, состоящей из
вирусного вектора, где необязательно вирусный вектор представляет собой природный вирус, сконструированный вирус или химерный вирус,
полинуклеотида без дополнительных средств, предусматривающего полинуклеотид согласно любому из вариантов осуществления 20-25,
полинуклеотидного комплекса, где необязательно полинуклеотидный комплекс представляет собой липидную наночастицу, содержащую полинуклеотид согласно любому из вариантов осуществления 20-25 и липиды, и
любой их комбинации.
Вариант осуществления 48. Вектор для генной терапии согласно варианту осуществления 46 или варианту осуществления 47, где вектор для генной терапии представляет собой вирусный вектор, выбранный из группы, состоящей из ретровируса, аденовируса, вируса простого герпеса, поксвируса, вируса осповакцины, лентивируса или аденоассоциированного вируса.
Вариант осуществления 49. Вектор для генной терапии согласно варианту осуществления 47 или варианту осуществления 48, где вектор для генной терапии представляет собой AAV9, Anc80, химерный AAV2/8 и/или AAV, псевдотипированный по конкретной ткани, например, печени или нейронной ткани.
Вариант осуществления 50. Мультидоменный терапевтический белок, содержащий по меньшей мере два домена доставки и по меньшей мере один ферментный домен, где каждый из двух доменов доставки независимо выбран из группы, состоящей из антитела, полуантитела и scFv, и где по меньшей мере один или более доменов доставки ассоциированы с по меньшей мере одним ферментным доменом, где предпочтительно один или более доменов доставки ковалентно связаны с по меньшей мере одним ферментным доменом.
Вариант осуществления 51. Мультидоменный терапевтический белок согласно варианту осуществления 50, содержащий не более двух доменов доставки.
Вариант осуществления 52. Мультидоменный терапевтический белок согласно варианту осуществления 50 или варианту осуществления 51, где только один из доменов доставки ассоциирован с по меньшей мере одним ферментным доменом.
Вариант осуществления 53. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 50-52, где каждый из по меньшей мере двух доменом доставки ковалентно связан с ферментным доменом.
Вариант осуществления 54. Мультидоменный терапевтический белок согласно варианту осуществления 53, где каждый из по меньшей мере двух доменов доставки ковалентно связан с одним и тем же ферментным доменом.
Вариант осуществления 55. Мультидоменный терапевтический белок согласно варианту осуществления 53, где каждый из по меньшей мере двух доменов доставки ковалентно связан с отличным ферментным доменом.
Вариант осуществления 56. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 50-55, где Мультидоменный терапевтический белок содержит не более двух доменов доставки, где первый домен доставки содержит полуантитело, и где второй домен доставки содержит scFv.
Вариант осуществления 57. Мультидоменный терапевтический белок согласно варианту осуществления 56, где scFv слит с Fc.
Вариант осуществления 58. Мультидоменный терапевтический белок согласно варианту осуществления 56 или варианту осуществления 57, где полуантитело ковалентно связано по своему карбокси-концу с первым ферментным доменом, и/или где scFv ковалентно связан по своему карбокси-концу с Fc и необязательно вторым ферментным доменом.
Вариант осуществления 59. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 50-55, где Мультидоменный терапевтический белок содержит не более двух доменов доставки, где каждый из первого и второго доменов доставки содержит scFv.
Вариант осуществления 60. Мультидоменный терапевтический белок согласно варианту осуществления 59, где как первый, так и второй scFv ковалентно связаны с ферментным доменом.
Вариант осуществления 61. Мультидоменный терапевтический белок согласно варианту осуществления 59, содержащий от N-конца к С-концу: первый scFv, второй scFv и ферментный домен.
Вариант осуществления 62. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 50-61, где по меньшей мере один домен доставки связывает молекулу, обеспечивающую транспорт в лизосому, и по меньшей мере один домен доставки связывает эффектор трансцитоза.
Вариант осуществления 63. Мультидоменный терапевтический белок согласно варианту осуществления 62, где молекула, обеспечивающая транспорт в лизосому, выбрана из группы, состоящей из CD63, ITGA7, CD9, CD63, CD81, CD82 или CD151, и где эффектор трансцитоза выбран из группы, состоящей из рецептора LDL, рецептора IgA, рецептора трансферрина, неонатального Fc-рецептора, рецептора инсулина, CD98 и басигина.
Вариант осуществления 64. Мультидоменный терапевтический белок согласно любому из вариантов осуществления 50-63, содержащий структуру, представленную на фигуре 1C, фигуре 1D, фигуре 1Е или фигуре 1F.
Вариант осуществления 65. Применение нуклеотида, который кодирует Мультидоменный терапевтический белок согласно любому из вариантов осуществления 21-39 и 50-64, полинуклеотид согласно любому из вариантов осуществления 40-45 или вектор для генной терапии согласно любому из вариантов осуществления 46-49 в способе согласно любому из вариантов осуществления 1-20.
[213] Следующие примеры представлены с целью дальнейшей иллюстрации способов согласно настоящему изобретению. Данные примеры являются исключительно иллюстративными и не предназначены для ограничения объема настоящего изобретения каким-либо образом.
ПРИМЕРЫ
Пример 1. Конструирование полинуклеотида ScFv к hCD63::GAA и вектора для генной терапии
[214] Вирусы AAV2/8, кодирующие экспрессию GAA человека (hGAA; SEQ ID NO: 1; последовательность нуклеиновой кислоты, представленная под SEQ ID NO: 12) или одноцепочечный вариабельный фрагмент к CD63 человека (ScFv), слитый на его С-конце с GAA человека (scFv к hCD63-hGAA; SEQ ID NO: 10; нуклеиновая кислота, представленная под SEQ ID NO: 11), генерировали с применением стандартного протокола тройной трансфекции (Gray et al. 2011; см. также «Production of recombinant adeno-associated viral vectors and use т vitro and in vivo administration», Current Protocols in Neuroscience, John Wiley & Sons, New York (1999), pp. 4.17.1-4.17.25, Vol 1). Для продуцирования 1×107 клеток HEK293 высевали на чашки диаметром 15 см. На следующий день клетки трансфицировали с помощью (А) либо 8 мкг контрольного вектора pAAV, содержащего специфический в отношении печени энхансер серпина 1 (SEQ ID NO: 9) и кодирующего TTR-управляемую GAA человека, либо тестируемого pAAV, содержащего специфический в отношении печени энхансер серпина 1 (SEQ ID NO: 9) и кодирующего TCD-управляемый scFv к hCD63-hGAA (см. фигуру 1В) и (В) вектора, полученного из pAAV RC2/8, (Gao, 2002) и 16 мкг pHelper (Agilent, № по кат. 240074), с применением PEIpro (Polyplus transfection,
Нью-Йорк, Нью-Йорк, США № по кат. 115-100)-опосредованной трансфекции в соотношении 1:1 (1 мкл PEIpro: I мкг ДНК). Через семьдесят два часа после трансфекции клетки собирали и лизировали в буфере, содержащем 20 мМ Tris-HCl, 1 мМ MgCl2, 2,5 мМ KCl, 100 мМ NaCl, с применением стандартного способа замораживания-оттаивания. Затем к образцам добавляли бензоназу (Sigma, № по кат. E1014-25KU) в конечной концентрации 0,5 ед./мкл, а затем инкубировали при 37°С в течение 60 минут. Затем вирусы очищали с применением ультрацентрифугирования в градиенте йодиксанола, как описано в (Zolotukhin et al., 1999, Gene Ther 1999;6:973-985), а затем титровали с помощью qPCR.
[215] Образцы AAV обрабатывали с помощью DNaseI (Thermofisher Scientific, № по кат. EN0525) при 37°С в течение одного часа и лизировали с применением экстракта ДНК All Reagents (Thermofisher Scientific № по кат. 4403319).
Инкапсидированные вирусные геномы определяли количественно с применением системы ПЦР в режиме реального времени QuantStudio 3 (Thermofisher Scientific) с применением праймеров, направленных на ITR AAV2. Последовательности праймеров к ITR AAV2 представляют собой 5'-GGAACCCCTAGTGATGGAGTT-3' (прямой праймер к ITR; SEQ ID NO: 3) и 5'-CGGCCTCAGTGAGCGA-3' (обратный праймер к ITR; SEQ ID NO: 4) (Aumhammer et al., 2012), с помощью которых получают последовательность левого внутреннего инвертированного повтора (ITR) AAV (SEQ ID NO: 6) и правого внутреннего инвертированного повтора (ITR) AAV (SEQ ID NO: 7), соответственно. Последовательность зонда ITR AAV2 представляет собой 5'-6-FAM-CACTCCCTCTCTGCGCGCTCG-TAMRA-3' (SEQ ID NO: 5) (Aumhammer С., Haase M., Muether N., et al., 2012, Hum. Gene Ther. Methods 23, 18-28). После стадии активации при 95°С, длившейся 10 минут, осуществляли цикл двухстадийной ПЦР при 95°С в течение 15 секунд и при 60°С в течение 30 секунд, всего 40 циклов. Для qPCR применяли TaqMan Universal PCR Master Mix (Thermofisher Scientific, №по кат.4304437). ДНК-плазмиду (Agilent, № по кат. 240074) применяли в качестве стандарта для определения абсолютных титров.
[216] Для антител к CD63 человека и слитых молекул на их основе применяли вариабельные домены мышиного Н5С6 к CD63 человека (аминокислоты 1-119 из SEQ ID NO: 10 обеспечивают аминокислотную последовательность вариабельного домена тяжелой цепи (VH) антитела Н5С6, и аминокислоты 135-245 из SEQ ID NO: 10 обеспечивают аминокислотную последовательность вариабельного домена легкой цепи (vl) антитела Н5С6). Используемый в данном документе scFv к hCD63 (SEQ ID NO: 2) получали из клона Н5С6, который представляет собой легкую цепь антитела каппа из моноклонального мышиного IgG1 к hCD63 (Н5С6 внесли в Банк гибридом для исследований развития Developmental Studies Hybridoma Bank) Университета Айовы к августу, J.T. / Hildreth, J.E.K. (DSHB Hybridoma Product Н5С6; DSHB № по кат. h5c6, RRID:AB 528158). ScFv-версии антител клонировали с вариабельными доменами в порядке тяжелая цепь-легкая цепь с глицин-сериновым линкером между ними (5'-VH-Gly-Ser-VL-3').
Пример 2. Содержание гликогена в мышиной модели болезни Помпе после введения AAV
[217] Чтобы определить эффект доставленного с помощью AAV слитого белка, содержащего scFv к hCD63 и GAA, по сравнению с доставленной с помощью AAV GAA в соответствующей модели накопления гликогена in vivo, оба средства терапии доставляли в мышиную модель болезни Помпе, где мыши были гомозиготными по делеции гена GAA мыши и были гомозиготными по экспрессии CD63 человека вместо CD63 мыши с фоновым генотипом штамма, составляющим 75% C57BL/6; 25% 129SvJ. Эти мыши в данном документе упоминаются как мыши CD63 HumIn с нокаутом GAA или, в качестве альтернативы, CD63hu/hu; мыши GAA-/-.
[218] Для эксперимента 2-месячным мышам CD63 HumIn с нокаутом GAA вводили посредством инъекции в хвостовую вену либо вирус AAV2/8, содержащий геном либо со специфическим в отношении печени TTR-промотором, управляющим GAA человека (AAV-hGAA; описанный в примере 1), либо со специфическим в отношении печени TTR-промотором, управляющим scFv к CD63 человека, слитым на своем С-конце с GAA человека (AAV-scFv к hCD63-hGAA; описанный в примере 1). Оба вируса AAV2/8 доставляли в одной из двух доз, 1е10 vg/мышь или 1e11 в. г. /мышь. В качестве контроля в анализ были включены необработанные мыши CD63 HumIn с нокаутом GAA и необработанные мыши CD63 HumIn с интактным геном GAA. Мышей содержали в течение 3 месяцев после обработки и периодически (ежемесячно) брали у них кровь в течение этого периода для измерений уровней содержания GAA и антител к GAA в сыворотке крови. Через 3 месяца всех мышей умерщвляли и собирали отдельные ткани для измерений уровней гликогена, окрашивания с помощью PAS-H, количественного определения центрально расположенных ядер, измерения уровня пролиферации лизосом и измерения уровня экспрессии LC3b. Протокол введения доз и обработки для групп мышей в ходе эксперимента показан в таблице 3.
[219] Результаты также представлены на фигуре 2, из которой видно, что scFv к hCD63::GAA понижает уровень содержания гликогена в скелетной мышце до уровней, характерных для дикого типа, в отличие от GAA отдельно. Обработка с помощью мультидоменного терапевтического белка, представляющего собой двухдоменный scFv к hCD63::GAA; привела к гораздо большему снижению содержания накопленного гликогена по сравнению с обработкой с помощью однодоменного заместительного фермента GAA. Из графика зависимости уровней содержания гликогена в квадрицепсе (фигура 3) или уровней содержания гликогена в сердце (фигура 4) от общей экспрессии GAA или scFv-GAA в сыворотке крови в течение трех месяцев для отдельных мышей видно, что слитый белок scFv к hCD63::GAA удаляет больше гликогена, чем фермент GAA отдельно, даже при аналогичных уровнях содержания в сыворотке крови (фигуры 3 и 4).
Пример 3. Иммунный ответ на GAA
[220] Для измерения уровней содержания антител к GAA человека в сыворотке крови во всех группах обработки отделение сыворотки от крови, собранной во время терминального кровотечения, осуществляли с применением пробирок для отделения сыворотки крови (BD Biosciences, № по кат. 365967) в соответствии с инструкциями производителя. Отдельно 96-луночные планшеты с высокой эффективностью связывания белков (ThermoFisher, № по кат. 15041) покрывали с помощью 20 мкг hGAA (R&D Systems, № по кат. 8329-GH-025), разбавленного в PBS в течение ночи. Планшеты промывали с помощью PBS + 0,05% Tween (PBS-T) 3 раза. Планшеты блокировали с помощью 0,5% BSA в PBS-T, и серийные разбавления мышиной сыворотки крови в диапазоне от 1:300 до 1:5. При этом 1е7 добавляли в планшет на ночь. Общее количество антител к IgG мыши (подклассы 1 + 2а + 2b + 3) измеряли с применением конъюгированного с HRP козьего антитела к IgG мыши (Jackson Immuno Research, № по кат. 115-035-164) и набора субстратов BD Opt EIA. Колориметрические реакции останавливали с применением 1 н. фосфорной кислоты. Затем измеряли поглощение при 450 нм на планшет-ридере Spectramax i3 (Molecular Devices). Кривые разбавлений аппроксимировали по сигмоидальным кривым, и из кривых рассчитывали титры. Титры, выраженные в виде среднего общего титра IgG+/- SD, показаны в таблице 4.
[221] Как показано в таблице 4, мыши, которые не подвергались обработке, демонстрировали средний фоновый титр со средними уровнями 1.1Е+03. Мыши, которых обрабатывали с помощью низкой дозы вируса (1е10 в. г. /мышь) либо AAV-scFv к hCD63-hGAA, либо AAV-hGAA демонстрировали высокие титры, тогда как у мышей, обработанных высокой дозой (1e11 в. г. /мышь), титры были ниже. Мыши, обработанные с помощью 1e11 в. г. AAV-scFv к hCD63-hGAA, которые показывали наиболее высокие уровни GAA в сыворотке крови, имели титры, находящиеся в диапазоне таковых у необработанных мышей.
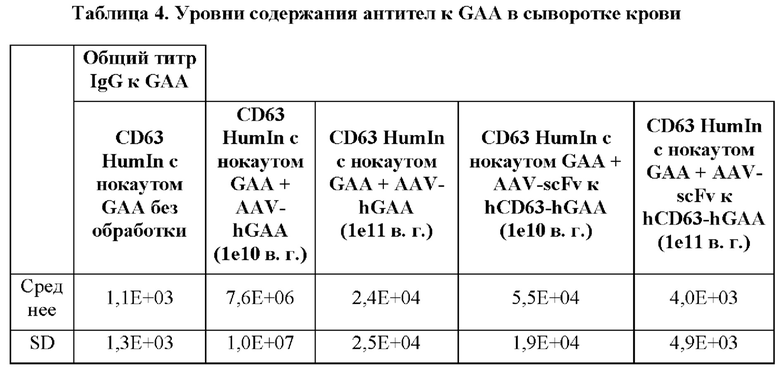
[222] Более высокие уровни содержания GAA или scFv к hCD63::GAA после введения AAV соответствуют более низким титрам антител к GAA. Сыворотку крови мышей с нокаутом по GAA, обработанных высокими или низкими титрами AAV-scFv к hCD63::GAA или AAV-GAA, оценивали в отношении содержания антител к GAA в течение трех месяцев после инъекции. На фигуре 5 изображена зависимость сывороточных титров антител к GAA от уровня воздействия GAA (т.в. общая экспрессия GAA или scFv-GAA в сыворотке крови в течение 3 месяцев) для отдельных мышей, что демонстрирует отрицательную корреляцию между титром антител и уровнем воздействия GAA на сыворотку, демонстрируя, что мыши с высоким уровнем воздействия GAA были подвергнуты индуцированию толерантности к GAA. Аналогично, фигура 6, на которой представлены титры антител к GAA для различных групп, инфицированных AAV, кодирующим GAA или белок scFv к hCD63::GAA, демонстрирует, что более высокие дозы конструкции приводили к более низким титрам антител к GAA.
Пример 4. Содержание GAA в сыворотке крови
[223] Чтобы измерить уровни содержания GAA человека в сыворотке крови в течение эксперимента, образцы отбирали в определенные моменты каждый месяц, вызывая хвостовое кровотечение. Сыворотку отделяли от крови с использованием пробирок для отделения сыворотки (BD Biosciences, № по кат. 365967) в соответствии с инструкциями производителя. Затем 1 мкл выделенной сыворотки крови загружали в 4-20% предварительно залитый гель Novex wedgewell, прогоняли при 220 В в течение 45 минут и переносили на нитроцеллюлозную мембрану при 200 мА в течение 1 часа с применением стандартных процедур. Затем нитроцеллюлозную мембрану изучали с помощью первичного антитела к GAA (Abeam, № ab137068), используемого в разбавлении 1:2000, и антитела к GAPDH (Abeam, № АВ9484), используемого в разбавлении 1:1000, в 12 мл и инкубировали в течение ночи при 4°С.После первичной инкубации с антителами мембрану трижды промывали с помощью 1 × TBST, по 5 минут на каждую промывку. Затем к мембране добавляли вторичные антитела к IgG кролика (LiCor, 926-32211) и к IgG мыши (LiCor, 925-68070) (LiCor, Линкольн, Небраска) в разбавлении 1:15000 в 12 мл и инкубировали в течение 1 часа при комнатной температуре. После инкубации с вторичными антителами мембрану дважды промывали с помощью 1 × TBST, по 5 минут на каждую промывку, и один раз с помощью 1 × TBS в течение 5 минут. Затем мембрану визуализировали и осуществляли количественное определение с применением прибора LiCor Odyssey (LI-COR Biotechnology). Уровни содержания GAA в сыворотке крови, выраженные как среднее +/- стандартное отклонение (SD) в произвольных единицах, показаны в таблице 5.
[224] Как показано в таблице 5, мыши CD63 HumIn с нокаутом GAA, обработанные высокой дозой (1011 в. г. /мышь) исследуемых AAV-scFv к hCD63-hGAA или AAV-hGAA, продемонстрировали устойчивые уровни содержания GAA в сыворотке крови в течение эксперимента, при этом уровни содержания GAA в сыворотке крови были несколько выше у мышей, обработанных с помощью AAV-scFv к hCD63-hGAA, чем у мышей, обработанных с помощью AAV-hGAA. У мышей, обработанных низкой дозой (1010 в. г. /мышь) либо AAV-scFv к hCD63-hGAA, либо AAV-hGAA, уровни GAA снижались в течение эксперимента, приближаясь к пренебрежительно малым уровням у некоторых мышей к моменту времени на 12 неделе.
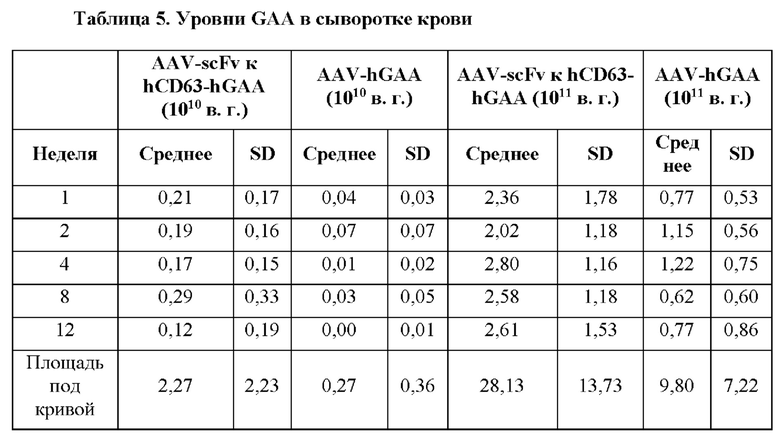
[225] Экспрессия GAA или scfv к hCD63::GAA сохранялась в течение времени у мышей, получавших высокую дозу AAV (1011 в. г. /мышь), но снижалась у мышей, получавших более низкую дозу (1010 в. г. /мышь). На фигуре 7А представлен график изменения уровней содержания GAA в сыворотке крови, измеренных с помощью вестерн-блоттинга, с течением времени для различных групп, инфицированных AAV, кодирующим GAA или scFv к hCD63, слитый с GAA. В случае слитого белка (scFv::GAA) демонстрировали неизменно более высокие уровни (например, в 2,5-3 раза) содержания GAA в сыворотке крови, чем в случае фермента GAA без домена доставки (фигура 7А).
[226] Количественная оценка экспрессии с помощью ПЦР в режиме реального времени в лизатах печени, сердца и квадрицепса спустя 3 месяца после инъекции показана на фигуре 7В. Экспрессия в печени была обнаружена при всех инъекциях конструкции на основе AAV, при этом самые высокие уровни были обнаружены при инъекциях 1e11 в. г. /мышь как для AAV-hGAA, так и для AAV-фрагмента, связывающего hCD63::hGAA (оба управляются специфическим для печени промотором LSP). Провели также сравнение уровня содержания GAA в сыворотке крови с уровнем экспрессии РНК GAA (фигура 7С), и результаты показывают, что мыши, получающие AAV, кодирующий слитый белок, демонстрировали более низкую экспрессию РНК GAA, локализующейся в печени, через 3 месяца, однако уровни содержания GAA в сыворотке крови были высокими у этой конкретной мыши. В случае инъекций AAV-LSP-hGAA не показали высокого уровня содержания GAA в сыворотке крови при низких уровнях содержания РНК в печени. См. фигуру 7С. Эти данные свидетельствуют о том, что AAV, кодирующий слитый белок (экспрессия управляется специфическим для печени промотором), обеспечивает улучшенный профиль секреции GAA.
[227] Также в гепатоцитах Huh-7 наблюдали более высокое отношение секретируемого к внутриклеточному антителу:hGAA по сравнению с введением hGAA отдельно. В одном эксперименте гепатоциты Huh-7 человека были временно трансфицированы конструкциями, управляемыми специфическим для печени промотором, которые кодировали hGAA, слитый белок scFv к hCD63::GAA или контрольный слитый белок, содержащий несвязывающий scFv и GAA. Обе слитые конструкции scFv::GAA характеризовались более высоким соотношением белка в секретируемом супернатанте, чем в случае hGAA отдельно, через 3 дня после трансфекции (статистически значимо для р<0,05, n=3). Добавление М6Р в супернатант в течение экспериментального периода для уменьшения CI-MPR-опосредованного захвата не влияло на соотношение.
Пример 5. Измерение уровня содержания гликогена в ткани и гистологическая характеристика мышечной ткани
[228] Измерение уровня содержания гликогена в ткани: для измерения содержания гликогена в отдельных тканях, тканях сердца, квадрицепса, икроножной мышцы, диафрагмы, камбаловидной мышцы и EDL, ткани вырезали у мышей из всех групп сразу же после асфиксии с помощью CO2, а затем мгновенно замораживали в жидком азоте и хранили при -80°С. Лизировали ~50 мг каждой ткани на настольном гомогенизаторе с шариками из нержавеющей стали в дистиллированной воде в соотношении от 1 мг до 25 мкл воды для измерений уровня содержания гликогена. Лизаты гликогена для анализа нагревали при 105°С в течение 15 минут и центрифугировали при 21000 × g для удаления дебриса. Измерения уровня гликогена проводили с применением набора для анализа гликогена (Sigma-Aldrich, № MAK016) в соответствии с инструкциями производителя для флуорометрических анализов.
Флуоресценцию каждого образца измеряли при длине волны возбуждения 535 нм и длине волны излучения 587 нм на флуоресцентном планшет-ридере (Molecular Devices, Spectramax i3). Рассчитанное количество гликогена рассчитывали с использованием следующей формулы, предоставленной производителем. Затем рассчитанное количество гликогена из каждой ткани в каждой группе обработки усредняли и полученные значения выражали в виде среднего +/- стандартное отклонение (SD) в таблице 6.
[229] Как показано в таблице 6, потеря Gaa вызывает значительное повышение средних уровней содержания гликогена во всех тканях, в отношении которых осуществляли измерения, по сравнению с мышами GAA WT. Обработка с помощью AAV-scFv к hCD63-hGAA при 1011 в. г. /мышь снижала уровень содержания гликогена до уровней, характерных для WT, или почти до уровней, характерных для WT, во всех протестированных тканях, в отличие от обработки с помощью AAV-GAA, которая обеспечивала лишь частичное снижение содержания накопленного гликогена. Низкие дозы любого вируса также снижали уровень содержания гликогена, но в меньшей степени, чем высокие дозы. Доза 1010 в. г. /мышь AAV-scFv к hCD63-hGAA снижала уровни содержания гликогена аналогично дозе 1011 в. г. /мышь AAV-GAA.
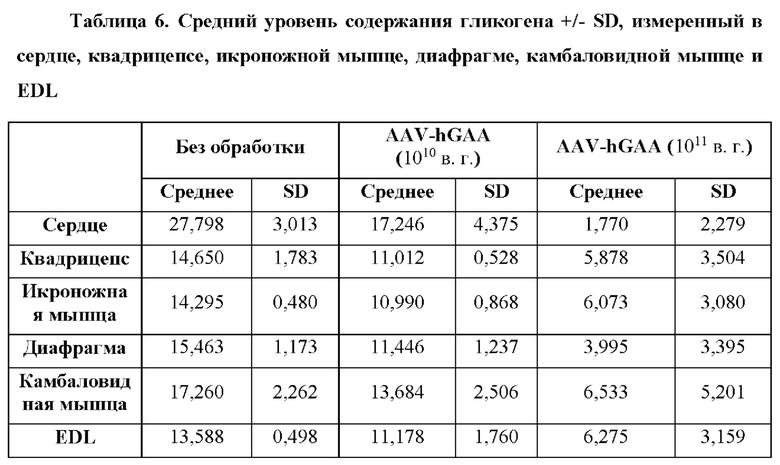
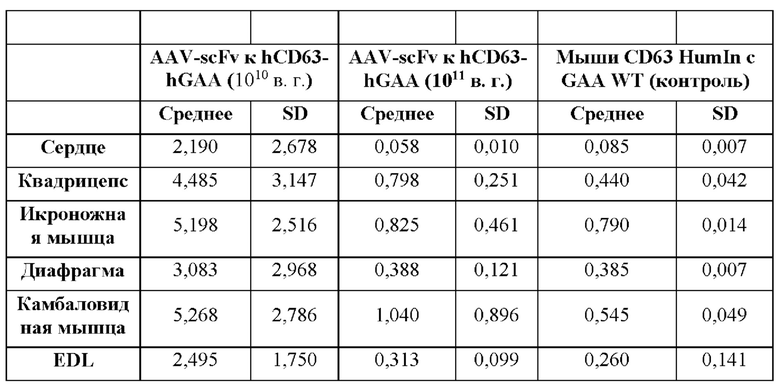
[230] Сбор квадрицепса для гистопатологического исследования и количественного определения. Образцы ткани квадрицепса от мышей из каждой группы, кроме группы, которую обрабатывали с помощью низкой дозы (1е10 в. г. /мышь), либо мгновенно замораживали в жидком азоте сразу после вырезания и хранили при -80°С для количественного определения экспрессии LC3b, либо помещали в блоки, содержащие среду О.С.Т (Tissue-Tek, №4583).
[231] Образцы тканей в среде О.С.Т отправляли в Histoserv, Inc. (Джермантаун, Мэриленд, США) для получения срезов и окрашивания с помощью реактива Шиффа (PAS) для выявления полисахаридов. Получали дополнительные срезы и возвращали для окрашивания с целью определения центрально расположенных ядер и уровня пролиферации лизосом.
[232] Окрашивание с помощью PAS: окрашенные с помощью PAS срезы визуализировали с применением сканера для препаратов Leica при увеличении 20х. Полученные изображения от мышей, являющихся репрезентативными для каждой группы обработки, показаны на фигуре 8.
[233] Как показано на фигуре 8, CD63 HumIn с нокаутом GAA, которых обработали с помощью AAV-scFv к hCD63-hGAA, через 3 месяца демонстрировали заметное снижение окрашивания по сравнению как с мышами CD63 HumIn с нокаутом GAA без обработки, так и с мышами CD63 HumIn GAA, обработанными с помощью AAV-hGAA, которые показали высокий уровень окрашивания с помощью PAS. Это дополнительно указывает на то, что обработка с помощью AAV-scFv к hCD63-hGAA может снизить уровень аккумуляции полисахаридов у мышей CD63 HumIn с нокаутом GAA и может действовать таким образом одинаково на все мышечные волокна.
[234] Количественное определение центральных ядер и пролиферации лизосом. Неокрашенные срезы от Histoserv извлекали из морозильной камеры, а затем фиксировали с помощью 4% параформальдегида в PBS в течение 15 минут в камере для окрашивания. Фиксированные препараты затем дважды промывали по 5 минут в PBS и затем инкубировали с блокирующим буфером (eBiosciences, 00-4953-54) в течение 1 часа при комнатной температуре. Затем препараты либо окрашивали с помощью крысиного антитела к Lamp-1 (Abcam, № АВ25245) при разбавлении 1:50 в блокирующем буфере, с помощью антитела кролика к ламинину (Sigma, №L9393) в разбавлении 1:1000 в блокирующем буфере или с помощью блокирующего буфера без добавления антител в камере для окрашивания с высокой влажностью, а затем переносили в 4°С для инкубации в течение ночи. Затем на следующий день препараты дважды промывали по 5 минут в PBS, а затем окрашивали либо козьим суперклональным вторичным антителом к IgG кролика (H+L), конъюгированным с Alexa Fluor 647 (Life Tech Thermo, № А27040), либо козьим перекрестно-адсорбированным вторичным антитело к IgG крысы (H+L), конъюгированным с Alexa Fluor 555 (Life Tech Thermo, №А21434) в камере для окрашивания, затем оставляли для инкубации в течение 1 часа при комнатной температуре. Затем окрашенные препараты дважды промывали по 5 минут в PBS, после чего их заливали средой Fluoromount-G с DAPI (Life Tech Thermo, №00-4959-52) и визуализировали с помощью прибора Zeiss LSM710 (Carl Zeiss Microscopy GmbH). Количество ядер, расположенных по центру, количественно определяли с использованием программного обеспечения Halo (Indica Labs, Нью-Мексико, США), и это количество выражено в виде процента волокон, для которых показано центральное расположение ядра, +/- стандартное отклонение и показано в таблице 7. Пролиферация лизосом изображена на фигуре 8.
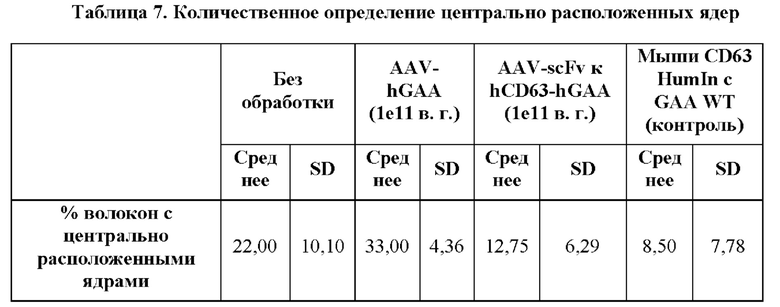
[235] Количественное определение уровня экспрессии LC3b. Для количественного определения уровня экспрессии LC3b образцы, подвергнутые мгновенному замораживанию, размораживали, гомогенизировали, а затем лизировали в буфере RIPA при соотношении 1 мг ткани и 25 мкл буфера RIPA (150 мМ NaCl, 1,0% IGEPAL® CA-630, 0,5% дезоксихолата натрия, 0,1% SDS, 50 мМ Tris, pH 8,0, Sigma Aldrich, R0278) с помощью соударения с шариками в течение 45 секунд (МР Biomedical). Лизаты очищали от нерастворимого материала путем центрифугирования при 21000 × g, а затем 300 мкг лизата в буфере RIPA загружали в 4-20% предварительно залитый гель Novex wedgewell, переносили на нитроцеллюлозную мембрану и анализировали с помощью вестерн-блоттинга с применением протокола, аналогичного ранее описанному, для анализа уровней содержания GAA в сыворотке крови с заменой первичного антитела к GAA на использование первичного антитела, которое распознает LC3b-I и LC3b-II мыши (Sigma, №L7543). Затем мембрану визуализировали и осуществляли количественное определение с применением прибора LiCor Odyssey (LI-COR Biotechnology). Уровни LC3b-I и LC3b-II, выраженные в виде (среднее +/- стандартное отклонение) в произвольных единицах, показаны в таблице 8.
[236] Как показано в таблице 8, наблюдалось значительное увеличение как средних уровней LC3b-I, так и LC3b-II у мышей с дефицитом GAA по сравнению с мышами CD63 HumIn с GAA WT. Обработка с помощью AAV-scFv к hCD63-hGAA снизила средние уровни LC3b-I и LC3b-II в CD63 HumIn с нокаутом GAA до уровней, характерных для WT, или почти до уровней, характерных для WT. CD63 HumIn с нокаутом GAA, обработанные с помощью AAV-hGAA, демонстрировали слегка пониженные средние уровни LC3b-I и LC3b-II по сравнению с мышами CD63 HumIn с нокаутом GAA, но это снижение было не таким выраженным, как при обработке с помощью AAV-scFv к hCD63-hGAA.
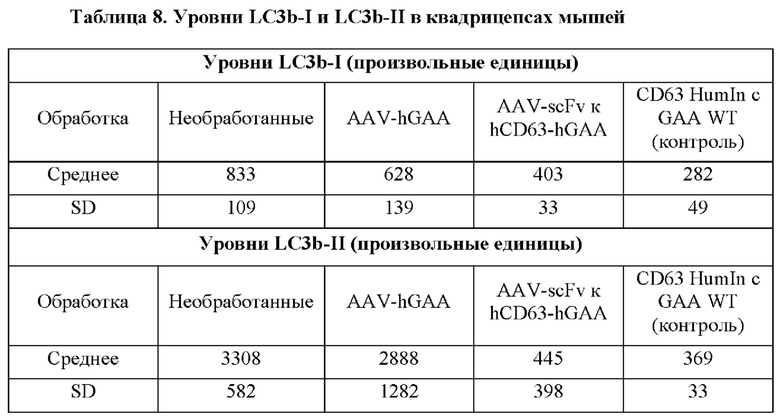
Пример 6. Обработка с помощью AAV, содержащего фрагмент, связывающий hCD63::GAA, приводила к значительным улучшениям в тестах мышечной силы и координации
[237] Сила захвата и эффективность выполнения теста с вращающимся барабаном у мышей, обработанных (см. выше) с помощью либо AAV-LSP-hGAA, либо AAV-LSP-фрагмент, связывающий hCD63::hGAA. Измерения при ускорении вращающегося барабана (фигура 9А) и измерения силы захвата передних конечностей (фигура 9В) у мышей с GAA дикого типа, необработанного контроля при обработке с помощью AAV-LSP-hGAA (1e11 в. г. /мышь) или AAV-LSP-фрагмента, связывающего hCD63::hGAA (1e11 в. г. /мышь), проводили с месячными интервалами в течение 6 месяцев. Планки погрешностей представляли собой +/- SD. N=8-10 для всех групп.
Пример 7. Другие мембранные белки в качестве «направляющих», которые направляют GAA в ткани
[238] Тестировали другие мембранные белки, такие как слитые белки на основе фрагмента, связывающего ITGA7 (интегрин альфа-7), в отношении направления GAA в ткани для замещения GAA у мышей с дефицитом ферментов. Миобласты С2С12 мыши инкубировали в течение ночи с комплексом фрагмента, связывающего mCD63, и GAA, или комплексом фрагмента, связывающего ITGA7, и GAA, с или без 5 мМ М6Р. Динамику содержания активного фермента GAA в лизатах миобластов выявляли в случае обоих слитых белков (фигура 10А). В дальнейших экспериментах мышам с нокаутом GAA, гуманизированным по CD63 (GAA-/-; CD63hu/hu), вводили плазмиды, кодирующие фрагмент, связывающий hCD63::GAA в формате scFv::GAA или фрагмент, связывающий интегрин альфа-7, в формате полноразмерного IgG4::GAA путем гидродинамической доставки (HDD), и мышей умерщвляли через 3 недели после HDD. Уровни содержания гликогена в тканях измеряли в сердце, квадрицепсе, икроножной мышце и диафрагме. Необработанных контрольных мышей GAA-/- xCD63hu/hu и необработанных контрольных мышей дикого типа GAA+/+; CD63hu/hu (4) также тестировали в тех же условиях. Уровни содержания гликогена были на очень низком уровне как у мышей, обработанных с помощью комплекса фрагмент, связывающий hCD63::GAA, так и у мышей, обработанных с помощью комплекса фрагмент, связывающий ITGA7::GAA, как у мышей дикого типа. См. фигуру 10В.
Пример 8. При сопоставимых уровнях содержания в сыворотке крови обработка с помощью AAV-фрагмента, связывающего CD63::GAA, являлась более эффективной, чем конструкция AAV с оптимизированным GAA
[239] Мыши CD63 HumIn с нокаутом GAA (GAA-/- xCD63hu/hu), инфицированные с помощью AAV, содержащих специфический в отношении печени энхансер (серпина 1; SEQ ID NO: 9) и специфический в отношении печени промотор (LSP; TTR; SEQ ID NO: 8), управляющие экспрессией мультидоменного терапевтического средства на основе комплекса фрагмент, связывающий hCD63::GAA (SEQ ID NO: 10), в котором используется сигнальный пептид химотрипсиноген В2 (SP7) и содержатся аминокислоты 36-952 GAA человека (Δ8GAA), показали значительный прирост в тестах на мышечную силу и координацию. Вводили три разные дозы каждого вируса: 5е11 в. г. /кг, 2е12 в. г. /кг и 4е12 в. г. /кг. Сыворотку крови собирали путем вызывания подчелюстного кровотечения на регулярной основе. Через месяц после инфицирования с помощью AAV мышей умерщвляли. Образцы ткани сердечной и скелетной мышцы собирали, и мгновенно замораживали в жидком азоте, и поддерживали при -80°С для хранения. Уровень содержания гликогена в тканях измеряли путем гомогенизации тканей с помощью соударения с шариками в дистиллированной воде. Образцы кипятили и центрифугировали, а супернатанты использовали в коммерческом наборе для анализа гликогена. В случае сыворотки крови количественное определение осуществляли с применением вестерн-блоттинга с антителом к GAA человека, как описано в предыдущих примерах. Для каждой мыши строили график зависимости уровня содержания гликогена в каждой ткани и уровня содержания конструкции в сыворотке крови через 1 месяц. Для определения ЕС50 для двух средств обработки в каждой ткани применяли аппроксимацию кривой по 4 параметрам.
[240] Инфицирование с помощью AAV, содержащих специфический в отношении печени промотор (LSP), кодирующий либо комплекс фрагмент, связывающий hCD63::GAA, либо sp7-Δ8GAA, обеспечивало сопоставимые уровни содержания GAA в сыворотке крови при каждой инфицирующей дозе. Фигура 11. Тем не менее, в каждой анализируемой мышечной ткани при использовании комплекса фрагмент, связывающий hCD63::GAA, в отличии от sp7-Δ8GAA наблюдалось снижение ЕС50 в ~2,2 раза, демонстрируя, что при эквивалентных уровнях содержания в сыворотке крови комплекс фрагмент, связывающий CD63::GAA, более эффективно удаляет гликоген, чем модифицированная конструкция для экспрессии GAA, которая не слита с антителом. См. фигуру 12.
Пример 9. Содержание гликогена в ЦНС мышиной модели заболевания Помпе после обработки с помощью AAV с различными конструкциями и дозами GAA
[241] Двухмесячным мышам CD63 HumIn с нокаутом GAA вводили посредством инъекции в хвостовую вену либо вирус AAV2/8, содержащий геном либо со специфическим в отношении печени TTR-промотором, управляющим GAA человека (AAV-hGAA; описанный в примере 1), либо со специфическим в отношении печени TTR-промотором, управляющим scFv к CD63 человека, слитым на своем С-конце с GAA человека (AAV-scFv к hCD63-hGAA; описанный в примере 1). Оба вируса AAV2/8 доставляли при 1e11 в. г. /мышь. В качестве контроля в анализ были включены необработанные мыши CD63 HumIn с нокаутом GAA (Gaa-/-) и необработанные мыши CD63 HumIn с интактным (мыши дикого типа) геном GAA. Мышей содержали в течение 9 месяцев после обработки, после чего всех мышей умерщвляли и собирали отдельные ткани для измерений содержания гликогена. Ткани ЦНС разрезали на льду и быстро замораживали через 9 месяцев после трансдукции AAV. Ткани спинного мозга, мозжечка и гиппокампа гомогенизировали в дистиллированной деионизированной воде с использованием соударения с шариками, и гликоген измеряли в надосадочных жидкостях лизатов тканей с использованием коммерческого набора для флуорометрического анализа гликогена (фигура 13).
[242] В другом аналогичном эксперименте нокаутных мышей обрабатывали с помощью конструкций на основе AAV, кодирующих GAA (1e11 в. г.), или слитого белка, состоящего из scFv к CD63 и GAA (дозы 1е10 в. г., 5е10 в. г. или 1e11 в. г.). Исследовали мышей дикого типа и количество накопленного гликогена на мг ткани ЦНС (спинной мозг: фигура 14А; головной мозг: фигура 14В) через 3 месяца после доставки AAV. Использовались мыши дикого типа и нокаутные мыши (GAA-/-), которые не подвергались обработке, в качестве объекта сравнения для их накопленных уровней гликогена в ткани ЦНС в течение той же продолжительности (3 месяца).
[243] Слитые конструкции ScFv-GAA были более эффективны, чем GAA отдельно, в снижении уровней накопленного гликогена в заболевших мышах при дозе 1e11 в. г. /мышь (фигуры 13-14). Доза 5е10 в. г. слитого ScFv-GAA обеспечила сниженные уровни накопленного гликогена, эквивалентные большим дозам отдельной конструкции GAA (фигуры 14А-14В). Как было показано в Bordeaux et al 2017, такие уровни сниженного накопленного гликогена являются эффективными (например, снижение уровней гликогена и улучшения мышечной силы у мышей, которым интратекально инъектировали AAV GAA). Коррелирующий уровень слитого белка ScFv-GAA в сыворотке крови выявляли при 5е10 в. г. и более чем 15 мкг/мл у мышей, получавших 1e11 в. г. (таблица 9).

[244] Без ограничения какой-либо теорией выявляемые уровни в сыворотке крови, например, уровни в сыворотке крови выше чем 1 мкг/мл GAA, связанного с доменом доставки, который проникает через гематоэнцефалический барьер, считаются терапевтическими.
Пример 10. Экспрессия мультидоменного терапевтического белка, содержащего по меньшей мере два домена доставки
Клетки СНО трансфицировали конструкциями для экспрессии, изображенными на фигурах 1C-1G, и подтверждали экспрессию каждой из конструкций (данные не показаны). Кроме того, связывание некоторых мультидоменных терапевтических белков, кодируемых 4W1 и 4М1 (фигура 1F), с CD63 подтверждали с помощью ELISA (данные не показаны).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Регенерон Фармацеутикалс, Инк.
Баик, Эндрю
Цигнар, Катерина
Праггастис, Мария
<120> СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ ТЕРАПЕВТИЧЕСКОГО БЕЛКА
<130> 009108.457WO1/10457WO01
<150> 62777683
<151> 2018-12-10
<150> 62627721
<151> 2018-02-07
<160> 13
<170> PatentIn версия 3.5
<210> 1
<211> 952
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Gly Val Arg His Pro Pro Cys Ser His Arg Leu Leu Ala Val Cys
1 5 10 15
Ala Leu Val Ser Leu Ala Thr Ala Ala Leu Leu Gly His Ile Leu Leu
20 25 30
His Asp Phe Leu Leu Val Pro Arg Glu Leu Ser Gly Ser Ser Pro Val
35 40 45
Leu Glu Glu Thr His Pro Ala His Gln Gln Gly Ala Ser Arg Pro Gly
50 55 60
Pro Arg Asp Ala Gln Ala His Pro Gly Arg Pro Arg Ala Val Pro Thr
65 70 75 80
Gln Cys Asp Val Pro Pro Asn Ser Arg Phe Asp Cys Ala Pro Asp Lys
85 90 95
Ala Ile Thr Gln Glu Gln Cys Glu Ala Arg Gly Cys Cys Tyr Ile Pro
100 105 110
Ala Lys Gln Gly Leu Gln Gly Ala Gln Met Gly Gln Pro Trp Cys Phe
115 120 125
Phe Pro Pro Ser Tyr Pro Ser Tyr Lys Leu Glu Asn Leu Ser Ser Ser
130 135 140
Glu Met Gly Tyr Thr Ala Thr Leu Thr Arg Thr Thr Pro Thr Phe Phe
145 150 155 160
Pro Lys Asp Ile Leu Thr Leu Arg Leu Asp Val Met Met Glu Thr Glu
165 170 175
Asn Arg Leu His Phe Thr Ile Lys Asp Pro Ala Asn Arg Arg Tyr Glu
180 185 190
Val Pro Leu Glu Thr Pro His Val His Ser Arg Ala Pro Ser Pro Leu
195 200 205
Tyr Ser Val Glu Phe Ser Glu Glu Pro Phe Gly Val Ile Val Arg Arg
210 215 220
Gln Leu Asp Gly Arg Val Leu Leu Asn Thr Thr Val Ala Pro Leu Phe
225 230 235 240
Phe Ala Asp Gln Phe Leu Gln Leu Ser Thr Ser Leu Pro Ser Gln Tyr
245 250 255
Ile Thr Gly Leu Ala Glu His Leu Ser Pro Leu Met Leu Ser Thr Ser
260 265 270
Trp Thr Arg Ile Thr Leu Trp Asn Arg Asp Leu Ala Pro Thr Pro Gly
275 280 285
Ala Asn Leu Tyr Gly Ser His Pro Phe Tyr Leu Ala Leu Glu Asp Gly
290 295 300
Gly Ser Ala His Gly Val Phe Leu Leu Asn Ser Asn Ala Met Asp Val
305 310 315 320
Val Leu Gln Pro Ser Pro Ala Leu Ser Trp Arg Ser Thr Gly Gly Ile
325 330 335
Leu Asp Val Tyr Ile Phe Leu Gly Pro Glu Pro Lys Ser Val Val Gln
340 345 350
Gln Tyr Leu Asp Val Val Gly Tyr Pro Phe Met Pro Pro Tyr Trp Gly
355 360 365
Leu Gly Phe His Leu Cys Arg Trp Gly Tyr Ser Ser Thr Ala Ile Thr
370 375 380
Arg Gln Val Val Glu Asn Met Thr Arg Ala His Phe Pro Leu Asp Val
385 390 395 400
Gln Trp Asn Asp Leu Asp Tyr Met Asp Ser Arg Arg Asp Phe Thr Phe
405 410 415
Asn Lys Asp Gly Phe Arg Asp Phe Pro Ala Met Val Gln Glu Leu His
420 425 430
Gln Gly Gly Arg Arg Tyr Met Met Ile Val Asp Pro Ala Ile Ser Ser
435 440 445
Ser Gly Pro Ala Gly Ser Tyr Arg Pro Tyr Asp Glu Gly Leu Arg Arg
450 455 460
Gly Val Phe Ile Thr Asn Glu Thr Gly Gln Pro Leu Ile Gly Lys Val
465 470 475 480
Trp Pro Gly Ser Thr Ala Phe Pro Asp Phe Thr Asn Pro Thr Ala Leu
485 490 495
Ala Trp Trp Glu Asp Met Val Ala Glu Phe His Asp Gln Val Pro Phe
500 505 510
Asp Gly Met Trp Ile Asp Met Asn Glu Pro Ser Asn Phe Ile Arg Gly
515 520 525
Ser Glu Asp Gly Cys Pro Asn Asn Glu Leu Glu Asn Pro Pro Tyr Val
530 535 540
Pro Gly Val Val Gly Gly Thr Leu Gln Ala Ala Thr Ile Cys Ala Ser
545 550 555 560
Ser His Gln Phe Leu Ser Thr His Tyr Asn Leu His Asn Leu Tyr Gly
565 570 575
Leu Thr Glu Ala Ile Ala Ser His Arg Ala Leu Val Lys Ala Arg Gly
580 585 590
Thr Arg Pro Phe Val Ile Ser Arg Ser Thr Phe Ala Gly His Gly Arg
595 600 605
Tyr Ala Gly His Trp Thr Gly Asp Val Trp Ser Ser Trp Glu Gln Leu
610 615 620
Ala Ser Ser Val Pro Glu Ile Leu Gln Phe Asn Leu Leu Gly Val Pro
625 630 635 640
Leu Val Gly Ala Asp Val Cys Gly Phe Leu Gly Asn Thr Ser Glu Glu
645 650 655
Leu Cys Val Arg Trp Thr Gln Leu Gly Ala Phe Tyr Pro Phe Met Arg
660 665 670
Asn His Asn Ser Leu Leu Ser Leu Pro Gln Glu Pro Tyr Ser Phe Ser
675 680 685
Glu Pro Ala Gln Gln Ala Met Arg Lys Ala Leu Thr Leu Arg Tyr Ala
690 695 700
Leu Leu Pro His Leu Tyr Thr Leu Phe His Gln Ala His Val Ala Gly
705 710 715 720
Glu Thr Val Ala Arg Pro Leu Phe Leu Glu Phe Pro Lys Asp Ser Ser
725 730 735
Thr Trp Thr Val Asp His Gln Leu Leu Trp Gly Glu Ala Leu Leu Ile
740 745 750
Thr Pro Val Leu Gln Ala Gly Lys Ala Glu Val Thr Gly Tyr Phe Pro
755 760 765
Leu Gly Thr Trp Tyr Asp Leu Gln Thr Val Pro Val Glu Ala Leu Gly
770 775 780
Ser Leu Pro Pro Pro Pro Ala Ala Pro Arg Glu Pro Ala Ile His Ser
785 790 795 800
Glu Gly Gln Trp Val Thr Leu Pro Ala Pro Leu Asp Thr Ile Asn Val
805 810 815
His Leu Arg Ala Gly Tyr Ile Ile Pro Leu Gln Gly Pro Gly Leu Thr
820 825 830
Thr Thr Glu Ser Arg Gln Gln Pro Met Ala Leu Ala Val Ala Leu Thr
835 840 845
Lys Gly Gly Glu Ala Arg Gly Glu Leu Phe Trp Asp Asp Gly Glu Ser
850 855 860
Leu Glu Val Leu Glu Arg Gly Ala Tyr Thr Gln Val Ile Phe Leu Ala
865 870 875 880
Arg Asn Asn Thr Ile Val Asn Glu Leu Val Arg Val Thr Ser Glu Gly
885 890 895
Ala Gly Leu Gln Leu Gln Lys Val Thr Val Leu Gly Val Ala Thr Ala
900 905 910
Pro Gln Gln Val Leu Ser Asn Gly Val Pro Val Ser Asn Phe Thr Tyr
915 920 925
Ser Pro Asp Thr Lys Val Leu Asp Ile Cys Val Ser Leu Leu Met Gly
930 935 940
Glu Gln Phe Leu Val Ser Trp Cys
945 950
<210> 2
<211> 245
<212> БЕЛОК
<213> Искуственная
<220>
<223> синтетическая
<400> 2
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Ser Gly Gly Ser Thr Tyr Tyr Ser Asp Thr Val
50 55 60
Lys Gly Gln Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Arg Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Glu Asp Tyr Asp Gly Arg Leu Thr Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Ile Ser Ala Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser
130 135 140
Leu Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser
145 150 155 160
Lys Ser Val Ser Thr Ser Gly Tyr Ser Tyr Met Asn Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Pro Pro Lys Val Leu Ile Tyr Leu Ala Ser Lys Leu
180 185 190
Glu Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr
210 215 220
Tyr Cys Gln His Ser Arg Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys
245
<210> 3
<211> 21
<212> ДНК
<213> Искуственная
<220>
<223> синтетическая
<400> 3
ggaaccccta gtgatggagt t
21
<210> 4
<211> 16
<212> ДНК
<213> Искуственная
<220>
<223> синтетическая
<400> 4
cggcctcagt gagcga
16
<210> 5
<211> 21
<212> ДНК
<213> Искуственная
<220>
<223> синтетическая
<400> 5
cactccctct ctgcgcgctc g
21
<210> 6
<211> 141
<212> ДНК
<213> Искуственная
<220>
<223> синтетическая
<400> 6
cctgcaggca gctgcgcgct cgctcgctca ctgaggccgc ccgggcaaag cccgggcgtc
60
gggcgacctt tggtcgcccg gcctcagtga gcgagcgagc gcgcagagag ggagtggcca
120
actccatcac taggggttcc t
141
<210> 7
<211> 141
<212> ДНК
<213> Искуственная
<220>
<223> синтетическая
<400> 7
aggaacccct agtgatggag ttggccactc cctctctgcg cgctcgctcg ctcactgagg
60
ccgggcgacc aaaggtcgcc cgacgcccgg gctttgcccg ggcggcctca gtgagcgagc
120
gagcgcgcag ctgcctgcag g
141
<210> 8
<211> 224
<212> ДНК
<213> Искуственная
<220>
<223> синтетическая
<400> 8
gtctgtctgc acatttcgta gagcgagtgt tccgatactc taatctccct aggcaaggtt
60
catatttgtg taggttactt attctccttt tgttgactaa gtcaataatc agaatcagca
120
ggtttggagt cagcttggca gggatcagca gcctgggttg gaaggagggg gtataaaagc
180
cccttcacca ggagaagccg tcacacagat ccacaagctc ctga
224
<210> 9
<211> 72
<212> ДНК
<213> Искуственная
<220>
<223> синтетическая
<400> 9
gggggaggct gctggtgaat attaaccaag gtcaccccag ttatcggagg agcaaacagg
60
ggctaagtcc ac
72
<210> 10
<211> 1133
<212> БЕЛОК
<213> Искуственная
<220>
<223> синтетическая
<400> 10
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Thr Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Ser Gly Gly Ser Thr Tyr Tyr Ser Asp Thr Val
50 55 60
Lys Gly Gln Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Arg Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Glu Asp Tyr Asp Gly Arg Leu Thr Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Ile Ser Ala Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Asp Ile Val Leu Thr Gln Ser Pro Ala Ser
130 135 140
Leu Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser
145 150 155 160
Lys Ser Val Ser Thr Ser Gly Tyr Ser Tyr Met Asn Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Pro Pro Lys Val Leu Ile Tyr Leu Ala Ser Lys Leu
180 185 190
Glu Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Asn Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr
210 215 220
Tyr Cys Gln His Ser Arg Glu Leu Pro Tyr Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser Ala His Pro Gly Arg Pro
245 250 255
Arg Ala Val Pro Thr Gln Cys Asp Val Pro Pro Asn Ser Arg Phe Asp
260 265 270
Cys Ala Pro Asp Lys Ala Ile Thr Gln Glu Gln Cys Glu Ala Arg Gly
275 280 285
Cys Cys Tyr Ile Pro Ala Lys Gln Gly Leu Gln Gly Ala Gln Met Gly
290 295 300
Gln Pro Trp Cys Phe Phe Pro Pro Ser Tyr Pro Ser Tyr Lys Leu Glu
305 310 315 320
Asn Leu Ser Ser Ser Glu Met Gly Tyr Thr Ala Thr Leu Thr Arg Thr
325 330 335
Thr Pro Thr Phe Phe Pro Lys Asp Ile Leu Thr Leu Arg Leu Asp Val
340 345 350
Met Met Glu Thr Glu Asn Arg Leu His Phe Thr Ile Lys Asp Pro Ala
355 360 365
Asn Arg Arg Tyr Glu Val Pro Leu Glu Thr Pro His Val His Ser Arg
370 375 380
Ala Pro Ser Pro Leu Tyr Ser Val Glu Phe Ser Glu Glu Pro Phe Gly
385 390 395 400
Val Ile Val Arg Arg Gln Leu Asp Gly Arg Val Leu Leu Asn Thr Thr
405 410 415
Val Ala Pro Leu Phe Phe Ala Asp Gln Phe Leu Gln Leu Ser Thr Ser
420 425 430
Leu Pro Ser Gln Tyr Ile Thr Gly Leu Ala Glu His Leu Ser Pro Leu
435 440 445
Met Leu Ser Thr Ser Trp Thr Arg Ile Thr Leu Trp Asn Arg Asp Leu
450 455 460
Ala Pro Thr Pro Gly Ala Asn Leu Tyr Gly Ser His Pro Phe Tyr Leu
465 470 475 480
Ala Leu Glu Asp Gly Gly Ser Ala His Gly Val Phe Leu Leu Asn Ser
485 490 495
Asn Ala Met Asp Val Val Leu Gln Pro Ser Pro Ala Leu Ser Trp Arg
500 505 510
Ser Thr Gly Gly Ile Leu Asp Val Tyr Ile Phe Leu Gly Pro Glu Pro
515 520 525
Lys Ser Val Val Gln Gln Tyr Leu Asp Val Val Gly Tyr Pro Phe Met
530 535 540
Pro Pro Tyr Trp Gly Leu Gly Phe His Leu Cys Arg Trp Gly Tyr Ser
545 550 555 560
Ser Thr Ala Ile Thr Arg Gln Val Val Glu Asn Met Thr Arg Ala His
565 570 575
Phe Pro Leu Asp Val Gln Trp Asn Asp Leu Asp Tyr Met Asp Ser Arg
580 585 590
Arg Asp Phe Thr Phe Asn Lys Asp Gly Phe Arg Asp Phe Pro Ala Met
595 600 605
Val Gln Glu Leu His Gln Gly Gly Arg Arg Tyr Met Met Ile Val Asp
610 615 620
Pro Ala Ile Ser Ser Ser Gly Pro Ala Gly Ser Tyr Arg Pro Tyr Asp
625 630 635 640
Glu Gly Leu Arg Arg Gly Val Phe Ile Thr Asn Glu Thr Gly Gln Pro
645 650 655
Leu Ile Gly Lys Val Trp Pro Gly Ser Thr Ala Phe Pro Asp Phe Thr
660 665 670
Asn Pro Thr Ala Leu Ala Trp Trp Glu Asp Met Val Ala Glu Phe His
675 680 685
Asp Gln Val Pro Phe Asp Gly Met Trp Ile Asp Met Asn Glu Pro Ser
690 695 700
Asn Phe Ile Arg Gly Ser Glu Asp Gly Cys Pro Asn Asn Glu Leu Glu
705 710 715 720
Asn Pro Pro Tyr Val Pro Gly Val Val Gly Gly Thr Leu Gln Ala Ala
725 730 735
Thr Ile Cys Ala Ser Ser His Gln Phe Leu Ser Thr His Tyr Asn Leu
740 745 750
His Asn Leu Tyr Gly Leu Thr Glu Ala Ile Ala Ser His Arg Ala Leu
755 760 765
Val Lys Ala Arg Gly Thr Arg Pro Phe Val Ile Ser Arg Ser Thr Phe
770 775 780
Ala Gly His Gly Arg Tyr Ala Gly His Trp Thr Gly Asp Val Trp Ser
785 790 795 800
Ser Trp Glu Gln Leu Ala Ser Ser Val Pro Glu Ile Leu Gln Phe Asn
805 810 815
Leu Leu Gly Val Pro Leu Val Gly Ala Asp Val Cys Gly Phe Leu Gly
820 825 830
Asn Thr Ser Glu Glu Leu Cys Val Arg Trp Thr Gln Leu Gly Ala Phe
835 840 845
Tyr Pro Phe Met Arg Asn His Asn Ser Leu Leu Ser Leu Pro Gln Glu
850 855 860
Pro Tyr Ser Phe Ser Glu Pro Ala Gln Gln Ala Met Arg Lys Ala Leu
865 870 875 880
Thr Leu Arg Tyr Ala Leu Leu Pro His Leu Tyr Thr Leu Phe His Gln
885 890 895
Ala His Val Ala Gly Glu Thr Val Ala Arg Pro Leu Phe Leu Glu Phe
900 905 910
Pro Lys Asp Ser Ser Thr Trp Thr Val Asp His Gln Leu Leu Trp Gly
915 920 925
Glu Ala Leu Leu Ile Thr Pro Val Leu Gln Ala Gly Lys Ala Glu Val
930 935 940
Thr Gly Tyr Phe Pro Leu Gly Thr Trp Tyr Asp Leu Gln Thr Val Pro
945 950 955 960
Val Glu Ala Leu Gly Ser Leu Pro Pro Pro Pro Ala Ala Pro Arg Glu
965 970 975
Pro Ala Ile His Ser Glu Gly Gln Trp Val Thr Leu Pro Ala Pro Leu
980 985 990
Asp Thr Ile Asn Val His Leu Arg Ala Gly Tyr Ile Ile Pro Leu Gln
995 1000 1005
Gly Pro Gly Leu Thr Thr Thr Glu Ser Arg Gln Gln Pro Met Ala
1010 1015 1020
Leu Ala Val Ala Leu Thr Lys Gly Gly Glu Ala Arg Gly Glu Leu
1025 1030 1035
Phe Trp Asp Asp Gly Glu Ser Leu Glu Val Leu Glu Arg Gly Ala
1040 1045 1050
Tyr Thr Gln Val Ile Phe Leu Ala Arg Asn Asn Thr Ile Val Asn
1055 1060 1065
Glu Leu Val Arg Val Thr Ser Glu Gly Ala Gly Leu Gln Leu Gln
1070 1075 1080
Lys Val Thr Val Leu Gly Val Ala Thr Ala Pro Gln Gln Val Leu
1085 1090 1095
Ser Asn Gly Val Pro Val Ser Asn Phe Thr Tyr Ser Pro Asp Thr
1100 1105 1110
Lys Val Leu Asp Ile Cys Val Ser Leu Leu Met Gly Glu Gln Phe
1115 1120 1125
Leu Val Ser Trp Cys
1130
<210> 11
<211> 3489
<212> ДНК
<213> Искуственная
<220>
<223> синтетическая
<400> 11
atgcacagac ctagacgtcg tggaactcgt ccacctccac tggcactgct cgctgctctc
60
ctcctggctg cacgtggtgc tgatgcagaa gtgaagctgg tggagtctgg gggaggctta
120
gtgcagcctg gagggtccct gaaactctcc tgtgcaacct ctggattcac tttcagtgac
180
tattacatgt cttgggttcg ccagactcca gagaagaggc tggagtgggt cgcatatatt
240
agtagtagtg gtggtagcac ctattattca gacactgtaa agggccaatt caccatctcc
300
agagacaatg ccaagaacac cctgtacctg caaatgagcc gtctgaagtc tgaggacaca
360
gccatgtatt actgtgcaag acgagaagat tacgacggaa gacttactta ctggggccaa
420
gggactctgg tcaccatctc tgcaggagga agtggtggag gcgggtcagg aggtggcggg
480
agcggcggtg acattgtgct gacacagtct cctgcttcct tagctgtatc tctggggcag
540
agggccacca tctcctgcag ggccagcaaa agtgtcagta catctggtta tagttatatg
600
aactggtacc aacagaaacc aggacagcca cccaaagtcc tcatctatct tgcatccaaa
660
ctagaatctg gggtccctgc caggttcagt ggcagtgggt cagggacaga cttcaccctc
720
aacatccatc ctgtggagga ggaggatgct gcaacctatt actgtcagca cagtagggag
780
cttccgtaca cgttcggagg ggggaccaaa ctggaaataa aaggtggtgg cggttcagca
840
caccccggcc gtcccagagc agtgcccaca cagtgcgacg tcccccccaa cagccgcttc
900
gattgcgccc ctgacaaggc catcacccag gaacagtgcg aggcccgcgg ctgttgctac
960
atccctgcaa agcaggggct gcagggagcc cagatggggc agccctggtg cttcttccca
1020
cccagctacc ccagctacaa gctggagaac ctgagctcct ctgaaatggg ctacacggcc
1080
accctgaccc gtaccacccc caccttcttc cccaaggaca tcctgaccct gcggctggac
1140
gtgatgatgg agactgagaa ccgcctccac ttcacgatca aagatccagc taacaggcgc
1200
tacgaggtgc ccttggagac cccgcatgtc cacagccggg caccgtcccc actctacagc
1260
gtggagttct ccgaggagcc cttcggggtg atcgtgcgcc ggcagctgga cggccgcgtg
1320
ctgctgaaca cgacggtggc gcccctgttc tttgcggacc agttccttca gctgtccacc
1380
tcgctgccct cgcagtatat cacaggcctc gccgagcacc tcagtcccct gatgctcagc
1440
accagctgga ccaggatcac cctgtggaac cgggaccttg cgcccacgcc cggtgcgaac
1500
ctctacgggt ctcacccttt ctacctggcg ctggaggacg gcgggtcggc acacggggtg
1560
ttcctgctaa acagcaatgc catggatgtg gtcctgcagc cgagccctgc ccttagctgg
1620
aggtcgacag gtgggatcct ggatgtctac atcttcctgg gcccagagcc caagagcgtg
1680
gtgcagcagt acctggacgt tgtgggatac ccgttcatgc cgccatactg gggcctgggc
1740
ttccacctgt gccgctgggg ctactcctcc accgctatca cccgccaggt ggtggagaac
1800
atgaccaggg cccacttccc cctggacgtc cagtggaacg acctggacta catggactcc
1860
cggagggact tcacgttcaa caaggatggc ttccgggact tcccggccat ggtgcaggag
1920
ctgcaccagg gcggccggcg ctacatgatg atcgtggatc ctgccatcag cagctcgggc
1980
cctgccggga gctacaggcc ctacgacgag ggtctgcgga ggggggtttt catcaccaac
2040
gagaccggcc agccgctgat tgggaaggta tggcccgggt ccactgcctt ccccgacttc
2100
accaacccca cagccctggc ctggtgggag gacatggtgg ctgagttcca tgaccaggtg
2160
cccttcgacg gcatgtggat tgacatgaac gagccttcca acttcatcag gggctctgag
2220
gacggctgcc ccaacaatga gctggagaac ccaccctacg tgcctggggt ggttgggggg
2280
accctccagg cggccaccat ctgtgcctcc agccaccagt ttctctccac acactacaac
2340
ctgcacaacc tctacggcct gaccgaagcc atcgcctccc acagggcgct ggtgaaggct
2400
cgggggacac gcccatttgt gatctcccgc tcgacctttg ctggccacgg ccgatacgcc
2460
ggccactgga cgggggacgt gtggagctcc tgggagcagc tcgcctcctc cgtgccagaa
2520
atcctgcagt ttaacctgct gggggtgcct ctggtcgggg ccgacgtctg cggcttcctg
2580
ggcaacacct cagaggagct gtgtgtgcgc tggacccagc tgggggcctt ctaccccttc
2640
atgcggaacc acaacagcct gctcagtctg ccccaggagc cgtacagctt cagcgagccg
2700
gcccagcagg ccatgaggaa ggccctcacc ctgcgctacg cactcctccc ccacctctac
2760
acactgttcc accaggccca cgtcgcgggg gagaccgtgg cccggcccct cttcctggag
2820
ttccccaagg actctagcac ctggactgtg gaccaccagc tcctgtgggg ggaggccctg
2880
ctcatcaccc cagtgctcca ggccgggaag gccgaagtga ctggctactt ccccttgggc
2940
acatggtacg acctgcagac ggtgccagta gaggcccttg gcagcctccc acccccacct
3000
gcagctcccc gtgagccagc catccacagc gaggggcagt gggtgacgct gccggccccc
3060
ctggacacca tcaacgtcca cctccgggct gggtacatca tccccctgca gggccctggc
3120
ctcacaacca cagagtcccg ccagcagccc atggccctgg ctgtggccct gaccaagggt
3180
ggggaggccc gaggggagct gttctgggac gatggagaga gcctggaagt gctggagcga
3240
ggggcctaca cacaggtcat cttcctggcc aggaataaca cgatcgtgaa tgagctggta
3300
cgtgtgacca gtgagggagc tggcctgcag ctgcagaagg tgactgtcct gggcgtggcc
3360
acggcgcccc agcaggtcct ctccaacggt gtccctgtct ccaacttcac ctacagcccc
3420
gacaccaagg tcctggacat ctgtgtctcg ctgttgatgg gagagcagtt tctcgtcagc
3480
tggtgttag
3489
<210> 12
<211> 2859
<212> ДНК
<213> Homo sapiens
<400> 12
atgggagtga ggcacccgcc ctgctcccac cggctcctgg ccgtctgcgc cctcgtgtcc
60
ttggcaaccg ctgcactcct ggggcacatc ctactccatg atttcctgct ggttccccga
120
gagctgagtg gctcctcccc agtcctggag gagactcacc cagctcacca gcagggagcc
180
agcagaccag ggccccggga tgcccaggca caccccggcc gtcccagagc agtgcccaca
240
cagtgcgacg tcccccccaa cagccgcttc gattgcgccc ctgacaaggc catcacccag
300
gaacagtgcg aggcccgcgg ctgttgctac atccctgcaa agcaggggct gcagggagcc
360
cagatggggc agccctggtg cttcttccca cccagctacc ccagctacaa gctggagaac
420
ctgagctcct ctgaaatggg ctacacggcc accctgaccc gtaccacccc caccttcttc
480
cccaaggaca tcctgaccct gcggctggac gtgatgatgg agactgagaa ccgcctccac
540
ttcacgatca aagatccagc taacaggcgc tacgaggtgc ccttggagac cccgcatgtc
600
cacagccggg caccgtcccc actctacagc gtggagttct ccgaggagcc cttcggggtg
660
atcgtgcgcc ggcagctgga cggccgcgtg ctgctgaaca cgacggtggc gcccctgttc
720
tttgcggacc agttccttca gctgtccacc tcgctgccct cgcagtatat cacaggcctc
780
gccgagcacc tcagtcccct gatgctcagc accagctgga ccaggatcac cctgtggaac
840
cgggaccttg cgcccacgcc cggtgcgaac ctctacgggt ctcacccttt ctacctggcg
900
ctggaggacg gcgggtcggc acacggggtg ttcctgctaa acagcaatgc catggatgtg
960
gtcctgcagc cgagccctgc ccttagctgg aggtcgacag gtgggatcct ggatgtctac
1020
atcttcctgg gcccagagcc caagagcgtg gtgcagcagt acctggacgt tgtgggatac
1080
ccgttcatgc cgccatactg gggcctgggc ttccacctgt gccgctgggg ctactcctcc
1140
accgctatca cccgccaggt ggtggagaac atgaccaggg cccacttccc cctggacgtc
1200
cagtggaacg acctggacta catggactcc cggagggact tcacgttcaa caaggatggc
1260
ttccgggact tcccggccat ggtgcaggag ctgcaccagg gcggccggcg ctacatgatg
1320
atcgtggatc ctgccatcag cagctcgggc cctgccggga gctacaggcc ctacgacgag
1380
ggtctgcgga ggggggtttt catcaccaac gagaccggcc agccgctgat tgggaaggta
1440
tggcccgggt ccactgcctt ccccgacttc accaacccca cagccctggc ctggtgggag
1500
gacatggtgg ctgagttcca tgaccaggtg cccttcgacg gcatgtggat tgacatgaac
1560
gagccttcca acttcatcag gggctctgag gacggctgcc ccaacaatga gctggagaac
1620
ccaccctacg tgcctggggt ggttgggggg accctccagg cggccaccat ctgtgcctcc
1680
agccaccagt ttctctccac acactacaac ctgcacaacc tctacggcct gaccgaagcc
1740
atcgcctccc acagggcgct ggtgaaggct cgggggacac gcccatttgt gatctcccgc
1800
tcgacctttg ctggccacgg ccgatacgcc ggccactgga cgggggacgt gtggagctcc
1860
tgggagcagc tcgcctcctc cgtgccagaa atcctgcagt ttaacctgct gggggtgcct
1920
ctggtcgggg ccgacgtctg cggcttcctg ggcaacacct cagaggagct gtgtgtgcgc
1980
tggacccagc tgggggcctt ctaccccttc atgcggaacc acaacagcct gctcagtctg
2040
ccccaggagc cgtacagctt cagcgagccg gcccagcagg ccatgaggaa ggccctcacc
2100
ctgcgctacg cactcctccc ccacctctac acactgttcc accaggccca cgtcgcgggg
2160
gagaccgtgg cccggcccct cttcctggag ttccccaagg actctagcac ctggactgtg
2220
gaccaccagc tcctgtgggg ggaggccctg ctcatcaccc cagtgctcca ggccgggaag
2280
gccgaagtga ctggctactt ccccttgggc acatggtacg acctgcagac ggtgccagta
2340
gaggcccttg gcagcctccc acccccacct gcagctcccc gtgagccagc catccacagc
2400
gaggggcagt gggtgacgct gccggccccc ctggacacca tcaacgtcca cctccgggct
2460
gggtacatca tccccctgca gggccctggc ctcacaacca cagagtcccg ccagcagccc
2520
atggccctgg ctgtggccct gaccaagggt ggggaggccc gaggggagct gttctgggac
2580
gatggagaga gcctggaagt gctggagcga ggggcctaca cacaggtcat cttcctggcc
2640
aggaataaca cgatcgtgaa tgagctggta cgtgtgacca gtgagggagc tggcctgcag
2700
ctgcagaagg tgactgtcct gggcgtggcc acggcgcccc agcaggtcct ctccaacggt
2760
gtccctgtct ccaacttcac ctacagcccc gacaccaagg tcctggacat ctgtgtctcg
2820
ctgttgatgg gagagcagtt tctcgtcagc tggtgttag
2859
<210> 13
<211> 398
<212> БЕЛОК
<213> Homo sapiens
<400> 13
Leu Asp Asn Gly Leu Ala Arg Thr Pro Thr Met Gly Trp Leu His Trp
1 5 10 15
Glu Arg Phe Met Cys Asn Leu Asp Cys Gln Glu Glu Pro Asp Ser Cys
20 25 30
Ile Ser Glu Lys Leu Phe Met Glu Met Ala Glu Leu Met Val Ser Glu
35 40 45
Gly Trp Lys Asp Ala Gly Tyr Glu Tyr Leu Cys Ile Asp Asp Cys Trp
50 55 60
Met Ala Pro Gln Arg Asp Ser Glu Gly Arg Leu Gln Ala Asp Pro Gln
65 70 75 80
Arg Phe Pro His Gly Ile Arg Gln Leu Ala Asn Tyr Val His Ser Lys
85 90 95
Gly Leu Lys Leu Gly Ile Tyr Ala Asp Val Gly Asn Lys Thr Cys Ala
100 105 110
Gly Phe Pro Gly Ser Phe Gly Tyr Tyr Asp Ile Asp Ala Gln Thr Phe
115 120 125
Ala Asp Trp Gly Val Asp Leu Leu Lys Phe Asp Gly Cys Tyr Cys Asp
130 135 140
Ser Leu Glu Asn Leu Ala Asp Gly Tyr Lys His Met Ser Leu Ala Leu
145 150 155 160
Asn Arg Thr Gly Arg Ser Ile Val Tyr Ser Cys Glu Trp Pro Leu Tyr
165 170 175
Met Trp Pro Phe Gln Lys Pro Asn Tyr Thr Glu Ile Arg Gln Tyr Cys
180 185 190
Asn His Trp Arg Asn Phe Ala Asp Ile Asp Asp Ser Trp Lys Ser Ile
195 200 205
Lys Ser Ile Leu Asp Trp Thr Ser Phe Asn Gln Glu Arg Ile Val Asp
210 215 220
Val Ala Gly Pro Gly Gly Trp Asn Asp Pro Asp Met Leu Val Ile Gly
225 230 235 240
Asn Phe Gly Leu Ser Trp Asn Gln Gln Val Thr Gln Met Ala Leu Trp
245 250 255
Ala Ile Met Ala Ala Pro Leu Phe Met Ser Asn Asp Leu Arg His Ile
260 265 270
Ser Pro Gln Ala Lys Ala Leu Leu Gln Asp Lys Asp Val Ile Ala Ile
275 280 285
Asn Gln Asp Pro Leu Gly Lys Gln Gly Tyr Gln Leu Arg Gln Gly Asp
290 295 300
Asn Phe Glu Val Trp Glu Arg Pro Leu Ser Gly Leu Ala Trp Ala Val
305 310 315 320
Ala Met Ile Asn Arg Gln Glu Ile Gly Gly Pro Arg Ser Tyr Thr Ile
325 330 335
Ala Val Ala Ser Leu Gly Lys Gly Val Ala Cys Asn Pro Ala Cys Phe
340 345 350
Ile Thr Gln Leu Leu Pro Val Lys Arg Lys Leu Gly Phe Tyr Glu Trp
355 360 365
Thr Ser Arg Leu Arg Ser His Ile Asn Pro Thr Gly Thr Val Leu Leu
370 375 380
Gln Leu Glu Asn Thr Met Gln Met Ser Leu Lys Asp Leu Leu
385 390 395
<---
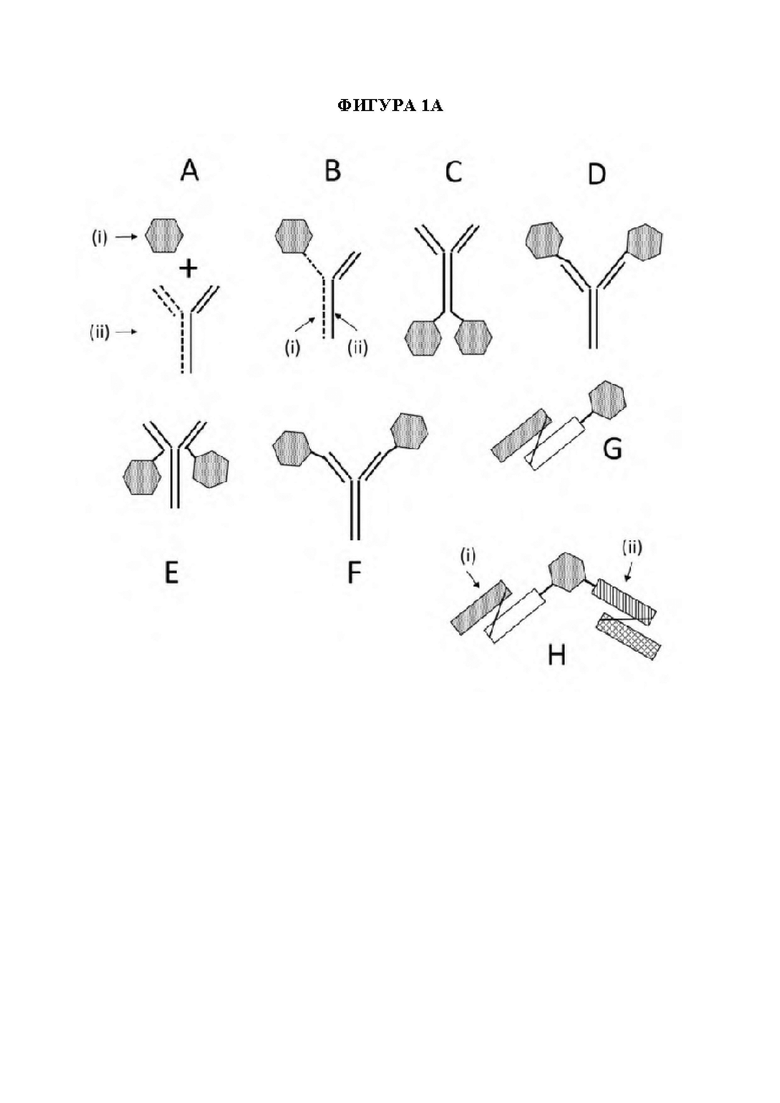

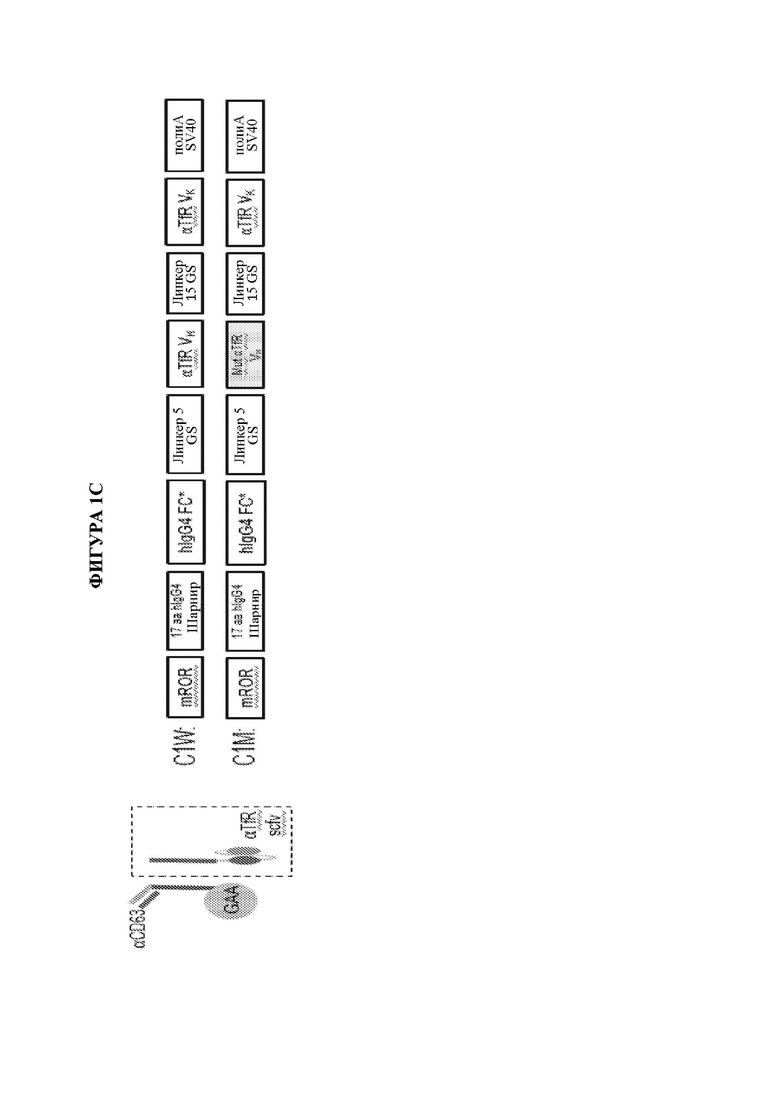
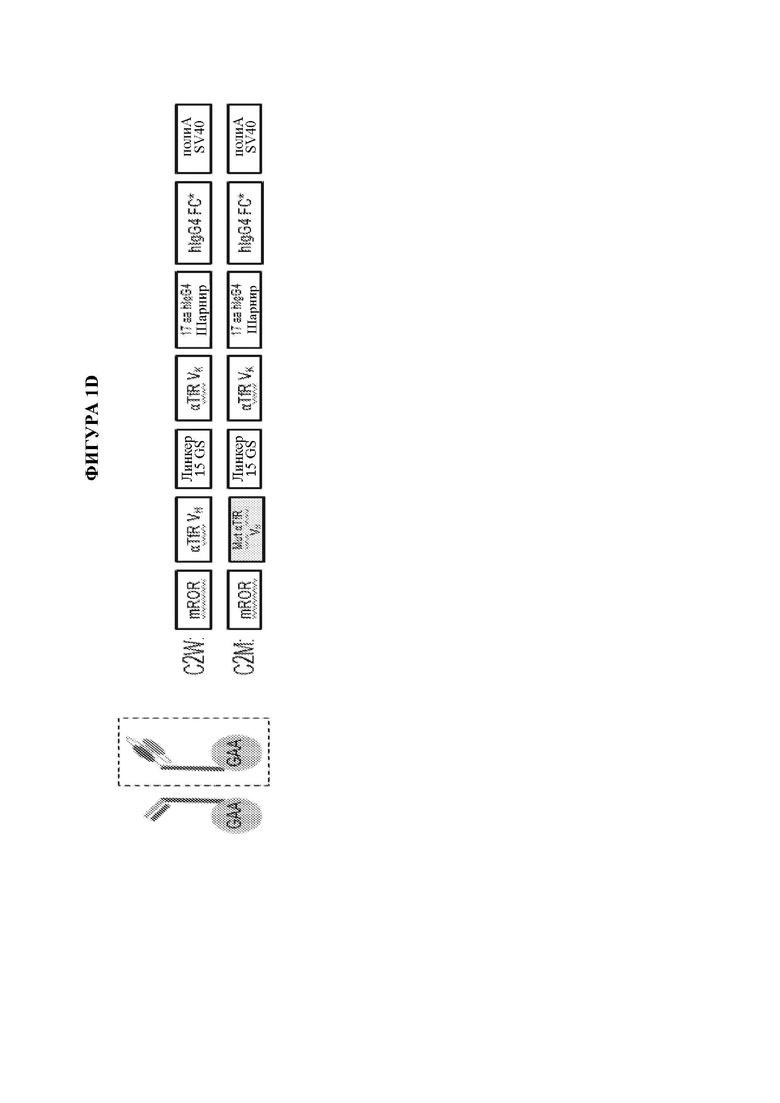
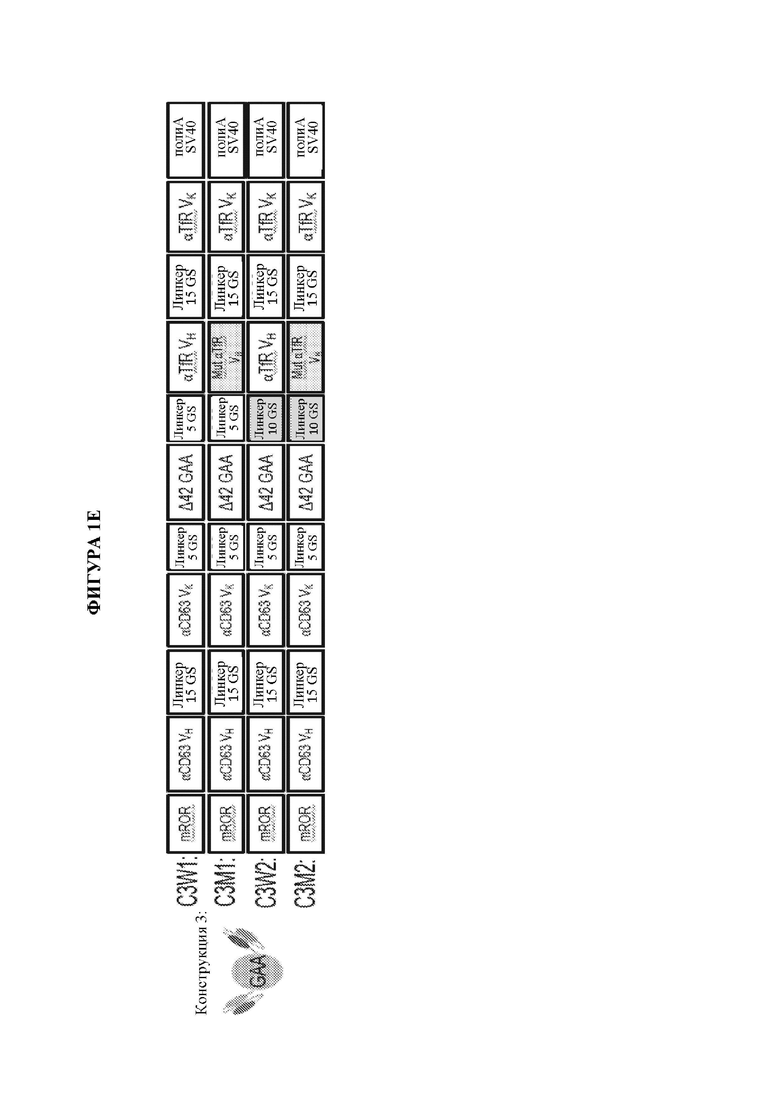
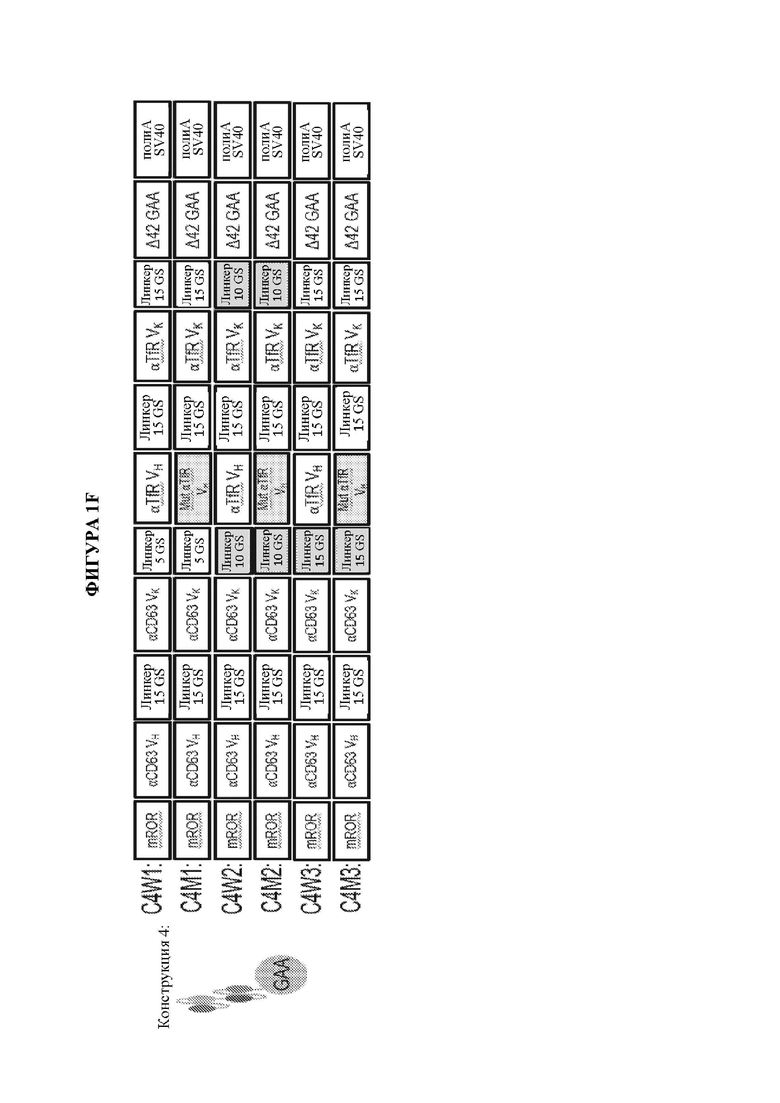
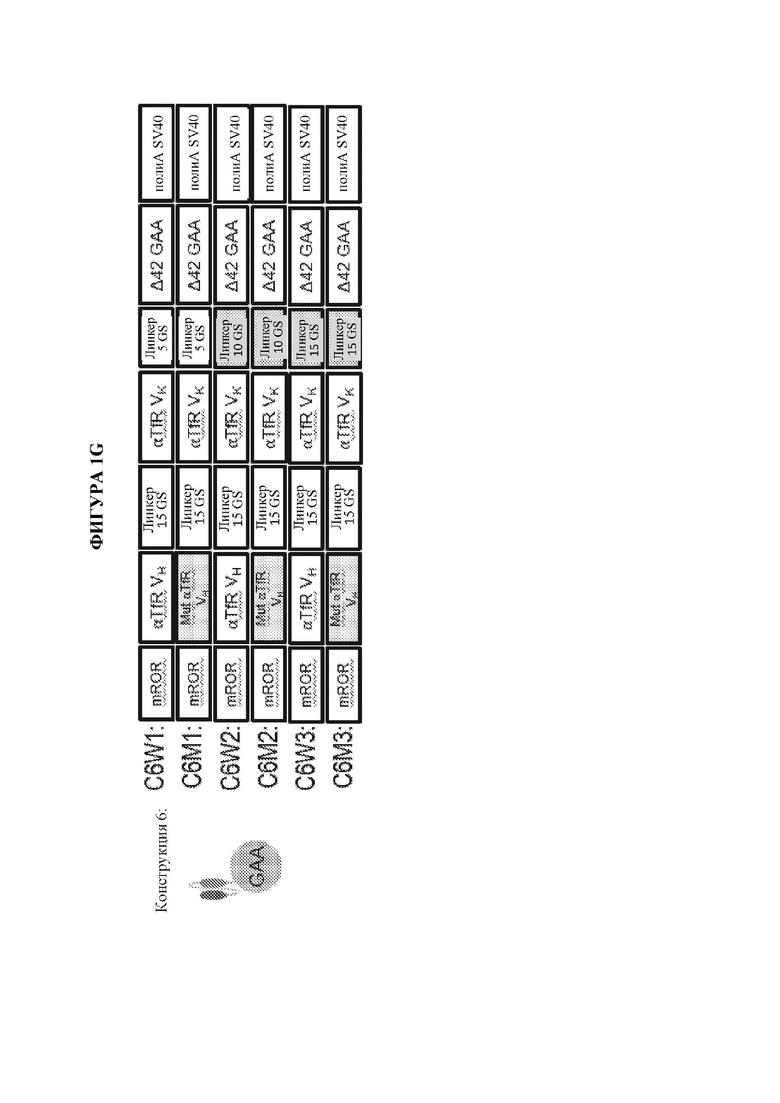
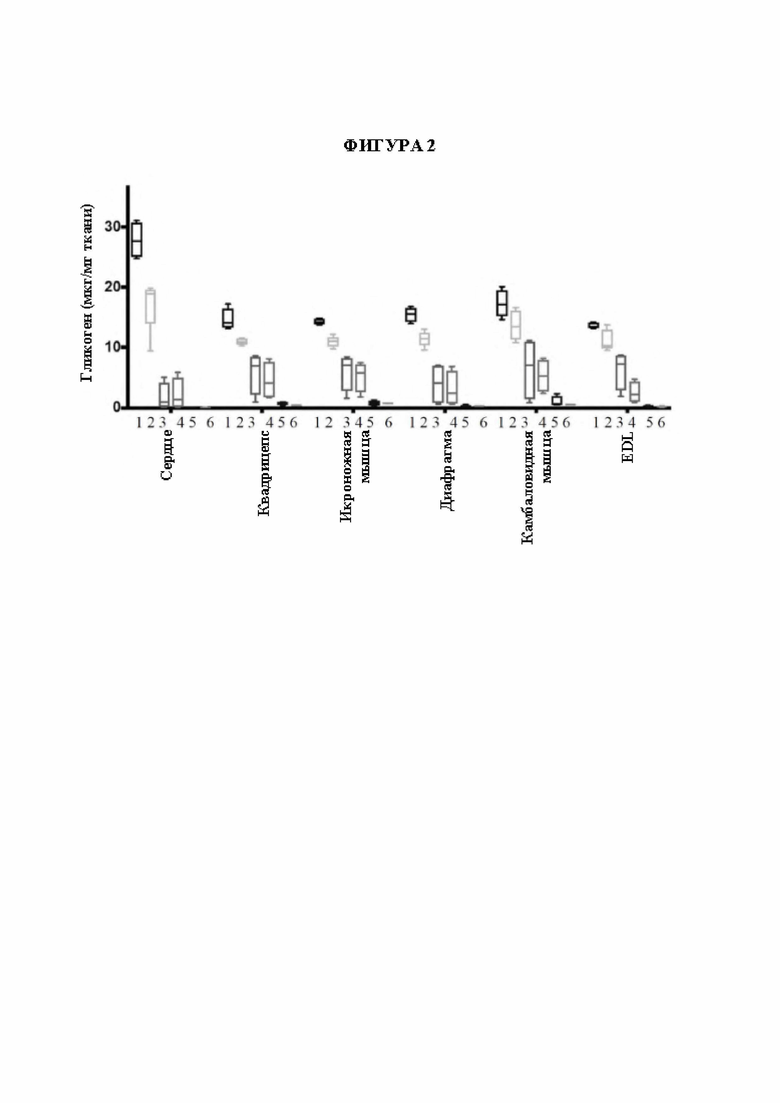
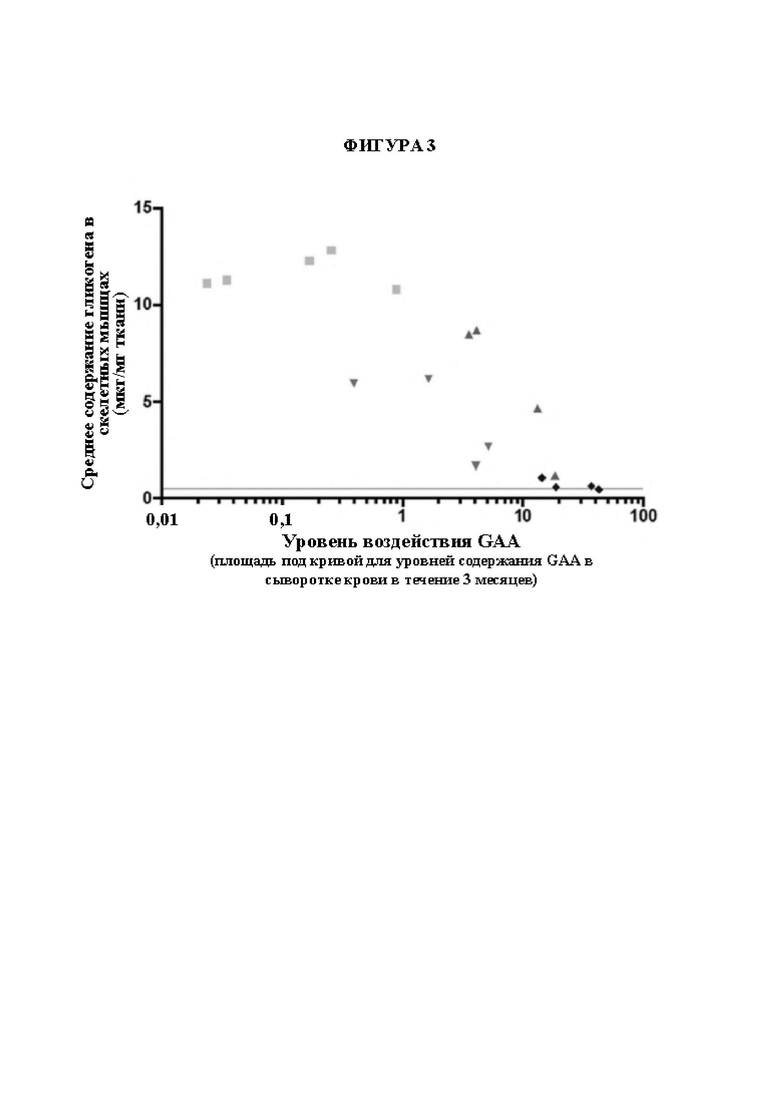
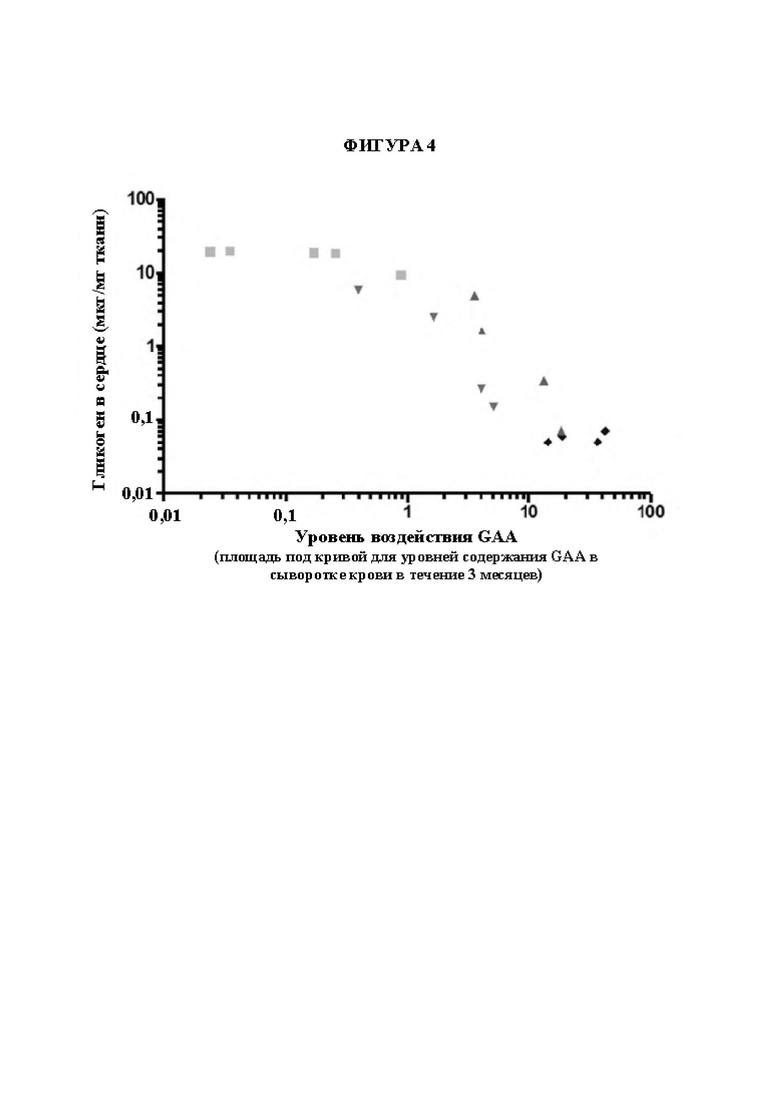
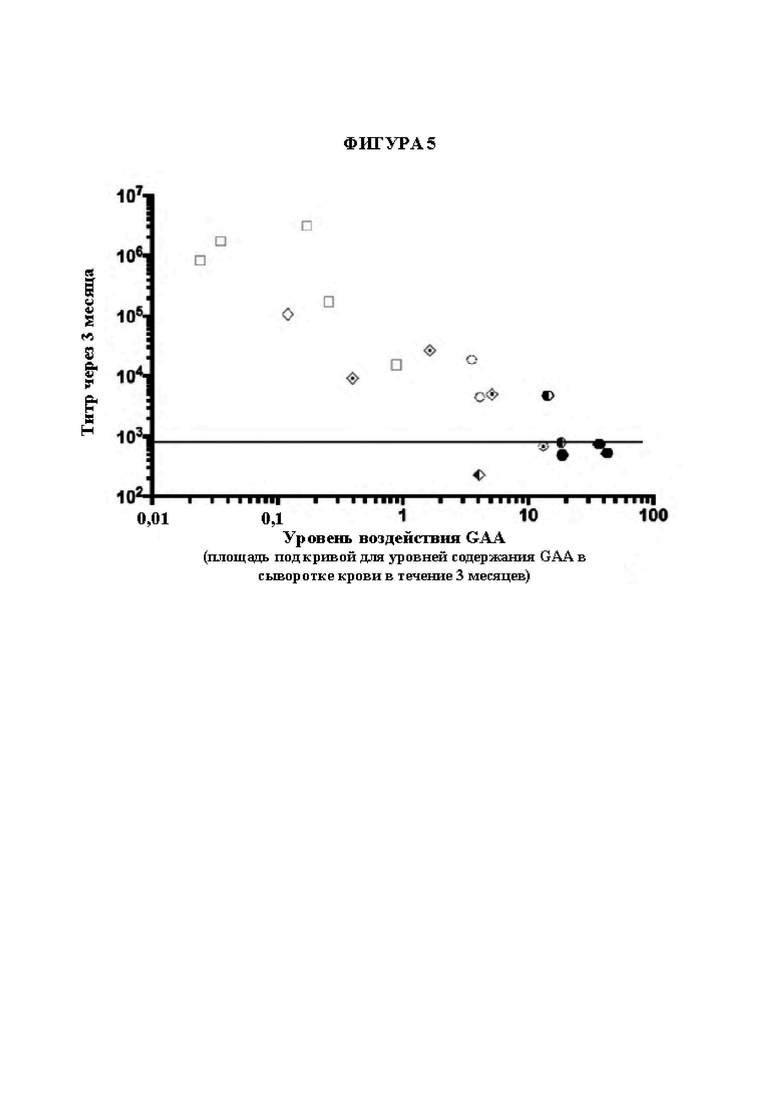
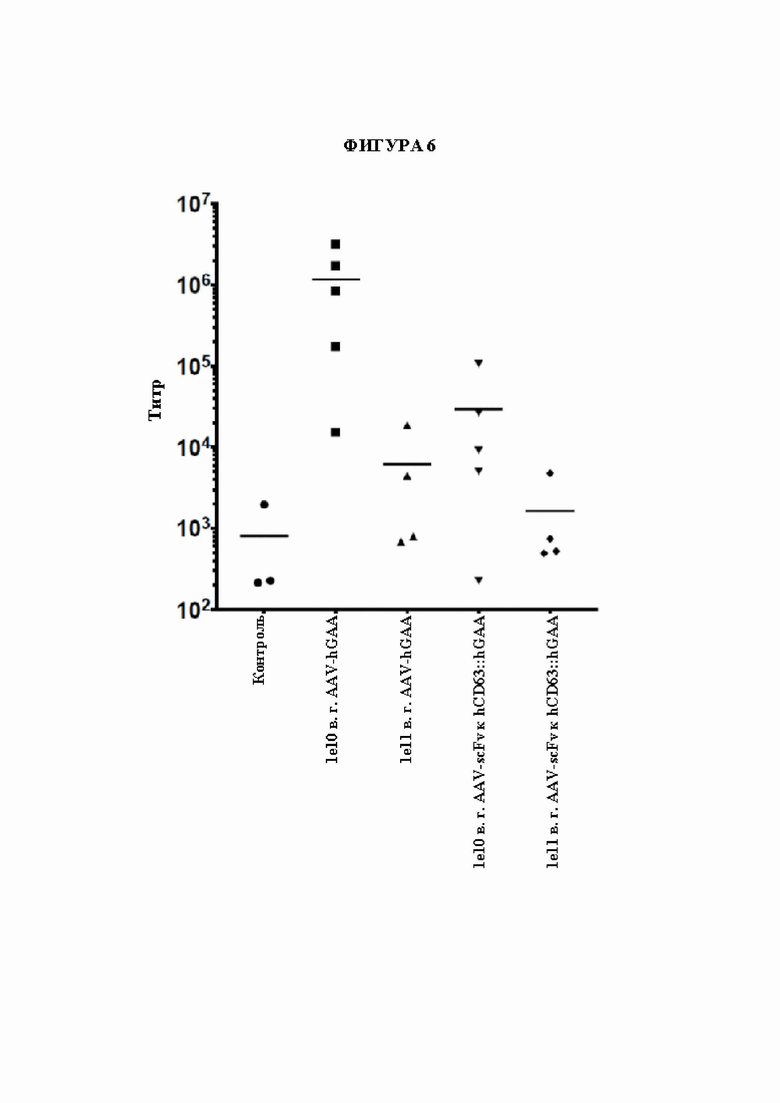
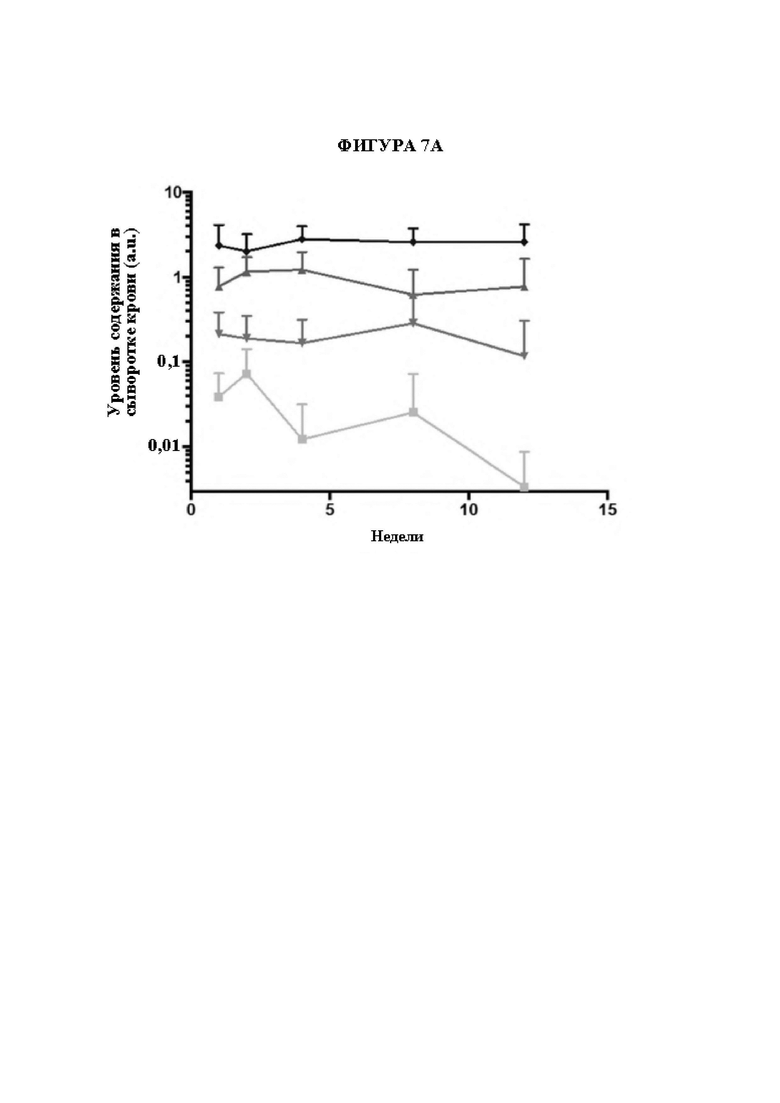
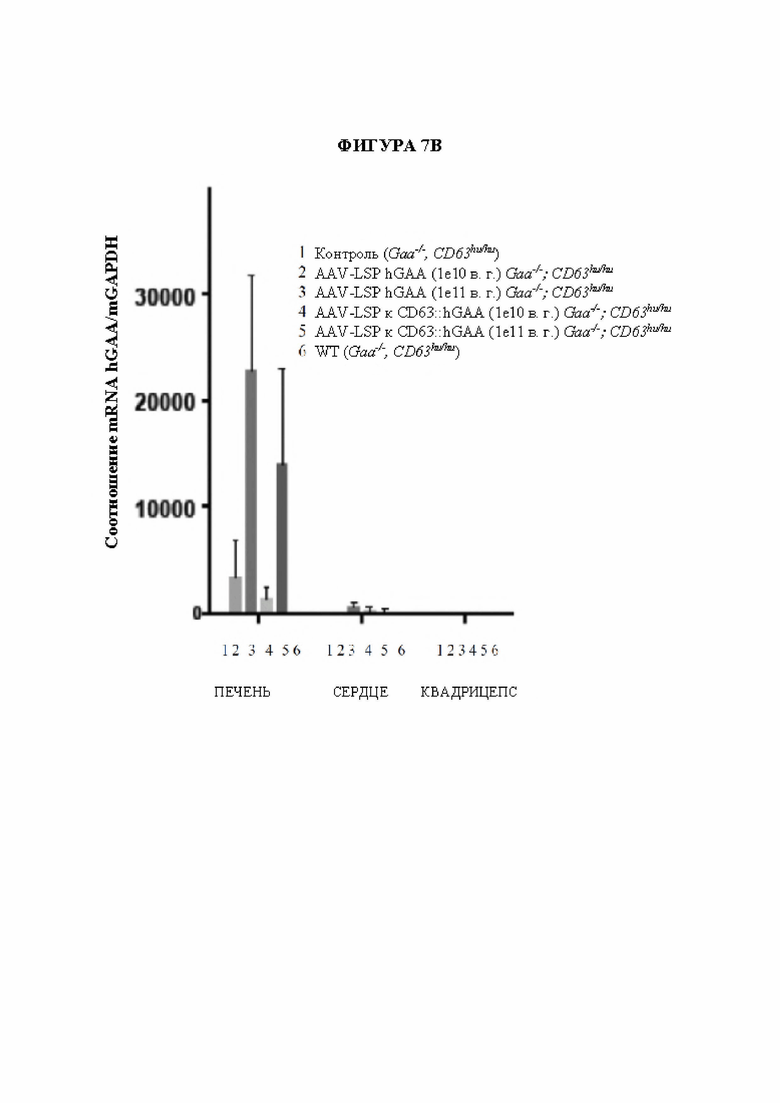
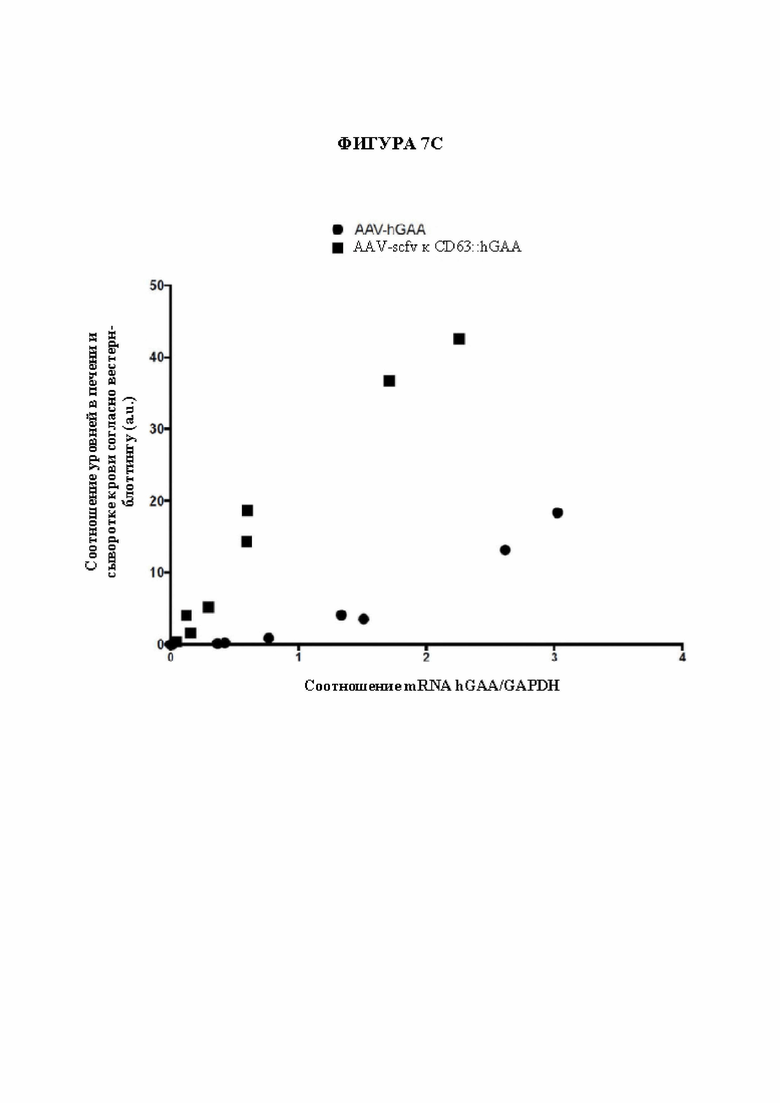
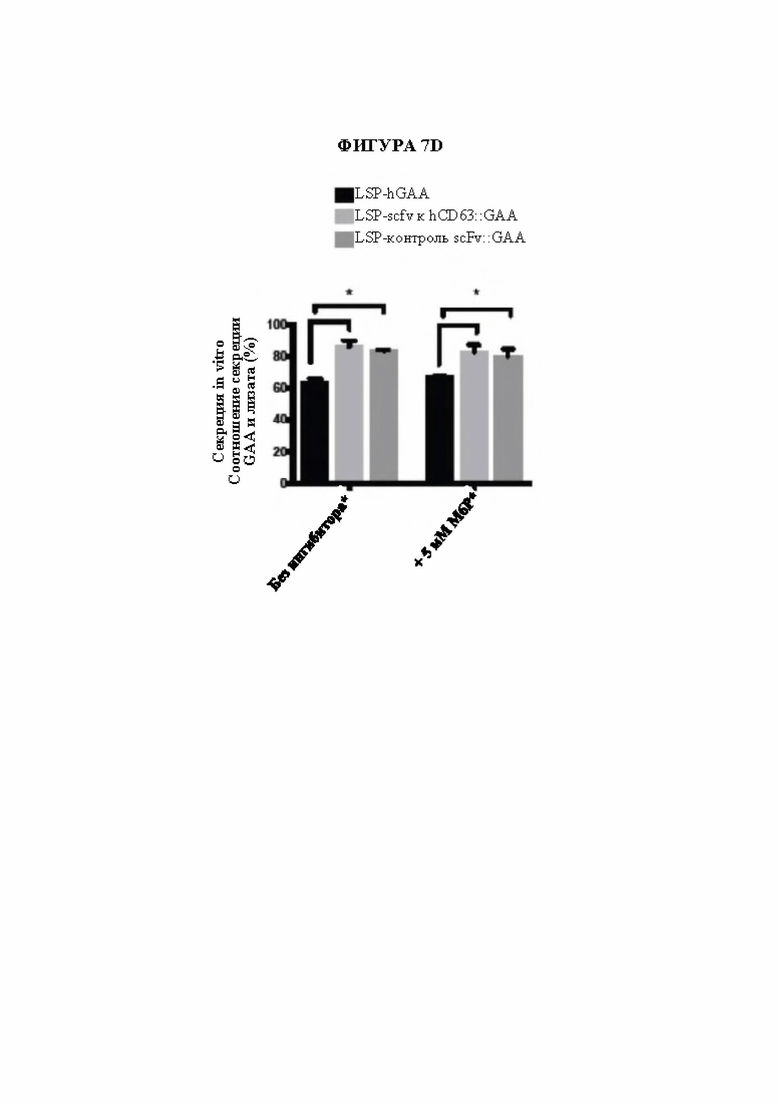
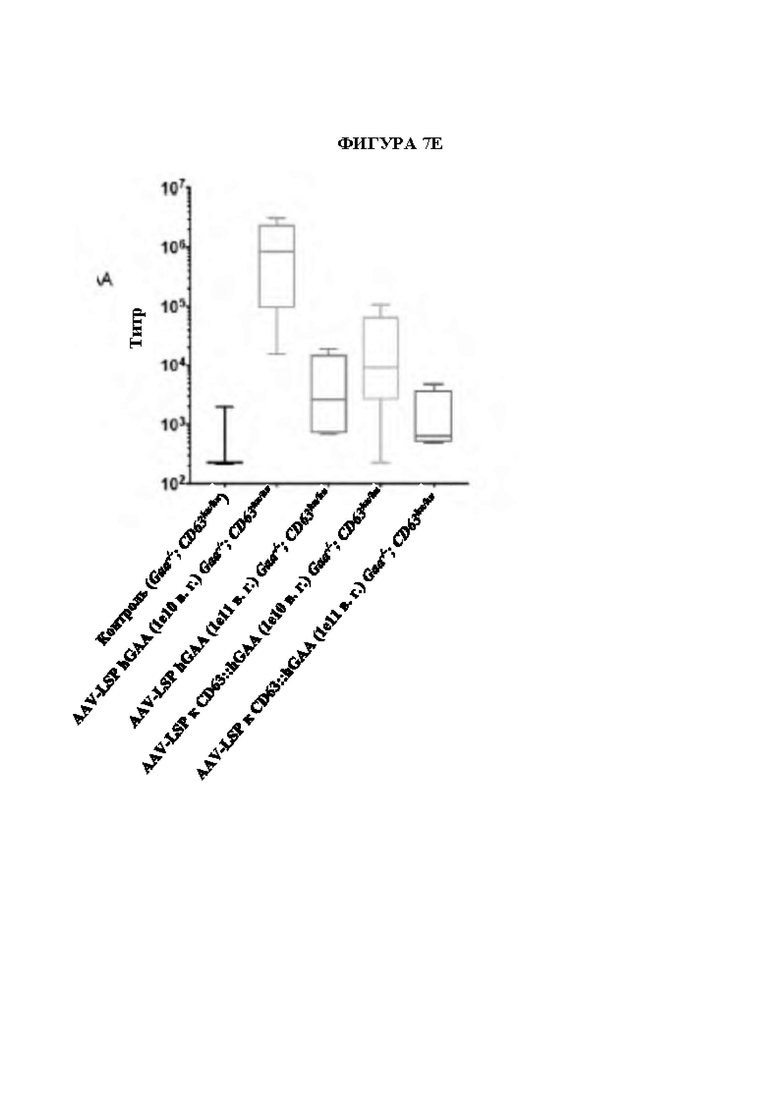
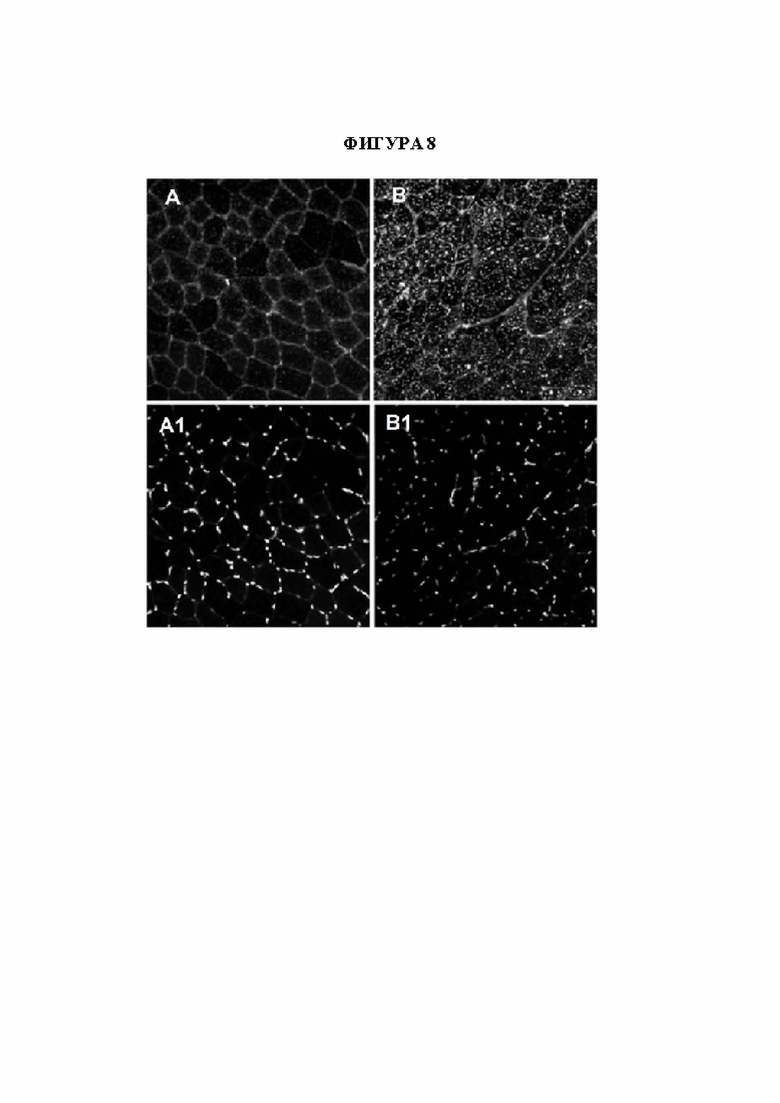
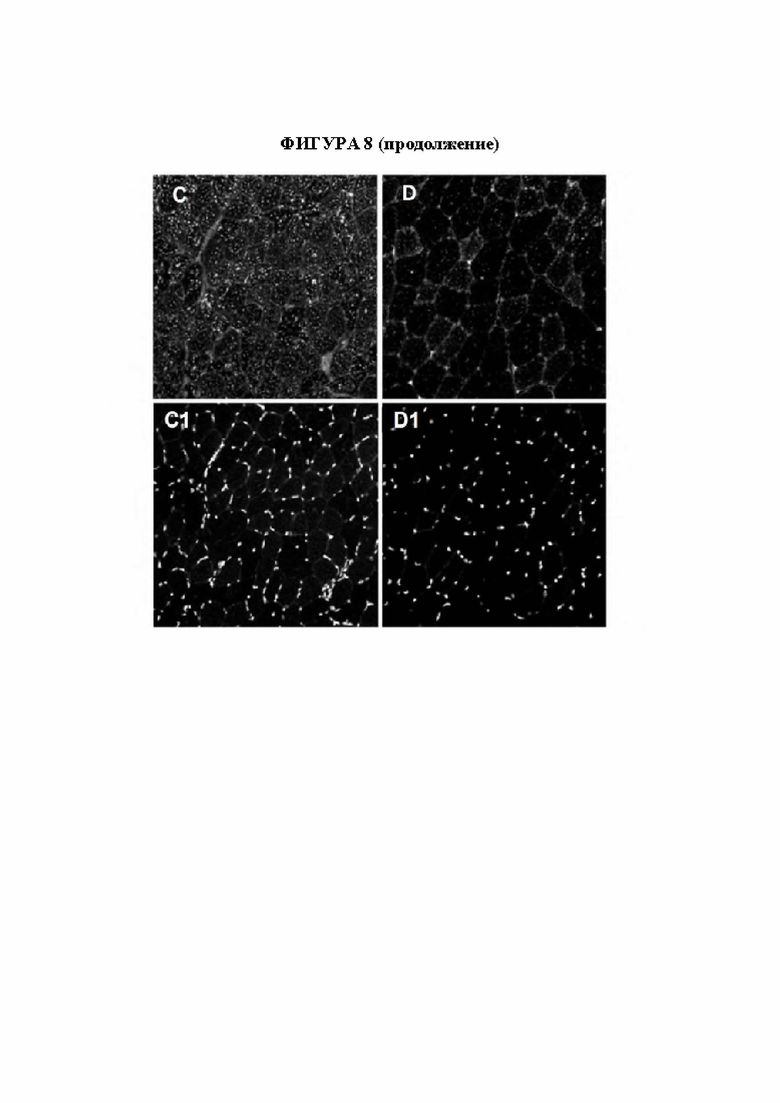
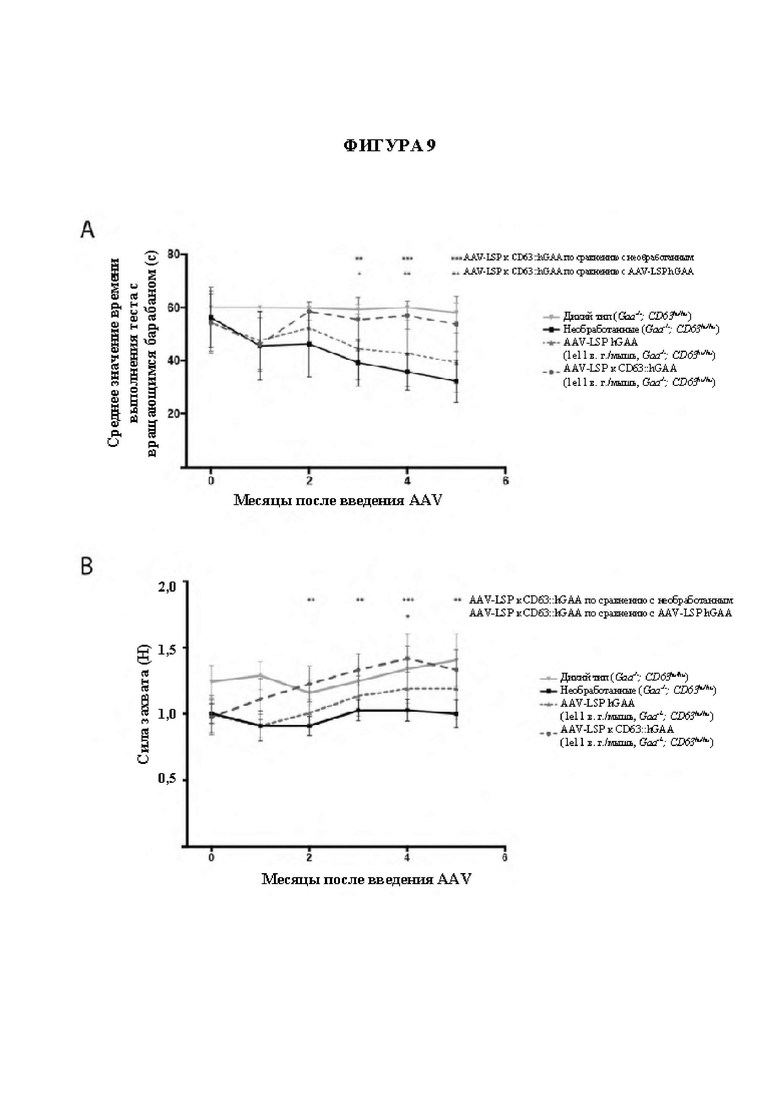
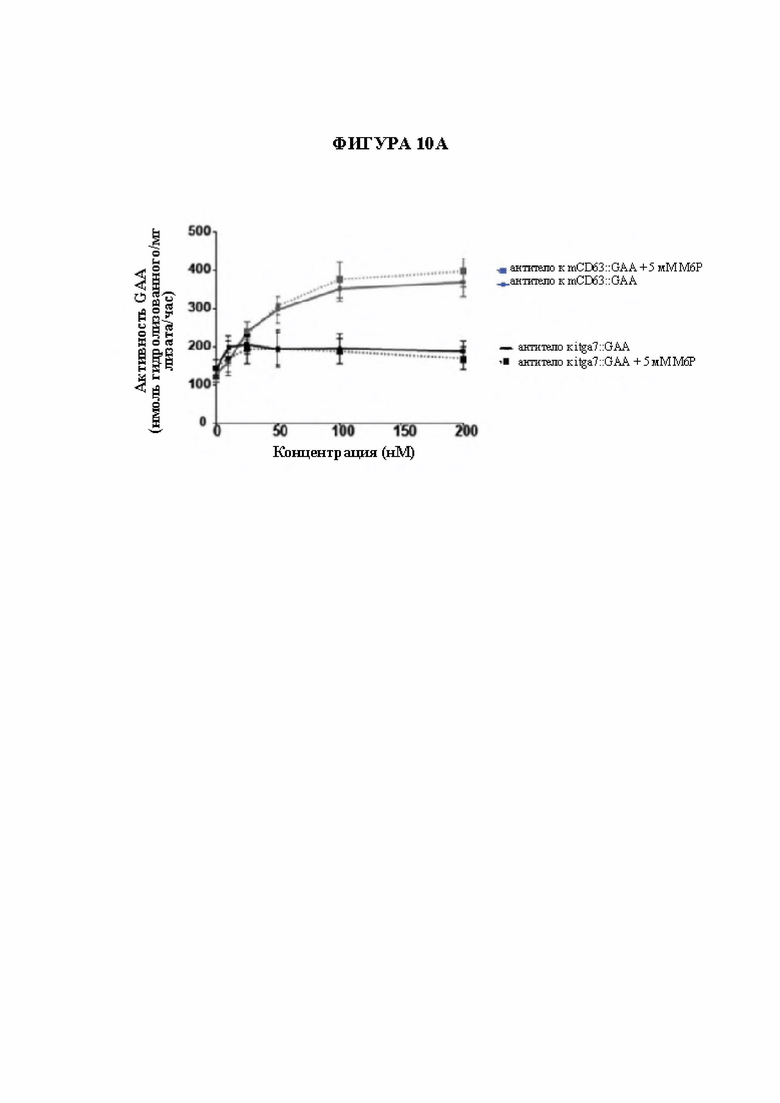
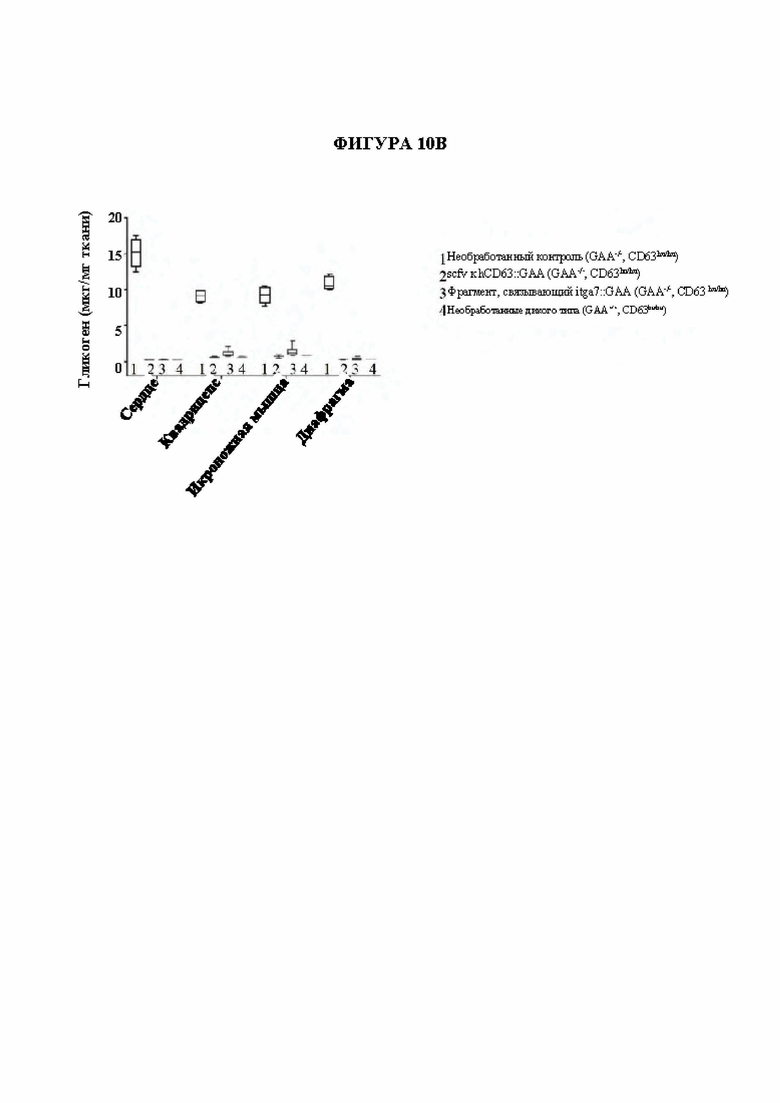
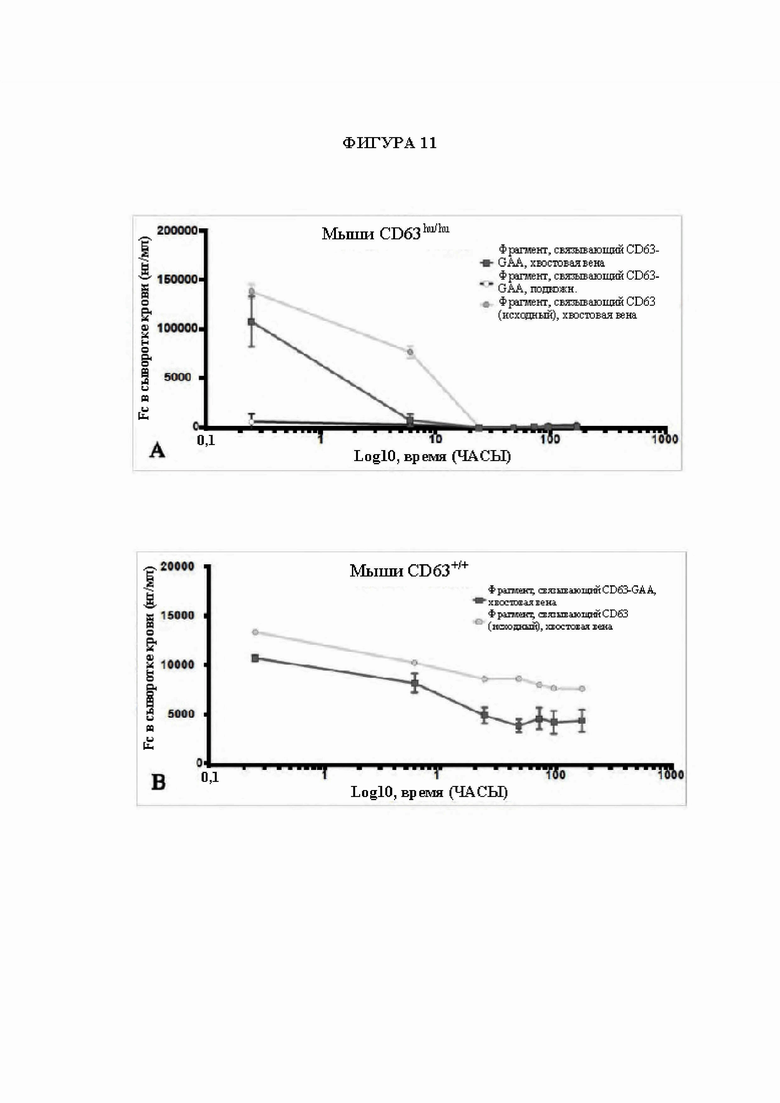
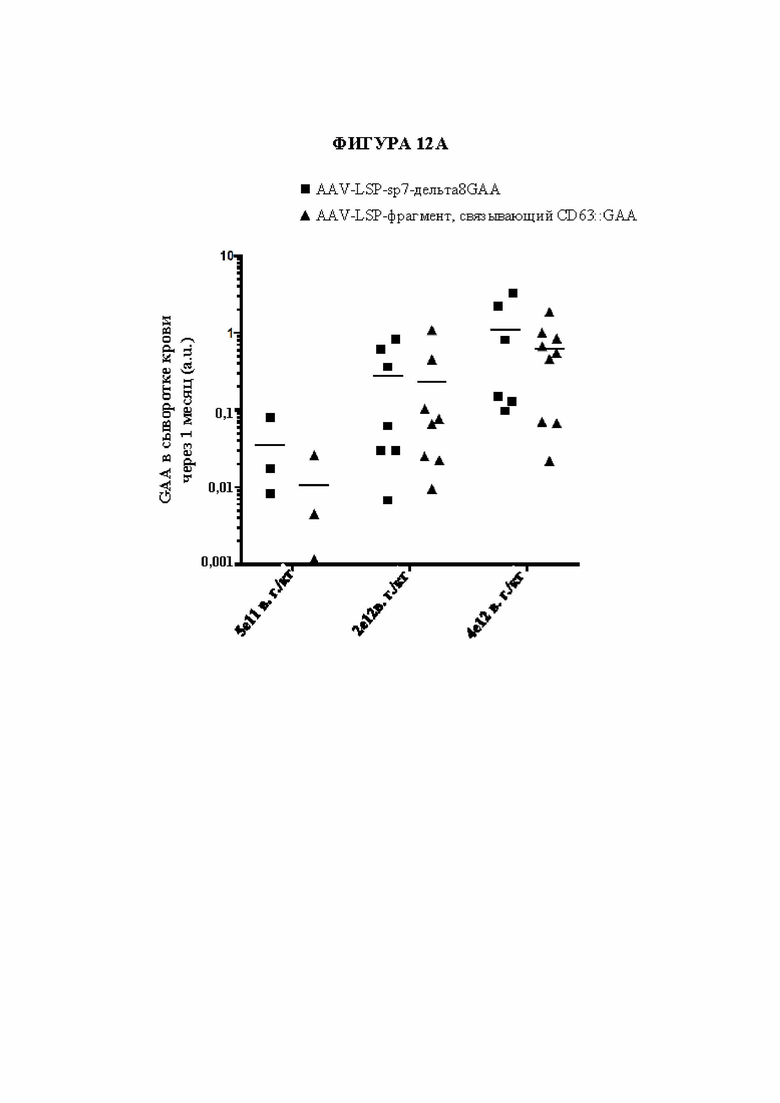
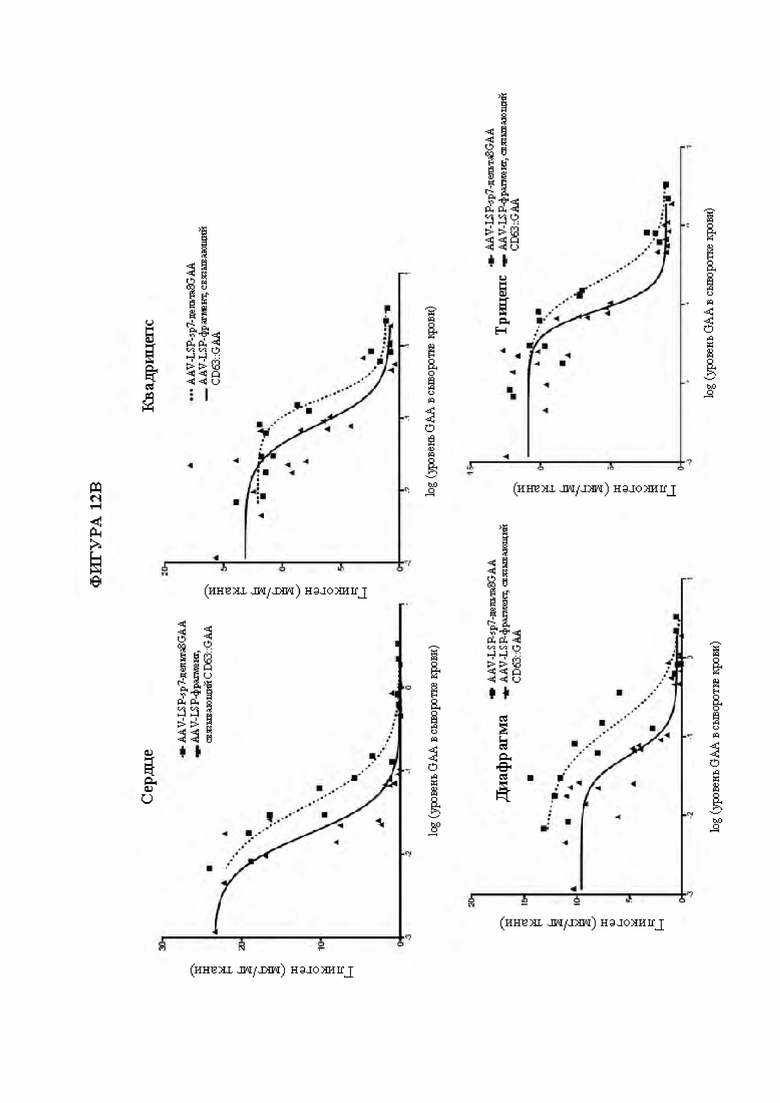
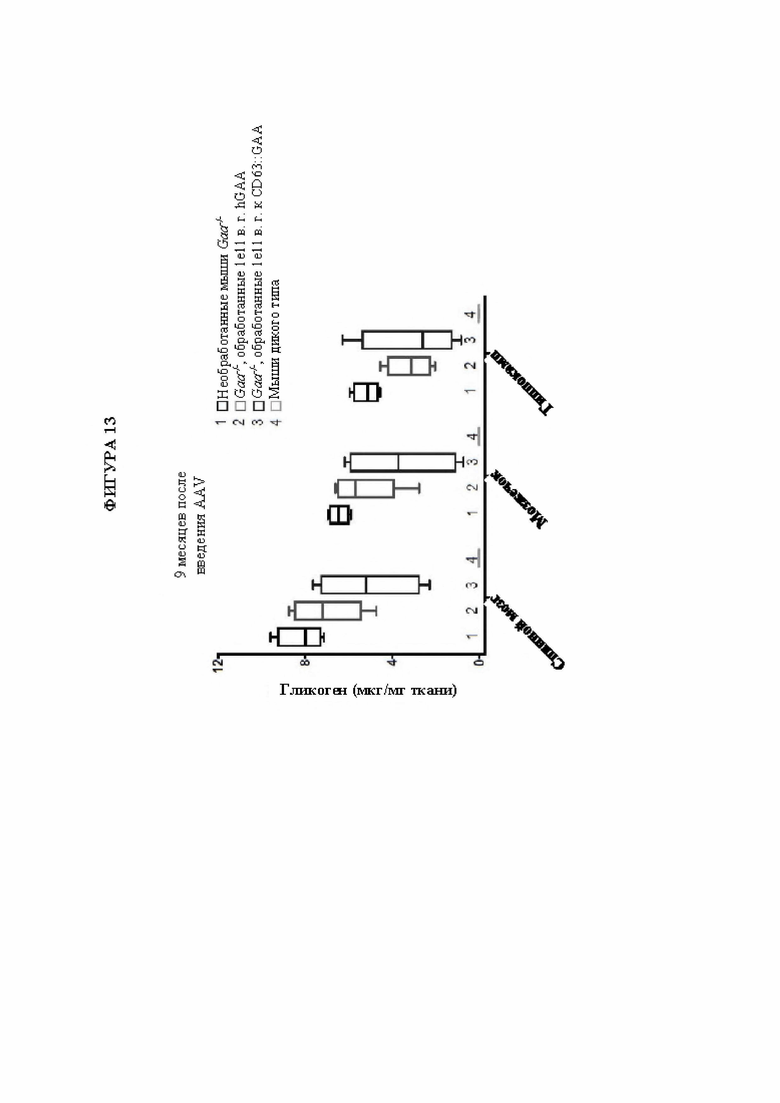
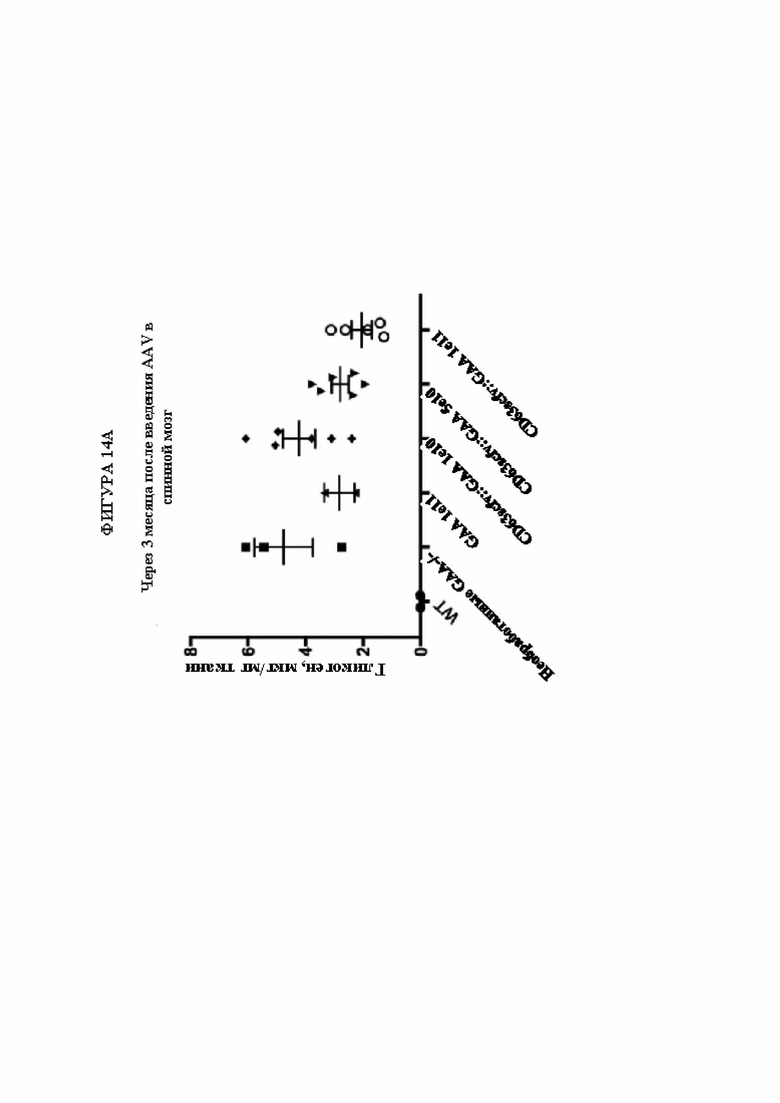
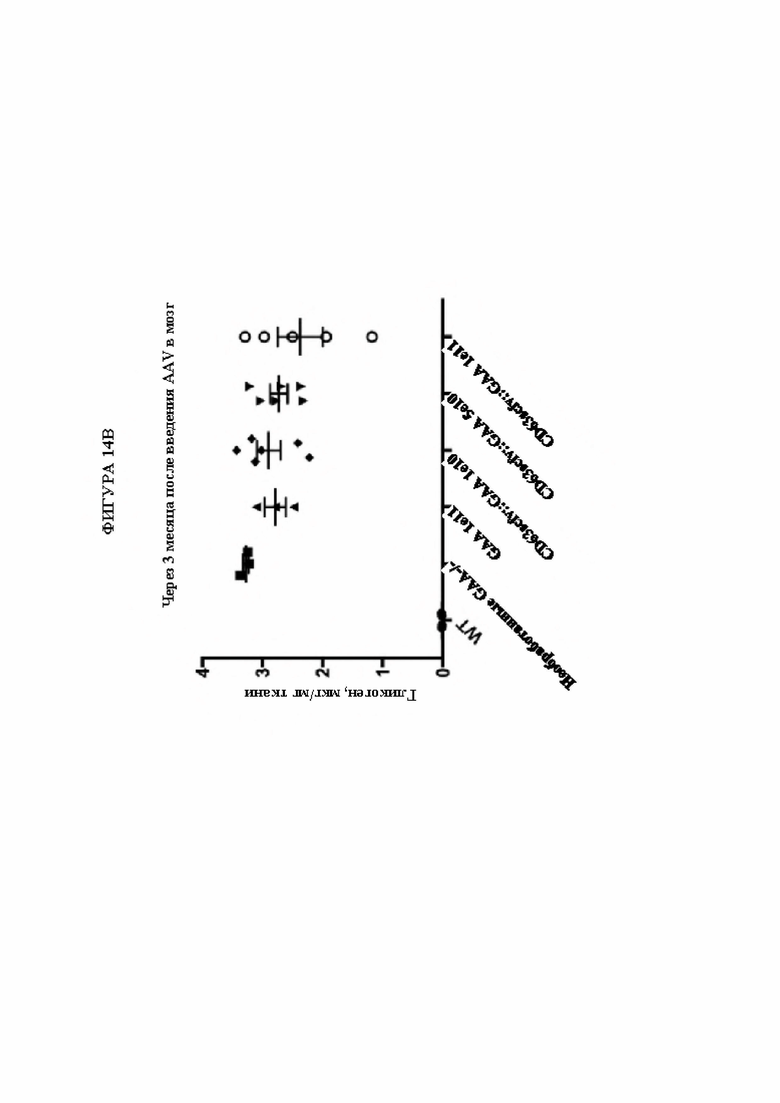
Изобретение относится к биохимии и медицине, в частности к композициям и способам для доставки терапевтического белка в центральную нервную систему (ЦНС) для лечения заболеваний и нарушений, при которых нарушается функция ЦНС, как, например, лечения лизосомных болезней накопления. Предусмотрены терапевтические белки, которые доставляются посредством терапевтически эффективного количества композиции, содержащей нуклеотид, кодирующий терапевтический белок, конъюгированный с белком, связывающим рецептор клеточной поверхности, который проникает через гематоэнцефалический барьер (BBB). 5 н. и 47 з.п. ф-лы, 27 ил., 9 табл., 10 пр.
1. Способ доставки мультидоменного терапевтического белка в центральную нервную систему (ЦНС) субъекта, предусматривающий введение субъекту композиции, содержащей полинуклеотид, который кодирует мультидоменный терапевтический белок, посредством способа доставки, нацеленного на печень, достаточного для обеспечения терапевтически эффективного количества мультидоменного терапевтического белка в ЦНС, где мультидоменный терапевтический белок содержит (i) антитело или его антигенсвязывающий фрагмент, которые связываются с CD63, и (ii) ферментный домен, где ферментный домен содержит лизосомный фермент.
2. Способ по п. 1, где полинуклеотид вводят посредством вирусного вектора.
3. Способ по п. 2, где вирусный вектор представляет собой вектор на основе AAV, где необязательно композицию, содержащую полинуклеотид, вводят в дозе, составляющей по меньшей мере 2×1012 вирусных геномов на килограмм (в. г./кг).
4. Способ по любому из пп. 1-3, где антитело или его антигенсвязывающий фрагмент содержит одноцепочечный вариабельный фрагмент (scFv).
5. Способ по любому из пп. 1-4, где антитело или его антигенсвязывающий фрагмент содержит аминокислотную последовательность под SEQ ID NO: 2.
6. Способ по любому из пп. 1-5, где ферментный домен содержит гидролазу.
7. Способ по любому из пп. 1-6, где ферментный домен содержит гликозилазу.
8. Способ по любому из пп. 1-7, где ферментный домен содержит гликозидазу.
9. Способ по любому из пп. 1-8, где ферментный домен содержит альфа-глюкозидазу (GAA).
10. Способ по любому из пп. 1-9, где ферментный домен содержит аминокислотную последовательность под SEQ ID NO: 1 или SEQ ID NO: 13 или ее фрагмент.
11. Способ по любому из пп. 1-10, где полинуклеотид содержит последовательность нуклеиновой кислоты под SEQ ID NO: 11.
12. Способ по любому из пп. 1-11, где ферментный домен содержит GAA и где уровни гликогена в любой ткани ЦНС у субъекта снижены в течение по меньшей мере девяти месяцев после лечения.
13. Способ по любому из пп. 1-12, где у субъекта имеется болезнь Помпе.
14. Способ по любому из пп. 1-13, где вводимая композиция обеспечивает уровень мультидоменного терапевтического белка в сыворотке крови, составляющий по меньшей мере 1 мкг/мл.
15. Мультидоменный терапевтический белок для доставки терапевтического белка в центральную нервную систему, содержащий первый домен доставки, второй домен доставки и ферментный домен,
где первый домен доставки связывает рецептор трансферрина человека (hTfR),
второй домен доставки включает антитело или его антигенсвязывающий фрагмент, который связывается с CD63, и
ферментный домен включает GAA или фермент, обладающий активностью GAA.
16. Мультидоменный терапевтический белок по п. 15, где первый домен
доставки содержит антигенсвязывающий белок.
17. Мультидоменный терапевтический белок по п. 15 или 16, где по меньшей мере один из первого и второго доменов доставки содержит одноцепочечный вариабельный фрагмент (scFv).
18. Мультидоменный терапевтический белок по любому из пп. 15-17, где по меньшей мере один из первого и второго доменов доставки содержит полуантитело.
19. Мультидоменный терапевтический белок по п. 18, где первый домен доставки представляет собой scFv, где второй домен доставки содержит полуантитело, где ферментный домен представляет собой GAA и где GAA конъюгирован с карбокси-концом полуантитела.
20. Мультидоменный терапевтический белок по п. 17, где каждый из первого и второго доменов доставки содержит scFv.
21. Мультидоменный терапевтический белок по любому из пп. 17-20, где по меньшей мере один scFv слит с Fc.
22. Мультидоменный терапевтический белок по п. 21, где Fc предусматривает изотип IgG4 человека дикого типа или его производное.
23. Мультидоменный терапевтический белок по п. 21 или 22, где GAA конъюгирован с карбокси-концом Fc.
24. Мультидоменный терапевтический белок по п. 20, содержащий scFv к hTfR и scFv к hCD63.
25. Мультидоменный терапевтический белок по п. 24, где оба из scFv к hTfR и scFv к hCD63 связаны по своим карбокси-концам с одним ферментом GAA.
26. Мультидоменный терапевтический белок по любому из пп. 15-17, где первый домен доставки представляет собой scFv к hTfR и ферментный домен связан с карбокси-концом VL-домена scFv.
27. Мультидоменный терапевтический белок по п. 26, где второй домен доставки связан с N-концом VH-домена scFv к hTfR.
28. Мультидоменный терапевтический белок по п. 27, где второй домен доставки представляет собой scFv к hCD63.
29. Мультидоменный терапевтический белок по пп. 15-28, где ферментный домен содержит аминокислотную последовательность, представленную под SEQ ID NO: 1.
30. Мультидоменный терапевтический белок по любому из пп. 15-29, где каждый из первого и второго доменов доставки независимо выбран из группы, состоящей из антитела, полуантитела и scFv, и где по меньшей мере один из первого и второго доменов доставки ассоциированы с ферментным доменом.
31. Мультидоменный терапевтический белок по любому из пп.15-30, содержащий не более двух доменов доставки.
32. Мультидоменный терапевтический белок по п. 30 или 31, где только один из первого и второго доменов доставки ассоциирован с ферментным доменом.
33. Мультидоменный терапевтический белок по п. 30 или 31, где каждый из первого и второго доменов доставки ковалентно связан с ферментным доменом.
34. Мультидоменный терапевтический белок по п. 33, где каждый из первого и второго доменов доставки ковалентно связан с одним и тем же ферментным доменом.
35. Мультидоменный терапевтический белок по п. 33, где каждый из первого и второго доменов доставки ковалентно связан с отличным ферментным доменом.
36. Мультидоменный терапевтический белок по любому из пп. 30-35, где мультидоменный терапевтический белок содержит не более двух доменов доставки, где первый домен доставки содержит полуантитело и где второй домен доставки содержит scFv.
37. Мультидоменный терапевтический белок по п. 36, где scFv слит с Fc.
38. Мультидоменный терапевтический белок по п. 36 или 37, где полуантитело ковалентно связано по своему карбокси-концу с первым ферментным доменом и/или где scFv ковалентно связан по своему карбокси-концу с Fc и необязательно вторым ферментным доменом.
39. Мультидоменный терапевтический белок по любому из пп. 30-35, где мультидоменный терапевтический белок содержит не более двух доменов доставки, где каждый из первого и второго доменов доставки содержит scFv.
40. Мультидоменный терапевтический белок по п. 39, где как первый, так и второй scFv ковалентно связаны с ферментным доменом.
41. Мультидоменный терапевтический белок по п. 39, содержащий от N-конца к C-концу: первый scFv, второй scFv и ферментный домен.
42. Полинуклеотид, содержащий последовательность, кодирующую мультидоменный терапевтический белок по любому из пп. 15-41, для доставки терапевтического белка в центральную нервную систему.
43. Полинуклеотид по п. 42, содержащий последовательность вирусной нуклеиновой кислоты и последовательность нуклеиновой кислоты, нацеливающуюся на локус.
44. Полинуклеотид по п. 43, где последовательность вирусной нуклеиновой кислоты представляет собой последовательность нуклеиновой кислоты аденоассоциированного вируса (AAV).
45. Полинуклеотид по п. 44, где последовательность нуклеиновой кислоты AAV содержит последовательность внутреннего концевого повтора и, необязательно, где полинуклеотид содержит тканеспецифический регуляторный элемент, содержащий специфический в отношении печени промотор или специфический в отношении нейронов промотор.
46. Полинуклеотид по п. 45, где последовательность внутреннего концевого повтора содержит SEQ ID NO: 6, SEQ ID NO: 7 или и то и другое.
47. Полинуклеотид по любому из пп. 42-46, содержащий тканеспецифический регуляторный элемент, содержащий последовательность, представленную под SEQ ID NO: 8 и/или SEQ ID NO: 9.
48. Вектор для генной терапии, содержащий полинуклеотид по любому из пп. 42-47, для лечения болезни Помпе.
49. Вектор для генной терапии по п. 48, где вектор для генной терапии представляет собой:
вирусный вектор, где необязательно вирусный вектор представляет собой природный вирус, сконструированный вирус или химерный вирус;
полинуклеотид без дополнительных средств; или
полинуклеотидный комплекс, где необязательно полинуклеотидный комплекс представляет собой липидную наночастицу, содержащую полинуклеотид.
50. Вектор для генной терапии по п. 48 или 49, где вектор для генной терапии представляет собой вирусный вектор, выбранный из группы, состоящей из ретровируса, аденовируса, вируса простого герпеса, поксвируса, вируса осповакцины, лентивируса и аденоассоциированного вируса.
51. Вектор для генной терапии по п. 49 или 50, где вектор для генной терапии представляет собой AAV9, Anc80, химерный AAV2/8 и/или AAV, псевдотипированный по конкретной ткани, необязательно, где конкретная ткань представляет собой ткань печени или нейронную ткань.
52. Применение полинуклеотида, который кодирует мультидоменный терапевтический белок по любому из пп. 15-41 или полинуклеотида по любому из пп. 42-47 в способе по любому из пп. 1-14.
| PUZZO F | |||
| et al., Rescue of Pompe disease in mice by AAV-mediated liver delivery of secretable acid α-glucosidase, Sci Transl Med., 2017, vol | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Способ пропитывания дерева | 1925 |
|
SU418A1 |
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ВЕКТОРЫ, УСЛОВНО ЭКСПРЕССИРУЮЩИЕ ТЕРАПЕВТИЧЕСКИЕ БЕЛКИ, КЛЕТКИ-ХОЗЯЕВА, СОДЕРЖАЩИЕ УКАЗАННЫЕ ВЕКТОРЫ, И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2612788C2 |
Авторы
Даты
2024-05-06—Публикация
2019-02-07—Подача