Изобретение относится к медицине, в частности к экспериментальной фармакологии и генетическим технологиям.
По известным литературным источникам - дисферлинопатия охватывает группу редких мышечных дистрофий, вызванных рецессивными мутациями в гене DYSF. Фенотип варьирует от бессимптомного повышения уровня креатинкиназы в сыворотке до избирательного и прогрессирующего поражения проксимальных и/или дистальных мышц конечностей [Contreras-Cubas, C., Barajas-Olmos, F., Frayre-Martínez, M. I., Siordia-Reyes, G., Guízar-Sánchez, C. C., García-Ortiz, H., Orozco, L., & Baca, V. (2022). Dysferlinopathy misdiagnosed with juvenile polymyositis in the pre-symptomatic stage of hyperCKemia: a case report and literature review. BMC medical genomics, 15(1), 139]. Возможность восстановления дефектного белка мышц путем введения в клетку функционального гена дикого типа является перспективным методом генной терапии мышечных дистрофий [Старостина И.Г. Создание рекомбинантного аденовируса, кодирующего кодон-оптимизированный ген дисферлина, и анализ экспрессии рекомбинантного белка в культуре клеток in vitro / И.Г. Старостина, В.В. Соловьева, К.Г. Шевченко, Р.В. Деев, А.А. Исаев, А.А. Ризванов // Клеточная трансплантология и тканевая инженерия. - 2012. - Т.7, №3. - С.25-28]. Было продемонстрировано, что генная терапия с использованием рекомбинантного аденоассоциированного вируса (AAV) безопасна и хорошо переносится [Naso, M. F., Tomkowicz, B., Perry, W. L., 3rd, & Strohl, W. R. (2017). Adeno-Associated Virus (AAV) as a Vector for Gene Therapy. BioDrugs: clinical immunotherapeutics, biopharmaceuticals and gene therapy, 31(4), 317-334].
Использование генетических моделей нейродегенеративных заболеваний человека, получаемых путем модификации и/или редактирования генома лабораторных животных, и воспроизводящих ключевые звенья патогенеза заболевания является незаменимым звеном исследований, направленных на выявление молекулярных мишеней для разработки комплексной терапии и идентификацию геномных локусов, редактирование которых приводит к реверсии патологического фенотипа [Gitler, A. D., Dhillon, P., & Shorter, J. (2017). Neurodegenerative disease: models, mechanisms, and a new hope. Dis Model Mech, 10(5), 499-502].
Известен способ терапии дисферлинопатий с применением кодон-оптимизированной кДНК, кодирующей дисферлин человека (патент на изобретение RU 2527073, публ. 27.08.2014), включающий введение фармацевтической композиции для восстановления нарушенной экспрессии и/или функции белка дисферлина в скелетной мышце, содержащая аденовирус, человеку (или животным) таким способом и в таком количестве, которые обеспечат лечебный эффект в зависимости от нозологической формы и медицинских показаний. Фармацевтическая композиция может вводиться внутримышечно - местно, системно - внутривенно, аэрозольно, в виде генно-клеточной трансплантации или трансфузии после in vitro обработки различных аутологичных клеток, например гемопоэтических и их более дифференцированных производных, мезенхимальных, сосудисто-стромальной фракции, мезангиобластов, миобластов, миосателлитоцитов и др.
Основным недостатком способа является то, что аденовирус обладает более высокой иммуногенностью по сравнению с AAV. Преимущество использования рекомбинантного AAV в генной терапии можно объяснить отсутствием патогенности и дополнительной безопасностью из-за дефектности его репликации и способности опосредовать более долгосрочную экспрессию в различных тканях, чем у рекомбинантного аденовируса [Lai, C.M., Lai, Y.K., & Rakoczy, P.E. (2002). Adenovirus and adeno-associated virus vectors. DNA and cell biology, 21(12), 895-913]. Помимо этого, в данном способе не приведены режимы введения и дозы препарата при конкретных показаниях.
Наиболее близким по существу предлагаемого изобретения (прототипом) является способ терапии дисферлинопатий [Lostal, W., et al., Efficient recovery of dysferlin deficiency by dual adeno-associated vector-mediated gene transfer. Hum Mol Genet, 2010. 19(10): p.1897-907]. Авторы клонировали кДНК дисферлина в вектор на основе AAV. Так как кДНК дисферлина превышает размер трансгенной вставки, которую способен нести геном AAV, кДНК гена DYSF клонировали в виде 2 частей в два независимых AAV вектора: один рекомбинантный AAV несет 5′ конец кДНК вместе с донорным сайтом сплайсинга интрона, другой рекомбинантный AAV несет акцепторный сайт сплайсинга и следующий за ним 3' концевую последовательность кДНК. В результате естественной способности AAV к конкатемеризации происходило объединение двух частей кДНК и экспрессия полноразмерного белка дисферлина. Системная инъекция в хвостовую вену самцов дисферлин-дефицитных мышей B6.A/J-Dysfprmd этих двух векторов приводила к системной, хотя и слабой, экспрессии белка. Инъекции приводили к улучшению гистологической картины мышечной ткани, сокращению числа некротических волокон, восстановлению репарации мембраны и глобальному улучшению двигательных функций.
Недостатком данного способа является слабая экспрессия белка дисферлина при введении двух рекомбинантных AAV.
Задачей настоящего изобретения является создание эффективного способа коррекции миодистрофии с использованием генно-инженерной конструкции на основе AAV, экспрессирующей дисферлин человека.
Техническим результатом предлагаемого изобретения является эффективный способ коррекции миодистрофии с использованием аденоассоциированного вирусного вектора в эксперименте, лишенный недостатков прототипа, а именно, высокой иммуногенности аденовируса, с приведением доз и режима введения ААВ9-ДИСФ-ДВ в эксперименте на дисферлин-дефицитных мышах, и недостатка аналога, а именно, слабой экспрессии дисферлина при введении двух рекомбинантных AAV, за счет применения мышцеспецифичного промотора в комбинации с химерным интроном для усиления экспрессии дисферлина.
Поставленная задача достигается тем, что предложен способ коррекции миодистрофии с использованием аденоассоциированного вирусного вектора в эксперименте, включающий использование самцов дисферлин-дефицитных мышей B6.A/J-Dysfprmd и однократное введение двувекторного препарата на основе аденоассоциированного вируса в хвостовую вену с оценкой мышечной функции через 30 дней после инъекции препарата, причем коррекцию миодистрофии проводят препаратом ААВ9-ДИСФ-ДВ на основе аденоассоциированного вируса 9 серотипа, несущего кодон-оптимизированную кДНК гена дисферлина под управлением мышцеспецифичного промотора в комбинации с химерным интроном для усиления экспрессии дисферлина в объеме 100 мкл, подтверждаемый результатами теста «Сила хватки».
Основным преимуществом предлагаемого способа является то, что однократное внутривенное введение ААВ9-ДИСФ-ДВ в объеме 100 мкл (титр вирусных частиц составляет 2,15Е+13гк/мл для AAV9-Dysf5'-DV и 2,06Е+13гк/мл для AAV9-Dysf3'-DV) приводит к выраженной коррекции миодистрофии у дисферлин-дефицитных мышей B6.A/J-Dysfprmd, что подтверждается достоверным увеличением пикового значения силы тяги у мышей B6.A/J-Dysfprmd с введением ААВ9-ДИСФ-ДВ по сравнению с нелеченными животными (p<0,05) в тесте «Сила хватки», так как двойные AAV векторы имеют перекрывающуюся область размером 1 т. п. н., которая служит субстратом для рекомбинации с целью создания полноразмерной кДНК дисферлина и более выраженной экспрессии полноразмерного белка дисферлина за счет наличия химерного интрона в 5'-кассете.
СПОСОБ ПОЛУЧЕНИЯ ААВ9-ДИСФ-ДВ
Пример 1
Этап 1. Был произведен дизайн и синтез олигонуклеотидов, кодирующих химерный интрон, представлено в таблице 1:
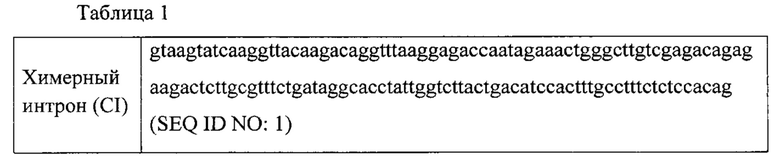
Этап 2. 5' последовательность дисферлина была клонирована в вектор для сборки AAV (pAAV-Dysf5'-DV), при этом вектор несет следующие регуляторные последовательности, представлено в таблице 2.
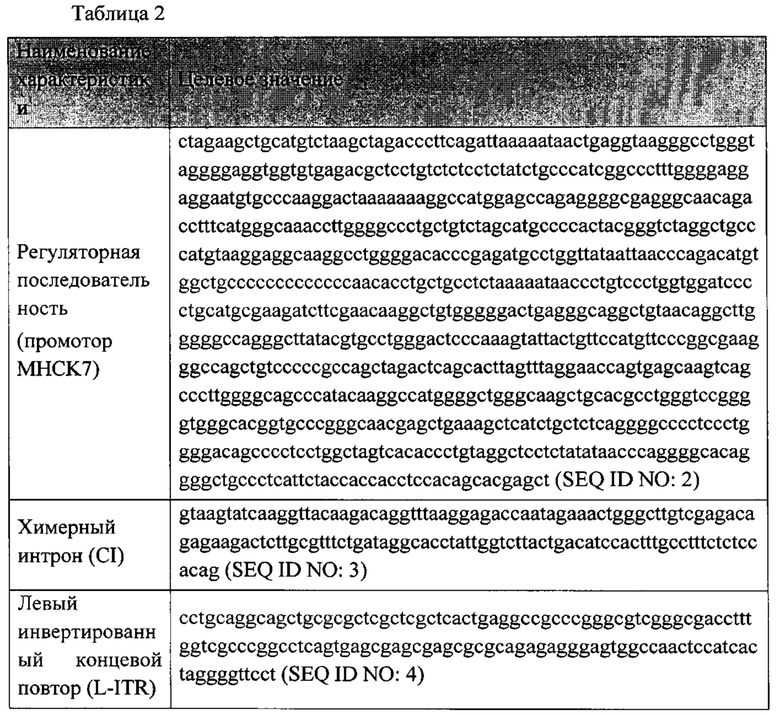

Этап 3. 3' последовательность дисферлина была клонирована в вектор для сборки AAV (pAAV-Dysf3'-DV), при этом вектор несет следующие регуляторные последовательности, представлено в таблице 3.

Этап 4. Была проведена проверка последовательностей плазмид pAAV-Dysf5'-DV и pAAV-Dysf3'-DV секвенированием (только клонированные последовательности, не включая ITR).
Для сборки пробной партии вирусов были в препаративных количествах получены 4 плазмиды: AAV9-Dysf5'-DV, AAV9-Dysf3'-DV, pAAV-RC2/9 и pHelper.
Методом тройной транзиентной трансфекции в клетках HEK293T были получены пробные партии вирусов AAV9-Dysf5'-DV и AAV9-Dysf3'-DV. Вирусные препараты были очищены по отработанной ранее в лаборатории методике от клеточного дебриса, примесных белков и пустых вирусных капсидов. Вирусный препарат стерилизовали через спин-колонки с размером пор 0,22 мкм и замораживали в буфере для хранения вирусных препаратов: 1х PBS, 350mM NaCl, 0,001% Pluronic F68 в пробирках типа эппендорф по 0,5 мл. Аликвоты вирусных препаратов отбирали перед замораживанием для контроля качества.
Качество полученных вирусов AAV9-Dysf5'-DV и AAV9-Dysf3'-DV определяли окрашиванием в полиакриламидном геле в денатурирующих условиях. Концентрацию вирусов определяли количественной ПНР в реальном времени с использованием зондов и праймеров к инвертированным повторам по отработанной ранее в лаборатории методике. Титр вирусных частиц в конечном препарате составляет 2,15Е+13 гк/мл для AAV9-Dysf5'-DV и 2,06Е+13 гк/мл для AAV9-Dysf3'-DV соответственно.
В ходе работ были получены 2 плазмидные конструкции, кодирующие кДНК дисферлина pAAV-Dysf5'-DV и pAAV-Dysf3'-DV. Последовательности полученных плазмид были подтверждены секвенированием по Сэнгеру. Полученные плазмиды были трансформированы в штамм Тор 10 E. coli для выделения.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА ААВ9-ДИСФ-ДВ
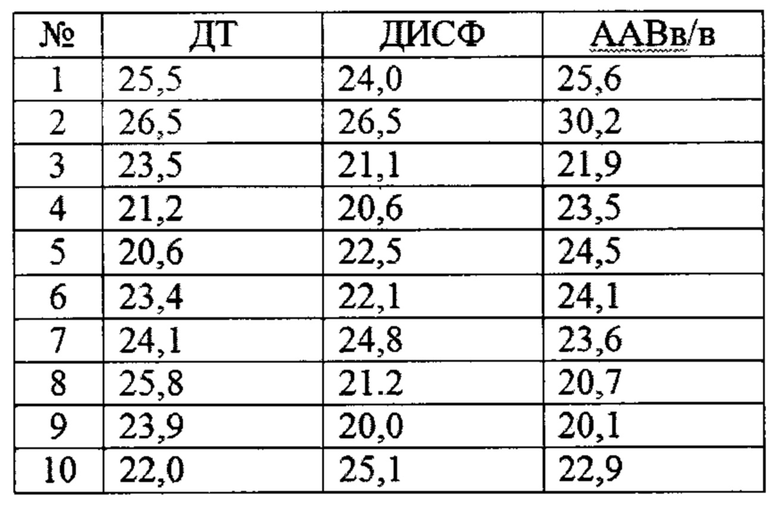
Эксперименты проведены на 30 мышах-самцах B6.A/J-Dysfprmd, Stock No: 012767, Jackson Laboratory, массы которых приведены в таблице 4. Каждая группа включала 10 крыс. Мыши были редеревированы в SPF зону экспериментально биологической клиники НИУ «БелГУ», рандомизированы в соответствии с массой и использованы для исследования специфической фармакологической активности препарата на основе аденоассоциированного вирусного вектора ААВ9-ДИСФ-ДВ.

Первая группа - положительный контроль - мыши дикого типа (шифр ДТ); вторая группа - отрицательный контроль - дисферлин-дефицитные мыши (шифр ДИСФ) с генотипом B6.A/J-Dysfprmd; третья группа - дисферлин-дефицитные мыши, получающие препарат ААВ9-ДИСФ-ДВ внутривенно, в хвостовую вену, в объеме 100 мкл (шифр ААВв/в). Титр вирусных частиц составляет 2,15Е+13 гк/мл для AAV9-Dysf5'-DV и 2,06Е+13 гк/мл для AAV9-Dysf3'-DV.
О выраженности эффекта судили по мышечной функции через 30 дней после однократной инъекции препарата. Для этого проводили тест «Сила хватки».
Тест «Сила хватки». Установка представляет собой сетку из нержавеющей стали подключенной к датчику для измерения силы хватки (в граммах) передних конечностей мыши. Животному давали ухватиться за горизонтальную сетку передними лапами, а затем мышь оттягивали назад за хвост, пока ее хватка не ослабевала, при этом задние лапы мыши не должны касаться сетки. Датчик измерения силы сохраняет пиковое значение силы тяги. Тест используется для изучения функции нейромышечной системы. Для анализа использовались среднее значения из 5 успешных измерений силы передних конечностей [Nagaraju K., Raben N., Loeffler L., Parker Т., Rochon P.J., Lee E., Danning C., Wada R., Thompson C., Bahtiyar G., Craft J., Hooft Van Huijsduijnen, R., Plotz P. Conditional up-regulation of MHC class I in skeletal muscle leads to self-sustaining autoimmune myositis and myositis-specific autoantibodies. Proceedings of the National Academy of Sciences of the United States of America. - 2000. №97. - P. 9209-9214;  X.,
X.,  Paz-Araos M., Astorga C, Cea L.A.,
Paz-Araos M., Astorga C, Cea L.A.,  Bevilacqua J.A., Caviedes P.,
Bevilacqua J.A., Caviedes P.,  N-Acetylcysteine Reduces Skeletal Muscles Oxidative Stress and Improves Grip Strength in Dysferlin-Deficient B1a/J Mice. International journal of molecular sciences. - 2020. №16; P. 4293].
N-Acetylcysteine Reduces Skeletal Muscles Oxidative Stress and Improves Grip Strength in Dysferlin-Deficient B1a/J Mice. International journal of molecular sciences. - 2020. №16; P. 4293].
Статистическую обработку проводили с использованием программной среды вычислений R. Характер распределения признаков в статистической выборке определяли с помощью критерия Шапиро-Уилка и критерия Шпигельхальтера (библиотека normtest), оценку равенства дисперсий - с помощью критерия Левене (библиотека lawstat). В зависимости от типа распределения признаков и равенства дисперсий значимость полученных результатов оценивали с применением параметрического (ANOVA) или непараметрического (критерий Краскела-Уоллиса) однофакторного дисперсионного анализа, а в качестве post-hoc анализа для выявления различий при межгрупповых сравнениях использовали непарный t-критерий Стьюдента или критерий Манна-Уитни, соответственно, с поправкой Бенджамини-Хохберга на множественную проверку гипотез. Результаты считали достоверными при р≤0,05.
ПРИМЕР КОНКРЕТНОГО ВЫПОЛНЕНИЯ
Сила передних конечностей в тесте «Сила хватки» была значительно снижена у мышей с диферлинопатией по сравнению с мышами дикого типа, на 23,4% (р<0,05), что свидетельствует о снижении выносливости у мышей с генотипом B6.A/J-Dysfprmd при развивающейся миодистрофии. Выраженная эффективность при коррекции миодистрофии установлена в группе животных, получавших препарат ААВ9-ДИСФ-ДВ внутривенно, на 27,3% (р<0,05) превышая показатель в группе ДИСФ, при этом достигая целевых значений (таблица 5).

Таким образом, в предлагаемом способе однократное внутривенное введение препарата на основе аденоассоциированного вирусного вектора ААВ9-ДИСФ-ДВ в объеме 100 мкл приводит к выраженной коррекции миодистрофии у дисферлин-дефицитных мышей В6.А/J-Dysfprmd, что подтверждается результатами теста «Сила хватки» через 30 дней после инъекции ААВ9-ДИСФ-ДВ.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="ru"
dtdVersion="V1_3" fileName="Способ коррекции миодистрофии с
использованием аденоассоциированного вирусного вектора в
эксперименте.xml" softwareName="WIPO Sequence"
softwareVersion="2.3.0" productionDate="2023-08-21">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>2022133746</ApplicationNumberText>
<FilingDate>2022-12-22</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>969</ApplicantFileReference>
<ApplicantName languageCode="ru">федеральное государственное
автономное образовательное учреждение высшего образования
"Белгородский государственный национальный исследовательский
университет" (НИУ "БелГУ")</ApplicantName>
<ApplicantNameLatin>federal'noe gosudarstvennoe avtonomnoe
obrazovatel'noe uchrezhdenie vysshego obrazovaniya
"Belgorodskij gosudarstvennyj nacional'nyj
issledovatel'skij universitet" (NIU
"BelGU")</ApplicantNameLatin>
<InventionTitle languageCode="ru">Способ коррекции миодистрофии с
использованием аденоассоциированного вирусного вектора в
эксперименте</InventionTitle>
<SequenceTotalQuantity>8</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>133</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..133</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gtaagtatcaaggttacaagacaggtttaaggagaccaatagaaactgg
gcttgtcgagacagagaagactcttgcgtttctgataggcacctattggtcttactgacatccactttgc
ctttctctccacag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>775</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..775</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q21">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Homo sapiens</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ctagaagctgcatgtctaagctagacccttcagattaaaaataactgag
gtaagggcctgggtaggggaggtggtgtgagacgctcctgtctctcctctatctgcccatcggccctttg
gggaggaggaatgtgcccaaggactaaaaaaaggccatggagccagaggggcgagggcaacagacctttc
atgggcaaaccttggggccctgctgtctagcatgccccactacgggtctaggctgcccatgtaaggaggc
aaggcctggggacacccgagatgcctggttataattaacccagacatgtggctgcccccccccccccaac
acctgctgcctctaaaaataaccctgtccctggtggatcccctgcatgcgaagatcttcgaacaaggctg
tgggggactgagggcaggctgtaacaggcttgggggccagggcttatacgtgcctgggactcccaaagta
ttactgttccatgttcccggcgaagggccagctgtcccccgccagctagactcagcacttagtttaggaa
ccagtgagcaagtcagcccttggggcagcccatacaaggccatggggctgggcaagctgcacgcctgggt
ccggggtgggcacggtgcccgggcaacgagctgaaagctcatctgctctcaggggcccctccctggggac
agcccctcctggctagtcacaccctgtaggctcctctatataacccaggggcacaggggctgccctcatt
ctaccaccacctccacagcacgagct</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>133</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..133</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gtaagtatcaaggttacaagacaggtttaaggagaccaatagaaactgg
gcttgtcgagacagagaagactcttgcgtttctgataggcacctattggtcttactgacatccactttgc
ctttctctccacag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>130</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..130</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cctgcaggcagctgcgcgctcgctcgctcactgaggccgcccgggcgtc
gggcgacctttggtcgcccggcctcagtgagcgagcgagcgcgcagagagggagtggccaactccatcac
taggggttcct</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>141</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..141</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>aggaacccctagtgatggagttggccactccctctctgcgcgctcgctc
gctcactgaggccgggcgaccaaaggtcgcccgacgcccgggctttgcccgggcggcctcagtgagcgag
cgagcgcgcagctgcctgcagg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>130</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..130</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q12">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>cctgcaggcagctgcgcgctcgctcgctcactgaggccgcccgggcgtc
gggcgacctttggtcgcccggcctcagtgagcgagcgagcgcgcagagagggagtggccaactccatcac
taggggttcct</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="7">
<INSDSeq>
<INSDSeq_length>122</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..122</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q22">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>taagatacattgatgagtttggacaaaccacaactagaatgcagtgaaa
aaaatgctctatttgtgaaatttgtgatgctattgtcctatttgtaaccattataagctgcaataaacaa
gtt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="8">
<INSDSeq>
<INSDSeq_length>141</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..141</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q18">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>aggaacccctagtgatggagttggccactccctctctgcgcgctcgctc
gctcactgaggccgggcgaccaaaggtcgcccgacgcccgggctttgcccgggcggcctcagtgagcgag
cgagcgcgcagctgcctgcagg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ повышения физической выносливости в эксперименте на дисферлин-дефицитных мышах | 2023 |
|
RU2833672C1 |
| Способ сохранения статической выносливости у дисферлин-дефицитных мышей в эксперименте | 2023 |
|
RU2829651C1 |
| Способ повышения физической работоспособности с использованием аденоассоциированного вирусного вектора в эксперименте на дисферлин-дефицитных мышах | 2023 |
|
RU2828839C1 |
| Способ коррекции миодистрофии с использованием плазмидной ДНК у дисферлин-дефицитных мышей | 2022 |
|
RU2805357C1 |
| Нуклеиновая кислота для аллотопической экспрессии гена MT-ND4 | 2023 |
|
RU2809065C1 |
| НАБОР РЕКОМБИНАНТНЫХ ГЕНЕТИЧЕСКИХ ВЕКТОРОВ, КОДИРУЮЩИХ ШИРОКО НЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА ПРОТИВ ВИЧ-1, ИММУНОБИОЛОГИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИЧ-ИНФЕКЦИИ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2024 |
|
RU2833072C1 |
| АДЕНОАССОЦИИРОВАННЫЙ ВИРУСНЫЙ ВЕКТОР, СОСТОЯЩИЙ ИЗ БЕЛКОВ КАПСИДА РНР.В, НУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩЕЙ БЕЛОК SMN, И ЕГО ПРИМЕНЕНИЕ | 2022 |
|
RU2833225C2 |
| Применение вектора для снижения иммунного ответа при вирусной доставке AIPL1 | 2023 |
|
RU2818342C1 |
| МИНИ-БЕЛОК USH2A, НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ МИНИБЕЛОК USH2A, И СОДЕРЖАЩИЙ ЕЕ ЭКСПРЕССИОННЫЙ ВЕКТОР ДЛЯ ГЕННОЙ ТЕРАПИИ | 2023 |
|
RU2822884C1 |
| Препарат для стимулирования регенерации и нейропротекции нервной ткани и способ его использования | 2023 |
|
RU2828544C1 |
Изобретение относится к медицине, в частности к экспериментальной фармакологии и генетическим технологиям. Описанный способ включает использование самцов дисферлин-дефицитных мышей B6.A/J-Dysfprmd и однократное введение двувекторного препарата на основе аденоассоциированного вируса в хвостовую вену с оценкой мышечной функции через 30 дней после инъекции препарата. Коррекцию миодистрофии проводят на основе аденоассоциированного вируса 9 серотипа, несущего кодон-оптимизированную кДНК гена дисферлина под управлением мышцеспецифичного промотора в комбинации с химерным интроном для усиления экспрессии дисферлина в объеме 100 мкл, подтверждаемый результатами теста «Сила хватки». Изобретение может быть использовано для лечения миодистрофии. 5 табл., 1 пр.
Способ коррекции миодистрофии с использованием аденоассоциированного вирусного вектора в эксперименте, включающий использование самцов дисферлин-дефицитных мышей B6.A/J-Dysfprmd и однократное введение двувекторного препарата на основе аденоассоциированного вируса в хвостовую вену с оценкой мышечной функции через 30 дней после инъекции препарата, отличающийся тем, что коррекцию миодистрофии проводят препаратом на основе аденоассоциированного вируса 9 серотипа, несущего кодон-оптимизированную кДНК гена дисферлина под управлением мышцеспецифичного промотора в комбинации с химерным интроном для усиления экспрессии дисферлина в объеме 100 мкл, подтверждаемый результатами теста «Сила хватки».
| Kasun Kodippili, Chady H Hakim et al., Dual AAV Gene Therapy for Duchenne Muscular Dystrophy with a 7-kb Mini-Dystrophin Gene in the Canine Model, Hum Gene Ther | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| WO 2019209777 A1, 31.10.2019 | |||
| RU 2015141336 A, 22.05.2017 | |||
| Lostal, W., et al., Efficient recovery of dysferlin deficiency by dual adeno-associated vector-mediated | |||
Авторы
Даты
2024-06-25—Публикация
2022-12-22—Подача