Область техники
[0001] Настоящее изобретение относится к соединению и способу, которые являются пригодными для получения лемборексанта, который является пригодным в качестве антагониста рецептора орексина-2. Кроме того, настоящее изобретение относится к лемборексанту, содержащему небольшое количество примесей.
Уровень техники
[0002] Рецепторы орексина представляют собой рецепторы, связанные с G-белком, которые в основном наблюдаются в головном мозге. Внутренние лиганды рецепторов орексина, орексин-A и орексин-B, экспрессируются нейронами, локализованными в области гипоталамуса. Орексин-A представляет собой пептид из 33 аминокислот, а орексин-B состоит из 28 аминокислот (Sakurai T. et al., Cell, 1998, Vol. 92, pp. 573-585). Существует два подтипа рецепторов орексина, OX1 и OX2, причем OX1 преимущественно связывается с орексином-A, тогда как OX2 связывается как с орексином-A, так и с орексином-B. Было высказано предположение (упомянутыми выше Sakurai et al.), что орексины стимулируют потребление пищи у крыс, и передача сигналов орексином может играть роль в основных механизмах обратной связи для регуляции пищевого поведения. Также наблюдалось, что орексины контролируют состояние пробуждения и сна (Chemelli R. M. et al., Cell, 1999, Vol. 98, pp. 437-451). Орексины также способны играть роль в изменениях мозга, сопровождающихся опиоидной и никотиновой зависимостью (SL Borgland et al., Neuron, 2006, Vol. 49, pp. 598-601; CJ Winrow et al. Neuropharmacology, 2010, Vol. 58, pp. 185-194) и добавлением этанола (JR Shoblock et al., Psychopharmacology, 2011, Vol. 215, pp. 191-203). Кроме того, было высказано предположение, что орексины играют роль в некоторых стрессовых реакциях (T. Ida et al., Biochem. Biophys. Res. Commun., 2000, Vol. 270, pp. 318-323).
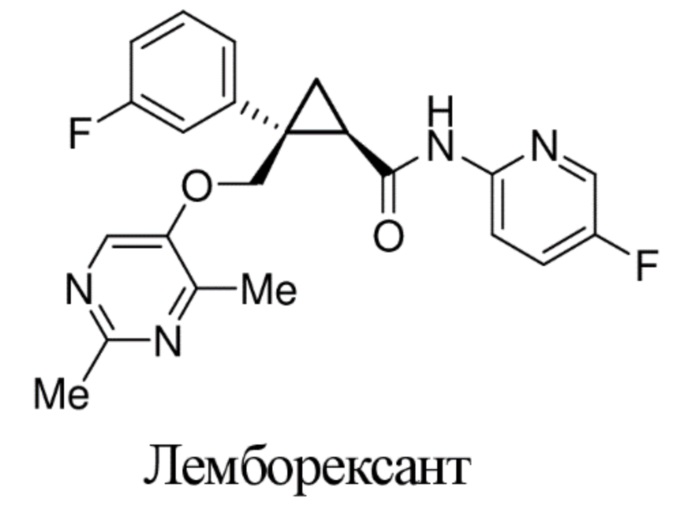
[0003] Известно, что такие соединения, как (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид (лемборексант) являются мощными антагонистами рецепторов орексина, и эти соединения пригодны для лечения нарушений сна, таких как бессонница, и других терапевтических применений.
Список цитируемой литературы
Патентные литературные источники
[0004] [Патентный литературный источник 1] WO 2012/039371
[Патентный литературный источник 2] WO 2013/123240
Непатентные литературные источники
[0005] [Непатентный литературный источник 1] Sakurai T. et al., Cell, 1998, Vol. 92, pp. 573-585
[Непатентный литературный источник 2] Chemelli R. M. et al., Cell, 1999, Vol. 98, pp. 437-451
[Непатентный литературный источник 3] S. L. Borgland et al., Neuron, 2006, Vol. 49, pp. 598-601
[Непатентный литературный источник 4] C. J. Winrow et al. Neuropharmacology, 2010, Vol. 58, pp. 185-194
[Непатентный литературный источник 5] J. R. Shoblock et al., Psychopharmacology, 2011, Vol. 215, pp. 191-203
[Непатентный литературный источник 6] T. Ida et al., BioChem. Biophys. Res. Commun., 2000, Vol. 270, pp. 318-323.
Краткое описание изобретения
Техническая задача
[0006] В качестве способа получения лемборексанта известен способ, описанный в патентной литературе 1; однако в патентной литературе 1 лемборексант синтезируют из соединения продукта 14-2 из примера получения 14 через соединение продукта 14-3.

Поскольку в этом способе получения выход является низким, все еще существует проблема в отношении использования описанного выше способа получения для промышленного производства.
[0007] В качестве способа получения лемборексанта известен способ, описанный в патентной литературе 2; однако в патентной литературе 2 лемборексант синтезируют из соединения 5 через соединение 6 путем ацетилирования, в котором используется фермент.

В этом способе получения, поскольку необходимо учитывать фермент, остающийся во время промывания установки, все еще существует проблема в отношении использования способа получения для промышленного производства.
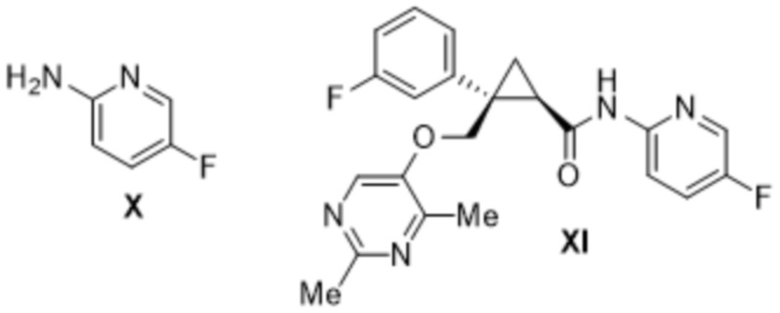
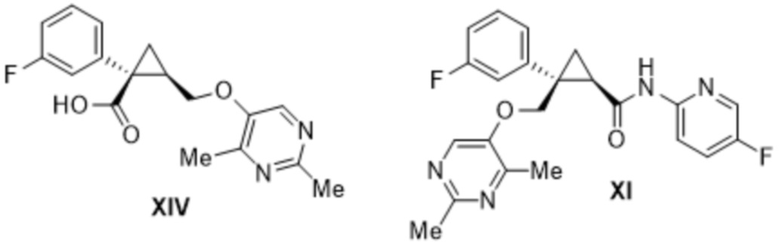
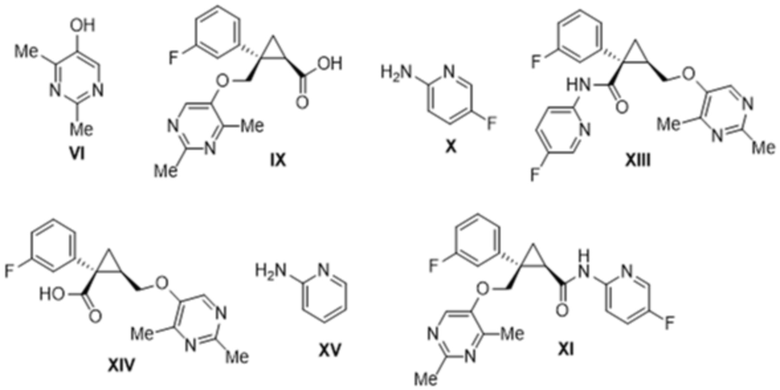
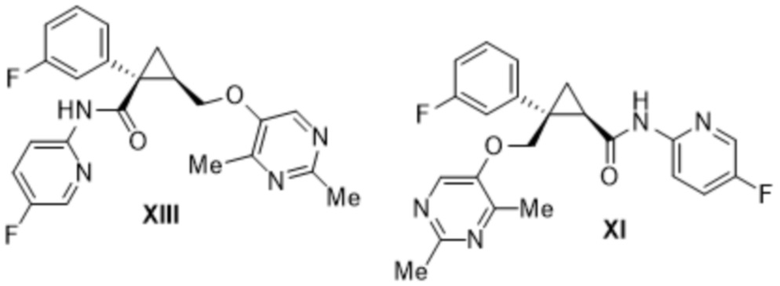
[0008] Кроме того, авторы настоящего изобретения обнаружили, что при получении лемборексанта содержатся соединения формулы VI, формулы IX, формулы X, формулы XII, формулы XIII, формулы XIV и формулы XV в виде примесей.

[0009] Существует потребность в способе синтеза и промежуточном продукте, которые пригодны к использованию в получении лемборексанта, который является пригодным фармацевтическим средством. Следовательно, целью настоящей заявки является обеспечение такого способа синтеза и такого промежуточного продукта. Кроме того, существует еще одна потребность в лемборексанте, содержащем небольшое количество примесей, который является полезным фармацевтическим средством. Следовательно, другой целью настоящей заявки является получение лемборексанта, содержащего небольшое количество примесей.
Решение задачи
[0010] В настоящем описании представлены соединение и способ, которые пригодны для получения лемборексанта, который является пригодным в качестве антагониста рецептора орексина-2. Кроме того, представлен лемборексант, содержащий небольшое количество примесей.
[0011] Предусмотрен способ получения соединения формулы III:

включающий:
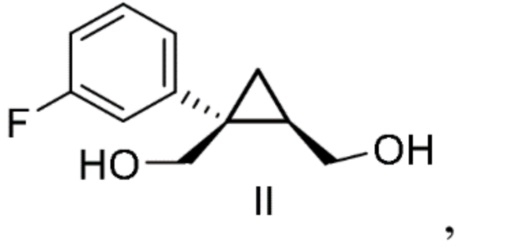
а) добавление реактива Гриньяра к смеси, содержащей соединение формулы II:
толуол и тетрагидрофуран, и
b) добавление смеси к смеси, содержащей ацетилхлорид и этилацетат.
[0012] В одном варианте осуществления реактив Гриньяра представляет собой циклогексилмагнийхлорид.
[0013] Предусмотрен способ получения соединения формулы XI:

включающий:
способ изготовления для получения соединения формулы III, описанного выше.
[0014] Предусмотрен способ получения соединения формулы XI, описанный выше, включающий:
перемешивание смеси
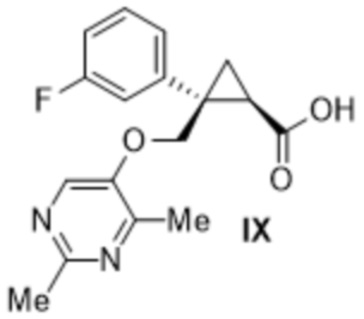
i) соединения формулы IX:
 ,
,
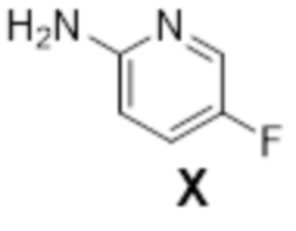
ii) соединения формулы X:
 ,
,
iii) этилацетата,
iv) N, N-диизопропилэтиламина и
v) 1-пропанфосфоновой кислоты
при температуре от 60°С до 80°С.
[0015] Предусмотрен способ получения соединения формулы IX:
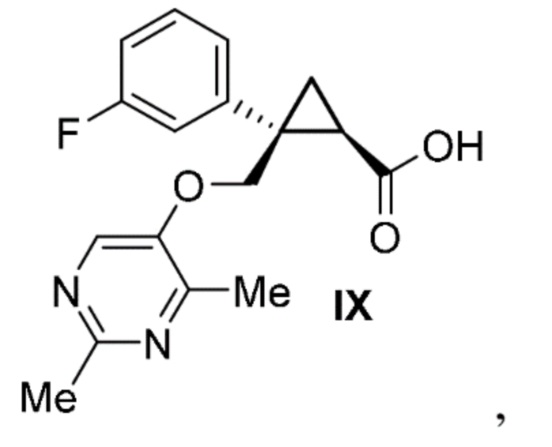
включающий:
получение соединения формулы III, описанного выше.
[0016] Предусмотрен способ получения соединения формулы IX:

включающий:
обеспечение реакции соединения формулы VII:

с окислителем.
[0017] В одном варианте осуществления стадию обеспечения реакции соединения формулы VII с окислителем проводят путем последовательного добавления гипохлорита натрия и хлорита натрия в качестве окислителя.
[0018] Предусмотрен способ получения соединения формулы IX:

включающий:
а) окисление соединения формулы VII:

гипохлоритом натрия с получением альдегида формулы VIII:

и
b) окисление альдегида хлоритом натрия.
[0019] В одном варианте осуществления окисление на стадии а) катализируют эффективным количеством 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO).
[0020] Предусмотрен способ получения соединения формулы VII:

включающий:
способ изготовления для получения соединения формулы III, описанного выше, и
добавление водного раствора гидроксида натрия к соединению формулы V:

и перемешивание обоих при температуре от 30°C до 50°C.
[0021] Предусмотрен способ получения соединения формулы V:

включающий:
а) добавление трет-бутоксида калия к смеси
i) соединения формулы VI:
 ,
,
ii) N-метилпирролидона и
iii) ацетонитрила, и
перемешивание смеси при температуре от 40°C до 70°C, и
b) перемешивание смеси, полученной путем добавления
i) соединения формулы IV:
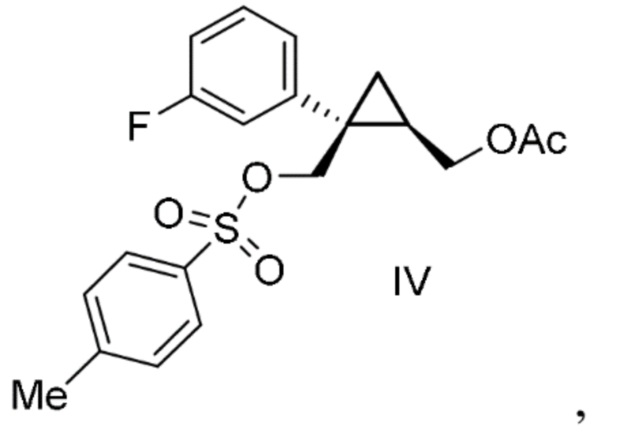
к смеси при температуре от 40°C до 70°C.
[0022] Предусмотрен способ получения соединения формулы IV:

включающий:
добавление смеси ii) п-толуолсульфонилхлорида, толуола и ацетонитрила к композиции, содержащей i) соединение формулы III:

полученное описанным выше способом, толуол, триэтиламин и 1-метилимидазол.
[0023] Предусмотрен способ получения соединения формулы II:

включающий:
добавление метанола к композиции, содержащей соединение формулы I:
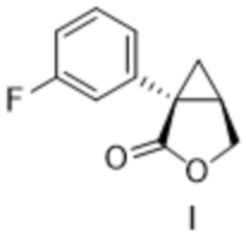 ,
,
толуол, тетрагидрофуран и борогидрид натрия.
[0024] Предусмотрено соединение формулы XI, где содержание соединения формулы XII составляет 0,10 масс. % или меньше.

[0025] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XII определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0026] Предусмотрено соединение формулы XI, где содержание всех родственных веществ, в том числе соединений формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, составляет 1,0 масс. % или меньше.

[0027] Предусмотрено соединение формулы XI, описанное выше, где содержание всех родственных веществ, в том числе соединений формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0028] Предусмотрено соединение формулы XI, где содержание соединения формулы XII составляет 0,10 масс. % или меньше и содержание всех родственных веществ, в том числе соединений формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, составляет 1,0 масс. % или меньше.
[0029] Предусмотрено соединение формулы XI, описанное выше, где содержания соединения формулы XII и всех родственных веществ, в том числе соединения формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0030] Предусмотрено соединение формулы XI, где содержание соединения формулы VI составляет 0,05 масс. % или меньше.

[0031] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы VI определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0032] Предусмотрено соединение формулы XI, где содержание соединения формулы IX составляет 0,05 масс. % или меньше.

[0033] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы IX определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0034] Предусмотрено соединение формулы XI, где содержание соединения формулы X составляет 0,05 масс. % или меньше.
[0035] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы X определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0036] Предусмотрено соединение формулы XI, где содержание соединения формулы XIII составляет 0,05 масс. % или меньше.

[0037] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XIII определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0038] Предусмотрено соединение формулы XI, где содержание соединения формулы XIV составляет 0,05 масс. % или меньше.
[0039] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XIV определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0040] Предусмотрено соединение формулы XI, где содержание соединения формулы XV составляет 0,05 масс. % или меньше.

[0041] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XV определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0042] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XI составляет 97,0 масс. % или больше.
[0043] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XI определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0044] Предусмотрено соединение, содержащее соединение формулы XI и соединение формулы XII, где содержание соединения формулы XI составляет 97,0 масс. % или больше, и содержание соединения формулы XII составляет 0,10 масс. % или меньше.

[0045] Предусмотрено соединение, описанное выше, где содержания соединения формулы XI и соединения формулы XII определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0046] Предусмотрено соединение, содержащее соединение формулы XI, соединение формулы XII и все родственные вещества, в том числе соединения формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, где содержание соединения формулы XI составляет 97,0 масс. % или больше, содержание соединения формулы XII составляет 0,10 масс. % или меньше, и содержание всех родственных веществ, в том числе соединений формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, составляет 1,0 масс. % или меньше.

[0047] Предусмотрено соединение, описанное выше, где содержания соединения формулы XI, соединения формулы XII и всех родственных веществ, в том числе соединения формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0048] Предусмотрено соединение, содержащее соединение формулы XI и соединение формулы VI, где содержание соединения формулы XI составляет 97,0 масс. % или больше, и содержание соединения формулы VI составляет 0,05 масс. % или меньше.

[0049] Предусмотрено соединение, описанное выше, где содержания соединения формулы XI и соединения формулы VI определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0050] Предусмотрено соединение формулы, содержащее соединение формулы XI и соединение формулы IX, где содержание соединения формулы XI составляет 97,0 масс. % или больше, и содержание соединения формулы IX составляет 0,05 масс. % или меньше.

[0051] Предусмотрено соединение, описанное выше, где содержания соединения формулы XI и соединения формулы IX определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0052] Предусмотрено соединение, содержащее соединение формулы XI и соединение формулы X, где содержание соединения формулы XI составляет 97,0 масс. % или больше, и содержание соединения формулы X составляет 0,05 масс. % или меньше.

[0053] Предусмотрено соединение, описанное выше, где содержания соединения формулы XI и соединения формулы X определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0054] Предусмотрено соединение, содержащее соединение формулы XI и соединение формулы XIII, где содержание соединения формулы XI составляет 97,0 масс. % или больше, и содержание соединения формулы XIII составляет 0,05 масс. % или меньше.

[0055] Предусмотрено соединение, описанное выше, где содержания соединения формулы XI и соединения формулы XIII определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0056] Предусмотрено соединение, содержащее соединение формулы XI и соединение формулы XIV, где содержание соединения формулы XI составляет 97,0 масс. % или больше, и содержание соединения формулы XIV составляет 0,05 масс. % или меньше.

[0057] Предусмотрено соединение, описанное выше, где содержания соединения формулы XI и соединения формулы XIV определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0058] Предусмотрено соединение, содержащее соединение формулы XI и соединение формулы XV, где содержание соединения формулы XI составляет 97,0 масс. % или больше, и содержание соединения формулы XV составляет 0,05 масс. % или меньше.

[0059] Предусмотрено соединение, описанное выше, где содержания соединения формулы XI и соединения формулы XV определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
Полезные эффекты настоящего изобретения
[0060] Настоящее изобретение способно обеспечить способ синтеза и промежуточное соединение, которые являются пригодными в получении антагониста рецептора орексина-2. Кроме того, настоящее изобретение позволяет получить лемборексант, содержащий небольшое количество примесей.
Описание вариантов осуществления
[0061] Далее будут описаны значения ссылочных позиций, терминологии и т. п., используемых в настоящем описании, и будет подробно описано настоящее описание.
[0062] В настоящем описании структурная формула соединения не ограничивается формулой, выраженной для удобства, и соединение может образовывать соль. Кроме того, соединение может иметь кристаллический полиморфизм и, аналогично, может представлять собой любую из монокристаллических форм или их смесь без ограничений и может представлять собой гидрат или сольват, отличный от ангидрида, все из которых включены в настоящее изобретение.
[0063] В настоящем описании, если не указано иное, конкретные примеры соли включают соль галогеноводородной кислоты (например, соль фтористоводородной кислоты, гидрохлорид, гидробромид, гидройодид и т. п.), неорганическую соль (например, сульфат, нитрат, перхлорат, фосфат, карбонат, бикарбонат или т. п.) и т. п.
[0064] В одном варианте осуществления соединение, которое описано в настоящем описании, может быть представлено в виде соли, например, фармацевтически приемлемой соли. "Фармацевтически приемлемая соль" относится к соли, которая сохраняет желаемую биологическую активность исходного соединения, но не оказывает нежелательного токсикологического действия. Конкретные примеры фармацевтически приемлемой соли включают соли неорганической кислоты (сульфат, нитрат, перхлорат, фосфат, карбонат, бикарбонат, соль фтористоводородной кислоты, гидрохлорид, гидробромид, гидроиодид и т. п.), органические карбоксилаты (ацетат, оксалат, малеат, тартрат, фумарат, цитрат и т. п.), органические сульфонаты (метансульфонат, трифторметансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, камфорсульфонат и т. п.), соли аминокислот (аспартат, глутамат и т. п.), соли четвертичных аминов, соли щелочных металлов (соли натрия, соли калия и т. п.) и соли щелочноземельных металлов (соли магния, соли кальция и т. п.).
[0065] Настоящее изобретение включает соединения, меченые изотопами, на основе соединения, которое описано в описании, и способы получения, в которых используется соединение. Соединение, меченое изотопом, является таким же, как соединение, описанное в описании, за исключением того, что один или несколько атомов заменены атомом, имеющим другую атомную массу или массовое число, чем атомная масса или массовое число, которые обычно встречаются в природе. Изотопный элемент, который может быть включен в соединение по настоящему изобретению, представляет собой, например, изотопный элемент водорода, углерода, азота, кислорода, фтора, хлора, фосфора, серы и йода, и их примеры включают 2H, 3H, 11C, 14C, 13N, 15O, 18F, 32P, 35S, 123I, 125I и т. п. Соединение по настоящему изобретению, содержащее такой изотопный элемент и/или другие изотопные элементы, и фармацевтически приемлемое производное (например, соль) соединения также включены в объем формулы настоящего изобретения.
[0066] Меченное изотопом соединение по настоящему изобретению, например соединение, в которое включен радиоактивный изотоп, такой как 3H и/или 14C, можно использовать для анализа тканевого распределения фармацевтических препаратов и/или матриц. 3H и 14C считаются полезными из-за простоты их получения и обнаружения. Изотопные элементы 11C и 18F считаются пригодными для позитронно-эмиссионной томографии (PET), изотопный элемент 125I считается пригодным для однофотонной эмиссионной компьютерной томографии (SPECT), и все эти изотопные элементы пригодны для визуализации мозга. Замена более тяжелым изотопным элементом, таким как 2H, обеспечивает определенный вид терапевтических преимуществ, таких как увеличение периода полураспада in vivo или уменьшение необходимой дозы, обусловленное более высокой метаболической стабильностью, и, таким образом, считается полезным в определенных ситуациях.
[0067] Структура, показанная в настоящем описании, означает также включение всех энантиомерных, диастереомерных и геометрических (или конформационных) форм структуры; например, конфигураций R-типа и S-типа в отношении каждого асимметричного центра, изомеров с двойной связью (Z)-типа и (E)-типа и конформационных изомеров (Z)-типа и (E)-типа. Следовательно, отдельные стереохимические изомеры, энантиомеры, диастереомеры и геометрические (или конформационные) смеси соединения по настоящему изобретению включены в объем настоящего изобретения. Если не указано иное, все таутомерные формы соединения по настоящему изобретению включены в объем настоящего изобретения.
[0068] "Соединение" в настоящем описании относится к соединению, которое содержит 90 масс. % или больше самого соединения и может содержать исходный материал или возможный побочный продукт в процессе производства соединения в качестве родственного вещества. Например, "соединение формулы XI" содержит 90 масс. % или больше соединения формулы XI и может содержать исходный материал, возможный побочный продукт или тому подобное в каждом процессе получения соединения формулы VI, соединения формулы IX, соединения формулы X, соединения формулы XII, соединения формулы XIII, соединения формулы XIV или соединения формулы XV. Следовательно, "соединение" в настоящем описании может содержать побочный продукт или тому подобное в качестве примесей и, таким образом, также характеризуется аспектом "композиции". В настоящем документе в случае указания содержания примеси, такой как соединение формулы VI, соединение формулы IX, соединение формулы X, соединение формулы XII, соединение формулы XIII, соединение формулы XIV или соединение формулы XV, содержание основано на общей массе соединения формулы XI.
[0069] "Содержание всех родственных веществ" в настоящем описании относится к общему количеству (масс. %) родственных веществ, в том числе формулу VI, формулу IX, формулу X, формулу XIII, формулу XIV или формулу XV.

[0070] В настоящем описании обеспечивается соединение (например, промежуточное соединение), используемое для получения (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (лемборексант), который известен как мощный антагонист рецептора орексина и пригоден для лечения расстройств сна, таких как бессонница, и других терапевтических путей применения, и способы его получения. Кроме того, в настоящем описании обеспечивается лемборексант, содержащий небольшое количество примесей.

[0071] Предусмотрен способ получения соединения формулы III:

включающий:
а) добавление реактива Гриньяра к смеси, содержащей
соединение формулы II:
 ,
,
толуол и тетрагидрофуран, и
b) добавление смеси к смеси, содержащей ацетилхлорид и этилацетат.
[0072] В описанном выше способе стадию a) можно проводить при 60°C или ниже, и стадию b) можно проводить при 20°C или ниже.
[0073] В одном варианте осуществления реактив Гриньяра представляет собой циклогексилмагнийхлорид.
[0074] Предусмотрен способ получения соединения формулы XI:

включающий:
получение соединения формулы III, описанного выше.
[0075] Предусмотрен способ получения соединения формулы XI, описанного выше, включающий
перемешивание смеси
i) соединения формулы IX:
 ,
,
ii) соединения формулы X:
 ,
,
iii) этилацетата,
iv) N, N-диизопропилэтиламина и
v) 1-пропанфосфоновой кислоты
при температуре от 60°С до 80°С.
[0076] В описанном выше способе реакционный растворитель может представлять собой этилацетат, и температура стадии перемешивания смеси может составлять 70°C.
[0077] Предусмотрен способ получения соединения формулы IX:

включающий:
получение соединения формулы III, описанного выше.
[0078] Предусмотрен способ получения соединения формулы IX:

включающий:
обеспечение реакции соединения формулы VII,

с окислителем.
[0079] В описанном выше способе реакционный растворитель может представлять собой жидкую смесь толуола и воды, и температура реакции может составлять 35°C или ниже.
[0080] В одном варианте осуществления стадия обеспечения реакции соединения формулы VII с окислителем выполняется путем последовательного добавления гипохлорита натрия и хлорита натрия в качестве окислителя.
[0081] Предусмотрен способ получения соединения формулы IX:

включающий:
а) окисление соединения формулы VII:

гипохлоритом натрия с получением альдегида формулы VIII:

и
b) окисление альдегида хлоритом натрия.
[0082] В описанном выше способе реакционный растворитель на стадии а) и стадии b) может представлять собой жидкую смесь толуола и воды, и температура реакции может составлять 25°C или ниже.
[0083] В одном варианте осуществления окисление на стадии а) катализируется эффективным количеством 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO).
[0084] Предусмотрен способ получения соединения формулы VII:

включающий:
способ изготовления для получения соединения формулы III, описанного выше, и
добавление водного раствора гидроксида натрия к соединению формулы V:

и перемешивание обоих при температуре от 30°C до 50°C.
[0085] В описанном выше способе реакционный растворитель может представлять собой жидкую смесь толуола, N-метилпирролидона, ацетонитрила и воды, и температура реакции может составлять 40°C.
[0086] Предусмотрен способ получения соединения формулы V:

включающий:
а) добавление трет-бутоксида калия к смеси
i) соединения формулы VI:
 ,
,
ii) N-метилпирролидона и
iii) ацетонитрила, и
перемешивание обоих при температуре от 40°C до 70°C и
b) перемешивание смеси, полученной путем добавления
i) соединения формулы IV:

к смеси при температуре от 40°C до 70°C.
[0087] В описанном выше способе реакционный растворитель на стадии а) может представлять собой жидкую смесь N-метилпирролидона и ацетонитрила, температура реакции может составлять 50°C, реакционный растворитель на стадии b) может представлять собой жидкую смесь толуола, N-метилпирролидона и ацетонитрила, и температура реакции может составлять 50°C.
[0088] Предусмотрен способ получения соединения формулы IV:

включающий:
добавление смеси ii) п-толуолсульфонилхлорида, толуола и ацетонитрила к композиции, содержащей
i) соединения формулы III:

полученное описанным выше способом, толуол, триэтиламин и 1-метилимидазол.
[0089] В описанном выше способе реакционный растворитель может представлять собой жидкую смесь толуола и ацетонитрила и температура реакции может составлять 8°C.
[0090] Предусмотрен способ получения соединения формулы II:

включающий:
добавление метанола к композиции, содержащей соединение формулы I:
 ,
,
толуол, тетрагидрофуран и борогидрид натрия.
[0091] В описанном выше способе реакционный растворитель может представлять собой жидкую смесь толуола, тетрагидрофурана и метанола, и температура реакции может составлять 50°C или ниже.
[0092] Предусмотрено соединение формулы XI, где содержание соединения формулы XII составляет 0,10 масс. % или меньше.

[0093] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XII определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0094] Предусмотрено соединение формулы XI, где содержание всех родственных веществ, в том числе соединений формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, составляет 1,0 масс. % или меньше.
[0095] Предусмотрено соединение формулы XI, описанное выше, где содержание всех родственных веществ, в том числе соединений формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0096] Предусмотрено соединение формулы XI, где содержание соединения формулы XII составляет 0,10 масс. % или меньше и содержание всех родственных веществ, в том числе соединений формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, составляет 1,0 масс. % или меньше.

[0097] Предусмотрено соединение формулы XI, описанное выше, где содержания соединения формулы XII и всех родственных веществ, в том числе соединения формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, определены с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0098] Предусмотрено соединение формулы XI, где содержание соединения формулы VI составляет 0,05 масс. % или меньше.

[0099] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы VI определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0100] Предусмотрено соединение формулы XI, где содержание соединения формулы IX составляет 0,05 масс. % или меньше.

[0101] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы IX определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0102] Предусмотрено соединение формулы XI, где содержание соединения формулы X составляет 0,05 масс. % или меньше.

[0103] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы X определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0104] Предусмотрено соединение формулы XI, где содержание соединения формулы XIII составляет 0,05 масс. % или меньше.
[0105] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XIII определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0106] Предусмотрено соединение формулы XI, где содержание соединения формулы XIV составляет 0,05 масс. % или меньше.
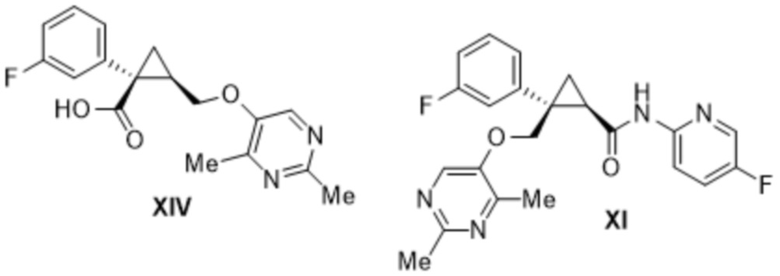
[0107] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XIII определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0108] Предусмотрено соединение формулы XI, где содержание соединения формулы XV составляет 0,05 масс. % или меньше.

[0109] Предусмотрено соединение формулы XI, описанное выше, где содержание соединения формулы XV определено с помощью высокоэффективной жидкостной хроматографии (HPLC).
[0110] Любые из соединений, которые приведены выше в качестве примеров и используются в способах, описанных в настоящем описании, могут быть предусмотрены в стереохимически чистой форме, и предполагается, что они включены в объем настоящего изобретения. В одном варианте осуществления стереохимически чистое соединение содержит приблизительно более 75 масс. % одного стереоизомера соединения и приблизительно менее 25 масс. % другого стереоизомера, приблизительно более 80 масс. % одного стереоизомера соединения и приблизительно менее 20 масс. % другого стереоизомера соединения, приблизительно более 85 масс. % одного стереоизомера соединения и приблизительно менее 15 масс. % другого стереоизомера, приблизительно более 90 масс. % одного стереоизомера соединения и приблизительно менее 10 масс. % другого стереоизомера, приблизительно более 95 масс. % одного стереоизомера соединения и приблизительно менее 5 масс. % другого стереоизомера, приблизительно более 97 масс. % одного стереоизомера соединения и приблизительно менее 3 масс. % другого стереоизомера или приблизительно более 98 масс. % одного стереоизомера соединения и приблизительно менее 2 масс. % другого стереоизомера. В одном варианте осуществления стереохимически чистое соединение содержит приблизительно более 99 масс. % одного стереоизомера соединения и приблизительно менее 1 масс. % другого стереоизомера.
[0111] Как описано выше, в одном варианте осуществления соединение, которое описано в настоящем описании, может быть предусмотрено в виде соли, например, фармацевтически приемлемой соли.
[0112] Определенный вариант осуществления обеспечивает возможность получения соединения формулы XI, где содержание соединения формулы XII составляет 0,10 масс. % или меньше, содержание каждого из соединений формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV составляет 0,05 масс. % или меньше, и содержание всех родственных веществ, в том числе соединения формулы VI, формулы IX, формулы X, формулы XIII, формулы XIV и формулы XV, составляет 1,0 масс. % или меньше.
[0113] Определенный вариант осуществления обеспечивает возможность получения соединения формулы XI, где содержание соединения формулы XI составляет 97,0 масс. % или больше, 98,0 масс. % или больше или 98,5 масс. % или больше и 102,0 масс. % или меньше, 100,0 масс. %. или меньше, 99,9 масс. % или меньше, 99,0 масс. % или меньше или 98,9 масс. % или меньше. В настоящем документе содержание соединения формулы XI определено с помощью высокоэффективной жидкостной хроматографии (HPLC). Более конкретно, HPLC проводят в условиях, описанных в разделе "Тест на чистоту" следующих примеров, и содержание представлено численным значением, полученным путем деления площади пика, соответствующего соединению формулы XI, которое является образцом, на площадь пика, соответствующего стандартному продукту соединения формулы XI на хроматограмме.
[0114] Другой вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, содержащую соединение формулы XI или его кристаллы и фармацевтически приемлемую добавку. Фармацевтическая композиция может быть получена путем смешивания фармацевтически приемлемой добавки с соединением формулы XI или его кристаллами. Фармацевтическая композиция согласно настоящему изобретению может быть получена известным способом, например способом, описанным в общих правилах получения Японской фармакопеи 17-го издания.
Примеры
[0115] Далее настоящее изобретение будет подробно описано с использованием примеров. Однако настоящее изобретение не ограничивается этими примерами. Кроме того, сокращения, которые используются в следующих примерах, являются общепринятыми сокращениями, хорошо известными специалистам в данной области техники, и несколько сокращений описаны ниже.
[0116] Химические сдвиги в спектре протонного ядерного магнитного резонанса (1H-ЯМР) регистрируются в единицах δ (ppm) по отношению к тетраметилсилану, и константы взаимодействия записываются в герцах (Гц). В спектрах s, d, br и m соответственно означают синглет, дублет, широкий и мультиплет.
[0117] 1H-ЯМР и 13С-ЯМР спектры измеряли с использованием Varian 400, спектрометра 500 МГц или спектрометра ядерного магнитного резонанса типа JNM-AL400 (400 МГц) производства JEOL Ltd.
[0118] "Комнатная температура" в следующих примерах обычно означает температуру от приблизительно 10°C до приблизительно 35°C. Если не указано иное, "%" обозначает массовые проценты.
[0119] (A) Получение (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она (соединение формулы I)
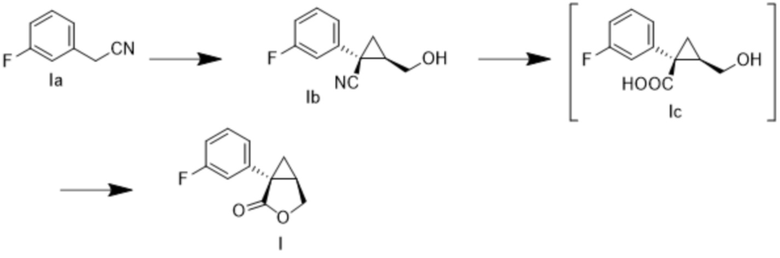
[0120] (A-1) Синтез (1S,2R)-1-(3-фторфенил)-2-(гидроксиметил)циклопропан-1-карбонитрила (соединение формулы Ib)
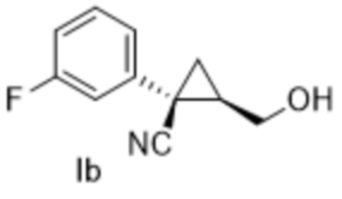
Раствор, полученный путем смешивания (3-фторфенил)ацетонитрила (120 кг, 888 моль, 1,0 экв.) и тетрагидрофурана (9,0 кг), добавляли по каплям при температуре от -10°C до 0°C к раствору, полученному путем смешивания трет-бутоксида натрия (188 кг, 1954 моль, 2,2 экв.) и тетрагидрофурана (890 кг). После перемешивания раствора в течение одного часа или больше к нему по каплям добавляли (2R)-2-(хлорметил)оксиран (94,5 кг, 1021 моль, 1,15 экв.) при температуре от -12°C до 18°C. После подтверждения завершения реакции анализом с помощью высокоэффективной жидкостной хроматографии (далее именуемой "HPLC"), к полученному добавляли воду (50 кг) и перемешивали. Растворитель отгоняли при пониженном давлении и получали раствор (1S,2R)-1-(3-фторфенил)-2-(гидроксиметил)циклопропан-1-карбонитрила, который использовали на следующей стадии.
[0121] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода
∙Ацетонитрил (Kanto Chemical Co., Inc., № по каталогу 01031-2B, для высокоэффективного жидкостного хроматографа или аналогичный продукт)
Перхлорная кислота (70%) (Wako Pure Chemical Industries, Ltd., № по каталогу 162-00695, химикат особого качества или аналогичный продукт)
Жидкость подвижной фазы А: жидкая смесь воды, ацетонитрила и хлорной кислоты (70%) (950:50:1, об./об./об.).
Жидкость подвижной фазы B: жидкая смесь воды, ацетонитрила и хлорной кислоты (70%) (100:900:1, об./об./об.).
Раствор: жидкая смесь воды и ацетонитрила (50:50, об./об.).
Средство для полоскания иглы в аппарате HPLC: жидкая смесь воды и ацетонитрила (50:50, об./об.).
Стандартный образец (3-фторфенил)ацетонитрила.
Условия HPLC
Детектор: ультрафиолетовый абсорбциометр Shimadzu SPD-20A (длина волны измерения: 262 нм) или аналогичный продукт.
Колонка: труба из нержавеющей стали с внутренним диаметром 4,6 мм и длиной 15 см, заполненная 2,7 мкм октадецилсилилированным силикагелем для жидкостной хроматографии.
Пример: Meteoric Core C18 (YMC), (эквивалент упаковки USP типа L1).
Температура колонки: постоянная температура приблизительно 30°С.
Подвижные фазы
Жидкость A: жидкая смесь воды, ацетонитрила и хлорной кислоты (70%) (950:50:1, об./об./об.).
Жидкость B: жидкая смесь воды, ацетонитрила и хлорной кислоты (70%) (100:900:1, об./об./об.).
Скорость потока: 0,9 мл/мин
Условия градиента:
Вводимое количество: 10 мкл.
Температура штатива для проб: постоянная температура приблизительно 5°С.
Диапазон измерения площади: 30 минут.
[0122] (A-2) Синтез (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она (соединение формулы I)

(A-2-1) Получение затравочных кристаллов
Бис(триметилсилил)амид натрия (раствор в тетрагидрофуране) (150 мл, 0,30 моль, 2,00 экв.) добавляли по каплям при температуре от 0°C до 7°C к раствору, полученному путем смешивания (3-фторфенил)ацетонитрила (20 г, 0,15 моль, 1,00 экв.) и тетрагидрофурана (150 мл). После перемешивания смеси в течение 0,5 часа к ней по каплям добавляли (2R)-2-(хлорметил)оксиран (11,8 мл, 0,15 моль, 1,00 экв.) при 17°C. Смесь перемешивали при 5°C в течение двух часов и перемешивали при комнатной температуре в течение трех дней, затем к ней добавляли воду (10 мл) и смесь перемешивали. Растворитель отгоняли при пониженном давлении и получали (1S,2R)-1-(3-фторфенил)-2-(гидроксиметил)циклопропан-1-карбонитрил и использовали его на следующей стадии.
К полученному (1S,2R)-1-(3-фторфенил)-2-(гидроксиметил)циклопропан-1-карбонитрилу добавляли этанол (150 мл) и 2 М водный раствор гидроксида калия (148 мл, 0,30 моль, 2,00 экв.), смесь перемешивали при 80°C в течение четырех часов и затем к ней добавляли воду (66 мл) и концентрированную соляную кислоту (47,5 мл, 0,57 моль, 3,80 экв.). Смесь перемешивали при 60°C в течение одного часа и дополнительно перемешивали при комнатной температуре в течение 45 часов. Осажденное твердое вещество фильтровали, промывали водой до тех пор, пока не было подтверждено, что показатель pH достиг пяти, и высушивали в потоке азота с получением тем самым (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она (23 г) с выходом 81% (общий выход для (3-фторфенил)ацетонитрила).
[0123] (A-2-2) Синтез (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она (соединение формулы I)
(A-2-2-стадия 1)
К раствору (1S,2R)-1-(3-фторфенил)-2-(гидроксиметил)циклопропан-1-карбонитрила добавляли этанол (237 кг), воду (237 кг) и 25% водный раствор гидроксида натрия (220 кг, 1376 моль, 1,55 экв.) и смесь перемешивали при внутренней температуре от 77°C до 87°C. После подтверждения завершения реакции с помощью анализа HPLC растворитель отгоняли при пониженном давлении, к смеси добавляли толуол (624 кг) и воду (60 кг), перемешивали и затем оставляли отстаиваться. После удаления органического слоя к водному слою добавляли толуол (624 кг), перемешивали и затем оставляли отстаиваться. Органический слой удаляли и использовали как таковой на следующей стадии.
[0124] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода, ацетонитрил, хлорная кислота (70%), жидкость подвижной фазы A, жидкость подвижной фазы B, раствор и ополаскиватель для иглы в аппарате HPLC были такими же, как в (A-1).
Стандартный образец (1S,2R)-1-(3-фторфенил)-2-(гидроксиметил)циклопропан-1-карбонитрила.
Условия HPLC:
такие же, как в (A-1).
[0125] (A-2-2-стадия 2)
Толуол (409 кг) и 35% соляную кислоту (287 кг, 2753 моль, 3,10 экв.) добавляли к раствору, полученному на (A-2-2-стадия 1). Смесь перемешивали при внутренней температуре от 55°C до 65°C, и окончание реакции подтверждали анализом HPLC. После подтверждения того, что внутренняя температура достигла 35°C, смесь оставляли отстаиваться, водный слой удаляли, затем к органическому слою добавляли толуол (172 кг) и 7% водный раствор гидрокарбоната натрия (482 кг), перемешивали и затем оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли воду (480 кг), перемешивали и затем оставляли отстаиваться. Водный слой удаляли и рассчитывали содержание (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она в органическом слое. Растворитель отгоняли при пониженном давлении и затем к нему добавляли этанол (614 кг). После отгонки растворителя при пониженном давлении к полученному добавляли этанол так, чтобы общий объем достиг количества, вдвое превышающего содержание (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она.
(1S,5R)-1-(3-Фторфенил)-3-оксабицикло[3.1.0]гексан-2-он нагревали и растворяли при перемешивании при внутренней температуре от 60°C до 65°C, и к полученному добавляли количество воды, равное 0,8-кратному содержанию (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она. После охлаждения к полученному добавляли 60 г затравочных кристаллов при внутренней температуре, составляющей от 40°C до 50°C, и подтверждали осаждение кристаллов. Смесь перемешивали при внутренней температуре от 40°C до 50°C в течение одного часа или дольше и охлаждали до температуры от -5°C до 5°C или ниже при от -10°C/ч. до -20°C/ч., и выпавшее в осадок твердое вещество фильтровали и промывали этанолом. Полученное твердое вещество высушивали при пониженном давлении при внешней температуре 45°C или ниже с получением (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она (103 кг) с выходом 60% (общий выход из (3-фторфенил)ацетонитрила).
[0126] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода, ацетонитрил, хлорная кислота (70%), жидкость подвижной фазы A, жидкость подвижной фазы B, раствор и ополаскиватель для иглы в аппарате HPLC были такими же, как в (A-1).
Раствор (1S,2R)-1-(3-фторфенил)-2-(гидроксиметил)циклопропан-1-карбоновой кислоты (концентрация приблизительно 0,5 мг/мл)
Условия HPLC:
Детектор, колонка, температура колонки, подвижные фазы, скорость потока, количество впрыска и температура стойки для образцов были такими же, как в (A-1).
Условия градиента:
Диапазон измерения площади: 40 минут.
[0127] Данные ЯМР
(1S,5R)-1-(3-Фторфенил)-3-оксабицикло[3.1.0]гексан-2-он:
1H ЯМР (500 МГц, DMSO-d6) δ 7,43-7,36 (m, 1H), 7,35-7,31 (m, 1H), 7,31-7,28 (m, 1H), 7,14-7,08 (m, 1H), 4,46 (dd, J=9,1, 4,6 Гц, 1H), 4,25 (d, J=9,1 Гц, 1H), 2,80 (dt, J=8,0, 4,6 Гц, 1H), 1,72 (dd, J=7,9, 4,8 Гц, 1H), 1,37 (t, J=4,8 Гц, 1H);
13C ЯМР (126 МГц, DMSO-d6) δ 175,35, 161,98 (d, JCF=243,1 Гц), 137,67 (d, JCF=8,2 Гц), 130,15 (d, JCF=8,6 Гц), 124,19 (d, JCF=2,8 Гц), 115,01 (d, JCF=22,4 Гц), 113,95 (d, JCF=20,9 Гц), 67,93, 30,70 (d, JCF=2,4 Гц), 25,57, 19,99.
[0128] (B) Получение 2,4-диметилпиримидин-5-ола (соединение формулы VI)
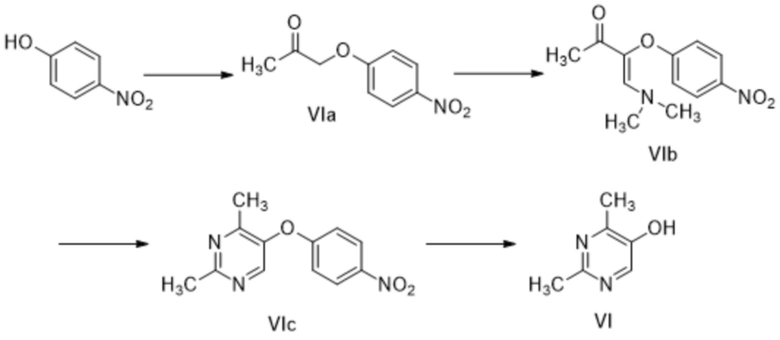
[0129] (B-1) Получение 1-(4-нитрофенокси)пропан-2-она (соединение формулы VIa)
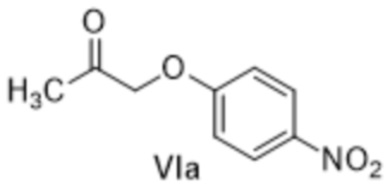
Смесь 4-нитрофенола (305,0 кг, 2192,5 ммоль), карбоната калия (318,2 кг, 2302,1 ммоль) и ацетонитрила (1678 кг) перемешивали при 60°C в течение 30 минут. Хлорацетон (нетто: 213,0 кг, 2302,1 ммоль) по каплям добавляли к реакционной смеси при 60°C, и полученную смесь перемешивали при 60°C (внешняя температура) в течение семи часов. Реакционную смесь охлаждали на ледяной бане и к реакционной смеси добавляли толуол (1847 кг) и воду (1830 кг) при той же температуре. Полученную реакционную смесь перемешивали при комнатной температуре и затем отделяли органический слой и промывали соленой водой (1525 кг воды и 170,8 кг соли). Растворитель отгоняли при пониженном давлении, полученный остаток растворяли в толуоле (1319 кг) при 55°C (внутренняя температура) и затем охлаждали до внутренней температуры 5°C, и выпавшее в осадок твердое вещество фильтровали. Полученное твердое вещество промывали подходящим количеством толуола с получением тем самым влажного продукта (выход сухого эквивалента 343,9 кг, выход 80%), представляющего собой указанное в заголовке соединение.
1H-ЯМР (CD3Cl) δ (ppm): 2,31 (3H, s), 4,67 (2H, s), 6,95 (2H, d, J=9,3 Гц), 8,22 (2H, d, J=9,3 Гц).
[0130] (B-2) Получение (Z)-4-(диметиламино)-3-(4-нитрофенокси)бут-3-ен-2-она (соединение формулы VIb)

Толуол (1785 кг) добавляли к 1-(4-нитрофенокси)пропан-2-ону (сухой эквивалент: 343,9 кг, 1762,1 ммоль) и частично концентрировали и затем добавляли N,N-диметилформамид диметилацеталь (231,0 кг, 1938,3 ммоль) и перемешивали при 78°C (внутренняя температура) в течение 20 часов. К реакционной смеси добавляли толуол (595 кг) при той же температуре и к полученному добавляли метанол (163 кг) при внутренней температуре 55°C, выдерживали в течение 30 минут и затем охлаждали до 5°C. Выпавшее в осадок твердое вещество фильтровали. Полученное твердое вещество промывали подходящим количеством толуола с получением тем самым влажного продукта (выход сухого эквивалента 159,0 кг, выход 36%), представляющего собой указанное в заголовке соединение.
1H-ЯМР (CD3Cl) δ (ppm): 2,00 (3H, brs), 3,01 (6H, s), 6,90-7,16 (2H, brm), 7,16-7,46 (1H, brs), 8,22 (2H, d, J=8,8 Гц).
[0131] Кроме того, соединение формулы VIb также можно получить способом, описанным ниже.
(B-2-a) Получение (Z)-4-(диметиламино)-3-(4-нитрофенокси)бут-3-ен-2-она (соединение формулы VIb)

Ацетонитрил (15 мл) добавляли к 1-(4-нитрофенокси)пропан-2-ону (15,0 г, 76,9 ммоль) и 4-нитрофенолу (802 мг, 5,76 ммоль) и к смеси добавляли N,N-диметилформамиддиметилацеталь (15,4 мл,115 ммоль) и перемешивали при 78°C (внешняя температура) в течение 19 часов. К реакционной смеси добавляли толуол (300 мл) при 50°C (внешняя температура) и охлаждали до 5°C (внешняя температура), и выпавшее в осадок твердое вещество фильтровали. Полученное твердое вещество промывали подходящим количеством толуола и затем высушивали при 50°C при пониженном давлении с получением указанного в заголовке соединения (12,4 г, выход 64%).
[0132] (B-2-b) Получение (Z)-4-(диметиламино)-3-(4-нитрофенокси)бут-3-ен-2-она (соединение формулы VIb)

Смесь 4-нитрофенола (50,0 г, 359 ммоль), карбоната калия (52,2 г, 377 ммоль) и ацетонитрила (350 мл) перемешивали при 60°C (внешняя температура) в течение одного часа. К реакционной смеси по каплям добавляли хлорацетон (31,5 мл, 377 ммоль) при той же температуре, и полученную смесь перемешивали при той же температуре в течение 25 часов. Реакционную смесь перемешивали в охлажденной льдом воде и к реакционной смеси добавляли толуол (350 мл) и воду (300 мл) при 13°C (внутренняя температура). Полученную реакционную смесь перемешивали при комнатной температуре и затем отделяли органический слой и промывали соленой водой (250 мл воды и 27,8 г соли). Растворитель отгоняли из этого органического слоя (168,5 г) при пониженном давлении и к полученному остатку добавляли ацетонитрил (60 мл) (1-(4-нитрофенокси)пропан-2-он (соединение формулы VIa); нетто: 16,7 г, 85,6 ммоль) для отгонки растворителя при пониженном давлении. После добавления ацетонитрила (60 мл) к полученному остатку для отгонки растворителя при пониженном давлении, к остатку добавляли ацетонитрил (16,7 мл) и растворяли в нем, и затем добавляли N,N-диметилформамиддиметилацеталь (17,2 мл, 128 ммоль) и перемешивали при 78°C (внешняя температура) в течение 19,5 часов. Толуол (200 мл) добавляли к реакционной смеси при той же температуре и охлаждали до 6°C (внешняя температура), и выпавшее в осадок твердое вещество фильтровали. Полученное твердое вещество промывали подходящим количеством толуола и затем высушивали при 50°C при пониженном давлении с получением указанного в заголовке соединения (12,3 г, выход 58%).
[0133] (B-2-c) Получение (Z)-4-(диметиламино)-3-(4-нитрофенокси)бут-3-ен-2-она (соединение формулы VIb)

Триэтиламин (5,3 мл, 38,2 ммоль) и хлорацетон (3,0 мл, 36,4 ммоль) добавляли к смеси 4-нитрофенола (5,57 г, 40,1 ммоль) и ацетонитрила (17 мл) при 18°C (внутренняя температура) и перемешивали при 55°C (внешняя температура) в течение 69 часов. К реакционной смеси добавляли N,N-диметилформамиддиметилацеталь (7,3 мл, 54,6 ммоль) при 30°C (внешняя температура) и перемешивали при 80°C (внешняя температура) в течение 43 часов. К реакционной смеси добавляли N,N-диметилформамиддиметилацеталь (7,3 мл, 54,6 ммоль) при 36°C (внутренняя температура) и перемешивали при 80°C (внешняя температура) в течение 18,5 часа. Внутреннюю температуру понижали до 45°C или ниже, затем к полученному добавляли толуол (40 мл) и отгоняли растворитель при пониженном давлении. К полученному остатку добавляли толуол (111 мл) и ацетонитрил (5,6 мл) и перемешивали при 80°C (внешняя температура), к полученному добавляли метанол (4,4 мл) и затем охлаждали до 6°C (внешняя температура) и осажденное твердое вещество фильтровали. Полученное твердое вещество промывали подходящим количеством толуола и затем высушивали при 50°C при пониженном давлении с получением указанного в заголовке соединения (3,97 г, выход 44%).
[0134] (B-2-d) Получение (Z)-4-(диметиламино)-3-(4-нитрофенокси)бут-3-ен-2-она (соединение формулы VIb)

Смесь 4-нитрофенола (50,0 г, 359 ммоль), карбоната калия (49,6 г, 359 ммоль) и ацетонитрила (350 мл) перемешивали при комнатной температуре в течение 25 минут. К смеси по каплям добавляли хлорацетон (33,3 г, 359 ммоль) при той же температуре и смесь перемешивали при 60°C (внешняя температура) в течение 14 часов. К полученной реакционной смеси (смесь 1-(4-нитрофенокси)пропан-2-она (соединение формулы VIa) и 4-нитрофенола (97:3)) добавляли толуол (350 мл) и воду (300 мл) и перемешивали. Органический слой отделяли и промывали водой (250 мл). Растворитель в органическом слое отгоняли при пониженном давлении, к полученному остатку (284 г) добавляли толуол (500 мл) и растворитель отгоняли при пониженном давлении. К полученному остатку (149 г) добавляли толуол (103 г) и N,N-диметилформамиддиметилацеталь (52,9 мл, 395 ммоль) и перемешивали при 80°C (внешняя температура) в течение 15 часов. Полученную реакционную смесь охлаждали до комнатной температуры, выдерживали в течение трех часов, затем охлаждали до 5°C (внешняя температура) и выдерживали в течение двух часов. Выпавшее в осадок твердое вещество фильтровали и промывали подходящим количеством толуола. Твердое вещество высушивали при 50°C при пониженном давлении с получением указанного в заголовке соединения (55,7 г, выход 62%).
[0135] (B-3) Получение 2-4-диметил-5-(4-нитрофенокси)пиримидина (соединение формулы VIc)

20% раствор этоксида натрия в этаноле (518,8 кг, 1524,9 моль), этанол (213 кг) и хлорид ацетамидиния (нетто: 144,2 кг, 1524,9 ммоль) добавляли и перемешивали при 25°C (внутренняя температура) в течение 94 минут. Подавали (Z)-4-(диметиламино)-3-(4-нитрофенокси)бут-3-ен-2-он (сухой эквивалент: 159,0 кг, 635,4 ммоль) и смесь перемешивали при 60°C (внутренняя температура) в течение пяти часов. Реакционную смесь охлаждали до 5°C (внутренняя температура), затем к ней добавляли воду (2385 кг) и выпавшее в осадок твердое вещество фильтровали. Полученное твердое вещество промывали подходящим количеством воды с получением тем самым влажного продукта (выход в сухом эквиваленте 146,1 кг, выход 94%), представляющего собой указанное в заголовке соединение.
1H-ЯМР (CD3Cl) δ (ppm): 2,40 (3H, s), 2,75 (3H, s), 6,96 (2H, d, J=9,0 Гц), 8,24 (2H, d, J=9,0 Гц), 8,32 (1H, s).
[0136] (B-4) Получение 2,4-диметилпиримидин-5-ола (соединение формулы VI)

Смесь 2-4-диметил-5-(4-нитрофенокси)пиримидина (сухой эквивалент: 146,1 кг, 595,8 ммоль), метанола (579 кг) и водного раствора гидроксида натрия (71,5 кг гидроксида натрия и 77,5 кг воды, 1787,3 ммоль) перемешивали при 60°C (внутренняя температура) в течение 13 часов. К реакционной смеси добавляли толуол (1264 кг) и воду (584 кг), перемешивали и оставляли отстаиваться, и затем водный слой отделяли и концентрировали при пониженном давлении. Полученную концентрированную жидкость охлаждали до 8°C (внутренняя температура), затем к ней добавляли толуол (316 кг), и к полученному добавляли концентрированную соляную кислоту (310,3 кг, 2978,8 ммоль) при внутренней температуре от 0°C до 15°C. К смеси добавляли этилацетат (328 кг), чтобы отделить жидкость. Водный слой отделяли и промывали смесью толуол-этилацетат (316 кг-328 кг). К полученному водному слою добавляли этилацетат (1311 кг), водный слой охлаждали до 5°C (внутренняя температура) и к нему добавляли 5 моль/л водный раствор гидроксида натрия так, чтобы показатель pH реакционной смеси достигал 6,5. Органический слой отделяли и водный слой снова экстрагировали этилацетатом (1311 кг). Полученный органический слой объединяли и затем промывали водой (44 кг) и растворитель отгоняли при пониженном давлении. К полученному остатку добавляли толуол (379 кг) для суспендирования и остаток перемешивали при 50°C (внутренняя температура) в течение двух часов. Смесь охлаждали до 10°C (внутренняя температура), перемешивали в течение двух часов и затем фильтровали. Полученное твердое вещество промывали подходящим количеством толуола и затем высушивали при 45°C при пониженном давлении с получением указанного в заголовке соединения (63,7 кг, 86%).
1H-ЯМР (CD3Cl) δ (ppm): 2,51 (3H, s), 2,65 (3H, s), 8,02 (1H, s), 10,01 (1H, brs).
[0137] (C) Получение (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты (соединение формулы IX)
[0138] (C-1) Получение [(1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил]диметанола (соединение формулы II)

Метанол (58,3 кг, 1821 моль, 5,00 экв.) добавляли к смеси (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она (70 кг, 364 моль, 1,00 экв.), толуола (350 л), тетрагидрофурана (350 л) и борогидрида натрия (13,8 кг, 364 моль, 1,00 экв.) и перемешивали при 50°C или ниже. После подтверждения завершения реакции с помощью анализа HPLC добавляли реакционную жидкость и толуол (140 л) к 20% водному раствору лимонной кислоты (350 кг), перемешивали и затем оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли 5% водный раствор гидрокарбоната натрия (140 кг), перемешивали и затем оставляли отстаиваться. Водный слой удаляли, к органическому слою добавляли 5% водный раствор хлорида натрия (140 кг), перемешивали и затем оставляли отстаиваться. Водный слой удаляли, растворитель отгоняли при пониженном давлении и получали раствор [(1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил]диметанола (эквивалент 67,2 кг, выход 94%) в толуоле и использовали на следующей стадии.
[0139] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода
Ацетонитрил (Kanto Chemical Co., Inc., № по каталогу 01031-2B, для высокоэффективного жидкостного хроматографа или аналогичный продукт)
Трифторуксусная кислота (Wako Pure Chemical Industries, Ltd., № по каталогу 208-02741, химикат особого качества или аналогичный продукт)
Жидкость подвижной фазы А: жидкая смесь воды и трифторуксусной кислоты (1000/1, об./об.).
Жидкость подвижной фазы B: жидкая смесь ацетонитрила и трифторуксусной кислоты (1000/1, об./об.).
Раствор: жидкая смесь воды, ацетонитрила и трифторуксусной кислоты (500/500/1, об./об./об.).
Средство для полоскания иглы в аппарате HPLC: жидкая смесь воды и ацетонитрила (100/900, об./об.).
Стандартный образец (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она.
Условия HPLC:
Детектор: ультрафиолетовый абсорбциометр Shimadzu SPD-20A (длина волны измерения: 220 нм) или аналогичный продукт.
Колонка: труба из нержавеющей стали с внутренним диаметром 4,6 мм и длиной 15 см, заполненная 3,5 мкм октадецилсилилированным силикагелем для жидкостного хроматографа.
Пример: SunFire C18 (Waters) (эквивалент упаковки L1 USP).
Температура колонки: постоянная температура приблизительно 40°С.
Подвижные фазы
Жидкость A: жидкая смесь воды и трифторуксусной кислоты (1000/1, об./об.).
Жидкость B: жидкая смесь ацетонитрила и трифторуксусной кислоты (1000/1, об./об.).
Скорость потока: Постоянная скорость потока приблизительно 1,0 мл/мин.
Условия градиента:
Вводимое количество: 5 мкл.
Температура штатива для проб: постоянная температура приблизительно 10°С.
Средство для ополаскивания иглы: жидкая смесь воды и ацетонитрила (10/90, об./об.).
Целевой диапазон измерения площади: до 34 минут.
[0140] (C-2) Получение [(1R, 2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил]метил=ацетата (соединение формулы III)

Циклогексилмагнийхлорид (1 моль/кг раствора в тетрагидрофуране) (349 кг, 349 моль, 1,02 экв.) добавляли к смеси раствора [(1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил]диметанола в толуоле (эквивалент 67,2 кг [(1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил]диметанола, 342 моль, 1,00 экв.) и тетрагидрофурана (269 л) и перемешивали при 60°C или ниже. Полученный раствор добавляли к смеси этилацетата (336 л) и ацетилхлорида (29,6 кг, 377 моль, 1,10 экв.) и перемешивали при 20°C или ниже. Окончание реакции подтверждали анализом HPLC, добавляли воду (202 л), перемешивали и затем оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли 6% водный раствор гидрокарбоната натрия (215 кг), перемешивали и затем оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли 4% водный раствор хлорида натрия (175 кг), перемешивали и затем оставляли отстаиваться. Водный слой удаляли, растворитель отгоняли при пониженном давлении, и к нему добавляли толуол (134 л). Растворитель отгоняли при пониженном давлении и получали раствор [(1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил]метил=ацетата в толуоле, который использовали на следующей стадии.
[0141] Условия HPLC для подтверждения реакции
Реагенты и подвижные фазы
Очищенная вода, ацетонитрил, трифторуксусная кислота, жидкость подвижной фазы A, жидкость подвижной фазы B и средство для ополаскивания иглы в аппарате для HPLC были такими же, как в (C-1).
Раствор: вода/ацетонитрил (500:500, об./об.).
Раствор [(1S,2R)-1-(3-фторфенил)циклопропан-1,2-диил]диметанола (концентрация приблизительно 0,5 мг/мл).
Условия HPLC
Детектор, колонка, температура колонки, подвижные фазы, скорость потока, количество впрыска и температура стойки для образцов были такими же, как в (C-1).
Условия градиента:
Целевой диапазон измерения площади: до 44 минут.
[0142] (C-3) Получение [(1R,2S)-2-(3-фторфенил)-2-({[(4-метилфенил)сульфонил]окси}метил)циклопропил]метил=ацетата (соединение формулы IV)

Добавляли п-толуолсульфонилхлорид (71,8 кг, 377 моль, 1,10 экв.) в толуоле (34 л) и раствор ацетонитрила (69 л) к смеси раствора [(1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил]метил=ацетата в толуоле (эквивалент 81,6 кг [(1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил]метил=ацетата, 342 моль, 1,00 экв.), толуола (294 л) (включая количество толуола в растворе толуола), триэтиламина (69,3 кг, 685 моль, 2,00 экв.) и 1-метилимидазола (1,41 кг, 17 моль, 0,05 экв.) при 30°C или ниже и затем перемешивали при внешней температуре 8°C. После подтверждения завершения реакции с помощью анализа HPLC, к полученному добавляли ацетонитрил (34 л) и перемешивали. Гидрохлорид триэтиламина удаляли путем фильтрования, отфильтрованное вещество промывали жидкой смесью толуола (51 л) и ацетонитрила (51 л) и перемешивали, в результате чего получали раствор [(1R,2S)-2-(3-фторфенил)-2-({[(4-метилфенил)сульфонил]окси}метил)циклопропил]метил=ацетата, который использовали на следующей стадии.
[0143] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода, ацетонитрил, трифторуксусная кислота, жидкость подвижной фазы A, жидкость подвижной фазы B и средство для ополаскивания иглы в аппарате для HPLC были такими же, как в (C-1).
Раствор: Ацетонитрил
Раствор [(1R,2S)-2-(3-фторфенил)-2-(гидроксиметил)циклопропил]метил=ацетата в толуоле (конечный продукт предыдущей стадии)
Условия HPLC
такие же, как в (C-1).
[0144] (C-4) Получение [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метил=ацетата (соединение формулы V)

Трет-бутоксид калия (46,1 кг, 411 моль, 1,20 экв.) добавляли к смеси 2,4-диметилпиримидин-5-ола (51,0 кг, 411 моль, 1,20 экв.), N-метилпирролидона (273 л) и ацетонитрила (85 л) и перемешивали при внешней температуре 50°C. К полученному раствору добавляли раствор [(1R,2S)-2-(3-фторфенил)-2-({[(4-метилфенил)сульфонил]окси}метил)циклопропил]метил=ацетата и перемешивали при внешней температуре 50°С. После подтверждения завершения реакции с помощью анализа HPLC, к полученному добавляли воду (547 л), перемешивали и затем оставляли отстаиваться при 30°C или ниже. После разделения жидкости органический слой сохраняли, к водному слою добавляли толуол (220 л), перемешивали и затем оставляли отстаиваться. Водный слой удаляли и органический слой перемешивали, в результате чего получали раствор [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метил=ацетата, используемый на следующей стадии.
[0145] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода, ацетонитрил, трифторуксусная кислота, жидкость подвижной фазы A, жидкость подвижной фазы B и средство для ополаскивания иглы в аппарате для HPLC были такими же, как в (C-1).
Раствор: Ацетонитрил
Раствор [(1R,2S)-2-(3-фторфенил)-2-({[(4-метилфенил)сульфонил]окси}метил)циклопропил]метил=ацетата (концентрация приблизительно 1 мг/мл)
Условия HPLC
такие же, как в (C-1).
[0146] (C-5) Получение [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метанола (соединение формулы VII)

Воду (734 л) и 25% водный раствор гидроксида натрия (107 л, 856 моль, 2,50 экв.) добавляли к раствору [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метил=ацетата и перемешивали при внешней температуре 40°C. После подтверждения завершения реакции с помощью анализа HPLC продукт реакции охлаждали и оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли водный раствор дигидрофосфата натрия (41,4 кг дигидрофосфата натрия и 255 л воды), перемешивали и затем оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли воду (204 л), перемешивали и затем оставляли отстаиваться. Водный слой удаляли, к нему добавляли толуол (86 л) и получали раствор [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метанола в толуоле, используемый на следующей стадии.
[0147] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода, ацетонитрил, трифторуксусная кислота, жидкость подвижной фазы A, жидкость подвижной фазы B и средство для ополаскивания иглы в аппарате для HPLC были такими же, как в (C-1).
Раствор: жидкая смесь воды и ацетонитрила (1/1, об./об.).
Раствор [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метил=ацетата (концентрация приблизительно 1 мг/мл).
Условия HPLC
Те же, что и в (C-1), за исключением того, что длина волны измерения детектора составляла 283 нм.
[0148] (C-6) Получение (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты (соединение формулы IX)

(1) Получение затравочных кристаллов
Смесь раствора [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метанола в толуоле (эквивалент 46,48 кг [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метанола, 154 моль, 1,00 экв.), свободный радикал 2,2,6,6-тетраметилпиперидин-1-оксила (0,48 кг, 3,1 моль, 0,02 экв.), толуол (186 л) и водный раствор дигидрофосфата натрия (6,1 кг дигидрофосфата натрия, 51 моль, 0,33 экв. и 56 кг воды) охлаждали при внешней температуре 7°C, добавляли 12% водный раствор гипохлорита натрия (9,1 кг, 15,4 моль, 0,10 экв.) и перемешивали. К смеси добавляли 25% водный раствор хлорита натрия (61,2 кг, 169 моль, 1,10 экв.) при 25°C. После подтверждения завершения реакции с помощью анализа HPLC, к полученному добавляли водный раствор сульфита натрия (9,7 кг сульфита натрия и 93 л воды) и перемешивали. К смеси добавляли 25% водный раствор гидроксида натрия (39 л), перемешивали при внешней температуре 70°C в течение одного часа, охлаждали до 50°C или ниже и оставляли отстаиваться. Водный слой сохраняли, к органическому слою добавляли воду (23 л), перемешивали и затем оставляли отстаиваться. Органический слой удаляли, водный слой смешивали, добавляли толуол (139 л) и 5 н. водный раствор соляной кислоты с регулированием pH до 2,5-4,0 и смесь оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли воду (93 л), перемешивали и затем оставляли отстаиваться. Водный слой удаляли и растворитель отгоняли из полученного органического слоя при пониженном давлении. Добавление ацетонитрила (232 л) и отгонку растворителя при пониженном давлении проводили один или несколько раз. К смеси добавляли ацетонитрил (232 л), получали раствор (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты и затем растворитель частично отгоняли при пониженном давлении. Добавляли ацетонитрил к концентрированному остатку, содержащему по сути 47,7 кг (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты, для доведения общего объема до 232 л. Эту смесь растворяли при перемешивании при внешней температуре 65°C. После охлаждения смеси было подтверждено осаждение кристаллов. Смесь нагревали до внутренней температуры 40°C или выше и охлаждали до внутренней температуры -15°C или ниже при -20°C/H, и выпавшее в осадок твердое вещество фильтровали и промывали ацетонитрилом. Полученное твердое вещество высушивали при внешней температуре 50°C и пониженном давлении и получали 43,5 кг (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты.
(2) Получение (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты (соединение формулы IX).
Смесь раствора [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метанола в толуоле (эквивалент 82,8 кг [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метанола, 274 моль, 1,00 экв.), свободный радикал 2,2,6,6-тетраметилпиперидин-1-оксила (0,856 кг, 5,48 моль, 0,02 экв.), толуол (25 л) и водный раствор дигидрофосфата натрия (10,8 кг дигидрофосфата натрия, 90 моль, 0,33 экв. и 82,8 кг воды) охлаждали при внешней температуре 8°C, добавляли 12% водный раствор гипохлорита натрия (48,5 кг, 82 моль, 0,30 экв.) и перемешивали при 35°C или ниже. После подтверждения хода реакции с помощью анализа HPLC смесь оставляли отстаиваться и удаляли водный слой. 25% водный раствор хлорита натрия (119 кг, 329 моль, 1,20 экв.) добавляли к смеси органического слоя и водного раствора дигидрофосфата натрия (16,4 кг дигидрофосфата натрия, 137 моль, 0,50 экв. и 82,8 кг воды) при температуре 35°C или ниже. После подтверждения завершения реакции с помощью анализа HPLC, к полученному добавляли водный раствор сульфита натрия (17,3 кг сульфита натрия и 166 л воды) и перемешивали. К реакционной смеси добавляли 25% водный раствор гидроксида натрия (85,9 л), нагревали и перемешивали при внешней температуре 70°C, охлаждали до 50°C или ниже и оставляли отстаиваться. Водный слой сохраняли, к органическому слою добавляли воду (41 л), перемешивали и затем оставляли отстаиваться. Органический слой удаляли, водный слой смешивали, добавляли толуол (248 л) и 5 н. водный раствор соляной кислоты с регулированием pH до 2,5-4,0 и смесь оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли воду (166 л), перемешивали и затем оставляли отстаиваться. Водный слой удаляли и растворитель отгоняли из полученного органического слоя при пониженном давлении. Добавление ацетонитрила (414 л) и отгонку растворителя при пониженном давлении проводили один или несколько раз. К смеси добавляли ацетонитрил (414 л), получали раствор (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты и затем растворитель частично отгоняли при пониженном давлении. Добавляли ацетонитрил к концентрированному остатку, содержащему по сути 84,9 кг (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты, для доведения общего объема до 497 л. Эту смесь растворяли при перемешивании при внешней температуре 65°C. После охлаждения к смеси добавляли 83 г затравочных кристаллов и подтверждали осаждение кристаллов. Смесь нагревали до внутренней температуры 40°C или выше и охлаждали до 10°C или ниже при -20°C/H, и выпавшее в осадок твердое вещество фильтровали и промывали ацетонитрилом. Полученное твердое вещество высушивали при внешней температуре 60°C или ниже при пониженном давлении с получением 62 кг (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты с выходом 54% (общий выход для (1S,5R)-1-(3-фторфенил)-3-оксабицикло[3.1.0]гексан-2-она).
[0149] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода, ацетонитрил, трифторуксусная кислота, жидкость подвижной фазы A, жидкость подвижной фазы B и средство для ополаскивания иглы в аппарате для HPLC были такими же, как в (C-1).
Раствор: жидкая смесь воды и ацетонитрила (1/1, об./об.).
Раствор [(1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропил]метанола (концентрация приблизительно 1 мг/мл)
Условия HPLC
Те же, что и в (C-1), за исключением того, что длина волны измерения детектора составляла 283 нм.
[0150] Данные ЯМР
(1R,2S)-2-(((2,4-Диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)циклопропанкарбоновая кислота:
1H ЯМР (500 МГц, DMSO-d6) δ 12,47 (s, 1H), 8,17 (s, 1H), 7,39 (td, J=8,0, 6,4 Гц, 1H), 7,29 (d, J=7,9 Гц, 1H), 7,27-7,22 (m, 1H), 7,10 (td, J=8,3, 2,1 Гц, 1H), 4,63 (d, J=10,2 Гц, 1H), 4,30 (d, J=10,2 Гц, 1H), 2,46 (s, 3H), 2,26 (s, 3H), 2,13 (dd, J=7,7, 6,6 Гц, 1H), 1,63-1,54 (m, 2H);
13C ЯМР (126 МГц, DMSO-d6) δ 172,65, 162,48 (d, JCF= 243,6 Гц), 159,08, 156,24, 149,45, 145,15 (d, JCF=7,5 Гц), 139,60, 130,71 (d, JCF=8,5 Гц), 124,79 (d, JCF=2,6 Гц), 115,60 (d, JCF=21,8 Гц), 114,32 (d, JCF=20,8 Гц), 71,15, 33,92 (d, JCF=2,0 Гц), 26,46, 24,96, 19,72, 18,70.
[0151] (D) Получение (1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамида (лемборексант: соединение формулы XI)

Смесь (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты (62,4 кг, 197 моль, 1,00 экв.), 5-фторпиримидин-2-амина (24,3 кг, 217 моль, 1,10 экв.), этилацетата (499 л), N,N-диизопропилэтиламина (53,5 кг, 414 моль, 2,10 экв.) и ангидрида 1-пропанфосфорной кислоты (50% раствор этилацетата) (188 кг, 296 моль, 1,50 эквивалента) нагревали при внешней температуре 70°C, и подтверждали окончание реакции анализом HPLC. После охлаждения реакционной жидкости к ней добавляли 312 л очищенной воды, перемешивали и затем оставляли отстаиваться. После удаления водного слоя водный раствор карбоната натрия (68,9 кг карбоната натрия и 312 л воды) добавляли к органическому слою, перемешивали и затем оставляли отстаиваться. После удаления водного слоя к органическому слою добавляли очищенную воду (187 л), перемешивали и затем оставляли отстаиваться. Водный слой удаляли и к органическому слою добавляли очищенную воду (187 л), перемешивали и затем оставляли отстаиваться. Водный слой удаляли и органический слой фильтровали. Линию осветительной фильтрации промывали этилацетатом и затем частично отгоняли растворитель при пониженном давлении. Смесь, полученную путем добавления этилацетата к концентрированному остатку (содержащему по сути 75,3 кг лемборексанта) так, чтобы общий объем достигал 256 л, нагревали и растворяли при перемешивании при внешней температуре 60°C и затем охлаждали до 45°C или ниже путем добавления к ней н-гептана (12,8 кг). К полученному добавляли этилацетат (31 л), смесь охлаждали до 35°C или ниже и затем к ней добавляли н-гептан (670 кг). После этого суспензию охлаждали до 10°C или ниже, твердое вещество в смеси фильтровали и промывали жидкой смесью этилацетата и н-гептана. Полученное твердое вещество высушивали при внешней температуре 60°C при пониженном давлении с получением лемборексанта (70 кг) с выходом 87%.
[0152] Условия HPLC для подтверждения описанной выше реакции
Реагенты и подвижные фазы
Очищенная вода, ацетонитрил, трифторуксусная кислота, жидкость подвижной фазы A, жидкость подвижной фазы B и средство для ополаскивания иглы в аппарате для HPLC были такими же, как в (C-1).
Раствор: жидкая смесь воды и ацетонитрила (1/1, об./об.).
Стандартный образец (1R,2S)-2-{[(2,4-диметилпиримидин-5-ил)окси]метил}-2-(3-фторфенил)циклопропанкарбоновой кислоты
Условия HPLC
Те же, что и в (C-1), за исключением того, что длина волны измерения детектора составляла 283 нм.
[0153] Данные ЯМР
(1R,2S)-2-(((2,4-диметилпиримидин-5-ил)окси)метил)-2-(3-фторфенил)-N-(5-фторпиридин-2-ил)циклопропанкарбоксамид:
1H ЯМР (500 МГц, DMSO-d6) δ 11,19 (s, 1H), 8,31 (d, J=3,0 Гц, 1H), 8,12 (s, 1H), 7,94-7,85 (m, 1H), 7,62 (tt, J=8,7, 3,1 Гц, 1H), 7,44 (dd, J=10,6, 1,5 Гц, 1H), 7,41-7,40 (m, 1H), 7,39 (s, 1H), 7,14-7,06 (m, 1H), 4,67 (d, J=10,2 Гц, 1H), 4,29 (t, J=9,9 Гц, 1H), 2,63 (t, J=7,0 Гц, 1H), 2,38 (s, 3H), 2,03 (s, 3H), 1,76-1,64 (m, 1H), 1,49 (dd, J=8,0, 4,8 Гц, 1H);
13C ЯМР (125 МГц, DMSO-d6) δ 168,68, 161,98 (d, JCF= 242,3 Гц), 158,46,155,15, 155,38 (d, JCF=247,9 Гц), 148,90, 148,51, 145,00 (d, JCF=7,7 Гц), 139,37, 135,15 (d, JCF= 24,9 Гц), 130,06 (d, JCF=8,4 Гц), 125,05 (d, JCF=19,5 Гц), 124,70 (d, JCF=2,6 Гц), 115,71 (d, JCF=21,7 Гц), 114,20 (d, JCF=4,1 Гц), 113,70 (d, JCF=20,9 Гц), 70,80, 34,09 (d, JCF=1,9 Гц), 26,90, 24,38, 18,37, 17,78.
[0154] Тест на чистоту
Стандартный продукт, представляющий собой соединение формулы XI, полученный с помощью способа из публикации международной заявки WO 2013/123240, использовали в качестве внешнего контраста, и площади пиков, соответствующие примесям в стандартном продукте и в образце, сравнивали друг с другом с вычислением таким образом массового процента каждого соединения в образце. Общее количество обнаруженных примесей, превышающее 0,05 масс. %, рассматривалось как общее содержание родственных веществ.
[0155] Способ тестирования: жидкостная хроматография, ультрафиолетовый абсорбциометр и площадь пика.
Способ количественного определения соединения формулы XI
Соединение формулы XI (%)=AT/CT x CS/AS x 100
AT: площадь пика соединения формулы XI в растворе образца
AS: площадь пика соединения формулы XI в стандартном растворе
CT: концентрация соединения формулы XI в растворе образца (мг/мл)
CS: концентрация соединения формулы XI в стандартном растворе (мг/мл)
Каждое родственное вещество (%)=AT/CT x CS/AS
Общее количество родственных веществ (%)=общее количество родственных веществ в растворе образца
AT: площадь пика каждого родственного вещества в растворе образца
AS: площадь пика соединения формулы XI в 1% стандартном растворе
CT: концентрация соединения формулы XI в растворе образца (мг/мл)
CS: концентрация соединения формулы XI в стандартном растворе (мг/мл)
[0156] Способ анализа
Раствора образца: настоящий продукт растворяли в разбавленном растворе (приблизительно 0,5 мг/мл).
Стандартный раствор соединения формулы XI: стандартное вещество, представляющее собой соединение формулы XI, растворяли в разбавленном растворе (приблизительно 0,5 мг/мл).
1% стандартный раствор: стандартный раствор (приблизительно 0,5 мг/мл) соединения формулы XI разбавляли в 100 раз разбавленным раствором.
Разбавленный раствор: жидкая смесь метанола и воды (7:3).
Вводимое количество: 10 мкл.
Диапазон измерения площади: 70 минут после введения раствора образца.
[0157] Условия тестирования
Условия HPLC:
Длина волны измерения: 281 нм.
Колонка: труба из нержавеющей стали с внутренним диаметром 4,6 мм и длиной 15 см, заполненная 2,7 мкм октадецилсилилированным силикагелем для жидкостного хроматографа.
Пример: Meteoric Core C18 (YMC) (или аналогичный продукт).
Температура колонки: постоянная температура приблизительно 40°С.
Подвижные фазы
Жидкость A: жидкая смесь воды, ацетонитрила и формиата аммония (950:50:1, об./об./мас.).
Жидкость B: жидкая смесь ацетонитрила, воды и формиата аммония (900:100:1, об./об./мас.).
Скорость потока: Постоянная скорость потока приблизительно 1,0 мл/мин.
[0158] [Таблица 1]
Введение раствора мобильной фазы
[0159] Результаты анализа чистоты с использованием жидкостной хроматографии для соединения, представленного формулой XI, полученного в описанном выше примере, и соединений формулы XI, полученных в различных вариантах осуществления 1-5, в которых был проведен тот же тест, что и в примере, показаны в таблице 2.
[0160] [Таблица 2]
[0161] Время удерживания соединения, представленного формулой XI, составляло 28 ± 3 минуты. Относительное время удерживания каждой примеси по отношению к времени удерживания соединения формулы XI было таким, как описано ниже.
Соединение формулы XV: 0,08.
Соединение формулы VI: 0,11
Соединение формулы X: 0,16
Соединение формулы IX: 0,39
Соединение формулы XIV: 0,41
Соединение формулы XII: 0,76
Соединение формулы XIII: 1,36.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И СОЕДИНЕНИЯ, КОТОРЫЕ МОЖНО ИСПОЛЬЗОВАТЬ ДЛЯ СИНТЕЗА АНТАГОНИСТОВ РЕЦЕПТОРОВ ОРЕКСИНА-2 | 2013 |
|
RU2617696C2 |
| ЛЕКАРСТВЕННОЕ ВЕЩЕСТВО ЛЕМБОРЕКСАНТ И ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕГО | 2021 |
|
RU2840786C1 |
| ЦИКЛОПРОПАНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2571414C2 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ АМИНОДИГИДРОТИАЗИНА, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ВАСЕ | 2012 |
|
RU2593756C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ АНДРОГЕН-РЕЦЕПТОР-ПОЛОЖИТЕЛЬНЫХ ФОРМ РАКА | 2020 |
|
RU2817802C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРИМИДИН-1-ОЛОВОГО СОЕДИНЕНИЯ И ЕГО ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ | 2015 |
|
RU2681937C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ 1,3-БЕНЗОДИОКСОЛЬНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ | 2018 |
|
RU2814175C2 |
| ПРОИЗВОДНОЕ ДИ- И ТРИАЗОЛИЛПРОПАНА, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1996 |
|
RU2145605C1 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ МАКРОЦИКЛИЧЕСКИХ ИНГИБИТОРОВ ПРОТЕАЗЫ HCV | 2011 |
|
RU2628081C2 |
Настоящее изобретение относится к способу получения соединения формулы III. Предложенный способ включает: а) добавление реактива Гриньяра к смеси, содержащей соединение формулы II, толуол и тетрагидрофуран при 60°C или ниже; и b) добавление полученной смеси к смеси, содержащей ацетилхлорид и этилацетат при 20°C или ниже. Также предложены способы получения соединений формулы XI, формулы IX, формулы VII, формулы V и формулы IV. Изобретение позволяет обеспечить способ синтеза соединения формулы III, пригодный в получении соединения формулы XI (лемборексант), содержащего небольшое количество примесей. 6 н. и 4 з.п. ф-лы, 3 пр., 2 табл.
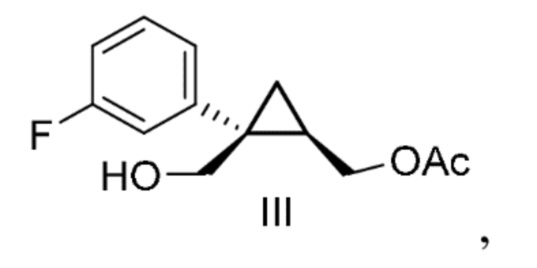
 ,
,  ,
,
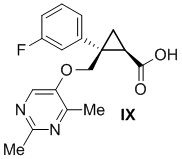 ,
, 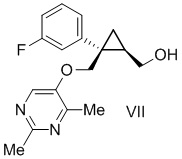 ,
, 
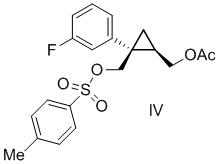
1. Способ получения соединения формулы III:

включающий:
а) добавление реактива Гриньяра к смеси, содержащей соединение формулы II:
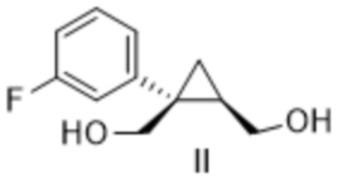 ,
,
толуол и тетрагидрофуран при 60°C или ниже; и
b) добавление полученной смеси к смеси, содержащей ацетилхлорид и этилацетат при 20°C или ниже.
2. Способ по п. 1, где реактив Гриньяра представляет собой циклогексилмагнийхлорид.
3. Способ получения соединения формулы XI:
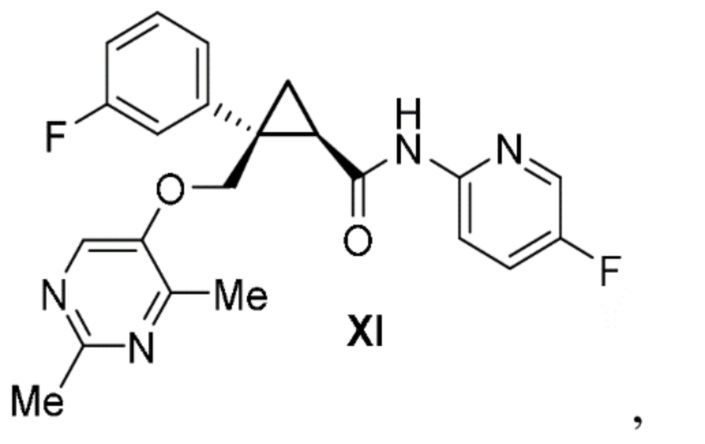
включающий:
I. получение соединения формулы III согласно способу по п. 1,
добавление смеси ii) п-толуолсульфонилхлорида, толуола и ацетонитрила к композиции, содержащей i) полученное соединение формулы III:
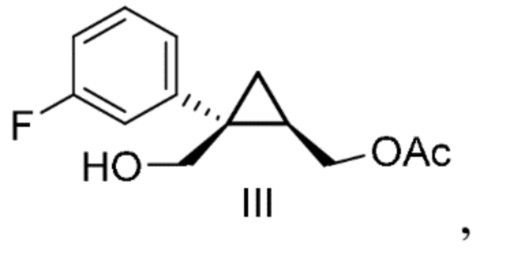
толуол, триэтиламин и 1-метилимидазол,
с получением соединения формулы IV:
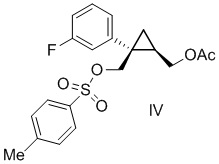 ;
;
II. a) добавление трет-бутоксида калия к смеси
i) соединения формулы VI:
 ,
,
ii) N-метилпирролидона и
iii) ацетонитрила, и
перемешивание смеси при температуре от 40°C до 70°C; и
b) перемешивание смеси, полученной путем добавления
i) соединения формулы IV:

к полученной смеси при температуре от 40°C до 70°C,
с получением соединения формулы V:
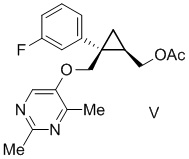 ;
;
III. добавление водного раствора гидроксида натрия к полученному соединению формулы V:

и перемешивание обоих при температуре от 30°C до 50°C, с получением соединения формулы VII:
 ;
;
IV. реакцию полученного соединения формулы VII:

с окислителем, с получением соединения формулы IX:
 ;
;
V. перемешивание смеси
i) полученного соединения формулы IX:
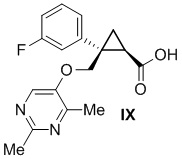 ,
,
ii) соединения формулы X:
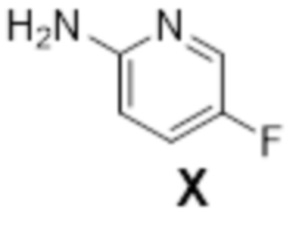 ,
,
iii) этилацетата,
iv) N,N-диизопропилэтиламина и
v) ангидрида 1-пропанфосфоновой кислоты
при температуре от 60°С до 80°С,
с получением соединения формулы XI:
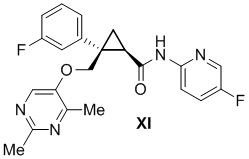 .
.
4. Способ получения соединения формулы IX:

включающий:
I. получение соединения формулы III согласно способу по п.1,
добавление смеси ii) п-толуолсульфонилхлорида, толуола и ацетонитрила к композиции, содержащей i) полученное соединение формулы III:

толуол, триэтиламин и 1-метилимидазол,
с получением соединения формулы IV:
 ;
;
II. a) добавление трет-бутоксида калия к смеси
i) соединения формулы VI:
 ,
,
ii) N-метилпирролидона и
iii) ацетонитрила, и
перемешивание смеси при температуре от 40°C до 70°C; и
b) перемешивание смеси, полученной путем добавления
i) полученного соединения формулы IV:

к смеси при температуре от 40°C до 70°C,
с получением соединения формулы V:
 ;
;
III. добавление водного раствора гидроксида натрия к полученному соединению формулы V:

и перемешивание обоих при температуре от 30°C до 50°C, с получением соединения формулы VII:
 ;
;
IV. реакцию полученного соединения формулы VII:

с окислителем, с получением соединения формулы IX:
 .
.
5. Способ по п.3 или 4, включающий:
последовательное добавление гипохлорита натрия и хлорита натрия в качестве окислителя на стадии IV.
6. Способ по п.3 или 4, где соединение формулы IX:

получают путем следующих стадий:
а) окисление соединения формулы VII:

гипохлоритом натрия с получением альдегида формулы VIII:
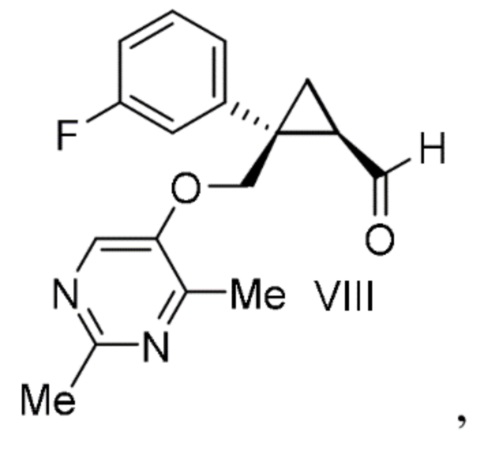
и
b) окисление альдегида хлоритом натрия.
7. Способ по п. 6, где окисление на стадии а) катализируют эффективным количеством 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO).
8. Способ получения соединения формулы VII:
 ,
,
включающий:
I. получение соединения формулы III согласно способу по п.1,
добавление смеси ii) п-толуолсульфонилхлорида, толуола и ацетонитрила к композиции, содержащей i) полученное соединение формулы III:

толуол, триэтиламин и 1-метилимидазол,
с получением соединения формулы IV:
 ;
;
II. a) добавление трет-бутоксида калия к смеси
i) соединения формулы VI:
 ,
,
ii) N-метилпирролидона и
iii) ацетонитрила, и
перемешивание смеси при температуре от 40°C до 70°C; и
b) перемешивание смеси, полученной путем добавления
i) полученного соединения формулы IV:

к полученной смеси при температуре от 40°C до 70°C,
с получением соединения формулы V:
 ;
;
III. добавление водного раствора гидроксида натрия к соединению формулы V:

и перемешивание обоих при температуре от 30°C до 50°C, с получением соединения формулы VII:
 .
.
9. Способ получения соединения формулы V:

включающий:
I. получение соединения формулы III согласно способу по п.1,
добавление смеси ii) п-толуолсульфонилхлорида, толуола и ацетонитрила к композиции, содержащей i) полученное соединение формулы III:

толуол, триэтиламин и 1-метилимидазол,
с получением соединения формулы IV:
 ;
;
II. a) добавление трет-бутоксида калия к смеси
i) соединения формулы VI:
 ,
,
ii) N-метилпирролидона и
iii) ацетонитрила, и
перемешивание смеси при температуре от 40°C до 70°C; и
b) перемешивание смеси, полученной путем добавления
i) соединения формулы IV:

к полученной смеси при температуре от 40°C до 70°C,
с получением соединения формулы V:
 .
.
10. Способ получения соединения формулы IV:
 ,
,
включающий:
получение соединения формулы III согласно способу по п.1,
добавление смеси ii) п-толуолсульфонилхлорида, толуола и ацетонитрила к композиции, содержащей i) соединение формулы III:

толуол, триэтиламин и 1-метилимидазол,
с получением соединения формулы IV:
 .
.
| СПОСОБЫ И СОЕДИНЕНИЯ, КОТОРЫЕ МОЖНО ИСПОЛЬЗОВАТЬ ДЛЯ СИНТЕЗА АНТАГОНИСТОВ РЕЦЕПТОРОВ ОРЕКСИНА-2 | 2013 |
|
RU2617696C2 |
| YOSHIDA Y | |||
| et al., Discovery of (1R,2S)‑2-{ [(2,4-Dimethylpyrimidin-5-yl)oxy]methyl} -2-(3-fluorophenyl)‑N‑(5-fluoropyridin-2-yl)cyclopropanecarboxamide (E2006): A Potent and Efficacious Oral Orexin Receptor Antagonist, J | |||
| Med | |||
| Chem., 2015, v | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| МАШИНА ДЛЯ ДВУСТОРОННЕЙ ФОРМОВКИ РАДИАТОРОВ ДЛЯ ОТОПЛЕНИЯ И Т.П. ПРЕДМЕТОВ | 1926 |
|
SU4648A1 |
| ЦИКЛОПРОПАНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2571414C2 |
| SEKI M | |||
| et al., Synthesis of | |||
Авторы
Даты
2024-07-31—Публикация
2020-05-13—Подача