Область техники
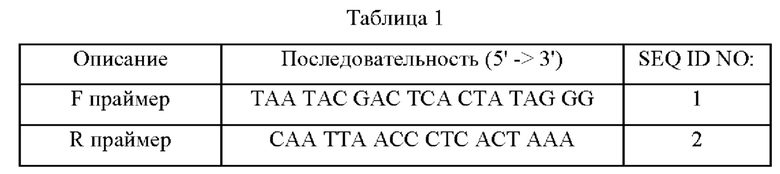
Перекрестная ссылка на родственные заявки
Данная заявка испрашивает приоритет KR 10-2019-0173087 и KR 10-2019-0173088, поданных 23 декабря 2019 в Корейское ведомство по интеллектуальной собственности, полное описание которых включено в этот документ посредством ссылки.
Предложены продуцирующий L-аминокислоту микроорганизм, обладающий повышенной активностью цитохрома С, и способ получения L-аминокислоты с его использованием.
Предшествующий уровень техники
Микроорганизмы, принадлежащие к роду Corynebacterium, являются грамположительными и широко используются в получении L-аминокислот. L-аминокислоты, особенно L-лизин, находят применение в производстве кормов для животных, в медицинской и косметической промышленности. L-аминокислоты для промышленного использования в основном производят посредством ферментирования с использованием штаммов Corynebacterium.
Было предпринято много попыток улучшения способов получения L-аминокислот с использованием штаммов Corynebacterium spp. Среди них имеются исследования по технологии рекомбинантных ДНК, посредством которой конкретные гены подвергаются нокдауну или ослаблению экспрессии для продуцирования L-аминокислот. Кроме того, имели место исследования, в ходе которых каждый из генов, вовлеченных в биосинтез L-аминокислоты, амплифицировали и анализировали в отношении их воздействия на продуцирование L-аминокислоты, модифицируя с учетом этого продуцирующие L-аминокислоту штаммы Corynebacterium.
В индустрии получения лизина посредством ферментирования важными факторами являются получение высокой концентрации лизина и улучшенный потенциал продуцирования лизина микроорганизмами. Исходя из этого, были продолжены попытки по увеличению потенциала продуцирования лизина микроорганизмами и стабильному поддерживанию улучшенного потенциала продуцирования лизина в процессе ферментирования культуры. Однако трудно поддерживать потенциал продуцирования лизина до поздней фазы культивирования из-за различных внутренних и внешних факторов, подавляющих микробную активность.
Таким образом, по-прежнему существует потребность в разработке штамма, у которого потенциал продуцирования L-лизина улучшен и может стабильно поддерживаться.
Описание изобретения
Техническая задача
В одном воплощении предложен продуцирующий L-аминокислоту микроорганизм, обладающий повышенной активностью цитохрома С. Например, повышение активности цитохрома С может быть достигнуто посредством введения гена, кодирующего цитохром С. В частности, ген, кодирующий цитохром С, может представлять собой экзогенный ген.
В другом воплощении предложен способ получения L-аминокислоты, включающий стадию культивирования продуцирующего L-аминокислоту микроорганизма.
В еще одном воплощении предложена композиция для получения L-аминокислоты или улучшения продуцирования L-аминокислоты в микроорганизме, содержащая ген, кодирующий цитохром С, рекомбинантный вектор, несущий этот ген, или оба из них.
Техническое решение
Согласно одному воплощению предложена технология модифицирования штамма для продуцирования аминокислоты, основанная на исследовании того, как амплификация гена, вовлеченного в продуцирование лизина микроорганизмами Corynebacterium spp., влияет на потенциал продуцирования ими лизина. В общем, стратегии увеличения потенциала продуцирования аминокислот, таких как лизин и тому подобное, включают улучшение выходов продуцирования аминокислот, таких как лизин и так далее, или повышение продукции аминокислот, таких как лизин и так далее, в единицу времени (продуктивность). В особенности, на аминокислотную продуктивность по лизину и так далее могут воздействовать различные факторы, включая компоненты сред для ферментации, осмотическое давление сред для ферментации, скорости перемешивания, скорости подачи кислорода и так далее. На протяжении времени периода культивирования у микроорганизмов неуклонно снижаются потенциал продуцирования лизина и клеточная активность вследствие таких проблем, как например, стресс, вызванный различными веществами и метаболитами, присутствующими в ферментативном бульоне, кислородное истощение, связанное с увеличением микробной массы, физические условия, такие как температура и скорость перемешивания. Согласно одному воплощению настоящего изобретения предложена технология модифицирования штамма для преодоления стресса, вызванного такими различными факторами, и для обеспечения возможности микроорганизмам сохранять постоянную активность продуцирования по целевым продуктам до поздней фазы культивирования.
Ниже представлено подробное раскрытие настоящего изобретения.
В одном воплощении предложен продуцирующий L-аминокислоту микроорганизм, обладающий усиленной активностью цитохрома С.
Термин "продуцирующий L-аминокислоту микроорганизм" при использовании в данном документе может относиться к микроорганизму, который имеет потенциал продуцирования L-аминокислоты, который повышен в результате увеличения в нем активности цитохрома С по сравнению с первоначальной и/или генерирован из нулевой активности посредством увеличения в нем активности цитохрома С. Термин "микроорганизм" при использовании в данном документе может быть предназначен для охвата одноклеточных бактерий и может использоваться взаимозаменяемо с "клеткой".
L-аминокислота может представлять собой L-лизин.
В этом документе микроорганизм до увеличения в нем активности цитохрома С может называться микроорганизмом-хозяином с целью отличия от "продуцирующего L-аминокислоту микроорганизма", который имеет потенциал продуцирования L-аминокислоты, который увеличен или генерирован посредством повышения активности цитохрома С.
В конкретном воплощении микроорганизм-хозяин может представлять собой любой микроорганизм, имеющий потенциал продуцирования L-аминокислоты (например L-лизина). В конкретном воплощении микроорганизм-хозяин может представлять собой микроорганизм, у которого потенциал продуцирования L-лизина имеется естественным образом или генерирован путем введения мутации в родительский штамм, который изначально не обладал потенциалом продуцирования L-лизина или имел очень низкий потенциал.
В конкретном воплощении микроорганизм-хозяин может представлять собой грамположительные бактерии, у которых потенциал продуцирования L-лизина имеется естественным образом или генерирован путем введения мутации в родительский штамм, который изначально не обладал потенциалом продуцирования L-лизина или имел очень низкий потенциал и, например, может быть выбран из группы, состоящей из микроорганизмов рода Corynebacterium и микроорганизмов рода Escherichia. Примеры микроорганизмов рода Corynebacterium могут включать Corynebacterium glutamicum, Corynebacterium ammoniagenes, Brevibacterium lactofermentum, Brevibacterium flavum, Corynebacterium thermoaminogenes и Corynebacterium efficiens, но без ограничения ими. Например, микроорганизм рода Corynebacterium может представлять собой Corynebacterium glutamicum.
При использовании в данном документе термин "цитохром С" может относиться к связанному с мембраной мономерному цитохрому С, который имеет происхождение из бактерий, имеет среднюю молекулярную массу 15 кДа или менее, например от примерно 8 к Да до примерно 15 кДа, и/или варьирует по длине от 90 до 150 аминокислот, от 100 до 150 аминокислот, от 120 до 150 аминокислот, от 90 до 125 аминокислот, от 100 до 125 аминокислот или от 120 до 125 аминокислот.В одном воплощении цитохром С может иметь происхождение из микроорганизмов рода Bacillus и может представлять собой по меньшей мере один, выбранный из семейства белков цитохрома С, который демонстрирует наименьшую полосу поглощения энергии (способность поглощать энергию) при длине волны 550-555 нм или от 550 до 551 нм в его восстановленном состоянии. В одном воплощении цитохром С может включать по меньшей мере один, например один, два или три белка, выбранных из группы, состоящей из цитохрома С-551 (способность поглощать энергию при примерно 551 нм) и цитохрома С-550 (способность поглощать энергию при примерно 550 нм), оба имеющие происхождение из микроорганизма роди Bacillus (цифры, приписанные в конце к цитохрому С, обозначают длину волны, при которой цитохром С демонстрирует эту длину волны в его восстановленном состоянии). Микроорганизм рода Bacillus может представлять собой один или более, выбранных из группы, состоящей из Bacillus pseudoflrmus, Bacillus subtilis и тому подобного.
В конкретном воплощении цитохром С, например по меньшей мере один, выбранный из цитохрома С-551 и цитохрома С-550, может содержать аминокислотную последовательность, кодируемую сссА или сссВ. В одном воплощении цитохром С может представлять собой по меньшей мере один, выбранный из группы, состоящей из цитохрома С-551, имеющего происхождение из Bacillus pseudofirmus (например Bacillus pseudofirmus OF4 и так далее) и/или Bacillus subtilis, и цитохрома С-550, имеющего происхождение ж Bacillus subtilis, и тому подобного.
Более подробно, цитохром С (например, имеющий происхождение из Bacillus subtilis цитохром С-551) может содержать полипептид, содержащий аминокислотную последовательность (например SEQ ID NO: 16), кодируемую сссА (например BpOF4_13740, имеющую происхождение из Bacillus pseudofirmus OF4), полипептид, содержащий аминокислотную последовательность (например SEQ ID NO: 27), кодируемую сссВ (например BpOF4_05495, имеющую происхождение из Bacillus pseudofirmus OF4), или оба из них.
Если не указано иное, цитохром С, описанный в этом документе, рассматривается как относящийся к любому белку, имеющему идентичность последовательности 20% или более, 30% или более, 40% или более, 50% или более, 55% или более, 60% или более, 65% или более, 70% или более, 75% или более, 80% или более, 82% или более, 85% или более, 87% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более (например от 60% до 99,5%, от 70% до 99,5%, от 80% до 99,5%, от 85% до 99,5%, от 90% до 99,5%, от 91% до 99,5%, от 92% до 99,5%, от 93% до 99,5%, от 94% до 99,5%, от 95% до 99,5%, от 96% до 99,5%, от 97% до 99,5%, от 98% до 99,5% или от 99% до 99,5%) с аминокислотной последовательностью SEQ ID NO: 16 или 27.
В частности, белки, имеющие идентичность последовательностей, подпадающую в область определения цитохрома С, описанного в этом документе, могут представлять собой белок, имеющий:
(1) по меньшей мере одну из указанных выше характеристик цитохрома С, например, выбранную из (а) бактериального происхождения, (б) средней молекулярной массы 15 кДа или менее, например от примерно 8 кДа до примерно 15 кДа и/или длины от 90 до 150, от 100 до 150, от 120 до 150, от 90 до 125, от 100 до 125 или от 120 до 125 аминокислотных остатков, (в) свойства связывания с мембраной и (г) свойства мономерности; и/или
(2) эффект, относящийся к увеличению активности в микроорганизме, имеющем (д) повышение потенциала продуцирования L-аминокислоты (например L-лизина), и/или (е) повышение скорости потребления сахара по сравнению с немодифицированными микроорганизмами, где эти повышения эквивалентны таковым для белков, имеющих аминокислотные последовательности SEQ ID NO: 16 или 27.
В конкретном воплощении продуцирующий L-аминокислоту микроорганизм, обладающий увеличенной активностью цитохрома С, может иметь повышенный потенциал продуцирования L-аминокислоты по сравнению с немодифицированными микроорганизмами того же вида, которые не были модифицированы с целью увеличения активности цитохрома С.
При использовании в данном документе термин "увеличение активности цитохрома С" может относиться к любой манипуляции в микроорганизме для увеличения в нем активности цитохрома С по сравнению с собственной активностью или предманипуляционной активностью микроорганизма, включая введение активности цитохрома С в этот микроорганизм. "Введение" может относиться к действию, посредством которого активность цитохрома С естественным образом или искусственно генерируется в микроорганизме, который изначально не обладал активностью цитохрома С. Термин "немодифицированный микроорганизм" может относиться к микроорганизму-хозяину, в котором активность цитохрома С не увеличена (например к микроорганизму-хозяину, который не был модифицирован для увеличения активности цитохрома С) или к микроорганизму-хозяину, который еще не был подвергнут увеличению активности цитохрома С. Термин "собственная активность" может относиться к активности цитохрома С, которая сохраняется микроорганизмом-хозяином, в котором активность цитохрома С не увеличена, или микроорганизмом-хозяином, который еще не был подвергнут увеличению активности цитохрома С. В данном контексте, термин "немодифицированный" можно использовать в том же значении, что и состояние, в котором генетическая модификация не была индуцирована, а собственная активность сохраняется.
Например, увеличение активности цитохрома С может быть достигнуто путем введения экзогенного цитохрома С или путем усиления собственной активности цитохрома С. В конкретном воплощении увеличение активности цитохрома С может быть достигнуто путем введения экзогенного цитохрома С.
В конкретном воплощении увеличение активности цитохрома С в микроорганизме может объясняться увеличением скорости потребления сахара у этого микроорганизма по сравнению с немодифицированными микроорганизмами, у которых активность цитохрома С не увеличена. В частности, микроорганизм с повышенной активностью цитохрома С, рассматриваемый в конкретном воплощении, может быть сходным с немодифицированным микроорганизмом в отношении скорости роста (величина ОП (оптическая плотность)) и/или выхода продукции L-аминокислоты, например L-лизина, в течение конкретного периода роста, но показывает повышенную скорость потребления сахара по сравнению с немодифицированным микроорганизмом, что дает основания предполагать, что микроорганизм с увеличенной активностью цитохрома С продуцирует большее количество L-аминокислоты в течение более короткого времени по сравнению с немодифицированными микроорганизмами, тем самым демонстрируя улучшенную продуктивность по L-аминокислоте.
В одном воплощении увеличение активности цитохрома С может быть достигнуто путем повышения экспрессии цитохрома С на генном (мРНК) уровне и/или на белковом уровне, и/или активности белка цитохрома С самого по себе, но без ограничения ими.
В одном воплощении увеличение активности цитохрома С может быть достигнуто путем введения гена, кодирующего цитохром С. Как таковое, введение гена, кодирующего цитохром С, может повысить потенциал продуцирования L-аминокислоты, который у микроорганизма уже имеется, или генерировать потенциал продуцирования L-аминокислоты, которым микроорганизм не обладает.
В одном воплощении цитохром С или кодирующий его ген могут иметь происхождение из микроорганизма-хозяина (гомогенные) или другого микроорганизма (экзогенные). В конкретном воплощении увеличение активности цитохрома С может быть осуществлено путем введения в микроорганизм-хозяин экзогенного гена, кодирующего цитохром С. Цитохром С является таким, как описано выше, и может, например, представлять собой цитохром С, имеющий происхождение из Bacillus pseudofirmus OF4 (цитохром С-551), который представлен аминокислотной последовательностью SEQ ID NO: 16 (например кодируемой сссА (BpOF4 13740)) или аминокислотной последовательностью SEQ ID NO: 27 (например кодируемой сссВ (BpOF4_05495)).
В одном воплощении ген, кодирующий цитохром С, или продуцирующий L-аминокислоту микроорганизм, имеющий введенный в него данный ген, может содержать полинуклеотид, кодирующий аминокислотную последовательность SEQ ID NO: 16, полинуклеотид, кодирующий аминокислотную последовательность SEQ ID NO: 27, или их комбинацию. В одном воплощении продуцирующий L-аминокислоту микроорганизм может представлять собой микроорганизм рода Corynebacterium, например, Corynebacterium glutamicum, который содержит полинуклеотид, кодирующий аминокислотную последовательность SEQ ID NO: 16, полинуклеотид, кодирующий аминокислотную последовательность SEQ ID NO: 27, или их комбинацию. Например, продуцирующий L-аминокислоту микроорганизм может представлять собой микроорганизм, депонированный с номером доступа KCCM12640P.
В отношении полинуклеотида (используется взаимозаменяемо с "геном") или полипептида (используется взаимозаменяемо с "белком"), то при использовании в данном документе формулировки "содержащий конкретную нуклеиново-кислотную или аминокислотную последовательность", "состоящий из конкретной нуклеиново-кислотной или аминокислотной последовательности" и "экспрессируемый в виде конкретной нуклеиново-кислотной или аминокислотной последовательности" представляют собой взаимозаменяемые выражения, эквивалентно означающие, что полинуклеотид или полипептид по существу содержит конкретную нуклеиново-кислотную или аминокислотную последовательность. Кроме того, эти формулировки могут быть истолкованы как "содержащий по существу эквивалентную последовательность" (или как "не исключая введение следующей мутации"), которая является результатом мутации (делеции, замены, модификации и/или вставки) в конкретной нуклеиново-кислотной или аминокислотной последовательности до той степени, при которой полинуклеотид или полипептид сохраняет свою исходную функцию и/или желательную функцию.
В одном воплощении предлагаемая нуклеиново-кислотная или аминокислотная последовательность может включать мутанты, полученные посредством обычно применяемых методов мутагенеза, например непосредственной эволюции и/или сайт-направленного мутагенеза, до той степени, при которой мутанты сохраняют исходную функцию или желательную функцию последовательности. В одном воплощении выражение, что полинуклеотид или полипептид "содержит или состоит из конкретной нуклеиново-кислотной или аминокислотной последовательности", может означать, что полинуклеотид или полипептид по существу содержит или по существу состоит из (1) конкретной нуклеиново-кислотной или аминокислотной последовательности или (2) нуклеиново-кислотной или аминокислотной последовательности, имеющей идентичность последовательностей 60% или более, 70% или более, 80% или более, 85% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 99% или более, 99,5% или более, или 99,9% или более (например от 60% до 99,5%, от 70% до 99,5%, от 80% до 99,5%, от 85% до 99,5%, от 90% до 99,5%, от 91% до 99,5%, от 92% до 99,5%, от 93% до 99,5%, от 94% до 99,5%, от 95% до 99,5%, от 96% до 99,5%, от 97% до 99,5%, от 98% до 99,5% или от 99% до 99,5%), где полинуклеотид или полипептид сохраняют свою исходную функцию и/или желательную функцию. При использовании в данном документе термин "исходная функция" означает функцию цитохрома С самого по себе (для аминокислотной последовательности) или функцию кодирования белка, имеющего функцию цитохрома С (для нуклеиново-кислотной последовательности), а термин "желательная функция" означает функцию увеличения потенциала продуцирования L-аминокислоты (например L-лизина) в микроорганизме или обеспечения микроорганизма потенциалом продуцирования L-аминокислоты (например L-лизина).
Для нуклеотидных последовательностей, описанных в этом документе, могут быть осуществлены различные модификации в кодирующих областях до той степени, в которой они не изменяют аминокислотные последовательности и/или функции белка (цитохрома С), экспрессируемого из кодирующих областей, в силу вырожденности кодонов или с учетом кодонов, предпочитаемых микроорганизмами, в которых должен экспрессироваться этот белок.
Термин "идентичность" при использовании в данном документе может относиться к степени идентичности между данными нуклеиново-кислотными или аминокислотными последовательностями, которая может быть выражена в процентах (%). Процент идентичности между последовательностями нуклеиновых кислот можно определять с использованием, например, алгоритма BLAST (программа для обнаружения сходства последовательностей белков путем их локального выравнивания) (смотри Karlin and Altschul, Pro. Natl. Acad. Sci. USA, 90, 5873 (1993)) или FASTA от Pearson (смотри Methods Enzymol., 183, 63 (1990)). Программы, называемые BLASTN и BLASTX, были разработаны на основе алгоритма BLAST (смотри http://www.ncbi.nlm.nih.gov).
В одном воплощении полинуклеотид, содержащий конкретную предлагаемую нуклеиново-кислотную последовательность, может быть истолкован как содержащий полинуклеотид, содержащий нуклеиново-кислотную последовательность, комплиментарную этой конкретной нуклеиново-кислотной последовательности, а также полинуклеотид, содержащий эту конкретную нуклеиново-кислотную последовательность или по существу эквивалентную ей нуклеиново-кислотную последовательность. Более конкретно, комплиментарные полинуклеотиды могут гибридизироваться при надлежащим образом отрегулированных значениях Tm, например при Tm, составляющих 55°С, 60°С, 63°С или 65°С, в соответствии с задачами и могут быть проанализированы в условиях, которые описаны более конкретно в известных документах. Например, можно упомянуть условие, при котором осуществляют гибридизацию между генами, если их гомология составляет 60% или более, 70% или более, 80% или более, 85% или более, 90% или более, 91% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, 98% или более, 99,5% или более, или 99,9% или более, но не осуществляют, если их гомология ниже этих значений, или типичное условие для Саузерн-гибридизации, при котором выполняют одну или более, более конкретно две или три промывки при температуре и концентрации солей 60°С, lx SSC (солевой раствор цитрата натрия) и 0,1% (м/об.) SDS (додецилсульфат натрия); 60°С, 0,1х SSC и 0,1% SDS; или 68°С, 0,1х SSC и 0,1% SDS, но без ограничения ими. Для гибридизации два полинуклеотид а должны иметь последовательности, комплиментарные друг другу. В зависимости от жесткости гибридизации, может(гут) быть разрешена(ы) ошибка или ошибки спаривания между основаниями. Термин "комплиментарный" можно использовать для описания взаимоотношения между нуклеотидными основаниями, которые могут спариваться друг с другом. Для ДНК, например, аденозин комплиментарен тимину, и цитозин комплиментарен гуанину. Подходящая жесткость гибридизации для полинуклеотидов может варьировать в зависимости от различных факторов, включающих длину полинуклеотида и комплиментарность, что хорошо известно в данной области техники (смотри Sambrook et al., 9.50-9.51, 11.7-11.8).
Увеличение активности цитохрома С может быть достигнуто на уровне гена цитохрома С (мРНК) посредством следующих стратегий:
1) увеличение числа копий полинуклеотида, кодирующего цитохром С,
2) модификация регуляторного элемента (последовательности) экспрессии таким образом, чтобы усилить экспрессию этого полинуклеотида, или
3) одновременно (1) и (2), но без ограничения ими.
Стратегию (1) увеличения числа копий полинуклеотида можно реализовывать посредством введения полинуклеотида в микроорганизм-хозяин с помощью вектора или введения полинуклеотида в хромосому микроорганизма-хозяина, но не ограничиваясь этим. В качестве примера, увеличение числа копий может быть осуществлено посредством введения в микроорганизм-хозяин полинуклеотида, кодирующего экзогенный цитохром С, или вариантного полинуклеотида, который является кодон-оптимизированным в отношении этого полинуклеотида. В настоящем изобретении может быть использован любой экзогенный полинуклеотид, без ограничений в плане его происхождения или последовательности, при условии, что кодируемый им полипептид проявляет идентичную или схожую активность с цитохромом С. Специалист в данной области техники сможет надлежащим образом адаптировать и/или модифицировать методы трансформации, известные в данной области техники, для осуществления такого введения. Будучи введенным в микроорганизм-хозяин, полинуклеотид экспрессируется с генерированием экзогенного цитохрома С.
Стратегию (2) модифицирования последовательности контроля экспрессии для усиления экспрессии полинуклеотида можно применять как для эндогенных, так и для экзогенных полинуклеотидов. Для увеличения экспрессионной регуляторной активности может быть осуществлено модифицирование регулирующей экспрессию последовательности посредством делеции, вставки, консервативной или неконсервативной замены нуклеотидов, или их комбинации. Альтернативно, последовательность контроля экспрессии может быть заменена более сильным заместителем, но без ограничения этим. Последовательность контроля экспрессии может представлять собой по меньшей мере одну, выбранную из группы, состоящей из промотора, операторной последовательности, последовательности, кодирующей сайт связывания рибосомы, и последовательности для контроля терминации транскрипции и/или трансляции. В одном воплощении вместо эндогенного промотора выше звена экспрессии полинуклеотида может быть функциональным образом присоединен сильный экзогенный промотор. Примеры сильного промотора включают промотор CJ7, промотор lysCP1, промотор EF-Tu, промотор groEL и промотор асе А или асеВ. Более конкретно, сильный промотор может представлять собой промотор lysCP1 (WO 2009/096689) или промотор CJ7 (WO 2006/065095), которые происходят из рода Corynebacterium, но без ограничения ими.
Далее в данном документе более конкретно описаны случаи, когда ген, кодирующий цитохром С, вводят в микроорганизм-хозяин с помощью вектора или встраивают в хромосому микроорганизма. Раскрытое здесь введение гена может быть осуществлено посредством (1) введения экзогенного гена (имеющего происхождение из вида, гетерологичного и/или гомологичного микроорганизму-хозяину, но отличного от него) в клетку-хозяина с помощью рекомбинантного вектора, несущего функционально связанный с ним ген, или (2) встраивания (например случайного встраивания) экзогенного гена в хромосому (геном) клетки-хозяина. В случае (2) встраивания в хромосому (геном) клетки-хозяина такое встраивание может быть осуществлено в сайт, который не имеет отношения к росту клетки-хозяина (например нетранскрипционный спейсер (NTS) и так далее), и/или может быть повышена эффективность случайного встраивания (например ретротранспозон и так далее), но без ограничения этим.
Для введения гена или вектора специалист в данной области техники может надлежащим образом выбрать способ трансформации, известный в данной области техники. При использовании в данном документе термин "трансформация" может относиться к действию, посредством которого вектор, несущий полинуклеотид, кодирующий целевой белок (цитохром С), вводят в микроорганизм-хозяин для экспрессии белка, кодируемого полинуклеотидом, в клетке-хозяине. Введенный полинуклеотид может быть локализован внутри или вне хромосомы микроорганизма-хозяина с возможностью экспрессии в микроорганизме-хозяине. Кроме того, полинуклеотид содержит ДНК или РНК, кодирующую целевой белок. Может быть использовано любое средство доставки при условии, что оно обеспечивает введение полинуклеотида в микроорганизм-хозяин и его экспрессию. Например, полинуклеотид может принимать форму экспрессионной кассеты, которая содержит все элементы, необходимые для автономной экспрессии для того, чтобы вводить полинуклеотид в клетку-хозяина. Экспрессионная кассета обычно может содержать регуляторные элементы экспрессии, функциональным образом связанные с полинуклеотидом, такие как промотор, сигнал остановки транскрипции, сайт связывания рибосомы и/или сигнал остановки трансляции. Экспрессионная кассета может представлять собой вектор экспрессии, который может реплицироваться сам по себе. Кроме того, полинуклеотид сам по себе может быть введен в клетку-хозяина и может быть функциональным образом соединен с последовательностью, необходимой для экспрессии в клетке-хозяине. При использовании в данном документе термин "функциональным образом соединенный" означает функциональную связь между регуляторным элементом экспрессии (например промотором) и полинуклеотидом так, чтобы регуляторный элемент экспрессии мог контролировать (например инициировать) транскрипцию этого полинуклеотида. Осуществление соединения функциональным образом может быть произведено с использованием технологии генетической рекомбинации, известной в данной области техники, например, обычным сайт-специфическим расщеплением и лигированием ДНК, но без ограничения этим.
Можно использовать любой способ введения, который обеспечивает возможность трансформации полинуклеотидом микроорганизма-хозяина. Технологии трансформации, известные в данной области техники, могут быть надлежащим образом выбраны в зависимости от микроорганизма-хозяина. Примеры технологий трансформации, известных в данной области техники, могут включать электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекцию, опосредованный полиэтиленгликолем (PEG) захват, опосредованную диэтиламиноэтил-декстраном (DEAE) доставку, метод катионных липосом, липофекцию и метод с использованием ацетат лития-DMSO (диметилсульфоксид), но без ограничения ими.
Специалист в данной области техники может выбрать подходящий способ для введения гена в геном (хромосому) в клетке. Например, введение может быть осуществлено с использованием системы РНК-направляемой эндонуклеазы (например по меньшей мере одной, выбранный из группы, состоящей из смеси (а) РНК-направляемой эндонуклеазы (например белка Cas9 и так далее), кодирующего ее гена или вектора, несущего этот ген; и (б) направляющей РНК (то есть одиночной направляющей РНК (sgRNA) и так далее), кодирующей ее ДНК или вектора, несущего эту ДНК (например смесь белка РНК-направляемой эндонуклеазы и направляющей РНК), комплекса (например рибонуклеопротеина (RNP) и вектора, несущего рекомбинантный вектор (например ген, кодирующий РНК-направляемую эндонуклеазу, и ДНК, кодирующая направляющую РНК, и так далее)), но без ограничения ими.
Согласно другому воплощению предложено применение кодирующего цитохром С гена, рекомбинантного вектора, несущего (содержащего) этот ген, и/или клетки, несущей (содержащей) этот рекомбинантный вектор, для увеличения потенциала продуцирования L-аминокислоты в микроорганизме и/или придания микроорганизму потенциала продуцирования L-аминокислоты и/или в получении микроорганизма, обладающего потенциалом продуцирования L-аминокислоты.
В другом воплощении предложена композиция для получения L-аминокислоты, содержащая ген, кодирующий цитохром С, рекомбинантный вектор, несущий этот ген, или клетку, несущую этот рекомбинантный вектор.
В другом воплощении предложена композиция для получения L-аминокислоты, содержащая ген, кодирующий цитохром С, рекомбинантный вектор, несущий этот ген, или их комбинацию. Композицию для получения L-аминокислоты можно использовать для обеспечения микроорганизму возможности продуцировать L-аминокислоту, для повышения потенциала продуцирования L-аминокислоты и/или для придания потенциала продуцирования L-аминокислоты.
В другом воплощении предложен способ увеличения потенциала продуцирования L-аминокислоты у микроорганизма или придания микроорганизму потенциала продуцирования L-аминокислоты, включающий стадию введения (трансформации) гена, кодирующего цитохром С, или рекомбинантного вектора, несущего этот ген, в этот микроорганизм.
Цитохром С, кодирующий его ген и микроорганизм являются такими, как описано выше.
При использовании в данном документе термин "вектор" может относиться к ДНК конструкту, содержащему кодирующую целевой белок нуклеотидную последовательность, которая функциональным образом связана с подходящей регуляторной последовательностью, способной к осуществлению экспрессии целевого белка в подходящем хозяине. Такие регуляторные последовательности содержат промотор для осуществления транскрипции, возможную операторную последовательность для регулирования такой транскрипции, последовательность, кодирующую подходящие сайты связывания рибосом на мРНК, и/или последовательности, которые регулируют терминацию транскрипции и/или трансляции. После трансформации в подходящего хозяина вектор может реплицироваться и функционировать с экспрессией целевого белка независимо от хозяйского генома либо может интегрироваться в сам геном.
Может быть использован любой вектор, который реплицируется в клетке-хозяине, без особых накладываемых ограничений. Он может быть выбран из числа обычно используемых векторов. Примеры таких обычно используемых векторов могут включать плазмиды, космиды, вирусы и бактериофаги, которые могут находиться в природном или рекомбинантном состоянии. Например, примерами фагового вектора или космидного вектора являются pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A и Charon21A. Плазмидные векторы могут происходить из линий pBR-, pUC-, pBluescriptII-, pGEM-, pTZ-, pCL- и pET. Примеры вектора могут включать pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 и pCC1BAC, но без ограничения ими.
Возможный вектор может представлять собой известный вектор экспрессии и/или вектор для встраивания полинуклеотида в хромосому клетки-хозяина. Встраивание полинуклеотида в хромосому клетки-хозяина может быть осуществлено с помощью любого метода, известного в данной области техники, например, посредством гомологичной рекомбинации, но не ограничиваясь ею. Вектор может дополнительно нести селективный маркер для определения того, встроен ли представляющий интерес ген в хромосому. Селективный маркер предназначен для отбора трансформированных вектором клеток, то есть для определения встраивания полипептида, и он может быть выбран из числа генов, которые придают селектируемые фенотипы, такие как резистентность к лекарственному средству, ауксотрофия, резистентность к цитотоксическому лекарственному средству и экспрессия поверхностных белков. В условиях, когда клетки подвергаются действию селективного агента, только клетки, способные экспрессировать селективный маркер, могут выживать или проявлять характерный фенотип, вследствие чего такие трансформированные клетки могут быть отобраны.
В другом воплощении предложен способ получения L-аминокислоты, включающий стадию культивирования продуцирующего L-аминокислоту микроорганизма в среде. Способ может дополнительно включать стадию выделения L-аминокислоты из культивируемого микроорганизма, среды или из того и другого, после стадии культивирования.
В этом способе стадия культивирования микроорганизма может быть осуществлена посредством известных способов периодического культивирования, способов непрерывного культивирования, способов периодического культивирования с подпиткой и так далее, но без конкретного ограничения ими. Условия культивирования можно поддерживать при оптимальном рН (например рН от 5 до 9, конкретно рН от 6 до 8 и наиболее конкретно рН 6,8) с помощью основных соединений (например гидроксида натрия, гидроксида калия или аммиака) и кислых соединений (например фосфорной кислоты или серной кислоты) или в аэробных условиях путем подачи кислорода или кислородсодержащей газовой смеси в клеточную культуру, но без конкретных ограничений этим. Температуру культивирования можно поддерживать при 20-45°С и, конкретно, при 25-40°С, и клетки можно культивировать в течение примерно от 10 до 160 часов, но без ограничений этим. L-аминокислота (то есть L-лизин), продуцируемая в результате культивирования, может выделяться в культуральную среду или оставаться внутри клеток.
Среда, пригодная для культивирования, может содержать по меньшей мере одно, выбранное из сахара и углевода (например глюкозы, сахарозы, лактозы, фруктозы, мальтозы, мелассы, крахмала и целлюлозы), масла и жира (например соевого масла, подсолнечного масла, арахисового масла и кокосового масла), жирной кислоты (например пальмитиновой кислоты, стеариновой кислоты и линолевой кислоты), спирта (например глицерина и этилового спирта) и органической кислоты (например уксусной кислоты), в качестве источника углерода; по меньшей мере одно, выбранное из азотсодержащих органических соединений (например пептона, дрожжевого экстракта, мясного сока, солодового экстракта, кукурузного экстракта, порошка соевого шрота и мочевины), неорганических соединений (например сульфата аммония, хлорида аммония, фосфата аммония, карбоната аммония и нитрата аммония) в качестве источника азота; по меньшей мере одно, выбранное из дигидрофосфата калия, гидрофосфата калия или соответствующей натрийсодержащей соли, в качестве источника фосфора; и по меньшей мере одно, выбранное из других незаменимых стимулирующих рост веществ, таких как соли металлов (например сульфат магния или сульфат железа), аминокислот и/или витаминов, но не ограничиваясь ими.
На стадии выделения L-аминокислоты (то есть L-лизина) целевая аминокислота может быть собрана из среды, культуры или микроорганизмов с использованием подходящего метода, известного в данной области техники, в зависимости от способа культивирования. В качестве примера, стадию выделения можно осуществлять, используя по меньшей мере один метод, выбранный из центрифугирования, фильтрования, анионообменной хроматографии, кристаллизации и HPLC (высокоэффективная жидкостная хроматография), а целевая аминокислота может быть выделена из среды или микроорганизма с использованием любого подходящего метода, известного в данной области техники. Способ может дополнительно включать стадию очистки перед стадией выделения, одновременно с ней или после нее.
Полезные эффекты
Введение экзогенного гена обеспечивает повышение активности продуцирования лизина у лизин-продуцирующего штамма и сохраняют повышенную активность продуцирования лизина до более поздней фазы роста, посредством этого улучшая потенциал продуцирования лизина.
Описание графических материалов
Чертеж представляет собой схематическую диаграмму, составленную на основании результатов анализа нуклеиново-кислотных последовательностей библиотеки векторов, полученной в одном воплощении.
Осуществление изобретения
Далее настоящее изобретение будет описано более подробно с помощью примеров, но эти примеры предназначены только для целей иллюстрации и не предназначены ограничивать объем настоящего изобретения. Специалисту в данной области техники очевидно, что примеры, описанные ниже, можно модифицировать без отступления от сущности изобретения.
ПРИМЕР 1: Конструирование векторной библиотеки для доставки генов
С целью изучения генов, полезных для увеличения потенциала продуцирования лизина у Corynebacterium glutamicum, была сконструирована библиотека геномных ДНК, полученных из экстремофильных бактерий, которые адаптируются к различным экстремальным условиям окружающей среды и выживают в них. В качестве экстремофильных бактерий, которые могут расти в экстремальных условиях высокого осмотического давления, высоких температур, гипоксии и различных концентраций ионов водорода, использовали четыре репрезентативных микроорганизма, Bacillus atrophaeus (АТСС 49337), Bacillus licheniformis (КСТС 1030), Lactobacillus fermentum (KCTC 3112) и Bacillus pseudofirmus OF4 (АТСС BAA2126).
Сначала из этих четырех штаммов экстрагировали геномные ДНК, используя QIAamp DNA Micro Kit (QIAGEN). Полученные таким образом геномные ДНК расщепляли с помощью рестрикционного фермента Sau3A1 (NEB) при 37°С в течение 10 мин и затем при 65°С в течение 30 мин с получением сырых генных фракций, которые затем подвергали электрофорезу на 1%-ном агарозном геле. Извлекали только фрагмент геля в полосе от 5 до 7 т.п.о. (тысяч пар оснований). Генные фрагменты для вставки элюировали из геля, используя набор GeneAll Expin GEL SV (Seoul, KOREA).
Полученные таким образом генные фрагменты инкубировали с рестрикционным ферментом BamHI-HF (NEB) при 37°С в течение одного часа и затем с CIP (NEB) при 37°С в течение 30 мин, после чего лигировали их с вектором pECCG117 (патент Кореи №0057684). Полученным рекомбинантным вектором трансформировали Е. coli DH5α, которую затем наносили на чашку со средой LB, содержащей канамицин (25 мг/л). Гены из единичной колонии амплифицировали посредством ПЦР (полимеразная цепная реакция), используя праймеры SEQ ID NO: 1 и 2, показанные в Таблице 1 ниже. ПЦР начинали с первичной 10-ти минутной денатурации при 95°С и осуществляли 30 циклов денатурации при 95°С в течение 1 мин, отжигая при 55°С в течение 1 мин и с удлинением при 72°С в течение 4 мин с последующим заключительным удлинением при 72°С в течение 10 мин.
Обнаружение продуктов ПЦР подтвердило, что фрагменты геномной ДНК (гДНК), полученные из экстремофильной бактерии и имеющие размер от 3 до 5 т.п.о., были успешно встроены в вектор pECCG117 с показателем 99% или выше. Было получено примерно 10000 колоний трансформантов на штамм. Из этих трансформантов экстрагировали плазмиды с помощью набора для получения плазмид (QIAGEN). Библиотечные векторы были обозначены как p117-Lib.Bat (имеет происхождение из Bacillus atrophaeus), p117-Lib.Bli (имеет происхождение из Bacillus licheniformis), p117-Lib.Lfe (имеет происхождение из Lactobacillus fermentum) и p117-Lib.Bps (имеет происхождение из Bacillus pseudofirmus OF4).
ПРИМЕР 2: Создание и скрининг штамма, имеющего введенную в него векторную библиотеку
Четырьмя библиотечными векторами (p117-Lib.Bat, p117-Lib.Bli, p117-Lib.Lfe и p117-Lib.Bps), сконструированными в Примере 1, трансформировали лизин-продуцирующий штамм Corynebacterium glutamicum KCCM11016P (патент Кореи №10-0159812) методом электропорации (Van der Rest et al., Appl. Microbiol. Biotecnol. 52:541-545, 1999), и бактерии наносили на комплексную питательную среду, содержащую канамицин (25 мг/л). В конечном счете, было получено примерно по 5000 колоний на библиотечный вектор и им были присвоены обозначения LYS_Lib.Bat, LYS_Lib.Bli, LYS_Lib.Lfe и LYS_Lib.Bps, соответственно. Штамм KCCM11016P, который был трансформирован вектором pECCG117, не несущим полученных из гДНК генных фрагментов, использовали в качестве контроля сравнения со штаммами с библиотеками и его обозначили как контрольный LYS_117.
Состав использованной комплексной питательной среды был следующим.
Комплексная питательная среда (рН 7,0):
глюкоза 10 г, пептон 10 г, мясной экстракт 5 г, дрожжевой экстракт 5 г, сердечно-мозговая вытяжка 18,5 г, NaCl 2,5 г, мочевина 2 г, сорбит 91 г, агар 20 г (на литр дистиллированной воды).
Каждый из четырех полученных штаммов с библиотекой на основе KCCM11016P инокулировали в планшет Dome с 96 глубокими лунками (96-Deep Well Plate Dome, Bioneer), содержащими 400 мкл среды для скрининга, используя сборщик колоний (SINGER, PIXL), и инкубировали в инкубаторе для встряхивания планшетов (TAITEC) при 32°С в течение 15 ч при скорости 12000 об./мин.
Среда для посева имеет следующий состав.
Среда для скрининга (рН 7,0):
глюкоза 45 г, меласса, полученная из сахарной свеклы, 10 г, жидкость вымачивания сои 10 г, (NH4)2SO4 24 г, MgSO4⋅7H2O 0,6 г, KH2PO4 0,55 г, мочевина 5,5 г, биотин 0,9 мг, тиамин HCl 4,5 мг, пантотенат кальция 4,5 мг, никотинамид 30 мг, MnSO4⋅5H2O 9 мг, ZnSO4⋅5H2O 0,45 мг, CuSO4⋅5H2O 0,45 мг, FeSO4⋅5H2O 9 мг и канамицин 25 мг (на литр дистиллированной воды).
В ходе культивирования наблюдали за ростом клеток с помощью ридера микропланшетов (BioTek). Концентрации глюкозы и продуцируемого лизина в средах измеряли, используя анализатор сахара (YSI) и установку для HPLC (высокоэффективная жидкостная хроматография, Shimadzu), соответственно.
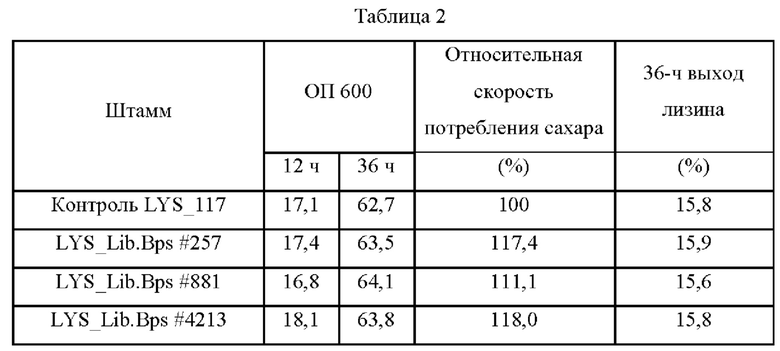
В ходе эксперимента были окончательно отобраны три штамма, которые показывают прекрасный рост и высокие скорости потребления глюкозы по сравнению с контролем (Таблица 2). При этом было обнаружено, что эти три отобранных штамма несут библиотечные векторы LYS_Lib.Bps. Хотя они были сходны с контролем LYS_117 по показателям выхода и величинам ОП, у них была обнаружена отличная продуктивность, поскольку их скорости потребления глюкозы в час (г/ч) в точке отбора проб были повышены до 118% в сравнении со 100% у контроля LYS_117.
ПРИМЕР 3: Секвенирование оснований библиотеки гДНК
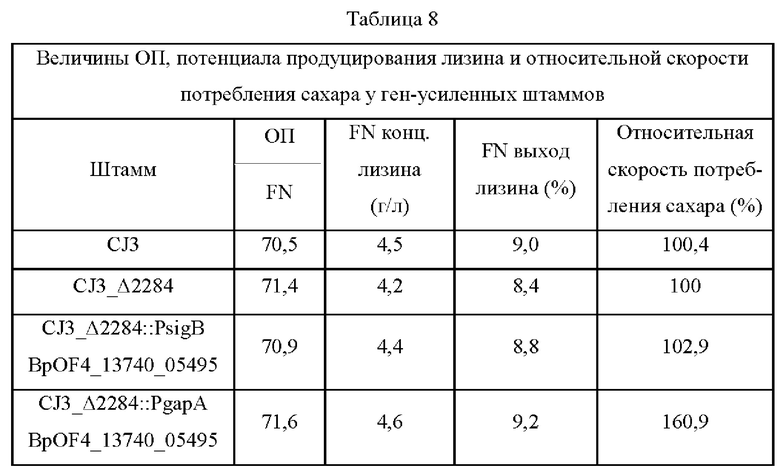
Для идентификации последовательностей генов, введенных в три колонии, отобранные в Примере 2, LYS_Lib.Bps #257, #881 и #4213, генные фрагменты библиотеки гДНК, которые содержатся в колониях, амплифицировали посредством ПЦР с использованием праймеров SEQ ID NO: 1 и 2, показанных в Таблице 1 Примера 1. ПЦР выполняли в таких же условиях, как в Примере 1. ПЦР фрагменты выделяли с использованием набора GeneAll Expin GEL SV (Seoul, KOREA) и анализировали на последовательности оснований. На основе результатов анализа получили информацию о генах посредством BLAST (NCBI (Национальный центр биотехнологической информации) эталонная последовательность NC_013791.2).
Результаты анализа представлены на чертеже. Как показано на чертеже, результат секвенирования оснований свидетельствует о том, что в колонии LYS_Lib.Bps #257 имеется генный фрагмент 4794 п.о., в колонии #881 - генный фрагмент 3985 п.о., а в колонии #4213 генный фрагмент 4483 п.о. Было обнаружено, что эти три колонии содержат BpOF4_13735 и BpOF4_13740 в виде ОРС (открытая рамка считывания) интактных генов, подобных друг другу. В дальнейшем выполняли дополнительные эксперименты в отношении влияния этих двух генов.
ПРИМЕР 4: Конструирование вектора и штамма, содержащего введенный в него отдельный ген
Для использования в изучении влияния двух отдельных генов, идентифицированных в Примере 3, был сконструирован геномный инсерционный вектор. Для использования в качестве основного вектора для инсерции гена был сконструирован вектор pDZ_Δ2284, нацеленный на Ncgl2284, представляющую собой одну из транспозаз.
Более конкретно, АТСС13032 гДНК использовали в качестве матричной ДНК для ПЦР. Праймеры готовили с учетом последовательности оснований NCBI (NC_003450.3). В присутствии праймеров SEQ ID NO: 3 и 4 начинали ПЦР с 10-ти минутной денатурации при 95°С и осуществляли 30 циклов денатурации при 95°С в течение 1 мин, отжига при 55°С в течение 1 мин и удлинения при 72°С в течение 4 мин с последующим заключительным удлинением при 72°С в течение 10 мин с получением 5' ДНК фрагмента, имеющего длину примерно 900 п.о. Аналогично проводили ПЦР с использованием праймеров SEQ ID NO: 5 и 6 в таких же условиях, как изложено выше, для амплификации фрагмента 3' ДНК. Два эти ампликона ДНК очищали с использованием набора GeneAll Expin GEL SV (Seoul, KOREA) и расщепляли с помощью рестрикционного фермента XbaI (NEB). Используя набор для клонирования In-Fusion, продукт расщепления лигировали с pDZ (патент Кореи №2009-0094433), которая была термически обработана при 65°С в течение 20 мин. Образованную таким образом рекомбинантную плазмиду трансформировали в Е. coli DH5α, которую затем наносили на чашку со средой LB, содержащей канамицин (25 мг/л). Ген, вставленный в вектор pDZ, подвергали секвенированию оснований с получением в конечном счете вектора pDZ_Δ2284.
Дополнительный вектор обогащения (экспрессии) для отдельных генов был сконструирован путем расщепления основного вектора pDZ_Δ2284 с помощью рестрикционных ферментов NdeI и CIP (NEB), термической обработки расщепленного вектора при 65°С в течение 20 мин, очистки термически обработанного вектора и лигирования промотора и каждого генного ДНК фрагмента в вектор с помощью набора для клонирования In-Fusion. В качестве промотора для дополнительной генной экспрессии использовали генный промотор gapA с SEQ ID NO: 13. С целью получения промотора выполняли ПЦР с использованием праймеров SEQ ID NO: 7 и 8 с АТСС13032 гДНК (NC_003450.3), служащей в качестве матрицы. В присутствии pfu-полимеразы ПЦР начинали с 10 мин денатурации при 95°С и осуществляли 30 циклов денатурации при 95°С в течение 1 мин, отжига при 55°С в течение 1 мин и удлинения при 72°С в течение 1 мин с последующим заключительным удлинением при 72°С в течение 10 мин. ДНК фрагменты для двух генов BpOF4_13735 и BPOF4_13740 амплифицировали из гДНК Bacillus pseudofirmus OF4 таким же образом, как для промотора, за исключением использования праймеров SEQ ID NO: 9 и 10 для BpOF4_13735 (SEQ ID NO: 14) и праймеров SEQ ID NO: 11 и 12 для BpOF4_13740 (SEQ ID NO: 15). Полученные таким образом ДНК фрагменты очищали с использованием набора GeneAll Expin GEL SV (Seoul, KOREA) и затем лигировали с pDZ_Δ2284 с получением в конечном счете двух разных векторов: pDZ_Δ2284::PgapA BpOF4_13735 и pDZ_Δ2284::PgapA BpOF4_13740.
Каждым из двух векторных конструктов трансформировали лизин-продуцирующий штамм Corynebacterium glutamicum KCCM11016P (патент Кореи №10-0159812), используя метод электропорации. Вторичный ДНК-кроссовер обогащал отдельные гены в штаммах. Два сконструированных таким образом конечных штамма были обозначены как KCCM11016P_Δ2284::Pgap A BpOF4_13735 и KCCM11016P_Δ2284::PgapA BpOF4_13740, соответственно.
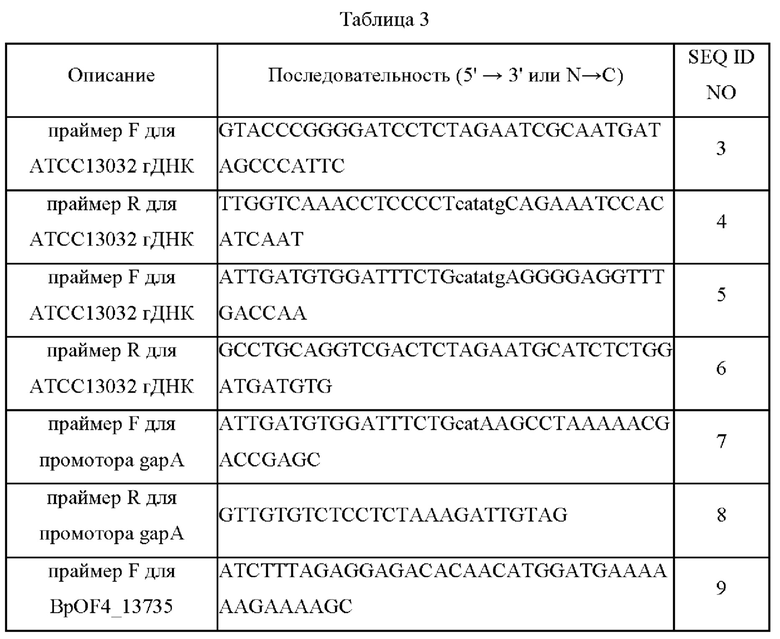
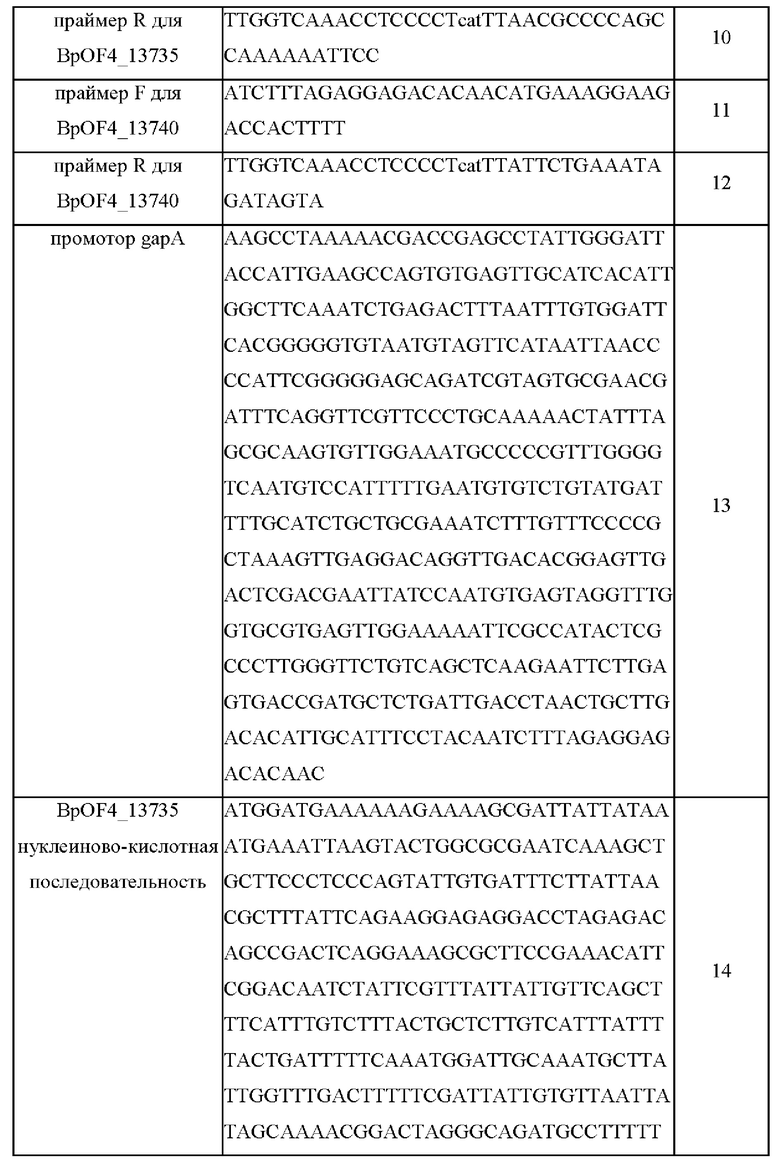
Используемые праймеры, промоторы, нуклеиново-кислотные
последовательности генов BpOF4 и аминокислотные последовательности, кодируемые этими генами, приведены в Таблице 3 ниже.

ПРИМЕР 5: Анализ потенциала продуцирования лизина у штаммов с введенными в них отдельными генами
Два штамма, полученных в Примере 4, культивировали следующим образом так, чтобы измерять значения ОП, выходы продукции лизина и скорости потребления сахара (г/ч). Сначала каждый штамм инокулировали в 250-мл колбу с угловыми перегородками, содержащую 25 мл посевной среды и затем культивировали при 30°С в течение 20 часов со встряхиванием при 150 об./мин. Затем 1 мл посевной культуры инокулировали в колбу на 250 мл с угловыми перегородками, содержащую 24 мл среды для продуцирования и затем культивировали при 32°С в течение 40 часов со встряхиванием при 150 об./мин. Составы посевной среды и среды для продуцирования приведены ниже, а результаты культивирования представлены в Таблице 4 ниже. Посевная среда (рН 7,0):
глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, пантотенат кальция 2000 мкг, никотинамид 2000 мкг (на литр дистиллированной воды).
Среда для продуцирования (рН 7,0):
глюкоза 45 г, меласса, полученная из сахарной свеклы 10 г, жидкость вымачивания сои 10 г, (NH4)2SO4 24 г, MgSO4⋅7H2O 0,6 г, KH2PO4 0,55 г, мочевина 5,5 г, СаСО3 30 г, биотин 0,9 мг, тиамин HCl 4,5 мг, пантотенат кальция 4,5 мг, никотинамид 30 мг, MnSO4⋅5H2O 9 мг, ZnSO4⋅5H2O 0,45 мг, CuSO4⋅5H2O 0,45 мг, FeSO4⋅5H2O 9 мг и канамицин 25 мг (на литр дистиллированной воды).
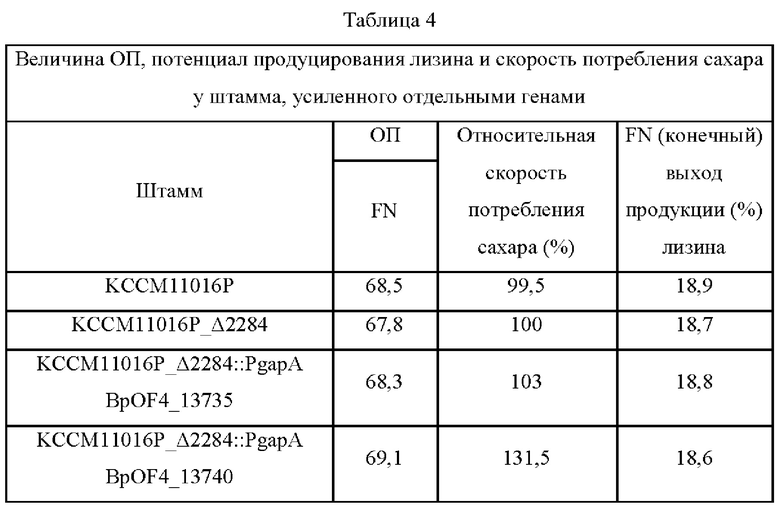
Штамм, в котором был сверхэкспрессирован BpOF4_13735, представляющий собой один из двух генов, полученных из библиотеки гДНК, не демонстрировал существенно улучшенного эффекта в показателях выхода продукции лизина и скорости потребления сахара по сравнению с родительским штаммом KCCM11016P_Δ2284. В отличие от него, было обнаружено, что штамм KCCM11016P_Δ2284::PgapA BpOF4_13740, хотя и сходный с родительским штаммом KCCM11016P_Δ2284 по конечной величине ОП и выходу, имеет скорость потребления сахара в час в течение среднего периода культивирования (от 17 до 24 часов), повышенную на 31,5% по сравнению с родительским штаммом.
И наконец, было обнаружено, что эффекты колоний LYS_Lib.Bps #257, #881 и #4213, показанные в Примере 2, были связаны с усилением BpOF4_13740.
ПРИМЕР 6: Увеличение потенциала продуцирования лизина в ВрОР4_13740-усиленном штамме
Для того, чтобы вторично проверить эффект гена BpOF4_13740, подтвержденный в Примере 5, ген BpOF4_13740 анализировали после его усиления с помощью другого промотора. И также анализировали эффект для гена BpOF4_05495, также подтвержденный посредством анализа NCBI BLAST как такой же функциональный белок.
С этой целью дополнительно сконструировали вектор экспрессии гена таким же образом, как в случае вектора, сконструированного в Примере 3.
Промотор sigB амплифицировали посредством ПЦР с использованием праймеров SEQ ID NOS: 17 и 18 с АТСС13032 гДНК в качестве матрицы. Используя праймеры SEQ ID NOS: 19 и 12, ПЦР выполняли на матрице гДНК Bacillus pseudofirmus OF4 с амплификацией гена BpOF4_13740. Эти два генных фрагмента лигировали с pDZ_Δ2284 с получением вектора pDZ_Δ2284::PsigB BpOF4_13740.
Усиления гена BpOF4_05495 также достигали аналогичным образом, сконструировав векторы pDZ_Δ2284::PsigB BpOF4_05495 и pDZ_Δ2284::PgapA BpOF4_05495. Генный фрагмент BpOF4_05495 получали с использованием праймеров SEQ ID NOS: 20 и 21 и праймеров SEQ ID NOS: 22 и 21. Также оценивали эффект, полученный при одновременном обогащении этих двух генов. Для этого дополнительно синтезировали праймеры SEQ ID NOS: 23 и 24, которые были сконструированы так, что они содержали последовательность связывания рибосом (RBS), и конструировали вектора pDZ_Δ2284::PsigB BpOF4_13740_05495 и pDZ_Δ2284::PgapA BpOF4_13740_05495.
Каждым из пяти дополнительных векторных конструктов (вектор pDZ_Δ2284::PsigB BpOF4_13740, вектор pDZ_Δ2284::PsigB BpOF4_05495, вектор pDZ_Δ2284::PgapA BpOF4_05495, вектор pDZ_Δ2284::PsigB BpOF4_13740_05495 и вектор pDZ_Δ2284::PgapA BpOF4_13740_05495) трансформировали лизин-продуцирующий штамм Corynebacterium glutamicum KCCM11016P (патент Кореи №10-0159812) методом электропорации и подвергали вторичному ДНК-кроссоверу с получением штаммов, содержащих усиленные отдельные гены.
Эти пять полученных таким образом штаммов были обозначены как KCCM11016P_Δ2284::PsigB BpOF4_13740, KCCM11016P_Δ2284::PsigB BpOF4_05495, KCCM11016P_Δ2284::PgapA BpOF4_05495, KCCM11016P_Δ2284::PsigB BpOF4_13740_05495 и KCCM11016P_Δ2284::PgapA BpOF4_13740_05495, соответственно.
Праймеры, промоторы, нуклеиново-кислотные последовательности BpOF4_05495 и аминокислотная последовательность, кодируемая этим геном, приведены в Таблице 5 ниже.
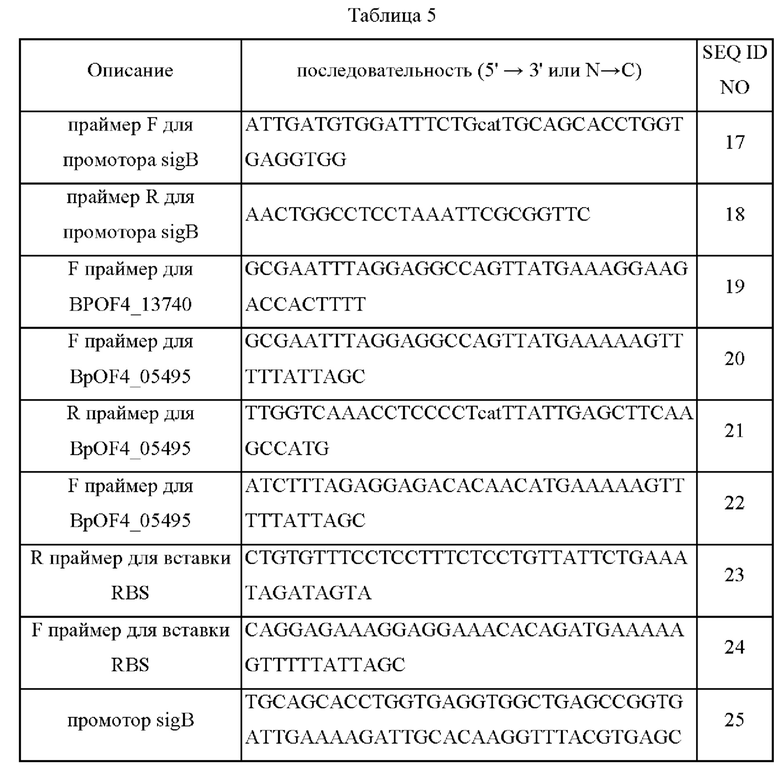

Эти пять штаммов, KCCM11016P_Δ2284::PsigB BpOF4_13740, KCCM11016P_Δ2284::PsigB BpOF4_05495, KCCM11016P_Δ2284::PgapA BpOF4_05495, KCCM11016P_Δ2284::PsigB BpOF4_13740 05495 и KCCM11016P_Δ2284::PgapA BpOF4_13740 05495, оценивали в колбах в таких же условиях, как в Примере 5, и результаты представлены в Таблице 6 ниже.
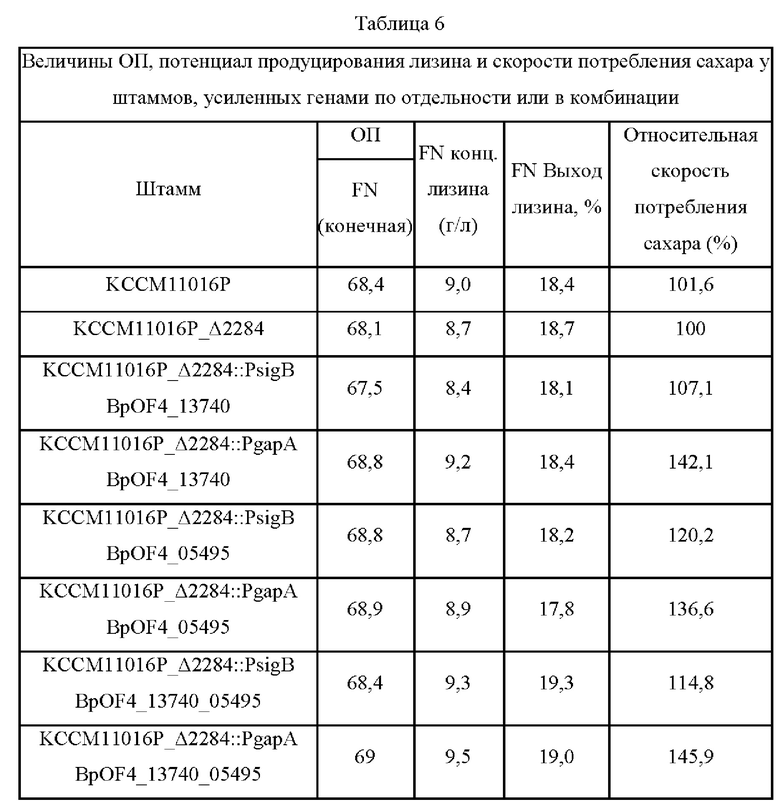
Экспрессия гена BpOF4_13740 под контролем промотора sigB и промотора gapA имела результатом повышение скоростей потребления сахара в час на 7,1% и 42,1%, соответственно, по сравнению с контролем KCCM11016P_Δ2284. Кроме того, когда ген BpOF4_05495, который кодирует аналогичный белок, дополнительно вводили под контролем промоторов sigB и gap А, скорости потребления сахара повышались на 20,2% и 36,6%, соответственно. Эти два результата свидетельствуют о том, что скорости потребления сахара (г/ч) повышаются при усилении гена под контролем промотора. Кроме того, наблюдали, что скорости потребления сахара достигали максимальных значений при одновременной экспрессии генов BpOF4_13740 и BpOF4_05495. Более конкретно, штамм KCCM11016P_Δ2284::PgapA BpOF4_13740 05495 демонстрировал скорость потребления сахара в час, повышенную на 45,9% по сравнению с контролем KCCM11016P_Δ2284.
Штамм KCCM11016P_Δ2284::PgapA BpOF4_13740_05495 (обозначенный как Corynebacterium glutamicum СМ03-885), который имеет увеличенный потенциал продуцирования лизина, был депонирован в Корейском центре культур микроорганизмов, расположенном в Hongje-dong, Seodamun-Gu, Seoul, Korea, 13 декабря 2019 с присвоением ему номера доступа KCCM 12640Р.
ПРИМЕР 7: Анализ ВрОЕ4_13740_05495-усиленного штамма в отношении потенциала продуцирования лизина
Каждый из продуцирующих L-лизин штаммов Corynebacterium glutamicum KCCM10770P (патент Кореи №10-0924065) и KCCM11347P (патент Кореи №10-0073610) усиливали генами, отобранными в Примере 6. С этой целью гены вводили таким же образом, как в Примере 6. В конечном счете, каждым из трех векторов pDZ_A2284, PDZ_A2284::PsigB BpOF4_13740_05495 и pDZ_Δ2284::PgapA BpOF4_13740 05495 трансформировали два штамма Corynebacterium glutamicum KCCM10770P и KCCM11347P с получением всего шести штаммов, KCCM10770P_Δ2284, KCCM10770P_Δ2284::PsigB BpOF4_13740_05495, KCCM10770P_Δ2284::PgapA BpOF4_13740_05495, KCCM11347P_Δ2284, KCCM11347P_Δ2284::PsigB BpOF4_13740_05495 и KCCM11347P_Δ2284::PgapA BpOF4_13740 05495.
Полученные таким образом усиленные генами штаммы культивировали таким же образом, как в Примере 5, и измеряли ОП, выход продукции лизина и относительную скорость потребления сахара в час (когда скорости потребления сахара в час для KCCM10770P_Δ2284 и KCCM11347P_Δ2284 были приняты за 100%), и результаты представлены в Таблице 7 ниже.
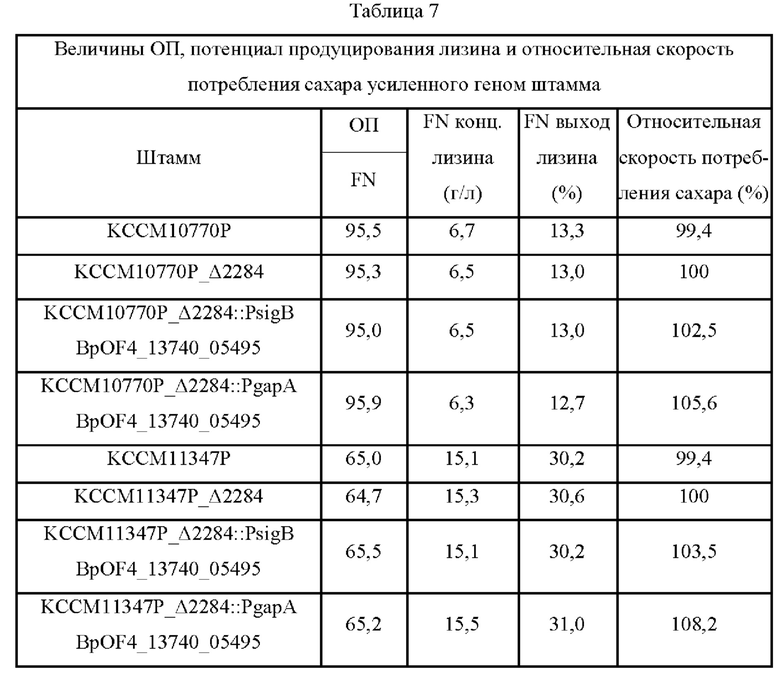
Как показано в Таблице 7, ген-усиленные штаммы, полученные в этом Примере, хотя и схожи контролем по показателям OD, конечной (FN) концентрации лизина и выхода продукции лизина, имели более короткое время ферментирования вследствие более высокой скорости потребления ими сахара.
ПРИМЕР 8: Получение штамма CJ3P с введенным BpOF4_13740_05495 и его анализ в отношении потенциала продуцирования им лизина
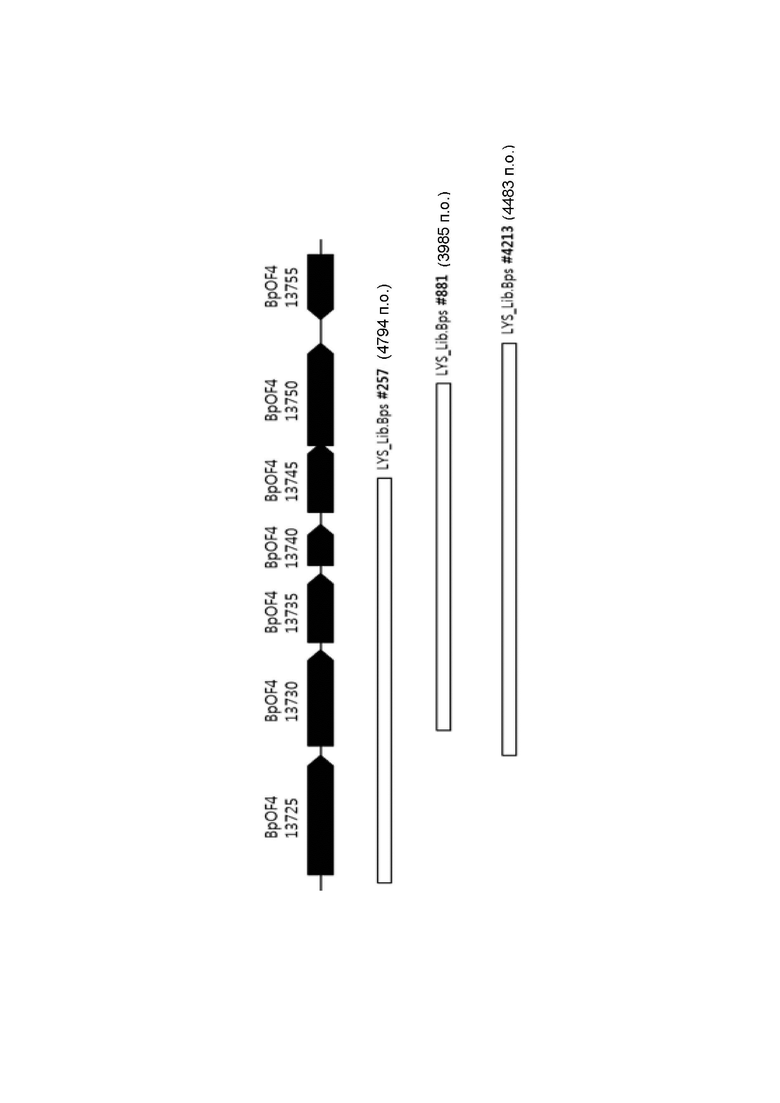
Было проведено исследование, чтобы установить, будут ли разные варианты Corynebacterium glutamicum, продуцирующие L-лизин, демонстрировать такой же эффект, как показано выше. Для этого штамм Corynebacterium glutamicum CJ3P (Binder et al. Genome Biology 2012, 13:R40), который был получен путем введения трех мутаций [pyc(P458S), hom(V59A) и lysC(T311I)] в дикий тип для придания ему потенциала продуцирования L-лизина, был усилен посредством BpOF4_13740_05495 таким же образом, как в Примере 7. Полученные таким образом усиленные штаммы были обозначены как CJ3_Δ2284, CJ3_Δ2284::PsigB BpOF4_13740_05495 и CJ3_Δ2284::PgapA BpOF4_13740_05495, соответственно. Контрольный штамм CJ3P (не усиленный посредством BpOF4_13740_05495) и три полученных штамма культивировали таким же образом, как в Примере 5, и измеряли у них ОП, выход продукции лизина и относительную скорость потребления сахара в час (где скорость потребления сахара в час у каждого из KCCM10770P_Δ2284 и KCCM11347P_Δ2284 была принята за 100%), а результаты представлены в Таблице 8 ниже.
Как видно из Таблицы 8, было установлено, что BpOF4_13740_05495-усиленный штамм, хотя и схож с контролем по показателям ОП, конечной (FN) концентрации лизина и выхода продукции лизина, демонстрирует повышение скорость потребления сахара в час на 60% или более.
Из приведенного выше описания специалисту в данной области техники будет понятно, что настоящее изобретение может быть воплощено в других конкретных формах без отступления от его сущности или основных характеристик. Таким образом, следует понимать, что воплощения, описанные выше, являются иллюстративными во всех аспектах и не ограничивающими. Объем настоящей заявки следует интерпретировать как находящийся в объеме настоящей заявки, всех изменений или модификаций, полученных из значения и объема прилагаемой формулы изобретения и из ее эквивалентов, а не из подробного описания.
--->
<110> CJ CheilJedang Corporation
<120> Microorganism for L-Amino Acid Production with Enhanced
Cytochrome C Activity and Method of L-Amino Acid Production Using the
Same
<130> OPP20203644KR
<150> KR 10-2019-0173087
<151> 2019-12-23
<150> KR 10-2019-0173088
<151> 2019-12-23
<160> 27
<170> koPatentIn 3.0
<210> 1
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер
<400> 1
taatacgact cactataggg
20
<210> 2
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер
<400> 2
caattaaccc tcactaaa
18
<210> 3
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для ATCC13032 гДНК
<400> 3
gtacccgggg atcctctaga atcgcaatga tagcccattc
40
<210> 4
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер для ATCC13032 гДНК
<400> 4
ttggtcaaac ctcccctcat atgcagaaat ccacatcaat
40
<210> 5
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для ATCC13032 гДНК
<400> 5
attgatgtgg atttctgcat atgaggggag gtttgaccaa
40
<210> 6
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер для ATCC13032 гДНК
<400> 6
gcctgcaggt cgactctaga atgcatctct ggatgatgtg
40
<210> 7
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для промотора gapA
<400> 7
attgatgtgg atttctgcat aagcctaaaa acgaccgagc
40
<210> 8
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер для промотора gapA
<400> 8
gttgtgtctc ctctaaagat tgtag
25
<210> 9
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для BpOF4_13735
<400> 9
atctttagag gagacacaac atggatgaaa aaagaaaagc
40
<210> 10
<211> 44
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер для BpOF4_13735
<400> 10
ttggtcaaac ctcccctcat ttaacgcccc agccaaaaaa ttcc
44
<210> 11
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для BpOF4_13740
<400> 11
atctttagag gagacacaac atgaaaggaa gaccactttt
40
<210> 12
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер для BpOF4_13740
<400> 12
ttggtcaaac ctcccctcat ttattctgaa atagatagta
40
<210> 13
<211> 481
<212> DNA
<213> Artificial Sequence
<220>
<223> промотор gapA
<400> 13
aagcctaaaa acgaccgagc ctattgggat taccattgaa gccagtgtga gttgcatcac
60
attggcttca aatctgagac tttaatttgt ggattcacgg gggtgtaatg tagttcataa
120
ttaaccccat tcgggggagc agatcgtagt gcgaacgatt tcaggttcgt tccctgcaaa
180
aactatttag cgcaagtgtt ggaaatgccc ccgtttgggg tcaatgtcca tttttgaatg
240
tgtctgtatg attttgcatc tgctgcgaaa tctttgtttc cccgctaaag ttgaggacag
300
gttgacacgg agttgactcg acgaattatc caatgtgagt aggtttggtg cgtgagttgg
360
aaaaattcgc catactcgcc cttgggttct gtcagctcaa gaattcttga gtgaccgatg
420
ctctgattga cctaactgct tgacacattg catttcctac aatctttaga ggagacacaa
480
c
481
<210> 14
<211> 540
<212> DNA
<213> Artificial Sequence
<220>
<223> нуклеиново-кислотная последовательность BpOF4_13735
<400> 14
atggatgaaa aaagaaaagc gattattata aatgaaatta agtactggcg cgaatcaaag
60
ctgcttccct cccagtattg tgatttctta ttaacgcttt attcagaagg agaggaccta
120
gagacagccg actcaggaaa gcgcttccga aacattcgga caatctattc gtttattatt
180
gttcagcttt catttgtctt tactgctctt gtcatttatt ttactgattt ttcaaatgga
240
ttgcaaatgc ttattggttt gactttttcg attattgtgt taattatagc aaaacggact
300
agggcagatg ccttttttct taaacaattt tactatttta taggggctct gatcctcttt
360
ttactaacga ttgaatgggt tgttcactac aaaagtacta ataacctttt attatcagca
420
acaatcattt tacattgcgt tttttggctc tttgcagggc tgaaatggaa aatgcgattt
480
tttacgatat ctgctatact aggactagta gtgttaggaa ttttttggct ggggcgttaa
540
540
<210> 15
<211> 372
<212> DNA
<213> Artificial Sequence
<220>
<223> нуклеиново-кислотная последовательность BpOF4_13740
<400> 15
atgaaaggaa gaccactttt accatttgcg atcatagcaa ttgtcgggat tgttgttatg
60
atttcgcttt catttattgg gttaaaccag cgtgaagcga tgcaggcaga tgaagaagga
120
gaagaagaag taactgaaat tgaagatccg gtagcagctg gagaagaatt agtgcaaact
180
tcttgtatcg gttgtcacgg tggcgattta agcggtggtg caggtcctgc cctaacgtct
240
cttgaaggtc aatacactca agaagaaatt acagatattg ttgttaatgg gattggatca
300
atgccgtcag ttaacgataa cgaagtagaa gcagacgcaa ttgcacagta tttactatct
360
atttcagaat aa
372
<210> 16
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<223> аминокислотная последовательность BpOF4_13740
<400> 16
Met Lys Gly Arg Pro Leu Leu Pro Phe Ala Ile Ile Ala Ile Val Gly
1 5 10 15
Ile Val Val Met Ile Ser Leu Ser Phe Ile Gly Leu Asn Gln Arg Glu
20 25 30
Ala Met Gln Ala Asp Glu Glu Gly Glu Glu Glu Val Thr Glu Ile Glu
35 40 45
Asp Pro Val Ala Ala Gly Glu Glu Leu Val Gln Thr Ser Cys Ile Gly
50 55 60
Cys His Gly Gly Asp Leu Ser Gly Gly Ala Gly Pro Ala Leu Thr Ser
65 70 75 80
Leu Glu Gly Gln Tyr Thr Gln Glu Glu Ile Thr Asp Ile Val Val Asn
85 90 95
Gly Ile Gly Ser Met Pro Ser Val Asn Asp Asn Glu Val Glu Ala Asp
100 105 110
Ala Ile Ala Gln Tyr Leu Leu Ser Ile Ser Glu
115 120
<210> 17
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для промотора sigB
<400> 17
attgatgtgg atttctgcat tgcagcacct ggtgaggtgg
40
<210> 18
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер для промотора sigB
<400> 18
aactggcctc ctaaattcgc ggttc
25
<210> 19
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для BPOF4_13740
<400> 19
gcgaatttag gaggccagtt atgaaaggaa gaccactttt
40
<210> 20
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для BpOF4_05495
<400> 20
gcgaatttag gaggccagtt atgaaaaagt ttttattagc
40
<210> 21
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер для BpOF4_05495
<400> 21
ttggtcaaac ctcccctcat ttattgagct tcaagccatg
40
<210> 22
<211> 40
<212> DNA
<213> Artificial Sequence
<220>
<223> F праймер для BpOF4_05495
<400> 22
atctttagag gagacacaac atgaaaaagt ttttattagc
40
<210> 23
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> R праймер для вставки RBS
<400> 23
ctgtgtttcc tcctttctcc tgttattctg aaatagatag ta
42
<210> 24
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> праймер F для вставки RBS
<400> 24
caggagaaag gaggaaacac agatgaaaaa gtttttatta gc
42
<210> 25
<211> 280
<212> DNA
<213> Artificial Sequence
<220>
<223> промотор sigB
<400> 25
tgcagcacct ggtgaggtgg ctgagccggt gattgaaaag attgcacaag gtttacgtga
60
gcgcggaatc accgtggaac aaggacgatt cggcgcaatg atgaaggtca catcggttaa
120
cgaaggcccc ttcaccgttt tggtcgagtg ctagccagtc aatcctaaga gcttgaaacg
180
ccccaatgtg ggggtgttaa gaactccata aaagcgcttg ggaacttttt gtggaagcag
240
tccgttgaac ctcttgaacc gcgaatttag gaggccagtt
280
<210> 26
<211> 366
<212> DNA
<213> Artificial Sequence
<220>
<223> нуклеиново-кислотная последовательность BPOF4_05495
<400> 26
atgaaaaagt ttttattagc tcttggcgca gttgttgctc ttacagcatg tggcggcgga
60
gacgaagctg ctccaccggt tgatgaggag tctccagcag tagatgaagc tccagcagat
120
gagcctgcag atgatgcaac agctggtgat tacgatgcag aatcagctcg tgctacatat
180
gagcaaagct gtatcgcatg tcatggcggc gatcttcaag gggcatcagg tccagctcta
240
gtaggaactg gcctgtcagc tgctgaaatt caagacatca tccaaaacgg acaaggttca
300
atgcctgctc aaaatttaga tgatgacgaa gctgctaacc tagctgcatg gcttgaagct
360
caataa
366
<210> 27
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> аминокислотная последовательность BPOF4_05495
<400> 27
Met Lys Lys Phe Leu Leu Ala Leu Gly Ala Val Val Ala Leu Thr Ala
1 5 10 15
Cys Gly Gly Gly Asp Glu Ala Ala Pro Pro Val Asp Glu Glu Ser Pro
20 25 30
Ala Val Asp Glu Ala Pro Ala Asp Glu Pro Ala Asp Asp Ala Thr Ala
35 40 45
Gly Asp Tyr Asp Ala Glu Ser Ala Arg Ala Thr Tyr Glu Gln Ser Cys
50 55 60
Ile Ala Cys His Gly Gly Asp Leu Gln Gly Ala Ser Gly Pro Ala Leu
65 70 75 80
Val Gly Thr Gly Leu Ser Ala Ala Glu Ile Gln Asp Ile Ile Gln Asn
85 90 95
Gly Gln Gly Ser Met Pro Ala Gln Asn Leu Asp Asp Asp Glu Ala Ala
100 105 110
Asn Leu Ala Ala Trp Leu Glu Ala Gln
115 120
<---
Изобретение относится к биотехнологии. Предложены продуцирующий L-лизин микроорганизм рода Corynebacterium, обладающий увеличенной активностью цитохрома C по сравнению с немодифицированным микроорганизмом, и способ получения L-лизина с использованием этого микроорганизма. При этом указанный микроорганизм содержит ген cccA, кодирующий аминокислотную последовательность SEQ ID NO: 16 цитохрома С-551, и/или ген cccВ, кодирующий аминокислотную последовательность SEQ ID NO: 27 цитохрома С-551, где цитохром C-551 имеет происхождение из микроорганизма Bacillus pseudofirmus OF4. Изобретение обеспечивает повышение продукции L-лизина. 2 н. и 2 з.п. ф-лы, 1 ил., 8 табл., 8 пр.
1. Продуцирующий L-лизин микроорганизм рода Corynebacterium, обладающий увеличенной активностью цитохрома C по сравнению с немодифицированным микроорганизмом, содержащий ген cccA, кодирующий аминокислотную последовательность SEQ ID NO: 16 цитохрома С-551, и/или ген cccВ, кодирующий аминокислотную последовательность SEQ ID NO: 27 цитохрома С-551, где цитохром C-551 имеет происхождение из микроорганизма Bacillus pseudofirmus OF4.
2. Продуцирующий L-лизин микроорганизм по п. 1, имеющий повышенную скорость потребления сахара по сравнению с гомогенным микроорганизмом, у которого активность цитохрома C не увеличена.
3. Продуцирующий L-лизин микроорганизм по любому из пп. 1 или 2, имеющий улучшенный потенциал продуцирования L-лизина по сравнению с гомогенным микроорганизмом, у которого активность цитохрома C не увеличена.
4. Способ получения L-лизина, включающий стадии:
культивирования продуцирующего L-лизин микроорганизма по п. 1 или 2 в среде; и
выделения L-лизина из культивируемого микроорганизма, среды или из того и другого.
| US 20020048795 A1, 25.04.2002 | |||
| NCBI Reference Sequence: WP_012960434.1, 14.12.2017 | |||
| Сytochrome c [Bacillus pseudofirmus] | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| NCBI Reference Sequence: WP_012958161.1, 26.05.2013 | |||
| Рабочее колесо паровой турбины | 1922 |
|
SU551A1 |
| Найдено онлайн: https://www.ncbi.nlm.nih.gov/protein/502723177?sat=21&satkey=58939752 | |||
Авторы
Даты
2024-05-16—Публикация
2020-12-22—Подача