ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым пиридазин-3-илфенольным соединениям, которые применимы в качестве ингибиторов сигнального пути инфламмасомы на основе NOD-подобного рецепторного белка 3 (NLRP3). Настоящее изобретение также относится к способам получения указанных соединений, фармацевтическим композициям, содержащим указанные соединения, способам применения указанных соединений в лечении различных заболеваний и нарушений и лекарственным препаратам, содержащим их, и их применению при заболеваниях и нарушениях, опосредованных NLRP3.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
NOD-подобный рецепторный белок 3 (NLRP3) представляет собой ген, кодирующий белок: белок принадлежит к семейству рецепторов, подобных нуклеотидсвязывающему олигомеризационному домену (NLR), и также известен как "белок 3, содержащий пириновый домен" (Inoue et al., Immunology, 2013, 139, 11-18). Данный ген кодирует белок, содержащий пириновый домен, домен с нуклеотидсвязывающим сайтом (NBD) и мотив с повторами, богатыми лейцином (LRR). В ответ на сигналы опасности об асептической воспалительной реакции NLRP3 взаимодействует с адапторным белком, представляющим собой подобный пятнышку регуляторный белок, ассоциированный с апоптозом (ASC), и прокаспазой-1 с образованием инфламмасомы NLRP3. Активация инфламмасомы NLRP3 затем приводит к высвобождению провоспалительных цитокинов IL-1β (интерлейкин-1β) и IL-18 (интерлейкин-18) и при нарушении регуляции может обуславливать патологический процесс в ряде ситуаций развития заболевания.
Для активации инфламмасомы NLRP3 обычно требуются две стадии. Первая стадия предусматривает примирующий сигнал, в рамках которого молекулярные структуры, активируемые патогенами (PAMP), или молекулярные структуры, активируемые сигналами опасности (DAMP), распознаются Toll-подобными рецепторами, что приводит к активации передачи сигнала, опосредованной ядерным фактором каппа-В (NF-κB), которая, в свою очередь, активирует транскрипцию компонентов, связанных с инфламмасомой, включая неактивный NLRP3 и про-IL-1β (проинтерлейкин-1β) (Bauernfeind et al J. Immunol. 2009, 183, 787-791; Franchi et al Nat. Immunol. 2012, 13, 325-332, Franchi et al J. Immunol. 2014, 193, 4214-4222). Вторая стадия представляет собой олигомеризацию NLRP3 и последующую сборку NLRP3, ASC и прокаспазы-1 в комплекс инфламмасомы. Это запускает превращение прокаспазы-1 в каспазу-1 и продуцирование и секрецию зрелых IL-1β и IL-18 (Kim et al J. Inflamm. 2015, 12, 41; Ozaki et al J. Inflamm. Res. 2015, 8, 15-27; Rabeony et al. Eur. J. Immunol. 2015, 45, 2847-2857).
Было установлено, что активация инфламмасомы NLRP3 связана с различными заболеваниями/нарушениями, связанными с инфламмасомами, иммунными заболеваниями, воспалительными заболеваниями, аутоиммунными заболеваниями и аутовоспалительными заболеваниями, например, аутовоспалительным лихорадочным синдромом, таким как криопирин-ассоциированный периодический синдром (CAPS) (Mortimer et al Nature Immunol. 2016, 17(10), 1176-1188); серповидно-клеточной анемией; системной красной волчанкой (SLE); заболеваниями/нарушениями, связанными с печенью, такими как хроническое заболевание печени, вирусный гепатит, неалкогольный стеатогепатит (NASH), алкогольный стеатогепатит и алкогольная болезнь печени (Petrasek et al J. Clin. Invest. 2012, 122, 3476-89; Petrasek et al. Nat. Rev. Gastroenterol. Hepatol. 2015, 12, 387-400; Mridha et al J. Hepatol. 2017, 66, 1037-46); нарушениями, связанными с воспалительным артритом, такими как подагра, псевдоподагра (хондрокальциноз), остеоартрит (Ridker et al N. Engl. J. Med. 2017, 377, 1119-31) и ревматоидный артрит (Mathews et al Ann. Rheum. Dis. 2014, 73, 1202-10), острая или хроническая артропатия; заболеваниями, связанными с почками, такими как гипероксалурия (Knauf et al. Kidney Int. 2013, 84, 895-901), волчаночный нефрит, гипертензивная нефропатия (Krishnan et al Br. J. Pharmacol. 2016, 173, 752-65), воспаление, связанное с гемодиализом, и диабетическая нефропатия, которая представляет собой осложнение сахарного диабета (сахарного диабета 1 типа и 2 типа), связанное с почками, также называемое диабетическим заболеванием почек (Shahzad et al Kidney Int. 2015, 87, 74-84). В появляющихся исследованиях было выявлено, что вовлечение повышенного продуцирования IL-1β и IL-18 инфламмасомой NLRP3 может способствовать началу проявления и прогрессированию различных заболеваний, таких как нарушения, связанные с нейровоспалением, например, инфекция головного мозга, острое повреждение, рассеянный склероз, болезнь Альцгеймера и нейродегенеративные заболевания (Shao et al. Front. Pharmacol. 2015, 6, 262); сердечно-сосудистые/метаболические нарушения/заболевания, например, снижение сердечно-сосудистого риска (CvRR), атеросклероз, сахарный диабет I типа и II типа и связанные с ним осложнения (например, нефропатия, ретинопатия), заболевание периферических артерий (PAD), острая сердечная недостаточность и гипертензия (Ridker et al N. Engl. J. Med. 2017, 377, 1119-31; Vandanmasgar et al Nat. Med. 2011, 17, 179-88; Hu et al Proc. Natl. Acad. Sci. 2015, 112, 11318-23; Antonopoulos et al Curr. Opin. Pharmacol. 2017, 39, 1-8; Toldo S et al Nat. Rev. Cardiol. 2018, 15, 203-214); заживление ран и образование шрамов; воспалительные заболевания кожи, например, акне, гнойный гидраденит (Sweeney et al Br. J. Dermatol. 2015, 173, 1361), астма, саркоидоз, возрастная макулярная дегенерация; заболевания/нарушения, связанные с раком, например, миелопролиферативные новообразования, формы лейкоза, формы миелодиспластического синдрома (MDS), миелофиброз, рак легкого, рак толстой кишки (Ridker et al Lancet 2017, 390, 1833-42; Derangere et al Cell. Death Differ. 2014, 21, 1914-24, Gelfo et al Oncotarget 2016, 7, 72167-83, Baiorka et al Blood 2016, 128, 2960-75; Carey et al Cell. Rep. 2017, 18, 3204-18). Те заболевания/нарушения, которые имеют иммунную или воспалительную природу, обычно трудно диагностировать или эффективно лечить. Большинство видов лечения включают лечение симптомов, замедление прогрессирования заболевания/нарушения, изменение образа жизни и хирургическую операцию в качестве крайней меры (например, хирургическую операцию на открытом сердце в случае запущенных форм атеросклероза). В недавних исследованиях была установлена связь митохондриальной дисфункции и активации NLRP3 при заболеваниях, связанных с нейровоспалением, таких как болезнь Паркинсона (Sarkar et al npj Parkinson's disease 2017, 3:30; Zhou et al Nature, 2011, 469, 221). Одной из основных проблем, связанных с модуляторами митохондрий, является их слабая метаболическая стабильность; поэтому существует необходимость в селективных и стабильных ингибиторах при нейровоспалении, имеющем данную природу (Lee et al Eur J. Org. Chem. 2017, 141, 240).
Следовательно, существует необходимость в ингибиторах сигнального пути инфламмасомы NLRP3 для обеспечения новых и/или альтернативных видов лечения для этих заболеваний/нарушений, связанных с инфламмасомами, и других, таких как аутовоспалительный лихорадочный синдром, представляющий собой криопирин-ассоциированный периодический синдром (например, CAPS), серповидно-клеточная анемия, хроническое заболевание печени, неалкогольный стеатогепатит (NASH), подагра, гипероксалурия, псевдоподагра (хондрокальциноз), сахарный диабет I типа/II типа и связанные с ним осложнения (например, нефропатия, ретинопатия), нарушения, связанные с нейровоспалением (например, рассеянный склероз, инфекция головного мозга, острое повреждение, нейродегенеративные заболевания, болезнь Альцгеймера), атеросклероз и сердечно-сосудистый риск (например, снижение сердечно-сосудистого риска (CvRR), гипертензия), гнойный гидраденит, заживление ран и образование шрамов, а также рак (например, рак толстой кишки, рак легкого, миелопролиферативные новообразования, формы лейкоза, формы миелодиспластического синдрома (MDS), миелофиброз).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предусмотрены соединения или их фармацевтически приемлемые соли, фармацевтические композиции на их основе и их комбинации, при этом данные соединения ингибируют сигнальный путь инфламмасомы NLRP3. В настоящем изобретении дополнительно предусмотрены способы лечения или предупреждения заболевания и/или нарушений, связанных с NLRP3, включающие введение субъекту, нуждающемуся в этом, эффективного количества соединений по настоящему изобретению или их фармацевтически приемлемой соли.
В данном документе описаны различные варианты осуществления настоящего изобретения.
В определенных аспектах в данном документе предусмотрено соединение формулы (I) или его фармацевтически приемлемая соль:
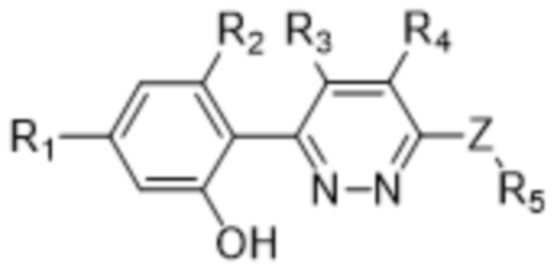 (I),
(I),
где
R1 представляет собой Cl, CH3, -OCF3 или CF3;
R2 представляет собой H, галоген, C1-C4алкил или галоген-C1-C4алкил;
R3, R4 представляют собой H, CN, C1-C4алкил или галоген-C1-C4алкил;
Z представляет собой -O- или -NH-(CH2)n-, где n равняется 0, 1 или 2;
R5 представляет собой моно- или бициклический гетероциклил, необязательно замещенный 1-2 заместителями, независимо выбранными из C1-C4алкила, галоген-C1-C4алкила, гидрокси-C1-C4алкила, -OH, галогена, оксо и -CO2H; или
R5 представляет собой арил или гетероарил, необязательно замещенный 1-2 заместителями, независимо выбранными из галогена, галоген-C1-C4алкила, C1-C4алкила и -SO2NH2; или
R5 представляет собой C3-C6циклоалкил, необязательно замещенный 1-3 заместителями, независимо выбранными из C1-C4алкила, галогена, галоген-C1-C4алкила и -OH; или
R5 представляет собой C2-C6алкил, замещенный 1 или несколькими заместителями, независимо выбранными из -OH, C1-C4алкокси, галогена, -NH2, -NH(C1-C4алкил) и -N(C1-C4алкил)2.
В другом аспекте в настоящем изобретении предусмотрена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения в соответствии с определением соединения формулы (I) или ее подформул, раскрытых в данном документе, или его фармацевтически приемлемой соли и один или несколько фармацевтически приемлемых носителей. Фармацевтическая композиция применима для лечения заболеваний и/или нарушений, связанных с активностью NLRP3.
В другом аспекте в настоящем изобретении предусмотрена комбинация, в частности, фармацевтическая комбинация, содержащая терапевтически эффективное количество соединения в соответствии с определением соединения формулы (I) или ее подформул, раскрытых в данном документе, или его фармацевтически приемлемой соли и одно или несколько терапевтических средств.
В другом аспекте в настоящем изобретении предусмотрена комбинация, в частности, фармацевтическая комбинация, раскрытая в данном документе, для применения в качестве лекарственного препарата.
В другом аспекте в настоящем изобретении предусмотрены соединение формулы (I) или ее подформул, раскрытых в данном документе, или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, при котором передача сигнала, опосредованная NLRP3, способствует патологическому процессу, и/или проявлению симптомов, и/или прогрессированию указанного заболевания или нарушения.
В другом аспекте в настоящем изобретении предусмотрен способ лечения заболевания или нарушения, при котором передача сигнала, опосредованная NLRP3, способствует патологическому процессу, и/или проявлению симптомов, и/или прогрессированию указанного заболевания или нарушения, включающий введение терапевтически эффективного количества соединения формулы (I) или ее подформул, раскрытых в данном документе, или его фармацевтически приемлемой соли.
В другом аспекте в настоящем изобретении предусмотрен способ ингибирования активности инфламмасомы NLRP3 у субъекта, нуждающегося в этом, при этом способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или ее подформул, раскрытых в данном документе, или его фармацевтически приемлемой соли.
Другой аспект настоящего изобретения относится к применению соединения формулы (I) или ее подформул, раскрытых в данном документе, или его фармацевтически приемлемой соли в качестве лекарственного препарата.
Другой аспект настоящего изобретения относится к соединению формулы (I) или ее подформул, раскрытых в данном документе, или его фармацевтически приемлемой соли для применения в качестве лекарственного препарата.
В другом аспекте настоящего изобретения также предусматривается соединение формулы (I) или ее подформул, раскрытых в данном документе, или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, выбранного из заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Таким образом, в настоящем изобретении предусматривается соединение формулы (I),
 (I),
(I),
где
R1 представляет собой Cl, CH3, -OCF3 или CF3;
R2 представляет собой H, галоген, C1-C4алкил или галоген-C1-C4алкил;
R3, R4 представляют собой H, CN, C1-C4алкил или галоген-C1-C4алкил;
Z представляет собой -O- или -NH-(CH2)n-, где n равняется 0, 1 или 2;
R5 представляет собой моно- или бициклический гетероциклил, необязательно замещенный 1-2 заместителями, независимо выбранными из C1-C4алкила, галоген-C1-C4алкила, гидрокси-C1-C4алкила, -OH, галогена, оксо и -CO2H; или
R5 представляет собой арил или гетероарил, необязательно замещенный 1-2 заместителями, независимо выбранными из галогена, галоген-C1-C4алкила, C1-C4алкила и -SO2NH2; или
R5 представляет собой C3-C6циклоалкил, необязательно замещенный 1-3 заместителями, независимо выбранными из C1-C4алкила, галогена, галоген-C1-C4алкила и -OH; или
R5 представляет собой C2-C6алкил, замещенный 1 или несколькими заместителями, независимо выбранными из -OH, C1-C4алкокси, галогена, -NH2, -NH(C1-C4алкил) и -N(C1-C4алкил)2.
Определения
Для цели толкования данного описания будут применяться следующие определения, если не указано иное, и при необходимости термины, используемые в единственном числе, будут также включать множественное число, и наоборот.
Следует отметить, что применяемые в данном документе и в прилагаемой формуле изобретения формы единственного числа и подобные термины, применяемые в контексте настоящего изобретения (особенно в контексте формулы изобретения), следует истолковывать как охватывающие как единственное число, так и множественное число, если контекст явно не предусматривает иное или это явно не противоречит контексту. Таким образом, например, ссылка на "соединение" включает ссылку на одно или несколько соединений и т. д.
Используемый в данном документе термин "C2-C6алкил" относится к радикалу с прямой или разветвленной углеводородной цепью, состоящему только из атомов углерода и водорода, не содержащему ненасыщенных связей, содержащему от двух до шести атомов углерода, и который присоединен к остальной части молекулы посредством одинарной связи. "C2-C6алкил", определенный в данном документе, необязательно замещен 1 или несколькими заместителями, предпочтительно 1-13 заместителями, более предпочтительно 1-8 заместителями. Более предпочтительно не более чем 7 заместителями. Термин "C1-C4алкил" следует истолковывать соответствующим образом. Примеры C2-C6алкила включают без ограничения этил, н-пропил, 1-метилэтил (изо-пропил), н-бутил, н-пентил и 1,1-диметилэтил (трет-бутил).
Используемый в данном документе термин "галогено-C1-C4алкил" или "галоген-C1-C4алкил" относится к C1-C4алкильному радикалу, определенному выше, замещенному одним или несколькими представляющими собой атом галогена радикалами, как определенно выше. Примеры галоген-C1-C4алкила включают без ограничения трифторметил, дифторметил, фторметил, трихлорметил, 2,2,2-трифторэтил, 1,3-дибромпропан-2-ил, 3-бром-2-фторпропил и 1,4,4-трифторбутан-2-ил.
Используемый в данном документе термин "C1-C4алкокси" относится к радикалу формулы -ORa, где Ra представляет собой C1-C4алкильный радикал, в целом определенный выше. Примеры "C1-C4алкокси" включают без ограничения метокси, этокси, пропокси, изопропокси, бутокси и изобутокси.
Используемый в данном документе термин "гидрокси-C1-C4алкил" относится к C1-C4алкильному радикалу, где один из атомов водорода C1-C4алкильного радикала заменен на OH. Примеры гидрокси-C1-C4алкила включают без ограничения гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил и 4-гидроксибутил.
Используемый в данном документе термин "атом галогена" или "галоген" относится к брому, хлору, фтору или йоду.
Используемый в данном документе термин "гетероциклил" или "гетероциклический" относится к стабильным 5- или 6-членному неароматическому моноциклическому кольцу, или бициклическому кольцу, или полициклическому кольцевому радикалу, которые содержат 3-24, предпочтительно 4-16, наиболее предпочтительно 5-10 атомов в кольце; где один или несколько, предпочтительно от одного до четырех, в частности один или два атома в кольце представляют собой гетероатом, выбранный из, например, кислорода, серы и азота (остальные атомы в кольце, следовательно, представляют собой атомы углерода). Термин "гетероциклил" исключает гетероарил. Гетероциклическая группа может быть присоединена к остальной части молекулы с помощью гетероатома, выбранного из, например, атома кислорода, серы, азота или углерода. Гетероциклил может включать, например, конденсированные или мостиковые кольца, а также спироциклические кольца. Например, термин "гетероциклил" может относиться к 5-7-членному моноциклическому кольцу, содержащему 1, 2 или 3 гетероатома, выбранных из атомов кислорода, азота и серы. Примеры моногетероциклила включают дигидрофуранил, диоксоланил, диоксанил, дитианил, пиперазинил, пирролидин, дигидропиранил, оксатиоланил, дитиолан, оксатианил, тиоморфолино, оксиранил, азиридинил, оксетанил, оксепанил, азетидинил, тетрагидрофуранил, тетрагидротиофенил, пирролидинил, тетрагидропиранил, пиперидинил, морфолино, пиперазинил, оксапинил, оксаазепанил, оксатианил, тиепанил, азепанил, диоксепанил и диазепанил. Предпочтительно моногетероциклил представляет собой морфолинo, пирролидин или пиперидинил. Примеры бициклического гетероциклила включают, например, азабициклооктанил или октагидроиндолизинил. В соответствии с настоящим изобретением термин "гетероциклил", замещенный заместителем "OH", также включает "гетероциклил", где гетероатом, например N или S, окислен с получением, например, гетероциклил-N-оксида, гетероциклил-S-оксида или гетероциклил-S-диоксида. Примеры гетероциклил-N-оксида включают пиперидинил-N-оксид. 1-Метилпирролидин-1-оксид. Примеры гетероциклил-S-оксида или гетероциклил-S-диоксида включают тетрагидро-2H-тиопиран-1-оксид, тетрагидро-2H-тиопиран-1,1-диоксид и тетрагидротиофен-1-оксид.
Используемый в данном документе термин "гетероарил" относится к радикалу, представляющему собой 5- или 6-членное ароматическое моноциклическое кольцо, которое содержит 1, 2, 3 или 4 гетероатома, по отдельности выбранных из атомов азота, кислорода и серы. Гетероарильный радикал может быть связан посредством атома углерода или гетероатома. Примеры гетероарила включают без ограничения фурил, пирролил, тиенил, пиразолил, имидазолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тетразолил, пиразинил, пиридазинил, пиримидил или пиридил.
Используемый в данном документе термин "C3-C6циклоалкил" относится к стабильному моноциклическому, бициклическому или трициклическому насыщенному углеводородному радикалу, состоящему только из атомов углерода и водорода, содержащему от трех до десяти атомов углерода. Термин "бициклический циклоалкил" также включает спиробициклический циклоалкил. Примеры моноциклического C3-C6циклоалкила включают без ограничения циклопропил, циклобутил, циклопентил и циклогексил. Примеры бициклического C3-C10циклоалкила включают без ограничения бицикло[1.1.1]пентан.
Используемый в данном документе термин "арил" относится к ароматической углеводородной группе, содержащей 6-20 атомов углерода в кольцевой части. Как правило, арил является моноциклическим, бициклическим или трициклическим арилом, содержащим 6-20 атомов углерода. В предпочтительном варианте осуществления арил представляет собой фенил.
Если не указано иное, термин "соединения по настоящему изобретению" относится к соединениям формулы (I) или ее подформул (таким как соединение формулы (II), соединение формулы (III) или соединение формулы (III-A), описанные в данном документе) и их солям, а также ко всем стереоизомерам (включая диастереоизомеры и энантиомеры), ротамерам, таутомерам и изотопно-меченым соединениям (включая замещенные дейтерием). Термин "соединения по (настоящему) изобретению" или "соединение по (настоящему) изобретению" относится к соединению, определенному в любом из вариантов осуществления, указанных ниже.
Различные варианты осуществления настоящего изобретения описаны в данном документе, при этом необходимо понимать, что признаки, указанные в каждом варианте осуществления, можно объединять с другими указанными признаками с получением дополнительных вариантов осуществления настоящего изобретения.
В варианте осуществления 1 в настоящем изобретении предусмотрены соединение формулы (I) или его фармацевтически приемлемая соль, описанные выше.
В варианте осуществления 2 в настоящем изобретении предусмотрены соединение формулы (I) или его фармацевтически приемлемая соль в соответствии с вариантом осуществления 1, характеризующиеся формулой (II),
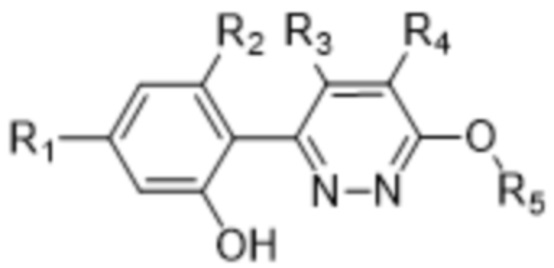 (II),
(II),
где R1, R2, R3, R4 и R5 определены в варианте осуществления 1.
В варианте осуществления 3 в настоящем изобретении предусмотрены соединение формулы (I) или его фармацевтически приемлемая соль в соответствии с вариантом осуществления 1, характеризующиеся формулой (III),
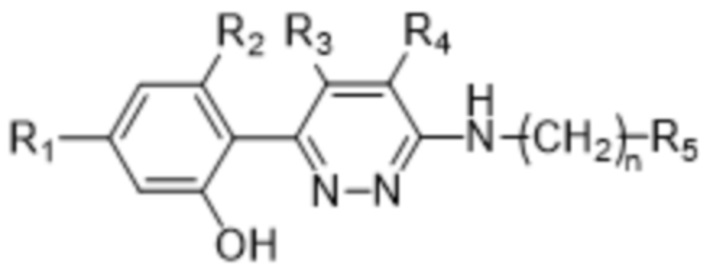 (III),
(III),
где n равняется 0, 1 или 2; и R1, R2, R3, R4 и R5 определены в варианте осуществления 1.
В варианте осуществления 3a и в соответствии с вариантом осуществления 3 в настоящем изобретении предусмотрены соединение формулы (III) или его фармацевтически приемлемая соль, характеризующиеся формулой (III-A),
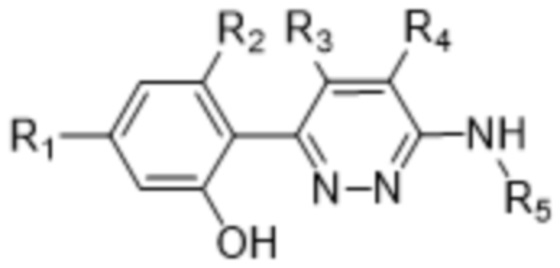 (III-A),
(III-A),
где R1, R2, R3, R4 и R5 определены в варианте осуществления 1.
В варианте осуществления 4 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с вариантом осуществления 1, 2, 3 или 3a, где R5 представляет собой моно- или бициклический гетероциклил, необязательно замещенный 1-2 заместителями, независимо выбранными из C1-C4алкила, галоген-C1-C4алкила, гидрокси-C1-C4алкила, -OH, галогена, оксо и -CO2H.
В варианте осуществления 5 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с вариантом осуществления 4, где R5 выбран из следующего:
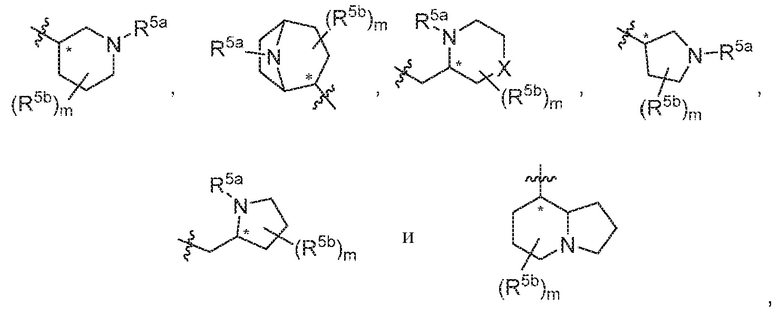
где R5a независимо выбран из C1-C4алкила, гидрокси-C1-C4алкила и H; и R5b независимо выбран из -OH, гидрокси-C1-C4алкила, H, галогена, оксо, галоген-C1-C4алкила и -CO2H; X представляет собой O или CH2; и m равняется 0 или 1.
В варианте осуществления 5a и в соответствии с вариантом осуществления 5 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 выбран из следующего:
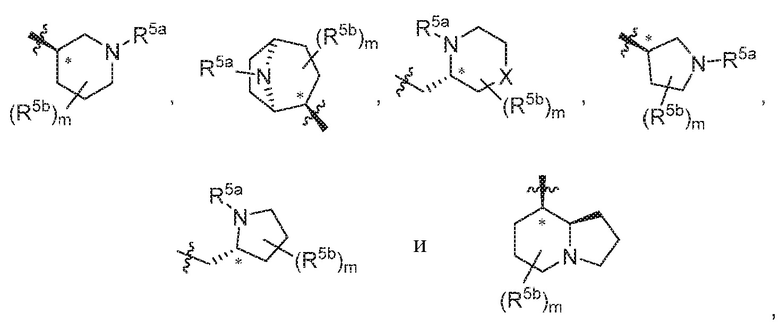 ,
,
где R5a независимо выбран из C1-C4алкила, гидрокси-C1-C4алкила и H; и R5b независимо выбран из -OH, C1-C4алкила, гидрокси-C1-C4алкила, H, галогена, оксо, галоген-C1-C4алкила и -CO2H; X представляет собой O или CH2; и m равняется 0 или 1.
В варианте осуществления 5b и в соответствии с вариантом осуществления 5 и 5b в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 является таким, как описано в данном документе выше, и стереохимическая конфигурация при атоме углерода, меченном "⃰", представляет собой (R) или (S). Предпочтительно, если Z представляет собой -NH-(CH2)n-, при этом n=1 или 2, стереохимическая конфигурация при атоме углерода, меченном "⃰", представляет собой (S). Предпочтительно Z представляет собой -O- или -NH-(CH2)n-, при этом n=0, стереохимическая конфигурация при атоме углерода, меченном "⃰", представляет собой (R).
В варианте осуществления 5c и в соответствии с вариантом осуществления 5, 5a и 5b в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
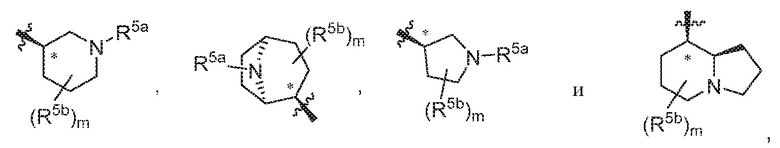
где R5a независимо выбран из C1-C4алкила, гидрокси-C1-C4алкила и H; и R5b независимо выбран из -OH, C1-C4алкила, гидрокси-C1-C4алкила, H, галогена, оксо, галоген-C1-C4алкила и -CO2H; и m равняется 0 или 1.
В варианте осуществления 5d и в соответствии с вариантами осуществления 5, 5a, 5b и 5c в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
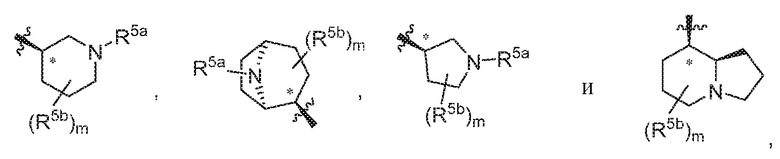
где R5a независимо выбран из C1-C4алкила, гидрокси-C1-C4алкила и H; и R5b независимо выбран из -OH, C1-C4алкила, гидрокси-C1-C4алкила, H, галогена, оксо, галоген-C1-C4алкила и -CO2H; и m равняется 0 или 1.
В варианте осуществления 5e и в соответствии с вариантами осуществления 5, 5a, 5b, 5c и 5d в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно представляет собой следующую структуру:
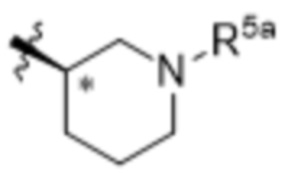 ,
,
где R5a независимо выбран из C1-C4алкила, гидрокси-C1-C4алкила и H.
В варианте осуществления 6 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с вариантами осуществления 1, 2, 3 или 3a, где R5 представляет собой арил или гетероарил, необязательно замещенный 1-2 заместителями, независимо выбранными из галогена, галоген-C1-C4алкила, C1-C4алкила и -SO2NH2.
В варианте осуществления 6a и в соответствии с вариантом осуществления 6 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
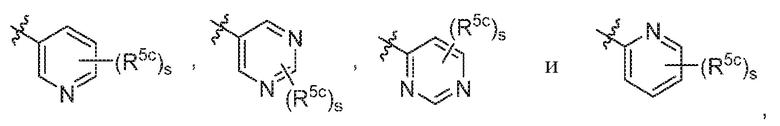
где R5c независимо выбран из H, C1-C4алкила и -SO2NH2; и s равняется 0, 1 или 2.
В варианте осуществления 6b и в соответствии с вариантом осуществления 6 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
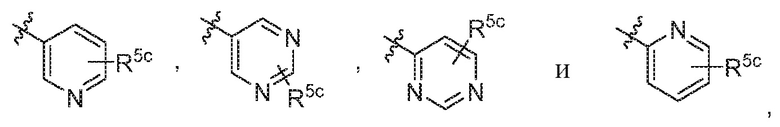
где R5c независимо выбран из H, C1-C4алкила и -SO2NH2.
В варианте осуществления 6c и в соответствии с вариантами осуществления 6 и 6b в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
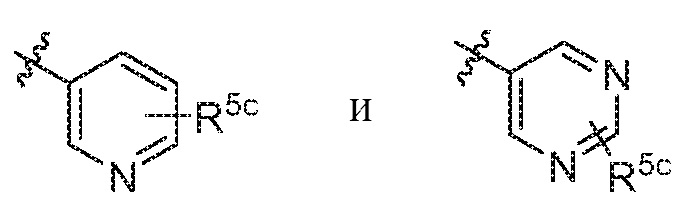
где R5c независимо выбран из H и C1-C4алкила.
В варианте осуществления 7 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с вариантом осуществления 1, 2, 3 или 3a, где R5 представляет собой C3-C6циклоалкил, необязательно замещенный 1-3 заместителями, независимо выбранными из C1-C4алкила, галогена, галоген-C1-C4алкила и -OH.
В варианте осуществления 7a и в соответствии с вариантом осуществления 7 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно представляет собой циклопропил, циклобутил, циклопентил или циклогексил, необязательно замещенные 1-3 заместителями, независимо выбранными из C1-C4алкила, галогена, галоген-C1-C4алкила и -OH.
В варианте осуществления 7b и в соответствии с вариантом осуществления 7 и 7a в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
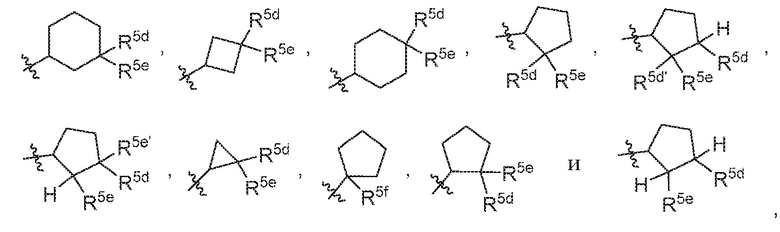 ,
,
где R5e, R5e', R5d, R5d' и R5f независимо выбраны из H, C1-C4алкила, галогена, галоген-C1-C4алкила и -OH.
В варианте осуществления 7c и в соответствии с вариантом осуществления 7, 7a и 7b в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
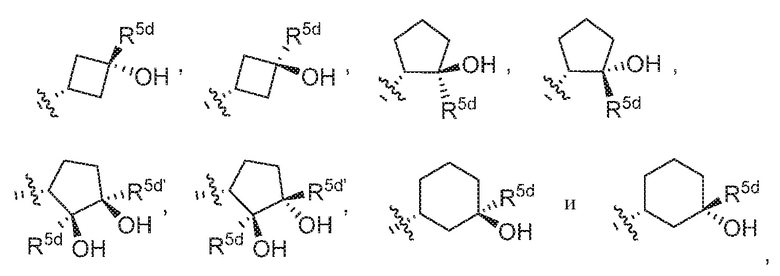
где R5d и R5d' независимо выбраны из H, галогена, галоген-C1-C4алкила и C1-C4алкила.
В варианте осуществления 7d и в соответствии с вариантом осуществления 7, 7a, 7b и 7c в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
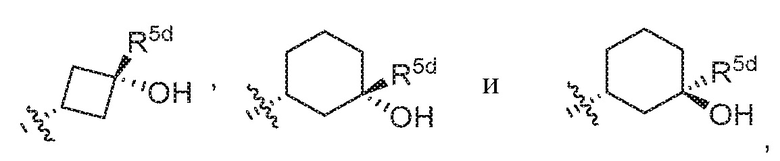
где R5d и R5d' независимо выбраны из H, галогена, галоген-C1-C4алкила и C1-C4алкила.
В варианте осуществления 8 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с вариантами осуществления 1, 2 или 3, где R5 представляет собой C2-C6алкил, замещенный 1 или несколькими заместителями, независимо выбранными из -OH, C1-C4алкокси, галогена, -NH2, -NH(C1-C4алкил) и -N(C1-C4алкил)2.
В варианте осуществления 8a и в соответствии с вариантом осуществления 8 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R5 предпочтительно выбран из следующих структур:
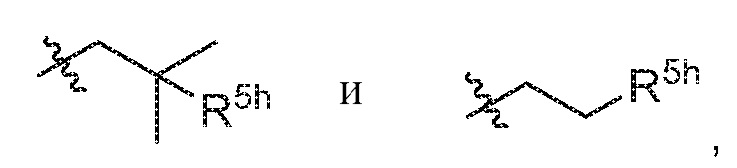
где R5h выбран из -NH2, -OH, -NH(C1-C4алкил) и -N(C1-C4алкил)2.
В варианте осуществления 9 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с любым из вариантов осуществления 1, 2, 3, 3a, 4, 5, 5a - 5e, 6, 6a - 6c, 7, 7a - 7d, 8 и 8a, где по меньшей мере один из R2 и R3 представляет собой H.
В варианте осуществления 9a и в соответствии с вариантом осуществления 9 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R2 представляет собой галоген, C1-C4алкил или галоген-C1-C4алкил; и R3 представляет собой H.
В варианте осуществления 9b и в соответствии с вариантом осуществления 9 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R2 представляет собой H; и R3 представляет собой CN, C1-C4алкил или галоген-C1-C4алкил.
В варианте осуществления 10 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с вариантами осуществления 1-9, где R1 представляет собой -OCF3 или -CF3.
В варианте осуществления 10a и в соответствии с вариантом осуществления 10 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль, где R1 представляет собой CF3.
В варианте осуществления 11 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с вариантом осуществления 1, где соединение выбрано из
2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((1-изопропилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1-этилпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-(((1-этилпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-(((1-этилпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5,5-дифторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-(трифторметил)пропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-((1-этилпиперидин-3-ил)амино)-6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-4-карбонитрила;
(S)-3-((1-этилпиперидин-3-ил)амино)-6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-4-карбонитрила;
(R)-3-((1-этилпиперидин-3-ил)амино)-6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-4-карбонитрила;
3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((пирролидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((пирролидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((пирролидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-(диметиламино)-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола; (S)-3-метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(2-гидрокси-2-метилпропокси)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(6-(((4,4-дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((4,4-дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-(((4,4-дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-гидроксициклопентил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(цис)-2-(6-((2-гидроксициклопентил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(транс)-2-(6-((2-гидроксициклопентил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3,5-дихлор-2-(6-((2-гидроксиэтил)амино)пиридазин-3-ил)фенола;
2-(6-((2-гидроксиэтил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3,5-дихлор-2-(6-((2,2,2-трифторэтил)амино)пиридазин-3-ил)фенола;
3-метил-2-(6-((пиридин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((2-амино-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-хлор-2-(6-((2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((цис-3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((транс-3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-(((2-метилпиридин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
5-хлор-2-(6-(((2-метилпиридин-3-ил)метил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((2-гидроксиэтил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(S)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли 5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли (S)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли (R)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3,5-бис(трифторметил)фенола;
(S)-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3,5-бис(трифторметил)фенола;
(R)-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3,5-бис(трифторметил)фенола;
2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(4,5-диметил-6-(((S)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(4,5-диметил-6-(((R)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
TFA-соли 2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
TFA-соли 2-(4,5-диметил-6-(((S)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
TFA-соли 2-(4,5-диметил-6-(((R)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-карбоновой кислоты;
3-метил-2-(6-((1-метилпиперидин-3-ил)окси)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)окси)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)окси)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(пиримидин-5-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
3,5-дихлор-2-(6-(циклопропиламино)пиридазин-3-ил)фенола;
3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(S)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли 3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли (S)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли (R)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
3-метил-2-(6-(пиридин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
3,5-диметил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(S)-3,5-диметил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-3,5-диметил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
5-метил-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(S)-5-метил-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(R)-5-метил-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
(S)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
(R)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
2-(6-((1,3-диметилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
TFA-соли 2-(6-((1,3-диметилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-2-она;
2-(6-((2-фтор-3-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((2-фтор-3-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((2-фтор-3-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-она;
(S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-она;
(R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-она;
3-метил-5-(трифторметил)-2-(6-((6-(трифторметил)пиперидин-3-ил)амино)пиридазин-3-ил)фенола;
3-метил-2-(6-((1-(2,2,2-трифторэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-(2,2,2-трифторэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-(2,2,2-трифторэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-((1-метилпиперидин-3-ил)амино)-5-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)-5-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)-5-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифтор
метил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-(трифторметил)циклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-(трифторметил)циклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-(трифторметил)циклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-хлор-2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)фенола;
5-хлор-2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)фенола; 5-хлор-2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)фенола;
5-хлор-2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(S)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(R)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(S)-5-хлор-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-5-хлор-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)-4-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2S,4S)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2R,4S)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2R,4R)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2S,4R)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-3-метил-2-(6-(((4-метилморфолин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-(((4-метилморфолин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(рац)-3-метил-2-(6-(((4-метилморфолин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
HCl-соли 3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
HCl-соли (R)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
HCl-соли (S)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-гидрокси-2-метилпропан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((1-(2-гидрокси-2-метилпропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-(2-гидрокси-2-метилпропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидрокси-2-метилпропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметокси)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметокси)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметокси)фенола;
2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметокси)фенола;
(S)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметокси)фенола;
(R)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметокси)фенола;
3-метил-2-(6-((октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8R,8aR)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8R,8aS)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8S,8aR)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8S,8aS)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2S,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2R,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2R,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2S,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2R,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2S,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2S,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2R,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,2R,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,2S,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,2S,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,2R,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2S,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2R,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2R,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2S,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,6R)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,6R)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,6S)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,6S)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола;
3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола;
3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1S,2S,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1S,2R,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1S,2S,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1S,2R,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2R,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2S,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2R,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2S,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(S)-2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола; 3-метил-2-(6-(((2S,3S)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((2R,3S)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((2S,3R)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((2R,3R)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((R)-1-((S)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((S)-1-((R)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((S)-1-((S)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((R)-1-((R)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)
фенола;
2-(6-(((3S,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
(3S,5S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
(3R,5S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
(3R,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
(3S,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
2-(6-(((1-гидроксициклопентил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
3-метил-2-(5-метил-6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(5-метил-6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(5-метил-6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-этилпиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-этилпиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-этилпиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
4-(2-((6-(2-гидрокси-4,6-диметилфенил)пиридазин-3-ил)амино)этил)бензолсульфонамида;
1-оксида 3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
1-оксида (3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
1-оксида (3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
TFA-соли 1-оксида 3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
TFA-соли 1-оксида (3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
TFA-соли 1-оксида (3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина
или их фармацевтически приемлемой соли.
В варианте осуществления 11a и в соответствии с вариантом осуществления 11 в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль в соответствии с вариантом осуществления 1, где соединение предпочтительно выбрано из
(R)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((1-изопропилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-(((1-этилпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5,5-дифторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-(трифторметил)пропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-((1-этилпиперидин-3-ил)амино)-6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-4-карбонитрила;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((пирролидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-(диметиламино)-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(2-гидрокси-2-метилпропокси)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(6-(((4,4-дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-(((4,4-дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(транс)-2-(6-((2-гидроксициклопентил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3,5-дихлор-2-(6-((2-гидроксиэтил)амино)пиридазин-3-ил)фенола;
2-(6-((2-гидроксиэтил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3,5-дихлор-2-(6-((2,2,2-трифторэтил)амино)пиридазин-3-ил)фенола;
3-метил-2-(6-((пиридин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((2-амино-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-хлор-2-(6-((2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((цис-3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((транс-3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-(((2-метилпиридин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
5-хлор-2-(6-(((2-метилпиридин-3-ил)метил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((2-гидроксиэтил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
TFA-соли (R)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3,5-бис(трифторметил)фенола;
TFA-соли 2-(4,5-диметил-6-(((R)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-карбоновой кислоты;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)окси)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(пиримидин-5-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
3,5-дихлор-2-(6-(циклопропиламино)пиридазин-3-ил)фенола;
TFA-соли (R)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
3-метил-2-(6-(пиридин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3,5-диметил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-5-метил-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(R)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
TFA-соли 2-(6-((1,3-диметилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(R)-2-(6-((2-фтор-3-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-она;
3-метил-5-(трифторметил)-2-(6-((6-(трифторметил)пиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-3-метил-2-(6-((1-(2,2,2-трифторэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)-5-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-(трифторметил)циклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-хлор-2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)фенола;
5-хлор-2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(R)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(R)-5-хлор-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)-4-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((((2S,4S)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2S,4R)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(рац)-3-метил-2-(6-(((4-метилморфолин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
HCl-соли (S)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-гидрокси-2-метилпропан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидрокси-2-метилпропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметокси)фенола;
(R)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметокси)фенола;
3-метил-2-(6-(((8R,8aR)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8S,8aS)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2S,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2R,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((1R,2R,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2S,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,6R)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,6S)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола;
(1S,2R,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2S,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(S)-2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-(((2S,3S)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((2R,3R)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((R)-1-((S)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((R)-1-((R)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(3S,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
2-(6-(((1-гидроксициклопентил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(R)-3-метил-2-(5-метил-6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(6-((1-этилпиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
4-(2-((6-(2-гидрокси-4,6-диметилфенил)пиридазин-3-ил)амино)этил)бензолсульфонамида;
TFA-соли 1-оксида (3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина
или их фармацевтически приемлемой соли.
В варианте осуществления 11b настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли в соответствии с вариантом осуществления 1, где соединение представляет собой 3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой (S)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В предпочтительном примере соединение представляет собой (R)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемую соль.
В варианте осуществления 11c настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли в соответствии с вариантом осуществления 1, где соединение представляет собой 2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой (S)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В предпочтительном примере соединение представляет собой (R)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемую соль.
В варианте осуществления 11d настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли в соответствии с вариантом осуществления 1, где соединение представляет собой 2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой (S)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В предпочтительном примере соединение представляет собой (R)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль.
В варианте осуществления 11e настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли в соответствии с вариантом осуществления 1, где соединение представляет собой 2-(6-((3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой 2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В предпочтительном примере соединение представляет собой 2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль.
В варианте осуществления 11f настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли в соответствии с вариантом осуществления 1, где соединение представляет собой 2-(6-((3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой 2-(6-(((1S,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой 2-(6-(((1R,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой 2-(6-(((1S,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль. В предпочтительном примере соединение представляет собой 2-(6-(((1R,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемую соль.
В варианте осуществления 11g настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли в соответствии с вариантом осуществления 1, где соединение представляет собой 5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой (3R,5S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой (3R,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемую соль. В одном примере соединение представляет собой (3S,5S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемую соль. В предпочтительном примере соединение представляет собой (3S,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемую соль.
В варианте осуществления 12 настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g и один или несколько фармацевтически приемлемых носителей.
В варианте осуществления 13 настоящее изобретение относится к комбинации, содержащей терапевтически эффективное количество соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g и одно или несколько терапевтических средств.
В варианте осуществления 14 настоящее изобретение относится к комбинации, содержащей терапевтически эффективное количество соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с вариантом осуществления 13, где одно или несколько терапевтических средств независимо выбраны из агонистов фарнезоидного Х-рецептора (FXR); противостеатозных средств; противофиброзных средств; ингибиторов JAK; ингибиторов иммунных контрольных точек, в том числе ингибиторов PD1, ингибиторов LAG-3, ингибиторов TIM-3 или ингибиторов PDL1; средств химиотерапии, лучевой терапии и хирургических процедур; средств терапии, снижающих уровни уратов; анаболических средств и средств регенеративной терапии хрящевой ткани; средств блокады IL-17; ингибиторов системы комплемента; ингибиторов тирозинкиназы Брутона (ингибиторов BTK); ингибиторов Toll-подобных рецепторов (ингибиторов TLR7/8); средств CAR-T-клеточной терапии; антигипертензивных средств; средств, снижающих уровень холестерина; ингибиторов лейкотриен-А4-гидролазы (LTAH4); ингибиторов SGLT2; β2-агонистов; противовоспалительных средств; нестероидных противовоспалительных лекарственных средств ("NSAID"); лекарственных средств на основе ацетилсалициловой кислоты (ASA), в том числе аспирина; парацетамола; средств лечения методом регенеративной терапии; средств лечения муковисцидоза или средства лечения атеросклероза.
В одном варианте осуществления настоящее изобретение относится к способу ингибирования активность NLRP3 у субъекта, включающему введение субъекту терапевтически эффективного количества соединения формулы (I), (II), (III) или (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1, 2, 3, 3a, 4, 5, 5a - 5e, 6, 6a - 6c, 7, 7a - 7d, 8, 8a, 9, 9a - 9b, 10, 10a, 11, 11a - 11g, 12, 13 и 14.
В варианте осуществления 15 настоящее изобретение относится к соединению любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g или комбинации в соответствии с любым из вариантов осуществления 13-14 для применения в качестве лекарственного препарата. В частности, настоящее изобретение относится к соединению любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g для применения в качестве лекарственного препарата. В частности, настоящее изобретение относится к соединению любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g для применения в качестве лекарственного препарата для ингибирования сигнального пути NLRP3. В другом конкретном варианте осуществления настоящее изобретение относится к комбинации в соответствии с любым из вариантов осуществления 13-14 для применения в качестве лекарственного препарата.
В варианте осуществления 16 настоящее изобретение относится к соединению в соответствии с любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g для применения в лечении заболевания или нарушения, при котором передача сигнала, опосредованная NLRP3, способствует патологическому процессу, и/или проявлению симптомов, и/или прогрессированию указанного заболевания или нарушения.
В варианте осуществления 17 настоящее изобретение относится к способу лечения заболевания или нарушения, при котором передача сигнала, опосредованная NLRP3, способствует патологическому процессу, и/или проявлению симптомов, и/или прогрессированию указанного заболевания или нарушения, включающему введение терапевтически эффективного количества соединения в соответствии с любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g.
В варианте осуществления 18 настоящее изобретение относится к соединению любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g для применения в соответствии с вариантом осуществления 16 или к способу лечения в соответствии с вариантом осуществления 17, где заболевание или нарушение выбрано из заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), заболеваний/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В конкретном аспекте варианта осуществления 16 настоящее изобретение относится к соединению любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли, где заболевание или нарушение предпочтительно выбрано из форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
В одном варианте осуществления настоящее изобретение относится к соединению любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g для применения в лечении заболевания или нарушения, выбранного из заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), заболеваний/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В конкретном аспекте варианта осуществления 18 настоящее изобретение относится к соединению любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли, где заболевание или нарушение предпочтительно выбрано из форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
В варианте осуществления 19 настоящее изобретение относится к способу ингибирования активности инфламмасомы NLRP3 у субъекта, нуждающегося в этом, при этом способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1-11g.
В одном варианте осуществления настоящее изобретение относится к способу ингибирования активности NLRP3 у субъекта, где способ включает введение субъекту терапевтически эффективного количества соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1, 2, 3, 3a, 4, 5, 5a - 5e, 6, 6a - 6c, 7, 7a - 7d, 8, 8a, 9, 9a - 9b, 10, 10a, 11, 11a - 11g, 12, 13 и 14.
В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания или нарушения, выбранного из связанных с инфламмасомой заболеваний/нарушений, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболеваний/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольного заболевания печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, острой или хронической артропатии), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, диабетической нефропатии, гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, диабета типа I и типа II и связанных осложнений, заболеваний периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза), где способ включает введение субъекту терапевтически эффективного количества соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли в соответствии с любым из вариантов осуществления 1, 2, 3, 3a, 4, 5, 5a - 5e, 6, 6a - 6c, 7, 7a - 7d, 8, 8a, 9, 9a - 9b, 10, 10a, 11, 11a - 11g, 12, 13 и 14. В частности, заболевание или нарушение предпочтительно выбрано из форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
В зависимости от выбора исходных материалов и процедур соединения могут присутствовать в форме одного из возможных стереоизомеров или в виде их смесей, например, в виде чистых оптических изомеров, или в виде смеси стереоизомеров, таких как рацематы и смеси диастереоизомеров, в зависимости от числа асимметрических атомов углерода. В настоящем изобретении подразумевается включение всех таких возможных стереоизомеров, в том числе рацемических смесей, смесей диастереоизомеров и оптически чистых форм. Оптически активные (R)- и (S)-стереоизомеры можно получать с использованием хиральных синтонов или хиральных реагентов или разделять с применением традиционных методик. Если соединение содержит дизамещенный циклоалкил, циклоалкильный заместитель может иметь цис- или транс-конфигурацию. Также предполагается включение всех таутомерных форм. В настоящем изобретении также подразумевается включение любых псевдоасимметрических атомов углерода, представленных в данном документе как (r)- и (s)-, которые являются инвариантными относительно зеркального отражения, но превращаются в противоположные путем обмена любых двух объектов (PAC 1996, 68, 2193, Basic terminology of stereochemistry IUPAC recommendations 1996).
Используемые в данном документе термины "соль" или "соли" относятся к соли присоединения кислоты или присоединения основания соединения по настоящему изобретению. "Соли" включают, в частности, "фармацевтически приемлемые соли". Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства соединений по настоящему изобретению и которые, как правило, не являются нежелательными с биологической или иной точки зрения. Во многих случаях соединения по настоящему изобретению способны образовывать кислые и/или основные соли вследствие присутствия амино- и/или карбоксильных групп или подобных им групп.
Фармацевтически приемлемые соли присоединения кислоты могут быть образованы с неорганическими кислотами и органическими кислотами.
Неорганические кислоты, из которых могут быть получены соли, включают, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т. п.
Органические кислоты, из которых могут быть получены соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту, сульфосалициловую кислоту и т. п.
Фармацевтически приемлемые соли присоединения основания могут быть образованы с неорганическими и органическими основаниями.
Неорганические основания, из которых могут быть получены соли, включают, например, соли аммония и металлов из групп I-XII периодической таблицы элементов. В определенных вариантах осуществления соли получены из натрия, калия, аммония, кальция, магния, железа, серебра, цинка и меди; особенно подходящие соли включают соли аммония, калия, натрия, кальция и магния.
Органические основания, из которых могут быть получены соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, в том числе встречающиеся в природе замещенные амины, циклические амины, основные ионообменные смолы и т. п. Определенные органические амины включают изопропиламин, бензатин, холинат, диэтаноламин, диэтиламин, лизин, меглюмин, пиперазин и трометамин.
В другом аспекте в настоящем изобретении предусмотрены соединения любой из формул (I), (II), (III) и (III-A) в форме соли, представляющей собой ацетат, аскорбат, адипат, аспартат, бензоат, безилат, бромид/гидробромид, бикарбонат/карбонат, бисульфат/сульфат, камфорсульфонат, капринат, хлорид/гидрохлорид, хлортеофиллинат, цитрат, этандисульфонат, фумарат, глюцептат, глюконат, глюкуронат, глутамат, глутарат, гликолят, гиппурат, гидройодид/йодид, изетионат, лактат, лактобионат, лаурилсульфат, малат, малеат, малонат, манделат, мезилат, метилсульфат, муцинат, нафтоат, напсилат, никотинат, нитрат, октадеканоат, олеат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, полигалактуронат, пропионат, себацинат, стеарат, сукцинат, сульфосалицилат, сульфат, тартрат, тозилат, трифенатат, трифторацетат или ксинафоат.
В другом аспекте в настоящем изобретении предусмотрены соединения любой из формул (I), (II), (III) и (III-A) в форме соли натрия, калия, аммония, кальция, магния, железа, серебра, цинка, меди, изопропиламина, бензатина, холина, диэтаноламина, диэтиламина, лизина, меглюмина, пиперазина или трометамина.
Любая формула, приведенная в данном документе, также предполагает представление немеченых форм, а также изотопно-меченых форм соединений. Изотопно-меченые соединения имеют структуры, изображенные с помощью формул, приведенных в данном документе, за исключением того, что один или несколько атомов заменены атомом, характеризующимся выбранными атомной массой или массовым числом. Изотопы, которые можно включать в состав соединений по настоящему изобретению, включают, например, изотопы водорода.
Кроме того, включение определенных изотопов, в частности, дейтерия (т. е., 2H или D), может обеспечивать определенные терапевтические преимущества, обусловленные более высокой метаболической стабильностью, например, увеличенным периодом полувыведения in vivo, или снижением требуемой дозы, или улучшением терапевтического индекса или переносимости. Понятно, что дейтерий в данном контексте рассматривается в качестве заместителя соединения формулы (I). Концентрацию дейтерия можно определять по коэффициенту изотопного обогащения. Используемый в данном документе термин "коэффициент изотопного обогащения" означает соотношение между распространенностью изотопа и природной распространенностью указанного изотопа. Если заместитель в соединении по настоящему изобретению указан как дейтерий, такое соединение характеризуется коэффициентом изотопного обогащения для каждого обозначенного атома дейтерия, составляющим по меньшей мере 3500 (52,5% включение дейтерия по каждому обозначенному атому дейтерия), по меньшей мере 4000 (60% включение дейтерия), по меньшей мере 4500 (67,5% включение дейтерия), по меньшей мере 5000 (75% включение дейтерия), по меньшей мере 5500 (82,5% включение дейтерия), по меньшей мере 6000 (90% включение дейтерия), по меньшей мере 6333,3 (95% включение дейтерия), по меньшей мере 6466,7 (97% включение дейтерия), по меньшей мере 6600 (99% включение дейтерия) или по меньшей мере 6633,3 (99,5% включение дейтерия). Следует понимать, что термин "коэффициент изотопного обогащения" можно применять в отношении любого изотопа таким же образом, как описано для дейтерия.
В другом аспекте в настоящем изобретении предусмотрены соединение формулы (I),
 (I),
(I),
или его фармацевтически приемлемая соль, определенные в данном документе, где R5 выбран из следующего:
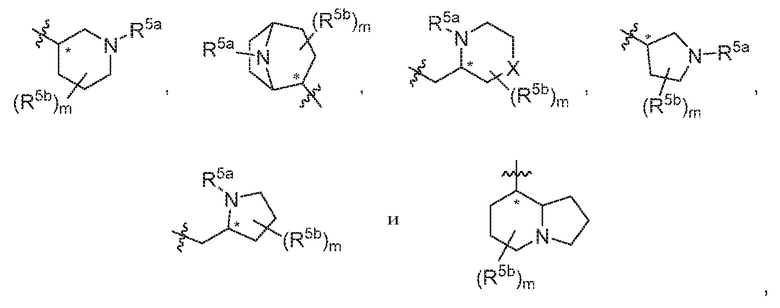
где R5a, R5b, X и m определены в вариантах осуществления 5, 5a - 5e, и один или несколько атомов водорода, присутствующих в R5a и/или R5b, могут быть заменены атомом дейтерия (в том числе R5a или R5b могут представлять собой атом дейтерия). Например, без ограничения дейтерий может быть включен следующим образом:
 .
.
В другом аспекте в настоящем изобретении предусмотрены соединение формулы (I),
 (I),
(I),
или его фармацевтически приемлемая соль, определенные в данном документе, где если R2, R3, R4 выбраны из следующего: H, C1-C4алкила или галоген-C1-C4алкила, то один или несколько атомов водорода, присутствующих в указанных группах, могут быть заменены атомом дейтерия. Например, без ограничения дейтерий может быть включен следующим образом:
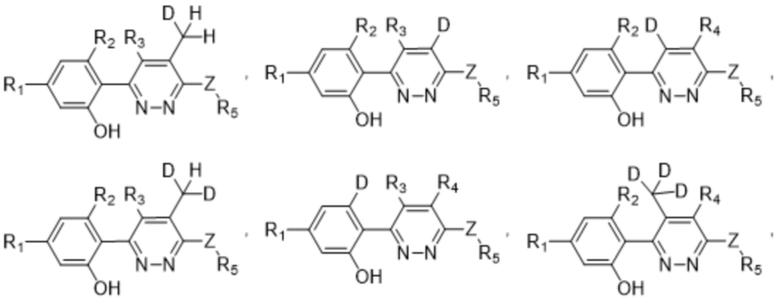
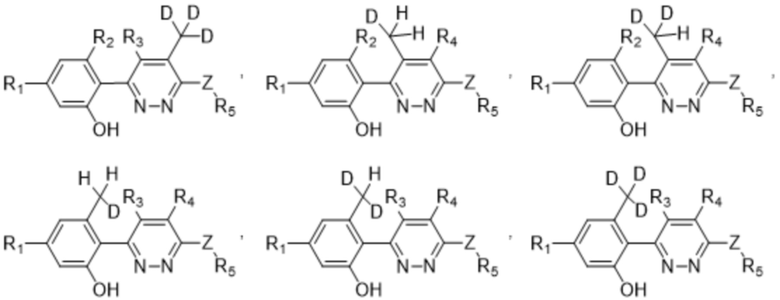 .
.
Другие примеры изотопов, которые можно включать в состав соединений по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, хлора и йода, такие как 3H, 11C, 13C, 14C, 15N, 18F, 31P, 32P, 35S, 36Cl, 123I, 124I, 125I соответственно. Следовательно, следует понимать, что настоящее изобретение включает соединения, в состав которых включены один или несколько любых из вышеуказанных изотопов, в том числе, например, радиоактивные изотопы, такие как 3H и 14C, или соединения, в которых присутствуют нерадиоактивные изотопы, такие как 2H и 13C. Такие изотопно-меченые соединения применимы в метаболических исследованиях (с использованием 14C), исследованиях кинетики реакций (например, с использованием 2H или 3H), методиках выявления или визуализации, таких как позитронно-эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT), включая анализы распределения лекарственного средства или субстрата в тканях, или при лечении пациентов радиоактивными изотопами. В частности, 18F или меченое соединение может быть особенно желательным для исследований методом PET или SPECT. Изотопно-меченые соединения формулы (I) или их фармацевтически приемлемую соль, как правило, можно получать с помощью традиционных методик, известных специалистам в данной области, или посредством способов, аналогичных описанным в сопутствующих примерах и способах получения, с использованием подходящего изотопно-меченого реагента вместо немеченого реагента, используемого ранее.
ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
Используемый в данном документе термин "фармацевтическая композиция" относится к соединению по настоящему изобретению или его фармацевтически приемлемой соли вместе с по меньшей мере одним фармацевтически приемлемым носителем в подходящей для перорального или парентерального введения форме.
Используемый в данном документе термин "фармацевтически приемлемый носитель" относится к веществу, применимому в получении или применении фармацевтической композиции, и включает, например, подходящие разбавители, растворители, дисперсионные среды, поверхностно-активные вещества, антиоксиданты, консерванты, изотонические средства, буферные средства, эмульгаторы, средства, замедляющие всасывание, соли, стабилизаторы лекарственных средств, связывающие вещества, наполнители, разрыхлители, смазывающие вещества, смачивающие средства, подсластители, ароматизирующие средства, красители и их комбинации, которые должны быть известны специалистам в данной области (см., например, Remington The Science and Practice of Pharmacy, 22nd Ed. Pharmaceutical Press, 2013, pp. 1049-1070).
Термин "терапевтически эффективное количество" соединения по настоящему изобретению относится к количеству соединения по настоящему изобретению, которое будет вызывать биологический или медицинский ответ у субъекта, например, снижение или ингибирование активности фермента или белка, или уменьшать интенсивность проявления симптомов, облегчать состояния, замедлять или задерживать прогрессирование заболевания или предупреждать заболевание и т. д. В одном неограничивающем варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое при введении субъекту является эффективным для (1) по меньшей мере частичного облегчения, ингибирования, предупреждения и/или уменьшения интенсивности проявления состояния, или нарушения, или заболевания, (i) опосредованного NLRP3, или (ii) ассоциированного с активностью NLRP3, или (iii) характеризующегося активностью (нормальной или аномальной) NLRP3; или (2) снижения или ингибирования активности NLRP3; или (3) снижения или ингибирования экспрессии NLRP3. В другом неограничивающем варианте осуществления термин "терапевтически эффективное количество" соединения по настоящему изобретению относится к количеству, которое при введении в клетку, или ткань, или неклеточный биологический материал, или среду является эффективным для по меньшей мере частичного снижения или ингибирования активности NLRP3 или по меньшей мере частичного снижения или ингибирования экспрессии NLRP3.
Используемый в данном документе термин "субъект" относится к приматам (например, людям - мужчинам или женщинам), собакам, кроликам, морским свинкам, свиньям, крысам и мышам. В определенных вариантах осуществления субъект является приматом. В еще одном варианте осуществления субъект является человеком.
Используемые в данном документе термины "ингибировать", "ингибирование" или "ингибирующий" относятся к снижению интенсивности или подавлению данного состояния, симптома, или нарушения, или заболевания, или значительному уменьшению базальной активности для биологической активности или процесса. В частности, ингибирование NLRP3 или ингибирование сигнального пути инфламмасомы NLRP3 включает снижение способности NLRP3 или сигнального пути инфламмасомы NLRP3 индуцировать продуцирование IL-1-бета и/или IL-18. Это может быть достигнуто с помощью механизмов, включающих без ограничения инактивацию, дестабилизацию и/или изменение распределения NLRP3.
Подразумевается, что используемый в данном документе термин "NLRP3" включает без ограничения нуклеиновые кислоты, полинуклеотиды, олигонуклеотиды, смысловые и антисмысловые нити полинуклеотидов, комплементарные последовательности, пептиды, полипептиды, белки, гомологичные и/или ортологичные молекулы NLRP, изоформы, предшественники, мутантные формы, варианты, производные, сплайс-варианты, аллели, различные соединения и их активные фрагменты.
Используемый в данном документе термин "лечить", "осуществление лечения" или "лечение" любого заболевания или нарушения относится к облегчению или уменьшению интенсивности проявления заболевания или нарушения (т. е. замедлению или остановке развития заболевания или по меньшей мере одного из его клинических симптомов) или облегчению или уменьшению интенсивности проявления по меньшей мере одного физического параметра или биомаркера, ассоциированного с заболеванием или нарушением, включая те, которые могут не быть ощутимыми для пациента.
Используемый в данном документе термин "предупреждать", "осуществление предупреждения" или "предупреждение" любого заболевания или нарушения относится к профилактическому лечению заболевания или нарушения или обеспечению задержки возникновения или прогрессирования заболевания или нарушения.
При использовании в данном документе субъект "нуждается в" или является "нуждающимся в" лечении, если такое лечение принесет пользу такому субъекту с биологической, медицинской точки зрения или с точки зрения качества его жизни.
Все способы, описанные в данном документе, можно осуществлять в любом подходящем порядке, если в данном документе не указано иное или это иным образом явно не противоречит контексту. Использование всех без исключения примеров или вводных слов перед примерами (например, "такой как"), приведенных в данном документе, предназначено только для лучшего объяснения настоящего изобретения и не налагает ограничения на объем настоящего изобретения, заявленного иным образом.
Любой асимметрический атом (например, углерод или подобный) соединения(соединений) по настоящему изобретению может присутствовать в рацемической или энантиомерно обогащенной форме, например, в (R)-, (S)- или (R, S)-конфигурации. В определенных вариантах осуществления каждый асимметрический атом характеризуется по меньшей мере 50% энантиомерным избытком, по меньшей мере 60% энантиомерным избытком, по меньшей мере 70% энантиомерным избытком, по меньшей мере 80% энантиомерным избытком, по меньшей мере 90% энантиомерным избытком, по меньшей мере 95% энантиомерным избытком или по меньшей мере 99% энантиомерным избытком в (R)- или (S)-конфигурации.
Соответственно, как используется в данном документе, соединение по настоящему изобретению может находиться в форме одного из возможных стереоизомеров, ротамеров, атропоизомеров, таутомеров или их смесей, например, в виде по сути чистых геометрических (цис- или транс-) стереоизомеров, диастереоизомеров, оптических изомеров (антиподов), рацематов или их смесей.
Любые полученные в результате смеси стереоизомеров могут быть разделены на основании физико-химических отличий их составляющих на чистые или по сути чистые геометрические или оптические изомеры, диастереомеры, рацематы, например, посредством хроматографии и/или фракционной кристаллизации.
Любые полученные в результате рацематы соединений по настоящему изобретению или промежуточных соединений можно разделять на оптические антиподы посредством известных способов, например, путем разделения их диастереоизомерных солей, полученных на основе оптически активных кислоты или основания, и выделения оптически активного кислотного или основного соединения. В частности, основный фрагмент таким образом может быть использован для разделения соединений по настоящему изобретению на их оптические антиподы, например, путем фракционной кристаллизации соли, образованной с оптически активной кислотой, например, винной кислотой, дибензоилвинной кислотой, диацетилвинной кислотой, ди-O, O'-п-толуоилвинной кислотой, миндальной кислотой, яблочной кислотой или камфор-10-сульфоновой кислотой. Рацемические продукты также можно разделять с помощью хиральной хроматографии, например, высокоэффективной жидкостной хроматографии (HPLC) с использованием хирального адсорбента.
СПОСОБ СИНТЕЗИРОВАНИЯ СОЕДИНЕНИЙ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Соединения по настоящему изобретению могут быть получены в соответствии с определением соединения формулы (I) или его фармацевтически приемлемой соли с помощью путей, описанных в следующих схемах или примерах. Все способы, описанные в данном документе, можно осуществлять в любом подходящем порядке, если в данном документе не указано иное или это иным образом явно не противоречит контексту. Использование всех без исключения примеров или вводных слов перед примерами (например, "такой как"), приведенных в данном документе, предназначено только для лучшего объяснения настоящего изобретения и не налагает ограничения на объем настоящего изобретения, заявленного иным образом. В следующих общих способах R1, R2, R3, R4, R5, галоген и Z определены ранее в вышеуказанных вариантах осуществления или ограничены обозначениями на схемах. Если не указано иное, то исходные материалы являются коммерчески доступными либо получены с помощью известных способов.
Схема реакции 1
Соединения по настоящему изобретению, описанные в данном документе, можно получать с помощью последовательности реакций, показанной на схеме 1 (ниже), согласно которой соответствующим образом замещенный 3,6-дигалогенпиридазин (M1) вводят в реакцию либо с подходящим амином (M2a) в присутствии основания, например DIPEA, при повышенных температурах, как правило от 150°C до 180°C (необязательно в условиях микроволнового облучения), с получением 6-галогенпиридазин-3 амина (M3a), либо с подходящим спиртом (M2b) в присутствии основания, например NaH, при низкой температуре, как правило 0°C, с получением 3-галоген-6-алкоксипиридазина (M3b). Оба промежуточных соединения, (M3a) или (M3b), затем подвергают реакции перекрестного сочетания Сузуки с подходящим боронатом (M4) в форме бороновой кислоты или сложного боронового эфира, например 4,4,5,5-тетраметил-1,3,2-диоксабороланом, с применением подходящего палладиевого катализатора, например Pd(PPh3)4, и водного основания, как правило Na2CO3 или NaHCO3, в смешиваемом растворителе, таком как DME или диоксан, с получением соединения формулы (I) или его фармацевтически приемлемой соли.
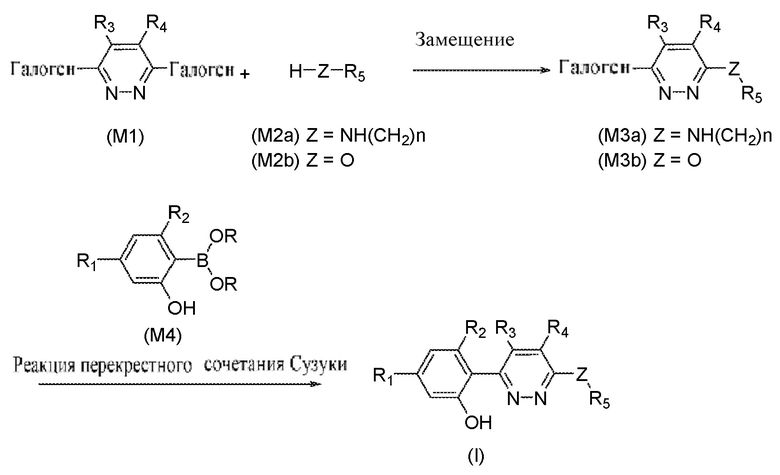
Схема 1
Схема реакции 2
В качестве альтернативы соединения по настоящему изобретению, описанные в данном документе, можно получать с помощью последовательности реакций, показанной на схеме 2 (ниже), согласно которой соответствующим образом замещенный 3,6-дигалогенпиридазин (M1) подвергают реакции перекрестного сочетания Сузуки либо с подходящим боронатом (M4) в форме бороновой кислоты или сложного боронового эфира, например 4,4,5,5-тетраметил-1,3,2-диоксабороланом (путь A), с применением подходящего палладиевого катализатора, например Pd(PPh3)4 или XantPhos-Pd-G2, и водного основания, как правило Na2CO3 или NaHCO3, в смешиваемом растворителе, таком как DME или диоксан, с получением 3-галоген-пиридазина (M5), либо таким же образом подвергают реакции с боронатом (M6), несущим защитную группу P на феноле, такую как метил или бензил, (путь B), с получением соединения формулы 3-галоген-пиридазин (M7). Промежуточное соединение (M5) затем вводят в реакцию с подходящим амином (M2a) в присутствии основания, например DIPEA, при повышенных температурах, как правило от 150°C до 180°C (необязательно в условиях микроволнового облучения), с получением соединения формулы (I) или его фармацевтически приемлемой соли, при этом из промежуточного соединения (M7), обработанного таким же образом, получают защищенную форму (M8), которую далее подвергают действию типичных средств для расщепления, таких как BBr3, или каталитической гидрогенизации с получением соединения формулы (I) или его фармацевтически приемлемой соли.
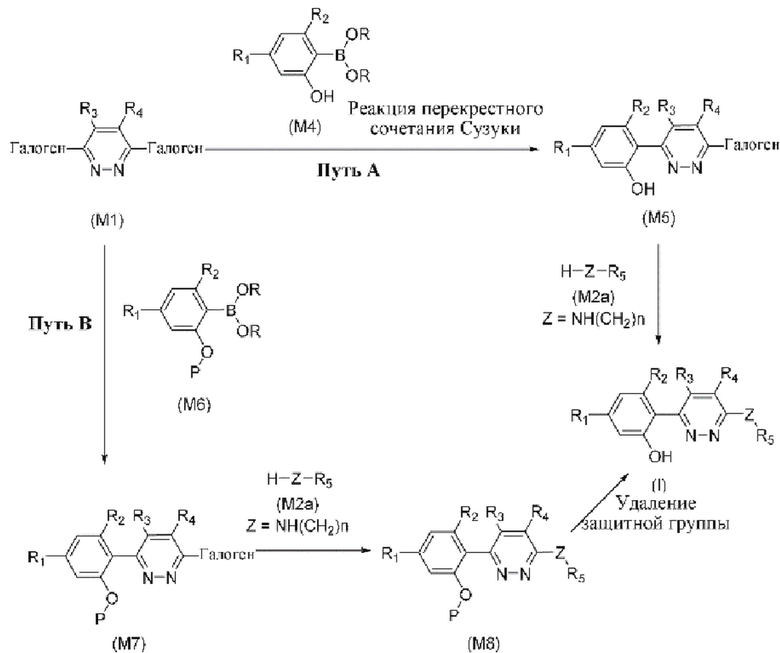
Схема 2
Схема реакции 3
В качестве альтернативы соединения по настоящему изобретению, описанные в данном документе, можно получать с помощью последовательности реакций, показанной на схеме 3 (ниже), посредством которой соответствующим образом замещенное промежуточное соединение (M5) подвергают реакции аминирования Бухвальда с подходящим амином (M2a) в присутствии подходящего палладиевого катализатора, например PdCl2(dppf), и основания, как правило LiOtBu, в непротонном растворителе, таком как толуол, с получением соединения формулы (I) или его фармацевтически приемлемой соли.
Схема 3
Способы могут быть расширены для получения соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли, описанных в данном документе. В зависимости от исходных материалов и выбранного пути, которые указаны на схеме 1, схеме 2 или схеме 3 выше, специалисту в данной области будет понятно, как получить соединение формулы (I) или его фармацевтически приемлемую соль. Определенные варианты или альтернативные способы описаны в данном документе ниже в экспериментальном разделе.
Настоящее изобретение дополнительно включает любой вариант способов по настоящему изобретению, в которых промежуточный продукт, получаемый на любой их стадии, применяют в качестве исходного материала и проводят остальные стадии, или в которых исходные материалы получают in situ в условиях реакции, или в которых компоненты реакционной смеси применяют в форме их солей или оптически чистого материала. Соединения по настоящему изобретению и промежуточные соединения также могут превращаться друг в друга в соответствии со способами, общеизвестными специалистам в данной области.
В другом аспекте в настоящем изобретении предусмотрена фармацевтическая композиция, содержащая соединение по настоящему изобретению или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В дополнительном варианте осуществления композиция содержит по меньшей мере два фармацевтически приемлемых носителя, таких как описанные в данном документе. Фармацевтическая композиция может быть составлена для конкретных путей введения, таких как пероральное введение, парентеральное введение (например, путем инъекции, инфузии, трансдермального или местного введения) и ректальное введение. Местное введение может также относиться к ингаляционному или интраназальному применению. Фармацевтические композиции по настоящему изобретению можно изготовлять в твердой форме (включающей без ограничения капсулы, таблетки, пилюли, гранулы, порошки или суппозитории) или в жидкой форме (включающей без ограничения растворы, суспензии или эмульсии). Таблетки могут быть покрытыми пленочной оболочкой либо энтеросолюбильной оболочкой в соответствии со способами, известными из уровня техники. Как правило, фармацевтические композиции представляют собой таблетки или желатиновые капсулы, содержащие активный ингредиент вместе с одним или несколькими из:
a) разбавителей, например лактозы, декстрозы, сахарозы, маннита, сорбита, целлюлозы и/или глицина;
b) смазывающих веществ, например диоксида кремния, талька, стеариновой кислоты, ее магниевой или кальциевой соли и/или полиэтиленгликоля; также в случае таблеток
c) связующих средств, например алюмосиликата магния, крахмальной пасты, желатина, трагаканта, метилцеллюлозы, натрий-карбоксиметилцеллюлозы и/или поливинилпирролидона; при необходимости
d) разрыхлителей, например видов крахмала, агара, альгиновой кислоты или ее натриевой соли или шипучих смесей; и
e) абсорбентов, красителей, ароматизаторов и подсластителей.
СПОСОБ ПРИМЕНЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Существует доказательство роли NLRP3-индуцированных IL-1 и IL-18 в воспалительных ответах, возникающих в связи с множеством различных нарушений или в их результате (Menu et al, Clinical and Experimental Immunology, 2011, 166, 1-15; Strowig et al, Nature, 2012, 481, 278-286). Было обнаружено, что мутации NLRP3 отвечают за группу редких аутовоспалительных заболеваний, известных как CAPS (Ozaki et al, J. Inflammation Research, 2015, 8,15-27; Schroder et al, Cell, 2010, 140: 821-832; Menu et al, Clinical and Experimental Immunology, 2011, 166, 1-15). CAPS представляет собой группу наследственных заболеваний, характеризующихся возвратной лихорадкой и воспалением, и состоит из трех аутовоспалительных нарушений, которые образуют клинический континуум. Этими заболеваниями, в порядке увеличения степени тяжести, являются семейный холодовой аутовоспалительный синдром (FCAS), синдром Макла-Уэльса (MWS) и хронический младенческий неврологический кожно-артикулярный синдром (CINCA; также называемый мультисистемным воспалительным заболеванием неонатального возраста, NOMID), и было показано, что все они обусловлены мутациями приобретения функции в гене NLRP3, что приводит к увеличению секреции IL-1-бета. Также было установлено, что NLRP3 вовлечен во множество аутовоспалительных заболеваний, в том числе пиогенный артрит, гангренозную пиодермию и акне (PAPA), синдром Свита, хронический небактериальный остеомиелит (CNO) и обыкновенное акне (Cook et al, Eur. J. Immunol., 2010, 40, 595-653).
Было показано, что NLRP3 вовлечен во множество аутоиммунных заболеваний, в том числе, в частности, рассеянный склероз, сахарный диабет 1 типа (T1D), псориаз, ревматоидный артрит (RA), болезнь Бехчета, синдром Шницлера, синдром активации макрофагов (Braddock et al. Nat. Rev. Drug Disc. 2004, 3, 1-10; Inoue et al., Immunology, 2013, 139, 11-18, Coll et al, Nat. Med. 2015, 21(3), 248-55; Scott et al, Clin. Exp. Rheumatol. 2016, 34(1), 88-93), системную красную волчанку и ее осложнения, такие как волчаночный нефрит (Lu et al, J. Immunol., 2017, 198(3), 1119-29) и системный склероз (Artlett et al, Arthritis Rheum. 2011, 63(11), 3563-74). Также было показано, что NLRP3 играет роль в ряде заболеваний легких, в том числе при хроническом обструктивном заболевании легких (COPD), астме (включая стероидорезистентную астму), асбестозе и силикозе (De Nardo et al, Am. J. Pathol., 2014, 184: 42-54; Kim et al. Am. J. Respir. Crit. Care Med, 2017, 196(3), 283-97). Также было выдвинуто предположение, что NLRP3 играет роль во множестве состояний центральной нервной системы, в том числе при рассеянном склерозе (MS), болезни Паркинсона (PD), болезни Альцгеймера (AD), деменции, болезни Хантингтона, церебральной малярии, повреждении головного мозга вследствие пневмококкового менингита (Walsh et al, Nature Reviews, 2014, 15, 84-97; и Dempsey et al. Brain. Behav. Immun. 2017, 61, 306-16), внутричерепных аневризмах (Zhang et al. J. Stroke and Cerebrovascular Dis., 2015, 24, 5, 972-9) и травматическом повреждении головного мозга (Ismael et al. J. Neurotrauma., 2018, 35(11), 1294-1303). Также было показано, что активность NRLP3 вовлечена в различные метаболические заболевания, в том числе сахарный диабет 2 типа (T2D) и его органоспецифические осложнения, атеросклероз, ожирение, подагру, псевдоподагру, метаболический синдром (Wen et al, Nature Immunology, 2012, 13, 352-357; Duewell et al, Nature, 2010, 464, 1357-1361; Strowig et al, Nature, 2014, 481, 278-286) и неалкогольный стеатогепатит (Mridha et al. J. Hepatol. 2017, 66(5), 1037-46). Также было выдвинуто предположение о роли NLRP3 посредством IL-1-бета в атеросклерозе, инфаркте миокарда (van Hout et al. Eur. Heart J. 2017, 38(11), 828-36), сердечной недостаточности (Sano et al. J. Am. Coll. Cardiol. 2018, 71(8), 875-66), аневризме и расслоении аорты (Wu et al. Arterioscler. Thromb. Vase. Biol., 2017,37(4), 694-706) и других сердечно-сосудистых событиях (Ridker et al., N. Engl. J. Med., 2017, 377(12), 1119-31).
Другие заболевания, в которые, как было показано, вовлечен NLRP3, включают глазные заболевания, такие как влажная и сухая формы возрастной макулярной дегенерации (Doyle et al. Nature Medicine, 2012, 18, 791-798; Tarallo et al. Cell 2012, 149(4), 847-59), диабетическая ретинопатия (Loukovaara et al. Acta Ophthalmol., 2017, 95(8), 803-8), неинфекционный увеит и поражение зрительного нерва (Puyang et al. Sci. Rep. 2016, 6, 20998); заболевания печени, в том числе неалкогольный стеатогепатит (NASH) и острый алкогольный гепатит (Henao-Meija et al, Nature, 2012, 482, 179-185); воспалительные реакции в легких и коже (Primiano et al. J. Immunol. 2016, 197(6), 2421-33), в том числе контактную гиперчувствительность (такую как буллезный пемфигоид (Fang et al. J Dermatol Sci. 2016, 83(2), 116-23)), атопический дерматит (Niebuhr et al. Allergy, 2014, 69(8), 1058-67), гнойный гидраденит (Alikhan et al. J. Am. Acad. Dermatol., 2009,60(4), 539-61) и саркоидоз (Jager et al. Am. J. Respir. Crit. Care Med., 2015, 191, A5816); воспалительные реакции в суставах (Braddock et al, Nat. Rev. Drug Disc, 2004, 3, 1-10); боковой амиотрофический склероз (Gugliandolo et al. Int. J. Mol. Sci., 2018, 19(7), E1992); муковисцидоз (Iannitti et al. Nat. Commun., 2016, 7, 10791); инсульт (Walsh et al, Nature Reviews, 2014, 15, 84-97); хроническое заболевание почек (Granata et al. PLoS One 2015, 10(3), eoi22272); а также воспалительные заболевания кишечника, в том числе неспецифический язвенный колит и болезнь Крона (Braddock et al., Nat. Rev. Drug Disc, 2004, 3, 1-10; Neudecker et al. J. Exp. Med. 2017, 214(6), 1737-52; Lazaridis et al. Dig. Dis. Sci. 2017, 62(9), 2348-56). Было обнаружено, что инфламмасома NLRP3 активируется в ответ на окислительный стресс. Также было показано, что NLRP3 вовлечен в воспалительную гипералгезию (Dolunay et al, Inflammation, 2017, 40, 366-86).
Было показано, что при активации инфламмасомы NLRP3 усиливаются некоторые патогенные инфекции, такие как грипп и лейшманиоз (Tate et al., Sci Rep., 2016, 10(6), 27912-20; Novias et al., PLOS Pathogens 2017, 13(2), e1006196).
NLRP3 также вовлечен в патогенез многих форм рака (Menu et al, Clinical and Experimental Immunology, 2011, 166, 1-15). Например, в нескольких предыдущих исследованиях было выдвинуто предположение о роли IL-1-бета в инвазивности, росте и метастазировании раковых опухолей и было показано, что при ингибировании IL-1-бета с помощью канакинумаба снижается частота возникновения рака легкого и общая смертность от рака в рандомизированном двойном слепом плацебо-контролируемом испытании (Ridker et al. Lancet., 2017, 390(10105), 1833-42). Также было показано, что при ингибировании инфламмасомы NLRP3 или IL-1-бета ингибируется пролиферация и миграция раковых клеток легкого in vitro (Wang et al. Oncol Rep., 2016, 35(4), 2053-64). Было выдвинуто предположение о роли инфламмасомы NLRP3 в формах миелодиспластического синдрома, миелофиброзе и других миелопролиферативных новообразованиях и остром миелоидном лейкозе (AML) (Basiorka et al. Blood, 2016, 128(25), 2960-75.), а также в канцерогенезе различных других форм рака, в том числе глиомы (Li et al. Am. J. Cancer Res. 2015, 5(1), 442-9), опухолей, индуцированных воспалением (Allen et al. J. Exp. Med. 2010, 207(5), 1045-56; Hu et al. PNAS., 2010, 107(50), 21635-40), множественной миеломы (Li et al. Hematology, 2016 21(3), 144-51) и плоскоклеточной карциномы головы и шеи (Huang et al. J. Exp. Clin. Cancer Res., 2017, 36(1), 116). Также было показано, что активация инфламмасомы NLRP3 опосредует химиорезистентность опухолевых клеток к 5-фторурацилу (Feng et al. J. Exp. Clin. Cancer Res., 2017, 36(1), 81), а активация инфламмасомы NLRP3 в периферических нервах способствует нейропатической боли, индуцированной химиотерапией (Jia et al. Mol. Pain., 2017, 13, 1-11). Также было показано, что NLRP3 требуется для эффективного контроля вирусов, бактерий и грибов.
Активация NLRP3 приводит к пироптозу клетки, и данный признак играет важную роль в проявлении клинического заболевания (Yan-gang et al., Cell Death and Disease, 2017, 8(2), 2579; Alexander et al., Hepatology, 2014, 59(3), 898-910; Baldwin et al., J. Med. Chem., 2016, 59(5), 1691-1710; Ozaki et al., J. Inflammation Research, 2015, 8, 15-27; Zhen et al., Neuroimmunology Neuroinflammation, 2014, 1(2), 60-65; Mattia et al., J. Med. Chem., 2014, 57(24), 10366-82; Satoh et al., Cell Death and Disease, 2013, 4, 644). Таким образом, предполагается, что ингибиторы NLRP3 будут блокировать пироптоз, а также высвобождение провоспалительных цитокинов (например, IL-1-бета) из клетки.
Соединения любой из формул (I), (II), (III) и (III-A), или соединение в соответствии с любым из предыдущих вариантов осуществления, или соединение в соответствии с любым из иллюстративных примеров (например, от пр. 001 до пр. 104, раскрытых в данном документе) в свободной форме или в форме фармацевтически приемлемой соли проявляют ценные фармакологические свойства, например свойства ингибирования NRLP3 в сигнальном пути NLRP3, например, показанные с помощью in vitro тестов, приведенных в следующем разделе, и, следовательно, показаны для терапии или для применения в качестве химических веществ для исследований, например в качестве фармакологически активных соединений.
Соединения по настоящему изобретению могут быть применимы в лечении показания, выбранного из заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, заболеваний, нарушений или состояний, при которых передача сигнала, опосредованная NLRP3, способствует патологическому процессу, и/или проявлению симптомов, и/или прогрессированию, и которые могут быть восприимчивыми к ингибированию NLRP3, и которые можно лечить или предупреждать в соответствии с любым из вариантов осуществления 1-19 или с помощью соединения в соответствии с любым из иллюстративных примеров (например, от пр. 001 до пр. 104, раскрытых в данном документе), по настоящему изобретению, включающих следующее.
I. Воспаление, в том числе воспаление, возникающее в результате воспалительного нарушения, например, аутовоспалительного заболевания, воспаление, возникающее в качестве симптома невоспалительного нарушения, воспаление, возникающее в результате инфекции, или воспаление вследствие травмы, повреждения или аутоиммунной реакции. Примеры воспаления, которое можно лечить или предупреждать, включают воспалительные ответы, возникающие в связи со следующим или в результате следующего:
(a) кожное состояние, такое как контактная гиперчувствительность, буллезный пемфигоид, солнечный ожог, псориаз, атопический дерматит, контактный дерматит, аллергический контактный дерматит, себорейный дерматит, красный плоский лишай, склеродермия, пемфигус, буллезный эпидермолиз, крапивница, формы эритемы или алопеция;
(b) суставное состояние, такое как остеоартрит, системный ювенильный идиопатический артрит, болезнь Стилла, развившаяся у взрослых, рецидивирующий полихондрит, ревматоидный артрит, ювенильный хронический артрит, микрокристаллическая артропатия (например, псевдоподагра, подагра) или серонегативная спондилоартропатия (например, анкилозирующий спондилоартрит, псориатический артрит или болезнь Рейтера);
(c) мышечное состояние, такое как полимиозит или тяжелая миастения;
(d) состояние желудочно-кишечного тракта, такое как воспалительное заболевание кишечника (в том числе болезнь Крона и неспецифический язвенный колит), язва желудка, целиакия, проктит, панкреатит, эозинофильный гастроэнтерит, мастоцитоз, антифосфолипидный синдром или пищевая аллергия, которое могут характеризоваться эффектами в отдалении от кишечника (например, мигренью, ринитом или экземой);
(e) состояние дыхательной системы, такое как хроническое обструктивное заболевание легких (COPD), астма (в том числе бронхиальная, аллергическая, эндогенная, экзогенная или пылевая астма и, в частности, хроническая или застарелая астма, такая как поздняя астма и гиперчувствительность дыхательных путей), бронхит, ринит (в том числе острый ринит, аллергический ринит, атрофический ринит, хронический ринит, хронический ринит с образованием казеозных масс, гипертрофический ринит, гнойный ринит, сухой ринит, медикаментозный ринит, мембранозный ринит, сезонный ринит, например, сенная лихорадка, и вазомоторный ринит), синусит, идиопатический легочный фиброз (IPF), саркоидоз, "легкое фермера", силикоз, асбестоз, респираторный дистресс-синдром взрослых, гиперчувствительный пневмонит или идиопатическая интерстициальная пневмония;
(f) сосудистое состояние, такое как атеросклероз, болезнь Бехчета, васкулит или гранулематоз Вегенера;
(g) иммунопатологическое состояние, например, аутоиммунное состояние, такое как системная красная волчанка (SLE), синдром Шегрена, системный склероз, тиреоидит Хашимото, сахарный диабет I типа, идиопатическая тромбоцитопеническая пурпура или болезнь Грейвcа;
(h) глазное состояние, такое как увеит, аллергический конъюнктивит или весенний конъюнктивит;
(i) нервное состояние, такое как рассеянный склероз или энцефаломиелит;
(j) инфекционное или связанное с инфекцией состояние, такое как синдром приобретенного иммунодефицита (AIDS), острая или хроническая бактериальная инфекция, острая или хроническая паразитарная инфекция, острая или хроническая вирусная инфекция, острая или хроническая грибковая инфекция, менингит, гепатит (A, B или C или другой вирусный гепатит), перитонит, пневмония, эпиглоттит, малярия, геморрагическая лихорадка денге, лейшманиоз, стрептококковый миозит, инфекция, вызываемая Mycobacterium tuberculosis, инфекция, вызываемая комплексом Mycobacterium avium-intracellulare, пневмония, вызываемая Pneumocystis carinii, орхит/эпидидимит, легионеллез, болезнь Лайма, инфекция, вызываемая вирусом гриппа A, инфекция, вызываемая вирусом Эпштейна-Барр, вирусный энцефалит/асептический менингит или воспалительное заболевание тазовых органов;
(k) почечное состояние, такое как мезангиальный пролиферативный гломерулонефрит, нефротический синдром, нефрит, гломерулярный нефрит, острая почечная недостаточность, уремия или нефритический синдром;
(l) лимфатическое состояние, такое как болезнь Кастлемана;
(m) состояние иммунной системы или состояние, в которое вовлечена иммунная система, такое как гипер-IgE-синдром, лепроматозная проказа, семейный гемофагоцитарный лимфогистиоцитоз или реакция "трансплантат против хозяина";
(n) печеночное состояние, такое как хронический активный гепатит, неалкогольный стеатогепатит (NASH), алкогольный гепатит, неалкогольная жировая болезнь печени (NAFLD), алкогольная жировая болезнь печени (AFLD), алкогольный стеатогепатит (ASH) или первичный билиарный цирроз;
(o) рак, в том числе формы рака, перечисленные в данном документе ниже;
(p) ожог, рана, травма, кровоизлияние или инсульт;
(q) воздействие излучения; и/или
(r) ожирение; и/или
(s) боль, такая как воспалительная гипералгезия.
II. Воспалительное заболевание, в том числе воспаление, возникающее в результате воспалительного нарушения, например, аутовоспалительное заболевание, такое как формы криопирин-ассоциированного периодического синдрома (CAPS), синдром Макла-Уэльса (MWS), семейный холодовой аутовоспалительный синдром (FCAS), семейная средиземноморская лихорадка (FMF), мультисистемное воспалительное заболевание неонатального возраста (NOMID), синдром Маджид, синдром пиогенного артрита, гангренозной пиодермии и акне (PAPA), болезнь Стилла, развившаяся у взрослых (AOSD), гаплонедостаточность по A20 (HA20), детский гранулематозный артрит (PGA), PLCG2-ассоциированный дефицит антител с иммунной дисрегуляцией (PLAID), аутовоспаление и PLCG2-ассоциированный дефицит антител с иммунной дисрегуляцией (APLAID) или сидеробластная анемия с B-клеточным иммунодефицитом, эпизодами периодической лихорадки и задержкой в развитии (SIFD).
III. Иммунные заболевания, например, аутоиммунные заболевания, такие как острый рассеянный энцефаломиелит, болезнь Аддисона, анкилозирующий спондилоартрит, синдром антифосфолипидных антител (APS), антисинтетазный синдром, апластическая анемия, аутоиммунный адреналит, аутоиммунный гепатит, аутоиммунный оофорит, аутоиммунная полигландулярная недостаточность, аутоиммунный тиреоидит, целиакия, болезнь Крона, сахарный диабет 1 типа (T1D), синдром Гудпасчера, болезнь Грейвcа, синдром Гийена-Барре (GBS), болезнь Хашимото, идиопатическая тромбоцитопеническая пурпура, болезнь Кавасаки, эритематозная волчанка, включая системную красную волчанку (SLE), рассеянный склероз (MS), включая первично-прогрессирующий рассеянный склероз (PPMS), вторично-прогрессирующий рассеянный склероз (SPMS) и рецидивирующе-ремиттирующий рассеянный склероз (RRMS), тяжелая миастения, опсо-миоклональный синдром (OMS), неврит зрительного нерва, атрофическая форма аутоиммунного тиреоидита, пемфигус, злокачественная анемия, полиартрит, первичный билиарный цирроз, ревматоидный артрит (RA), псориатический артрит, ювенильный идиопатический артрит или болезнь Стилла, рефрактерный подагрический артрит, синдром Рейтера, синдром Шегрена, системный склероз как системное нарушение со стороны соединительной ткани, артериит Такаясу, височный артериит, аутоиммунная гемолитическая анемия с тепловыми антителами, гранулематоз Вегенера, общая алопеция, болезнь Бехчета, болезнь Шагаса, дизавтономия, эндометриоз, гнойный гидраденит (HS), интерстициальный цистит, нейромиотония, псориаз, саркоидоз, склеродермия, неспецифический язвенный колит, синдром Шницлера, синдром активации макрофагов, синдром Блау, гигантоклеточный артериит, витилиго или вульводиния;
IV. Рак, в том числе рак легкого, почечноклеточная карцинома, немелкоклеточная карцинома легкого (NSCLC), гистиоцитоз из клеток Лангерганса (LCH), миелопролиферативные новообразования (MPN), рак поджелудочной железы, рак желудка, миелодиспластический синдром (MDS), лейкоз, включая острый лимфоцитарный лейкоз (ALL) и острый миелоидный лейкоз (AML), промиелоцитарный лейкоз (APML или APL), рак надпочечника, рак анального канала, базальноклеточный и плоскоклеточный рак кожи, рак желчных протоков, рак мочевого пузыря, рак костей, опухоли головного мозга и спинного мозга, рак молочной железы, рак шейки матки, хронический лимфоцитарный лейкоз (CLL), хронический миелоидный лейкоз (CML), хронический миеломоноцитарный лейкоз (CMML), колоректальный рак, рак эндометрия, рак пищевода, опухоли семейства саркомы Юинга, рак глаза, рак желчного пузыря, карциноидные опухоли желудочно-кишечного тракта, стромальная опухоль желудочно-кишечного тракта (GIST), гестационная трофобластическая болезнь, глиома, болезнь Ходжкина, саркома Капоши, рак почки, рак гортани и гипофарингеальный рак, рак печени, карциноидная опухоль легкого, лимфома, включая кожную Т-клеточную лимфому, злокачественная мезотелиома, меланомный рак кожи, рак кожи из клеток Меркеля, множественная миелома, рак полости носа и придаточных пазух, рак носоглотки, нейробластома, неходжкинская лимфома, немелкоклеточный рак легкого, рак полости рта и ротоглотки, остеосаркома, рак яичника, рак полового члена, опухоли гипофиза, рак предстательной железы, ретинобластома, рабдомиосаркома, рак слюнной железы, рак кожи, мелкоклеточный рак легкого, рак тонкой кишки, саркома мягких тканей, рак желудка, рак яичка, рак вилочковой железы, рак щитовидной железы, включая анапластический рак щитовидной железы, саркома матки, рак влагалища, рак вульвы, макроглобулинемия Вальденстрема и опухоль Вильмса;
V. Инфекции, в том числе вирусные инфекции (например, вызываемые вирусом гриппа, вирусом иммунодефицита человека (HIV), альфавирусом (таким как вирус чикунгуньи и вирус лихорадки реки Росс), флавивирусами (такими как вирус лихорадки денге и вирус Зика), вирусами герпеса (такими как вирус Эпштейна-Барр, цитомегаловирус, вирус ветряной оспы и KSHV), поксвирусами (такими как вирус осповакцины (модифицированный вирус осповакцины Анкара) и вирус миксомы), аденовирусами (таким как аденовирус 5 типа) или папилломавирусом), бактериальные инфекции (например, вызываемые Staphylococcus aureus, Helicobacter pylori, Bacillus anthracis, Bordetella pertussis, Burkholderia pseudomallei, Corynebacterium diphtheriae, Clostridium tetani, Clostridium botulinum, Streptococcus pneumoniae, Streptococcus pyogenes, Listeria monocytogenes, Haemophilus influenzae, Pasteurella multocida, Shigella dysenteriae, Mycobacterium tuberculosis, Mycobacterium leprae, Mycoplasma pneumoniae, Mycoplasma hominis, Neisseria meningitidis, Neisseria gonorrhoeae, Rickettsia rickettsii, Legionella pneumophila, Klebsiella pneumoniae, Pseudomonas aeruginosa, Propionibacterium acnes, Treponema pallidum, Chlamydia trachomatis, Vibrio cholerae, Salmonella typhimurium, Salmonella typhi, Borrelia burgdorferi или Yersinia pestis), грибковые инфекции (например, вызываемые видами Candida или Aspergillus), протозойные инфекции (например, вызванные Plasmodium, Babesia, Giardia, Entamoeba, Leishmania или видами Trypanosoma), гельминтные инфекции (например, вызываемые шистосомами, круглыми червями, ленточными червями или сосальщиками) и прионные инфекции;
VI. Заболевания центральной нервной системы, такие как болезнь Паркинсона, болезнь Альцгеймера, деменция, болезнь двигательного нейрона, болезнь Хантингтона, церебральная малярия, повреждение головного мозга вследствие пневмококкового менингита, внутричерепные аневризмы, травматическое повреждение головного мозга, рассеянный склероз и боковой амиотрофический склероз;
VII. Метаболические заболевания, такие как сахарный диабет 2 типа (T2D), атеросклероз, ожирение, подагра и псевдоподагра;
VIII. Сердечно-сосудистые заболевания, такие как гипертензия, ишемия, реперфузионное повреждение, включая ишемически-реперфузионное повреждение после MI, инсульт, включая ишемический инсульт, транзиторная ишемическая атака, инфаркт миокарда, включая рецидивирующий инфаркт миокарда, сердечная недостаточность, включая застойную сердечную недостаточность и сердечную недостаточность с сохраненной фракцией выброса, эмболия, аневризмы, включая аневризму брюшной аорты, снижение сердечно-сосудистого риска (CvRR) и перикардит, включая синдром Дресслера;
IX. Респираторные заболевания, в том числе хроническое обструктивное заболевание легких (COPD), астма, такая как аллергическая астма и стероидорезистентная астма, асбестоз, силикоз, воспаление, индуцированное наночастицами, муковисцидоз и идиопатический легочный фиброз;
X. Заболевания печени, в том числе неалкогольная жировая болезнь печени (NAFLD) и неалкогольный стеатогепатит (NASH), включая стадии F3 и F4 выраженного фиброза, алкогольная жировая болезнь печени (AFLD) и алкогольный стеатогепатит (ASH);
XI. Заболевания почек, в том числе острое заболевание почек, гипероксалурия, хроническое заболевание почек, оксалатная нефропатия, нефрокальциноз, гломерулонефрит и диабетическая нефропатия;
XII. Заболевания глаз, в том числе заболевания глазного эпителия, возрастная макулярная дегенерация (AMD) (сухая и влажная формы), увеит, инфекция роговицы, диабетическая ретинопатия, поражение зрительного нерва, сухость глаз и глаукома;
XIII. Заболевания кожи, в том числе дерматит, такой как контактный дерматит и атопический дерматит, контактная гиперчувствительность, солнечный ожог, повреждения кожи, гнойный гидраденит (HS), другие заболевания кожи, вызывающие образование кисты, и шаровидные угри;
XIV. Лимфатические состояния, такие как лимфангит и болезнь Кастлемана;
XV. Психические расстройства, такие как депрессия и психологический стресс;
XVI. Реакция "трансплантат против хозяина";
XVII. Заболевания костей, в том числе остеопороз, остеопетроз;
XVIII. Заболевание крови, в том числе серповидно-клеточная анемия;
XIX. Аллодиния, в том числе механическая аллодиния; и
XX. Любое заболевание, при котором было определено, что индивидуум является носителем герминативной или соматической немолчащей мутации в NLRP3.
Более конкретно, соединения по настоящему изобретению могут быть применимы в лечении показания, выбранного из заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболеваний/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, это относится к формам аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарному диабету I типа/II типа и связанным с ним осложнениям (например, нефропатии, ретинопатии), подагре, псевдоподагре (хондрокальцинозу), хроническому заболеванию печени, NASH, нарушениям, связанным с нейровоспалением (например, рассеянному склерозу, инфекции головного мозга, острому повреждению, нейродегенеративным заболеваниям, болезни Альцгеймера), атеросклерозу и сердечно-сосудистому риску (например, снижению сердечно-сосудистого риска (CvRR), гипертензии), гнойному гидрадениту, заживлению ран и образованию шрамов, а также раку (например, раку толстой кишки, раку легкого, миелопролиферативным новообразованиям, формам лейкоза, формам миелодиспластического синдрома (MDS), миелофиброзу).
В частности, соединения по настоящему изобретению или их фармацевтически приемлемая соль могут быть применимы в лечении заболевания или нарушения, предпочтительно выбранного из форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
Таким образом, в качестве дополнительного аспекта в настоящем изобретении предусмотрено применение соединения любой из формул (I), (II), (III) и (III-A), или соединения в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g), или соединения в соответствии с любым из иллюстративных примеров (например, от пр. 001 до пр. 104, раскрытых в данном документе), или их фармацевтически приемлемой соли в терапии. В дополнительном варианте осуществления терапия выбрана из терапии заболевания, лечение которого можно осуществлять посредством ингибирования сигнального пути инфламмасомы NLRP3. В другом варианте осуществления заболевание выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболевания/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, это относится к формам аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарному диабету I типа/II типа и связанным с ним осложнениям (например, нефропатии, ретинопатии), гипероксалурии, подагре, псевдоподагре (хондрокальцинозу), хроническому заболеванию печени, NASH, нарушениям, связанным с нейровоспалением (например, рассеянному склерозу, инфекции головного мозга, острому повреждению, нейродегенеративным заболеваниям, болезни Альцгеймера), атеросклерозу и сердечно-сосудистому риску (например, снижению сердечно-сосудистого риска (CvRR), гипертензии), гнойному гидрадениту, заживлению ран и образованию шрамов, а также раку (например, раку толстой кишки, раку легкого, миелопролиферативным новообразованиям, формам лейкоза, формам миелодиспластического синдрома (MDS), миелофиброзу).
Таким образом, в качестве дополнительного аспекта в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A), или соединение в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g), или соединение в соответствии с любым из иллюстративных примеров (например, от пр. 001 до пр. 104, раскрытых в данном документе), или его фармацевтически приемлемая соль для применения в терапии. В дополнительном варианте осуществления терапия выбрана из терапии заболевания, лечение которого можно осуществлять посредством ингибирования сигнального пути инфламмасомы NLRP3. В другом варианте осуществления заболевание выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболевания/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, это относится к формам аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарному диабету I типа/II типа и связанным с ним осложнениям (например, нефропатии, ретинопатии), гипероксалурии, подагре, псевдоподагре (хондрокальцинозу), хроническому заболеванию печени, NASH, нарушениям, связанным с нейровоспалением (например, рассеянному склерозу, инфекции головного мозга, острому повреждению, нейродегенеративным заболеваниям, болезни Альцгеймера), атеросклерозу и сердечно-сосудистому риску (например, снижению сердечно-сосудистого риска (CvRR), гипертензии), гнойному гидрадениту, заживлению ран и образованию шрамов, а также раку (например, раку толстой кишки, раку легкого, миелопролиферативным новообразованиям, формам лейкоза, формам миелодиспластического синдрома (MDS), миелофиброзу).
В другом аспекте в настоящем изобретении предусмотрен способ лечения заболевания, лечение которого осуществляется посредством ингибирования NLRP3, включающий введение терапевтически эффективного количества соединения любой из формул (I), (II), (III) и (III-A), или соединения в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g), или соединения в соответствии с любым из иллюстративных примеров (например, от пр. 001 до пр. 104, раскрытых в данном документе), или его фармацевтически приемлемой соли. В дополнительном варианте осуществления заболевание выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболеваний/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, это относится к формам аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарному диабету I типа/II типа и связанным с ним осложнениям (например, нефропатии, ретинопатии), гипероксалурии, подагре, псевдоподагре (хондрокальцинозу), хроническому заболеванию печени, NASH, нарушениям, связанным с нейровоспалением (например, рассеянному склерозу, инфекции головного мозга, острому повреждению, нейродегенеративным заболеваниям, болезни Альцгеймера), атеросклерозу и сердечно-сосудистому риску (например, снижению сердечно-сосудистого риска (CvRR), гипертензии), гнойному гидрадениту, заживлению ран и образованию шрамов, а также раку (например, раку толстой кишки, раку легкого, миелопролиферативным новообразованиям, формам лейкоза, формам миелодиспластического синдрома (MDS), миелофиброзу).
В дополнительном аспекте в настоящем изобретении предусмотрены соединение любой из формул (I), (II), (III) и (III-A), или соединение в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g), или соединение в соответствии с любым из иллюстративных примеров (например, от пр. 001 до пр. 104, раскрытых в данном документе), или его фармацевтически приемлемая соль, применимые в лечении заболевания, нарушения или состояния, по сути или полностью опосредованных активностью инфламмасомы NLRP3, как раскрыто в данном документе, и/или NLRP3-индуцированным IL-1-бета, и/или NLRP3-индуцированным IL-18. Некоторые из заболеваний, расстройств или состояний, указанных в данном документе, возникают вследствие мутаций в NLRP3, в частности возникают в результате повышенной активности NLRP3.
Таким образом, в качестве дополнительного аспекта в настоящем изобретении предусмотрено применение соединения любой из формул (I), (II), (III) и (III-A), или соединения в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g), или соединения в соответствии с любым из иллюстративных примеров (например, от пр. 001 до пр. 104, раскрытых в данном документе), или его фармацевтически приемлемой соли для изготовления лекарственного препарата. В дополнительном варианте осуществления лекарственный препарат предназначен для лечения заболевания, лечение которого осуществляется посредством ингибирования сигнального пути инфламмасомы NLRP3. В другом варианте осуществления заболевание выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболеваний/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, это относится к формам аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарному диабету I типа/II типа и связанным с ним осложнениям (например, нефропатии, ретинопатии), гипероксалурии, подагре, псевдоподагре (хондрокальцинозу), хроническому заболеванию печени, NASH, нарушениям, связанным с нейровоспалением (например, рассеянному склерозу, инфекции головного мозга, острому повреждению, нейродегенеративным заболеваниям, болезни Альцгеймера), атеросклерозу и сердечно-сосудистому риску (например, снижению сердечно-сосудистого риска (CvRR), гипертензии), гнойному гидрадениту, заживлению ран и образованию шрамов, а также раку (например, раку толстой кишки, раку легкого, миелопролиферативным новообразованиям, формам лейкоза, формам миелодиспластического синдрома (MDS), миелофиброзу).
В другом варианте осуществления настоящего изобретения предусмотрены 3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены (S)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В предпочтительном варианте осуществления настоящего изобретения предусмотрены (R)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. Например, заболевание или нарушение выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболевания/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, соединения по настоящему изобретению могут быть применимы в лечении форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
В одном варианте осуществления настоящего изобретения предусмотрены 2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены (S)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В предпочтительном варианте осуществления настоящего изобретения предусмотрены (R)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. Например, заболевание или нарушение выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболевания/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, соединения по настоящему изобретению могут быть применимы в лечении форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
В другом варианте осуществления настоящего изобретения предусмотрены 2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены (S)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В предпочтительном варианте осуществления настоящего изобретения предусмотрены (R)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. Например, заболевание или нарушение выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболевания/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, соединения по настоящему изобретению могут быть применимы в лечении форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
В другом варианте осуществления настоящего изобретения предусмотрены 2-(6-((3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены 2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В предпочтительном варианте осуществления настоящего изобретения предусмотрены 2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. Например, заболевание или нарушение выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболевания/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, соединения по настоящему изобретению могут быть применимы в лечении форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
В другом варианте осуществления настоящего изобретения предусмотрены 2-(6-((3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены 2-(6-(((1S,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены 2-(6-(((1R,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены 2-(6-(((1S,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В предпочтительном варианте осуществления настоящего изобретения предусмотрены 2-(6-(((1R,3S)-3-гидроксициклогексил) амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. Например, заболевание или нарушение выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболевания/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, соединения по настоящему изобретению могут быть применимы в лечении форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
В другом варианте осуществления настоящего изобретения предусмотрены 5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены (3R,5S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены (3R,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В другом варианте осуществления настоящего изобретения предусмотрены (3S,5S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. В предпочтительном варианте осуществления настоящего изобретения предусмотрены (3S,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол или его фармацевтически приемлемая соль для применения в лечении заболевания или нарушения, лечение которого осуществляется посредством ингибирования сигнального пути NLRP3. Например, заболевание или нарушение выбрано из вышеупомянутого списка, предпочтительно заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например, форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), серповидно-клеточной анемии, системной красной волчанки (SLE), заболевания/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза). В частности, соединения по настоящему изобретению могут быть применимы в лечении форм аутовоспалительного лихорадочного синдрома (например, CAPS), серповидно-клеточной анемии, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипероксалурии, подагры, псевдоподагры (хондрокальциноза), хронического заболевания печени, NASH, нарушений, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), атеросклероза и сердечно-сосудистого риска (например, снижения сердечно-сосудистого риска (CvRR), гипертензии), гнойного гидраденита, заживления ран и образования шрамов, а также рака (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
Фармацевтическая композиция или комбинация по настоящему изобретению может быть предусмотрена в однократной дозировке, составляющей приблизительно 1-1000 мг активного(активных) ингредиента(ингредиентов) для субъекта весом приблизительно 50-70 кг, или приблизительно 1-500 мг, или приблизительно 1-250 мг, или приблизительно 1-150 мг, или приблизительно 1-100 мг, или приблизительно 1-50 мг активных ингредиентов. Терапевтически эффективная дозировка соединения, фармацевтической композиции или их комбинаций зависит от вида субъекта, веса тела, возраста и индивидуального состояния, нарушения или заболевания, лечение которых осуществляется, или их тяжести. Лечащий врач, клиницист или ветеринар средней квалификации может легко определить эффективное количество каждого из активных ингредиентов, необходимое для предупреждения, лечения или ингибирования прогрессирования нарушения или заболевания.
Вышеупомянутые параметры дозировки являются очевидными в тестах in vitro и in vivo с использованием преимущественно млекопитающих, например, мышей, крыс, собак, нечеловекообразных обезьян, или выделенных органов, тканей и их препаратов. Соединения по настоящему изобретению можно применять in vitro в форме растворов, например, водных растворов, и in vivo энтерально либо парентерально, преимущественно внутривенно, например, в виде суспензии или водного раствора. Дозировка in vitro может находиться в диапазоне концентраций от приблизительно 10-3 моль/л до 10-9 моль/л. Терапевтически эффективное количество in vivo в зависимости от пути введения может находиться в диапазоне приблизительно 0,1-500 мг/кг или приблизительно 1-100 мг/кг.
КОМБИНИРОВАННЫЙ ПРОДУКТ И КОМБИНИРОВАННАЯ ТЕРАПИЯ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
"Комбинация" относится к фиксированной комбинации в одной единичной лекарственной форме либо к комбинированному введению, где соединение по настоящему изобретению и партнер по комбинации (например, другое лекарственное средство, которое поясняется ниже, также называемое "терапевтическим средством" или "совместно применяемым средством") могут вводиться независимо в одно и то же время или по отдельности через промежутки времени, особенно в случае, если данные промежутки времени обеспечивают возможность проявления партнерами по комбинации кооперативного, например, синергического, эффекта. Отдельные компоненты могут быть упакованы в набор или предоставлены по отдельности. Один или оба компонента (например, порошки или жидкости) могут быть восстановлены или разбавлены до необходимой дозы перед введением. Термины "совместное введение" или "комбинированное введение" или им подобные, используемые в данном документе, подразумеваются как охватывающие введение выбранного партнера по комбинации одному субъекту, нуждающемуся в этом (например, пациенту), и предполагают включение режимов лечения, в которых средства не обязательно вводят одним и тем же путем введения или в одно и то же время. Термин "фармацевтическая комбинация", используемый в данном документе, означает продукт, полученный в результате смешивания или комбинирования более чем одного терапевтического средства, который включает как фиксированные, так и нефиксированные комбинации терапевтических средств. Используемый в данном документе термин "фармацевтическая комбинация" относится к фиксированной комбинации в одной единичной лекарственной форме либо нефиксированной комбинации или набору из частей для комбинированного введения, где два или более терапевтических средства можно вводить независимо в одно и то же время или по отдельности через промежутки времени, особенно в случае, если данные промежутки времени обеспечивают возможность проявления партнерами по комбинации кооперативного, например, синергического, эффекта. Термин "фиксированная комбинация" означает, что оба терапевтических средства, например, соединение по настоящему изобретению и партнер по комбинации, вводятся пациенту одновременно в форме единого объекта или дозы. Термин "нефиксированная комбинация" означает, что оба терапевтических средства, например, соединение по настоящему изобретению и партнер по комбинации, вводятся пациенту в виде отдельных объектов одновременно, параллельно либо последовательно без конкретных временных пределов, при этом такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также применимо в отношении "коктейльной терапии", например, при введении трех или более терапевтических средств.
Термин "комбинированная терапия" относится к введению двух или более терапевтических средств для лечения терапевтического состояния или нарушения, описанного в настоящем изобретении. Такое введение охватывает совместное введение этих терапевтических средств по сути одновременно, как, например, в одной капсуле, имеющей фиксированное соотношение активных ингредиентов. В качестве альтернативы такое введение охватывает совместное введение в нескольких или в отдельных контейнерах (например, таблетках, капсулах, порошках и жидкостях) для каждого активного ингредиента. Порошки и/или жидкости могут быть восстановлены или разбавлены до необходимой дозы перед введением. Кроме того, такое введение также охватывает применение каждого типа терапевтического средства последовательно примерно в одно и то же время либо в разное время. В любом случае режим лечения будет обеспечивать благоприятные эффекты комбинации лекарственных средств при лечении состояний или нарушений, описанных в данном документе.
Соединение по настоящему изобретению можно вводить одновременно с одним или несколькими другими терапевтическими средствами либо перед ними или после них. Соединение по настоящему изобретению можно вводить отдельно от других средств посредством того же или другого пути введения или же вместе с ними в одной фармацевтической композиции. Терапевтическое средство представляет собой, например, химическое соединение, пептид, антитело, фрагмент антитела или нуклеиновую кислоту, которые являются терапевтически активными или повышают терапевтическую активность при введении пациенту в комбинации с соединением по настоящему изобретению.
В одном варианте осуществления в настоящем изобретении предусмотрен продукт, содержащий соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемую соль и по меньшей мере одно другое терапевтическое средство в виде комбинированного препарата для одновременного, раздельного или последовательного применения в терапии. В одном варианте осуществления терапия представляет собой лечение заболевания или состояния, опосредованного NLRP3. Продукты, предусмотренные в виде комбинированного препарата, включают композицию, содержащую соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемую соль и другое(другие) терапевтическое(терапевтические) средство(средства) вместе в одной и той же фармацевтической композиции, или соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемую соль и другое(другие) терапевтическое(терапевтические) средство(средства) в раздельной форме, например в форме набора.
В одном варианте осуществления в настоящем изобретении предусмотрена фармацевтическая комбинация, содержащая соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемую соль или соединение в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтический приемлемую соль и другое(другие) терапевтическое(терапевтические) средство(средства). Фармацевтическая комбинация необязательно может содержать фармацевтически приемлемый носитель, описанный выше.
В одном варианте осуществления в настоящем изобретении предусмотрен набор, содержащий две или более отдельные фармацевтические композиции, по меньшей мере одна из которых содержит соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемую соль или соединение в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемую соль. В одном варианте осуществления набор содержит средства для раздельного содержания указанных композиций, такие как контейнер, секционная бутылка или секционный пакет из фольги. Примером такого набора является блистерная упаковка, как правило, применяемая для упаковки таблеток, капсул и т. п.
Набор по настоящему изобретению можно применять для введения различных лекарственных форм, например, для перорального и парентерального применения, для введения отдельных композиций с различными интервалами между введениями доз или для титрования отдельных композиций относительно друг друга. В целях содействия соблюдению режима лечения набор по настоящему изобретению, как правило, содержит инструкции по введению.
В видах комбинированной терапии по настоящему изобретению соединение по настоящему изобретению и другое терапевтическое средство могут быть изготовлены и/или составлены одним и тем же или различными производителями. Более того, соединение по настоящему изобретению и другое терапевтическое средство могут быть объединены в средство комбинированной терапии: (i) до передачи врачам комбинированного продукта (например, в случае с набором, содержащим соединение по настоящему изобретению и другое терапевтическое средство); (ii) самими врачами (или под руководством врача) незадолго до введения; (iii) самими пациентами, например, во время последовательного введения соединения по настоящему изобретению и другого терапевтического средства.
Соответственно, в настоящем изобретении предусмотрено применение соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли для лечения заболевания или состояния, опосредованного NLRP3, где лекарственный препарат получен для введения с другим терапевтическим средством. В настоящем изобретении также предусматривается применение другого терапевтического средства для лечения заболевания или состояния, опосредованного NLRP3, где лекарственный препарат вводится с соединением любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой солью или соединением в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтический приемлемой солью.
В настоящем изобретении также предусматривается соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль или соединение в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемая соль для применения в способе лечения заболевания или состояния, опосредованного NLRP3, где соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль или соединение в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемая соль получены для введения с другим терапевтическим средством. В настоящем изобретении также предусматривается другое терапевтическое средство для применения в способе лечения заболевания или состояния, опосредованного NLRP3, где другое терапевтическое средство получено для введения с соединением любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой солью или соединением в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемой солью. В настоящем изобретении также предусматривается соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль или соединение в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемая соль для применения в способе лечения заболевания или состояния, опосредованного NLRP3, где соединение любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемая соль или соединение в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемая соль вводится с другим терапевтическим средством. В настоящем изобретении также предусматривается другое терапевтическое средство для применения в способе лечения заболевания или состояния, опосредованного NLRP3, где другое терапевтическое средство вводится с соединением любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой солью или соединением в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемой солью.
В настоящем изобретении также предусматривается применение соединения любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой соли или соединения в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемой соли для лечения заболевания или состояния, опосредованного NLRP3, где пациент ранее (например, в период до 24 часов перед этим) подвергался лечению другим терапевтическим средством. В настоящем изобретении также предусматривается применение другого терапевтического средства для лечения заболевания или состояния, опосредованного сигнальным путем инфламмасомы NLRP3, где пациент ранее (например в период до 24 часов перед этим) подвергался лечению соединением любой из формул (I), (II), (III) и (III-A) или его фармацевтически приемлемой солью или соединением в соответствии с любым из предыдущих вариантов осуществления (т. е. в соответствии с любым из вариантов осуществления 1-11g) или его фармацевтически приемлемой солью.
В одном варианте осуществления другое терапевтическое средство представляет собой терапевтическое средство, применимое в лечении заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, раскрытых в данном документе.
В одном варианте осуществления другое терапевтическое средство, применимое в комбинированной терапии, выбрано из агонистов фарнезоидного Х-рецептора (FXR); противостеатозных средств; противофиброзных средств; ингибиторов JAK; ингибиторов иммунных контрольных точек; средств химиотерапии, лучевой терапии и хирургических процедур; средств терапии, снижающих уровни уратов; анаболических средств и средств регенеративной терапии хрящевой ткани; средств блокады IL-17; ингибиторов системы комплемента; ингибиторов тирозинкиназы Брутона (ингибиторов BTK); ингибиторов Toll-подобных рецепторов (ингибиторов TLR7/8); средств CAR-T-клеточной терапии; антигипертензивных средств; средств, снижающих уровень холестерина; ингибиторов лейкотриен-А4-гидролазы (LTAH4); ингибиторов SGLT2; β2-агонистов; противовоспалительных средств; нестероидных противовоспалительных лекарственных средств ("NSAID"); лекарственных средств на основе ацетилсалициловой кислоты (ASA), в том числе аспирина; парацетамола; средств лечения методом регенеративной терапии; средств лечения муковисцидоза и средства лечения атеросклероза.
Подходящие ингибиторы лейкотриен-A4-гидролазы (LTA4H) для применения в комбинации включают без ограничения соединения, раскрытые в WO2015/092740 (№ дела патентного поверенного PAT056044-WO-PCT).
Подходящие ингибиторы натрийзависимого переносчика глюкозы 2 (SGLT2) для применения в комбинации включают без ограничения соединения, раскрытые в US 8163704 (№ дела патентного поверенного PAT053854-WO-PCT), WO2011/048112, WO2011/048148 или в WO2010/128152.
Подходящие β2-агонисты для применения в комбинации включают без ограничения арформотерол, бамбутерол, битолтерол, броксатерол, карбутерол, кленбутерол, допексамин, фенотерол, формотерол, гексопреналин, ибутерол, изоэтарин, изопреналин, левосальбутамол, мабутерол, мелуадрин, метапротеренол, ноломирол, орципреналин, пирбутерол, прокатерол, репротерол, ритодрин, римитерол, сальбутамол, сальмефамол, сальметерол, сибенадет, сотенерот, сульфонтерол, тербуталин, тиарамид, тулобутерол, GSK-597901, GSK-159797, GSK-678007, GSK-642444, GSK-159802, HOKU-81, моногидрат гидрохлорида (-)-2-[7(S)-[2(R)-гидрокси-2-(4-гидроксифенил)этиламино]-5,6,7,8-тетрагидро-2-нафтилокси]-N, N-диметилацетамида, кармотерол, QAB-149 и 5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-он, 4-гидрокси-7-[2-{[2-{[3-(2-фенилэтокси)пропил]сульфонил}этил]амино}этил]-2(3H)-бензoтиазолон, 1-(1-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-l,4-бензоксазин-8-ил]-2-[3-(4-N, N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2H-5-гидрокси-3-оксо-4H-1,4-бензоксазин-8-ил]-2-{4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламино}этанол, 5-гидрокси-8-(1-гидрокси-2-изопропиламинобутил)-2H-1,4-бензоксазин-3-(4H)-он, 1-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламино)этанол, 1-(4-этоксикарбониламино-3-циано-5-фторфенил)-2-(трет-бутиламино)этанол и их комбинации, каждый из которых необязательно находится в форме рацемата, энантиомера, диастереомера или их смесей и также необязательно в форме фармакологически совместимой соли присоединения кислоты.
Подходящие средства регенеративной терапии хрящевой ткани для применения в комбинации включают без ограничения пептидомиметики ANGPTL3, раскрытые в WO2014/138687 (номер дела патентного поверенного PAT055625-WO-PCT), или активатор хондрогенеза, раскрытый в WO2015/175487 (номер дела патентного поверенного PAT055940-WO-PCT).
Подходящие ингибиторы иммунных контрольных точек для применения в комбинации включают без ограничения ингибиторы PD1, ингибиторы LAG-3, ингибиторы TIM-3, ингибиторы PDL1. Подходящие ингибиторы PD1 включают без ограничения молекулу антитела, раскрытую в WO2015/112900. Подходящие ингибиторы LAG-3 включают без ограничения молекулу антитела, раскрытую в WO2015/138920. Подходящие ингибиторы TIM-3 включают без ограничения молекулу антитела, раскрытую в WO2015/117002. Подходящие ингибиторы TIM-3 включают без ограничения молекулу антитела, раскрытую в WO2015/117002. Подходящие ингибиторы PDL1 включают без ограничения молекулу антитела, раскрытую в WO/2016/061142.
Подходящие ингибиторы Toll-подобных рецепторов (ингибиторы TLR7/8) для применения в комбинации включают без ограничения соединение, раскрытое в WO2018/04081.
Подходящие агонисты FXR для применения в комбинации включают без ограничения обетихолевую кислоту (так называемую OCA, Intercept), GS9674, элафибранор (GFT505), GW4064, UPF987, FXR-450, фексарамин, метилфолат, метилдезоксихолат, 5β-холановую кислоту, 7α,12α-диольное производное 5β-холановой кислоты, NIHS700, маршантин A, маршантин E, MFA-1, INT767 (также называемый 6α-этил-CDCA, раскрытый в WO2014/085474), MET409 (Metacrine), EDP-305 (Enanta), 2-[(1R,3r,5S)-3-({5-циклопропил-3-[2-(трифторметокси)фенил]-1,2-оксазол-4-ил}метокси)-8-азабицикло[3.2.1]октан-8-ил]-4-фтор-1,3-бензoтиазол-6-карбоновую кислоту (также известную под названием тропифексор) или их фармацевтически приемлемую соль или соединение, раскрытое в WO 2012/087519, или соединение, раскрытое в WO 2015/069666.
Подходящие ингибиторы JAK для применения в комбинации включают без ограничения руксолитиниб.
Подходящие NSAID для применения в комбинации включают без ограничения ацеклофенак, ацеметацин, ацетилсалициловую кислоту, алклофенак, алминопрофен, амфенак, ампироксикам, амтолметин гуацил, аниролак, антрафенин, азапропазон, бенорилат, бермопрофен, биндарит, бромфенак, буклоксовую кислоту, буколом, буфексамак, бумадизон, бутибуфен, бутиксират, карбасалат кальция, карпрофен, трисалицилат холина и магния, целекоксиб, цинметацин, цинноксикам, клиданак, клобузарит, дебоксамет, дексибупрофен, декскетопрофен, диклофенак, дифлунисал, дроксикам, элтенак, энфенаминзаур, этерсалат, этодолак, этофенамат, эторикоксиб, феклобузон, фелбинак, фенбуфен, фенклофенак, фенопрофен, фентиазак, фепрадинол, фепразон, флобуфен, флоктафенин, флуфенамовую кислоту, флуфенизал, флуноксапрофен, флурбипрофен, флурбипрофенаксетил, фурофенак, фурпрофен, глюкаметацин, ибуфенак, ибупрофен, индобуфен, индометацин, индометацинфарнезил, индопрофен, изоксепак, изоксикам, кетопрофен, кеторолак, лобензарит, лоназолак, лорноксикам, локсопрофен, лумиракоксиб, меклофенамовую кислоту, меклофен, мефенаминовую кислоту, мелоксикам, месалазин, миропрофен, мофезолак, набуметон, напроксен, нифлумовую кислоту, олсалазин, оксапрозин, оксипинак, оксифенбутазон, парекоксиб, фенилбутазон, пелубипрофен, пимепрофен, пиразолак, пироксикам, пирпрофен, пранопрофен, прифелон, приномод, проглуметацин, проквазон, протизининзаур, рофекоксиб, ромазарит, салициламид, салициловую кислоту, сальмистеин, салнацедин, салсалат, сулиндак, судоксикам, супрофен, талнифлюмат, тенидап, теносал, теноксикам, тепоксалин, тиапрофеновую кислоту, тарамид, тилнопрофен арбамел, тимегадин, тиноридин, тиопенак, толфенамовую кислоту, толметин, уфенамат, валдекоксиб, ксимопрофен, залтопрофен, золипрофен и их комбинации.
Подходящие ингибиторы BTK включают, например, ибрутиниб, акалабрутиниб (ACP-196), эвобрутиниб; фенебрутиниб; тирабрутиниб (ONO-4059, GS-4059); занубрутиниб (BGB-3111), спебрутиниб (CC-292, AVL-292), поселтиниб (HM-71224, LY3337641), векабрутиниб (SNS-062), BMS-986142; BMS986195; PRN2246; PRN1008, M7583, CT1530, BIIBO68, AC-0058TA, ARQ-531, TAK-020, TG1701 или соединение, описанное в WO2015/079417, WO2015/083008, WO2015/110923, WO2014/173289, WO2012/021444, WO2013/081016, WO2013/067274, WO2012/170976, WO2011/162515, US2017/119766, WO2016/065226, US 9688676, WO2016/201280, WO2017/059702, US 9630968, US2014/0256734, WO2017118277, WO2014/039899, WO/16/105531, WO2018/005849, WO2013/185082 или в J. Med. Chem., 2016, 59(19), 9173-9200. Особый интерес представляют ингибиторы BTK, включающие соединение из примера 31, описанное в WO2014/039899, при этом соединение характеризуется следующей структурой:
и описано как соединение 14f в Journal of Medicinal Chemistry, 2016, 59 (19), 9173-9200; соединение из примера 2, описанное в US2017/119766, соединение из примера 223, описанное в WO2016/065226, которое представляет собой
или соединение 1, описанное в WO2016/201280, соединение 1, описанное в WO2017/059702, или соединение 1, описанное в WO2017/118277; или их фармацевтически приемлемая соль.
Также особый интерес представляют ингибиторы BTK, включающие соединение, описанное в WO2015/079417, например, соединение, выбранное из N-(3-(5-((1-акрилоилазетидин-3-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-((1-пропиолоилазетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилакриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилпропиоламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-этилакриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-(2-фторэтил)акриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-(2-(бут-2-инамидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида и N-(3-(6-амино-5-(3-(N-метилакриламидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида или их фармацевтически приемлемой соли.
ПРИМЕРЫ
ПОЯСНЕНИЕ ИЗОБРЕТЕНИЯ НА ПРИМЕРАХ
Настоящее изобретение дополнительно проиллюстрировано следующими примерами и схемами синтеза, которые не следует истолковывать как ограничивающие объем или сущности настоящего изобретения конкретными процедурами, описанными в данном документе. Следует понимать, что примеры приведены для иллюстрации определенных вариантов осуществления, и что это не накладывает каких-либо ограничений на объем настоящего изобретения. Кроме того, следует понимать, что можно прибегнуть к различным другим вариантам осуществления, модификациям и их эквивалентам, которые могут предложить специалисты в данной области, не отступая от сущности настоящего изобретения и/или объема прилагаемой формулы изобретения.
Соединения по настоящему изобретению можно получать с помощью способов, известных в области органического синтеза. Подразумевается, что во всех способах при необходимости можно использовать защитные группы для неустойчивых или реакционноспособных групп в соответствии с общими принципами химии. Работу с защитными группами проводят в соответствии со стандартными способами органического синтеза (T. W. Green и P. G. M. Wuts (2014) Protective Groups in Organic Synthesis, 5th edition, John Wiley & Sons). Эти группы удаляют на подходящей стадии синтеза соединения с использованием способов, очевидных для специалистов в данной области.
Если не указано иное, реагенты и растворители использовали в том виде, в котором их получали от частных поставщиков.
Химические названия генерировали с применением ChemBioDraw Ultra v14 от CambridgeSoft.
Значения температуры приведены в градусах Цельсия. Если не указано иное, все операции выпаривания осуществляют при пониженном давлении, как правило, от приблизительно 15 мм рт. ст. до 100 мм рт. ст. (= 20-133 мбар). Структуру конечных продуктов, промежуточных соединений и исходных материалов подтверждают посредством стандартных аналитических способов, например, микроанализа и определения спектроскопических характеристик, например, с помощью MS, IR, ЯМР. Используемые сокращения представляют собой стандартные сокращения, используемые в данной области техники.
СОКРАЩЕНИЯ
ПОДРОБНОСТИ АНАЛИЗА
• ЯМР. Измерения проводили на спектрометре Bruker UltrashieldTM 400 (400 MГц), или Bruker AscendTM (400 MГц), или Bruker cryo system (600 MГц) с использованием или без использования тетраметилсилана (TMS) в качестве внутреннего стандарта. Химические сдвиги (δ) приведены в ppm в сторону слабого поля от TMS, картина разделения спектров обозначена как синглет (s), дублет (d), триплет (t), квартет (q), квинтет (quint), септет (sept), мультиплет, неразделенные или перекрывающиеся сигналы (m), широкий сигнал (br). Дейтерированные растворители приведены в скобках и характеризуются химическими сдвигами относительно диметилсульфоксида (δ 2,50 ppm), метанола (δ 3,31 ppm), хлороформа (δ 7,26 ppm) или других растворителей, как указано в данных ЯМР-спектра.
• LC-MS. Система: Waters Acquity UPLC с детектором Waters SQ.
Колонка: Acquity HSS T3, 1,8 мкм, 2,1×50 мм, температура колонки: 60°C.
Градиент: от 5 до 98% B за 1,4 мин, A=вода+0,05% муравьиной кислоты+3,75 мM ацетата аммония, B=ацетонитрил+0,04% муравьиной кислоты, скорость потока: 1,0 мл/мин.
Результаты масс-спектрометрии приведены в виде соотношения массы и заряда.
ПРЕПАРАТИВНЫЕ СПОСОБЫ
• Система для колоночной флэш-хроматографии
Система: Teledyne ISCO, CombiFlash Rf.
Колонки: предварительно упакованные картриджи RediSep Rf.
Образцы, как правило, адсорбировали на Isolute.
• Aхиральная хроматография с обращенной фазой (RP)
Система: Аутоочистительная LC-система Gilson,
колонка Sunfire C18 5 мкм, 30×100 мм.
Выявление: Детектор Gilson UV/VIS 155
Температура колонки: к. т.
Элюент A: вода+0,1% TFA
Элюент B: ацетонитрил
Скорость потока: 30 мл/мин
Градиент
• Хиральная хроматография с нормальной фазой
Система: Аутоочистительная LC-система Gilson
Выявление: Детектор Gilson UV/VIS-155
Температура колонки: к. т.
• Aхиральная сверхкритическая флюидная хроматография (SFC)
Система: SFC-система Waters SFC-100
Выявление: PDA-детектор Waters 2998,
масс-детектор Waters 3100
Элюент A: CO2
Элюент B: описан в примерах
• Хиральная сверхкритическая флюидная хроматография (SFC)
Система: SFC-система Waters SFC-100
Выявление: PDA-детектор Waters 2998,
масс-детектор Waters 3100
Элюент A: CO2
Элюент B: описан в примерах
Все исходные материалы, структурные элементы, реагенты, кислоты, основания, дегидрирующие средства, растворители и катализаторы, используемые для синтеза соединений по настоящему изобретению, являются коммерчески доступными либо могут быть получены с помощью способов органического синтеза, известных специалисту средней квалификации в данной области.
СИНТЕЗ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
Синтез промежуточных соединений с боронатной группой
3-Хлор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)фенол и 5-хлор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3-(трифторметил)фенол, пром. соед. B001,
 и
и 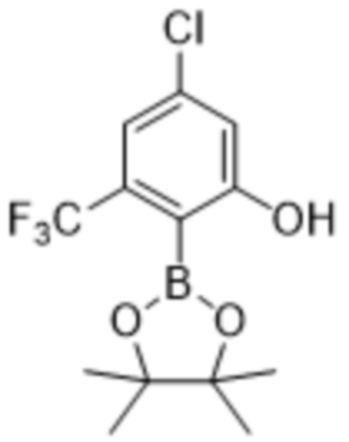 .
.
(1) 3-Хлор-2-йод-5-(трифторметил)фенол и 5-хлор-2-йод-3-(трифторметил)фенол, пром. соед. B002,
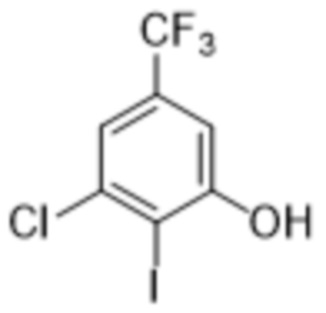 и
и 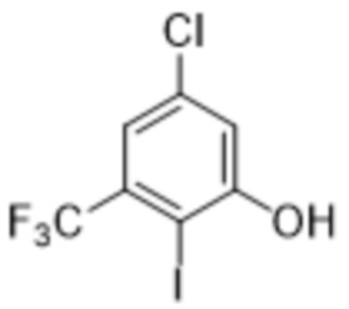 .
.
Смесь 3-хлор-5-(трифторметил)фенола (10 г, 50,9 ммоль) и гидрида натрия (2,44 г, 102 ммоль) в 150 мл толуола перемешивали при 0°C в течение 30 мин. Затем добавляли йод (12,9 г, 50,9 ммоль) и раствор перемешивали при 0°C в течение 3 ч. Затем реакционную смесь подкисляли с помощью концентрированного HCl с получением конечного pH 4-5. Ее экстрагировали с помощью EtOAc и органический слой промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенную смесь региоизомеров применяли как таковую на следующей стадии. LC-MS: Rt=1,10 и 1,12 мин; MS масса/заряд 320,9 [M-H]-.
(2) 5-Хлор-1-(этоксиметокси)-2-йод-3-(трифторметил)бензол и 1-хлор-3-(этоксиметокси)-2-йод-5-(трифторметил)бензол, пром. соед. B003,
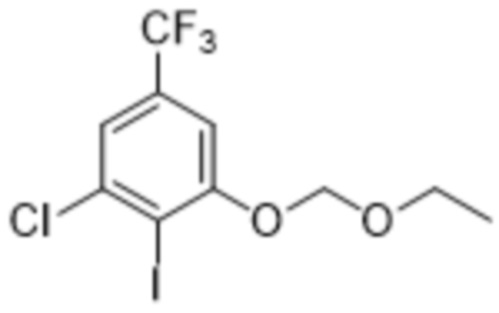 и
и 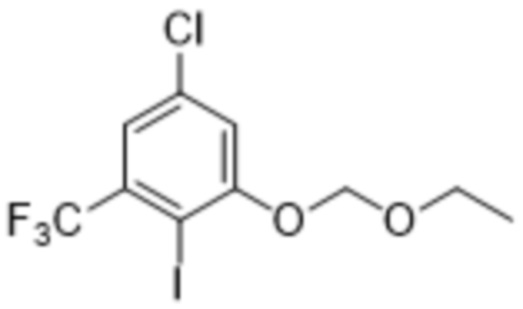 .
.
(Хлорметокси)этан (7,25 мл, 62,5 ммоль) добавляли в суспензию пром. соед. B002 (16 г, 49,6 ммоль) и Cs2CO3 (16,2 г, 49,6 ммоль) в 70 мл DMF. Реакционную смесь перемешивали при к. т. в течение 18 ч. Добавляли дополнительное количество (хлорметокси)этана (2,88 мл, 24,8 ммоль) и продолжали перемешивание в течение 24 ч. Суспензию фильтровали через целит и фильтрат выпаривали с получением указанного в заголовке соединения в виде смеси региоизомеров, которую применяли без дополнительной очистки на следующей стадии. LC-MS: Rt=1,37 и 1,38 мин.
(3) 2-(2-Хлор-6-(этоксиметокси)-4-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан и 2-(4-хлор-2-(этоксиметокси)-6-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан, пром. соед. B004,
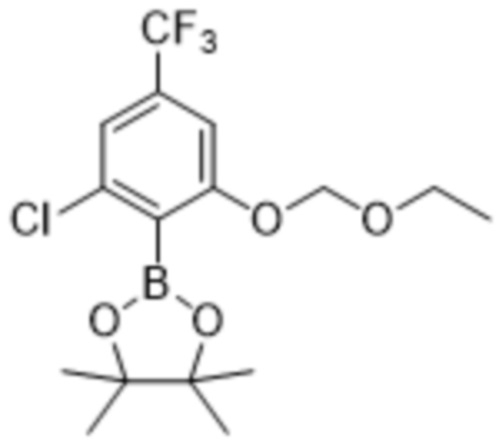 и
и 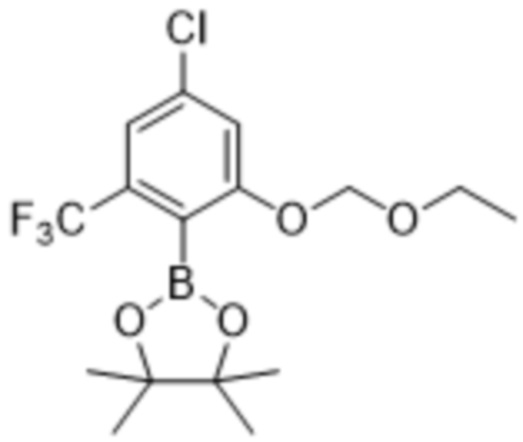 .
.
Раствор пром. соед. B003 (11,9 г, 31,3 ммоль), 4,4,5,5-тетраметил-[1,3,2]диоксаборолана (9,08 мл, 62,5 ммоль) и NEt3 (13,08 мл, 94 ммоль) в 60 мл 1,4-диоксана продували азотом. Добавляли Pd(OAc)2 (0,35 г, 1,56 ммоль) и бифенил-2-ил-дициклогексилфосфан (1,1 г, 3,13 ммоль) и полученную смесь перемешивали при 80°C в течение 3 ч. Добавляли дополнительное количество Pd(OAc)2 (0,35 г, 1,56 ммоль) и нагревание продолжали в течение 13 ч. Реакционную смесь охлаждали до к. т., промывали насыщенным раствором NH4Cl, водой и солевым раствором с получением оранжевого масла. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле с применением циклогексана и EtOAc (от 0% до 100%) с получением указанного в заголовке соединения в виде смеси региоизомеров. LC-MS: Rt=1,43 мин.
(4) 3-Хлор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)фенол и 5-хлор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3-(трифторметил)фенол, пром. соед. B001
Раствор пром. соед. B004 (8,5 г, 22,34 ммоль) и TFA (25,8 мл, 670,2 ммоль) в 25 мл CH2Cl2 продували азотом и перемешивали при 0°C в течение 1 ч. Смесь промывали насыщенным раствором NH4Cl, водой и солевым раствором. Органический слой высушивали над Na2SO4, фильтровали и выпаривали с получением оранжевого масла. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле с применением циклогексана и EtOAc (от 0% до 5%) с получением указанного в заголовке соединения в виде смеси региоизомеров. LC-MS: Rt=1,23 мин и 1,28 мин; MS масса/заряд 321,1 [M-H]-.
(2-Гидрокси-6-метил-4-(трифторметил)фенил)бороновая кислота, пром. соед. B005
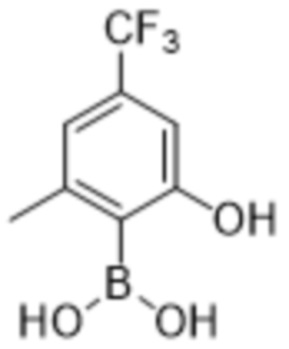
(1) 3-Метил-5-(трифторметил)фенол, пром. соед. B006
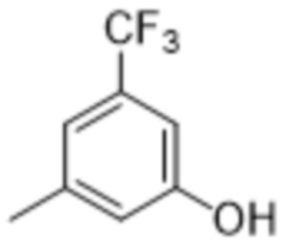
LiOH (26,5 г, 630,33 ммоль), Pd2(dba)3 (3,85 г, 4,20 ммоль) и BippyPhos (4,25 г, 8,40 ммоль) добавляли в раствор 1-бром-3-метил-5-(трифторметил)бензола (50 г, 210,11 ммоль) в 500 мл 1,4-диоксана и 50 мл H2O. Реакционную смесь продували азотом и нагревали при 100°C в течение 16 ч. Реакционную смесь охлаждали до к. т., фильтровали через слой Celite® и промывали с помощью EtOAc. Фильтрат промывали с помощью 1,5 M HCl, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенный материал очищали с помощью колоночной хроматографии на силикагеле с применением петролейного эфира и EtOAc (от 0% до 15%) с получением указанного в заголовке соединения в виде желтого масла. 1H ЯМР (400 МГц, CDCl3) δ (ppm) 7,01 (s, 1H), 6,88 (s, 1H), 6,82 (s, 1H), 5,11 (br s, 1H), 2,36 (s, 3H). LC-MS: Rt=0,95 мин; MS масса/заряд 175,0 [M-H]-.
(2) 2-Йод-3-метил-5-(трифторметил)фенол, пром. соед. B007
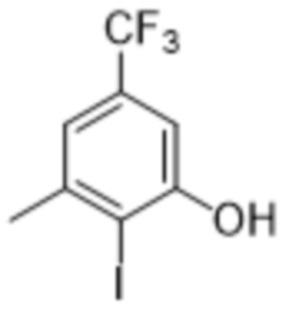
В ледяной раствор пром. соед. B006 (13,03 г, 74 ммоль) в 370 мл толуола добавляли NaH (60% дисперсия в минеральном масле, 5,92 г, 148 ммоль). Суспензию перемешивали при 0°C в течение 30 минут, затем медленно частями добавляли йод (18,77 г, 74 ммоль) и продолжали перемешивание в течение 3 ч. Смесь разбавляли водой, подкисляли с помощью 2 M HCl до pH=5 и экстрагировали с помощью EtOAc. Органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (220 г) с применением циклогексана и EtOAc (от 5% до 100%) с получением указанного в заголовке соединения в виде желтого масла. 1H ЯМР (400 МГц, CDCl3) δ (ppm) 7,08-7,04 (m, 2H), 5,74 (s, 1H), 2,50 (s, 3H). LC-MS: Rt=1,11 мин; MS масса/заряд 301,0 [M-H]-.
(3) 2-Йод-1-метокси-3-метил-5-(трифторметил)бензол, пром. соед. B008
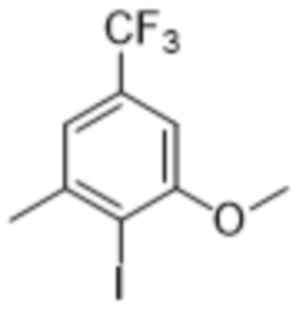
Смесь K2CO3 (24 г, 172,22 ммоль), метилиодида (8,1 мл, 129,13 ммоль) и пром. соед. B007 (26 г, 86,09 ммоль) в 300 мл безводного ацетона перемешивали при к. т. в течение 5 ч. Затем ее фильтровали и фильтрат выпаривали. Остаток растворяли в CH2Cl2, промывали водой, высушивали над Na2SO4, фильтровали и выпаривали с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ (ppm) 7,15 (s, 1H), 6,84 (s, 1H), 3,93 (s, 3H), 2,54 (s, 3H).
(4) 2-(2-Метокси-6-метил-4-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан, пром. соед. B009
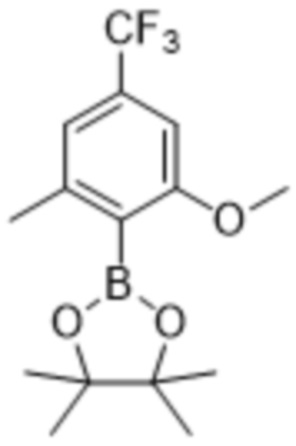
Пинаколборан (50,5 мл, 348,03 ммоль), бифенил-2-ил-дициклогексилфосфан (2,44 г, 6,96 ммоль), Pd(OAc)2 (1,55 г, 6,96 ммоль) и NEt3 (48,5 мл, 348,03 ммоль) добавляли в раствор пром. соед. B008 (22 г, 69,61 ммоль) в 300 мл безводного 1,4-диоксана (300 мл). Реакционную смесь продували азотом и нагревали до 100°C в течение 16 ч. После охлаждения до к. т. ее фильтровали через слой Celite® и промывали с помощью EtOAc. Фильтрат выпаривали и остаток очищали с помощью колоночной хроматографии на силикагеле с применением петролейного эфира и EtOAc (от 0% до 10%) с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР (400МГц, CDCl3) δ (ppm) 7,02 (s, 1H), 6,85 (s, 1H), 3,84 (s, 3H), 2,40 (s, 3H), 1,40 (s, 9H).
(5) (2-Гидрокси-6-метил-4-(трифторметил)фенил)бороновая кислота, пром. соед. B005
BBr3 (1 M в CH2Cl2, 95 мл, 94,86 ммоль) добавляли в раствор пром. соед. B009 (12 г, 37,95 ммоль) в 150 мл безводного CH2Cl2 при 0°C. Реакционную смесь перемешивали при 0°C в течение 30 мин, после чего ее осторожно выливали в ~250 мл 10% раствора NaOH так, что значение pH поддерживалось при ~9. Полученную смесь промывали с помощью CH2Cl2. Водный слой отделяли и регулировали pH до 5 с помощью 1,5 M HCl. Осажденное твердое вещество, которое отфильтровывали, промывали петролейным эфиром и высушивали под вакуумом с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ (ppm) 6,94 (s, 1H), 6,82 (s, 1H), 2,29 (s, 3H). MS (ESI): масса/заряд 219,8 [M-H]-
3-Метил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)фенол, пром. соед. B010
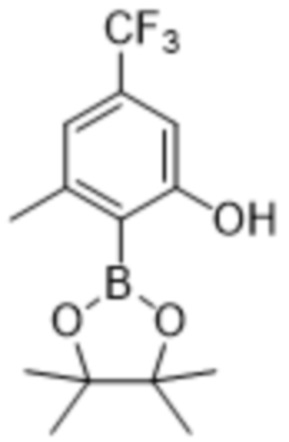
(1) 1-(Этоксиметокси)-2-йод-3-метил-5-(трифторметил)бензол, пром. соед. B011
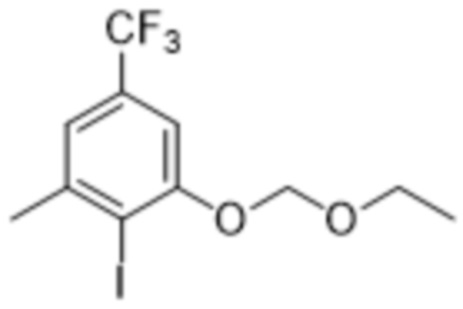
(Хлорметокси)этан (3,35 г, 35,50 ммоль) по каплям добавляли в белую суспензию пром. соед. B007 (8,50 г, 28,10 ммоль) и Cs2CO3 (9,17 г, 28,10 ммоль) в 30 мл сухого DMF. Реакционную смесь перемешивали при к. т. в течение 2 ч., затем ее выпаривали до сухого состояния. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле с применением циклогексана и EtOAc (от 0% до 5%) с получением указанного в заголовке соединения. LC-MS: Rt=1,39 мин.
(2) 2-(2-(Этоксиметокси)-6-метил-4-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан, пром. соед. B012
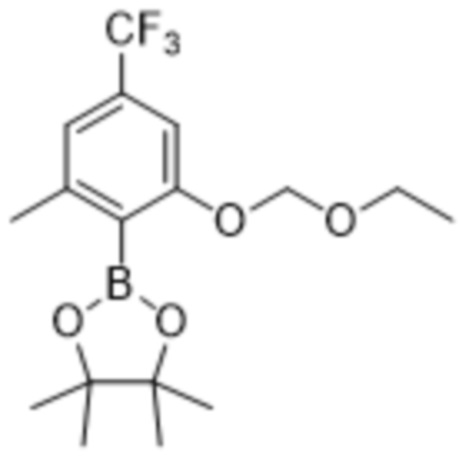
Раствор пром. соед. B011 (10 г, 27,80 ммоль), 4,4,5,5-тетраметил-[1,3,2]диоксаборолана (20,15 мл, 139 ммоль) и NEt3 (28,6 мл, 205 ммоль) в 60 мл 1,4-диоксана продували азотом. Добавляли Pd(OAc)2 (0,81 г, 3,61 ммоль) и бифенил-2-ил-дициклогексилфосфан (2,33 г, 6,66 ммоль) и смесь перемешивали при 80°C в течение 18 ч. Затем ее охлаждали до к. т., разбавляли с помощью EtOAc и промывали насыщенным NH4Cl, водой и солевым раствором. Органический слой высушивали над Na2SO4, фильтровали и выпаривали. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле с применением циклогексана и CH2Cl2 (от 0% до 20%) с получением указанного в заголовке соединения. LC-MS: Rt=1,40 мин.
(3) 3-Метил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)фенол, пром. соед. B010
TFA (44,9 мл, 583 ммоль) медленно добавляли в раствор пром. соед. B012 (7,00 г, 19,43 ммоль) в 250 мл CH2Cl2 при 0°C. Реакционную смесь перемешивали при 0°C в течение 20 мин и затем выпаривали. Полученное масло очищали с помощью колоночной хроматографии на силикагеле с применением циклогексана и CH2Cl2 (от 0% до 100%) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 9,80 (s, 1H), 6,92 (s, 1H), 6,82 (s, 1H), 2,30 (s, 3H), 1,30 (s, 12H). LC-MS : Rt= 1,38 мин; MS масса/заряд 301,1 [M-H]-
3,5-Диметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол, пром. соед. B013
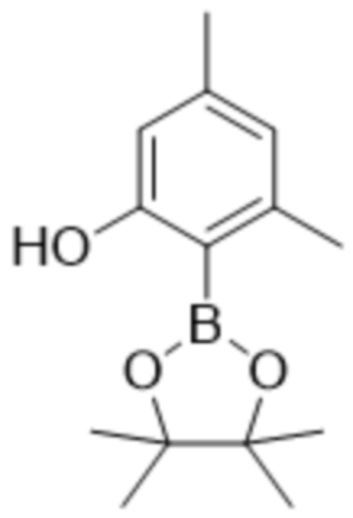
(1) 2-Йод-3,5-диметилфенол, пром. соед. B014
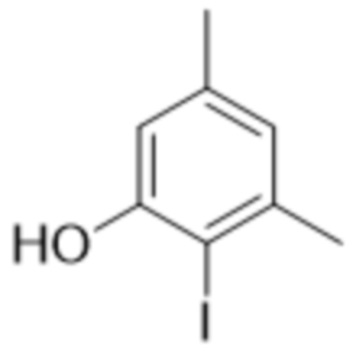
3,5-Диметилфенол (1 г, 8,2 ммоль) растворяли в 40 мл толуола и охлаждали до 0°C. Частями добавляли NaH (60% дисперсия в минеральном масле, 655 мг, 16,4 ммоль) и смесь перемешивали при 0°C в течение 20 мин, затем при к. т. в течение 10 мин и наконец снова охлаждали до 0°C. Затем частями добавляли йод (2,08 г, 8,2 ммоль) и перемешивание продолжали в течение 30 мин. Реакционную смесь гасили путем добавления 0,5 M HCl и экстрагировали с помощью EtOAc. Объединенные органические экстракты промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (100 г) с применением н-гептана и EtOAc (от 0% до 20%) с последующим вторым (изократическим) циклом с применением н-гептана и EtOAc (5%) с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,07 (s, 1H), 6,60 (s, 1H), 6,51 (s, 1H), 2,30 (s, 3H), 2,15 (s, 3H). LC-MS: Rt=1,03 мин; MS масса/заряд 246,9 [M-H]-
(2) 1-(Этоксиметокси)-2-йод-3,5-диметилбензол, пром. соед. B015
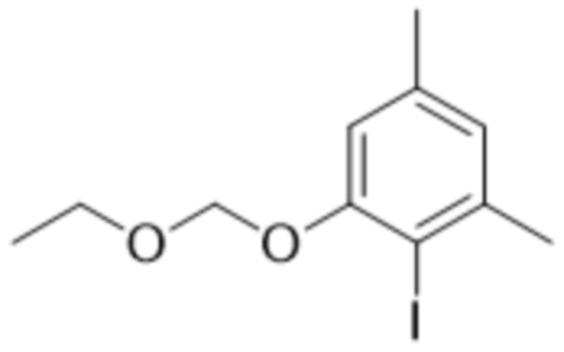
В раствор пром. соед. B014 (660 мг, 2,66 ммоль) в 6 мл DMF добавляли Cs2CO3 (867 мг, 2,66 ммоль), затем (хлорметокси)этан (311 мкл, 3,35 ммоль). Реакционную смесь перемешивали при к. т. в течение ночи, затем гасили путем добавления воды и экстрагировали с помощью EtOAc. Объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (50 г) с применением н-гептана и EtOAc (от 0% до 10%) с получением указанного в заголовке соединения в виде желтого масла. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 6,82 (s, 1H), 6,74 (s, 1H), 5,27 (s, 2H), 3,69 (q, 2H), 2,35 (s, 3H), 2,23 (s, 3H), 1,13 (t, 3H). LC-MS: Rt=1,36 мин; MS масса/заряд 307,2 [M+H]+
(3) 2-(2-(Этоксиметокси)-4,6-диметилфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан, пром. соед. B016
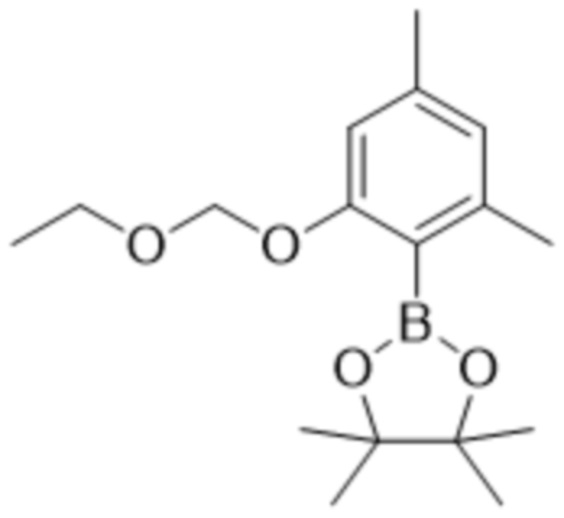
В раствор пром. соед. B015 (393 мг, 1,28 ммоль) в 2,5 мл 1,4-диоксана добавляли 4,4,5,5-тетраметил-1,3,2-диоксаборолан (373 мкл, 2,57 ммоль) и NEt3 (537 мкл, 3,85 ммоль) и флакон продували азотом. Добавляли Pd(OAc)2 (14,4 мг, 64 мкмоль) и бифенил-2-ил-дициклогексилфосфан (45 мг, 0,128 ммоль), флакон герметично закрывали и нагревали при 80°C в течение ночи. Реакционную смесь охлаждали до к. т., гасили путем добавления воды и экстрагировали с помощью EtOAc. Объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (50 г) с применением н-гептана и EtOAc (от 0% до 20%) с получением указанного в заголовке соединения в виде бесцветного масла. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 6,63 (s, 1H), 6,60 (s, 1H), 5,13 (s, 2H), 3,64 (q, 2H), 2,23 (s, 3H), 2,20 (s, 3H), 1,29 (s, 12H), 1,12 (t, 3H). LC-MS: Rt=1,36 мин; MS масса/заряд 307,2 [M+H]+
(4) 3,5-Диметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол, пром. соед. B013
Раствор пром. соед. B016 (486 мг, 1,59 ммоль) в 25 мл CH2Cl2 охлаждали до -30°C и медленно добавляли TFA (611 мкл, 7,94 ммоль). Через 1 ч. реакционную смесь гасили при -30°C путем добавления воды. Смесь нейтрализовали путем добавления 1 M раствора NaHCO3 и дважды экстрагировали с помощью CH2Cl2. Объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали с получением указанного в заголовке соединения в виде желтого масла, которое применяли без дополнительной очистки. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 8,72 (s, 1H), 6,43 (s, 1H), 6,38 (s, 1H), 2,24 (s, 3H), 2,16 (s, 3H), 1,30 (s, 12H). LC-MS: Rt=1,37 мин; MS масса/заряд 249,2 [M+H]+
(2-Метокси-4,6-диметилфенил)бороновая кислота, пром. соед. B017
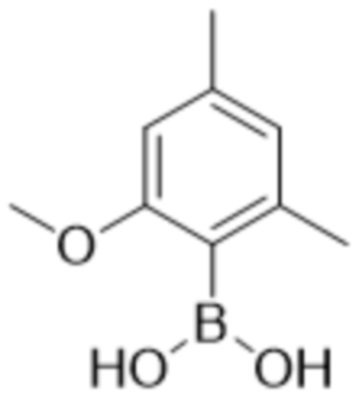
1-Метокси-3,5-диметилбензол (1,04 мл, 7,34 ммоль) и TMEDA (2,44 мл, 16,15 ммоль) растворяли в 16 мл Et2O и охлаждали до 0-5°C в атмосфере азота. По каплям добавляли n-BuLi (1,6 M в гексане, 10,1 мл, 16,15 ммоль) в бесцветный раствор с поддерживанием температуры ниже 10°C. Полученную желтую суспензию перемешивали при к. т. в течение 1 ч., затем ее охлаждали до -78°C. В течение периода времени, составляющего приблизительно 4 мин, добавляли B(OMe)3 (1,15 мл, 10,28 ммоль) с поддерживанием температуры ниже -70°C. Продолжали перемешивание при -78°C в течение 20 мин, затем обеспечивали нагревание реакционной смеси до к. т. в течение ночи. Ее гасили путем добавления воды и подкисляли с помощью 4 M HCl до pH 1. Смесь 3 раза экстрагировали с помощью CH2Cl2 и объединенные органические экстракты выпаривали. Остаток растворяли в MeOH и дважды промывали н-гептаном. Нижний слой MeOH выпаривали с получением указанного в заголовке соединения в виде желтого полутвердого вещества. LC-MS: Rt=0,74 мин; MS масса/заряд 180,9 [M+H]+
(2,4-Дихлор-6-гидроксифенил)бороновая кислота и 3,5-дихлор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол, пром. соед. B018,
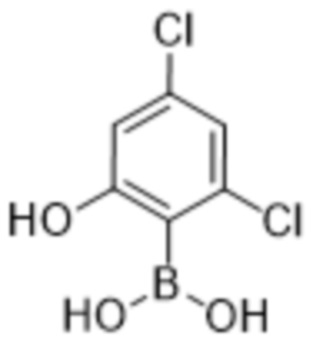 и
и 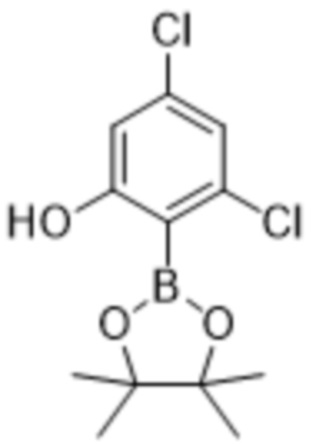 .
.
(1) 3,5-Дихлор-2-йодфенол, пром. соед. B019
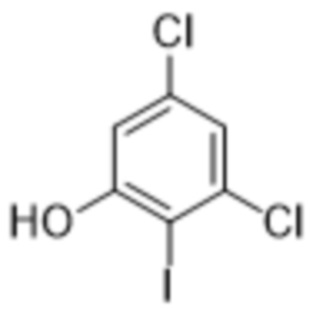
Частями добавляли NaH (60% дисперсия в минеральном масле, 1,472 г, 36,8 ммоль) в раствор 3,5-дихлорфенола (2,00 г, 12,27 ммоль) в 30 мл сухого толуола при 0°C в атмосфере азота. Обеспечивали нагревание полученной смеси до к. т. и перемешивали в течение 30 мин. Затем суспензию охлаждали до 0°C и очень медленно добавляли йод (2,49 г, 9,82 ммоль). Реакционную смесь перемешивали в течение 1,5 ч. при 0°C, затем гасили путем добавления 1 M HCl и экстрагировали с помощью CH2Cl2. Органический экстракт промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (50 г) с применением н-гептана и EtOAc (от 0% до 50%) с получением указанного в заголовке соединения в виде желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 11,32 (s, 1H), 7,14 (d, 1H), 6,81 (d, 1H). LC-MS: Rt=1,09 мин; MS масса/заряд 287,0 [M-H]-
(2) 1,5-Дихлор-3-(этоксиметокси)-2-йодбензол, пром. соед. B020
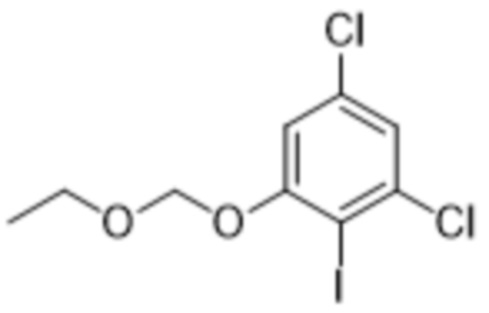
Суспензию (хлорметокси)этана (1,004 г, 10,62 ммоль), пром. соед. B019 (2,8 г, 8,43 ммоль) и Cs2CO3 (2,75 г, 8,43 ммоль) в 25 мл DMF перемешивали при к. т. в течение 22 ч. Реакционную смесь гасили путем добавления воды и слои разделяли. Водный слой экстрагировали с помощью CH2Cl2 и объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (100 г) с применением н-гептана и EtOAc (от 0% до 25%) с получением указанного в заголовке соединения в виде коричневого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,39 (d, 1H), 7,13 (d, 1H), 5,39 (s, 2H), 3,69 (q, 2H), 1,14 (t, 3H).
(3) 2-(2,4-Дихлор-6-(этоксиметокси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан, пром. соед. B021
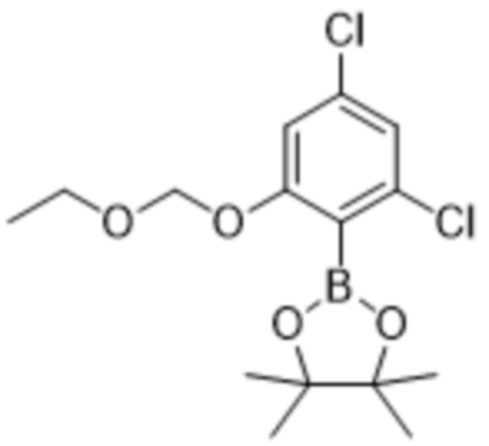
Раствор пром. соед. B020 (2,7 г, 7,78 ммоль), 4,4,5,5-тетраметил-[1,3,2]диоксаборолана (1 M в THF, 15,56 мл, 15,56 ммоль) и NEt3 (3,25 мл, 23,34 ммоль) в 15 мл 1,4-диоксана продували азотом в течение 30 мин. Затем добавляли Pd(OAc)2 (87 мг, 0,389 ммоль) и бифенил-2-ил-дициклогексилфосфан (273 мг, 0,778 ммоль) и смесь перемешивали при 80°C в течение 20 ч. Реакционную смесь гасили путем добавления насыщенного NH4Cl и слои разделяли. Органический слой промывали водой и солевым раствором, затем выпаривали с получением оранжевого масла. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (100 г) с применением н-гептана и EtOAc (от 0% до 20%) с последующим вторым циклом хроматографии на силикагеле (50 г) с применением н-гептана и EtOAc (от 0% до 5%) с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,17 (d, 1H), 7,11 (d, 1H), 5,26 (s, 2H), 3,64 (q, 2H), 1,31 (s, 12H), 1,12 (t, 3H).
(4) (2,4-Дихлор-6-гидроксифенил)бороновая кислота и 3,5-дихлор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол, пром. соед. B018
Раствор пром. соед. B021 (880 мг, 2,54 ммоль) в 10 мл CH2Cl2 охлаждали до 0°C. Добавляли TFA (3,91 мл, 50,7 ммоль) и реакционную смесь перемешивали при 0°C в течение 1 ч. Смесь гасили путем добавления насыщенного NH4Cl. Слои разделяли и органический экстракт промывали водой и солевым раствором. Растворитель выпаривали с получением указанных в заголовке соединений в виде смеси, которую применяли без очистки. LC-MS: Rt=0,76 мин и 1,32 мин; MS масса/заряд 205,0 [M-H]- и 289,0 [M+H]+
3-Хлор-5-фтор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол и 5-хлор-3-фтор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол, пром. соед. B022,
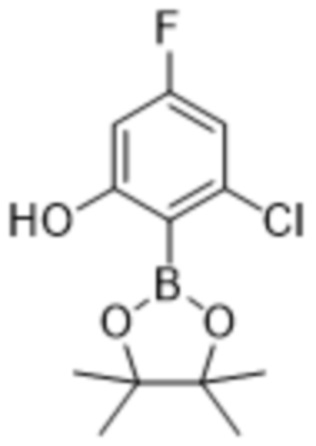 и
и 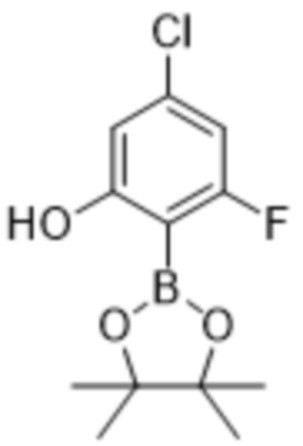 .
.
Смесь региоизомеров синтезировали аналогично пром. соед. B018, как описано выше, начиная с 3-хлор-5-фторфенола. LC-MS: Rt=1,25 мин.
(2-Гидрокси-4,6-бис(трифторметил)фенил)бороновая кислота, пром. соед. B023
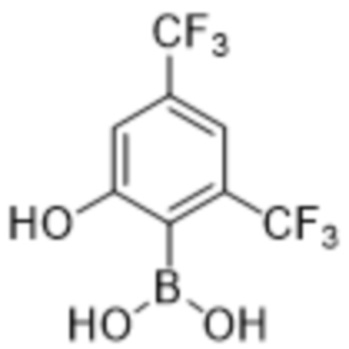
В раствор (2-метокси-4,6-бис(трифторметил)фенил)бороновой кислоты (500 мг, 1,736 ммоль) в 10 мл CH2Cl2 по каплям добавляли BBr3 (1 M в CH2Cl2, 8,68 мл, 8,68 ммоль) при 0°C в атмосфере азота. Обеспечивали нагревание полученного бледно-оранжевого раствора до к. т. и осуществляли его перемешивание в течение 17 ч. Реакционную смесь выливали в ледяную воду (~30 мл) и pH регулировали до 10 путем добавления 2 M NaOH. Водный слой отделяли, подкисляли до pH 1 путем добавления 2 M HCl и экстрагировали с помощью CH2Cl2, затем EtOAc. Объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (25 г) с применением CH2Cl2 и MeOH (от 0% до 5%) с получением указанного в заголовке соединения в виде бежевого твердого вещества. LC-MS: Rt=0,81 мин; MS масса/заряд 273,1 [M-H]-
Синтез 6-галоген-пиридазин-3-аминовых промежуточных соединений
(R)-6-Хлор-N-(1-этилпиперидин-3-ил)пиридазин-3-амин, пром. соед. P024
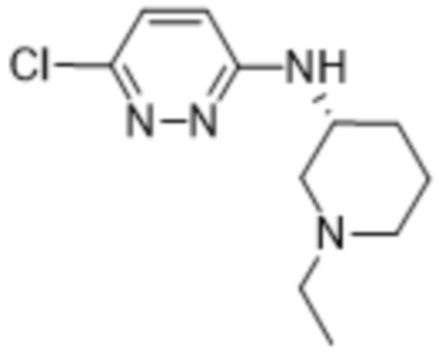
В раствор 3,6-дихлорпиридазина (3 г, 20,13 ммоль) и (R)-1-этилпиперидин-3-амина (5,24 г, 22,15 ммоль) в 80 мл NMP добавляли DIPEA (17,59 мл, 101 ммоль) и реакционную смесь перемешивали при 150°C в течение 48 ч. Затем ее охлаждали до к. т., выливали в воду и дважды экстрагировали с помощью EtOAc. Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле с применением CH2Cl2 и MeOH (от 0% до 10%) с получением указанного в заголовке соединения. LC-MS: Rt=0,42 мин; MS масса/заряд 241,2 [M+H]+
(R)-6-Хлор-N-(1-метилпиперидин-3-ил)пиридазин-3-амин, пром. соед. P025
Смесь 3,6-дихлорпиридазина (500 мг, 3,26 ммоль), (R)-1-метилпиперидин-3-амина (379 мг, 3,32 ммоль) и DIPEA (505 мг, 3,91 ммоль) в 4 мл NMP нагревали при 150°C в течение 4 ч. Реакционную смесь охлаждали до к. т. и выпаривали до сухого состояния. Остаток растворяли в EtOAc и промывали насыщенным раствором Na2CO3. Водный слой экстрагировали еще 3 раза с помощью EtOAc. Объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали с получением темно-оранжевого масла, которое очищали с помощью колоночной хроматографии на силикагеле (50 г) с применением CH2Cl2 и MeOH, содержащего 5% NH4OH (от 0% до 10%), с получением указанного в заголовке соединения. 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 7,34 (d, 1H), 7,00 (d, 1H), 6,92 (d, 1H), 4,03-3,93 (m, 1H), 2,90-2,70 (m, 1H), 2,58-2,51 (m, 1H) перекрывание с сигналом DMSO, 2,19 (s, 3H), 2,12-1,87 (m, 2H), 1,84-1,75 (m, 1H), 1,74-1,64 (m, 1H), 1,57-1,47 (m, 1H), 1,37-1,23 (m, 1H). LC-MS: Rt= 0,34 мин; MS масса/заряд 227,2 [M+H]+
(R)-6-Хлор-N-(1-метилпиперидин-3-ил)-4-(трифторметил)пиридазин-3-амин, пром. соед. P026 и (R)-6-хлор-N-(1-метилпиперидин-3-ил)-5-(трифторметил)пиридазин-3-амин, пром. соед. P027,
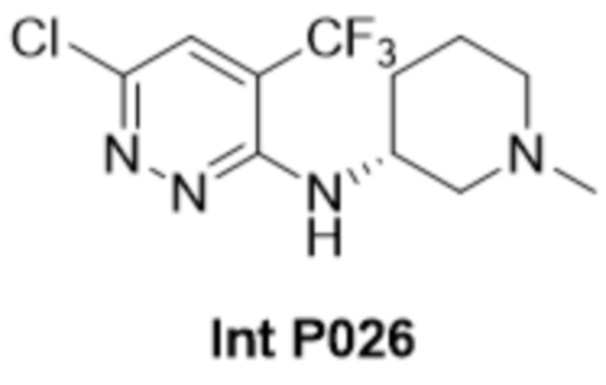 и
и 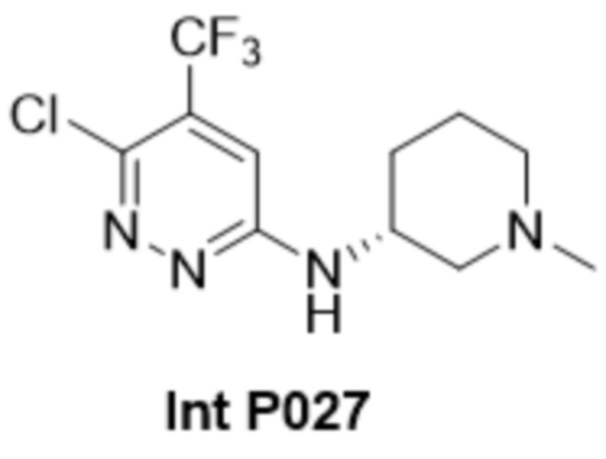 .
.
Раствор 3,6-дихлор-4-(трифторметил)пиридазина (3,4 г, 15,67 ммоль), (R)-1-метилпиперидин-3-амина (2,468 мл, 18,80 ммоль) и DIPEA (8,21 мл, 47,0 ммоль) в 5 мл 1-бутанола нагревали при 110°C в течение 20 ч. Реакционную смесь выпаривали, и неочищенное вещество очищали и отделяли с помощью колоночной хроматографии на силикагеле (220 г) с применением CH2Cl2 и MeOH (от 0% до 10%). Фракции, содержащие пром. соед. P026 (первое элюирование) или пром. соед. P027 (второе элюирование), объединяли по отдельности и выпаривали. Оба продукта затем по отдельности разделяли между CH2Cl2 и 1 M NaOH. Органические экстракты высушивали над Na2SO4, фильтровали и выпаривали с получением указанных в заголовке соединений, представляющих собой пром. соед. P026 в виде коричневого масла и пром. соед. P027 в виде бледно-желтого твердого вещества соответственно.
Пром. соед. P026 (первое элюирование): 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,91 (s, 1H), 6,22 (d, 1H), 4,44-4,27 (m, 1H), 2,69-2,55 (m, 1H), 2,42-2,28 (m, 1H), 2,18 (s, 3H, перекрывание с m, 2H), 1,71-1,58 (m, 3H), 1,56-1,43 (m, 1H). LC-MS: Rt=0,52 мин; MS масса/заряд 295,1 [M+H]+
Пром. соед. P027 (второе элюирование): 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,50 (d, 1H), 7,39 (s, 1H), 4,12-4,02 (m, 1H), 2,79-2,64 (m, 1H), 2,46-2,37 (m, 1H), 2,17 (s, 3H, перекрывание с m, 1H), 2,08-1,98 (m, 1H), 1,81-1,63 (m, 2H), 1,58-1,46 (m, 1H), 1,43-1,30 (m, 1H). LC-MS: Rt=0,59 мин; MS масса/заряд 295,1 [M+H]+
цис-3-((6-Хлор-4-(трифторметил)пиридазин-3-ил)амино)-1-метилциклобутан-1-ол, пром. соед. P028, и цис-3-((6-хлор-5-(трифторметил)пиридазин-3-ил)амино)-1-метилциклобутан-1-ол, пром. соед. P029,
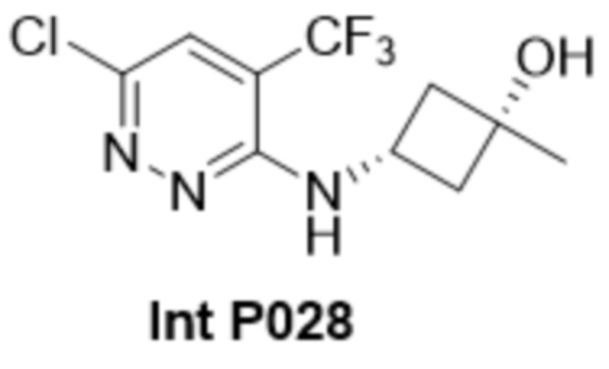 и
и 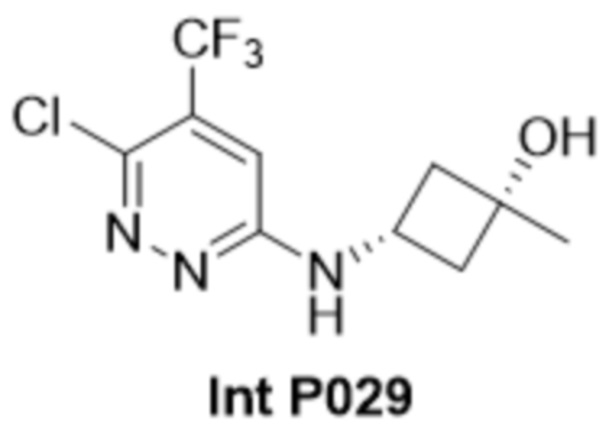 .
.
Раствор 3,6-дихлор-4-(трифторметил)пиридазина (1 г, 4,61 ммоль), гидрохлорида цис-3-амино-1-метилциклобутан-1-ола (0,698 г, 5,07 ммоль) и DIPEA (2,415 мл, 13,83 ммоль) в 5 мл 1-бутанола нагревали при 180°C в течение 1 ч. в микроволновом аппарате. Реакционную смесь разделяли между EtOAc и 10% раствором NaHCO3. Органический экстракт промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали и отделяли с помощью колоночной хроматографии на силикагеле (40 г) с применением CH2Cl2 и MeOH (от 0% до 10%). Фракции, содержащие продукт, объединяли по отдельности и выпаривали с получением указанных в заголовке соединений, представляющих собой пром. соед. P028 (первое элюирование) в виде коричневатого масла и пром. соед. P029 (второе элюирование) в виде бледно-желтого твердого вещества соответственно.
Пром. соед. P028 (первое элюирование): 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,87 (s, 1H), 6,91 (d, 1H), 4,94 (s, 1H), 4,19-4,01 (m, 1H), 2,44-2,35 (m, 2H), 2,19-2,10 (m, 2H), 1,27 (s, 3H). LC-MS: Rt=0,82 мин; MS масса/заряд 282,1 [M+H]+
Пром. соед. P029 (второе элюирование): 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,83 (d, 1H), 7,24 (s, 1H), 5,06 (s, 1H), 4,02-3,87 (m, 1H), 2,46-2,37 (m, 2H), 1,99-1,88 (m, 2H), 1,27 (s, 3H). LC-MS: Rt=0,82 мин; MS масса/заряд 282,1 [M+H]+
(R)-6-Хлор-4-метил-N-(1-метилпиперидин-3-ил)пиридазин-3-амин, пром. соед. P030, и (R)-6-хлор-5-метил-N-(1-метилпиперидин-3-ил)пиридазин-3-амин, пром. соед. P031,
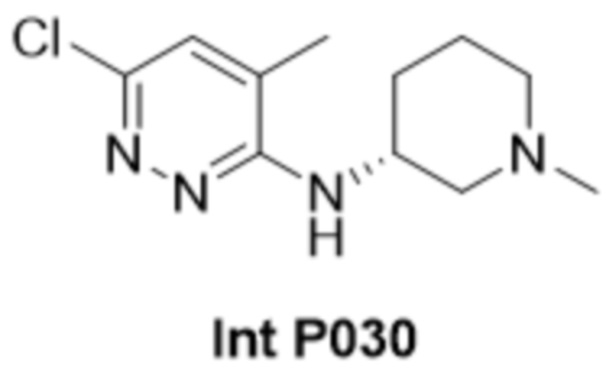 и
и 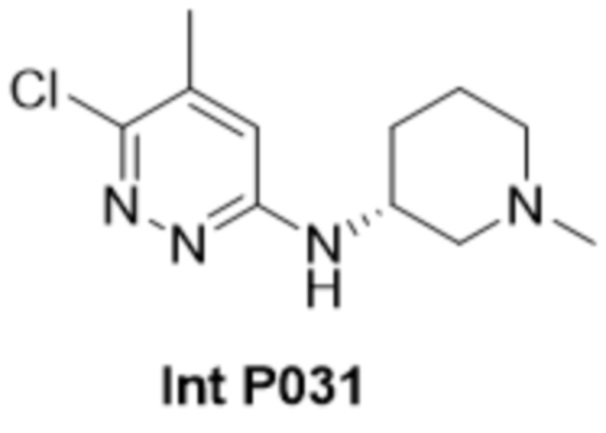 .
.
Раствор 3,6-дихлор-4-метилпиридазина (1,02 г, 6,26 ммоль), (R)-1-метилпиперидин-3-амина (0,986 мл, 7,51 ммоль) и DIPEA (3,28 мл, 18,77 ммоль) в 5 мл NMP нагревали при 180°C в течение 2 ч. в условиях микроволнового облучения. Реакционную смесь по большей части выпаривали и остаток разделяли между CH2Cl2 и 1 M NaOH. Органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (40 г) с применением CH2Cl2 и MeOH (от 0% до 20%) с получением указанных в заголовке соединений в виде смеси региоизомеров ~1:3. Данную смесь дополнительно очищали и разделяли с помощью хиральной SFC (колонка: ChiralPak AY, 250 × 30 мм, 5 мкм; при 38°C, элюент B: 35% EtOH+0,1% NH4OH, скорость потока: 50 мл/мин, давление: 100 бар, время цикла: 8 мин) с получением указанных в заголовке соединений, представляющих собой пром. соед. P030 (первое элюирование) в виде оранжевого масла и пром. соед. P031 (второе элюирование) в виде коричневого твердого вещества соответственно.
Пром. соед. P030 (первое элюирование): 1H-ЯМР (400 МГц, CDCl3) δ (ppm) 6,99 (s, 1H), 4,97 (br s, 1H), 4,50-4,42 (m, 1H), 2,69-2,38 (m, 3H), 2,25 (s, 3H), 2,18-2,25 (m, 1H) перекрывание с 2.13 (s, 3H), 1,89-1,77 (m, 1H), 1,74-1,67 (m, 1H), 1,61-1,51 (m, 2H). LC-MS: Rt=0,40 мин; MS масса/заряд 241,1 [M+H]+
Пром. соед. P031 (второе элюирование): 1H ЯМР (400 МГц, CDCl3) δ (ppm) 6,52 (s, 1H), 5,13 (br s, 1H), 4,08-3,97 (m, 1H), 2,65-2,33 (m, 3H), 2,32-2,24 (m, 1H) перекрывание с 2.26 (s, 3H) и 2,25 (s, 3H), 1,75-1,69 (m, 1H), 1,69-1,52 (m, 3H). LC-MS: Rt=0,43 мин; MS масса/заряд 241,1 [M+H]+
В качестве альтернативы замещенное пиридазиновое промежуточное соединение, представляющее собой пром. соед. P030, получали с применением региоселективного пути, описанного ниже.
(R)-6-Хлор-4-метил-N-(1-метилпиперидин-3-ил)пиридазин-3-амин, пром. соед. P030
(1) 6-Хлор-2-(4-метоксибензил)-5-метилпиридазин-3(2H)-он, пром. соед. P032
6-Хлор-4-метилпиридазин-3(2H)-он (25 г, 173 ммоль), 1-(бромметил)-4-метоксибензол (36,5 г, 182 ммоль), K2CO3 (47,8 г, 346 ммоль) и Bu4NBr (2,79 г, 8,65 ммоль) растворяли в 300 мл ацетонитрила. Смесь нагревали до 90°C и перемешивали в течение 2,25 ч. Смесь охлаждали до к. т. и фильтровали через слой Celite®. Фильтрат выпаривали до сухого состояния при пониженном давлении с получением указанного в заголовке соединения в виде коричневого масла, которое применяли на следующей стадии без дополнительной очистки. LC-MS: Rt=0,98 мин; MS масса/заряд 265,1 [M+H]+
(2) (R)-2-(4-Метоксибензил)-5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3(2H)-он, пром. соед. P033
Смесь пром. соед. P032 (30,5 г, 115,3 ммоль), (R)-1-метилпиперидин-3-амина (15 г, 131 ммоль) и Cs2CO3 (75 г, 231 ммоль) в 300 мл сухого толуола продували азотом в течение 5 мин. Затем последовательно добавляли Pd(OAc)2 (1,3 г, 5,79 ммоль) и BINAP (8 г, 12,85 ммоль) и реакционную смесь перемешивали при нагревании с обратным холодильником в течение 3 ч. Затем ее охлаждали до к. т. и фильтровали через слой Celite®. Осадок на фильтре промывали толуолом. Фильтрат выпаривали до сухого состояния при пониженном давлении с получением указанного в заголовке соединения в виде коричневого масла, которое применяли без дополнительной очистки. LC-MS: Rt=0,51 мин; MS масса/заряд 343,5 [M+H]+
(3) (R)-5-Метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3(2H)-он, пром. соед. P034
Пром. соед. P033 (39,4 г, 115 ммоль) растворяли в 250 мл TFA. Темно-коричневую смесь перемешивали при нагревании с обратным холодильником в течение 2 дней. Реакционную смесь выпаривали до сухого состояния. Остаток растворяли в 200 мл ацетонитрила и 5 мл воды и снова выпаривали до сухого состояния. Полученное черное масло растирали с Et2O. Супернатант удаляли и оставшееся коричневое масло высушивали в условиях высокого вакуума с получением указанного в заголовке соединения, которое применяли без дополнительной очистки. LC-MS: Rt=0,19/0,25 мин (пики введенного образца); MS масса/заряд 223,2 [M+H]+
(4) (R)-6-Хлор-4-метил-N-(1-метилпиперидин-3-ил)пиридазин-3-амин, пром. соед. P030
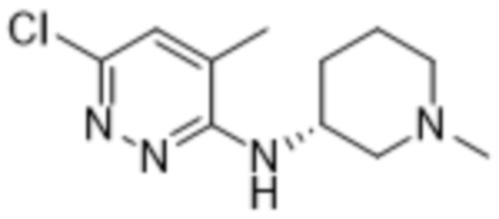
POCl3 (250 мл) добавляли в раствор пром. соед. P034 (38,7 г, 115 ммоль) в 250 мл сухого ацетонитрила и смесь нагревали с обратным холодильником в течение 2,5 дней. Реакционную смесь охлаждали до к. т. и выпаривали до сухого состояния. Черный масляный остаток растворяли в 200 мл ацетонитрила. Данный раствор добавляли по каплям (в высокой степени экзотермическая реакция) в ледяной насыщенный раствор Na2CO3. pH регулировали до >12 путем добавления 30% NaOH. Данную черную смесь выпаривали до сухого состояния, затем обрабатывали смесью CH2Cl2 и MeOH 1:1. Данную черную суспензию перемешивали в течение 30 мин при к. т. Затем ее фильтровали через слой Celite® и осадок на фильтре промывали дополнительным количеством смеси CH2Cl2 и MeOH 1:1 (~500 мл). Фильтрат выпаривали до сухого состояния с получением указанного в заголовке соединения в виде черного твердого вещества, которое применяли без дополнительной очистки. LC-MS: Rt=0,43 мин; MS масса/заряд 241,1 [M+H]+
цис-3-((6-Хлор-4-метилпиридазин-3-ил)амино)-1-метилциклобутан-1-ол, пром. соед. P035, и цис-3-((6-хлор-5-метилпиридазин-3-ил)амино)-1-метилциклобутан-1-ол, пром. соед. P036,
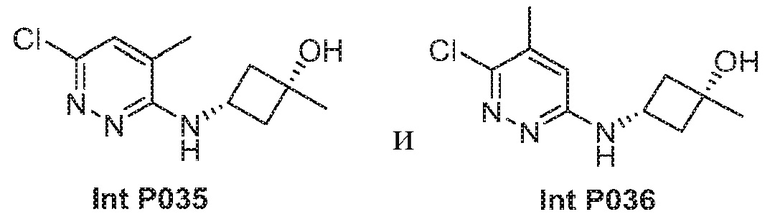 .
.
Раствор цис-3-амино-1-метилциклобутан-1-ола (309 мг, 2,392 ммоль), 3,6-дихлор-4-метилпиридазина (300 мг, 1,840 ммоль) и DIPEA (1,3 мл, 7,36 ммоль) в 1,9 мл 1-бутанола нагревали при 180°C в течение 90 минут в микроволновом аппарате. Реакционную смесь выпаривали и неочищенное оранжевое масло разделяли между EtOAc и 2 M раствором Na2CO3. Органический экстракт промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали и отделяли с помощью колоночной хроматографии на силикагеле (40 г) с применением CH2Cl2 и MeOH (от 0% до 5%). Фракции, содержащие продукт, объединяли по отдельности и выпаривали с получением указанных в заголовке соединений, представляющих собой пром. соед. P035 (первое элюирование) в виде бежевого твердого вещества и пром. соед. P036 (второе элюирование) в виде белого твердого вещества соответственно.
Пром. соед. P035 (первое элюирование): 1H-ЯМР (400 МГц, CDCl3) δ (ppm) 7,02 (s, 1H), 4,38 (br s, 1H), 4,32-4,20 (m, 1H), 2,77-2,63 (m, 2H), 2,11 (s, 3H), 2,09-2,00 (m, 2H), 1,96 (s, 1H), 1,45 (s, 3H). LC-MS: Rt=0,58 мин; MS масса/заряд 228,1 [M+H]+
Пром. соед. P036 (второе элюирование): 1H ЯМР (400 МГц, CDCl3) δ (ppm) 6,52-6,47 (m, 1H), 5,81-5,69 (m, 1H), 3,91-3,76 (m, 1H), 2,76 (s, 1H), 2,72-2,63 (m, 2H), 2,29 (d, 3H), 2,18-2,08 (m, 2H), 1,43 (s, 3H). LC-MS: Rt=0,58 мин; MS масса/заряд 228,1 [M+H]+
цис-3-((6-Хлорпиридазин-3-ил)амино)-1-метилциклобутан-1-ол, пром. соед. P037
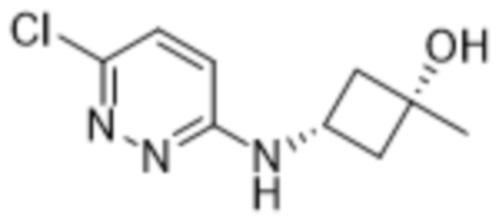
Раствор 3,6-дихлорпиридазина (1 г, 6,71 ммоль), цис-3-амино-1-метилциклобутан-1-ола (0,970 г, 7,05 ммоль) и DIPEA (4,1 мл, 23,49 ммоль) в 8 мл 1-бутанола нагревали при 180°C в течение 1 ч. в условиях микроволнового облучения. Реакционную смесь выливали в воду и 3 раза экстрагировали с помощью EtOAc. Объединенные органические экстракты промывали солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество растирали с ацетонитрилом в течение 20 мин, отфильтровывали и один раз промывали дополнительным количеством ацетонитрила с получением указанного в заголовке соединения в виде бежевого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,33 (перекрывание d, 1H и br s, 1H), 6,84 (d, 1H), 4,98 (s, 1H), 3,91-3,78 (m, 1H), 2,42-2,34 (m, 2H), 1,96-1,86 (m, 2H), 1,26 (s, 3H). LC-MS: Rt=0,53 мин; MS масса/заряд 214,1 [M+H]+
(1S,3R)-3-((6-Хлорпиридазин-3-ил)амино)циклогексан-1-ол, пром. соед. P038
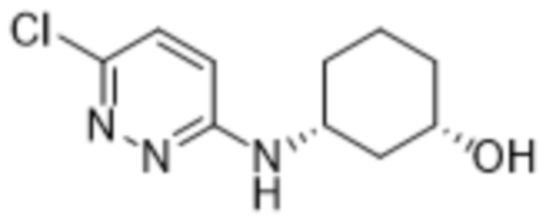
Раствор 3,6-дихлорпиридазина (100 мг, 0,671 ммоль), (1S,3R)-3-аминоциклогексан-1-ола (102 мг, 0,671 ммоль) и DIPEA (0,352 мл, 2,014 ммоль) нагревали при 180°C в микроволновом аппарате в течение 1 часа. Остаток растворяли в EtOAc и промывали насыщенным NaHCO3 и солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Осуществление колоночной хроматографии на силикагеле (12 г) с применением CH2Cl2 и MeOH (от 0% до 10%) обеспечивало получение указанного в заголовке соединения в виде липкого твердого вещества. LC-MS: Rt=0,55 мин; MS масса/заряд 228,1 [M+H]+
(R)-3-Хлор-6-((1-метилпиперидин-3-ил)окси)пиридазин, пром. соед. P039
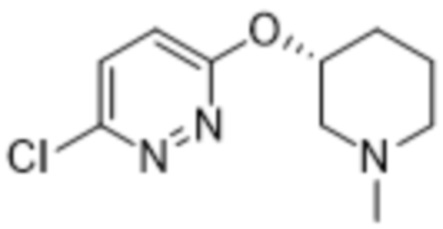
В ледяную смесь 3,6-дихлорпиридазина (150 мг, 1,0 ммоль) и (R)-3-гидрокси-1-метилпиперидина (128 мг, 1,1 ммоль) в 1 мл 1,4-диоксана медленно добавляли NaH (60% в минеральном масле, 161 мг, 4,0 ммоль) и суспензию перемешивали при 0°C в течение 1 ч. Затем ее гасили путем осторожного добавления воды и подкисляли с помощью 1 M HCl. Водный слой отделяли и промывали с помощью EtOAc, затем делали основным путем добавления насыщенного раствора Na2CO3 и экстрагировали с помощью EtOAc. Органический экстракт выпаривали и неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (25 г) с применением CH2Cl2 и MeOH (от 0% до 20%) с получением указанного в заголовке соединения в виде бесцветного масла. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,76 (d, 1H), 7,31 (d, 1H), 5,22-5,14 (m, 1H), 2,90-2,82 (m, 1H), 2,48-2,43 (m, 1H) перекрывание с сигналом DMSO, 2,24-2,19 (m, 1H), 2,17 (s, 3H), 2,14-2,05 (m, 1H), 2,02-1,92 (m, 1H), 1,79-1,72 (m, 1H), 1,55-1,50 (m, 2H). LC-MS: Rt=0,36 мин; MS масса/заряд 228,2 [M+H]+
Следующие пиридазиновые промежуточные соединения (IntP) получали аналогично указанным выше процедурам с применением соответствующих 3,6-дигалогенпиридазинов и подходящих аминов необязательно с последующей стадией удаления защитной группы.
(мин; масса/заряд)
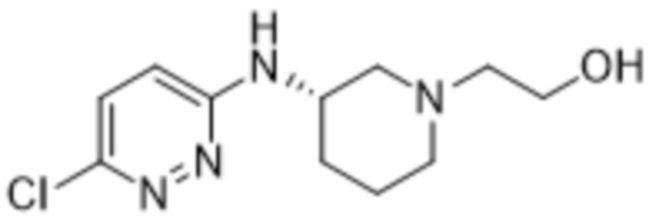
257,2 [M+H]+
253,2 [M+H]+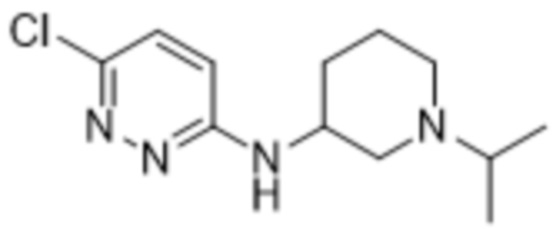
255,3 [M+H]+
329,2 [M+H]+
271,2 [M+H]+
241,2 [M+H]+
349,2 [M+H]+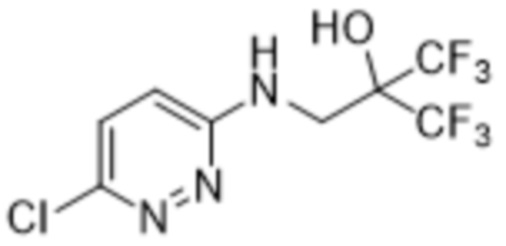
310,1 [M+H]+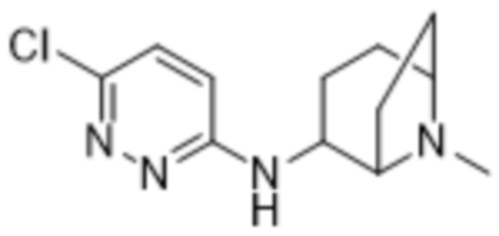
253,2 [M+H]+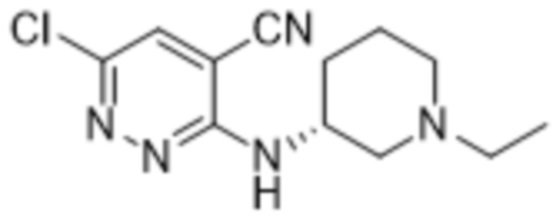
266,3 [M+H]+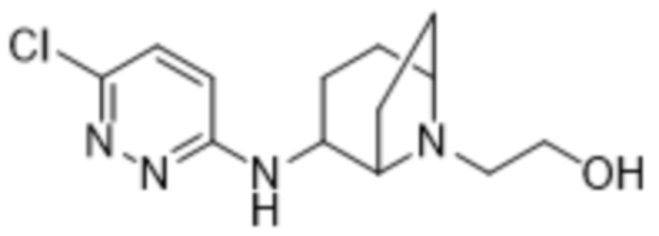
284,2 [M+H]+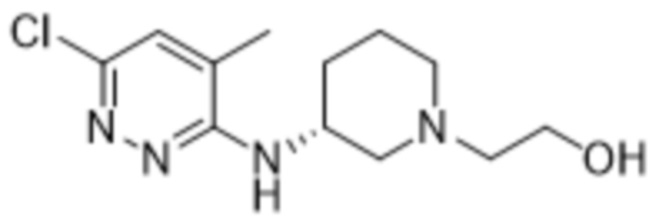
271,3 [M+H]+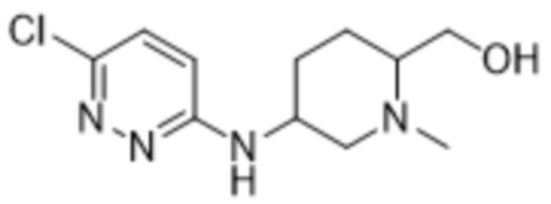
257,2 [M+H]+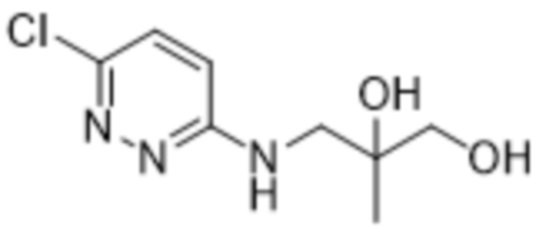
218,1 [M+H]+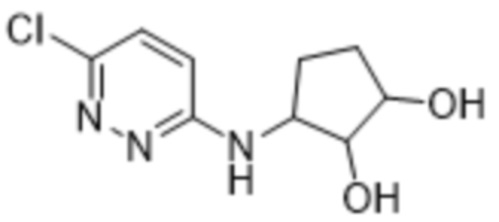
230,1 [M+H]+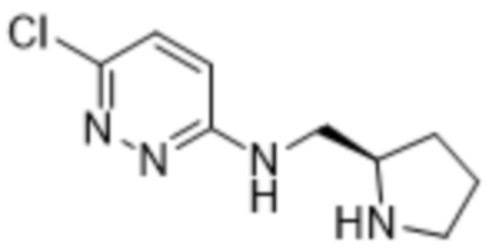
213,2 [M+H]+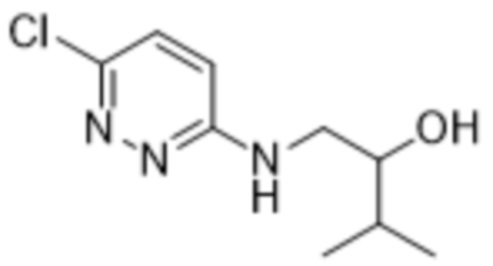
216,2 [M+H]+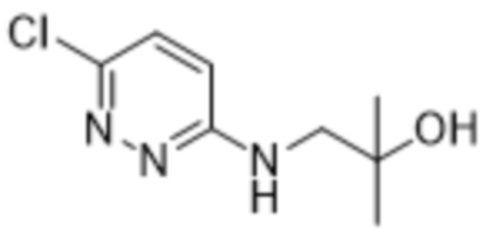
202,1 [M+H]+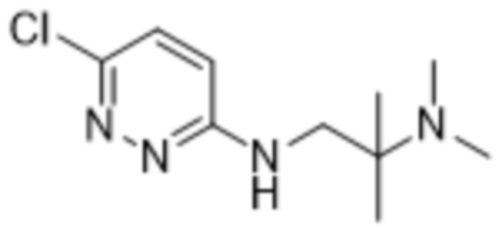
229,2 [M+H]+
213,1 [M+H]+
203,1 [M+H]+
227,1 [M+H]+
227,1 [M+H]+
249,1 [M+H]+
249,1 [M+H]+
214,2 [M+H]+
174,0 [M+H]+
242,1 [M+H]+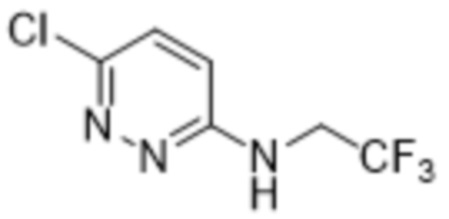
212,1 [M+H]+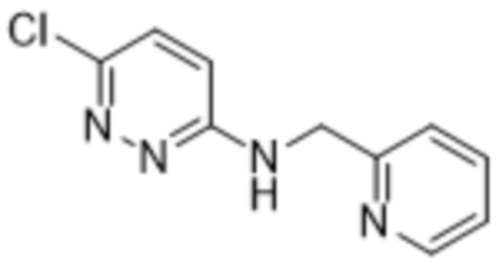
221,1 [M+H]+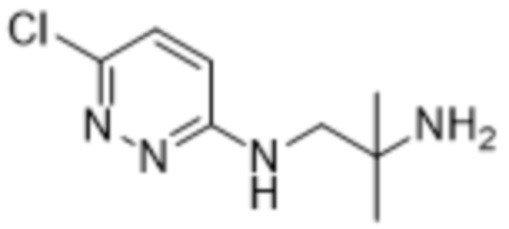
201,1 [M+H]+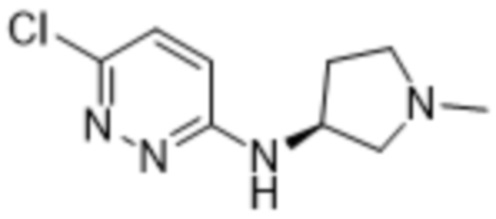
353,2 [M+H]+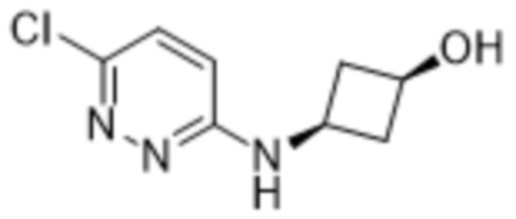
200,1 [M+H]+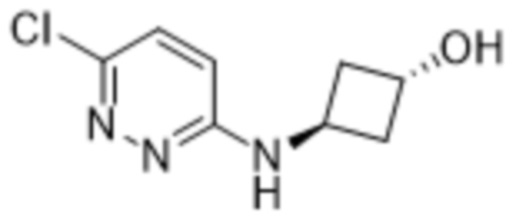
200,1 [M+H]+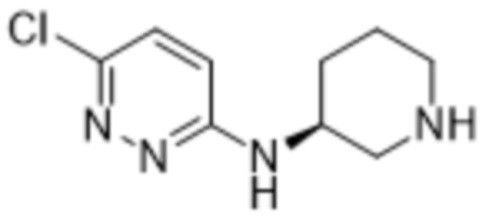
213,2 [M+H]+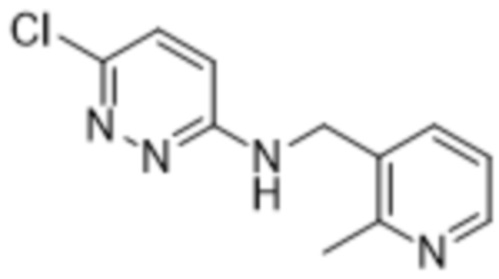
235,1 [M+H]+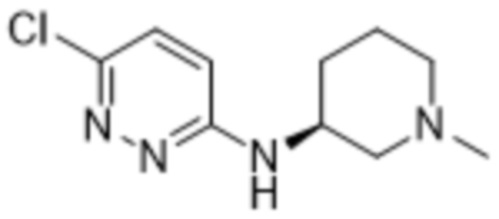
227,2 [M+H]+
228,1 [M+H]+
320,1 [M+H]+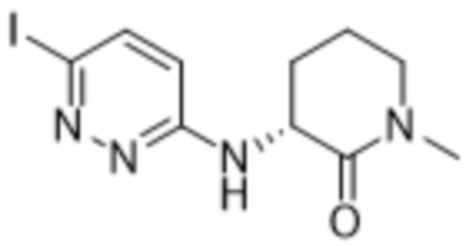
333,0 [M+H]+
227,1 [M+H]+
326,0 [M+H]+
373,1 [M+H]+
295,1 [M+H]+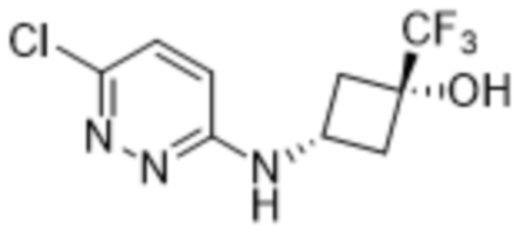
268,0 [M+H]+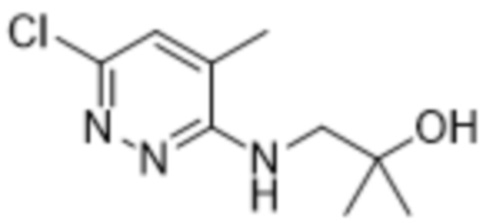
216,1 [M+H]+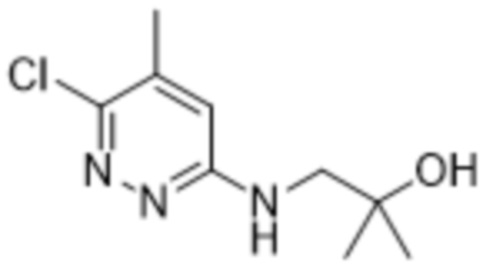
216,1 [M+H]+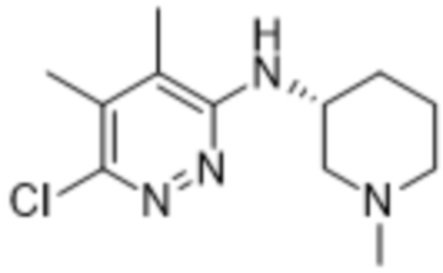
255,3 [M+H]+
371,4 [M+H]+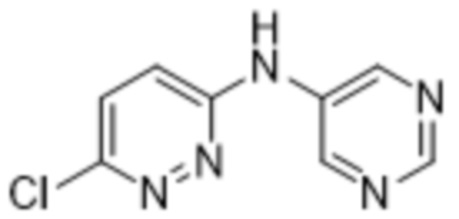
208,1 [M+H]+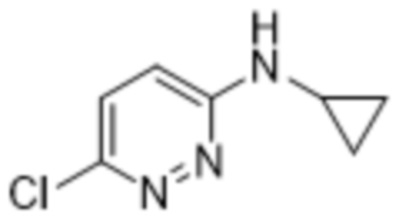
170,1 [M+H]+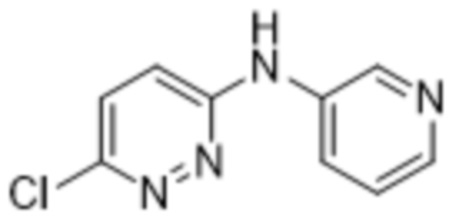
207,1 [M+H]+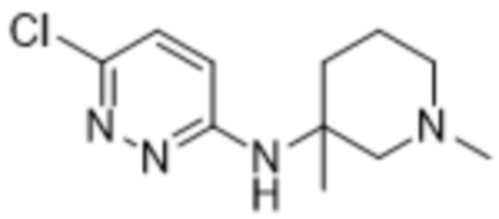
241,1 [M+H]+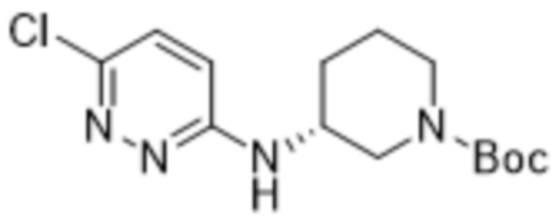
313,3 [M+H]+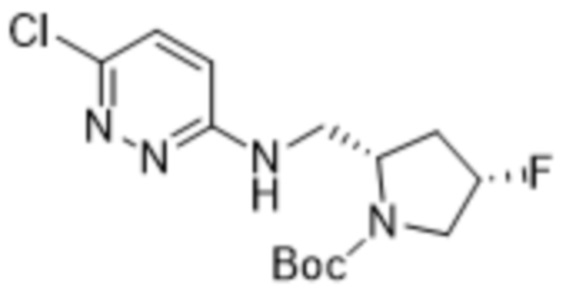
331,2 [M+H]+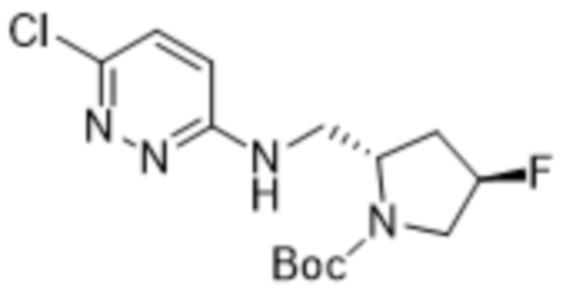
331,3 [M+H]+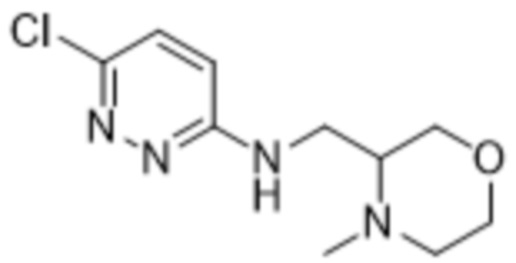
243,3 [M+H]+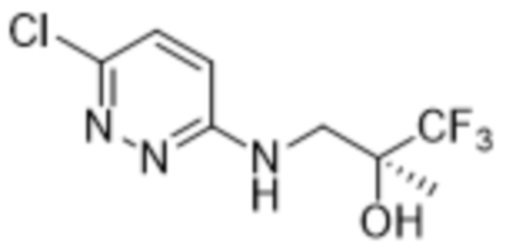
256,1 [M+H]+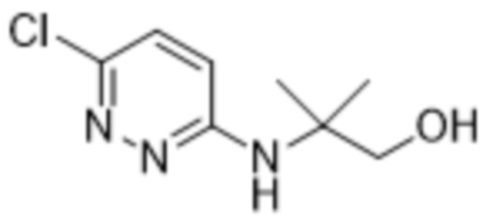
202,0 [M+H]+
361,2 [M+H]+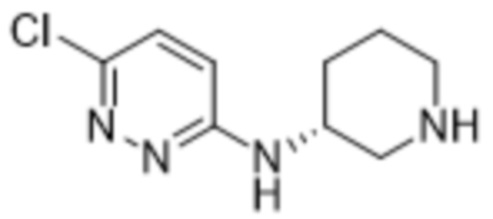
213,1 [M+H]+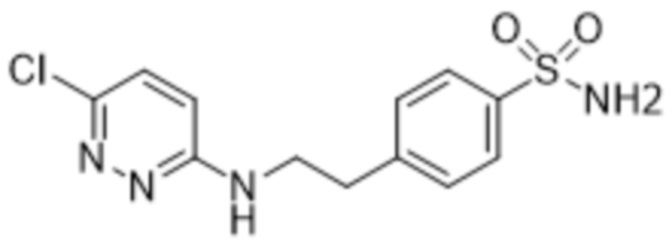
313,3 [M+H]+
231,1 [M+H]+
245,1 [M+H]+
231,1 [M+H]+
Дополнительные модификации пиперазиновых промежуточных соединений
1-((R)-3-((6-Хлорпиридазин-3-ил)амино)пиперидин-1-ил)пропан-2-ол, пром. соед. P105
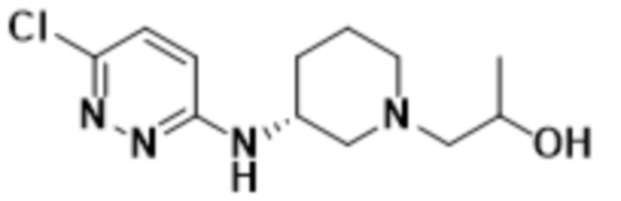
Пром. соед. P100 (200 мг, 0,621 ммоль) растворяли в 2 мл DMF перед осуществлением добавления K2CO3 (429 мг, 3,11 ммоль) и 1-хлорпропан-2-ола (0,23 мл, 1,86 ммоль). Желтую суспензию перемешивали при 100°C в течение 4,5 часа и затем при 120°C в течение 1,5 часа. Смесь охлаждали до к. т., разбавляли небольшим количеством воды и очищали с помощью aхиральной HPLC с обращенной фазой с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. LC-MS: Rt=0,40 мин; MS масса/заряд 271,2 [M+H]+
(R)-1-(3-((6-Хлорпиридазин-3-ил)амино)пиперидин-1-ил)-2-метилпропан-2-ол, пром. соед. P106
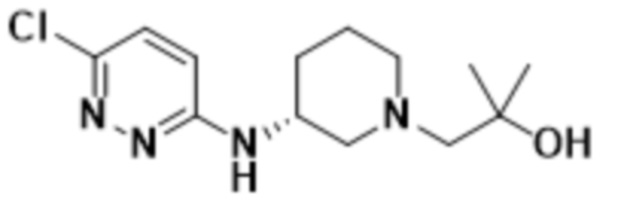
Указанное в заголовке соединение синтезировали аналогично процедуре, описанной выше для пром. соед. P105, с применением пром. соед. P100 и 1-хлор-2-метилпропан-2-ола. LC-MS: Rt=0,47 мин; MS масса/заряд 285,3 [M+H]+
СИНТЕЗ ВЫБРАННЫХ АМИНОВ ДЛЯ УКАЗАННЫХ ВЫШЕ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
Дигидрохлорид (R)-2-(3-аминопиперидин-1-ил)этан-1-ола, пром. соед. A107
(1) трет-Бутил-(R)-(1-(2-гидроксиэтил)пиперидин-3-ил)карбамат, пром. соед. A108
Суспензию трет-бутил-(R)-пиперидин-3-илкарбамата (10 г, 49,9 ммоль), 2-бромэтан-1-ола (6,24 г, 49,9 ммоль) и Na2CO3 (10,58 г, 100 ммоль) в 100 мл ацетонитрила перемешивали при к. т. в течение 2 дней. Суспензию фильтровали и твердое вещество несколько раз промывали ацетонитрилом. Объединенные фильтраты выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле с применением CH2Cl2 и MeOH (от 0% до 10%) с получением указанного в заголовке соединения. LC-MS: Rt=0,40 мин; MS масса/заряд 245,1 [M+H]+
(2) Дигидрохлорид (R)-2-(3-аминопиперидин-1-ил)этан-1-ола, пром. соед. A107
Раствор пром. соед. A108 (10,0 г, 40,9 ммоль) в 20 мл CH2Cl2 обрабатывали с помощью 4 M HCl в 1,4-диоксане (40,9 мл, 164 ммоль). Смесь перемешивали при к. т. в течение 3 ч. Осажденное вещество отфильтровывали, несколько раз промывали 1,4-диоксаном и высушивали в течение ночи при 60°C в условиях высокого вакуума с получением указанного в заголовке соединения. LC-MS: Rt=0,15 мин; MS масса/заряд 145,2 [M+H]+
1-(трет-Бутил)-2-метил-5-аминопиперидин-1,2-дикарбоксилат, пром. соед. A109
(1) 1-(трет-Бутил)-2-метил-5-гидроксипиперидин-1,2-дикарбоксилат, пром. соед. A110
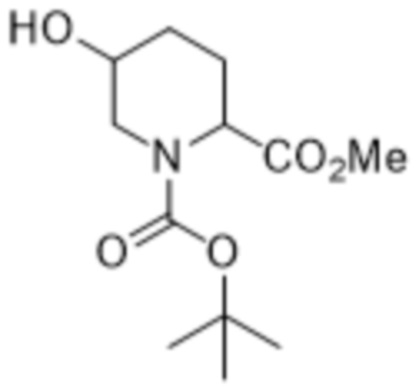
1-трет-Бутил-2-метил-5-оксопиперидин-1,2-дикарбоксилат (500 мг, 1,943 ммоль) растворяли в 15 мл MeOH и охлаждали до 0°C. Частями добавляли NaBH4 (73,5 мг, 19,43 ммоль). После перемешивания в течение 3 ч. половину MeOH удаляли при пониженном давлении. Остаток разбавляли с помощью EtOAc и последовательно промывали с помощью 0,5 M HCl, 0,5 M NaOH и солевого раствора. Органический экстракт высушивали над Na2SO4, фильтровали и выпаривали с получением указанного в заголовке соединения в виде бесцветного масла. Смесь диастереомеров применяли без дополнительной очистки. 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 4,95 (d, 1H), 4,70-4,54 (m, 1H), 3,97-3,84 (m, 1H), 3,68 и 3,67 (2 s (диастереомеры), 3H), 3,42-3,29 (m, 2H), 2,11-2,05 (m, 1H), 1,85-1,72 (m, 1H), 1,72-1,58 (m, 1H), 1,41 и 1,36 (2 s (диастереомеры), 9H), 1,04-0,94 (m, 1H).
(2) 1-(трет-Бутил)-2-метил-5-азидопиперидин-1,2-дикарбоксилат, пром. соед. A111
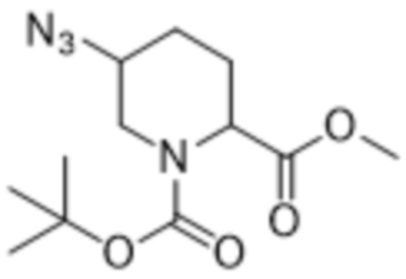
Пром. соед. A110 (526 мг, 1,927 ммоль) растворяли в 10 мл толуола и обрабатывали при к. т. С помощью PPh3 (1,064 г, 4,06 ммоль) и Zn(N3)2 (468 мг, 1,521 ммоль). Затем в данную смесь по каплям добавляли DIAD (0,789 мл, 4,06 ммоль). После перемешивания при к. т. в течение 4 ч. реакционную смесь фильтровали через Hyflo и промывали с помощью EtOAc. Фильтрат выпаривали и неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (50 г) с применением н-гептана и EtOAc (от 10% до 80%) с получением указанного в заголовке соединения в виде смеси диастереомеров. 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 4,88-4,63 (m, 1H), 4,05-3,90 (m, 2H), 3,68 (s, 3H), 3,19-2,97 (m, 1H), 1,99-1,78 (m, 2H), 1,72-1,63 (m, 1H), 1,55-1,47 (m, 1H), 1,41 и 1,39 (2 s (диастереомеры), 9H).
(3) 1-(трет-Бутил)-2-метил-5-аминопиперидин-1,2-дикарбоксилат, пром. соед. A109
В суспензию Pd/C (159 мг, 0,15 ммоль, содержание Pd 10%) в 10 мл MeOH добавляли раствор пром. соед. A111 (426 мг, 1,498 ммоль) в 30 мл MeOH. Смесь гидрогенизировали при атмосферном давлении при к. т. в течение 1 ч. Смесь фильтровали через слой Celite® и промывали с помощью EtOAc. Фильтрат выпаривали с получением указанного в заголовке соединения в виде смеси диастереомеров и применяли без дополнительной очистки. 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 4,75-4,5 (m, 1H), 3,65 (s, 3H), 3,59-3,52 (m, 1H), 3,31 (s, 2H), 3,15-2,86 (m, 2H), 2,16-2,02 (m, 1H), 1,82-1,71 (m, 1H), 1,49-1,40 (m, 2H) перекрывание с 1.38 (s, 9H).
СИНТЕЗ ПРИМЕРОВ
Пример пр. 001
(R)-2-(6-((1-Этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
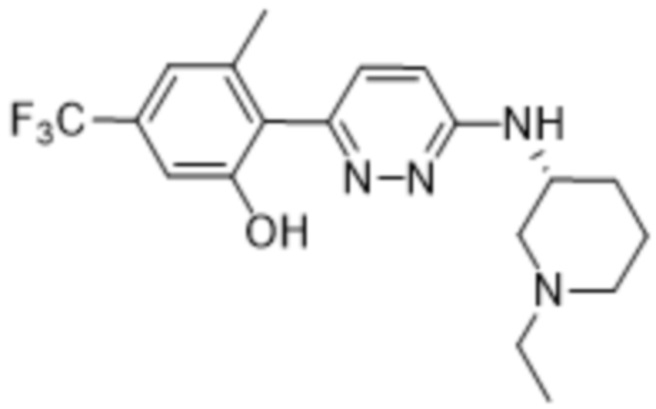
Пром. соед. P024 (770 мг, 1,663 ммоль) и пром. соед. B010 (754 мг, 2,495 ммоль) растворяли в 8 мл 1,4-диоксана и добавляли 2 M Na2CO3 (0,25 мл, 0,499 ммоль). Затем добавляли Pd(Ph3P)4 (96 мг, 0,083 ммоль), и реакционную смесь продували азотом в течение 5 мин, и затем перемешивали при 120°C в течение 1 ч. в условиях микроволнового облучения. Реакционную смесь выливали в воду и дважды экстрагировали с помощью EtOAc. Объединенные органические экстракты выпаривали и остаток очищали с помощью колоночной хроматографии на силикагеле с применением CH2Cl2 и MeOH (от 0% до 10%) с получением указанного в заголовке соединения. 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,14 (s, 1H), 7,22 (d, 1H), 7,10 (d, 1H), 7,04 (d, 1H), 6,88 (d, 1H), 6,75 (d, 1H), 4,07 (s, 1H), 2,97 (s, 1H), 2,37 (s, 3H), 2,13 (s, 3H), 2,08-1,83 (m, 3H), 1,78-1,67 (m, 1H), 1,60-1,48 (m, 1H), 1,39-1,27 (m, 1H), 1,01 (t, 3H). LC-MS: Rt=0,42 мин; MS масса/заряд 241,3 [M+H]+
Пример пр. 002
2-(6-(((цис)-3-Гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
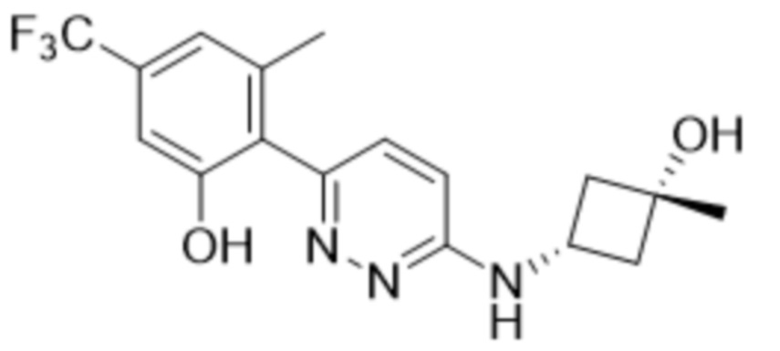
Смесь пром. соед. P037 (50 мг, 0,145 ммоль), пром. соед. B005 (35,1 мг, 0,160 ммоль) и 2 M Na2CO3 (0,218 мл, 0,435 ммоль) в 1 мл DME и 1 мл воды продували аргоном в течение 3 мин. Затем добавляли Pd(PPh3)4 (8,38 мг, 7,25 мкмоль) и смесь нагревали при 140°C в течение 30 мин в условиях микроволнового облучения. Реакционную смесь выпаривали и очищали с помощью колоночной хроматографии на силикагеле (4 г) с применением CH2Cl2 и MeOH (от 0% до 4%) с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,13 (s, 1H), 7,22 (d, 1H), 7,13 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,81 (d, 1H), 4,99 (s, 1H), 4,03-3,90 (m, 1H), 2,45-2,38 (m, 2H), 2,12 (s, 3H), 2,00-1,92 (m, 2H), 1,29 (s, 3H). LC-MS: Rt=0,80 мин; MS масса/заряд 354,1 [M+H]+
Пример пр. 003
2-(6-(((1R,3S)-3-Гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
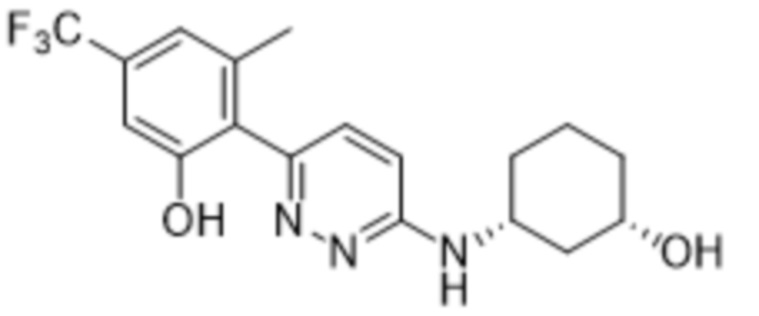
Смесь пром. соед. P038 (50 мг, 0,220 ммоль), пром. соед. B010 (73,0 мг, 0,242 ммоль) и 2 M Na2CO3 (0,329 мл, 0,659 ммоль) в 5 мл 1,4-диоксана продували аргоном в течение 3 мин. Затем добавляли Pd(PPh3)4 (7,61 мг, 6,59 мкмоль) и смесь перемешивали при 120°C в течение 6 ч. Добавляли еще одну часть пром. соед. B010 (50,0 мг, 0,166 ммоль) вместе с дополнительным количеством Pd(PPh3)4 (5 мг, 4,33 мкмоль) и нагревание продолжали в течение 24 ч. Обеспечивали охлаждение реакционной смеси до к. т. Ее разбавляли водой и экстрагировали с помощью EtOAc. Органический слой промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью SFC (колонка: Waters TORUS 2-PIC 130A, 250 × 30 мм, 5 мкм; 35°C, элюент B: 17-25% MeOH за 10 мин, скорость потока: 100 мл/мин, давление: 120 бар) с получением указанного в заголовке соединения в виде белого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,14 (s, 1H), 7,21 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,84-6,76 (m, 2H), 4,65 (d, 1H), 3,93-3,80 (m, 1H), 3,54-3,45 (m, 1H), 2,27-2,18 (m, 1H), 2,13 (s, 3H), 2,02-1,92 (m, 1H), 1,87-1,79 (m, 1H), 1,76-1,65 (m, 1H), 1,37-1,22 (m, 1H), 1,18-1,00 (m, 3H). LC-MS: Rt=0,78 мин; MS масса/заряд 368,2 [M+H]+
Пример пр. 004
(R)-2-(4-Метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
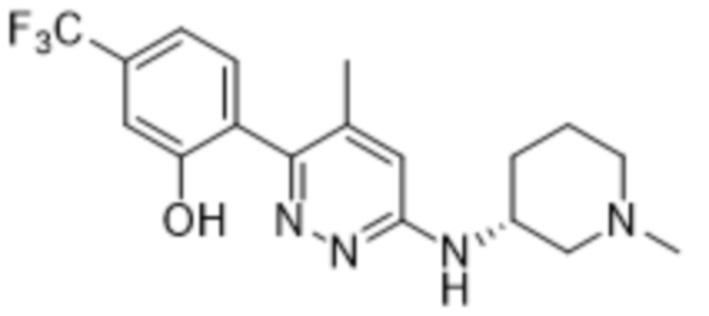
Смесь пром. соед. P031 (438 мг, 1,819 ммоль), коммерчески доступной (2-гидрокси-4-(трифторметил)фенил)бороновой кислоты (CAS 1072951-50-8, 412 мг, 2,001 ммоль), Pd(PPh3)4 (63,1 мг, 0,055 ммоль) и 1,2 M NaHCO3 (4,55 мл, 5,46 ммоль) в 9 мл 1,4-диоксана нагревали при 105°C в течение ночи. Для полного преобразования добавляли еще одну часть (2-гидрокси-4-(трифторметил)фенил)бороновой кислоты (187 мг, 0,909 ммоль) и смесь нагревали при 180°C в течение 30 мин в условиях микроволнового облучения. Реакционную смесь разбавляли водой и экстрагировали дважды с помощью CH2Cl2. Объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (40 г) с применением CH2Cl2 и MeOH (от 0% до 20%). Фракции, содержащие продукт, выпаривали и растирали с CH2Cl2 с получением указанного в заголовке соединения в виде белого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,45 (s, 1H), 7,39 (d, 1H), 7,26-7,16 (m, 2H), 6,70 (s, 1H), 6,63 (d, 1H), 4,11-3,98 (m, 1H), 2,89-2,82 (m, 1H), 2,18 (s, 3H), 2,01 (s, 3H, перекрывание с m, 1H), 1,94-1,78 (m, 3H), 1,75-1,66 (m, 1H), 1,59-1,48 (m, 1H), 1,35-1,24 (m, 1H). LC-MS: Rt=0,67 мин; MS масса/заряд 367,3 [M+H]+
Пример пр. 005
(R)-3-Метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
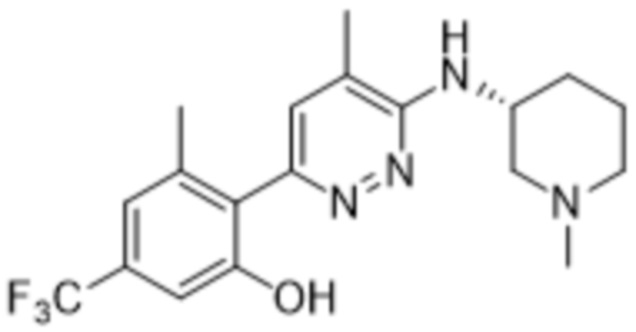
Смесь амина, пром. соед. P030 (76 мг, 0,316 ммоль), бороната пром. соед. B010 (124 мг, 0,410 ммоль) и водного 2 M Na2CO3 (0,474 мл, 0,947 ммоль) в 2 мл 1,4-диоксана продували аргоном в течение 3 минут. Затем добавляли Pd(Ph3P)4 (10,9 мг, 9,4 мкмоль) и смесь нагревали при 120°C в течение 2 часов. Добавляли еще одну часть пром. соед. B010 (50 мг, 0,166 ммоль) и Pd(Ph3P)4 (10,9 мг, 9,4 мкмоль) и нагревание продолжали в течение ночи. Обеспечивали охлаждение реакционной смеси до к. т., осуществляли ее разбавление водой и экстрагирование этилацетатом. Органический слой промывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью SFC (колонка: Waters Viridis 2-EP 130A, 250 × 30 мм, 5 мкм; 35°C, элюент B: 16-24% MeOH за 10 мин. Скорость потока: 100 мл/мин, давление: 120 бар) с получением указанного в заголовке соединения в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,12 (s, 1H), 7,13-7,11 (m, 1H), 7,09 (br s, 1H), 7,05 (br s, 1H), 5,80 (d, 1H), 4,33-4,22 (m, 1H), 3,00-2,89 (m, 1H), 2,69-2,59 (m, 1H), 2,21 (s, 3H), 2,12 (br s, 3+3H), 2,04-1,92 (m, 2H), 1,92-1,84 (m, 1H), 1,77-1,66 (m, 1H), 1,63-1,51 (m, 1H), 1,49-1,36 (m, 1H). LC-MS: Rt=0,74 мин; MS масса/заряд 381,3 [M+H]+
Следующие примеры синтезировали аналогично указанным выше процедурам с применением подходящих галоген-пиридазиновых промежуточных соединений (пром. соед. P) и соответствующих бороновых кислот, или промежуточных соединений с боронатной группой (пром. соед. B), или коммерчески доступных бороновых кислот (BCA) соответственно, при этом необязательно с последующими осуществлением стадий удаления защитной группы.
(мин; масса/заряд)
и
IntB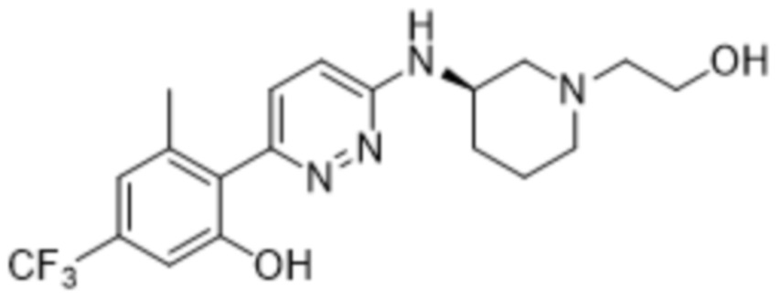
(R)-2-(6-((1-(2-Гидроксиэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
397,2 [M+H]+
и
пром. соед. B010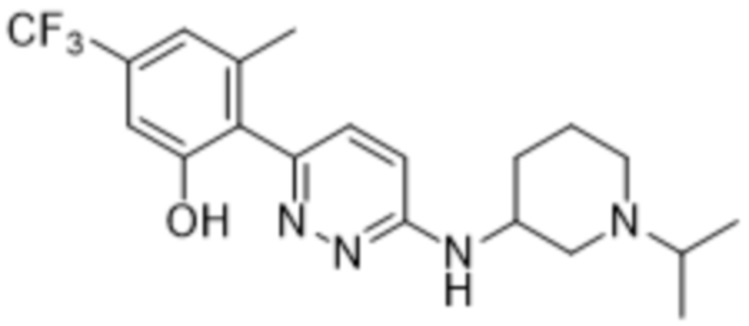
2-(6-((1-Изопропилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
395,4 [M+H]+
и
пром. соед. B010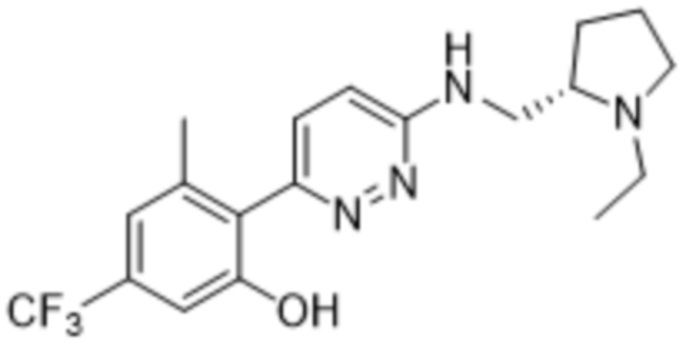
(S)-2-(6-(((1-Этилпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
381,4 [M+H]+
и
пром. соед. B010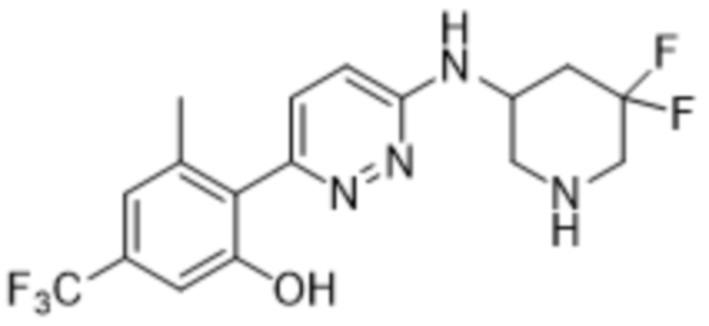
2-(6-((5,5-Дифторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
389,3 [M+H]+
и
пром. соед. B010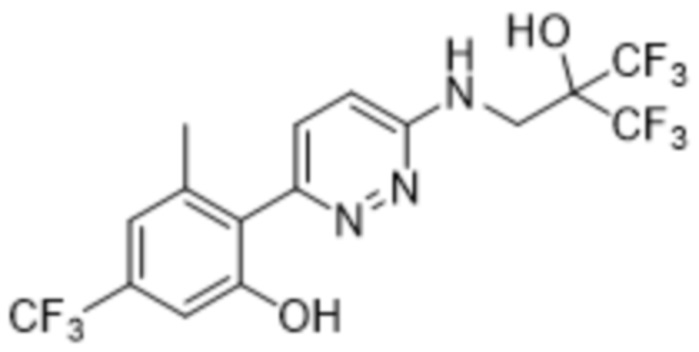
3-Метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-(трифторметил)пропил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
450,2 [M+H]+
и
пром. соед. B010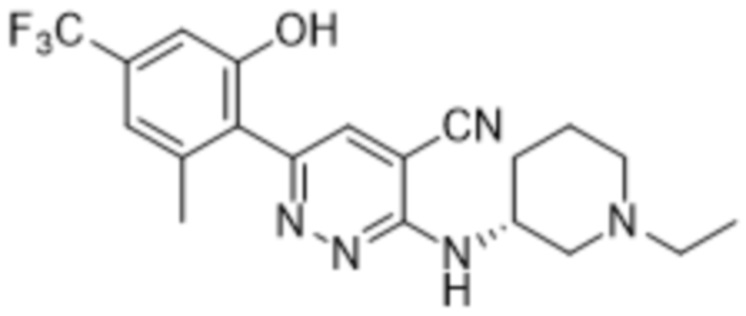
(R)-3-((1-Этилпиперидин-3-ил)амино)-6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-4-карбонитрил
406,3 [M+H]+
и
пром. соед. B010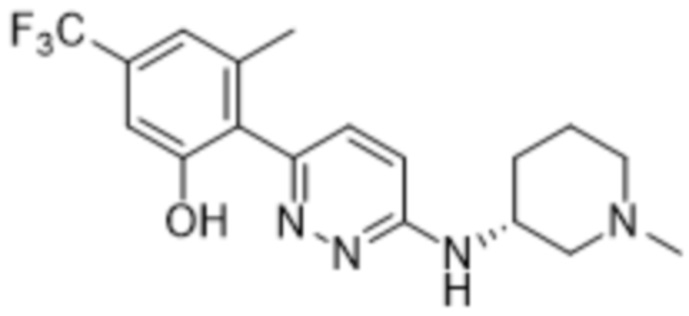
(R)-3-Метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
367 [M+H]+
и
пром. соед. B010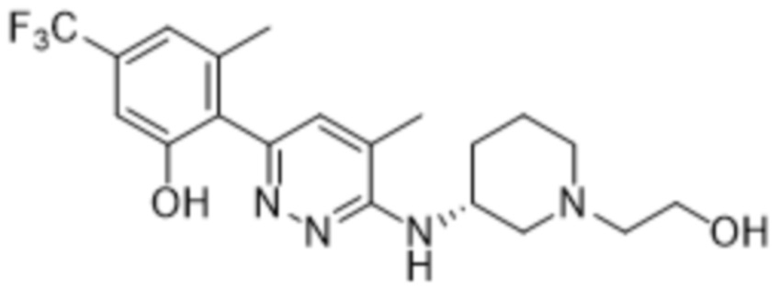
(R)-2-(6-((1-(2-Гидроксиэтил)пиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенол
411 [M+H]+
и
пром. соед. B010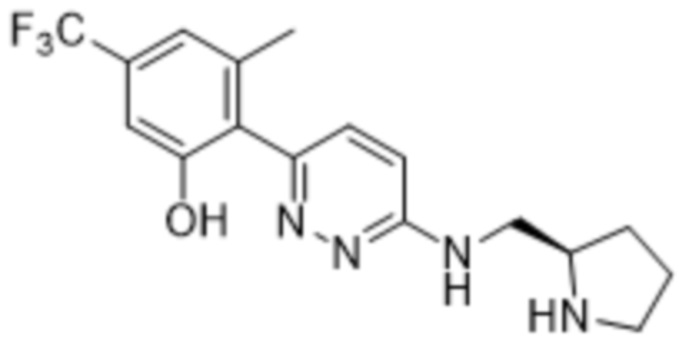
(R)-3-Метил-2-(6-((пирролидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
353 [M+H]+
и
пром. соед. B010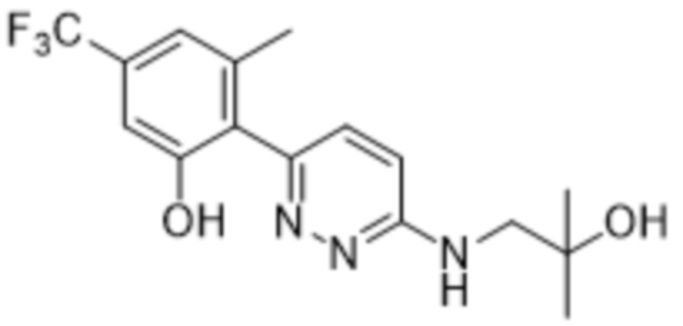
2-(6-((2-Гидрокси-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
342 [M+H]+
и
пром. соед. B010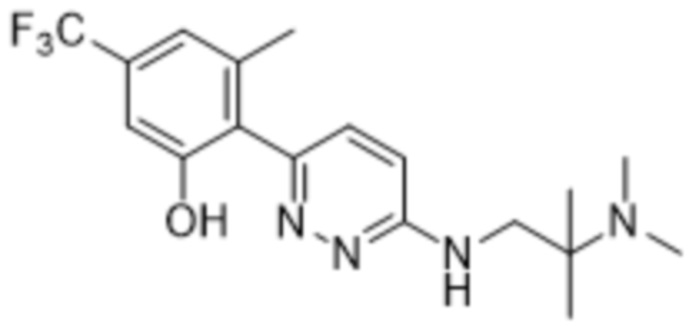
2-(6-((2-(Диметиламино)-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
369 [M+H]+
и
пром. соед. B010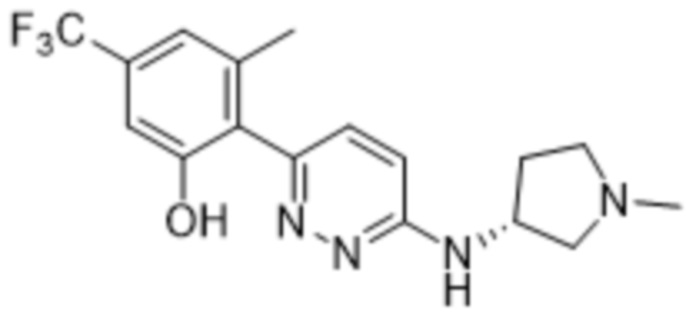
(R)-3-Метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
353 [M+H]+
и
пром. соед. B010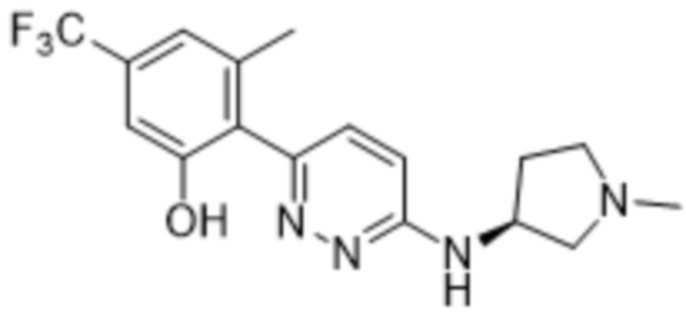
(S)-3-Метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
353 [M+H]+
и
пром. соед. B010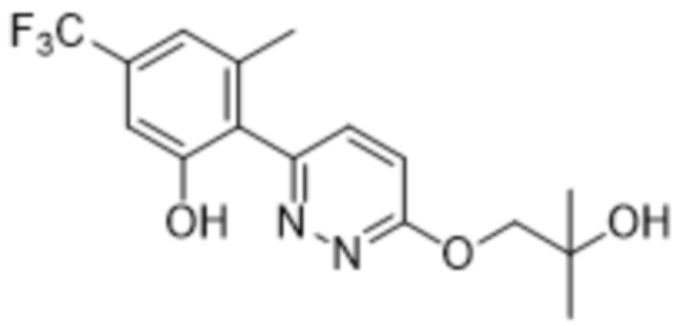
2-(6-(2-Гидрокси-2-метилпропокси)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
343 [M+H]+
и
пром. соед. B010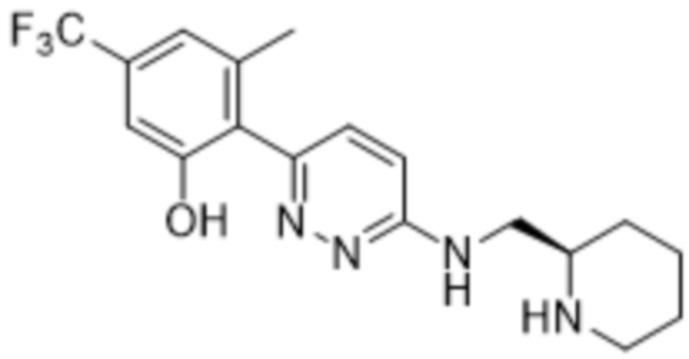
(R)-3-Метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
367,3 [M+H]+
и
пром. соед. B010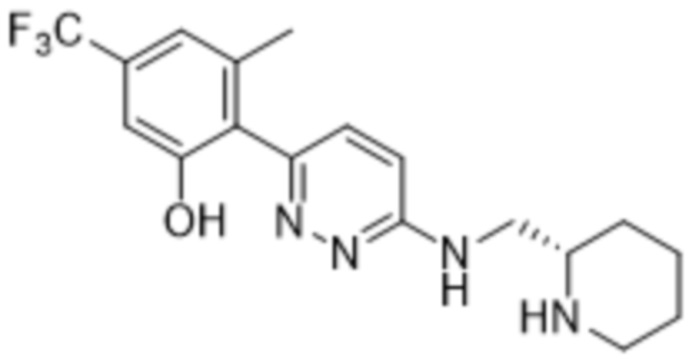
(S)-3-Метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
367,3 [M+H]+
и
пром. соед. B010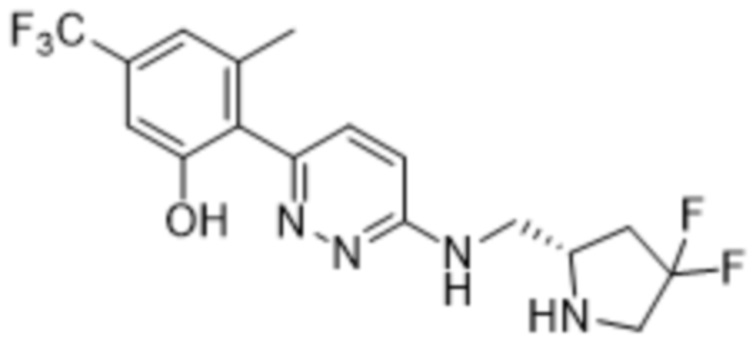
(S)-2-(6-(((4,4-Дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
389 [M+H]+
и
пром. соед. B010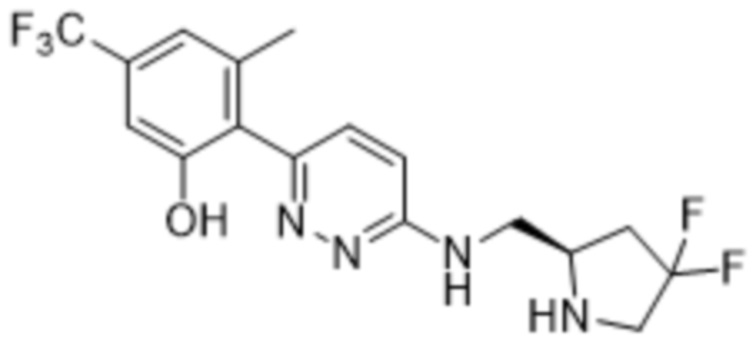
(R)-2-(6-(((4,4-Дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
389 [M+H]+
и
пром. соед. B010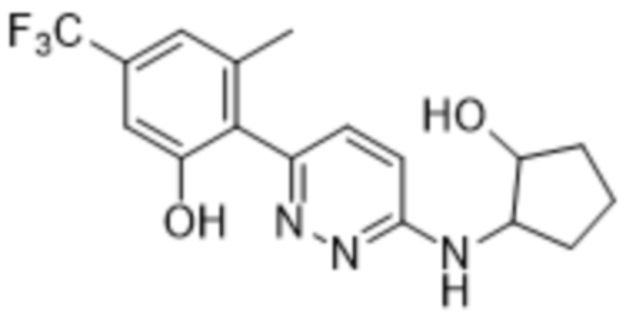
(транс)-2-(6-((2-Гидроксициклопентил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
354 [M+H]+
и
пром. соед. B010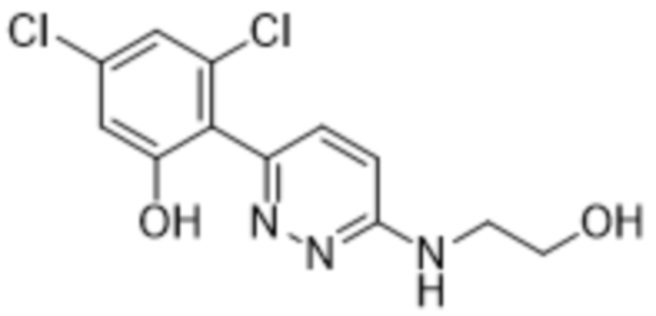
3,5-Дихлор-2-(6-((2-гидроксиэтил)амино)пиридазин-3-ил)фенол
300 [M+H]+
и
пром. соед. B018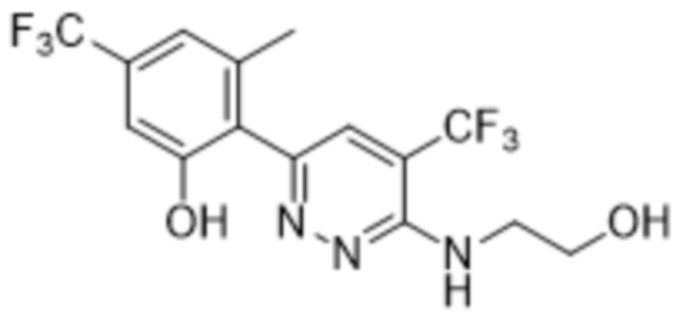
2-(6-((2-Гидроксиэтил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
382 [M+H]+
и
пром. соед. B010
3,5-Дихлор-2-(6-((2,2,2-трифторэтил)амино)пиридазин-3-ил)фенол
338 [M+H]+
и
пром. соед. B018
3-Метил-2-(6-((пиридин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
361 [M+H]+
и
пром. соед. B010
2-(6-((2-Амино-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
341 [M+H]+
и
пром. соед. B010
3-Хлор-2-(6-((2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
362 [M+H]+
и
пром. соед. B001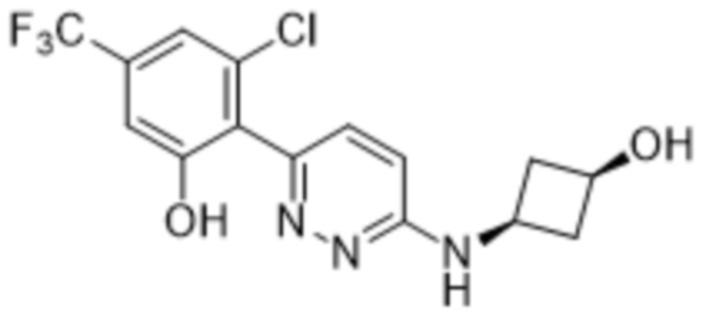
3-Хлор-2-(6-((цис-3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
360 [M+H]+
и
пром. соед. B001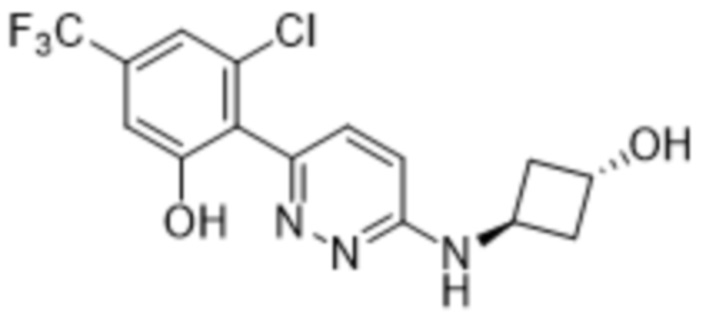
3-Хлор-2-(6-((транс-3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
360 [M+H]+
и
пром. соед. B001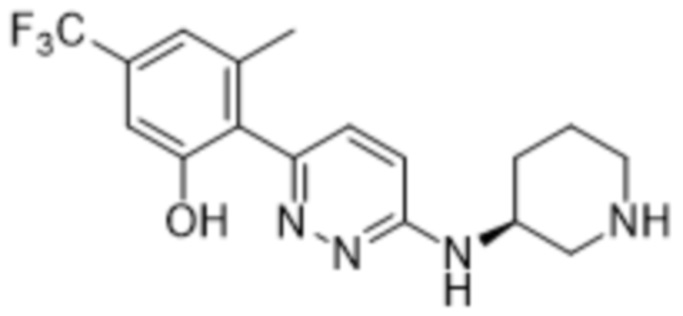
(S)-3-Метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенол
353 [M+H]+
и
пром. соед. B010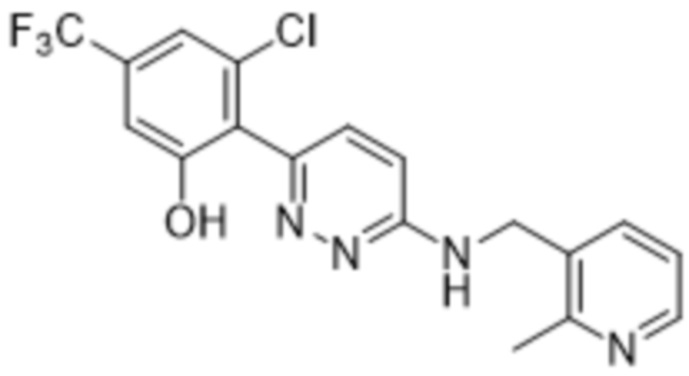
3-Хлор-2-(6-(((2-метилпиридин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
395 [M+H]+
и
пром. соед. B001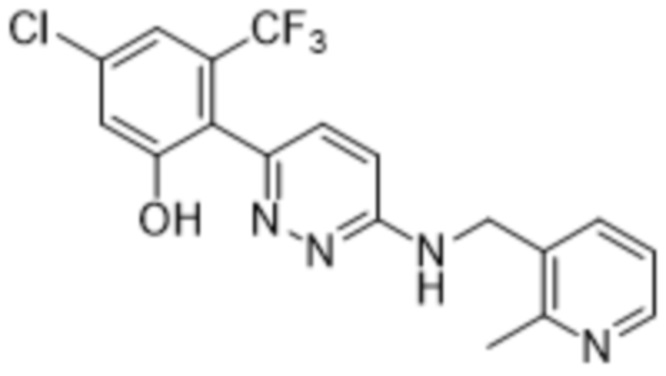
5-Хлор-2-(6-(((2-метилпиридин-3-ил)метил)амино)пиридазин-3-ил)-3-(трифторметил)фенол
395 [M+H]+
и
пром. соед. B001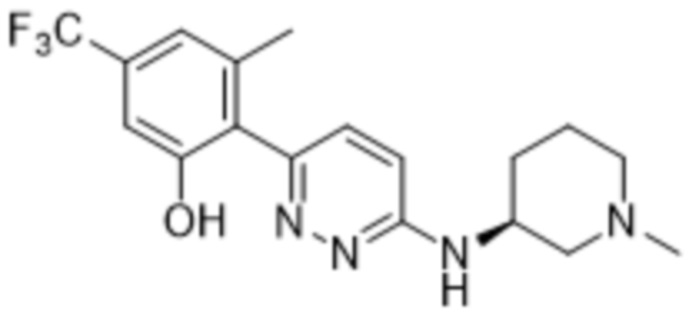
(S)-3-Метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
367 [M+H]+
и
пром. соед. B010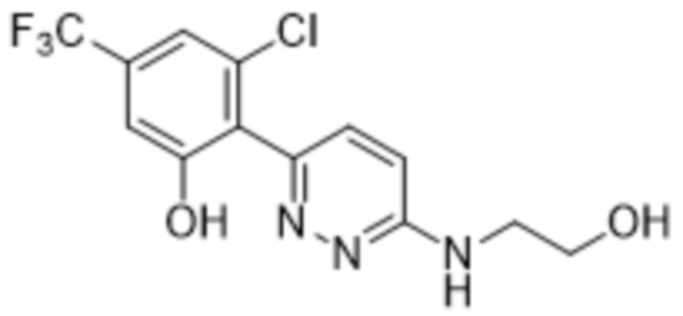
3-Хлор-2-(6-((2-гидроксиэтил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
334 [M+H]+
и
пром. соед. B001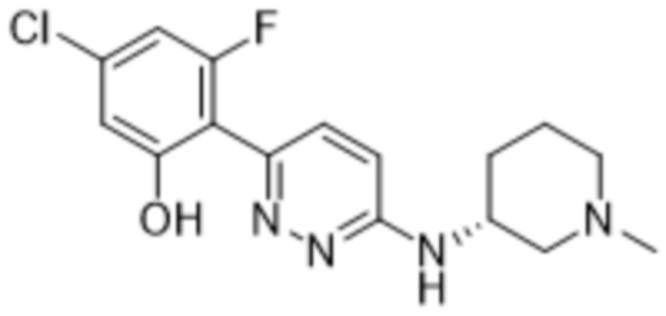
TFA-соль (R)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола
337,2 [M+H]+
и
пром. соед. B022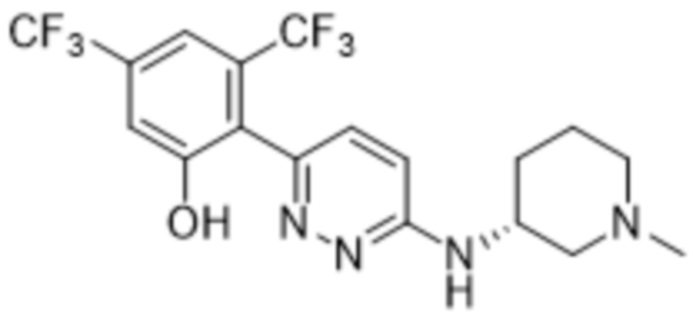
(R)-2-(6-((1-Метилпиперидин-3-ил)амино)пиридазин-3-ил)-3,5-бис(трифторметил)фенол
424,4 [M+H]+
и
пром. соед. B023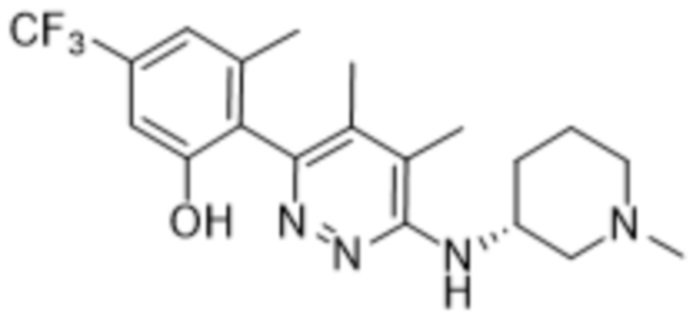
TFA-соль 2-(4,5-диметил-6-(((R)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола
395,3 [M+H]+
и
пром. соед. B010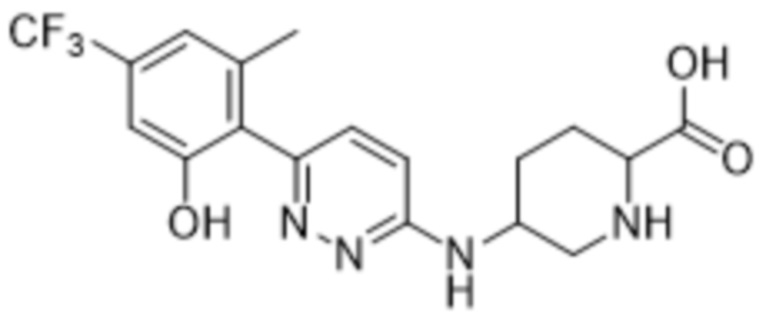
5-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-карбоновая кислота
397,3 [M+H]+
и
пром. соед. B010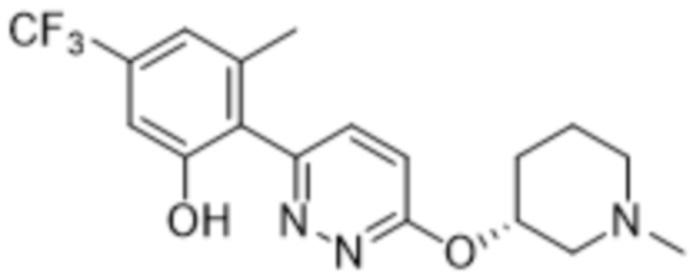
(R)-3-Метил-2-(6-((1-метилпиперидин-3-ил)окси)пиридазин-3-ил)-5-(трифторметил)фенол
368,4 [M+H]+
и
пром. соед. B010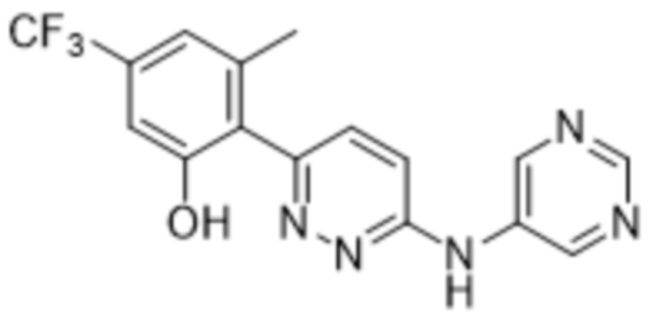
3-Метил-2-(6-(пиримидин-5-иламино)пиридазин-3-ил)-5-(трифторметил)фенол
348,3 [M+H]+
и
пром. соед. B010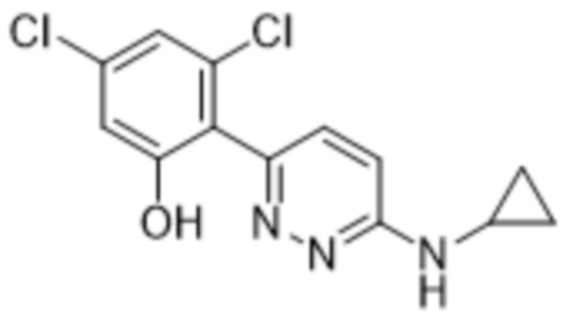
3,5-Дихлор-2-(6-(циклопропиламино)пиридазин-3-ил)фенол
296,1 [M+H]+
и
пром. соед. B018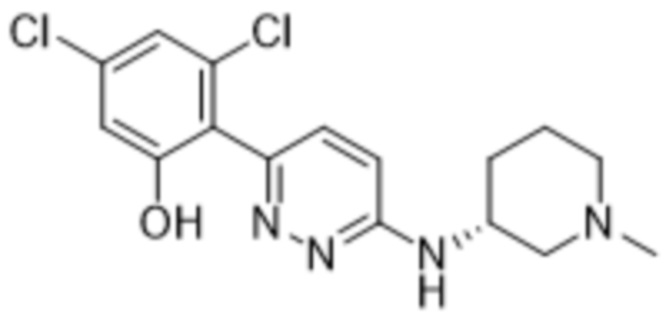
TFA-соль (R)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола
353,2 [M+H]+
и
пром. соед. B018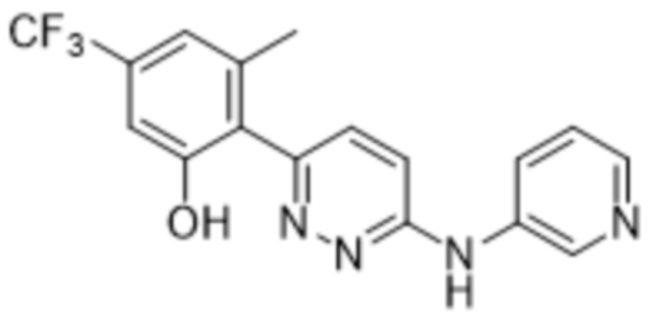
3-Метил-2-(6-(пиридин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенол
346,9 [M+H]+
и
пром. соед. B010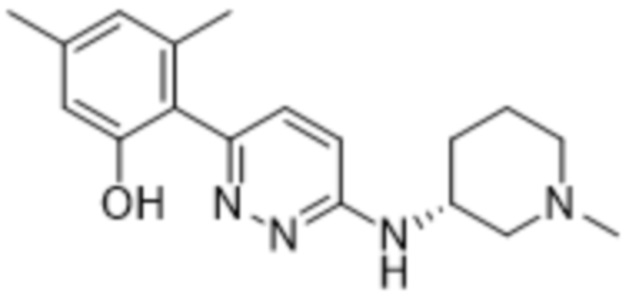
(R)-3,5-Диметил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенол
313,3 [M+H]+
и
пром. соед. B013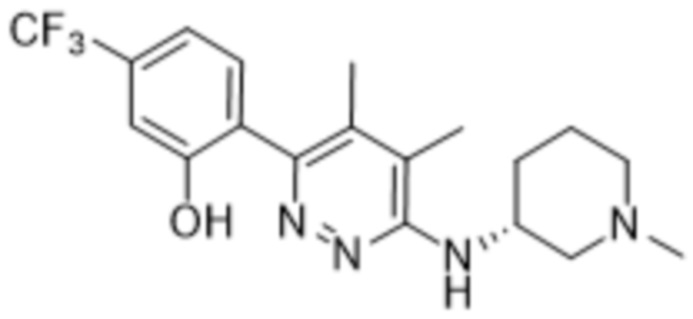
(R)-2-(4,5-Диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
381,3 [M+H]+
и
BCA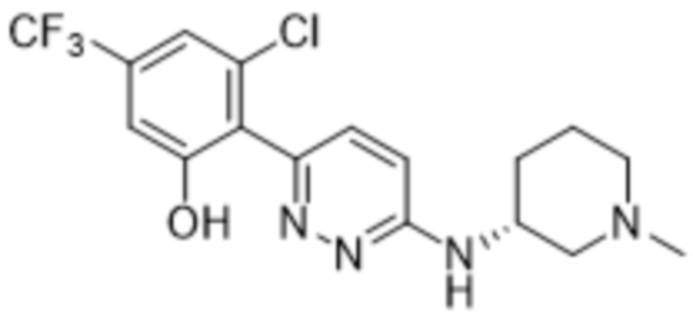
(R)-3-Хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
387,2 [M+H]+
и
пром. соед. B001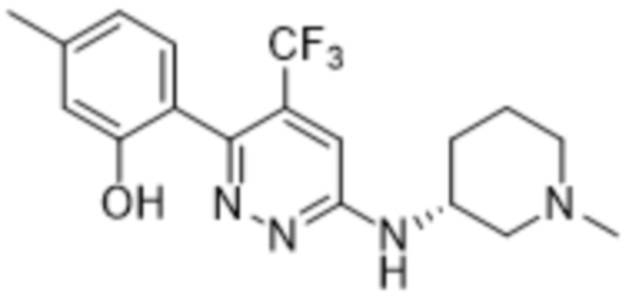
(R)-5-Метил-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенол
367,2 [M+H]+
и
коммерч.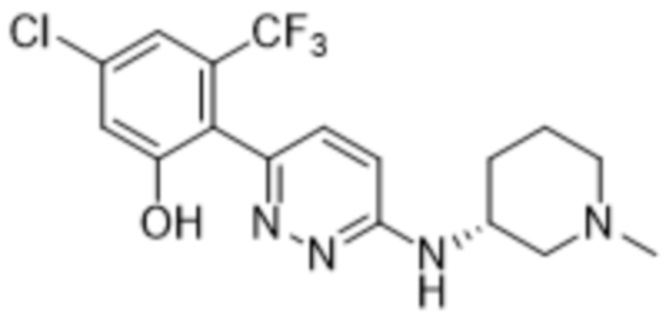
(R)-5-Хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-(трифторметил)фенол
387,3 [M+H]+
и
пром. соед. B001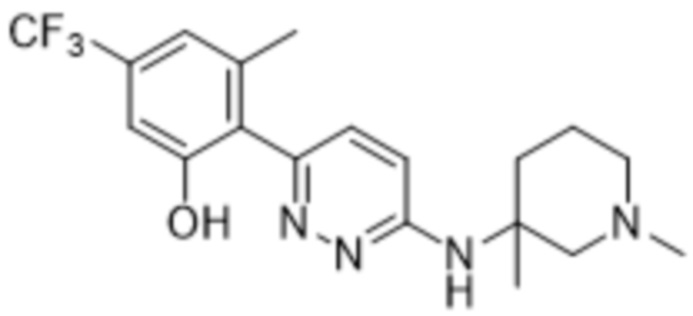
TFA-соль 2-(6-((1,3-диметилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола
381,2 [M+H]+
и
пром. соед. B005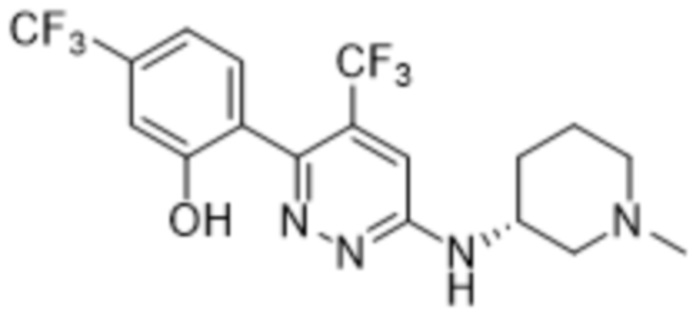
(R)-2-(6-((1-Метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенол
421,1 [M+H]+
и
BCA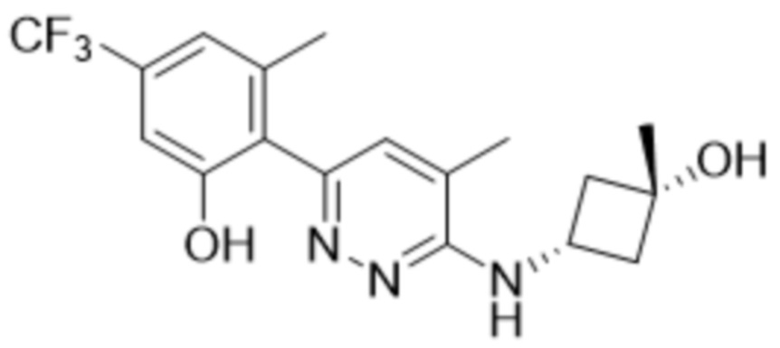
2-(6-(((цис)-3-Гидрокси-3-метилциклобутил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенол
368,2 [M+H]+
и
пром. соед. B010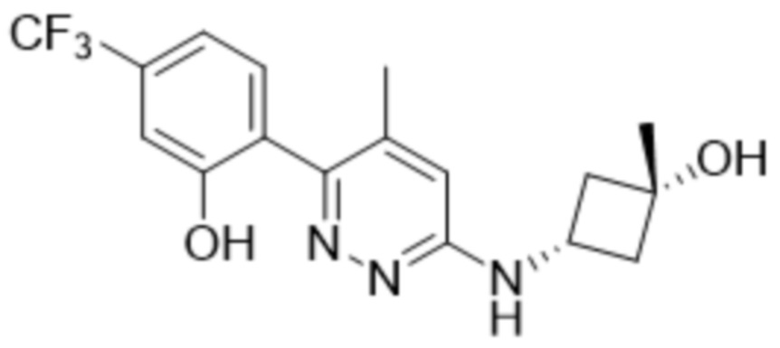
2-(6-(((цис)-3-Гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметил)фенол
354,2 [M+H]+
и
BCA
2-(6-(((цис)-3-Гидрокси-3-метилциклобутил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
422,2 [M+H]+
и
пром. соед. B010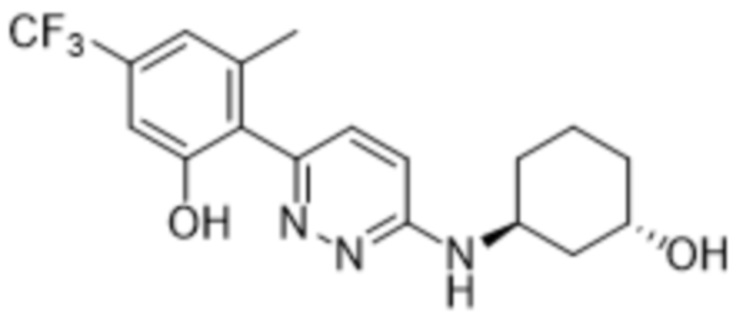
2-(6-(((1S,3S)-3-Гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
368,2 [M+H]+
и
пром. соед. B010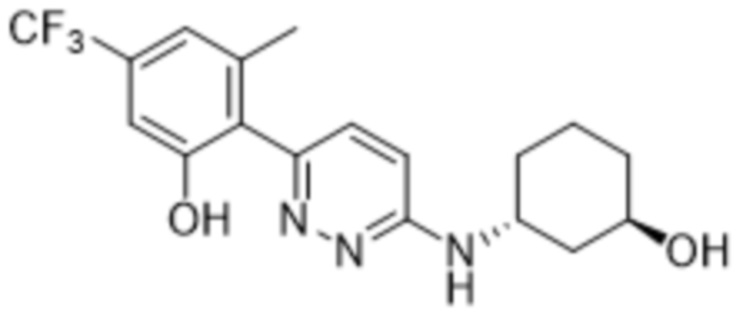
2-(6-(((1R,3R)-3-Гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
368,2 [M+H]+
и
пром. соед. B010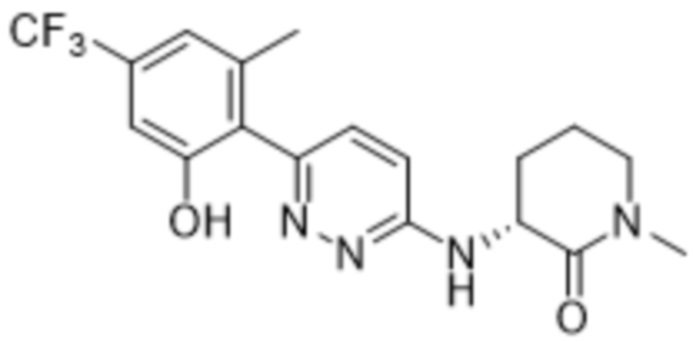
(R)-3-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-2-он
381,2 [M+H]+
и
пром. соед. B010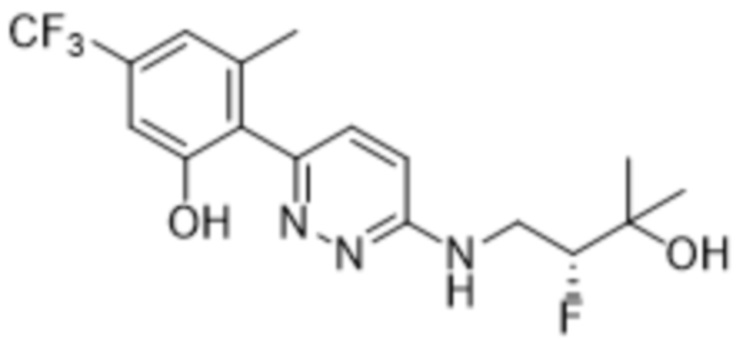
(R)-2-(6-((2-Фтор-3-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
374,2 [M+H]+
и
пром. соед. B010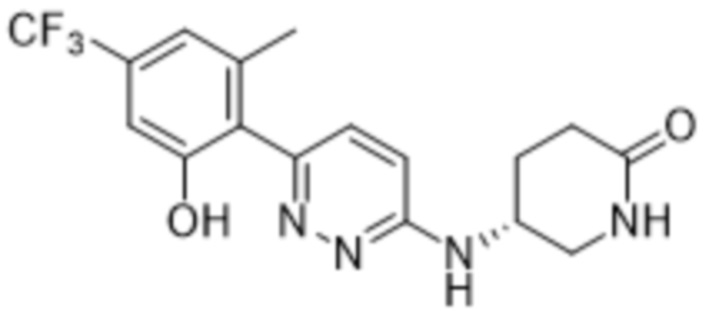
(R)-5-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-он
367,2 [M+H]+
и
пром. соед. B010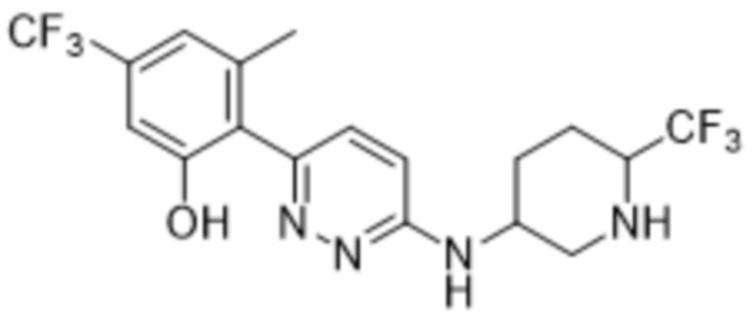
3-Метил-5-(трифторметил)-2-(6-((6-(трифторметил)пиперидин-3-ил)амино)пиридазин-3-ил)фенол
421,3 [M+H]+
и
пром. соед. B010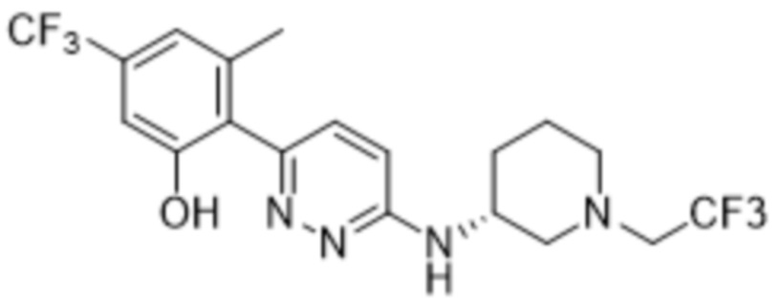
(R)-3-Метил-2-(6-((1-(2,2,2-трифторэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
435,2 [M+H]+
и
пром. соед. B010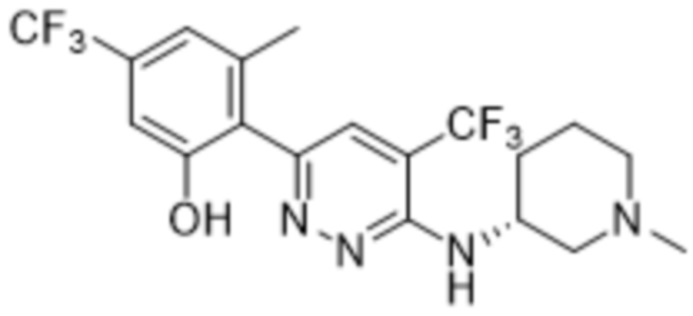
(R)-3-Метил-2-(6-((1-метилпиперидин-3-ил)амино)-5-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенол
435,3 [M+H]+
и
пром. соед. B010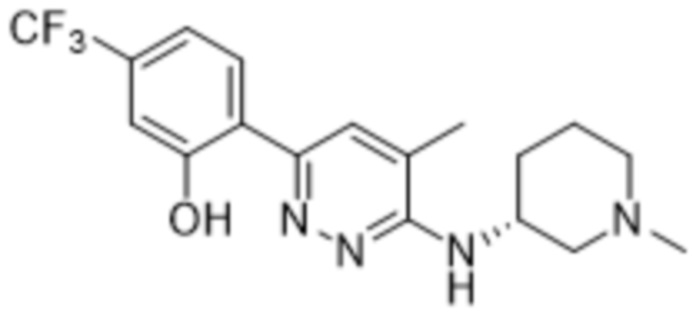
(R)-2-(5-Метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
367,3 [M+H]+
и
BCA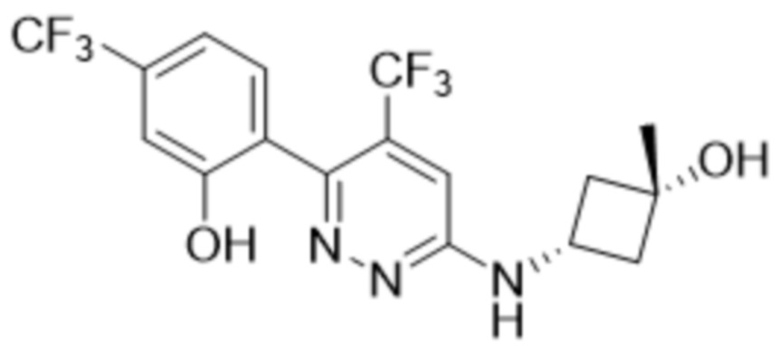
2-(6-(((цис)-3-Гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенол
408,2 [M+H]+
и
BCA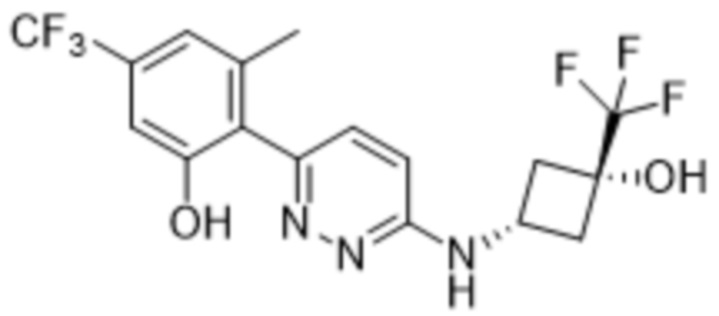
2-(6-(((цис)-3-Гидрокси-3-(трифторметил)циклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
408,2 [M+H]+
и
пром. соед. B005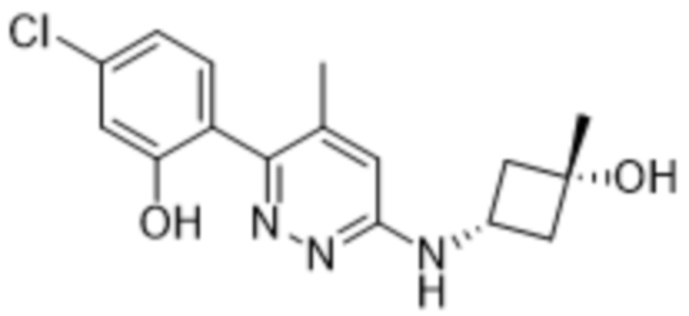
5-Хлор-2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)фенол
320,1 [M+H]+
и
BCA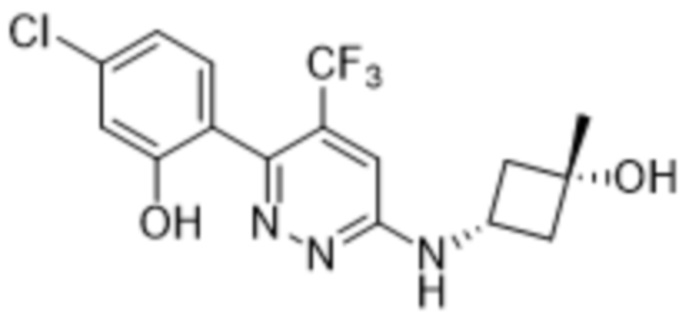
5-Хлор-2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)фенол
374,1 [M+H]+
и
BCA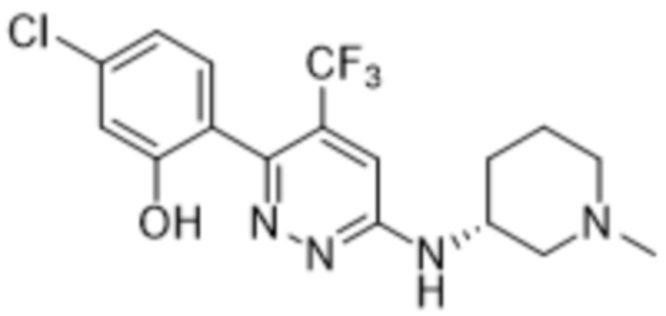
(R)-5-Хлор-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенол
387,2 [M+H]+
и
BCA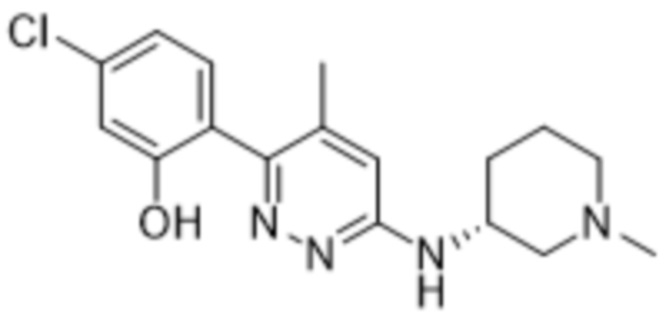
(R)-5-Хлор-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенол
333,2 [M+H]+
и
BCA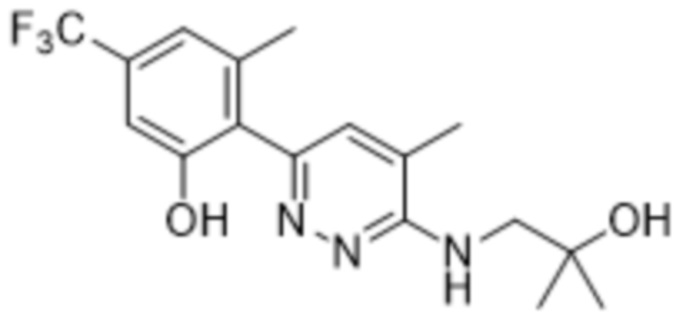
2-(6-((2-Гидрокси-2-метилпропил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенол
356,2 [M+H]+
и
пром. соед. B010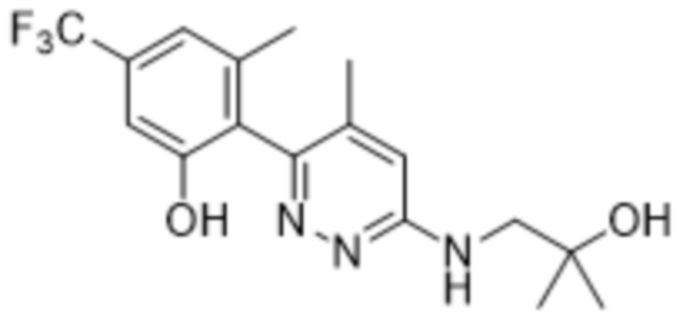
2-(6-((2-Гидрокси-2-метилпропил)амино)-4-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенол
356,3 [M+H]+
и
пром. соед. B005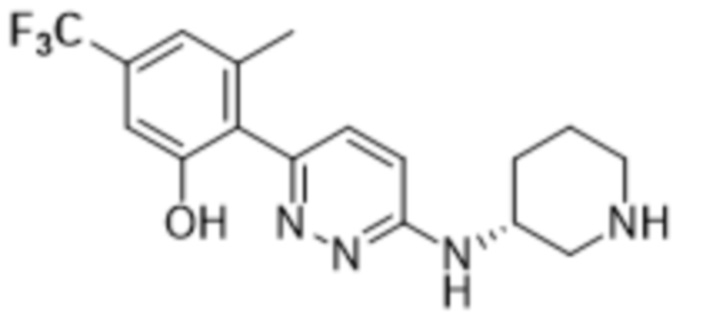
(R)-3-Метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенол
353,3 [M+H]+
и
пром. соед. B010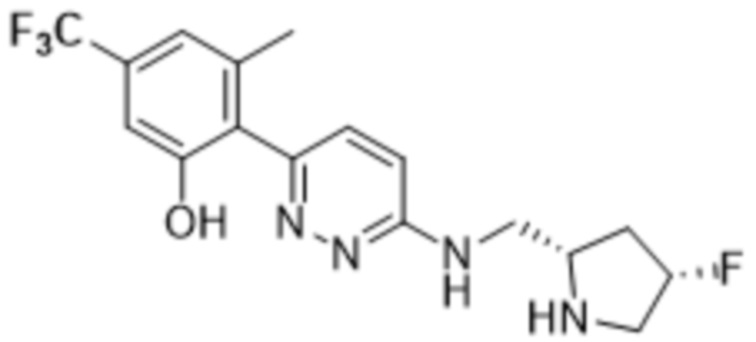
2-(6-((((2S,4S)-4-Фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
371,3 [M+H]+
и
пром. соед. B010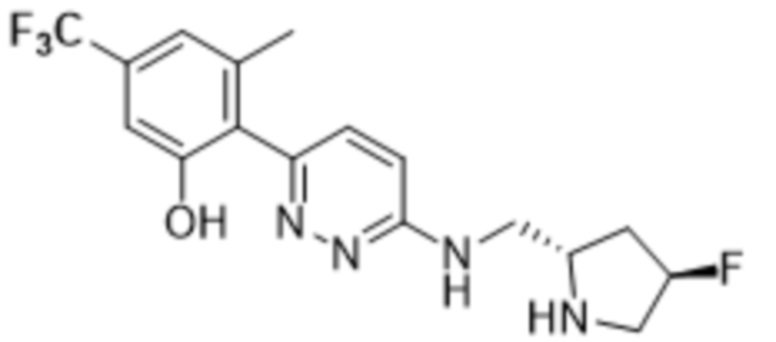
2-(6-((((2S,4R)-4-Фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
371,3 [M+H]+
и
пром. соед. B010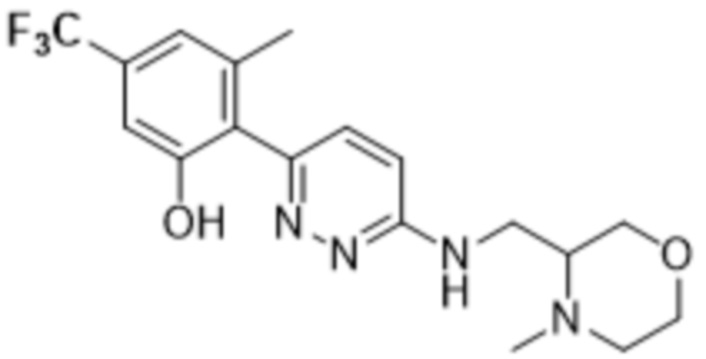
(рац)-3-Метил-2-(6-(((4-метилморфолин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
383,3 [M+H]+
и
пром. соед. B010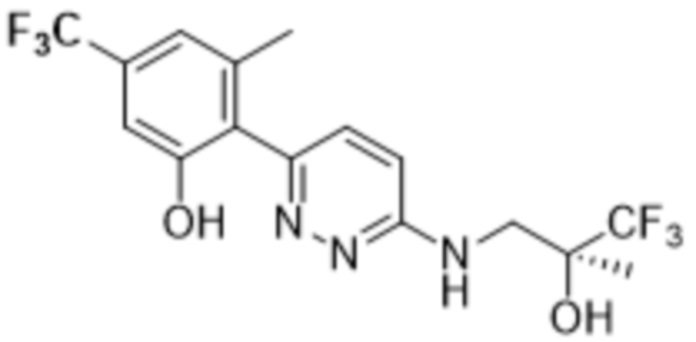
HCl-соль (S)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола
396,3 [M+H]+
и
пром. соед. B010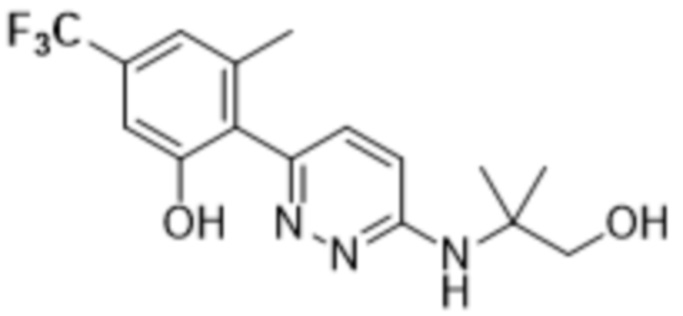
2-(6-((1-Гидрокси-2-метилпропан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
342,3 [M+H]+
и
пром. соед. B010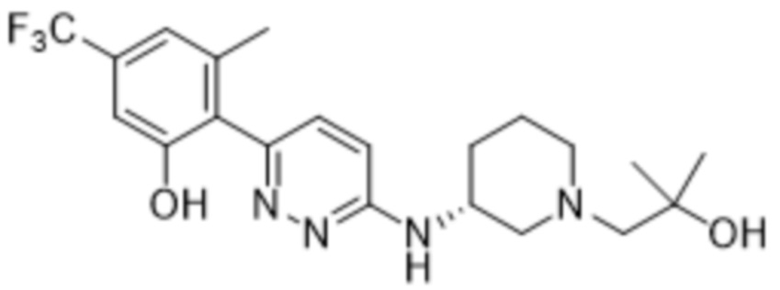
(R)-2-(6-((1-(2-Гидрокси-2-метилпропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
425,3 [M+H]+
и
пром. соед. B010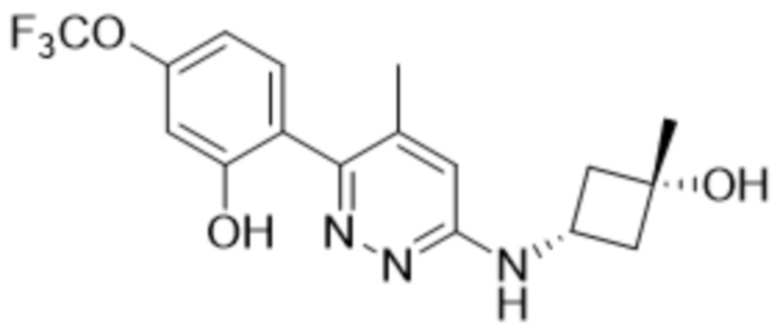
2-(6-(((цис)-3-Гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметокси)фенол
370,1 [M+H]+
и
BCA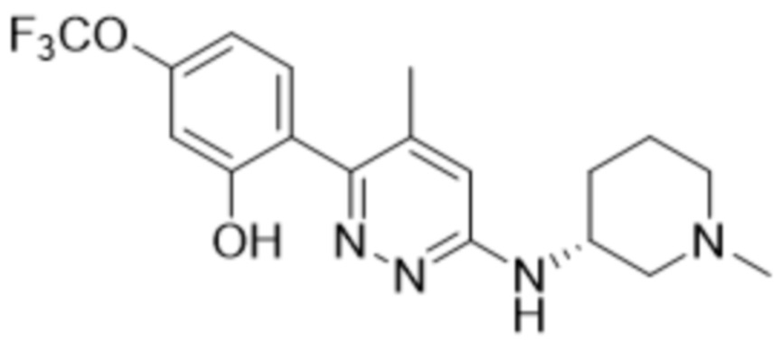
(R)-2-(4-Метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметокси)фенол
383,1 [M+H]+
и
BCA
Следующие примеры, от пр. 083(A/B) до пр. 096 (A/B), получали в виде рацематов в соответствии с процедурами, аналогичными примеру пр. 001, с применением соответствующего амина и бороната, определенных в данном документе, с последующей стадией разделения с помощью хиральной хроматографии.
Пример пр. 083A и пр. 083B
3-Метил-2-(6-(((8R,8aR)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол и 3-метил-2-(6-(((8S,8aS)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
Рацемат (рац)-3-метил-2-(6-(((8r,8ar)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола (полученный как описано для примера пр. 001, начиная с пром. соед. P041 и пром. соед. B010) разделяли с помощью хиральной хроматографии с нормальной фазой (колонка: Chiralpak AD, 250×30 мм, 5 мкм; к. т., элюент: н-гептан:EtOH=90:10 +0,05% DEA; скорость потока: 20 мл/мин; время цикла: 15 мин) с получением двух энантиомеров, представляющих собой пр. 083A (первое элюирование, Rt=25 мин) и пр. 083B (второе элюирование, Rt=31 мин) соответственно.
Пр. 083A 1H ЯМР (400 МГц, DMSO-d6) δ 10,14 (s, 1H), 7,21 (d, 1H), 7,12-7,08 (m, 1H), 7,07-7,02 (m, 1H), 6,88-6,75 (m, 2H), 3,96-3,77 (m, 1H), 3,29-3,20 (m, 2H), 3,13-2,93 (m, 2H), 2,16-2,09 (m, 4H), 2,05-1,88 (m, 2H), 1,72-1,45 (m, 5H), 1,17-1,04 (m, 1H). LC-MS: Rt=0,73 мин; MS масса/заряд 393,2 [M+H]+
Пр. 083B 1H ЯМР (600 МГц, DMSO-d6) δ 10,19 (s, 1H), 7,23 (d, 1H), 7,11 (s, 1H), 7,06 (s, 1H), 6,96-6,76 (m, 2H), 3,99-3,82 (m, 1H), 3,34-3,28 (m, 2H), 3,17-3,02 (m, 2H), 2,19-2,11 (m, 4H), 2,03-1,87 (m, 2H), 1,77-1,49 (m, 5H), 1,20-1,13 (m, 1H). LC-MS: Rt=0,73 мин; MS масса/заряд 393,2 [M+H]+
Пример пр. 084A и пр. 084B
(R)-2-(6-(((1-(2-Гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол и (S)-2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Рацемат 2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола (полученный как описано для примера пр. 001, начиная с пром. соед. P044 и пром. соед. B010) разделяли с помощью хиральной хроматографии с нормальной фазой (колонка: Chiralpak AD, 250×30 мм, 5 мкм; к. т., элюент: н-гептан:EtOH=80:20 +0,05% DEA; скорость потока: 20 мл/мин; время цикла: 30 мин) с получением двух энантиомеров, представляющих собой пр. 084A (первое элюирование, Rt=15 мин) и пр. 084B (второе элюирование, Rt=23,5 мин) соответственно.
Пр. 084A 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,15 (s, 1H), 7,22 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,93 (d, 1H), 6,70 (s, 1H), 4,51-4,38 (m, 1H), 3,68-3,57 (m, 2H), 3,56-3,47 (m, 2H), 3,44-3,34 (m, 1H), 2,97-2,77 (m, 2H), 2,37-2,23 (m, 1H), 2,13 (s, 3H), 1,70-1,62 (m, 2H), 1,57-1,41 (m, 4H). LC-MS: Rt=0,72 мин; MS масса/заряд 411,3 [M+H]+
Пр. 084B 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,15 (s, 1H), 7,22 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,93 (d, 1H), 6,70 (s, 1H), 4,51-4,38 (m, 1H), 3,68-3,57 (m, 2H), 3,56-3,47 (m, 2H), 3,44-3,34 (m, 1H), 2,97-2,77 (m, 2H), 2,37-2,23 (m, 1H), 2,13 (s, 3H), 1,70-1,62 (m, 2H), 1,57-1,41 (m, 4H). LC-MS: Rt=0,72 мин; MS масса/заряд 411,3 [M+H]+
Пример пр. 085A и пр. 085B
3-Метил-2-(6-(((1S,2S,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол (пр. 085A) и
3-метил-2-(6-(((1R,2R,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол (пр. 085B)
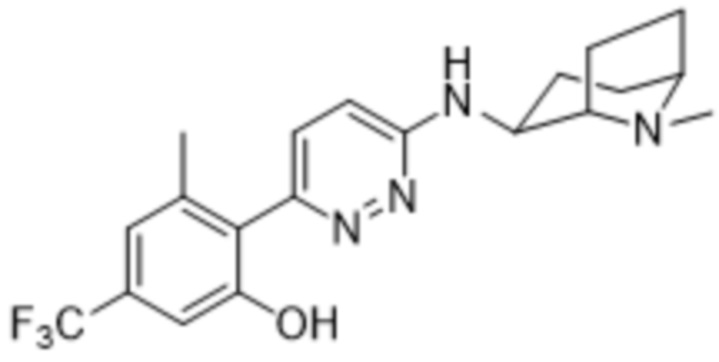 (85A) и
(85A) и 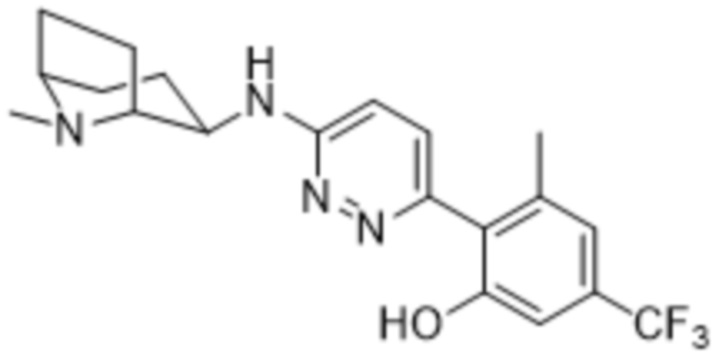 (85B)
(85B)
Рацемический продукт (полученный как описано для примера пр. 001, начиная с пром. соед. P048 и пром. соед. B010) разделяли с помощью хиральной хроматографии с нормальной фазой (колонка: Chiralpak IG, 250×30 мм, 5 мкм; 40°C, элюент: н-гептан:i-PrOH=70:30 +0,1% аммиака; скорость потока: 80 мл/мин; давление: 120 бар, время цикла: 20 мин) с получением двух энантиомеров, представляющих собой пр. 085A (первое элюирование, Rt=7 мин) и пр. 085B (второе элюирование, Rt=11,9 мин) соответственно. Стереохимию определяли с помощью рентгеноструктурной кристаллографии.
Пр. 085A 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,16 (s, 1H), 7,21 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,82 (d, 1H), 6,75 (br d, 1H), 4,13-4,04 (m, 1H), 3,28-3,21 (m, 1H), 3,06-3,0 (m, 1H), 2,20 (s, 3H), 2,13 (s, 3H), 2,05-1,94 (m, 1H), 1,86-1,61 (m, 4H), 1,55-1,29 (m, 3H). LC-MS: Rt=0,71 мин; MS масса/заряд 393,2 [M+H]+
Пр. 085B 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,21 (s, 1H), 7,21 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,82 (d, 1H), 6,75 (br d, 1H), 4,12-4,04 (m, 1H), 3,26-3,22 (m, 1H), 3,06-3,0 (m, 1H), 2,20 (s, 3H), 2,13 (s, 3H), 2,01-1,92 (m, 1H), 1,80-1,61 (m, 4H), 1,48-1,28 (m, 3H). LC-MS: Rt=0,71 мин; MS масса/заряд 393,2 [M+H]+
Пример пр. 086A и пр. 086B
2-(6-(((1R,2R,5R)-8-(2-Гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол (пр. 086B) и
2-(6-(((1S,2S,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол (пр. 086A)
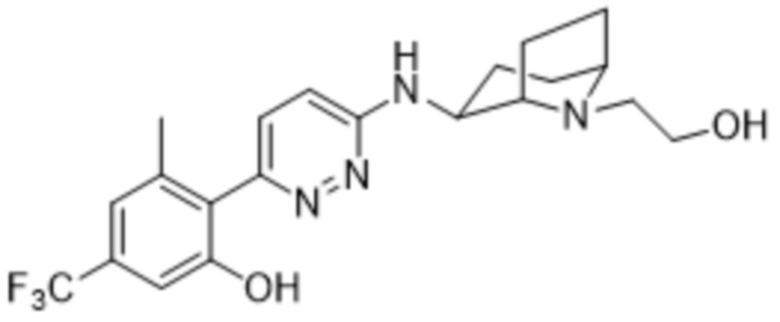 (86A) и
(86A) и
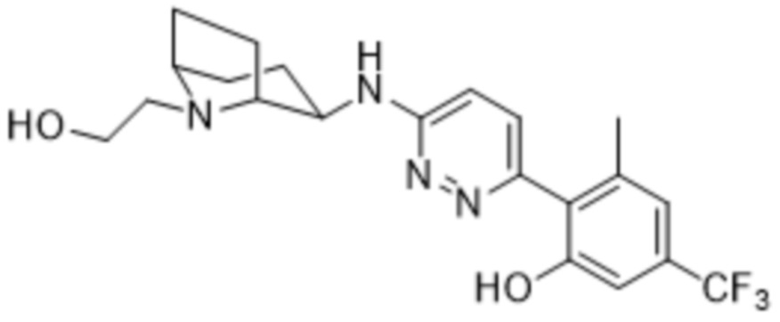 (86B)
(86B)
Рацемат 2-(6-((-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола (полученный как описано для примера пр. 001, начиная с пром. соед. P050 и пром. соед. B010) разделяли с помощью хиральной SFC (колонка: Chiralpak IG, 250×30 мм, 5 мкм, 40°C, элюент B: i-PrOH 35% +0,1% аммиак; скорость потока: 70 мл/мин; давление: 110 бар, время цикла: 6 мин) с получением двух энантиомеров, представляющих собой пр. 086A (первое элюирование, Rt=5,2 мин) и пр. 086B (второе элюирование, Rt=6,5 мин) соответственно. Стереохимии определяли с помощью ROESY-ЯМР.
Пр. 086A 1H ЯМР (600 МГц, DMSO-d6) δ 10,17 (s, 1H), 7,21 (d, 1H), 7,11 (s, 1H), 7,05 (s, 1H), 6,83 (d, 1H), 6,75 (d, 1H), 4,41-4,30 (m, 1H), 4,16-4,04 (m, 1H), 3,52-3,43 (m, 2H), 3,33-3,29 (m, 1H), 3,23-3,15 (m, 1H), 2,47-2,36 (m, 2H), 2,13 (s, 3H), 1,94-1,85 (m, 1H), 1,80-1,61 (m, 4H), 1,49-1,30 (m, 3H). LC-MS: Rt=0,71 мин; MS масса/заряд 423,3 [M+H]+
Пр. 086B 1H ЯМР (600 МГц, DMSO-d6) δ 10,17 (s, 1H), 7,21 (d, 1H), 7,11 (s, 1H), 7,05 (s, 1H), 6,83 (d, 1H), 6,75 (d, 1H), 4,41-4,30 (m, 1H), 4,16-4,04 (m, 1H), 3,52-3,43 (m, 2H), 3,33-3,29 (m, 1H), 3,23-3,15 (m, 1H), 2,47-2,36 (m, 2H), 2,13 (s, 3H), 1,94-1,85 (m, 1H), 1,80-1,61 (m, 4H), 1,49-1,30 (m, 3H). LC-MS: Rt=0,71 мин; MS масса/заряд 423,3 [M+H]+
Пример пр. 087A и пр. 087B
2-(6-(((3R,6R)-6-(Гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол и 2-(6-(((3S,6S)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Рацемат 2-(6-((-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола (полученный как описано для примера пр. 001, начиная с пром. соед. P052 и пром. соед. B010) разделяли с помощью хиральной SFC (колонка: Chiralpak IG-LL, 250×30 мм, 5 мкм, 40°C, элюент B: MeOH 22% +0,1% аммиак; скорость потока: 80 мл/мин; давление: 120 бар, время цикла: 20 мин) с получением двух диастереоизомеров, представляющих собой пр. 087A (первое элюирование, Rt=8,2 мин) и пр. 087B (второе элюирование, Rt=11,3 мин) соответственно.
Пр. 087A 1H ЯМР (600 МГц, DMSO-d6) δ 10,19 (s, 1H), 7,22 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 7,02 (d, 1H), 6,72 (d, 1H), 4,44-4,34 (m, 1H), 4,27-4,17 (m, 1H), 3,64-3,56 (m, 1H), 3,48-3,40 (m, 1H), 2,80-2,73 (m, 1H), 2,44-2,37 (m, 1H), 2,27 (s, 3H), 2,13 (s, 3H), 2,07-1,98 (m, 1H), 1,86-1,78 (m, 1H), 1,66-1,52 (m, 3H). LC-MS: Rt=0,71 мин; MS масса/заряд 423,3 [M+H]+
Пр. 087B 1H ЯМР (600 МГц, DMSO-d6) δ 10,19 (s, 1H), 7,22 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 7,02 (d, 1H), 6,72 (d, 1H), 4,45-4,33 (m, 1H), 4,26-4,15 (m, 1H), 3,64-3,55 (m, 1H), 3,50-3,40 (m, 1H), 2,81-2,72 (m, 1H), 2,44-2,36 (m, 1H), 2,27 (s, 3H), 2,13 (s, 3H), 2,07-1,99 (m, 1H), 1,86-1,78 (m, 1H), 1,68-1,51 (m, 3H). LC-MS: Rt=0,71 мин; MS масса/заряд 423,3 [M+H]+
Пример пр. 088A и пр. 088B
(S)-3-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диол и (R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диол
Рацемат 3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола (полученный как описано для примера пр. 001, начиная с пром. соед. P053 и пром. соед. B010) разделяли с помощью хиральной SFC (колонка: Chiralpak IG, 250×30 мм, 5 мкм, 40°C, элюент B: MeOH 25% +0,1% аммиак; скорость потока: 80 мл/мин; давление: 120 бар, время цикла: 20 мин) с получением двух энантиомеров, представляющих собой пр. 088A (первое элюирование, Rt=8,7 мин) и пр. 088B (второе элюирование, Rt=13,8 мин) соответственно.
Пр. 088A 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,19 (s, 1H), 7,24 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 7,02 (d, 1H), 6,88-6,83 (m, 1H), 4,99-4,92 (m, 1H), 4,77 (s, 1H), 3,44-3,37 (m, 2H), 3,32-3,27 (m, 1H), 3,24-3,18 (m, 1H), 2,12 (s, 3H), 1,11 (s, 3H). LC-MS: Rt=0,7 мин; MS масса/заряд 358,1 [M+H]+
Пр. 088B 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,17 (s, 1H), 7,24 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 7,02 (d, 1H), 6,90-6,82 (m, 1H), 4,99-4,92 (m, 1H), 4,77 (s, 1H), 3,43-3,37 (m, 2H), 3,32-3,26 (m, 1H), 3,24-3,18 (m, 1H), 2,12 (s, 3H), 1,11 (s, 3H). LC-MS: Rt=0,7 мин; MS масса/заряд 358,1 [M+H]+
Пример пр. 089A и пр. 089B
(1S,2R,3S)-3-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диол и (1R,2S,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диол
Рацемат 3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола (полученный как описано для примера пр. 001, начиная с пром. соед. P054 и пром. соед. B010) разделяли с помощью хиральной SFC (колонка: i-LuxCel (IC), 250×30 мм, 5 мкм; элюент B: MeOH 15% +0,1% аммиак; скорость потока: 80 мл/мин; время цикла: 30 мин) с получением двух диастереоизомеров, представляющих собой пр. 089A (первое элюирование, Rt=14,3 мин) и пр. 089B (второе элюирование, Rt=22,2 мин) соответственно.
Пр. 089A 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,18 (s, 1H), 7,24 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 7,02 (d, 1H), 6,89 (d, 1H), 5,11 (d, 1H), 4,43 (d, 1H), 4,19-4,05 (m, 1H), 3,98-3,91 (m, 1H), 3,74-3,66 (m, 1H), 2,29-2,19 (m, 1H), 2,13 (s, 3H), 1,95-1,83 (m, 1H), 1,63-1,52 (m, 1H), 1,42-1,32 (m, 1H). LC-MS: Rt=0,7 мин; MS масса/заряд 370,3 [M+H]+
Пр. 089B 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,19 (s, 1H), 7,24 (d, 1H), 7,10 (s, 1H), 7,06-6,98 (m, 2H), 6,89 (d, 1H), 5,11 (d, 1H), 4,43 (d, 1H), 4,16-4,05 (m, 1H), 3,98-3,90 (m, 1H), 3,76-3,68 (m, 1H), 2,28-2,18 (m, 1H), 2,13 (s, 3H), 1,95-1,85 (m, 1H), 1,63-1,52 (m, 1H), 1,42-1,32 (m, 1H). LC-MS: Rt=0,7 мин; MS масса/заряд 370,3 [M+H]+
Пример пр. 090A и пр. 090B
(S)-2-(6-((2-Гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол и (R)-2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Рацемат 2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола (полученный как описано для примера пр. 001, начиная с пром. соед. P056 и пром. соед. B010) разделяли с помощью хиральной SFC (колонка: Chiralpak IB-N, 250×30 мм, 5 мкм, 40°C, элюент B: i-PrOH 23% +0,1% аммиак; скорость потока: 80 мл/мин; давление: 120 бар, время цикла: 20 мин) с получением двух энантиомеров, представляющих собой пр. 090A (первое элюирование, Rt=9,6 мин) и пр. 090B (второе элюирование, Rt=13 мин) соответственно.
Пр. 090A 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,18 (s, 1H), 7,22 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,94 (d, 1H), 6,83 (t, 1H), 4,82 (d, 1H), 3,59-3,52 (m, 1H), 3,49-3,43 (m, 1H), 3,27-3,21 (m, 1H), 2,12 (s, 3H), 1,76-1,66 (m, 1H), 0,96-0,89 (m, 6H). LC-MS: Rt=0,85 мин; MS масса/заряд 356,2 [M+H]+
Пр. 090B 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,17 (s, 1H), 7,22 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,94 (d, 1H), 6,83 (t, 1H), 4,82 (d, 1H), 3,58-3,50 (m, 1H), 3,50-3,42 (m, 1H), 3,28-3,21 (m, 1H), 2,12 (s, 3H), 1,77-1,67 (m, 1H), 0,96-0,89 (m, 6H). LC-MS: Rt=0,85 мин; MS масса/заряд 356,2 [M+H]+
Пример пр. 091A и пр. 091B
3-Метил-2-(6-(((2S,3S)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол и 3-метил-2-(6-(((2R,3R)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенол
Рацемат 3-метил-2-(6-((2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола (полученный как описано для примера пр. 001, начиная с пром. соед. P099 и пром. соед. B010) разделяли с помощью хиральной SFC (колонка: Lux i-Cellulose 5, 250 × 30 мм, 5 мкм, 40°C, элюент B: MeOH 23% + 0,1% NH3, скорость потока: 80 мл/мин, давление: 120 бар, время цикла: 20 мин) с получением указанных в заголовке соединений, представляющих собой пр. 091A (первое элюирование, Rt=9,17 мин) и пр. 091B (второе элюирование, Rt=12,01 мин) соответственно.
Пр. 091A 1H ЯМР (400 МГц, CD3OD) δ (ppm) 7,34 (d, 1H), 7,08 (s, 1H), 7,01-7,03 (m, 2H), 4,27-4,22 (m, 1H), 3,18-3,12 (m, 1H), 3,10-3,03 (m, 1H), 2,81-2,73 (m, 1H), 2,21 (s, 3H), 2,08-2,01 (m, 1H), 1,75-1,70 (m, 2H), 1,59-1,53 (m, 1H), 1,15 (d, 3H). LC-MS: Rt=0,73 мин; MS масса/заряд 367,1 [M+H]+
Пр. 091B 1H ЯМР (400 МГц, CD3OD) δ (ppm) 7,35 (d, 1H), 7,07 (s, 1H), 7,05-7,01 (m, 2H), 4,27-4,21 (m, 1H), 3,18-3,12 (m, 1H), 3,11-3,02 (m, 1H), 2,81-2,72 (m, 1H), 2,21 (s, 3H), 2,10-1,99 (m, 1H), 1,78-1,68 (m, 2H), 1,61-1,51 (m, 1H), 1,16 (d, 3H) LC-MS: Rt=0,73 мин; MS масса/заряд 367,1 [M+H]+
Пример пр. 092A и пр. 092B
2-(6-(((R)-1-((S)-2-Гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол и 2-(6-(((R)-1-((R)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Смесь диастереомеров 2-(6-(((3R)-1-(2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола (полученную как описано для примера пр. 001, начиная с пром. соед. P105 и пром. соед. B010) разделяли с помощью хиральной SFC (колонка: ChiralPak AD, 250 × 30 мм, 5 мкм, 40°C, элюент B: EtOH 25% + 0,1% NH3, скорость потока: 80 мл/мин, давление: 120 бар, время цикла: 20 мин) с получением указанных в заголовке соединений, представляющих собой пр. 092A (первое элюирование, Rt=8,7 мин) и пр. 092B (второе элюирование, Rt=12,0 мин) соответственно.
Пр. 092A 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,14 (s, 1H), 7,22 (d, 1H), 7,10 (s, 1H), 7,05 (s, 1H), 6,88 (d, 1H), 6,79 (d, 1H), 4,32-4,26 (m, 1H), 4,14-4,06 (m, 1H), 3,80-3,72 (m, 1H), 3,48-3,40 (m, 1H), 2,95-2,87 (m, 1H), 2,28-2,16 (m, 3H), 2,12 (s, 3H), 1,86-1,78 (m, 1H), 1,76-1,67 (m, 1H), 1,58-1,47 (m, 1H), 1,43-1,34 (m, 1H), 1,03 (d, 3H). LC-MS: Rt=0,73 мин; MS масса/заряд 411,2 [M+H]+
Пр. 092B 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,14 (s, 1H), 7,22 (d, 1H), 7,10 (s, 1H), 7,05 (s, 1H), 6,88 (d, 1H), 6,79 (d, 1H), 4,29-4,24 (m, 1H), 4,14-4,06 (m, 1H), 3,80-3,72 (m, 1H), 3,48-3,40 (m, 1H), 2,95-2,87 (m, 1H), 2,29-2,16 (m, 3H), 2,13 (s, 3H), 1,88-1,78 (m, 1H), 1,76-1,67 (m, 1H), 1,61-1,48 (m, 1H), 1,42-1,31 (m, 1H), 1,04 (d, 3H) LC-MS: Rt=0,73 мин; MS масса/заряд 411,2 [M+H]+
Пример пр. 093A и пр. 093B
2-(6-(((3S,5S)-5-Фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол и 2-(6-(((3R,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Смесь диастереомеров 2-(6-((5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола (полученная как описано для примера пр. 003, начиная с пром. соед. P102 и пром. соед. B005) разделяли с помощью хиральной SFC (колонка: Lux i-Cellulose-5, 250 × 30 мм, 5 мкм, 40°C, элюент B: 33% [iPrOH+0,1% NH3], скорость потока: 80 мл/мин, давление: 120 бар, время цикла: 20 мин) с получением указанных в заголовке соединений, представляющих собой пр. 093A (первое элюирование, Rt=6,9 мин) и пр. 093B (второе элюирование, Rt=11,5 мин) соответственно.
Пр. 093A 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,17 (s, 1H), 7,23 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,85 (d, 1H), 6,81 (d, 1H), 4,89-4,72 (m, 1H), 4,25-4,15 (m, 1H), 3,12-3,05 (m, 1H), 2,94-2,84 (m, 1H), 2,82-2,68 (m, 1H), 2,44-2,35 (m, 2H), 2,24-2,13 (m, 1H), 2,13 (s, 3H), 1,86-1,68 (m, 1H); LC-MS: Rt=0,85 мин; MS масса/заряд 371,2 [M+H]+
Пр. 093B 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,14 (s, 1H), 7,24 (d, 1H), 7,10 (s, 1H), 7,05 (s, 1H), 6,85 (d, 1H), 6,82 (d, 1H), 4,93-4,75 (m, 1H), 4,28-4,18 (m, 1H), 3,16-3,10 (m, 1H), 2,99-2,90 (m, 1H), 2,86-2,71 (m, 1H), 2,49-2,40 (m, 2H), 2,26-2,15 (m, 1H), 2,13 (s, 3H), 1,88-1,70 (m, 1H); LC-MS: Rt=0,85 мин; MS масса/заряд 371,2 [M+H]+
Пример пр. 094A и пр. 094B
2-(6-(((3S,5S)-5-Фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол и 2-(6-(((3R,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Смесь диастереомеров 2-(6-((5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола получали следующим образом: рац-пр. 093A/B (40 мг, 0,10 ммоль) растворяли в THF и добавляли формальдегид (0,038 мл, 0,51 ммоль, 37% в воде). Добавляли NaBH(OAc)3 (43 мг, 0,205 ммоль) и полученную смесь перемешивали при к. т. в течение 1 ч. Добавляли дополнительное количество формальдегида (0,038 мл, 0,51 ммоль, 37% в воде), NaBH(OAc)3 (43 мг, 0,205 ммоль) и AcOH (1 каплю). После перемешивания в течение дополнительных 2 ч. реакционную смесь гасили путем добавления раствора NaHCO3 и экстрагировали с помощью EtOAc. Объединенные органические фазы промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали под вакуумом. Остаток очищали с помощью aхиральной RP-хроматографии. Фракции, содержащие чистый продукт, объединяли и переносили в условия с pH 8-9 с применением насыщенного раствора NaHCO3, затем дважды экстрагировали с помощью EtOAc. Органические фазы высушивали над Na2SO4, фильтровали и концентрировали под вакуумом. Дистереомерные продукты разделяли с помощью хиральной SFC (колонка: Lux i-Cellulose-5, 250 × 30 мм, 5 мкм, 40°C, элюент B: 33% [iPrOH+ 0,1% NH3], скорость потока: 80 мл/мин, давление: 120 бар, время цикла: 20 мин) с получением указанных в заголовке соединений, представляющих собой пр. 094A (первое элюирование, Rt=3,99 мин) и пр. 094B (второе элюирование, Rt=4,52 мин) соответственно.
Пр. 094A 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,18 (s, 1H), 7,24 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,88-6,84 (m, 1H), 5,02-4,84 (m, 1H), 4,42-4,33 (m, 1H), 2,93-2,86 (m, 1H), 2,80-2,70 (m, 1H), 2,37-2,24 (m, 1H), 2,22 (s, 3H), 2,12 (s, 3H), 2,12-2,03 (m, 1H), 2,01-1,93 (m, 1H), 1,77-1,58 (m, 1H). LC-MS: Rt=0,86 мин; MS масса/заряд 385,2 [M+H]+
Пр. 094B 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,19 (s, 1H), 7,24 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,88-6,84 (m, 1H), 5,02-4,84 (m, 1H), 4,42-4,33 (m, 1H), 2,93-2,86 (m, 1H), 2,80-2,70 (m, 1H), 2,37-2,24 (m, 1H), 2,22 (s, 3H), 2,12 (s, 3H), 2,12-2,03 (m, 1H), 2,01-1,93 (m, 1H), 1,77-1,58 (m, 1H). LC-MS: Rt=0,86 мин; MS масса/заряд 385,2 [M+H]+
Пример пр. 095A и пр. 095B
2-(6-(((3S,5R)-5-Фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол и 2-(6-(((3R,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Смесь диастереомеров 2-(6-((5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола (полученная как описано для примера пр. 001, начиная с пром. соед. P103 и пром. соед. B005) разделяли с помощью хиральной SFC (колонка: Lux Amylose-1, 250 × 30 мм, 5 мкм, 40°C, элюент B: 17% [iPrOH+ 0,1% NH3], скорость потока: 80 мл/мин, давление: 120 бар, время цикла: 20 мин) с получением указанных в заголовке соединений, представляющих собой пр. 095A (первое элюирование, Rt=13,58 мин) и пр. 095B (второе элюирование, Rt=15,01 мин) соответственно.
Пр. 095A 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,16 (br s, 1H), 7,24 (d, 1H), 7,09 (s, 1H), 7,04 (s, 1H), 6,88 (d, 1H), 6,82 (d, 1H), 4,84-4,63 (m, 1H), 4,20-4,09 (m, 1H), 3,01-2,91 (m, 2H), 2,39-2,30 (m, 1H), 2,26 (s, 3H), 2,12 (s, 3H), 2,10-2,04 (m, 1H), 1,91-1,84 (m, 1H), 1,56-1,44 (m, 1H). LC-MS: Rt=0,83 мин; MS масса/заряд 385,3 [M+H]+
Пр. 095B 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,17 (br s, 1H), 7,24 (d, 1H), 7,09 (s, 1H), 7,04 (s, 1H), 6,89 (d, 1H), 6,82 (d, 1H), 4,84-4,63 (m, 1H), 4,20-4,10 (m, 1H), 3,01-2,91 (m, 2H), 2,39-2,32 (m, 1H), 2,26 (s, 3H), 2,12 (s, 3H), 2,10-2,04 (m, 1H), 1,91-1,84 (m, 1H), 1,56-1,44 (m, 1H). LC-MS: Rt=0,83 мин; MS масса/заряд 385,2 [M+H]+
Пример пр. 096A и пр. 096B
2-(6-(((3S,5R)-5-Фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол и 2-(6-(((3R,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Смесь диастереомеров 2-(6-((5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола (полученная как описано для примера пр. 001, начиная с пром. соед. P104 и пром. соед. B005) разделяли с помощью хиральной SFC (колонка: Lux Amylose-1, 250 × 30 мм, 5 мкм, 40°C, элюент B: 40% [MeOH+ 0,1% NH3], скорость потока: 80 мл/мин, давление: 120 бар, время цикла: 20 мин) с получением указанных в заголовке соединений, представляющих собой пр. 096A (первое элюирование, Rt=4,79 мин) и пр. 096B (второе элюирование, Rt=9,34 мин) соответственно.
Пр. 096A 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,16 (br s, 1H), 7,24 (d, 1H), 7,09 (s, 1H), 7,04 (s, 1H), 6,87-6,82 (m, 2H), 4,67-4,46 (m, 1H), 4,04-3,96 (m, 1H), 3,17-3,08 (m, 2H), 2,47-2,37 (m, 2H), 2,25-2,18 (m, 1H), 2,13 (s, 3H), 1,60-1,49 (m, 1H).
LC-MS: Rt=0,82 мин; MS масса/заряд 371,2 [M+H]+
Пр. 096B 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 10,17 (br s, 1H), 7,24 (d, 1H), 7,10 (s, 1H), 7,04 (s, 1H), 6,87-6,82 (m, 2H), 4,67-4,46 (m, 1H), 4,04-3,96 (m, 1H), 3,17-3,08 (m, 2H), 2,47-2,37 (m, 2H), 2,25-2,18 (m, 1H), 2,13 (s, 3H), 1,60-1,49 (m, 1H).
LC-MS: Rt=0,82 мин; MS масса/заряд 371,2 [M+H]+
Пример пр. 097
(3S,5R)-5-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ол
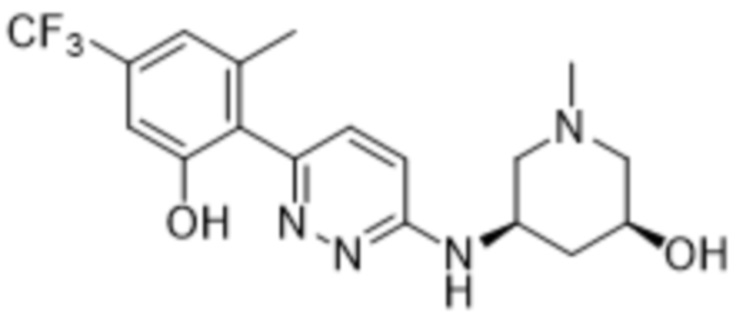
Раствор неочищенного трет-бутил-(3S,5R)-3-гидрокси-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-1-карбоксилата (660 мг, 1,409 ммоль), полученный аналогично примеру пр. 002 с применением промежуточного соединения пром. соед. P043 и бороновой кислоты пром. соед. B005, в 3 мл CH2Cl2 обрабатывали с помощью 4 M HCl в 1,4-диоксане (4,23 мл, 16,91 ммоль) при к. т. в течение 2 ч. Реакционную смесь выпаривали. Полученное твердое вещество растворяли в смеси 2 мл DMSO и 2 мл CH2Cl2 и обрабатывали параформальдегидом (76 мг, 2,52 ммоль). Через 1 ч. добавляли NaBH(OAc)3 (534 мг, 2,52 ммоль) и перемешивание продолжали при к. т. в течение 18 ч. Реакционную смесь выпаривали и неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле с применением CH2Cl2 и MeOH, содержащего 5% аммиака (от 0% до 30%), с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,17 (s, 2H), 7,26 (d, 1H), 7,11 (s, 1H), 7,06 (s, 1H), 6,96-6,89 (m, 1H), 6,86 (d, 1H), 4,20-4,09 (m, 1H), 3,76-3,65 (m, 1H), 3,41-3,29 (m, 1H), 3,37 (s, 3H), 3,26-3,15 (m, 1H), 3,07-2,94 (m, 1H), 2,46-2,32 (s, 3H). LC-MS: Rt=0,61 мин; MS масса/заряд 383,2 [M+H]+.
Пример пр. 098
2-(6-(((1-Гидроксициклопентил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
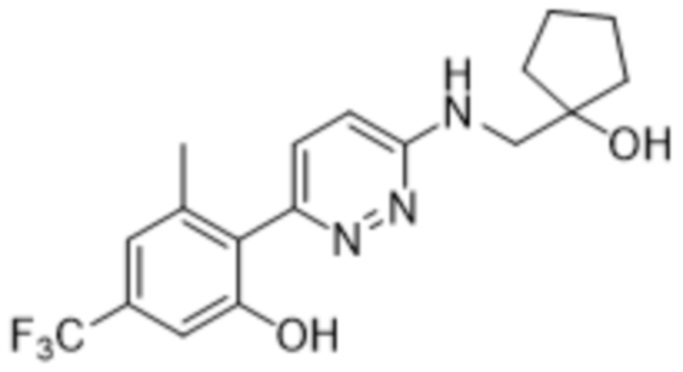
(1) 2-(6-Хлорпиридазин-3-ил)-3-метил-5-(трифторметил)фенол, пром. соед. X109
Смесь пром. соед. B010 (150 мг, 0,497 ммоль), 3,6-дихлорпиридазина (89 мг, 0,596 ммоль), Pd(Ph3P)4 (28,7 мг, 0,025 ммоль) и 2 M Na2CO3 (0,75 мл, 1,5 ммоль) в 3,9 мл 1,4-диоксана продували азотом. Флакон герметично закрывали и нагревали при 120°C в условиях микроволнового облучения в течение 1 ч. Реакционную смесь разбавляли солевым раствором и 3 раза экстрагировали с помощью AcOEt. Объединенные органические слои высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (25 г) с применением циклогексана и EtOAc (от 0% до 50%) с получением указанного в заголовке соединения. 1H ЯМР (600 МГц, DMSO-d6) δ (ppm) 10,43 (s, 1H), 8,02 (d, 1H), 7,85 (d, 1H), 7,19 (s, 1H), 7,10 (s, 1H), 2,11 (s, 3H). LC-MS: Rt=0,95 мин; MS масса/заряд 289,1 [M+H]+
(2) 2-(6-(((1-Гидроксициклопентил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенол
Смесь пром. соед. X109 (95 мг, 0,214 ммоль), 1-(аминометил)циклопентанола (73,9 мг, 0,642 ммоль) и DIPEA (0,112 мл, 0,642 ммоль) в 5 мл NMP нагревали при 150°C в течение 18 ч. Реакционную смесь выпаривали и очищали с помощью SFC (колонка: Reprospher PEI 100A, 250×30 мм, 5 мкм, 40°C, элюент B: 25-35% MeOH за 10 мин, скорость потока: 100 мл/мин, давление: 120 бар) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 8,37 (s, 1H), 7,22 (d, 1H), 7,09 (s, 1H), 7,05 (s, 1H), 7,01 (d, 1H), 6,81-6,71 (m, 1H), 4,66 (s, 1H), 3,49 (d, 2H), 2,13 (s, 3H), 1,79-1,54 (m, 8H). LC-MS: Rt=0,84 мин; MS масса/заряд 368,2 [M+H]+
Пример пр. 099
5-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-он
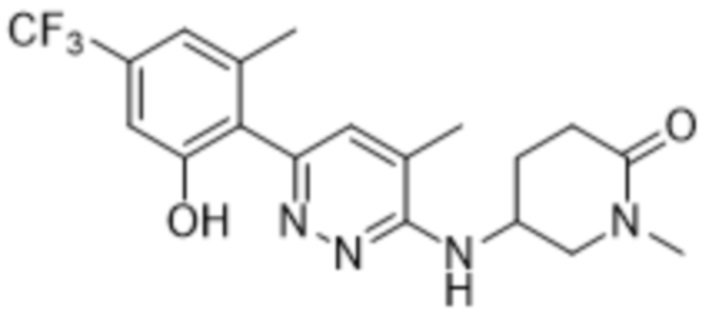
(1) 2-(6-Хлор-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенол, пром. соед. X110
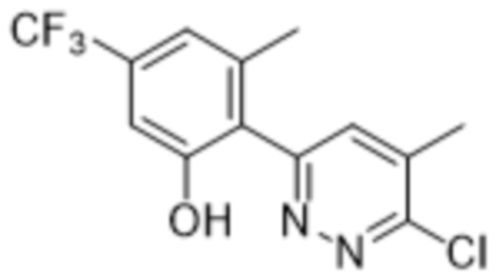
Смесь 3,6-дихлор-4-метилпиридазина (1,60 г, 9,52 ммоль), (2-гидрокси-6-метил-4-(трифторметил)фенил)бороновой кислоты (2,09 г, 9,52 ммоль) и 2 M Na2CO3 (14,28 мл, 28,6 ммоль) в 95 мл 1,4-диоксана продували аргоном в течение 5 мин. Затем добавляли Pd(PPh3)4 (0,66 г, 0,57 ммоль) и смесь перемешивали в атмосфере аргона при 120°C в течение 1 ч. Реакционную смесь гасили водой и солевым раствором (50 мл каждого) и экстрагировали с помощью EtOAc (2×150 мл). Объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали. Неочищенный продукт растирали с 5 мл CH2Cl2 в течение ночи. Полученное твердое вещество собирали с помощью фильтрации, промывали с помощью небольшого количества CH2Cl2 и высушивали с получением указанного в заголовке соединения в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 10,36 (s, 1H), 7,80 (d, 1H), 7,17 (s, 1H), 7,11 (s, 1H), 2,45 (s, 3H), 2,09 (s, 3H). LC-MS: Rt=1,07min, MS масса/заряд 303,0 [M+H]+
(2) 5-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-он
В суспензию пром. соед. X110 (100 мг, 0,330 ммоль) и 5-амино-1-метилпиперидин-2-она (63,5 мг, 0,496 ммоль) в 2 мл толуола добавляли LiOtBu (167 мг, 1,982 ммоль) и PdCl2(dppf) (12,09 мг, 0,017 ммоль). Флакон закрывали и нагревали при 105°C в течение ночи. После охлаждения до к. т. реакционную смесь выливали в воду (30 мл) и экстрагировали с помощью EtOAc (3×50 мл). Объединенные органические экстракты высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (25 г) сначала с применением н-гептана и EtOAc (от 0% до 100%), затем CH2Cl2 и MeOH (от 0% до 30%) с получением указанного в заголовке соединения в виде коричневого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ 10,14 (s, 1H), 7,18-7,15 (m, 1H), 7,10 (s, 1H), 7,06 (s, 1H), 6,16 (d, 1H), 4,68-4,51 (m, 1H), 3,63 (dd, 1H), 3,31-3,25 (m, 1H), 2,83 (s, 3H), 2,42-2,35 (m, 2H), 2,16 (s, 3H), 2,11 (s, 3H), 2,09-1,94 (m, 2H). LC-MS: Rt=0,93 мин; MS масса/заряд 395,3 [M+H]+
Пример пр. 100
(R)-3-Метил-2-(5-метил-6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенол
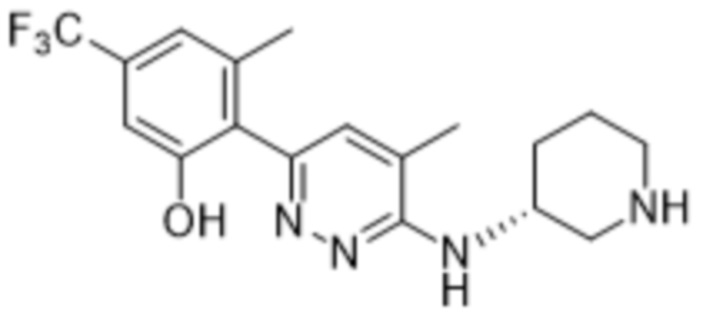
Соединение синтезировали аналогично процедуре, описанной для примера пр. 099, с применением трет-бутил-(R)-3-аминопиперидин-1-карбоксилата на стадии (2) с последующим TFA-опосредованным отщеплением Boc и экстрагированием с помощью NaHCO3 с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,10 (s, 1H), 7,05 (s, 1H), 7,02 (s, 1H), 5,75 (d, 1H), 4,16-4,09 (m, 1H), 3,12 (d, 1H), 2,81 (d, 1H), 2,12 (s, 6H), 1,99-1,91 (m, 1H), 1,70-1,43 (m, 3H), 1,27-1,20 (m, 2H). LC-MS: Rt=0,86 мин; MS масса/заряд 367,1 [M+H]+.
Пример пр. 101
(R)-2-(6-((1-Этилпиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)-фенол
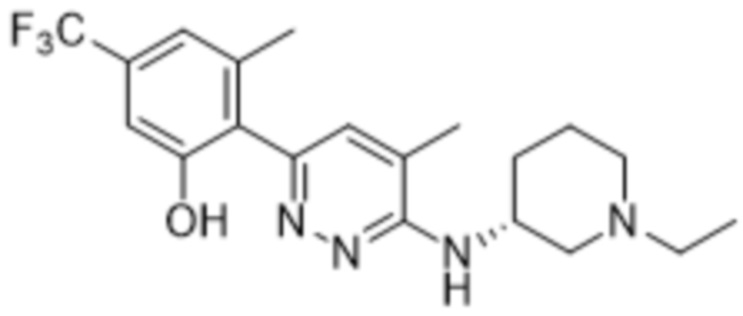
Соединение синтезировали аналогично процедуре, описанной для примера пр. 099, с применением (R)-1-этилпиперидин-3-амина на стадии (2) с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР (400 МГц, MeOH-d4) δ (ppm) 7,26 (s, 1H), 7,09 (s, 1H), 7,02 (s, 1H), 4,56 (s br, 1H), 3,67 (s, 1H), 3,10-3,00 (m, 2H), 2,88-2,66 (m, 2H), 2,26 (s, 3H), 2,17 (s, 3H), 2,12-2,05 (m, 2H), 1,96-1,73 (m, 3H), 1,31 (t, 3H). LC-MS: Rt=0,87 мин; MS масса/заряд 395,2 [M+H]+
Пример пр. 102
(R)-3-((6-(2-Гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-он
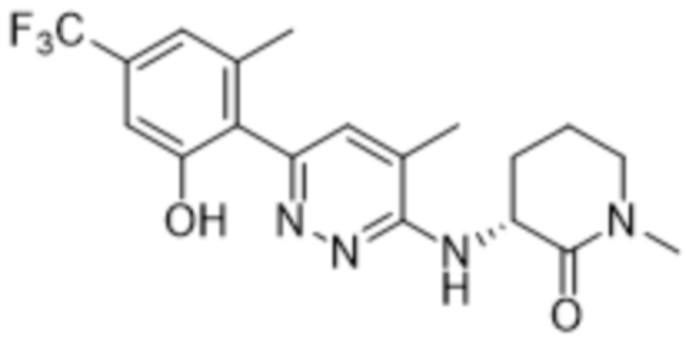
Соединение синтезировали аналогично процедуре, описанной для примера пр. 099, с применением гидрохлорида (R)-3-амино-1-метилпиперидин-2-она на стадии (2) с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 7,15 (s, 1H), 6,92 (s, 1H), 6,85 (s, 1H), 6,25 (d, 1H), 4,73-4,66 (m, 1H), 3,37-3,34 (m, 2H), 2,88 (s, 3H), 2,37-2,30 (m, 1H), 2,10 (s, 3H), 2,08 (s, 3H), 1,96-1,90 (m, 2H), 1,88-1,78 (m, 1H). LC-MS: Rt=0,87 мин; MS масса/заряд 395,2 [M+H]+
Пример пр. 103
4-(2-((6-(2-Гидрокси-4,6-диметилфенил)пиридазин-3-ил)амино)этил)бензолсульфонамид
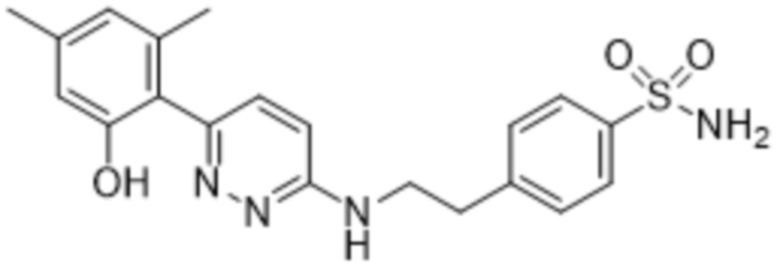
(1) 4-(2-((6-(2-Метокси-4,6-диметилфенил)пиридазин-3-ил)амино)этил), пром. соед. X111
Пром. соед. P101 (400 мг, 1,279 ммоль), пром. соед. B017 (493 мг, 1,918 ммоль) и Pd(Ph3P)4 (148 мг, 0,128 ммоль) растворяли в 10 мл DME. Добавляли 2 M Na2CO3 (1,92 мл, 3,84 ммоль) и реакционную смесь перемешивали при 90°C в течение 22 ч. Реакционную смесь выливали в воду и 3 раза экстрагировали с помощью EtOAc. Объединенные органические экстракты промывали солевым раствором и выпаривали до сухого состояния. Неочищенное вещество очищали с помощью колоночной хроматографии на силикагеле (12 г) с применением CH2Cl2 и MeOH (от 0% до 10%). Фракции, содержащие продукт, выпаривали до сухого состояния и растирали с MeOH с получением указанного в заголовке соединения в виде грязно-белого твердого вещества. LC-MS: Rt=0,80 мин; MS масса/заряд 413,2 [M+H]+
(2) 4-(2-((6-(2-Гидрокси-4,6-диметилфенил)пиридазин-3-ил)амино)этил)бензолсульфонамид
Пром. соед. X111 (65 мг, 0,137 ммоль) суспендировали в 5 мл CH2Cl2, затем добавляли BBr3 (1 M в CH2Cl2, 0,206 мл, 0,206 ммоль). Полученную оранжевую суспензию перемешивали при к. т. в течение 3 ч. Реакционную смесь выпаривали до сухого состояния и остаток очищали с помощью aхиральной RP-хроматографии. Фракции, содержащие чистый продукт, объединяли и переносили в условия с pH 8-9 с применением насыщенного раствора NaHCO3, затем дважды экстрагировали с помощью CH2Cl2. Объединенные органические экстракты выпаривали с получением указанного в заголовке соединения в виде бежевого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 9,46 (s, 1H), 7,78 (d, 2H), 7,49 (d, 2H), 7,31 (s, 2H), 7,20 (d, 1H), 6,96-6,91 (m, 1H), 6,84 (d, 1H), 6,60-6,55 (m, 2H), 3,74-3,57 (m, 2H), 3,07-2,94 (m, 2H), 2,22 (s, 3H), 2,05 (s, 3H). LC-MS: Rt=0,71 мин; MS масса/заряд 399,2 [M+H]+
Пример пр. 104
TFA-соль 1-оксида (3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина
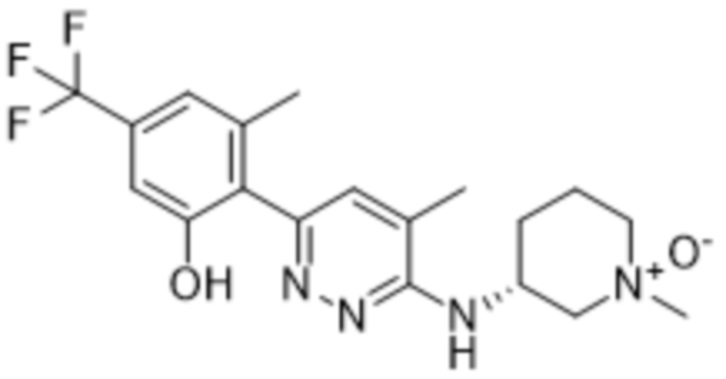
Раствор примера пр. 005 (27 мг, 0,071 ммоль) в 1 мл CH2Cl2 обрабатывали с помощью mCPBA (13,6 мг, 0,079 ммоль) и перемешивали при к. т. в течение 90 мин. Реакционную смесь гасили насыщенным раствором NaHCO3 и экстрагировали с помощью CH2Cl2. Неочищенное вещество очищали с помощью aхиральной RP-хроматографии с получением указанного в заголовке соединения в виде белого твердого вещества. 1H ЯМР (400 МГц, DMSO-d6) δ (ppm) 12,63 (s, 1H), 10,27 (s, 1H), 7,36 (s, 1H), 7,14 (s, 1H), 7,08 (s, 1H), 4,84-4,69 (m, 1H), 4,08-3,92 (m, 1H), 3,88-3,80 (m, 1H), 3,63-3,52 (m, 5H), 2,20 (s, 3H), 2,26-2,10 (m, 1H), 2,13 (s, 3H), 2,08-1,96 (m, 2H), 1,85-1,70 (m, 1H). LC-MS: Rt=0,86 мин; MS масса/заряд 397,2 [M+H]+
БИОЛОГИЧЕСКИЕ АНАЛИЗЫ И ДАННЫЕ
Активность соединения в соответствии с настоящим изобретением можно оценить с помощью следующих способов in vitro. Соединение формулы (I) или его фармацевтически приемлемая соль проявляют ценные фармакологические свойства, например, свойства склонности к ингибированию активности NLRP3, например, как указанно в тестах, приведенных в следующих разделах и, следовательно, показаны для терапии, связанной с активностью инфламмасомы NLRP3.
Анализ секреции IL-1β
Моноцитарные клетки THP-1 (ATCC: TIB-202) поддерживали в соответствии с инструкциями производителя в среде RPMI (RPMI/HEPES +10% фетальная бычья сыворотка крови+пируват натрия+0,05 мМ бета-меркаптоэтанола (1000x исходный раствор) + смесь пенициллин-стрептомицин). Дифференцировку клеток обеспечивали в их общей массе с помощью 0,5 мкМ форбол-12-миристат-13-ацетата (PMA; Sigma № P8139) в течение 3 часов, среду заменяли, и клетки высевали при 50000 клеток на лунку в 384-луночные плоскодонные планшеты для культивирования клеток (Greiner, № 781986), и им давали возможность дифференцироваться в течение ночи. Соединение в серийных разведениях 1:3,16 в DMSO добавляли в соотношении 1:100 к клеткам и инкубировали в течение 1 часа. Инфламмасома NLRP3 активировалась при добавлении 15 мкМ (конечная концентрация) нигерицина (Enzo Life Sciences, № BML-CA421-0005), и клетки инкубировали в течение 3 часов. 10 мкл надосадочной жидкости удаляли, и уровни IL-1β отслеживали с помощью анализа HTRF (CisBio, № 62IL1PEC) в соответствии с инструкциями производителя. Жизнеспособность и пироптоз отслеживали путем добавления реагента для определения жизнеспособности клеток PrestoBlue (Life Technologies, № A13261) непосредственно в планшет для культивирования клеток.
Анализ секреции TNF-α
Моноцитарные клетки THP-1 поддерживали в соответствии с инструкциями поставщика в среде RPMI, как описано выше. Недифференцированные клетки высевали при 50000 клеток на лунку в 384-луночные плоскодонные планшеты для культивирования клеток (Greiner, № 781986) и оставляли в покое в течение ночи. Экспериментальные соединения получали и добавляли, как описано выше. Секреция TNF-α запускалась при добавлении 1 мкг/мл LPS (Sigma, № L4391) либо 100 нг/мл Pam3CSK4 (Invivogen, № tlrl-pms) в зависимости от эксперимента, и клетки инкубировали в течение 3 часов. 10 мкл надосадочной жидкости удаляли, и уровни TNF-α отслеживали с помощью анализа HTRF (CisBio, № 62TNFPEC) в соответствии с инструкциями производителя. Жизнеспособность отслеживали, как описано выше.
Интерпретация данных
Величины IC50 рассчитывали, исходя из графика процентной величины ингибирования в зависимости от концентрации ингибитора посредством логистической аппроксимации в соответствии с:
y=A2 + (A1 - A2)/(1 + (x/IC50) ^ p),
где y представляет собой % ингибирования при концентрации ингибитора x, A1 представляет собой наиболее низкую величину ингибирования, т. е. 0%, а A2 представляет собой максимальную величину ингибирования, т. е. 100%. Показатель степени p представляет собой коэффициент Хилла. Аппроксимацию кривой проводили с помощью пакета программного обеспечения собственной разработки.
NLRP3-зависимую секрецию IL-1β стимулировали в клетках THP-1, дифференцированных под действием PMA, путем добавления нигерицина, и измеряли уровни цитокинов в сыворотке крови через 3 часа. Как обсуждается выше, активация инфламмасомы NLRP3 требует как стадии NF-kB-зависимого примирования, так и добавления активатора NLRP3. Для обеспечения того, чтобы ингибиторы не препятствовали стадии примирования, NF-kB-зависимую секрецию TNF-α, стимулируемую Pam3CSK4, отслеживали в качестве обратного скрининга. Данные об ингибирующем эффекте (IC50) соединений по настоящему изобретению для обоих анализов приведены в таблице ниже.
IC50 [мкМ]
IC50 [мкМ]
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ, ИНГИБИРУЮЩИЕ МЕТАЛЛОФЕРМЕНТЫ | 2017 |
|
RU2764666C2 |
| ПИПЕРИДИНИЛПИРАЗОЛОПИРИМИДИНОНЫ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2713937C2 |
| НОВЫЕ СОЕДИНЕНИЯ И ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2785126C2 |
| МОДУЛЯТОРЫ ЯДЕРНЫХ РЕЦЕПТОРОВ | 2016 |
|
RU2715897C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PRMT5 | 2018 |
|
RU2797822C2 |
| ЗАМЕЩЕННЫЕ АМИНОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2014 |
|
RU2675105C9 |
| ПОЛИЦИКЛИЧЕСКИЕ АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ИММУННЫХ РАССТРОЙСТВ | 2016 |
|
RU2783748C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛОМ ПИРИДИНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2756743C2 |
| СПИРО-АМИНОСОЕДИНЕНИЯ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ СНА И ЛЕКАРСТВЕННОГО ПРИВЫКАНИЯ | 2010 |
|
RU2562609C2 |
| ИНГИБИТОРЫ GCN2 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2811408C2 |
Группа изобретений относится к области медицины, а именно к соединению определённой структуры или его фармацевтически приемлемой соли, к фармацевтической композиции, обладающей ингибирующей активностью в отношении сигнального пути инфламмасомы NLRP3, и к применению вышеуказанного соединения или его фармацевтически приемлемой соли для производства лекарственного средства для лечения заболевания или нарушения, при котором передача сигнала, опосредованная NLRP3, способствует патологическому процессу, и/или проявлению симптомов, и/или прогрессированию указанного заболевания или нарушения. Соединение формулы (I)
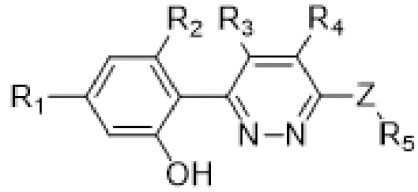 (I),
(I),
или его фармацевтически приемлемая соль, где R1 представляет собой Cl, CH3, -OCF3 или CF3, R2 представляет собой H, галоген, C1-C4алкил или галоген-C1-C4алкил, R3, R4 представляют собой H, CN, C1-C4алкил или галоген-C1-C4алкил, Z представляет собой -O- или -NH-(CH2)n-, где n равняется 0, 1 или 2, R5 выбирают из следующих структур:
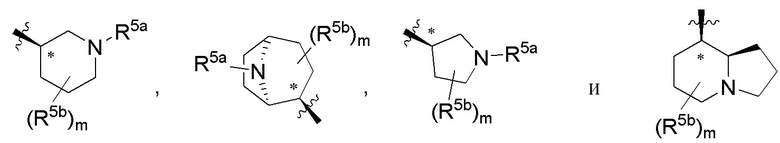 ,
,
где R5a независимо выбирают из C1-C4алкила, гидрокси-C1-C4алкила и H, и R5b независимо выбирают из -OH, C1-C4алкила, гидрокси-C1-C4алкила, H, галогена, оксо, галоген-C1-C4алкила и -CO2H, и m равняется 0 или 1, или R5 выбирают из следующих структур:
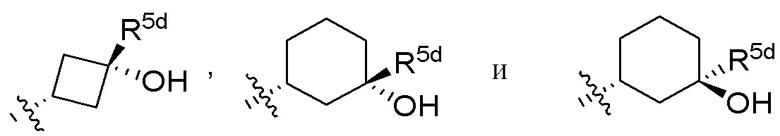 ,
,
где R5d независимо выбирают из H, галогена, галоген-C1-C4алкила и C1-C4алкила. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении сигнального пути инфламмасомы на основе NOD-подобного рецепторного белка 3 (NLRP3), содержащая терапевтически эффективное количество вышеуказанного соединения или его фармацевтически приемлемой соли и один или несколько фармацевтически приемлемых носителей. Применение вышеуказанного соединения или его фармацевтически приемлемой соли для производства лекарственного средства для лечения заболевания или нарушения, при котором передача сигнала, опосредованная NLRP3, способствует патологическому процессу, и/или проявлению симптомов, и/или прогрессированию указанного заболевания или нарушения. Указанная группа изобретений может использоваться для ингибирования сигнального пути инфламмасомы NLRP3, лечения или предупреждения заболеваний и/или нарушений, связанных с NLRP3. 4 н. и 5 з.п. ф-лы, 104 пр.
1. Соединение формулы (I)
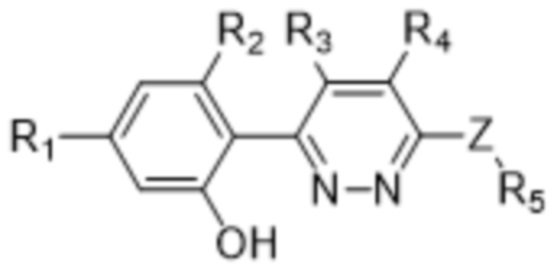 (I)
(I)
или его фармацевтически приемлемая соль,
где R1 представляет собой Cl, CH3, -OCF3 или CF3;
R2 представляет собой H, галоген, C1-C4алкил или галоген-C1-C4алкил;
R3, R4 представляют собой H, CN, C1-C4алкил или галоген-C1-C4алкил;
Z представляет собой -O- или -NH-(CH2)n-, где n равняется 0, 1 или 2;
R5 выбирают из следующих структур:
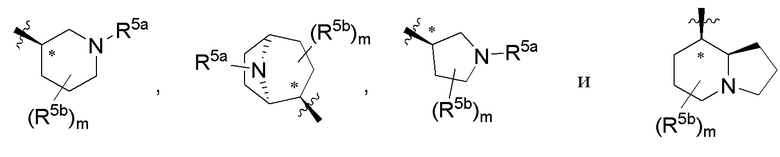 ,
,
где R5a независимо выбирают из C1-C4алкила, гидрокси-C1-C4алкила и H; и R5b независимо выбирают из -OH, C1-C4алкила, гидрокси-C1-C4алкила, H, галогена, оксо, галоген-C1-C4алкила и -CO2H; и m равняется 0 или 1; или
R5 выбирают из следующих структур:
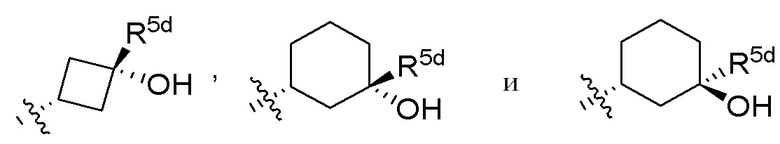 ,
,
где R5d независимо выбирают из H, галогена, галоген- C1-C4алкила и C1-C4алкила.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, характеризующиеся формулой (II)
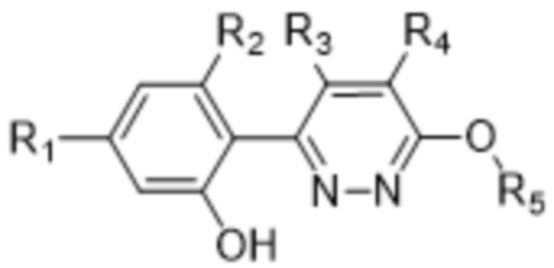 (II),
(II),
где R1, R2, R3, R4 и R5 определены в п. 1.
3. Соединение по п. 1 или его фармацевтически приемлемая соль, характеризующиеся формулой (III)
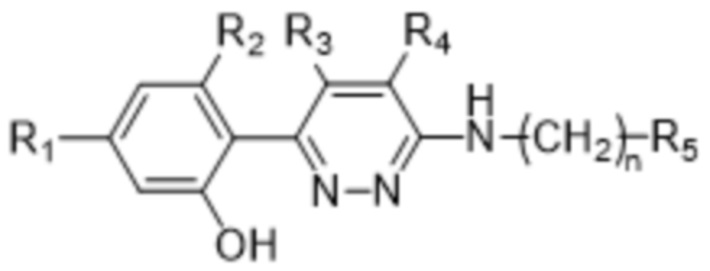 (III),
(III),
где n равняется 0, 1 или 2; и R1, R2, R3, R4 и R5 определены в п. 1.
4. Соединение по любому из пп. 1-3 или его фармацевтически приемлемая соль, где по меньшей мере один из R2 и R3 представляет собой H.
5. Соединение по любому из пп. 1-4 или его фармацевтически приемлемая соль, где R1 представляет собой -OCF3 или CF3.
6. Соединение или его фармацевтически приемлемая соль, выбранные из:
2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-этилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((1-изопропилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1-этилпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-(((1-этилпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-(((1-этилпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5,5-дифторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-(трифторметил)пропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-((1-этилпиперидин-3-ил)амино)-6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-4-карбонитрила;
(S)-3-((1-этилпиперидин-3-ил)амино)-6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-4-карбонитрила;
(R)-3-((1-этилпиперидин-3-ил)амино)-6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-4-карбонитрила;
3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидроксиэтил)пиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((пирролидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((пирролидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((пирролидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-(диметиламино)-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпирролидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(2-гидрокси-2-метилпропокси)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((пиперидин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(6-(((4,4-дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((4,4-дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-(((4,4-дифторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-гидроксициклопентил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(цис)-2-(6-((2-гидроксициклопентил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(транс)-2-(6-((2-гидроксициклопентил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3,5-дихлор-2-(6-((2-гидроксиэтил)амино)пиридазин-3-ил)фенола;
2-(6-((2-гидроксиэтил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3,5-дихлор-2-(6-((2,2,2-трифторэтил)амино)пиридазин-3-ил)фенола;
3-метил-2-(6-((пиридин-2-илметил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((2-амино-2-метилпропил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-хлор-2-(6-((2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((цис-3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((транс-3-гидроксициклобутил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-(((2-метилпиридин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
5-хлор-2-(6-(((2-метилпиридин-3-ил)метил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((2-гидроксиэтил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(S)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли 5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли (S)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли (R)-5-хлор-3-фтор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3,5-бис(трифторметил)фенола;
(S)-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3,5-бис(трифторметил)фенола;
(R)-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3,5-бис(трифторметил)фенола;
2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(4,5-диметил-6-(((S)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(4,5-диметил-6-(((R)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
TFA-соли 2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
TFA-соли 2-(4,5-диметил-6-(((S)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
TFA-соли 2-(4,5-диметил-6-(((R)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-карбоновой кислоты;
3-метил-2-(6-((1-метилпиперидин-3-ил)окси)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)окси)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)окси)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(пиримидин-5-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
3,5-дихлор-2-(6-(циклопропиламино)пиридазин-3-ил)фенола;
3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(S)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли 3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли (S)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
TFA-соли (R)-3,5-дихлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
3-метил-2-(6-(пиридин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
3,5-диметил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(S)-3,5-диметил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-3,5-диметил-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(4,5-диметил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
5-метил-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(S)-5-метил-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(R)-5-метил-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
(S)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
(R)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-(трифторметил)фенола;
2-(6-((1,3-диметилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
TFA-соли 2-(6-((1,3-диметилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-5-(трифторметил)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3S)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,3R)-3-гидроксициклогексил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-2-она;
2-(6-((2-фтор-3-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((2-фтор-3-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((2-фтор-3-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-она;
(S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-она;
(R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)пиперидин-2-она;
3-метил-5-(трифторметил)-2-(6-((6-(трифторметил)пиперидин-3-ил)амино)пиридазин-3-ил)фенола;
3-метил-2-(6-((1-(2,2,2-трифторэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-(2,2,2-трифторэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-(2,2,2-трифторэтил)пиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-((1-метилпиперидин-3-ил)амино)-5-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)-5-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((1-метилпиперидин-3-ил)амино)-5-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(5-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-(трифторметил)циклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((транс)-3-гидрокси-3-(трифторметил)циклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((цис)-3-гидрокси-3-(трифторметил)циклобутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-хлор-2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)фенола;
5-хлор-2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)фенола;
5-хлор-2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)фенола;
5-хлор-2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(S)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
(R)-5-хлор-2-(6-((1-метилпиперидин-3-ил)амино)-4-(трифторметил)пиридазин-3-ил)фенола;
5-хлор-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(S)-5-хлор-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
(R)-5-хлор-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-гидрокси-2-метилпропил)амино)-4-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-(((4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2S,4S)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2R,4S)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2R,4R)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((((2S,4R)-4-фторпирролидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-3-метил-2-(6-(((4-метилморфолин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-(((4-метилморфолин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(рац)-3-метил-2-(6-(((4-метилморфолин-3-ил)метил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
HCl-соли 3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
HCl-соли (R)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
HCl-соли (S)-3-метил-2-(6-((3,3,3-трифтор-2-гидрокси-2-метилпропил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-гидрокси-2-метилпропан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((1-(2-гидрокси-2-метилпропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-(2-гидрокси-2-метилпропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-(2-гидрокси-2-метилпропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметокси)фенола;
2-(6-(((транс)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметокси)фенола;
2-(6-(((цис)-3-гидрокси-3-метилциклобутил)амино)-4-метилпиридазин-3-ил)-5-(трифторметокси)фенола;
2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметокси)фенола;
(S)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметокси)фенола;
(R)-2-(4-метил-6-((1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметокси)фенола;
3-метил-2-(6-((октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8R,8aR)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8R,8aS)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8S,8aR)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((8S,8aS)-октагидроиндолизин-8-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-(((1-(2-гидроксиэтил)пиперидин-2-ил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2S,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2R,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2R,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1S,2S,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2R,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2S,5S)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2S,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((1R,2R,5R)-8-метил-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,2R,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,2S,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,2S,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1R,2R,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2S,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2R,5R)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2R,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((1S,2S,5S)-8-(2-гидроксиэтил)-8-азабицикло[3.2.1]октан-2-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,6R)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,6R)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,6S)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,6S)-6-(гидроксиметил)-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола;
3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-2-метилпропан-1,2-диола;
3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1S,2S,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1S,2R,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1S,2S,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1S,2R,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2R,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2S,3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2R,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(1R,2S,3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)циклопентан-1,2-диола;
(S)-2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((2-гидрокси-3-метилбутил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-метил-2-(6-((2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((2S,3S)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((2R,3S)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((2S,3R)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
3-метил-2-(6-(((2R,3R)-2-метилпиперидин-3-ил)амино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((R)-1-((S)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((S)-1-((R)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((S)-1-((S)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((R)-1-((R)-2-гидроксипропил)пиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фтор-1-метилпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-((5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3S,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5R)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
2-(6-(((3R,5S)-5-фторпиперидин-3-ил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
(3S,5S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
(3R,5S)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
(3R,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
(3S,5R)-5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)пиридазин-3-ил)амино)-1-метилпиперидин-3-ола;
2-(6-(((1-гидроксициклопентил)метил)амино)пиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
5-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
3-метил-2-(5-метил-6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(S)-3-метил-2-(5-метил-6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
(R)-3-метил-2-(5-метил-6-(пиперидин-3-иламино)пиридазин-3-ил)-5-(трифторметил)фенола;
2-(6-((1-этилпиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(S)-2-(6-((1-этилпиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
(R)-2-(6-((1-этилпиперидин-3-ил)амино)-5-метилпиридазин-3-ил)-3-метил-5-(трифторметил)фенола;
3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
(R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидин-2-она;
4-(2-((6-(2-гидрокси-4,6-диметилфенил)пиридазин-3-ил)амино)этил)бензолсульфонамида;
1-оксида 3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
1-оксида (3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
1-оксида (3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
TFA-соли 1-оксида 3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
TFA-соли 1-оксида (3S)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина;
TFA-соли 1-оксида (3R)-3-((6-(2-гидрокси-6-метил-4-(трифторметил)фенил)-4-метилпиридазин-3-ил)амино)-1-метилпиперидина
или их фармацевтически приемлемой соли.
7. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении сигнального пути инфламмасомы на основе NOD-подобного рецепторного белка 3 (NLRP3), содержащая терапевтически эффективное количество соединения по любому из пп. 1-6 или его фармацевтически приемлемой соли и один или несколько фармацевтически приемлемых носителей.
8. Применение соединения по любому из пп. 1-6 или его фармацевтически приемлемой соли для производства лекарственного средства для лечения заболевания или нарушения, при котором передача сигнала, опосредованная NLRP3, способствует патологическому процессу, и/или проявлению симптомов, и/или прогрессированию указанного заболевания или нарушения.
9. Применение по п. 8, где заболевание или нарушение выбрано из заболеваний/нарушений, связанных с инфламмасомами, иммунных заболеваний, воспалительных заболеваний, аутоиммунных заболеваний или аутовоспалительных заболеваний, например форм аутовоспалительного лихорадочного синдрома (например, криопирин-ассоциированного периодического синдрома), заболеваний/нарушений, связанных с печенью (например, хронического заболевания печени, вирусного гепатита, неалкогольного стеатогепатита (NASH), алкогольного стеатогепатита и алкогольной болезни печени), нарушений, связанных с воспалительным артритом (например, подагры, псевдоподагры (хондрокальциноза), остеоартрита, ревматоидного артрита, артропатии, например, острой, хронической), заболеваний, связанных с почками (например, гипероксалурии, волчаночного нефрита, сахарного диабета I типа/II типа и связанных с ним осложнений (например, нефропатии, ретинопатии), гипертензивной нефропатии, воспаления, связанного с гемодиализом), заболеваний, связанных с нейровоспалением (например, рассеянного склероза, инфекции головного мозга, острого повреждения, нейродегенеративных заболеваний, болезни Альцгеймера), сердечно-сосудистых/метаболических заболеваний/нарушений (например, снижения сердечно-сосудистого риска (CvRR), гипертензии, атеросклероза, сахарного диабета I типа и II типа и связанных с ним осложнений, заболевания периферических артерий (PAD), острой сердечной недостаточности), воспалительных заболеваний кожи (например, гнойного гидраденита, акне), заживления ран и образования шрамов, астмы, саркоидоза, возрастной макулярной дегенерации и заболеваний/нарушений, связанных с раком (например, рака толстой кишки, рака легкого, миелопролиферативных новообразований, форм лейкоза, форм миелодиспластического синдрома (MDS), миелофиброза).
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| ГАРИБ Ф.Ю., РИЗОПУЛУ А.П | |||
| Инфламмасомы и воспаление | |||
| Российский иммунологический журнал, 2017, том 11(20), N 4 | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ВЫСОКОЙ СТЕПЕНИ РАЗРЕЖЕНИЯ | 1922 |
|
SU620A1 |
| НАСОНОВ Е.Л., ЕЛИСЕЕВ М.С | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2024-09-16—Публикация
2020-05-15—Подача