Изобретение относится к способу получения новых производных эрголиновых алкалоидов, именно эргол-8-ена или эрголина общей формулы I
R2 Н2-1 -СН2-СН2-Кз
Y-СЛ,
,Y
- - /I
где ЭС -СЕ-С или -СН -СН-;
R - водород или метил; Ri, - водород или бром; На-Ci,-С алкилсульфоннл, или их солей, обладакнцих ценными фармакологическими свойствами.
Известны соединения: б-метил-8)3 (ацетиламинометил)-эрголин, проявляющий окситоцинное действие; 1,6-диметил-8)5- {бензилоксикарбонил-аминометил)-эрголин, оказывающий антисеротокическое действие; 1-метил-10о метоксидигидролкзергол-5-бром-нйкоткцат. снижающий кровяное давление ГА J.
Известен способ получения азида 6-метил-9-эрголен-8-уксусной кислоты реакцией б-метил-9-эрголен-8-уксусной кислоты в смеси органических растворителей с азидом натрия при телтературе от Г23,
Известен также способ получения 2-бромзамещенных производных эрголииов путем бромирования соответствующего производного эрголина с помощью №-бромсукцинимида в среде безводного диоксана при температуре от комнатной до СЗ .
Цель изобретения - получение новых синтетических производных эрголиновых алкалоидов.
Указанная цель достигается способом, заключающимся в том, что соединение общей формулы
2 CHa-lf-CHj-Clfj-R,
j N-CH,
где X
имеют указанные значения, R - водород; Н -С -С- - алкилсульфонилбкси-,
группа,
подвергают взаимодействию с азидом щелочного металла и при необходимос5 ти бромируют в положении 2 N-бромсукцинимидом и полученные целевые продукты выделяют в свободном виде или в виде солей.
Пример. Кислый малеиново0 кислый 6-метил-8- {N-метансульфонил, N-азидоэтил)-аминометил -эргол8-ен.
4,43 г б-метил-8 {N-метансульфонил, N-метансульфонилокси-зтил)5 аминометил -эргол-8-ен растворяют при перемешивании в смеси 70 мл метилцеллозольва и 7 мл воды. Полученный раствор смешивают с 2,34 г азида натрия и кипятят смесь в течение 2 ч с обратным холодильником. Ход реакции контролируют с помощью тонкослойной хроматографии. По окончании реакции раствор упаривают в вакууме и остаток распределяют в смеси 150 мл воды и 300 мл хлороформа. После встряхивания в делительной воронке органическую фазу отделяют, а из водной проводят еще.4 раза экстракцию хлороформом порциями по 100 мл. Органические фракции объ0 единяют, высушивают, фильтруют и упаривают в вакууме. Сырой продукт растворяют в использующемся в качестве элюента растворителе и вводят раствор в колонку, заполненную
5 60 г силикагеля. Элюирование осуществляют с помощью смеси хлороформа, воды и этанола, взятых в соотношении 100:0,75:20. Фракции с R 0,85 объединяют и упаривают в ва0 кууме. Обрабатывая остаток спиртовым раствором малеиновой кислоты, получают соль. В результате получают 4,23 г (82% от теоретического выхода) кислого малеиновокислого 6-ме5 f (N-метансульфонил, N-азидоэтил} -аминомети4 -эргол-8-ена. .Т.пл. 158-160С, fotj | -39(с 0,5, 50%-ный этиловый спирт).
Пример2. Кислый малеиновокислый 2-бром-б-метил-8-((N-метан0 сульфонил, N-азидоэтил)-aминoмeтилJ.эргол-8-ен. I
4,0 г свободного основания продукта, полученного по способу в соответствии с примером 1, растворяют при перемешивании при комнатной температуре в 140 мл безводного, не содержащего перекиси водорода диоксане и полученный раствор смешивают в течение 30 мин с раствором 1,8 г
0 N-бромсукцинимида в 10 мл диоксана. Реакционную смесь перемешивают при этой температуре в течение 3 ч. Ход реакции контролируют с помощью тонкослойной хроматографии описанным
5 в примере 1 способом. Хроматограмму проявляют с помощью паров иода. По окончании реакции реакционную смесь разбавляют 210 мл воды, встряхивают в делительной воронке с 500 мл хлороформа, рН водной фазы устанавлива ют с помощью раствора аммиака равны 8, обе, фазы затем снова смешивают путем встряхивания и, наконец, орга ническую фазу отделяют. Из водной фазы с рН 8 еще четыре раза проводят экстракцию хлороформом порциями по 100 мл. Органические фазы объеди няют, высушивают над сульфатом натрия, фильтруют и упаривают в вакуум Сырой продукт растворяют в элюенте вводят в колонку, заполненную 60 г силикагеля. Элюирование осуществляю с помощью хлороформа, содержащего 2 этанола. Чистоту получаемого про дукта контролируют с помощью тонкослойной хроматографии. В качестве подвижной фазы используют элюент, применяемый при хроматографии на колонке. Фракции с Rt 0,45 упаривгиот в вакууме, Обраб атывая осадок после упаривания спиртовым растворо малеиновой кислоты, получают соль. В результате получают 3,76 г (63% от теоретического выхода) кислого малеиновокислого 2-бром-6-метйл-8(Ы-метансульфонил,Н-азидоэтил)аминометил1-эргол-8-ена. Т.:пл. 161 , Toi , 6, основание (с 0,1, пиридин)., П р им е р 3. Тетрат 1,6-диметил-8-(N-метансульфонил,N-азидоэтил)-аминометил -эргол-8-ена. Проводят те же операции, что и в примере 1. В качестве исходного сое динения однако используют 4,6 .г 1,6-диметил-8-Е(N-метансульфонил, N- метансульфонилоксиэтил) -аминометил З-Эргол-в-ена и полученное основание обрабатывают метанольным раст вором винной кислоты. В результате получают 3,3 г (59% от теоретическо го выхода) тартрата 1,6-диметил-8{(Ы-метансульфонил, N-азидоэтил)аминометил 1-эргол-8-ена. Т. пл, 168 170°С, roQ|--80,(c 0.,1, пиридин П р и м е р 4. Тетрат 2-бром-1,6 диметил-8-(N-метансульфонил,N-азидоэтил) -аминометил -эргол-8-ена . Процесс проводят так же, какв примере 2, с той разницей, что в ка честве исходного соединения используют 4, 14 г 1,6-диметил-8- (N-метан сульфонил,N-азидоэтил)-аминометил эргол-8-ена и полученное основание обрабатывают метанольным раствором винной кислоты. В результате получа ют 4,37 г тартрата 2-бром 1,6-диметил-8-(N-метансульфонил, N-азидоэтйл)-аминометил -эргол-8-ена, что соответствует 68% от теоретическозго выхода. Т. пл. 111-113 с, foij|,r,-93, (,l, пиридин), Пр име р 5. Кислый малеиново кислый 6-метил-8-((N-метансульфонйл, N-азидоэтил)-г№1инометилj-эрголйн.; Процесс проводят так же, как в примере 1, с той разницей, что в качестве исходного соединения используют 4,55 г 6-метил-8- (N-MeTatfсульфонил, N-метансульфонилоксиэтил)с1МинометилД-эрголина. В результате получают 3,1 г (60% от теоретического выхода) кислого малеиновокислого 6-метил-8-(N-метансульфонил,N-азидоэтил) -аминометил -эрголина. Т. пл. 160-162 С, fci l--38-,94°Лс 0,5, 50%-ный этиловый спирт). П р и м е р 6. Кислый малеиновокислый 1,6-диметил-8-((N-метансульфонил, Ы-азидоэтил) -аминометил7-эрголин. . Процесс проводят так же, как в примере 1, q той разницей, что в качестве исходного соединения используют 4,6 г 1,6-диметил-8-(N-метансульфонил, N-мeтaнcyльфoнилokcиэтил) . аминометилJ-эрголина. В результате получают 3,08 г кислого малеиновокислого 1,6-диметил-8-(N-Метансульфонил, N-азидоэтиламинометил -эрголина. Т. пл. 155-157С, fotj|,,4(c 0,5 50%-ный этиловый спирт) . П р и м е р 7. Тартрат 2-бром1,6-диметил-8-(Ы-метансульфон л, N-азидоэтил)-аминометилЗ-эрголина. Процесс проводят тйк же, как в примере 2, с той разницей, что в качестве исходного соединения используют 4,16 г 1,6-диметил-8-(N-мвтансульфонил, N-азидоэтил) -aминoмeтилjf эрголина и полученное основание обрабатывают метанольным раствором винной кислоты. В результате получают 3,05 г (47% от теоретического выхода) тартрата 2-бром-1,6 диметил-8-(N-метансульфонил, N-азидоэтил)-аминометил -эрголина. Т.пл. 213-215°С, -60,1 (с 0,1, пи. ридин)., Пример8. Получение применяемого в качестве исходного соеди- i нения кислого малеиновокислого 6- , метил-8-(N-метансульфонил, N метансульфонилокси-этил)-аминометил}-эргол-8-ена. 2,97 г 6-метил-8-(2-оксиэтил1 аминометил-эргол-8-ена растворяют при перемешивании в 700 мл безводного пиридина. Раствор охлаждают до и в течение 10 мин смешивают с раствором 2,29 г хлорида метансульфокислоты в 5 мл ацетонитрила. Реакционную смесь выдерживают в течение часа при указанной температуре а затем перемешивают в течение 3 ч при комнатной температуре. Протекание реакции контролируют с помощью тонкослойной хроматографии (адсорбент: силикагель на алюминиевой фольге для тонкослойной хроматографии 60/5553 фирмы Merck, ФРГ, подвижная фаза: смесь хлороформа, воды и этанола в соотношении 100:0,75:20, про явитель: реактив Ван Урка). По окон чании реакции смесь выливают в 200 ледяной воды и встряхивают в л-:лите ной воронке с 500 мл хлороформа, рН водной фазы устанавливают с помощью 2%-ного раствора карбоната натрия равным 7,5 и смесь снова встряхивают в делительной воронке, после чего хлороформ отделяют. Из .водной фазы еще трижды проводят экстракцию хлороформом порциями по 100 мл. Органические вытяжки объеди няют, высушивают над сульфатом натрия и упаривают в вакууме. Остаток после упаривания растворяют в смеси хлороформа, воды и этанола в соотношении 100:0,3:12 и вводят в колонку, заполненную 60 г силикагеля (силикагель для колоночной хроматографии: Woelm 63-200), Элюирование осуществляют вышеуказанной смесью растворителей. Чистоту получаемого вещества определяют с помощью тонко слойной хроматографии. Фракции с R 0,7 упаривают в вакууме. Из остатка после упаривания путем обработки его спиртовым раствором малеиновой кислоты получают соль. В результате получают 4,55 г (71% от теоретического выхода) кислого малеиновокислого 6-мётил-8-(Nметансульфонил, N-метансульфонилоксиэтил)-аминометил J- эргол-8-ена, Температура плавления полученного продукта 158-160 c, ffi-33, 5 ° (с 0,5, 50%-ный этиловый спирт) . П р и м е р 9. Получение применя емого в качестве исходного соединен кислого малеиновокислого 6-метил-6t(N-метансульфонил, N-метансульфонилоксиэтил)-аминометил 3-эрголина, Процесс проводят так же, как в дримере 8, с той разницей, что в ка честве исходного соединения используют 3,0 г 6-метил-8-(2-оксиэтил)аминометилJ-эрголина, В результате получают 4,11 г (72% от теоретического выхода) кислого малеиновокисло го б-метил-В-(N-метансульфонил, Ы-метансульфонилоксиэтил)-аминометил -эрголина. Т. пл. 138-140°С Cot3 ,0°, (с 0,5, 50%-НЫЙ этиловьш спирт), .Пр и м е р 10, Получение применяемого в качестве исходного соединения кислого малеиновокислого 1,6диметил-8-(N-метансульфонил, N-метансульфонилоксиэтил)-аминометил эрголина. Процесс проводят так же, как в примере 8, с той разницей, что в качестве исходного соединения испол зуют 3,15 г 1, 6-диметил-8- С(2-оксиэтил)-гшинометил -эрголина. В резул тате получают 3,7 г (64% от теорети ческого выхода) кислого малеиновокис лого 1,6-диметил-8- (N-метансульфо- НИЛ, N-метансульфонилоксиэтил)-аминометил J-эрголина. Т. пл. 112-114 С, Cot 20.. (с 0,5, 50%-ный э иловьой спирт) . Полученные по предлагаемому способу соединения формулы Г оказывают антагонистическое свротонинрецепторное, антидепрессивнЬё и стимулирующее допамин-рецепторное действие, а также снижают кровяное давление. Антагонистическое серотонинрецепторное действие соединений может бытЕ обнаружено в опытах, про-, водимых как in vitro, так и in vivo. При проведении испытаний in vitro на изолированных гладких мышцах было установлено, что указанные соединения уже при очень низких концентрациях тормозят конкурентно вызываемое серотонином сокращение гладкой мускулатуры. При проведении испытаний in vivo они сильно тормозят как при парентеральном, так и при пероральном введении вызываемую серотонином отечность. Особенно сильно этот эффект проявляется в следующих соединенях общей формулы I: тартрат 1,6-диметил-8-(N-метансульфонил, N-азидоэтил)-аминометил -эргол-8-ена (пример 3); кислый малеиновокислый 6-метил-8-(N-метансульфонил, N-азидоэтил) -аминометилЗ- эрголин (пример 5); кислый малеиновокислый 1,6диметил-8-(N-метансульфонил, N-азидоэтил) -:аминометилЗ-эрголин (пример 6); тартрат 2-бром-1,6-диметил8-(N-метансульфонил, N-азидоэтил)аминометил/-эрголин (пример 7). Эффективность некоторых из приведенных соединений такая же или превосходит эффективность используемого в качестве контрольного соединения кислого малеиновокислого (+)-бутаноламида (2) -1-метил-й-Лизергнновой кислоты (метизергида). Описанный в примере 6 кислый малеиновокислый Д,6-диметил-8-(N-ме- тансульфонил, -азидоэтнл)-аминометил - эрголин при оральном введении по своему действию эффективнее, чем метизергид. Данные по эффективности соединений приведены в табл. 1. Антисеротоническое действие in vitro определялось на изолированных матках крыс по методу I.A. Gaddum, L,A. Hairaned. Опыты in vivo проводили на подошвенной отечности крыс по методу I.L. Bonta. Некоторые из полученных по предлагаемому способу соединений общей формулы I оказывают заметное антидепрессивное действие. Действие использовавшегося в качестве контрольного соединения 5-(З-диметиламиноп О
пил)-10,11-дигидро-5Н-дибензо- 6 ,азепина(имипрамина) не превосходит действие полученного в соответствии с примером 1 кислого малеиновокислого 6-метил-8-(N-метансульфонил, N-аэидоэтил)-аминометил -эргол-вена. Указанные.соединения активны и при пероральном введении. Они нетоксичны. Их эффективность зависит от дозировки.
Данные по активности этих соедине НИИ приведены в табл. 2,
Антидепрессивное действие соединений определялось при использовании их в качестве антасонистов вызывающего гипотермию резерпина путем определения температуры тела и сравнения ее с температурой тепа контрольного животного, ui - разница температур (В.М. Askew). Острая токсичность определялась на мьш1ах. Оценку проводили через 24 ч после введения препарата (Lichfield, Wilcoxon).
Описанный в примере 1 кислый малеиновокислый 6-метил-8-(N-метансульфонил, N-азидоэтил)-аминометил эргол-8-ен оказывает, кроме того, допё1минрецепторное стимулирующее действие. Активность этого соединения в опытах in vitro такая же, а в опытах in vivo вьвле, чем активность бромкриптина (2-бром-о -эргокриптина) Фармакодинамическое действие этого соединения хорошо проявляется и при пероральном введении.
Данные по его активности приведены в табл. 3.
Допаминрецепторное стимулирующее действие соединений определялось in vitrp на изолированных, раздражаемых электрическим током семявыносяцих протоках мьпией по методу I, .Hughes, H.W. Kosterlitz и P.M. Leslfe
В опытах in vivo в качестве под-опытных животных использовались крысы. Определялось антигонистическое действие соединений по отношению к потенцированному наркозу, вызываемому вводимым парентерально галоперидолом в количестве 5 мг/кг. Наркоз: гексабарбитал Na, 50 мг/кг внутривенно.
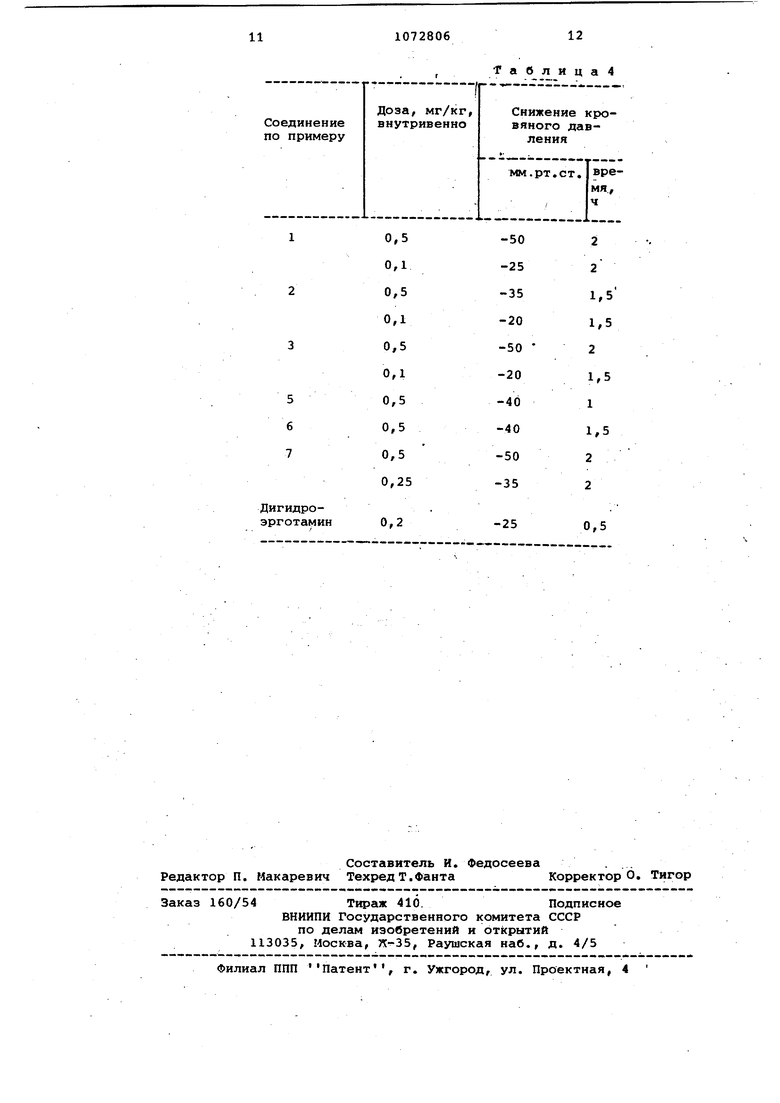
Некоторые из соединений, полученных по предлагаемому способу, при
введении их в небольших дозах наход% щимся под наркозом животным способствуют снижению кровяного давления. Величина эффекта и продолжительность действия в случае исследованных соединений вьппе, чем соответствующие величины в случае использования в качестве контрольного соединения дигидроэрготемина. Снижение кровяного давления при использовании предла0гаемых соединений сопровождается уменьшением частоты пульса (брадикардия). Соединения тормозят йегатативные рефлексы как в центральных, так и периферийных структурах. Ме5ханизм влияния предлагаемых соединений на кровяное давление несколько иной, чем в случае алкалоидов спорялньи. Предлагаемые соединения не оказывают адренОлитического действия вообще или оказывают его в малой
0 степени. Их действие проявляется главным образом в сосудодвигательном центре. Соединения снижают кровяное давление и у животных больных гипертонией при пероральном введении. Так,
5 описанный в примере 1 кислый малеиновокислый 6-метил-8-, (N-метансульфонил, N-азидоэтил)-аминометил -эргол8-ен, при введении его перорально в количестве 1,0-2,5 мг/кг бодрствую0щим крысёи14, больным гипертонией, снижал кровяное давление.,Действие его при этом продолжалось в течение нескольких часов. Соединения снижают кровяное давление и при испытаниях
5 их на кошках.
Результаты, полученные в опытах на кошках, приведены в табл. 4.
Кровяное давление измерялось у находящихся под наркозом кошек (наркоз осуществлялся введением им
0 30 мг/кг пентотала-натриевой соли 5-ЭТИЛ-5-(1-метилбутил)-2-тиобарбитуровой кислоты) с помощью вводимого в левую бедренную артерию манометра (Statham Р 23) и регистри5рО1валось полиграфом Не лига. Испытуемые соединения вводились в npaBSTO бедренную вену (Мс Leod L.I,).
Таким образом, предлагаемый способ позволяет получать новые произ0водные эргол-8-ен или эргодина общей формулы Z, обладакхкие ценными фа; макологическими свойствами. Айдисвротоничес Соединение у) г/м по примеру in vitro 35-10- ° 51-10 61-10 75-10 Метиэергид5-10 Айтидепресси Соединение 4t, °С По примеру 1 +6,5 Имипрамин +5,2 - - - --- - «---.™«. «...«.-..J«, Допаминрецепторное Семявыносящий проток Соединение мыши , М(1) , in vitro ПО примеру 1 5 Бромокриптин :5-10 ---- . - . -- .,- доза, вызывающая 50% Таблица оё действие , 50%-ное торможениеотечности, вызываемой серототином, ЕОуо , мг/кг, in vivo под- перокожно рально 0,223,7 0,291,7 0,0420,47 0,32,0 0,260,64 Таблица2 ное действие LDg , мг/кг паренте- пероральрально но, 10 мг/кг 100 100 115 666 44«.«M«,.M«4«..p.-. I т а б л и ц а 3 тимулирующее действие На крысах Галоперидол-антагониэм, мг/кг, % торможения in yivo подкожно перорально 3,0 68,7 10,0 92,2 38,9 30,048,2 10,0 25,9 30 , 34,2 54,8 . ное торможение.
11
Соединение по примеру
107280612
.Та6лица4
Снижение кровяного давления
времм.рт.ст. мя.




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных эргол-8-ена или эрголина или их солей | 1980 |
|
SU1053752A3 |
| Способ получения производных 6-метил-8 @ -гидразинометилэрголина или их солей | 1979 |
|
SU922108A1 |
| Способ получения эрголиновых соединений или их солей | 1975 |
|
SU625612A3 |
| Способ получения 2-галоген-никэрголинов | 1986 |
|
SU1445557A3 |
| Способ получения производных стероидспирооксатиазолидинов в виде их стереоизомеров или их смесей или их солей | 1981 |
|
SU1079177A3 |
| Способ получения метиловых эфиров октапептидов | 1981 |
|
SU1041030A3 |
| Способ получения средства, селективно тормозящего рост или размножение нормальных и лейкемических клеток миелоидов | 1981 |
|
SU1367837A3 |
| Способ получения производных диазабицикло /3,3,1/ нонана или их солей | 1983 |
|
SU1272990A3 |
| Способ получения производных 3-азабицикло 3,3,1 нонана,или их изомеров,или их фармацевтически приемлемых солей присоединения кислот (его варианты) | 1984 |
|
SU1395141A3 |
| Способ получения бициклических соединений или стереоизомеров этих соединений или их фармацевтически приемлемых солей с кислотами | 1982 |
|
SU1222197A3 |

5 6 7
Дигидроэрготамин
-50
2
-25
2
IfS
-35
-20
1,5
-50
2
-20
1,5
-40
1
-40
1,5
-50
2
-35
2
-25
0,5
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Stadler Р.А., Stutz Р | |||
| The alkaloids chemistry and Physiology | |||
| Academic Press n-l | |||
| Сплав для отливки колец для сальниковых набивок | 1922 |
|
SU1975A1 |
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Сплав для отливки колец для сальниковых набивок | 1922 |
|
SU1975A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Чугунный экономайзер с вертикально-расположенными трубами с поперечными ребрами | 1911 |
|
SU1978A1 |
Авторы
Даты
1984-02-07—Публикация
1982-02-23—Подача