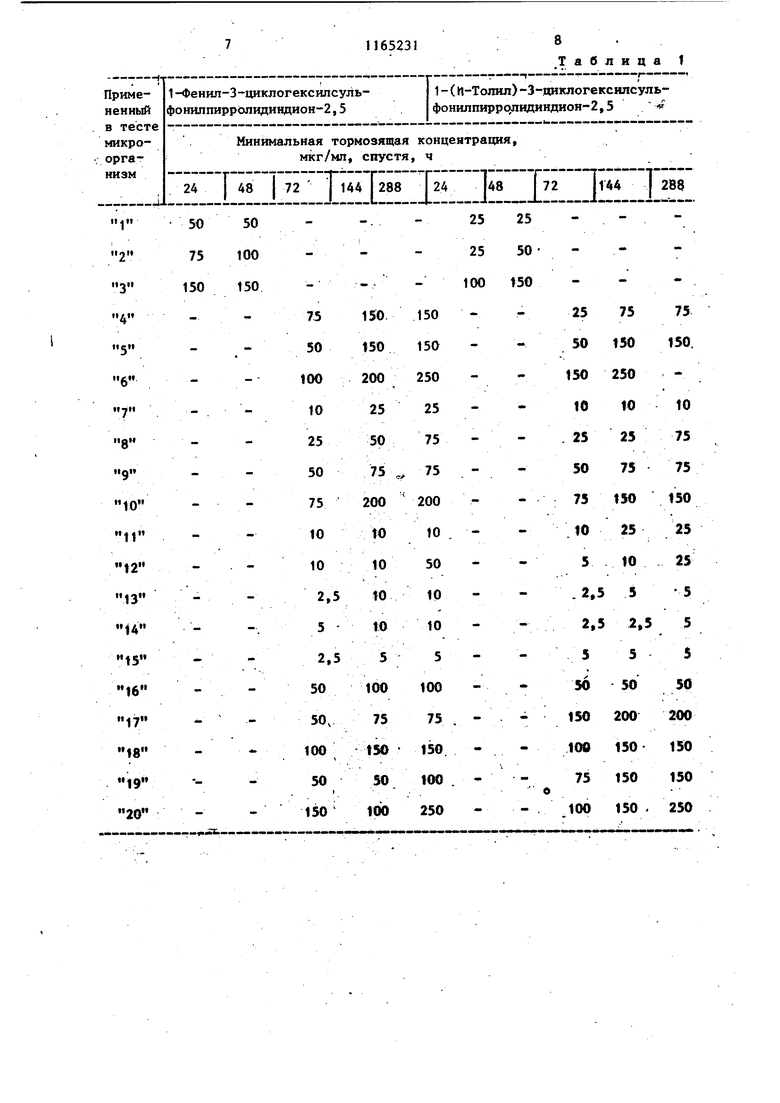
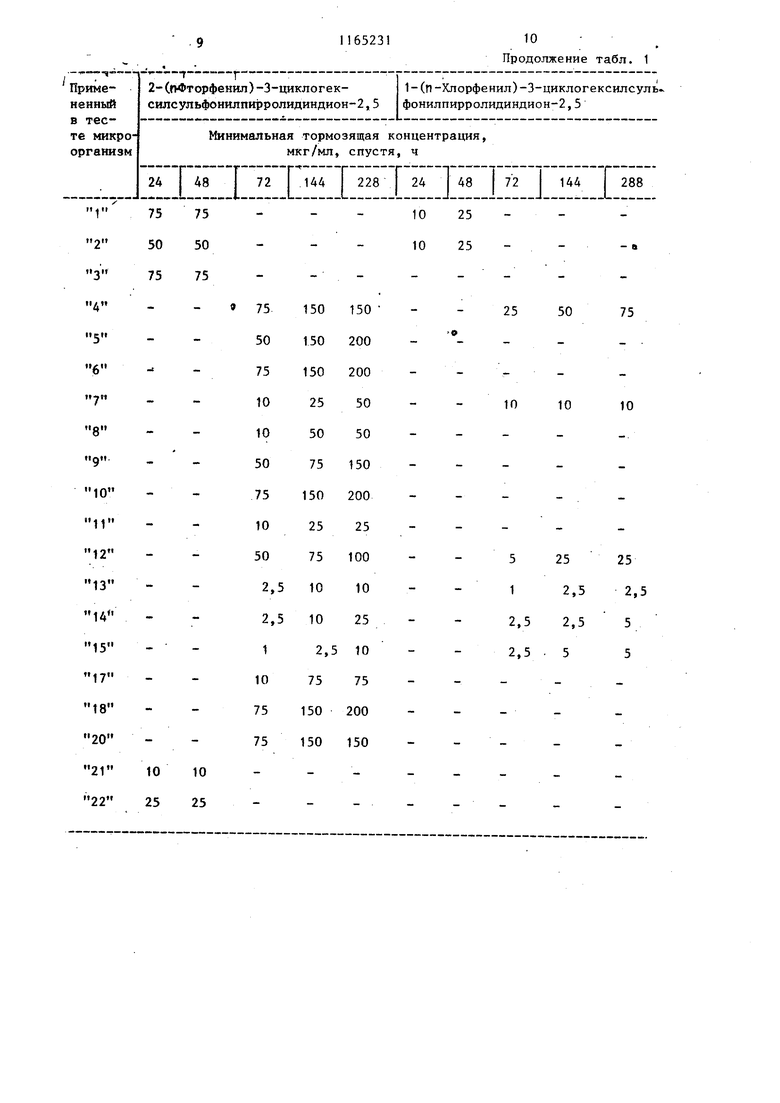
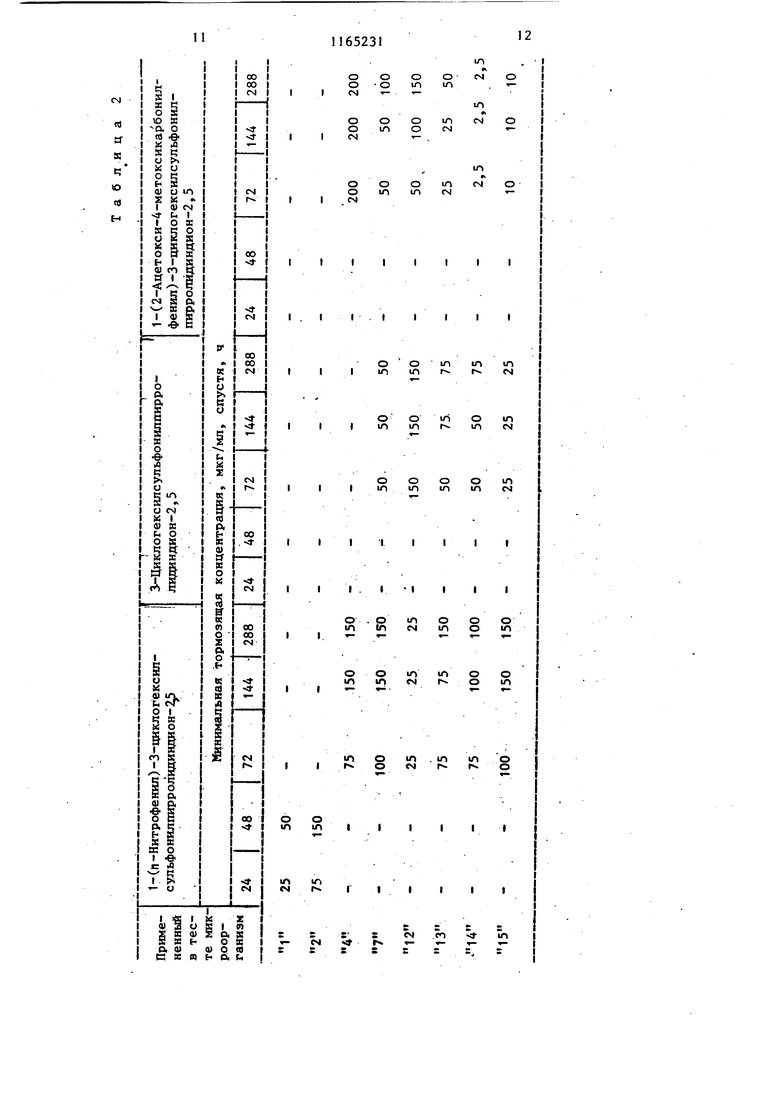
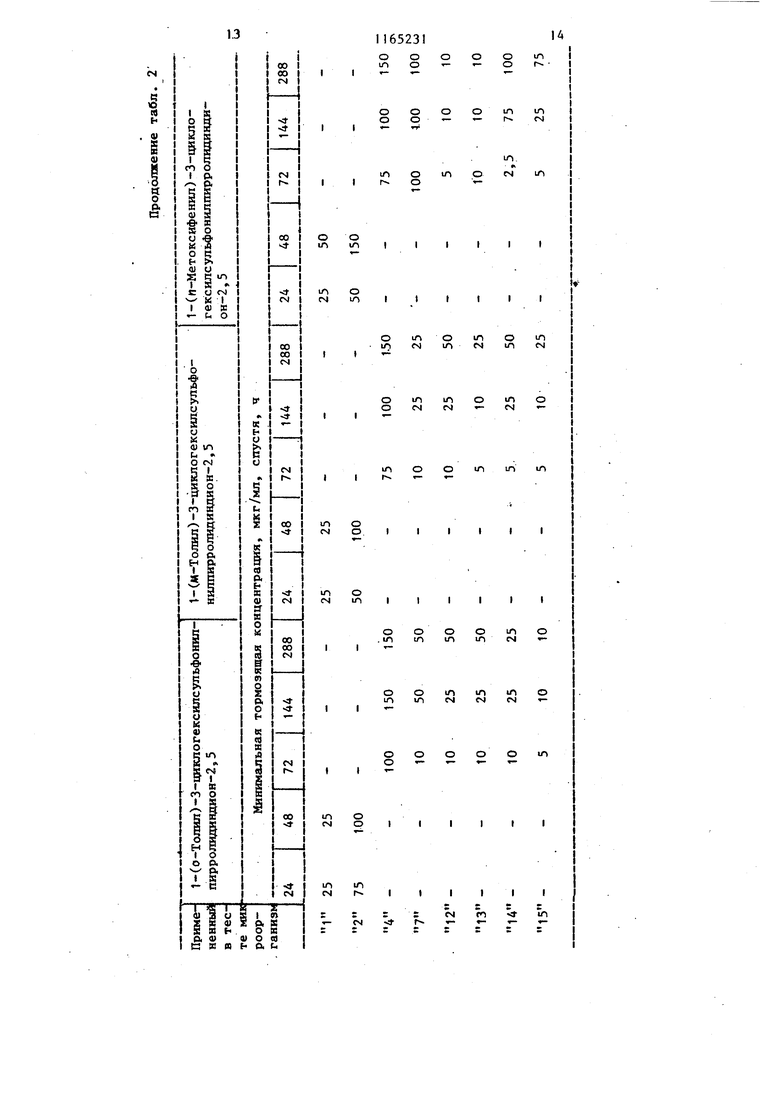
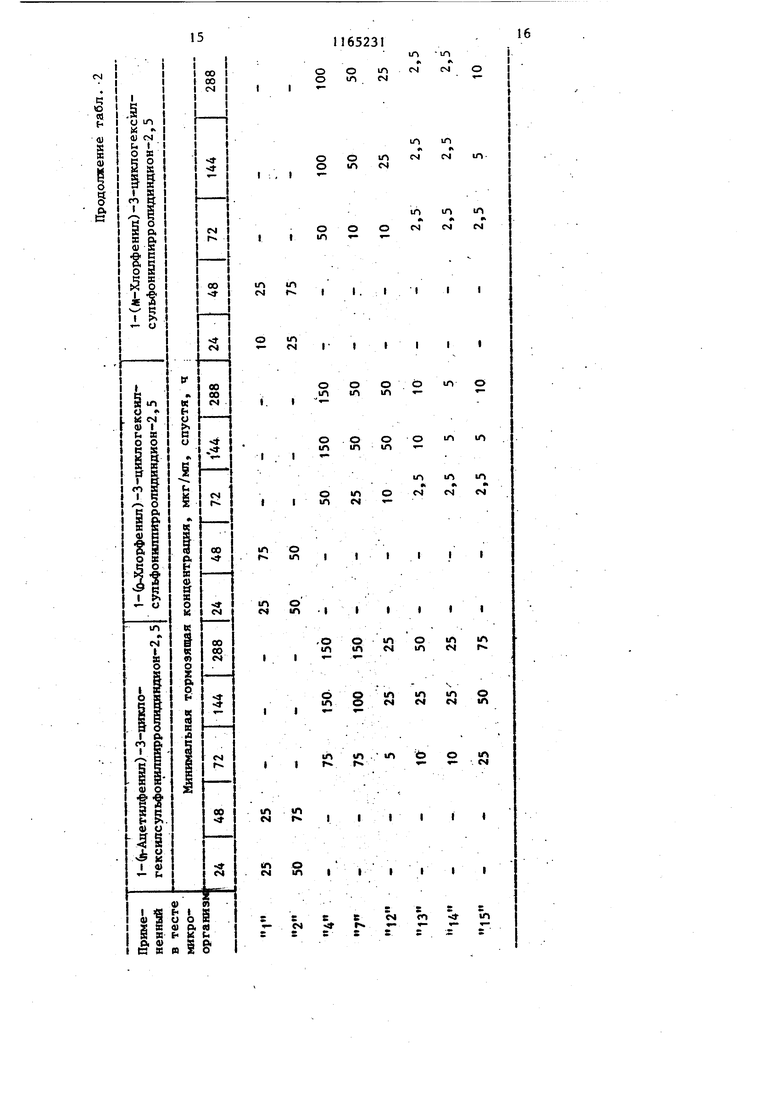
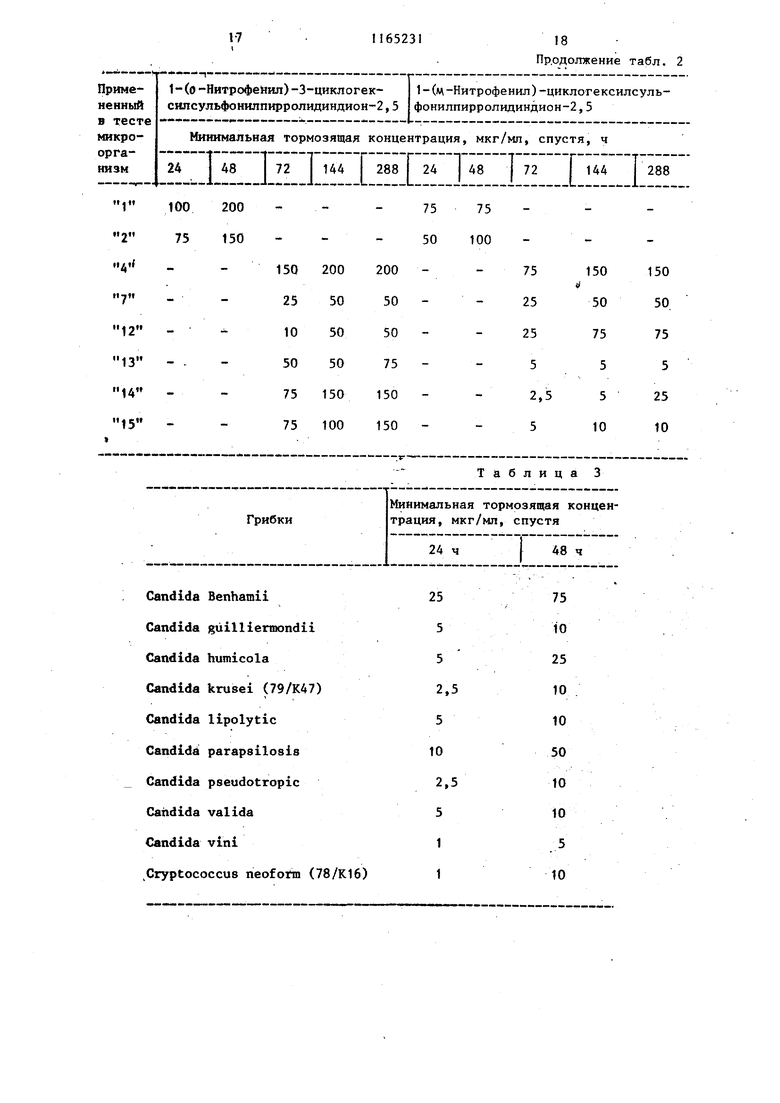
Изобретение от-носйтся к получен иовьос производных 3-циклоалкилсуль фонилпирролидиндиона-2,5, проявляющих фунгицидную активность. Известно образование пирролидин -2,5-онового цикла путем замыкания соответствующего полиамида при нагревании ij . Цель изобретения - разработка н основе известного метода способа получения новых соединений, обладающих повышенным фунгицидным действием. Поставленная дель достигается тем, что согласно способу получени N-замещенных З-циклоалкилсульфонил пирролидиндиона-2,5 общей формулы $0,А Г , (Где А - циклопентил или циклогекс R - этил, гексил, фенил, бен зил, толил, 4-метил-2-сульфофенил, 3,4-метиле диоксифенил, 4-метил-З-карбоксифенил, 4-метил-2-оксиметилфенил или фенил, замещенный в поло жении 4 метильной, меток си-, аминосульфонил-, ад ТИЛ-, этоксикарбониламиносульфонил- или сульфогруппой, в положении 2 хлором,а в положении 3 нитрогруппой, полиамид цикпоалкилсульфонилянтарн кислоты общей формулы CHj-CH-SOi-A (и i I В D где А имеет указанное значение; В и D - заместители, один из которых - гидроксильная группа, а другой - груп па - NH-R, где R имеет указанные значения, подвергают дегидратации ангидридом уксусной кислоты в присутствии без водного уксуснокислого натрия. Соединения общей формулы (I), к торые образуются во время реакции, выделяются из реакционной смеси в осадок и могут быть отделены от реакционной смеси посредством фильтрования или центрифугирования или же они остаются в растворе. В последнем случае реакционную смесь обычно обрабатывают таким образом, что посредством фильтрования отделяют присутствующие в некоторых случаях побочные продукты, затем реакционную смесь выливают, например, на лед, после чего производят отделение вьщелившегося в овадок продукта. В соответствии с другим способом из реакционной смеси удаляют посредством отгонки летучие компоненты и растворитель, и полученный остаток подвергают очистке, например, с помощью перекристаллизации . Пример 1. 1-Фенил-З-циклогексилсульфонилпирролидиндион-2,5. 3,39 г (0,01 моль) 2-циклогексилсульфонш1-4-фениламино-4-оксобутановой кислоты растворяют в смеси 20 МП ангидрида уксусной кислоты и 0,82 г (0,01 моль) безводного уксуснокислого натрия и реакционный раствор нагревают в течение 1 ч при 100 С. Затем реакционную массу выливают на измельченный лед и выделившееся в осадок указанное соединение отделяют фильтрованием, после чего, промывая водой, удаляют из него кислоту. В результате получают 2,76 г (86%) целевого соединения с т.пл. 149-151 с. После перекристаллизации из .метилового спирта продукт имеет т.пл. около 150-152°С. Минимальная тормозящая концентрация в случае Trichbphyton men- tagrophytes 2,5 мкг/мл, в Случае Trichophyton floccosum-1,0 мкг/мл. Указанными способами также могут быть получены следующие соединения: 1-Этил-З-циклогексилсульфоНилпирролидиндион-2,5, выход 47,6%, т.пл. 118-120 0. 1 -Ч-Гексил-З-циклогексилсульфонилпирролидиндион--2, 5, выход 39,8%, т. пл. 127-130°С. 1-(2-Хлорфенил)-З-циклогексилсульфонилпирролидиндион-2,5, выход 71,4%, т.пл. 153-155°С. 1-(3-Нитрофенил)-3-циклогексилсульфонилпирролидиндион-2,5, выход 92%, т.пл. US-Ue c. 3 1-(4-Ацетоксифенил)-3-циклогексилсульфонилпирролидиндион-2,5, выход 79,1%, т.гш. 203-206°С. 1-(4-Сульфоаминофенил)-3-циклогексилсульфонилпирролидиндион-2,5, выход 71,8%, т.пл.208-210°С. 1-(4-Метоксифенил)-3-циклогексил сульфонилпирролидиндион-2,5, выход 85,7%, т.пл. 139-140с. (N-Этоксикарбонилсульфониламино)-фёнил -3-циклогексилсульфониппирролидиндион-2,5, выход 42,6%, т.пл. 115-И8°С. 1-Бензил-3-циклогексялсульфонилпирролидиндион-2,5, выход 84%, т. ГО1. 160-162 С. 1-Фенил-3-циклопентилсульфонилпи ролидиндион-2,5, выход 60,2%, т. пл. 158-159с (из этилового спир та) . . 1-(П-Толял)-3-циклопентнлсульфонилпирролидиндион-2,5, выход 86,1%, т.пл. t78-180 С(после перекристалли зации из этилового спирта). 1- (И Сульфофенил)-3-циклогексилсульфонилшсрролидиндион-2,5, выход 56,2%, т.пл. 230-236 С. 1-(4-Метил-2-сульфофенил)-3-циклогексш1сульфонилпирролйдиидион-2,5 выход 53, tZ, т.пл. 244-247 с. 1-(3,4-Диоксифенил) -3-циклогексилсульфонилпирролидиндион-2,5, выход 91,8%, т.пл. 186-188°С. 1-(4-Метил-3-карбоксифенил)-3-циклогексилсульфонилпирролидиндион-2,5, выход 46,7%, т.пл. 184-188 0. 1-(4-Метил-2-оксиметилфейш1)-3-щиелогексипсульфонилпирролидиндион-2,5, выход 86,2%, Т.ПЛ. 174-177с. П р и м е р 2. 1(П-Толш1)-3-цикяогексилсульфонилпирро1ШДин-2,5 -диои. ; 2,82,г (8 моль) 2-циклогексилсул фонйл-4-(п-толиламино)-4-оксомасляной кислоты в 10 МП диметилформам да смешивают с 1,0 г пентаокиси фос фора, затем по каплям прибавляют |0,3 мл концентрированной серной кис лоты. Смесь нагревают до и 2 ч аьздерживают при этой температуре.. Реак1р1ояную смесь выпаривают досуха и оставшееся густое масло разво дят небольшим количеством метанола. Получают 1,26 г (47%) 1-(Л-толкл)-3-1Щклогексилсульфонилпирролидии-2,5-диоиа. Т.Ш1. 170-171°С (крнсташшз&ванного из метанола). 314 П р и м е р 3. 1-(4-Этилфенил)-3-циклогекснлсульфонилпирролидин-2,3-дион. 3,66 г (10 ммоль) 2-цию1огексилсульфонил-4-(4-этилфенш1амино)-4-оксимасляной кислоты смепгавают с 60 мл ксилола и при перемешивании прибавляют по каплям 3 мл треххлористого фосфора. Реакционную смесь нагревают до при перемешивании 20 мин, затем фильтруют и фильтрат концентрируют под разрежением. Остаток переносят в эфир и отфильтровывают пол.у1(енн1йй белый кристаллический материал. Получают 2,17 г (62%) 1-(4-зтш1фенил)-3-циклогексш1сульфонилпирролидин-2,5-диона. Т.пл.153156°(выкристаллизован из метанола). П р и. м е р 4. 1-(и-Толил)-3-Циклогексилсульфонилпирролидин-2,5-дион.3,53 г (10 ммоль) 2-циклогексипсульфонил-4-(и-толиламино)-4-оксимасляной кислоты в 30 мл безводного дихлорметана охлалщают.при перемешивании до . При перемешивании и температуре 0-5°С по каплям прибавляют 1,19 г (11 ммоль) этилового эфира хлормурааьиной кислоты. Температуру медленно повышают до 30°С и реакционную смесь при этой температуре медленно перемешивают еще 30 мин. Вьиелившийся продукт отняты тровывают фильтрат вьтаривают досуха Получают 1,72 (51%) 1-(|7-толил)-З-циклогексилсульфошшпирролидин-2,5-диона. Т. пл. ITO-HI C (выкрис таллизовай из метанола). Новые замеренные в полояении t производные З-циклоалкклсульфонилпнр ролидиндиона-2,5, соответствующие общей формуле (1), вследствие наличия у них сильно выраженной фунгицидной активности могут быть применены в качестве биологически активных веществ в фунгицидных препаратах. Фзшгицидную активность новых соег динений общей формулы исследуют следующим образом, Питательную почву инокулируют с. щ именением 10 мп микробов и проросяме грибки исследуют через 24, 48, . 72, 144 и 288 ч,, после чего опредеяют минимальную тормозящую концентрацию. Полученные результаты представлены в табл. 1 и 2.
В тестах бьши исследованы следуюие организмы:
Saccharomyces
cereyisiae OKI 1282 1
CandidaS
albicans. CBS.562 2
Candida
tropicalls CBS, 433 3
Aeperpillus
niger CBS.12648 4 0
Aspergillus
niger ССМГ-330 20
Aspergillus
fumigatus CBS.11326 - 5
Aspergillus5
flairis CBS.24765 6
Penicillium
digitatum CBS.31948 7
Penicillium
digitatum ССМ.Г-382 8 20
Penicilliuin
chrysogehum CBS.19646 9
Penicillium
chrysogehum CCM.F-362 10 Microsporum,
gypseum
var vinosum CBS.10064 11 . Sporetrichum
schenfii CBS.34033 12
Trichephyton30
rubrum CBS.30338 13
Trichophyton
roentagrophytes CBS.50148 14
Epidermophyton
floccosumOKI/IV 15 з5
Fusarifira
graminorum DSM.11802 16
Fusariura
oxysporum DSM.10975 17
Fusarium40
raoniliforme DSM. 11778 18
Fusarium
си1яюгитаDSM. 11425 19
Candida
krusei79/K47
Cryptococcus
neoform78/K16 22
В табл. 1 и 2 вместо названий микроорганизмов приведены номера, находя1диеся рядом с названиями. so
Со фащения, использованные в названиях микроорганизмов: CBS. Centralbureau voor Schimmelcultures, Верн, Нидерланды; ССМ. CzichoSlovak Collecticnof Microorganism, I.E.Pyr- 55 kyne University, ЧССР, Bmo; DSM,
Deutsche Samralung.fur Mikroorganismen, Institution of Mycology БерлинДалем, Федератив.ная Республика Германия,- OKI.: Orszages K3zeg szzeV,tan Intizet, Будапешт.
При внутрнбрюшинном введении значение LDjo N-фенил-З-циклогексилсульфонилпирролиДиндиона-2,5, определенное на самках мышек, составляет 382 мг/кг, а определенное на самцах мышей - 61 мг/кг.
При применении per os соединения не проявляют токсичность. «
В табл. 3 приведены минимальные тормозящие концентрации 1-((1-толил) -З-циклогексилсульфонилпирролидиндиона-2,5, мкг/мл среды, спустя 24 и 48 ч наблгодения за важнейшими патогенными грибками.
Указанные минимальные тормозящие концентрации полностью тормозят развитие микроорганизмов. В качестве питательной почвы применяли Sabourod.
1-(п-Толил)-3-циклогексилсульфрнилпирролидиндион-2,5 и 1-фенилциклогексилсульфонилпирролидиндион-2,5 также обладают активностью против следующих фитопатогенных грибков: Botrytis cinerea, Ascochy ta pisi, Carcospora beticola, Taphrina deformans, Phytophtera infestans, Sclerotinia Sclorotiorum, Verticillium alsoatrum, Verticiliiu dahliae, Venturia.
Наиболее предпочтительным целевым соединением по предлагаемому спсобу является 1-(р-толил)-3-циклогексилсульфониппирролидин-2,5-дион (соединение А).
Для сравнения бьти взяты следующие соединения:
Хлортримазол: 1-(2-хлорфенил)-дифенил-метил -1Н-имидазол (соединение В) .
Толиафтат: | -нафтиловый эфир N-метил (N-АЛ-толил) -тиокарбаминовой кислоты (соединение С).
Результаты сравнительных опытов приведены в табл. 4.
Как видно из приведенных данных, представители соединений формулы (1) обладают более высокой эффективностью против грибков, вызьтающи большую часть грибковых заболеваний чем известные фунгициды..
Таблица 1
75 50 75
75 50 75
9 75 50 75 10 10 50 75 10 50
150150
150200
150200
2550
5050
75150
150200
2525
75100
2.5
1010 25
2,5 10
1 2,5 10
10 75 75
75 75
150 200 150 150
10 25
10 25
10 10
25 25
- л
25 50
75
10 10
10
25 2,5
25 2,5 2,5
5 5 5
.Таблица 4



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения @ -замещенных 3-циклоалкилсульфонилпирролидиндионов-2,5 | 1981 |
|
SU1156594A3 |
| Способ получения @ -замещенных 3-циклоалкилсульфонилпирролидиндиона-2,5 | 1981 |
|
SU1192616A3 |
| 3-Циклоалкилсульфонилпирролидиндионы-2,5,обладающие фунгицидной активностью | 1980 |
|
SU1373704A1 |
| Способ получения N-замещенных 3-циклоалкилсульфонилпирролидиндионов-2,5 | 1980 |
|
SU1007555A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1980 |
|
SU1082324A3 |
| Способ получения производных пиретроида | 1986 |
|
SU1581219A3 |
| Способ получения 3-замещенных тетрагидропирроло/1,2- @ / пиримидинов,их кислотно-аддитивных или четвертичных солей | 1980 |
|
SU1048986A3 |
| Способ получения производных пиридо (1,2- @ ) пиримидина или их кислотно-аддитивных солей | 1978 |
|
SU1022659A3 |
| Способ получения производных пиридазона | 1973 |
|
SU533337A3 |
| Способ получения производных угольной кислоты | 1982 |
|
SU1186085A3 |
СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ 3-ЩШЮАЛКИЛСУЛЬФОНИШШРРОЛИДИНДИОНА - 2,5 общей формулы СП SOjA i, I R где А - циклопентил или циклогексил} R - этил, гексил, фенил, беНзил, толил, 4-метил-2-сульфофенш1, 3,4-метилендиоксифенил, 4-ме-. тил-3-карбоксифенил, 4-метип-2-оксиметилфен1ш или фенил, замещенный в положении 4 метил ьной, метокси-, аминосульфонил-, ацетил-, этоксикарбониламиносульфонил- или сульфогруппой, в положении 2 - хлором, а в положении 3 - нитрогруппой, о, тличающййс я тем, что полиамид циклоалкилСульфонилянтарной кислоты общей формулы 
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Gazzetta,- 2Д, 239 | |||
Авторы
Даты
1985-06-30—Публикация
1981-08-12—Подача