ИлпОретеине относится к получению новых производных З-диклоалкилсульфо пш11ирролидиндиона 2,5, обладающих фунгицидным действием.
Из литературы известно, что Nярилмалеинимиды вступают в реакцию присоединения с фенилсульфокислота ми ij .
Цель изобретения - разработка на основе известного метода, способа получения новых соединений, обладающих повьшенным фунгицидным действием.
Поставленная цель достигается тем что согласно способу получения - N замещенных 3-циклоалкилсульфонилпирролидиндиона-2,5 общей формулы
SO-i
0
/I) I R
где A - циклопентил или циклогексил; R - этил, гекг.ИоТ, фенил, бензил, толил, 4-т4етил-2-суль;фофенил, 3,4-метилендиоксифенил, А-метил-З-карбокспфенил, -MeTHJi-Z-OKCH- метилфенил ujfit фенил, замещенный в положении 1 4-метильной, метоксн-, змино- сульфоиил-, ацетпп-, этоксикарбонилаКИносульфонил- imH сульфог1)зппами, в положении 2 - хлором, в положении 3 - питporpyппoЙJ заключакяцемуся в том, что N -замещенный пирролидинд1юн-2,5 общей формулы
. R (-}
1де К имеет вышеуказанные значения, подвергают взаимодейстшпо с циклоалкилсульфиновой кислотой общей формулы
НО - SO - А ,
где А имеет вьшеуказанные значения, в смеси воды и низшего спирта.
Соединения вводят во взаимодействие таким образом, что сначала соединение JJ растворяют или суспендируют в смеси воды и низшего спирта и к приготовленному раствору или суспензии при перемешивании ц при температуре в интервале от О до 25 С ирибанляют циклоалкшк-.ульфиновую кнслиту. При соблюдении указанных ус
ьи,1
ловн11 реакция протекает н течение нескольких часов, ирпчем продукт общей формулы 1 выделяется из реакционной смеси в осадок.
5 Соединения общей формулы 1, которые образуются во время реакции, выделяются из реакционной смеси в осадок и могут быть отделены от реакционной смеси посредством фильтрования или центрифугирования, или же остаются в растворе. В этом случае реакционную смесь обычно обрабатывают таким образом, что гюсредством фильтрования отделяют присутст-
15 вующие в некоторых случаях побочные продукты, затем реакционную смесь вьшивают, например на лед, после чего производят отделение выделившегося в осадок продукта. В соответст-
20 ВИИ с другим способом из реакционной смеси удаляют посредством отгонки летучие компоненты и растворитель, и полученный остаток подвергают очистке, например с помощью перекристал-
5 лизации. Конечные продукты также могут быть вьщелены и подвергнуты очистке другими способами, обычно применяемыми на практике в органической химии.
Q Пример. 1-Фенш1-3-циклогексилсульфонилпирролидиндион-2,5.
. Раствор о;296 г (0,002 моль) цшслогексилсульфиновой кислоты в 100 ми воды при перемешивании и температуре прибавляют к раствору
0,346 г (0,002 моль) 1-фенилпирролидиндиона-2,5 в 100 мл этилового спирта. Затем реакционную смесь перемешивали в течение 10 ч при
15 С. Выделившийся в осадок продукт отфильтровывали и промывали водой. В результате получали 0,475 г (74%) указанного соединения, т.пл. которо- ,го составляла 149-151°С.
Указанным вьш1е способом также могут быть получены следующие соединения:. 1-этил-3-циклогексилс-ульфо- нш1пирролидиндион-2,5-выход: 47,6%, т.пл. 118-120 с. 1-н-гексил-3-ЦИК-
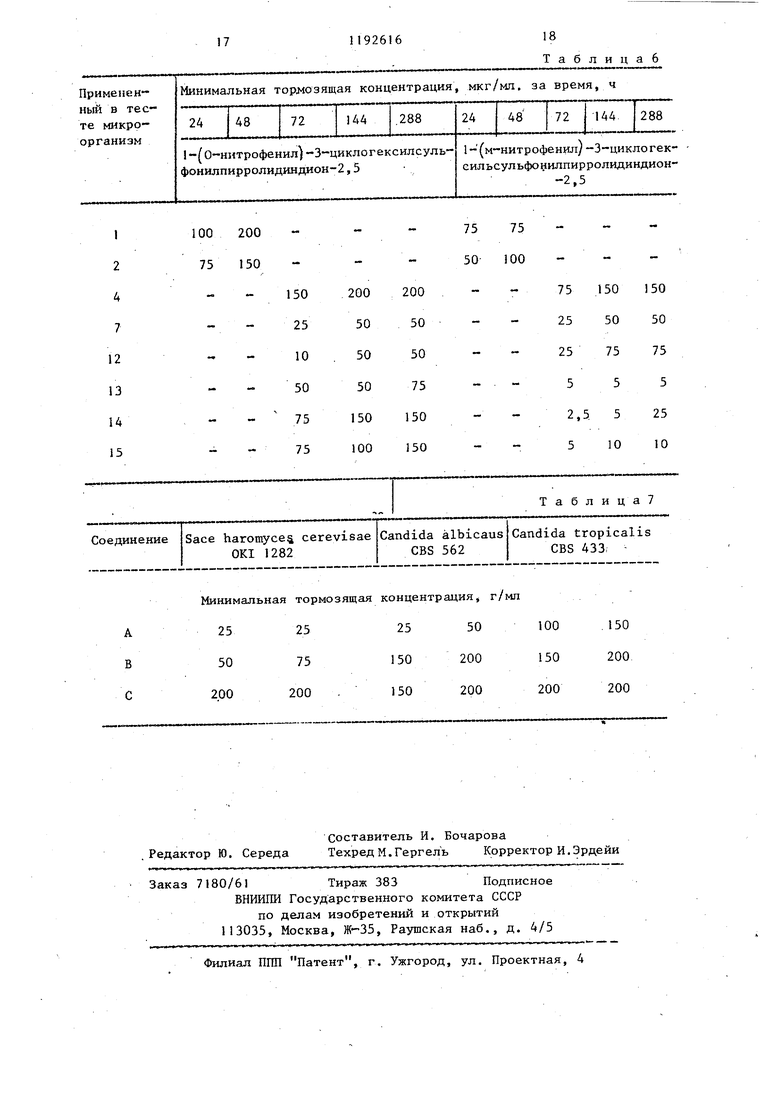
логексилсульфонилпирролидиндион-2,5, выход: 39,8%, т.пл. 127-130°С. i-(2-хлорфенил -3-циклогексилсульфонилпирролидиндион-2,5, выход: 71,4%, т.пл. 153-155 С. 1-(3-нитрофенил)-З-циклогексилсульфонилпирролидин-дион-2,5,.выход: 92%, т.пл. 145146 С. 1-(4-ацетилфенил)-3-цикло- гексилсульфонилпирролидиндион-2,5, 3 выход: 79,1%, т.пл. ZOS-ZOe C. 1( -аминосульфонилфенил)-3 циклогексил сульфонилпирролидиндион 2,5, выход 71,8%, т.пл. 208 210°С. 1-(4-метоксифенил)-3 циклогексш1сул,ьфонилпир ролидиндион 2,5, выход: 85,7%, т.пл 139-140 С, (N-этoкcикapбoнил аминосульфонил)-фенил |-3-циклогекси сульфонилпирролидиндион-2,5, выход 42,6%, т.пл. . 1--бензил-3 циклогексилсульфонилпирролидинди он-2,5, выход: 84%, т.пл. 16(Ы62®С 1- енил-3-циклопентилсульфонилпир ролидиндион-2,5, выход: 60,2%, т.пл 158-159 0 (из этилового спирта). 1- (п-толил)-З-циклопентилсульфонил- пирролидивдион-2,5, выход 86,1%, т.пл. 178-180 С (после перекристаллизации из этилового спирта). 1-(п- -сульфофенш1)-3-циклогексилсульфонилпирролидиндион-2,5, выход: 56,2% т.пл. 23О-236 С. 1-(4-метил-2-сульф фенил)-3-циклогексилсульфонилпирро- л1адиндион-2,5, выход: 53,1%, т.пл. 244-247 С. 1-(3,4-метилендиокси-ди- оксифенил)-3-циклогексилсульфонил- пирролидиндион-2,5, выход: 91,8%, т.пл. 186-188с. 1-(4-метил-3-карбокс1 е1:1ил )-3-циклогексилсульфонил- пирролидиидиои-2,5, выход: 46,7%, т.пл. 184-188 С. 1-(4-метил-2-окси- метилфеиил)-3-циклoгeкcилcyльфoнил- пиppoлидиндиoн-2,5, выход: 86,2%, т.пл. 175-177 С. (1-этнлфенил-3-(ци логексил-сульфонил)-пирролидии-2,5- дион, т.пл. 154-156 С (кристалличес кий из метанола). Новые замещенные в положении I производные 3-циклоалкилсульфонилпирролидиндиона-2,5, соответствующие общей формуле 1, вследствие наличия у них сильно выраженной фунги цидной активности, могут быть применены в качестве биологически активных веществ в фунгицидных препаратах . Фунгицидиую активность новых соединений общей формулы исследовали следующим образом. Питательную почву инокулировапи с применением 10 мл микробов и про росшие грибки исследовали через 24, 48, 72 и 144, 288 час, после чего определяли минимальную тормозящую концентрацию. Полученные результаты представлены в табл. 1-6. В тестах были исследованы слещие организмы: Sac еЬатошу с es cerebisial OKI 1282 I Candida albicanc CBS 562.2 Candida tropicalis CBS 433 3 Aspergillus niger CBS 12648 4. Aspergillus niger COM Г-330 20 Aspergillus fumigatus5 CBS 11326,-- Aspergillus fla- . , iris CBS 24765 6 Penicillium digitatum CBS 31948 7 Penicillium digitatian CCM Г-3828 Penicillium chrysogenujn CBS 196-69 Penicillium chrysogenum CCM Г-36210 Microspor m gyp- - seiMfi. var. vinosxom CBS 100641 Sporotrichum schenfu CBS 34035 12 Trichophyton rubrum CBS 30338 13 Trichophyton mentagrophytes CBS 14 Epidermophyton floccosum OKl/iy 15 Fusariimi graminorxan DSM 1180216 Fusariiffli oxysporum DSM 10975 . 17 Fusarium moniliforme DSM 11778 18 Fusarium culmorum bSM П42519 Candida krusei 79/K472Г Cryptococcus neoform 7в/К1622 В таблицах вместо названий микрганизмов приведены номера, наящиеся рядом с названиями. Сокращения, испольдованные в ваниях микроорганизмов: CBS tralbxireau voor -Schimmelcules, Берн, Нидерланды, CCM. Czechovak Collection of Microorganism, . Pyrkyne University, Brno, ЧССР, . Deutsche Sammlung Mr Mikroor5gairlanien, Institution of 1Iycology Г.-р..н-,1я.ппм, Федеративная Республ ка Ге.рмани.ч, OKI .: Orszagos Kozeg Bip,i:.:iri3. nt- et, Будапешт. Црт 1)нутр:(-т кчшг-.ним введении зн ,«vie Ь D, П -4чмтт.т,1- V-чщклогексилсул 1 ош111ПИ1)ри1Гт ;гшу,иона-2,5, определ иое на сямклх ,I«K, составляет МГ/К1, т .ленное на самц tlUiUf-V - 61 Mi/, г. При iTD-Mf :. НИН |Ч:г OS соединени ИГ 7фО RJiai r ОГ ..Ь . Ниже приг;1 до« 1 M«HI.мз.чьные торм ЗИ1Ц1П- KOKTi-nV 1(n-ТОЛ1Ш 3 ло1 -ксHJff . г-фои1иИлирог.- -1;11г1ндиона- в мкг/мл ср.-дч м«(.м /t ii А8 ч н блюдснил за 1 а;лЧон;и; и ...« огеиным грибками: .м.илшмальная Грибки у.пмочящая т; п Ц .-птраци ч ; гфемя, ч -;ч Ca.ndidft ln.Mb.imiiCandida {tuilli n.-mondiiCandida banicc,- la Candida krusei (79/K4, Candida lipoJ.yticCandida pp.rapsilosisCandida pseudotropicCandida valida Candida vini 6 Cryptococcun neoform (78/K|g) 1 10 Указанные минимальные тормозящие концентраини полностью тормозят развитие микроорганизмов. В качестве питательной почвы применяли Sabourod питательную почву. 1-(п-толил)-3-циклогексилсульфо- нилпнрролидиндион-2,5 и 1 -фенилциклогексш1сульфонилпирролидиндион-2,5 Также обладают активностью против следующих фитопатогенных грибков: Botrytis cinerea, ascochyta pisi, Carcospora beticola, Taphrina deformans, phytophtera infestans, Sclerotinia sclerotiorum, Verticillium alsoatrum, Verticillium dahlial, Venturia. Наиболее предпочтительным целевым соединением по предлагаемому способу является 1-р-толш:-3-(циклогексил сульфонил)пирролидин-2,5-дион (соединение А). Дпя сравнения быпи взяты спедунущие соединения: хлортримазол: I |(-хлорфенил)-дифенил-метш1 -1Н-имидазол (соединение В) , толнафтат: /3 fнафтиловый эфир Н-метил(М-м-толил)тиокарбаминовой кислоты (соединение С). Результаты Сравнительных опытов приведены в табл. 7, Как видно из приведенных данных, представители соединений формулы I обладают более высокой эффективностью против грибков, вызывающих боль- шую часть грибковых заболеваний, чем известные фунгициды. Таблица 1

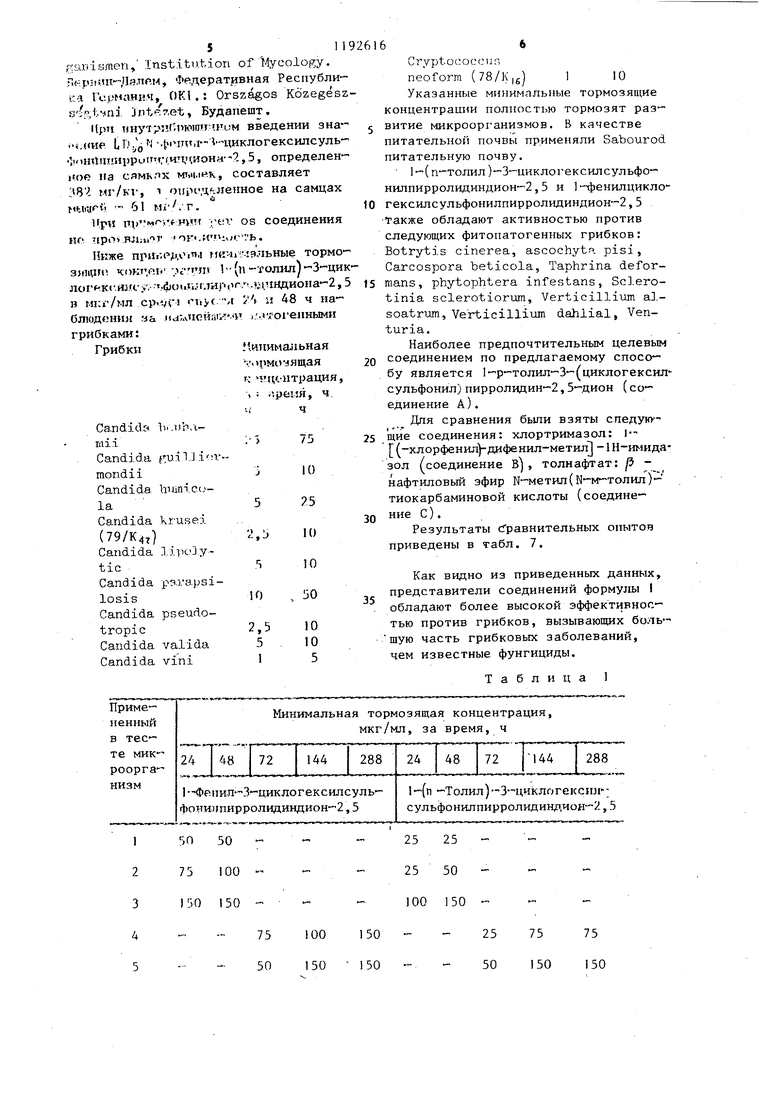
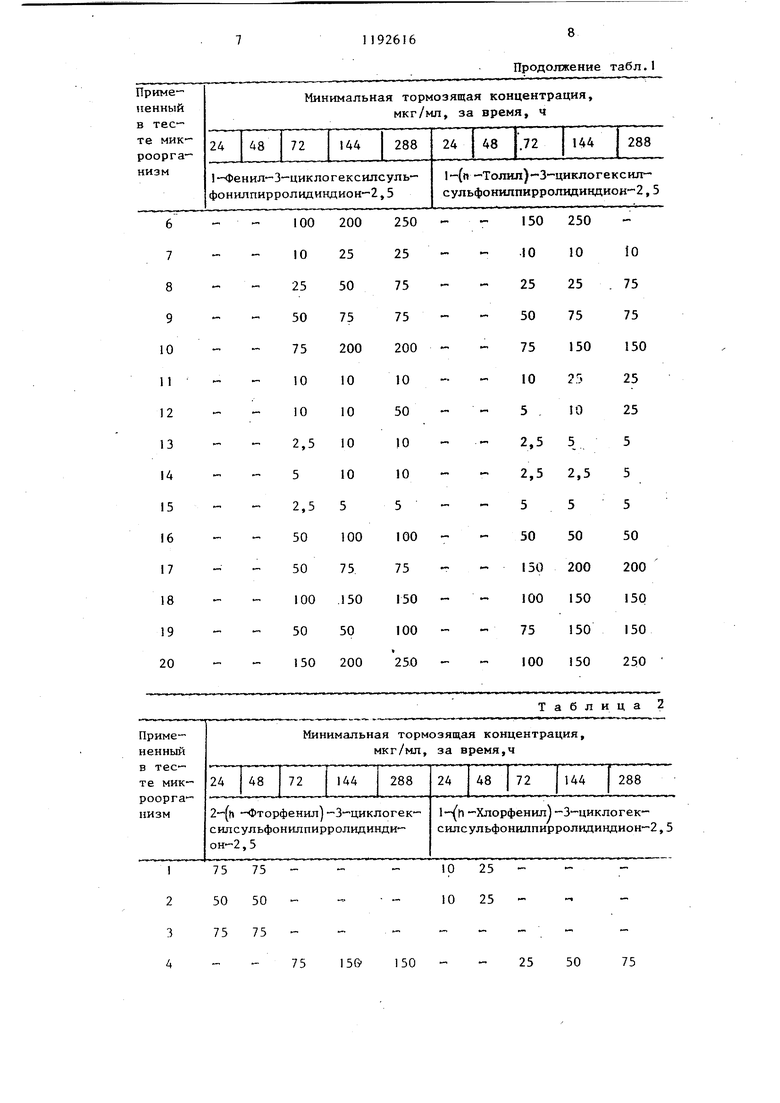
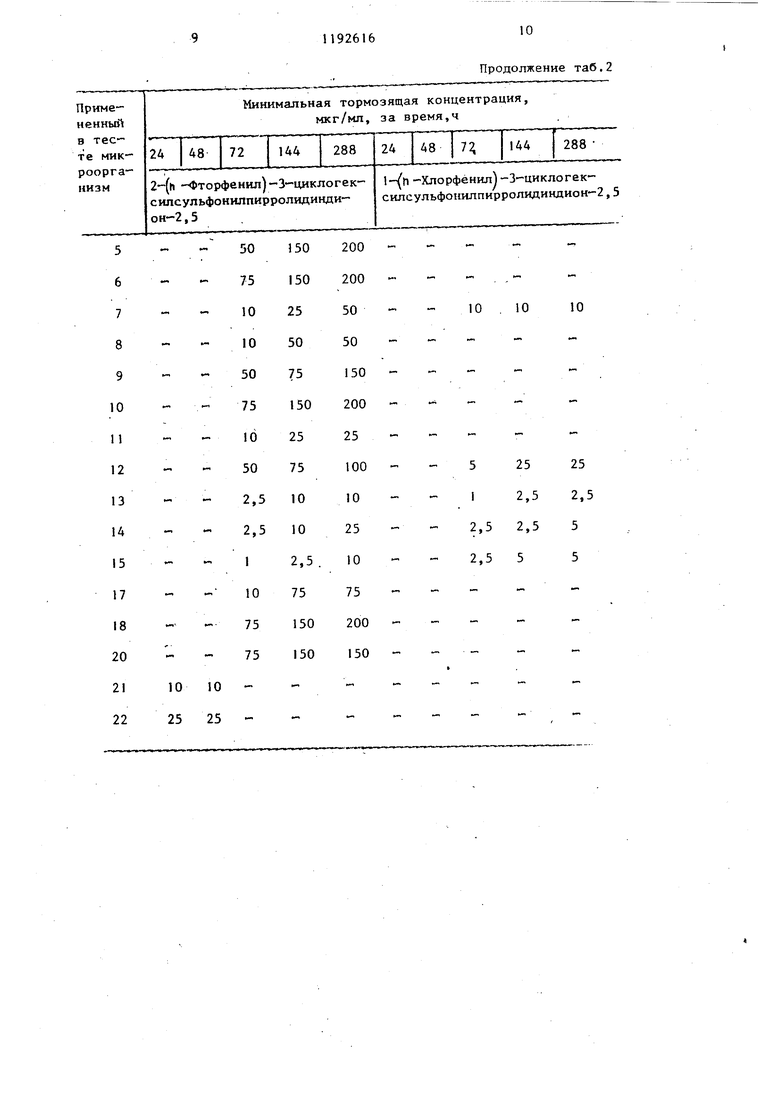


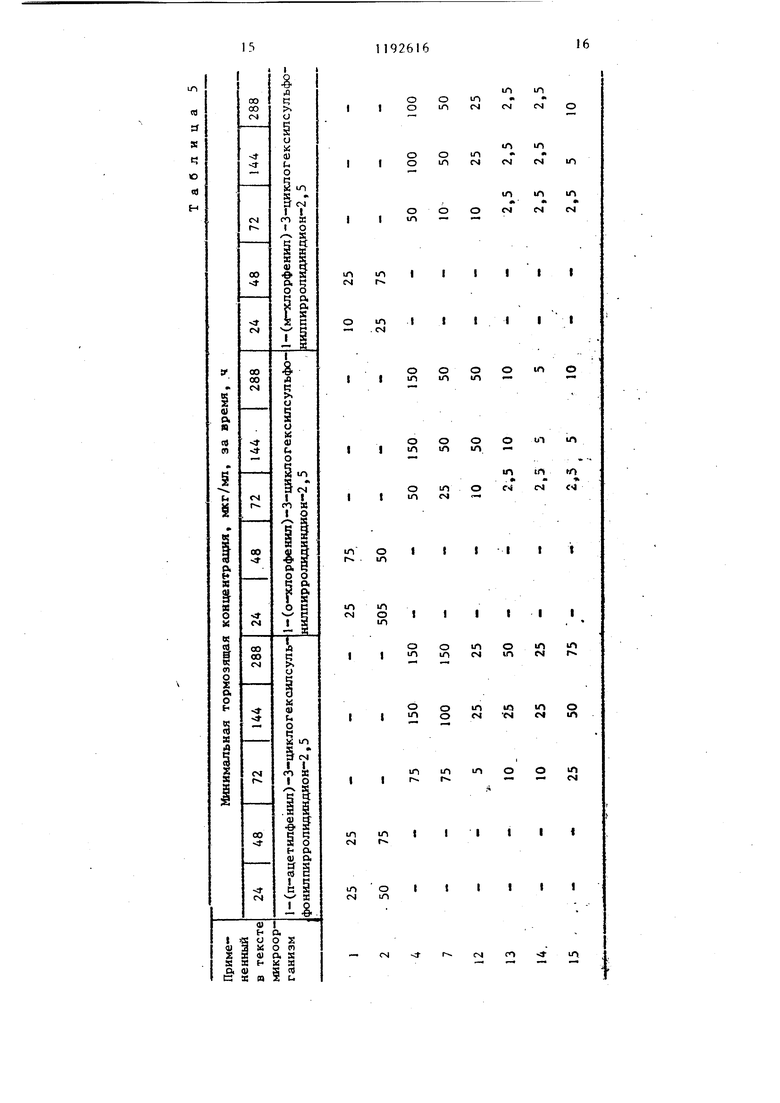
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения @ -замещенных 3-циклоалкилсульфонилпирролидиндионов-2,5 | 1981 |
|
SU1156594A3 |
| 3-Циклоалкилсульфонилпирролидиндионы-2,5,обладающие фунгицидной активностью | 1980 |
|
SU1373704A1 |
| Способ получения @ -замещенных 3-циклоалкилсульфонилпирролидиндиона-2,5 | 1981 |
|
SU1165231A3 |
| Способ получения N-замещенных 3-циклоалкилсульфонилпирролидиндионов-2,5 | 1980 |
|
SU1007555A3 |
| Способ получения геминальных дигалоидных производных конденсированных пиримидин-4-онов,рацематов или оптически активных антиподов | 1980 |
|
SU1151210A3 |
| Способ получения N-(карбамоилоксифенил)-карбаматов | 1975 |
|
SU886738A3 |
| Способ получения производных угольной кислоты | 1982 |
|
SU1186085A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1980 |
|
SU1082324A3 |
| Способ получения производных пиридо (1,2- @ ) пиримидина или их кислотно-аддитивных солей | 1978 |
|
SU1022659A3 |
| Способ получения 3-замещенных тетрагидропирроло/1,2- @ / пиримидинов,их кислотно-аддитивных или четвертичных солей | 1980 |
|
SU1048986A3 |
СПОСОБ ПОЛУЧЕНИЯ N-3AME ЩЕННЫХ 3 ЦИКЛОАЛК11ПСУЛЬФОНИШ1ИРРОЛИДИНДИОНА-2,5 общей формулы S02A о О N К где А - циклопентил или циклогексил; R - этил, гексил, фенил, бензил, толил, 4-метил-2-суль- . фофенил, 3,4-метилендиокснфеиил, 4-метил-3-карбоксифенил, 4-- метил-2-оксиметил- фенилили фенил, замещенньш в положении 1 4-метильной, метокси-, аминосульфонил-, ацетил-, этоксикарбонилами- носульфонил- или сульфогруппами, в положении 2 - хлором, в положении 3 - нитрогруппой, о т л и ч а ю щ-и и с я тем, что N-замещенньи пирролиди1здион-2,5 общей формулы to о (Л I я где R имеет указанные значения, подвергают взаимодействию с циклоалкилсульфиновой кислотой общей формулы НО - SO - А, где А имеет указанные значения, в смеси воды и низшего спирта.
50 50
100
75
150 150
4 5
100
75 50 150
25 25
25
50
100 150 25 50
75 150
75 150
Продолжение табл.1
50
150
75
150
10
25
10
50
50
75
150
75
10
25
50
75
2,5
10
2,5
10
1
2,5.
10
75
75
150
75
150
10 25
10 25
Продолжение таб.2
10
10
25
25
2,5
2,5
2,5
5
5
5
Itсм Ш io см см -
I ( III { t I
t I J JItI
j J I in (N
I I I t IS I
{ i (II1si
I J .-.- 4-- jг „
S § ( 115 I I
4Г IIt11I
-см
о о ою
о о 1Л о«о
см- -.1Л fsl
оою
о о о ю «о j см 1Л -. см см
ош
о о о 1Л «о
о.
о toin1Л. 1Л
о
Ю
CM - A о
о in
in
- П
CM
ооооо
ininin«nою
о оо о
IT) щ Ш in о ю
. „ см г - -
оо
1/1 от Щ Ш о
in m
о о lO«
IоЮtMOJ(N
in
in
m
о in
M
in
CM04
in in
in
«t«k
k
fvlCsl
О О CM
- -
in m
CMr.
о m
. CM
о о о о in о I I in ш «n --
от Ш
о о о о
щ Ш in-
1Л Ю
ш
.
«чъ
Cvlt-t r«i
in о
см-
in о I « II I I
r . in
Й S I I I I
о о in о in in
tlA in CM in M r
о о m «o m о
IIin о CM (M «ч in
in in m о о irt II r- f-„ CM
in in
CMГin о
CM m
- МчГГ- еМСО- 1П
17
Минимальная тормозящая концентрация г/мл
18 Таблицаб
1192616
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Bull of the Chem | |||
| Soc | |||
| of Japan,48/12/, 3675-77 | |||
Авторы
Даты
1985-11-15—Публикация
1981-08-12—Подача