Изобретение относится к способу получения новых а нтрациклингликозидов общих формул I и II
О
О онII
.C - CHs
он
где R - Н
(б),облада
ющих противоопухолевой активностью.
Цель изобретения - разработка способа получения гликозидных произ водных антрациклина, обладающих улучшенными свойствами по сравнению с противоопухолевыми препаратами-струк- турными аналогами: даунорубицином и доксорубидином
Пример 1. Получение 7-0-(2,6- дидеокси-о -Ь-арабиногексопиранозил)- дауномицинона Па и 7-0-.З б-три- деокси-оС- L-эритрогекс-2-енопирано- . зи.п -дауномицинона (На).
К раствору, содержащему 2 г да- уномицинона в 200 мл безводного хлористого метилена, прибавляют 1}25 г хлорида 3,4-ди-0-ацетил-2,6-дидеок- си-(1-Ъ арабиногексопиранозилла, растворенные в 30 МП хлористого метилена J и 12 г молекулярных сит (4 А Мерк). Смесь обрабатывают 1,28 г трифторметансульфоната серебра раст воренными в 30 мл безводного диэти- лового эфира. Через 5 мин смесь нейтрализуют прибавлением 0,65 мл безводного коллидина. После выдержки в течение 30 мин при комнатной температуре органический раствор промываю насыщенным водным раствором кислого углекислого натрия; водой, Ojl н„
0
5
0
5
30
35
40
45
55
водным раствором хлористоводородной кислоты и, наконец, водой. Органическую фазу отделяют и упаривают в вакууме до получения сухого остатка. Полученный остаток подвергают очистке с помощью хроматографии на колонке, наполненной кремневой кислотой, при применении в качестве элюируюшего средства смеси этилового эфира уксусной, кислоты и циклогексана (1:1 по объему). В результате порознь получают 0,9 г соединения формулы, Vap т.пл„ in-ne C, ПМР (CDCl): infer alia около l,235(d, CHj-C-S ); 1,95S (S, CHjCOGC) 2,07 § (S , CHjCOOC), 2,43S-(S, CHjCO); 5,20S (CH-7); 5,53 (S (CH-1 ) и 0,9 г соединения формулы Via, т,пл. 83-84 с.
Соединение формулы .Va (0,7 г) растворяли в ацетоне (45 мл) и производили обработку 50 мл 0,2 н. водного раствора гидроокиси натрия при комнатной температуре. Через 1 ч значение рН раствора доводили до 7, после чего производили экстрагирование хлороформом. После отгонки органического растворителя в вакууме получали чистое соединение 1а с количественным выходом, т.пл, 161- 162 С, FD-MC: m/z 528 (М). После обработки соединения формулы Via в основных условиях получали в чистом виде соединение формулы На, т.пл. 181- 82 с. FD-MC: n/z 510 (М) ПЛР (CDClj): inter alia около l,40S (d5 СНз-С-5-),, 2,42:9 (S, CHjCO); 5,33 S (CH-7} , 5,588(CH-1 ) и 5,5-6,0 /m; CH-2 (CH-3),
П p и M e p 2. Получение 4-демет- окси-7-0- (2, б-дидеокси-оо-Ь-арабино- гексопиранозил)-дауномицинона (IB) и 4-деметокси-7-0-(2,3,6-тридеокси- оС-Ь-эритрогекс-2-енопиранозил)-дау- номицинона (Ив).
К раствору 0,74 г 4-деметоксидау- номицинона (Шв) в безводном хлористом метилена (70 мл) прибавляют 0,65 г галогенида сахара формулы IV, растворенные в 10 мл хлористого метилена, и 5 г молекулярных сит (4 А Мерк), Смесь обрабатывают 0,64 г трифторметансульфоната серебра, растворенными в 15 мл безводного диэти- лового эфира. Через 5 мин реакционную смесь нейтрализуют прибавлением 0,4 мл безводного коллидина. После выдержки в течение ч при комнатной температуре органический раствор
промывают иасмщенным водным раствором кислого углекислого натрия, водой, водным 0,1 и. раствором хлористоводородной кислоты и снова водой. Органическую) фазу отделяют, после чего раствор упаривали до получения сухого остатка в вакууме. Полученный в результате этого остаток подвергают очистке с помощью хроматографии на колонке, заполненной кремневой кислотой, при применении в качестве элюирующего средства смеси хлороформа и ацетона (96:4 по объему). В результате получают 0,48 г соединения формулы Vb,, т.пл, 65-66 С, FD-MC: m/z 582 (М), и 0,43 г соединения формулы Vlh. Соединение Vh растворяют в 20 мл ацетона и производят обработку 20 мл 0,2 н. водного раствора гидроокиси натрия при комнатной температуре. Через 1 ч значение рН раствора доводят до 7 и экстрагируют хлороформом. После отгонки органического растворителя в вакууме получают чистое соединение формулы 1Ъ с количественным выходом, т.пл. , FD-MC: m/z 498 (м ). После обработки соединения формулы VIb в основных условиях получали чистое соединение формулы lib. IMP (CDCl) inter alia около 1,39 (CHj-C-5 ); 2,42& (S, CHj-CO), 3,50-4,00 5(m, и C-H-5 ); 4,08(f: , CHjO); 5,33iS:(bs, C-H-7), 5,58i(bs, C-II-l ) 5,65 (d, С-Н-З О, 5,93 .(d, C-H-fO.
Биологическая активность соединений На, Ib,
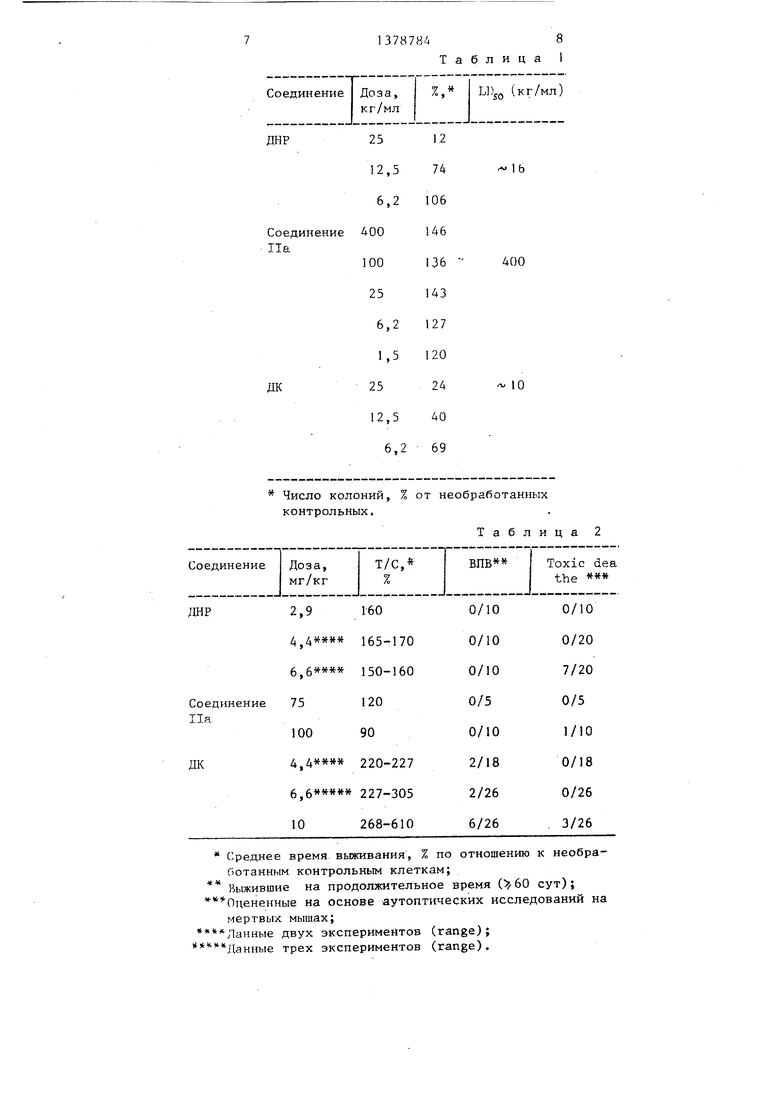
Соединения На и Ib были испытаны в сравнении с даунорубицином (ДНР) и доксорубидином (ДК) в in vitro и in vivo системах с целью установления их цитотоксичности и противоопухолевой активности.
В табл. 1 приведены активности на Hela клетках, размножаюгщхся продуктивно in vitro (обработка 24 ч).
Соединение Па примерно в 25 раз менее цитотоксично, чем ДНР, и в 40 раз менее цитотоксично, чем ДК.
Первичные исследования in vitro были проведены на CDF-1 мышах, стра- даю1 шх асцитической Р388 лейкемией (10 клеток/мышь). Результаты представлены в табл. 2 (обработка i.p. 1 раз в сутки). Соединения На, суспендировали в 10%-ном Tween 80 и инъицировали внутрибрюшинно. Сое- динение На оказалось менее токсичным и было инертным по отношению к Р388 асцитической лейкемие при двух- дозном .испытании, включая максималь- 5 переносимую дозу (ШД) 100мг/кг.
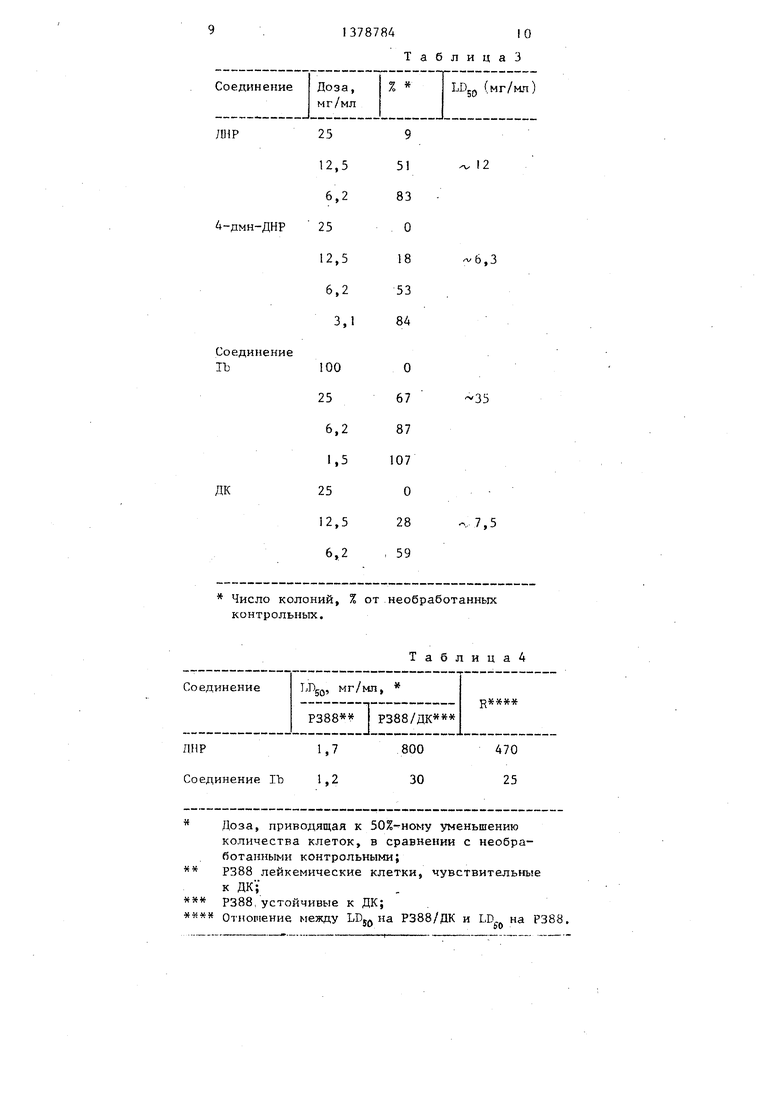
Соединение Ib было изучено in vitro на Heln и Р388 лейкемических клеток чувствительных (Р388) и устойчивых (Р388/ДК) к ДК, а in vitro- O на Р388 и Gi OKS leukemia. Значения, приведенные в табл. 3, показывают, что соединения Ib, исследованное на Hela клетках, размножаюглз хся продуктивно in vitro, в сравнении с изпест- 5 иыми соединег1иями ДНР и 4-деметок- си-ДПР (4-дм-ДНР), в 3 и 6 раз менее цитоксично, чем ДНР и 4-дм-ДНР,
Соединение Ib было изучено на Р388/ДК in vitro.
0 Р388 и Р388/ДК лер1ке шческие клетки бьти отобраны из асцитической жидкости мышей и помещены для выра- иивания в суспензию in idtro. Тесты на питотоксичность осуществляли 5 путем воздействия на клетки препаратов в различных концентрациях в течение 48 ч. В конце экспозиционного периода клетки были подсчитаны с помощью счетчика Coulter клеток, а Q доза, которая дает 50%-ное
уменьи1ение количества клеток, в сравнении с необработанными контрольными клетками была рассчитана.
Табл. 4 показывает, что соединение Ib было приблизительно таким же цитотоксичным, как ДНР на Р388 лей- кемических клетках, и было очень активно по отношению к Р388/ДК лейке- мическим клеткам. ДНР было приблизительно в 500 раз менее активно по отнопению к устойчивым клеткам, чем к чувствительным клеткам.
Результаты первичного исследования in , проведенного на CDF-1 мышах, страдающих асцитической Р388 лейкемией и обработанных i.p. через сутки после трансплантации опухоли, показаны в табл. 5.
Сравнение на максимальную пере- дозу показало, что соединение 0 Ib менее активно, чем ДНР и 4-дм-Д}1Р.
Результаты исследований, проведенных на СЗН/Ме мышах с i.v. трансплантированной Gross leukema, обработанных i.v. через сутки после 5 трансплантации опухоли, приведены в табл. 6. Соединения ТЬ оказались более токсичными и более сильнодей- ствуюшлми, чем родственные соедине5
0
5
нияо Сравнение максимальных переносимых доз показывает, что Ib более активно, чем ДНР. Соединение ТЪ далее исследовали на активность при введении через рот, на Gross leuke- nia трансплантированную i.v., в сравнении с ДНР, ДК, вводимыми i.v, и в сравнении с 4-дм-ДНР, вводимым через рот.
Данные, приведенные в табл. 7, показывают, обладает хорошей противоопухолевой активностью при введении через рот 1 раз в сутки в сравнении с активностью 4-дм-ДНР (где продемонстрирована как активная при введении через рот) и ДНР при введении i.v.
Таким образом, соединения 1Ъ и На обладают улучшенными свойствами по сравнению с противоопухолевыми препаратами - доксорубидином и даун рубицином.
Формула изобретени
, Способ получения антра1Д1клин- гликозидов общих формул
он
о он
где R - Н (а), OCHj б, отличающийся тем, что антрациклинон общей формулы
О
В О ОН ОН
где R имеет указанные значения, растворяют в хлористом метилене и обрабатывают хлористьм 3,4-ди-()-аце- тил-2,6-дидезокси-/-Ь-арабиногек- сопиранозилом формулы
VN
о
ОССНч
и
о
в присутствии трифторметансульфоната серебра и молекулярных сит, полученную смесь гликозидов обших формул ОН О
,с-сн
он
оссн, II
о он н
.С-СНа
ОН
OCCHj
о
где R имеет указанные значения, разделяют и очищают хроматографированием на колонке, заполненной сили- кагелем, с использованием смеси этил- ацетата и цикло.гексана 1:1 (по объему) в качестве элюента, загщтные 0- ацетильные группы удаляют обработкой
0,2 Н. водным раствором гидроокиси натрия при комнатной температуре.
Таблица




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 4 @ -галоид-антрациклингликозидов | 1984 |
|
SU1579465A3 |
| Способ получения 4-йодпроизводных антрациклингликозидов | 1982 |
|
SU1181550A3 |
| Способ получения антрациклиновых гликозидов | 1986 |
|
SU1553015A3 |
| Способ получения 6-деоксиантрациклингликозидов | 1984 |
|
SU1429935A3 |
| Способ получения хлоргидратов замещенных антрациклинов | 1979 |
|
SU867315A3 |
| Способ получения гликозида | 1987 |
|
SU1590045A3 |
| Способ получения дезоксиантрациклинов | 1979 |
|
SU902667A3 |
| Способ получения гидрохлоридов поли-4-аминопиррол-2-карбоксамидопроизводных | 1986 |
|
SU1544185A3 |
| Способ получения гликозидов антрациклина | 1980 |
|
SU993822A3 |
| Способ получения гидрохлоридов поли-4-аминопиррол-2-карбоксамидопроизводных | 1987 |
|
SU1609445A3 |
Изобретение касается замещенных гликозидов, в частности получения антрациклингликозидов общих Лормул I и II с(о)снз он --он R ОН вон с(о)снз --он --ш он где R - Н (а);,ОСН (б), которые обладают противоопухолевой активностью. Цель изобретения - разработка нового способа получения более активных веществ указанного класса. Синтез соединений I и II ведут реакцией соединений формул III и IV О ОН R О ОН ОН СНч- с-о о Cri,Gl сл о 0-С(0)СНз Процесс ведут в хлористом метилене в присутствии трифторметансульфона- та серебра и молекулярных сит с последующим разделением и очисткой хроматографией на колонке. Последняя заполнена силикагелем и процесс ведут с использованием смеси зтилацета- та и циклогексана (равные объемы)в качестве элюента. Защитные 0-ацетиль- ные .группы удаляют обработкой 0,2 н. раствором NaOH при комнатной температуре. Новые вещества обладают лучшим противоопухолевым действием, чем известные - доксорубицин и дауно- рубицин. Активная доза 3-4,4 мг/кг. 7 табл. 00 00 ч 00 4 СМ
Число колоний, % от необработанных контрольных.
Таблица 2
инение
2,91600/100/10
4,4 165-1700/100/20
6,6 150-1600/107/20
751200/50/5
100900/101/10
4,4 220-2272/180/18
6,6 227-3052/260/26
10268-6106/26 . 3/26
Среднее время выживания, % по отношению к необработанным контрольным клеткам;
Выжившие на продолжительное время (60 сут); Оцененные на основе аутоптических исследований на
мертвых мышах;
Ланные двух экспериментов (range); Данные трех экспериментов (range).
137878410
ТаблицаЗ
Число колоний, % от необработанных
контрольных.
Доза, приводящая к уменьшению
количества клеток, в сравнении с необработанными контрольными;
Р388 лейкемические клетки, чувствительные к ДК ;
Р388.устойчивые к ДК; .
Отношение между на Р388/ДК и LD. на Р388.
ТаблицаА
дар
2,9
4,4
ДНР
нение
0,75
1,25
2,5
5
4,4,
6,6
10
159-194 140-184 163
140 163 63 220 305 610
0/18 0/18 0/8
0/8.
0/9
0/10
1/10
0/10
5/10
0/8
7/18
0/8
0/8
3/9
10/10
0/10
0/10
0/10
Таблица 6
Таблица
3,6
150
0/6
13
1378784
День после трансплантации опухоли; Данные двух экспериментов (rande).
14 Продолжение табл,7
Авторы
Даты
1988-02-28—Публикация
1983-05-17—Подача