Изобретение относится к микробиологии и касается способов получения ферментов нуклеинового обмена, в частности рестриктаз.
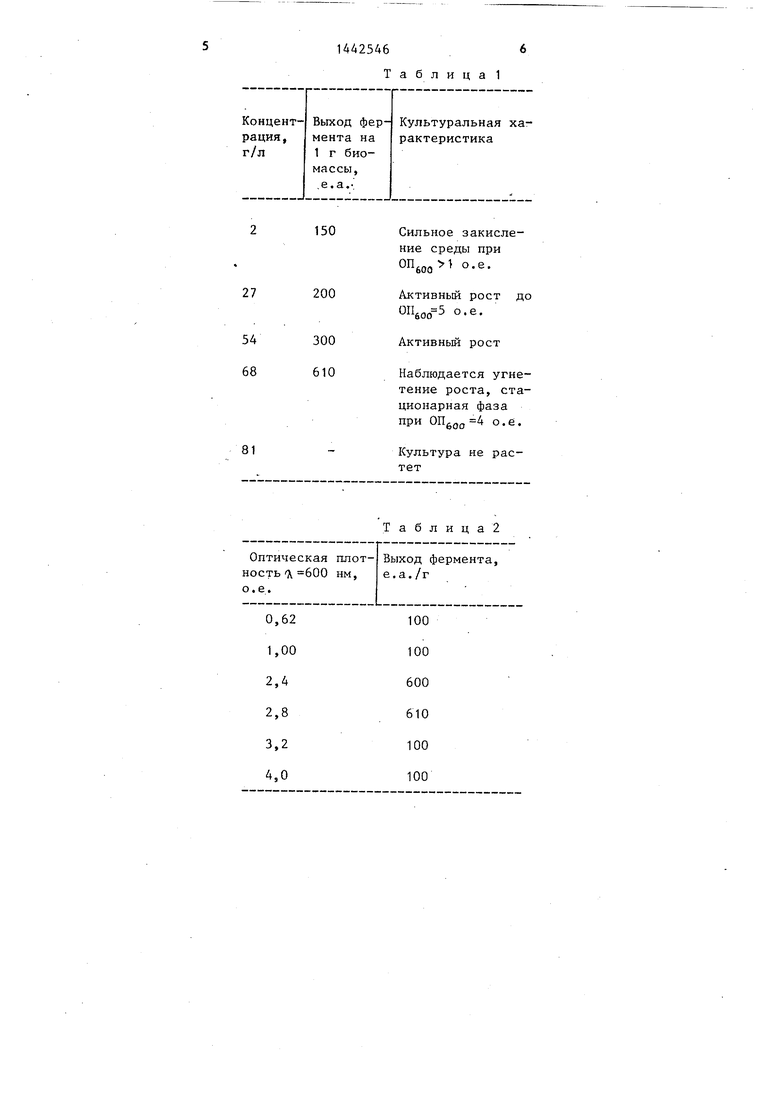
Целью изобретения является повышение удельной активновти и выхода целевого продукта. Для осуществления способа подбирают концентрацию неорганического фосфа та. Экспериментальные данные представлены в табл. 1 .
Как виднЬ из табл. 1, оптимальная концентрация составляет 68 г/л и значительно (в 34 раза) превьшает концентрацию . в известном способе .
Оптимальную фазу роста, при которой следует прекратить культивирование и начинать сбор урожая, подбира- ют, исходя из экспериментальных данных, приведенных в табл. 2.
Наибольший удельньм выход рестри- ктазы наблюдается при оптической плотности 2,4-2,8 о.е.
Биомассу осаждают центрифугированием и подвергают разрушению на ультразвуковом дезинтеграторе MSE. Клеточные обломки осаждают повторным центрифугированием. Хроматографичес- кую очистку проводят, используя фос- фоцеллюлозу Р-11, дальнейшую очистку ведут на DEAE-целлюлозе. Концентрирование осуществляют хроматографией на Р-11 целлюлозе.
Пример 1 (по известному способу) . Получение рестриктазы SfaN I из Streptococcus faecalis ND 547.
Клетки высевают на чашки с пита- тельной средой,следующего состава, т;риптон (Difco) 10; дрожжевой экстракт-(Difсо) 5; глюкоза 5; ( 2 (рН 7,2); агар 15, инкубируют при . Выросшие клетки вносят бактериологической петлей в 100 мл жидкой питательной среды такого же состава (без агара) и культивируют при . Затем инокулят вносят в 2 л свежей питательной среды и культивируют до оптической плотности 1,5 о.е. при длине волны нм. Биомассу осаждают центрифугированием на центрифуге , J - 21, ротор J А - . 10,8 тыс. об/мин 15 мин. Выход биомассы 6,6 г.
Биомассу суспендируют в 48 мл 10 мМ трис-НС (рН 7,5), содержащего 10 мМ 2-меркаптоэтанола, и разрушают в ультразвуковом дезинтеграторе MSE
s
Q 5 Q
5
три раза по 40 с на частоте 20 кГц, амплитуда 12 мкм. Клеточные остатки осаждают при 16- тыс. об/мин в течение 30 мин. Осветленный супернатант наносят на колонку с BiO Gel А 0,5М. Фракции, содержащие эндонуклеазные активности, собирают и концентрируют диализом против 100% глицерина и далее диализируют против буфера 1, содержащего 10 мМ К-Р (рН 7,4), 10 мМ 2-меркаптоэтанола, 6,1 мМ ЭДТА и 10% глицерина. Пробы наносят на колонку с DEAE-целлюлозой. Элюцию ведут в линейном градиенте 0-0,5 М КС1 в буфере 1, Эндонуклеазу диализуют и очищают в колонке с фосфоцеллюлозой (0,5х х15 см). Элюцию ведут линейным градиентом 0-1,011 КС1 (140 мл) в буфере 1. Эндонуклеазные пробы собирают и используют в экспериментах. Выход рестриктазы 150 е.а./г биомассы. Активность фермента 600 е.а./мл.
П р и м е р 2 (по предлагаемому способу). Получение Sfa N I.
Культивирование ведут как в примере 1, только в составе питательной среды вместо дрожжевого экст1 акта фирмы Difco используют дрожжевой экстракт НПО Биолар, а концентрация составляет 68 г/л. Культивирование ведут до оптической плотности 2,4. Выход биомассы 11,2 г.
Выделение и очистка Sfa N I. Выделение фермента проводят при . Биомассу ресуспендируют в буфере А (0,05 М трис-HCl, рН 7,5; 5, ЭДТА, 0,1 М 2-меркаптоэтанол, 0,2% NP-40) в соотношении 6 г биомассы на , 20 мл буфера. Разрушают ультразвуком в ультразвуковом дезинте- rjpaTOpe MSE три раза по 40 с на частоте 20 кГц, амплитуда 12 мкм. Осаждают клеточные остатки при 16 тыс. об/мин в течение 30 мин. Осветленный супернатант наносят на колонку с фосфоцеллюлозой Р-11, предварительно уравновешенную буфером В (0,02 М КН5,Р04, рН 7,5; 5,4 10 - М ЭДТА, О,1 М 2-меркаптоэтанол), колонку промьгоают этим же буфером, объем которого равняется двум объемам смолы. Сорбированньй на фосфоцеллюлозе белок смывают 1 М NaCl в буфере, собранный белок диализуют 3 ч против 3 л буфера и,наносят на колонку с DEAE-целлюлозой. Элюцию проводят 40 мл буфера В с линейным градиентом NaCl (О - 1 М), собирают фракции по 2 мл.
10
15
20
31442546
Фермент элюируют при 0,4-0,6 М NaCl. Фракции, содержащие ферментативную активность, собирают, диализуют 3 ч против 3 л буфера В и концентрируют с помощью хроматографии на Р-11 целлюлозе объемом 3-5 см . Элюцию проводят градиентом NaCl в буфере В, 40 мл О - 1 М. Фермент смывают с колонки при 0,65 М NaCl. Фракции по 2 мл, содержащие I, собирают, диализуют 20 ч против буфера С (0,02 М К-фосфат, рН 7,5; 0,02 М КС1, 5,4х ЭДТА, 0,1 М 2-меркаптоэтанол, 50% глицерин).
Определение активности фермента проводят следующим образом.
К 30 мкл реакционной смеси, содержащей 2 мкг ДНК фага С1857 (0,02 М трис-HCl, рН 7,5; 0,01 М MgCl, 0,15 М NaCl), добавляют 1 мкл из соответствующих фракций при очистке фермента. Инкубацию ведут 60 мин при 37 С. Продукты гидролиза анализируют электрофорезом в 1,7%-ной агарозе в трис-ацетатном буфере, рН 0,05 (0,5 М трис-HCl, 0,2 М ацетат натрия, 0,02 М ЭДТА). Гель окрашивают бромистьм эти- дием (5 мг/л), фотографируют в ультрафиолете через красный светофильтр (К-8 ). За единицу активности приниг мают количество фермента, необходимое для полного гидролиза 1 мкг ДНК фага С1857 за 1 ч при 37°С.
Выход рестриктазы на 1 г биомассы составляет 600 е.а. Активность фермента 4000 е.а./мл.
Результаты сравнения известного и предлагаемого способов представлены в табл. 3.
П р и М е р 3. Фермент получают по примеру 2, но культивирование ведут до оптической плотности 2,8 при длине волны «Л 600 нм. Выход биомассы 13г. Выход фермента 610 е.а./1 г биомассы, а его активность 4000 е.а./мл (табл,3) .
П р и М е р 4. Фермент получают по примеру 2, но культивирование ведут
25
30
40
П р им ер 6. Фермент получают по примеру 3, но концентрация глюкозы 3 г/л. Отмечается увеличение лаг-фазы выход фермента 580 е.а./г.
Пример. Фермент получают по примеру 3, но концентрация глюкозы 1 г/л. Отмечается увеличение темпов роста, но выход фермента снижается до 500 е.а./г.
П р и М е р 8. Фермент получают по примеру 3, но концентрация дрожжевого зкстракта 10 г/л. Резко ингиби- рует рост культуры, фермент не удается тестировать.
П р и М е р 9. Фермент получают по примеру 3, но концентрация дрожжевого зкстракта 3 г/л. Отмечается увеличение лаг-периода, выход фермента 300 е.а./г.
Концентрацию триптона подбирают, исходя из экспериментальных данных, представленных в табл. 4.
Предлагаемый способ позволяет увеличить выход биомассы с 1 л культу- ральной жидкости в 1,5-2,0 раза, увеличить выход фермента на 1 г биомассы в 4 раза и повысить его активность в 6-7 раз (табл.3).
Ф о рмула изобретения
Способ получения рестриктазы 35 Sfa N I, способной узнавать и расщеплять последовательность нуклеотидрв 5 -GCATCN5- , З -CGTAGN, включающий
культивирование продуцента штамма Streptococcus faecalis при 3-7 С в
питательной среде, содержащей триптон .в концентрации 10 г/л, глюкозу и дрожжевой экстракт в концентрации по 5 г/л, двузамещенньй фосфат калия и воду, центрифугирование биомассы, 45 разрушение клеток ультразвуком и хро- матографическую очистку, включая , ДЭАЭ-целлюлозу и фосфоцеллюлозу, о т- личающийся тем, что, с целью повьш1ения удельной активности
до. оптической плотности 1,0 при длине gQ выхода целевого продукта, в качест0
5
0
5
0
П р им ер 6. Фермент получают по примеру 3, но концентрация глюкозы 3 г/л. Отмечается увеличение лаг-фазы, выход фермента 580 е.а./г.
Пример. Фермент получают по примеру 3, но концентрация глюкозы 1 г/л. Отмечается увеличение темпов роста, но выход фермента снижается до 500 е.а./г.
П р и М е р 8. Фермент получают по примеру 3, но концентрация дрожжевого зкстракта 10 г/л. Резко ингиби- рует рост культуры, фермент не удается тестировать.
П р и М е р 9. Фермент получают по примеру 3, но концентрация дрожжевого зкстракта 3 г/л. Отмечается увеличение лаг-периода, выход фермента 300 е.а./г.
Концентрацию триптона подбирают, исходя из экспериментальных данных, представленных в табл. 4.
Предлагаемый способ позволяет увеличить выход биомассы с 1 л культу- ральной жидкости в 1,5-2,0 раза, увеличить выход фермента на 1 г биомассы в 4 раза и повысить его активность в 6-7 раз (табл.3).
Ф о рмула изобретения
Способ получения рестриктазы 35 Sfa N I, способной узнавать и расщеплять последовательность нуклеотидрв 5 -GCATCN5- , З -CGTAGN, включающий
культивирование продуцента штамма Streptococcus faecalis при 3-7 С в
40
питательной среде, содержащей триптон .в концентрации 10 г/л, глюкозу и дрожжевой экстракт в концентрации по 5 г/л, двузамещенньй фосфат калия и воду, центрифугирование биомассы, 45 разрушение клеток ультразвуком и хро- матографическую очистку, включая , ДЭАЭ-целлюлозу и фосфоцеллюлозу, о т- личающийся тем, что, с целью повьш1ения удельной активности


| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм бактерий SтRертососсUS FaecaLIS - продуцент рестриктазы SFa N @ | 1988 |
|
SU1645293A1 |
| Способ получения эндонуклеазы рестрикции | 1982 |
|
SU1095645A1 |
| Способ получения рестриктазы, способной узнавать и расщеплять последовательность нуклеотидов GTCGAC | 1989 |
|
SU1752769A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ HINF I | 1997 |
|
RU2136749C1 |
| Штамм бактерий PaRacoccUS DеNIтRIFIсаNS-продуцент эндонуклеазы рестрикции Р @ 121 | 1988 |
|
SU1532583A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO RV | 1984 |
|
SU1218678A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ BSE 21 I | 1999 |
|
RU2184777C2 |
| Штамм бактерий АсINетовастеR саLсоасетIсUS продуцент рестриктазы Аса 1 | 1989 |
|
SU1661212A1 |
| Штамм бактерий ТнеRмUS RUвеR-продуцент рестриктазы TRU 9 1 | 1989 |
|
SU1687614A1 |
| ШТАММ БАКТЕРИЙ KLEBSIELLA AZEANAE - ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ KAZ 48 KI | 1993 |
|
RU2044055C1 |
Изобретение относится к микробиологии, в частности к способам получения ферментов нуклеинового обмена. Цель изобретения - повьппение удельного выхода и удельной активности рестриктазы SfaHI. Штамм Streptococcus faecalis В-2293, продуцент рестриктазы Sfa N I, выращивают на питательной среде следующего состава, г/л: триптон 10, глюкоза 5, дрожжевой зкстракт 5, 68 до достижения , оптической плотности 2,4-2,8 о.е. i при Л 600 нм. Биомассу осаждают центрифугированием и разрушают на ультразвуковом дезинтеграторе, клеточные обломки осаждают повторным центрифу- гированием. Очищают хроматографией на фосфоцеллюлозе Р-11, а затем на DEAE-целлюлозе, концентрируют хрома- тографией на целлюлозе Р-11. 4 табл. (Л 4а N9 S Од
волны Д 600 нм. Выход рестриктазы 100 е.а./г биомассы.
П р и М е р 5. Фермент получают по примеру 2, но концентрация
ве продуцента используют штамм Streptococcus faecalis ВКПМ В-2293, культивирование ведут на среде, содержащей двузамещенньй фосфат калия в кокв культуральной жидкости 27 г/л. Вы- 55 центрации 68 г/л, до достижения оптиход биомассы 12,8 г, выход рестриктазы 200 е.а./г.
ве продуцента используют штамм Streptococcus faecalis ВКПМ В-2293, культивирование ведут на среде, содержащей двузамещенньй фосфат калия в кокческой плотности 2,4-2,8 о.е. мм.
при
14425466
Т а б л и ц а 1
Выход фермента на 1 г биомассы, .е.а.-.
150
200
300 610
81
Таблица 2
плот- Выход фермента, им, е.а./г
100
100
600
610
100
100
Культуральная характеристика
Сильное закисле- ние среды при ОП, о.е.
Активньй рост до 011, о.е.
Активньй рост
Наблюдается угнетение роста, стационарная фаза при 4 о.е.
Культура не растет
Параметры
Выход биомассы с -1 л культураль- ной жидкости, г
Выход фермента, е.а./л
Выход фермента
на 1 г биомассы,
а.а.
Активность фермента, е.а./мп 600 4000
Таблица4
Концентра- Выход фер- Дополнительная ция трип- мента на характеристика тона, г/л 1 г,е.а.
5 500 Увеличение лаг- -фазы роста
10 600 Стабильное ; .культивирование
15 600 Удорожание процесса культивирования
Составитель Н.Ходаров Редактор Н.Гунько Техред М.Дидык Корректор М.Демчик
Заказ 6355/23 Тираж 520 Подписное
ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, -1-35, Раушская наб,, д, 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
14425468
ТаблицаЗ
Показатели по способу
извест- предла- ному I гаемому
6,5
4000
610
| Janulaitis А., Магеinkevicie- ne L., Petrusyte M., Mironov A | |||
| A | |||
| new Sequence-specific endonuclea- se from Stre.ptococcus durans | |||
| - FEES Letters, 1981, m, 172-174 | |||
| Fitzgerlad G.F., Daly C., Brown L.R., GingerasiT.R | |||
| Scr-.FI: A new sequence-specific endonuclease from Streptococcus cremoris | |||
| - Nucleic Acids Res, 1982, Ш, 24, 8171- 8179. | |||
| WU King C.T., Jay E | |||
| A new sequence-specific endonuclease from Streptococcus faecalis subsp | |||
| zymo- genes | |||
| - Gene, 1978, 4, 4, 329-336. |
Авторы
Даты
1988-12-07—Публикация
1987-04-20—Подача