ы
Изобретение относится к способу получения новых производных гидантои на, обладающих антиаритмическим действием при очень-низкой токсичности.
Цель изобретения - получение новы производных гидантоина, обладающих о активностью,не характерной для этого ряда соединений.
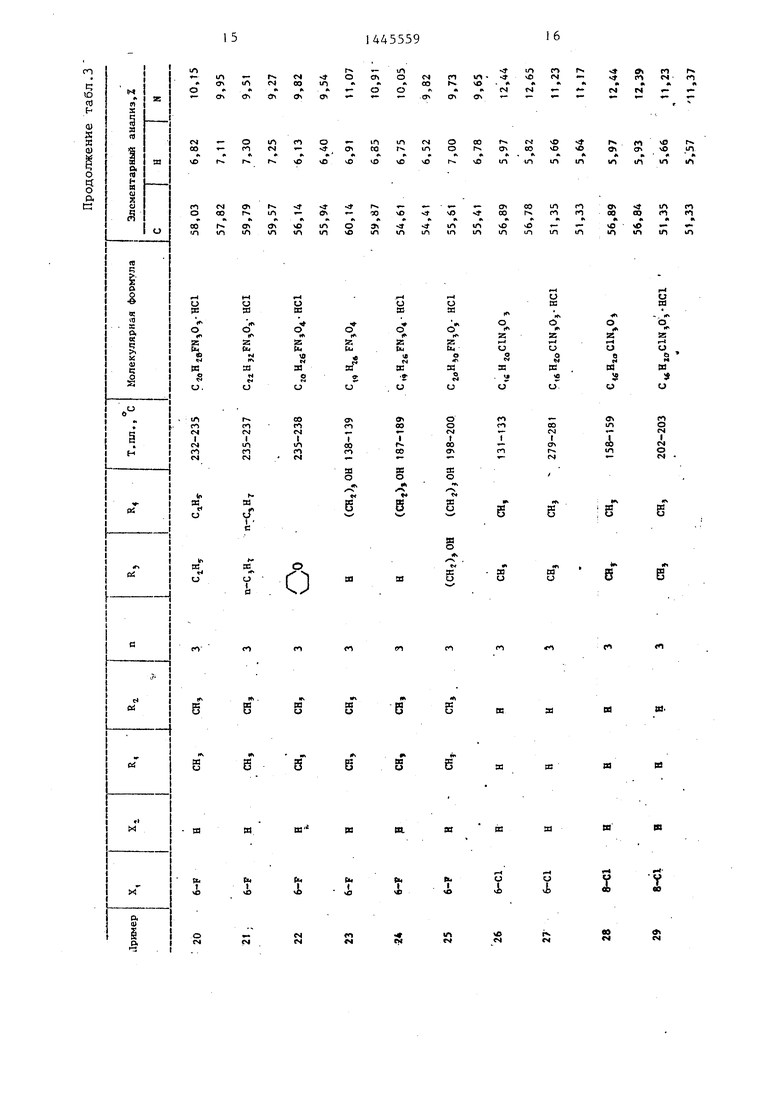
Пример 1, 2,2-Диметил-6-фтор (4-оксипипе ридино)-пропил (спи ро)хроман-4,4 -имидазолидинЗ-2 ,5 - дион. .
а. 2,2-Диметил-6-фтор-1 - З-бром- пропил(спиро)хроман-4,4 -имидазоли- ,5 -дион.
1,0 г (25 мМ) гидрида натрия (60%-ная суспензия в минеральном масле) добавили в раствор 6,6 г (25 мМ) 2,2-диметил-6-фторспиро(хроман-4,4 - имидазолидин)-2 ,5 -диона и к раствору 10,1 г (50 мМ) 1,3-дибромпропа- на 5 70 мл диметилформамида при 15- 30 С. Смесь 5 ч перемешивали при комнатной температуре. Реакционную жидкость вылили в лед/воду. После экстрагирования этилацетатом полученный в результате слой этилацетата промьши водой-и высушили затем над сульфатом магния. Растворитель ото- гнали при низком давлении, 12,7 г остатка очистили при помощи колоночной хроматографии на силикагеле (проявитель, дихлорметан / этанол) и получили 6,95 г (72,2%) целевого продукта. Т.пл. 190-192°С.
Вычислено, %: С 49,87; Н 4,71; N 7,27.
C fiH eBrFNjOj.
Найдено, %: С 49,63; Н 4,59; N 7,15.
ЯМР (CDClj)5 : 1,32(ЗН, с); 1,50 (ЗН, с); 2,02(1Н, д Гц); 2,24 (2Н,к, Гц); 2,60 (1Н,д Гц) 3,40 (2Н, т. Гц); 3,74 (2И,т, Гц); 6,36 (1Н, с); 6,45-7,10 (ЗН, м).
Ь. 2,2-Диметил-6-фтор-1 (4- оксипиперидино)пропил(спиро)хроман-4 4 -имидазолидин -2 ,5 -дион,
6,0 г (15,6 мМ) бромистого соеди- нения, полученного в примере 1а, 3,15 г (31,2 мМ) 4-оксипиперидина, 4,31 г (31,2 мМ) карбоната кальция и раствор небольшого количества Йодида калия в 70 мл диметилформа- МИДа перемешивали 5 ч при 90 С, Реакционную жидкость вылили в воду и экстрагировали этилацетатом. Полу
5
0
о о
50 55
35
45
ченный слой этилацетата промыли водой, а затем высушили над сульфатом магния. Растворитель отогнали при пониженном давлении и остаток кристаллизовали из зтанолэтилацетата. Получили 5,85 г (92,6%) целевого продукта, который затем преобразовали в его хлористоводородную соль обычным способом. Т.пл. хлористоводородной соли 211-2J3 С (свободная форма 195-197 С).
Вычислено, %: С 62,20; Н 6,96;
N 10,36.
C2,H,gFN,04.
Найдено, %: С 61,92; Н 7,01; N 10,25,
ЯМР (CDCl,) : 1,32(ЗН,с); 1,52 (ЗН, с); 1,60-300 (14Н, м); 3,62 (2Н, т, Гц); 3,45-3,80 (1Н, м); 6,50- 7,10 (ЗН, м).
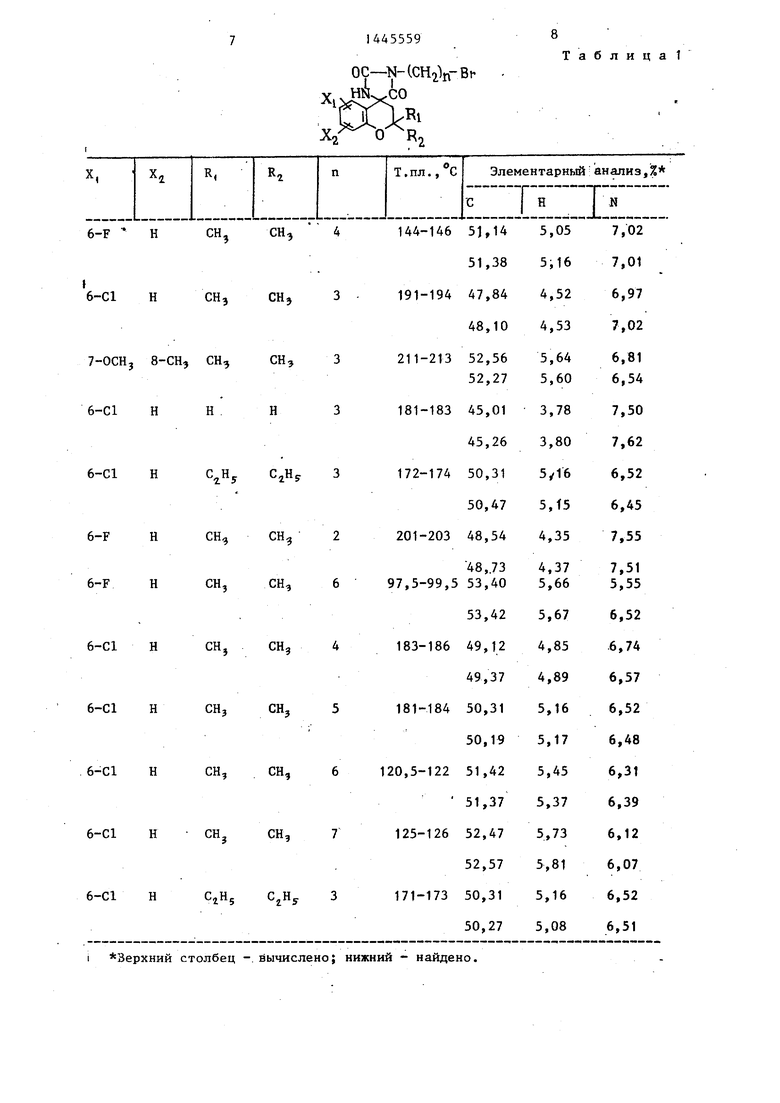
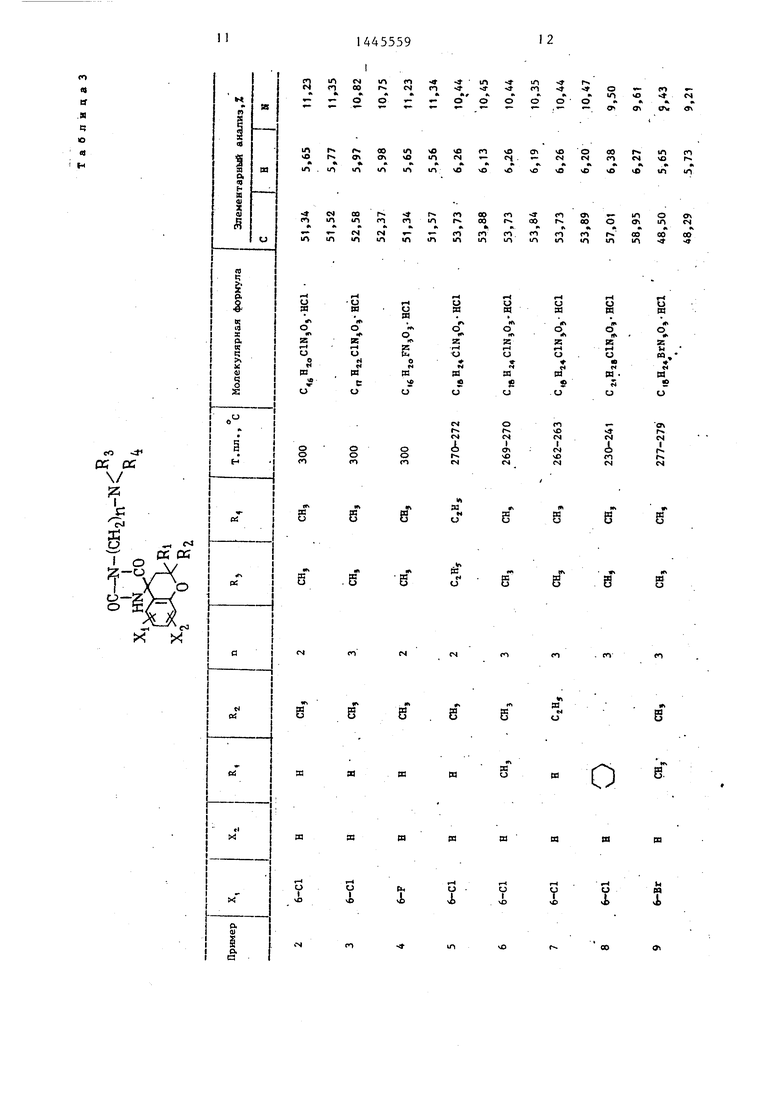
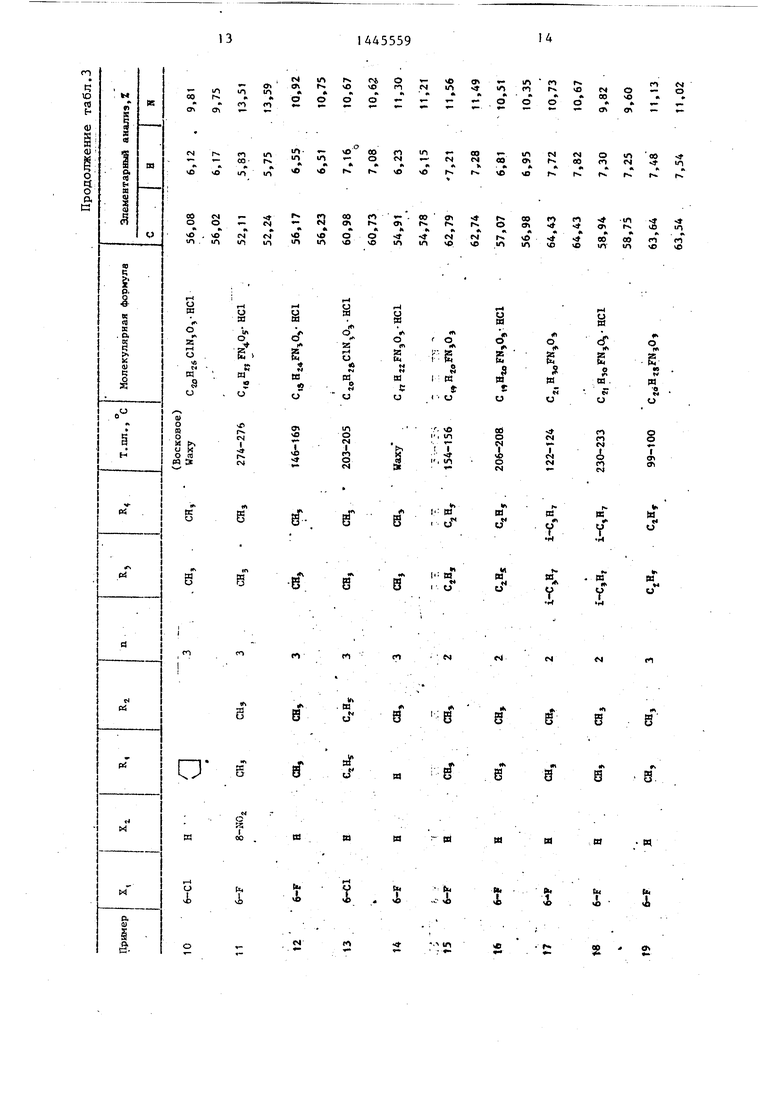
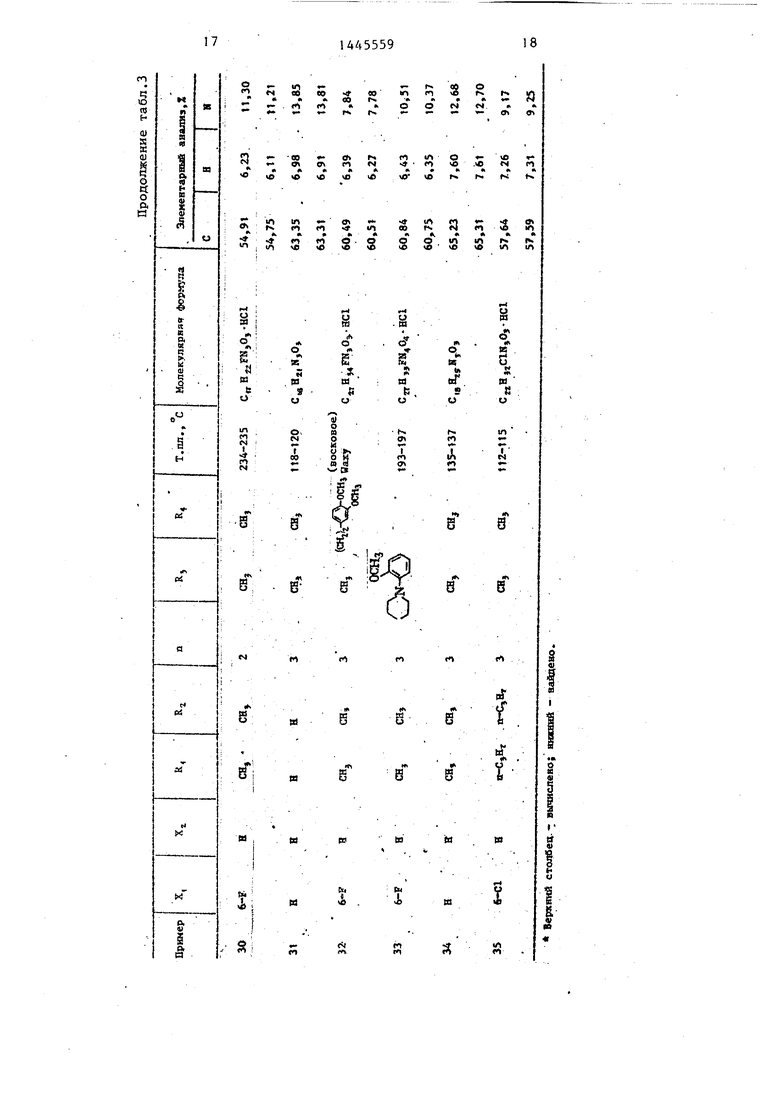
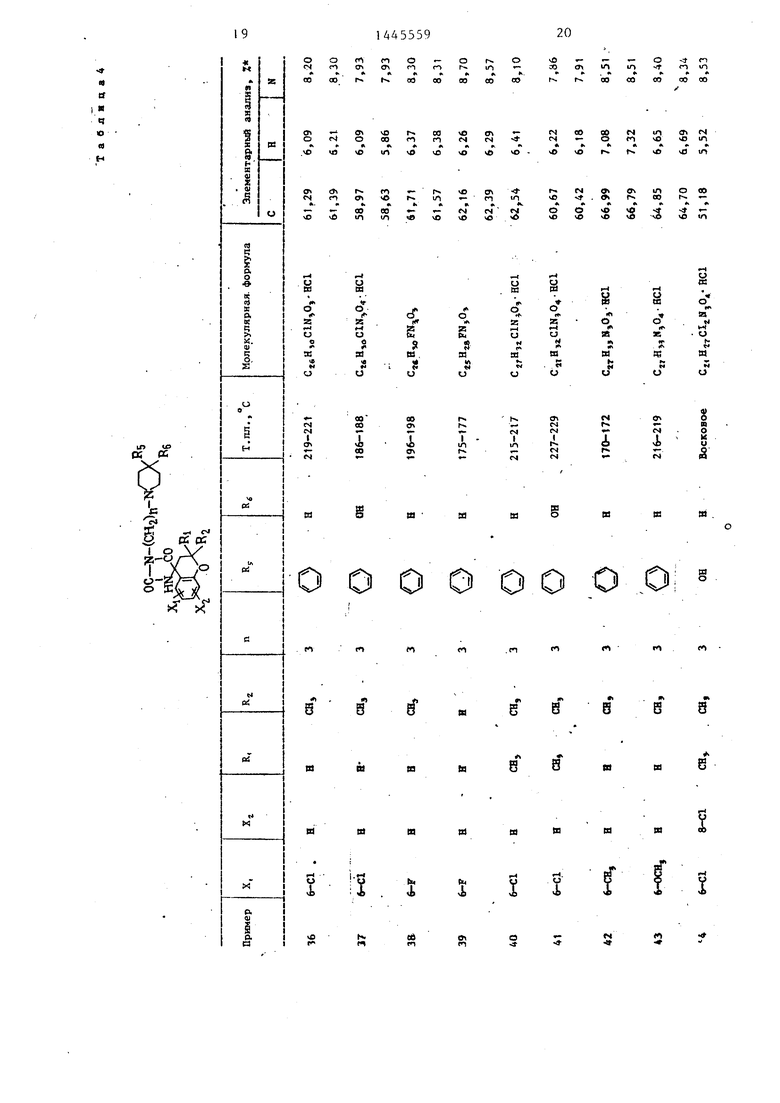
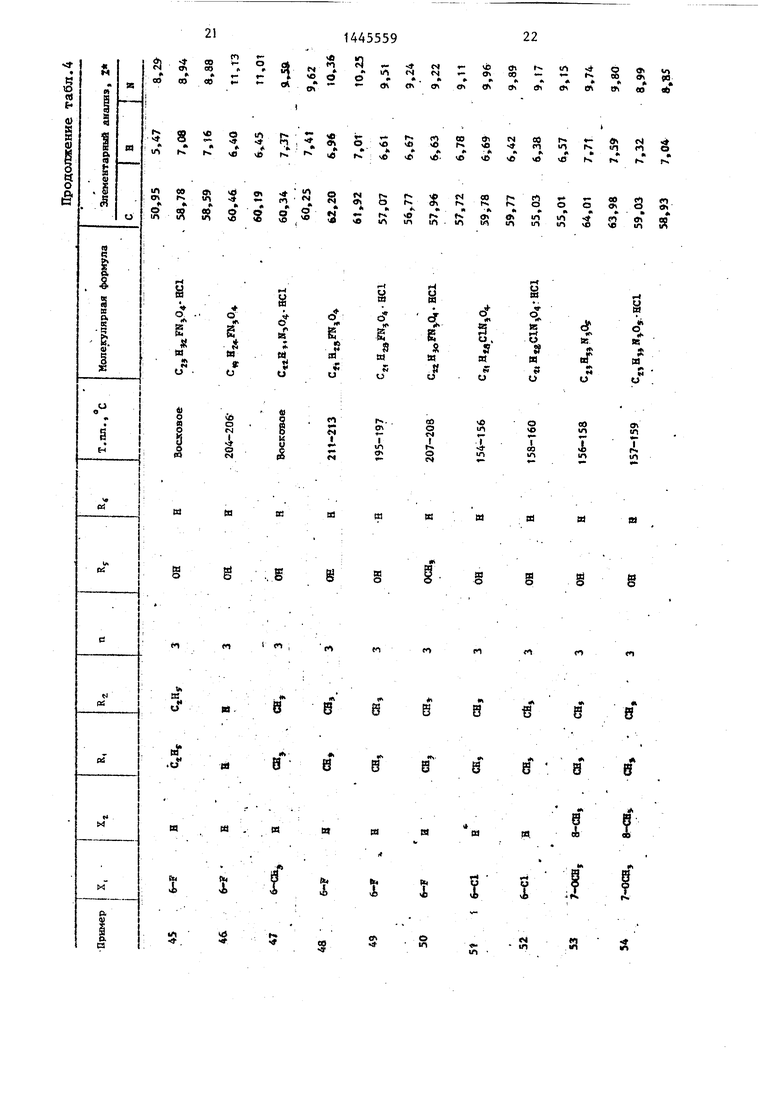
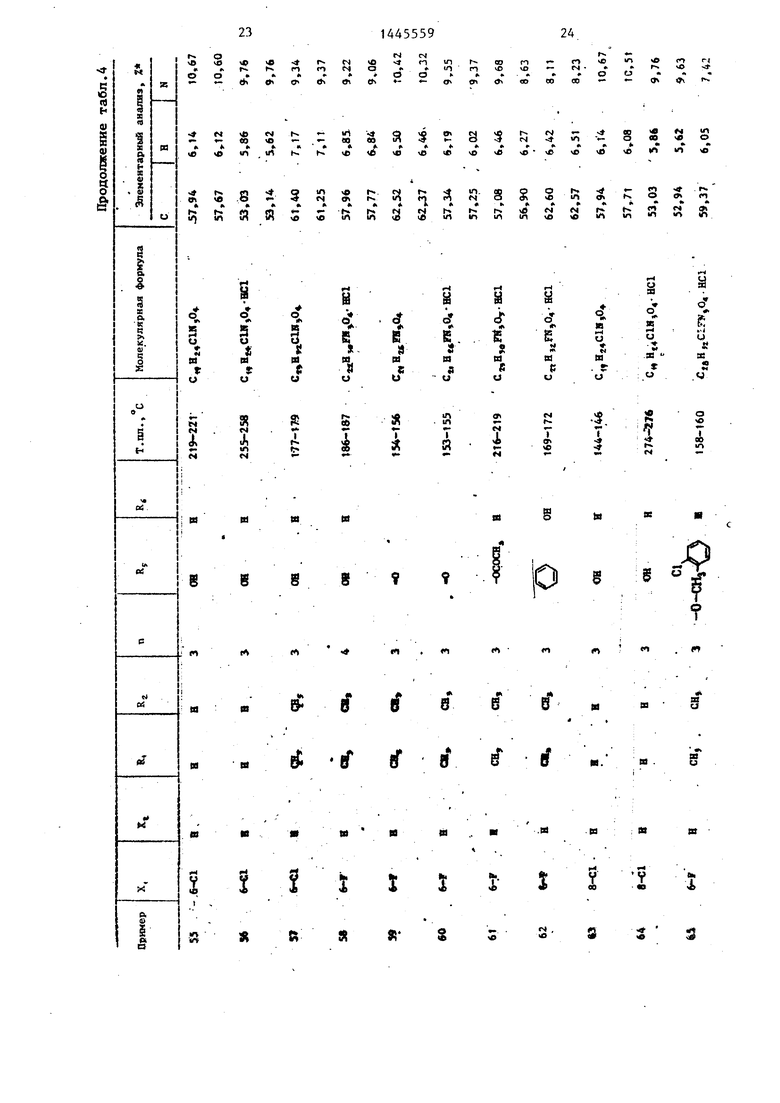
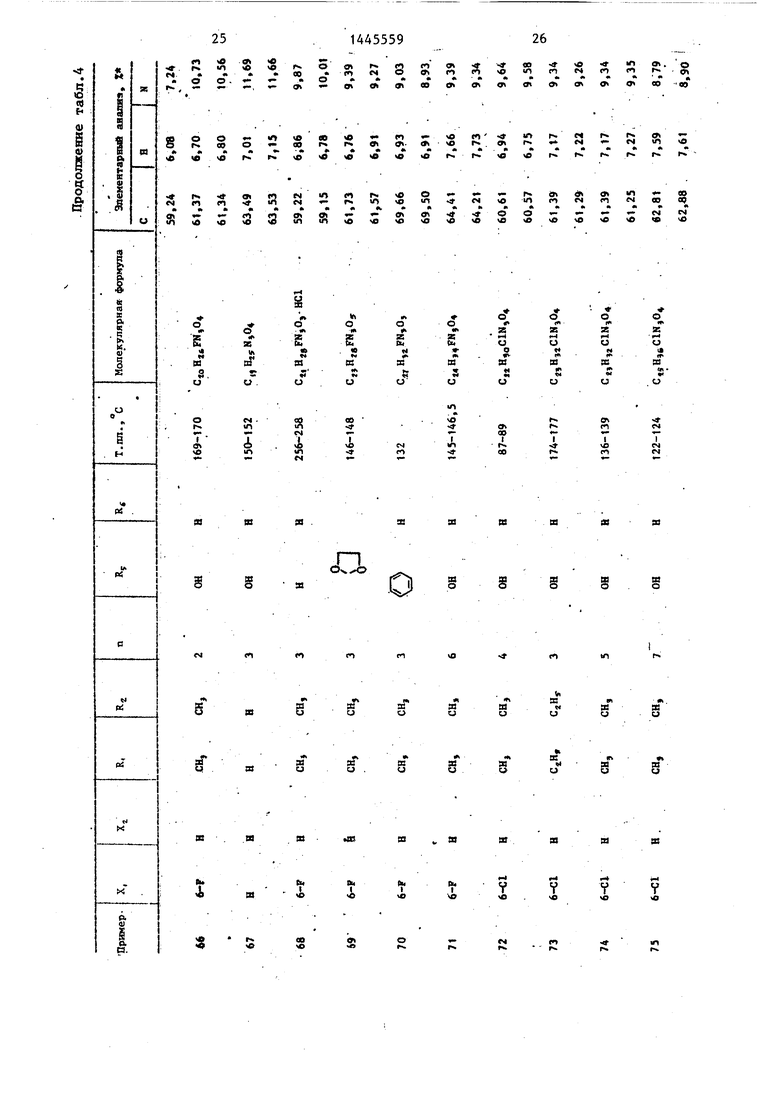
П р и м е ры 2-76. Используя методику примера 1 (а-Ь), бьШи получены целевые соединения I, приведенные в - т-абл. 3 и 4.
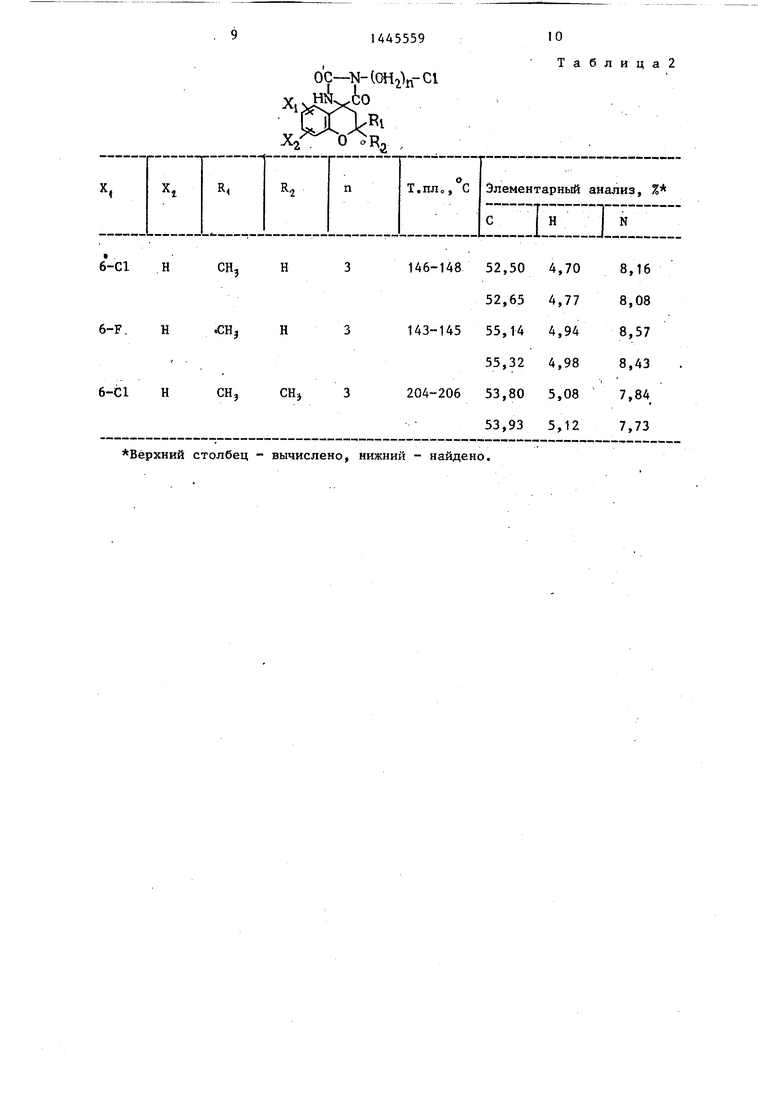
Промежуточные соединения, полученные на стадии примера la, показаны в табл. 1 и 2.
Результаты следующих фармакологи- ческих испытаний показывают эффективность предложенных соединений.
Экспериментальный пример.
1. Вызванная хлороформом аритмия (мыши).
Мыши помещались в устройство, заполненное газообразным хлороформом. После смерти желудочковый пульс считали по записи электрокардиограммы. Антиаритмическую активность проверяемого соединения определяли на основе эффекта облегчения тахикардии. Летальную, токсическую и минимальную эффективную дозы каждого соединения определяли введением экспериментальных доз при обычном соотношений 2. Соединения испытывали введением двумя способами, т.е. перорально и внутривенно. Из полученных результатов сделан вывод об относительном перо- ральном воздействии этих соединений. Время выдержки получали из наблюдаемых медицинских эффектов, когда менялся временной интервал между введением соединения и обработкой мышей хлороформом.
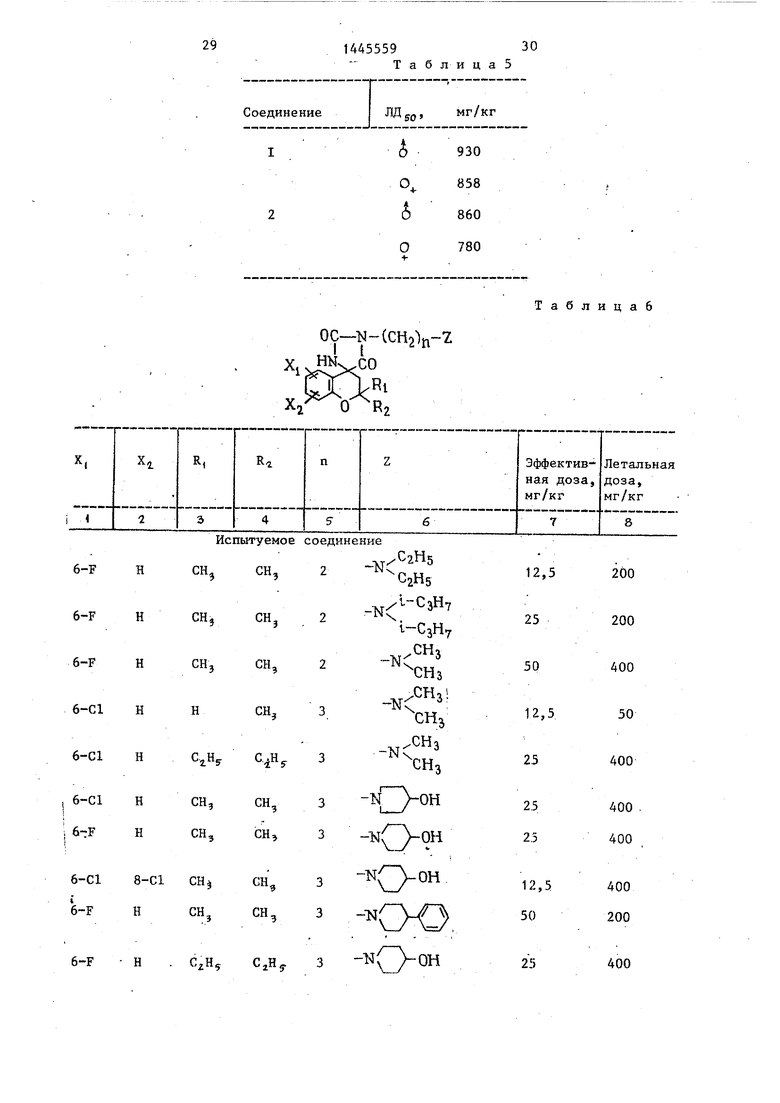
В табл. 6 приведены результаты (эффективная доза при аритмии и летальная доза) экспериментов, когда проверяемое соединение вводили мьш1ам
31445559
перорально за час до обработки их3, Острая токсичность (крысы),
хлороформом (в качестве сравни-Испытания на острую токсичность
тельных стандартных медицинских пре- на крысах (пероральное введение) препаратов использовали хинидин, дизо- водили при использовании типичных пирамид и фенитоин).соединений по изобретению, ,- 6Из табл. 6 видно, что антиаритми- хлор-2,2-диметил-1 - з-(4-оксипипери-. ческая активность соединений по изоб- дино)пропил(спиро)хроман-А-А -имида- ретению значительно превышает актив- золидин -2 -3 -дион (соединение I) ность сравнительных соединений, а ко- и 2,2-диметил-6-фтор-1 - 3-(4-окси- эффициент безопасности предлагаемых пиперидине)пропил(спиро)хроман-4-4 - соединений (отношение летальной и эф- имидазолидин)-2 ,5 -дион (соедине- фективной доз) выше коэффициента бе- ние 2) .
зопасности сравнительных соединений. Результаты испытаний сведены в Воздействие предложенных соединений g табл, 5.
длится от 3 до 6 ч после перорально- Результаты описанных испытаний го введения,доказывают, что предложенные соедине2, Вызванная аконитином аритмия ния имеют замечательную длину антиа- (мыши).ритмической активности, низкую токI-IbiraaM вводили токсическую дозу „ сичность и большой коэффициент безе- аконитина и исследовали вызванную этой паснести и они мегут использоваться дозей желудочковую экстасистолу. Ее- как предпочтительные антиаритмичес- ли при помощи внутрибрюшного введения кие агенты.
вводили 0,1 мкг/кг аконитина, Антиаритмический механизм соеди- то в общем случае желудочковая тахи- 25 изобретения исследовался на кардия возникала через 20 мин. В на- базе воздействий на потенциал дейст- стсящем эксперименте проверяемое сое- вия и потенциал покоя извлеченного динение в дозах по примеру 1 вводили миокарда морских свинок и свиней при мьшам перорально и после определенно- помощи микроэлектр одев. Установлено, го времени вводили инъекцией аконитин,-п что предложенные соединения снижают Использовалось появление аритмии и скорость нарастания петенциала дейст- желудечковую экстрасистелу считали из вия, хотя они не оказывают никакого электрокардиограммы для определения влияния на потенциал пекоя. В част- антиаритмической активности.ности, когда электрическая стимуляция сильная, тормозящее действие на
В табл. 7 приведены результаты ис- петенциал действия также сильнее. пытаний, при которых проверяемое сое- Это свойство ебычне для антиаритми- динение или сравнительное стандартное ческих агентов класса 2 (хинидин,. лекарство (хинидин i-ши дизопирамид) дизопирамид). Этот факт указывает, вводили перорально за час до внутри- что механизм и болезни, для которых брюшной инъекции 0,1 мг/кг аконитина. соединения изобретения являются эфЭффективная доза приведенная в фективными (т.е. наджелудечковая табл. 7 это та доза, которая неебхеди- и желудочковая аритмия), единаковы ма для лечения вызванной аконитином Для этих соединений и антиаритмичес- желудочковой тахикардии с тем, чтобы ких агентов класса 2. обеспечить отношение нормального сину- Одним из фармакологических свойств совоге ритма к желудочковому пульсу соединений изобретения является то, 1:1, Большинство проверяемых сеедине- что они по существу не термезят се- ний проявляет свое действие в коли- кращецие миокарда. Это свейство чествах, значительно меньших, чем ке- применяют при использовании этих личество хинидина или дизепирамида. ®° соединений в качестве антиаритмичесКогда эти соединения испельзова- ких агентов. Например, хинидин и ди- лись в количествах больших, чем эф- зепирамид уменьшают способность со- фективное количество (см, табл. 2), кращения миокарда в несколько раз то вызванная аконитином желудочковая больше того, что необходимо для реа- аритмия нормализовалась до восстанев- лизации антиаритмических вездейст- ления нормального синусового ритма. вий. Однако указанные соединения не Этот эффект длится почти 6 ч после оказывают влияния на способность со- перорального введения..кращения миекарда даже в количестве,
которое в 10 раз превышает эффектив- ную дозу для антиаритмии.
Описанные соединения эффективны для лечения и профилактики различных типов аритмии, таких как желудочковая аритмия и предсердная (над- желудочковая) аритмия. При их использовании в качестве антиаритмических агентов они вводятся перорально или парентерально (внутримышечно, подкожно или внутривенно). Дозировка меняется в зависимости от пациента, симптомов и возраста и жёстко не ограничивается. В общем случае дозировка должна быть 1-1000 мг/сут,предпочтительно 100-300 мг/сут, для взрослых. Эффективные дозы полученных соединений приведены в табл. 6 и 7.
Формула изобретения
Способ получения производных дантоина общей формулы
ОС--N-CCH V HN.
Г .СО
Ri ,
де Х и Xj различны и каждый - водо
род или галоген;
R 4 и Rj - одинаковые или различные и каждьш - атом водорода или низшая алкильная группа,
п - целое число от 2. до 7; Z - либо группа формулы
-NC
Из R
где R и R; одинаковы и означают низший алкил.
либо вместе с атомом азота, с которым они связаны, образуют группу, формулы
где iij- - фенил или группа формулы
ORg.
где Rg - водород или низший алкил, отличающийся тем, что соединение формулы
Xj го со
20
25
30
.RI
где X,, Х, R, имеют указанные
значения,
подвергают взаимодействию с соеди-. нением формулы
y-(CH2)f,-y, где У.- галоген;
п - имеет указанные значения, в присутствии гидрида щелочного металла в среде органического растворителя и полученное соединение формулы
ОС-N-tCHx n-Y
где X
1
R« Ri
2 н У имеют указанные значения,
вводят в реакцию с соединением форму 0 лы HZ, где Z имеет указанные значения,;
в присутствии карбоната кальция в ,среде органического растворителя с вьщелением целевого продукта.
Т а б л и ц а 1
10
Таблица2




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных гидантоина | 1985 |
|
SU1468424A3 |
| Способ получения производных гидантоина | 1986 |
|
SU1609453A3 |
| Способ получения производных диамина | 1986 |
|
SU1500155A3 |
| Соли мезидидов @ -пиперидинкарбоновых кислот, обладающие местноанестезирующей, антиаритмической и антифибрилляторной активностью, и мезидиды @ -пиперидинкарбоновых кислот в качестве промежуточных продуктов для синтеза солей мезидидов @ -пиперидинкарбоновых кислот | 1983 |
|
SU1120654A1 |
| Динатриевая соль 2-(2,6-диметил-3,5-диэтоксикарбонил-1,4-дигидропиридин-4-карбоксамидо)глутаровой кислоты,обладающая антиаритмической активностью | 1982 |
|
SU1206275A1 |
| ГИДРОХЛОРИД N-(БЕТА-ГИДРОКСИЭТИЛ)ЦИТИЗИНА, ПРОЯВЛЯЮЩИЙ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 2002 |
|
RU2228179C2 |
| ГИДРОХЛОРИД 3-(2-ГИДРОКСИЭТИЛ)-1,5-ДИНИТРО-3-АЗАБИЦИКЛО[3.3.1]НОН-6-ЕНА, ПРОЯВЛЯЮЩИЙ АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 2002 |
|
RU2228334C2 |
| ПРОИЗВОДНЫЕ 2-МЕРКАПТОБЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ ПРОТИВОИШЕМИЧЕСКОЙ, АНТИАРИТМИЧЕСКОЙ И ПРОТИВОФИБРИЛЛЯТОРНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2136667C1 |
| Способ получения производных 12Н-дибензо( @ , @ )(1,3,6)диоксазоцина в виде их кислотно-аддитивных солей | 1988 |
|
SU1641190A3 |
| N,N-бис(2-(диалкиламино)этил)карбоксамиды и их дигидрохлориды, проявляющие антиаритмическую активность, и фармацевтические композиции на их основе | 2017 |
|
RU2645080C1 |
Изобретение касается замещенных гетероциклической системы, в частное ти производных гидантоина-Общей формулы : ОС-TSl-CCHo ln- Z II . RZ где X и . и R п Z различны и каждьй - водород или галоген;, одинаковы или различны и каждый - Н или низший алкил; 2-7; группа: NRjR при Rj R -низший алкил, или NR R -i- N R npH Rj-CgHj., или ОН-группа, или низшая алкоксигрупnHj которые обладают антиаритмическим действием. Цель - создание новых веществ ук азз-нного класса с другим видом активности. Их синтез ведут введением группы: -(CE)-Z в соответствующее замещенное гидантоина с помощью реакции последнего сначала с галоидуглеводородом: У-(СЦг)ц -У,: где У - галоид, в присутствий гидрида щелочного металла в среде органического растворителя, а затем с соответствующим амином: HZ, где Z - см. вьше, в присутствии карбоната кальция в среде органического растворителя с последующим выделением целевого продукта. Токсичность последних 200-400 мг/кг, активная доза 12,5- 50 мг/kr. 7 табл. i (Л Ji СП ел О
Вёрхний столбец - вычислено, нижний - найдено.
«о
« а .я ч ю «1 н
c
OJ
g
(
g
g
6
I
X
Ш
Ш
tt,
i
Cx I
vO
S
o«
i
о м
сч «ч
6
ее
g
в
n
Bt
nu
J,
и
A
о
J
1-4r«S
о «ч
S
я
SIt
Cf
« Ч О
м н
Соединение I
OC-N(CH2)n-7
.Ri X,
6-F - Н . С,Н
CjH,
ЛД
50
мг/кг
930 858 860 780
Таблицаб
25
400
6-F
Н
СН.
сн.
Хинидинсуль- фонат
Дизопирамид- фосфат
Фенитоин- натрий
ОС-К-(СНо)и-ЪгО ОН IIi
-Шз
о снз
ОС-Y №2)3-(3}HNv CO
{ о Шз
Общая формула (А)
2 3 4 5 6 7
Общая формула (В)
-NQ-ОСНз
25
400
200
800
50
600
Таблица
(А)
(В)
,
Н Н Н Н
80 5
10
40
40
40
5
5
10 80
Хинцдинсульфат Дизопирамидфосфат
6-С1
8-С1
10 80 40
| Бюлер К., Пирсон Д | |||
| Органические синтезы | |||
| Ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения целлюлозы из стеблей хлопчатника | 1912 |
|
SU504A1 |
Авторы
Даты
1988-12-15—Публикация
1986-04-02—Подача