1
(21)4027023/23-04
(22)10.02.86
(31)8503425
(32)11..02.85
(33)GB
(46) 30.08.90. Бюл. № 32
(71)Империал Кемикал Индастриз ПЛ.С. (GB)
(72)Родни Брайан Харгривс, Бернард Джозеф Маклафлин и Стюарт Деннет Миллс (GB)
(53) .547.022.1.07(088.8)
(56) Japanese Jounal of Pharmacolosv
1987,0-46.
Japanese Jounal of Pharmacoloev
1988,P-377.
Европейский патент № 0167371, кл. С 07 D 211/90, 1986.
Патент СССР № 1342413, кл. С 07 D 211/82, 1984. (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,4-ДИГИДРОПИРИДИНА
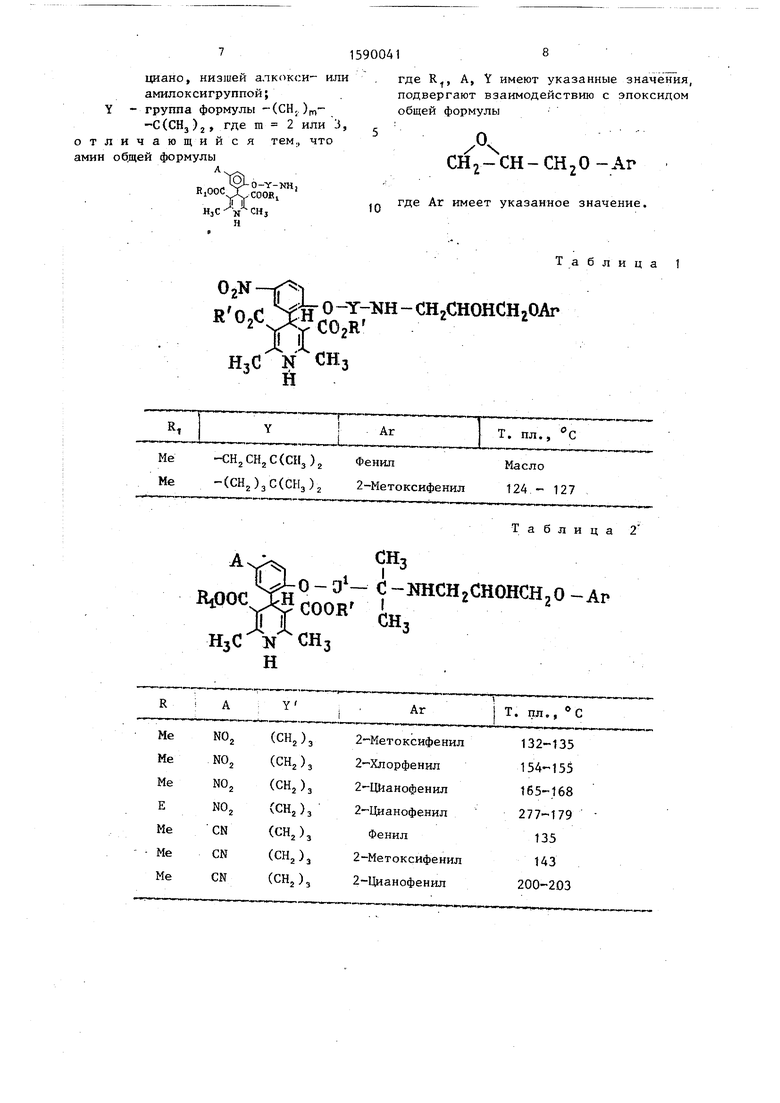
(57) Изобретение касается гетероциклических соединений, в частности способа получения производных 1,4-дигид- ропиридина общей формулы X-NH-CHj- -СН Сон }-СЕ,-ОАг, где X - груЬпа формулы -Y-0-C CH-CH CA-CH C СН-С OC(O)OR-, С(СНз )-NH-C(CH3 ) (0)OR,J; R - СНз или .; A-CN или NO, ; Аг - фенил | может быть замещен С1, NGj, CN, низшей алкок си-, или амплоксигруппой J; Y -fCHj -С(СНз )2-; при m 2 или 3, обладающих антигипертензивной и -адренергической активностью, что может быть использовано в медицине. Цель - создание новых активных веществ указанного класса. Синтез ведут взаимодействием амина общей формулы Х-МН, где X указано выше, с эпоксидом формулы CHjO-Ar, где Аг указано вьщ1е. Новые соединения понижают среднее артериальное давление на 20-42 мм рт.ст, и одновременно проявляют л-адренерги- ческую активность без токсичности в применяемых концентрациях 10 мг/кг. 3 табл.
о
(Л
сд
;о



Изобретение касается гетероциклических соединений, в частности способа получения производных 1,4-дигидропиридина общей формулы X-NH-CH 2-CH[OH]-CH 2-OAR, где X - группа формулы -Y-O-C=CH-CH-CA-CH=C- CH-C[C(O)OR 1]=C(CH 3)-NH-C(CH 3)=C[C(O)OR 1]
R 1-CH 3 или C 2H 5
A-CN или NO 2
AR-фенил [может быть замещен CL, NO 2, CN, низшей алкокси- или амилоксигруппой]
Y=-[CH 2] M-C/CH 3/ 2-
при M=2 или 3, обладающих антигипертензивной и β-адренергической активностью, что может быть использовано в медицине. Цель - создание новых активных веществ указанного класса. Синтез ведут взаимодействием амина общей формулы X-NH 2, где X указано выше, с эпоксидом формулы O-CH 2-CH-CH 2O-AR, где AR указано выше. Новые соединения понижают среднее артериальное давление на 20-42 мм рт.ст. и одновременно проявляют β-адренергическую активность без токсичности в применяемых концентрациях [10 мг/кг]. 3 табл.
Изобретение относится к химии гетероциклических соединений, в частности к производным 1,4-дигидропирвди- на, обладающим антигипертензивной и -адренергической активностью, что может найти применение в медицине.
Цель изобретения - создание на основе известных методов способа получения производных 1,4-дигидропири- , дина, обладающих одновременно /5-алре- нергической и антигипертензивной ак тивностъю при низкой токсичности.
Изобретение иллюстрируется следующими примерами.
Пример 1. Смесь диметил-4-Г 2-(4-аминобутокси)-5-нитрофенил.}-1,4- -дигидро-2,6-диметилпиридин-З,5-ди- карбокбилата (0,35 г), фенилглициди- лового простого эфира (0,12 г) и изо- фопанол а (10 мл) нагревают при кипячении с обратным холодильником в течение 3,5 ч, а затем выпаривают досуха, а полученный остаток очищают хро- матографически с мгновенным ис парени (/I
ем на колонке с силикагелем (Мегск 9385), используя смесь 80:20:3 (объ- ем-объем- объем) этилацетата, метанола и концентрированного водного раствора аммиака в качестве элюента. Полученный продукт кристаллизуют из смеси этилацетата и петролейного эфира (т.кип. ) и в результате полу- , чают диметил-1,4-дигидро-4- 2 .-4-(2-ок-1о си-3-феноксипропиламино)бyтoкcиJ-5- -нитрофенил-2, б.-диметилпиридин-3,5-ди карбоксилат, т.пл. 117-120 с (соединение сравнения - пример 15).
Диметилпиридин 3,5-дикарбоксилат, tS кот,орый используют в качестве исходного материала, получают следующим об разом.
Перемешиваемую смесь 5-нитросали-: цилальдегида (8,36 г), карбоната ка- 20 ЛИЯ (11,04 г) иодида калия (0,2 г), М-(4-бромбутил) фталимида (13,6- г) и диметилформамида (120 мл) нагревают до 100°С в течение 48 ч, а затем охридин-3,5-дикарбоксилат, т.пл. 119 - 123 С.
Смесь полученного соединения (1,8 г) гидразингидрат (1,8 мл) и этанол (35 мл) нагревают при температуре кипения с обратным холодильником в течение 18 ч, вьцшрживают при температуре окружающей среды в течение 18 ч, а затем фильтруют. Полученный фильтрат вьтаривают досуха а остаток кристаллизуют из этанола. Получают в результате диметил-4- 2-(4-аминобуток- си)-5-нитрофенил }-1,4-дигидро-2,6- ди- метилпиридин-3,5-дикарбоксилат, т.пл. 200-202 С.
Пример 2. Повторяют методику примера 3, используя соответствующий 4-(2-аминогидрокарбилоксифенил)пиридин и соответствующий эпоксид в качестве исходных материалов, в результате чего получают соединения, опи- санные в табл. 1. Если соединения не кристаллизовались и их поэтому нельзя
лаждают до комнатной температуры. До- 25 охарактеризовать по температурам плав- бавляют насыщенный водный раствор хлористого натрия (1200 мл) и этилацетат (300 мл) и полученную смесь встряхивают и фильтруют, твердый остаток оставляют. Слои фильтрата разделяют., зО водный слой экстрагируют этилпцетатом (200 мл) и объединенные этилацетатные раствором трижды промывают яясьщен- . ным водным раствором хлористого натления, строение подтверждают по данным элементного анализа, масс-спектроско- пии и спектроскопии протонного магнитного резонанса.
Пример 3. Процесс, описанный в примере 1, повторяют, но в качестве исходного материала использовали соответственным образом замещенрия (по ШО мл каждый раз), сущат над 35 ный (8)-фенилглицидиловый простой
эфир и таким образом получили соединения, описанные в табл. 2.
сульфатом магния и выпаривают дос уха. Объединенный остаток и оставшуюся твердую часть кристаллизуют из метанола и получают таким образом 5-нитро-2- - (4-фталимидобутокси) бензальдегид, т.пл. 145-148 С.
Перемешиваемую смесь указанного альдегида (5,68 г) метил-3-аминокрото ната (1,92 г), метилацетоацетата (1,79 г) и изопропанола (30 мл) нагре вают при температуре кипения: с обратным холодильником в течение 40 ч, охлаждают, до температуры окружающей среды и жидкую часть декантируют из осажденной смолы. Смолу перемещивают с диэтиловым эфиром и полученную смес фильтруют, а жидкость храняг при комнатной температуре в течение 18 ч, а затем фильтруют. Объединенные твер- дые остатки кристаллизуют из изопрог панола и получают в результате диме- ткл-1,4-дигидро-2,6-диметил 4- 2 -(4- -фтапимидобутокси)-5-нитрофенил }--пи
ридин-3,5-дикарбоксилат, т.пл. 119 - 123 С.
Смесь полученного соединения (1,8 г) гидразингидрат (1,8 мл) и этанол (35 мл) нагревают при температуре кипения с обратным холодильником в течение 18 ч, вьцшрживают при температуре окружающей среды в течение 18 ч, а затем фильтруют. Полученный фильтрат вьтаривают досуха а остаток кристаллизуют из этанола. Получают в результате диметил-4- 2-(4-аминобуток- си)-5-нитрофенил }-1,4-дигидро-2,6- ди- метилпиридин-3,5-дикарбоксилат, т.пл. 200-202 С.
Пример 2. Повторяют методику примера 3, используя соответствующий 4-(2-аминогидрокарбилоксифенил)пиридин и соответствующий эпоксид в качестве исходных материалов, в результате чего получают соединения, опи- санные в табл. 1. Если соединения не кристаллизовались и их поэтому нельзя
охарактеризовать по температурам плав-
ления, строение подтверждают по данным элементного анализа, масс-спектроско- пии и спектроскопии протонного магнитного резонанса.
Пример 3. Процесс, описанный в примере 1, повторяют, но в качестве исходного материала использовали соответственным образом замещенный (8)-фенилглицидиловый простой
0
эфир и таким образом получили соединения, описанные в табл. 2.
Все соединения имели (S) конфигурацию при указанной группе СНОН-,
Методика и результаты фармакологического испытания. Каяздую крысу в группе из 4, 5 или 6 особей женского рода спонтанно гипёртензивной линии Okotnoto приблизительно 5-месячного возраста и весом между 200 и 250 г анестезируют галотаном (2%) и сонную артерию выделяют через разрез ниже шеи. Постоянный катетор, наполненный гепаринизированным физиолог ическим раствором (50 единиц на 1 мл) имплан- тируют в артерию и выворачивают наружу с задней части шеи. Животных оставляют на 24 ч с целью восстановления после операции и затем ограничивают в. пластмассовых пробирках с открытыми концами. Затем датчик давления подсоединяют к катетору, а также к регистрирующему оборудованию с тем, чтобы обеспечить непрерывную регистрацию частоты сердечных сокращений и кровяного давления.
Испытуемое соединение вводят каждому животному в виде однократной (10 мг на 1 кг веса тела) пероральной дозы, растворенной в 1 мл 5:4:1 об. смеси полиэтиленгликоля, физиологи- ческого раствора и этанола. Кровяное давление регистрируют перед дозированием и через 1,3 и 5 ч после него.
Максимальное понижение (по сравнению со значением предварительной дозировки) среднего артериального давления (САД) регистрируют в течение 5-часового периода наблюдения. Соединение является активным в качестве гипотензивного средства, если это понижение составляет по крайней мере 20 мм рт.ст.
Забивание крыс. Каждую крысу в группе из 4 особей женского рода нор- мотензивной линии Wistor весом приблизительно 250 г анестезируют галота- ном (2%) и вставляют трахеотомическую канюлю. Затем крысу быстро забивают через глазную впадину посредством стального прокалывающего стержня 14 калибра. Затем крысу немедленно переводят на искусственное дыхание с использованием насоса Пальмера со смесью 3:2 об. азота и кислорода при ударном объеме крови 3 мл и 53 циклов в i .мин.
Первую яремную вену канюлируют для- введения лекарств и левую общую сон- , ную артерию канюлируют и присоединяют к датчику давления, который также под- соединяют к записывающему оборудова
повышения частоты сердечных сокращений на 50 ударов в .1 мин, считывают с кривой. Если соединение обладает бета-адренергической блокирующей активностью, доза изопреналина, необхо димая для получения повышения частоты сокращения сердца на 50 ударов, будет более высокой, чем доза в конт-
д рольном эксперименте на животном, не получившем лекарства.
Соединение, как предполагают, яв- . ляется активным в качестве бета-адре нергетического блокирующего средства
15 если его коэффициент составляет, по крайней мере 15.
Результаты, полученные с использованием определенных алканоламиновых производных приведены в табл. 3.
20 Все соединения испытаны при получении спонтанно-гипертензивных крыс и результаты зарегистрированы. Только несколько соединений испытаны при получении забитой крысы, если не заре25 гистрировано ни одного результата, это значит, что соединение не испытано при данном получении.
Все соединения в данной табл. 3 имеют (S)-конфигурацию при указанной
30 группе -СНОН-.
Предпочтительные предлагаемые соединения, у которых Y обозначает алки- леновую группу с разветвленной цепью (табл. 3), являются более активными в отношении теста с забитыми крысами (т.е. в качестве адренергических бета локаторов) по сравнению с известными соединениями,.
При дозах прЬизводного дигидропинию с тем, чтобы осуществить непрерыв- «. ридина, которые оказывают эффективное
ное записывание частоты сердечных сокращений и кровяного давления. Оба. блуждающих нерва также рассекают.
Затем выстраивают кривую зависимости доза-эффект от частоты сердечных сокращений в отношении изопреналина, используя уровни дозировок 0,003; 0,01; 0,03 и 0,1 мкг на 1 кг веса тела изопреналина. Испытуемое соединение затем вводят внутривенно в течение 3 мин в 0,25 мл раствора 5:4: : 1(об.).Смеси полиэтиленгликоля, физио- логического раствора и этанола, содержащей 1 мг на 1 кг веса тела соединения. Через 30 мин после дозирования вновь выстраивают кривую зависимости доза-эффект от частоты сердечных сокращений в отношении изопреналина. Дозы изопреналина, необходимые для
50
антигипертензивное действие на крыс или собак, не наблюдается никаких симптомов токсичности.
Формула изобретения
Способ получения производных 1,4- дигидропиридина общей формулы
O-Y-HH-CHjCHCHiOAr
он .
55 « t
А
Аг метил или этил; заместитель, выбранный из циано- или нитрогруппы; фенил, не обязательно замещенный хлором, нитрогруппой.
повышения частоты сердечных сокращений на 50 ударов в .1 мин, считывают с кривой. Если соединение обладает бета-адренергической блокирующей активностью, доза изопреналина, необходимая для получения повышения частоты сокращения сердца на 50 ударов, будет более высокой, чем доза в конт-
д рольном эксперименте на животном, не получившем лекарства.
Соединение, как предполагают, яв- . . ляется активным в качестве бета-адре нергетического блокирующего средства
5 если его коэффициент составляет, по крайней мере 15.
Результаты, полученные с использованием определенных алканоламиновых производных приведены в табл. 3.
0 Все соединения испытаны при получении спонтанно-гипертензивных крыс и результаты зарегистрированы. Только несколько соединений испытаны при получении забитой крысы, если не заре5 гистрировано ни одного результата, это значит, что соединение не испытано при данном получении.
Все соединения в данной табл. 3 имеют (S)-конфигурацию при указанной
0 группе -СНОН-.
Предпочтительные предлагаемые соединения, у которых Y обозначает алки- леновую группу с разветвленной цепью (табл. 3), являются более активными в отношении теста с забитыми крысами (т.е. в качестве адренергических бета- локаторов) по сравнению с известными соединениями,.
При дозах прЬизводного дигидропиантигипертензивное действие на крыс или собак, не наблюдается никаких симптомов токсичности.
Формула изобретения
Способ получения производных 1,4- дигидропиридина общей формулы
50
O-Y-HH-CHjCHCHiOAr
он .
« t
А
Аг метил или этил; заместитель, выбранный из циано- или нитрогруппы; фенил, не обязательно замещенный хлором, нитрогруппой.
циано, низшей алкокси- или
амилоксигруппой; Y - группа формулы -(СН,, ),,
-С(СНз)2, где га 2 или 3, тличающийся тем,, что ин общей формулы
А
р -,., LO-Y-NH,
J lOOC уГ coofij
HjC CHj
H
virO-T-:NH-
V СНз H
Me-CH,CH,C(CH,), Фенш Масло
Me-(CK)C(CEy), 2-Метоксифенил124 - 127
СНз
C-NHCH CHOHCH O -Аг
сн,
где R, A, Y имеют указанные значения, подвергают взаимодействию с эпоксидом общей формулы
СН СН-СНгО-Аг
где Аг имеет указанное значение.
Таблица 1
CH CHOHCHzOAr
Таблица 2
сн,
1590041
10 Таблица 3
Авторы
Даты
1990-08-30—Публикация
1986-02-10—Подача