где R - Н, СН, низший алкил-С2 С - бензил, гидроксиалкил, цианалкил, кар,бокси- и карбоксиалкил, фе нацил, ароил, которые проявляют иммуносупрес- сивную активность, что может быть использовано в медицине. Цель -. создание нового способа получения новых веществ указанного класса. Синтез ведут реакцией соответствующих замещенных бензимидазо(2,1-в)хиназолино- на-12(5 или 6Н) с бромом и йодистым
калием или натрием при молярном со- отношении 1:2:1 в водной среде с последующим кипячением реакционной массы до обесцвечивания и нейтрализаци- ей основанием - карбонатом натрия или аммиаком. Новые вещества получают с высоким выходом (97-98%) с активностью по подавлению мицелия грибов и бактерий, а также по подавлению развития болезней. 3 табл.
i




Изобретение касается гетероциклических веществ, в частности получения соединений общей ф-лы I или II
Изобретение относится к органической химии,а именно к новому спосооу получения новых 5 или 6-замещенных 9-иодбензиО
N N
R
(и)
мидазоло(2,1-в)хиназолинонов-12 (5 или 6Н) общей формулы
где R - Н, CHj низший алкил Сг-С4, бензил, гидроксиалкил, цианалкил, карбокси-, карбалкоксиалкил, фенацил, арсил.
Производные 6(5Н)-бен.зимидазо- (2,1-в)хиназолинона-,12 являются новым классом имуносупрессивных средств и могут найти применение в фармакологии, а также в качестве полупродуктов в синтезе новых лекарственных « препаратов или фунгицидов.
. . о
. А;
NN R
где R - И, CHj, низший алкил , бензил, гидроксиалкил, цианалкил карбокси- и карбалкоксиалкил, фенацил, ароил, в водной среде действуют бромом и эквивалентным количеством йодистого натрия или калия с последующим кипячением реакционной смеси до обесцвечивания и нейтрализации основанием, таким как карбонат натрия или аммиак.
Пример 1. Получение -9-иод бензимидазо(2,1-в)хиназолинона-12 действием йодистого калия или натрия после окончания добавления брома, 2,35 г (0,01 моль) бензимидазо (2,1-в)хиназолинона-12 суспендируют в растворе 1,66 г (0,01 моль) иодида калия (или 1,5 г (0,01 моль) иодида натрия) в 50 мл воды и при тщательном перемешивании по каплям прибавляют 3Э2 г (0,02 моль) брома. Наблюдается образование бурого периодида. Доводят водную суспензию периодида до кипения и кипятят до обесцвечивания кристаллов периодида (5-15 мин). Охлаж- дают, нейтрализуют 10%-ным раствором соды или концентрированным аммиаком и бесцветные кристаллы отфильтровывают.
Выход 3,54 г (98,2%), т.пл. 347- 348°С .(из ДМФА).
Анализ и данные ИК-спектра приведены в табл. 1. Приведенные в табл.1 соединения 1б-о получены аналогично.
Пример 2. Действие йодистого калия или натрия на бензимидазо(2,1- в)хиназолинон-12 без действия брома.
а). 1,66,г (0,01 моль) йодистого калия (или 1,5 г (0,01 моль) иодистоЦель изобретения - разработка нового способа получения новых 5- или 6-замещенных 9-иод-бен зимидазо- (2,1-в)хиназолинонов-12 (5шш6Н), об- падающих ценными свойствами.
Поставленная цель достигается предлагаемым способом, заключающимся в том, что на 5 или б-замещенные бензимида- зо(2,1-в)хиназолиноны-12 (5 или 6Н) общей формулы
(III)
N N 1
R
i
го натрия) растворяют в 5 мл воды и вносят 2,35 г (0,Of м) бензимидазо- (2.1-в)/шназолинона-12 (6Н) нагревают до кипения и кипятят 15 мин. Образование бурого иона иодония не наблюдается. Охлаждают, отфильтровывают исходный бензимидазо(2,1-в)хиназолинон-12 6Н) (2,33 г).
б). Действие иода на бензимидазо (2,1-в) хиназолинон-12 без действия бр ома,
1,66 г (0,01 моль) йодистого калия (или 1,5 г (0,01 моль) йодистого натрия) растворяют в 5 мл воды и добавляют 0,8 г (0,005 моль) брома. Дают отстояться образующемуся темному осадку иода (5-10 мин) и при перемешивании вносят 2,35 г (0,01 моль) бензимидазо(2,1-в)хиназолинона-12 (611) . Образование бурого иона иодония пербромида не наблюдается. В воде суспендирован иод и бензимидазо (2, 1-в)хиназолинон-12(бН). Нагревают до кипения и кипятят 15 мин. Летят фиолетовые пары иода; реакционная смесь не обесцвечивается. Охлаждают, отфильтровывают смесь иода и бензимидазо (2, 1-в)хиназолинона-12. Исходный продукт (II) выделяют раскристаллиза цией из ДМЛА. Проба Бельштейна и элементный анализ показывают, что иод не вошел в молекулу.
Выход бензимидазо(2,)хиназоли- нона-12(6Н) 2,3 г.
Пример 3. Получение 9-иод- 6-метил бензимидазо (2,. 1-в)хинозолин- 12-она встречным синтезом.
а). Получение 9-иодбензимидазо- (2,1-в)хиназолин-12-она.
5
3,25 г (0,01 моль) 5/6-иодбензи- мидазол-2-сульфокислоты и 1,37 г (0,01 моль) антраниловой кислоты сплавляют при 140-160°С в течение
2ч до полного прекращения выделени S0Ј. Охлаждают, отфильтровывают и нейтрализуют аммиаком. Бесцветные ксталлы.
Выход 2,18 г (60,4%), т.пл. 347- 348°С (из ДМФА).
Найдено, %: С 46,4 Н; 2,3 3 35,2 N 11,7
C14H83N3°
Вычислено, %: С 46,5; II 2,2;
335,2; Н 11,6.
б), Метилирование 9-иодбензимида зо(2,1-в)хиназолинона-12 в условиях межфазного катализа.
3,61 г (0,01 моль) 9-иодбензими- дазо(2,1-в)хиназолинона-12 вносят в раствор 3 г NaOH в 3 мл воды и при тщательном перемешивании добавляют 10 мл ацетона и 2,13 г (0,015 моль) йодистого метила. Перемешивают при комнатной температуре до исчезновения зеленой окраски ме- эомерного иона (1 ч), Разбавляют двойным объемом холодной воды и фильтруют Получают бесцветные кристаллы 9-иод-6-метилбензимидазо- (2,1-в)хиназолинона-12.
Выход 3,3 г (87,6%), т.пл. 251- 252°С (из ЛИФА).
Найдено, %: С 48,1; 1 2,6; I 33,9; N 11,1
C,yHwIN,0
Вычислено, %:С 48,0; Н 2,7; I 33,9; N 11,2.
Пример 4. 6-(1,2- дииод-3- пропшг) бензимидазо (2,1 в)хиназолин- 12-он. 2,75 г (0,01 моль) 5-аллил- бензимидазо(2,1-в)хиназолинона-12 суспендируют в растворе 3,32 г (0,02 моль) йодистого калия в 50 мл воды и при тщательном перемешивании прибавляют по каплям 1,6 г (0,01 мол брома. Бурый раствор нагревают на вдяной бане до 40-60°С и выдерживают при этой температуре до полного обецвечивания (5-10 мин). Охлаждают. Бцветные кристаллы отфильтровывают.
Выход 4,55 г (86,1%), т.пл. 199- 200еС (из ПМФА).
Найдено, %: С 38,49; Н 2,48; I 48,12; N 7,86.
Вычислено, %: С 38,56, Н 2,46; I 48,01; N 7,94.
8206
Пример 5. Получение 5-метил- 9-иодбензимидазо(2,1-в)хинаэолино- на-12.
а). Действием йодистого калия или натрия на пербромид.
2,49 г (0,01 моль) 5-метилбензими- дазо(2,1-в)хинаэолинока-12 суспендируют в 40 мл воды и при тщательном
перемешивании по каплям прибавляют 3,2 г (0,02 моль) брома. К образующемуся оранжевому пербромиду прибавляют раствор 1,66 г (0,01 моль) иодида калия или 1,5 г (0,01 моль) иодида
5 натрия в 10 мл воды. Наблюдается переход оранжевого пербромида в бурый периодид. Нагревают водную суспензию образовавшегося периодида до температуры кипения и кипя,тят до обес0 цвечивания кристаллов (5-15 мин). Охлаждают, нейтрализуют содой или аммиаком и бесцветные кристаллы отЛильтро- вывают. Выход 3,67 г (97,9%), т.пл. 253-254вС (из ДМФА).
5 б). Действие брома на суспензию 5-метилбензимидазо(2,1-в)хиназолино- на-12 в водном растворе йодистого калия или натрия, 2.49 г (0,01 моль) 5-метилбензимидазо(2,1-в)хиназолино0 на-12 суспендируют в растворе 1,66 г (0,01 моль) иодида калия (или 1,5 г (0,01 моль) иодида натрия) в 50 мл воды и при тщательном перемешивании по каплям прибавляют 3,2 г (0,02 моль) брома Наблюдается образование бурого периодида. Доводят водную cvcnen- зию периодида до кипения и кипятят до обесцвечивания кристаллов периодида (5-15 мин). Охлаждают, нейтрализуют 10%-ным раствором соды или концентрированным аммиаком и бесцветные кристаллы отфильтровывают.
Выход 3,67 г (97,9%), т.пл. 253- 254°М (ия ДМФА).
Анализ и данные ИК-спектра приведены в табл. 2.
Приведенные в табл. 2 соединения 1б-о получены аналогично.
Пример 6. Пействие йодистого калия или натрия на бензимидазол в отсутствие брома.
1,66 г (0,01 моль) йодистого калия (или 1,5 г (0,01 моль) йодистого натрия) растворяют в 5 мл воды и вносят 2,49 г (0,01 моль) 5-метилбензимидазо(2,1-в)хиназолинона-12 (5Н) нагревают до кипения и кипятят 15 мин. Образование бурого иона иодония не наблюдается. Охлаждают, отЛильтровыва5
0
5
0
71
ют исходный 5-метилбензимидазо(2,1-в хиназолинон-12(5Н) (2,33
б). Действие иода на бензймидазол в отсутствии брома.
1,66 г (0,01 моль) йодистого, кали (или 1,5 г (0,01 моль) йодистого натрия) растворяют в 5 мл воды и добавляют 0,8 г (0,005 моль) брома. Дают отстояться образующемуся темному осаку иода (5-10 мин) и при перемешивании вносят 2,49 г (0,01 моль) 5-ме- тилбензимидазо(2,1-в)хиназолинона-12 (5Н). Образование бурого иона иоДо- ния пербромида не наблюдается. В воде суспендирован иод и 5-метил- бензимидазо(2,1-в)хиназолинон-12(5Н) Нагревают до кипения и кипятят 15 ми Летят фиолетовые пары иода: реакционная смесь не обесцвечивается.Охлаждают, отфильтровывают смесь иода и 5-метилбензимидазо(2,1-в)хиназоли- нона-12(5Н). Исходный продукт (I) выделяют раскристаллизацией из ДМФА. Проба Бельштейна и элементный анализ показывают, что иод не вошел в молекулу о
Выход 5-метилбензимидазо(2,1-в)- хиназолинона-12 (5) 2,7 г,
Пример 7. Получение 9-иод- 5-метилбензимидазо(2,1-в)хиназолино- на-12 встречным синтезом,
а). Получение 9-иодбензимидазо- (2,1-в)хиназолинона-12.
3,25 г (0,01 моль) 5/6-иодбензими дазол-2-сульфокислоты и 1,37 г (0,01 моль) антраниловой кислоты сплавляют при 140-160°С в течение 2 ч до полного прекращения выделе
ния 50. Охлаждают, обрабатывают
20 мл 10%-ной НС1, гидрохлорид отфильтровывают и нейтрализуют аммиаком о Бесцветные кристаллыс
Выход 2,18 г (60,4%), т.пл. 347- 348°С (из ДМФА).
Найдено, %: С 46,4; Н 2,3; I 35,2 N 11,7с
С 4Н61Н30
Вычислено, %: С 46,5; ll 2,2; I 35,2; N 11,6.
б). Метилирование 9-иодбензимида- зо(2,1-в)хиназолин-12-она в нейтральной средео
3,61 г (0,01 моль) 9-иодбензими- дазо(2,1-в)хиназолинона-12 и 1,42 г (0,01 моль) йодистого метила в 10 мл ДМФА кипятят с обратным холодильником в течение 1 ч о Охлаждают, выпавший гидроиодид отфильтровывают и ней
0
5
1820
0
8
трализуют аммиаком„ Бесцветные кристаллы 9-иод-5-метилбензимидазо(2,1- в)хиназолинона-12.
Выход 3,04 г (81,3%), т.пл. 253- 254°С (из ДМФА).
Найдено, %: С 47,8; Н 2,7; I 33,8; Н 11,3.
C S-H40IN30
I Вычислено, %; С 48,0; Н 2,7; I 33,9; N 11,2.
Пример
2,75 г (0,01 моль) 5-аллилбензимида- зо(2,1-в)хиназолинона-12 суспендируют в растворе 3,32 г (0,02 моль) йодистого калия в 50 мл воды и при тщательном перемешивании прибавляют по каплям 1,6 г (0,01 моль) брома. Бурый раствор нагревают на водяной бане до 40-60°С и выдерживают.при этой температуре до полного обесцвечивания (5-10 мин). Охлаждают. Бесцвет- 5 ные кристаллы отфильтровывают.
Выход 4,59 г (86,7%), т.плс 203- 204°С (из ДМФА).
Найдено, %: С 38,60; Н 2,51;
I 47,92; N 7,16. C1 HWIZN30
Вычислено, %: С 38,56; Н 2,46; I 48,01, N 7,94.
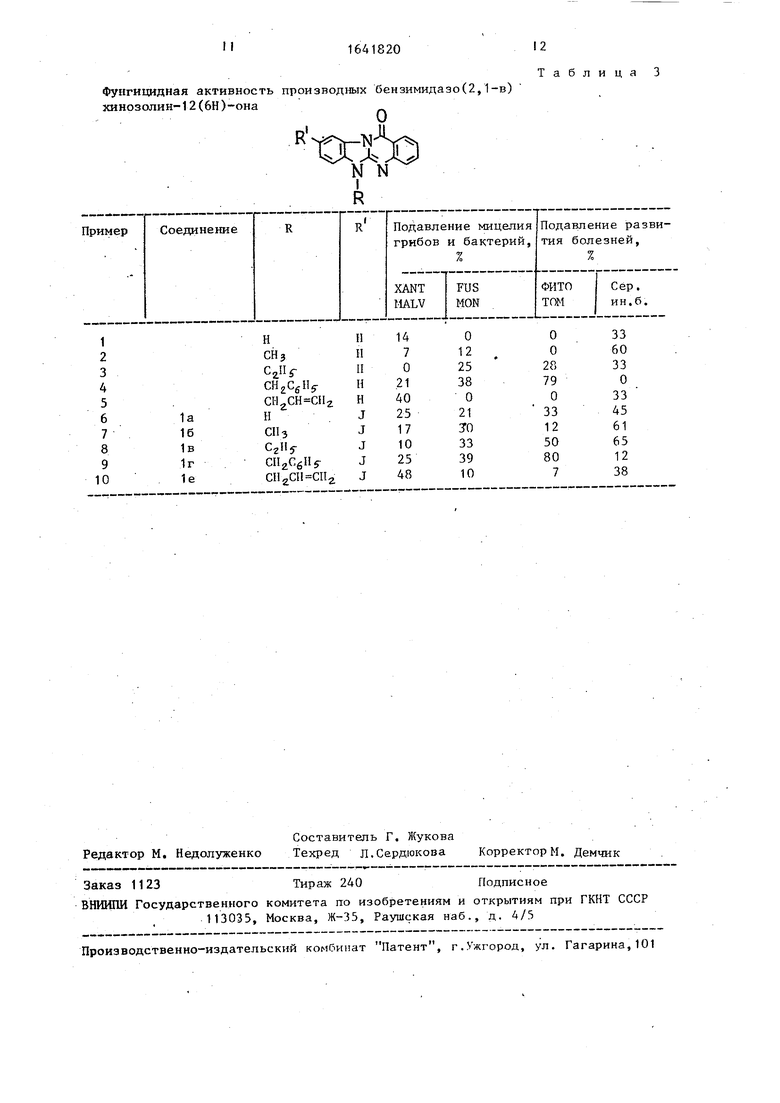
Физико-химические свойства новых соединений приведены в таблицах 1 и 2 фунгицидная активность - в табл.3.
Таким образом, предлагаемый способ позволяет получать с высоким выходом (97-98%) неописанные ранее 5 или 6-замещенные 9-иодбензимидазо- (2,1-в)хиназолиноны-12.
Формула изобретения
Способ получения 5- или 6-замещен- ных 9-иод-бензимидазо(2,1-в)-хиназо- линонов-12(5 или 6) общей фомрулы (I) или (II)
50
ИЛИ
где R имеет указанные значения, подвергают обработке бромом и йодистым калием или натрием при соотноше- 15 нии соединения (III) или (IV) - бром - иодчгтый калий или натрий, равном
6-Замешенкьк -9-|10дС | Ч1ччмнлзчо-(. l-D}xlina4cuiiuioiiij-12((SII)
О
хх-йо
По суммарному содержи кию ranoi енов найдено 38,10, вычислено 38,33. По суммарному содержанию галогенов найдено 34,955, вычислено 35,02
5-Заме«еиные-9-иолбензнмилаэо-(2,1-в}хиназолннолы-12 (5Н)
О
Данные по суммарному содержанию галогенов
1:2:1 молярных % в водной среде с последующим кипячением реакционной массы до обесцвечивания и нейтрализации основанием, таким как карбонат натрия или аммиак,
Т а и л и И я 1
Т л Л л н ц л 2
II
производных бензимидазо(2,1-в)
R YS:V-N тГ5 kAAJU
N N R
1641820
12
Таблица 3
| I.Heterocycl | |||
| Cliem, 1971, v 8, № 1, p | |||
| Топливник с глухим подом | 1918 |
|
SU141A1 |
Авторы
Даты
1991-04-15—Публикация
1989-01-18—Подача