Изобретение относится к микробиологии и генной инженерии, в частности к получению эндонуклеаз рестрикции с высокой степенью очистки, свободных от примесных нуклеаз.
РестриктазаАра 1 является уникальной, не имеет изошизомеров и, следовательно, не может быть заменена какой-либо ре- стриктазой из другого источника.
Целью изобретения является повышение чистоты и увеличение выхода целевого продукта.
Способ заключается в том, что для выделения рестриктазы Ара 1 используется фракционирование клеточного гомогената в двухфазной системе 7-%ный полиэтиленгликоль (ПЭГ), 2%-ный декстран в присутствии определенной (0,6 М) концентрации хлористого натрия, а дальнейшая очистка фермента осуществляется хроматографией на фосфоцеллюлозе Р-11 с элюцией градиентом (0,15 - 1) М хлористого калия в буфере и хроматографией на гидроксилапатите (ГАП) с элюцией градиентом (0,01.- 0,6) М концентрации калийфосфатного буфера рН 7,4. Использование в процессе хроматографии на фосфоцеллюлозе Р-11 и гидроксилапатите буфера, содержащего определенную (0,1 мМ) концентрацию ЭДТА, ведет к большей стабильности фермента и повышению выхода целевого продукта.
Для фракционирования клеточного гомогената в двухфазной системе ПЭГ - декстран оптимальная концентрация NaCI
ON СЛ СП
ю
00
Os
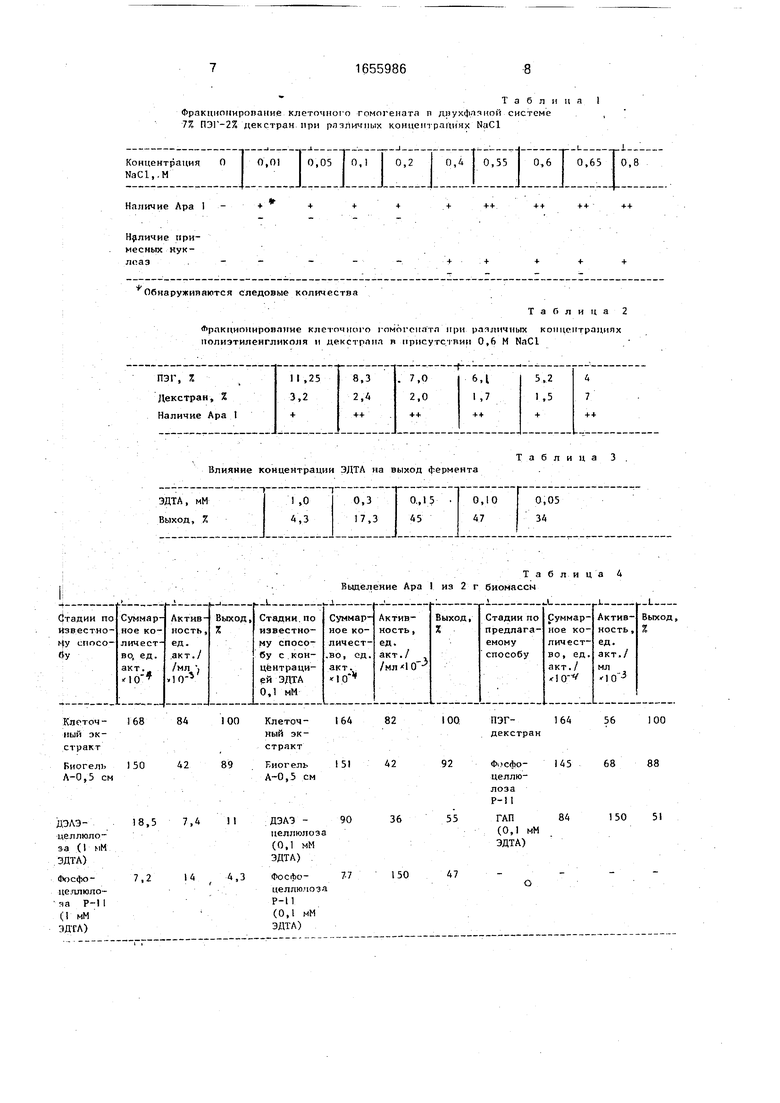
равна 0,55 - 0,65 М (табл. 1), а ПЭГ и декстра- на - 7 и 2% соответственно (табл.2),
Как видно из табл.2, двухфазная система 7%-ный полиэтиленгликоль - 2 %-ный де- кстран является оптимальной. Двухфазная система 4%-ный ПЭГ - 7%-ный декстран по составу фаз соответствует двухфазной системе 7%-ный ПЭГ - 2%-ный декстран, но при этом увеличивается объем нижней фазы, что вызывает методические трудности при разделении фаз.
Подбор концентрации ЭДТА в элюиру- ющих хроматографических буферах позволяет увеличить выход рестриктазы Ара 1 (табл.3).
Из табл.3 видно, что использование оптимальной (0,10 - 0,15 мМ) концентрации ЭДТА значительно увеличивает выход целевого продукта.
В табл.4 представлена зависимость выхода эндонуклеазы рекстрикции Ара 1 от концентрации ЭДТА в хроматографических буферах при выделении по известному способу и согласно изобретению.
Объем градиента на начальных этапах очистки (хроматография на фосфоцеллюло- зе) составляет 5-10 объемов хроматографи- ческой колонки. При более тонкой очистке (стадия доочистки фермента на гидроксила- патите) объем градиента увеличивают до 15 - 30 объемов колонки. Объемы колонок рассчитывают в зависимости от емкости сорбента и количества наносимого материала. Начальная концентрация соли в градиенте определяется концентрацией соли в буфере. Конечная концентрация соли определяется экспериментальным путем. Использование крутых градиентов сказывается на эффективности разделения, а применение пологих градиентов приводит к разбавлению фермента, что иллюстрируется данными, представленными в табл.5.
Оптимальными концентрациями градиентов при хроматографической очистке целевого продукта являются при хроматографии на фосфоцеллюлозе 0,15 - 1,0 М КС1, и на гидроксилапатите - 0,1 - 0,6 М калийфосфата.
Способ позволяет получить препарат рестриктазы с высоким выходом (табл.4) и очищенный от примесей экзонуклеаз и фос- фатаэ, тогда как препараты фермента, выделенные по известному способу, содержат примесные экзонуклеазы.
Получение рекстриктазы Ара 1 из Acetobacter pasteurlanus.
П р и м е р 1. Для получения рестриктазы Ара 1 используют штамм Acetobacter Pasteurlanus BK-440, полученный из Центрального Музея промышленных микроорганизмов института ВНИИ генетика.
Все операции по выделению и очистке фермента проводят при +4°С. Активность
рестриктазы тестируют методом гидролиза ДНК фага А с последующим разделением полученных фрагментов электрофорезом на пластинах с 1 %-ным агарозным гелем. Для увеличения разрешающей способности
электрофореза в агарозном геле используют метод, основанный на периодическом изменении полярности напряжения, подаваемого на электроды электрофоретической камеры (пульсирующий форез). Для разделения Ара 1 рестриктов ДНК фага А и на- тивной ДНК фаза А используется пульсирующее поле с периодом 1, 2 с в прямом и 0,6 с в обратном направлениях. Реакционная смесь для гидролиза содержит 10
ММ трис-HCI рТН 7,9; 6 мМ MgCl2, 6 мМ KCI, 10 мМ 2-меркаптоэтанол; 1 мкг ДНК фага Аи 1 мкл фермента. Реакцию проводят при 37°С 10 мин. Электрофорез проводят в 0,06 М трис-ацетатном буфере, рН 7,9, 2 мМ ЭДТА в течение 5 ч при напряжении 100 В Окрашенные этидий-бромидом (1 мкг/мл) гели просматривают в УФ-свете
За единицу активности принимают количество фермента, которое в оптимальных
условиях за 1 ч полностью расщепляет 1 мкг ДНК фага А . 2 г биомассы Acetobacter pasteurianus суспендируют в 4 мл буфера экстракции, содержащего 10 мМ трис-HCI, рН 7,5; 10 мМ 2-меркаптоэтанол; 0,1 мМ
ЭДТА и 0,1 %-ный тритон Х-100, обрабатывают ультразвуком на Дезинтеграторе при частоте 20 кГц и амплитуде 17 мкм по 30 с 5 раз с интервалом 30с для охлаждения смеси.
К 6 мл клеточного гомогенатэ приливают 6 мл смеси 21 % ПЭГ - декстран, 2,7 мл 4 М натрия хлористого и 3,3 мл деионизован- ной воды (конечная концентрация ингредиентов - 7%-ный ПЭГ, 2%-ный декстран,
0,6 М NaCI). Смесь перемешивают 15 мин, выдерживают 30 мин в ледяной бане и центрифугируют на центрифуге Bekman С 2 - 21 при 8000 об/мин 1 ч.
Верхнюю фазу сливают и диалиэуют
против 1 л буфера В, содержащего 10 мМ калий фосфат рН 7,4; 10 мМ 2-меркаптоэтанол; 0,1 мМ ЭДТА; 10%-ный глицерин. Диализ проводят со смекой буфера (три раза) в течение 6 ч.
Отдиализованную фракцию со скоростью 15 мл/ч наносят на колонку 1,5x30 см с фосфоцеллюлозой Р-11. Колонку промывают 50 мл 0,15 М калия хлористого в буфере. Далее для элюции используют линейный
градиент концентрации калия хлористого 0,15 - 1,0 М в буфере В объемом 200 мл. Фракции, элюируемые при 0,35 - 0,45 М KCI и содержащие основную часть активности, объединяют.
Ферментный раствор без диализа со скоростью 3 мл/ч наносят на колонку 0,9x4 см с гидроксилапатитом. Элюцию проводят линейным градиентом концентрации калия фосфорнокислого рН 7,4 от 0,01 до 0,6 М, содержащего 10 мМ 2-меркаптоэтанол, 0, мМ ЭДТА и 10%-ный глицерин. Общий овьем градиента 50 мл. Фракции, элюируемые при 0,22 - 0,28 М соли, содержащие активность рестриктазы Ара 1, объединяют и ди- ализуют против буфера В, содержащего 50%-ный глицерин. Выход рестриктазы Ара 1 составил 420000 ед.акт./г биомассы. В препарате рестриктазы отсутствуют примеси неспецифических эндонуклеаз (сохране- ниеспецифическойкартины
рестрикции при инкубации 1 мкг ДНК фага А с 30 ед. акт. фермента в течение 17ч при 37°С и примеси экзонуклеаз и фосфатаз (фрагменты ДНК, полученные гид- релизом 1 мкг ДНК фага АЗО ед.акт.фермента в течение 1 ч при 37°С сшиваются с ДНК-лигазой и повторно гидролизуются ре- стриктазой). Концентрированные препараты хранят без снижения активности год и более при минус 20°С.
П р и м е р 2. Эндонуклеазу рестрикции Ара 1 выделяют из 2 г клеток аналогично примеру 1, но к клеточному гомогенату приливают 2,5 мл 4М NaCI (до конечной концен- трации 0,55 М) и 3,5 мл деионизованной воды. Выход препарата составил 385000 ед.акт./r биомассы.
Примеси неспецифических эндонуклеаз , экзонуклеаз и фосфатаз в препарате не обнаруживаются.
ПримерЗ. Эндонуклеазу рестрикции Ара 1 выделяют из 2 г биомассы аналогично примеру 1, однако к клеточному гомогенату приливают 2,9 мл 4 М NaCI (до конечной концентрации 0,65 М) и 3,1 мл деионизованной воды. Выход препарата составил 400000 ед.акт./r биомассы.
Примеси неспецифических эндонуклеаз, экзонуклеаз из фосфатаз в препарате не обнаруживаются.
П р и м е р 4. Эндонуклеазу рестрикции Ара 1 выделяют из 2 г клеток аналогично примеру 1, однако буфер В содержит 0,15 мМ ЭДТА Выход препарата составил 370000 ед.акт./r биомассы.
Примеси неспецифических эндонуклеаз, экзонуклеаз и фосфатаз в препарате не обнаруживаются.
Таким образом, выход рекстриктазы Ара 1 составляет 420000 ед.акт. с 1 г биомассы. В препарате рестриктазы отсутствуют примеси неспецифических эндонуклеаз (сохранение специфической картины рестрикции при инкубации 1 мкг ДНК фага Я с 30 ед. акт. фермента в течение 17ч при 37°С) и примеси эндонуклеаз и фосфатаз (фрагменты ДНК, полученные гидролизом 1 мкг ДНК фага 30 ед.акт. фермента в течение 1 ч при 37°С сшиваются ДНК-лигазой и повторно гидролизуются рекстриктазой).
Формула изобретения
Способ выделения эндонуклеазы рестрикции Ара 1, включающий разрушение биомассы ультразвуком, фракционирование лизата и хроматографическую очистку, отличающийся тем, что, с целью повышения чистоты и увеличения выхода целевого продукта, фракционирование лизата осуществляют в двухфазной системе, содержащей 7% полиэтиленгликоля и 2% декстрана в присутствии 0,55 - 0,65 М NaCI, хроматографическую очистку фермента проводят последовательно методом ионообменной хроматографии на фосфоцеллю- лозе Р-11 в градиенте KCI 0,15 - 1,0 М и методом адсорбционной хроматографии на гидроксилапатите в градиенте фосфорнокислого калия 0,01 - 0,6 М с использованием в элюирующих хроматографических буферах 0,10 - 0,15 мМ ЭДТА.
716559868
Т а б л и и я I
Фракцнониропание клеточнсн о гомогената п днухфачкой системе 7% ПЭГ-2% дек стран при ра-эличмых концет рациях NaCl



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения рестриктазы, способной узнавать и расщеплять последовательность нуклеотидов GTCGAC | 1989 |
|
SU1752769A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ BSE 21 I | 1999 |
|
RU2184777C2 |
| Способ получения эндонуклеазы рестрикции Н @ а I | 1988 |
|
SU1613490A1 |
| Способ получения ферментов из биомассы BacILLUS амYLоLIQUеFасIеNS штамм ВКПМ В-3188 | 1989 |
|
SU1661211A1 |
| Способ получения эндонуклеазы рестрикции @ | 1988 |
|
SU1634713A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO RV | 1984 |
|
SU1218678A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ HINF I | 1997 |
|
RU2136749C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ SST 12 I | 2001 |
|
RU2233877C2 |
| Способ выделения рестриктаз II класса | 1989 |
|
SU1698289A1 |
| Способ получения рестриктазы S @ II | 1991 |
|
SU1822877A1 |
Изобретение относится к микробиологии и генной инженерии, в частности к получению эндонуклеаз рестрикции с высокой степенью очистки, свободных от примесных нуклеаз. Целью изобретения является повышение чистоты и увеличение выхода целевого продукта. Для выделения рестриктазы Ара 1 используется фракционирование клеточного гомогената в двухфазной системе полиэтиленгликоль - декстран в присутствии хлористого натрия. Дальнейшая очисткаферментаосуществляется хроматографией на фосфоцеллюлозе и на гидроксилапатите. Способ позволяет получать 420000 ед.акт/г биомассы высокоочищенного препарата фермента, свободного от примеси неспецифических нуклеаз и фос- фатаз, выход по активности составляет 51 %, удельная активность препарата 150000 ед/мг. 5 табл. Ё
Обнаруживаются следовые количества
ракционирование клетчксп о гомогемпта при различных концентрациях полиэтиленгликоля ч декстраия. в ирису rcinmi 0,6 М NaCl
Таблица 4 Вьщеление Ара 1 из 2 г биомассы
168
150
84
42
100
89
Клеточный экстракт
Биогель А-0,5 см
164
151
18,5 7,4
7,2
14
1
4,3
ДЭАЭ - 90 целлюлоза (0,1 мМ ЭДТА)
ФосАо- 77
целлючоза
Р-11
(0,1 мМ
ЭДТА)
Таблица 2
100
ПЭГ- 164 декстран
56 100
2
6
92
55
Фпсфо- целлю- лоза Р-11
ГАП
(0,1 мМ ЭДТА)
145
84
68 88
150 51
150
47
О
Стадия очистки
Градиент
соли, М0,15-1,5 0,15-1,0 0,15-0,60,01-1,0. 0,01-0,60,01-0,4
Наличие
примесных
нуклеаз++ ++ Обнаруживаются следовые количества
Влияние изменения концентрации градиентов на эффективность хроматографической очистки
Хроматография на фосфоцеллюлоэе Р-П
Хроматография на гидроксилапа- тите
| Greene P.J., Heyneker H.L, Boltvar F., Rodrigues R | |||
| et al., A general method for the purification of restriction enzymes | |||
| - Nucl | |||
| Acids Res., 1978, v.5, №7 | |||
| p | |||
| ПРИСПОСОБЛЕНИЕ ДЛЯ ПОГРУЗКИ РЕЛЬСОВ И Т.П. ПРЕДМЕТОВ НА ЖЕЛ.-ДОР. ПЛАТФОРМЫ | 1925 |
|
SU2373A1 |
| Seurinck J.A., M.Van de Voorde.A new Restriction endonuclease from Acetobacter pasterlanus | |||
| - Nucl | |||
| Acids Research, 1983, v.11,№ Ю.р.4409-4415 | |||
Авторы
Даты
1991-06-15—Публикация
1989-04-24—Подача