Изобретение относится к биохимии и микробиологии, в частности к выделению и очистке эндонуклеаз рестрикции. синтезируемых микроорганизмами рода Streptomyces, а именно к получению эндонуклеаз рестрикции Sst 12I, узнающей и расщепляющей последовательность нуклеотидов 5’CTGCAG3’.
Сайт-специфические эндонуклеазы рестрикции (рестриктазы) стали в настоящее время незаменимым инструментом для исследования структуры ДНК, создания рекомбинантных молекул, изучения генетического материала. В связи с этим актуальной задачей является создание методологических подходов к разработке высокоэффективной технологии получения ферментов этого типа.
В каждом конкретном случае эта задача решается эмпирически путем подбора способов и условий очистки ферментов в ходе предварительных опытов. Наиболее известные способы очистки рестриктаз описаны в [1, 2].
Известен способ получения эндонуклеазы рестрикции Hinf I [1], который включает разрушение клеток ультразвуком, термообработку не менее 5-10 мин при 58-60°С, центрифугирование, хроматографию на ДЕАЕ-целлюлозе-ДЕ-52. доочистку на фосфоцеллюлозе Р-11, гепарин-сефарозе, концентрирование против 50%-ного раствора глицерина. Выход фермента составляет 170000-200000 ед/10 г сырой биомассы.
Недостатками данного способа получения являются многостадийность процесса (использование трех сорбентов, что приводит к потерям препарата), снижение активности при продолжительном нагревании и удлинение времени выделения фермента.
Известен способ получения рестриктаз (3, прототип], который включает дезинтеграцию ультразвуком при повышении температуры до 50-60°С в течение 10-15 мин, центрифугирование, хроматографию.
Недостаток данного способа выделения рестриктаз заключается в том, что режим термостатирования подходит не ко всем рестриктазам, т.е. длительная выдержка при 50-60°С часто приводит к инактивации ферментов, выделяемых из мезофильных штаммов микроорганизмов; на последующей стадии хроматографической очистки происходит потеря фермента за счет неполной сорбции белка на фосфоцеллюлозе.
Технической задачей изобретения является усовершенствование процесса выделения эндонуклеазы рестрикции Sst 12I для увеличения выхода продукта высокой степени чистоты и удлинения сроков ее хранения.
Поставленная задача решается за счет использования способа получения эндонуклеазы рестрикции Sst 12I, включающего разрушение клеток ультразвуком, термообработку при температуре не выше 60°С, центрифугирование, хроматографию на фосфоцеллюлозе Р-11, концентрирование против 50%-ного раствора глицерина. Термообработку клеточной суспензии проводят дробно не менее чем в три этапа по 3-5 мин каждый и после каждого этапа термообработки суспензию охлаждают до 3-4°С. Центрифугирование суспензии провопят после каждого этапа термообработки при 15000 об/мин в течение 30 мин. Процесс получения фермента протекает при рН не менее 7,4-7,5, а перед этапом хроматографии на фосфоцеллюлозе P-11 рН суспензии снижают до 7,0.
Фермент представляет собой вязкий раствор в 50%-ном растворе глицерина, содержащий 10 мМ кадий фосфата рН 7,0; 100 мМ натрия хлористого; 1 мМ ЭДТА; 7 мМ 2-меркаптоэтанола.
Концентрация белка в растворе не менее 0,3 мг/мл, удельная активность не менее 50000 Е/мг белка, активность не менее 10000 Е/мл.
Точная молекулярная масса фермента не установлена.
Для работы фермента необходимы ионы Mg2+ в концентрации 5 мМ, 2-меркаптоэтанол в концентрации 7 мМ или дитиотреитол в концентрации 1 мМ.
Оптимум рH действия 8,0
Оптимум температуры 55°С.
Оптимум соли NaCl 50 мМ.
Концентрация соли более 100 мМ ингибирует активность рестриктазы.
Рестриктаза Sst 121 гидролизует двуцепочечные молекулы ДНК по строго определенной последовательности: 5’-CTGCAG-3’. В результате действия фермента образуются фрагменты двуцепочечной ДНК, которые имеют 3’-гидроксильный и 5’-фосфатный концы.
Для выделения рестриктазы биомассу клеток суспендируют в буфере А из расчета 2 мл на 1 г биомассы и дезинтегрируют при температуре 4-5°С. Затем суспензию подвергают термообработке. Термообработку осуществляют дробно: суспензию выдерживают при температуре 55-60°С три раза по 3-5 мин с центрифугированием после каждого термостатирования. При таком режиме термообработки наблюдается стабилизация белковой молекулы фермента и освобождение от большей части примесных белков. При непрерывной обработке в течение 9-10 мин происходит инактивация выделяемого фермента.
Весь процесс получения продукта (кроме хроматографии) протекает при рН 7,5, это связано с наиболее оптимальным условием разрушения клеточных стенок и выделения фермента, более резкое увеличение рН среды приводит к шоковому состоянию клеток и инактивации белка.
Дальнейшую очистку фермента проводят путем хроматографии на фосфоцеллюлозе Р-11. Перед нанесением на колонку рН экстракта фермента изменяют от 7,5 до 7,0. При таких условиях фермент полностью сорбируется на фосфоцеллюлозу. Элюцию сорбированных белков проводят линейным градиентом NaCl от 0 до 0,6 М в буфере В. Фракции, дающие полный специфический гидролиз, объединяют и концентрируют диализом против 50%-ного раствора глицерина в буфере В.
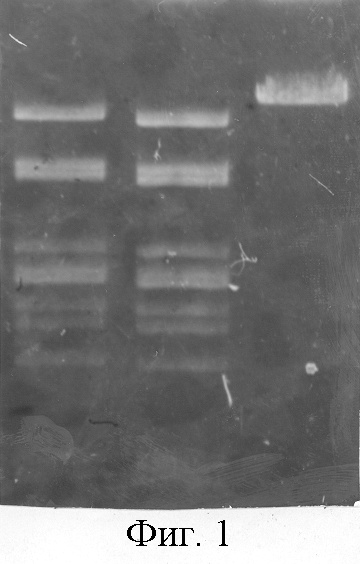
Выход фермента из 10 г клеток составляет 500000 Е. Полученный таким способом фермент свободен от примесей неспецифических эндонуклеаз: обработка ДНК фага λ 10-кратным избытком фермента в течение 16 ч при 37°С не изменяет специфическую картину гидролиза (фиг.1).
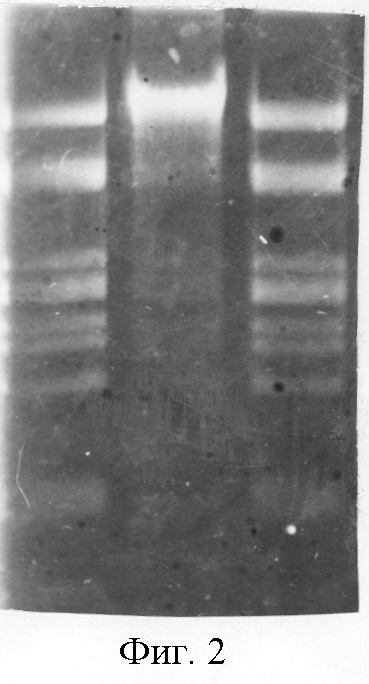
Проверка полученного препарата фермента на чистоту показывает, что полученный препарат не содержит также примесной экзонуклеазной и фосфотазной активностей (фиг.2) и пригоден для выполнения молекулярно-биологических и генно-инженерных работ.
Рестриктаза Sst 12I хранится при -20°С в течение 1-10 лет без потери активности (фиг.3).
Новым по сравнению с прототипом является:
- применение дробной трехкратной термообработки при температуре не выше 60°С в течение 3 мин с последующим центрифугированием после каждого термостатирования для стабилизации белковой молекулы и освобождения от большей части примесных белков;
- снижение рН от 7,5 до 7,0 перед проведением стадии хроматографии для полного сорбирования белка на фосфоцеллюлозу Р-11.
Поскольку предлагаем ни способ получения эндонуклеазы рестрикции Sst 12I предложен впервые, можно сделать вывод о соответствии предлагаемого штамма критериям изобретения "новизна" и "изобретательский уровень".
Способ иллюстрируется следующими графическими материалами.
На фигуре 1:
1 дорожка - гидролиз 1 мкг ДИК фага λ 10-кратным избытком фермента в течение 1 ч;
2 дорожка - гидролиз 1 мкг ДНК фага λ 10-кратным избытком фермента в течение 16 ч;
3 дорожка - контроль ДНК фага λ.
На фигуре 2;
1 дорожка - гидролиз 1 мкг ДНК фага λ в течение 1 ч 10-кратным избытком фермента;
2 дорожка - 1 мкг фрагментов ДНК сшитых ДНК-лигазой;
3 дорожка - гидролиз сшитых фрагментов ДНК рестриктазой Sst 12I.
На фигуре 3:
1 дорожка - гидролиз 1 мкг ДНК фага λ однократным избытком фермента, срок хранения 0 лет;
2 дорожка - гидролиз 1 мкг ДНК фага λ однократным избытком фермента, срок хранения 5 лет;
3 дорожка - гидролиз 1 мкг ДНК фага λ однократным избытком фермента, срок хранения 8 лет.
Далее следуют примеры конкретного выполнения способа.
Пример 1, Выделение рестриктазы Sst 12I. Для выделения рестриктазы бактериальную биомассу штамма Streptomyces sp. ST-12 в количестве 10 г суспендируют в буфере А (0,01 М калий фосфатный буфер рН 7,5, 1 мМ 2-меркаптоэтанол, 0,1 М ЭДТА) из расчета 2 мл на 1 г биомассы и подвергают ультразвуковой дезинтеграции на дезинтеграторе (MSE, Англия) при температуре 4-5°С. Затем суспензию подвергают термообработке. Термообработку осуществляют дробно: суспензию выдерживают при температуре 55°С три раза по 3 мин, с центрифугированием после каждого термостатирования при температуре 3-4°С. Режим центрифугирования: скорость 15000 об/мин, 30 мин на центрифуге J-21 (Beckman, США). Дальнейшую очистку рестриктазы Sst-12I проводят путем хроматографии на фосфоцеллюлозе Р-11 (Whatman, Англия), Перед нанесением на колонку рН экстракта фермента изменяют от 7,5 до 7,0. Элюцию сорбированных белков проводят линейным градиентом NaCl от 0 до 0,6 М в буфере В (0,01 М калий-фосфатный буфер рН 7,0, 1 мМ 2-меркаптоэтанол, 0,1 М ЭДТА,). Фракции, дающие полный специфический гидролиз, объединяют и концентрируют диализом против 50%-ного раствора глицерина в буфере В. Выход фермента из 10 г клеток составляет 500000 Е. Полученный таким способом фермент свободен от примесей неспецифических эндонуклеаз: обработка ДНК фага λ 10-кратным избытком фермента в течение 16 ч при 37°С не изменяет специфическую картину гидролиза (фиг.1). Проверка полученного препарата фермента на чистоту показывает, что полученный препарат не содержит также примесной экзонуклеазной и фосфотазной активностей (фиг.2) и пригоден для выполнения молекулярно-биологических и генно-инженерных работ.
Пример 2. Определение активности рестриктазы Sst 12I. Метод определения активности рестриктазы Sst 12I основан на определении полноты специфического гидролиза молекул нативной ДНК фага С 1857 в оптимальных условиях для фермента: 100 мМ трис-НСl буфер рН 8,0; 5 мМ магний хлористый; 50 мМ NaCl; 7 мМ 2-меркаптоэтанол; температура 55°С. Для определения активности препарата Sst 121 в пронумерованные пробирки разливают по 20 мкл реакционной смеси, содержащую 1 мкг фага С1857 и затем в каждую пробирку добавляют соответственно от 1 до 10 мкл фермента, выдерживают 1 ч при 55°С Продукты гидролиза разделяют электрофоретически в 1% агарозе.
За единицу активности (Е) принимают минимальное количество фермента, которое в течение 1 ч в оптимальных условиях полностью гидролизует 1 мкг фага λ С1857 в 20 мкл реакционной смеси.
Пример 3. Определение активности рестриктазы Sst 12I после длительного хранения. Образцы препарата Ssst 12I после длительного хранения подвергают анализу определения активности. Рестриктаза Sst 12I хранится при -20°С в течение 1-10 лет без потери активности. Метод определения активности длительно хранящихся партий фермента основан на определении полного специфического гидролиза молекул нативной ДНК фага λ С1857. Оптимальные условия гидролиза субстрата рестриктазой Sst 121: 100 мМ трис-НCl буфер рН 7,5; 5 мМ магний хлористый; 7 мМ 2-меркаптоэтанол; температура 55°С. Реакцию гидролиза проводят в 20 мкл реакционной смеси, содержащей 1 мкг нативной ДНК фага С1857 при температуре 55°С (фиг.3).
За единицу активности (Е) принимают минимальное количество фермента, которое в течение 1 ч в оптимальных условиях полностью гидролизует 1 мкг фага λ С1857 в 20 мкл реакционной смеси.
Таким образом, по сравнению с прототипом выход продукта увеличен в 2,5 раза, а срок его хранения составляет не менее 10 лет.
Литература
1. Патент РФ №2136749 "Способ получения эндонуклеазы рестрикции Нinf I", С 12 N 9/14, опубл. БИ 25, 1999 г.
2. Bickle Т.А., Pirotta V., Imber R. "A simple, general procedure for purifying restriction endonucleases" - In: Nucieic acids research, v.4, №8, Aug. 1977.
3. Авторское свидетельство СССР №1406159 "Способ получения рестриктаз" С 12 N 9/16 опубл. БИ №24, 1988.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ HINF I | 1997 |
|
RU2136749C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ BSE 21 I | 1999 |
|
RU2184777C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ Escherichia coli N41 (pBpuN4/MR)-ПРОДУЦЕНТ САЙТ-СПЕЦИФИЧЕСКОЙ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ BpuN4I | 2013 |
|
RU2529362C1 |
| ШТАММ БАКТЕРИИ Paenibacillus sp., ПРОДУЦЕНТ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ Psp1009I | 2007 |
|
RU2340663C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ ECO RV | 1984 |
|
SU1218678A1 |
| Способ получения рестриктазы, способной узнавать и расщеплять последовательность нуклеотидов GTCGAC | 1989 |
|
SU1752769A1 |
| Штамм бактерий PaRacoccUS DеNIтRIFIсаNS-продуцент эндонуклеазы рестрикции Р @ 121 | 1988 |
|
SU1532583A1 |
| Рекомбинантная плазмидная ДНК @ 435,кодирующая синтез ДНК-лигазы фага Т 4.способ ее конструирования и штамм @ . @ ВКМ в-1449-продуцент ДНК-лигазыфага Т4 | 1981 |
|
SU1122003A1 |
| Способ конструирования плазмидной ДНК,штамм @ @ -продуцент эндонуклеазы рестрикции @ и способ получения эндонуклеазы рестрикции @ | 1981 |
|
SU1040791A1 |
| Способ тестирования рестриктаз S @ и S @ из микроорганизмов рода SтRертомYсеS | 1988 |
|
SU1634714A1 |

Изобретение относится к биохимии и микробиологии. Выделение и очистка эндонуклеаз рестрикции, синтезируемых микроорганизмами рода Streptomyces, а именно получение эндонуклеаз рестрикции Sst 12I, узнающих и расщепляющих последовательность нуклеотидов 5'CTGCAG3', включает разрушение клеток ультразвуком, дробную термообработку 3 раза по 3 мин при температуре не выше 60°С, центрифугирование, хроматографию на фосфоцеллюлозе Р-11, концентрирование против 50%-ного раствора глицерина. Выход фермента составляет 500000 E/10г биомассы. Данный способ позволяет получить фермент, не содержащий примесей неспецифических нуклеаз и фосфатаз, 3 ил.
Способ получения эндонуклеазы рестрикции Sst 121, включающий разрушение ультразвуком, термообработку при температуре не выше 60°С, центрифугирование, хроматографию на фосфоцеллюлозе Р-11, концентрирование против 50%-ного раствора глицерина, отличающийся тем, что термообработку клеточной суспензии проводят дробно, не менее чем в три этапа по 3-5 мин каждый, после каждого этапа термообработки суспензию охлаждают до 3-4°С и центрифугируют при 15000 об/мин в течение 30 мин, весь процесс получения фермента проводят при рН не менее 7,4-7,5, а перед этапом хроматографии на фосфоцеллюлозе Р-11 рН суспензии снижают до 7,0.
| Способ получения рестриктаз | 1986 |
|
SU1406159A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНДОНУКЛЕАЗЫ РЕСТРИКЦИИ HINF I | 1997 |
|
RU2136749C1 |
Авторы
Даты
2004-08-10—Публикация
2001-11-12—Подача