или 4-пиперидил, замещенный ал- килом или низшим алкилкарбоннлом или их солей, обладающих анксиолити- ческои, гипнотической, антиконвульсивной, антиэпилептической и миорел- аксантной активностями.
Цель изобретения - разработка на основе известных методов способа получения новых соединений в ряду изоиндолинона, обладающих ценными фармакологическими свойствами при низкой токсичности.
В качестве примеров фармацевтически совместимых солей можно назвать соли присоединения с неорганическими кислотами, такие как хлоргидраты, сульфаты, нитраты, фосфаты, или органическими кислотами, такие как ацетаты, пропионаты, сукцинаты, бен- зоаты, фумараты, малеаты, метансуль- фонаты, нзотионаты, тиофиллинацетаты салнцилаты, фенолфталинаты, метилен- -бис-/}-оксинафтоаты, или производные от замещения этих соединений.
Могут быть использованы:
2-(7-Хлор-1,8-нафтиридин-2-ил)-3- -оксо-1-изоиндолинил-4-ацетамидобути рат (RS)
2-)7-Хлор-1,8-нафтиридин-2-ил)-3- -оксо-1-изоиндолинил-(1-пропионил-4- -пиперидил)-карбоксилат (RS)
2-(7-Метокси-1,8-нафтиридин-2-ил) -З-оксо-1-изоиндолинил-5-метилгекса- ноат (RS)
2-(7-Хлор-1,8-нафтиридин-2-ил)-3- -оксо-1-изоиндолинил-З-диизопропил- аминопропионат (RS)
Пример 1. К суспензии 6,15 3-окси-2-(7-метокси-1,8-нафтиридин-2 -ил)-1-изоиндолинона в 50 см безводного диметилформамида, в течение 15 мин добавляют 0,96 г масляной суспензии (50 мас.%) гидрида натрия, поддерживая температуру около 0°С, затем перемешивают снова в течение 30 мин при 0°С. В течение 30 мин прикапывают 2,9 см диэтилхлорфосфата, поддерживая температуру около О С. К полученному раствору при температуре около О °С добавляют раствор 4-аце тиламинобутаноата натрия, полученный из 2,9 г 4-ацетаминобутановой (масляной) кислоты в 30 см безводного диметилформамида и 0,96 г масляной суспензии (50 мас.%) гидрида натрия. Смесь перемешивают в течение 1 ч при О С, затем в течение 20 ч при температуре, близкой к , и,
0
5
5
0
0
5
0
5
0
5
наконец, 4 ч при . Реакционную смесь выливают в 400 см воды и экстрагируют 3 раза в 200 см мети- ленхлорида. Органические экстракты объединяют и промывают водой, высушивают и концентрируют досуха при пониженном давлении (2,7 кПа). Полученный остаток очищают путем хроматографии на 350 г диоксида кремния (0,063-0,2 мм), содержащегося в колонке диаметром 5 см (элюирующее средство: метиленхлорид - метанол 99:1 по объему), собирая фракции по 100 см. Фракции 23-39 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа) при 40СС. Остаток перекристаллизуют из ацетонит- рила.
Получают 2 г 2-(7-метокси-1,8-наф- тиридин-2-ил)-3-оксо-1-изоиндолинил- -4-ацетиламинобутирата, т. пл. 190.
Аналогично примеру 1, но исходя из соответствующих исходных продуктов, получают вещества по примерам 2-21.
2-(7-Хлор-1,8-нафтиридин-2-ил)-3- -оксо-1-иноиндолинил-4-метилпента- ноат, т. пл. (пример 2)
2-(7-Хлор-1,8 нaфтиpидин-2-ил)-3- -oкco-1-изoиндoлиншl-1-мeтил-3-пипe- ридинкарбоксилат, кислый фумарат которого плавится при 211°С (пример 3)
2-(7-Хлор-1,8-нaфтиpидин-2-ил)-3- -oкco-1-изoиндoлинил-3-диизoпpoпшт- аминопропионат, т. пл. 135 (пример 4)
2-(7-Метокси-1,8-нафтиридин-2-ил)- -3-ок со-1-из оиндолинил-4-ме тилпе нта- ноат, т. пл. 133° С (пример 5)
2-(7-Хлор-1,8-нафтиридин-2-ил)-3- -оксо-1-изоиндолинил-1-ацетил-4-пипе- ридилкарбоксилат, т. пл. (пример 6)
2-(7-Хлор-1,8-нафтиридин-2-ил)-3- -оксо-1-изоиндолинил-5-метилгексано- ат, т. пл. 132°С (пример 7)
2-(7-Метокси-1,8-нафтиридин-2-ил)- -3-оксо-1-изоиндолинил-5-метилгексано- ат, т. пл. (пример 8)
2-(7-Хлор-1,8-нафтиридин-2-ил)-1- -изоиндолинил-4-ацетамидобутират, т. пл. 186°С (пример 9)
2-(7-Хлор-1,8-нафтиридин-2-ил)- -3-оксо-1-изоиндолинил-3-(2,6-диме- тилпиперидино)пропионат, т. пл. (пример 10)
2-(7-Хлор-1,8-нафтиридин-2-ил)- -3-оксо-1-изоиндолинил-4- ропионами- добутират, т. пл. 179 С (пример 11)
2-(7 Метокси-1,8-нафтириднн-2-ил) -3-оксо-1-изоиндолинил-2-метилпропок сиацетат, т. пл. 1 14°С (пример 12)
2-(7-Хлор-1,8-нафтиридин-2-ил)-
-3-оксо-1-иэоиндолинил-З-ацетамидопр пионат, т. пл. 220°С (пример 13)
2-(7-Хлор- 1,8-нaфтиpидин-2-ил)- -3-oкco-1-изoиндoли ил-4-изoбyтиpил- амшюбутират, т. пл. (пример 14)
2-(7-Хлор-1,8-нафтиридин-2-ил)- -3-оксо-1-изоиндолинил-(1-бутирил-4- -пиперидино)-карбоксилат, т.пл. 165РС (пример 15)
2-(7-Хлор-1,8-нафтиридин-2-ил)-3- -оксо-1-изоиндолинил-З-метилбутпрат, т. пл. 154°С (пример 16) 2-(7-Хлор-1,8-нафтиридин-2-ил)- -3-оксо-1-изоиндолинил-бутират, т. пл. 140°С (пример 17)
2-(7-Бром-1,8-нафтиридин-2-ил)- -3-оксо-1-изоиндолинил-5-метилгекса- ноат, т. пл. 136°С (пример 18) 2-(7-Метил-1,8-нафтиридин-2-ил)- , -3-оксо-1-изоиндолинил-5-метилгекса- ноат, т. пл. 144вС (пример 19)
2-(7-Хлор-1,8-нафтиридин-2-ил)-3- -оксо-1-изоиндолинил-4- -метилацет- амидо)-бутират, т. пл. 170СС (пример 20)
2-(7-Фтор-1,8-нaфтиpидин-2-ил)- -3-oкco-1-изoиндoлинил-4-мeтилпeнтa ноат, т. пл. 154° С (пример 21).
Испытание на токсичность.
Определяют максимальную дозу продукта (ЛЦдо, которая, введенная мыша перорально, вызывает смерть 50% из них.
Тест на сродство к центральным рецепторным участкам бензодиазеппнов
Метод заключается в определении в присутствии изучаемого продукта специфической фиксации лиганда бен- зодиазепиновых рецепторов, меченного тритием флюнитразепама.
Если продукт обладает сродством к рецепторным участкам бензодиазегти- нов, специфическая фиксация лиганда уменьшается.
Эксперимент состоит в следующем. Смешивают промытый гомогенат (2 центрифугирования при 50 OOOg) всей коры головного мозга самца крысы в 50 мМ буфера трис-HCl с рН 7,4 (конечная концентрация О,1 мг протеина на 1 кг с испытуемым продуктом в различных концентрациях и меченным тритием флю- нитразепамом (конечная концентрация
0
5
0
5
(
.
0
5
0
5
1,5 мМ). Не специфическая фиксация определяется в присутствии диазепама (10 мМ). Посгте инкубации в течение 120 мин при 0°С каждый образец фильтруют на фильтре из стекловолокна (фильтр WHATMAN GF/B) и удержанную фильтром радиоактивность измеряют в сцинтиллирующей жидкости.
Таким образом определяют CLjy т.е. концентрацию изучаемого продукта, которая ингибирует 50% специфической фиксации лиганда.
Тест на химические конвульсии, наведенные пентетразолом.
Используют мышей весом по 18-22 г. Все мыши получают подкожно фиксированную дозу 150 мг/кг пентетразола (одиночная доза, содержащаяся в 250 мл раствора на 1 кг веса мыши). Изучаемые продукты вводятся перорально за 45 мин и за 1,5 ч до пентетразола, причем единичные дозы содержатся в объеме 25 мл на 1 кг веса мыши.
Используют по 5 мышеи на дозу и по 3 дозы на продукт.
После инъекции пентетразола, мышей помещают в камеру, разделенную на 15 секций со стороной 13 см, так чтобы каждая мышь оставалась изолированной в течение всей продолжительности наблюдения. Эти камеры покрывают прозрачной пластинкой Rhodoid. Все контрольные мыши, получившие дозу 150 мг/кг подкожно пентетразола, меньше, чем за 15 мин, имеют более или менее сильные конвульсии, которые быстро приводят к гибели. Мышей наблюдают в течение 30 мин после инъекции пентетразола. Защищенной против конвульсий считается мышь, которая в интервале 30 мин не имеет конвульсий. ЭД, продукта представляет собой дозу, которая при максимуме своего эффекта уничтожает конвульсии, вызванные пентетразолом, у 50% животных. Тест на зацепление. Этот метод состоит в подвешивании мыши передними лапами на горизонтально натянутой металлической проволоке. В качестве мыши с депрессивным мышечно-нервным действием рассматривается всякое животное, которое не старается зацепиться после 3 попыток или которое, если оно прицепилось к проволоке, падает за 5 с или менее чем за 5 с. Все контрольные животные легко прицепляются к прово
локе, остаются там прицепленными и даже совершают за 5 с или менее чем за 5 с подтягивание, которое приводит по крайней мере одну из задних лап в соприкосновение с проволокой.
Используют по 6 мышей на дозу и 4-5 доз на продукт.
ЭДзо продукта представляет собой дозу, которая при максимуме своего эффекта, развивает депрессивную нервно-мышечную активность у 50% животных.
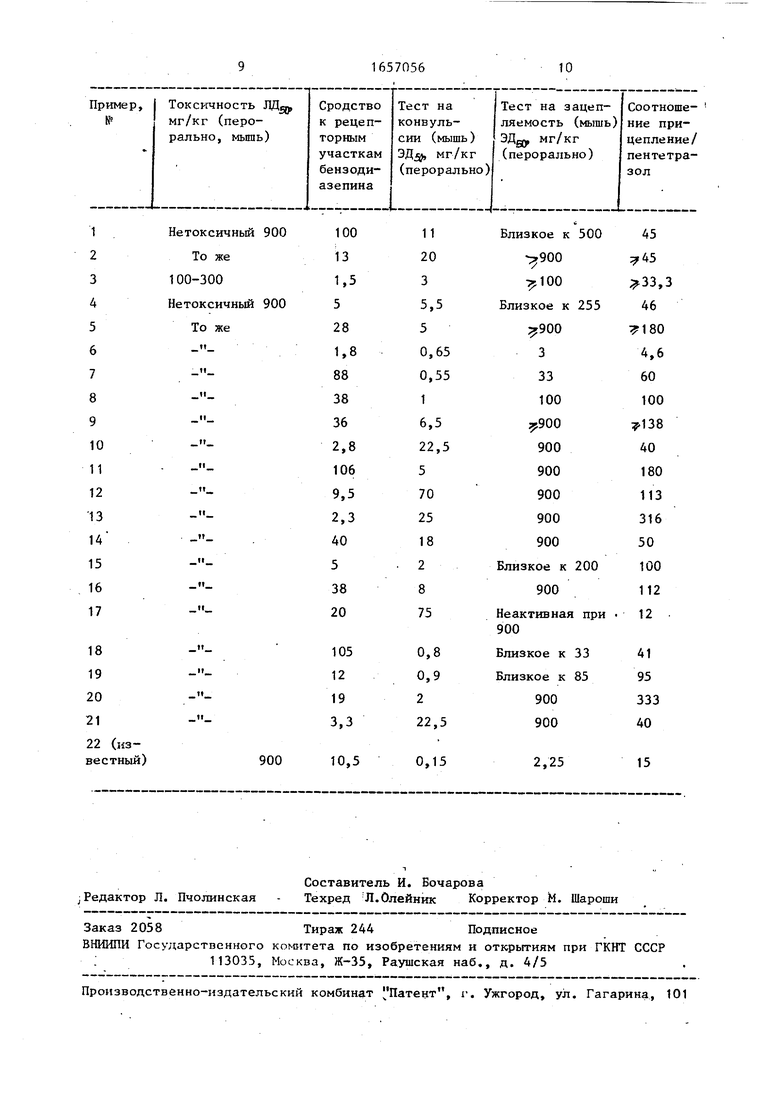
Полученные результаты сведены в таблицу. Их действие сравнивали с на иболее активным известным продуктом (пример 22).
В результате сравнения выявлено, что предлагаемые и известное в тест на сродство к рецепторным участкам бензодиазепина и в тесте на конвульсию, наведенную пентетразолом, показали сходные результаты.
Однако предлагаемые соединения имеют невысокую седативность. Эта активность определялась в тесте на зацепление. Так, чем больше соотно-
ПЕзо зацепления
шение: -----, тем меньш
ДЕ 5о пентетразола
седативное действие соединений. Сле- довательно, предлагаемые соединения, будучи транквилизаторами, не проявляют депрессивного нервно-мышечного эффекта, который для такого рода соединений представляет собой нежела- тельное побочное действие.
Формула изобретения
Способ получения производных изо- индолинона общей формулы
О
0-CO-R
где Гет - нафтиридиниловый радикал, замешенный галогеном или С -С4--алкоксигруппой; R - С -Ctj-алкил, линейный или разветвленный, незамещенный или замещенный низшим алкокси, низшим диалкил- амино- или низшим алкил- карбониламино, или R - 3- или 4-пиперидил, замещенный алкилом или низшим алкилкарбонилом,
или их фармацевтически приемлемых солей, отличающийся тем, что соединение общей формулы
О
N-Гет
ОН
где Гет имеет указанное значение, подвергают взаимодействию с диэтил- хлорфосфатом в среде диметилформами- да в присутствии гидрида щелочного металла, полученный in sity продукт общей формулы:
О
N-fem
0-Р(ОС2Н5)о и
О
где Гет имеет указанные значения, обрабатывают щелочной солью кислоты общей формулы
R - СООН ,
где R имеет указанные значения, и процесс ведут в среде диметилформ- амида в присутствии гидрида щелочного металла при температуре от 0 до 25 С с последующим выделением целевого продукта в свободном виде или в виде фармацевтически приемлемой соли.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных пиррола | 1988 |
|
SU1678202A3 |
| Способ получения производных пиррола или их оптических изомеров либо фармацевтически приемлемых солей | 1987 |
|
SU1616515A3 |
| Способ получения производных пиррола или их фармацевтически приемлемых солей | 1988 |
|
SU1612997A3 |
| Способ получения производных пиррола | 1988 |
|
SU1685264A3 |
| Способ получения конденсированных производных пиррола | 1987 |
|
SU1577698A3 |
| Способ получения производных пиррола | 1989 |
|
SU1630612A3 |
| Способ получения производных нафтиридина или их солей | 1974 |
|
SU583757A3 |
| Способ получения производных нафтиридинов или их солей | 1976 |
|
SU648102A3 |
| Способ получения гетероциклических соединений | 1976 |
|
SU645582A3 |
| Способ получения гетероциклических соединений | 1975 |
|
SU673173A3 |
Изобретение касается получения . производных изоиндолинона, в частности соединений обшей Ь-лы Гет-М-СНХ-С-СН СН С(0)С-СН СН где Гет - замещенный галогеном или С -С4 алкокси группой нафтиридинил; X - -0-C(0)-R; R - С(-С6-апкил(линейный или разветвленный), который Изобретение относится к способу получения новых производных изоиндолинона общей формулы О возможно замещен низшим алкокси-, низшим диалкиламино или низшим ал- килкарбониламино-, или R - 3- или 4-пиперидил, замещенный алкилом или низшим алкилкарбонилом, или их фармацевтически приемлемых солей, обладающих анксиолитической, гипнотической, антиконвульсивной, антиэпилептической и миорелаксантной активностями, что может быть использовано в медицине. Цель - создание новых с широким спектром активностей и низкой токсичностью веществ указанного класса. Синтез ведут реакцией соединения указанной ф-лы, где X - ОН, с диэтилхлорфосфатом в среде диме- тилформамида в присутствии гидрида щелочного металла с последующей обработкой полученного продукта (без выделения) соответствующей кислотой- |R-C(O)OH, процесс ведут в среде шиметилформамида в присутствии гидрида щелочного металла при О, и выделением целевого продукта в свободном виде или в виде нужной соли. Новые вецества в отличие от известных транквилизаторов, не проявляют депрессивного нервно-мышечного эффекта. 1 табл. где Гет - нафтиридиниловый радикал, замещенный галогеном или алкоксигруппой, R - fy -С -алкил, линейный или разветвленный, незамещенный или замещенный низшим алксуссн, низшим диалкиламино или низшим алкилкарбониламино, или R - 3fe сь ел XI о ел о со

| Способ получения гетероциклических соединений | 1975 |
|
SU673173A3 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1991-06-15—Публикация
1988-11-04—Подача